ТЕРМІНОЛОГІЯ ЗА МКХ-10
Порушення ліпідного спектра крові займають провідне місце в переліку факторів ризику основних захворювань серцево-судинної системи і відповідно до існуючої МКХ 10-го перегляду вони були віднесені до IV класу захворювань, а саме «Хвороби ендокринної системи, розлади харчування і порушення обміну речовин», позначені рубрикою Е78.
E78 Порушення обміну ліпопротеїнів та інші ліпідемії
Виключений: сфінголіпідоз (E75.0–E75.3)
E78.0 Ізольована гіперхолестеринемія
E78.1 Ізольована гіпертригліцеридемія
E78.2 Змішана гіперліпідемія
Виключено: церебротендинозний холестероз [Ван-Богарта — Шерера — Епштейна] (E75.5)
E78.3 Гіперхіломікронемія
E78.4 Інші гіперліпідемії
E78.5 Гіперліпідемія неуточнена
E78.6 Недостатність ліпопротеїнів
E78.8 Інші порушення обміну ліпопротеїнів
E78.9 Порушення обміну ліпопротеїнів неуточнені
КЛАСИФІКАЦІЯ ДИСЛІПІДЕМІЙ
На сучасному етапі для характеристики порушень ліпідного спектра крові використовують наступну термінологію: дисліпідемія, гіперліпопротеїнемія та гіперліпідемія.
Термін дисліпідемія є найбільш широким, тому що включає підвищення рівня ліпідів і ліпопротеїнів вище оптимального значення та/або можливе зниження показників частини ліпідного спектра, а саме ЛПВЩ або альфа-ліпопротеїнів.
Термін гіперліпопротеїнемія означає будь-яке підвищення рівня ліпідів і ліпопротеїнів у плазмі крові вище оптимального рівня.
Термін гіперліпідемія — найбільш простий, тому що для його використання досить тільки визначення підвищення ліпідів крові (ХС і ТГ) вище оптимального рівня.
Для характеристики гіперліпопротеїнемій найбільш вживаною є класифікація ВООЗ (табл. 2.1).

I фенотип характеризується ізольованим підвищенням рівня ХМ. ХС і ТГ можуть бути помірно підвищені. Цей фенотип гіперліпопротеїнемії відзначають рідко і зазвичай не асоціюють із розвитком атеросклерозу. Однак ремнанти, що утворюються в процесі гідролізу ХМ, можуть бути атерогенними.
Для IIa фенотипу характерне підвищення концентрації ХС ЛПНЩ і ХС, рівень ТГ перебуває в межах норми. Цей фенотип досить розповсюджений у популяції і тісно пов’язаний із розвитком атеросклерозу коронарних судин. При спадкових порушеннях ліпідного обміну IIa фенотип діагностують у хворих із сімейною і полігенною гіперхолестеринемією.
При IIb фенотипі підвищені концентрації ХС ЛПНЩ і ХС ЛПДНЩ. В осіб із фенотипом IIb спостерігають комбіновану гіперліпопротеїнемію, тому що підвищені концентрації ХС і ТГ. Це розповсюджений і атерогенний тип. У випадках первинної гіперліпопротеїнемії IIb фенотип відзначають частіше у хворих із сімейною комбінованою гіперліпопротеїнемією. Часто комбінована гіперліпопротеїнемія служить проявом вторинних порушень ліпідного обміну.
III фенотип проявляється підвищенням рівня ЛППЩ і, як наслідок, ХС і ТГ. Це доволі рідкісний вид порушення ліпідного обміну, часто асоціюється із фенотипом Е2/2 апобілка Е, при якому рецептори печінки гірше, ніж при інших фенотипах апо-Е, зв’язують ЛППЩ. III фенотип зазвичай виявляють при метаболічних порушеннях, зокрема у хворих із метаболічним синдромом і цукровим діабетом. При підозрі на III фенотип істотну роль у діагностиці відіграє електрофорез сироватки крові в агарозному гелі. На електрофореграмі з’являється характерна широка бета-смуга, яка відображає високий вміст ЛППЩ у крові. У носіїв III фенотипу з вищевказаними порушеннями існує високий ризик розвитку атеросклерозу.
Для IV фенотипу характерна підвищена концентрація ЛПДНЩ і гіпертригліцеридемія. Це розповсюджений тип дисліпідемії, його виявляють у 40% хворих із порушеннями ліпідного обміну. IV фенотип може бути проявом сімейної гіпертригліцеридемії, а також частим проявом вторинних порушень ліпідного обміну. У комбінації із низькою концентрацією ХС ЛПВЩ цей фенотип характеризується високою атерогенністю.
V фенотип виявляють рідко. Характеризується він одночасним підвищенням концентрації ХМ і ЛПДНЩ, а також гіпертригліцеридемією і помірним підвищенням вмісту ХС. Зазвичай немає чіткого зв’язку між V фенотипом і розвитком атеросклерозу. Однак виражена гіпертригліцеридемія, характерна для цього фенотипу, небезпечна розвитком гострого панкреатиту.
Класифікація ВООЗ не враховує фенотип, для якого характерне вибіркове зниження ХС ЛПВЩ (гіпоальфаліпопротеїнемія). Цей фенотип частіше відзначають у чоловіків, він супроводжується ураженням коронарних і мозкових судин. Слід зазначити, що наведена класифікація не дозволяє поставити діагноз захворювання, що спричинило дисліпідемію, однак дає можливість установити ступінь її атерогенності.
Водночас у медичній літературі для оцінки рівнів ліпопротеїнів часто використовується класифікація компонентів ліпідного спектра крові, запропонована в Третій доповіді по лікуванню дисліпідемій у дорослих (Adult Treatment Panel — ATP-III) Національної освітньої програми по холестерину США (табл. 2.2).
У 2003 р. проф. М.І. Лутай запропонував Українському товариству кардіологів нову Клінічну класифікацію дисліпідемій, створену на основі рекомендацій Сінгапурського кардіологічного товариства — Clinical Practice Guidelines «Lipids» (2001) і доповнену шостим варіантом первинних дисліпідемій — ізольованим зниженням ХС ЛПВЩ (гіпоальфаліпопротеїнемією), що досить рідко діагностується.
Таблиця 2.2
Класифікація ХС ЛПНЩ, загального ХС, ХС ЛПВЩ і ТГ, мг/дл/ммоль/л
|
ХС ЛПНЩ |
|
|
<100 (<2,6) 100–129 (2,6–3,3) 130–159 (3,4–4,0) 160–189 (4,1–4,8) ≥190 (≥4,9) |
Оптимальний рівень Вищий оптимального Гранично високий Високий Дуже високий |
|
Загальний ХС |
|
|
<200 (<5,2) 200–239 (5,2–6,1) ≥240 (≥6,2) |
Бажаний Гранично високий Високий |
|
ХС ЛПВЩ |
|
|
<40 (<1,0) ≥60 (≥1,6) |
Низький Високий |
|
ТГ |
|
|
<150 (<1,7) |
Нормальний |
|
150–199 (1,7–2,2) |
Гранично підвищений |
|
200–499 (2,3–4,4) |
Високий |
|
≥500 (≥4,5) |
Дуже високий |
Клінічна класифікація первинних дисліпідемій Українського наукового товариства кардіологів (Лутай М.І., 2003)
У клінічній класифікації дисліпідемій Українського наукового товариства кардіологів (2003), наведеній у табл. 2.3, рівень ліпідів крові було рекомендовано вважати патологічним, якщо показник загального ХС ≥6,2 ммоль/л (240 мг/дл), ХС ЛПНЩ ≥4,1 ммоль/л (160 мг/дл) і ТГ ≥2,3 ммоль/л (200 мг/дл).
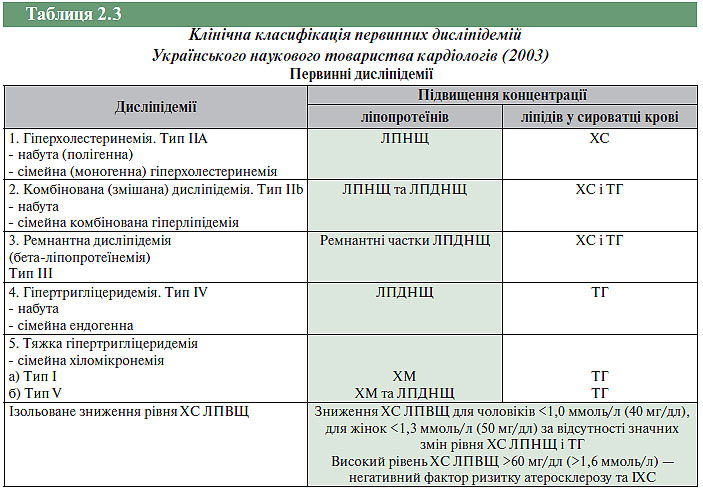

Діагноз дисліпідемії, гіперліпопротеїнемії та гіперліпідемії не є самостійним, а повинен бути включеним в основний клінічний діагноз серцево-судинного захворювання. Для широкого використання в клінічному діагнозі в 2007 р. запропоновано спрощений варіант класифікації дисліпідемій.
Клінічна класифікація дисліпідемій Українського наукового товариства кардіологів (2007):
- Гіперхолестеринемія (відповідає типу IIa за D. Fredrickson).
- Комбінована дисліпідемія (відповідає типу IIb і типу III за D. Fredrickson).
- Гіпертригліцеридемія (відповідає типу IV за D. Fredrickson).
Слід відзначити, що останнім часом зазнали змін нормативні величини основних характеристик ліпідограми. Відповідно до третього перегляду Рекомендацій Європейського товариства кардіологів по профілактиці серцево-судинних захворювань (ССЗ) (2007) вважають оптимальними наступні рівні ліпідів і ліпопротеїнів (табл. 2.4).
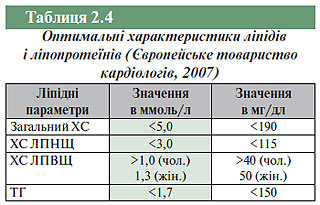
При реалізації заходів первинної і вторинної профілактики серцево-судинних ускладнень відповідно до рекомендацій Європейського товариства кардіологів (2007) лікарі повинні орієнтуватися на наступні цільові рівні загального ХС і ХС ЛПНЩ:
- для загальної популяції цільовий рівень ХС у плазмі крові повинен становити <5,0 ммоль/л (190 мг/дл), а рівень ХС ЛПНЩ <3 ммоль/л (115 мг/дл);
- цільові рівні для пацієнтів з ІХС, клінічними проявами ССЗ і пацієнтів із цукровим діабетом: для загального ХС <4,5 ммоль/л (175 мг дл), при можливості <4,0 ммоль/л (155 мг/дл) і для ХС ЛПНЩ <2,5 ммоль/л (100 мг/дл), при можливості <2,0 ммоль/л (80 мг/дл).
ЕПІДЕМІОЛОГІЯ ДИСЛІПІДЕМІЙ
ССЗ, як і раніше, посідають перше місце в структурі смертності громадян України (63,4% у 2006 р.), причому в більшості випадків в основі їх патогенезу лежить атеросклеротичне ураження кровоносних судин, що визначає в 66,6% розвиток ІХС, а в 21,5% — цереброваскулярних захворювань. В Україні протягом 2005 р. тільки за статистикою звернень до лікаря зареєстровано більше ніж 7,9 млн пацієнтів з ІХС, серед яких особи зі стенокардією склали близько 36%.
Експериментальні, епідеміологічні і клінічні дослідження, проведені за останні 50 років, виявили тісний зв’язок між порушенням ліпідного спектра (дисліпідеміями) та розвитком атеросклерозу. За даними Національного наукового центру «Інститут кардіології ім. М.Д. Стражеска» АМН України в українській популяції підвищення рівня загального ХС серед населення працездатного віку спостерігається в середньому в 40–50% випадків. Проте слід зазначити, що всі епідеміологічні дослідження ліпідного спектра в популяції, що проводилися дотепер в Україні, виконані згідно з протоколом, відповідно до якого гіперхолестеринемією вважається рівень загального ХС >6,2 ммоль/л та рівень ХС ЛПНЩ >4,1 ммоль/л, а гіпертригліцеридемією — рівні ТГ крові >2,3 ммоль/л, що, безумовно, не відповідає сучасним європейським вимогам діагностики дисліпідемій і призводить до значного зниження в українських статистичних звітах відсотка пацієнтів із порушеннями ліпідного спектра крові, маскуючи відповідно від 20 до 60% хворих із цим прогностично значимим фактором ризику.
У той же час виявлений прямий кореляційний зв’язок між захворюваністю та смертністю від ІХС, з одного боку, і рівнем ХС у крові — з іншого, а гіперхолестеринемія в поєднанні з палінням, ожирінням, АГ, цукровим діабетом і віком є основним предиктором розвитку атеросклерозу та його ускладнень. Підтвердження прогностичного значення гіперхолестеринемії отримано в результаті багатоцентрових досліджень, насамперед таких як MRFIT (Multiple Risk Factor Intervention Trial) і Seven Countries Study, згідно з якими у великих популяціях продемонстрований ріст абсолютних і відносних характеристик смертності від ІХС у прямій залежності від рівня загального ХС (рис. 2.1).
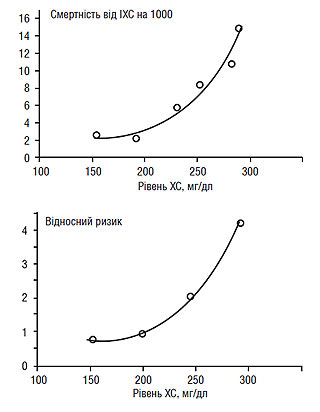
Рис. 2.1. Показники смертності від ІХС залежно від рівня ХС (дані MRFIT, 1982)
Визначальну роль у створенні концепції факторів ризику відіграло Фремінгемське дослідження, його підходи послужили основою для розробки концепції заходів як первинної, так і вторинної профілактики ССЗ.
Під первинною профілактикою слід розуміти сукупність заходів, спрямованих на попередження дії факторів ризику (у тому числі дисліпідемії), що призводять до виникнення клінічних симптомів ІХС та інших проявів атеросклерозу. Під вторинною профілактикою мається на увазі вся сукупність терапевтичних заходів, спрямованих на попередження ускладнень ІХС, поліпшення її клінічного перебігу та прогнозу. Такі заходи передбачають вплив на фактори ризику шляхом модифікації способу життя і застосування медикаментозного лікування.
Зниження смертності від ССЗ у розвинених країнах відзначали паралельно зі зниженням середнього рівня ХС у крові у дорослого населення. В результаті реалізації Національної освітньої програми по холестерину в США було продемонстровано, що зниження на 1% середнього рівня загального ХС у жителів країни зумовило зниження смертності від ССЗ на 2%.
Дослідження останніх років показали, що поряд із гіперхолестеринемією цілий ряд інших порушень ліпідного спектра також є чинником ризику ІХС і атеросклерозу. Це стосується гіпертригліцеридемії та низького рівня ХС ЛПВЩ у плазмі крові. Головна особливість факторів ризику полягає в тому, що вони, як правило, підсилюють дію один одного, тобто за наявності двох факторів ризику ймовірність розвитку атеросклерозу збільшується не в 2, а в 3 рази і більше. Відповідно будь-яка стратегія профілактики передбачає комплексний вплив на всі фактори ризику, наявні у хворого, а інтенсивність втручання й цільові рівні показників (загального ХС, ХС ЛПНЩ, ТГ) залежать від сумарного абсолютного ризику розвитку ІХС та її ускладнень протягом певного періоду. Слід мати на увазі, що ефект від проведення профілактичних заходів у певних категорій осіб тим вищий, чим вищий абсолютний ризик розвитку ІХС. У зв’язку із цим стратифікація ризику і визначення близького та віддаленого прогнозів у конкретного пацієнта має першочергове значення для вибору методу впливу на дисліпідемію (зміна способу життя, медикаментозне лікування).
У третій версії Рекомендацій Європейського товариства кардіологів, опублікованих у 2003 р., — «Європейські рекомендації із профілактики серцево-судинних захворювань у клінічній практиці» велика увага приділена питанням, що стосуються гіперхолестеринемії та цільових рівнів ХС залежно від категорій ризику. Серед нововведень звертає на себе увагу система оцінки ризику SCORE, графічне подання якої нагадує шкалу з кольоровими квадратами, прийняту в 1998 р. Істотна відмінність від попередніх 1-ї і 2-ї версій Рекомендацій Європейського товариства кардіологів полягає в тому, що показники ризику розраховані не за даними Фремінгемського дослідження, а на підставі аналізу 12 європейських епідеміологічних досліджень. У тому числі враховували дані найбільшого міжнародного проекту EUROASPIRE, який включав 205 178 осіб по всій Європі, серед яких зареєстровано близько 7000 смертей від ССЗ. Створено два варіанти таблиць для країн з низьким і високим рівнем ризику ССЗ, на жаль, в Україні застосовується останній варіант. Крім того, на відміну від попередньої версії Рекомендацій у якості основного прогностичного критерію виступає не ризик розвитку основних коронарних подій (нефатального ІМ або смерті від ІХС), а ймовірність тільки фатальних серцево-судинних подій, тобто смерті від будь-якого ССЗ у найближчі 10 років життя пацієнта. За величину високого ризику прийнятий показник 5% і більше. У молодих пацієнтів, крім визначення ризику на найближчі 10 років, пропонується оцінювати ризик при проекції сукупності факторів ризику на вік 60 років.
З 1995 р. Європейським товариством кардіологів реалізується Європейська програма по первинній і вторинній профілактиці серцево-судинних захворювань (Euro Heart Survey on Secondary and Primary Prevention of Coronary Heart Disease). У науковій літературі дана робота представлена двома звітними доповідями EUROASPIRE-I (EUROpean Action on Secondary Prevention through Intervention to Reduce Events), у якій підсумована робота за 1995–1996 рр., і EUROASPIRE-II за період 1999–2000 рр. Відповідно до них Україна перебуває серед країн з найбільш несприятливим профілем серцево-судинної смертності, стандартизованої на 1 тис. жителів (рис. 2.2).
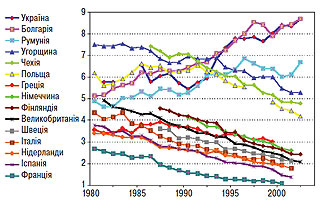
Рис. 2.2. Серцево-судинна смертність у європейських країнах, стандартизована на 1000 мешканців за віковими та гендерними критеріями
У процесі виконання Euro Heart Survey, а також беручи до уваги основні цілі первинної й вторинної профілактики, виконаний аналіз проведених заходів щодо модифікації способу життя (відмова від тютюнопаління, прийом збалансованої здорової їжі, достатня фізична активність), а також облік адекватності контролю інших факторів ризику, що модифікуються, (рівень АТ <140/90 мм рт. ст.; рівень загального ХС <5,0 ммоль/л (190 мг/дл); ХС ЛПНЩ <3,0 ммоль/л (115 мг/дл), а також досягнення контрольного рівня глюкози в пацієнтів із цукровим діабетом). Згідно з отриманими даними відсоток поширеності гіперхолестеринемії з рівнем ХС >5 ммоль/л (190 мг/дл) у країнах Європи досить високий і становить приблизно 58% (рис. 2.3). У цей же час в Україні офіційна епідеміологічна статистика враховує лише рівні ХС тільки >6,2 ммоль/л (240 мг/дл). Дані зміни виявлені тільки в 35% популяції, тобто показник відповідно до сучасних вимог штучно занижений.
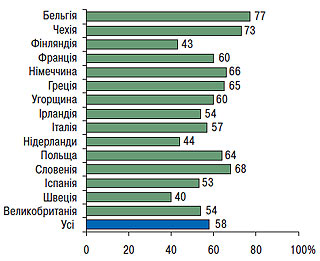
Рис. 2.3. Поширеність гіперхолестеринемії >5 ммоль/л у різних країнах
За період з 2004 по 2007 р. з ініціативи Національного наукового центру «Інститут кардіології ім. М.Д. Стражеска» АМН України та Української асоціації кардіологів виконане багатоцентрове дослідження з виявлення гіперхолестеринемії, у якому проаналізована кількість пацієнтів із рівнем гіперхолестеринемії >5,0 ммоль/л (190 мг/дл) та рівнем гіперхолестеринемії >6,2 ммоль/л (240 мг/дл). У роботі взяли участь ліпідні центри на базі 19 обласних кардіодиспансерів України та експрес-лабораторія Національного наукового центру «Інститут кардіології ім. М.Д. Стражеска» АМН України. Обстежені 6564 пацієнти, що звернулися за спеціалізованою допомогою, отже, мова йде не про популяційне дослідження, а про виявлення гіперхолестеринемії у пацієнтів на прийомі у лікаря-кардіолога. За результатами обстеження всіх 6564 пацієнтів гіперхолестеринемія >5,0 ммоль/л (190 мг/дл) виявлена в 65,5%, а гіперхолестеринемія >6,2 ммоль/л (240 мг/дл) — у 28,0%, причому в 4358 обстежених за результатами роботи ліпідних центрів на базі 19 обласних кардіодиспансерів гіперхолестеринемія >5,0 ммоль/л (190 мг/дл) виявлена в 63,6%, а гіперхолестеринемія >6,2 ммоль/л (240 мг/дл) — в 27,3%, тоді як у 2206 обстежених в експрес-лабораторії на базі Національного наукового центру «Інститут кардіології ім. М.Д. Стражеска» АМН України гіперхолестеринемія >5,0 ммоль/л (190 мг/дл) виявлена в 69,3%, а гіперхолестеринемія >6,2 ммоль/л (240 мг/дл) — у 29,3%, що може свідчити про те, що в Національний науковий центр звертаються по допомогу пацієнти, які належать до більш тяжкого контингенту (рис. 2.4).
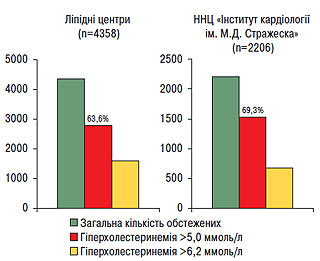
Рис. 2.4. Виявлення гіперхолестеринемії за результатами роботи ліпідних центрів у 2004–2007 рр. (n=6564)
Згідно з даними EUROASPIRE-II дослідження Euro Heart Survey використання ліпідознижувальних препаратів у Європі становить у середньому 55% від потреби їхнього призначення (рис. 2.5), тоді як в Україні цей показник не перевищує 1% (рис. 2.6), що вказує на недостатнє використання такого антиатеросклеротичного потенціалу. В той же час, відповідно до звіту АНА за 2007 р., проведення медикаментозних і немедикаментозних заходів, спрямованих на нормалізацію ліпідного профілю в рамках реалізації Національної освітньої програми по ХС у США з 1971 по 2000 р., призвело до того, що поширеність серед популяції дорослого населення «високої гіперхолестеринемії» або рівня загального ХС >6,2 ммоль/л (240 мг/дл) знизилася з 30 до 18% і продовжує знижуватися (рис. 2.7). Так, уже в 2004 р. гіперхолестеринемія >6,2 ммоль/л (240 мг/дл) становила 16,8%, а поширеність гіперхолестеринемії >5,2 ммоль/л (200 мг/дл) — усього 48,4%. При цьому відзначено, що зниження на 10% рівня загального ХС призвело до зменшення на 30% усіх випадків ССЗ.
Важливою обставиною, встановленою в останніх дослідженнях, є те, що деякі ліпідознижувальні препарати, такі як статини, крім їхньої прямої дії, мають неліпідні ефекти, з чим пов’язують їх сприятливий вплив на прогноз ІХС і показники серцево-судинної смертності в осіб з нормальним рівнем ХС (CARE, HPS). Сьогодні ефективність ліпідознижувальної терапії в аспекті її сприятливої дії на ускладнення та смертність від коронарної патології доведена для широкого спектра пацієнтів при проведенні первинної (WOSCOPS, AFCAPS, ALLHAT-LLT, ASCOT-LLA, CARDS, 4D) і вторинної профілактики (4S, CARE, LIPID, HPS, IDEAL, TNT), а також у пацієнтів із гострим коронарним синдромом (MIRACL, PROVIT-TIMI 22, A to Z). Доцільність активного впливу на дисліпідемію підтверджують недавні дослідження, що показали переваги агресивної ліпідознижувальної терапії поряд з коронарною ангіопластикою (AVERT), а також отримані останнім часом переконливі докази можливості досягнення регресу атеросклеротичних бляшок шляхом застосування агресивної ліпідознижувальної терапії (REVERSAL, 2004; ASTEROID, 2006).
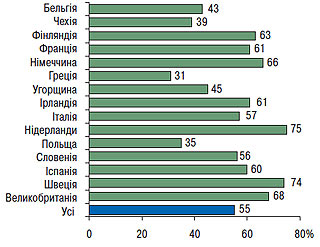
Рис. 2.5. Застосування ліпідознижувальної терапії
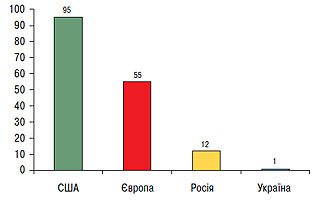
Рис. 2.6. Частота призначення статинів пацієнтам у групах ризику
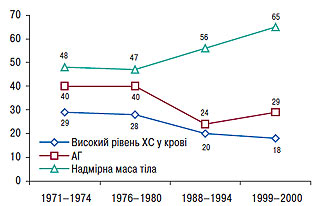
Рис. 2.7. Динаміка поширеності ожиріння, АГ і гіперхолестеринемії в США з 1971 по 2000 р.
Державні програми по профілактиці атеросклерозу сприяли зменшенню захворюваності й смертності від ІХС на 30–50% у більшості країн Європи й Америки. Слід визнати непереконливими твердження про те, що сучасні ліпідознижувальні засоби (статини та фібрати) коштують дорого і можуть призводити до ускладнень при тривалому застосуванні, в той час, як відомо, що лікування інфаркту або інсульту в кілька разів дорожче вартості первинної і вторинної профілактики. Недостатньо активна тактика корекції гіперхолестеринемії часто зумовлена невірною інформацією про цільові рівні атерогенних ліпопротеїнів у хворих з ІХС і перебільшенням можливих несприятливих впливів статинів на печінку при їх тривалому застосуванні. У той же час хочеться сподіватися, що проведення широкої просвітницької роботи як серед медичного персоналу, так і серед пацієнтів, адекватне проведення первинної й вторинної профілактики вплине на показники здоров’я населення України.
ЕТІОЛОГІЯ ТА ПАТОГЕНЕЗ ДИСЛІПІДЕМІЙ
Характеристика ліпідів плазми крові
Основними ліпідами плазми крові є вільні, тобто неетерифіковані жирні кислоти, ТГ, фосфоліпіди та ефіри ХС.
Більша частина жирних кислот утворюється в печінці з вуглеводних попередників. Лише лінолева кислота та продукт її метаболізму — арахідонова кислота не синтезуються в організмі і є незамінними жирними кислотами. Вільні жирні кислоти циркулюють у крові в поєднанні з альбумінами. Вони надходять у кров з їжі або з жирової тканини, де містяться у вигляді ТГ і згодом мобілізуються за допомогою ліпопротеїнліпази. Окислення вільних жирних кислот — важливе джерело енергії, зокрема в серцевому м’язі. Швидкість їхнього обміну дуже висока — щохвилини утилізується близько 20–40% кількості жирних кислот у плазмі крові. Вони відіграють важливу роль у ліпідному обміні, етерифікуючи ХС і гліцерин. Виділяють насичені жирні кислоти (пальмітинова, стеаринова), мононенасичені жирні кислоти (олеїнова) та поліненасичені жирні кислоти (лінолева, арахідонова, ейкозапентаєнова, докозагексаєнова). Насиченість залежить від числа подвійних зв’язків у складі жирних кислот. Незамінні жирні кислоти не синтезуються в організмі людини і повинні надходити в складі харчових продуктів. Насичені жирні кислоти переважають у жирах тваринного походження, мононенасичені та поліненасичені жирні кислоти — у рослинних оліях та у риб’ячому жирі.
ТГ — це об’єднання 3 етерів жирних кислот і гліцерину, що є багатоатомним спиртом. Екзогенні або «харчові» ТГ ресинтезуються в клітинах тонкої кишки з моногліцеридів і надходять у кров у вигляді ХМ. Ендогенні ТГ синтезуються головним чином у печінці з вільних жирних кислот, звідки транспортуються з кров̓ю переважно в складі ЛПДНЩ. Після прийому жирної їжі концентрація ТГ у крові швидко підвищується, але вже через 10–12 год дорівнює вихідному рівню. На сьогодні для оцінки порушення обміну ТГ запропоновані тести з харчовим навантаженням жиром (вершковим маслом, сметаною). У хворих на цукровий діабет, з метаболічним синдромом і ожирінням концентрація ТГ тривалий час (>12 год) не дорівнює вихідному рівню. Цей феномен у світовій літературі позначається терміном «постпрандіальна дисліпідемія». Хворі з постпрандіальною дисліпідемією більше схильні до розвитку атеросклерозу.
Фосфоліпіди — це складні ліпіди, що складаються із гліцерину, жирних кислот, фосфорної кислоти і азотовмісних сполук. Синтезуються майже у всіх тканинах, найбільше в печінці. Як і ХС, є складовими клітинних мембран, а в плазмі крові відіграють важливу роль у забезпеченні розчинності ліпопротеїнових часток. Їхній вміст у крові не пов’язаний із ризиком розвитку ІХС, тому при призначенні гіполіпідемічної терапії концентрація фосфоліпідів у плазмі крові, як правило, не береться до уваги.
ХС належить до групи стероїдів (як статеві гормони і жовчні кислоти), оскільки містить у своєму складі циклічні структури. ХС знаходиться в організмі у вигляді вільного стерину і його ефірів. Ефір ХС представлений сполукою ХС із однією з жирних кислот. Функції ХС зумовлені тим, що він поряд з фосфоліпідами входить до складу клітинних мембран, регулюючи їхню проникність і активність мембранних ферментів, а також є попередником деяких біологічно активних речовин (стероїдних гормонів, вітамінів групи D і жовчних кислот). ХС частково надходить із їжею в складі ХМ (20–30%), але в основному синтезується de novo (70–80%) в організмі людини. Здатністю синтезувати ХС володіє більшість клітин, але основний процес здійснюється в печінці, де формуються і основні метаболіти ХС — жовчні кислоти. ХС, що надійшов у просвіт тонкого кишечнику в складі жовчних кислот, піддається зворотному всмоктуванню і знову надходить у печінку (внутрішньопечінковий шлях обміну ХС). Як ми вже відзначали, ХС буває вільним і етерифікованим. Вільний ХС метаболічно активний, тоді як ефіри ХС є його формою, що транспортується і депонується. Етерифікований ХС переважає в складі кори надниркової залози, у плазмі крові, в атеросклеротичних бляшках. У складі клітинних мембран ХС перебуває у вільному стані.
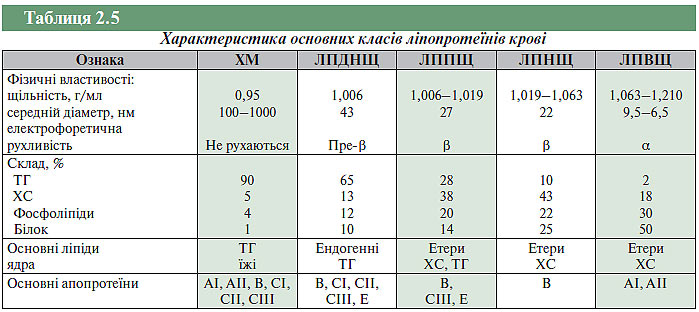
У плазмі крові ХС і ТГ перебувають у поєднанні з білками, утворюючи ліпопротеїни. Ці сполуки забезпечують їх транспорт і являють собою сферичні частки різного розміру, що складаються з вільного та етерифікованого ХС, ТГ, фосфоліпідів і білків, кількість яких варіює. Усередині знаходиться гідрофобне ядро із щільно розміщених молекул ТГ і ефірів ХС. Зовні ядро вкрите шаром з фосфоліпідів, що забезпечують стабілізацію ліпопротеїнової частки в розчиненому стані, а також невеликою кількістю вільного ХС і білків — аполіпопротеїнів або апобілків. Апобілки виконують структурну й адресну функції. Завдяки високоспецифічній взаємодії між апобілками ліпопротеїнів і білками-рецепторами на клітинній мембрані здійснюється рецептор-опосередковане зв’язування ліпопротеїнів із клітинами. Полярні частини молекул апобілків, фосфоліпідів і вільного ХС створюють зовнішній, гідрофільний шар ліпопротеїнових часток, тоді як ефіри ХС і ТГ становлять їхнє гідрофобне ядро. Основними ліпопротеїнами, залежно від їхньої щільності, розмірів і складу ліпідів (табл. 2.5), а також апобілків, є ХМ, ЛПДНЩ, ЛППЩ, ЛПНЩ, ЛПВЩ.
Екзогенні ліпіди — ТГ і ХС (приблизно 100 г/добу і 1 г/добу відповідно) надходять до епітеліальних клітин кишечнику, де вони всмоктуються, інкорпоруючись у більші ліпопротеїнові частки — ХМ, найбільші за розмірами і найлегші ліпопротеїнові частки. Їхня щільність становить 0,95 г/мл. ХМ синтезуються в епітеліальних клітинах тонкого кишечнику з ліпідів екзогенного (харчового) походження; через систему лімфатичних судин ХМ надходять у грудну лімфатичну протоку і звідти в кров, де піддаються ліполізу під дією ліпопротеїнліпази плазми крові. До складу ХМ входять ТГ, у меншій кількості ефіри ХС, фосфоліпіди і апобілки. У результаті ліполізу ХМ втрачають значну частину ТГ і перетворюються в ремнанти (залишки) ХМ. Основними білками ремнант ХМ є апобілки: апо-В-48, апо-Е і апо-С. Саме завдяки апо-Е ремнанти зв’язуються з рецепторами печінки. Ізольовану гіперхіломікронемію виявляють рідко, остання зазвичай свідчить про спадковий дефект ліпопротеїнліпази. Гіперхіломікронемія не є біохімічним маркером атеросклерозу, але супутня їй гіпертригліцеридемія може спровокувати розвиток гострого панкреатиту. Основною функцією ХМ є транспорт харчових ТГ, з яких вони складаються на 90%, і ХС через лімфу в плазму крові. Потрапляючи в капіляри жирової тканини й м’язів, ХМ взаємодіють із ліпопротеїнліпазою, що пов’язана із глікозаміногліканами на зовнішній поверхні ендотелію капілярів. У результаті гідролізу ХМ звільняють вільні жирні кислоти і моногліцериди, які надходять до адипоцитів та м’язових клітин, де метаболізуються, а ХМ перетворюються на ремнанти, відносно бідні на ТГ і багаті на етери ХС. Ремнанти захоплюються рецепторами печінки, які розпізнають апо-Е та надходять всередину гепатоцита. Таким чином, у результаті транспорту ХМ харчові ТГ доставляються в жирову тканину, а ХС — у печінку. У фізіологічних умовах ХМ присутні в крові тільки після прийому їжі, що містить жири (до 12 год), але не натще. У печінці ХС частково перетворюється на жовчні кислоти, що виділяються з жовчю в тонку кишку, де останні, виступаючи в ролі детергентів, полегшують всмоктування аліментарних жирів.
Ендогенні ліпіди, представлені ТГ, синтезованими в печінці з жирних кислот і гліцерину, разом з невеликою кількістю етерифікованого ХС виділяються в кров у складі ядра ЛПДНЩ. Основні структурно-функціональні білки ЛПДНЩ — апо-В-100, апо-Е і апо-С-I, C-II, C-III. ЛПДНЩ в основному складаються з ендогенних ТГ і меншою мірою з ефірів ХС, тому їхній підвищений зміст у плазмі крові проявляється гіпертригліцеридемією і часто діагностується у хворих з інсуліннезалежним цукровим діабетом, гіпотиреозом, ожирінням. Гіпертригліцеридемія в поєднанні з низьким рівнем ЛПВЩ служить фактором ризику розвитку атеросклерозу. У капілярах жирової й м’язової тканини під впливом ліпопротеїнліпази відбувається гідроліз ТГ із відділенням жирних кислот, які надходять у тканини й використовуються для ресинтеза ТГ. Унаслідок цього багаті на ТГ ЛПДНЩ аналогічно ХМ перетворюються на багаті етерифіковані ХС їх ремнанти — ЛППЩ. Основні транспортні і функціональні білки ЛППЩ — апо-В-100 і апо-Е. Завдяки цим білкам ЛППЩ зв’язуються з відповідними рецепторами печінки. Щільність ЛППЩ — 1,006–1,019 г/мл. Підвищена концентрація в крові ЛППЩ визначається при гіперхолестеринемії і гіпертригліцеридемії. Досить рідко в клінічній практиці відзначають ізольоване підвищення ЛППЩ, яке пов’язане зі спадковим дефектом печінкової ліпопротеїнліпази і супроводжується прогресуючим атеросклерозом. У нормі ЛППЩ частково катаболізуються в печінці шляхом рецептор-опосередкованого ендоцитозу з розпізнаванням апо-Е і апо-В, частково за допомогою печінкової ліпази перетворюються на ЛПНЩ у результаті вилучення з них більшої частини ТГ зі збільшенням відносного вмісту ефірів ХС. При цьому губиться більша частина апопротеїнів.
Ядро новоствореного ЛПНЩ складається переважно з етерів ХС, а оболонка містить тільки апо-В-100 і апо-Е. Оскільки в цих ліпопротеїнах міститься всього 70% ХС плазми крові, їхньою основною функцією є транспорт ХС до позапечінкових клітин організму. Підвищений вміст у плазмі крові ЛПНЩ чітко пов’язаний із розвитком атеросклерозу коронарних, сонних артерій і периферичних судин. Однак для того, щоб ЛПНЩ стали атерогенними, вони повинні модифікуватися. Причиною модифікації найчастіше служить процес перекисного окислювання ЛПНЩ. Окислені ЛПНЩ змінюють свої властивості у двох напрямках: спочатку підвищується їхня взаємодія з рецепторами печінки, потім вони стають активними хемоаттрактантами (подразниками) для моноцитів. Активовані моноцити крові проникають у субендотеліальний простір судин, перетворюючись у макрофаги, які фагоцитують модифіковані ЛПНЩ і перетворюються на «пінисті» клітини, тобто клітини, переповнені етерами ХС. Активовані макрофаги і «пінисті» клітини вивільняють біологічно активні речовини: фактори росту, протизапальні цитокіни, молекули адгезії. У результаті значно підсилюються процеси проникності ендотелію і росту атеросклеротичної бляшки, що в підсумку веде до звуження просвіту судини і/або розриву покришки бляшки з утворенням внутрішньосудинного тромбу. Саме ХС ЛПНЩ, з огляду на його важливу роль у формуванні атеросклеротичної бляшки, представляє головну мішень гіполіпідемічної терапії.
Катаболізм ЛПНЩ здійснюється трьома шляхами: метаболізацією позапечінковими паренхіматозними клітинами (основний шлях), системою фагоцитуючих клітин (клітинами-скевенджерами або «сміттярами») і печінкою. У лізосомах периферійних клітин із ЛПНЩ вивільняється вільний ХС, що за механізмом зворотного зв’язку регулює синтез ХС усередині клітини шляхом інгібування ферменту ГМГ-КоА-редуктази. Цей фермент каталізує перетворення ГМГ-КоА на мевалонову кислоту — ключовий момент синтезу ХС. Клітини-скевенджери поглинають тільки модифіковані ЛПНЩ, які змінили свої властивості внаслідок процесу вільнорадикального окислення ліпідів і перетворюються на вищевказані «пінисті» клітини.
Надлишок ХС у складі ЛПНЩ надходить у печінку, взаємодіючи зі специфічними клітинними рецепторами, де він використовується для утворення жовчних кислот. У патологічних умовах атерогенні ліпопротеїни, багаті на ХС (ЛПНЩ, ЛППЩ, ЛПДНЩ), ініціюють механізми формування атеросклеротичної бляшки в артеріальній стінці.
ЛПВЩ прийнято вважати антиатерогенним фактором. Низькі концентрації ХС ЛПВЩ можуть бути пов’язані не тільки з раннім розвитком атеросклерозу, але також з погіршенням прогнозу для осіб, що мають ССЗ. Негативні ефекти низького вмісту ХС ЛПВЩ залежать від безлічі медико-соціальних причин і тісно пов’язані із загальним ризиком ССЗ в урбанізованих суспільствах, де люди курять, ведуть малорухливий спосіб життя, вживають велику кількість продуктів тваринного походження. Низькі концентрації ЛПВЩ метаболічно пов’язані із високими концентраціями ЛППЩ і ЛПДНЩ. Експерименти на тваринах продемонстрували антиатерогенну активність ЛПВЩ. Участь ХС ЛПВЩ у транспорті ХС від інших органів до печінки або «зворотний транспорт ХС» — основний механізм, завдяки якому ХС ЛПВЩ може захистити стінку артерії. Існують також численні механізми, що пояснюють його прямий захисний ефект: стимуляція простацикліну, блокада синтезу фактора активації тромбоцитів в ендотеліальних клітинах, стимуляція антиоксидантної активності, інгібування адгезії моноцитів на ендотеліальних клітинах на ранніх стадіях атеросклеротичного процесу та ін. Як і для ТГ, не визначені точні цільові рівні, до яких слід підвищувати концентрацію ХС ЛПВЩ. Однак ХС ЛПВЩ <1 ммоль/л (40 мг/дл) у чоловіків і <1,2 ммоль/л (46 мг/дл) у жінок вважають маркером підвищеного серцево-судинного ризику. При виявленні цього лікар повинен звернути увагу пацієнта на необхідність зміни способу життя, зниження високого рівня ХС ЛПНЩ і нормалізації АТ.
Комбінацію помірно підвищеного рівня ТГ і низьких концентрацій ХС ЛПВЩ зазвичай спостерігають у пацієнтів з ранньою маніфестацією атеросклеротичного ураження. Виділяють так звану атерогенну дисліпідемію або атерогенну тріаду, яка включає підвищення сумарної концентрації ХС ЛППЩ і ХС ЛПДНЩ, наявність маленьких щільних часток ХС ЛПНЩ і низьку концентрацію ХС ЛПВЩ. Комбінація високого рівня ТГ і низького рівня ХС ЛПВЩ характерна не тільки для пацієнтів із цукровим діабетом ІІ типу, але також і для пацієнтів з абдомінальним ожирінням і асоціюється з високим ризиком серцево-судинної патології.
Надлишок вільного ХС, що накопичився в периферичних клітинах, ЛПВЩ видаляють шляхом зв’язування апо-А зі специфічними рецепторами. «Навантажені» ХС ЛПВЩ частково транспортують його назад із тканин у печінку, де він катаболізується із утворенням жовчних кислот, частково передають ХС ЛПДНЩ, у результаті чого останні перетворюються на ЛППЩ, а потім на ЛПНЩ. У такий спосіб замикається коло перетворень ХС. Виділяють два підкласи ЛПВЩ: ЛПВЩ-2 і ЛПВЩ-3. ЛПВЩ-3 мають дискоїдну форму і саме вони починають активне захоплювання ХС із периферичних клітин і макрофагів, перетворюючи на ЛПВЩ-2 сферичні частки, багаті на етери ХС і фосфоліпіди. Апобілки апо-А1 і апо-А2 являють собою основні білки ЛПВЩ, за допомогою яких останні зв’язуються з рецепторами печінки і клітинами судинної стінки. Рівень ХС ЛПВЩ у плазмі крові перебуває у зворотній залежності від розвитку атеросклерозу: чим нижчий вміст ХС ЛПВЩ, тим вища ймовірність розвитку атеросклерозу.
Гіпертригліцеридемія також пов’язана із ризиком розвитку атеросклерозу, але цей зв’язок не настільки важливий, як при гіперхолестеринемії, і продовжує обговорюватися клініцистами. Метааналіз 17 популяційних досліджень, що включають >46 000 чоловіків і >10 000 жінок, показав, що ризик ССЗ зростав з підвищенням рівня гіпертригліцеридемії, але був більш тісно пов’язаний з помірною, ніж з тяжкою гіпертригліцеридемією. Це пояснюється тим, що перша відбувається шляхом накопичення в плазмі ХС ЛППЩ і маленьких часток ХС ЛПДНЩ, тоді як остання зумовлена накопиченням великої кількості ХС ЛПДНЩ і ХМ.
Зв’язок гіпертригліцеридемії з атеросклерозом на сьогодні пояснюють трьома патогенетичними механізмами:
1. Подібно ХС ЛПВЩ деякі багаті на ТГ ліпопротеїни можуть проникати в стінку артерії, де згодом накопичуються, спричиняючи атерогенну дію. Це стосується маленьких часток ХС ЛПДНЩ і ХС ЛППЩ.
2. Метаболізм багатих на ТГ ліпопротеїнів тісно пов’язаний із метаболізмом атерогенних ХС ЛПНЩ і ХС ЛППЩ. Маленькі щільні ЛПНЩ з’являються в плазмі крові при концентрації ТГ >1,4 ммоль/л. Високі концентрації ТГ зазвичай спостерігаються в осіб з низькими концентраціями антиатерогенних ЛПВЩ.
3. Гіпертригліцеридемія часто поєднується з іншими факторами ризику ССЗ, і таке сполучення може потенціювати ранній початок хвороби. Перелік цих факторів включає метаболічний синдром, цукровий діабет II типу, АГ, низьку фізичну активність, ожиріння, низьке споживання фруктів і овочів і т.д. При цьому рівні ТГ >1,7 ммоль/л (150 мг/дл) вважають маркером підвищеного серцево-судинного ризику, однак концентрація ТГ <1,7 ммоль/л не розглядається як цільовий рівень терапії.
Серцево-судинний ризик опосередкований також, як зазначалося, концентрацією білкових компонентів ліпопротеїнів — апопротеїнів. На сьогодні обговорюється роль 5 класів аполіпопротеїнів — А, В, C, Д та Е. Аполіпопротеїни або апопротеїни виконують три основні функції: 1) взаємодіють із фосфоліпідами, допомагають солюбілізувати ефіри ХС і ТГ; 2) регулюють взаємодію ліпідів з ферментами — ліпопротеїнліпазою; 3) забезпечують зв’язування ліпопротеїнів зі специфічними рецепторами клітинної мембрани в місцях їхньої взаємодії. Так, апопротеїн А (апо-А) — головний компонент білка ЛПВЩ. Низькі концентрації його субчастки апо-А1, подібно до низьких концентрацій ХС ЛПВЩ, пов’язані із погіршенням прогнозу ССЗ.
На противагу цьому апопротеїн B (aпo-В) — головний компонент білка ЛПНЩ, ЛППЩ, ЛПДНЩ і ХМ. Однак ХМ зазвичай не присутні в плазмі крові натще, і майже весь aпo-В перебуває в атерогенних ліпопротеїнах. Концентрація aпo-В може бути маркером атерогенності ліпопротеїнів плазми крові, особливо у пацієнтів із гіпертригліцеридемією і в осіб з нормальними концентраціями ХС ЛПНЩ, тому що відзначено, що рівні aпo-В >150 мг/дл тісно пов’язані із підвищеним серцево-судинним ризиком.
Велике значення для розуміння патогенезу і лікування хворих із первинними гіпертригліцеридеміями послужило відкриття особливостей метаболізму аполіпопротеїну Е (апо-Е) і мутацій гена ліпопротеїнової ліпази. Апо-Е є одним із ключових регуляторів рівня ліпідів у плазмі крові. Активність апо-Е-рецепторів печінки, зокрема, визначає ступінь катаболізму багатих на ТГ часток або ремнантів ЛПДНЩ і ЛППЩ. Велике клінічне значення в ліпідному обміні відіграють різні ізоформи апо-Е. Ізоформа апо-Е3 вважається «нормальною». Навпаки, гомозиготність по аллелі апо-Е2/апо-Е2 є причиною розвитку рідкісного типу гіперліпідемії — III типу.
Описано також участь у процесах атерогенезу ліпопротеїну (а), що за фізико-хімічними властивостями подібний до ЛПНЩ, але на додаток має апо-а (читати як «ей» маленьке) і в свою чергу має структурну спорідненість із молекулою плазміногену. Ліпопротеїн (а) має атерогенні і тромбогенні властивості, підвищення його рівня в плазмі крові >30 мг/дл тісно корелює з розвитком і прогресуванням атеросклерозу коронарних і сонних артерій. Ліпопротеїн (а) — це атерогенна ліпопротеїнова частка із щільністю 1,051–1,082 г/мл, із середнім діаметром 26 нм, подібна до ЛПНЩ; основною відмінністю між ними служить наявність у складі ліпопротеїну (а) молекули унікального апобілка апо-А, ковалентно пов’язаного з молекулою апо-В-100. Показано, що первинна структура активних ділянок апо-А має 98% гомології з молекулою плазміногену. Ця структурна подібність забезпечує участь ліпопротеїну (а) у процесах атеротромбогенезу шляхом прикріплення тромбу на ділянках судинної стінки, багатих на ліпопротеїн (а). Концентрація ліпопротеїну (а) у крові людини прямо залежить від ступеня атеросклеротичного ураження коронарних, сонних і периферичних артерій. Зараз ліпопротеїн (а) розглядають як незалежний біохімічний маркер атеросклерозу.
Ступінь атерогенності ліпопротеїнів залежить не тільки від їх концентрації, але й від їхнього розміру. Найменшими з ліпопротеїнів є ЛПВЩ, вони легко можуть проникати в стінку артерії та залишати її, не спричиняючи атеросклерозу. У той же час ЛПНЩ, ЛППЩ і маленькі ЛПДНЩ мають також невеликі розміри, що дозволяє їм проникнути в стінку артерії, але при цьому, будучи модифікованими в результаті окислення, вони можуть там затримуватися і поступово ініціювати атеросклеротичний процес. Найбільші ліпопротеїни ХМ і великі ЛПДНЩ власно не є атерогенними, однак високі концентрації цих великих багатих на ТГ ліпопротеїнів можуть спричиняти захворювання підшлункової залози.
Встановлено, що більшість ХС у плазмі крові зазвичай перебуває у вигляді ХС ЛПНЩ. За останні 25 років можна визначити кілька ключових досягнень серед досліджень обміну ліпідів, які так чи інакше вплинули на клінічну практику. Одне з них — це відкриття Мішелем Брауном і Джозефом Гольдштейном механізму генетичних порушень при спадковій гіперхолестеринемії. Розшифровка його у вигляді дефекту рецепторів до ЛПНЩ стала основою для присудження цим видатним вченим Нобелівської премії в 1985 р. і дала ключ до розуміння механізму атерогенності ліпопротеїнів.
Виявлений позитивний зв’язок між рівнем загального ХС, а також ХС ЛПНЩ і ризиком ССЗ. Це стосується як пацієнтів без кардіальної патології, так і пацієнтів з установленою коронарною хворобою; чоловіків і жінок, хоча загальний рівень ризику в жінок нижчий; поширюється на всі вікові групи. У той же час загальний серцево-судинний ризик, відповідно до Рекомендацій Європейського товариства кардіологів, залежить не тільки від рівня ХС, але й від цілого ряду інших факторів ризику: віку, статі, тютюнопаління та АГ. Гіпертригліцеридемія, низький рівень ХС ЛПВЩ і цукровий діабет значно погіршують ефекти ХС ЛПНЩ навіть при помірно підвищених їхніх концентраціях. Разом з тим ІХС виявляють досить рідко в популяціях з рівнем загального ХС <3–4 ммоль/л (115–155 мг/дл), навіть за наявності інших факторів ризику. Навпаки, ІХС неминуча в пацієнтів, яким не проводилася терапія, з важкими формами сімейної гіперхолестеринемії навіть за відсутності інших факторів ризику, що підтверджує провідну роль дисліпідемій в атерогенезі. ХС ЛПНЩ може бути значно підвищеним у пацієнтів зі звичайною формою гетерозиготної сімейної гіперхолестеринемії [7–12 ммоль/л (270–465 мг/дл)] і дуже високим при рідкісній гомозиготній формі [12–20 ммоль/л (465–770 мг/дл)].
Подібно до інших класів ЛПНЩ неоднорідні. Найбільш атерогенні маленькі, щільні ЛПНЩ. Вони з’являються в плазмі крові при концентрації ТГ >1,4 ммоль/л і пов’язані з раннім розвитком ІХС в осіб молодого віку. Атерогенність ХС ЛПНЩ підтверджена результатами епідеміологічних і клінічних досліджень по ангіографічних або клінічних кінцевих точках. Зниження ХС ЛПНЩ повинне бути основним завданням як первинної, так і вторинної профілактики.
КЛІНІЧНІ ПРОЯВИ І ЛАБОРАТОРНЕ ДОСЛІДЖЕННЯ ХВОРИХ ІЗ ДИСЛІПІДЕМІЯМИ
Зовнішні прояви дисліпідемії
У більшості хворих з помірною дисліпідемією зовнішні ознаки порушень ліпідного обміну відсутні. Поява зовнішніх ознак порушення ліпідного обміну у вигляді ксантелазм на повіках (рис. 2.8), ліпоїдної дуги рогівки, туберозних і сухожильних ксантом на ділянках шкіри кистей рук, ліктьових і колінних суглобів (рис. 2.9), ахіллових сухожиль частіше відзначають у хворих із сімейною гіперхолестеринемією або іншими спадковими порушеннями ліпідного обміну. Жовтувате забарвлення долоневого малюнка характерне для хворих з гіперліпідемією ІІІ типу (рис. 2.10), а еруптивні ксантоми, розсіяні по всьому тілу, типові для хворих із комбінованою дисліпідемією.

Рис. 2.8. Ксантелазми повік у хворого з гіперхолестеринемією (Мітченко О.І., Романов В.Ю., 2004. Відділ дисліпідемій Національного наукового центру «Інститут кардіології ім. М.Д. Стражеска»)
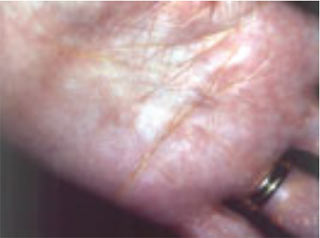
Рис. 2.9. Еруптивно-туберозні ксантоми ліктьового суглоба при сімейній комбінованій дисліпідемії (Мітченко О.І., Романов В.Ю., 2003)
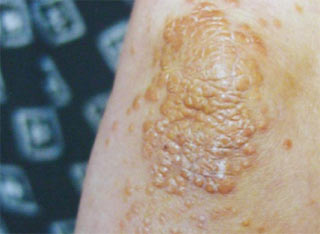
Рис. 2.10. Жовте забарвлення долонь і еруптивний ксантоматоз у хворої з III типом гиперліпідемії (Мітченко О.І., Романов В.Ю., 2008)
Виявлення супутніх факторів ризику ССЗ
Під час обстеження пацієнта важливо виявити супутні, неліпідні фактори ризику. Сполучення декількох факторів ризику істотно збільшує небезпеку розвитку основних серцево-судинних ускладнень у хворих з дисліпідеміями. Виділяють фактори ризику, що модифікуються, та ті, що не модифікуються. До перших належать тютюнопаління, АГ, надмірна маса тіла, низька фізична активність. Факторами ризику, що не модифікуються, є вік пацієнта, стать, обтяжена спадковість, тобто розвиток клінічних проявів ІХС серед найближчих родичів у чоловіків <55 років, у жінок <65 років. Цукровий діабет ІІ типу розглядається як еквівалент ІХС, тобто захворювання, при якому ризик розвитку судинних ускладнень надзвичайно високий (табл. 2.6).
Таблиця 2.6
Основні фактори ризику розвитку й прогресування ІХС
|
Вік |
Чоловіки >45 років Жінки >55 років або з ранньою менопаузою |
|
Ранній початок ІХС у найближчих родичів |
ІМ або раптова смерть у чоловіків <55 років, у жінок <65 років |
|
Тютюнопаління |
Незалежно від кількості |
|
АГ |
АТ >140/90 мм рт. ст. або проведення антигіпертензивної терапії |
|
Гіперхолестеринемія |
Загальний ХС >5 ммоль/л (200 мг/дл); ХС ЛПНЩ >3,0 ммоль/л (115 мг/дл) |
|
Гіпертригліцеридемія |
ТГ >1,7 ммоль/л (150 мг/дл) |
|
Низький рівень ХС ЛПВЩ |
У чоловіків <1 ммоль/л (40 мг/дл); у жінок <1,2 ммоль/л (46 мг/дл) |
|
Цукровий діабет |
Глюкоза крові натще >7,0 ммоль/л (125 мг/дл) |
|
Абдомінальне ожиріння |
Об’єм талії: у чоловіків >102 см, у жінок >88 см (ATP-III, 2001); або в чоловіків >94 см, у жінок >80 см (IDF, 2005) |
Лабораторне визначення ліпідного спектра крові
Беручи до уваги необхідність моніторування рівнів ліпопротеїнів у клінічній практиці, слід користуватися лабораторною діагностикою, яка дозволяє виділити групи ризику. Існуючі методи визначення ліпопротеїнів враховують головним чином ті або інші фізико-хімічні характеристики, які дозволяють ідентифікувати окремі їх класи, що мають певний склад і специфічні шляхи метаболізму. При прямому їх визначенні в клініко-лабораторній практиці застосовують дві методики. Одна з них заснована на особливостях, що виявляються при проведенні електрофорезу, згідно з якими розрізняють ХМ, які залишаються на старті; пре-β-ліпопротеїни, β-ліпопротеїни, що займають проміжне положення, та α-ліпопротеїни як найбільш рухливі фракції. Інша методика враховує характер поділу ліпопротеїнів при ультрацентрифугуванні. Відповідно до цієї методики залежно від питомої щільності виділяють ХМ як найлегші частки, а наступні — як ЛПДНЩ, ЛПНЩ і ЛПВЩ. Між ліпопротеїнами, які ідентифікуються зазначеними методами, існує певна аналогія, тобто пре-β-ліпопротеїни, β-ліпопротеїни і α-ліпопротеїни відповідають ЛПДНЩ, ЛПНЩ і ЛПВЩ.
Разом з тим найчастіше лабораторним шляхом визначаються тільки три складові ліпідного спектра, а саме ХС, ТГ і ХС ЛПВЩ. Прогностично значимий ХС ЛПНЩ у цій ситуації обчислюють за формулою Friedewald*:
- у ммоль/л: ХС ЛПНЩ = загальний ХС — ХС ЛПВЩ — (0,45 · рівень ТГ);
- у мг/дл: ХС ЛПНЩ = загальний ХС — ХС ЛПВЩ — (0,2 · рівень ТГ).
*Обчислення дійсне тільки, якщо концентрації ТГ <4,5 ммоль/л (400 мг/дл). Помилка у визначенні ХС ЛПВЩ або у визначенні ТГ у пацієнтів, що порушили дієтичні рекомендації перед здачею крові, неухильно може викликати помилку в обчисленні найбільш прогностично значимого ХС ЛПНЩ!
Для запобігання виникнення похибок у «Європейських рекомендаціях із профілактики серцево-судинних захворювань у клінічній практиці» рекомендовано визначати ХС не-ЛПВЩ натще. Цей ХС знаходиться в ЛПНЩ, ЛППЩ, ЛПДНЩ. Розрахований шляхом простого вирахування ХС ЛПВЩ із загального ХС ХС не-ЛПВЩ, на відміну від ХС ЛПНЩ, не вимагає умови, щоб рівень ТГ був <5 ммоль/л. Цей показник подібно до апо-B визначає ступінь атерогенності ліпопротеїнів у плазмі і є більше доступним, ніж визначення апо-B. Лікарі, що використовують ХС не-ЛПВЩ для оцінки ризику ССЗ своїх пацієнтів, повинні розглядати його рівень <4 ммоль/л (150 мг/дл) як цільовий.
Визначення декількох змінних плазмових ліпопротеїнів, з одного боку, уточнює, але з іншого — ускладнює оцінку серцево-судинного ризику. Як приклад можна навести обчислення співвідношення загального ХС або ХС ЛПНЩ до ХС ЛПВЩ. Разом з тим слід вказати, що визначення загального ХС, а не ХС ЛПНЩ для визначення ризику ССЗ у наших умовах важливіше, оскільки, як випливає з формули Friedewald, помилка, допущена при вимірюванні ХС ЛПВЩ або ТГ, торкнеться обчислення прогностично значимого ХС ЛПНЩ. Для цієї цілі більш перспективно для оцінки ризику використовувати відношення загального ХС до ХС ЛПВЩ. Відношення загального ХС до ХС ЛПВЩ >5 вказує на підвищений ризик ССЗ, що особливо важливо при оптимальних і граничних концентраціях загального ХС — 5–6,5 ммоль/л (190–250 мг/дл). Значення визначення відношення загального ХС до ХС ЛПВЩ як індикатора ризику ССЗ засноване на ідеї щодо близьких фізіологічних співвідношень між ЛПНЩ і ЛПВЩ і на концепції балансу між «прямим» і «зворотним» транспортом ХС.
Необхідно також враховувати, що дисліпідемія може бути вторинною відносно інших станів, і по очевидних причинах вони повинні бути усунуті перед початком дієти й особливо медикаментозної терапії. Вони включають зловживання алкоголем, цукровий діабет, гіпотиреоз, хвороби печінки і нирок і прийом деяких лікарських засобів. Виключення вимагає клінічної оцінки і проведення деяких клінічних тестів у вигляді визначення тиреотропного гормону, АлАТ, ГГТ, альбуміну, глюкози, рівня глікозильованого гемоглобіну і креатиніну в плазмі крові; визначення середнього змісту еритроцитів, глюкози і білка в сечі. Пацієнти, у яких передбачається генетичне захворювання типу сімейної гіперхолестеринемії, повинні консультуватися з фахівцями, включаючи встановлення молекулярного генетичного діагнозу.
Визначення ризику загальної серцево-судинної смертності з використанням системи SCORE
Пацієнти із установленими ССЗ є групою високого ризику розвитку серцево-судинних ускладнень. Таким пацієнтам необхідні заходи щодо модифікації способу життя, за наявності показань — призначення медикаментозної терапії. У групах із безсимптомним перебігом, тобто у відносно «здорових» пацієнтів, профілактичні заходи необхідно проводити відповідно до рівня загального ризику розвитку ССЗ. Запропоновано різні моделі для підрахунку ризику ССЗ у пацієнтів із безсимптомним перебігом. Ці моделі використовують мультифакторіальний аналіз різних комбінацій факторів ризику в популяціях для визначення подальшого прогнозу.
На сучасному етапі пропонується використовувати модель визначення загального ризику, що ґрунтується на системі SCORE (Systematic Coronary Risk Evaluation — Систематична оцінка коронарного ризику), вперше представлену в Рекомендаціях Європейського товариства кардіологів у 2003 р. Існують деякі відмінності від попередніх варіантів підрахунку. Система SCORE базується на даних ряду останніх проспективних європейських багатоцентрових досліджень і враховує всі варіанти фатальних атеросклеротичних кінцевих точок, тобто фатальних серцево-судинних подій за 10-річний період. У системі SCORE використані наступні фактори ризику: стать, вік, тютюнопаління, САТ, загальний ХС або співвідношення ХС і ЛПВЩ. Критерієм високого ризику був визначений ризик ≥5%, на відміну від попереднього ≥20% у діаграмах з використанням комплексної коронарної крапки.
Практикуючі лікарі повинні використовувати визначення загального ризику ССЗ із метою інтенсифікації профілактичних заходів, тобто при необхідності рекомендувати дієтичні заходи, індивідуалізувати фізичну активність, призначати або коригувати медикаментозну терапію, адаптувати дозування препаратів або їхніх комбінацій для контролю над факторами ризику.
Загальний серцево-судинний ризик може бути легко підрахований з використанням діаграми (рис. 2.11), де практикуючим лікарям і пацієнтам запропоноване використання системи SCORE для визначення загального серцево-судинного ризику і шляхів його зниження (як шляхом модифікації способу життя, так і медикаментозною терапією) відповідно до доведеної ефективності і безпеки (ґрунтуючись на даних багатоцентрових досліджень).
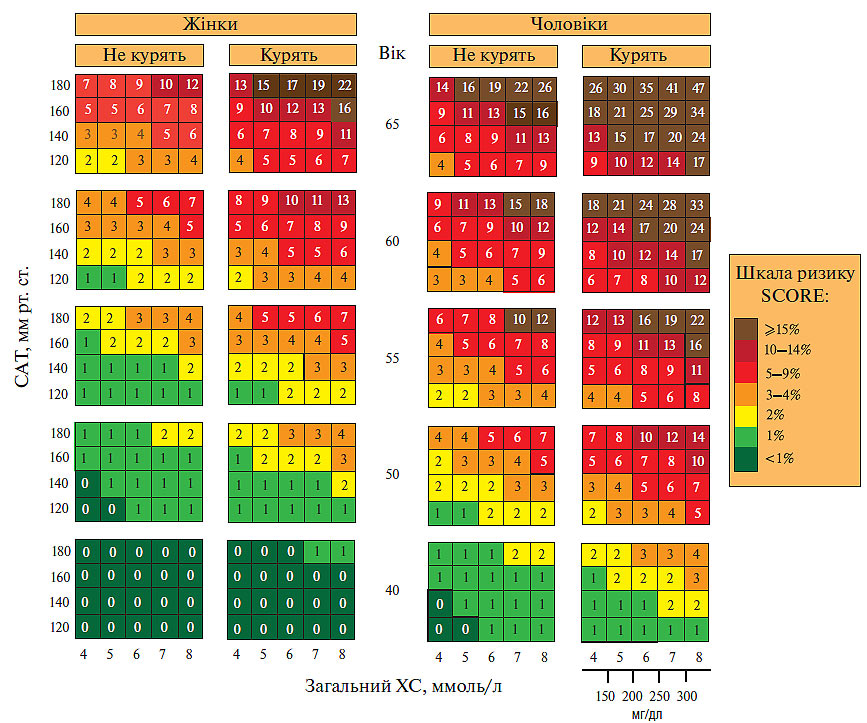
Рис. 2.11. 10-річний ризик фатальних ССЗ у європейських регіонах високого ризику з урахуванням статі, віку, CАТ, загального ХС і тютюнопаління
Система SCORE дозволяє визначити загальний прогнозований серцево-судинний ризик до 60-літнього віку. Визначення цього ризику особливо важливо для довгострокового прогнозу у пацієнтів молодого віку (20–30 років) при низькому абсолютному ризику, але вже з несприятливим профілем факторів ризику. Це дозволяє віднести таких пацієнтів до категорії більш високого ризику, що з віком буде підвищуватися.
До категорій високого загального ризику розвитку фатальних серцево-судинних подій належать:
1. Пацієнти із встановленим ССЗ (хворі з будь-якими клінічними проявами ІХС, периферичним атеросклерозом, атеросклерозом мозкових артерій, аневризмою черевного відділу аорти).
2. Пацієнти з безсимптомним перебігом, що мають
2.1. Множинні фактори ризику, що визначають 10-літній ризик ≥5% у цей момент і до досягнення 60-літнього віку.
2.2. Значно підвищені рівні одного фактора ризику: загального ХС >8 ммоль/л (320 мг/дл); ХС ЛПНЩ >6 ммоль/л (240 мг/дл); АТ >180/110 мм рт. ст.
2.3. Цукровий діабет ІІ типу або діабет І типу з мікроальбумінурією.
3. Найближчі родичі хворих з раннім початком ССЗ: у чоловіків віком до 55 років, у жінок — 65 років.
Інструкція з використання діаграми. Для оцінки персонального 10-літнього ризику кардіоваскулярної смерті необхідно знайти відповідне місце в таблиці з урахуванням статі, віку, статусу курця. Знаходять місце в таблиці з найбільш близьким значенням САТ (мм рт. ст.) і загального ХС (ммоль/л або мг/дл).
Оцінка факторів ризику у віковому аспекті визначається у верхній частині таблиці. Це може бути корисним для дачі рекомендацій людям молодого віку. Осіб з низьким рівнем ризику слід інформувати про необхідність підтримувати цей низький рівень ризику надалі. Максимальну увага необхідно приділяти особам середнього віку, що мають ризик ≥5%. Для визначення відносного персонального ризику порівнюють отримані результати з параметрами, що відповідають пацієнтам, які не курять, того ж віку і статі, з рівнем АТ <140/90 мм рт. ст. і загальним ХС <5 ммоль/л (200 мг/дл). Діаграму можна використовувати для порівняльної оцінки переходу з однієї категорії ризику в іншу, наприклад при відмові від тютюнопаління або зниженні інших факторів ризику.
Примітка: слід зазначити, що загальна кількість факторів ризику може бути вищою, ніж зазначена в діаграмі, оскільки:
- можливий перехід до наступної вікової категорії;
- у пацієнтів із безсимптомними доклінічними проявами атеросклерозу (наприклад за даними КТ, ультрасонографії);
- при сімейному анамнезі попередніх ССЗ;
- у випадках, якщо в пацієнта визначають низький рівень ХС ЛПВЩ, підвищений рівень ТГ, СРБ, фібриногену, гомоцистеїну, аполіпопротеїну В або ліпопротеїну (a), зниження толерантності до глюкози;
- при ожирінні та гіподинамії.
Слід брати до уваги, що вищевказаний 10-річний прогноз кардіоваскулярної смертності >5% (>0,5% за рік) вважається високим для первинної профілактики. Його не слід безпосередньо переносити на ризик виявленої ІХС, тобто використовувати для вторинної профілактики! Відповідно до останніх Рекомендацій по діагностиці і профілактиці стабільної стенокардії (2006) Європейського суспільства кардіологів ризик для встановленої ІХС може бути розцінений як високий при смертності за рік >2%, помірний — 1–2%, низький — <1%. Стратифікацію ризику в останньому випадку необхідно проводити відповідно до клінічних проявів, результатами стрес-тестів, станом функції шлуночків серця та станом коронарного русла.
ПЕРВИННА І ВТОРИННА ПРОФІЛАКТИКА ССЗ ІЗ УРАХУВАННЯМ ВИЯВЛЕННЯ ДИСЛІПІДЕМІЙ
Первинна профілактика спрямована на зниження найближчого (≤10 років) і віддаленого (>10 років) ризику виникнення ІХС і передбачає зміну способу життя: зменшення споживання жирів тваринного походження і ХС, підвищення фізичної активності, контроль маси тіла, зниження рівня ХС у плазмі крові. Цільові рівні ХС ЛПНЩ при проведенні первинної профілактики залежать від абсолютного ризику, чим вищий ризик — тим нижчий цільовий рівень ХС ЛПНЩ.
Основою первинної профілактики є зміна способу життя, однак високі рівні загального ХС (>8 ммоль/л (320 мг/дл)) або наявність множинних факторів ризику є показанням до призначення ліпідознижувальної терапії.
Кожному пацієнтові з високим рівнем ХС ЛПНЩ або іншою формою гіперліпідемії слід провести клініко-лабораторне обстеження для виключення вторинних дисліпідемій ще до початку ліпідознижувальної терапії.
Причинами вторинних дисліпідемій можуть бути:
- цукровий діабет
- гіпотиреоз
- обструкція жовчовивідних шляхів
- ХНН
- прийом препаратів, що підвищують рівень ХС ЛПНЩ, ТГ і що зменшують ХС ЛПВЩ (прогестерон, анаболічні стероїди, ГКС).
При виключенні вторинної дисліпідемії цільові рівні ХС для ліпідознижувальної терапії при первинній профілактиці визначаються відповідно до категорії ризику.
Вторинна профілактика
Останні проведені клінічні дослідження продемонстрували зниження загальної й коронарної смертності, основних коронарних подій, необхідності в проведенні інвазивних процедур на коронарних артеріях та інсульту в осіб із встановленою ІХС під впливом ліпідознижувальної терапії. Як встановлено, рівень загального ХС <4,5 ммоль/л (175 мг/дл), при можливості <4,0 ммоль/л (155 мг/дл) і ХС ЛПНЩ <2,5 ммоль/л (100 мг/дл), при можливості <2,0 ммоль/л (80 мг/дл) є оптимальним, тому він визначений як цільовий рівень терапії при вторинній профілактиці. Це підтверджується результатами клінічних досліджень по оцінці клінічних і ангіографічних кінцевих точок і результатами проспективних епідеміологічних досліджень. Ті ж цільові рівні слід використовувати і у пацієнтів з еквівалентами ризику ІХС. Якщо хворі госпіталізовані у випадку розвитку гострого коронарного синдрому або з метою проведення інвазивних процедур на коронарних артеріях, визначення рівня ліпідів необхідно провести відразу при госпіталізації або протягом 24 год. Цільові рівні повинні орієнтувати лікаря на початок ліпідознижувальної терапії до або відразу після проведення процедур. Корекція терапії може бути проведена через 12 тиж.
ДІАГНОСТИКА ДИСЛІПІДЕМІЙ І АЛГОРИТМ ОБСТЕЖЕННЯ ХВОРИХ ІЗ УРАХУВАННЯМ РИЗИКУ РОЗВИТКУ ТА ПРОГРЕСУВАННЯ ССЗ
Кожній людині віком старше 20 років при зверненні до медичної установи необхідно визначити рівні ХС і ТГ (табл. 2.7); при подальшому обстеженні лікар повинен:
- зібрати анамнез, провести клінічне обстеження;
- при підвищенні рівня ХС і/або ТГ провести визначення розгорнутого ліпідного профілю плазми: ХС, ХС ЛПВЩ, ТГ, ХС ЛПНЩ;
- у пацієнтів без клінічних ознак ІХС і атеросклерозу будь-якої іншої локалізації оцінити за шкалою SCORE фатальний 10-річний ризик ССЗ
- намітити поетапну ціль гіполіпідемічної терапії: зниження ХС ЛПНЩ, потім підвищення ХС ЛПВЩ і в підсумку зниження ТГ;
- почати немедикаментозну терапію: дотримання дієти, корекція маси тіла, підвищення фізичної активності, відмова від тютюнопаління;
- якщо шляхом модифікації способу життя протягом 8–12 тиж не вдається досягти поставленої мети, зберігаючи всі попередні умови, почати медикаментозну гіполіпідемічну терапію. Якщо у хворих із встановленою ІХС або її еквівалентами рівень ХС >4,5 ммоль/л, а ХС ЛПНЩ >2,5 ммоль/л, медикаментозну терапію необхідно почати одночасно із заходами щодо немедикаментозної профілактики ІХС;
- контролювати показники ліпідного обміну, рівень ферментів АлАТ, АсАТ, КФК 1 раз на 3 міс протягом першого року спостереження.
Таблиця 2.7
Категорії осіб, що підлягають лабораторному скринінгу залежно від ступеня ризику ССЗ
|
Вік ≥20 років |
Що визначати |
|
У здорових осіб, що звернулися до медичної установи |
ХС і ТГ |
|
У пацієнтів з ІХС, цукровим діабетом, з АГ, в осіб з декількома факторами ризику (сумарний фатальний ризик >5%) |
Натще ХС, ХС ЛПВЩ, ТГ, ХС ЛПНЩ |
Примітка: у будь-якого пацієнта віком ≥20 років, що звернувся до лікувальної установи, необхідно визначити показники ХС і ТГ. Якщо в обстежуваного виявлена гіперхолестеринемія і/або гіпертригліцеридемія (натще), необхідно визначити повний ліпідний профіль (ХС, ХС ЛПВЩ, ТГ, ХС ЛПНЩ) натще. Рекомендується розрахувати індекс атерогенності ХС — ХС ЛПВШ/ХС ЛПВЩ як важливий показник загрози розвитку і прогресування атеросклерозу.
ЛІКУВАННЯ ХВОРИХ ІЗ ДИСЛІПІДЕМІЄЮ
Модифікація факторів ризику в пацієнтів з дисліпідеміями
Поведінкові фактори ризику
Зміна способу життя (здоровий спосіб життя) необхідна більшості пацієнтів з діагностованим ССЗ і особам із високим ризиком розвитку цієї патології. Однак в останніх публікаціях звертають увагу на значні розходження між рекомендаціями зі зміни способу життя та фактичним дотриманням їх на практиці. Зміна поведінкових факторів ризику аналогічна як для пацієнтів із ССЗ, так і для осіб з високим рівнем ризику розвитку цієї патології, але зміни зазначених факторів ризику (неправильне харчування, тютюнопаління, сидячий спосіб життя), що склалися протягом багатьох років, вимагають професійного підходу.
Багатьом пацієнтам досить важко змінити спосіб життя тільки за порадою лікаря. Це властиво особам соціально та економічно дезадаптованим, самотнім, що перебувають у хронічному стресовому стані.
Крім того, негативні емоції, включаючи депресію, гнів і агресивний настрій, можуть бути бар’єром для профілактичних заходів у такої групи осіб. Терапевт може перебороти ці бар’єри за допомогою простого набору питань. Однак, хоча бесіда і розуміння лікаря можуть бути корисними, а в деяких випадках і достатніми для усунення факторів ризику, для того щоб упоратися з постійними негативними емоціями і стресовим станом пацієнтові може бути необхідна психологічна допомога або проведення відповідної медикаментозної терапії. Оскільки психосоціальні фактори незалежні від стандартних факторів ризику, по можливості необхідно прагнути їхньої нормалізації.
Стратегічні кроки для підвищення ефективності рекомендацій включають:
- розвиток довірчих відносин між терапевтом і пацієнтом;
- розуміння пацієнтом зв’язку між способом життя, здоров’ям і хворобою;
- допомога пацієнтам у зміні поведінки;
- зацікавленість пацієнтів у цій модифікації поведінки;
- залучення пацієнтів до ідентифікації й аналізу факторів ризику;
- використання комбінованих стратегій для зміцнення самосвідомості пацієнта;
- проектування плану модифікації способу життя;
- контроль ефективності при наступному спостереженні;
- залучення до рішення цього питання інших підрозділів органів охорони здоров’я.
Відмова від тютюнопаління
Всі курці повинні заохочуватися в прагненні відмовитися від тютюнопаління. Стратегія містить у собі «5А»:
1A) — «ask» (запитати): систематично ідентифікувати курців;
2А) — «assess» (оцінити): ступінь готовності до відмови від тютюнопаління;
3A) — «advise» (радити): переконливо радити відмовитися від тютюнопаління;
4A) — «assist» (брати участь): рекомендувати нікотинзамісну терапію та/або фармакологічний вплив;
5A) — «arrange» (упорядковувати): упорядкувати графік наступних відвідувань.
Підвищення фізичної активності
Фізична активність повинна підвищуватися в пацієнтів усіх вікових груп — від дитячого до дорослого населення. Особливу увагу слід приділити групі підвищеного ризику, у якій фізична активність повинна приводити до зниження ризику виникнення ССЗ. Ціль, до якої необхідно прагнути, — це як мінімум півгодини фізичної активності щодня, хоча більш помірна активність також приносить користь. Здоровим людям необхідно радити вибрати найбільш прийнятні фізичні навантаження, які вписуються в їхній розпорядок дня, переважно 30–45 хв 4–5 разів на тиждень, досягаючи 60–75% максимального навантаження на серце.
Для пацієнтів із установленим ССЗ рекомендації з розширення фізичної активності повинні базуватися на всебічному клінічному обстеженні із залученням результатів навантажувальних тестів.
Для оцінки припустимих фізичних навантажень пацієнта корисно застосовувати наступний розподіл фізичної активності (табл. 2.8).
Таблиця 2.8
Зіставлення градацій фізичної активності
|
Активність |
Щоденна |
Професійна |
Спортивна |
|
Легка <40 Вт |
Самообслуговування, туалет, одягання |
Водіння автомобіля |
Прогулянки |
|
Середня 40–85 Вт |
Домашні роботи |
Робота стоячи |
Велосипед |
|
Енергетична 85–120 Вт |
Сексуальна активність |
Будівельні роботи |
Плавання |
|
Напружена 120–160 Вт |
Швидкий підйом по сходам |
Робота на городі, у парку |
Біг |
|
Атлетична 150–240 Вт |
Підйом ваги >40 кг |
Робота лісоруба |
Регбі, футбол |
Надмірна маса тіла й ожиріння
Нормалізація маси тіла або зниження наявної надмірної маси важливі як для пацієнтів з ІХС, так і для осіб з високим ступенем ризику. Наявність ожиріння верифікується відповідно до критерію ВООЗ (1998) — ІМТ при його значенні >30 кг/м2. Зниження маси тіла потрібне особам з ожирінням або надмірною масою тіла (25 кг/м2< ІМТ <30 кг/м2), а також всім особам з абдомінальним типом ожиріння, що визначається за об’ємом талії (>94 см у чоловіків і >80 см у жінок (IDF, 2005)). Зниження маси тіла буде більш успішним, якщо буде підтримуватися, з одного боку, професійно лікарями, а з іншого боку — наявністю мотивації з боку самого пацієнта.
Ліпідознижувальна терапія у пацієнтів із дисліпідеміями
Дієта
Формування здорової дієти є невід̓ємною частиною лікування пацієнтів із дисліпідеміями. У кожному окремому випадку необхідна професійна консультація щодо вибору дієти, яка б максимально знижувала ризик ССЗ. Правильно підібрана дієта сприяє нормалізації маси тіла, АТ, ліпідного обміну, контролює рівень глюкози крові та знижує ймовірність виникнення тромбозу.
Загальні рекомендації необхідно адаптувати відповідно до національних особливостей:
- необхідно урізноманітити раціон харчування; споживання енергії повинне бути відрегульоване відповідно до енерговитрат з метою підтримки ідеальної маси тіла;
- пріоритет необхідно надавати таким продуктам, як овочі й фрукти, неочищені злаки й хліб грубого помолу, молочні продукти з низьким вмістом жиру, знежирені дієтичні продукти, пісне м’ясо і риба;
- бажано переважне споживання жирних сортів риби, які містять омега-3-поліненасичені жирні кислоти, що мають специфічні захисні властивості;
- загальне споживання жиру не повинне перевищувати 30% витраченої енергії, частка насичених жирів не повинна перевищувати ⅓ загального споживання жиру; добове споживання ХС не повинне перевищувати 300 мг;
- у низькокалорійній дієті насичені жири можуть частково заміщатися складними вуглеводами, моно- і поліненасиченими жирами овочів і морепродуктів.
- збільшення споживання вуглеводів, що містяться у свіжих фруктах, злаках і овочах. Гіпертонікам та особам з надмірною масою тіла рекомендується додатково знизити споживання кухарської солі ≤5 г/добу; обмежити вживання алкоголю.
Для осіб з надмірною масою тіла необхідне обмеження калорійності їжі. Продукти харчування, що рекомендуються, зазвичай містять мало жирів і/або багато клітковини. Ці продукти повинні бути основою раціону (табл. 2.9). Деякі пацієнти з вираженою гіпертригліцеридемією мають потребу в дієті, що суворо обмежує вміст довголанцюгових жирних кислот у продуктах тваринного і рослинного походження. Метою цієї дієти є запобігання панкреатиту. Ця рекомендація істотно відрізняється від загальних дієтичних рекомендацій, більшість пацієнтів буде потребувати допомоги кваліфікованого дієтолога.
Таблиця 2.9
Харчовий склад антиатерогенної дієти
|
Поживні речовини |
Рекомендоване споживання |
|
Насичені жири* |
<7% загального калоражу |
|
Поліненасичені жири |
До 10% загального калоражу |
|
Мононенасичені жири |
До 20% загального калоражу |
|
Загальні жири |
25–35% загального калоражу |
|
Вуглеводи** |
50–60% загального калоражу |
|
Харчові волокна |
20–30 г/добу |
|
Білок |
Приблизно 15% загального калоражу |
|
ХС |
<200 мг/дл/добу |
|
Добовий калораж*** |
Для підтримки бажаної маси тіла і запобігання її збільшенню необхідно дотримуватися балансу між споживанням і витратами енергії Для зменшення маси тіла необхідно зменшити споживання калорій, але не <1200 ккал/добу |
*Споживані жирні кислоти сприяють збільшенню ХС ЛПНЩ, їх споживання слід обмежити.
**Вуглеводи необхідно отримувати переважно з харчових продуктів, багатих складними вуглеводами, включаючи зернові, особливо цільне зерно, а також із фруктів та овочів.
***Щоденні енерговитрати повинні включати хоча б помірну фізичну активність (приблизно 200 ккал/добу).
Пацієнти з АГ, цукровим діабетом, гіперхолестеринемією або іншими дисліпідеміями повинні консультуватися з дієтологом.
Ліпідознижувальні препарати
Ефективність застосування ліпідознижувальних препаратів пов’язана із поліпшенням функції ендотелію, стабілізацією атеросклеротичної бляшки, гальмуванням або регресією атеросклерозу. Медикаментозне лікування дисліпідемій передбачає використання 4 груп препаратів: інгібіторів ГМГ-КоА-редуктази, статинів (ловастатин, симвастатин, правастатин, аторвастатин, розувастатин); секвестрантів жовчних кислот (колестирамін, колестипол); нікотинової кислоти, нікотинаміду, фібратів (гемфіброзил, безофібрат, фенофібрат).
Інгібітори ГМГ-КоА-редуктази (статини)
Статини — основний клас препаратів у лікуванні дисліпідемій. За результатами великих рандомізованих досліджень продемонстрована їх висока ефективність у зниженні загального ХС і прогностично значимого ХС ЛПНЩ. Відповідно до висновків цих досліджень виявлене зниження основних ускладнень ССЗ (інфаркту, інсульту, загальної і серцевої смертності) більше ніж на 25–40%.
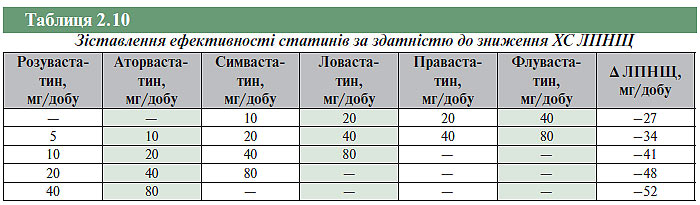
На сьогодні застосовують наступні препарати: ловастатин, правастатин, флувастатин, симвастатин, аторвастатин і найбільш активний відносно блокади ГМГ-КоА-редуктази, новий препарат розувастатин. В основі механізму дії статинів — часткова зворотна блокада ферменту ГМГ-КоА-редуктази, відповідального за внутрішньоклітинний синтез ХС. Зниження внутрішньоклітинної концентрації ХС приводить до відновлення/підвищення функції клітинних рецепторів до ЛПНЩ, що забезпечує збільшення сироваткового кліренсу і зниження сироваткового рівня ХС ЛПНЩ у середньому на 25–40%. На фоні терапії статинами спостерігають помірне підвищення ХС ЛПВЩ (на 5–15%) і зниження рівня ТГ на 10–40%. Ефекти статинів дозозалежні. Так, наприклад, симвастатин у дозі 40 мг/добу знижує рівень ХС ЛПНЩ у середньому на 41%, а в дозі 80 мг — на 47%. Разом з тим крива залежності ефекту симвастатину від дози, як і у інших статинів, має вигляд експоненти: кожне подвоєння дози приводить до додаткового зниження рівня ХС ЛПНЩ у середньому на 6% («правило шістки»).
Вплив статинів на організм хворого — багатоступінчастий процес прояву ефектів препарату в часі, у зв’язку із чим можна говорити про терапевтичний каскад ефектів статинів. Найбільш рання дія цих засобів реалізується через кілька тижнів/місяців після початку терапії і проявляється в поліпшенні функції ендотелію, зменшенні процесів судинного запалення (зниження рівня СРБ), стабілізації атероматозної бляшки, що в результаті приводить до поліпшення перфузії міокарда, зменшення ішемії. Важливим на цьому етапі є також більш раннє (після 1 року терапії — у дослідженні HPS) розходження кривих виживаності порівняно з очікуваними результатами, які могли б бути зумовлені винятково гіполіпідемічним впливом статинів. Наприклад, у дослідженні POSCH пацієнтам проводили часткове шунтування тонкого кишечнику, що приводило до зниження всмоктування жирів і зниження рівня ХС ЛПНЩ на 39%, однак підвищення виживаності відзначали тільки через 3 роки після оперативного втручання. Одним із механізмів стабілізуючої дії статинів на атерому є їх вплив на макрофаги. Статини впливають на нуклеарні α-рецептори пероксисомних проліфераторів, у зв’язку із чим пригнічується продукція металопротеїназ та інших факторів, що сприяють дестабілізації атероматозної бляшки.
Основними ефектами статинів на другому рівні терапевтичного каскаду є запобігання прогресуванню старих бляшок і появі нових, а також часткове зменшення (регрес) об’єму вже існуючих. Так, у дослідженні MAAS після 2-річного лікування симвастатином прогресування атеросклерозу відзначали на 30% рідше, ніж у контрольній групі, а регрес атером — на 30% частіше.
Третій рівень каскаду дії статинів досягається через ≥4 роки від початку лікування. При цьому досягаються основні стратегічні цілі: зниження кардіальної та загальної смертності (на 18–30%); запобігання серйозним серцево-судинним ускладненням, зменшення потреби в реваскуляризації. Найбільш високу ефективність статини демонструють у групах високого ризику: у пацієнтів похилого віку, із супутнім цукровим діабетом, атеросклерозом мозкових і периферичних артерій.
Четвертий рівень дії статинів — позитивний вплив на некардіальну патологію. Так, є відомості про позитивний вплив статинів не тільки на кількість серцево-судинних ускладнень у хворих на цукровий діабет, але й на перебіг самого захворювання. Встановлено, що серед осіб, що приймають статини, частота розвитку цукрового діабету на 30% нижче. Перспективною є інформація про зниження на фоні терапії статинами ризику розвитку хвороби Альцгеймера і судинної деменції. Результати недавно проведених досліджень показали, що застосування статинів приводить до дворазового зменшення остеопорозу і частоти переломів кісток, особливо в групі пацієнтів похилого віку. Ці ефекти статинів не пов’язані з ліпідознижувальною дією, паралельний аналіз не виявив зазначених ефектів ані для нікотинової кислоти, ані для фібратів.
Різні статини відрізняються за фармакологічними властивостями. Перші статини (ловастатин, симвастатин і правастатин) були виділені з культури пеніцилінових грибів і грибів Aspergillus terreus, у той час як флувастатин, аторвастатин і розувастатин — синтетичні препарати. Відрізняються статини і за іншими властивостями: так, ловастатин і симвастатин — ліпофільні сполуки, правастатин і флувастатин — більшою мірою гідрофільні. Ловастатин і симвастатин надходять в організм у неактивній формі (pro-drugs/проліки) і перетворюються на активні метаболіти в печінці. Суттєва перевага природних статинів полягає в тому, що активні форми препарату діють тільки в печінці і не досягають периферичних тканин, що знижує ризик серйозних побічних ефектів, таких як міопатія. Період напіввиведення природних статинів із плазми крові становить 0,5–3 год, що також важливо для зниження ризику побічних явищ. Період напіввиведення синтетичного препарату аторвастатину (у вигляді активного метаболіту) становить 14 год. Статини метаболізуються системою цитохромів, у тому числі Р450, у зв’язку з чим лікарські препарати, що впливають на активність печінкових цитохромів, можуть значно змінювати їхні властивості (біодоступність, тривалість дії та ін.). Найбільш виражений гіполіпідемічний ефект характерний для розувастатину (табл. 2.10).
На сьогодні для проведення первинної і вторинної профілактики ІХС найбільш обґрунтованим слід вважати застосування статинів, для яких доведений позитивний вплив на довгостроковий прогноз (зниження серцево-судинної смертності на 30–40%). Як показали результати досліджень (АЕСАР TexCAPS, WOSCOPS, 4S, CARE, LIPID, MIRAС, AVERT), застосування статинів приводить до зниження на 25–40% коронарної смертності, на 26–30% знижує ризик розвитку ішемічних подій. Призначення пацієнтам з ІХС правастатину (CARE, 1996) і симвастатину (HPS, 2001) супроводжувалося зменшенням загальної й серцево-судинної смертності як у пацієнтів з підвищеним, так і нормальним або трохи зниженим рівнем ХС.
Результати повторних коронароангіографій у серії досліджень із застосуванням різних гіполіпідемічних препаратів підтвердили їх здатність приводити до гальмування і регресії коронарного атеросклерозу. Клінічний ефект зниження ХС ЛПНЩ за принципом «чим нижче, тим краще» був неодноразово підтверджений у серії клінічних досліджень, проведених в 80–90-ті роки із застосуванням повторних ангіографій, які довели регресію атеросклерозу. Був встановлений гіпотетичний діапазон, при якому зниження ХС ЛПНЩ мало анатомічний і клінічний ефект — ∆% ХС ЛПНЩ = 25–45%. Клінічні дані по безпеці і зниженню серцево-судинної смертності, отримані в регресивних дослідженнях, а також дані тривалої доброї переносимості і безпеки застосування статинів послужили науковим обґрунтуванням для проведення багатоцентрових клінічних досліджень із «твердими» кінцевими точками (серцево-судинна і загальна смертність).
Однак виражені клінічні ефекти при застосуванні ліпідознижувальних засобів, особливо статинів, не завжди відповідали результатам ангіографічного дослідження. Як виявилося, крім гальмування прогресування атеросклерозу шляхом зменшення накопичення ліпідів у місці атеросклеротичного ураження, статини також реалізують свою дію шляхом нормалізації функції ендотелію і стабілізації атеросклеротичної бляшки, яка стає більш щільною і стійкою до механічних впливів. Відповідно знижується ймовірність розриву бляшки і розвитку тромбозу і тим самим забезпечується попередження гострого коронарного синдрому. Ці додаткові ефекти статинів, пов’язані із поліпшенням функції ендотелію, вивільненням і біодоступністю оксиду азоту, зменшенням процесу запалення в атеросклеротичній бляшці, міграції і проліферації гладком’язових клітин судинної стінки, агрегації тромбоцитів, підвищенням фібринолітичної активності крові та інші, добре вивчені в експериментальних і клінічних дослідженнях і отримали назву плейотропних, ліпідонезалежних ефектів. Саме з цими механізмами багато дослідників пов’язують вищу клінічну ефективність статинів порівняно з іншими групами ліпідознижувальних препаратів. Нещодавно встановлено, що статини в низьких дозах викликають неоангіогенез дрібних судин міокарда, чим поліпшують його перфузію.
У підходах до призначення гіполіпідемічних засобів було зроблено переворот, коли з’ясувалося, що навіть нормальний рівень ХС може бути потенційно небезпечним відносно розвитку і прогресування атеросклерозу коронарних судин. Як виявилося, 35% хворих з ІХС мають нормальний рівень загального ХС і ХС ЛПНЩ. Однак у таких пацієнтів може спостерігатися дисліпопротеїнемія з підвищеним вмістом у крові найбільш атерогенної субфракції ЛПНЩ, так званих маленьких щільних часток ЛПНЩ, яка поєднується з підвищенням ТГ і низьким рівнем ХС ЛПВЩ. Особливо часто такі порушення виявляють у пацієнтів з метаболічним синдромом і цукровим діабетом ІІ типу. У дослідженні CARE (The Cholesterol and Recurrent Events Trial) уперше показаний ефект ліпідознижувальної терапії (правастатин) у пацієнтів, які перенесли серцевий напад із середнім рівнем ХС 209 мг/дл. У великому дослідженні HPS (Heart Protection Study), у якому брали участь 20 536 пацієнтів, оцінювали вплив симвастатину (40 мг/добу) і вітамінів (600 мг вітаміну Е; 250 мг вітаміну С; 20 мг β-каротину щодня) на загальну смертність і смертність від серцево-судинних причин у хворих з ІХС із групи високого ризику. За результатами дослідження зроблені наступні висновки:
- застосування вітамінів було безпечним, однак не знижувало ризик розвитку серцево-судинних подій протягом 5 років, незважаючи на підвищення рівня вітамінів у крові;
- застосування симвастатину 40 мг/добу також безпечно, але при цьому знижувався ризик розвитку несприятливих судинних подій на 24% у всіх вікових групах незалежно від статі. У старшій віковій групі (в осіб >75 років) лікування спричиняло найбільш виражений ефект і привело до зниження ризику смерті на 32%;
- застосування симвастатину не супроводжувалося підвищенням частоти онкологічних захворювань, сумарний показник смертності від всіх причин зменшився на 12%.
Застосування симвастатину супроводжувалося зниженням ризику розвитку судинних подій у пацієнтів з початково нормальним рівнем ЛПНЩ і ТГ, так само ефективно, як і для пацієнтів з високим рівнем зазначених показників. Таким чином, призначення статинів рекомендується всім пацієнтам з доведеною ІХС і високим ризиком судинних ускладнень незалежно від статі, віку і вихідного рівня ХС. Непризначення статинів таким хворим є лікарською помилкою.
Прийом статинів як мінімум на третину знижував ризик розвитку ІМ, мозкового інсульту, необхідність у реваскуляризації і запобігав судинним ускладненням також незалежно від вихідного рівня ХС. У дослідженні захисту серця — HPS (Heart Protection Study) продемонстровано, що зниження рівня ХС під впливом симвастатину знижує ризик частоти ішемічного інсульту. Встановлено, що ефект ліпідознижувальної терапії залежить від вихідного рівня ризику: чим вищий ризик, тим вищий ефект, тобто абсолютне скорочення ризику було найбільш високим у пацієнтів найбільш високого ризику. Головна знахідка HPS полягає в тому, що лікування пацієнтів з цереброваскулярною патологією, захворюваннями периферичних артерій і цукровим діабетом настільки ж ефективно, як і терапія пацієнтів з ІХС.
Слід зазначити, що на сьогодні проведено ряд багатоцентрових досліджень, у яких порівнювали ефективність та безпеку ліпідознижувальних препаратів. Показовими виявилися результати аналізу зіставних доз статинів у дослідженні CURVES (Comparative study of HMG-Co Reductase inhibitor, atorvastatin, Versus Equivalent dose strengths of Statins) — рандомізованому відкритому вивченні статинів у паралельних групах порівняння. У ньому аторвастатин продемонстрував більш виражене зниження рівня загального ХС і ХС ЛПНЩ у дозі 10 мг порівняно з дозами 20 мг симвастатину і 40 мг правастатину і церивастатину. Побічні ефекти на фоні використання аторвастатину відзначали тільки у 2% хворих. Наступним слід згадати дослідження ACCESS (The Atorvastatin Comparative Cholesterol Efficacy and Safety Study), у якому порівняно з іншим статинами (симвастатин, ловастатин, правастатин, флувастатин), лікування аторвастатином привело до максимального зниження ХС ЛПНЩ як через 6 тиж (–36%), так і через 54 тиж терапії (–42%).
Наступна група доказів отримана в багатоцентрових дослідженнях з досягнення клінічних точок. Так, у дослідженні ASCOT-LLA (Anglo-Scandinavian Cardiac Outcomes Trial — Lipid-Lowering Arm), у якому ліпідознижувальна гілка спостереження була закінчена достроково у зв’язку з явною перевагою ліпідознижувальної терапії проти плацебо. Аторвастатин знижував рівень загального ХС на 1,3 ммоль/л в 1-й рік і на 1,1 ммоль/л через 3 роки. У групі аторвастатину було зареєстроване зниження відносного ризику первинних кінцевих точок (нефатальний ІМ і фатальні випадки ІХС) порівняно з групою плацебо на 36%. У групі аторвастатину було також відзначене зниження відносного ризику для фатального і нефатального інсульту на 27%, усіх серцево-судинних подій на 21%, а коронарних — на 29%. За результатами дослідження MIRACL (Myocardial Ischaemia Reduction with Aggressive Cholesterol Lowering) — рандомізованого подвійного сліпого плацебо-контрольованого порівняння застосування 80 мг/добу аторвастатину або плацебо з дотриманням дієти відзначали редукцію міокардіальної ішемії на фоні агресивної холестеринзнижувальної терапії. При цьому сумарну первинну кінцеву точку (смерть, нефатальний ІМ, зупинка серця з реанімаційними заходами, рецидив симптомів ішемії міокарда з об’єктивним підтвердженням, що потребує невідкладної повторної госпіталізації) відзначали в 14,8% випадків у групі аторвастатину й у 17,4% у групі плацебо. Порівняно з плацебо аторвастатин знизив ризик ішемії з об’єктивними ознаками, яка вимагає невідкладної повторної госпіталізації. Застосування препарату вірогідно знизило ризик розвитку фатального і нефатального інсульту у хворих з високим ризиком на 50%. У групі пацієнтів, які приймали аторвастатин, рівень ХС ЛПНЩ знизився з 3,2 до 1,9 ммоль/л. Одним з основних висновків цього дослідження було те, що в пацієнтів з гострим коронарним синдромом лікування аторвастатином, що було розпочато в гострий період коронарних подій, допомогло запобігти повторенню міокардіальної ішемії протягом наступних 4 міс.
Наступним рішенням актуальних завдань терапії статинами було дослідження оптимального рівня, до якого необхідно знижувати ХС ЛПНЩ із метою отримання максимального клінічного ефекту. Цій меті відповідало дослідження PROV-IT, відповідно до якого порівнювали лікування високоінтенсивною ліпідознижувальною терапією, у якості якої застосовувався аторвастатин у дозі 80 мг/добу, і стандартної ліпідознижувальної терапії правастатином у дозі 40 мг/добу. Перевагу інтенсивної терапії було виявлено вже через 30 днів, вона зберігалося протягом всього дослідження. Як і передбачалося, у пацієнтів із ХС ЛПНЩ >3,23 ммоль/л найвищий ефект лікування (–34% при досягненню первинної кінцевої точки) відзначений у групі інтенсивної ліпідознижувальної терапії аторвастатином.
Гіпотеза щодо переваги зниження ХС ЛПНЩ нижче згаданого цільового рівня в рекомендаціях ATP-III (2001), а саме — 2,6 ммоль/л знайшла своє підтвердження в дослідженні TNT (Treating to New Targets — «Лікування до нових цілей»), у якому була порівняна ефективність двох доз одного препарату — аторвастатину 10 мг і 80 мг. Протягом 5 років отримані переконливі результати при інтенсивній ліпідознижувальній терапії аторвастатином у дозі 80 мг, що дозволили знизити ризик серцево-судинних ускладнень на 22% (р<0,001). Проте було відзначене зростання побічних реакцій у вигляді росту гіперферментемії на фоні інтенсивного режиму лікування від 0,1–0,3 до 1,2%.
Додатковий результат переваги своєчасної ліпідознижувальної терапії навіть невисокими дозами статинів у груп із високим ризиком отриманий відповідно до результатів багатоцентрового рандомізованого дослідження CARDS, присвяченого спостереженню хворих із високим ризиком серцево-судинних ускладнень (хворі на цукровий діабет), у пацієнтів без серцево-судинних захворювань на момент включення в дослідження. Відповідно до отриманих результатів аторвастатин у дозі 10 мг/добу забезпечив на 37% зниження частоти розвитку тяжких серцево-судинних ускладнень, на 48% — частоти розвитку інсультів, на 27% — смертності від всіх причин. А дебати щодо того, чи всім хворим на цукровий діабет ІІ типу необхідно призначати статини, відтепер повинні трансформуватися в питання: чи існують на сьогодні хворі з досить низьким ризиком ускладнень, яким статини можна не призначати, тобто їх потрібно обов’язково призначати хворим на цукровий діабет ІІ типу.
Проведений нещодавно метааналіз тривалих багатоцентрових досліджень (опублікований у журналі «Lancet», 2005), у якому проаналізовані спостереження 90 056 пацієнтів, які отримували терапію статинами, продемонстрував, що зниження ХС ЛПНЩ на 1,0 ммоль/л/рік привело до зниження на 12% загальної смертності від усіх причин і на 19% — коронарної смертності. Ці закономірності з’являються вже наприкінці 1-го року спостереження і мають подальший достовірний ріст. Протягом 5 років зниження ХС ЛПНЩ на 20% приводить до зменшення на 48 випадків з кожної 1000 пролікованих із приводу основних серцево-судинних подій (інфаркт, інсульт), на 27 — коронарної реваскуляризації, при цьому не визначено достовірного зростання побічних реакцій, у тому числі випадків онкозахворювань. Ці результати підтверджені переконливими доказами великих метааналізів, проведених іншими дослідниками, в яких отримані відомості про переваги більш інтенсивного зниження ХС ЛПНЩ — <70 мг/дл (1,8 ммоль/л), що знайшло відображення в новій редакції американських рекомендацій ATP-III, відкоригованих у 2004 р., де вищевказані рівні ХС ЛПНЩ позначені як цільові для груп високого ризику, насамперед для хворих із поєднанням ІХС і цукрового діабету. Проте слід зазначити, що такі цільові рівні для ХС ЛПНЩ, не прийняті ще для широкого використання у хворих з ІХС Європейським кардіологічним товариством відповідно до Рекомендацій по діагностиці і лікуванню стабільної стенокардії (2006), зазначені як «цільові» для хворих на цукровий діабет відповідно до Рекомендацій Європейського кардіологічного товариства по діагностиці і лікуванню діабету, предіабету і кардіоваскулярних захворювань (2007).
Останніми переконливими доказами ефективності ліпідознижувальної терапії є результати двох досліджень — REVERSAL, 2004 і ASTEROID, 2006. При аналізі підсумків відзначається можливість регресу атеросклеротичної бляшки внаслідок інтенсивної терапії статинами з об’єктивізацією отриманих даних шляхом проведення внутрішньосудинного УЗД (IVUS). Відповідно до отриманих результатів зниження ХС ЛПНЩ і підвищення ХС ЛПВЩ привело до регресу атеросклеротичних бляшок щодо проведених параметрів дослідження, що дозволило рекомендувати подальшу інтенсивну терапію статинами всім хворим з діагностованими атеросклеротичними ураженнями коронарних судин.
Подальше підвищення ефективності гіполіпідемічної терапії статинами можливо 3 шляхами: 1 — підвищення дози статинів, але цей шлях, безумовно, призводить до росту кількості побічних реакцій; 2 — застосування нових синтетичних статинів, однак слід брати до уваги побічні ефекти церивастатину, що значно перевищував за гіполіпідемічною ефективністю інші статини, але був знятий з виробництва у зв’язку з більшим відсотком розвитку побічних реакцій; 3 — застосування комбінації статинів з іншими ліпідознижувальними засобами. Найбільші перспективи на сьогодні притаманні комбінації статинів з езетимібом, який перешкоджає всмоктуванню ХС у кишечнику. Позитивний клінічний досвід зареєстрований на фоні комбінації езетимібу із симвастатином, що привело до значного посилення гіполіпідемічного ефекту ліпідознижувальних засобів.
Секвестранти жовчних кислот
Препарати цієї групи (колестирамін, колестипол) використовують у клінічній практиці >3 десятиліть. Препарати відрізняються за хімічною структурою, але подібні за механізмом дії, який полягає в перериванні природної рециркуляції пулу жовчних кислот, збагачених ХС. Жовчні кислоти синтезуються в печінці. У нормі близько 3% жовчних кислот видаляється з організму, а частина, що залишилася, рециркулює після абсорбції в дистальних відділах кишечнику. Препарати зв’язують жовчні кислоти в кишечнику, запобігаючи їх реабсорбції та підвищуючи їх екскрецію в 2–10 разів. Підвищене виведення жовчних кислот приводить до посилення їхнього синтезу в печінці, що в свою чергу викликає зниження рівня внутрішньопечінкового ХС. Додатково препарати знижують абсорбцію ХС, що надходить із їжею, і впливають на рецептори до ЛПНЩ. Основним недоліком тривалої терапії секвестрантами жовчних кислот є зниження їхньої ефективності, що зумовлене вторинною стимуляцією печінкового ферменту ГMГ-КoА-редуктази і в свою чергу приводить до підвищення синтезу ХС. У зв’язку із цим колестирамін і колестипол часто призначають у комбінації зі статинами, блокуючи цим активність ГMГ-КoА-редуктази. Призначення секвестрантів жовчних кислот приводить до зниження загального ХС і ХС ЛПНЩ, останнього на 15–30%, підвищенню ХС ЛПВЩ у середньому на 5%, показники ТГ можуть варіювати, незначно може підвищуватися ХС ЛПДНЩ. Позитивною стороною терапії секвестрантами жовчних кислот є відсутність у них системної дії. Однак у цілому вони викликають велику кількість побічних реакцій з боку ШКТ: біль, здуття живота, гастроезофагеальний рефлюкс. Застосування зазначених препаратів призводить до порушення всмоктування жиророзчинних вітамінів (А, D, E). Для секвестрантів жовчних кислот характерні взаємодії з тироксином, дигоксином, блокаторами β-адренорецепторів, діуретиками, варфарином, різними антибіотиками. У зв’язку із чим призначення перелічених препаратів рекомендується за 1 год до або через 4–6 год після прийому колестираміну/колестиполу.
Нікотинова кислота
Нікотинова кислота являє собою вітамін групи В, однак дози, які використовуються для корекції ліпідних порушень, набагато перевищують природну потребу організму власне у вітаміні. Нікотинова кислота виявляє позитивну дію практично при всіх порушеннях ліпідного обміну, за винятком дисліпідемій I типу за Фридериксоном (збільшення кількості ХМ). Нікотинова кислота впливає на печінковий синтез і вивільнення ЛПДНЩ. Утворення ЛПДНЩ — перша сходинка в ендогенному ліпідному каскаді, зниження синтезу і вивільнення ліпопротеїнів-попередників приводить до зниження концентрації всіх наступних ліпопротеїнів. Механізм впливу нікотинової кислоти на ліпідний обмін може також бути пов’язаний із впливом на рецептори ЛПНЩ. Нікотинова кислота виявляє позитивний вплив на вміст ХС ЛПВЩ. Підвищення ХС ЛПВЩ найбільш значне в осіб із початково підвищеним рівнем ТГ. На відміну від усіх інших гіполіпідемічних засобів нікотинова кислота знижує концентрацію ліпопротеїну (a). Терапія нікотиновою кислотою також знижує концентрацію найбільш атерогенних дрібних щільних часток ЛПНЩ. Дози нікотинової кислоти для забезпечення добової вітамінної потреби становлять 1–5 мг/добу. Доза 1 г/добу підвищує рівень ХС ЛПВЩ. Для впливу на ХС ЛПНЩ необхідно 2–6 г нікотинової кислоти на добу. Призначення нікотинової кислоти приводить до зниження ХС ЛПНЩ на 20–30%, ТГ — на 20–50%. Зміни ХС ЛПВЩ залежно від вихідного рівня ТГ становлять 15–35%. Застосування нікотинової кислоти обмежують побічні реакції. Найчастіше відзначають гіперемію й свербіння шкірних покровів, гіпотензію, зумовлені простагландин-залежними механізмами. Призначення нікотинової кислоти у нижчих дозах (50 мг/добу) на початку лікування, поступове їх підвищення і комбінація з ацетилсаліциловою кислотою, яка виявляє протилежну, антипростагландинову дію, допомагають усунути або істотно зменшити вираженість зазначених реакцій. Найважливіші побічні реакції нікотинової кислоти пов’язані із порушенням функції печінки. Патологічне підвищення активності печінкових трансаміназ відзначають приблизно у 5% хворих, що отримують нікотинову кислоту в дозі 3 г/добу. Раптове невмотивоване «падіння» рівня ХС може бути провісником загрозливої тяжкої печінкової дисфункції. Це ускладнення найчастіше спостерігали при заміні кристалічної нікотинової кислоти на форми пролонгованої дії. Терапія нікотиновою кислотою може сприяти розвитку периферичної інсулінорезистентності. У 10% пацієнтів на фоні терапії виявляли порушення вуглеводного обміну. Міопатія не є характерним ускладненням для монотерапії нікотиновою кислотою, однак ризик її розвитку зростає при призначенні комбінації з інгібіторами ГMГ-КoА-редуктази та фібратами. Крім перерахованих побічних реакцій, нікотинова кислота може провокувати гіперурикемію (у 5–10% хворих), напади подагричного артриту, гастроінтестинальні порушення, нудоту, дискомфорт приблизно в 20% пацієнтів (аж до розвитку пептичної виразки).
Похідні фіброєвої кислоти (фібрати)
Фібрати дуже численні, однак найбільше розповсюдження отримали клофібрат, гемфіброзил і фенофібрат. У фібратів складний механізм дії, що характеризується впливом і на синтез, і на розпад ліпідних часток, збагачених ТГ. Фібрати здійснюють тригерний вплив на α-рецептори проліфераторів пероксисом. Це підгрупа ядерних рецепторів, що контролюють різні клітинні функції, зокрема ліпідний метаболізм, окислювання жирних кислот, обмін глюкози, адипогенез і клітинну диференціацію. Активовані РРАRα регулюють генну експресію синтезу апо-А1, транспортного протеїну, беруть участь в апо-А1-залежному процесі видалення ХС. Крім того, РРАRα впливають на атерогенез на рівні судинної стінки. Фібрати підвищують катаболізм ліпідних часток, збагачених ТГ за рахунок активації ензиму протеїнліпази, яка у свою чергу каталізує гідроліз ХМ і ЛПДНЩ. Вплив фібратів на обмін ЛПНЩ багатогранний і функціонально залежить від відносної активності ЛПНЩ-рецепторів і вихідного рівня ТГ. У пацієнтів із гіпертригліцеридемією часто зростає концентрація атерогенних дрібних щільних часток ЛПНЩ. Фібрати зменшують частку дрібних щільних ЛПНЩ на користь більших, з меншою щільністю і тому потенційно менш атерогенних, що мають більшу спорідненість до клітинних рецепторів ЛПНЩ.
Фібрати, як правило, призначають у випадках дисліпідемії з підвищенням ТГ і зниженням ЛПВЩ. Терапія фібратами дозволяє домогтися зниження ТГ на 20–50%, що супроводжується підвищенням ЛПВЩ на 5–20%. Вплив на ЛПНЩ менш передбачуваний, відзначено зниження концентрації ЛПНЩ на 10–20%. Фібрати також впливають на синтез фібриногену, плазмовий активатор фібриногену, адреналін-індуковану агрегацію тромбоцитів. З побічних ефектів найчастіше відзначають гастроінтестинальні симптоми (у 5% хворих). Не виключена провокуюча роль фібратів (зокрема клофібрату) у розвитку жовчнокам’яної хвороби. Порушення функції печінки і міопатія не характерні для монотерапії фібратами, але ризик їх розвитку підвищується у випадку комбінації з іншими препаратами, особливо статинами. Фібрати потенціюють дію варфарину.
Останні відомості про гіполіпідемічний вплив фібратів отримані після завершення великого міжнародного багатоцентрового плацебо-контрольованого дослідження FIELD (2006), відповідно до якого в групі хворих, що приймають фенофібрат у дозі 200 мг/добу, рівень загального ХС знизився на 11%, ХС ЛПНЩ — на 12%, ТГ — на 29%, а ХС ЛПВЩ зріс на 5%. Складність порівняльної характеристики груп фенофібрату порівняно з плацебо зумовлена дозволом приймати додаткову гіполіпідемічну терапію одночасно з досліджуваною, хоча потреба в ліпідознижувальних засобах у групі фенофібрату була вірогідно нижчою — 8% проти 17% (р<0,0001) протягом 5 років спостереження. Також у групі плацебо частіше відзначене призначення інгібіторів АПФ, блокаторів β-адренорецепторів і діуретиків, що не могло не вплинути на кінцеві точки дослідження. У результаті відповідно до висновків FIELD основні коронарні події у групі фенофібрату відзначали на 11% менше, ніж у групі плацебо, проте ці результати не були достовірними, хоча кількість нефатального інфаркту зменшилася на 24% у групі фенофібрату (р<0,01) і на 21% зменшилася потреба в проведенні коронарної реваскуляризації (р<0,05). Перевагами терапії фенофібратом також було зменшення прогресування альбумінурії (р<0,05) і випадків ретинопатії, яка вимагає застосування лазеротерапії (р<0,001).
Основний висновок дослідження полягав у тому, що хоча фенофібрат вірогідно не знизив ризик розвитку первинної кінцевої точки (основних коронарних подій), однак відзначене достовірне зменшення розвитку нефатального ІМ і необхідності в реваскуляризаціїї у хворих на цукровий діабет. Більш часте призначення статинів хворим, рандомізованих до групи плацебо, могло маскувати позитивний вплив фенофібрату. Таким чином, зроблено висновок про позитивний вплив фенофібрату на перебіг цукрового діабету ІІ типу на ранніх етапах захворювання без маніфестації ІХС; фенофібрат застосовують у якості монотерапії, у комбінації зі статинами, а також фенофібрат є альтернативою статинам при їх непереносності хворими; сприяє зменшенню мікросудинних ускладнень цукрового діабету; відзначена хороша переносимість при призначенні в комбінації зі статинами.
Короткий аналіз усіх класів гіполіпідемічних засобів представлений у табл. 2.11.
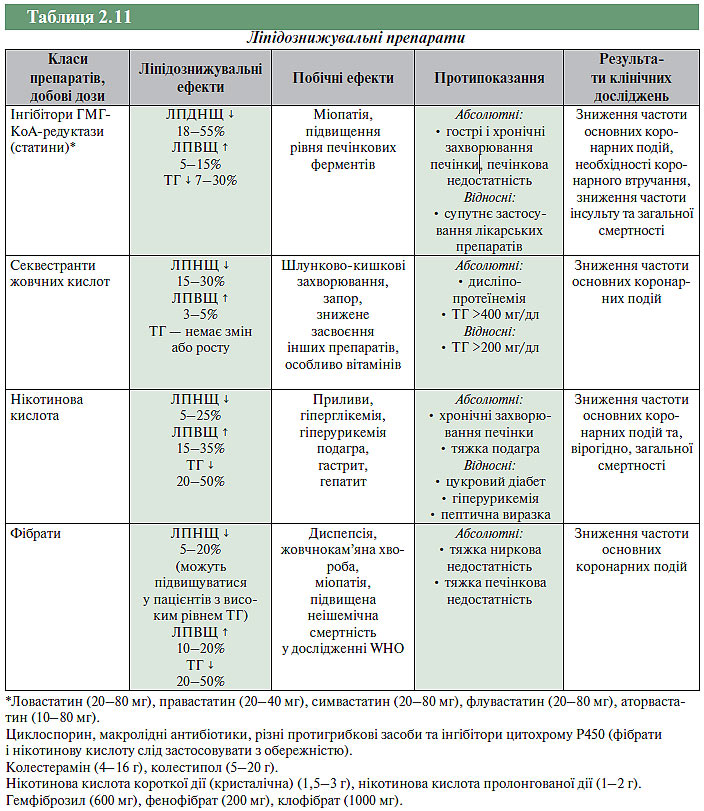
Цільові рівні гіполіпідемічної терапії
Цільовими рівнями загального ХС і фракцій ліпопротеїнів у плазмі крові прийнято вважати ті рівні, досягнення яких у результаті ліпідознижувальних заходів (дієта, підвищення фізичної активності, медикаментозна терапія, у ряді випадків — плазмоферез) дозволяє сприятливо впливати на клінічний перебіг захворювання та прогноз життя хворого.
Фізіологічні концентрації ХС ЛПНЩ, відповідно до рекомендацій Європейського товариства кардіологів, знаходяться у діапазоні 1–2 ммоль/л (40–80 мг/дл), але чи є клінічна необхідність у зниженні ХС ЛПНЩ у пацієнтів до таких низьких рівнів? Це питання продовжує залишатися предметом дискусії. Аналіз результатів досліджень CARE (Cholesterol And Recurrent Events) і WOSCOPS (West Of Scotland Coronary Prevention Study) дозволив припустити, що зниження рівня ХС ЛПНЩ <3 ммоль/л (115 мг/дл) не має клінічного значення, у той час як дослідження 4S і LIPID (Long-term Intervention with Pravastatin in Ischaemic Disease) продемонстрували, що немає того рівня ХС ЛПНЩ, при якому подальше його зниження буде недоцільним. У той же час дослідження HPS продемонстрували подібні результати внаслідок зниження ХС ЛПНЩ як у діапазоні від 3 до 2 ммоль/л, так і при зниженні його від 4 до 3 ммоль/л, однак автори висловлюють припущення, що зниження ХС ЛПНЩ до 2 ммоль/л має певні клінічні переваги. Це твердження також підтверджується результатами дослідження АSСО-LLA, у яких продемонстровані клінічні ефекти при зниженні ХС ЛПНЩ від 3,4 ммоль/л до 1,2 ммоль/л. У дослідженні HPS усі пацієнти одержували симвастатин (40 мг/добу) у помірних дозах і було відзначено, що зниження рівня ХС ЛПНЩ приблизно на 1 ммоль/л супроводжувалося порівнянним позитивним впливом на ризик розвитку ССЗ незалежно від того, чи був рівень ХС ЛПНЩ 3 ммоль/л, 4 ммоль/л або 5 ммоль/л на початку дослідження. Відповідно до рекомендацій Європейського товариства кардіологів, цільовий рівень ХС плазми в загальній популяції повинен бути <5 ммоль/л (190 мг/дл), а рівень ХС ЛПНЩ <3 ммоль/л (115 мг/дл). Для пацієнтів із клінічними проявами ССЗ і цукровим діабетом цільові рівні ліпідознижувальних заходів повинні бути нижчими: загальний ХС <4,5 ммоль/л (175 мг/дл), при можливості <4,0 ммоль/л (155 мг/дл) і ХС ЛПНЩ <2,5 ммоль/л (100 мг/дл), при можливості <2,0 ммоль/л (80 мг/дл). Для ХС ЛПВЩ і ТГ цільові рівні не визначені, але концентрації ХС ЛПВЩ і ТГ можуть використовуватися як маркери підвищеного ризику ССЗ. Рівні ХС ЛПВЩ <1,0 ммоль/л (<40 мг/дл) у чоловіків і <1,2 ммоль/л (46 мг/дл) у жінок, рівні ТГ, визначені натще >1,7 ммоль/л (150 мг/дл), служать маркерами підвищеного серцево-судинного ризику й повинні враховуватися при виборі медикаментозної терапії. У пацієнтів з безсимптомним перебігом захворювання при високому багатофакторному ризику розвитку серцево-судинної патології, у яких рівні загального ХС і ХС ЛПНЩ близькі до 5 ммоль/л і 3 ммоль/л, необхідно проводити подальше зниження загального ХС до рівня <4,5 ммоль/л (175 мг/дл) і ХС ЛПНЩ до рівня <2,5 ммоль/л (100 мг/дл) помірними дозами ліпідознижувальних препаратів.
У цієї категорії пацієнтів (схема 2.1), відповідно до Рекомендацій Європейського товариства кардіологів по профілактиці ССЗ (2003), першим кроком повинна бути оцінка загального серцево-судинного ризику та ідентифікація факторів ризику, які необхідно усунути. Якщо у пацієнта 10-річний ризик серцево-судинної смерті <5% і не буде перевищувати 5% при проекції поєднання факторів ризику на 60-річний вік, пацієнтові необхідно дати рекомендації з дотримання збалансованої дієти, розширення фізичної активності й припинення тютюнопаління з метою збереження серцево-судинного ризику на низькому рівні. Оцінка ризику повинна бути повторена через 5 років. Слід звернути увагу, що подібна оцінка загального ризику не підходить пацієнтам із сімейною гіперхолестеринемією, тому що починаючи з величини загального ХС >8 ммоль/л (320 мг/дл) і ХС ЛПНЩ >6 ммоль/л (240 мг/дл) пацієнтів слід віднести до категорії високого загального ризику ССЗ.
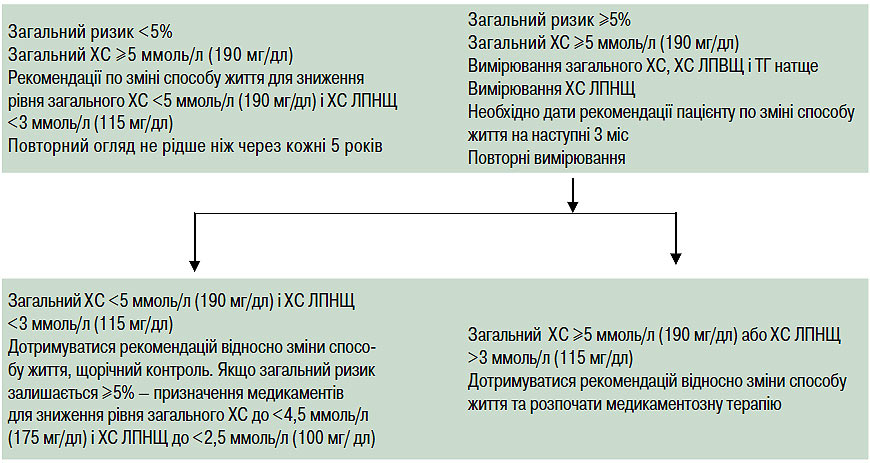
Схема 2.1. Рекомендації щодо корекції рівня ліпідів у пацієнтів із безсимптомним перебігом захворювання
У випадку, якщо 10-річний ризик серцево-судинної смерті >5% або може бути >5% при проектуванні поєднання факторів ризику на 60-річний вік, слід провести аналіз ліпопротеїнів плазми крові і дати рекомендації з модифікації способу життя, особливо щодо дієтотерапії. Оцінку ризику загальної серцево-судинної смертності слід проводити з використанням шкали SCORE. Для оцінки ризику необхідно враховувати первинний рівень загального ХС (або співвідношення загального ХС до ХС ЛПВЩ). Якщо через 3 міс рівні загального ХС і ХС ЛПНЩ будуть <5 ммоль/л (190 мг/дл) і 3 ммоль/л (115 мг/дл) відповідно, серцево-судинний ризик складе <5%, таким пацієнтам слід щорічно проходити повторне обстеження для підтвердження низького рівня серцево-судинного ризику.
При збереженні серцево-судинного ризику >5% слід застосовувати ліпідознижувальну терапію для зниження рівня загального ХС і ХС ЛПНЩ. Цільові рівні в таких пацієнтів становлять для загального ХС <4,5 ммоль/л (175 мг/дл) і ХС ЛПНЩ <2,5 ммоль/л (100 мг/дл). Необхідно згадати, що спочатку клінічні дослідження, що документували клінічне поліпшення в результаті використання ліпідознижувальної терапії статинами, були обмежені, — у них брали участь пацієнти віком <70 років і при рівні загального ХС >5 ммоль/л. Останні розробки продемонстрували, що ця терапія може також бути ефективною і у похилому віці, а також в осіб з нижчим рівнем ХС.
Слід також згадати про пацієнтів із сімейною гіперхолестеринемією або іншими серйозними, генетично зумовленими порушеннями метаболізму ліпідів. У цьому випадку зниження ХС ЛПНЩ навіть нижче рівня 3 ммоль/л (115 мг/дл) із приєднанням комбінованої ліпідознижувальної терапії з подвійним або потрійним режимом препаратів є важкоздійсненним завданням і лікар має підготувати пацієнта до цієї ситуації. Дослідження із застосуванням статинів показали, що зниження загального ХС принаймні на 20% і ХС ЛПНЩ на 30% супроводжується вираженим клінічним ефектом.
Метаболічний синдром як вторинна мета терапії (результат, що не залежить від ліпідознижувальної терапії)
Існують докази того, що ризик ІХС може бути знижений без ліпідознижувальної терапії модифікацією інших факторів ризику. Одна з потенційних вторинних цілей терапії — усунення метаболічного синдрому, що представляє собою поєднання ліпідних і неліпідних факторів ризику метаболічного походження. Цей синдром тісно пов’язаний із генералізованим метаболічним порушенням, названим інсулінорезистентністю. Додатковий вісцеральний жир (особливо при абдомінальному типі ожиріння) і низька фізична активність сприяють розвитку інсулінорезистентності, що у деяких осіб може бути спадково детермінованою.
Фактори ризику формування метаболічного синдрому здатні взаємно потенціюватися; у поєднанні підвищують ризик ІХС незалежно від рівня ХС ЛПНЩ. Діагноз метаболічного синдрому встановлюють при наявності ≥3 факторів ризику, наведених у табл. 2.12, які можна легко визначити в клінічній практиці.
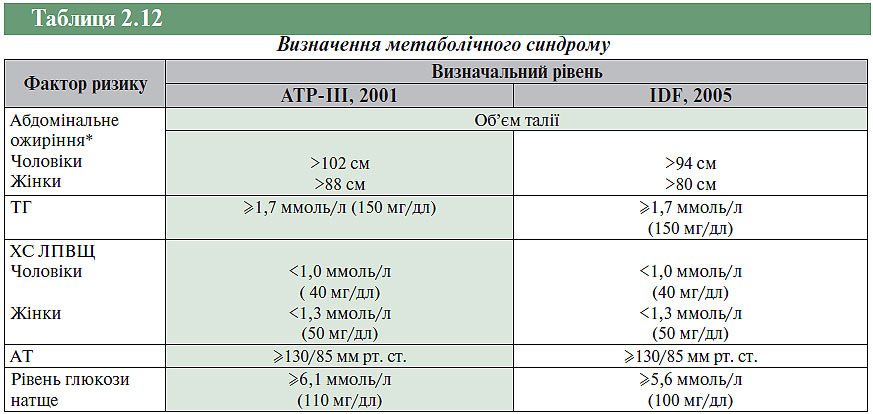
Лікування метаболічного синдрому здійснюється 2 шляхами: 1 — зменшенням основних причин (ожиріння і низька фізична активність) і 2 — усуненням комбінації ліпідних і неліпідних факторів ризику. Слід зазначити, що останнім часом концепція метаболічного синдрому привертає підвищену увагу кардіологів, ендокринологів та інших фахівців у зв’язку з надзвичайно прогресуючим характером поширення ожиріння, цукрового діабету і проявів усього кластера суміжних факторів ризику. До 2005 р. метаболічний синдром верифікувався відповідно до критеріїв, викладених в 2001 р. у документах програми АТР-III. Однак з метою уніфікації всіх підходів до діагностики метаболічного синдрому в 2005 р. введені нові критерії метаболічного синдрому відповідно до консенсусу Міжнародної протидіабетичної асоціації (IDF).
Істотною відмінністю останніх було затвердження абдомінального ожиріння як основного критерію і зменшення нормативних критеріїв об’єму талії (<94 см для чоловіків і <80 см для жінок), гіперглікемії натще (>5,6 ммоль/л). При цьому ще раз було підкреслено, що макросудинні ускладнення (ІМ, інсульт) є основною причиною смерті пацієнтів з метаболічним синдромом і цукровим діабетом. Діагноз метаболічного синдрому відповідно до IDF (2005) встановлюється при наявності абдомінального ожиріння як основного критерію і двох будь-яких критеріїв з нижчеперелічених.
Усунення основних причин метаболічного синдрому
Первинні заходи щодо усунення всіх ліпідних і неліпідних факторів ризику, пов’язаних з метаболічним синдромом — це зменшення маси тіла і підвищення фізичної активності.
Зниження маси тіла. Надмірна маса тіла і ожиріння визнані основними факторами ризику ІХС при метаболічному синдромі і є основною мішенню додаткових терапевтичних втручань. Зменшення маси тіла сприяє зниженню ХС ЛПНЩ і зменшує вираженість інших компонентів метаболічного синдрому.
Фізична активність. Низька фізична активність — також один з головних факторів ризику ІХС при метаболічному синдромі. Потенціює вираженість ліпідних і неліпідних факторів ризику. На противагу цьому раціональне підвищення фізичної активності знижує рівні ХС ЛПДНЩ, підвищує ХС ЛПВЩ, а в деяких осіб знижує рівні ХС ЛПНЩ. Це поєднується зі зниженням АТ, зменшенням інсулінорезистентності та сприятливо впливає на всю серцево-судинну систему.
Усунення інших факторів ризику при метаболічному синдромі, тобто нормалізацію підвищеного АТ, лікування дисліпідемій і виявлених порушень вуглеводного обміну, необхідно проводити відповідно до прийнятих Рекомендацій Європейського й Українського товариств кардіологів.
СПЕЦІАЛЬНІ РОЗДІЛИ
Лікування специфічних дисліпідемій
Дуже високий ХС ЛПНЩ (≥190 мг/дл). Особи з дуже високим ХС ЛПНЩ зазвичай мають генетично детерміновані форми гіперхолестеринемії: моногенну сімейну гіперхолестеринемію, сімейний дефект аполіпопротеїну B і полігенну гіперхолестеринемію. Раннє виявлення цих порушень в осіб молодого віку необхідне з метою запобігання передчасного розвитку ІХС. У цьому випадку для ідентифікації стану дуже важливим є обстеження близьких (кровних) родичів. Стандартна ліпідознижувальна терапія може бути недостатньою, і нерідко з’являється необхідність у комбінованій терапії, як наприклад, поєднання статинів і секвестрантів жовчних кислот для досягнення цільових рівнів ХС ЛПНЩ.
Підвищений рівень сироваткових ТГ. Результати метааналізу проспективних досліджень продемонстрували, що підвищення рівня ТГ є незалежним чинником ризику ІХС. Фактори, що сприяють підвищенню рівня ТГ в організмі, включають ожиріння і надмірну масу тіла, низьку фізичну активність, тютюнопаління, зловживання алкоголем, гіпервуглеводну дієту (>60% добового калоражу). Аналогічний ефект спричиняє поєднання в пацієнта декількох захворювань (наприклад цукрового діабету ІІ типу, ХНН, нефротичного синдрому), вплив деяких препаратів (наприклад ГКС і блокаторів β-адренергічних рецепторів у високих дозах) і генетичні порушення (сімейна комбінована гіперліпідемія, сімейна гіпертригліцеридемія і сімейна дисліпопротеїнемія).
У реальній клінічній практиці підвищення рівня сироваткових ТГ найчастіше відзначають в осіб з метаболічним синдромом, хоча вторинні або генетичні фактори також впливають. Вміст сироваткових ТГ класифікується:
- нормальний рівень ТГ <150 мг/дл;
- гранично підвищений рівень ТГ — 150–199 мг/дл;
- високий рівень ТГ — 200–499 мг/дл;
- дуже високий рівень ТГ ≥500 мг/дл.
При виділенні гіпертригліцеридемії як незалежного фактора ризику ІХС приймається до уваги наявність високої атерогенності ліпопротеїнів, збагачених ТГ. Останні частково представлені ремнантами (залишками) ліпопротеїнів, що утворюються внаслідок розпаду ЛПДНЩ. У клінічній практиці ЛПДНЩ — найбільш доступні для вимірювання атерогенних ремнантів ліпопротеїни, які є мішенню для ліпідознижувальної терапії. На сьогодні ідентифікують суму ХС ЛПНЩ + ЛПДНЩ, так званий ХС ліпопротеїнів невисокої щільності — ХС не-ЛПВЩ (визначається як результат віднімання: загальний ХС — ХС ЛПВЩ) як вторинну ціль терапії для осіб з високим рівнем ТГ (≥200 мг/дл). Цільовий рівень ХС не-ЛПВЩ в осіб з високим
сироватковим рівнем ТГ встановлений на 30 мг/дл вищий, ніж ХС ЛПНЩ, з огляду на те, що рівень ХС ЛПДНЩ ≤30 мг/дл є нормальним.
Стратегія лікування для осіб з підвищеним рівнем ТГ залежить від етіологічних причин і ступеня їхнього підвищення. Для осіб з гіпертригліцеридемією первинною метою терапії є досягнення цільового рівня ХС ЛПНЩ. Якщо рівень ТГ погранично високий (150–199 мг/дл), акцент терапевтичних заходів слід зробити на зменшенні маси тіла і підвищенні фізичної активності. Для осіб з високим рівнем ТГ (200–499 мг/дл) вторинною метою терапії є ХС не-ЛПВЩ. Для досягнення цільових рівнів ХС не-ЛПВЩ, поряд зі зниженням маси й підвищенням фізичної активності, необхідно призначати ліпідознижувальну терапію, яка включає 2 етапи. Спочатку терапія повинна бути спрямована на досягнення цільового рівня ХС не-ЛПВЩ за рахунок збільшення доз ліпідознижувальної терапії, а потім призначають нікотинову кислоту або фібрати для досягнення цільового рівня ХС не-ЛПВЩ і подальшого зниження рівня ХС ЛПДНЩ. При нечастих випадках дуже високого рівня ТГ (≥500 мг/дл) у першу чергу необхідно виключити наявність гострого панкреатиту. Слід призначити дієту з низьким вмістом жирів (≤15% споживаних калорій) і лікарські препарати, що сприяють зниженню рівня ТГ (фібрати або нікотинову кислоту). Тільки після зниження рівня ТГ <500 мг/дл необхідно приступити до зниження ХС ЛПНЩ із метою зниження ризику ІХС.
Низький рівень ХС ЛПВЩ. Відповідно до результатів останніх досліджень низький рівень ХС ЛПВЩ є самостійним предиктором ІХС і визначається як рівень <40 мг/дл, що пред’являє більш серйозні вимоги до терапії порівняно із прийнятим раніше рівнем <35 мг/дл. Низький рівень ХС ЛПВЩ змінює цільовий рівень ХС ЛПНЩ при проведенні ліпідознижувальної терапії і використовується як фактор ризику при оцінці 10-річного ризику ІХС.
Зниження рівня ХС ЛПВЩ може бути зумовлене рядом причин, пов’язаних з інсулінорезистентністю та метаболічним синдромом (ожиріння, низька фізична активність, високий рівень ТГ і цукровий діабет ІІ типу). Інші причини — тютюнопаління, високе споживання вуглеводів (>60% добового калоражу) і прийом деяких лікарських препаратів (блокатори β-адренорецепторів, анаболічні стероїди, гестагени).
Незважаючи на те що результати клінічних досліджень дають підставу очікувати від підвищення рівня ХС-ЛПВЩ відповідного зниження ступеня ризику ІХС, спеціальний цільовий рівень для ХС ЛПВЩ не визначений. Крім того, на сьогодні немає фармакологічних препаратів, здатних істотно підвищити рівень ХС ЛПВЩ. Проте низький рівень ХС ЛПВЩ слід враховувати при виборі лікувальної тактики.
У всіх осіб з низьким рівнем ХС ЛПВЩ первинне завдання терапії — зниження рівня ХС ЛПНЩ. Після досягнення цільового рівня ХС ЛПНЩ необхідне вживання заходів по зменшенню маси тіла і підвищенню фізичної активності (при наявності метаболічного синдрому). Якщо низький рівень ХС ЛПВЩ поєднується з високим рівнем ТГ (200–499 мг/дл), необхідна ліпідознижувальна терапія для досягнення цільового рівня ХС не-ЛПВЩ, як зазначено вище. При рівні ТГ <200 мг/дл (ізольованому низькому рівні ХС ЛПВЩ) призначають фібрати або нікотинову кислоту; однак лікування при таких порушеннях сироваткових ліпопротеїнів в основному показане пацієнтам з ІХС і еквівалентами ризику ІХС.
Діабетична дисліпідемія. Це порушення ідентифікують як високоатерогенну дисліпідемію (підвищення рівня ТГ і змісту маленьких щільних ЛПНЩ і низький рівень ХС ЛПВЩ) в осіб із цукровим діабетом ІІ типу. Незважаючи на підвищення рівня ТГ і/або зниження рівня ХС і ХС ЛПВЩ у такого контингенту хворих, первинною метою ліпідознижувальної терапії є зниження рівня ХС ЛПНЩ так само, як і в осіб без цукрового діабету. Оскільки цукровий діабет визначений як еквівалент ризику ІХС, цільовий рівень ХС ЛПНЩ для осіб із цукровим діабетом <100 мг/дл. Тому при рівні ХС ЛПНЩ ≥130 мг/дл пацієнтам із цукровим діабетом необхідно проводити ліпідознижувальну терапію одночасно з модифікацією способу життя. Якщо рівні ХС ЛПНЩ перебувають у діапазоні 100–129 мг/дл, можливі 2 терапевтичних підходи: використання комбінованої ліпідознижувальної терапії з додаванням фібратів або нікотинової кислоти або ж модифікація інших факторів ризику, включаючи гіперглікемію. Якщо рівні ТГ ≥200 мг/дл, ХС не-ЛПВЩ стають вторинною ціллю ліпідознижувальної терапії. Ряд останніх багатоцентрових клінічних досліджень (наприклад дослідження впливу антигіпертензивної та ліпідознижувальної терапії на частоту серцевих нападів [ALLHAT]) вірогідно встановив переваги ліпідознижувальної терапії в осіб із цукровим діабетом старших вікових груп. В осіб похилого віку із цукровим діабетом (≥65 років) без додаткових факторів ризику ІХС необхідна більш ретельна оцінка клінічного статусу, включаючи наявність супутніх захворювань, що допоможе визначити необхідну тактику лікування.
СПЕЦІАЛЬНІ РЕКОМЕНДАЦІЇ ДЛЯ РІЗНИХ ГРУП НАСЕЛЕННЯ
Чоловіки середнього віку (35–65 років). У цілому ризик ІХС у чоловіків вищий, ніж у жінок. У зазначеній віковій групі чоловіків вища поширеність основних факторів ризику ІХС, схильність до абдомінального ожиріння і метаболічного синдрому. Тому потреба в інтенсивній ліпідознижувальній терапії у чоловіків середньої вікової групи надзвичайно висока.
Жінки (45–75 років). У жінок ІХС маніфестує приблизно на 10–15 років пізніше порівняно із чоловіками і більшість випадків ІХС діагностується після 65 років. У жіночій популяції існують всі фактори ризику, але ранній (віком до 65 років) розвиток ІХС відзначений тільки у жінок із множинними факторами ризику і метаболічним синдромом.
У той же час, незважаючи на очікуваний захисний ефект терапії естрогенами, немає переконливих даних про позитивний ефект застосування замісної гормональної терапії для зниження ризику ІХС у жінок у постменопаузальний період. Навпаки, відзначено позитивний ефект терапії статинами у жінок цієї вікової групи.
Старші вікові групи (чоловіки ≥65 років і жінки ≥75 років). У осіб похилого віку (≥65 років) дуже високий ризик розвитку основних коронарних подій. Високий рівень ХС ЛПНЩ і низький рівень ХС ЛПВЩ є факторами ризику ІХС у старших вікових групах. Результати дослідження великого контингенту хворих у віковому діапазоні 65–75 років по вторинній профілактиці показали значне скорочення ризику ІХС внаслідок проведення терапії статинами. Отже, не існує вікових обмежень для пацієнтів з діагностованою ІХС при призначенні ліпідознижувальної терапії. З метою первинної профілактики для старших вікових груп рекомендується модифікація способу життя.
Дорослі молодого віку (чоловіки 20–35 років; жінки 29–45 років). У цьому віковому контингенті ІХС виявляють досить рідко, за винятком випадків з тяжкими факторами ризику, наприклад сімейною гіперхолестеринемією, викурюванням великої кількості цигарок, декомпенсованим цукровим діабетом. Дослідження, присвячені віддаленому прогнозу, продемонстрували, що збільшення сироваткового ХС у молодому віці визначає більш високий ступінь ризику ІХС при досягненні середнього віку. Таким чином, ідентифікація факторів ризику в молодому віці — важлива мета віддаленої профілактики. У цій віковій групі раннє виявлення ХС ЛПНЩ ≥130 мг/дл у поєднанні зі здоровим способом життя здатне попередити розвиток ІХС. Особливу увагу слід приділяти молодим людям, які курять, з високим рівнем ХС ЛПНЩ (160–189 мг/дл), якщо ж визначаються дуже високі рівні ХС ЛПНЩ (≥190 мг/дл), ліпідознижувальну терапію необхідно призначати так само, як і в старших вікових групах. У випадках тяжких генетичних форм гіперхолестеринемії слід призначати комбіновану ліпідознижувальну терапію (наприклад статини + секвестранти жовчних кислот).
ДОДАТОК 1
Стандарти лікування хворих з дисліпідемією:
Лікувальна програма
Перелік і обсяг обов’язкових медичних заходів асортименту
Хворі з дисліпідеміями повинні одержувати комплексне лікування:
1. Немедикаментозна терапія (дієта, корекція маси тіла, підвищення фізичної активності, відмова від тютюнопаління) для досягнення оптимальних характеристик ліпідного профілю.
2. Медикаментозне лікування відповідно до різних варіантів дисліпідемій:
a) Гіперхолестеринемія — статини.
б) Комбінована дисліпідемія — статини, деяким пацієнтам можна рекомендувати комбінацію статинів та фібратів.
в) Гіпертригліцеридемія — фібрати та/або статини.
3. У пацієнтів із безсимптомним перебігом: якщо шляхом модифікації способу життя протягом 8–12 тиж не вдається досягти необхідного ефекту, почати медикаментозну гіполіпідемічну терапію відповідно до варіанта дисліпідемії (статини та/або фібрати).
4. У хворих з діагностованою ІХС або її еквівалентами терапію статинами необхідно почати одночасно із заходами щодо немедикаментозної профілактики.
5. Контролювати показники ліпідного обміну, печінкові та м’язові ферменти: АлАТ, АсАТ, КФК 1 раз на 3 міс.
Перелік та обсяг додаткових медичних заходів:
- При супутній АГ — антигіпертензивна терапія.
- При супутньому цукровому діабеті — гіпоглікемізуюча терапія.
- При тяжких формах сімейних дисліпідемій можлива корекція ліпідного профілю методом плазмоферезу.
Характеристика кінцевого очікуваного результату лікування:
1. Досягнення цільових рівнів ХС і ХС ЛПНЩ:
- для загальної популяції цільовий рівень ХС плазми повинен бути <5,0 ммоль/л (190 мг/дл), а рівень ХС ЛПНЩ <3 ммоль/л (115 мг/дл);
- для пацієнтів з ІХС, її еквівалентами та пацієнтів із цукровим діабетом цільовий рівень ХС повинен бути <4,5 ммоль/л (175 мг/дл), при можливості <4,0 ммоль/л (155 мг/дл), а рівень ХС ЛПНЩ — <2,5 ммоль/л (100 мг/дл), при можливості <2,0 ммоль/л (80 мг/дл).
2. Для пацієнтів із сімейною гіперхолестеринемією або іншими генетичними порушеннями метаболізму ліпідів, при неможливості зниження ХС ЛПНЩ нижче рівня 3 ммоль/л (115 мг/дл) із залученням комбінованої ліпідознижувальної терапії, з подвійними або потрійними режимами препаратів необхідно намагатися знизити рівні загального ХС не менше ніж на 20% і ХС ЛПНЩ на 30%, що повинно супроводжуватися вираженим клінічним ефектом.
Тривалість лікування
Хворі мають потребу в довічному немедикаментозному та медикаментозному лікуванні.
Критерії якості лікування
У переважної більшості пацієнтів з дисліпідеміями критерієм якості є досягнення цільових рівнів ХС і ХС ЛПВЩ.
У хворих із сімейною гіперхолестеринемією або іншими генетичними порушеннями метаболізму ліпідів зниження рівня загального ХС на 20% і ХС ЛПНЩ на 30% є критерієм досягнення вираженого клінічного ефекту.
Ймовірні побічні дії та ускладнення
Можлива поява побічних ефектів відповідно до фармакологічних властивостей ліпідознижувальних препаратів (статинів, фібратів): підвищення рівня трансаміназ (АлАТ, АсАТ більш ніж в 3 рази) і КФК (більш ніж в 10 разів). При підозрі на розвиток побічних реакцій потрібна відміна ліпідознижувальних препаратів.
Рекомендації щодо подальшого надання медичної допомоги
Хворі повинні перебувати на диспансерному спостереженні за місцем проживання. Контролювати параметри ліпідного обміну, рівень печінкових і м’язових ферментів: АлАТ, АсАТ, КФК із частотою 1 раз на 3 міс протягом першого року. Надалі слід проводити щорічне обов’язкове обстеження, а за його результатами — корекцію терапії не рідше ніж 1 раз на рік.
Вимоги до дієтичних призначень і обмежень
Хворі з дисліпідеміями повинні дотримуватися низькокалорійної дієти, загальне споживання жиру не повинне перевищувати 30% споживаної енергії, частина насичених жирів не повинна перевищувати третини від загального споживання жиру. Споживання ХС повинне бути <300 мг/добу. Рекомендується дієта, збагачена харчовими волокнами. Насичені жири можуть частково бути замінені складними вуглеводами й омега-3-поліненасиченими жирними кислотами морепродуктів.
Для хворих з АГ і осіб з надмірною масою тіла рекомендується додатково знизити споживання солі до ≤5 г/добу; обмежити прийом алкоголю.
Вимоги до режиму роботи, відпочинку, реабілітації
Необхідне дозоване фізичне навантаження відповідно до рекомендацій лікаря після одержання результатів навантажувальних тестів.
ДОДАТОК 2
Рекомендовані наступні цільові рівні ХС:
- Пацієнтам з ІХС або еквівалентами ризику ІХС: ХС <4,0 ммоль/л (155 мг/дл) і для ХС ЛПНЩ <2,0 ммоль/л (80 мг/дл).
- Для загальної популяції цільовий рівень ХС плазми повинен бути <5 ммоль/л (190 мг/дл), а рівень ХС ЛПНЩ — <3 ммоль/л (115 мг/дл).
Для різних варіантів дисліпідемій рекомендується наступна терапія:
- Гіперліпідемія IIA типу (високий рівень ХС ЛПНЩ) — статини.
- Гіперліпідемія IV типу (високий рівень ТГ) — фібрати.
- Гіперліпідемія IIB типу (високий рівень ХС ЛПНЩ і ТГ) — статини, якщо високий рівень ХС ЛПНЩ є переважним порушенням, і фібрати, якщо переважає високий рівень ТГ. Деяким пацієнтам можна рекомендувати комбінацію статинів та фібратів.
Формули перерахунку:
Загальний ХС, ЛПНЩ і ЛПВЩ у ммоль/л · 38,7 = мг/дл ТГ у ммоль/л · 88,6 = мг/дл
ДОДАТОК 3
Дієтичні рекомендації Європейського товариства кардіологів і Європейського товариства атеросклерозу.
Загальні принципи:
- частка всіх жирів у загальній енергетичній цінності їжі повинна становити ≤30%;
- частка тваринних (насичених) жирів повинна становити не більше ⅓ загальної кількості споживаного жиру;
- обмеження добового споживання ХС — <300 мг;
- збільшення споживання моно- і поліненасичених жирів з овочів і морської риби;
- збільшення споживання вуглеводів, що містяться у свіжих фруктах, злаках і овочах.
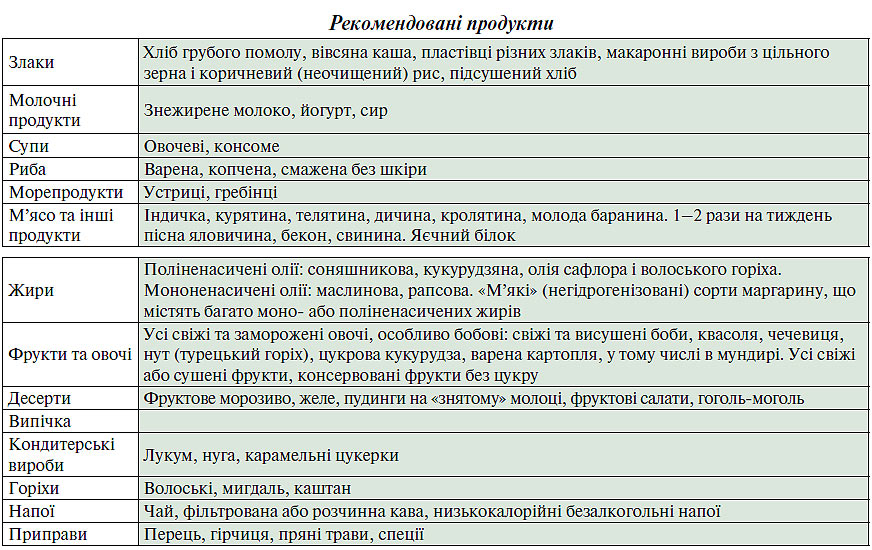
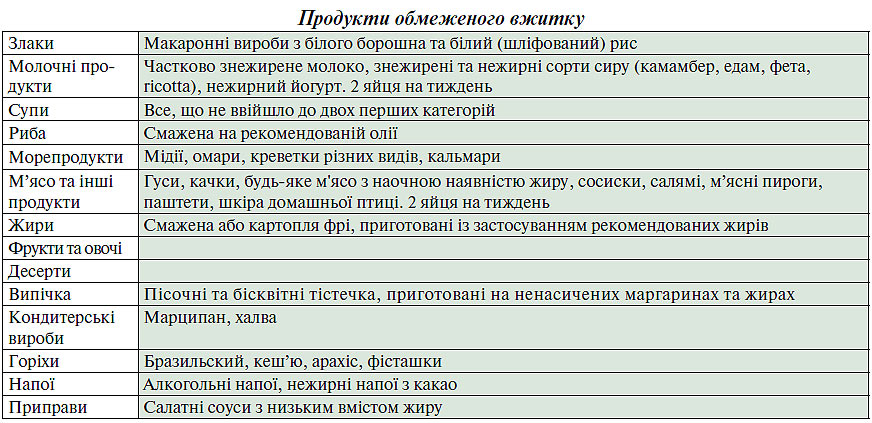
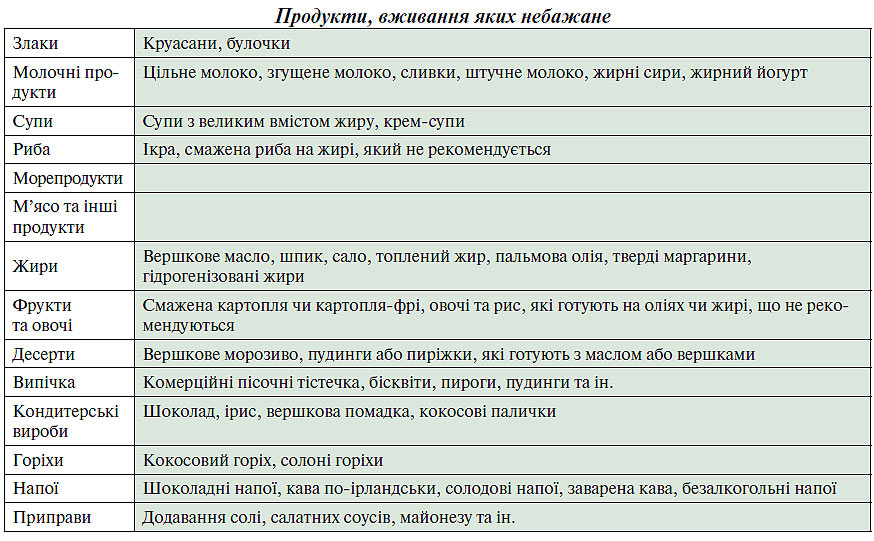
ЛІТЕРАТУРА
- Дисліпідемії: діагностика, профілактика та лікування (2007) Методичні рекомендації Робочої групи з проблем атеросклерозу та хронічних форм ІХС та Робочої групи з проблем метаболічного синдрому, діабету та серцево-судинних захворювань Українського наукового товариства кардіологів. Київ, 56 с.
- Карпов Ю.А., Сорокин Э.В. (2001) Атеросклероз и факторы воспаления: нелипидные механизмы действия статинов. РМЖ, 9(10): 5–9.
- Карпов Ю.А., Сорокин Э.В. (2002) Профилактика инсульта — новая область применения статинов. РМЖ, 10(1): 12–15.
- Климов Н.А., Никульчева Н.Г. (1995) Липиды, липопротеиды и атеросклероз. Питер, Санкт-Петербург, 89–199.
- Лутай М.И. (2003) К вопросу о клинической классификации дислипопротеинемий. Укр. кардіол. журн., 4: 9–16.
- Лякишев А.А. (2003) Клиническое применение статинов. РМЖ, 11(4): 193–196.
- Митченко Е.И. (2004) Дислипидемия как фактор развития сердечно-сосудистых заболеваний. Укр. кардіол. журн., додаток 1: 28–39.
- Сусеков А.В., Поваренок В.В. (2001) Дериваты фиброевой кислоты. Кардиология, 7: 60–65.
- Шевченко О.П., Шевченко А.О. (2003) Статины. Ингибиторы ГМГ-КоА-редуктазы. Реафарм, Москва, 67 с.
- AHA Guidelines for Preventing Heart Attack and Death in Patients With Atherosclerotic Cardiovascular Disease: 2001 Update (2001) Circulation,104: 1577–1579.
- Beisiegel U. (1998) Lipoprotein metabolism. Eur. Heart J., 19 (Suppl A): A20–A23.
- Brewer H.B. (1999) Hypertriglyceridemia: changes in the plasma lipoproteins, associated with an increased risk of cardiovascular disease. Am. J. Cardiol., 83: 3–12.
- European guidelines on cardiovascular disease prevention in clinical practice (2003) Eur. Heart J., 24: 1601–1610.
- Grundy S. (1999) Hypertriglyceridemia, insulin resistance and the metabolic syndrome. Am. J. Cardiol., 83: 25F–29F.
- Guidelines on management of stable angina pectoris: Executive summary (2006) Eur. Heart J., 27: 1341–1381.
- Jeppesen J., Hein H.O., Suadicany P. et al. (1998) Triglycerides concentration and ischaemic heart disease: an eight-year follow-up in the Copenhagen Male Study. Circulation, 97: 1029–1036.
- Long-term Intervention with Pravastatin in Ischaemic Disease (LIPID) Study Group. Prevention of cardiovascular events and death with pravastatin in patients with coronary heart disease and a broad range of initial cholesterol levels (1998) N. Engl. J. Med., 339: 1349–1357.
- Mahley R.W., Huang Y. (1999) Apolipoprotein E: from atherosclerosis to Alzheimer̓s disease. Curr. Opin. Lipidol., 10: 207–217.
- Nissen S.E., for the REVERSAL Investigators. Comparison of Intensive Versus Moderate Lipid Lowering on the Progression of Coronary Atherosclerosis Measured by Intravascular Ultrasound: A Randomized Controlled Trial (abstract) (2003) Circulation, 108: 2723 р.
- Reaven G.M., Chen Y.-D.L., Jeppesen J. et al. (1993) Insulin resistance and hypertriglyceridemia in an individuals with smal, dense low density lipoprotin particles. J. Clin. Invest., 92: 141.
- Scandinavian Simvaststin Survival Study Group. Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvaststin Survival Study (4S) (1994) Lancet, 344: 1383–1389.
- Sever P.S., Dahlof B., Poulter N.R. et al. (2003) Prevention of coronary and stroke events with atorvastatin in hypertensive patients who have average or lower-than-average cholesterol concentrations, in the Anglo-Scandinavian Cardiac Outcomes Trial-Lipid Lowering Arm (ASCOT-LLA): a multicentre randomised controlled trial. Lancet, 361: 1149–1158.
- The ILIB Lipid Handbook for clinician Practice: Dyslipidemia and Coronary Heart Disease. 3rd edition (2003) International Lipid Information Bureau, New York: 242 р.
- Third report of the National Cholesterol Education Program (NCEP) expert panel on detection, evaluation, and treatment of high blood cholesterol in adults (Adult Treatment Panel III). Final Report (2002) Circulation, 106: 3143–3421.
- Thompson G.R. (1995) Angiographic trials of lipid-lowering therapy: end of an era? Br. Heart J., 74: 343–347.
- Thompson G.R., Maher V.G.M., Matthews S. et al. (1995) Familial Hypercholesterolaemial Regression Study: a randomized trial of low-density lipoprotein apheresis. Lancet, 345: 811–816.
- Thompson G.R. (1999) The proving of the lipid hypothesis. Curr. Opin. in Lipidol. 10th Anniversary issue, 10(3): 201–205.
- Waters D., Higginson L., Gladstone P. et al. (1994) Effects of monotherapy with an HMG-CoA-reductase inhibitor on the progression of coronary atherosclerosis as assessed by serial quantitative arteriography. The Canadian Coronary Atherosclerosis Interventional Trial. Circulation, 89(3): 959–968.