НОМЕНКЛАТУРА І СУЧАСНА ТЕХНОЛОГІЯ ЕЛЕКТРОКАРДІОСТИМУЛЯТОРІВ
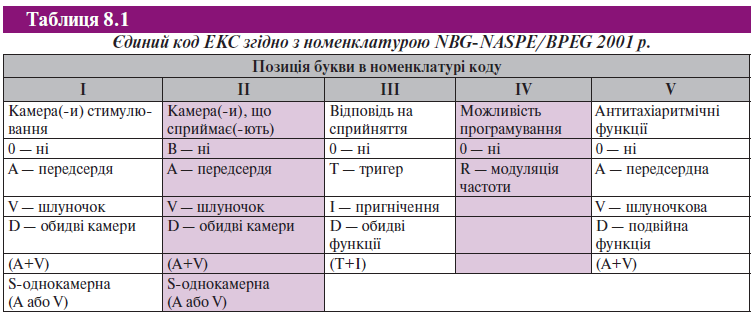
У міжнародній практиці використовується п’ятизначний буквений номенклатурний код, що є спільною розробкою робочих груп Північноамериканського товариства по стимуляції і електрофізіології (NASPE) і Британської групи по стимуляції і електрофізіології (BPEG). Він відомий як загальний код NBG-NASPE/BPEG (Hayes D.L. et al., 2001) (табл. 8.1). Як правило, використовують перші 3 букви, а буква R (IV позиція) застосовується для програмованих електрокардіостимуляторів (ЕКС) з частотою ритмоводіння, яка змінюється (адаптація за частотою) — VVIR, DDDR. п’ята буква в коді NBG пов’язана з антитахікардитичними функціями.
Перші моделі ЕКС працювали в асинхронному режимі (VOO) і проводили стимуляцію з фіксованою частотою. У 1965 р. з’явилися перші моделі ЕКС, здатні визначати власну діяльність серця і працювати в режимі demand, тобто на вимогу (VVI). Мультипрограмовані стимулятори забезпечили широкий набір характеристик, необхідних для зміни електричних параметрів при мінливій взаємодії серцевого м’яза і самого ЕКС. Наступне покоління стимуляторів забезпечило фізіологічний характер електрокардіостимуляції (режими VAT, VDD, AAI і DDD) шляхом автоматичного контролю частоти та/або підвищення ступеня наповнення шлуночків серця за рахунок синхронного скорочення передсердя (внесок передсердь). Фізіологічна стимуляція нормалізує серцевий викид і значно підвищує функціональні можливості пацієнта. На сьогодні найбільш завершена система стимуляції — це повністю автоматизована електростимуляція серця в режимі DDD, що дозволяє зберегти передсердно-шлуночкову синхронізацію при зниженні частоти ЧСС нижче встановленої межі. Проте і цього режиму недостатньо при хронотропній недостатності міокарда. Таким прикладом є синдром слабкості синусного вузла, при якому не відбувається спонтанного підвищення ЧСС у відповідь на фізіологічне навантаження. Тільки включення в електронну систему ЕКС спеціальних детекторів (сенсорів), реагуючих на різні сигнали, що відрізняються від Р-хвилі і підвищують відповідно частоту, оптимізують фізіологічну стимуляцію.
Ряд закордонних фірм використовують або використовували сенсори, що реагують на навантаження (механічні струси) — «Medtronic», частоту дихання і хвилинний об’єм дихання — «Telectronics», коефіцієнт dР/dt (індекс скоротності) ПШ — «Medtronic», зміну температури центральної венозної крові — «Biotronik», інтервал Q–Т — «Vitatron» та інші параметри. Сьогодні з’явилися ЕКС, які мають по два сенсори в одному пристрої, що дозволяє нівелювати недоліки односенсорних. Новим у цьому напрямку стало використання поєднання функції адаптації за частотою з двокамерним (секвенціальним) режимом стимуляції, що дозволяє досягти оптимальної частоти ритму в будь-якій фазі навантаження.
Останні розробки — ЕКС, що працюють у режимі DDDR. Вони здатні визначати наявність у хворого фібриляції і тріпотіння передсердь, а також автоматично перемикатися на інший, безпечний режим стимуляції (шлуночковий) (VVIR), що адаптується за частотою, — так званий режим switch mode. Таким чином виключається можливість підтримання надшлуночкової тахіаритмії.
Ці рекомендації присвячені правильному підходу до імплантації кардіостимуляторів і кардіовертерів-дефібриляторів. Той факт, що використання ЕКС належить до класу I рекомендацій (корисно й ефективно), не виключає інших методів лікування, які можуть бути так само ефективні, як й інші клінічні рекомендації. Наведений документ узагальнює основні підходи до лікування пацієнта з конкретним порушенням ритму серця. Супутні захворювання або їх прогноз, а також ряд інших умов можуть змінюватися, але остаточний вибір залишається за лікарем.
Вибір кардіостимулятора
Після ухвалення рішення про імплантацію ЕКС конкретному пацієнтові другим головним завданням клініциста є вибір оптимального стимулювального пристрою серед безлічі ЕКС та електродів. Необхідно вибрати між одно- і двокамерним кардіостимулятором, уніполярною та біполярною конфігурацією електрода, наявністю і типом сенсора для частотної адаптації, деякими додатковими функціями, наприклад автоматичною зміною режиму, розміром ЕКС, ємністю батареї та вартістю.
Після імплантації ЕКС лікар повинен зробити підбір і програмування деяких його параметрів. У сучасних однокамерних ЕКС програмовані параметри включають вибір режиму стимуляції, нижній рівень частоти, тривалості імпульсу, амплітуди чутливості і рефрактерного періоду. Крім того, у двокамерних кардіостимуляторах програмується максимальний рівень частоти, АV-затримка і т.д. Частотно-адаптивні ЕКС містять програму для регуляції співвідношення чутливості і частоти стимуляції та обмеження за максимальною частою стимуляції, що сприймається. З появою більш складних систем електрокардіостимуляції оптимальне програмування стає ще більш складним і специфічним, що вимагає особливих знань лікаря. Деталі програмування ЕКС у цьому документі не розглядаються. Фундаментальна проблема лікаря — оптимальний вибір стимулювальної системи: однокамерна стимуляція шлуночка, однокамерна або двокамерна стимуляція передсердя.
У табл. 8.2 коротко викладені принципи вибору різних ЕКС залежно від показань до електрокардіостимуляції.
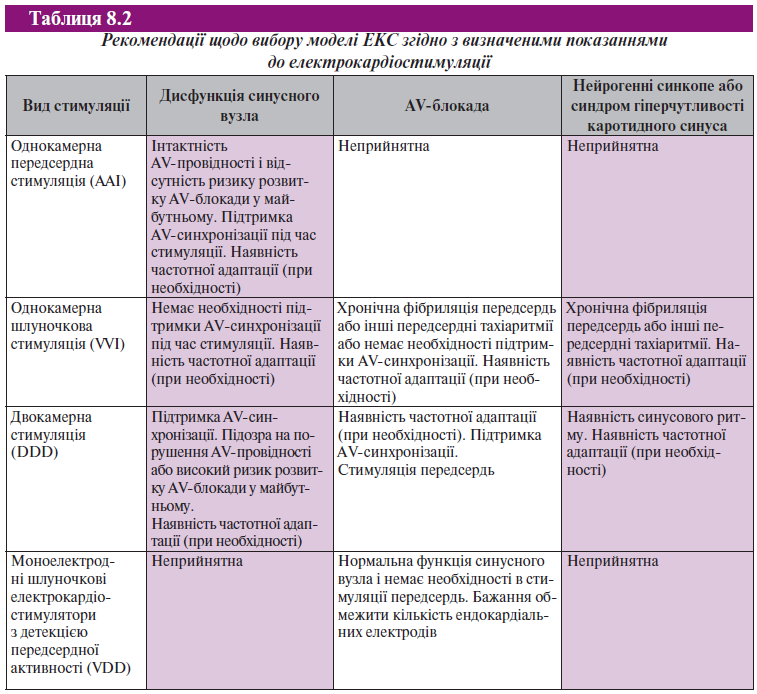
Важливо також правильно вибрати стимулювальну систему — вибрати таку, яка попередить прогресування порушень автоматизму та провідності найкращим чином. У зв’язку з цим доцільний підбір ЕКС з більшими можливостями програмування, ніж це необхідно на момент імплантації. Так, у пацієнта з дисфункцією синусного вузла і пароксизмальною фібриляцією передсердь надалі може розвинутися АV-блокада (внаслідок прогресування захворювання, прийому препаратів або катетерної абляції), а при наявності двокамерного ЕКС можливе перемикання режиму стимуляції.
Моноелектродні системи VDD
Незважаючи на переваги частотно-адаптивних стимулювальних систем, нормально функціонуючий синусний вузол здійснює найбільш оптимальну хронотропну реакцію ритму серця на фізіологічний стрес і навантаження. Найчастіше з такою метою використовують двокамерні ЕКС з окремим передсердним електродом, що детектує деполяризацію передсердь, і шлуночковим електродом. Моноелектродні трансвенозні стимулювальні системи, здатні здійснювати детекцію деполяризації передсердь, набувають усе більшої популярності. Дистальний кінець електрода встановлюється в ПШ, де здійснюється детекція шлуночкової активності і стимуляція, а пара електродів, що об’єднана в проксимальній частині єдиного електрода, розміщується в порожнині правого передсердя для детекції його активності. Сучасні моноелектродні системи в режимі VDD у 100% випадків не здатні стимулювати передсердя, оскільки передсердний сигнал, що визначається, меншої амплітуди, ніж у двокамерних системах і варіює залежно від положення тіла. Тому моноелектродні ЕКС у режимі VDD з простішою технікою імплантації є альтернативою двокамерній електрокардіостимуляції у пацієнтів з АV-блокадою, що не потребує стимуляції передсердя (нормальна хронотропна функція передсердь).
Автоматичне перемикання режиму стимуляції (mode switch)
З появою пароксизмів передсердної тахіаритмії (тріпотіння, фібриляція передсердь) у пацієнта зі стимуляцією в режимі DDD або DDDR тахіаритмія може сприйматися як максимальна частота в запрограмованому діапазоні, що може викликати небажане підвищення частоти шлуночкової стимуляції. У нові покоління двокамерних ЕКС включені алгоритми детекції частого, нефізіологічного передсердного ритму і автоматичного включення іншого режиму стимуляції (наприклад DDI або DDIR). Після закінчення тахіаритмії кардіостимулятор автоматично перемикається на початковий режим стимуляції (DDD або DDDR). Ця функція особливо корисна у пацієнтів з АV-блокадою та пароксизмальною фібриляцією передсердь. Вона дозволяє використовувати двокамерні стимулювальні системи у таких хворих. Більшість двокамерних ЕКС, що імплантуються на сьогодні у США, містять функцію автоматичного перемикання режиму.
Електроди для стимулювальних систем
При імплантації ЕКС найчастіше використовуються трансвенозні ендокардіальні електроди, рідше — епікардіальні. Трансвенозні електроди можуть бути біполярної або уніполярної конфігурації. Перевагою біполярних електродів є можливість запобігати епізодам міопотенціального інгібування і стимуляції скелетних м’язів, а найцінніша їх властивість — сумісність з кардіовертерами-дефібриляторами.
Електроди з активною фіксацією містять на дистальному кінці електрода спіралеподібний гвинт для фіксації до ендокарда і є альтернативними електродам з пасивною фіксацією. Активна фіксація дозволяє використовувати різні зони ендоміокарда для стимуляції. Наприклад, якщо шлуночковий електрод з пасивною фіксацією зазвичай розміщується на верхівці шлуночка, електрод з активною фіксацією може бути поміщений у верхівку, виносний тракт, приносний відділ ПШ, міжшлуночкову перегородку. Інша перевага електродів з активною фіксацією — полегшення екстракції після давно проведеної імплантації.
Розробка нових електродів з нижчим порогом стимуляції знижує енерговитрати батареї при стимуляції.
Спостереження пацієнтів з кардіостимуляторами
Після імплантації ЕКС необхідно ретельне, динамічне спостереження пацієнта. Багато загальних моментів у спостереженні за ЕКС та кардіовертерами-дефібриляторами. Перед випискою хворого необхідне тестування параметрів, запрограмованих під час імплантації. Вони повинні бути змінені у разі потреби при наступних візитах пацієнта з урахуванням отриманих у результаті застосування вихідних даних, їх тестування та скарг пацієнта. Програмування амплітуди, довжини імпульсу та інших діагностичних функцій, що впливають на стан батареї кардіостимулятора, не повинні знижувати безпеку застосування приладу для хворого. Оптимізація функції ЕКС повинна проводитися у кожного пацієнта індивідуально.
Частота і спосіб спостереження залежать від багатьох факторів, зокрема від наявних серцево-судинних захворювань та інших проблем зі здоров’ям, тривалості використання ЕКС, географічної віддаленості пацієнта від медичного центру. Більшість маніпуляцій за спостереженням пацієнтів виконується в умовах клініки. Автоматичні функції, наприклад оцінка порога стимуляції, широко використовуються в нових моделях ЕКС і полегшують спостереження хворих, які живуть віддалено. Проте автоматичні функції не універсальні, вони не можуть замінити індивідуальне програмування й тестування, що супроводжуються збиранням анамнезу та оглядом пацієнта. Спостереження в умовах клініки включає оцінку клінічного статусу хворого, стану батареї, порогів стимуляції і тривалості імпульсу, функції чутливості, цілісність електрода, а також оптимізацію PR-керованої частоти серцевого ритму. Розклад оглядів в умовах клініки складається на розсуд лікарів, що спостерігають цих пацієнтів. Загальноприйнятим у світі вважається настанова HCFA від 1984 р., відповідно до якої рекомендується: пацієнтам з однокамерними ЕКС після імплантації необхідно проводити обстеження 2 рази протягом 6 міс, потім щорічно. Хворим з двокамерними ЕКС після імплантації проводиться обстеження 2 рази на 6 міс, потім 1 раз на 6 міс.
Нещодавно з’явилися нові рекомендації для транстелефонного моніторування (ТТМ), що еволюціонувало з появою нових стимулювальних систем і транстелефонних технологій. Мета ТТМ полягає в реєстрації електрокардіостимуляторів у спокої і під час проведення магнітного тесту (табл. 8.3).
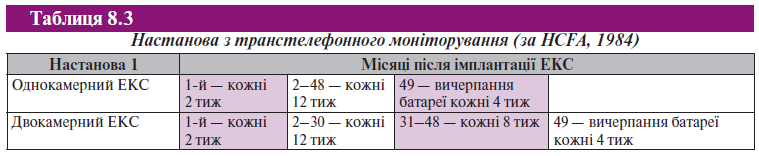
При ТТМ реєстрація ЕКС у спокої виявляє спонтанний ритм, переміжну або постійну електрокардіостимуляцію. Визначають ритм передсердь, наприклад наявність фібриляції передсердь або синусового ритму. При наявності спонтанного ритму визначають адекватність функції чутливості певної камери (або обох камер серця) залежно від виду ЕКС і режиму стимуляції.
Мета ТТМ при реєстрації ЕКГ під час магнітного тесту — виявлення ефективності стимуляції певної камери (або обох) залежно від виду ЕКС і режиму стимуляції. Оцінюючи магнітний тест, порівнюють частоту стимуляції з даними попереднього ТТМ і відзначають зміни. Пацієнт повинен знати про величину частоти магнітного тесту, що характерна для появи ознак виснаження батареї.
РЕКОМЕНДАЦІЇ ЩОДО ІМПЛАНТАЦІЇ ЕЛЕКТРОКАРДІОСТИМУЛЯТОРІВ І АНТИАРИТМІЧНИХ ПРИСТРОЇВ
Кардіостимуляція при набутій AV-блокаді у дорослих
За ступенем вираженості розрізняють АV-блокади I, II і III ступеня, анатомічно їх розподіляють на супра-, інтра- та інфрагісовську. I ступінь АV-блокади визначається як аномальне подовження інтервалу P–R >0,2 с. II ступінь АV-блокади поділяється на I і II тип. I тип АV-блокади II ступеня характеризується прогресивним подовженням інтервалу P–R до блокованого скорочення і зазвичай асоційований з вузьким комплексом QRS. II тип АV-блокади II ступеня характеризується фіксованим інтервалом P–R до і після блокованих комплексів, зазвичай асоційований з широким комплексом QRS. Якщо визначається проведення 2:1, блок не може бути класифікований на I або II тип, хоча це можливо припустити за шириною QRS. При вираженій АV-блокаді II ступеня не проводиться дві або більше послідовних Р-хвилі, але деякі хвилі проводяться, що показує наявність часткової АV-провідності. При III ступені АV-блокади (повній поперечній блокаді) АV-провідність відсутня (визначається передсердно-шлуночкова дисоціація).
Пацієнти з порушеннями АV-провідності можуть не відчувати симптомів (бути асимптомними) або пред’являти серйозні скарги внаслідок брадикардії, шлуночкових аритмій або їх поєднання. Рішення щодо необхідності імплантації кардіостимулятора багато в чому залежить від наявності або відсутності симптоматики, безпосередньо пов’язаної з брадикардією. Багато показань до кардіостимуляції, вироблені більш ніж за 40-річний період, базуються на клінічному досвіді, без проведення порівняльних рандомізованих клінічних досліджень, зокрема тому, що не існує прийнятної альтернативи лікування більшості брадиаритмій.
АV-блокада I ступеня
Нерандомізовані дослідження з високою вірогідністю показують, що постійна стимуляція поліпшує виживаність пацієнтів з блокадою III ступеня, особливо при наявності синкопе. Незважаючи на незначну кількість доказів того, що використання ЕКС підвищує виживаність пацієнтів з ізольованою АV-блокадою I ступеня, на сьогодні відомо, що значима АV-блокада I ступеня (P–R >300 мс) може викликати симптоматику при відсутності вищих ступенів блокади. Подібна значима АV-блокада I ступеня може бути наслідком катетерної абляції швидкого шляху АV-з’єднання з проведенням, що зберігається, по повільному шляху. Коли АV-блокада I ступеня з наявністю симптомів будь-якої етіології викликає скорочення передсердь у безпосередній близькості від систоли шлуночків, можуть з’явитися гемодинамічні наслідки і симптоми, як при ретроградному (вентрикулоатріальному) проведенні (пейсмейкерному синдромі). При АV-блокаді I ступеня (з клінічними симптомами) скорочення передсердь відбувається до їх повного наповнення, порушується наповнення шлуночків, підвищується тиск в легеневих капілярах, що веде до зниження серцевого викиду. Невеликі, неконтрольовані дослідження говорять про зменшення вираженості симптомів і поліпшення функції серця на фоні кардіостимуляції у пацієнтів з інтервалом P–R >300 мс при зменшенні часу АV-провідності. Нарешті, довгий інтервал P–R можуть мати пацієнти з дисфункцією ЛШ, стан яких може покращати при двокамерній стимуляції з укороченою АV-затримкою. Ці ж принципи можуть бути застосовані до пацієнтів з I типом АV-блокади II ступеня, гемодинаміка яких погіршується у зв’язку з втратою АV-синхронізації навіть при відсутності брадикардії.
АV-блокада II ступеня I типу
Перший тип АV-блокади II ступеня зазвичай викликаний затримкою проведення в АV-вузлі, незалежно від тривалості комплексу QRS. Оскільки прогресування АV-блока в цій ситуації не є частим, стимуляція зазвичай не показана, за винятком випадків, коли є виражена симптоматика.
АV-блокада II ступеня II типу
Не завжди можливо визначити рівень АV-блокади без ЕФД, оскільки АV-блокада II ступеня I типу може бути інфранодальною, навіть при вузькому QRS. Якщо при ЕФД виявляється I тип АV- блокади II ступеня з вузькими або широкими QRS на рівні або нижче пучка Гіса, показана постійна стимуляція. II тип АV-блокади II ступеня зазвичай інфранодальний (інтра- або інфрагісовський), особливо якщо комплекс QRS розширений. У таких пацієнтів часто присутня симптоматика, гірший прогноз, часто відзначають перехід у блокаду III ступеня. Таким чином, II тип АV-блокади II ступеня і широкий комплекс QRS свідчать про дифузне ураження провідної системи, тому рекомендоване проведення кардіостимуляції навіть при відсутності симптоматики.
АV-блокада III ступеня
Оскільки і для пацієнта, і для лікаря може бути складно пов’язати неспецифічні симптоми (такі як стомлюваність) з появою брадикардії, слід звертати особливу увагу на те, чи пов’язані скарги пацієнта з нечастим серцевим ритмом. Таким чином, у пацієнта з АV-блокадою III ступеня кардіостимуляція абсолютно показана при частоті ритму шлуночків <40 уд./хв.
АV-блокада іноді провокується фізичним навантаженням. Якщо АV-блокада не є вторинною відносно до ішемії міокарда, то зазвичай пов’язана з ураженням системи Гіса — Пуркіньє й асоціюється з поганим прогнозом, тобто стимуляція показана. Навпаки, довгі синусові паузи і АV-блокада можуть відзначатися при апное під час сну. При відсутності симптомів ці зміни оборотні і не вимагають стимуляції. Якщо симптоматика виражена й не зникає, стимуляція показана, як і в інших ситуаціях.
Рішення про імплантацію постійного ЕКС повинно прийматися залежно від того, чи буде блокада постійною. У першу чергу слід провести корекцію оборотних причин АV-блокади, таких як електролітні порушення. Деякі захворювання мають спонтанне завершення (наприклад хвороба Лайма), при деяких блокадах можна сподіватися на її оборотний характер (наприклад гіперваготонія внаслідок відомих і фізіологічних факторів, які можна попередити, периопераційна блокада внаслідок гіпотермії або запалення в області АV-вузла після хірургічного втручання). Навпаки, деякі умови можуть виправдовувати імплантацію стимулятора, внаслідок можливості прогресування захворювання, навіть коли АV-блокада транзиторно завершується, наприклад саркоїдоз, амілоїдоз, нейром’язові захворювання. АV-блокада після пластики або протезування клапанів серця має різний перебіг і рішення про постійну кардіостимуляцію приймає лікар (табл. 8.4).

Кардіостимуляція при хронічних біфасцикулярних і трифасцикулярних блокадах
Біфасцикулярна блокада належить до ситуацій з доведеними на ЕКГ порушеннями провідності нижче АV-вузла у двох гілках правої або лівої ніжки пучка Гіса. Альтернувальна блокада ніжок (відома також як білатеральна блокада ніжок) належить до ситуацій, у яких є явні ЕКГ докази блокади всіх трьох гілок. Наприклад, блокада правої і блокада лівої ніжки на ЕКГ або блокада правої ніжки в поєднанні з блокадою передньої гілки лівої ніжки пучка Гіса на одній ЕКГ і блокадою задньої гілки лівої ніжки пучка Гіса — на іншій. При чітко визначеній трифасцикулярній блокаді блок документований у всіх трьох гілках або послідовно, або в різний час. Альтернувальна блокада ніжок також відповідає цьому критерію. Цей термін також використовується для опису АV-блокади I ступеня з біфасцикулярним блоком. У пацієнтів з подібними ЕКГ-аномаліями і з вираженими симптомами АV-блокади відзначається високий рівень смертності і значна частота раптової серцевої смерті. Хоча біфасцикулярний блок найчастіше передує АV-блокаді III ступеня, є докази того, що перехід біфасцикулярного блока в АV-блокаду III ступеня відбувається поступово і тривалий час. Більше того, жодна із клінічних або лабораторних ознак, включаючи біфасцикулярний блок, не визначається у пацієнтів з високим ризиком раптової смерті від брадиаритмії, внаслідок блокади в області ніжок пучка Гіса.
У пацієнтів з біфасцикулярним блоком часто відзначають синкопе. Незважаючи на те що вони можуть повторюватися, це не пов’язано з підвищенням ризику раптової смерті. Електрокардіостимуляція попереджає появу короткочасних неврологічних симптомів, але не знижує частоту раптової смерті. Для оцінки і підбору терапії з приводу індукованих шлуночкових аритмій, часто наявних у пацієнтів з біфасцикулярними і трифасцикулярними блокадами, необхідне проведення ЕФД. Існують переконливі докази того, що наявність постійної або минущої АV-блокади III ступеня, синкопе асоційована з підвищеним ризиком раптової смерті незалежно від результатів ЕФД. Крім того, якщо при біфасцикулярній або трифасцикулярній блокаді відзначають синкопе нез’ясованого генезу або використовується терапія (медикаментозна), що може викликати АV-блокаду, показана профілактична постійна електрокардіостимуляція, особливо у випадку, якщо втрата свідомості зумовлена короткочасною (минущою) АV-блокадою III ступеня.
За даними обстеження тільки PR- і HV-інтервали можуть бути можливими предикторами АV-блокади III ступеня та раптової серцевої смерті. Хоча подовження PR-інтервалу часто відзначають у пацієнтів з біфасцикулярним блоком, затримка проведення часто відбувається на рівні АV-вузла. Не існує кореляції між PR- і HV-інтервалами, тривалістю PR і настанням АV-блокади III ступеня, а також раптової смерті. Хоча у більшості пацієнтів з хронічною або інтермітуючою АV-блокадою III ступеня відзначається подовження HV-інтервалу при антероградному проведенні, деякі дослідники вважають, що асимптомним пацієнтам з біфасцикулярним блоком показана постійна стимуляція, особливо коли HV-інтервал перевищує або дорівнює 100 мс. Незважаючи на те що подовження HV відзначають часто, частота переходу в АV-блокаду III ступеня невисока. Оскільки подовження HV-інтервалу відзначають при тяжких захворюваннях серця з підвищеною смертністю, смерть частіше буває не раптовою або викликаною АV-блокадою, а зумовлена основним серцевим захворюванням і неаритмічними причинами.
Використання передсердної стимуляції при ЕФД у асимптомних пацієнтів для виявлення блокади високого ступеня є суперечливим. Імовірність одержання блокади дистальніше АV-вузла (інтра- або інфрагісовської) за допомогою частої передсердної стимуляції невисока. Неможливість досягнення дистальної блокади при стимуляції не може бути доказом того, що в майбутньому не виникне АV-блокада III ступеня. Проте, одержання при передсердній стимуляції нефізіологічної інфрагісовської блокади розглядається деякими фахівцями як показання до стимуляції (табл. 8.5).

Кардіостимуляція при гострому ІМ
Показання до постійної стимуляції після ІМ у пацієнтів, що перенесли АV-блокаду, належать більшою мірою до порушень внутрішньошлуночкового проведення. На відміну від інших показань до постійної стимуляції, критерії для пацієнтів з гострим ІМ і АV-блокадою необов’язково залежать від наявності симптомів. Більше того, потреба в тимчасовій стимуляції при гострому ІМ сама по собі не визначає показань до постійної стимуляції.
Довгостроковий прогноз у пацієнтів, що перенесли гострий ІМ і мали АV-блокаду, залежить більшою мірою від розмірів ураження міокарда та характеру порушень внутрішньошлуночкової провідності, ніж від самої АV-блокади. Пацієнти з гострим ІМ, що мають порушення внутрішньошлуночкового проведення, за винятком ізольованої блокади передньої гілки лівої ніжки, мають несприятливий коротко- і довгостроковий прогнози, а також підвищений ризик раптової смерті. Цей несприятливий прогноз необов’язково пов’язаний з розвитком АV-блокади високого ступеня, хоча блокади відзначають частіше у пацієнтів, що перенесли ІМ з порушеним внутрішньошлуночковим проведенням.
Коли АV- або внутрішньошлуночкова блокада проведення ускладнює гострий ІМ, при розгляді показань до постійної стимуляції повинні враховуватися тип порушення провідності, локалізація інфаркту і зв’язок з ним електричних порушень. Навіть при наявності всіх даних, рішення не завжди однозначне, тому що можливість визначення порушення провідності і значимість порушень провідності за даними літератури дуже варіює. Незважаючи на проведення тромболітичної терапії і первинної ангіопластики, що знижують частоту АV-блокад при гострому ІМ, смертність при виникненні АV-блокади залишається високою.
Хоча найтяжчі порушення провідності загалом асоційовані з вищою смертністю, вплив раніше існуючої блокади ніжок пучка Гіса на смертність при гострому ІМ є суперечливим. Особливо несприятливий прогноз пов’язаний з наявністю блокади лівої ніжки в поєднанні з блокадою II або III ступеня, що далеко зайшла, або з наявністю блокади правої ніжки в поєднанні з блокадою передньої або задньої гілки лівої ніжки. Незалежно від передньої або нижньої локалізації ІМ розвиток порушень внутрішньошлуночкової провідності відображає велике ураження міокарда, а не окрему «електричну» проблему. Хоча АV-блокада, що виникає при нижньому ІМ, пов’язана з кращим довгостроковим клінічним результатом, госпітальна виживаність знижується незалежно від тимчасової або постійної стимуляції. Більше того, стимулятори не повинні імплантуватися, якщо периінфарктна блокада може бути припинена або не має негативного впливу на довгостроковий прогноз, як при нижньому ІМ (табл. 8.6).

Кардіостимуляція при дисфункції синусного вузла
Дисфункція синусного вузла поєднує цілий спектр аритмій, що включає синусову брадикардію, відмову синусного вузла, синоатріальну блокаду і пароксизмальні надшлуночкові тахіаритмії, що змінюються періодами брадикардії і/або асистолії. Такі пацієнти можуть мати симптоми тахікардії, брадикардії або ті й інші одночасно. Зв’язок симптомів з аритмією встановлюється за допомогою ЕКГ. Визначення цього зв’язку може бути складним через минущий характер епізодів аритмій. В електрофізіологічній лабораторії порушена функція синусного вузла може бути охарактеризована подовженням коригованого періоду відновлення функції синусного вузла або часу синоатріального проведення. Проте інформативність ЕФД обмежена чутливістю та специфічністю методу.
Дисфункція синусного вузла може проявлятися хронотропною недостатністю з неадекватною відповіддю синусного вузла на навантаження або стрес. Частотно-адаптивні ЕКС допомагають пацієнтам відновити фізіологічну частоту ритму під час фізичної активності.
Синусова брадикардія допускається як фізіологічна знахідка у тренованих атлетів. У них ЧСС нерідко становить 40–50 уд./хв під час відпочинку та пробудження. ЧСС до 30 уд./хв відзначається у таких осіб під час сну, із синусовими паузами або АV-блокадою II ступеня I типу, що дають асистолічні інтервали до 2,8 с. Ці особливості зумовлені підвищеним тонусом блукаючого нерва.
Хоча дисфункція синусного вузла часто є первинним показанням для імплантації постійного ЕКС, постійна стимуляція у таких пацієнтів необов’язково сприяє підвищенню виживаності тоді, коли симптоми брадикардії можуть зникати. При моніторуванні паузи частіше відзначають під час сну, хоча їх тривалість і клінічна значимість однозначно не визначені. Якщо вони пов’язані з апное під час сну — необхідно лікувати апное. Невелике ретроспективне дослідження частої (overdrive) передсердної стимуляції при лікуванні апное під час сну показало зниження частоти епізодів або центрального обструктивного апное в цей період без зменшення часу сну. Хоча результати такого дослідження обнадійливі, вони є передчасними для надання рекомендацій (до проведення більшої кількості клінічних випробувань). З іншого боку, немає переконливих доказів, що дозволяють розрізнити фізіологічну і патологічну нічну брадикардію (табл. 8.7).
Запобігання і припинення тахіаритмій методом електрокардіостимуляції
За певних обставин імплантований стимулятор може бути корисний для лікування пацієнтів із зворотною симптомною шлуночковою і надшлуночковою тахікардією. Стимуляцію можна використовувати для запобігання та купірування аритмій. Рецидивуючі аритмії, такі як тріпотіння передсердь, пароксизмальні реципрокні надшлуночкові тахікардії і шлуночкові тахікардії можуть бути купіровані різними режимами стимуляції, включаючи програмовану стимуляцію і короткі залпи частої стимуляції (burst, ramp). Антиаритмічні пристрої можуть детектувати тахікардію і автоматично активувати стимуляцію або відповідати на зовнішній запуск (наприклад піднесення магніту).
Профілактика аритмій за допомогою кардіостимуляції продемонстрована в ряді випадків. У деяких пацієнтів із синдромом подовженого інтервалу Q–T рецидивуючій, брадизалежній шлуночковій тахікардії можна запобігти overdrive-стимуляцією. Описано, що комбінація передсердної стимуляції та прийом блокаторів β-адренорецепторів сприяє скороченню інтервалу Q–T і допомагає запобігти раптовій смерті. Імплантація штучного кардіовертера-дефібрилятора у поєднанні зі стимуляцією повинна розглядатися у пацієнтів групи високого ризику ранньої серцевої смерті (табл. 8.8).

Синхронізована з передсердям шлуночкова стимуляція може запобігати надшлуночковим реципрокним тахікардіям, хоча ця методика рідко використовується у зв’язку з можливістю проведення катетерної абляції або інших видів лікування. Хоча шлуночкова ектопічна активність також може бути пригнічена подібною стимуляцією, серйозні і симптоматичні аритмії рідко піддаються профілактиці. У деяких пацієнтів з брадизалежною фібриляцією передсердь передсердна стимуляція може бути ефективною для зниження частоти рецидивів. У пацієнтів із синдромом слабкості синусного вузла і внутрішньопередсердною блокадою проведення (Р >160 мс) біатріальна стимуляція може знизити частоту рецидивів фібриляції передсердь.
Потенційні реципієнти антиаритмічних пристроїв, що переривають аритмії, повинні піддаватися розширеному тестуванню перед імплантацією, для того щоб переконатися в безпеці апарата, а також у тому, що він надійно купірує механізм аритмії без прискорення аритмії та індукції фібриляції шлуночків (табл. 8.9). Пацієнти, яким рекомендується антитахікардитичний стимулятор, зазвичай рефрактерні до антиаритмічної терапії. Коли постійний антитахікардитичний прилад детектує та перериває надшлуночкову тахікардію, у зв’язку з описаними побічними ефектами використання шлуночкової стимуляції, необхідна тільки передсердна стимуляція. Постійна антитахікардитична стимуляція як монотерапія шлуночкової тахікардії неприйнятна. Застосування цих алгоритмів можливе при послідовних режимах терапії при імплантованому кардіовертері-дефібриляторі, коли є можливість кардіоверсії та дефібриляції у випадках, якщо антитахікардитична стимуляція неефективна або при збільшенні вираженості тахікардії.

КАРДІОСТИМУЛЯЦІЯ ПРИ ГІПЕРЧУТЛИВОСТІ КАРОТИДНОГО СИНУСА І НЕЙРОКАРДІОГЕННОМУ СИНКОПЕ
Синдром гіперчутливості каротидного синуса проявляється синкопальними (повна втрата свідомості) або пресинкопальними станами в результаті підвищеної рефлекторної відповіді на стимуляцію каротидного синуса. Ця причина синкопе досить рідко діагностується і представлена двома компонентами рефлекторної відповіді:
1) кардіоінгібіторний — внаслідок підвищення парасимпатичного тонусу, що призводить до маніфестації синусової брадикардії або подовження інтервалу P–R з появою АV-блокади або до їх комбінації;
2) вазодепресорний — у результаті зниження симпатичної регуляції тонуса судинної стінки, що проявляється зниженням тонусу і гіпотонією. Цей ефект виникає незалежно від змін ритму серця.
Для визначення показань до постійної кардіостимуляції в подібних випадках необхідно з’ясувати, яка ступінь участі того або іншого компонента у симптомокомплексі синкопального стану пацієнта. Гіперчутливість каротидного синуса може проявлятися як у вигляді епізодів асистолії тривалістю >3 с, внаслідок відмови синусного вузла або АV-блокади, у вигляді симптомного зниження САТ, так і у вигляді поєднання цих симптомів. У нормі у здорових людей і у пацієнтів з ІХС при проведенні проби з масажем каротидного синуса паузи не перевищують 3 с. з’ясування причинно-наслідкового зв’язку у випадку діагностування синдрому гіперчутливості каротидного синуса є першорядним завданням. Сама поява синкопальних станів при стимуляції каротидного синуса припускає наявність цього синдрому. Незначний тиск на зону каротидного синуса у людей похилого віку і пацієнтів, що приймають препарати дигіталісу, також може призвести до змін серцевого ритму і АТ, які не є ознаками синдрому гіперчутливості каротидного синуса. Постійна кардіостимуляція досить ефективно усувала симптоми при кардіоінгібіторному типі синдрому гіперчутливості каротидного синуса. У 10–20% пацієнтів із синдромом гіперчутливості каротидного синуса кардіоінгібіторний тип поєднується в різному відсотковому співвідношенні з вазодепресорним компонентом. Ефективність кардіостимуляції у таких пацієнтів залежить від верифікації причини синкопальних станів. Тому слід переконатися, що воно викликане саме епізодом асистолії.
Практика показує, що більшість синкопальних станів нез’ясованого генезу у пацієнтів похилого віку зумовлені синдромом гіперчутливості каротидного синуса. При спостереженні хворих з проведенням електрокардіостимуляції ймовірність виникнення епізодів втрати свідомості була значно нижчою.
Нейрокардіогенні синкопе і синдроми розвиваються за різними сценаріями, проте і брадикардія, і периферична вазодилатація можуть призводити до минущої системної гіпотонії. Нейрокардіогенні синкопе становлять близько 10–40% усіх причин синкопальних станів. Під терміном «вазо-вагальні синкопе» мається на увазі найпоширеніший сценарій синкопального стану і також належить до категорії нейрокардіогенних синкопальних синдромів. Як правило, у таких пацієнтів відзначають попередні продромальні симптоми — нудоту, пітливість (у осіб похилого віку вони можуть бути відсутніми), які нерідко успадковуються. Ці напади можуть провокуватися болем, занепокоєнням, стресовими ситуаціями, перебуванням у задушливому приміщенні. Зазвичай структурних змін серця у таких пацієнтів не виявляють, виключені також інші причини синкопальних станів — обструкція виносного тракту ЛШ, брадиаритмія, тахіаритмія. З діагностичною метою ефективне проведення ортостатичної проби на столі, кут нахилу якого змінюється — тилт-тест (tilt-test).
Роль постійної кардіостимуляції при рефрактерних нейрокардіогенних синкопальних станах, що поєднуються з вираженою брадикардією і асистолією, суперечлива. Приблизно у 25% пацієнтів з домінуючим вазодепресорним ефектом виражена брадикардія може не реєструватися. Крім того, більшу частину становлять хворі з поєднанням компонентів. За даними досліджень відзначена деяка ефективність кардіостимуляції у цієї категорії пацієнтів, в інших роботах показано, що стимуляція з частотою, що на 20% перевищує спонтанний ритм, не запобігала появі синкопе і фармакотерапія не поступалася за ефективністю лікування. Отримані результати пояснювали тим, що брадикардія з’являлася повторно на фоні зниження АТ. Двокамерна кардіостимуляція при кардіоінгібіторному типі синдрому гіперчутливості каротидного синуса, підтвердженого тилт-тестом, виявилася ефективним методом лікування. За даними рандомізованих досліджень постійна кардіостимуляція у пацієнтів з вираженою симптомною брадикардією значно збільшувала строки появи синкопальних станів (табл. 8.10).

Вивчалися і різні види стимуляції у цієї категорії пацієнтів. В одному з досліджень продемонстрована ефективність DDD-стимуляції з функцією частотної адаптації порівняно з терапією блокаторами β-адренорецепторів для запобігання рецидивів у пацієнтів із симптомними вазо-вагальними синкопе та помірною брадикардією під час тилт-тесту. В цілому у таких пацієнтів прогноз при відсутності кардіостимуляції досить сприятливий. Ряд дослідників підкреслюють ефективність електрокардіостимуляції у пацієнтів із синдромом гіперчутливості каротидного синуса, в основі якого лежить симптомна брадикардія, підтверджена ЕФД.
При дослідженні цих пацієнтів важливо не упустити інші, більш небезпечні причини станів втрати свідомості, таких як шлуночкова тахіаритмія.
Кардіостимуляція у дітей, підлітків і пацієнтів з вродженими вадами серця
Показаннями для імплантації постійного ЕКС дітям, підліткам і пацієнтам молодого віку з вродженими вадами серця є:
1) симптомна синусова брадикардія;
2) синдром брадитахікардії;
3) вроджена повна АV-блокада;
4) хірургічна або набута АV-блокада II або III ступеня.
Хоча показання до імплантації у дітей і дорослих подібні, слід зазначити кілька моментів. По-перше, збільшується кількість пацієнтів, яким проводяться складні паліативні хірургічні втручання, не спрямовані на повну корекцію вади серця. Порушення функції шлуночків, що зберігається, може призвести до розвитку симптомів брадикардії при ЧСС, яка б у випадку збереженої фізіології кровообігу не супроводжувалася симптоматикою. Таким чином, у таких пацієнтів показання до імплантації ґрунтуються на поєднанні симптомів з рівнем ЧСС. По-друге, клінічна значимість брадикардії залежить від віку. Наприклад, ЧСС 50 уд./хв у підлітка може бути варіантом норми, а у немовляти — вираженою брадикардією.
Брадикардія і асоційовані з нею симптоми у дітей часто бувають минущими (наприклад минуща АV-блокада або зупинка синусного вузла), що утруднює їх діагностику. Дисфункція синусного вузла часто реєструється в педіатричній практиці. Проте лише при наявності синкопального стану і брадикардії (ЧСС <40 уд./хв або асистолії тривалістю >3 с) таким пацієнтам показана імплантація ЕКС. Зв’язок появи симптомів з брадикардією встановлюється за допомогою холтерівського моніторування або транстелефонної ЕКГ. Тільки після виключення інших причин появи симптомів — напади, затримка дихання, апное або нейрокардіогенні синкопе приймається рішення про імплантацію ЕКС.
Синдром брадитахікардії (синусова брадикардія в поєднанні з тріпотінням/фібриляцією передсердь або передсердною реципрокною тахікардією) нерідко діагностують у пацієнтів молодого віку після хірургічної корекції вроджених вад серця. Великий відсоток захворюваності і смертності відзначений серед пацієнтів молодого віку з персистувальним або хронічним тріпотінням/фібриляцією передсердь, а синусова брадикардія є незалежним предиктором розвитку тріпотіння/фібриляції передсердь. Фармакотерапія має ряд обмежень: тривалий прийом одних препаратів (соталол або аміодарон) при тріпотінні/фібриляції передсердь може призвести до симптомної брадикардії, а прийом інших (препарати I класу — хінідин, пропафенон) підвищує ризик розвитку шлуночкових аритмій або вираженої брадикардії, небезпечної розвитком раптової смерті. У деяких випадках при вроджених вадах серця альтернативним способом терапії є радіочастотна катетерна абляція і модифікація анатомічного субстрату тахікардії.
Показання до імплантації ЕКС у пацієнтів молодого віку з вродженою повною поперечною блокадою згодом зазнали змін, які базувалися як на спостереженні природного перебігу захворювання, так і на успіхах діагностики і появи сучасних технологій електрокардіостимуляції. У декількох дослідженнях було показано, що кардіостимуляція у пацієнтів з асимптомною повною блокадою підвищувала їх довгострокову виживаність і запобігала синкопальним станам. У таких хворих, у тому числі і після імплантації, необхідно контролювати функцію ЛШ. У асимптомних пацієнтів з повною АV-блокадою обов’язково дослідження середньодобової ЧСС, виявлення пауз при спонтанному ритмі, структурних аномалій, вимірювання інтервалу Q–T і дослідження толерантності до фізичних навантажень.
Багато спостережень підкреслюють доцільність використання блокаторів β-адренорецепторів на фоні кардіостимуляції у пацієнтів із вродженим синдромом подовженого інтервалу Q–T. Найбільш оптимальний ефект від електрокардіостимуляції відзначений у пацієнтів з брадизалежною блокадою в поєднанні з вродженим синдромом подовженого інтервалу Q–T. Імплантація ЕКС у таких пацієнтів зменшує кількість симптомів, забезпечуючи таким чином зниження ризику раптової зупинки серця.
Набагато гірший прогноз у хворих з післяопераційною АV-блокадою при постійній електрокардіостимуляції. АV-блокада II або III ступеня, що зберігається протягом 7–10 діб після операції є абсолютним показанням до імплантації ЕКС. Необхідність електрокардіостимуляції у пацієнтів з минущою АV- і біфасцикулярною блокадою не настільки очевидна, так як у хворих після нормалізації АV-провідності прогноз поліпшується.
Для ухвалення рішення про імплантацію ЕКС пацієнтам зі збереженими інтракардіальними дефектами необхідно враховувати ризик парадоксальної емболії тромботичними масами, локалізованими на ендокардіальному електроді, і вибір варіанта імплантації (трансвенозний або епікардіальний).
Кардіостимуляція при специфічних станах
Обструктивна ГКМП
У ранніх нерандомізованих дослідженнях було продемонстроване зниження градієнта між ЛШ і його виносним трактом при двокамерній кардіостимуляції з укороченою АV-затримкою та зменшення симптоматики у деяких пацієнтів з гіпертофічною обструктивною кардіоміопатією. Тривале дослідження за участю 8 осіб з двокамерною кардіостимуляцією протягом тривалого періоду виявило зниження цього градієнта навіть після припинення стимуляції. Це дозволило припустити, що завдяки стимуляції відбулося ремоделювання шлуночків. Результати двох рандомізованих досліджень показали суб’єктивне покращання якості життя у близько 50% випробовуваних, що проте не було пов’язане зі зниженням градієнта. Дані третього рандомізованого дослідження не показали будь-якого поліпшення якості життя у пацієнтів при кардіостимуляції, хоча було висловлено припущення, що стимуляція у хворих похилого віку (старше 65 років) була більш ефективною (табл. 8.11).
Таблица 8.11. Рекомендації для постійної електрокардіостимуляції при ГКМП
| Ефективність | Клінічні групи пацієнтів |
| Високоефективно | При дисфункції синусного вузла або АV-блокади згідно із загальноприйнятими рекомендаціями |
| Малоефективно | Стійка до медикаментозної терапії, що проявляється клінічно ГКМП зі значним зниженням ФВ ЛШ в спокої або при навантаженні |
| Неефективно | 1. Пацієнти з безсимптомним перебігом або при успішному медикаментозному контролі
2. Пацієнти, у яких є симптоми, але відсутні ознаки зниження ФВ ЛШ |
У невеликої групи пацієнтів з обструктивною ГКМП проводилася VDD-стимуляція з передчасним збудженням шлуночків, тобто короткою АV-затримкою. У цій групи відзначили покращання клінічної симптоматики, підвищення серцевого резерву і толерантності до фізичних навантажень. Двокамерна стимуляція може зменшити градієнт вихідного тракту і у педіатричній практиці. Проте у деяких пацієнтів ефективність кардіостимуляції знижується при високій частоті передсердного ритму, швидкій АV-провідності та вроджених аномаліях мітрального клапана.
Сьогодні практично відсутні докази того, що електрокардіостимуляція попереджає подальше прогресування захворювань і поліпшує виживаність або якість життя. Крім того, рутинна імплантація двокамерного ЕКС не рекомендується абсолютно всім пацієнтам із симптомною обструктивною ГКМП. Ефективність кардіостимуляції визначається головним чином вираженістю градієнтів (>30 мм рт. ст. у спокої і >50 мм рт. ст. при навантаженні).
У дуже симптомних пацієнтів замість двокамерної кардіостимуляції краще проводити септальну міотомію або внутрішньокоронарну септальну спиртову деструкцію.
Ідіопатична ДКМП
Як показали результати деяких досліджень, двокамерна електрокардіостимуляція з укороченою АV-затримкою тільки незначно поліпшувала перебіг симптомної ДКМП, резистентної до медикаментозного лікування. Теоретично укорочення АV-затримки оптимізує час механічної AV-синхронізації і наповнення шлуночків. При подовженні інтервалу P–R >200 мс показники часу діастолічного наповнення можна поліпшити за допомогою укорочення АV-затримки на фоні двокамерної стимуляції. В одному із проведених досліджень у такий спосіб було досягнуто збільшення ФВ ЛШ до 38%, при вихідному середньому інтервалі P–R 280 мс. При коротшому вихідному інтервалі P–R подібних результатів досягти не вдалося. У цілому можна чекати позитивного ефекту від постійної кардіостимуляції у цієї категорії хворих у поєднанні з подовженням інтервалу P–R, що підтверджують дані короткострокових досліджень. Проте на сьогодні довгостроковий прогноз у таких пацієнтів невідомий і немає єдиної думки серед учених у визначенні показань для імплантації ЕКС. Механізм позитивного ефекту двокамерної стимуляції при ДКМП дотепер ще не зовсім зрозумілий. Відповідно до однієї гіпотези, завдяки передсердному внеску оптимально заповнюються шлуночки і зменшується мітральна регургітація, збільшується ударний об’єм і підвищується АТ.
У 30–50% пацієнтів із застійною СН діагностують порушення внутрішньошлуночкової провідності. Ці порушення — незалежний предиктор раптової серцевої смерті згодом прогресують і призводять до дискоординації скорочення шлуночків з уже вихідним погіршенням скорочувальної функції. Затримка активації ЛШ під час стимуляції правого також призводить до вираженого порушення синхронізації скорочення і розслаблення ЛШ. Бівентрикулярна стимуляція забезпечує координоване скорочення шлуночків, скорочує ширину комплексу QRS, зменшує внутрішньошлуночкову і міжшлуночкову асинхронність.
Так, у осіб із застійною СН III і IV класу за NYHA, зниженою ФВ ЛШ, розширеним комплексом QRS бівентрикулярна стимуляція скорочувала тривалість комплексу QRS і поліпшувала показники 6-хвилинної ходи, а також клас СН і якість життя пацієнтів, знижувала частоту повторних госпіталізацій. Незважаючи на це, на сьогодні немає достатньої інформації, наскільки кардіостимуляція у таких пацієнтів підвищує виживаність, є лише припустимі дані про зниження спонтанної шлуночкової ектопічної активності і шокових розрядів кардіовертера-дефібрилятора. Дослідження ефективності бівентрикулярної кардіостимуляції у поєднанні з функцією дефібриляції показало вплив електротерапії на суб’єктивне самопочуття і підвищення показників виживаності при одночасній імплантації бівентрикулярного штучного кардіовертера-дефібрилятора (дослідження COMPANION) (табл. 8.12).

Трансплантація серця
Частота розвитку брадикардії після трансплантації серця варіює в межах 8–23%. Більшість брадиаритмій пов’язана з дисфункцією синусного вузла. У деяких програмах з трансплантації рекомендується використовувати електрокардіостимуляцію у таких пацієнтів, оскільки з появою симптомів затягується відновлювальний і реабілітаційний період. Протягом наступних 6–12 міс у 50% пацієнтів відзначали припинення брадиаритмій, тому у багатьох з них немає необхідності в постійній електрокардіостимуляції. Виражені брадиаритмія та асистолія часто були причиною раптової смерті. Предикторів розвитку післяопераційної брадикардії не виявлено. Деяким пацієнтам потрібна тимчасова електрокардіостимуляція. Повноцінний передсердний внесок забезпечує ефективний серцевий викид і хронотропну функцію, що поліпшує стан хворого. Призначення таких препаратів, як теофілін, може зменшити необхідність в електростимуляції. Після трансплантації особам з необоротною дисфункцією синусового вузла і АV-блокадою абсолютно показана імплантація ЕКС.
СН (показання до серцевої ресинхронізаційної терапії)
У Європі СН діагностована у більше ніж 10 млн осіб. ХСН — розповсюджена причина погіршення якості життя, передчасної смерті та широкого спектра супутніх захворювань.
Двома основними безпосередніми причинами летального кінця у пацієнтів з СН є порушення насосної функції серця і раптова серцева смерть. Дані дослідження ATLAS, проведеного у Великобританії, а також результати раніше проведених робіт свідчать про те, що на частку раптової серцевої смерті доводиться до 33–50% усіх смертей унаслідок СН.
Сучасна медична апаратура дозволяє поєднати терапію імплантованими кардіовертерами-дефібриляторами із серцевою ресинхронізаційною, підвищуючи ступінь захисту пацієнта з ризиком загрозливих для життя аритмій, а також якість життя та клінічних результатів при СН. Загальною метою таких комбінованих пристроїв є сповільнення прогресування СН, скорочення часу лікування в стаціонарі та профілактика раптової серцевої смерті.
Лікувальні пристрої, що застосовуються
Ресинхронізуюча електростимуляція серця
Постійна бівентрикулярна ресинхронізуюча кардіоелектростимуляція (так званий режим CRT-P) показана пацієнтам із зниженою ФВ ЛШ та асинхронністю скорочення шлуночків (тривалість QRS ≥120 мс), клінічний стан яких залишається на рівні ІІІ–ІV ФК за NYHA, незважаючи на оптимальну медикаментозну терапію (тобто стандартну для ХСН із застосуванням максимально переносимих доз рекомендованих препаратів). Застосування зазначеного підходу сприяє зменшенню симптомів СН, зростанню толерантності до фізичного навантаження, знижує смертність та ризик госпіталізацій зазначеної категорії хворих.
Імплантація кардіовертера-дефібрилятора
З метою первинної профілактики раптової аритмічної смерті:
а) показана хворим ІІ–ІІІ ФК за NYHA з ФВ ЛШ ≤35%, що перенесли ІМ не раніше, ніж 40 днів тому, які отримують оптимальну схему стандартної медикаментозної терапії, за умови орієнтовного очікуваного сприятливого прогнозу виживання >1 року;
б) показана хворим на ДКМП ІІ–ІІІ ФК за NYHA з ФВ ЛШ ≤35%, які отримують оптимальну схему стандартної фармакотерапії, за умови орієнтовного очікуваного сприятливого прогнозу виживаності >1 року.
З метою вторинної профілактики раптової аритмічної смерті. Показана хворим із систолічною дисфункцією ЛШ незалежно від наявності клінічних симптомів СН, які перенесли епізод(-и) фібриляції шлуночків або шлуночкової тахікардії з нестабільною гемодинамікою чи синкопальними проявами і отримують оптимальну схему стандартної медикаментозної терапії, за умови орієнтовного очікуваного прогнозу виживаності у задовільному функціональному стані >1 року.
Постійна ресинхронізуюча стимуляція серця з паралельною функцією дефібрилятора (режим CRT-D)
Рекомендована з метою поліпшення прогнозу виживання та зниження ризику госпіталізацій, пацієнтам ІІІ–IV ФК за NYHA з ФВ ЛШ ≤35% та тривалістю QRS ≥120 мс, які отримують оптимальну схему стандартної медикаментозної терапії.
Пацієнти з такими ознаками можуть вважатися підходящими кандидатами для ресинхронізаційної терапії:
- ХСН (ФК II–IV NYHA), стійка до оптимальної стандартної медикаментозної терапії;
- ФВ ЛШ <35%;
- кінцево-діастолічний розмір ЛШ >55 мм;
- тривалість QRS ≥120 мс;
- наявність або відсутність показань до застосування імплантованого кардіовертера-дефібрилятора.
Порівняння медикаментозної терапії, штучних водіїв ритму і дефібриляції при ХСН проводилося в дослідженні COMPANION. Попередні результати цього випробування були представлені на початку 2003 р. на АСС, а в серпні — на засіданні Європейського товариства кардіологів. У дослідженні брали участь 1520 пацієнтів з низькою ФВ ЛШ, широким QRS, ФК III–IV NYHA, нормальним синусовим ритмом на фоні оптимальної медикаментозної терапії СН при необхідності антиаритмічної терапії.
Пацієнти одержували або ресинхронізаційну терапію з оптимальною медикаментозною терапією, або ресинхронізаційну терапію + імплантацію кардіовертера-дефібрилятора (РСТ-Д) і оптимальну антиаритмічну терапію, або тільки оптимальну медикаментозну терапію. Було показано, що режим РСТ-Д знижує загальну смертність пацієнтів з СН на 43% порівняно тільки з оптимальною медикаментозною терапією.
Попередні результати дослідження COMPANION свідчать про значне зниження смертності при поєднанні ресинхронізаційної терапії та імплантованих кардіовертерів-дефібриляторів у пацієнтів групи високого ризику з СН, зниженою ФВ ЛШ, широким комплексом QRS, ФК III–IV NYHA, нормальним синусовим ритмом і оптимальною антиаритмічною терапією.
Механізми поліпшення стану при ресинхронізаційній терапії досягаються шляхом:
- покращання систолічної функції (збільшення ФВ);
- координації скорочення ЛШ;
- укорочення часу скорочення ЛШ;
- діастолічної функції;
- подовження часу заповнення ЛШ;
- зменшення мітральної регургітації;
- можливого ремоделювання шлуночків серця.
Сучасна класифікація абсолютних показань до ресинхронізаційної терапії включає пацієнтів з:
1) ДКМП: ФВ <35%, кінцево-діастолічний розмір >55 мм;
2) ФК за NYHA — III–IV;
3) неефективною оптимальною фармакотерапією: інгібітори АПФ, препарати наперстянки, спіронолактон;
4) наявністю шлуночкової десинхронізації:
а) QRS >130–150 мс;
б) затримкою передвигнання з аорти >140 мс;
в) механічною міжшлуночковою затримкою >40 мс;
г) лівошлуночковим сегментарним постсистолічним скороченням.
ПОКАЗАННЯ ДЛЯ ПРОВЕДЕННЯ ІМПЛАНТАЦІЇ КАРДІОВЕРТЕРА-ДЕФІБРИЛЯТОРА
Раптова серцева смерть: визначення
Під раптовою серцевою смертю мається на увазі природна смерть внаслідок серцевої патології, якій передувала раптова втрата свідомості протягом 1 год після виникнення гострої симптоматики, коли може бути відомо про попереднє захворювання серця, але час і спосіб настання смерті несподівані. Ключові поняття, що займають центральне місце у визначенні — це нетравматична природа події і той факт, що раптова смерть несподівана і негайна.
Відповідно до класифікації серцево-судинних захворювань, що прийнята в Україні, під раптовою серцевою смертю (аритмічною) розуміють смерть, що настала в період до 1 год після появи перших симптомів захворювання або значного погіршення стану пацієнта на фоні стабільного хронічного перебігу захворювання.
Епідеміологія
Серцево-судинні захворювання продовжують залишатися головною причиною смерті. Зокрема, у Великобританії щорічно від них помирають більше 300 тис. жителів. Після ІМ, кількість летальних випадків внаслідок якого щорічно становить близько 125 тис., раптова серцева смерть є другою за поширеністю причиною серцево-судинної смертності, забираючи за рік у Великобританії приблизно 70–90 тис. життів, у США — 300–400 тис. і, за деяким даними, >200 тис. у Росії. Близько 83% випадків раптової серцевої смерті пов’язано з ІХС, недіагностованою на момент смерті.
Відомо декілька факторів ризику раптової серцевої смерті: наявність в анамнезі епізоду раптової серцевої смерті, шлуночкової тахікардії, ІМ, захворювань коронарних судин, випадки раптової серцевої смерті або раптової непоясненої смерті в родині, погіршення функції ЛШ, ГКМП або гіпертрофія шлуночків, застійна СН, кардіоміопатія, синдром Бругада, синдром подовженого інтервалу Q–T та ін.
Найважливішою причиною смерті серед дорослої популяції є раптова серцева смерть внаслідок коронарної хвороби серця. У пацієнтів із раптовим серцево-судинним колапсом при реєстрації ЕКГ було показано, що фібриляція шлуночків і шлуночкова тахікардія відзначаються у 75–83% випадків, у той час як брадиаритмії, очевидно, відіграють незначну роль у розвитку раптової серцевої смерті. Приблизно в 5–10% випадків раптова серцева смерть настає без наявності коронарної хвороби серця або застійної СН.
Частота раптової серцевої смерті, що відзначається в країнах Заходу, приблизно однакова і варіює від 0,36 до 1,50 на 1000 жителів на рік. У ці дослідження включалися тільки підтверджені свідками випадки раптової серцевої смерті або пацієнти, реанімовані медичним персоналом, отже, ці дані занижені щодо дійсної частоти раптової серцевої смерті в загальній популяції.
Варіанти проведеної терапії
Лікування пацієнтів зі шлуночковими аритміями спрямоване на профілактику або купірування аритмії. Сьогодні варіанти лікування включають:
- базисну терапію основного захворювання;
- терапію антиаритмічними препаратами III класу;
- радіочастотну абляцію;
- імплантацію штучних кардіовертерів-дефібриляторів.
Роль антиаритмічних препаратів полягає в профілактиці аритмії. Проте якщо епізод шлуночкової тахікардії або фібриляції шлуночків розвинувся в період прийому антиаритмічних препаратів, препарат не в змозі купірувати аритмію, тільки імплантація кардіовертера-дефібрилятора може купірувати епізод шлуночкової тахікардії або фібриляції шлуночків. Слід зазначити, що цей метод досить дорогий і як стандарт не може розглядатися у всіх країнах, особливо економічно малорозвинених.
Радіочастотна абляція проводиться у невеликої кількості пацієнтів зі шлуночковою тахікардією зі стабільною гемодинамікою і не буде розглядатися в цьому розділі.
Було показано, що імплантація кардіовертера-дефібрилятора сприяє зниженню загальної смертності (від усіх причин на 31% серед пацієнтів, що перенесли ІМ і мають ФВ <30%). Зниження загальної смертності було повністю зумовлене зменшенням випадків раптової серцевої смерті.
Дані досліджень COMPANION, InSync ICD і MIPACLE ICD продемонстрували безпеку та ефективність цих апаратів, що поєднують переваги імплантації кардіовертера-дефібрилятора та серцевої ресинхронізаційної терапії у пацієнтів з ХСН. Крім того, підвищується якість життя хворих, знижується ФК СН, покращуються фізичні можливості, припиняються шлуночкові аритмії.
Результати нещодавно проведеного дослідження свідчили про покращання якості життя пацієнтів з імплантованим кардіовертером-дефібрилятором порівняно з тими, хто одержував тільки антиаритмічні препарати. Для невеликої кількості пацієнтів, що випробували кілька розрядів імплантованого кардіовертера-дефібрилятора, може знадобитися психологічна реабілітація і додаткова підтримка.
Розроблені за останні 5 років пристрої та електроди відрізняються більшою довговічністю, можливостями тонкої настройки, зручністю використання для пацієнтів завдяки зменшеним розмірам. У сумі це сприяє підвищенню їх економічної ефективності і якості життя пацієнтів.
За показником «кількість пацієнтів, яким необхідно провести лікування для порятунку життя одного пацієнта» (NNT), дослідження з використання імплантованого кардіовертера-дефібрилятора вигідно відрізняються від деяких фундаментальних фармацевтичних досліджень, що змінили клінічну практику використання інгібіторів АПФ, гіполіпідемічних препаратів та інших кардіологічних засобів, що мають істотний позитивний вплив на здоров’я людини.
У профілактиці раптової серцевої смерті розрізняють первинну і вторинну. Під первинною профілактикою раптової серцевої смерті мають на увазі заходи, що проводяться з метою запобігання раптової серцевої смерті у хворих, у яких, незважаючи на тяжку кардіальну патологію, ніколи не реєструвалися злоякісні шлуночкові тахіаритмії. Під вторинною профілактикою раптової серцевої смерті мають на увазі заходи щодо попередження раптової серцевої смерті у пацієнтів, реанімованих після раптової серцевої смерті або після зареєстрованих епізодів небезпечних для життя порушень ритму.
Крім категорій хворих, раніше визначених для імплантації штучного кардіовертера-дефібрилятора, клінічні дані останніх років свідчать на користь таких показань:
- первинна профілактика для пацієнтів, що перенесли ІМ і мають ФВ <30%;
- первинна профілактика для пацієнтів, що перенесли ІМ і мають ФВ <40% з безсимптомною нестійкою шлуночковою тахікардією;
- первинна профілактика для пацієнтів з ідіопатичною застійною кардіоміопатією, ФВ <30% і синкопальними/пресинкопальними станами або надшлуночковими тахікардіями;
- вторинна профілактика для пацієнтів із задокументованими шлуночковими аритміями — кандидати на пересадку серця;
- вторинна профілактика для пацієнтів з ДКМП, ФВ <30% і стійкими шлуночковими тахікардіями або фібриляцією шлуночків в анамнезі.
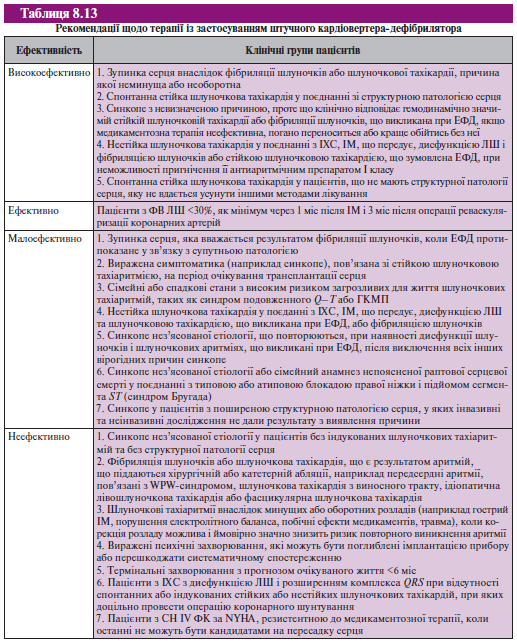
Рекомендації
Результати досліджень переконливо свідчать про те, що імплантація штучного кардіовертера-дефібрилятора повинна розглядатися як метод вибору лікування пацієнтів, що перенесли ІМ і мають низьку ФВ (табл. 8.13).
Дослідження економічної ефективності, проведене рядом незалежних джерел, підтвердило обґрунтованість більш широкого використання штучного кардіовертера-дефібрилятора як першочергової терапії у поєднанні з оптимальним лікуванням антиаритмічними препаратами або без такої.
Рання імплантація штучного кардіовертера-дефібрилятора після ІМ при наявності ехоКГ підтвердження ФВ ЛШ <30% є як економічно ефективною, так і клінічно обґрунтованою, оскільки знижує ризик смерті внаслідок аритмії на 31%.
Удосконалена терапія за допомогою імплантації кардіовертера-дефібрилятора у поєднанні з серцевою ресинхронізаційною терапією поліпшує як функціональний стан пацієнтів з класичними ознаками СН (ФК NYHA II–IV, ФВ ЛШ <30%, ширина зубця QRS ≥120 мс, блокада лівої ніжки пучка Гіса), так і зниження смертності на 43% порівняно зі звичайною медикаментозною терапією. У цьому випадку ми переконливо рекомендуємо використання штучного кардіовертера-дефібрилятора + ресинхронізаційної терапії для пацієнтів, що мають ФВ ЛШ <30%, блокаду лівої ніжки пучка Гіса, широкий QRS ≥120 мс, ФК III або IV за NYHA, включаючи і будь-яке з показань до імплантації штучного кардіовертера-дефібрилятора.
Результати економічного аналізу, проведеного в економічно розвинених країнах, підтверджують обґрунтованість профілактичного використання штучного кардіовертера-дефібрилятора у поєднанні з ресинхронізаційною терапією, оскільки якість життя пацієнтів покращується, а ризик передчасної смерті внаслідок аритмії істотно знижується. На жаль, у нашій країні на сучасному етапі розвитку через досить високу вартість імплантація штучного кардіовертера-дефібрилятора може розглядатися як рекомендація пацієнтові, а не обов’язковий стандарт терапії (табл. 8.14).

Останні досягнення в імплантації штучного кардіовертера-дефібрилятора
Виробники продовжують виділяти значні ресурси на розробку нових удосконалених штучних кардіовертерів-дефібриляторів, які будуть більш ефективними, дешевими та економічно вигідними. За останні роки досвід імплантації штучного кардіовертера-дефібрилятора з’явився і в Україні.
Зменшення розмірів пристрою стало можливим завдяки меншому споживанню енергії, необхідної для дефібриляційного розряду при фібриляції шлуночків. Розміри більшості вироблених сьогодні штучних кардіовертерів-дефібриляторів не перевищують 40 см3, багато які мають розміри 30–35 см3, що поліпшує комфорт пацієнта. Нові пристрої працюють не менше 6 років, перш ніж виникає необхідність у їх заміні, що ще більше підвищує їх економічну ефективність. За останні 3 роки в штучних кардіовертерах-дефібриляторах удосконалена здатність розпізнавати аритмію та диференціювати передсердну і шлуночкову тахіаритмії. Покращання дискримінаційних здатностей призвело до зменшення кількості немотивованих розрядів при надшлуночковій тахікардії.
Використання антитахікардитичної стимуляції у штучних кардіовертерах-дефібриляторах
Антитахікардитична стимуляція — це безбольове лікування, що може проводитися для зняття пароксизму частої шлуночкової тахікардії. Раніше лікарі неохоче використовували антитахікардитичну стимуляцію для зняття пароксизму частої шлуночкової тахікардії, з огляду на ту обставину, що часта шлуночкова тахікардія може швидко переходити у фібриляцію шлуночків. У результаті доводилося частіше застосовувати дефібриляційну терапію (розряд) для зняття пароксизму частої шлуночкової тахікардії. Результати нещодавно проведених досліджень переконливо свідчать на користь більш широкого застосування антитахікардитичної стимуляції, включаючи часті шлуночкові тахікардії, завдяки чому зменшується кількість розрядів, які отримує пацієнт.
Лікування супутніх захворювань
Сучасні штучні кардіовертери-дефібрилятори здатні краще, ніж раніше, розпізнавати та знімати як бради-, так і тахіаритмії. Удосконалена технологія, поруч з полегшеним і більш надійним способом імплантації електродів, дозволила ефективно боротися із загрозливими для життя аритміями за допомогою штучного кардіовертера-дефібрилятора. Двома ключовими нозологіями, для яких були проведені дослідження з використання штучного кардіовертера-дефібрилятора, є фібриляція/тріпотіння передсердь і СН.
Різні властивості штучного кардіовертера-дефібрилятора, такі як антитахікардитична стимуляція, вихідний розряд, що варіює, або останнім часом подвійний незалежний вихід для шлуночкової стимуляції дозволяють проводити більш диференційоване лікування, ніж просто зняття шлуночкової тахікардії або фібриляції шлуночків.
Фібриляція передсердь
Сучасні штучні кардіовертери-дефібрилятори мають широкі можливості для диференціювання та лікування передсердних тахіаритмій. У декількох дослідженнях була описана висока частота передсердних тахіаритмій у пацієнтів зі штучним кардіовертером-дефібрилятором. Двокамерні штучні кардіовертери-дефібрилятори здатні проводити як електротерапію шлуночкових, так і передсердних тахіаритмій. Лікар може запрограмувати пристрій на виявлення та купірування шлуночкових аритмій, використовувати антитахікардитичну стимуляцію для електротерапії передсердних тахіаритмій і селективного купірування передсердної тахіаритмії, стійкої до антитахікардитичної стимуляції. Двокамерний штучний кардіовертер-дефібрилятор може ефективно купірувати близько 60% епізодів передсердних тахіаритмій у режимі антитахікардитичної стимуляції. У пацієнтів, яким потрібна дефібриляція, штучний кардіовертер-дефібрилятор ефективно усуває >30% епізодів фібриляції передсердь.
Серцева недостатність
Пристрої останніх поколінь дозволяють об’єднати терапію штучним кардіовертером-дефібрилятором з серцевою ресинхронізаційною, дозволяючи захистити пацієнта з ризиком загрозливих для життя аритмій, а також поліпшити якість життя та клінічні результати при СН. Загальною метою таких комбінованих пристроїв є сповільнення прогресування СН, скорочення часу перебування в стаціонарі та профілактика раптової серцевої смерті.
ЛІТЕРАТУРА
- Casillas J.M., Gremeaux V., Labrunee M. et al. (2008) Low-frequency electromyostimulation and chronic heart failure. Ann. Readapt Med. Phys.
- Cha Y.M., Oh J., Miyazaki C. et al. (2008) Cardiac Resynchronization Therapy Upregulates Cardiac Autonomic Control. J. Cardiovasc. Electrophysiol.
- D’Avenio G., Canese R., Podo F. et al. (2007) A novel method for measuring the torque on implantable cardiovascular devices in MR static fields. J. Magn. Reson. Imaging, 26(5): 1368–1374.
- Epstein A.E., Dimarco J.P., Ellenbogen K.A. et al. (2008) American College of Cardiology/American Heart Association Task Force on Practice; American Association for Thoracic Surgery; Society of Thoracic Surgeons. ACC/AHA/HRS 2008 guidelines for Device-Based Therapy of Cardiac Rhythm Abnormalities: executive summary. Heart Rhythm., 5(6): 934–955.
- Fawzy M.E., Shoukri M., Osman A. et al. (2008) Impact of atrial fibrillation on immediate and long-term results of mitral balloon valvuloplasty in 531 consecutive patients. J. Heart Valve Dis., 17(2):141–148.
- Ferreira A.M., Adrag Јo P., Cavaco D.M. et al. (2008) Benefit of cardiac resynchronization therapy in atrial fibrillation patients vs. patients in sinus rhythm: the role of atrioventricular junction ablation. Europace.
- 7. Hu K., Scheer F.A., Buijs R.M. et al. (2008) The Circadian Pacemaker Generates Similar Circadian Rhythms in the Fractal Structure of Heart Rate in Humans and Rats. Cardiovasc. Res.
- 8. Kleine P., Grеnefeld G., Dogan S. et al. (2002) Robotically enhanced placement of left ventricular epicardial lectrodes during implantation of a biventricular implantable cardioverter defibrillator system. Pacing Clin. Electrophysiol., 25(6): 989–991.
- Kong W., Huang J., Rollins D.L. et al. (2007) A semi-implantable multichannel telemetry system for continuous electrical, mechanical and hemodynamical recordings in animal cardiac research. Physiol. Meas., 28(3): 249–257.
- Krahn A.D., Champagne J., Healey J.S. et al. (2008) Canadian Heart Rhythm Society Device Advisory Committee. Outcome of the Fidelis implantable cardioverter-defibrillator lead advisory: a report from the Canadian Heart Rhythm Society Device Advisory Committee. Heart Rhythm., 5(5): 639–642.
- Lau E.W. (2008) An ergonomic guide catheter slitting technique designed to avoid lead dislodgement. J. Interv. Card. Electrophysiol.
- Linde C. (2008) Future directions in cardiac resynchronization therapy. Curr Heart Fail. Rep., 5(1): 51–55.
- Morrison L.J., Nichol G., Rea T.D. et al. (2008) ROC Investigators. Rationale, development and implementation of the Resuscitation Outcomes Consortium Epistry-Cardiac Arrest. Resuscitation.
- Mueller P.S., Jenkins S.M., Bramstedt K.A. et al. (2008) Deactivating implanted cardiac devices in terminally ill patients: practices and attitudes. Pacing Clin. Electrophysiol., 31(5): 560–568.
- Mјller S., Hexamer M., Werner J. (2006) A fiber optic sensor system for control of rate-adaptive cardiac pacemakers and implantable defibrillators. Biomed. Tech. (Berl.), 51(5–6): 331–336.
- Narasimhan S. (2008) Electroconvulsive therapy and electrocardiograph changes. N. Z. Med. J., 121(1273): 89–92.
- Pasquali S.K., Marino B.S., Kaltman J.R. et al. (2008) Rhythm and conduction disturbances at midterm follow-up after the ross procedure in infants, children, and young adults. Ann. Thorac. Surg., 85(6): 2072–2078.
- Patel A.M., Heist E.K., Chevalier J. et al. (2008) Effect of presenting rhythm on image integration to direct catheter ablation of atrial fibrillation. J. Interv. Card. Electrophysiol.
- Pellegrini C.N., Yeh R.W., Olgin J. et al. (2008) Episodic ventricular pacing with intact atrioventricular nodal function in a DDDR device: what is the rhythm and how can it be prevented? Heart Rhythm., 5(6): 897–898.
- Philbin D.M., Marieb M.A., Aithal K.H. et al. (1998) Inappropriate shocks delivered by an ICD as a result of sensed potentials from a transcutaneous electronic nerve stimulation unit. Pacing Clin. Electrophysiol., 21(10): 2010–2011.
- Potenza D., Vigna C., Massaro R. et al. Double rhythm in double heart. J. Cardiovasc. Med. (Hagerstown), 9(6): 625–627.
- Saul J.P., Epstein A.E., Silka M.J. et al. (2008) American College of Cardiology; American Heart Association; Heart Rhythm Society; Pediatric and Congenital Electrophysiology Society. Heart Rhythm Society/Pediatric and Congenital Electrophysiology Society Clinical Competency Statement: training pathways for implantation of cardioverter-defibrillators and cardiac resynchronization therapy devices in pediatric and congenital heart patients. Heart Rhythm., 5(6): 926–933.
- Schurr M.O., Schostek S., Ho C.N. et al. (2007) Microtechnologies in medicine: an overview. Minim. Invasive Ther. Allied Technol., 16(2): 76–86.
- Shalaby A., Sharma M.S., Zenati M.A. (2006) Robotic implantation of a multichamber cardiac resynchronization therapy defibrillator. Pacing Clin. Electrophysiol., 29(8): 906–909.
- Skladany M., Vilkomerson D., Lyons D. et al. (1998) New, angle-independent, low cost Doppler system to measure blood flow. Am. J. Surg., 176(2): 179–182.
- Sojak V., Mazic U., Cesen M. et al. (2008) Cardiac resynchronization therapy for the failing Fontan patient. Ann. Thorac. Surg., 85(6): 2136–2138.
- Tang A.S., Ross H., Simpson C.S. et al. (2005) Canadian Heart Rhythm Society; Canadian Cardiovascular Society. Canadian Cardiovascular Society/Canadian Heart Rhythm Society position paper on implantable cardioverter defibrillator use in Canada. Can. J. Cardiol., Suppl. A: 11A–18A.
- Uemura H. (2008) Invited commentary. Ann. Thorac. Surg., 85(6): 2078.
- Wilkoff B.L., Auricchio A., Brugada J. et al. (2008) Heart Rhythm Society; European Heart Rhythm Association; American College of Cardiology; American Heart Association; European ociety of Cardiology; Heart Failure Association of ESC; Heart Failure Society of America. HRS/EHRA expert consensus on the monitoring of cardiovascular implantable electronic devices (CIEDs): description of techniques, indications, personnel, frequency and ethical considerations. Heart Rhythm., 5(6): 907–925.
- Wilkoff B.L., Auricchio A., Brugada J. et al. (2008) Heart Rhythm Society (HRS); European Heart Rhythm Association (EHRA); American College of Cardiology (ACC); American Heart Association (AHA); European Society of Cardiology (ESC); Heart Failure Association of ESC (HFA); Heart Failure Society of America (HFSA). HRS/EHRA Expert Consensus on the Monitoring of Cardiovascular Implantable Electronic Devices (CIEDs): description of techniques, indications, personnel, frequency and ethical considerations: developed in partnership with the Heart Rhythm Society (HRS) and the European Heart Rhythm Association (EHRA); and in collaboration with the American College of Cardiology (ACC), the American Heart Association (AHA), the European Society of Cardiology (ESC), the Heart Failure Association of ESC (HFA), and the Heart Failure Society of America (HFSA). Endorsed by the Heart Rhythm Society, the European Heart Rhythm Association (a registered branch of the ESC), the American College of Cardiology, the American Heart Association. Europace, 10(6): 707–725.
- Witte K.K., Sasson Z., Persaud J.A. et al. (2008) Biventricular pacing: impact on exercise-induced increases in mitral insufficiency in patients with chronic heart failure. Can. J. Cardiol., 24(5): 379–384.
- Xu W., Tse H.F., Chan F.H. et al. (2002) New Bayesian discriminator for detection of atrial tachyarrhythmias. Circulation, 105(12): 1472–1479.