Фібриляція передсердь (ФП) — різновид надшлуночкової тахіаритмії, що характеризується некоординованою електричною активністю передсердь з подальшим погіршенням їх скоротної функції. ФП — найпоширеніше стійке порушення серцевого ритму, частота якого підвищується з віком. На частку ФП доводиться близько ⅓ госпіталізацій з приводу порушень серцевого ритму. ФП часто супроводжується захворюванням серця з наявністю структурних змін. У частини пацієнтів ФП виникає без ознак серцево-судинного захворювання, проте гемодинамічні порушення та тромбоемболічні ускладнення, пов’язані з ФП, зумовлюють високу захворюваність, дворазове підвищення смертності при ФП і потребують значних витрат при лікуванні.
КЛАСИФІКАЦІЯ ФІБРИЛЯЦІЇ ПЕРЕДСЕРДЬ
Епізод ФП, що виник вперше, виділяють незалежно від того, супроводжувався напад будь-якими клінічними симптомами чи був купіруваний самостійно. При цьому слід враховувати, що тривалість нападу ФП може бути невизначеною, а попередні епізоди нерозпізнаними.
Якщо у пацієнта було ≥2 напади, то ФП вважається рецидивною.
При цьому ФП може бути:
- пароксизмальною — якщо аритмія купірується самостійно і епізоди тривають <2 діб;
- персистувальною — якщо аритмія не закінчується самостійно і триває >2 діб.
Якщо епізод ФП триває >48 год, необхідна антикоагулянтна терапія у зв’язку із зростанням ризику виникнення тромбоемболічних ускладнень. До постійної ФП належать випадки існуючої тривалий час ФП (наприклад >1 року), при яких кардіоверсія була неефективною або її проведення вважалось недоцільним (схема 4.1). Вищенаведені терміни належать до епізодів >30 діб, що не пов’язані з оборотною причиною ФП.
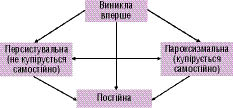
Схема 4.1. Класифікація ФП. ФП, що виникла вперше. Пароксизмальна ФП — напади тривають <2 днів (включно). Персистувальна триває >2 днів. Постійна форма — кардіоверсія неефективна чи не проводилася. Пароксизмальна і персистувальна форми можуть бути рецидивними
Залежно від частоти шлуночкових скорочень виділяють брадисистолічний варіант — частота шлуночкових скорочень <60 уд./хв, а також тахісистолічний варіант — частота шлуночкових скорочень >90 уд./хв.
Вторинна ФП, що виникає під час гострого ІМ, операцій на серці, при перикардиті, міокардиті, гіпертиреозі, ТЕЛА, пневмонії чи іншому гострому захворюванні легень, розглядається окремо. Це пов’язане з тим, що при зникненні етіологічного фактора існує мала ймовірність розвитку повторного епізоду аритмії. У цій ситуації ФП — не основна проблема, і одночасне лікування етіологічного фактора і нападу ФП зазвичай завершується купіруванням аритмії без її рецидивів у подальшому.
Термін «ідіопатична ФП» має багато визначень, але, як правило, використовується при ФП, що виникає у осіб віком молодше 60 років, у яких відсутні клінічні чи ехоКГ-ознаки серцево-легеневого захворювання, включаючи АГ.
Не зазнав істотних змін розділ «Діагностика ФП». Серед обов’язкових методів обстеження пацієнтів з ФП збережено опитування та огляд, ЕКГ і трансторакальна ехоКГ (ТехоКГ). Деяких змін зазнало дослідження крові. У пацієнтів з вперше виявленою ФП, а також при труднощах контролю ЧСС пропонується досліджувати кров не лише для оцінки функції щитовидної залози, а й нирок і печінки. Рентгенографічне обстеження грудної клітки у зв’язку з невисокою його інформативністю перейшло в розряд додаткових обстежень. Серед додаткових обстежень, як і раніше, виділяють використання холтерівського моніторування (чи реєстратора подій) і ЕФД. Для оцінки ефективності контролю ЧСС, крім тесту з фізичним навантаженням, пропонується проведення тесту з 6-хвилинною ходьбою.
КЛІНІЧНА ОЦІНКА ПАЦІЄНТІВ З ФП
При спілкуванні з пацієнтом з підозрою на ФП або її наявністю необхідно уточнити характер захворювання, його класифікацію, визначити причину ФП і наявність асоційованих серцевих і позасерцевих факторів. Уважний збір анамнезу та огляд хворого допоможуть розробити раціональний, конкретний план обстеження, що служитиме ефективною настановою до лікування.
Мінімально необхідні обстеження
1. Анамнез захворювання і дані об’єктивного огляду для визначення:
— наявності та природи симптомів, пов’язаних з ФП;
— клінічної форми ФП (вперше виявлена, пароксизмальна, персистувальна чи постійна);
— початку першого нападу, що супроводжувався симптоматикою, або дати виявлення ФП;
— частоти, тривалості, провокуючих факторів і способів купірування ФП;
— ефективності будь-яких лікарських засобів, призначених раніше;
— наявності захворювань серця чи інших оборотних станів (наприклад гіпертиреозу чи вживання алкогольних напоїв).
2. ЕКГ для визначення:
— ритму (підтвердження ФП);
— частоти шлуночкових скорочень;
— ГЛШ;
— тривалості й морфології зубця Р або наявності хвиль фібриляції;
— передзбуждення шлуночків;
— блокади гілок пучка Гіса;
— ІМ у минулому;
— інших аритмій;
— тривалості інтервалів R–R, Q–T, комплексу QRS в динаміці для оцінки дії антиаритмічних препаратів.
3. ТехоКГ для виявлення:
— захворювань клапанів серця;
— розмірів лівого та правого передсердь;
— розмірів і функції ЛШ;
— максимального тиску в ПШ (при легеневій гіпертензії);
— ГЛШ;
— тромбу в лівому передсерді (низька чутливість методу);
— захворювання перикарда.
4. Аналіз крові для визначення функції щитовидної залози, нирок і печінки:
— при всіх клінічних формах ФП, а також при труднощах контролю частоти шлуночкових скорочень.
Додаткові методи обстеження
(може знадобитися проведення одного або кількох обстежень)
1. Проба з 6-хвилинною ходьбою:
— при сумніві в адекватності контролю частоти шлуночкових скорочень.
2. Проби з фізичним навантаженням:
— при сумніві в адекватності контролю шлуночкового ритму (при постійній ФП);
— для відтворення ФП, що провокується фізичним навантаженням;
— для виключення наявності ішемії міокарда перед початком лікування антиаритмічними препаратами групи IС за класифікацією V. Williams.
3. Холтерівське моніторування чи реєстрація подій:
— при сумніві у визначенні форми ФП;
— як спосіб оцінки контролю шлуночкового ритму.
4. Черезстравохідна ехоКГ (ЧСехоКГ):
— для виявлення тромбу в лівому передсерді (вушку лівого передсердя);
— при з’ясуванні можливості кардіоверсії.
5. ЕФД:
— для уточнення механізму розвитку тахікардії з широкими комплексами QRS;
— для виявлення аритмії, що призводить до ФП, наприклад тріпотіння передсердь або пароксизмальної надшлуночкової тахікардії;
— для визначення ділянок абляції чи блокади AV-провідності.
6. Рентгенографія грудної клітки:
— для оцінки стану легеневої паренхіми та легеневого судинного русла.
Інструментальні обстеження
Для діагностики ФП необхідна наявність ознак ФП хоча б в одному відведенні ЕКГ під час нападу. Якщо напади відбуваються часто, можна застосувати 24-годинне холтерівське моніторування. На рентгенограмі грудної клітки можна виявити збільшення камер серця і ознаки СН, проте найбільшу цінність це обстеження становить для виявлення патології легень і оцінки стану легеневих судин. Двомірну ТехоКГ варто призначати всім пацієнтам з ФП при початковому обстеженні для визначення розмірів лівого передсердя і ЛШ, товщини стінки і функції ЛШ, а також для виключення безсимптомного ураження клапанів, захворювання перикарда, ГКМП. Оцінка систолічної та діастолічної функції ЛШ допомагає прийняти рішення щодо необхідності антикоагулянтної і антиагрегантної терапії. Тромб слід шукати у лівому передсерді, проте його рідко можна виявити без ЧСехоКГ.
Додаткові інструментальні методи обстеження
1. Холтерівське моніторування і визначення толерантності до фізичного навантаження. Крім встановлення діагнозу ФП, холтерівське моніторування і тредміл-тест сприяють кращій оцінці адекватності контролю, ніж ЕКГ у спокої. Тест з функціональним навантаженням слід призначати при підозрі на ішемію міокарда чи плануванні тактики лікування із застосуванням антиаритмічних препаратів групи ІС.
2. ЧСехоКГ — найбільш чутлива й специфічна, коли йдеться про джерела та можливі механізми серцевої емболії, і використовується для стратифікації хворих з ФП за ризиком розвитку інсульту, а також для підготовки до кардіоверсії.
3. ЕФД у хворих з пароксизмальною формою ФП допомагає визначити механізм розвитку ФП, що важливо при намірі застосувати катетерну абляцію. Причиною ФП може бути фокус з швидкою імпульсацією, що часто міститься в ділянці легеневих вен, надшлуночкової тахікардії з правильним ритмом, АV-вузлове re-entry або тріпотіння передсердь, що переходить у ФП. ЕФД використовують при підозрі на дисфункцію синусного вузла, а також для визначення механізму утворення широких комплексів QRS при ФП, особливо при швидкому шлуночковому ритмі. Для контролю ритму шляхом катетерної абляції або зміни АV-провідності, а також для відбору хворих з метою профілактичної імплантації штучного водія ритму необхідне ЕФД.
ТАКТИКА ВЕДЕННЯ ПАЦІЄНТІВ З ФП
На початковому етапі ведення пацієнтів з ФП включає переважно застосування тактики контролю частоти шлуночкових скорочень і синусового ритму. При тактиці контролю частоти шлуночкових скорочень шлуночковий ритм контролюють без наміру відновити та підтримувати синусовий ритм. При тактиці контролю синусового ритму намагаються його відновити та/чи підтримувати. При застосуванні останньої тактики необхідно приділяти увагу і контролю шлуночкового ритму. Якщо спочатку вибрана тактика виявилася неефективною у зв’язку з особливостями перебігу аритмії у цього пацієнта, застосовують альтернативну тактику. Незалежно від застосування тактики (контролю частоти шлуночкових скорочень або синусового ритму) необхідно приділяти увагу антитромботичній терапії для профілактики тромбоемболії.
Алгоритми ведення пацієнтів з ФП
Ведення хворих з ФП потребує від лікаря знання її форми (вперше виявлена, пароксизмальна, персистувальна чи постійна), факторів, що провокують її появу, засобів, спрямованих на відновлення та підтримку синусового ритму, а також антитромботичної терапії. Алгоритми застосування лікарських засобів складені шляхом консенсусу експертів через недостатні дані рандомізованих клінічних досліджень застосування антиаритмічних препаратів для лікування пацієнтів з ФП. Алгоритми переглядатимуться в міру надходження нових даних.
Медикаментозна терапія пацієнтів з різними формами ФП (вперше виявленої, пароксизмальної, персистувальної та постійної) наведена на схемах 4.2, 4.3 і 4.4.
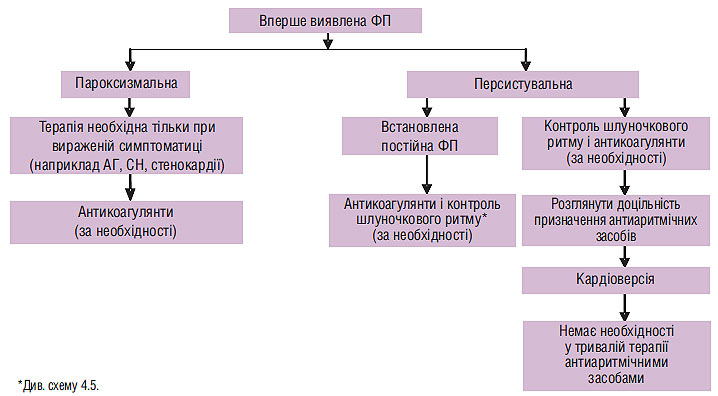
Схема 4.2. Медикаментозна терапія пацієнтів із вперше виявленою ФП
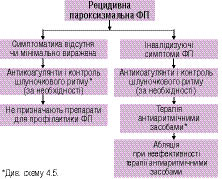
Схема 4.3. Медикаментозна терапія пацієнтів з пароксизмальною ФП
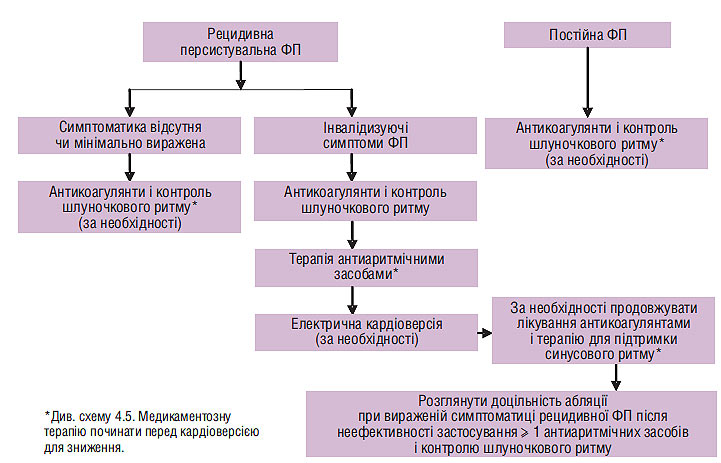
Схема 4.4. Медикаментозна терапія пацієнтів з персистувальною і постійною ФП
На схемах 4.3 і 4.4 підсумовані сучасні погляди щодо тактики лікування хворих з рецидивною пароксизмальною і персистувальною ФП. Очевидно, що порівняно з рекомендаціями 2001 р. вони доповнені катетерною абляцією: перш за все ізоляцією легеневих вен і радіочастотною модифікацією операції «лабіринт».
Досить важливі зміни з’явилися у визначенні тактики збереження синусового ритму у пацієнтів з пароксизмальною і персистувальною ФП (схема 4.5).
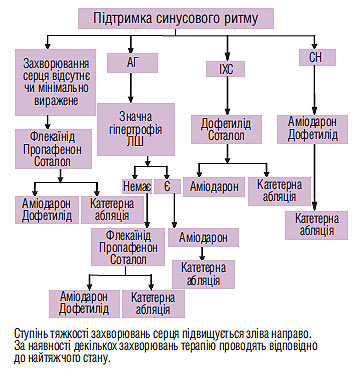
Схема 4.5. Медикаментозна терапія антиаритмічними препаратами для підтримки синусового ритму у пацієнтів з пароксизмальною і персистувальною ФП
Відзначимо відразу, що істотних змін у першій лінії антиаритмічної терапії не відбулося. Для хворих без структурних змін серця чи з мінімальними структурними змінами із зареєстрованих в Україні препаратів це, як і раніше, пропафенон і соталол (із незареєстрованих — флекаїнід). Ті ж препарати є першою лінією терапії пацієнтів з АГ без вираженої ГЛШ. Проте слід відзначити, що в рекомендаціях 2001 р. соталол для лікування цих хворих відносили до другої лінії терапії. Як і колись, для пацієнтів з АГ та істотною ГЛШ, а також для хворих з ХСН препаратом вибору є аміодарон, а для хворих з ІХС — соталол. А от з другою лінією відбулися радикальні зміни, зумовлені тим, що своє гідне місце зайняли катетерні методи лікування. Тепер для пацієнтів з мінімальними структурними змінами серця чи їх відсутністю, пацієнтів з АГ і невираженою ГЛШ, осіб з ІХС друга лінія становить альтернативу між призначенням аміодарону і катетерною абляцією. Для хворих із ХСН, а також з АГ та істотною ГЛШ (тобто для тих, у кого аміодарон — перша лінія) друга лінія — це катетерна абляція. Таким чином третя лінія лікування для збереження синусового ритму припинила своє існування; разом з нею ми прощаємося з рекомендованими раніше препаратами 1А підкласу за класифікацією V. Williams хінідином, прокаїнамідом і дизопірамідом. За рамками обговорення ми залишили наявні в рекомендаціях, але не зареєстровані в Україні препарати дофетилід і флекаїнід. Слід звернути увагу на таку обставину: в рекомендаціях 2001 р., в частині щодо збереження синусового ритму у хворих з АГ, виділені групи пацієнтів з ГЛШ у межах ≥1,4 см. У нових рекомендаціях виділяють відповідно менш виражену та виражену ГЛШ.
Невеликі зміни стосуються фармакологічної кардіоверсії при ФП (табл. 4.1).
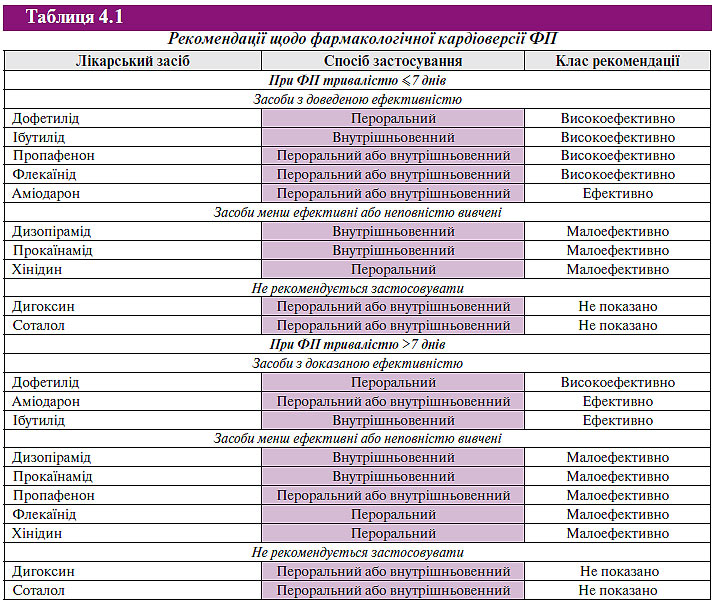
Слід звернути увагу на такі відмінності. Так, для купірування ФП тривалістю до 7 днів найактуальнішим для нас залишається застосування пропафенону (інших препаратів з типом рекомендацій I ми просто не маємо), меншою мірою — аміодарону. Хінідин, дуже популярний раніше, «розжалуваний» у менш ефективні чи менш вивчені препарати і склав у цьому розділі компанію прокаїнаміду, а також дизопіраміду. Соталол з дигоксином включені в новий порівняно з 2001 р. розділ: препарати, не рекомендовані до застосування.
У цей же спосіб змінена таблиця, що стосується відновлення синусового ритму при ФП тривалістю >7 днів. І тут у новий розділ — препарати, які не рекомендується застосовувати, — включені соталол і дигоксин. Препаратом з доведеною ефективністю (тобто препаратом вибору) із числа зареєстрованих в Україні є аміодарон.
А от пропафенон і хінідин виявилися тепер серед менш ефективних або менш вивчених препаратів, склавши в цьому розділі компанію прокаїнаміду, що займав там місце і раніше, а також дизопіаміду, якого в списку препаратів не було.
Рекомендовані дози лікарських засобів з доведеною ефективністю при фармакологічній кардіоверсії у пацієнтів з ФП наведені в табл. 4.2.
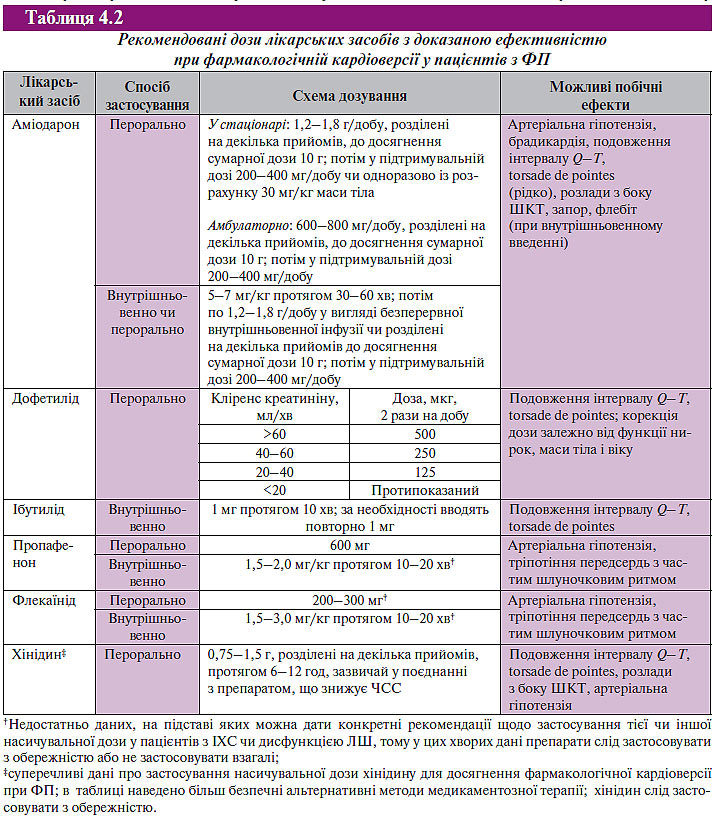
Цікаво, що з метою відновлення синусового ритму в 2001 р. рекомендувалося застосовувати одноразово внутрішньо 450–600 мг пропафенону, а в 2006 р. лише одну дозу — 600 мг.
Перед електричною кардіоверсією для кожного пацієнта слід розглянути можливість призначення медикаментозної терапії для профілактики рецидивів ФП. Медикаментозна терапія перед електричною кардіоверсією у пацієнтів з персистувальною ФП наведена в табл. 4.3.
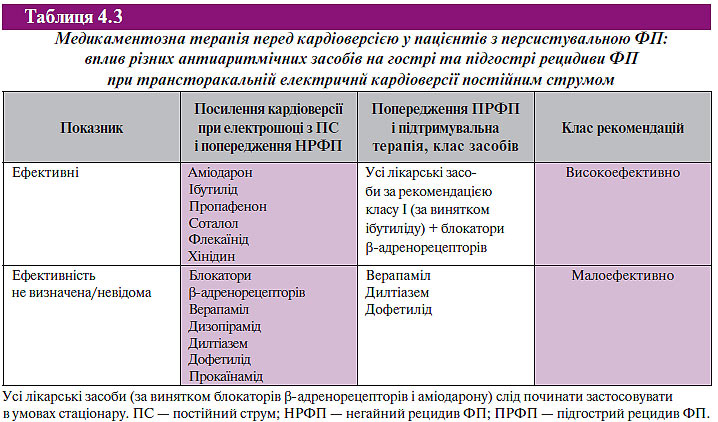
Основна мета застосування антиаритмічних засобів у поєднанні з електричною кардіоверсією — підвищення ймовірності успіху останньої та запобігання раннього рецидиву ФП. Ризик цієї медикаментозної терапії включає можливість індукції шлуночкової аритмії.
У табл. 4.4 наведено типові дози антиаритмічних препаратів, що застосовуються для підтримки синусового ритму у пацієнтів з ФП.
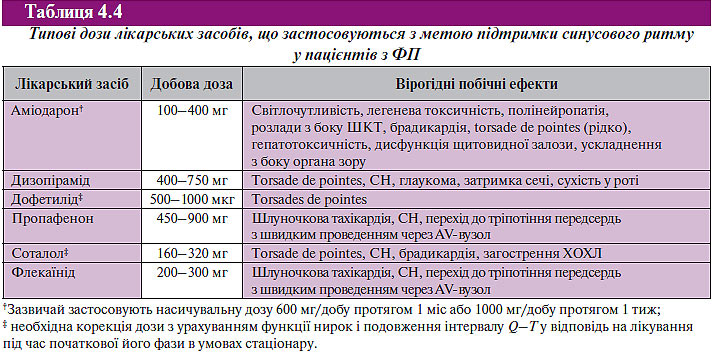
Контроль частоти шлуночкових скорочень
Частота шлуночкових скорочень вважається контрольованою, коли варіює в межах 60–80 уд./хв у стані спокою та 90–120 уд./хв при помірному фізичному навантаженні.
Фармакологічні препарати для контролю частоти шлуночкових скорочень в ургентній ситуації та при постійній ФП наведено в табл. 4.5.
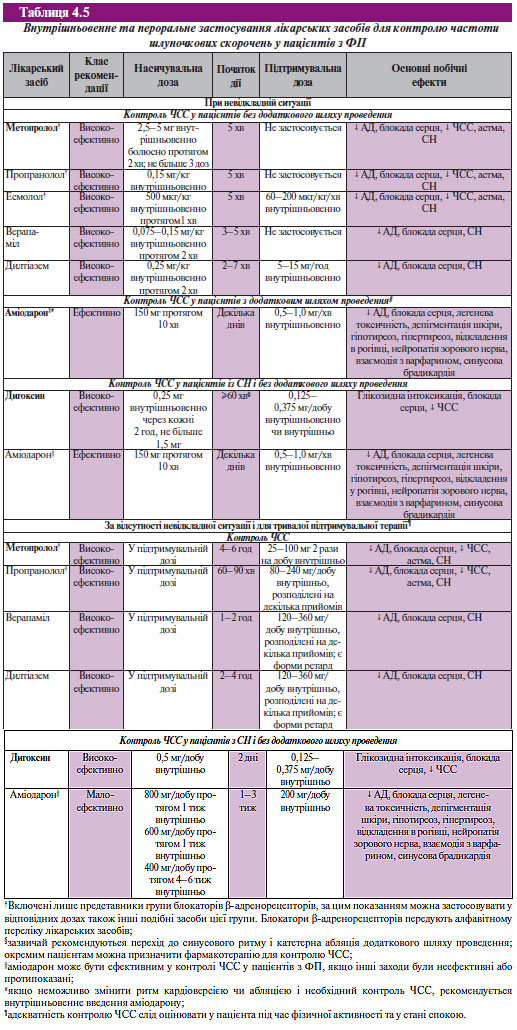
Для регуляції шлуночкового ритму при ФП можна використовувати їх електричну стимуляцію з частотою, що наближається до середньої частоти шлуночкових скорочень при спонтанній АV-провідності. Електричну стимуляцію шлуночків використовують для зниження ступеня нерегулярності шлуночкового ритму. Її можна застосовувати у пацієнтів з вираженою варіабельністю шлуночкового ритму, а також у хворих з брадикардією у спокої при лікуванні препаратами для контролю підвищення частоти шлуночкових скорочень при фізичному навантаженні.
Абляція АV-вузла та імплантація постійного штучного водія ритму — високоефективні способи лікування деяких пацієнтів з ФП. Найбільшу користь від такого лікування одержують хворі, у яких виражена симптоматика з’являється на фоні підвищення частоти шлуночкових скорочень, що не піддається адекватному медикаментозному контролю. Незважаючи на те що переваги абляції АV-вузла безсумнівні, серед обмежень цього методу слід вказати на постійну необхідність антикоагулянтної терапії, втрату АV-синхронності й довічну залежність від штучного водія ритму.
Досить цікавими є зміни щодо антитромботичної терапії. Рекомендації 2006 р. передбачають інший принцип антитромботичної терапії. У бальній шкалі оцінки ступеня ризику інсульту CHADS2 (Cardiac Failure, Hypertension, Ade, Diabetes, Stroke [×2]) інтегровані елементи декількох систем визначення ризику інсульту. Показник заснований на бальній системі, відповідно до якої 2 бали дають за наявності перенесеного інсульту або транзиторної ішемічної атаки та по 1 балу — за наявності кожного з наступних критеріїв ризику: вік >75 років, АГ в анамнезі, цукровий діабет, СН, що розвинулася недавно. Усі фактори ризику розподілені на три групи. Фактори більш низького ризику або менш підтверджені: жіноча стать, вік 65–74 роки, ІХС і тиреотоксикоз. Фактори помірного ризику: вік 75 років та старше, АГ, СН, ФВ ≤35%, цукровий діабет. Фактори високого ризику: попередні інсульти, транзиторна ішемічна атака чи емболія, мітральний стеноз, протези клапанів серця.
У пацієнтів з неклапанною формою ФП перенесений інсульт або транзиторна ішемічна атака — найбільш сильні незалежні предиктори інсульту. За відсутності протипоказань для всіх пацієнтів з перенесеним інсультом або транзиторною ішемічною атакою необхідна антикоагулянтна терапія. Похилий вік теж є незалежним предиктором інсульту, але у пацієнтів цієї категорії при застосуванні антикоагулянтів підвищений і ризик кровотечі. У зв’язку з цим ретельна оцінка стану пацієнтів похилого віку вкрай важлива для ефективної профілактики інсульту.
У табл. 4.6 наведені рекомендації щодо застосування антитромботичних засобів у пацієнтів з ФП.
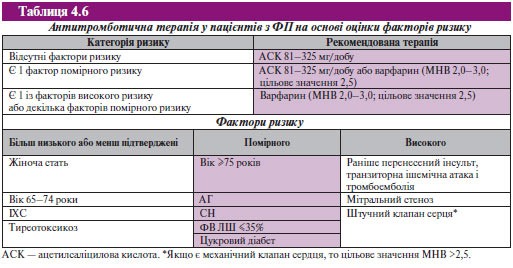
Незалежно від форми ФП за відсутності факторів ризику необхідно призначати ацетилсаліцилову кислоту в добовій дозі 81–325 мг, за наявності одного помірного ризик-фактора — ацетилсаліцилову кислоту в добовій дозі 81–325 мг або варфарин (МНВ 2,0–3,0; цільове МНВ 2,5), за наявності будь-якого високого ризик-фактора — варфарин (МНВ 2,0–3,0; цільове МНВ 2,5). За наявності механічного протезу клапана цільове МНВ >2,5. Слід звернути увагу на більш ліберальний підхід до вибору дози ацетилсаліцилової кислоти: 81–325 мг, а не 325 мг, як було раніше.
У пацієнтів з ФП невизначеної тривалості або з ФП, що триває >48 год, рекомендується проведення антикоагулянтної терапії протягом 3 тиж до кардіоверсії та 4 тиж після неї. Незважаючи на те що у пацієнтів з меншою тривалістю ФП зареєстровані випадки утворення тромбу в лівому передсерді та системної тромбоемболії, у цих хворих недостатньо точно встановлена необхідність проведення антикоагулянтної терапії. У випадках коли ФП, що гостро виникла, призводить до нестабільності гемодинаміки, що проявляється у формі стенокардії, ІМ, шоку чи набряку легень, не варто відкладати негайне проведення кардіоверсії у зв’язку з лікуванням антикоагулянтними засобами. Проте перед проведенням кардіоверсії за допомогою протишокової терапії постійним струмом або внутрішньовенним введенням антиаритмічних засобів необхідно почати внутрішньовенне введення нефракціонованого гепарину чи підшкірне введення низькомолекулярного гепарину.
Ще однією зміною порівняно з рекомендаціями 2001 р. слід вважати появу розділу «Первинна профілактика ФП». Поруч із передсердною і передсердно-шлуночковою синхронізованою стимуляцією, що використовується для профілактики ФП у хворих з брадикардією, з’явився ще один напрямок первинної профілактики. З посиланням на результати ретроспективного аналізу цілого ряду багатоцентрових досліджень йдеться про доцільність застосування інгібіторів АПФ і антагоністів рецепторів ангіотензину II для первинної профілактики ФП у хворих із структурними змінами серця (АГ, СН, цукровий діабет, ІХС, ІМ в анамнезі). Менш переконливі докази доцільності призначення з цією метою статинів, а також дієтотерапії.
Таким чином, найбільш значимими є такі зміни, важливі для лікування пацієнтів з ФП: препаратом вибору для відновлення синусового ритму при ФП тривалістю до 7 діб є пропафенон, >7 діб — аміодарон; для збереження синусового ритму препаратами вибору є аміодарон, пропафенон і соталол, а препарати 1А підкласу втрачають своє значення.
Враховуючи те, що 1 таблетка аміодарону містить річну норму йоду, доцільно, особливо при сформованій епідеміологічній обстановці в Україні, суворо контролювати призначення цього препарату, структурні зміни та функцію щитовидної залози. Слід контролювати рівень гормонів щитовидної залози до призначення аміодарону, на фоні прийому препарату кожні 3 міс протягом 1-го року, а далі кожні 6 міс з обстеженням структури щитовидної залози з моменту початку лікування.
Одним з основних методів збереження синусового ритму стає катетерна радіочастотна абляція. Виділяють три групи ризик-факторів тромбоемболічних ускладнень; відповідно до їх наявності й поєднання призначається антитромботична терапія, вибір якої стає більш обережним. Це особливо важливо в нашій країні, де прихильність терапії, а також можливість контролювати МНВ залишають бажати кращого. Нарешті у нас з’являється можливість первинної профілактики ФП, в основному за допомогою інгібіторів АПФ і рецепторів ангіотензину.
ПРОФІЛАКТИКА ТРОМБОЕМБОЛІЧНИХ УСКЛАДНЕНЬ У ХВОРИХ З ФП
ФП — найпоширеніше у клінічній практиці порушення ритму серця, що за даними Фремінгемського дослідження становить у загальній популяції 0,4% і значною мірою залежить від віку. Так, ФП відзначають у 0,5% населення віком 40–50 років, у 1% — 50–60 років, у 4% — 60–70 років, у 9% — 70–80 років, у 15%— старше 80 років. Слід також зазначити, що ФП у чоловіків розвивається в 1,5–3,4 раза частіше, ніж у жінок. За останні десятиріччя поширеність цієї форми аритмії значно зросла і досягла 1–1,5% у загальній популяції. Частота госпіталізацій з приводу ФП становить не менше 40% всієї кількості госпіталізацій з приводу порушень серцевого ритму. За даними 5-річного дослідження SPRINT, госпітальна смертність пацієнтів з ФП була в 1,6 раза вища, а 1- та 5-річна смертність при пароксизмальній формі ФП у 2,4 і 1,7 раза вища, ніж у хворих без неї.
Клінічне значення ФП полягає не лише в погіршенні гемодинамічних показників роботи серця — насамперед небезпека пов’язана з можливістю розвитку тромбоемболічних ускладнень, перш за все ішемічних інсультів, частота яких також з віком підвищується від 1,5% в 50–59 років до 23,5% на рік у 80–89 років. У пацієнтів >80 років не менше 35% ішемічних інсультів зумовлені ФП. При ревматичному ураженні серця та наявності ФП річна частота розвитку інсульту становить 17%, за його відсутності — 4–5%. Разом з тим при хронічній формі ФП у осіб без ураження клапанів серця ризик інсульту та емболії у 6 разів (5,6–7,1) вищий, ніж у хворих із синусовим ритмом. Таким чином встановлена висока частота кардіогенної емболії судин мозку в загальній структурі порушень кровообігу головного мозку. За даними J.L. Halperin і співавторів, 15–20% випадків розвитку ішемічного інсульту зумовлені наявністю у хворих ФП. Отже, приблизно 1 із 6 усіх ішемічних інсультів припадає на долю кардіогенних тромбоемболій у пацієнтів з ФП, а головним джерелом емболів є вушко лівого передсердя, де локалізується до 90% всіх внутрішньопередсердних тромбів. Третина пацієнтів з ФП переносять інсульт, і до цієї кількості не входять хворі з так званими німими інфарктами мозку, які визначаються при КТ за даними різних авторів від 14,7 до 37% випадків. У пацієнтів з інсультом або транзиторною ішемічною атакою в анамнезі частота повторного інсульту становить 10–12% на рік, навіть у разі прийому ацетилсаліцилової кислоти.
Безсумнівно, причиною інсульту у пацієнтів з ФП може бути не лише кардіогенна тромбоемболія: до 25–30% ішемічних інсультів при ФП мають атеротромботичну природу, пов’язану з атеросклерозом судин головного мозку чи атероматозом дуги аорти. Приблизно у половини всіх хворих з ФП відзначають АГ, значення якої в патогенезі цереброваскулярних захворювань надзвичайно велике, а близько 12% пацієнтів мають атеросклеротичне ураження брахіоцефальних артерій. За результатами епідеміологічних досліджень встановлено, що АГ підвищує ризик кардіоемболічного інсульту при ФП, але, з іншого боку, АГ тісно пов’язана з ризиком ішемічного інсульту атеротромботичної природи. У пацієнтів з інсультом АГ виявляють у 91% випадків у групі з ФП і у 78% хворих із синусовим ритмом. Крім того, вищезазначена залежність частоти інсульту при ФП від віку зумовлена його зв’язком з багатьма факторами. У людей похилого віку збільшуються розміри лівого передсердя, знижуються скоротність та швидкість кровотоку в його вушку, частіше спостерігається феномен спонтанного ехоконтрастування. Також відомо, що вік — фактор ризику атеросклерозу, в тому числі й розвитку атером дуги аорти, які можуть бути причиною інсульту незалежно від ФП. Відносно висока частота синусового ритму під час виникнення інсульту у пацієнтів, що була визначена в найбільшому дослідженні AFFIRM, дозволила деяким авторам зробити припущення про некардіогенне джерело церебральних інфарктів у цієї групи хворих, хоча, безумовно, неможливо повністю виключити висловлене іншими авторами припущення про асимптоматичні епізоди ФП.
Результати досліджень щодо порівняння двох підходів до лікування пацієнтів з ФП — контроль ритму серця та контроль ЧСС, проведених у різних країнах і континентах (AFFIRM, PIAF, RACE, STAF), продемонстрували, що частота ішемічних інсультів за статистичними даними не відрізнялася в обох групах хворих. Подібні результати одержані в дослідженнях SPAF І-ІІІ: щорічна частота ішемічних інсультів у хворих з рецидивною і постійною формою ФП майже однакова (3,2 і 3,3% відповідно).
Частота інсульту у хворих з ФП пов’язана з наявністю супутніх серцево-судинних захворювань. Нижча при ізольованій ФП, під якою розуміють відсутність будь-яких інших клінічних ознак первинного ураження серця, і становить всього 0,5% на рік, а за даними дослідження в окрузі Олмстед (штат Міннесота) — 1,3%. Захворювання серця — один із провідних факторів ризику виникнення інсульту, що відіграють важливу роль у перебігу та результаті гострого порушення мозкового кровообігу. На думку деяких вчених, сам факт ФП не має прогностичного значення для оцінки ризику розвитку ускладнень, тому що не є основним чинником, а лише засвідчує наявність супутньої патології, що веде до різкого підвищення протикоагулянтної активності крові та виникнення інсульту. Тому для запобігання тромбоемболічних ускладнень необхідно враховувати всі фактори ризику у кожного хворого з ФП і виходячи з цього приймати рішення щодо проведення антитромботичної терапії.
Стратифікація ризику тромбоемболічних ускладнень
Щорічний ризик виникнення інсульту у пацієнтів з ФП 3–8%, що пов’язане з факторами ризику. До найпоширеніших факторів ризику при неклапанній ФП відносять вік старше 65 років, цукровий діабет, АГ (САТ >160 мм рт. ст.), ІХС, ХСН з ФВ ЛШ <40%, перенесені раніше інсульт або транзиторні ішемічні атаки, наявність тромбу в лівому передсерді чи вушку лівого передсердя при ТехоКГ або ЧСехоКГ. Інші автори до факторів ризику також відносять жіночу стать, зловживання алкоголем, замісну гормонотерапію та збільшення розмірів лівого передсердя до ≥4,5 см.
Відносний ризик ішемічного інсульту, пов’язаний з окремими клінічними станами, за даними об’єднаного аналізу учасників 5 рандомізованих досліджень, що мали неклапанну ФП і не одержували антитромботичної терапії, такий: перенесений інсульт або транзиторна ішемічна атака (відносний ризик 2,5), цукровий діабет (1,7), похилий вік (1,4), АГ в анамнезі (1,6), застійна СН (1,4).
Раніше згадувалося, що при ревматичному ураженні серця і ФП відсоток розвитку інсультів надзвичайно високий і становить 17% на рік. Причому при мітральному стенозі емболію відзначають у 1,5 раза частіше, ніж при недостатності мітрального клапана. Можливо, це пов’язане з тим, що недостатність сприяє виникненню турбулентного регургітаційного потоку крові, що зменшує стаз крові у лівому передсерді.
Визначення ризику інсульту в окремих пацієнтів з ФП — основний чинник, що впливає на рішення про початок проведення індивідуальної антикоагулянтної терапії. Відповідно до рекомендацій АСС/AHA/ESC 2006 р. пацієнтів з ФП стратифікували на групи низького, середнього та високого ризику розвитку тромбоемболічних ускладнень (див. табл. 4.6).
Граничний ризик інсульту, при якому слід призначати антикоагулянтну терапію, залишається невизначеним. Хворі з низьким ризиком, які приймають ацетилсаліцилову кислоту, мало виграють від переходу на альтернативний режим антикоагулянтної терапії, але у них збільшується кількість геморагічних ускладнень. Для попередження одного інсульту на рік необхідне проведення антикоагулянтної терапії у >100 пацієнтів. Кількість хворих з ФП груп високого ризику, яким необхідне проведення антикоагулянтної терапії для попередження одного інсульту на рік, при прийомі ацетилсаліцилової кислоти становить 25%, що підтверджує ефективність використання антикоагулянтів у відкоригованій дозі. Залишається невирішеним питання щодо профілактичного призначення антикоагулянтів хворим із середнім ризиком інсульту.
Який же ризик інсульту у хворих з тріпотінням передсердь? У недалекому минулому тріпотіння передсердь вважалося «доброякісною» аритмією щодо розвитку тромбоемболічних ускладнень, проте за даними нещодавно проведених досліджень відзначено, що тріпотіння передсердь зумовлює такий же ризик тромбоемболічних ускладнень, як і ФП. У нерандомізованих дослідженнях ризик тромбоемболічних ускладнень був у межах 1,7–7%. У ретроспективному дослідженні за участю 100 хворих з тріпотінням передсердь, які не одержували антикоагулянтної терапії, тромбоемболічні ускладнення виникли у 6 випадках. У роботі D. Wood повідомляється про 1–6% ризику тромбоемболічних ускладнень у хворих з хронічним тріпотінням передсердь, що, на його думку, приблизно в 3 рази менше, ніж у хворих з ФП. Епідеміологічні й нерандомізовані дослідження, проведені протягом останніх 10 років у групах хворих з тріпотінням передсердь, дозволяють зробити висновок, що тріпотіння передсердь пов’язане з помірним ризиком тромбоемболічних ускладнень, що перевищують такий у порівняльній популяції пацієнтів з більш низьким синусовим ритмом, ніж у хворих з ФП.
Серед пацієнтів високого ризику з ФП предикторами тромбоемболічних ускладнень є такі ехокардіографічні особливості: порушення систолічної функції ЛШ при ехоКГ; спонтанне ехоконтрастування чи зниження швидкості кровотоку у вушці лівого передсердя, складні атероматозні бляшки у грудній аорті, виявлені за допомогою ЧСехоКГ. Інші ознаки, такі як діаметр ЛШ і фіброкальцифікуючі ендокардіальні зміни, варіабельно асоціюються з тромбоемболіями і можуть взаємодіяти з іншими факторами. Чи вказує відсутність цих змін на групу пацієнтів низького ризику, які можуть уникнути прийому антикоагулянтів, не встановлено, і це поки не знайшло відображення у схемах ризику-стратифікації.
АНТИТРОМБОТИЧНА ТЕРАПІЯ ДЛЯ ПРОФІЛАКТИКИ ТРОМБОЕМБОЛІЧНИХ УСКЛАДНЕНЬ
З метою тестування різних типів і комбінацій антитромботичної терапії для профілактики інсульту при ФП проведено 24 рандомізовані дослідження за участю 20 012 пацієнтів з неклапанною ФП, що змінили тактику антитромботичної терапії у мільйонів пацієнтів з ФП.
Ефективність антикоагулянтної терапії реr os при первинній профілактиці тромбоемболічних ускладнень оцінювалася в п’яти проспективних плацебо-контрольованих дослідженнях (AFASAK, SPAF, BAATAF, CAFA, SPINAF). Загалом за даними метааналізу тривале застосування непрямих антикоагулянтів у хворих з ФП неревматичного генезу дозволяє знизити ризик інсульту і периферичних тромбоемболічних ускладнень порівняно з використанням плацебо з 4,52 до 1,4%, або на 69% (р<0,001). Це рівноцінно попередженню 31-го випадку цих ускладнень на кожні 1000 хворих, що лікувалися протягом 1 року. При виключенні пацієнтів, які не одержували антикоагулянтів до моменту розвитку інсульту, профілактична ефективність цих засобів реr os перевищила 80%. Прийом варфарину дозволив знизити загальну смертність на 26%. Тривалість спостереження в цих дослідженнях становила 1–2 роки, найбільший період — 2,2 року, в той час як у клінічній практиці необхідність проведення антикоагулянтної терапії у хворих з ФП зазвичай значно більша.
Антикоагулянтна терапія ще більш ефективна щодо вторинної профілактики інсульту у хворих з ФП, які перенесли транзиторну ішемічну атаку або малий інсульт. Як показали результати багатоцентрового дослідження EAFT за участю 1007 таких пацієнтів, прийом варфарину сприяв зниженню частоти інсульту до 4% на рік порівняно з 12% у групі хворих, які одержували плацебо, тобто на 66% (p<0,001). Це рівнозначно попередженню приблизно 90 таких судинних катастроф при лікуванні 1000 хворих протягом 1 року.
Хоча на сьогодні після проведення контрольованих досліджень ефективність профілактичної терапії непрямими антикоагулянтами при ФП не викликає сумнівів, її зворотним боком є підвищення ризику виникнення тяжких кровотеч — внутрішньочерепних і/або при яких виникає необхідність у переливанні крові. За даними дослідження CAFA, їх частота становила 2,5% на рік (при прийомі плацебо — 0,5%).
Ризик виникнення кровотеч зростає з підвищенням ступеня гіпокоагуляції та тривалості антикоагулянтної терапії, що особливо виражено у хворих похилого та старечого віку. Цільовий рівень визначається досягненням рівноваги між профілактикою ішемічного інсульту і недопущенням геморагічних ускладнень. Максимальний захист від ішемічного інсульту при ФП досягається при значенні МНВ 2,0–3,0. Для первинної профілактики у більшості хворих з ФП віком до 75 років і для вторинної профілактики необхідно прагнути до досягнення рівня МНВ 2,5 (у межах 2,0–3,0). Цільове МНВ 2,0 (1,6–2,5) рекомендоване для первинної профілактики у пацієнтів віком старше 75 років з високим ризиком виникнення кровотеч, яким не протипоказана антикоагулянтна терапія, і хворим із середнім ступенем ризику тромбоемболії, для яких гіпокоагуляція з МНВ 2,0–3,0 небезпечна. У клінічних дослідженнях частіше виявляли МНВ нижче цільових значень. У зв’язку з ускладненнями антикоагулянтної терапії виникло питання про можливість заміни непрямих антикоагулянтів ацетилсаліциловою кислотою, а також про застосування антикоагулянтів у низьких дозах.
Порівняння ефективності антитромбоцитарних препаратів (як досліджуваний препарат у 90% випадків застосовували ацетилсаліцилову кислоту) із плацебо-контролем проводили у 6 дослідженнях (AFASAK, SPAF-І, ЕAFT, ESPS, LASAF, UK-TIA). Метааналіз усіх досліджень показав, що прийом ацетилсаліцилової кислоти вірогідно знижує ризик розвитку інсульту на 22%. При цьому відзначено, що ацетилсаліцилова кислота більшою мірою попереджає розвиток інсультів, які не призводять до інвалідізації (як у дослідженні SPAF-I). Для цієї групи інсультів зниження ризику становило 62%, в той час як для інсультів, що супроводжуються інвалідізацією, зниження ризику становило 17% і було недостовірним. Таким чином, чим вищий ризик розвитку інсульту, що призводить до інвалідизації, тим менш ефективна для його профілактики ацетилсаліцилова кислота. Частота розвитку внутрішньочерепних кровотеч на фоні застосування ацетилсаліцилової кислоти і плацебо становила 0,2%, а прийом ацетилсаліцилової кислоти впливав на загальну смертність (зниження ризику — 16%).
Для визначення місця ацетилсаліцилової кислоти у профілактиці тромбоемболічних ускладнень при ФП вирішальне значення мають дані прямих порівняльних досліджень ефективності ацетилсаліцилової кислоти і непрямих антикоагулянтів (AFASAK, SPAF-II, EAFT, AFASAK-II, PATAF). Як свідчать результати дослідження SPAF-IІ за участю 715 хворих, серед пацієнтів віком молодше 75 років частота ішемічного інсульту при лікуванні ацетилсаліциловою кислотою (325 мг/добу) і варфарином в повній дозі була практично однаковою — 1,9 і 1,3% на рік відповідно. Але у хворих старшого віку відзначали посилення тенденції (p<0,05) до більш вираженого зниження частоти ішемічного інсульту на фоні терапії варфарином порівняно із застосуванням ацетилсаліцилової кислоти (3,6 і 4,8% відповідно). Разом з тим за рахунок збільшення кількості випадків геморагічних інсультів загальна частота інсультів зі стійкими залишковими явищами у хворих цієї вікової групи при лікуванні обома препаратами виявилася однаковою — 4,3 і 4,6% відповідно. Потрібно відзначити і значне підвищення ризику тяжких кровотеч в цілому, частота яких при прийомі непрямих антикоагулянтів становила 4,2% порівняно з 1,6% при прийомі ацетилсаліцилової кислоти (р=0,004). Цього не відзначали у хворих віком до 75 років.
Можливість використання комбінації варфарину та ацетилсаліцилової кислоти для профілактики інсульту проведена в дослідженнях AFASAK-II, SPAF-III, MIWAF і РATAF. При комбінованій терапії варфарин застосовували в низьких фіксованих дозах, а при монотерапії — в індивідуально підібраних. У дослідженні SPAF-III, в яке були включені хворі з високим ризиком, доведена неефективність прийому варфарину у низьких дозах (2 мг), комбінованої терапії у низьких дозах (2 мг) і ультранизьких дозах (1 мг) варфарину з ацетилсаліциловою кислотою (300 мг) і показані доцільність і ефективність підібраних доз варфарину (МНВ 2,0–3,0). При низьких дозах частота розвитку інсульту підвищилася до 7,9% порівняно з 1,9% на рік при застосуванні цього препарату в повних дозах. Таким чином, при проведенні антикоагулянтної терапії для попередження тромбоемболічних ускладнень у хворих з ФП варто застосовувати загальноприйняті дози цих препаратів, які забезпечують терапевтичний рівень гіпокоагуляції.
Виходячи з наведених результатів контрольованих досліджень при профілактиці тромбоемболічних ускладнень у хворих з ФП неревматичної етіології доцільно дотримуватися наведеної тактики (див. табл. 4.6).
Цікаве і перспективне щодо профілактики тромбоемболічних ускладнень у хворих з ФП застосування синтетичних прямих інгібіторів активного центру тромбіну. У двох найбільших дослідженнях SPORTIF ІІІ і V вивчали першого представника цієї групи — препарат ксимелагатран, результати застосування якого у фіксованій дозі 36 мг 2 рази на добу порівнювали із застосуванням варфарину (МНВ 2,0–3,0). У дослідженні брали участь >7000 хворих з ФП неклапанного генезу і хоча б одним фактором ризику розвитку інсульту. Ксимелагатран, що застосовувався без контролю коагуляції і підбору дози, виявився настільки ж ефективним для профілактики інсульту та системної емболії, як і терапія підібраними, постійно контрольованими дозами варфарину, і значно знижував частоту загальних кровотеч (32% при застосуванні ксимелагатрану і 39% — варфарину). Але у 6,1% хворих, які приймали прямий інгібітор тромбіну, в перші 6 міс лікування підвищувався рівень АлАТ у 3 рази вище норми. У зв’язку з життєво небезпечними побічними ефектами ксимелагатрану, незважаючи на певні його переваги перед варфарином, цей препарат був знятий з реєстрації. У дослідженні PETRO застосовували інший препарат цієї групи — дабігатран у хворих з ФП у дозі 50–300 мг. Зроблено висновок, що дабігатран у дозі 150 мг подібний за ефективністю й безпекою до варфарину, але в комбінації з ацетилсаліциловою кислотою підвищує ризик розвитку кровотеч. Для подальшого вивчення препарату дабігатран був вибраний для включення у ІІІ фазу розпочатої програми RE-LY. Планується провести порівняння ефективності дабігатрану з варфарином у 15 000 хворих, лікування яких буде проводитися протягом 3 років.
Останнім часом велику увагу приділяють новим антикоагулянтам — синтетичним селективним інгібіторам фактора згортання крові Ха. За хімічною природою ці речовини — штучно синтезовані олігосахариди. На відміну від низькомолекулярних гепаринів, що впливають і на фактори Ха й ІIа, ця група препаратів ізольовано блокує фактор Ха. Такий механізм дії дозволяє більш ефективно блокувати тромбін, оскільки блокада однієї молекули Ха-фактора блокує 50 молекул фактора ІIа. Крім того, після інактивації однієї молекули фактора Ха молекула інгібітору фактора Ха звільняється в кровоток і послідовно зв’язується з новими молекулами фактора Ха.
Фондапаринукс натрію — перший препарат нової групи антикоагулянтів. Вище описаний механізм дії забезпечує можливість вводити 1 раз на добу фіксовану, єдину для всіх хворих невелику дозу препарату (2,5 мг) і досягати прогнозованої дії на систему коагуляції. При такому лікуванні немає потреби в контролі показників коагуляції. Ефективність фондапаринуксу натрію для попередження тромбоемболічних ускладнень відзначена в чотирьох великих рандомізованих дослідженнях (EPHESUS, PENTATHLON 2000, PENTAMAKS, PENTIFRA) у хворих після великих ортопедичних операцій, а також у двох дослідженнях PENTUA і OASIS-5, що включають хворих з гострим коронарним синдромом.
У 2006 р. в Барселоні на конгресі Європейського кардіологічного товариства канадський вчений Alexander G.G. Turpie звернув увагу на впровадження нових парентеральних і пероральних інгібіторів Ха-фактора, дія яких не залежить від прийому харчових продуктів і лікарських засобів і не потребує проведення постійного лабораторного контролю. У дослідженні AMADEUS (ІІІ фаза дослідження PERSIST) вивчали застосування представника цієї групи ідрапаринуксу — пентасахариду тривалої дії, що вводиться підшкірно в дозі 2,5 мг 1 раз на тиждень, — порівняно з варфарином для профілактики тромбоемболічних ускладнень у хворих з ФП. У зв’язку з розвитком тяжких кровотеч при застосуванні ідрапаринуксу дослідження було достроково завершене. У двох японських дослідженнях проводиться вивчення перорального прямого інгібітору фактора Ха — ривароксабану у пацієнтів з ФП. В одному дослідженні порівнюють дію різних доз препарату: 5; 10; 20 мг протягом 30 днів прийому, а в іншому — дію ривароксабану в дозі 5; 10; 15 і 20 мг з варфарином (МНВ 1,6–2,6). Ці дослідження дозволять виявити етнічні відмінності впливу на безпеку, фармакокінетику та фармакодинаміку ривароксабану у пацієнтів з ФП, а також вибрати оптимальну дозу препарату для проведення ІІІ фази японського дослідження.
Крім медикаментозної профілактики тромбоемболічних ускладнень у хворих з ФП застосовують і хірургічні методи. Однією з нових хірургічних методик, поки недостатньо дослідженою для широкого застосування в клініці, є облітерація вушка лівого передсердя для усунення основного джерела тромбоутворення у хворих з ФП і великою імовірністю розвитку ускладнень антикоагулянтної терапії. Крім прямого хірургічного видалення або відсікання частини вушка розробляється кілька методик з внутрішньосудинною катетеризацією чи трансперикардіальним доступом. Показання для вищезазначених методик, що залишаються експериментальними, поки не визначені.
ПРОФІЛАКТИКА ТРОМБОЕМБОЛІЇ ПРИ ВІДНОВЛЕННІ СИНУСОВОГО РИТМУ
Рекомендації АСС/AHA/ESC 2006 р. з проведення антикоагулянтної терапії у хворих з ФП при відновленні ритму наведені на схемі 4.6.
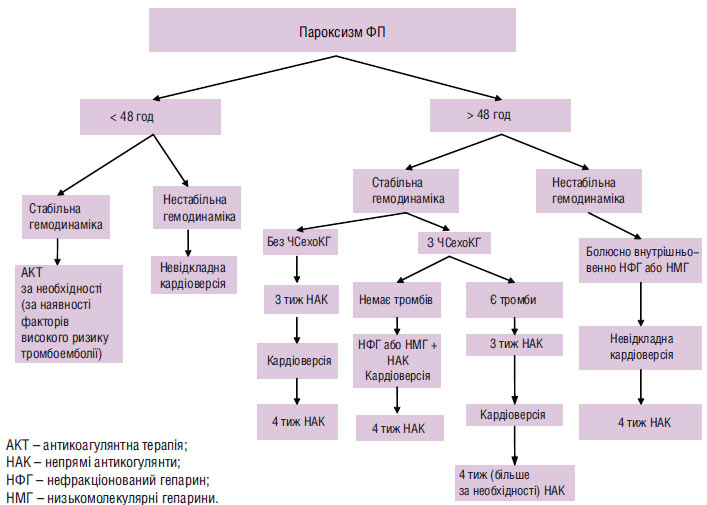
Схема 4.6. Антикоагулянтна терапія хворих з пароксизмальною та персистувальною ФП при відновленні синусового ритму
Короткочасний пароксизм ФП до 48 год не пов’язаний з підвищенням ризику розвитку тромбоемболії. Згідно з опублікованими даними, якщо тривалість ФП <2 діб, ризик виникнення тромбоемболічних ускладнень в межах 0,8–1,1%, а при застосуванні гепарину — 0,8%. Користь від антикоагулянтів при цьому не встановлена, тому й профілактичну антикоагулянтну терапію можна не проводити. Але деякі автори рекомендують застосовувати антикоагулянти (нефракціоновані гепарини з підтримкою АЧТЧ у межах терапевтичного діапазону або низькомолекулярні гепарини) до, під час і після кардіоверсії (перикардіоверсійний період). Зокрема, M.J. Weigner і співавтори (1997) рекомендують проводити антикоагулянтну терапію, призначаючи парентерально гепарин усім пацієнтам з ФП, навіть якщо її тривалість становила <48 год. На їх думку, терапія гепарином після кардіоверсії має тривати не менше 24 год. Автори вважають, що у цієї стратегії перевага перед відстрочкою гепаринотерапії в очікуванні, поки тривалість ФП стане >48 год, і відзначають, що перевага відстрочки гепаринотерапії, за наявними на сьогодні даними, непереконлива й потребує подальшого дослідження.
Але вже через 48 год наявної аритмії підвищується імовірність формування внутрішньопередсердних тромбів і тромбоемболічних ускладнень. Зростає вона в ранній період після успішної кардіоверсії (так звані нормалізаційні тромбоемболії). З огляду на це хворим з персистувальною ФП (>2 діб або тривалість невідома), яким запланована медикаментозна чи електрична кардіоверсія, показана профілактична терапія непрямими антикоагулянтами (варфарином) протягом 3–4 тиж до і після кардіоверсії під контролем МНВ у межах 2,0–3,0. Є обмежені дані, що свідчать про ефективність низькомолекулярних гепаринів при підготовці пацієнтів до кардіоверсії.
Проведено порівняльні дослідження ефективності й безпеки низькомолекулярних гепаринів і стандартного гепарину і доведено перевагу перших в ортопедичній, хірургічній, онкологічній практиці. Проведено також 4 великі рандомізовані дослідження у хворих з гострим коронарним синдромом, у яких порівнювали ефективність одного з низькомолекулярних гепаринів і стандартного гепарину: FRIC (дальтепарин), FRAXIS (надропарин), TIMІ 11B і ESSENCE (еноксапарин). Незважаючи на те що всі низькомолекулярні гепарини мають переваги, лише еноксапарин виявився вірогідно ефективнішим порівняно з низькомолекулярними гепаринами при лікуванні хворих з гострим коронарним синдромом. Але чітко не визначена оптимальна тривалість лікування низькомолекулярним гепарином. За даними метааналізу в усіх дослідженнях, де ефективність низькомолекулярних гепаринів порівнювали з такою плацебо після активної терапії протягом 3–5 діб, додатковий ефект при збільшенні тривалості антикоагулянтної терапії не відзначений. Отже, тривалість терапії остаточно не встановлена, але вона не повинна бути менше 3 діб. Незважаючи на значні розходження вартості еноксапарину і гепарину, загальні витрати на лікування при призначенні еноксапарину нижчі. Ці результати відзначено як у країнах Західної Європи, так і СНД.
Низькомолекулярні гепарини мають ряд беззастережних переваг перед нефракціонованим гепарином: висока біодоступність (до 90% після глибокої підшкірної ін’єкції) з мінімальним зв’язуванням з білками плазми крові, передбачуваний антикоагулянтний ефект, який не потребує контролю АЧТЧ, переважаюча активність щодо фактора Ха, більш тривала антитромботична активність (період напіввиведення >4,5 год після внутрішньовенного введення порівняно з 50–60 хв для звичайного гепарину) з частотою призначення 1–2 рази на добу. Ці параметри — реальна основа для прогнозованої постійно високоефективної терапії. Іншими недавно доведеними перевагами низькомолекулярних гепаринів є менший вплив на IV фактор тромбоцитів і відповідно низька частота виникнення аутоімунної тромбоцитопенії, пригнічення раннього росту фактора Віллебранда, що зумовлює зменшення подальшого утворення активного тромбіну в кровотоці.
За участю хворих з ФП проведено невеликі дослідження, результати яких свідчать про можливість застосування у них низькомолекулярних гепаринів для профілактики тромбоемболічних ускладнень. У дослідженні D. Stellbrink і співавторів запропоновано цікавий підхід до підшкірного застосування низькомолекулярних гепаринів в амбулаторній практиці. У роботі A. Roijer застосовували дальтепарин натрію 1 раз на добу для профілактики тромбоемболічних ускладнень у хворих з ФП і протипоказаннями до призначення варфарину. На фоні лікування низькомолекулярними гепаринами тромбоемболічних ускладнень не відзначали. У дослідженні Harenberg (1993) встановлено зниження частоти розвитку тромбоемболічних ускладнень у пацієнтів з ФП при застосуванні надропарину. Тому при протипоказаннях до проведення пероральної антикоагулянтної терапії застосування надропарину можна розглядати як альтернативний терапевтичний метод. Багатоцентрове дослідження АСС показало, що призначення еноксапарину натрію за 3 тиж до і 4 тиж після кардіоверсії виявилося більш ефективним, ніж лікування нефракціонованими гепаринами, з подальшим переходом на непрямі антикоагулянти. У дослідженні POSTEC доведена ефективність короткочасної антикоагулянтної терапії еноксапарином натрію під контролем ЧСехоКГ, що ймовірно є найбільш прийнятним методом профілактики тромбоемболічних ускладнень у хворих з ФП з огляду на найвищу анти-Ха-активність еноксапарину порівняно з іншими низькомолекулярними гепаринами. Але достатньої інформації про застосування низькомолекулярних гепаринів у хворих з ФП немає, тому необхідне проведення подальших досліджень.
Ризик розвитку системної тромбоемболії при відновленні ритму становить 1–5%, a при проведенні 4-тижневої антикоагулянтної терапії до і після кардіоверсії ризик тромбоемболічних ускладнень знижується і становить близько 1%.
Використання ЧСехоКГ у клінічній практиці дозволяє оцінити гемодинамічні показники вушка лівого передсердя та візуалізувати тромб у ньому, але не дає підстав не використовувати антикоагулянтної терапії за відсутності тромбу, оскільки останній може сформуватися через деякий час після успішного відновлення синусового ритму. При переході ФП у синусовий ритм спонтанно чи за допомогою електричної та фармакологічної кардіоверсії, черезстравохідної електрокардіостимуляції або радіочастотної катетерної абляції при тріпотінні передсердь відзначають минущу механічну дисфункцію лівого передсердя та вушка лівого передсердя, що отримала назву stunning, або оглушення, і характеризується значним зниженням скоротної здатності лівого передсердя і швидкості спорожнення систоли вушка лівого передсердя. При цьому часто відзначають появу різного ступеня спонтанного ехоконтрастування і навіть тромбів у лівому передсерді та вушку лівого передсердя. На відновлення механічної функції лівого передсердя потрібно кілька тижнів. На думку Manning та співавторів (1995), Grimm та співавторів (1995), тривалість цього періоду пов’язана з тривалістю існування ФП до кардіоверсії. Оборотність феномену оглушення і його взаємозв’язок з тривалістю аритмії дозволяють припустити, що головним механізмом цього феномену є кардіопатія, індукована високою ЧСС. Максимальне пригнічення скоротної здатності передсердь відзначають безпосередньо після кардіоверсії. У більшості випадків навіть у хворих з тривалістю аритмії >1 міс повне відновлення скоротної здатності передсердь спостерігають протягом 2–3 діб після кардіоверсії. Це корелює з клінічними спостереженнями, які свідчать про максимальну кількість тромбоемболічних ускладнень саме в цей період. За даними Berger і Schweitzer, що базуються на результатах об’єднаного аналізу 32 досліджень, близько 9% всіх тромбоемболічних ускладнень відзначають у перші 10 днів після кардіоверсії, а >80% з них — протягом перших 3 днів. Вважають, що тромб може сформуватися в період оглушення передсердя і може бути виштовхнутим з нього при відновленні механічної функції лівого передсердя, що і є причиною нормалізаційних тромбоемболічних ускладнень. Можливість виникнення пізніх тромбоемболічних ускладнень зумовлює необхідність подовження періоду антикоагулянтної терапії після кардіоверсії, що визначається двома причинами: частотою виникнення повторних пароксизмів ФП і ризиком розвитку тромбоемболічних ускладнень у конкретного хворого залежно від віку і наявності вищезазначених факторів ризику тромбоемболічних ускладнень.
Наявність тромбу у вушці лівого передсердя підвищує ризик тромбоемболічних ускладнень при кардіоверсії, тому у цих хворих необхідно проводити адекватну антикоагулянтну терапію протягом 3–4 тиж до і після кардіоверсії. Відсутність тромбу у вушку лівого передсердя за допомогою ЧСехоКГ може наблизити строки проведення кардіоверсії, але не виключає повністю антикоагулянтної терапії після її проведення. При метааналізі 7 досліджень по проведенню кардіоверсії під контролем ЧСехоКГ у пацієнтів, які не одержували антикоагулянтів, опублікованому Моreyra і співавторами, тромбоемболічні ускладнення виникали в 4 рази частіше, ніж при традиційному застосуванні антикоагулянтів протягом 3 тиж (1,34 і 0,33% відповідно). У таких випадках гіпокоагуляція перед процедурою кардіоверсії може бути досягнута введенням гепарину (зі збільшенням АЧТЧ в 1,5–2 рази від початкового) з одночасним призначенням непрямих антикоагулянтів і подальшим їх прийомом протягом 1 міс після відновлення ритму. Альтернативою призначення гепарину можуть бути низькомолекулярні гепарини.
У багатоцентровому дослідженні АCUTE за участю 1222 хворих з персистувальною ФП (тривалістю >2 діб) або тріпотінням передсердь і ФП в анамнезі пацієнти були рандомізовані за ЧСехоКГ і звичайною методикою. Хворі однієї групи одержували антикоагулянтну терапію гепарином перед проведенням кардіоверсії та варфарином протягом 4 тиж після неї. При виявленні тромбу призначали варфарин протягом 3 тиж, а потім повторювали ЧСехоКГ. Хворі іншої групи одержували антикоагулянти протягом 3 тиж до і 4 тиж після кардіоверсії. Обидві тактики були пов’язані з порівняно низьким ризиком інсульту (0,81% під контролем ЧСехоКГ і 0,5% — при стандартному підході) протягом 8 тиж спостереження, і ризик розвитку значних кровотеч був приблизно однаковим. Різниці в кількісному співвідношенні пацієнтів з відновленням синусового ритму не відзначали, але виявлені клінічні переваги проведення ЧСехоКГ щодо зменшення підготовчого періоду до кардіоверсії. При цьому зменшення тривалості ФП сприяє попередженню електричного і морфологічного ремоделювання передсердь, чим знижується імовірність поновлення ФП після кардіоверсії та виникнення тромбоемболічних ускладнень.
Проведено дослідження POSTEC з оцінкою функції вушка лівого передсердя до кардіоверсії і через 7 днів після відновлення ритму методом ЧСехоКГ. У нього були включені 206 пацієнтів, яких розподілили на дві групи. Хворі 1-ї групи приймали еноксапарин натрій короткочасно до і протягом 7 днів після кардіоверсії, а після проведення посткардіоверсійної ЧСехоКГ і виключення ознак тромбоутворення антикоагулянтну терапію у них на 8-й день після кардіоверсії було замінено призначенням ацетилсаліцилової кислоти. Хворі 2-ї групи короткочасно приймали нефракціоновані гепарини і непрямі антикоагулянти, а після проведення докардіоверсійної ЧСехоКГ і кардіоверсії продовжили прийом непрямих антикоагулянтів протягом 4 тиж. У кожній групі зафіксовано одне тромбоемболічне та одне незначне геморагічне ускладнення, а також одну велику кровотечу у хворого 1-ї групи, що одержував варфарин у зв’язку з тромбозом вушка лівого передсердя. Отже, у дослідженні POSTEC зменшені строки антикоагулянтной терапії як до, так і після кардіоверсії завдяки проведеній двічі ЧСехоКГ і застосуванню прямих антикоагулянтів.
Є невеликі дослідження ранньої відміни антикоагулянтної терапії після електричної кардіоверсії під контролем ЧСехоКГ. Так, С.Г. Канорський і співавтори досліджували відновлення механічної функції лівого передсердя після успішної кардіоверсії, визначаючи максимальну швидкість передсердного наповнення ЛШ. При підвищенні цього показника до ≥50 см/с механічну функцію лівого передсердя вважали відновленою, а антикоагулянтну терапію відміняли. Дослідження проводили протягом 1 міс. Результати демонструють позитивний вплив короткої тривалості ФП, нормального розміру лівого передсердя та відсутності основної серцево-судинної патології на темп відновлення функції лівого передсердя. Наявність цих факторів асоціюється з досить швидкою (у межах 3–7 днів) нормалізацією функції лівого передсердя, що можна підтвердити за допомогою допплєр-ехоКГ трансмітрального кровотоку і дозволяє відмінити антикоагулянтну терапію в більш ранній термін без розвитку тромбоемболічних ускладнень. Хоча ці результати потребують підтвердження у спеціально організованих дослідженнях.
За необхідності екстреного проведення кардіоверсії при ФП, що супроводжується нестабільністю гемодинаміки, можливе застосування прямих антикоагулянтів — нефракціонованого чи низькомолекулярного гепарину. Спочатку здійснюється болюсна внутрішньовенна інфузія, потім повільна інфузія до збільшення АЧТЧ в 1,5–2 рази вище вихідного показника з подальшим призначенням непрямих антикоагулянтів на 4 тиж, як при плановій кардіоверсії.
Наведені дані свідчать, що найбільш дослідженим і рекомендованим ACC/AHA/ESC методом антикоагулянтної терапії є використання непрямих антикоагулянтів (варфарину). При цьому часті ускладнення такої терапії, пов’язані з труднощами контролю її ефективності у зв’язку з недосконалістю лабораторної системи нашої країни та індивідуальною чутливістю до препарату, не дають можливості використовувати її в повному обсязі. Тому на сьогодні проводяться пошуки шляхів удосконалення проведення профілактики тромбоемболічних ускладнень у хворих з ФП, що зумовлено обмеженням існуючих методик. Сучасні рекомендації АСС/AHA/ESC при всій багатогранності та об’ємності залишають відкритими деякі питання, що потребують нашої уваги.На сьогодні чітко визначені рекомендації щодо строків антикоагулянтної терапії для тих випадків ФП, коли тривалість пароксизму не визначена чи виявлені тромби у вушку лівого передсердя і лівому передсерді при проведенні ЧСехоКГ. Для хворих, у яких відомий початок пароксизму і ФП нетривала, а також не виявлено тромбів у вушку лівого передсердя і лівому передсерді, загальноприйнятих схем лікування як щодо антитромботичного препарату, так і стосовно термінів його призначення немає. Виникає питання, як поводитися з хворими, у яких ФП триває від 2 діб до 1 міс? Чи повинні вони одержувати антикоагулянтну терапію протягом 3–4 тиж до і після кардіоверсії або, можливо, їм досить короткого курсу застосування низькомолекулярних гепаринів? Яка доза цих препаратів і тривалість їх застосування для профілактики тромбоемболічних ускладнень необхідна? Тому є всі підстави сподіватися, що відповіді на ці питання через деякий час будуть отримані у великих контрольованих дослідженнях, також буде розроблена тактика застосування низькомолекулярних гепаринів у практичній діяльності з огляду на їх прогнозовану антитромботичну дію та відсутність потреби в ретельному лабораторному контролі.
РЕКОМЕНДАЦІЇ
Контроль ЧСС при ФП за допомогою лікарських засобів
Високоефективно
1. Вимірювання ЧСС у спокої та контроль ЧСС за допомогою лікарських засобів рекомендуються всім пацієнтам з персистувальною і постійною формою ФП.
2. За відсутності передзбудження шлуночків рекомендується внутрішньовенне введення блокаторів β-адренорецепторів (есмолол, метопролол або пропранолол) або дилтіазему (верапамілу) для зниження частоти шлуночкових скорочень при ФП, що гостро виникла; при цьому слід дотримуватися обережності у пацієнтів з артеріальною гіпотензією чи СН.
3. Внутрішньовенне введення дигоксину чи аміодарону рекомендується для контролю ЧСС у пацієнтів з ФП і СН, у яких відсутній додатковий шлях проведення.
4. У пацієнтів з розвитком при фізичному навантаженні симптомів, зумовлених ФП, слід оцінити адекватність ЧСС під час фізичного навантаження, за необхідності провести корекцію медикаментозної терапії для підтримки ЧСС у межах цільових значень.
5. Дигоксин ефективний при пероральному прийомі у пацієнтів з ФП для контролю ЧСС у спокої; показаний пацієнтам із СН або дисфункцією ЛШ, а також пацієнтам, що ведуть малорухомий спосіб життя.
Ефективно
1. Комбінація дигоксину з блокатором β-адренорецепторів або з дилтіаземом (верапамілом) доцільна для контролю ЧСС як у спокої, так і при фізичному навантаженні у пацієнтів з ФП.
2. Доцільно застосовувати абляцію AV-вузла чи додатковий шлях проведення для контролю ЧСС у тому разі, якщо медикаментозна терапія недостатньо ефективна чи супроводжується розвитком побічних ефектів.
3. Внутрішньовенне введення аміодарону може бути корисним для контролю ЧСС у пацієнтів з ФП у випадках, коли інші заходи неефективні чи протипоказані.
4. Якщо відсутня необхідність у кардіоверсії у пацієнтів з ФП і додатковим шляхом проведення, обґрунтованою альтернативою може бути внутрішньовенне введення прокаїнаміду чи ібутиліду.
Малоефективно
1. Якщо частоту шлуночкових скорочень при ФП не вдається адекватно контролювати за допомогою блокатора β-адренорецепторів, дилтіазему, верапамілу чи дигоксину (монотерапія чи комбінація цих засобів), для зниження ЧСС можна призначити аміодарон внутрішньо.
2. У пацієнтів зі стабільною гемодинамікою, у яких у ФП бере участь додатковий шлях проведення, можна розглянути можливість внутрішньовенного введення прокаїнаміду, дизопіраміду, ібутиліду чи аміодарону.
3. Якщо частоту шлуночкових скорочень при ФП не вдається контролювати за допомогою лікарських засобів чи є підозра на кардіоміопатію, викликану тахікардією, слід розглянути доцільність катетерної абляції AV-вузла.
Профілактика тромбоемболій
Високоефективно
1. Антитромботична терапія для профілактики тромбоемболій рекомендується всім пацієнтам з ФП, за винятком осіб з ізольованою ФП або за наявності протипоказань.
2. Вибір антитромботичного засобу для конкретного пацієнта має базуватися на зіставленні абсолютного ризику інсульту та кровотечі, а також відносного ризику та користі.
3. Пацієнтам з високим ризиком розвитку інсульту рекомендується за відсутності протипоказань проведення тривалої антикоагулянтної терапії антагоністом вітаміну К (цільова величина МНВ 2,0–3,0). До факторів, асоційованих з високим ризиком інсульту у пацієнтів з ФП, належать раніше перенесений інсульт, транзиторна ішемічна атака чи системна тромбоемболія, а також ревматичний стеноз мітрального клапана чи наявність механічного штучного клапана серця.
4. Антикоагулянтна терапія антагоністом вітаміну К рекомендується пацієнтам з кількома факторами помірного ризику тромбоемболічних ускладнень (вік >75 років, АГ, цукровий діабет, СН, порушення систолічної функції ЛШ (ФВ 35% або фракція укорочення <25%).
5. На початковому етапі терапії МНВ варто визначати не рідше 1 разу на тиждень, а після стабілізації його цільової величини— 1 раз на місяць.
6. Застосування ацетилсаліцилової кислоти у дозі 81–325 мг/добу рекомендується пацієнтам з низьким ризиком тромбоемболічних ускладнень або особам, яким протипоказаний пероральний прийом антикоагулянтів.
7. У пацієнтів з ФП і механічними клапанами серця визначення цільового рівня для антикоагулянтної терапії має базуватися на типі штучного клапана; при цьому підтримують величину МНВ не менше 2,5.
8. Пацієнтам з тріпотінням передсердь рекомендується така ж антитромботична терапія, як і особам з ФП.
Ефективно
1. З метою первинної профілактики тромбоемболії у пацієнтів з ФП неклапанної етіології, у яких встановлено хоча б один із факторів ризику (вік >75 років, особливо для жінок, АГ, цукровий діабет, СН або дисфукція ЛШ), доцільне проведення антитромботичної терапії ацетилсаліциловою кислотою чи антагоністом вітаміну К з урахуванням оцінки ризику кровотечі, можливості безпечного проведення тривалої антикоагулянтної терапії та вподобань пацієнта при виборі лікування.
2. У пацієнтів з неклапанною ФП, у яких є один підтверджений або кілька менш підтверджених факторів ризику (вік 65–74 роки, жіноча стать або ІХС), доцільне лікування ацетилсаліциловою кислотою чи антагоністом вітаміну К.
3. Вибір антитромботичної терапії на основі вищеописаних критеріїв обґрунтований незалежно від форми ФП (пароксизмальної персистувальної чи постійної).
4. Пацієнтам з ФП, які не мають механічного клапана серця, доцільно перервати антикоагулянтну терапію (не більше ніж на 1 раз на тиждень) для проведення процедур з підвищеним ризиком кровотечі.
5. Доцільно регулярно проводити повторну оцінку необхідності антикоагулянтної терапії.
Малоефективно
1. У пацієнтів віком ≥75 років з підвищеним ризиком кровотечі, але за відсутності протипоказань до проведення антикоагулянтної терапії, а також у пацієнтів, які не можуть перенести без ускладнень стандартну антикоагулянтну терапію (з цільовим МНВ 2,0–3,0), можна розглянути питання про більш низьку цільову величину МНВ (1,6–2,5) для первинної профілактики інсульту та системної тромбоемболії.
2. У випадках коли пацієнтам групи високого ризику необхідно перервати антикоагулянтну терапію пероральними засобами більше ніж на 1 тиж, можна вводити парентерально нефракціонований або низькомолекулярний гепарин, хоча ефективність цього лікування недостатньо добре встановлена.
3. Після реваскуляризації міокарда пацієнтам з ФП можна призначити одночасно з непрямими антикоагулянтами ацетилсаліцилову кислоту в низьких дозах (<100 мг/добу) і/або клопідогрел (75 мг/добу), але ця тактика асоціюється з підвищеним ризиком розвитку кровотеч.
4. Пацієнтам, яким проводять реваскуляризацію міокарда, можна перервати проведення антикоагулянтної терапії для запобігання розвитку кровотеч, проте після втручання її слід відновити якнайшвидше та провести корекцію дози препаратів для досягнення терапевтичних значень МНВ. Під час такої перерви в лікуванні можна призначити ацетилсаліцилову кислоту. Пацієнтам, яким проводять черезшкірне коронарне втручання, як підтримувальну терапію слід призначити клопідогрел в дозі 75 мг/добу і варфарин (МНВ 2,0–3,0). Клопідогрел необхідно застосовувати після введення непокритого металевого стента протягом мінімум 1 міс; після імплантації стента, що елютує сиролімус,— 3 міс, після стента, що елютує паклітаксел,— 6 міс, у окремих пацієнтів, які приймають лише варфарин, — ≥12 міс.
5. У пацієнтів з ФП, які перенесли ішемічний інсульт або системну тромбоемболію під час терапії антикоагулянтами (МНВ 2,0–3,0), може бути обґрунтованим проведення більш інтенсивної антикоагулянтної терапії до цільового значення МНВ 3,0–3,5.
Кардіоверсія при ФП
Фармакологічна кардіоверсія
Високоефективно
1. З метою фармакологічної кардіоверсії при ФП рекомендується застосування флекаїніду, дофетиліду, пропафенону чи ібутиліду.
Ефективно
1. Обґрунтоване застосування аміодарону для фармакологічної кардіоверсії при ФП.
2. Окремим пацієнтам можна призначати однократний прийом внутрішньо пропафенону чи флекаїніду («таблетка в кишені») для купірування нападу ФП в амбулаторних умовах, якщо в клініці встановлено, що таке лікування безпечне. Перед початком терапії антиаритмічними препаратами пацієнту слід призначити блокатор β-адренорецепторів або дилтіазем (верапаміл) для запобігання можливого швидкого проведення імпульсів по AV-вузлу.
3. В амбулаторних умовах виправдане призначення аміодарону у пацієнтів з пароксизмальною чи персистувальною формою ФП у тому разі, коли необхідно швидко відновити синусовий ритм.
Малоефективно
1. Можна розглянути можливість застосування хінідину чи прокаїнаміду для кардіоверсії при ФП, але ефект їх застосування в таких випадках недостатньо добре встановлений.
Електрична кардіоверсія постійним струмом
Високоефективно
1. У разі відсутності швидкої реакції шлуночків на проведення медикаментозної терапії при ФП пацієнтам з ішемією міокарда, симптомами АГ, стенокардією чи СН рекомендується негайна кардіоверсія постійним струмом.
2. Негайне проведення кардіоверсії постійним струмом рекомендується для пацієнтів з передзбудженням шлуночків у тому разі, коли ФП супроводжується високою частотою шлуночкових скорочень або нестабільною гемодинамікою.
3. Кардіоверсія рекомендується у випадках, коли пацієнт погано переносить симптоми ФП. У разі рецидиву ФП можна провести повторну кардіоверсію постійним струмом після застосування антиаритмічних препаратів.
Ефективно
1. Кардіоверсія постійним струмом може бути ефективна у відновленні синусового ритму як складова частина тривалої тактики ведення пацієнтів з ФП.
2. При виборі кардіоверсій, що рідко повторюються, для лікування симптоматичної чи рецидивної ФП доцільно враховувати побажання пацієнта щодо лікування.
Медикаментозне посилення кардіоверсії постійним струмом
Ефективно
1. Попередня терапія аміодароном, флекаїнідом, ібутилідом, пропафеноном або соталолом може бути корисною для посилення кардіоверсії постійним струмом і запобігання рецидивів ФП.
2. У пацієнтів з рецидивом ФП після успішної кардіоверсії може бути доцільним повторне проведення цієї процедури після застосування антиаритмічних препаратів.
Малоефективно
1. У пацієнтів з персистувальною формою ФП можна розглянути можливість застосування блокаторів β-адренорецепторів, дизопіраміду, дилтіазему, дофетиліду, прокаїнаміду або верапамілу, хоча ефективність зазначених засобів у підвищенні ймовірності успішної кардіоверсії постійним струмом чи щодо запобігання ранніх рецидивів ФП точно не встановлена.
2. У пацієнтів, які не мають захворювання серця, можна розглянути доцільність початку лікування антиаритмічними препаратами в амбулаторних умовах для підвищення імовірності успішної кардіоверсії при ФП.
3. Можна розглянути можливість амбулаторного застосування антиаритмічних препаратів для підвищення імовірності успішної кардіоверсії при ФП у пацієнтів з певними захворюваннями серця, якщо у пацієнта вже встановлена безпека застосування цього антиаритмічного засобу.
Профілактика тромбоемболії у пацієнтів з ФП при проведенні кардіоверсії
Високоефективно
1. У пацієнтів з ФП тривалістю ≥48 год або якщо її тривалість невідома, рекомендується проведення антикоагулянтної терапії з цільовими значеннями МНВ 2,0–3,0 протягом мінімум 3 тиж перед кардіоверсією і протягом 4 тиж після неї незалежно від методу, що використаний для відновлення синусового ритму.
2. Пацієнтам з ФП тривалістю >48 год, яким необхідне негайне проведення кардіоверсії у зв’язку з нестабільною гемодинамікою, слід ввести внутрішньовенно болюсно гепарин з подальшою безперервною внутрішньовенною інфузією гепарину до збільшення АЧТЧ в 1,5–2,0 рази порівняно з контрольним значенням. Після цього необхідно проводити терапію пероральними антикоагулянтами (МНВ 2,0–3,0) протягом мінімум 4 тиж, так само як при плановій кардіоверсії. Недостатньо даних про ефективність підшкірного введення з такою метою низькомолекулярного гепарину.
3. Пацієнтам з ФП тривалістю <48 год, що супроводжується нестабільною гемодинамікою, кардіоверсію слід проводити негайно без попередньої антикоагулянтної терапії.
Ефективно
1. Протягом 48 год після початку ФП питання про необхідність проведення антикоагулянтної терапії перед кардіоверсією чи після неї може вирішуватися на підставі оцінки ризику розвитку тромбоемболії у пацієнта.
2. Як альтернативу застосування антикоагулянтів перед кардіоверсією при ФП доцільно провести ЧСехоКГ для виявлення тромбу:
a) пацієнтам, у яких тромб невиявлений, доцільно негайно провести кардіоверсію після введення антикоагулянту.
Після цього рекомендується продовжити лікування пероральним антикоагулянтом (МНВ 2,0–3,0) протягом мінімум 4 тиж, як при плановій кардіоверсії.
Недостатньо даних, що свідчать про ефективність застосування в цьому випадку низькомолекулярного гепарину.
б) пацієнтам, у яких виявлено тромб, доцільно провести антикоагулянтну терапію (МНВ 2,0–3,0) протягом мінімум 3 тиж перед відновленням синусового ритму та протягом 4 тиж після нього; більш тривала терапія антикоагулянтами може бути обґрунтованою після успішної кардіоверсії, оскільки в таких випадках зберігається підвищений ризик тромбоемболії.
3. При кардіоверсії у пацієнтів з тріпотінням передсердь може виявити сприятливий ефект проведення антикоагулянтної терапії відповідно до рекомендацій для пацієнтів з ФП.
Підтримка синусового ритму
Високоефективно
1. Перед початком терапії антиаритмічними препаратами рекомендується лікування, спрямоване на усунення оборотних причин ФП, що викликають розвиток повторних нападів.
Ефективно
1. У пацієнтів з ФП може застосовуватися медикаментозна терапія для підтримки синусового ритму та запобігання кардіоміопатії, що викликана тахікардією.
2. Обґрунтовано розглядати рідкісні, що добре переносяться пацієнтом рецидиви ФП як успішний результат терапії антиаритмічними препаратами.
3. Доцільно проводити медикаментозну терапію амбулаторно у пацієнтів з ФП, що не мають супутніх захворювань серця і добре переносять прийом антиаритмічних препаратів.
4. При ідіопатичній ФП без структурних змін серця можна призначити прийом пропафенону або флекаїніду амбулаторним пацієнтам, у яких на момент початку терапії відзначається синусовий ритм.
5. Сприятливий ефект може бути досягнутий при застосуванні соталолу в амбулаторних пацієнтів з наявністю синусового ритму, відсутністю чи мінімальною вираженістю захворювання серця та пароксизмальною ФП у тому разі, якщо вихідна тривалість інтервалу Q–T <460 мс, відзначається нормальний рівень електролітів і відсутні фактори ризику, асоційовані з проаритмією.
6. Катетерна абляція — обґрунтована альтернатива медикаментозному лікуванню для запобігання рецидивної ФП у пацієнтів з аритмією, що супроводжується вираженою симптоматикою, за відсутності збільшення чи незначного збільшення лівого передсердя.
Післяопераційна ФП
Високоефективно
1. За відсутності протипоказань рекомендується застосування блокаторів β-адренорецепторів для запобігання розвитку післяопераційної ФП у пацієнтів, яким проведене оперативне втручання на серці.
2. Рекомендується застосування засобів, що уповільнюють проведення по AV-вузлу, для контролю ЧСС у пацієнтів з розвиненою післяопераційною ФП.
Ефективно
1. Застосування аміодарону в передопераційний період у пацієнтів, яким заплановане оперативне втручання на серці, знижує частоту випадків ФП і є адекватною профілактичною терапією у пацієнтів з високим ризиком розвитку післяопераційної ФП.
2. Пацієнтам, у яких розвинулася післяопераційна ФП, доцільно проводити фармакологічну кардіоверсію ібутилідом або кардіоверсію постійним струмом для відновлення синусового ритму.
3. Рекомендується застосування антиаритмічних препаратів для підтримки синусового ритму у пацієнтів з рецидивною чи рефрактерною післяопераційною ФП.
4. Рекомендується застосування антитромботичних засобів у пацієнтів з розвиненою післяопераційною ФП.
Малоефективно
1. У пацієнтів з підвищеним ризиком розвитку ФП після оперативного втручання на серці можна розглянути можливість застосування соталолу з профілактичною метою.
Гострий ІМ
Високоефективно
1. Кардіоверсія постійним струмом рекомендується пацієнтам з тяжкими порушеннями гемодинаміки, стійкою ішемією чи у разі неможливості досягнення адекватного контролю ЧСС за допомогою медикаментозної терапії у пацієнтів з гострим ІМ та ФП.
2. Рекомендується внутрішньовенне введення аміодарону для зниження частоти шлуночкових скорочень у відповідь на ФП і поліпшення функції ЛШ у пацієнтів з гострим ІМ.
3. Рекомендується внутрішньовенне введення блокаторів β-адренорецепторів і недигідропіридинових блокаторів кальцієвих каналів для зниження частоти шлуночкових скорочень у відповідь на ФП у пацієнтів з гострим ІМ, у яких відсутні дисфункція ЛШ, бронхоспазм або AV-блокада.
4. Пацієнтам з ФП і гострим ІМ рекомендується за відсутності протипоказань введення нефракціонованого гепарину (до досягнення АЧТЧ в 1,5–2,0 рази більше порівняно з контрольним значенням).
Ефективно
1. Доцільне внутрішньовенне введення препаратів наперстянки для зниження частоти шлуночкових скорочень і поліпшення функції ЛШ у пацієнтів з гострим ІМ і ФП, асоційованою з вираженою дисфункцією ЛШ і СН.
Ведення пацієнтів з ФП, асоційованою з WPW-синдромом
Високоефективно
1. Катетерна абляція додаткових шляхів проведення рекомендується пацієнтам з наявністю симптомів ФП з WPW-синдромом, особливо пацієнтам із синкопальними станами, зумовленими високою ЧСС і коротким рефрактерним періодом додаткових шляхів проведення.
2. Негайне проведення кардіоверсії постійним струмом рекомендується для запобігання фібриляції шлуночків у пацієнтів з коротким рефрактерним періодом антероградного шляху, у яких відзначають ФП з високою частотою шлуночкових скорочень, що супроводжується нестабільною гемодинамікою.
3. Рекомендується внутрішньовенне введення прокаїнаміду чи ібутиліду для відновлення синусового ритму у пацієнтів з WPW-синдромом, у яких ФП супроводжується стабільною гемодинамікою за наявності широких комплексів QRS (≥120 мс) на ЕКГ або високої частоти шлуночкових скорочень внаслідок їх передзбудження.
Ефективно
1. Доцільне внутрішньовенне введення флекаїніду чи проведення кардіоверсії постійним струмом у тому разі, якщо у пацієнтів з ФП з участю додаткових шляхів проведення відзначається висока частота шлуночкових скорочень.
Малоефективно
1. Доцільне внутрішньовенне введення прокаїнаміду, дизопіраміду, ібутиліду чи аміодарону при стабільній гемодинаміці у пацієнтів з ФП із залученням додаткових шляхів проведення.
Гіпертиреоз
Високоефективно
1. Рекомендується застосування блокаторів β-адренорецепторів за відсутності протипоказань для контролю ЧСС у пацієнтів з ФП, ускладненою тиреотоксикозом.
2. Якщо не можна призначити блокатор β-адренорецепторів, рекомендується застосування недигідропіридинового блокатора кальцієвих каналів для контролю частоти шлуночкових скорочень у пацієнтів з ФП і тиреотоксикозом.
3. Пацієнтам з ФП і тиреотоксикозом рекомендується пероральне застосування антикоагулянтів (МНВ 2,0–3,0).
4. Після досягнення еутиреоїдного стану проводять таку ж профілактику антитромботичними засобами, як і у пацієнтів з ФП без гіпертиреозу.
Ведення пацієнток з ФП у період вагітності
Високоефективно
1. Рекомендується застосування дигоксину, блокатора β-адренорецепторів або недигідропіридинових блокаторів кальцієвих каналів для контролю частоти шлуночкових скорочень у вагітних з ФП.
2. Рекомендується кардіоверсія постійним струмом вагітним, у яких ФП супроводжується нестабільною гемодинамікою.
3. Профілактику тромбоемболії рекомендується проводити протягом усього періоду вагітності пацієнткам з ФП, за винятком осіб з низьким ризиком розвитку тромбозів. При виборі антикоагулянтів або ацетилсаліцилової кислоти необхідно враховувати період вагітності.
Малоефективно
1. Під час I триместру і останнього місяця вагітності у пацієнток з ФП і факторами ризику розвитку тромбоемболії слід розглянути можливість введення нефракціонованого гепарину за допомогою безперервної внутрішньовенної інфузії (до досягнення АЧТЧ, що в 1,5–2 рази перевищує контрольні значення) або підшкірних ін’єкцій по 10 000–20 000 ОД кожні 12 год з корекцією дози через 6 год після ін’єкції для збільшення АЧТЧ в 1,5 раза порівняно з контрольним значенням.
2. Під час I триместру і останнього місяця вагітності можна розглянути можливість підшкірного введення низькомолекулярного гепарину пацієнткам з ФП і факторами ризику розвитку тромбоемболії, хоча даних про ефективність цього методу недостатньо.
3. Під час II триместру вагітності слід розглянути можливість перорального застосування антикоагулянтів у вагітних з ФП і високим ризиком розвитку тромбоемболій.
4. Можна розглянути можливість застосування хінідину або прокаїнаміду для фармакологічної кардіоверсії у пацієнток зі стабільною гемодинамікою, у яких ФП розвинулася під час вагітності.
Ведення пацієнтів з ФП і ГКМП
Високоефективно
1. Рекомендується пероральне застосування антикоагулянтів (МНВ 2,0–3,0) у пацієнтів з ГКМП, у яких розвинулася ФП.
Ефективно
1. Можна застосовувати антиаритмічні препарати для запобігання рецидиву ФП у пацієнтів з ГКМП. Переважно слід застосовувати дизопірамід в комбінації з блокатором β-адренорецепторів або недигідропіридиновий блокатор кальцієвих каналів чи проводити монотерапію аміодароном.
Ведення пацієнтів з ФП та захворюванням легень
Високоефективно
1. Перш за все рекомендується провести корекцію гіпоксемії та ацидозу пацієнтам, у яких ФП розвинулася під час гострого легеневого захворювання, його загострення чи при хронічному захворюванні легень.
2. Рекомендується застосування дилтіазему чи верапамілу для контролю частоти шлуночкових скорочень у пацієнтів з бронхообструктивним захворюванням легень, у яких розвинулася ФП.
3. Слід провести кардіоверсію постійним струмом у пацієнтів із захворюванням легень з нестабільною гемодинамікою в результаті ФП.
ЛІТЕРАТУРА
- Де Фритас Г.Р., Богусславский Д. (2001) Первичная профилактика инсульта. Инсульт, 1: 7–31.
- Дзяк Г.В., Клигуненко О.М., Снигар В.И. и др. (2004) Фракционированные и нефракционированные гепарины в интенсивной терапии. Здоровье, 192 с.
- Дзяк Г.В., Лапшей С.Л. (1997) Мерцательная аритмия: современное состояние проблемы. Междунар. мед. журнал, 3: 6–9.
- Канорский С.Г., Медведева И.В., Мельник М.Г. и др. (2004) Стратегия лечения фибрилляции предсердий. Леч. врач, 3: 60–65.
- Комарова В.П. (2000) Фармакоэкономические исследования низкомолекулярного гепарина эноксапарина в клинической практике. Клин. фармакология и терапия, 1: 79–81.
- Кушаковский М.С. (1999) Фибрилляция предсердий. Фолиант, Санкт-Петербург,176 c.
- Панченко Э.П. (2003) Профилактика кардиоэмболического инсульта у больных мерцательной аритмией. Кардиоваскуляр. терапия и профилактика. Т. 2, 3: 64–69.
- ACC/AHA/ESC 2006 guidelines for the management of patients with atrial fibrillation — executive summary (2006) Eur. Heart J., 27: 1979–2030.
- A comparison of rate control and rhythm control in patients with atrial fibrillation. The Atrial Fibrillation Follow-up Investigation of Rhythm Management (AFFIRM) Investigators (2002) New Engl. J. Med., 347 (23): 1825–1833.
- Albers G.W., Dalen J.E., Laupacis A. et al. (2001) Antithrombotic therapy in atrial fibrillation. In: Sixth ACCP Consensus Conference on Antithrombotic Therapy, Chest., 119 (1 Suppl): 194–206.
- Berger M., Schweitzer P. (1998) Timing of thromboembolic events after electrical cardioversion of atrial fibrillation or flutter: a retrospective analysis.Amer. J. Cardiology, 82: 1545–1547.
- Blackshear J.L., Johnson W.D., Odell J.A. et al. (2003) Thoracoscopic extracardiac obliteration of left atrial appendage for stroke risk reduction in atrial fibrillation. J. Am. Coll. Cardiol., 42: 1249–1252.
- Carlsson J. (2001) Mortality and stroke rates in a trial of Rhythm Control versus Rate Control in atrial fibrillation: results from the STAF Pilot Phase (Strategies of Treatment of Atrial Fibrillation). J. Amer. Coll. Cardiol., 38 (3): 603–604.
- Chung S., Blackshear J., Shеn W.K. et al. (2001) Epidemiology and atrial fibrillation: clinical implications. JACC, 37: 371–378.
- Deplanque D., Corea F., Arquizan C. et al. (1999) Stroke and atrial fibrillation: is stroke revention treatment appropriate beforehand. Heart, 92: 563–569.
- Design of a clinical trial for the assessment of cardioversion using transesophageal echocardiography (the ACUTE Multicenter Study) (1998) Am. J. Cardiol., 81: 877–883.
- Dunn M. (1998) Thromboembolism with atrial flutte. Am. J. Cardiol., 82: 638.
- Ezekowitz M.D., Verheugt F.W. (2000) Should patients with paroxysmal atrial fibrillation be treated with chronic antiplatelet drugs Abstracts of the XXIInd Congress of ESC: 26.
- Falk R.H. (2002) Management of Atrial fibrillation — radical reform or modest modification. N. Engl. J. Med., 347(23): 1883–1884.
- Fukazawa H., Yamamoto K., Ikeda U. et al. (1998) Effect of mitral regurgitation on coagulation activity in atrial fibrillation. Am. J. Cardiol., 81: 93–96.
- Go A.S., Hylek E.M., Phillips K.A. et al. (2001) Prevalence of diagnosed atrial fibrillation in adults: national implications for rhythm management and stroke prevention: the AnTicoagulation and Risk Factors in Atrial Fibrillation (ATRIA) Study, 285: 2370–2375.
- Halperin J.L., Gomberg-Maitland M. (2003) Obliteration of the left atrial appendage for prevention of thromboembolism. J. Am. Coll. Cardiol., 42: 1259–1261.
- Hart R.G., Benavente O., McBride R. et al. (1999) Antithrombotic therapy to prevent stroke in patients with atrial fibrillation: a meta-analysis. Ann. Intern. Med., 131: 492–501.
- Hart R., Halperin J.L. (2001) Atrial fibrillation and Stroke. Concepts and controversies, 32: 803–808.
- Hart R.G., Palacio S., Pearce L.A. (2002) Atrial fibrillation, Stroke, and acute Antithrombotic Therapy. Analysis of randomized clinical trials. Stroke, 33: 2722–2727.
- Hart R.G., Pearce L.A., Miller V.T. et al. (2000) Cardioembolic vs. Noncardioembolic strokes in atrial fibrillation: frequency and effect of antithrombotic agents in the Stroke Prevention in Atrial Fibrillation studies. Cardiovascular Dis., 10: 39–43.
- Hart R.G., Pearce L.A., Rothbart R.M. et al. (2000) Stroke with intermittent atrial fibrillation: incidence and predictors during aspirin therapy. Stroke Prevention in Atrial Fibrillation Investigators. J. Amer. Coll. Cardiol., 35 (1): 183–187.
- Hirsh J., Anand S.S., Halperin J.L. et al. (2001) Guide to Anticoagulant Therapy: Heparin. A Statement for Healthcare professionals From the American Heart Association. Arterioscler. Thromb. Vasc. Biol., 21: 9–33.
- Hirsh J., Fuster V., Ansell J. et al. (2003) American Heart Association/American College of Cardiology Foundation Guide to Warfarin Therapy. Circulation: 1692–1711.
- Klein A.L., Grimm R.A., Murray R.D. et al. (2001) Assessment of Cardioversion Using Transesophageal Echocardiography Investigators. Use of transesophageal echocardiography to guide cardioversion in patients with atrial fibrillation. N. Engl. J. Med., 344(19): 1411–1420.
- Mark D., Cowper P., Bercowitz S. et al. (1998) Economic assessment of low-molecular-weight heparin (enoxaparin) versus unfractionated heparin in acute coronary syndrome patients: results from the ESSENSE randomized trial. Circulation, 97: 1702–1707.
- Nacarelli G.V., Dell’Orfano J.T., Wolbrette D.L. et al. (2000) Cost-effective management of acute atrial fibrillation: role of rate control, spontaneous conversion, medical and direct current cardioversion, transesophageal echocardiography, and antiembolic therapy. Amer. J. Cardiology, 85: 36–45.
- Ostermayer S.H., Reisman M., Kramer P.H. et al. (2005) Percutaneous left atrial appendage transcatheter occlusion (PLAATO system) to prevent stroke in high-risk patients with non-rheumatic atrial fibrillation: results from the international multi-center feasibility trials. J. Am. Coll. Cardiol., 46: 9–14.
- Page R.L. (2000) Atrial Fibrillation takes the spotlight in the Arrhythmia Sessions at this year’s AHA. Annual Scientific Sessions of the American Heart Association, November, New Orleans, USA.
- Reiter M., Bucek R.A., Koca N. et al. (2003) PERSIST. Idraparinux and liver enzymes: observations from the PERSIST trial. Blood Coagul. Fibrinol., 14(1): 61–65.
- Roijer A., Eskilsson J., Olsson B. (2000) Transesophageal echocardiography-guided cardioversion atrial fibrillation and flutter. Eur. Heart J., 21: 837–847.
- Sievert H., Lech M., Treples T. et al. (2002) Percutaneous left atrial appendage transcatheter occlucion to prevent stroke high risk patients with atrial fibrillation.Circulation, 105: 1887–1889.
- Stellbrink D., Hanrath P. (2000) Optimal management cardio version atrial fibrillation and flutter: still a stunning problem. Eur. Heart J., 21: 793–798.
- Stellbrink D., Nixdorff U., Hofmann T. et al. (2004) ACE (Anticoagulation in Cardioversion using Enoxaparin) Study Group. Safety and efficacy of enoxaparin compared with unfractionated heparin and oral anticoagulants for prevention of thromboembolic complications in cardioversion of nonvalvular atrial fibrillation: the Anticoagulation in Cardioversion using Enoxaparin (ACE) trial. Circulation, 109: 997–1003.
- Stroke Prevention in Atrial Fibrillation Investigators: Transesophageal echocardiographic correlates of thromboembolism in high-risk patients with nonvalvular atrial fibrillation: The Stroke Prevention in Atrial Fibrillation Investigators Committee on Echocardiography (1998) Ann. Intern. Med., 128: 639–647.
- Thibault B., Talajic M., Dubuc M. et al. (2000) Thromboembolic events occur in patients with atrial fibrillation despite maintenance of sinus rhythm or use of anticoagulations. Circulation, 102: 627.
- Turpie A.G., Gallus A.S., Hoek J.A. for the Pentasaccharide Investigators (2001) A synthetic pentasaccharide for the prevention of deep-vein thrombosis after total hip replacement. N. Engl. J. Med., 344: 619–625.
- Van Gelder I.C., Hagens V.E., Bosker H.A. (2002) A comparison of rate control and rhythm control in patients with recurrent persistent atrial fibrillation. New Engl. J. Med., 347 (23): 1834–1840.