Міокардит — це запальне захворювання серцевого м’яза, зумовлене безпосереднім або опосередкованим через імунні механізми впливом інфекції, паразитарної або протозойної інвазії, хімічних і фізичних факторів, а також, яке виникає при алергічних, аутоімунних захворюваннях і трансплантації серця.
Епідеміологія
Поширеність міокардиту за даними різних авторів становить від 4 до 11% захворювань серцево-судинної системи взагалі і 20% некоронарогенних захворювань серця. У багатоцентрових дослідженнях встановлено, що поширеність міокардиту широко варіює. У дослідженні Myocarditis Treatment Trial (MTT) ознаки запалення при біопсії міокарду визначили тільки в 10% із 2233 обстежених пацієнтів. В епідеміологічному дослідженні ESETCID (European Study of Epidemiology and Treatment of Cardiac Inflammatory Diseases) виявляли позитивні результати біопсії у 17,2% із перших 3055 хворих. Докази міокардиту виявляють за результатами 1–9% рутинних аутопсій і до 20% випадків нез’ясованої раптової смерті в молодому віці. Реальну поширеність легких форм міокардиту складно встановити, оскільки більшість випадків минає без тривалої клінічної картини.
Класифікація
В Україні застосовується класифікація міокардиту, яка прийнята на IХ Конгресі кардіологів України (2008), що включає наступні рубрики;
Стадії:
- блискавичний;
- гострий (І40);
- підгострий (І40.10);
- хронічний (І51.4);
- міокардіофіброз (І51.4).
Етіологія:
- із встановленою етіологією І40, І41 (інфекційний — I40, бактеріальний — I41.0, вірусний — I41.1, паразитарний — I41.2, при інших захворюваннях — I41.8);
- неуточнений — I40.9.
Морфологічні особливості інфільтрату (за даними ендоміокардіальної біопсії — ЕМБ):
- лімфоцитарний;
- еозинофільний;
- гігантоклітинний;
- гранульоматозний.
Поширеність:
- вогнищевий — I40.1;
- дифузний — I40.8.
Характер перебігу:
- легкий;
- середньої тяжкості;
- тяжкий.
Ускладнення: порушення ритму серця та провідності, тромбоемболії та ін.
СН: 0–III стадії, I–IV ФК.
Етіологія
Нині вважається загальновизнаним, що запальне ураження міокарда може виникати при будь-яких інфекційних захворюваннях. Етіологічними факторами можуть бути віруси, бактерії, гриби, найпростіші, гельмінти, рикетсії та спірохети.
Провідна роль у розвитку міокардиту належить вірусам (50%), серед яких найбільш важливе значення мають ентеровіруси, зокрема віруси Коксакі групи В, а також аденовіруси, віруси грипу A та B, гепатиту C, парвовірус В19. Нещодавно в кардіоміоцитах виявлені специфічні так звані Коксакі аденовірусні рецептори (CAR), які служать мішенню для вірусів Коксакі групи В та 2- і 5-серотипів із сімейства аденовірусів.
Серед збудників невірусних інфекційних захворювань в останні роки важливе значення займає дифтерійна паличка, підвищується частота міокардиту грибкової етіології. Міокардит також може виникати при бруцельозі, лептоспірозі, сальмонельозі, трипаносомозі, скарлатині, висипному тифі.
Із неінфекційних етіологічних факторів міокардиту відомі різні імунопатогенні агенти: деякі лікарські засоби (антибіотики (доксорубіцин), сульфаніламіди, НПЗП (метамізол натрій), трициклічні антидепресанти, добутамін та ін.), лікувальні сироватки і вакцини, токсичні хімічні речовини, а також голодування, інтоксикація при опіковій хворобі, деякі фізичні фактори (перегрівання, вплив високих доз іонізуючого випромінювання).
Міокардит може розвиватися після укусів павуків і змій. Міокардит може супроводжувати системні запальні захворювання: саркоїдоз, хворобу Крона, тиреотоксикоз, системний червоний вовчак, склеродермію, ревматоїдний артрит. Запальні зміни міокарда можуть виникати після трансплантації серця.
Патологічна анатомія
Макроскопічно спостерігається локальна дилатація або гіпертрофія, порожнина ЛШ може бути нормальних розмірів. Відзначається в’ялість міокарда, строкатість малюнка на розрізі внаслідок запального інфільтрату. При хронічному перебігу міокардиту характерні замісний інтерстиційний фіброз, гіпертрофія із ділянками деструкції м’язових волокон, вогнищами інтерстиційної інфільтрації мононуклеарними клітинами, наявність тяжів грануляційної та фіброзної тканини.
Мікроскопічно виявляють порушення структури і взаємного розташування кардіоміоцитів, характерна наявність лімфогістіоцитарних інфільтратів із невеликою кількістю плазматичних клітин в інтерстиціальній тканині, деструкція м’язових волокон різного ступеня та інтерстиціальний набряк, відкладення імуноглобулінів і комплементу в сарколемі та інтерстиції із ушкодженням ендотелію капілярів. Відзначають повнокров’я судин мікроциркуляторного русла, спазм артеріол, парез капілярів і вен, еритроцитарні стази і фібринові мікротромби, порушується судинна проникність і розвивається набряк строми.
Електронно-мікроскопічні та гістохімічні дослідження виявляють порушення ультраструктури міокарда, пошкодження мітохондрій, зменшення кількості гранул глікогену в м’язових клітинах, порушення процесів утилізації глюкози та β-окислення жирних кислот.
Морфологічний варіант міокардиту пов’язаний із етіологічним фактором, що його спричинив. Переважним типом клітин у запальному інфільтраті при вірусному міокардиті є лімфоцити, при бактеріальних інфекціях — нейтрофільні гранулоцити, при алергічному медикаментозному міокардиті, паразитарній інвазії — еозинофільні гранулоцити.
При гігантоклітинному або гранульоматозному міокардиті в серцевому м’язі виявляють багатоядерні гігантські клітини, що локалізуються головним чином по краях великих ділянок некрозу і складаються переважно із макрофагів. У вогнищі некрозу виявляється запальний інфільтрат, що складається з еозинофільних гранулоцитів, гістіоцитів та інших клітин. Фіброз відсутній.
При некротизуючому еозинофільному міокардиті визначається дифузний запальний інфільтрат із превалюванням еозинофільних гранулоцитів, поширений некроз кардіоміоцитів.
Характерні патологічні зміни в міокарді, пов’язані з вірусом гепатиту, — невеликі вогнища некрозу ізольованих м’язових пучків, оточені лімфоцитами та дифузним серозним запаленням. Шлуночки можуть бути дилатовані із петехіальними крововиливами в міжшлуночкову перетинку, включаючи ділянку провідної системи серця.
При дифтерійному міокардиті при патоморфологічному дослідженні виявляють дилатоване серце із значною внутрішньоклітинною жировою інфільтрацією кардіоміоцитів, часто з інтерстиціальним запальним інфільтратом, міоцитолізом та гіаліновим некрозом м’язових волокон, виснаження депо глікогену. З часом розвиваються фіброз і гіпертрофія клітин міокарда, що залишилися. Часто уражується провідна система серця.
При менінгококовому міокардиті патоморфологічні знахідки включають геморагічні ураження міокарда, часто відзначають інтерстиційний міокардит з інфільтрацією, яка складається з лімфоцитів, плазматичних клітин і поліморфно-ядерних лейкоцитів, зрідка з некрозом міокарда. При менінгококцемії, яка розвивається раптово і швидко, можливий фокальний некроз міокарда, виражене жирове переродження і зерниста дистрофія кардіоміоцитів.
При лептоспірозі відзначають петехіальні або більш великі вогнища геморагій, часто локалізовані в епікарді. Можлива інтерстиціальна міокардіальна інфільтрація в субендокардіальних шарах із залученням сосочкових м’язів.
При грибковому міокардиті при посмертних дослідженнях визначали дифузні міокардіальні абсцеси, а також оклюзію коронарних судин грибковим міцелієм і тромбами.
Патогенез
Ураження міокарда при інфекційному міокардиті може бути наслідком прямої інфільтрації міокарда інфекційним агентом, впливу токсинів, які виділяються збудниками безпосередньо в серці або досягають його гематогенним шляхом, ураження ендотелію дрібних вінцевих артерій із розвитком коронариту, а також результатом розвитку імунопатологічних реакцій.
Специфічність етіологічного фактора має значення лише в гострій стадії захворювання, надалі перебіг міокардиту в значно більшій мірі зумовлений імунними та аутоімунними реакціями і безпосередньо процесами запалення/загоєння міокарда.
Особливості міокардиту вірусної етіології зумовлені можливим прямим проникненням вірусу в кардіоміоцити з наступною його реплікацією і цитотоксичним ефектом аж до лізису клітини або опосередкованою дією через гуморальні та клітинні імунні реакції в міокарді. Досягаючи поверхні міокардіоциту, віруси проникають всередину нього шляхом зв’язування зі специфічними молекулами САR (Coxsackie adenovirus receptor) і DAF (decay accelerating factor) і взаємодіють зі структурними елементами, ушкоджують генетичний апарат клітини, глибоко порушують внутрішньоклітинний метаболізм. Ще одним патогенетичним механізмом є вплив ентеровірусної протеази на деградацію дистрофіна й саркогліканового комплексу, що призводить до зміни архітектоніки клітин міокарда, порушення координації скорочувальної функції серця, некрозу або індукції апоптозу кардіоміоцитів, розвитку імунних та аутоімунних реакцій. Утворення нових вірусних часток відбувається за рахунок використання білкових молекул клітини, яка при цьому може загинути. При руйнуванні м’язової клітини вірусні частки, що утворилися (віріони) вивільняються та можуть проникати в сусідні кардіоміоцити. У клінічних дослідженнях установлено, що кардіотропний вірус як тригерний фактор індукує активацію клітинного і гуморального імунітету і запальне ушкодження тканини міокарда, опосередковуване реакціями імунітету у вигляді реакції гіперчутливості уповільненого типу.
Більшість вірусів фагоцитується та виводиться з організму протягом 10–14 днів. При цьому в ушкоджених клітинах міокарда зберігаються порушення нуклеїнового обміну, що призводить до утворення антитіл класу IgG, які вступають у реакцію з неушкодженими кардіоміоцитами, запускаючи аутоімунні процеси. Після первинної інфекції міокардит розвивається через кілька тижнів, а ушкодження міокарда носить інфекційно-алергічний характер.
Вважається, що у випадках блискавичного міокардиту прямий вірусопосередкований вплив може бути первинним механізмом ушкодження міокарда. При гострому та хронічному активному міокардиті вірусна фаза може бути під контролем імунних реакцій, при персистувальній реакції внаслідок глибокого порушення вірусами внутрішньоклітинного білкового обміну клони імунних клітин активуються проти власних протеїнів. Швидкому видужанню, ймовірно, сприяє генетично наслідуваний фактор, що забезпечує швидку відповідь у вигляді утворення віруснейтралізуючих антитіл класів IgM й IgG, які перешкоджають реплікації вірусів та сприяють їх елімінації. Якщо не відбувається елімінації вірусу з організму, ушкодження міокарда переходить у другу (аутоімунну) стадію внаслідок порушення структури знову синтезованих поліпептидів як результат вірусозалежних змін у генетичному апараті клітини.
У патогенезі міокардиту також має значення активація ферментних систем і вивільнення біологічно активних субстанцій (гістаміну, серотоніну, брадикініну, ацетилхоліну та ін.), що викликає ушкодження судин мікроциркуляторного русла серцевого м’яза, розвиток гіпоксії та ушкодження кардіоміоцитів із утворенням мікронекрозів.
При переході захворювання в хронічну стадію ознаки запалення в міокарді можуть не виявлятися, при цьому зберігаються міокардіальна дисфункція та кардіомегалія.
Бактерії можуть безпосередньо викликати розвиток запалення в міокарді, а також бути інфекційно-токсичним і сенсибілізуючим фактором. При виникненні міокардиту на тлі туберкульозу, сифілісу, черевного тифу імунний компонент запалення особливо виражений.
Міокардит на фоні дифтерії, скарлатини відрізняється особливою тяжкістю перебігу, що зумовлено прямим впливом мікробних токсинів, які ушкоджують ферментні системи м’язової клітини, інгібують синтез білка, а також викликають аутоімунне ушкодження різних відділів міокарда.
При дифтерії дисфункція міокарда, ймовірно, зумовлена порушенням метаболізму жирів, оскільки дифтерійний токсин викликає значне виснаження резервів міокардіального карнітину — кофактору, необхідного для їхнього бета-окислення.
Клінічна картина
Кардіальна патологія у більшості випадків проявляється наприкінці 1-го або на 2-й тиждень від початку інфекційного захворювання. Скарги різноманітні і неспецифічні. Класична маніфестація міокардиту — тахікардія, біль у грудях або задишка на фоні гострої фебрильної лихоманки. Біль в ділянці серця є найбільш частим й одним із ранніх симптомів міокардиту, може бути різної інтенсивності і тривалості, не пов’язаний із фізичним навантаженням. Задишка нерідко передує больовому синдрому, характерне відчуття серцебиття і перебоїв у роботі серця.
Перебіг міокардиту з незначною або без дисфункції ЛШ може бути взагалі без кардіальних симптомів. Іноді першими проявами міокардиту бувають швидка втомлюваність, підвищена пітливість, артралгія, астенізація.
При гігантоклітинному міокардиті і некротизуючому еозинофільному міокардиті початок захворювання може бути гострим зі швидким прогресуванням гемодинамічних порушень. При еозинофільному міокардиті захворювання зазвичай починається з бівентрикулярної СН, виникнення аритмій може призводити до раптової смерті. Як правило, гіпереозинофілія передує або збігається з появою симптомів ураження серця, але може з’являтися пізніше.
У пацієнтів з ознаками дисфункції ЛШ найбільш частими симптомами є прояви застійної (частіше лівошлуночкової) СН (задишка, втома, дискомфорт в ділянці серця). Підвищення венозного тиску, периферичні набряки свідчать про ураження ПШ.
Клінічна картина хронічного міокардиту складається з послідовного ряду загострень, які наступають через невизначені проміжки часу.
При фізикальному обстеженні може визначатися приглушеність (глухість) тонів серця, поява III і IV тонів серця, систолічний шум на верхівці, не пов’язаний з I тоном, його інтенсивність не змінюється при зміні положення тіла.
Діагностика
Суттєве значення у встановленні діагнозу має ЕКГ-дослідження. Найчастіше на фоні синусової тахікардії відзначаються неспецифічні зміни зубця Т і сегмента ST, а також зниження амплітуди всіх зубців, зміщення інтервалу S–T вниз або вгору від ізолінії в одному або декількох відведеннях, збільшення тривалості інтервалу P–Q. Можуть реєструватися різні порушення ритму і провідності серця: передсердні та шлуночкові екстрасистоли, фібриляція та тріпотіння передсердь, AV-блокади різного ступеня, аж до повної, блокади ніжок пучка Гіса. Зміни ЕКГ у гострий період характеризуються швидкою зміною патологічних ознак, часто їхньою сукупністю та повною нормалізацією картини ЕКГ при видужанні. Холтерівське моніторування ЕКГ дозволяє виявити передсердні та шлуночкові аритмії, які не виявляються при звичайній реєстрації ЕКГ.
При ехоКГ-дослідженні можна визначити збільшення розмірів порожнин серця, зниження скорочувальної функції міокарда ЛШ (ПШ), гіпо- або акінез різних ділянок міокарда, що супроводжує ексудативний перикардит, внутрішньошлуночкові тромби (15%).
При катетеризації порожнин серця у хворих міокардитом пік систолічного тиску зміщений у бік фази скороченого вигнання крові з шлуночка, що вказує на зниження швидкості скорочення міофібрил у період вигнання, фаза напруження зменшена в основному за рахунок асинхронного скорочення, у той час як фаза ізометричного скорочення укорочена, різко подовжений час ізометричного розслаблення міокарда, характеризуючи порушення діастолічної піддатливості міокарда.
Рентгенологічне дослідження виявляється інформативним лише у хворих з дифузним міокардитом, коли можна виявити дилатацію серця, зміни амплітуди та форми зубців на рентгенокімограмі. Рентгенографія органів грудної клітки іноді виявляє збільшення розмірів серця від незначних до кардіомегалії та/або ознаки застою в легенях.
Істотну допомогу в діагностиці міокардиту (особливо хронічного) надає радіоізотопна сцинтиграфія з використанням технецію-99, цитрату галію-67 (має афінність до клітин, здатних мігрувати до вогнища запалення — моноцитів, нейтрофільних гранулоцитів, активованих Т-лімфоцитів), індій-111-оксима (використовується для маркування моноклональних антитіл до міозину).
В останні роки використовують КТ і МРТ як чутливі методи виявлення гострого міокардиту. Однак методи недостатньо специфічні, тому що вони виявляють активне запалення незалежно від його етіології, у тому числі після ІМ та при інших патологічних процесах у міокарді. Використання цих методів при проведенні ЕМБ допомагає здійснити прицільне взяття біоптатів та істотно підвищити її діагностичну цінність.
У хворих із симптомами гострої фебрильної лихоманки необхідно проводити дослідження сироватки крові на наявність найбільш частих вірусних збудників: вірусу Коксакі В, грипу А і В, цитомегаловірусу та відповідних аденовірусних форм. Для верифікації діагнозу використовують визначення віруснейтралізуючих антитіл (імуноглобулінів класів G і М (IgG, IgМ)) у плазмі крові, а також полімеразну ланцюгову реакцію (ПЛР) і гібридизацію in situ, які є досить специфічними при вірусному міокардиті та дозволяють швидко підтвердити або виключити наявність вірусної реплікації і диференціювати вірусний та аутоімунний міокардит. На нещодавно перенесену вірусну інфекцію вказує чотириразове підвищення титру противірусного IgG у період видужання порівняно із гострим періодом.
При міокардиті з більшої, ніж при іншій патології серця, частотою виявляють антитіла до міозину, актину, міолеми. Органоспецифічним для міокардиту вважають визначення аутоантитіл до аденіннуклеотидного транслокатора — ферменту внутрішньої мембрани мітохондрій.
Результати лабораторних досліджень виявляють ознаки імунологічної перебудови, у тому числі підвищення рівня циркулюючих імунних комплексів, титру антитіл до мембран кардіоміоцитів, білків міокарда, зниження абсолютної та відносної кількості Т-лімфоцитів (у тому числі активних) та зміна співвідношення їх субпопуляцій (хелпери, супресори), зміна стану нейтрофільних гранулоцитів і моноцитів, процентного вмісту дегранульованих форм базофільних гранулоцитів у периферичній крові (в нормі 10%), підвищення експресії маркерів ранньої активації запалення (антигенів CD25-рецепторів для інтерлейкіну-2 і CD71-рецепторів трансферину).
Міокардит звичайно діагностується як «підозрюване» запалення міокарда.
Діагностика міокардиту ґрунтується на динаміці патологічних змін ЕКГ, наявності кардіомегалії, застійної СН, що гостро почалася і прогресує. Серологічний аналіз для хворих із підозрюваним міокардитом повинен включати дослідження рівня кардіоспецифічних ферментів — КФК, МВ- фракції КФК, ЛДГ та кардіальних фракцій із співвідношенням ЛДГ1/ЛДГ2 >1, а також тропонінів. Недавні дослідження показали, що визначення тропоніну I і тропоніну Т є більше чутливим методом діагностики міокардіального ушкодження у хворих з міокардитом порівняно з виявленням у крові кардіоспецифічних ферментів. Підвищення рівня цих показників свідчить про ушкодження серця.
Для встановлення діагнозу «міокардит» загальновизнаних критеріїв не існує. Відповідно до рекомендацій NYHA до великих діагностичних критеріїв відносять перенесену інфекцію та появу протягом 10 днів після неї застійної СН/кардіогенного шоку, повної AV-блокади із синдромом Морганьї — Адамса — Стокса, патологічних змін ЕКГ, підвищення активності міокардіальних ферментів у сироватці крові.
До малих критеріїв відносять лабораторні підтвердження перенесеного вірусного захворювання (позитивні реакція нейтралізації, реакція гальмування гемаглютинації та реакція зв’язування комплементу), тахікардія, послаблення I тону, ритм галопу, результати ЕМБ.
Для діагностики легкого перебігу міокардиту досить наявності в анамнезі попередньої інфекції й сполучення двох великих критеріїв або одного з них із двома малими. Наявність же в числі критеріїв одного із трьох перших дозволяє констатувати середньотяжкий або тяжкий перебіг міокардиту.
Дані лабораторних досліджень у діагностиці міокардиту неспецифічні та суперечливі. Виявлення в сироватці крові протикардіальних антитіл служить серйозним аргументом на користь діагнозу «міокардит», однак ці зміни виявляють переважно при тяжких його формах.
Використання ЕМБ при лікуванні хворих після трансплантації підвищило її значення при захворюваннях нативного міокарда, гістологічні докази запалення стали «золотим стандартом» у діагностиці міокардиту. Однак чутливість ЕМБ історично була обмежена помилками аналізу зразків, і посмертні дослідження хворих, у яких був підтверджений міокардит, показали чутливість ЕМБ у межах 60–70%.
У 1984 р. групою провідних американських морфологів були розроблені так звані «даллаські» діагностичні критерії міокардиту, згідно з якими за результатами первинної ЕМБ виділяли певний міокардит, граничний (імовірний) міокардит або відсутність міокардиту.
При повторних біопсіях визначали триваючий (персистувальний) міокардит, міокардит, що завершується (загоюється), та міокардит, що завершений (що загоївся).
Суворим діагностичним критерієм гострого міокардиту визнається наявність запальної клітинної інфільтрації міокарда з некрозом та/або дегенерацією кардіоміоцитів, нетиповою для ішемічного ураження. Термін «граничний міокардит» використовують у випадках виявлення клітинної інфільтрації і неушкоджених кардіоміоцитів. Дані повторних біопсій дозволяють визначити динаміку або результат процесу і говорити про персистувальний процес, що завершується або завершений.
У 1998 р. Всесвітньою кардіологічною федерацією був прийнятий Консенсус по визначенню запальної кардіоміопатії (міокардиту). Гострий міокардит розглядається як активний міокардит, хронічний — як граничний або міокардит, що загоюється.
При первинній біопсії можна діагностувати:
- Гострий (активний) міокардит: наявність інфільтрату (дифузного або локального) з визначенням не менше 14 інфільтруючих лімфоцитів на 1 мм2 (переважно Т-лімфоцитів (CD45ro) або активованих Т-лімфоцитів і до 4 макрофагів). Кількісно інфільтрат повинен бути підрахований імуногістохімічним методом. Визначається некроз або дегенерація, необхідно враховувати також фіброз, наявність якого не обов’язкова.
- Хронічний міокардит: наявність інфільтрату, що містить не менше 14 інфільтруючих лімфоцитів на 1 мм2 (переважно Т-лімфоцитів (CD45ro) або активованих Т-лімфоцитів і до 4 макрофагів). Кількісно інфільтрат слід підраховувати імуногістохімічним методом. Некроз і дегенерація, як правило, не виражені, слід враховувати фіброз.
- Відсутність міокардиту: не виявляються інфільтруючі клітини або їхня кількість <14 на 1 мм2.
Для оцінки фіброзу розроблені критерії: відсутність фіброзу — 0-й ступінь, початковий фіброз — 1-й ступінь, помірний фіброз — 2-й ступінь, виражений фіброз — 3-й ступінь.
При наступних біопсіях можна діагностувати:
- Триваючий (персистувальний) міокардит: критерії 1 або 2;
- Міокардит, що завершується (загоюється): критерії 1 або 2, але імунологічний процес більш млявий, ніж при первинній біопсії;
- Міокардит завершений (що загоївся), який відповідає «даллаським» критеріям. Усі категорії можуть супроводжуватися або не супроводжуватися фіброзом.
Сьогодні використовують результати гістоморфологічних, імуногістохімічних методів і молекулярно- біологічних технологій (полімеразна ланцюгова реакція, гібридизація in situ), за допомогою яких можна верифікувати діагноз міокардиту (схема 6.1). Вірусний міокардит характеризується інтракардіальною наявністю вірусу з ознаками запалення. Хронічний аутоімунний міокардит підтверджується імунологічно активним запаленням, при цьому вірус у молекулярних біологічних середовищах не визначається. Критеріями вилікуваного міокардиту або переходу його в ДКМП є зникнення ознак запалення в міокарді, а також негативні результати полімеразної ланцюгової реакції і гібридизації in situ.
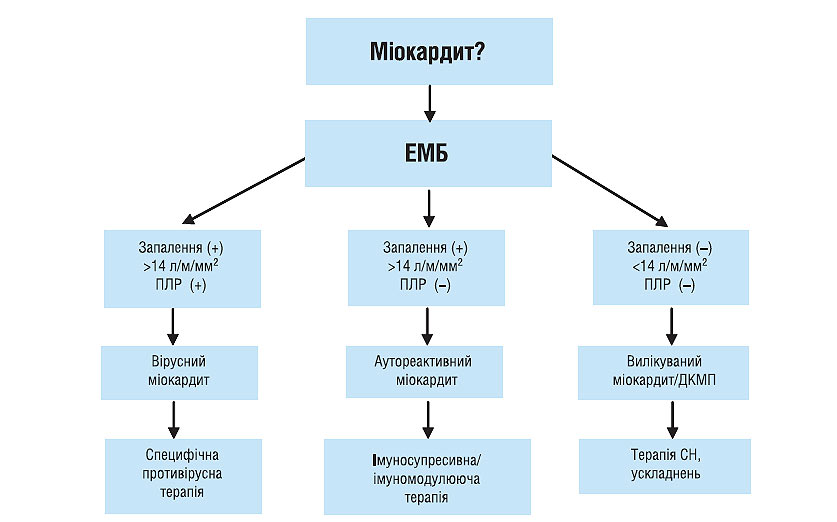
Схема 6.1. Алгоритм діагностики і лікування міокардиту. ПЛР — полімеразна ланцюгова реакція
При хронічному міокардиті ЕМБ не дозволяє виявити патогномонічні ознаки вже через 1–2 міс від початку захворювання після проведення адекватної терапії.
Відповідно до об’єднаних рекомендацій АНА, Американської колегії кардіологів і Європейського товариства кардіологів (2007) ЕМБ показана при наступних клінічних ситуаціях:
- при непоясненому виникненні симптомів СН протягом <2 тиж при нормальному або дилатованому ЛШ і порушеннях гемодинаміки (може визначатися лімфоцитарний міокардит, гігантоклітинний міокардит і некротизуючий еозинофільний міокардит);
- при непоясненому виникненні симптомів СН протягом від 2 тиж до 3 міс при дилатованому ЛШ та зі шлуночковими аритміями, які виникли знову, блокадою типу Мобітц II 2–3-го ступеня або недостатньою ефективністю звичайної терапії протягом 1–2 тиж (може визначатися гігантоклітинний міокардит);
- при непоясненому виникненні симптомів СН протягом >3 міс при дилатованому ЛШ та із вперше виявленими шлуночковими аритміями, блокадою типу Мобітц II 2–3-го ступеня або недостатньою ефективністю стандартної терапії протягом 1–2 тиж (може визначатися ідіопатичний гранульоматозний міокардит);
- при непоясненому виникненні симптомів СН, які пов’язані із ДКМП будь-якої тривалості, що асоціюється з підозрою на алергічну реакцію з еозинофілією (гіперсенситивний міокардит, некротизуючий еозинофільний міокардит);
- у виняткових випадках при непоясненій шлуночковій аритмії (лімфоцитарний міокардит, гранульоматозний міокардит).
У більшості пацієнтів із доведеним за даними ЕМБ запаленням виявляють лімфоцитарний міокардит з переважанням лімфоцитів в міокардіальному клітинному інфільтраті. Превалювання еозинофільних гранулоцитів виявляється при міокардиті, пов’язаному із алергічною реакцією або периферійною еозинофілією. Лімфоцитарний міокардит визначають приблизно в 10% пацієнтів, яким була проведена біопсія, а в 1–2% — гігантоклітинний міокардит, що характеризується наявністю багатоядерних гігантських клітин. Гіперсенситивний міокардит виявляють в основному при аутопсії в 2,4–7% випадків.
ЕМБ у більшості випадків не рекомендована через відсутність специфічних, заснованих на цьому методі рекомендацій із терапії.
Достовірний діагноз «міокардит» встановити дуже тяжко, оскільки захворювання може бути зовсім безсимптомним або проявлятися різними неспецифічними симптомами. Всі інструментальні і лабораторні методи дослідження дозволяють підтвердити наявність міокардиту, однак негативні результати не є критерієм виключення діагнозу, навіть негативні результати ЕМБ. У гостру фазу міокардиту активність серцевих ферментів зазвичай підвищена, що може спричинити помилкову діагностику ІМ. Діагноз «міокардит» майже завжди є певною мірою ймовірним, але стає досить переконливим, якщо до нього приєднуються ознаки супутнього перикардиту.
Лікування
Пацієнти з легким перебігом вогнищевого міокардиту можуть проходити лікування в амбулаторних умовах. Хворі з міокардитом середнього ступеня тяжкості та тяжким перебігом підлягають госпіталізації. Принципи лікування хворих із міокардитом включають застосування немедикаментозних підходів, медикаментозного й хірургічного методів лікування (схема 6.2).

Схема 6.2. Тактика ведення хворих з міокардитом
До немедикаментозного лікування можна віднести обмеження фізичної активності, повноцінне раціональне харчування з обмеженням споживання повареної солі, відмова від паління, обмеження вживання алкоголю.
Медикаментозне лікування міокардиту передбачає кілька напрямків:
- вплив на запальні, аутоімунні та алергічні процеси, у тому числі на зменшення ушкоджуючої дії антиміокардіальних антитіл;
- скорочення продукції біологічно активних речовин;
- відновлення і підтримка гемодинаміки;
- вплив на метаболізм міокарда;
- активну санацію вогнищ інфекції.
Специфічного лікування міокардиту на сьогодні не існує, основними напрямками лікувальної тактики можуть бути:
- етіотропна терапія при встановленому збуднику:
- противірусні засоби,
- антибактеріальні засоби,
- протипаразитарні засоби;
- неспецифічна протизапальна терапія:
- НПЗП,
- ГКС;
- вплив на аутоімунний процес;
- симптоматична терапія ускладнень.
Значення специфічної антивірусної терапії не встановлено. При виявленні вірусу грипу (А і В) застосовують римантадин протягом 7 діб (лікування починають не пізніше 48 год із моменту появи симптомів). При ідентифікації вірусу Varicella zoster, вірусу простого герпеса, вірусу Епштейна — Барр призначають ацикловір, цитомегаловірусу — ганцикловір або фоскарнет натрій, зидовудин.
У випадках вірусної етіології міокардиту в перші 2–3 тиж протипоказане призначення НПЗП, ГКС, оскільки під їхнім впливом у гострій фазі можливо значне прискорення реплікації вірусів, збільшення ушкодження міокарда, зменшення продукції інтерферону.
При інфікуванні Mycoplasma pneumoniae ефективний еритроміцин. При інфікуванні S. aureus (до визначення чутливості збудника до антибіотиків) призначають ванкоміцин, при зараженні грибами — амфотерицин В. Якщо збудником є Cryptococcus neoformans (найчастіший збудник), застосовують комбінацію амфотерицина В і флуцитозида.
При ідентифікації Toxoplasma gondii комбінують піриметамін + сульфадіазин, а також фолієву кислоту для профілактики мієлосупресії.
При дифтерійному міокардиті лікування малоефективне. Для поліпшення ефективності лікування захворювання необхідно негайно ввести протидифтерійний антитоксин, терапія антибіотиками менш невідкладна.
НПЗП виявляють активну протизапальну дію. Найчастіше використовують диклофенак або інгібітори ЦОГ-2 — групу препаратів, що впливають на метаболізм арахідонової кислоти і зменшують синтез ендогенних простагландинів внаслідок блокади ізоформи ферменту ЦОГ (ЦОГ-2), інгібірування якого має велике значення в усуненні запалення. Призначення НПЗП виправдане при наявності ознак супутнього перикардиту.
Немає єдиної думки щодо застосування імуносупресивної терапії в пацієнтів із гострим міокардитом вірусної етіології. У багатоцентровому дослідженні Myocarditis Treatment Trial (MTT) оцінювали застосування преднізолону і циклоспорину в лікуванні доведеного даними біопсії лімфоцитарного міокардиту. Терапевтичний ефект імуносупресії не був досягнутий, оскільки збільшення ФВ ЛШ становило 10% у групі з імуносупресивною терапією і 7% — у контрольній групі. Не отримано різниці в довгостроковому виживанні (p=0,96) при загальній смертності 20% за 1 рік і 56% — за 4,3 року. Призначення імуносупресивної терапії на ранніх стадіях захворювання не виправдано, оскільки пригнічення імунної відповіді може призводити до пролонгації персистування вірусу або його фрагментів в організмі та хронізації запального процесу в міокарді.
Імуносупресивна терапія, що включає ГКС, може бути ефективною в пацієнтів з аутоімунною фазою міокардиту. При тяжкому перебігу міокардиту — вираженій прогресуючій СН або тяжких порушеннях ритму, рефрактерних до антиаритмічної терапії, призначають ГКС у поєднанні з цитостатиками (у випадку тяжкого перебігу дифузного міокардиту, рецидивируючого перебігу, що супроводжується алергозами або вираженими ознаками активності запального процесу, що зберігаються при лікуванні НПЗП). Найчастіше застосовують преднізолон у дозі 70–80 мг/добу та азатіоприн у дозі 150–200 мг/добу. Лікування в більшості випадків продовжують 6 міс і більше (дозу преднізолону поступово знижують).
Призначення імуносупресивної терапії показане у випадку підтвердженого при ЕМБ гігантоклітинного міокардиту.
Сьогодні вивчаються можливості застосування імуномодуляторів, в 2002 р. було розпочате Європейське рандомізоване дослідження BICC (Betaferon in Chronic Viral Cardiomyopathy Trial).
Ефективність імуноглобуліну для внутрішньовенного введення в дорослих з міокардитом була оцінена в багатоцентровому дослідженні Intervention in Myocarditis and Acute Cardiomyopathy (IMAC), в якому було рандомізовано 62 пацієнти для інфузії імуноглобуліну в дозі 2 г/ кг маси тіла або плацебо. Не виявлено ніяких переваг внутрішньовенного введення імуноглобуліну, оскільки за 6 міс приріст ФВ склав 14% в обох групах і через 12 міс — 16% у групі лікування порівняно з 15% — у групі плацебо. Загальна виживаність (події визначені як смерть, проведення трансплантації серця або необхідність у використанні допоміжних пристроїв для підтримки функції ЛШ) склала 91% через 1 рік і 88% за 2 роки; ніяких істотних відмінностей між групами не виявлено.
У комплексній терапії міокардиту можливе використання препаратів системної ензимотерапії.
Ефективність лікування і прогноз при міокардиті значно відрізняються в залежності від функції ЛШ.
При легкому перебігу міокардиту (підозрі на міокардит) і відсутності дисфункції ЛШ медикаментозна терапія не потрібна, рекомендовано уникати аеробних фізичних навантажень або підйому надмірної ваги протягом як мінімум 6–8 тиж. Обстеження, що включає проведення ЕКГ та ехоКГ, варто повторити через 6–8 тиж після початку захворювання для оцінки прогресування ураження міокарда.
При дисфункції ЛШ пацієнтам з СН терапія проводиться за загальними правилами. Всім хворим рекомендоване застосування інгібіторів АПФ (при їх непереносимості — антагоністів рецепторів ангіотензину II) і блокаторів β-адренорецепторів. Застій у легенях або симптоми перенавантаження рідиною необхідно усувати застосуванням петльових діуретиків у мінімальній ефективній дозі. Дигоксин додають до схеми лікування у хворих з III-IV ФК NYHA, однак слід враховувати його потенційні проаритмогенні і прозапальні ефекти, призначаючи в мінімальних ефективних підтримуючих дозах або не призначаючи зовсім у хворих з мінімально вираженою симптоматикою (I або II ФК). Навіть на фоні застосування серцевих глікозидів у звичайних дозах існує високий ризик глікозидної інтоксикації. СН при міокардиті відрізняється резистентністю до терапії серцевими глікозидами і діуретиками. Важливо усунути гіпокаліємію та ацидоз. Для лікування рефрактерної СН виправдане застосування периферичних вазодилататорів. Нітрати зменшують венозне повернення крові до серця, тиск у судинах малого кола кровообігу, тобто переднавантаження на ЛШ, що проявляється клінічним поліпшенням. Застосування серцевих глікозидів на фоні периферичних вазодилататорів дозволяє досягти адекватної дигіталізації при відсутності токсичного ефекту.
У пацієнтів із блискавичним перебігом міокардиту можуть використовуватися механічні пристрої для підтримання функції шлуночків, у випадках коли їхній стан не поліпшується, незважаючи на максимальну інотропну терапію.
У хворих, розмір і систолічна функція ЛШ в яких повністю нормалізувалися, терапія інгібіторами АПФ і блокаторами β-адренорецепторів у принципі може бути припинена за умов ретельного контролю функції ЛШ і хронічних захворювань. У багатьох пацієнтів, що одужали, можуть мати місце суб’єктивні обмеження у функціональній здатності і об’єктивні обмеження при навантажувальних пробах, можливо, завдяки більш повільному відновленню діастолічної функції ЛШ.
Непрямі антикоагулянти призначають хворим із тромбоемболічними ускладненнями (у тому числі в анамнезі), наявністю тромбів у порожнинах серця і фібриляцією передсердь на фоні кардіомегалії.
При порушеннях ритму призначають антиаритмічні препарати або вживляють кардіовертер-дефібрилятор, електрокардіостимулятор.
Трансплантацію серця слід планувати тільки на пізніх стадіях захворювання, особливо враховуючи ризик високої ранньої післяопераційної смертності в результаті відторгнення трасплантата в пацієнтів, імунна система яких була з початку активована проти антигенів міоцитів. При відторгненні трансплантата, що частіше розвивається в перші 3 міс після трансплантації серця, призначають ГКС у високих дозах (пульс-терапія).
У термінальній стадії використовують двокамерну стимуляцію, апаратну підтримку скорочення шлуночків.
Прогноз
Прогноз значною мірою залежить від ступеня відновлення функції ЛШ. У більшості випадків (до 90%) перебіг міокардиту безсимптомний і протягом 1–2 міс завершується повним одужанням, зникають усі суб̓єктивні симптоми, нормалізується ЕКГ у спокої та при проведенні ВЕМ. У 30–50% пацієнтів з дисфункцією ЛШ відбувається істотне її поліпшення протягом першого року після захворювання. У багатьох хворих зберігаються залишкові зміни ЕКГ, що свідчать про розвиток вогнищевого міокардитичного кардіосклерозу (міокардіофіброзу), що підтверджується при ехоКГ-дослідженні. За наявності клінічних проявів дисфункції ЛШ прогноз гірший: у 10–33% хворих розвивається ДКМП.
Гігантоклітинний міокардит і некротизуючий еозинофільний міокардит можуть мати блискавичний розвиток симптомів з несприятливим прогнозом. При гігантоклітинному міокардиті тривалість життя без трансплантації серця в середньому становить 5,5 міс, через 4 роки залишаються живими тільки 11%, при лімфоцитарному міокардиті — 44% хворих.
Несприятливими чинниками, що обтяжують прогноз міокардиту, вважають підвищення тиску в лівому передсерді, низький серцевий індекс, діастолічну дисфункцію ПШ, розвиток застійної СН, тромбоемболії, порушення провідності та аритмії високих градацій.
ЛІТЕРАТУРА
- Амосова Е.Н. (2000) Миокардиты. Междунар. мед. журн., 1: 22–25.
- Дерюгин М.В., Бойцов С.А. (2005) Хронические миокардиты. ЭЛБИ-СПб, Санкт-Петербург, 288 с.
- Коваленко В.Н., Несукай Е.Г. (2001) Некоронарогенные болезни сердца. Практ. руководство. Морион, Киев, 480 с.
- Коваленко В.Н., Рябенко Д.В. (2005) Современные представления о миокардите. Мистецтво лікування, 9: 12–20.
- Коваленко В.Н. (ред.) (2008) Руководство по кардиологии. Морион, Киев, 1424 с.
- Наказ № 436 Міністерства охорони здоров’я України від 03.07.2006 р. «Про затвердження протоколів надання медичної допомоги за спеціальністю «Кардіологія» (2006) Укр. кардіол. журн., 6: 89–115.
- Badorff C., Knowlton K.U. (2004) Dystrophin disruption in enterovirus-induced myocarditis and dilated cardiomyopathy: from bench to bedside. Med. Microbiol. Immunol, 193: 121–126.
- Bowles N.E., Ni J., Kearney D.L. et al. (2003) Detection of viruses in myocardial tissues by polymerase chain reaction: evidence of adenovirus as a common cause of myocarditis in children and adults. J. Amer. Coll. Cardiol., 42: 466–472.
- Chimenti C., Russo A., Pieroni M. et al. (2004) Intramyocyte detection of Epstein-Barr virus genome by laser capture microdissection in patients with inflammatory cardiomyopathy. Circulation, 110: 3534–3539.
- Cooper L.T., Baughman K.L., Feldman A.M. et al. (2007) The role of endomyocardial biopsy in the management of cardiovascular disease. Eur. Heart J., 28: 3076–3093.
- Daliento L., Calabrese F., Tona F. et al. (2003) Successful treatment of enterovirus-induced myocarditis with interferon-α. J. Heart Lung Transplant., 22: 214–217.
- D’Ambrosio A., Patti G., Manzoli A. et al. (2001) The fate of acute myocarditis between spontaneous improvement and evolution to dilated cardiomyopathy: a review. Heart, 85: 499–504.
- Deonarain R., Cerullo D., Fuse K. et al. (2004) Protective role for Interferon-β in coxsackievirus B3 infection. Circulation, 110: 3540–3543.
- Dill T., Ekinci O., Hansel J. et al. (2005) Delayed contrast-enhanced magnetic resonance imaging for the detection of autoimmune myocarditis and long-term follow-up. J. Cardiovasc. Magn. Reson., 7: 521–523.
- Elliott P., Andersson B., Arbustini E. et al. (2008) Classification of the cardiomyopathies: a position statement from the european society of cardiology working group on myocardial and pericardial diseases. Eur. Heart J., 29: 270–276.
- Eckart R.E., Scoville S.L., Campbell C.L. et al. (2004) Sudden death in young adults: a 25-year review of autopsies in military recruits. Ann. Intern. Med., 141: 829–834.
- Galderisi M., Mondillo S. (2007) Echocardiography in clinical practice. One Way S.r.l., 120 p.
- Huber S.A., Sartini D. (2005) Roles of tumor necrosis factor alpha and the p55 receptor in CD1d induction and Coxsackievirus B3-induced myocarditis. J. Virol., 79: 2659–2665.
- Hufnagal G., Pankuweit S., Schonian U. et al. (2000) The European Study of Epidemiology and Treatment of Cardiac Inflammatory Diseases (ESETCID). First epidemiology results. Herz, 25: 279–285.
- Kittleson M.M., Minhas K.M., Irizarry R.A. et al.(2005) Gene expression in giant cell myocarditis: altered expression of immune response genes. Intl. J. Cardiol., 102: 333–340.
- Kühl U., Pauschinger M., Schwimmbeck P.L. et al. (2003) Interferon-β treatment eliminates cardiotropic viruses and improves left ventricular function in patients with myocardial persistence of viral genomes and left ventricular dysfunction. Circulation, 107: 2793–2798.
- Liu P.P., Mason J.W. (2001) Advances in understanding of myocarditis. Circulation, 104: 1076.
- Liu P.P., Yan A.T. (2005) Cardiovascular magnetic resonance for the diagnosis of acute myocarditis. J. Amer. Coll. Cardiol., 45: 1823–1825.
- Maisch B., Portig I., Ristic A. et al. (2000) Definition of inflammatory cardiomyopathy (myocarditis): on the way to Consensus. A status report. Herz, 25(issue 3): 200–209.
- Mason J.W., O’Connell J.B., Herskowitz A. et al. (1995) A clinical trial of immunosuppressive therapy for myocarditis. The Myocarditis Treatment Trial Investigators. N. Engl. J. Med., 333: 269–313.
- McCarthy R.E., Bochmer J.P., Hruban R.H. et al. (2000) Long-term outcome of fulminant myocarditis as compared with acute (nonfulminant) myocarditis. New Engl. J. Med., 342: 690–694.
- McNamara D.M., Rosenblum W.D., Janosko K.M. et al. (1997) Intravenous immune globulin in the therapy of myocarditis and acute cardiomyopathy. Circulation, 95: 2476–2478.
- Pauschinger M., Chandrasekharan K., Noutsias M. et al. (2004) Viral heart disease: molecular diagnosis, clinical prognosis, and treatment strategies. Med. Microbiol. Immunol., 193: 65–69.
- Smith S.C., Ladenson J.H., Mason J.W. et al. (1997) Elevations of cardiac troponin I associated with myocarditis. Circulation, 95: 163–168.
- Topol E.J. (Ed.) (2007) Textbook of cardiovascular medicine. 3th ed. Lippincott Williams&Wilkins, 1628 p.
- Wojnicz R., Nowalany-Kozielska E., Wojciechowska C. et al. (2001) Randomized, placebo-controlled study for immunosuppressive treatment of inflammatory dilated cardiomyopathy: two-year follow-up results. Circulation, 104: 39–45.