Набуті вади серця являють собою структурні аномалії і деформації клапанів серця і субклапанного апарату, що виникли внаслідок різних причин, які порушують внутрішньосерцеву і системну гемодинаміку і призводять до розвитку гострої або хронічної недостатності кровообігу.
Етіологія
Вада серця виникає внаслідок різних патологічних процесів. Ревматизм є основним етіологічним фактором мітрального стенозу (85%), значно рідше вражає аортальний клапан (26%), може бути причиною різних комбінацій стенозу і недостатності аортального або мітрального клапана серця. Ізольована мітральна недостатність, аортальний стеноз і аортальна недостатність часто бувають неревматичного походження і зумовлені дегенеративними змінами. До розвитку набутих вад серця можуть також призводити інфекційний ендокардит, атеросклероз, сепсис, сифіліс, травми, у незначній частині випадків — системний червоний вовчак (ендокардит Лібмана — Сакса), системна склеродермія, ревматоїдний артрит з вісцеральними ураженнями.
Класифікація
Приведена класифікація набутих вад серця прийнята на VI Конгресі кардіологів України (Київ, 2000). Після нозологічних одиниць наведена їх рубрика за МКХ-10.
Мітральний стеноз:
Ревматичний I05.0
Неревматичний I34.2 (з уточненням етіології)
Мітральна недостатність:
Ревматична I05.1
Неревматична I34.0 (з уточненням етіології)
Комбінована ревматична мітральна вада (ревматичний мітральний стеноз із недостатністю I05.2):
Із перевагою стенозу
Із перевагою недостатності
Без явної переваги
Пролапс мітрального клапана I34.1
Аортальний стеноз:
Ревматичний I06.0
Неревматичний I35.0 (з уточненням етіології)
Аортальна недостатність:
Ревматична I06.1
Неревматична I35.1 (з уточненням етіології)
Комбінована аортальна вада:
Ревматичний аортальний стеноз із недостатністю I06.2
Неревматичний аортальний (клапанний) стеноз із недостатністю I35.2 (із уточненням етіології)
Із перевагою стенозу
Із перевагою недостатності
Без явної переваги
Трикуспідальний стеноз:
Ревматичний I07.0
Неревматичний I36.0 (із уточненням етіології)
Трикуспідальна недостатність:
Ревматична I07.1
Неревматична I36.1 (із уточненням етіології)
Комбінована трикуспідальна вада:
Ревматичний трикуспідальний стеноз із недостатністю I07.2
Неревматичний трикуспідальний стеноз із недостатністю I36.2 (із уточненням етіології)
Клапанний стеноз ЛА I37.0
Недостатність клапана ЛА I37.1
Комбінована вада клапана ЛА (стеноз ЛА із недостатністю клапана I37.2)
Поєднані вади серця:
Мітрально-аортальна I08.0
Мітрально-трикуспідальна I08.1
Аортально-трикуспідальна I08.2
Поєднане ураження мітрального, аортального й трикуспідального клапанів I08.3
Ваду серця вважають «комбінованою» при наявності стенозу і недостатності одного клапана і «поєднаною» при ураженні декількох клапанів. При наявності декількох вад їх перераховують, першою указуючи ваду, вираженість якої більша.
Ступінь кальцинозу клапанів
I + Окремі включення кальцію в товщі комісур або стулок
II ++ Значна кальцинація стулок і комісур без залучення клапанного кільця
III +++ Масивний кальциноз клапана з переходом на фіброзне кільце, а іноді на стінку аорти і міокард шлуночків
У діагнозі також необхідно вказувати етіологію вади (ревматизм, інфекційний ендокардит, дегенеративні зміни), стадію СН.
Для хворих, які перенесли операцію на клапанах серця, слід позначити вид вади, з приводу якої була проведена операція, вказати дату оперативного лікування, характер післяопераційних ускладнень.
ЕхоКГ є стандартним методом діагностики для оцінки структури і функції клапана.
Згідно з наказом МОЗ України № 436 у перелік обсягу обов’язкових послуг входить оперативне лікування вади серця, цілорічна пеніцилінопрофілактика при ревматичній етіології та лікування СН залежно від її типу (систолічна або діастолічна).
МІТРАЛЬНИЙ СТЕНОЗ
Етіологія
Мітральний стеноз — найбільша за частотою ревматична вада серця, виникає внаслідок тривалого перебігу ревматичного кардиту. Вада звичайно формується у молодому віці і частіше (80%) у жінок. Рідко звуження мітрального отвору може виникати при карциноїдному синдромі, системному червоному вовчаку, ревматоїдному артриті, у 13% випадків причиною є дегенеративні зміни клапана.
Класифікація
За ступенем тяжкості виділяють незначний мітральний стеноз (максимальний градієнт тиску 7–11 мм рт. ст., площа мітрального отвору >2 см2), помірний стеноз (максимальний градієнт тиску 12–20 мм рт. ст., площа мітрального отвору 1–2 см2), значний стеноз (максимальний градієнт тиску >20 мм рт. ст., площа мітрального отвору <1 см2).
Патологічна анатомія
В основі вади лежать кальцинація і потовщення стулок клапана, у патологічний процес також залучені фіброзне кільце, хорди і сосочкові м’язи. Звуження отвору виникає спочатку внаслідок склеювання країв стулок клапана, що дотикаються з утворенням комісур, надалі поширюється до середини отвору, поступово його звужуючи. Паралельно відбуваються фіброзні зміни структур клапанного апарату, склерозується і втрачає свою еластичність фіброзне кільце. При тривалому існуванні вади відбувається кальцинація клапана.
Патологічна фізіологія
«Критична площа», при якій починаються помітні гемодинамічні розлади, становить 1–1,5 см2. Опір кровотоку, створюваний звуженим мітральним отвором («перший бар’єр»), запускає в хід компенсаторні механізми, що забезпечують достатню продуктивність серця. Через підвищення градієнта тиску між лівим передсердям і ЛШ компенсаторно зростає тиск у лівому передсерді (рис. 4.1), міокард передсердя гіпертрофується, порожнина його розширюється. Коли тиск у лівому передсерді вище певного рівня, виникає рефлекторне звуження дрібних ЛА на прекапілярному рівні («другий бар’єр») — рефлекс Китаєва, що попереджає переповнення кров’ю капілярної мережі легень. Високий тиск у ЛА (до 80 мм рт.ст. і вище) призводить до компенсаторної гіпертрофії, а потім і дилатації ПШ, у ньому підвищується діастолічний тиск, виникає правошлуночкова недостатність і відносна недостатність тристулкового клапана.
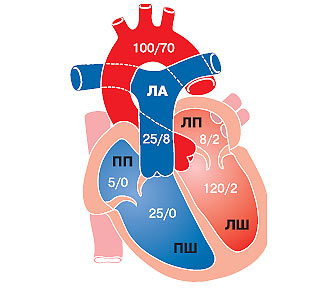
Рис. 4.1. Тиск крові (мм рт. ст.) у різних відділах серця і судин в нормі (САТ/ДАТ)
Клінічна картина
Залежить від стадії захворювання, стану компенсації кровообігу. Вада звичайно в стані спокою клінічно не проявляється, якщо площа мітрального отвору перевищує 1,5 см2. При компенсаторній гіперфункції лівого передсердя хворі зазвичай не скаржаться, можуть виконувати значні фізичні навантаження.
При підвищенні тиску у малому колі кровообігу з’являються скарги на задишку і відчуття серцебиття при фізичному навантаженні. При різкому підвищенні тиску в капілярах розвиваються напади серцевої астми, виникає сухий або з виділенням невеликої кількості слизуватого мокротиння кашель, часто з домішкою крові (кровохаркання). При високій легеневій гіпертензії у хворих з’являються скарги на слабкість, підвищену стомлюваність.
При вираженому стенозі і наростанні симптомів легеневої гіпертензії відзначають типове facies mitralis: «мітральний» рум’янець на щоках на фоні блідої шкіри обличчя, ціаноз губ, кінчика носа, вушних раковин.
При огляді ділянка серця в нижній частині грудини часто вибухає і пульсує внаслідок утворення так званого «серцевого горба», зумовленого посиленими ударами ПШ об передню грудну стінку. В ділянці верхівки серця або дещо латеральніше визначається діастолічне тремтіння — «котяче муркотіння».
Аускультативно мітральний стеноз діагностують на підставі характерної мелодії тонів серця (ритм перепела) — посилений (хлопаючий) I тон на верхівці серця і тон (клацання) відкриття мітрального клапана, що з’являється через 0,08–0,11 с після II тону. Характерним є діастолічний шум, що може виникати в різні періоди діастоли. Протодіастолічний шум низький, рокочучий (його пальпаторним еквівалентом є «котяче муркотіння»), різної тривалості, з поступовим зниженням його інтенсивності. Пресистолічний шум звичайно короткий, грубого, скребучого тембру, має наростаючий характер, закінчується хлопаючим I тоном.
Діагностика
На ЕКГ в процесі прогресування вади з’являються ознаки перевантаження лівого передсердя (P mitrale), гіпертрофії ПШ: збільшена амплітуда зубців комплексу QRS у поєднанні зі зміненою кінцевою частиною шлуночкового комплексу (сплощення, інверсія зубця Т, зниження сегмента SТ) у відповідних відведеннях. Часто реєструють порушення ритму серця (фібриляцію, тріпотіння передсердь).
На рентгенограмі визначається збільшення лівого передсердя і ПШ, кальцифікація мітрального клапана, перерозподіл легеневого судинного кровотоку в верхніх відділах легень, розширення ЛА.
ЕхоКГ і допплєрографія є основними методами оцінки ступеня тяжкості вади і морфологічних змін клапана (потовщення, фіброз, кальциноз (рис. 4.2), порушення руху стулок), функціональних параметрів (градієнт тиску, тиск у ЛА, наявність і ступінь тяжкості супутньої мітральної регургітації, функція ПШ і ЛШ), розміру лівого передсердя, а також розрахунку площі мітрального отвору. При проведенні ехоКГ у М-режимі відзначають односпрямований (П-подібний) рух передньої й задньої стулок мітрального клапана вперед (рис. 4.3), зниження швидкості раннього діастолічного прикриття передньої стулки мітрального клапана (до 1 см/с), зменшення амплітуди відкриття стулки мітрального клапана, збільшення порожнини лівого передсердя (передньозадній розмір може збільшуватися до 70 мм).
Рис. 4.2. Мітральний стеноз. В-режим, парастернальна позиція, коротка вісь

Рис. 4.3. Мітральний стеноз. М-режим
Трансезофагеальну ехоКГ проводять для виключення тромбозу лівого передсердя перед проведенням комісуротомії або після епізоду емболії.
У хворих з помірним або тяжким мітральним стенозом можна проводити стрес-ехоКГ, що дозволяє об’єктивно оцінити функціональну здатність серця і величину трансмітрального градієнта у стані спокою і при навантаженні та найчастіше виявити легеневу гіпертензію при навантаженні. Значення середнього трансмітрального градієнта при навантаженні ≥20 мм рт. ст. і максимального систолічного тиску в ПШ ≥60 мм рт. ст. свідчать про наявність гемодинамічно значимого мітрального стенозу. У хворих, які не можуть виконувати проби з фізичним навантаженням, проводять ехоКГ-дослідження з добутаміном. Середній трансмітральний градієнт понад 18 мм рт. ст. під час піку інфузії добутаміну дозволяє виявити пацієнтів з ризиком розвитку серцево-судинних ускладнень.
Катетеризація порожнин серця відіграє в діагностиці допоміжну роль і проводиться в тому випадку, коли клінічні дані суперечать результатам ехоКГ. Повне гемодинамічне і ангіографічне дослідження при мітральному стенозі включає катетеризацію правих і лівих відділів серця для визначення тиску у всіх чотирьох його камерах; особливо важливий вимір діастолічного градієнта на мітральному клапані. Коронарну ангіографію проводять у пацієнтів старшого віку при наявності факторів ризику розвитку ІХС.
Перебіг
Перебіг процесу визначається ступенем вираженості стенозу, наявністю легеневої гіпертензії і станом скорочувальної здатності міокарда ПШ. Мітральний стеноз у більшості пацієнтів неухильно прогресує, швидкість зменшення площі мітрального отвору становить 0,09–0,32 см2/рік. Після появи симптомів СН при проведенні медикаментозного лікування протягом 5 років вмирають 50% хворих.
Виділяють 5 стадій мітрального стенозу.
I стадія — повної компенсації. Гемодинамічні порушення зумовлені незначним звуженням мітрального отвору (площа його становить 2–2,5 см2), тиск у лівому передсерді підвищений до 10–15 мм рт. ст. Клінічні прояви мінімальні: скарги відсутні, працездатність не обмежена. На ЕКГ — ознаки перевантаження лівого передсердя (Р mitrale), рентгенологічно визначається незначне збільшення лівого передсердя і діаметра ЛА.
Хірургічне лікування не показане.
II стадія — легеневого застою. Характеризується звуженням мітрального отвору до 1,5–2 см2, тиск у лівому передсерді підвищується до 20–30 мм рт. ст. Клінічні симптоми: задишка при фізичному навантаженні, ознаки гіпертензії в малому колі кровообігу із частим розвитком ускладнень, працездатність обмежена, ознаки правошлуночкової декомпенсації відсутні. Аускультативно визначаються типові ознаки мітрального стенозу, акцент II тону над ЛА. На ЕКГ — Р mitrale, ознаки гіпертрофії ПШ. На ехоКГ — односпрямований П-подібний рух стулок мітрального клапана. При рентгенологічному дослідженні — збільшення лівого передсердя, ЛА, посилення легеневого малюнка, застійні явища в легенях. Порушення кровообігу відповідає I стадії СН. Показання до оперативного лікування відносні.
III стадія — правошлуночкової недостатності. Площа мітрального отвору становить 1–1,5 см2. Характеризується стійкою гіпертензією в малому колі кровообігу з утворенням «другого бар̓єра», посиленням роботи ПШ і розвитком його недостатності. Склерозування легеневих судин, зменшення легеневого кровотоку зумовлює зниження частоти або зникнення нападів серцевої астми і набряку легень. Дистрофічні зміни в паренхіматозних органах виражені помірно.
Клінічні симптоми: виражена задишка, блідість шкірних покривів, ціаноз, непереносимість фізичних навантажень, ознаки правошлуночкової декомпенсації, підвищення венозного тиску, збільшення печінки, значне розширення правих відділів серця. На ЕКГ виражений мітральний зубець Р, ознаки гіпертрофії ПШ, може визначатися фібриляція передсердь. Рентгенологічно — виражене збільшення ЛА, лівого передсердя, розширення ПШ і правого передсердя.
Показання до операції абсолютні.
IV стадія — дистрофічна. Площа мітрального отвору менше 1 см2. Характеризується вираженим порушенням кровообігу у великому і малому колах. Підвищується венозний тиск, з’являється застій крові в печінці, судинах нижніх кінцівок, набряки. При проведенні ехоКГ розміри серця значно збільшені за рахунок передсердь і ПШ, визначається відносна недостатність тристулкового клапана, виявляють кальциноз мітрального клапана, тромбоз лівого передсердя. Рентгенологічно — подальше збільшення серцевої тіні, посилення легеневого малюнка, розширення коренів легень.
Медикаментозне лікування дає незначний та короткочасний ефект.
Можливе проведення операції, але вона продовжує життя ненадовго.
V стадія — термінальна. Клініка відповідає III стадії СН. Характеризується тяжкими порушеннями кровообігу з незворотними дегенеративними змінами внутрішніх органів (печінки, нирок) та асцитом, атрофією м’язової системи. На ЕКГ — глибокі дистрофічні зміни міокарда, різні порушення ритму серця. Рентгенологічно визначається кардіомегалія, високе стояння куполу діафрагми, виражений застій в легенях, часто випотівання ексудату в плевральну порожнину. Медикаментозне лікування неефективне. Оперативне лікування не показане.
Лікування
Медикаментозна терапія спрямована на лікування та запобігання ускладнень. У пацієнтів молодого віку з гострою ревматичною лихоманкою в анамнезі зберігається високий ризик розвитку рецидиву, тому профілактичну антибіотикотерапію їм проводять постійно до досягнення дорослого віку.
Застосування діуретиків або органічних нітратів пролонгованої дії дозволяє тимчасово зменшити вираженість задишки. Блокатори β-адренорецепторів або блокатори кальцієвих каналів, що знижують ЧСС, здатні значно підвищити толерантність до фізичних навантажень за рахунок подовження діастоли і часу наповнення ЛШ.
Показанням для призначення антикоагулянтів є фібриляція передсердь, у пацієнтів з синусовим ритмом вони показані у випадку великих розмірів лівого передсердя (>50 мм), наявності спонтанного ехоконтрастування при проведенні трансезофагеальної ехоКГ, тромбоемболій в анамнезі і наявності тромбу в лівому передсерді.
Перед проведенням електричної кардіоверсії, якщо тривалість фібриляції передсердь становила ≥48 год, необхідне застосування антикоагулянтів протягом 3–4 тиж до і 4 тиж після кардіоверсії. Проведення кардіоверсії до операції не показане у хворих із тяжким мітральним стенозом, оскільки вона не відновлює синусовий ритм на тривалий період.
Мітральний стеноз найбільш успішно коригується хірургічними методами (вальвулопластика або ендопротезування клапана).
Мітральна комісуротомія проводиться у хворих з вираженим мітральним стенозом при наявності симптомів, що обмежують фізичну активність і знижують працездатність.
Черезшкірна мітральна комісуротомія показана хворим із площею отвору <1,5 см2:
- у пацієнтів з симптоматикою і оптимальними клінічними характеристиками;
- у пацієнтів із симптоматикою при наявності протипоказань або високого ризику оперативного втручання;
- як початкове втручання у пацієнтів з симптоматикою при несприятливому анатомічному стані клапана, але з оптимальними клінічними характеристиками;
- у безсимптомних пацієнтів з оптимальними клінічними характеристиками і високим ризиком розвитку тромбоемболічних ускладнень або декомпенсацією гемодинаміки (тромбоемболії в анамнезі, наявність спонтанного контрастування в лівому передсерді, нещодавно перенесена або пароксизмальна фібриляція передсердь, систолічний тиск у ЛА в стані спокою >50 мм рт. ст., необхідність у проведенні позасерцевого хірургічного втручання, планування вагітності).
Алгоритм лікування хворих із тяжким мітральним стенозом представлений на схемі 4.1.
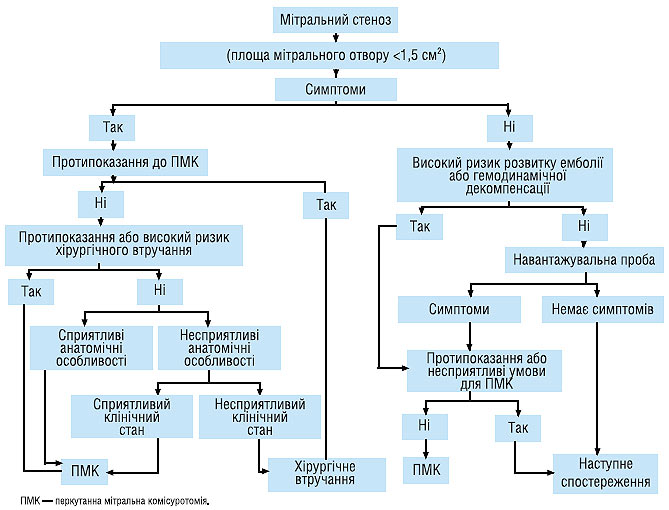
Схема. 4.1. Лікування хворих з тяжким мітральним стенозом
Протипоказанням для черезшкірної мітральної комісуротомії є:
- площа мітрального отвору >1,5 см2;
- тромб у лівому передсерді;
- помірна і тяжка мітральна регургітація;
- тяжка або бікомісуральна кальцифікація;
- тяжке супутнє ураження аортального клапана або тяжкий комбінований стеноз і недостатність тристулкового клапана;
- супутня ІХС, що вимагає проведення АКШ.
Поліпшення стану хворих після виконання мітральної комісуротомії настає в 70–89% випадків. Неефективність втручання зазвичай зумовлена пізнім направленням хворого до хірурга, вираженими морфологічними змінами серця та інших внутрішніх органів.
При наявності протипоказань до проведення черезшкірної мітральної комісуротомії єдиним альтернативним методом лікування є повномасштабне хірургічне втручання.
МІТРАЛЬНА НЕДОСТАТНІСТЬ
Етіологія
Зниження поширеності ревматичної лихоманки і збільшення тривалості життя в індустріальних країнах змінили причини виникнення цієї вади, у зв’язку з чим сьогодні в Європі домінує дегенеративна мітральна недостатність (61%) над ревматичною (14%). Іншими причинами виникнення вади є інфекційний ендокардит, системні захворювання сполучної тканини (системний червоний вовчак, системна склеродермія), ІХС.
Класифікація
За ступенем тяжкості мітральну недостатність поділяють на початкову (об’єм регургітації <30 мл за скорочення, фракція регургітації <30%, ефективна площа отвору регургітації <0,20 см2); помірну (об’єм регургітації 30–59 мл за скорочення, фракція регургітації 30–49%, ефективна площа отвору регургітації 0,20–0,39 см2); тяжкого ступеня (об’єм регургітації ≥60 мл за скорочення, фракція регургітації ≥50%, ефективна площа отвору регургітації ≥0,40 см2).
Патологічна анатомія
У результаті патологічного процесу утворюються крайові дефекти, скручування країв стулок клапана, стулки не замикаються в систолу ЛШ. Вкорочення і спаювання хорд призводить до обмеження рухливості стулок (частіше задньої). Для мітральної недостатності внаслідок інфекційного ендокардиту характерна крайова узурація стулок клапана або центральна їх перфорація. Часто виявляють відрив хорд, на кінцях розриву можуть бути свіжі або кальциновані вегетації.
Патологічна фізіологія
Гемодинамічні порушення при мітральній недостатності зумовлені поверненням частини крові із ЛШ у ліве передсердя, що викликає перевантаження об’ємом лівого передсердя і ЛШ, яке залежить від обсягу регургітації. Вада тривалий час компенсується потужним ЛШ, надалі розвивається дилатація лівого передсердя, і воно починає функціонувати як порожнина з низьким опором. Із часом ЛШ прогресивно розширюється, підвищується діастолічний тиск і знижується ФВ, причини цього ще до кінця не з’ясовані. Підвищується тиск заклинювання в легеневих капілярах і розвивається легенева гіпертензія і дисфункція ПШ. Із декомпенсацією останнього розвивається відносна недостатність тристулкового клапана і з’являються ознаки правосерцевої недостатності. Тривалі порушення кровообігу призводять до стійких змін у легенях, печінці, нирках та інших органах.
Клінічна картина
У фазі компенсації вада може бути виявлена випадково при медичному огляді. При зниженні скорочувальної функції ЛШ і підвищенні тиску в малому колі кровообігу виникають задишка при фізичному навантаженні і серцебиття. При зростанні застійних явищ у малому колі (капілярах) і симптомів правошлуночкової недостатності з’являються набряки на ногах і біль у правому підребер’ї, можуть виникати напади серцевої астми і задишка в стані спокою.
Хворих часто турбує біль у ділянці серця ниючого, колючого, давлячого характеру, не завжди пов’язаний з фізичним навантаженням.
При значній регургітації зліва від грудини відзначають серцевий горб, верхівковий поштовх посилений і поширений локалізується в V межребер’ї із зовнішнього боку від середньоключичної лінії.
Аускультативно визначається послаблення або повна відсутність I тону серця, часто над ЛА вислухується розщеплення II тону, на верхівці серця визначається глухий III тон. Акцент II тону над ЛА зазвичай виражений помірно і визначається при наявності застійних явищ у малому колі кровообігу.
Найбільш характерний систолічний шум, який добре вислуховується на верхівці серця, вздовж лівого краю грудини, проводиться в ліву пахвову ділянку, інтенсивність його варіює в широких межах і зазвичай зумовлена вираженістю клапанного дефекту. Тембр шуму різний — м’який, дуючий або грубий, може поєднуватися з пальпаторно відчутним систолічним тремтінням в ділянці верхівки. Систолічний шум може займати частину або всю систолу (пансистолічний шум).
Діагностика
На ЕКГ при вираженій недостатності мітрального клапана визначають ознаки гіпертрофії лівого передсердя і ЛШ у вигляді збільшеної амплітуди зубців комплексу QRS, частіше у поєднанні зі зміненою кінцевою частиною шлуночкового комплексу (сплощення, інверсія зубця Т, зниження сегмента ST) у відповідних відведеннях. При розвитку легеневої гіпертензії з’являються ознаки гіпертрофії ПШ і правого передсердя. Фібриляцію передсердь виявляють у 30–35% хворих.
При рентгенологічному дослідженні в передньозадній проекції серце збільшене в розмірах, більше вліво, серцева талія відсутня за рахунок значного збільшення лівого передсердя, що може досягати гігантських розмірів і виступати за правий контур серця у вигляді додаткової тіні.
ЕхоКГ є принципово важливим дослідженням і повинна включати оцінку механізмів виникнення вади, морфологію клапана і його функцію, тяжкість мітральної регургітації, функцію ПШ і ЛШ. ЛШ може бути нормальних розмірів або дилатований залежно від тяжкості і тривалості мітральної регургітації, ліве передсердя дилатоване, особливо значно при наявності фібриляції передсердь.
При допплєрівській ехоКГ можлива оцінка ступеня вираженості мітральної регургітації. Пряма ознака вади — турбулентний систолічний потік крові в порожнині лівого передсердя, що корелює з вираженістю регургітації (рис. 4.4а, б).

a
б
Рис. 4.4. Мітральна недостатність: а) режим колірного допплєрівского картування, апікальна чотирикамерна позиція; б) колірний М-режим
Тяжкість мітральної регургітації оцінюють напівкількісним методом, що ґрунтується на величині (довжина, площа) потоку регургітації або кількісним методом із урахуванням об’єму і фракції регургітації і ефективної площі отвору регургітації.
Розроблено ехоКГ-критерії тяжкої органічної мітральної недостатності. До специфічних ознак відносять наступні:
- розмір vena contracta ≥0,7 см із великим центральним потоком мітральної регургітації площею >40% лівого передсердя або пристінковим потоком будь-якого розміру, що циркулює в лівому передсерді (рис. 4.5);
- широка конвергенція потоку (радіус ≥0,9 см);
- систолічний зворотний потік у легеневих венах;
- патологічна рухливість мітрального клапана або розрив папілярного м’яза.

Рис. 4.5. Мітральна недостатність. В-режим, парастернальна позиція, довга вісь. Візуалізація vena contracta
Додаткові ознаки тяжкої мітральної недостатності наступні:
- інтенсивний трикутний потік мітральної регургітації при постійнохвильовій допплєрографії (рис. 4.6);
- переважання піка Е трансмітрального потоку (Е >1,2 м/с) (рис. 4.7);
- збільшення розмірів лівого передсердя і ЛШ (особливо при нормальній функції останнього).

Рис. 4.6. Мітральна недостатність. Режим постійнохвильового допплєра
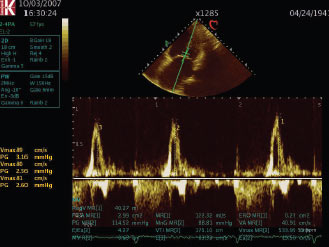
Рис. 4.7. Мітральна недостатність. Режим імпульсно-хвильового допплєра
Кількісні критерії тяжкої мітральної недостатності включають величину об’єму регургітації ≥60 мл за скорочення, фракцію регургітації ≥50%, ефективну площу отвору регургітації ≥0,40 см2.
Черезстравохідну ехоКГ проводять перед оперативним втручанням для точного визначення характеру ушкодження клапана, а також інтраопераційної оцінки необхідності додаткової корекції. У випадку недостатньої інформативності трансторакальної ехоКГ уточнюють діаметр лівого передсердя і ЛШ, ФВ, систолічний тиск у ЛА, тяжкість мітральної регургітації.
Стрес-ехоКГ використовують для оцінки функціонального значення мітральної регургітації, особливо у безсимптомних хворих, а також для виявлення прихованої дисфункції ЛШ.
При катетеризації порожнин серця визначають підвищений тиск у ЛА. На кривій легенево-капілярного тиску видно характерну картину у вигляді збільшення хвилі V більше ніж на 15 мм рт. ст. із швидким і крутим падінням. При проведенні вентрикулографії можна спостерігати, як контрастна речовина в систолу ЛШ заповнює порожнину лівого передсердя. Інтенсивність контрастування останнього залежить від ступеня недостатності мітрального клапана.
Перебіг
Виділяють 5 стадій перебігу мітральної недостатності.
I стадія — компенсації. Характеризується мінімальною регургітацією крові крізь мітральний отвір, порушення гемодинаміки практично відсутні. Клінічно виявляється невеликий систолічний шум на верхівці серця, незначне збільшення лівого передсердя. За даним ехоКГ визначається незначна регургітація на мітральному клапані. Оперативне лікування не показане.
II стадія — субкомпенсації. Зворотній плин крові у ліве передсердя збільшується, порушення гемодинаміки призводять до його дилатації і ГЛШ, що дозволяє ефективно компенсувати порушення гемодинаміки. Має місце незначне обмеження фізичної активності, задишка виникає лише при значному фізичному навантаженні. Визначається систолічний шум середньої інтенсивності на верхівці серця. На ЕКГ відхилення електричної осі вліво, у деяких випадках — ознаки перевантаження лівих відділів серця. При рентгенологічному дослідженні визначається збільшення і посилення пульсації лівих відділів серця. При ехоКГ помірна регургітація на мітральному клапані. Оперативне лікування не показане.
III стадія — правошлуночкової декомпенсації настає при значній регургітації крові в ліве передсердя. Періодично виникає декомпенсація серцевої діяльності, що усувається медикаментозною терапією. При фізичному навантаженні виникає задишка. Грубий систолічний шум на верхівці серця, що іррадіює у пахвову ділянку. На ЕКГ — ознаки ГЛШ. При рентгенологічному дослідженні виявляється значне збільшення лівих відділів серця, посилення їх пульсації — симптом «коромисла». При ехоКГ відзначають значну регургітацію на мітральному клапані. Показано хірургічне лікування.
IV стадія — дистрофічна, характеризується появою правошлуночкової недостатності. При огляді визначається посилення верхівкового поштовху, пульсація венозних судин шиї. При аускультації, крім грубого систолічного шуму мітральної недостатності, нерідко відзначаються різні шуми, що виникають внаслідок дилатації фіброзних кілець, появи недостатності тристулкового клапана. На ЕКГ — ознаки ГЛШ або обох шлуночків, фібриляція передсердь, екстрасистолічна аритмія. При рентгенологічному дослідженні — значне розширення серця, застій крові в малому колі кровообігу. Порушення функції нирок і печінки. Працездатність втрачена. Показане хірургічне лікування.
V стадія — термінальна, клінічно відповідає III стадії СН. Дистрофічна стадія порушення кровообігу з тяжкими незворотними змінами внутрішніх органів (печінки, нирок), асцитом. Хірургічне лікування не проводиться.
Предикторами поганого прогнозу є вік, наявність клінічних симптомів, фібриляції передсердь, тяжка ступінь мітральної регургітації, дилатація лівого передсердя і ЛШ, низька ФВ, прогресування легеневої гіпертензії.
Лікування
Усім хворим показане профілактичне застосування антибіотиків перед проведенням стоматологічних або інших оперативних втручань для зниження ризику розвитку інфекційного ендокардиту.
Основним є лікування основного захворювання у пацієнтів з ІХС або інфекційним ендокардитом.
Показанням для призначення антикоагулянтів є постійна або пароксизмальна форма фібриляції передсердь. У хворих із синусовим ритмом їх призначення показано у випадку вказівок на тромбоемболічні епізоди в анамнезі або при наявності тромбу в лівому передсерді, а також протягом перших 3 міс після хірургічного відновлення клапана (значення показника МНО слід підтримувати в межах 2,0–3,0).
На сьогодні немає доказів ефективності застосування вазодилататорів, включаючи інгібітори АПФ, у пацієнтів без ознак СН, тому їх застосування таким хворим не рекомендується. З іншого боку, при наявності СН інгібітори АПФ показані у випадку значної мітральної недостатності і вираженої клінічної симптоматики при наявності протипоказань до оперативного лікування або при наявності резидуальних симптомів після оперативного лікування, зазвичай у результаті порушеної функції ЛШ.
СН, що розвивається, лікують загальноприйнятими методами, за показаннями призначають сечогінні препарати, блокатори β-адренорецепторів і спіронолактон.
Основною метою хірургічного втручання є зменшення вираженості клінічної симптоматики, збереження функції ЛШ, попередження/зменшення вираженості легеневої гіпертензії і дисфункції ПШ, підтримка й/або відновлення синусового ритму.
Показанням до проведення реконструктивних операцій є вади без грубих змін стулок, хорд, сосочкових м’язів і при відсутності кальциноза клапанів. При тяжкій мітральній недостатності відновлення клапана — оптимальний хірургічний підхід. Кращі результати отримують, якщо у хворих до операції визначається ФВ >60% і величина кінцево-систолічного розміру <45 мм.
У випадках неможливості відновлення клапана доцільно проводити заміну клапана механічним або біологічним протезом із збереженням природного апарату мітрального клапана.
Алгоритм лікування тяжкої мітральної недостатності представлений на схемі 4.2. Протезування мітрального клапана у більшості пацієнтів забезпечує продовження життя, а також відновлення працездатності в післяопераційний період.

Схема 4.2. Лікування хронічної тяжкої мітральної недостатності
Немає єдиного погляду відносно хірургічного лікування безсимптомних хворих, оскільки відсутні результати рандомізованих досліджень відносно даної проблеми. У окремих груп безсимптомних пацієнтів із тяжкою мітральною недостатністю хірургічне лікування показане при наявності ознак дисфункції ЛШ (величина ФВ не більше 60% й/або кінцево-систолічного розміру >45 мм), у хворих із фібриляцією передсердь і збереженою функцією ЛШ, із збереженою функцією ЛШ і легеневою гіпертензією.
АОРТАЛЬНИЙ СТЕНОЗ
Епідеміологія
На сьогодні аортальний стеноз є найбільш поширеною набутою вадою серця, яка виявляється серед жителів Європи і Північної Америки. Найбільш часто діагностують кальцинуючий аортальний стеноз (2–7%) у віковій популяції старше 65 років, частіше у чоловіків.
Етіологія
Ревматизм як етіологічний фактор стенозу устя аорти на сьогодні визначається рідко (11%). У розвинених країнах у пацієнтів старшого віку найбільш частою причиною вади є дегенеративний кальцинуючий процес на аортальному клапані (82%). У третини хворих з двостулковим аортальним клапаном прогресує фіброз стулок внаслідок ушкодження тканини клапана і прискорення атерогенних процесів, що призводить до виникнення аортального стенозу. Підвищений рівень холестерину, дисліпідемія, паління, вік можуть прискорювати фіброзні процеси і розвиток аортального стенозу.
Класифікація
За ступенем тяжкості виділяють незначний аортальний стеноз (площа отвору >1,8 см2, максимальний градієнт тиску 10–35 мм рт. ст.); помірний (площа отвору 1,2–0,75 см2, максимальний градієнт тиску 36–65 мм рт.ст.); тяжкий (площа отвору <0,75 см2, максимальний градієнт тиску >65 мм рт. ст.).
Патологічна анатомія
Стулки аортального клапана потовщуються і ущільнюються внаслідок появи фіброзних нашарувань на шлуночковій стороні клапана, а також розростання тканини клапана внаслідок механічного подразнення інтенсивним кровотоком. Вільні краї стулок спаюються, що призводить до поступового звуження аортального отвору, яке починається в місці кріплення клапанних листків до фіброзного кільця і поширюється у напрямку центру. Внаслідок завихрення потоку крові з обох сторін клапанів на шлуночковій поверхні клапана відбувається відкладення пластин фібрину, які фіксуються на комісурах, утворюються містки, що зв’язують стулки клапана між собою та стінкою аорти. Надалі пластини організуються і утворюється фіброзна тканина. У тканинах клапана розвиваються дегенеративні процеси, які завершуються кальцинозом, що може поширюватися на навколишні структури — міжшлуночкову перегородку, передню стулку мітрального клапана, стінку ЛШ.
Стенозований отвір може мати трикутну, щілиноподібну або округлу форму, розміщується найчастіше ексцентрично.
Міокард ЛШ гіпертрофований, у ньому розвиваються дистрофічні зміни — білкове і жирове переродження м’язових волокон, а надалі — дифузний і вогнищевий склероз. Унаслідок гіпертрофії міокарда маса серця може досягати 1200 мг і більше.
При зменшенні площі отвору до 0,8–1 см2 виникають гемодинамічні прояви вади і реєструється систолічний градієнт тиску між аортою та ЛШ. Виражені порушення гемодинаміки із градієнтом до 100 мм рт. ст. і вище визначають при стенозуванні отвору до 0,5–0,6 см2 (величина градієнта обернено пропорційна площі устя аорти).
Компенсація при аортальному стенозі здійснюється переважно за рахунок ізометричної гіперфункції і ГЛШ, подовження фази вигнання. Ступінь вираженості ГЛШ пропорційна тяжкості стенозу і тривалості захворювання. У подальшому порожнина ЛШ розширюється, виникає спочатку тоногенна, а потім міогенна дилатація.
Поява застою і гіпертензії в малому колі кровообігу відноситься до пізніх ознак вади, праві відділи серця включаються в патологічний процес при «мітралізації» вади і розвитку легеневої гіпертензії.
Клінічна картина
При невеликих анатомічних змінах аортального клапана пацієнти не скаржаться і багато років зберігають досить високу працездатність, можуть виконувати роботу, пов’язану з великими фізичними навантаженнями, і навіть займатися спортом. Іноді першими ознаками вади можуть бути симптоми СН.
Гемодинамічні порушення супроводжуються підвищеною стомлюваністю, зумовленою централізацією кровообігу. Ця ж причина викликає запаморочення і випадки непритомності. Часто (35%) відзначають біль, подібний до болю при стенокардії. При розвитку декомпенсації вади основними стають скарги на задишку при фізичному навантаженні. Неадекватне фізичне навантаження може спровокувати набряк легень. Поява нападів серцевої астми, що поєднується з нападами стенокардії розглядається як прогностично несприятлива ознака.
При огляді відзначають блідість шкірних покривів. При вираженому аортальному стенозі пульс малий і повільний, систолічний і пульсовий тиск знижений. Верхівковий поштовх потужний, поширений, що піднімає передню грудну стінку, зміщений вниз і вліво. Пальпаторно в ділянці рукоятки грудини відчувається виражене систолічне тремтіння. Перкуторні межі відносної серцевої тупості зміщені вліво і вниз (до 20 мм і більше).
Аускультативно у другому міжребер’ї справа від грудини визначається послаблення II тону, а також систолічний шум, що проводиться в усі точки серця, на судини шиї, переважно вправо і на спину, з піком в другій половині систоли. Іноді шум вислуховується на відстані (дистанційний шум). Зникнення II аортального тону специфічно для вираженої вади.
Діагностика
На ЕКГ при прогресуванні вади визначаються ознаки ГЛШ у вигляді збільшеної амплітуди зубців комплексу QRS у відповідних відведеннях, часто у поєднанні зі зміненою кінцевою частиною шлуночкового комплексу. На пізній стадії вади визначаються високі розщеплені зубці РІ і РІІ та низькі зубці РІІІ. Нерідко реєструються різного ступеня порушення передсердно-шлуночкової провідності: від подовження інтервалу P–Q до повної AV-блокади.
Рентгенологічне дослідження має важливе значення: на ранніх етапах виявляється помірне розширення серця вліво і подовження дуги ЛШ із заокругленням верхівки. При тривалому перебігу вади і вираженому стенозі серце має типову аортальну конфігурацію. При розвитку відносної недостатності мітрального клапана визначається збільшення розмірів лівого передсердя і поява рентгенологічних ознак застою в малому колі кровообігу.
ЕхоКГ має основне діагностичне значення, з її допомогою верифікують ваду, оцінюють ступінь кальцинації клапана, гіпертрофії міокарда (масу ЛШ) і функцію ЛШ (рис. 4.8а, б). При двомірній ехоКГ виявляється потовщення і кальцинація стулок аортального клапана із зменшенням їх рухливості. Методом допплєрографії можна провести точну оцінку ступеня тяжкості вади, величину систолічного градієнта і площу аортального отвору, оскільки величина трансклапанного градієнта тиску залежить від кровотоку. Також визначаються ознаки діастолічної дисфункції за типом порушення релаксації ЛШ. Величина стенозування <1 см2 розцінюється як тяжка вада (рис. 4.9).
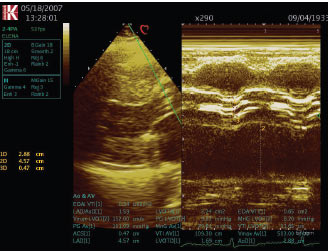
а

б
Рис. 4.8. Аортальний стеноз, ГЛШ. М-режим: а) рівень аортального клапана; б) рівень ЛШ
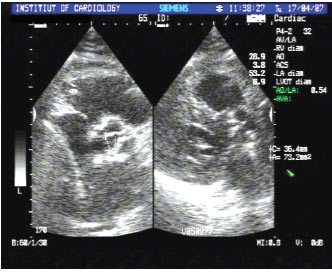
Рис. 4.9. «Критичний» аортальний стеноз (площа отвору 0,6 см2, градієнт тиску на аортальному клапані 99 мм рт. ст.). В-режим, парастернальна позиція, коротка вісь, на рівні аортального клапана
Катетеризація правих відділів дозволяє визначити тиск у лівому передсерді, ПШ і у ЛА, що дозволяє визначити ступінь компенсації вади. Ретроградна катетеризація ЛШ дозволяє за величиною систолічного градієнта між ЛШ і аортою визначити ступінь стенозування аортального отвору.
Навантажувальні тести протипоказано проводити симптомним хворим, але вони застосовуються для виявлення симптомів і стратифікації ризику у безсимптомних пацієнтів із тяжким аортальним стенозом.
При необхідності для оцінки стану висхідної аорти проводять КТ або МРТ.
Перебіг
Виділяють 5 стадій аортального стенозу.
I стадія — повної компенсації. Скарги відсутні, вади виявляють лише при аускультації. На ехоКГ визначається невеликий максимальний градієнт систолічного тиску на аортальному клапані (до 35 мм рт. ст.). Хірургічне лікування не показане.
II стадія — прихованої СН. Хворі скаржаться на підвищену втомлюваність, задишку при фізичному навантаженні, запаморочення. Крім аускультативних ознак аортального стенозу виявляють рентгенологічні та електрокардіографічні ознаки ГЛШ. При ехоКГ-дослідженні визначається помірний градієнт систолічного тиску на аортальному клапані (до 65 мм рт. ст.). Показано хірургічне лікування.
III стадія — відносної коронарної недостатності. Пацієнти скаржаться на біль стенокардичного характеру, задишку, що прогресує, запаморочення і непритомність після фізичних навантажень. Визначається значне збільшення розмірів серця, переважно за рахунок ЛШ. На ЕКГ — виражені ознаки ГЛШ, гіпоксії міокарда. При проведенні ехоКГ визначається максимальний градієнт систолічного тиску >65 мм рт. ст. Показане хірургічне лікування.
IV стадія — вираженої лівошлуночкової недостатності. Скарги подібні таким, як при III стадії, але більш виражені. Періодично виникають напади пароксизмальної задишки вночі, серцевої астми, з’являється набряк легень, збільшення печінки. На ЕКГ — ознаки порушення коронарного кровообігу, часто — фібриляція передсердь. При проведенні ехоКГ на фоні вираженого погіршення показників скорочувальної функції ЛШ визначається значний градієнт систолічного тиску на аортальному клапані, часто кальциноз клапана. При рентгенологічному дослідженні визначається збільшення ЛШ та інших відділів серця, а також застійні явища в легенях.
Постільний режим і консервативна терапія сприяють тимчасовому поліпшенню стану окремих хворих. Хірургічне лікування в більшості випадків неможливе, питання вирішується індивідуально.
V стадія — термінальна, характеризується прогресуючою недостатністю ЛШ і ПШ. Різко виражені всі суб’єктивні і об’єктивні ознаки вади. Стан хворого вкрай тяжкий, лікування неефективне, хірургічне лікування не проводять.
Лікування
Прогресування дегенеративного аортального стенозу є активним процесом, що має багато подібного з атеросклерозом, у зв’язку з чим рекомендується підхід, аналогічний такому для вторинної профілактики атеросклерозу.
Незважаючи на те що у кількох ретроспективних повідомленнях показаний позитивний ефект від застосування статинів та інгібіторів АПФ, ці дані суперечливі та є недостатніми для внесення до рекомендацій.
Специфічних консервативних методів лікування аортального стенозу немає. При неможливості оперативного лікування, СН, що розвивається, лікують із застосуванням діуретиків, серцевих глікозидів, інгібіторів АПФ або антагоністів рецепторів ангіотензину II. Блокатори β-адренорецепторів призначати таким пацієнтам не слід. При супутній АГ дозу антигіпертензивних препаратів варто обережно титрувати з метою уникнення гіпотензії.
Для підтримки синусового ритму застосовують антиаритмічні препарати.
Усім хворим з аортальним стенозом показана медикаментозна профілактика ендокардиту.
Радикальний метод лікування аортального стенозу — хірургічне лікування, абсолютних протипоказань до операції немає, крім термінальної стадії СН. Алгоритм лікування тяжкого аортального стенозу представлений на схемі 4.3.
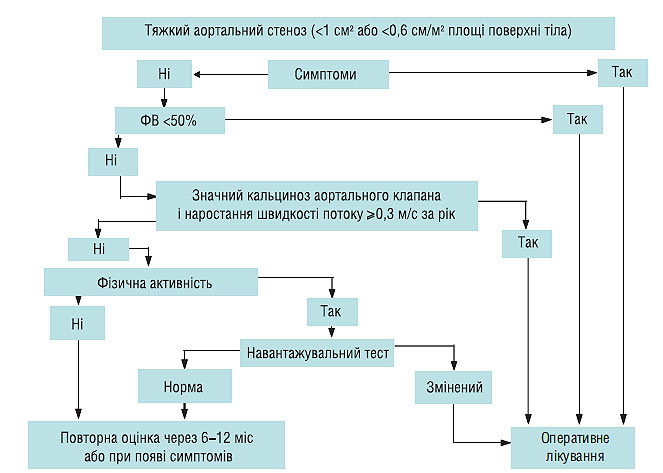
Схема 4.3. Лікування тяжкого аортального стенозу
Балонна вальвулопластика має обмежене значення у дорослих пацієнтів у зв’язку з її низькою ефективністю, а також високим рівнем ускладнень (>10%), рестенозів і клінічного погіршення у більшості пацієнтів протягом 6–12 міс після втручання.
Доцільність перкутанної заміни клапана на ранніх стадіях потребує подальшого вивчення для оцінки її ефективності. Немає єдиної думки щодо терапії безсимптомних хворих із тяжким аортальним стенозом.
При вчасно проведеній операції віддалені результати хороші.
Прогноз
Середня тривалість життя після появи виражених симптомів СН не перевищує 1 року. Вважають, що з появою випадків непритомності, стенокардії або лівошлуночкової недостатності тривалість життя обмежується 2–4 роками. Смерть настає від хронічної недостатності кровообігу, а також раптово внаслідок коронарної недостатності або фібриляції шлуночків (14–18% випадків), не завжди вдається усунути у хворого набряк легень.
Нещодавно визначені предиктори прогресування і поганого прогнозу аортального стенозу у безсимптомних пацієнтів, серед яких до клінічних належать старший вік і наявність чинників ризику атеросклерозу, до ехоКГ-предикторів належать кальцинація клапана, максимальна швидкість потоку, ФВ ЛШ, прогресування гемодинамічних розладів і збільшення градієнта тиску при навантаженні, а також поява симптомів при проведенні навантажувальних тестів.
АОРТАЛЬНА НЕДОСТАТНІСТЬ
Епідеміологія
Частота виявлення вад серця залежить від методів дослідження, що використовуються з метою діагностики. Загальна розповсюдженість аортальної недостатності становила 4,9% у Фремінгемському дослідженні і 10% — в строгому дослідженні серця, з них аортальна недостатність середнього або тяжкого ступеня становила 0,5 і 2,7% відповідно. Поширеність цієї вади збільшується з віком, при цьому клінічні прояви тяжкої аортальної недостатності частіше визначають у чоловіків, ніж у жінок.
Етіологія
Найчастіша причина захворювання останнім часом пов̓язана із захворюванням висхідної аорти (аневризма) і двостулкового аортального клапана, у 50% причиною є дегенеративні зміни аортального клапана. Менш частими причинами можуть бути ревматизм (15%), атеросклероз, інфекційний ендокардит (8%).
Класифікація
За ступенем тяжкості виділяють початкову аортальну недостатність (об’єм регургітації <30 мл за скорочення, фракція регургітації <30%, ефективна площа отвору регургітації <10 см2), помірну (об’єм регургітації 30–59 мл за скорочення, фракція регургітації 30–49%, ефективна площа отвору регургітації 0,10–0,29 см2), тяжку аортальну недостатність (об’єм регургітації ≥60 мл за скорочення, фракція регургітації ≥50%, ефективна площа отвору регургітації ≥0,30 см2).
Патологічна анатомія
Морфологічні зміни виявляють переважно у сполучній тканині клапана аорти: стулки вкорочуються і деформуються, краї їх стають товстішими, вільний край може підвертатися, стулка часто провисає. Всі ці зміни призводять до незмикання стулок клапана в діастолу.
При інфекційному ендокардиті недостатність клапана виникає внаслідок перфорації, розриву стулок або руйнування його вільного краю. Після гострого інфекційного процесу деформація може продовжуватися внаслідок формування рубцевої деформації (зморщування) та кальцинації.
ЛШ збільшений, визначається ГЛШ і дилатація його порожнини, маса серця досягає 1000–1300 г. При гістологічному дослідженні виявляються зміни запального і дегенеративного характеру.
Патологічна фізіологія
Недостатність аортального клапана характеризується значними порушеннями центральної і периферичної гемодинаміки, які зумовлені регургітацією крові в ЛШ у період діастоли, що веде до його об’ємного перевантаження і підвищення діастолічного розтягнення міокарда з наступним збільшенням сили його скорочення.
Необхідний капілярний тиск підтримується за рахунок скорочення діастолічного періоду. У підтримці компенсації кровообігу має значення активна зміна тонусу периферичних судин: тимчасове його зниження в систолу і підвищення в період діастоли ЛШ. Зворотний потік крові в ЛШ різко збільшує обсяг виконуваної ним роботи. Спочатку ЛШ збільшується, потім гіпертрофується, при цьому маса міокарда може збільшуватися втричі. Виснаження функціональних резервів призводить до підвищення діастолічного тиску в ЛШ, його дилатації і відносної недостатності мітрального клапана з наступною легеневою гіпертензією.
Клінічна картина
Багато в чому залежить від темпів формування та величини дефекту клапана. У фазі компенсації суб’єктивні відчуття звичайно відсутні. Поступово прогресуюча вада має сприятливий перебіг навіть при значній величині аортальної регургітації. При швидкому розвитку великих дефектів симптоматика стрімко прогресує і призводить до СН.
Деякі хворі відчувають серцебиття, запаморочення. Приблизно у 50% хворих з недостатністю аортального клапана атеросклеротичної або сифілітичної етіології провідним симптомом є стенокардія. Задишка виникає спочатку при значному фізичному навантаженні, при подальшому розвитку лівошлуночкової недостатності — у стані спокою і нагадує серцеву астму. Іноді перебіг раптово може ускладнитися набряком легень внаслідок лівошлуночкової недостатності.
Для вираженої недостатності аортального клапана характерні периферичні симптоми, зумовлені значними перепадами тиску в судинному руслі: блідість шкірного покриву, пульсація сонних («танець каротид»), скроневих і плечових артерій, синхронні струшуючі рухи голови (симптом Мюссе), пульсуюче звуження зіниць (симптом Ландольфі), капілярний пульс — ритмічна зміна інтенсивності забарвлення піднебінного язичка і мигдалин (симптом Мюллера), нігтьового ложа (симптом Квінке).
Під час огляду визначається високий і швидкий пульс (пульс Корригана), посилений і поширений верхівковий поштовх, межі серця розширені вліво і вниз. Над великими судинами вислуховується подвійний тон Траубе, при натисканні стетоскопом на клубову артерію в ділянці пупартової зв’язки виникає подвійний шум Дюроз’є. САТ частіше підвищений до 160–180 мм рт. ст., а ДАТ різко знижений — до 50–30 мм рт. ст.
Аускультативно виявляють основну характерну ознаку: діастолічний шум, що починається відразу за II тоном, заглушає останній у звʼязку з великою інтенсивністю та поступово слабшає до кінця діастоли. При перфорації стулок шум набуває дзвінкий, «музичний» відтінок. Із розвитком СН ознаки вади стають менш вираженими, інтенсивність і тривалість діастолічного шуму зменшується.
Діагностика
На ЕКГ при вираженій аортальній недостатності визначаються відхилення електричної осі серця вліво, ознаки ГЛШ у вигляді збільшеної амплітуди зубців комплексу QRS у відповідних відведеннях, частіше у поєднанні зі зміненою кінцевою частиною шлуночкового комплексу (сплощення, інверсія зубця Т, зниження сегмента ST). Іноді визначається подовження інтервалу P–Q, що свідчить про порушення AV-провідності.
Рентгенологічне дослідження виявляє збільшення розмірів серця: ЛШ масивний, збільшений, із заокругленою верхівкою. Висхідна частина аорти розширена, виступає з правого боку контуру тіні серця, з лівого боку контуру визначається розширена дуга аорти. Серце набуває аортальної конфігурації.
ЕхоКГ і допплєрографія є важливими методами діагностики і оцінки ступеня тяжкості аортальної недостатності. Метод дозволяє провести оцінку причини та механізму виникнення аортальної регургітації, визначити морфологію клапана, а також стан і розміри аорти на 4 різних рівнях (кільце, синус Вальсальви, синотубулярне з’єднання та висхідна аорта), оцінити ФВ ЛШ, розміри і ступінь ГЛШ. Для діагностики і визначення ступеня тяжкості вади використовують колірну і постійнохвильову допплєрографію, за допомогою якої можна візуалізувати потік аортальної регургітації (рис. 4.10).

Рис. 4.10. Аортальна недостатність. Режим постійнохвильового допплєра
Черезстравохідну ехоКГ застосовують для більш чіткої оцінки морфології клапана та висхідної аорти, особливо перед плановим хірургічним втручанням.
Розроблені ехоКГ-критерії тяжкої аортальної недостатності. До специфічних ознак відносять наступні:
- центральний потік становить не менше 65% виносного тракту ЛШ;
- розмір vena contracta >0,6 см (рис. 4.11).
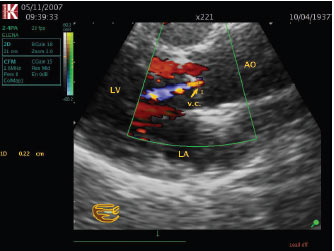
Рис. 4.11. Аортальна недостатність. Парастернальна позиція, довга вісь. Візуалізація vena contracta
До ймовірних ознак тяжкої аортальної недостатності відносять наступні:
- час напівспаду тиску <200 мс;
- голодіастолічний аортальний потік в низхідну аорту;
- помірне або значне розширення ЛШ.
Кількісні критерії тяжкої аортальної недостатності включають величину об’єму регургітації не менше 60 мл за скорочення, фракцію регургітації не менше 50%, ефективну площу отвору регургітації не менше 0,30 см2 (рис. 4.12).
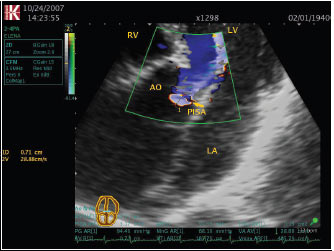
Рис. 4.12. Аортальна недостатність. Апікальна п’ятикамерна позиція, ZOOM. Дослідження за допомогою методу PISA
На сьогодні клінічне рішення не базується ні на зміні ФВ при навантаженнях, ні на даних стрес-ехоКГ, оскільки ці параметри не можна адекватно оцінити.
Катетеризація правих відділів серця дозволяє визначити рівень легенево-капілярного тиску і потік регургітації. Катетеризація лівих відділів серця дозволяє виявити збільшення амплітуди пульсового тиску. При аортографії визначається виражена регургітація з аорти в ЛШ. Ангіографію коронарних артерій проводять до операції протезування аортального клапана у пацієнтів із високим ризиком розвитку ІХС. При необхідності хворим можна проводити МРТ для визначення ступеня тяжкості регургітації і функції ЛШ, особливо при недостатній візуалізації за даними ехоКГ. МРТ або КТ рекомендується проводити для оцінки стану аорти при ознаках її розширення, виявлених при ехоКГ, особливо при наявності двостулкового аортального клапана або синдрому Марфана.
Перебіг
Виділяють 5 стадій недостатності аортального клапана.
I стадія — компенсації, характеризується початковими симптомами вади при відсутності скарг. При ехоКГ визначається незначна регургітація на аортальному клапані. Хірургічне лікування не показане.
II стадія — прихованої СН. Має місце помірне зниження працездатності при виражених клінічних ознаках вади. Визначаються характерні фізикальні дані вади, підвищення пульсового тиску. На ЕКГ — ознаки помірної ГЛШ. При рентгенологічному дослідженні — помірне збільшення і посилення пульсації ЛШ. При проведенні ехоКГ визначається помірна регургітація на аортальному клапані. Хірургічне лікування не показане.
III стадія — субкомпенсації, визначається значне зниження фізичної активності, напади ангінозного болю. Посилена пульсація сонних артерій, мінімальний АТ звичайно становить менше половини максимального. На ЕКГ — ознаки вираженої гіпоксії міокарда і ГЛШ. При рентгенологічному обстеженні визначають дилатацію і посилену пульсацію ЛШ і аорти. При ехоКГ визначається значна регургітація на аортальному клапані. Показане хірургічне лікування.
IV стадія — декомпенсації. Проявляється вираженою задишкою і нападами ангінозного болю при незначному фізичному навантаженні, визначається значна дилатація серця, яка зумовлює відносну мітральну недостатність, подальше погіршення функції міокарда, прогресування коронарної недостатності. Виражені розлади кровообігу, які проявляються серцевою астмою, збільшенням печінки та ін. Застосування медикаментозної терапії і постільний режим сприяють лише тимчасовому поліпшенню стану хворих. Показане хірургічне лікування.
V стадія — термінальна, клінічно відповідає III стадії СН і характеризується прогресуючою недостатністю ЛШ і ПШ, глибокими дегенеративними змінами внутрішніх органів (периферичні набряки, асцит, трофічні порушення). Медикаментозне лікування неефективне. Хірургічне лікування не проводять.
Лікування
Специфічних консервативних методів лікування аортальної недостатності немає. СН, що розвивається, лікують, використовуючи загальноприйняті методи. Препаратами вибору при наявності протипоказань для хірургічного лікування або при персистуючій післяопераційній дисфункції ЛШ є інгібітори АПФ.
У безсимптомних хворих з АГ показано застосування вазодилататорів (інгібітори АПФ або дигідропіридинові антагоністи кальцієвих каналів). Роль вазодилататорів у безсимптомних пацієнтів без гіпертензії для відстрочки оперативного втручання не доведена.
При тяжкій аортальній недостатності блокатори β-адренорецепторів призначають дуже обережно, оскільки подовження діастоли збільшує об’єм регургітації, проте дані препарати можна використовувати у пацієнтів з вираженою дисфункцією ЛШ.
У хворих із синдромом Марфана блокатори β-адренорецепторів уповільнюють прогресування дилатації аорти, їх призначення також показано після оперативного втручання.
У хворих необхідно проводити антибіотикопрофілактику перед інвазивними процедурами.
На хірургічне лікування слід направляти всіх пацієнтів із симптомною аортальною недостатністю. Метою оперативного втручання є покращання виживаності, зменшення вираженості симптоматики, попередження розвитку післяопераційної СН та аортальних ускладнень у хворих з аневризмою аорти. Абсолютних протипоказань до операції немає, крім термінальних стадій СН. При вчасно проведеній операції віддалені результати хороші.
Показання для оперативного втручання при тяжкій аортальній недостатності:
- симптомні хворі (задишка, II–IV ФК за NYHA або стенокардія);
- безсимптомні хворі з ФВ ЛШ у спокої не більше 50%;
- хворі, у яких проводять АКШ або операцію на висхідній аорті або на іншому клапані;
- безсимптомні хворі з ФВ ЛШ >50% у стані спокою з вираженою дилатацією ЛШ (кінцево-діастолічний розмір >70 мм або кінцево-систолічний розмір >50 мм).
Алгоритм лікування аортальної недостатності представлений на схемі 4.4.

Схема 4.4. Лікування аортальної недостатності
Незалежно від ступеня тяжкості аортальної недостатності операція показана хворим з максимальним діаметром кореня аорти не менше 45 мм з синдромом Марфана, не менше 50 мм із двостулковим аортальним клапаном і не менше 55 мм у всіх інших хворих.
Прогноз
У середньому від часу появи суб’єктивних симптомів до летального результату проходить 6,5 року. Швидко формується СН у хворих із відривом стулки або із значним руйнуванням клапана при інфекційному ендокардиті, середня тривалість життя цих хворих не перевищує 1 року. Більш сприятливий перебіг має недостатність аортального клапана атеросклеротичної етіології, що рідко призводить до великих дефектів стулок клапана.
ТРИКУСПІДАЛЬНИЙ СТЕНОЗ
Етіологія
Найбільш частою причиною набутої вади тристулкового клапана є ревматизм (>90%) і карциноїдний синдром (10–50%). Серед інших причин можна назвати травми, пухлини правого передсердя та інфекційний ендокардит (у ін’єкційних наркоманів).
Патологічна анатомія
Морфологічно визначають склероз стулок, фіброзного кільця, сухожильних хорд і верхівок сосочкових м’язів. При ревматичному ураженні тристулкового клапана відбувається потовщення та вкорочення стулок, зрощення комісур.
Патологічна фізіологія
При стенозі отвору тристулкового клапана переміщення крові із правого передсердя в ПШ відбувається при наявності градієнта тиску між ними, що збільшується на вдиху або при навантаженні і зменшується на видиху. Компенсація кровообігу у певних межах відбувається за рахунок розширення і гіпертрофії правого передсердя. Надалі відносно слабке праве передсердя швидко розширюється (дилатує); коли середній тиск у правому передсерді перевищує 10 мм рт. ст., розвивається застій у великому колі кровообігу із залученням органів черевної порожнини. Ранній розвиток застою у венах великого кола кровообігу, характерний для стенозу отвору тристулкового клапана, контрастує з відсутністю ортопное та легеневого застою.
Клінічна картина і діагностика
Особливих скарг хворі не мають, часто виникає задишка. При огляді відзначаються набряклі яремні вени — одна з перших ознак трикуспідального стенозу. У більшості випадків виражена пресистолічна пульсація шийних вен. Венозний тиск різко підвищений, визначають артеріальну гіпотензію.
Аускультативно визначається характерний низькоамплітудний діастолічний шум, найбільш інтенсивний наприкінці діастоли.
На ЕКГ характерними ознаками вади є гіпертрофія правого передсердя (високий зубець Р в II і III відведеннях та aVF) з нерізко вираженою гіпертрофією ПШ, можлива наявність неспецифічних змін кінцевої частини шлуночкового комплексу (сплощення, інверсія зубця Т, зниження сегмента SТ) у грудних відведеннях. Часто відзначається фібриляція передсердь.
При рентгенологічному дослідженні визначають збільшення розмірів правого передсердя.
При ехоКГ-дослідженні визначається типова картина стенозу отвору з наявністю градієнта діастолічного тиску між ПШ і правим передсердям. Не існує градацій тяжкості вади. Величина середнього градієнта тиску >5 мм рт. ст. вважається клінічно значимою, при площі отвору <2,0 см2 діагностують тяжку ступінь трикуспідального стенозу. Можна визначити морфологію клапана і підклапанного апарату, а також ступінь супутньої трикуспідальної регургітації. Стулки часто потовщені зі зниженою мобільністю внаслідок запального процесу вздовж комісур.
При катетеризації правих відділів серця серцевий викид знижений, тиск у ПШ і ЛА нормальний або знижений. Основною гемодинамічною ознакою вади є градієнт діастолічного тиску між ПШ і правим передсердям.
Лікування
Специфічних консервативних методів терапії немає. СН, що розвивається, лікують, використовуючи загальноприйняті методи. Лікування спрямоване на зменшення застою у великому колі кровообігу, збільшення наповнення ПШ. Ефективність діуретиків обмежена.
Необхідне проведення профілактики виникнення інфекційного ендокардиту.
Хірургічне лікування проводять в умовах штучного кровообігу, використовуючи пластику та протезування клапана. Протезування тристулкового клапана проводять тільки при грубих змінах стулок і підклапанних структур, що зумовлює тяжкий стеноз. Перевагу віддають біологічним протезам порівняно з механічними у зв’язку з високим ризиком розвитку тромбозу.
Прогноз
Період компенсації вади зазвичай нетривалий. Рано приєднується фібриляція передсердь, що ще більше порушує гемодинаміку. Трикуспідальний стеноз відносять до набутих вад серця, що мають найбільш несприятливий перебіг.
ТРИКУСПІДАЛЬНА НЕДОСТАТНІСТЬ
Етіологія
Причиною вади може бути будь-яке ушкодження клапанного апарату, включаючи патологію кільця, стулок, хорд і папілярних м’язів. Найчастіше недостатність тристулкового клапана зумовлена правошлуночковою недостатністю внаслідок легеневої гіпертензії, яка в свою чергу зумовлена лівошлуночковою недостатністю. Причинами також можуть бути ревматизм, карциноїд, інфекційний ендокардит, міксоматоз, травми.
Патологічна анатомія
Для органічної недостатності тристулкового клапана характерне значне розширення фіброзного кільця за рахунок ділянки передньої і задньої стулок і відповідних комісур. Частина фіброзного кільця, що відповідає основі перегородкової стулки, не розширюється і являє собою єдине ціле з перегородковою частиною міжшлуночкової перегородки. Відносна недостатність характеризується відсутністю фіброзних змін, визначається лише потовщення країв стулок, викликане постійним впливом хвилі регургітації.
Патологічна фізіологія
Регургітація крові з ПШ у праве передсердя відносно швидко веде до дилатації правого передсердя без істотної його гіпертрофії. Компенсація вади здійснюється подібно до мітральної недостатності, проте компенсаторні можливості правого передсердя менші, тому рано формується венозна гіпертензія і венозний застій з депонуванням крові в печінці та інших органах черевної порожнини.
Недостатність тристулкового клапана з більшим обсягом регургітації створює в систолу хвилю зворотного потоку, що призводить до систолічної пульсації яремних вен і печінки. Середній тиск у порожнині правого передсердя підвищений в 2–3 рази і більше. Як і при недостатності мітрального клапана, внаслідок більшої піддатливості до розтягнення серцевого м’яза, ніж фіброзного кільця, можлива поява відносного стенозу з невеликим градієнтом діастолічного тиску між правим передсердям і ПШ, що проявляється слабким діастолічним шумом.
Клінічна картина
Типові скарги на задишку, слабкість, серцебиття, тяжкість у правому підребер’ї. Якщо вада формується у хворого, у якого попередньо були ознаки мітрального стенозу, застійні явища в малому колі кровообігу зменшуються, задишка слабшає, хворий легше переносить горизонтальне положення.
При огляді визначають систолічну пульсацію шийних вен, зумовлену зворотнім током крові з ПШ, набрякання шийних вен у положенні лежачи, виражену пульсацію в ділянці епігастрію та печінки.
Аускультативно визначається систолічний шум середньої інтенсивності, інтенсивність якого зростає до II тону, шум вислуховується біля основи мечоподібного відростка, зліва біля нижнього краю грудини і підсилюється під час вдиху (симптом Ріверо — Корвалло).
Діагностика
На ЕКГ визначаються ознаки гіпертрофії ПШ у вигляді збільшеної амплітуди зубців комплексу QRS у відповідних відведеннях у поєднанні зі зміненою кінцевою частиною шлуночкового комплексу (сплощення, інверсія зубця Т, зниження сегмента SТ) у тих же відведеннях, збільшення зубця Р у відведеннях II, III і aVF. Може виявлятися фібриляція передсердь.
Рентгенологічно визначається розширення верхньої порожнистої вени, збільшення переважно правих відділів серця, закруглення їх контурів у всіх проекціях, збільшення правого передсердя і ПШ у другій косій проекції.
ЕхоКГ-дослідження виявляє структурні зміни клапана, наявність вегетацій, дозволяє оцінити збільшення розмірів і функцію ПШ, незважаючи на певні обмеження. Допплєрографія дозволяє напівкількісно оцінити тяжкість регургітації, виміряти максимальний систолічний тиск у ПШ шляхом вимірювання максимальної швидкості потоку регургітації на тристулковому клапані.
Розроблені ехокардіографічні критерії тяжкої трикуспідальної недостатності. До специфічних ознак відносять наступні:
- розмір vena contracta >0,7 см;
- широка конвергенція потоку (радіус конвергенції ≥0,9 см для центрального потоку);
- систолічний зворотний потік у печінкових венах.
Додаткові ознаки тяжкої трикуспідальної недостатності наступні:
- інтенсивний трикутний потік трикуспідальної регургітації у режимі постійнохвильового допплєра (рис. 4.13);
- дилатація порожнистої вени та варіабельність її діаметра у фазу вдиху <50%;
- переважання піка Е транстрикуспідального потоку;
- дилатація правого передсердя і ПШ.
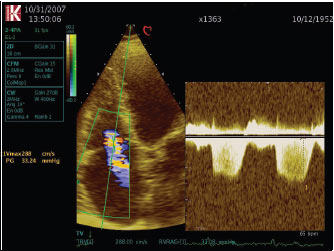
Рис. 4.13. Недостатність тристулкового клапана. Режим постійнохвильового допплєра, апікальна чотирикамерна позиція
При катетеризації серця і визначенні кривих тиску в правому передсерді можна отримати інформацію про наявність і вираженість трикуспідальної недостатності.
Проведення МРТ показане для отримання додаткової інформації про розміри і функцію ПШ.
Перебіг органічної трикуспідальної недостатності, як правило, швидко прогресуючий, рефрактерний до терапії. Найбільш тяжкий перебіг має органічна трикуспідальна недостатність, що приєднується до сформованої мітральної вади, оскільки швидко наростають порушення кровообігу. Ускладненнями вади часто бувають фібриляція передсердь, тромбування порожнини правого передсердя із розвитком ТЕЛА, іноді шлунково-кишкові кровотечі.
Лікування
Специфічних консервативних методів лікування немає, пацієнтів із СН, що розвивається, лікують за загальноприйнятими методами. Діуретики зменшують симптоми застою. За показаннями призначають периферичні вазодилататори, блокатори β-адренорецепторів, антикоагулянти. Лікування спрямоване на зменшення застою у великому колі кровообігу, зменшення об’єму викиду з ПШ, корекцію метаболізму міокарда і гомеостазу.
ЛІТЕРАТУРА
- Бешляга В.М., Кнышов Г.В., Зиньковский М.Ф. и др. (2000) Оценка степени нарушения гемодинамики и определение показаний к оперативному лечению больных с дискретным субаортальным стенозом, установленным по данным эхокардиографии. Укр. кардіол. журн., 3: 61–65.
- Дзяк Г.В., Писаревська О.В. (1998) Діагностична цінність деяких імунологічних показників у хворих, оперованих з приводу набутих вад серця. Укр. кардіол. журн., 7–8: 53–56.
- Кнышов Г.В., Бендет Я.А. (1997) Приобретенные пороки сердца. Институт сердечно-сосудистой хирургии, Киев, 280 с.
- Коваленко В.М., Лутай М.І., Сіренко Ю.М. (ред.) (2007) Серцево-судинні захворювання. Класифікація, стандарти діагностики та лікування кардіологічних хворих. Київ, 121 с.
- Коваленко В.Н. (2001) Сердечная недостаточность и ремоделирование левого желудочка у больных ревматическими пороками сердца. Серцево-судинна хірургія. Щорічник наукових праць Асоціації серцево-судинних хірургів України. Вип. 9, с. 168–171.
- Коваленко В.Н., Несукай Е.Г. (2001) Некоронарогенные болезни сердца. Практич. руководство. Морион, Киев, 480 с.
- Коваленко В.Н. (ред.) (2008) Руководство по кардиологии. Морион, Киев, 1424 с.
- Наказ № 436 Міністерства охорони здоров’я України від 03.07.2006 р. «Про затвердження протоколів надання медичної допомоги за спеціальністю «Кардіологія» (2006) Укр. кардіол. журн., 6: 89–115.
- Шиллер Н., Осипов М.А. (2005) Клиническая эхокардиография. 2-е изд. Практика, Москва, 344 с.
- Alpert J.S., Dalen J.E., Rahimtoola S.H. (2000) Valvular Heart Disease. 3rd ed. Williams&Wilkins, Lippincott, USA. 478 p.
- Babu, A.N., Kymes, S.M., Carpenter F.S.M. (2003) Eponyms and the Diagnosis of Aortic Regurgitation: What Says the Evidence? Ann. Intern. Med., 138: 736–742.
- Bermejo J., Odreman R., Feijoo J. et al. (2003) Clinical efficacy of Doppler-echocardiographic indices of aortic valve stenosis: a comparative test-based analysis of outcome. J. Am. Coll. Cardiol., 41: 142–151.
- Carabello B.A. (2005) Modern management of mitral stenosis. Circulation., 112: 432–437.
- Cowell S.J., Newby D.E., Prescott R.J. et al. (2005) A randomized trial of intensive lipid-lowering therapy in calcific aortic stenosis. N. Engl. J. Med.,. 352: 2389–2397.
- Das P., Rimington H., Chambers J. (2005) Exercise testing to stratify risk in aortic stenosis. Eur. Heart J., 26: 1309–1313.
- Enriquez-Sarano M., Avierinos J.F., Messika-Zeitoun D. et al. (2005) Quantitative determinants of the outcome of asymptomatic mitral regurgitation. N. Engl. J. Med., 352: 875–883.
- Evangelista A., Tornos P., Sambola A. et al. (2005) Long-term vasodilator therapy in patients with severe aortic regurgitation. N. Engl. J. Med., 353: 1342–1349.
- Fann J.I., Ingels N.B.Jr, Miller D.C. (2003) Pathophysiology of Mitral Valve Disease. Card. Surg. Adult., 2: 901–931.
- Gaasch, W.H., Meyer T.E. (2008) Left Ventricular Response to Mitral Regurgitation: Implications for Management. Circulation, 118: 2298–2303.
- Galderisi M., Mondillo S. Echocardiography in clinical practice (2007) One Way S.r.l., 120 p.
- Garcia D., Pibarot P., Landry C. et al. (2004) Estimation of aortic valve effective orifice area by Doppler echocardiography: effects of valve inflow shape and flow rate. J. Am. Soc. Echocardiogr., 17: 756–765.
- Glockner J.F., Johnston D.L, McGee K.P. (2003) Evaluation of Cardiac Valvular Disease with MR Imaging: Qualitative and Quantitative Techniques. Radiographics, 23: 5–9.
- Lung B., Gohlke-Barwolf C., Tornos P. et al. (2002) Recommendations on the management of the asymptomatic patient with valvular heart disease. Eur. Heart J., 23: 1253–1266.
- Lung B., Baron G., Butchart E.G. et al. (2003) A prospective survey of patients with valvular heart disease in Europe: the Euro heart Survey on Valvular Heart Disease. Eur. Heart J., 24: 1231–1240.
- Marui A., Saji Y., Nishina T. et al. (2008) Impact of left atrial volume reduction concomitant with atrial fibrillation surgery on left atrial geometry and mechanical function. J. Thorac. Cardiovasc. Surg., 135(6): 1304–1305.
- Matsumura Y., Gillinov A.M., Toyono M. et al. (2008) Usefulness of left ventricular shape to predict the early recovery of left ventricular function after isolated aortic valve replacement for aortic valve stenosis. Am. J. Cardiol., 102(11): 1530–1534.
- Messika-Zeitoun D., Yiu S.F., Cormier B. et al. (2003) Sequential assessment of mitral valve area during diastole using color M-mode flow convergence analysis: new insights into mitral stenosis physiology. Eur. Heart J., 24: 1244–1253.
- Monin J.L., Dehant P., Roiron C. et al. (2005) Functional assessment of mitral regurgitation by transthoracic echocardiography using standardized imaging planes diagnostic accuracy and outcome implications. J. Amer. Coll. Cardiol., 46: 302–309.
- Monmeneu Menadas J.V., Marin Ortuno F., Reyes Gomis F. et al. (2002) Beta-blockade and exercise capacity in patients with mitral stenosis in sinus rhythm. J. Heart Valve. Dis., 11: 199–203.
- Osswald B.R., Gegouskov V., Badowski-Zyla D. et al. (2009) Overestimation of aortic valve replacement risk by EuroSCORE: implications for percutaneous valve replacement. Eur. Heart J., 30(1): 74–80.
- Otto C.M. (2004) Aortic stenosis: even mild disease is significant. Eur. Heart J., 25: 185–187.
- Pedersen T.R. (2008) Intensive lipid-lowering therapy for patients with aortic stenosis. Am. J. Cardiol., 102(11): 1571–1576.
- Rosenhek R., Klaar U., Schemper M. et al. (2004) Mild and moderate aortic stenosis. Natural history and risk stratification by echocardiography. Eur. Heart J., 25: 199–205.
- Tarasoutchi F., Grinberg M., Spina G.S. et al. (2003) Ten-year clinical laboratory follow-up after application of a symptom-based therapeutic strategy to patients with severe chronic aortic regurgitation of predominant rheumatic etiology. J. Am. Coll. Cardiol., 41: 1316–1324.
- Topol E.J. (Ed.) (2007) Textbook of cardiovascular medicine. 3th ed. Williams&Wilkins, Lippincott, 1628 p.
- Vahanian A., Baumgartner H., Bax J. et al. (2007) Guidelines on the management of valvular heart disease. The task force on the management of valvular heart disease of European society of cardiology. Eur. Heart J., 28: 230–268.
- Zamorano J., Cordeiro P., Sugeng L. et al. (2004) Real-time three-dimensional echocardiography for rheumatic mitral valve stenosis evaluation: an accurate and novel approach. J. Amer. Coll. Cardiol., 43: 2091–2096.
- Zoghbi W.A., Enriques-Sarano M., Foster E. et al. (2003) American Society of Echocardiography: recommendations for evaluation of the severity of native valvular regurgitation with two-dimensional and Doppler echocardiography. Eur. J. Echocardiography, 4: 237–261.