Пролапс мітрального клапана — провисання (пролабування) однієї або обох стулок мітрального клапана в порожнину лівого передсердя в систолу ЛШ. Термін запропонований J.M. Criley і співавторами у 1966 р.
Епідеміологія
Частота реєстрації пролапса мітрального клапана в різних популяціях становить від 5 до 20%, ехоКГ-методом — 10%, методом ангіографії — 43%. Синдром пролапса можливий у зовсім здорових людей (5–15% у різних популяціях), у спортсменів, що мали високі спортивні досягнення. У Фремінгемському дослідженні частота пролабування стулок мітрального клапана була трохи вище у жінок (2,7%), ніж у чоловіків (2,1%). При спостереженні в різних етнічних групах частота виявлення пролапса мітрального клапана була найбільшою у осіб європеоїдної раси — 3,1%, у народів Близького Сходу — 2,7%, у китайців — 2,2%.
Етіологія і патогенез
Етіологія первинного пролапса мітрального клапана дотепер остаточно не встановлена, проте часте поєднання його з вродженими метаболічними і структурними порушеннями сполучної тканини свідчить на користь його генетичної детермінованості. Первинний пролапс являє собою звичайно доброякісне спадкове захворювання, при якому патологія зумовлена своєрідною «надмірністю» мітрального клапана або довшими, ніж в нормі, сухожильними хордами.
Пролапс мітрального клапана може розвинутися в результаті міксоматозного ураження клапанного апарату, внаслідок вродженої аномалії розвитку серця і судин (об’ємна надмірність, фестончатість і потовщення стулок) або генетично зумовленої слабкості сполучної тканини.
Найбільш важлива міксоматозна дегенерація мітрального клапана, характерною ознакою якої є нагромадження кислих мукополісахаридів, що призводить до значного підвищення гідрофільності стулок і більш пухкої їх структури. Міксоматозна дегенерація клапана асоційована з підвищенням активності матриксних металопротеїназ, синтезом аномального фібриліну, що призводить до втрати нормальної щільності колагенової структури і фрагментації колагенових волокон, вона може поширюватися не тільки на клапан, але також на сухожильні нитки і AV- кільце. На даний час розшифрований один із хромосомних локусів (Xq28), відповідальних за розвиток міксоматозної дегенерації.
Первинний пролапс мітрального клапана може успадковуватися за аутосомно-домінантним типом; виявлено локус MMVP1 у хромосомі 16p11.2-p12.1 і локус MMVP2 у хромосомі 11p15.4. Проте більш переконливо виглядає концепція полігенної моделі успадкування, оскільки можлива поява пролапса мітрального клапана при спадкових захворюваннях, у розвитку яких беруть участь мутації різних генів.
Деякі автори розглядають пролапс мітрального клапана у рамках феномена дисплазії сполучної тканини, вважаючи, що особливості будови структур мітрального клапана можуть бути зумовлені генетично детермінованими дефектами сполучної тканини. У хворих з синдромами Елерса — Данло, Марфана, доброякісної гіпермобільності встановлений зв’язок між генетично детермінованими особливостями сполучної тканини і пролапсом мітрального клапана, на даний час ідентифіковане точне розташування і варіанти мутацій на хромосомах у хворих з синдромом Елерса — Данло.
Нещодавно виявлено, що поліморфізм екзона 31-го гена колагену типу III — альфа 1 (COL3А1) впливає на ймовірність виникнення пролапса мітрального клапана: при наявності алеля G ризик його виникнення зростав у 2,3 раза, а в осіб гомозиготних за даним алелем — у 7,4 раза, поліморфізм екзона 52-го гена COL3А1 такого впливу не мав (Chou H.T. et al., 2004).
Вторинний пролапс мітрального клапана виникає при різних системних, запальних захворюваннях, ІХС (табл. 2.1).
Таблиця 2.1
Основні причини і стани, що поєднуються з пролапсом мітрального клапана
| Встановлена або ймовірна причина | Можлива причина |
Загальне ураження сполучної тканини:
Ревматизм Інфекційний ендокардит ІХС ГКМП Міокардит Перикардит Операції на мітральному клапані Травма Міксома лівого передсердя Системні захворювання сполучної тканини WPW-синдром |
Вроджені вади серця:
«Спортивне» серце Вроджений синдром подовженого інтервалу Q–Т |
Класифікація
Класифікація пролапса мітрального клапана зумовлена ступенем провисання стулки мітрального клапана в ліве передсердя за даними трансторакальної ехоКГ:
- I ступінь — пролабування стулки на 3–6 мм;
- II ступінь — пролабування стулки на 7–9 мм;
- III ступінь — пролабування стулки понад 9 мм;
- окремо описується ступінь вираженості супутньої мітральної регургітації.
Розрізняють первинний (ідіопатичний) і вторинний (придбаний) пролапс мітрального клапана.
Клінічна картина
У більшості пацієнтів клінічні ознаки можуть бути відсутні навіть при пролабуванні клапана I–II ступеня, що не супроводжується гемодинамічно значимою мітральною регургітацією. До загальних скарг належать астеноневротичні: підвищена дратівливість, емоційна лабільність, порушення сну, головний біль, зниження працездатності, швидка стомлюваність.
Частою ознакою є біль в ділянці серця (50–65%), що носить різноманітний характер і локалізується зазвичай у зоні проекції верхівки серця або за грудиною, триває від декількох секунд до доби, не пов’язаний з фізичним навантаженням, не купірується нітрогліцерином.
У походженні больового синдрому при пролапсі мітрального клапана провідну роль відводять вегетативній нервовій системі, поліморфізм болю свідчить про існування різних механізмів вегетативних порушень у таких хворих.
Відчуття серцебиття і перебої в роботі серця відзначають у 25–79% хворих.
В окремих випадках пацієнти періодично чують «писк» або шум у грудях, що посилюється при фізичному і психоемоційному навантаженні, часто супроводжується кардіальним і психоемоційним дискомфортом.
При аускультації визначається голосний «музичний» систолічний шум над проекцією верхівки серця, що частіше буває ізольованим, але може нашаровуватися на певну частину систолічного шуму, його звучання залежить від положення тіла хворого.
У 15–32% пацієнтів виникає задишка в стані спокою або при незначному фізичному навантаженні, незадоволеність вдихом, а також відчуття нестачі повітря або перешкоди на шляху повітря під час видиху, потреба періодично робити глибокий вдих.
Нерідко єдиними скаргами хворих є ліпотимія (комплекс відчуттів, що передують втраті свідомості) і синкопальний стан (4–86%). Провідна роль у патогенезі синкопальних станів приділяється пароксизмальним порушенням серцевого ритму (пароксизмальній шлуночковій, суправентрикулярній тахікардії і екстрасистолії), ортостатичну гіпотензію виявляють у 14% хворих. У пацієнтів з пролапсом мітрального клапана випадки непритомності не зумовлюють несприятливого впливу на прогноз, також немає доказів щодо їх ролі як провісників раптової смерті.
У хворих виявляють велику розмаїтість проявів дисфункції вегетативної нервової системи, включаючи епізоди підвищення АТ і ортостатичної гіпотензії, скарги на підвищене потовиділення, немотивоване відчуття жару, гіперемію окремих частин тіла. Різного роду парестезії, розлади терморегуляції, судинні прояви на шкірі кінцівок (блідість, мармуровий малюнок, синюшність), порушення за типом феномена Рейно (похолодіння і оніміння пальців кистей і стоп), підвищену стомлюваність зі зниженням толерантності до фізичного навантаження відзначають у 9–60% випадків. Внаслідок емоційно-афективних і вегетативних розладів можуть виникати вегетативні кризи або «панічні атаки», в ряді випадків вони є основою стану непритомності.
У 30% хворих із первинним пролабуванням мітрального клапана вдається виявити зовнішні ознаки дисплазії сполучнотканинних структур, які відповідають повному або неповному синдрому Марфана або Елерса — Данло.
Гемодинамічні порушення залежать від наявності і ступеня мітральної регургітації, що істотно впливає на прогноз і підвищує ризик різних ускладнень — фібриляції передсердь, СН, ішемічного інсульту, інфекційного ендокардиту.
Діагностика
При аускультації найбільш характерними ознаками є додатковий тон (клацання) у період, що відповідає середині систоли і/або виникнення після нього зростаючого систолічного шуму, що триває до появи аортального компонента II тону. У багатьох хворих специфічна звукова картина відсутня і не відображає вираженості пролабування стулки клапана.
До достовірних аускультативних проявів пролапса мітрального клапана належать:
- ізольоване мезосистолічне клацання (50–54%);
- ізольоване пізнє систолічне клацання/шум;
- множинне систолічне клацання;
- пансистолічний (голосистолічний) шум.
Зміни ЕКГ неспецифічні, у більшості пацієнтів у стані спокою відхилення від норми відсутні. Найбільш чутливим для виявлення порушень ритму і провідності у хворих із пролапсом мітрального клапана є 24-годинне (холтерівське) моніторування.
На ЕКГ можуть визначати:
- сплощені, двогорбі або негативні зубці Т у відведеннях II, III і aVF, рідше в V5–6 і високі зубці Т у відведеннях V1–2;
- зниження інтервалу S–Т у поєднанні з інверсією зубця Т у тих же відведеннях;
- подовження інтервалу Q–T;
- різні порушення ритму і провідності: найбільш часто — шлуночкова і передсердна екстрасистолічна аритмія, пароксизмальна передсердна і шлуночкова тахікардія, фібриляція передсердь.
ЕхоКГ і допплєрівська ехоКГ є ключовими дослідженнями в діагностиці пролапса мітрального клапана. До специфічних ехоКГ-ознак належать мезосистолічне, пізніше і голосистолічне «гамачне» провисання задньої або обох стулок мітрального клапана в порожнину лівого передсердя (рис. 2.1). Мезосистолічне провисання визначається найбільш часто і досить стабільно корелює з аускультативними і ангіографічними проявами.
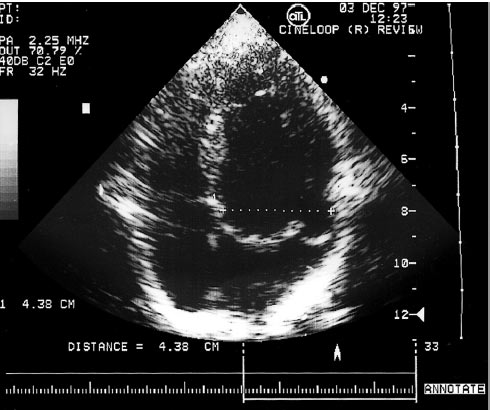
Рис. 2.1. Пролапс мітрального клапана. В-режим, апікальна чотирикамерна позиція
На ехоКГ у М-режимі пролабування має вигляд «знака запитання, повернутого приблизно на 90° за годинниковою стрілкою» (рис. 2.2).
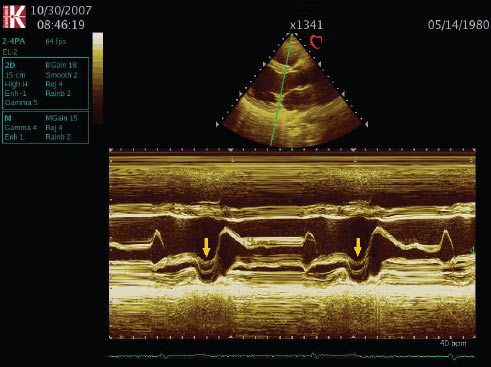
Рис. 2.2. Пролапс мітрального клапана. М-режим
Неспецифічними, але високочутливими є наступні ехоКГ-ознаки:
- дилатація мітрального кільця;
- збільшення екскурсії мітрального клапана, діастолічний контакт стулок із міжшлуночковою перегородкою;
- збільшення амплітуди діастолічної розбіжності стулок і швидкості відкриття передньої стулки клапана;
- систолічний зсув передньої й задньої стулок мітрального клапана (>3 мм) в ліве передсердя нижче закриття мітральної лінії;
- потовщення стулок мітрального клапана;
- ознаки міксоматозної дегенерації клапана (рис. 2.3);
- різний ступінь мітральної регургітації (рис. 2.4).
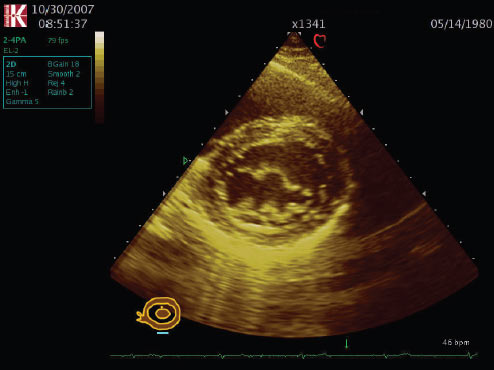
Рис. 2.3. Пролапс мітрального клапана. B-режим, парастернальна позиція, коротка вісь
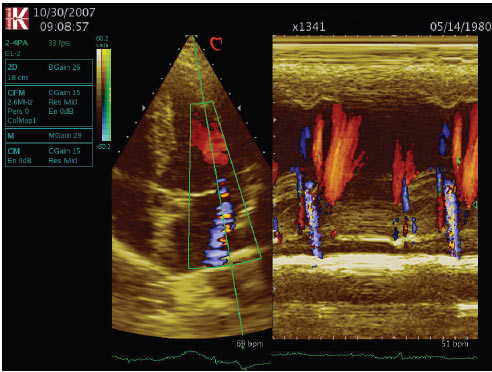
Рис. 2.4. Пролапс мітрального клапана. Колірний М-режим
Різновидом пансистолічного пролапса є так званий клапан, що бовтається (floppy mitral valve), який відзначають зазвичай при розриві хордальних ниток або відриві папілярного м’яза. При B-скануванні чітко видно нефіксований папілярний м’яз, нефіксовану стулку мітрального клапана, що робить неправильні, довільні рухи в фазу діастоли і що «провалюється» у порожнину лівого передсердя в фазу систоли шлуночків. У М-режимі відмінними ехоКГ-особливостями такого клапана є наявність додаткових ехо-сигналів від стулки мітрального клапана в порожнини лівого передсердя в систолу шлуночка, діастолічного тремтіння передньої стулки або парадоксального руху задньої мітральної стулки в систолу і діастолу.
Хворим з вираженою мітральною регургітацією, наявністю міксоматозної дегенерації, збільшенням стулок, подовженням хорд необхідно не рідше одного разу на півроку проводити ЕКГ і ехоКГ-дослідження з метою своєчасного попередження ускладнень.
Радіонуклідний метод дослідження дає можливість неінвазивним шляхом кількісно розрахувати об’єм регургітації і об’єктивно оцінити ступінь недостатності мітрального клапана.
Ангіокардіографія в більшості випадків доповнює клінічні ехоКГ-результати і показана в наступних випадках:
- наявність чинників ризику хвороб серця і судин;
- виражений біль в ділянці серця (при ІХС);
- наявність тяжкої мітральної регургітації (об’єм регургітації ≥60 мл/скорочення, фракція регургітації ≥50%, ефективна площа отвору регургітації ≥0,40 см2);
- необхідність проведення диференціальної діагностики з недостатністю мітрального клапана ревматичної або дегенеративної етіології з ГКМП;
- наявність пролапса мітрального клапана у поєднанні з дефектом міжпередсердної перегородки;
- наявність афонічного («німого») пролапса мітрального клапана.
Лівобічна вентрикулографія вважається найбільш надійним і точним методом діагностики пролапса мітрального клапана, її конфігурація в систолу при ангіографії допомагає діагностувати патологію. Також можна визначити кальцифікацію мітрального отвору, дилатацію і низьку скоротність базального відрізка ЛШ.
У 15% хворих (у чоловіків частіше, ніж у жінок) розвиваються серйозні ускладнення, до яких належать раптова смерть, інфекційний ендокардит, тромбоемболія, у тому числі церебральних артерій, що призводять до виникнення ішемічного інсульту.
У рекомендаціях робочої групи по раптовій смерті Європейського кардіологічного товариства (2006) наведені основні маркери ризику раптової смерті у хворих із пролапсом мітрального клапана:
- зупинка серця або шлуночкова тахіаритмія в анамнезі;
- міксоматозні зміни і збільшення розмірів стулок;
- раптова смерть близьких родичів.
Пролапс мітрального клапана виявляють у 10–30% дорослих хворих з інфекційним ендокардитом, ризик його розвитку при пролапсі мітрального клапана у 3,5–8,2 раза вищий, ніж у загальній популяції, і підвищується при наявності міксоматозної дегенерації стулок, їх збільшенні і потовщенні, а також при наявності мітральної регургітації.
Лікування
При шлуночковій і надшлуночковій аритмії препаратами вибору є блокатори β-адренорецепторів. У багатьох хворих антиаритмічна терапія не виправдана, оскільки прояви порушень серцевого ритму і провідності є незначними.
Абсолютними показаннями для призначення антиаритмічної терапії є:
1) клінічно виражена аритмія, що проявляється серцебиттям, запамороченням, синкопе, синдромом Морганьї — Адамса — Стокса;
2) часті суправентрикулярні шлуночкові екстрасистоли (>10–12/хв), особливо якщо вони ранні, групові або політопні при суправентрикулярній або шлуночковій тахікардії, синоаурикулярних, AV- і внутрішньошлуночкових (моно- і біфасцикулярних) блокадах.
Розповсюджені хірургічні методи лікування небезпечних порушень ритму серця, ефективна радіочастотна абляція додаткових провідних шляхів. Пацієнтам, які перенесли епізод зупинки серця, з метою вторинної профілактики раптової смерті рекомендується імплантація кардіовертера-дефібрилятора.
Деякими авторами показана ефективність інгібіторів АПФ у хворих з пролапсом мітрального клапана і вираженій мітральній регургітації з метою запобігання прогресування зниження скоротності ЛШ.
Ацетилсаліцилову кислоту й дипіридамол можна застосовувати профілактично для запобігання емболії мозкових судин у хворих, що мали навіть один церебральний епізод невизначеного генезу.
Методом вибору у пацієнтів з мітральною регургітацією є хірургічне лікування (вальвулопластика, протезування мітрального клапана), що поліпшує прогноз, зумовлює зниження ризику інфекційного ендокардиту, усуває порушення ритму серця.
Хворі без клінічних симптомів пролапса мітрального клапана підлягають профілактичним оглядам кожні 2–3 роки.
Пацієнтів із пролапсом мітрального клапана відносять до групи ризику розвитку інфекційного ендокардиту, перед проведенням різних хірургічних втручань, у тому числі на дихальних шляхах, стоматологічних маніпуляціях (екстракція зуба, установка імпланта), урологічних втручаннях (операція на передміхуровій залозі, цистоскопія) у них рекомендується проводити антибіотикопрофілактику за наступними показаннями:
- наявність систолічного клацання у сполученні з систолічним шумом;
- наявність ізольованого систолічного клацання у сполученні з ехоКГ-ознаками пролапса мітрального клапана і мітральної регургітації;
- наявність ізольованого систолічного клацання у сполученні з ехоКГ-ознаками високого ризику: потовщення стулок, подовження хорд, збільшення лівого передсердя або ЛШ.
Тактика первинної профілактики тромбоемболічних ускладнень пролапса мітрального клапана не розроблена.
ЛІТЕРАТУРА
- Дядык А.И., Багрий А.Э., Онищенко А.В. и др. (1999) Пролапс митрального клапана: современные представления о номенклатуре, эпидемиологии, диагностике, прогнозе и тактике ведения. Метод. рекомендации. Донецк, 28 с.
- Коваленко В.Н., Несукай Е.Г. (2001) Некоронарогенные болезни сердца. Практ. руководство. Морион, Киев, 480 с.
- Коваленко В.Н. (ред.) (2008) Руководство по кардиологии. Морион, Киев, 1424 с.
- Мартынов А.И., Степура О.Б., Остроумова О.Д. и др. (1998) Пролапс митрального клапана. Кардиология, 2: 74–81.
- Оганов Р.Г., Фомина И.Г. (ред.) (2006) Болезни сердца: руководство для врачей. Литтерра, Москва,1328 с.
- Фомин В.В., Моисеев С.В., Саркисова И.А. (2001) Клинические особенности и диагностика пролапса митрального клапана. Клин. мед., 79: 65–69.
- Шиллер Н., Осипов М.А.(2005) Клиническая эхокардиография. 2-е изд. Практика, Москва, 344 с.
- Alpert J.S., Dalen J.E., Rahimtoola S.H. (2000) Valvular Heart Disease. Lippincott Williams&Wilkins, USA. 3rd ed., 478 p.
- Avierinos J.F., Gersh B.J., Melton L.J. et al.(2002) Natural history of asymptomatic mitral valve prolapse in the community. Circulation, 106: 1355–1361.
- Barber J.E., Ratliff N.B., Cosgrove D.M. (2001) Myxomatous mitral valve chordae. Mechanical properties. J. Heart Valve Dis, 10: 320–324.
- Braunwald E., Zipes D.P., Libby P. (Eds.) (2001) Heart disease: a textbook of cardiovascular medicine. W.B. Saunders Company, 6th ed., 1: 1–1231.
- Chou H.T., Hung J.S., Chen Y.T. et al. (2004) Association between COL3A1 collagen gene exon 31 polymorphism and risk of floppy mitral valve/mitral valve prolapse. Int. J. Cardiol., 95: 299–305.
- Disse S., Abergel E. Berrebi A. et al. (1999) Mapping of a first locus for autosomal dominant myxomatous mitral-valve prolapse to chromosome 16p11.2-p12.1. Amer. J. Hum. Genet., 65: 1242–1251.
- Fauchier J.P., Babuty D., Fauchier L. et al. (2000) Mitral valve prolapse, arrhythmias and sudden death. Arch. Mal. Coeur. Vaiss., 93: 1541–1547.
- Freed L.A., Acierno Jr. J.S., Dai D. et al. (2003) A locus for autosomal dominant mitral valve prolapse on chromosome 11p15.4. Amer. J. Hum. Genet., 72: 1551–1559.
- Freed L.A., Benjamin E.J., Levy D. et al. (2002) Mitral valve prolapse in general population. The benign nature of echocardiographic features in the Framingham Heart Study. J. Amer. Coll. Cardiol., 40: 1298–1304.
- Hayek E., Gring C.N., Griffin B.P. (2005) Mitral valve prolapse. Lancet, 365: 507–518.
- Iung B., Gohlke-Barwolf C., Tornos P. et al. (2002) Recommendations on the management of the asymptomatic patient with valvular heart disease. Eur. Heart J., 23: 1253–1266.
- Falk V., Seeburger J., Czesla M. et al. (2008 ) How does the use of polytetrafluoroethylene neochordae for posterior mitral valve prolapse (loop technique) compare with leaflet resection? A prospective randomized trial. J. Thorac. Cardiovasc. Surg., 136: 1200–1206.
- Jowan J., Tapia M., Cook R. et al. (2004) Ischemic mitral valve prolapse: mechanisms and implications for valve repair. Eur. J. Cardiothorac. Surg., 26: 1112–1117.
- Kyndt F., Schott J.J., Trochu J.N. et al. (1998) Mapping of X-linked myxomatous valvular dystrophy to chromosome Xq28. Amer. J. Hum. Genet., 62: 627–632.
- Mills W.R., Barber E., Skiles J.A. et al. (2002) Clinical, echocardiographic and biomechanical differences in mitral valve prolapse affecting one or both leaflets. Amer. J. Cardiol., 89: 1394–1399.
- Nasuti J.F., Zhang P.J., Feldman M.D. et al. (2004) Fibrillin and other matrix proteins in mitral valve prolapse syndrome. Ann. Thorac. Surg., 77: 532–536.
- Otto C.M. (2001) Evaluation and management of chronic mitral regurgitation. N. Engl. J. Med., 345: 740–746.
- Pellerin D., Brecker S., Veyrat C. et al. (2002) Degenerative mitral valve disease with emphasis on mitral valve prolapse. Heart, 88(IV): 20–28.
- Pepin M., Schwarze U., Superti-Furga A. et al. (2000) Clinical and genetic features of Ehlers-Danlos syndrome type IV, the vascular type. N. Engl. J. Med., 342: 673–680.
- Playford D., Weyman A.E. (2001) Mitral valve prolapse: time for a fresh look. Rev. Cardiovasc. Med., 2: 73–81.
- Porciani M.C., Attanasio M., Lepri V. et al. (2004) Prevalence of cardiovascular manifestations in Marfan syndrome. Ital. Heart J., 5: 647–652.
- Stefanaidas C., Toutouzas P. (2000) Mitral valve prolapse: the merchant of Venice or much ado about nothing? Eur. Heart J., 21: 255–258.
- Theal M., Sleik K., Anand S. et al. (2004) Prevalence of mitral valve prolapse in ethnic groups. Can. J. Cardiol., 20: 511–515.
- Topol E.J. (Ed.) (2007) Textbook of cardiovascular medicine. 3th ed. Lippincott Williams&Wilkins, 1628 p.
- Zoghbi W.A., Enriquez-Sarano M., Foster E. et al. (2003) Recommendations for evaluation of the severity of native valvular regurgitation with two-dimensional and Doppler echocardiography. J. Am. Soc. Echocardiogr., 16: 777–802.