КРОВООБІГ
Кровообіг — безперервний рух крові по замкнутій системі, утвореній судинами різної будови і функціонального призначення, що забезпечується роботою серця. Кров — тканина внутрішнього середовища організму, її головними функціями є транспортна, дихальна, трофічна, екскреторна, захисна і регуляторна. Кров бере участь також у підтримці водного балансу тканин і сталості температури тіла.
З гемодинамічної точки зору систему кровообігу в цілому можна уявити як два резервуари — артеріальний і венозний, які сполучаються через розгалужену мережу мікросудин. З першого резервуару всі органи і тканинні структури одержують необхідну їм кількість крові, а в іншому, венозному, ця кров збирається і транспортується до серця.
В організмі дорослої людини у стані спокою центральні розподільні судини — артерії еластичного типу — приймають у момент систоли близько 70 мл крові. Дистальною межею цієї ланки судинної системи прийнято вважати артеріальні гілки, що належать до більше ніж одного органа. Стінки аорти та її великих гілок складаються в основному з колагену та еластину з відносно малою кількістю гладких м’язів, завдяки чому енергія, що витрачається в систолу на розтягання пружних стінок магістральних артерій, використовується для підтримки кровотоку в діастолу.
По мірі розгалуження артеріального русла кількість паралельно і послідовно з’єднаних судин збільшується в геометричній прогресії. Малі гілки артеріальної мережі (інтраорганні артерії невеликого калібру, артеріоли) становляють резистивну частину судинного русла, в якому відбувається найбільше у кровоносній системі падіння тиску, а потік крові втрачає пульсуючий характер. У стінках цих судин багато гладком’язових клітин, які забезпечують активну зміну судинного просвіту, що істотно впливає на периферичний опір кровотоку. Гладкі м’язи резистивних судин регулюють тканинний кровотік, реагуючи як на сигнали, що виникають у тканинах і циркулюють у крові, так і на сигнали, що передаються нервовими волокнами.
Більшість функцій крові реалізується в мікрогемоциркуляторному руслі, що включає артеріоли, прекапіляри, капіляри, венули і артеріовенозні анастомози. Основною функціональною ланкою мікрогемоциркуляторного русла є капіляри, хоча процеси обміну в тому чи іншому ступені здійснюються і у приносних кров, і у відвідних її мікросудинах. Стінка капілярів складається з одного шару ендотеліальних клітин і оточуючої їх базальної мембрани, що забезпечує тісний контакт крові, яка протікає по них, і тканинних структур, які вона живить. Геометрія та щільність мікросудинної мережі, діаметр, довжина і деталі будови капілярів, що утворюють цю мережу, в різних органах значно варіює. Кількість одночасно функціонуючих капілярів у кожній ділянці тканини залежить від виконуваної нею роботи та метаболічної активності і може змінюватися в значних межах. При надлишковому надходженні крові в артеріальне коліно мікрогемоциркуляторного русла гладком’язові сфінктери артеріоловенулярних шунтів-анастомозів розкриваються, частина крові скидається в її відвідні мікросудини.
Адекватність транскапілярного обміну потребам тканини і тим самим гомеостатична функція мікрогемоциркуляторного русла визначається не лише об’ємом крові, що надходить до нього, але й величиною посткапілярного опору, що залежить від умов кровотоку у венозній системі. Повернення венозної крові до серця забезпечується декількома факторами: енергією скорочення серцевого м’яза, що збереглася в потоці крові після проходження через мікросудини, скороченням діафрагми, скелетних м’язів, присмоктуючою дією негативного тиску в грудній порожнині, що створюється в момент вдиху.
Венозні (ємнісні) судини вміщують 70–80% всієї крові в організмі. Їх стінка значно тонша і бідніша на гладком’язові клітини, ніж стінка артерій. Вони мають велику розтягненість при відносно низькій еластичності. Місцеві метаболічні фактори фактично не впливають на венозне русло, і регуляція тонусу ємнісних судин здійснюється, як правило, нервовою системою. Тому при порушенні іннервації органа об’єм крові в ньому може збільшуватися на 20%, а при стимуляції нервів вени можуть виганяти до 30% об’єму крові, що в нормі утримується в них.
Кровоносна система координує і поєднує функціонально різні органи та системи цілісного організму. Цю функцію вона виконує в комплексі з лімфатичною системою, що повертає тканинну рідину в кров’яне русло. Будь-які впливи, що посилюють кровотік і гемотканинний обмін, підвищують колоїдно-осмотичний і гідростатичний тиск у тканинах, стимулюють лімфоутворення. Тканинна рідина, що містить електроліти і продукти метаболізму, які мають бути евакуйовані з тканини, надходить у лімфатичні капіляри, що сліпо закінчуються; міжендотеліальні стики цих капілярів розширюються при підвищенні внутрішньотканинного тиску. Завдяки цьому коріння лімфатичної системи працює як «інтерстиціальні» насоси. Трансформація первинної лімфи у вторинну відбувається в посткапілярах, стінки яких зберігають проникність для води, але затримують більші за розміром молекули. Наявність клапанів у лімфатичній системі, що з’являються вже на рівні посткапілярів, забезпечує ортоградну орієнтацію лімфотечії. Стінки лімфатичних судин, що транспортують лімфу за межі органів до регіональних лімфовузлів і далі, містять колагенові, еластичні волокна та гладком’язові елементи, що сприяють активному просуванню лімфи.
КОЛА КРОВООБІГУ
Судинна система організму — складно організований комплекс функціонально та структурно спеціалізованих судин різного калібру, що транспортують кров і лімфу, яка рухається завдяки роботі серця у всіх органах і тканинах, забезпечуючи їх метаболізм, передачу гуморальної інформації та елімінацію продуктів обміну (рис. 1.1).
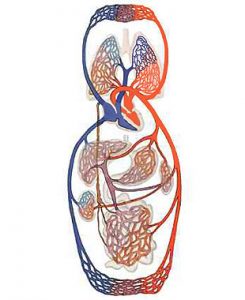
Рис. 1.1. Кола кровообігу людини
Центральною ланкою системи кровообігу організму ссавців є серце, яке інтегрує велике і мале кола кровообігу (рис. 1.2). Венозна кров із усього організму надходить у праве передсердя, потім через правий передсердно-шлуночковий отвір у ПШ. З нього кров нагнітається в легеневий стовбур, що розділяється на ЛА, які йдуть до правої та лівої легені. Тут ЛА послідовно діляться на дольові, сегментарні, лобулярні гілки і капіляри. Останні безпосередньо беруть участь у формуванні аерогематичного бар’єра, що опосередковує газообмін зі звільненням крові від надлишку СО2 і збагаченням її киснем, необхідним для нормального перебігу метаболічних процесів в організмі.
Оксигенована артеріальна кров повертається до серця чотирма легеневими венами, які впадають у ліве передсердя. Потім через лівий передсердно-шлуночковий отвір кров потрапляє в ЛШ серця, звідки в систолу виштовхується в аорту і розноситься її гілками по всьому організму.
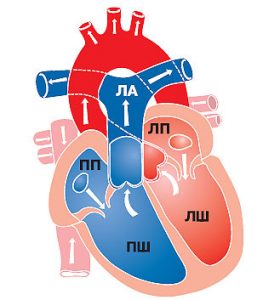
Рис. 1.2. Схема притоку, відтоку крові до серця та внутрішньосерцевого кровотоку. ПП — праве передсердя; ЛП — ліве передсердя
Калібр і відповідно пропускна здатність магістральних артерій, що відходять від аорти, неоднакові й визначаються обсягом регіону, що постачається кров’ю та інтенсивністю метаболічних процесів у відповідних тканинах та органах.
Внутрішньоорганний, переважно дихотомічний розподіл магістральних артерій на гілки другого, третього і т.д. порядку, визначається анатомічними особливостями органа, що постачається кров’ю і завершується формуванням тканиноспецифічної капілярної мережі, що забезпечує трофічні процеси на мікрорегіональному рівні. По ходу капілярної мережі артеріальна кров віддає кисень, насичується СО2 і продуктами тканинного метаболізму, перетворюючись у венозну, і направляється до серця.
Капіляри формують внутрішньоорганні шляхи відтоку крові зростаючого калібру. Послідовно поєднуючись, вони впадають у великі венозні судини, що йдуть від відповідних органів. Нарешті, всі екстраорганні вени збираються у два магістральні стовбури: верхню порожнисту вену, що збирає кров із ділянок та органів голови, шиї, верхніх кінцівок і тканин верхніх ділянок грудної клітки, і нижню порожнисту вену, що приймає венозну кров з усіх розташованих нижче ділянок тіла. Впадаючи у праве передсердя, куди вливається і венозна кров судин самого серця, нижня і верхня порожнисті вени замикають систему кровообігу.
Мале коло кровообігу, що починається в ПШ серця, закінчується легеневими венами, що впадають у ліве передсердя. При цьому загальний легеневий стовбур і ЛА несуть венозну кров, що трансформується в легенях в артеріальну і повертається в ліве передсердя. Звідси ЛШ нагнітає її у велике коло кровообігу, що починається аортою і закінчується верхньою та нижньою порожнистими венами, що впадають у праве передсердя.
АРТЕРІАЛЬНИЙ ВІДДІЛ КРОВОНОСНОЇ СИСТЕМИ
Кров, що надходить в аорту в систолу, розподіляється між всіма артеріями великого кола кровообігу, які, залежно від діаметра і будови стінки, умовно поділяються на великі еластичні, середні м’язово- еластичні та більш дрібні, або м’язові. До перших належить аорта, ЛА та їх найбільші великі гілки, в які кров надходить із великою швидкістю і під максимальним тиском, що розвивається в шлуночках серця.
Артерії еластичного типу
Артерії, що забезпечують кров’ю стінки тіла, належать до парієтальних (пристінкових), а ті, що живлять внутрішні органи — до вісцеральних або нутрощевих. Артеріальні стовбури, розташовані між магістральними судинами еластичного чи м’язово-еластичного типу і органом,що постачається кров’ю, позначають як зовнішньоорганні, а ті, що вступають до того чи іншого органу і розгалужуються в ньому — як внутрішньоорганні.
Розгалуження внутрішньоорганних артерій на більш дрібні судини визначається будовою органа і здійснюється за магістральним або розсипним варіантом. У першому випадку діаметр основного артеріального стовбура зменшується поступово, в міру відходження бічних гілок, у другому — артерія відразу ділиться на ≥2 гілок меншого діаметра. Артерії, що забезпечують обхідний кровотік, так звані колатеральні судини, можуть бути міжсистемними, які здійснюють зв’язок між судинами, що одержують кров із різних джерел, і внутрішньосистемними, з’єднуючи гілки однієї артерії.
У стінці артерій розрізняють три оболонки, що відрізняються за будовою в судинах різного калібру (рис. 1.3).
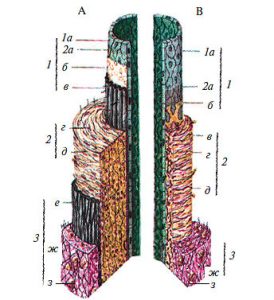
Рис. 1.3. Схема будови стінки кровоносних судин: А — артерія: 1 — внутрішня оболонка: 1а — ендотелій; 2а — базальна мембрана; б — субендотеліальний шар; в — внутрішня еластична мембрана; 2 — середня оболонка: г — гладком’язові клітини; д — еластичні волокна; 3 — зовнішня оболонка: е — зовнішня еластична мембрана; ж — фіброзна тканина зовнішньої мембрани; з — кровоносна судина судини; В — вена: 1 — внутрішня оболонка: 1а — ендотелій; 2а — базальна мембрана; б — субендотеліальний шар; 2 — серединна мембрана: в — скупчення гладком’язових клітин; г — еластичні волокна; д — колагенові волокна; 3 — зовнішня оболонка; ж — фіброзна тканина зовнішньої мембрани; з — кровоносна судина судини
Внутрішня поверхня судин покрита безперервним шаром сплощених клітин ендотелію з регіональними морфофункціональними особливостями. Ендотеліоцити артеріального типу мають неправильну подовжену форму, переважно орієнтовані за течією крові. Міжклітинні межі в моношарі ендотелію мають зубчасту форму, міжклітинні щілини заповнені білково-полісахаридними субстанціями, які внаслідок наявності глікозаміногліканів мають властивості макромолекулярних біологічних фільтрів (рис. 1.4).
Поверхня ендотеліоцитів вкрита тонким шаром глікокалікса, що також містить глікозаміноглікани і сіалові кислоти, аніонні властивості яких мають істотне значення для забезпечення антигемостатичної функції ендотелію. Різко сплощені ендотеліоцити досить широко варіюють за розмірами, досягаючи 500 мкм у довжину і 150 мкм у ширину.
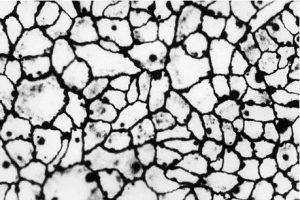
Рис. 1.4. Ендотеліальний моношар аорти
Природна структурна неоднорідність судинного ендотелію найбільше виражена у висхідному відділі, ділянці дуги та верхньої третини низхідного грудного відділу аорти, а також у місцях відгалуження від неї судин, тобто в ділянках, найменш резистентних до атеросклеротичного ураження.
Набір органел ендотеліоцитів стереотипний. Характерною особливістю є добре розвинутий цитоскелет, здатний змінювати ширину міжклітинної щілини і тим самим пасивну, за градієнтом тиску, проникність ендотеліального бар’єра. Активний енергозалежний транспорт речовин із судинного просвіту в субендотеліальний простір або назад здійснюється за допомогою мікропіноцитозних везикул, що формуються плазмолемою.
Відповідно до сучасних поглядів ендотелій — це сукупність високоспеціалізованих клітин епітеліального генеза, об’єднаних у функціональний синцитій, що в кровоносній системі утворює безперервний моношар, який покриває внутрішню поверхню судинної стінки. Розташовуючись між кров’ю і тканиною, судинний ендотелій є мішенню, доступною для будь-яких факторів внутрішнього середовища, а його багатофункціональність зумовлює широкий діапазон морфофункціональних реакцій ендотеліоцитів. Ендотелій поєднує властивості антигемостатичної поверхні та структурно-функціонального модулятора судинної стінки, ключового компонента гістогематичного бар’єра і масивної розгалуженої ланки системи підтримки гомеостазу.
Ендотелій забезпечує трофіку судинної стінки та її адекватне реагування при змінах гемодинаміки, якісного складу та реологічних властивостей крові, тобто адаптацію до будь-яких змін у навколишньому середовищі — плазмі крові та в інтерстиції судинної стінки. Крім цього, ендотелій забезпечує цілісність утвореного моношару і відповідає змінами своєї ауто- і паракринної функції на різноманітні нейрогуморальні сигнали.
Субендотеліальний шар (шар Лангханса) складається з пухкої сполучної тканини, багатої клітинами зірчастої форми, серед яких виявляють поодинокі гладком’язові клітини, орієнтовані за віссю судини. Міжклітинна речовина містить глікозаміноглікани і фосфоліпіди. Товщина субендотеліального шару обернено пропорційна діаметру судини.
Наступний шар стінки аорти та інших судин еластичного типу становить собою сплетення тонких еластичних волокон, які поблизу просвіту судини розташовані переважно циркулярно, набувають поздовжнього розташування у більш глибоких шарах і без чіткої межі переходять в середню оболонку судинної стінки. Цей шар складається з декількох десятків вікончатих еластичних мембран, зв’язаних між собою еластичними волокнами. Простори між ними заповнені проміжною речовиною, гладком’язовими клітинами, що лежать косо відносно мембран, і невеликою кількістю фібробластів.
Зовнішня оболонка стінки цих судин — адвентиція, складається з пухкої сполучної тканини із значною кількістю колагенових та еластичних волокон, орієнтованих в основному поздовжньо та занурених у міжклітинну речовину. Між ними часто виявляють сполучнотканинні клітини, проходять елементи нервової системи, судини, які постачають кров’ю тканини і які відводять лімфу. В цілому конструкція стінки артерії еластичного типу (рис. 1.5) забезпечує її високу еластичність і міцність, необхідну для пом’якшення пульсової хвилі та резервування частини переданої нею енергії серцевих скорочень за допомогою пружної деформації.
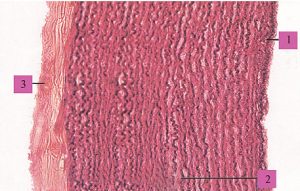
Рис. 1.5. Артерія еластичного типу: 1 — внутрішня оболонка; 2 — середня оболонка; 3 — зовнішня оболонка (фото надано чл.-кор. АМН України, проф. Ю. Б. Чайковським)
Артерії м’язово-еластичного типу
Зі зменшенням діаметра артерії більш тонкими стають і оболонки її стінки. Проте внутрішній шар стінки сонної чи підключичної артерій, що належать до м’язово-еластичного типу, відносно мало змінюється порівняно із судинами більшого калібру. Внутрішня еластична мембрана у них краще структурована, більш виражена, товстіша і міцніша, ніж еластичні елементи, що розташовані глибше. Утворені ними густі сітки лежать між гладком’язовими клітинами, зібраними в пучки, що переплітаються, і орієнтовані в основному за пологою спіраллю відносно осі судини.
У зовнішній оболонці таких артерій помітні шари: внутрішній, який ще містить розрізнені пучки гладком’язових клітин, і зовнішній, утворений поздовжньо- і косорозташованими пучками колагенових та еластичних волокон. Така конструкція стінки дозволяє судинам м’язово-еластичного типу поєднувати високу еластичність і здатність скорочуватися, значно обмежуючи свій просвіт при коливаннях рівня АТ.
Артерії м’язового типу
Судини середнього і дрібного калібрів, такі як плечова, стегнова, променева чи пальцева, як і більшість артерій внутрішніх органів, є артеріями м’язового типу (рис. 1.6).
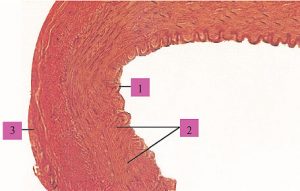
Рис. 1.6. Артерія м’язового типу: 1 — внутрішня оболонка; 2 — середня оболонка; 3 — зовнішня оболонка (фото надано чл.-кор. АМН України, проф. Ю. Б. Чайковським)
Стінка їх також має тришарову будову. Внутрішню оболонку становить ендотеліальний моношар і субендотеліальний шар, що стоншується зі зменшенням діаметра судини, складається з тонких, переважно поздовжньо спрямованих колагенових та еластичних волокон. У міжклітинній речовині, розташованій між ними і багатій глікозаміногліканами, виявляють малодиференційовані сполучнотканинні клітини неправильної зірчастої форми. Межею субендотеліального шару є фенестрована звивиста еластична мембрана, чітко виражена в артеріях м’язового типу значного діаметра.
Середня оболонка судин цього типу формується єдиним еластичним каркасом, структурно і функціонально інтегрованим із кількісно переважаючим гладком’язовим компонентом. Численні гладком’язові клітини медії, як і волокнисті елементи, орієнтовані у вигляді пологої спіралі, а еластичні волокна, розташовані біля поверхні клітин, є для них своєрідними сухожиллями. При цьому волокнисті елементи мають радіальне розташування, утворюючи дуги, вершини яких знаходяться в середині шару, а кінці спрямовані до зовнішньої або внутрішньої оболонки і зливаються з їх еластичними структурами. Побудований у такий спосіб волокнисто-м’язовий каркас судинної стінки надає їй еластичність при розтягненні, забезпечуючи пружність при компресії і тим самим безперервність потоку крові.
Середню і зовнішню оболонки судинної стінки розмежовує зовнішня еластична мембрана із щільними, позбавленими фенестр ділянками, утворена товстими, переплетеними між собою еластичними волокнами. Добре виражена в порівняно великих судинах, вона стоншується зі зменшенням їх діаметра, все більше поступаючись внутрішній мембрані за ступенем розвитку.
Зовнішня оболонка складається пухкою волокнистою неоформленою сполучною тканиною, нерівномірно та нещільно армованою волокнистими елементами. У проміжній речовині між поздовжньо орієнтованими волокнами перебуває невелика кількість адвентиціальних і жирових клітин, а також кровоносні судини, що живлять судинну стінку, елементи нервової системи.
Мікрогемоциркуляторне русло
Розгалуження артерій завершується мікрогемоциркуляторним руслом, де реалізуються основні функції крові щодо підтримки гомеостазу внутрішньотканинного середовища та забезпечення оптимальних умов функціонування тканинних компонентів. Відповідно до гістологічної номенклатури, прийнятої на IX Міжнародному конгресі анатомів (1970), серед внутрішньоорганних судин, що формують мікрогемоциркуляторне русло (рис. 1.7), розрізняють артеріоли, прекапілярні артеріоли (прекапіляри), капіляри, посткапілярні венули (посткапіляри) і венули.
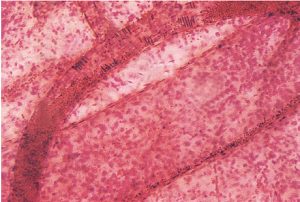
Рис. 1.7. Фрагмент мікрогемоциркуляторного русла
Артеріоли
Перший структурно-функціональний елемент мікрогемоциркуляторного русла — артеріоли (рис. 1.8) — становлять кінцеву ланку артеріального дерева, стінка яких ще зберігає принцип тришарової будови.
Внутрішній шар артеріол складається з ендотеліального моношару, що лежить на базальній мембрані. Краї подовжених ендотеліоцитів артеріол, як і судин більшого калібру, щільно з’єднані між собою спеціалізованими структурами. У субендотеліальній зоні ще наявні вогнищеві вкраплення еластичної мембрани, що пронизані тонкими фібрилами, кінці яких прикріплені до базальної поверхні ендотеліоцитів і до розташованих зовні міоцитів.
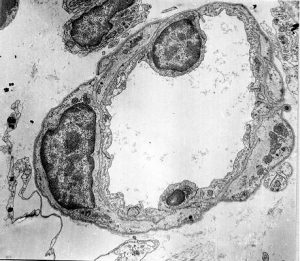
Рис. 1.8. Артеріола на поперечному зрізі
М’язова оболонка артеріол утворена одним суцільним шаром циркулярно розташованих гладком’язових клітин. Завдяки наявності гладком’язового шару, артеріоли здатні відповідати на вплив різних вазоактивних агентів активною зміною величини просвіту. Зовнішній, мало виражений сполучнотканинний шар стінки артеріол, без видимої межі інтегрується в інтерстицій відповідної тканини.
Термінальні розгалуження артеріального дерева, в яких вже відсутні поздовжньо орієнтовані гладком’язові клітинні елементи, а розпушена еластична мембрана втрачає безперервність, є основною ділянкою гасіння пульсової хвилі та зоною найбільшого опору кровотоку в судинному руслі. Ці судини, а також артеріоли і прекапіляри, адекватно реагуючи на системні сигнали та зміни інтенсивності тканинного метаболізму, здійснюють координацію регіональної гемоперфузії відповідно до потреб тканини, яку живлять.
Прекапіляри
Наступною за артеріолами ланкою мікрогемоциркуляторного русла є прекапіляри, короткі й тонкостінні мікросудини, у стінці яких гладком’язовий шар втрачає свою безперервність, а вкраплення еластичної мембрани вже відсутні. Прекапіляри дихотомічно і трихотомічно діляться на капіляри, які іноді відходять і безпосередньо від артеріол. Характерною структурною ознакою прекапілярів є спіралеподібна орієнтація і розрізнене розташування гладком’язових клітин стінки, а також наявність прекапілярних сфінктерів, утворених декількома циркулярно розташованими гладком’язовими клітинами при відгалуженні від артеріол та іноді — у місцях розподілу на капіляри. Між гладком’язовими клітинами прекапілярних сфінктерів і ендотеліоцитами, що покривають просвіт прекапілярів, є множинні міоендотеліальні з’єднання за типом нексусів, що синхронізують функції контактуючих клітин. Прекапілярні сфінктери здійснюють тонке коригування капілярного кровотоку, істотно впливаючи на гемотканинний обмін.
Крім посткапілярів, артеріоли також можуть утворювати анастомози з іншими судинами аналогічного калібру. Проте частіше вони сполучаються через капілярну мережу, де з’єднуються мікросудини, що виходять із різних прекапілярів і відповідно артеріол. Наступні за посткапілярами обмінні мікросудини, або капіляри, які анатомічно з’єднують артеріальний та венозний відділи судинної системи, функціонують як основна ланка, що реалізує транспортно-трофічне забезпечення життєдіяльності тканин і органів. Із всіх компонентів мікросудинної системи капіляри найбільш інтимно зв’язані з тканиною, яку вони живлять, а загальна архітектоніка капілярної мережі відповідає функціональній спеціалізації цього органа.
Кровоносні капіляри
Капіляри — найбільш тонкостінні судини мікрогемоциркуляторного русла. Основним компонентом їх стінки є ендотеліоцити, розташовані на базальній мембрані, і окремі перицити (клітини Руже), що тісно прилягають до базальної поверхні ендотеліального моношару.
Реакції капілярів на зміни тканинного гомеостазу і зовнішні впливи залежать від всіх конструктивних елементів стінки: ендотеліоцитів, перицитів, базальної мембрани.
Діаметр капілярів у різних тканинах коливається в широких межах — від 4,5 до 7 мк у м’язах та нервах, 7–11 мк — у шкірі та слизових оболонках, до 20–30 мк — у залозах внутрішньої секреції. Більше того, залежно від потреб у кровопостачанні відкриті капіляри багатьох тканин здатні трансформуватися у так звані плазматичні — непрохідні для формених елементів крові, у закриті чи резервні, в яких циркуляція рідини на якийсь час практично припиняється. Кількість капілярів у різних органах також неоднакова і визначається інтенсивністю їх метаболізму. Так, на поперечному зрізі м’язової тканини їх кількість може досягати 1400, у шкірі — не більше 40 на 1 мм2.
Проте сумарна площа поперечного перерізу капілярів завжди у багато разів більша, ніж вихідної артерії, що знижує швидкість перфузії та сприяє гемотканинному обміну.
Перевага обмінно-транспортної функції над іншими зумовлює відповідні структурні особливості ендотелію капілярів, їх більш округлу та сплощену форму, менш розвинутий цитоскелет і відносну бідність органелами при досить високому ступені везикуляції. Внутрішня поверхня капілярного ендотелію, вкрита тонким шаром глікокалікса, часто утворює субмікроскопічні виступи і мікроворсини, а краї клітин — маргінальні складки, що вільно звисають у просвіт. І ті, й інші збільшують обмінну поверхню капілярної стінки (рис. 1.9).

Рис. 1.9. Будова стінки кровоносного капіляра соматичного типу
Основні шляхи і механізми трансендотеліального масоперенесення різних речовин — активний транспорт у мікропіноцитозних везикулах, утворених плазмолемою, дифузійні процеси і ультрафільтрація за міжендотеліальними щілинами, прохідність яких обмежують прості з’єднання і з’єднання за типом замка з ущільненнями у вигляді десмосом між контактуючими листками плазмолеми суміжних клітин. Базуючись на сучасних поглядах, мікропіноцитозні везикули — кавеоли — носії активності конституативних NO-синтаз, найважливішого регуляторного механізму судинної стінки.
Інтенсивність гемотканинного обміну багато в чому залежить від градієнта тиску на вході й виході з мікросудини, а також осмотичних характеристик внутрішньотканинного середовища, що оточує капіляри. В ендотелії капілярів деяких органів і тканин (залози внутрішньої секреції, ниркові клубочки, ворсинки кишечнику тощо) спостерігається різке стоншення цитоплазми, аж до злиття внутрішнього і зовнішнього листків плазмолеми, з утворенням так званих фенестр, а в капілярах таких органів, як селезінка чи печінка між ендотеліоцитами є щілини, видимі під світловим мікроскопом.
За ендотеліальним моношаром розташовується базальна мембрана. Її внутрішня поверхня повторює рельєф ендотеліоцитів, а зовнішня має нечіткі контури, вплітаючись своїми фібрилами у міжклітинну речовину, що оточує мікросудини. Завдяки утвореній колагеном тонкофібрилярній структурі й наявності глікозаміногліканів у міжфібрилярному аморфному компоненті базальної мембрани, вона поєднує опорну функцію з властивостями макромолекулярного фільтра.
Посткапіляри
Зливаючись, капіляри утворюють посткапіляри чи посткапілярні венули, які в різних органах варіюють за шириною просвіту та довжиною, але за будовою стінки подібні й практично не відрізняються від капілярів. Завдяки більшій ширині просвіту, посткапіляри поєднують участь в обмінно-трофічних процесах з функціями мікрокомунікації та передають кров, насичену продуктами тканинного метаболізму, з капілярного ложа у збірні венули. Для посткапілярів характерні більш округла форма і більші розміри ендотеліоцитів і, відповідно, більша площа стоншених периферичних відділів клітини, більші мікропіноцитозні везикули, які, зливаючись, частіше формують трансендотеліальні канальці, спрощену структуру міжендотеліальних стиків. Вони утворені простим накладенням крайових зон контактуючих клітин, які перекриваються на значній площі, що зберігає рухливість цих мікросудин і забезпечує істотний резерв ємності.
Структура ендотеліоцитів посткапілярних венул різних тканин має деякі особливості, зумовлені їх приналежністю до різних анатомо-фізіологічних систем: різна товщина ендотеліоцитів, відсутність фенестр у мікросудинах соматичного типу, характерних для м’язової тканини, які наявні в мікросудинах секретуючих органів. До більш товстої, ніж у капілярів, базальної мембрани посткапілярних венул примикає сполучнотканинний футляр шириною 2–3 мкм, частіше виявляються перицити, які, проте, ще не утворюють суцільний шар. Посткапіляри і венули — остання ланка мікрогемоциркуляторного русла і водночас перший компонент венозної системи — утворюють найдрібніші вени за конвергентним принципом.
ВЕНОЗНИЙ ВІДДІЛ КРОВОНОСНОЇ СИСТЕМИ
Вени — спеціалізований відділ кровоносного русла, що збирає кров від органів і тканин і доставляє її до серця. Послідовне злиття судин, що відводять кров, у стовбури зростаючого калібру завершується у великому колі кровообігу утворенням верхньої та нижньої порожнистої вен, а в легеневому — чотирма легеневими венами. Серед вен різного калібру розрізняють дрібні, середні й великі зі структурними та функціональними особливостями.
Загальні закономірності будови стінки вен, як і артерій, пов’язані з умовами їх функціонування. Венозна стінка, більш тонка, ніж артеріальна, також має внутрішню, середню і зовнішню оболонки. Низький тиск і відносно мала швидкість кровотоку зумовлюють значно менший порівняно з артеріями розвиток еластичних елементів у всіх ланках венозного дерева.
Залежно від наявності та ступеня розвитку м’язових елементів вени прийнято відносити до судин безм’язового і м’язового типів, які, в свою чергу, поділяються на ті, що мають мало, середньо та дуже розвинутий м’язовий компонент стінки (рис. 1.10). Найважливішим фактором, що визначає наявність та кількість гладком’язових клітин, крім величини судини, є органоспецифічні особливості гемодинаміки і вплив сили тяжіння, що сприяє або перешкоджає просуванню крові до серця.
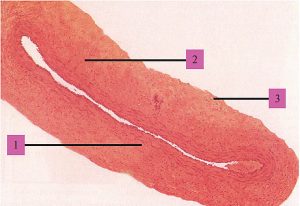
Рис. 1.10. Вена з середнім розвитком м’язових елементів: 1 — внутрішня оболонка; 2 — середня оболонка; 3 — зовнішня оболонка (фото надане чл.-кор. АМН України, проф. Ю. Б. Чайковським)
Венули і дрібні вени
Зливаючись, посткапіляри утворюють збірні венули, просвіт яких коливається в межах 30–50 мкм. Ендотелій, що їх покриває, набуває особливостей, характерних для ендотеліоцитів венозного типу: неправильну округлу форму, збільшену площу клітин за рахунок великої периферичної зони. В ендотеліоцитах венул менше органел, ніж в ендотеліоцитах артерій, значно слабше розвинений цитоскелет, спрощена конструкція міжендотеліальних стиків. У адвентиції збірних венул, яка ще мало розвинута, поряд з перицитами вже наявні клітини веретеноподібної форми, що утворюють невеликі скупчення навколо устя при впаданні посткапілярів. Ультраструктура цих клітин відповідає примітивним гладком’язовим клітинам, їх цитоплазма заповнена філаментозними структурами і електроннощільними тільцями, які верифікують як елементи контрактильного апарату.
Зі збільшенням калібру відвідних судин до ≥50 мкм, клітинний склад їх стінки набуває гетерогенності, зумовленої функціональною диференціацією. Справжні гладком’язові клітини, що з’явилися, розміщуються між базальною мембраною, що покриває ендотеліальний моношар, і глибше розташованими фібробластами, оточеними волокнистими елементами сполучної тканини. У судинах, діаметр яких не перевищує 100 мкм, середній шар стінки містить лише один ряд розрізнених безладно орієнтованих гладком’язових клітин із малорозвиненим контрактильним апаратом. Характерною рисою ендотеліоцитів цих мікросудин, які в цілому мало відрізняються від клітин посткапілярів і збірних венул, є наявність спеціалізованих органел — «стрижнеподібних» гранул, або «тілець Вейбеля», з компактним своєрідно структурованим вмістом.
Венули і дрібні вени пов’язані між собою численними анастомозами, розташованими на різних рівнях, які поєднують венозні мікросудини в єдину систему відтоку крові з капілярного басейну. На відміну від артеріальних, венулярні анастомози, що не мають структур, які забезпечують активну регуляцію кровотоку, організовані за принципом дублювання його шляхів, що підвищує надійність гемотранспортуючої системи. Структура тонкої стінки, що легко дилатує, звивисті й дугоподібні форми венозних коренів, що часто анастомозують, адаптовані до виконання ними резервуарної функції й до вибору оптимальних на цей момент шляхів відтоку крові чи її перекидання по рівнозначних ланках венулярної сітки.
Посткапілярні та збірні венули поєднують транспортну і ємнісну функції з резистивною і зумовлюють близько 20% загального судинного опору. Особливості локалізації як пост-, так і прекапілярів судинного ланцюга зумовлюють можливість контролю капілярного кровотоку за допомогою, насамперед, реологічного і в деякій мірі вазомоторного механізмів. Зростання гідростатичного тиску в капілярах при підвищенні опору в посткапілярних венулах зумовлює вихід рідини з крові аж до розвитку набряку інтерстиція, а його зниження переорієнтовує рух рідини у протилежному напрямку, в судинне русло.
Вени безм’язового типу
До судин безм’язового типу належать вени мозкових оболонок, сітківки ока, кісток, плаценти, селезінки. Загальна особливість вен цих органів — низький опір кровотоку внаслідок піддатливості судинної стінки при змінах кров’яного тиску, що полегшує евакуацію крові під дією її власної сили тяжіння. Частково це зумовлено пасивністю неспадних судин, зрощених із тканинами органів, які дренуються ними. Спрощена структура стінки цих судин складається з широких ендотеліоцитів венозного типу із звивистими границями, що покривають її внутрішню поверхню. До ендотеліоцитів примикає добре виражена базальна мембрана, під якою розташований тонкий шар пухкої сполучної тканини.
Вени із слаборозвиненими м’язовими елементами
До цього типу судин належать вени як дрібного або середнього, так і великого калібрів, включаючи верхню порожнисту вену, в яких сила тяжіння самої крові відіграє важливу роль як рушійна сила кровотоку. Стінки вен діаметром 1–2 мм, що зазвичай супроводжують артерії м’язового типу у верхній частини тулуба, а також більших, таких як вени верхніх кінцівок, помітно поступаються товщиною перед відповідними за калібром артеріями, насамперед за рахунок меншого вмісту гладком’язових клітин. Невелика їх кількість розташовується в середній оболонці судинної стінки у вигляді циркулярних пучків під маловираженим субендотеліальним шаром і розмежовується волокнистими елементами та міжклітинною речовиною.
У великих венах цього типу, незважаючи на більший об’єм крові, що протікає, стінка залишається досить тонкою, а шари, що її утворюють, малорозвинені та нечітко розмежовані. Базальна мембрана, що примикає до ендотеліального моношару, розташована на субендотеліальному шарі, що складається з досить рідких розрізнених волокон і сполучнотканинних клітин. Медія містить незначну кількість гладком’язових клітин, зібраних у циркулярно розташовані пучки, які розділені пухкою сполучною тканиною. Її нерівномірні прошарки безпосередньо переходять у зовнішню оболонку, що за товщиною в 3–4 рази перевищує обидві інші. Завдяки великій кількості косо і циркулярно розташованих колагенових волокон, а також поздовжньо спрямованим еластичним структурам, адвентиція є основною опірною структурою венозної стінки.
Стінка вен із середнім розвитком м’язових елементів характеризується рядом структурних особливостей. Вона багата на волокнисті елементи, ендотеліоцити, що покривають її, мають більш подовжену форму, краще виражений субендотеліальний шар. На межі з медією розміщується сітка еластичних волокон, які зв’язані в єдиний каркас з такими ж структурами середньої та зовнішньої оболонок. У внутрішній оболонці, поряд із циркулярними пучками гладком’язових клітин, наявні і клітини, орієнтовані поздовжньо. Прошарки сполучної тканини, що розмежовують гладком’язові пучки, зливаються з добре розвинутою адвентицією. Серед волокнистих структур останньої, орієнтованих переважно поздовжньо, виявляють гладком’язові клітини, що лежать як окремо, так і утворюють пучки з такою самою орієнтацією.
Вени із сильнорозвиненими м’язовими елементами
Для стінки судин цього типу характерна наявність численних гладком’язових пучків у всіх оболонках. У внутрішній та зовнішній оболонках вони мають поздовжній напрямок, а в середній розміщуються циркулярно. Добре розвинений гладком’язовий компонент необхідний для протидії силі тяжіння крові, що просувається в напрямку до серця під низьким тиском. Збільшення діаметра судин цього типу супроводжується «перерозподілом» гладком’язових клітин між шарами їх стінки: кількість м’язових пучків у медії зменшується, а в зовнішній оболонці збільшується.
Розподіл гладком’язових клітин у судинних оболонках функціонально детермінований. Ритмічні скорочення при їх циркулярному розташуванні допомагають ортоградному просуванню крові, в той час як поздовжня орієнтація пучків сприяє утворенню поперечних складок судинної стінки, які разом із клапанним апаратом дрібних, середніх (2–5 мм) і деяких великих (>5 мм в діаметрі) вен обмежують можливість ретроградного руху крові.
Клапаноподібні утворення з’являються вже в дистальних відділах венозної системи, в судинах калібром від 0,05 мм, де залежно від розміру судини вони становлять примітивні потовщення внутрішньої оболонки стінки чи складки інтими, що утворюють парні кишені. У периферичних відділах мікроклапани поділяють на пристінкові і розташовані біля устя, які локалізуються в місцях впадання менших за калібром судин у більші і блокують регургітацію крові.
Зі збільшенням калібру вен будова їх клапанів ускладнюється. У судинах середнього калібру це тонкі складки внутрішньої оболонки, основу яких становить волокниста сполучна тканина. На стороні, зверненій у просвіт судини, переважають еластичні структури, а на протилежній — колагенові волокна. Ендотеліальні клітини на поверхні стулки, зверненої в просвіт судини, мають подовжену форму і орієнтовані за течією крові, тоді як на протилежній стороні вони полігональні, розташовані хаотично і мають переважно полярну орієнтацію.
Товщина стінки судин, що завершують цей відділ венозної системи, у великому ступені визначається зовнішньою оболонкою, що досягає максимального розвитку в нижній порожнистій вені. Нечітко відмежовані внутрішній і середній шари стінки цього колектора за товщиною в 5–7 разів поступаються зовнішній оболонці, утвореній численними пучками гладком’язових клітин, що лежать поздовжньо і оточені волокнистими елементами. Сполучна тканина, що розділяє їх, містить шляхи лімфовідтоку і численні нервові волокна, які закономірно наявні у всіх судинах із досить добре диференційованою адвентицією.
За топографічною ознакою вени поділяються на поверхневі, що, як правило, ідуть самостійно, і глибокі, які йдуть або попарно з одноіменними артеріями, часто у складі судинно-нервового пучка, або є непарними, як, наприклад внутрішня яремна, підключична, пахвова, стегнова, клубова та деякі інші вени. Нерідко поверхневі й глибокі венозні стовбури з’єднані анастомозами — прободаючими венами. Численні зв’язки між сусідніми венами на поверхні чи в стінці деяких органів (сечовий міхур, пряма кишка) формують венозні сплетення.
Артеріовенозні анастомози
Між артеріальним і венозним відділами судинної системи існують анастомози різних типів (рис. 1.11), які функціонують як на рівні мікросудин, так і у проксимально розташованих ділянках судинного русла.
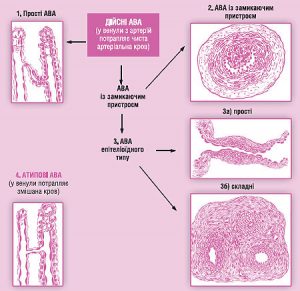
Рис. 1.11. Артеріоловенулярні анастомози (АВА): 1) прості АВА: у стінці анастомозу будова артеріоли безпосередньо змінюється будовою венули; 2) АВА типу замикаючих артеріол: у субендотеліальному шарі — валики, утворені розташованими поздовжньо міоцитами. При скороченні останніх анастомоз закривається; 3а) АВА епітеліоїдного типу (прості): у середній оболонці анастомозу — овальні світлі клітини, схожі на епітеліальні; 3б) АВА епітеліоїдного типу (складні): артеріола й венула пов’язані відразу декількома анастомозами епітеліоїдного типу, які містяться у спільній сполучнотканинній капсулі; 4) атипові АВА (напівшунти): між артеріолою та венулою — коротка судина капілярного типу, тому у венулу потрапляє не артеріальна, а змішана кров
Артеріовенозні анастомози забезпечують перерозподіл потоків крові, минаючи капілярну мережу, між судинами, які належать переважно до термінального кровоносного русла та істотно відрізняються за перфузійним тиском. У фізіологічних умовах вони беруть участь у регуляції кровонаповнення відповідних органів при змінах функціонального навантаження, при патології, наприклад при ангіоспазмі травматичного чи запального характеру, впливі термічних, хімічних або механічних факторів, при онкологічній патології чи АГ.
Залежно від будови артеріовенозні анастомози поділяють на ті, що включають епітеліоподібні м’язові елементи і ті, що побудовані за типом замикаючих артерій. В останньому випадку ширина просвіту контролюється орієнтованими поздовжньо гладком’язовими клітинами, що утворюють у субендотеліальній зоні на межі з внутрішньою еластичною мембраною скупчення з потужним еластичним каркасом. Скорочення цих гладком’язових клітин може призводити до повного перекриття просвіту судини. Анастомози такого типу відзначають у шкірі пальців, діафрагмі, брижі, плеврі, легенях та інших органах.
За будовою анастомози з епітеліоподібними елементами поділяють на прості, які відходять від артерії майже під прямим кутом і впадають у відповідну вену, і клубочкові, що розпадаються на кілька вторинних гілок й іноді закінчуються в різних венозних судинах. Артеріальні й венозні сегменти анастомозів неоднакові за структурою. Ці особливості краще простежуються у простих анастомозах цього типу, в артеріальному сегменті яких під тонкою внутрішньою оболонкою, що складається з ендотеліоцитів, тонкого субендотеліального шару і внутрішньої еластичної мембрани розташовуються пучки гладком’язових клітин медії, поздовжні — внутрішні та циркулярні — зовнішні.
Завдяки добре розвинутому поздовжньому м’язовому шару медії, при її скороченні на внутрішній поверхні судини утворюються складки, здатні закривати просвіт судини. Клітини цього шару мають ряд особливостей: вони коротші від звичайних міоцитів, мають світлу цитоплазму, овоїдної форми ядра, а не, як зазвичай, — паличкоподібні.
У міру наближення до вени просвіт анастомозу стає ширшим, стінка тоншою, а гладком’язові клітини — більш округлі; у їх світлій гомогенній цитоплазмі з’являється дрібна базофільна зернистість. Стінки артеріовенозних анастомозів мають здатність спонтанно скорочуватися, проте ритм цих скорочень може коригуватися нейрогуморальними факторами регіонального та системного походження.
Інтермедіарний обмін
Обов’язковою умовою підтримки гомеостазу внутрішньотканинного середовища є, поряд із доставкою кисню і субстратів, що утилізуються тканиною, звільнення інтерстиція від надлишку рідини і шлакових продуктів тканинного метаболізму. Ця і ряд інших життєво важливих функцій реалізуються в системі мікроциркуляції, що, незважаючи на виражену органоспецифічність, організована за єдиним принципом. Основу цієї системи становить мікрогемоциркуляторне русло — комплекс структурно і функціонально диференційованих елементів, тих, що приймають і відводять кров, регулюють інтенсивність гемоперфузії, забезпечують гемотканинний обмін, а також беруть участь у гуморальній регуляції клітинних та міжклітинних процесів.
Спеціалізовані клітинні елементи, інтегровані сполучною тканиною, разом із фрагментом мікрогемоциркуляторного русла формують мікроділянку тканини, що має основні структурні та функціональні властивості відповідного органа.
Кров, що протікає по артеріолах і прекапілярах, надходить в обмінний відділ мікрогемоциркуляторного русла, основу якого становлять капіляри і посткапіляри. Їх трофічна функція складається не лише з доставки кисню та різних речовин клітинам тканини, що живиться, але й у реабсорбції води та дрібнодисперсних, розчинних продуктів тканинного обміну. Втрата інтерстицієм води викликає зростання концентрації грубодисперсних метаболітів та підвищення осмотичного тиску, що може порушувати нормальне співвідношення між фільтрацією рідини з капілярів у тканину та її реабсорбцією в дистальні відділи мікрогемоциркуляторного русла. Ця ситуація коригується внутрішньоорганною лімфатичною системою, що спеціалізується на виведенні з тканини метаболітів та інших субстанцій, які можуть порушувати її осмотичний баланс та нормальне співвідношення між колоїдною і неколоїдною фазами міжклітинної речовини.
ЛІМФАТИЧНА СИСТЕМА
Лімфатична система анатомічно складається з капілярів, посткапілярів, які часто анастомозують, інтраорганних судин різного калібру і екстраорганних шляхів відтоку лімфи, що доставляють її до лімфатичних вузлів і далі, у правий та лівий лімфатичні протоки. Будова внутрішньоорганного лімфатичного русла в кожному випадку визначається структурою та функцією конкретного органа чи тканини, тоді як будова лімфатичних мікросудин досить стереотипна.
Периферичні відділи лімфатичного русла представлені сліпими мішкоподібними виростами і замкнутими сітками. Вони оточують протоки залоз і кровоносні судини у м’язах і паренхіматозних органах і характеризуються безліччю анастомозів.
Лімфатичні капіляри і посткапіляри
Для лімфатичних капілярів характерні звивистість, нерівномірність ширини просвіту, злиття в полігональні осередки з утворенням розширень — лакун — у місцях злиття петель лімфатичної сітки. Тонка стінка сплощених лімфатичних мікросудин складається з «розпластаних» ендотеліоцитів, які переважають за площею клітини кровоносних капілярів майже в 4 рази, чергуються з більш округлими клітинами ендотелію, навколоядерні зони яких помітно виступають у просвіт. Стінки лімфатичних капілярів, які за величиною просвіту значно переважають кровоносні, утворюють 3–4 ендотеліоцити; їх тіла нерівномірні за товщиною, а цитоплазма — за електронною щільністю. Відмінна риса лімфатичних капілярів — відсутність базальної мембрани — макромолекулярного фільтра, що зміцнює стінку кровоносних мікросудин. Міжендотеліальні контакти утворюються або простим накладенням крайових зон суміжних клітин, або ускладнені інтердигітаціями; закриті стики легко трансформуються у відкриті.
За капілярами ідуть посткапіляри, які відрізняються від капілярів більшим діаметром, наявністю переривчастої базальної мембрани, зон оклюзії, наявністю, поряд із розширеними міжендотеліальними щілинами, стиків, щільно закритих і укріплених спеціалізованими структурами, так званими плямами облітерації. Характерна також поява клапаноподібних структур, які спочатку представлені складками, утвореними інвагінацією дистального відрізка посткапіляра у просвіт проксимального, і примітивними двостулковими клапанами, що складаються з двох шарів ендотеліоцитів.
Лімфатичні судини
Перехід від посткапілярів до судин, що відводять лімфу, супроводжується зануренням у міжендотеліальний простір стулок волокнистих елементів, стромальних клітин та посиленням цитоскелета ендотеліоцитів, що покривають їх. Стінка сформованих судин складається з ендотеліального моношару і вже чітко диференційованої адвентиції, утвореної волокнистими та клітинними компонентами сполучної тканини, тоді як стулки їх клапанів формуються розвиненою інтимою без участі адвентиціальної оболонки.
У місці переходу капілярів у лімфатичну судину його калібр досить мінливий, а злиття посткапілярів не завжди супроводжується збільшенням діаметра судини. Лімфатичні судини розподіляються на інтра- й екстраорганні, а залежно від діаметра — на дрібні, середні та великі з відповідними особливостями будови стінки. Внутрішньоорганні судини, як і лімфатичні капіляри, часто анастомозують, формуючи більш-менш густу сітку. Вже на цьому рівні вони набувають характерної чіткоподібної форми, що зумовлена звуженнями просвіту в місцях розташування численних клапанів, які забезпечують ортоградний рух лімфи.
В екстраорганних лімфатичних судинах діаметром >0,2 мм вже помітні внутрішня, середня та зовнішня оболонки. У міжклапанних сегментах з’являються розрізнені групи поздовжньо орієнтованих гладком’язових клітин, які зі збільшенням калібру і переходом тонкостінних ініціальних судин у збірні формують суцільний шар. Внутрішня оболонка таких судин вкрита ендотеліальним моношаром, що опирається на суцільну базальну мембрану, під якою перебувають поздовжньо і косо орієнтовані колагенові та еластичні волокна. Проте еластична мембрана на межі з медією судини незначно виражена. Стулки клапанів цих судин, утворені медією, мають сполучнотканинну основу, в якій з’являються гладком’язові клітини.
При однаковій ширині просвіту, стінки позаорганних судин мають більш складну будову, ніж інтраорганні. Середня оболонка стінки складається з пучків поздовжньо і спірально орієнтованих гладком’язових клітин, колагенових та еластичних волокон, кількість, товщина і напрямок яких непостійні. Як і у венах, гладком’язовий шар у лімфатичних судинах голови, верхньої частини тулуба і верхніх кінцівок розвинений значно менше, ніж у нижній частини тіла, де транспорт лімфи поєднується з подоланням сили тяжіння.
Зовнішня оболонка лімфатичних судин складається з пухкої волокнистої неоформленої сполучної тканини. Судини нижніх кінцівок, як і колектори клубового лімфатичного сплетення, включають гладком’язові клітини, кількість пучків яких пропорційна калібру судини. У судин правого і лівого грудних протоків зовнішня оболонка в 3–4 рази товстіша двох інших оболонок за рахунок наявності потужних поздовжньо-орієнтованих гладком’язових пучків, розділених сполучнотканинними прошарками. Стінку лімфатичних судин значного калібру живлять vasa vasorum, які разом з елементами вегетативної нервової системи розміщуються в пухкій сполучній тканині їх зовнішньої оболонки.
Архітектоніка та гістотопографія сплетень лімфатичних судин визначаються будовою органа та інтенсивністю гемотканинного обміну. Початкові лімфатичні судини включаються безпосередньо в капілярну мережу, розміщуючись незалежно від кровоносних судин. Наступні за ними судини вже не з’єднуються ні з лімфатичними капілярами, ні з посткапілярами і входять до складу судинно-нервового пучка. Вони використовують пульсацію крові для просування лімфи, евакуація якої, як і резорбція інтерстиціальної рідини, є досить складним і не до кінця вивченим процесом.
Лімфоутворення та лімфотечія
Лімфоутворення і лімфотечія визначаються існуванням невеликого градієнта гідростатичного і колоїдно-осмотичного тиску між інтерстиціальною рідиною і лімфою. Ортоградна спрямованість потоку лімфи забезпечується на рівні посткапілярів і судинної ланки клапанним апаратом, що блокує ретроградне переміщення лімфи.
Регіональна лімфатична мережа структурно адаптована до тканин і органів, що дренуються, проте її функціонування здійснюється за стереотипним принципом і включає процеси резорбування інтерстиціальної рідини, формування лімфи та її евакуацію із тканини.
У людини з масою тіла 70 кг добовий об’єм рідини, що надходить в інтерстицій, приблизно 20 л, з яких до 75% повертається назад у кров через венозні шляхи, а близько 25% дренується лімфатичним руслом. Лімфа не ідентична інтерстиціальній рідині, становить майже прозору, білувату чи злегка жовтувату рідину, рН якої коливається залежно від місця утворення, прийому їжі чи функціональної активності тканини в межах 7,4–9, а щільність — 1,012–1,023. Підвищення активності тканини, проникності гістогематичного бар’єра чи посилення фільтраційних процесів у напрямку тканина – інтерстицій в умовах гіперемії є стимулами для лімфоутворення і прискорення лімфотечії, неадекватність якої призводить до розвитку набряку.
Цикл роботи початкових відділів лімфатичного русла складається із трьох послідовних фаз: наповнення, проміжної фази та фази вигнання резорбованої рідини у проксимальні відділи. Надлишкова гідратація інтерстиція, що оточує лімфатичні капіляри, супроводжується відкриттям стиків між ендотеліоцитами капілярної стінки і підвищенням її проникності. Процес заповнення початкових відділів лімфатичного русла полегшується відсутністю в них базальної мембрани.
Заповнення просвітів лімфатичних мікросудин рідиною, що містить білки, змінює градієнт тиску на стінці, зумовлюючи закриття міжендотеліальних стиків у проміжну фазу процесу і попереджаючи зворотний витік макромолекул в інтерстицій. Вміст білка в лімфі мікросудин приблизно в 3 рази вищий, ніж в інтерстиції, причому у фазу вигнання цей показник в 5 разів більший, ніж при заповненні капілярів.
Фаза вигнання, що завершує цикл, визначається декількома факторами. При компресії елементів лімфатичного русла деяка частина рідини та дрібнодисперсних молекул фільтрується у тканину. Проте частинки і макромолекулярні білки резорбовані капілярами, залишаються в лімфі, що відтікає, завдяки фіксованим міжендотеліальним стикам, що підвищують щільність судинної стінки.
Евакуація лімфи, що утворюється в органі, здійснюється екстраорганними судинами, які виходять з його воріт до однієї (яєчник, яєчки, нирки, легені, серце) чи декількох (щитовидна і підшлункова залози, шлунок, тонкий і товстий кишечник) груп лімфатичних вузлів.
Лімфатичні вузли
Понад 600 лімфатичних вузлів,наявних в організмі людини, є плюрипотентними органами, які беруть участь у лімфотранспортних процесах, кровотворенні, системі імунітету. Розміри та форма лімфатичних вузлів досить варіабельні, їх довжина коливається в межах 1–20 мм. На увігнутій стороні в лімфовузол через ворота проникають артерії, нервові елементи і виходять вени (рис. 1.12).
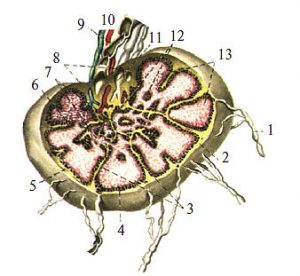
Рис. 1.12. Схема будови лімфатичного вузла: 1 — приносна лімфатична судина; 2 — капсула; 3 — трабекула; 4 — підкапсулярний лімфатичний синус; 5 — лімфоїдний вузлик; 6 — інтерстиціальний синус; 7 — м’якотні тяжі; 8 — виносна лімфатична судина; 9 — вена; 10 — артерія; 11 — воротний синус; 12 — мозкова речовина; 13 — коркова речовина
Артерії проходять у сполучній тканині трабекул, сполучнотканинних відгалуженнях капсули і розгалужуються в корковій речовині, яка розміщена субкапсулярно, і мозковій речовині паренхіми, що займає середню зону вузла і складається з ретикулярної тканини та клітинних елементів.
Лімфатичні судини, що приносять лімфу, розподіляються по поверхні лімфатичного вузла і вступають у його крайовий синус. Просуваючись вздовж трабекул, лімфа потрапляє в проміжні синуси, збирається у воротному синусі й надходить у виносні лімфатичні судини, які залишають лімфатичний вузол в ділянці його воріт. Лімфа, що переміщується по синусах, контактує з ретикулоендотеліальними клітинами з високою фагоцитарною активністю; при цьому збагачується лімфоцитами, які надходять із фолікулів і мозкових тяжів паренхіми вузла.
Лімфатичні вузли — механічний та біологічний фільтр, що затримує надходження у кров сторонніх часток, мікроорганізмів, клітин злоякісних пухлин, токсинів, чужорідних білків. Вони можуть неодноразово опинятися на шляху лімфи, наприклад 5–6 разів у верхній і 8–10 разів у нижній кінцівках. По шляху до лімфовузлів лімфатичні судини часто анастомозують і зливаються з утворенням головних та другорядних стовбурів. Множинність шляхів відтоку лімфи підвищує ефективність лімфотранспортної системи. Екстраорганні лімфосудини, що прямують до регіональних і віддалених лімфовузлів, нерідко звиваються навколо кровоносних судин, які вони супроводжують.
Калібр судин, які відводять лімфу від різних органів, неоднаковий і коливається в межах 0,025–1,8 мм відповідно до маси органа, що дренується. При цьому збільшення діаметра судини в міру наближення до лімфатичних колекторів не є настільки закономірним, як у кровоносному руслі.
Коливання тиску в правому і лівому венозних кутах, куди впадають відповідні грудні протоки, передаються лімфі, що транспортується ними, сприяючи її надходженню в венозну кров або утруднюючи лімфовідтік.
Серце і перикард
Перикард
Перикард (серцева сорочка) – замкнутий серозний мішок, що з усіх боків оточує серце. Порожнина перикарда включає також легеневий стовбур аж до його біфуркації і висхідну частину аорти до переходу її в дугу. Крім того, в порожнину перикарда включені термінальні сегменти легеневих, верхньої та нижньої порожнистих вен, які прикриті перикардом лише по своїй передній поверхні.
Передня стінка перикарда прилягає до медіастенальної та внутрішньогрудної плеври, вгорі стикається з відкладеннями жирової клітковини, вилочковою залозою, нижче — з передньою грудною стінкою. Задня поверхня серцевої сорочки прилягає до правої ЛА, стравоходу, трахеї і головних бронхів, аорти, стикається з розміщеними між нею і плеврою стовбурами блукаючих нервів. Основа перикарда міцно зрощена із сухожильним центром діафрагми. Звичайний вміст порожнини серцевої сорочки — близько 50 мл прозорої рідини солом’яно-жовтого кольору.
У перикарді розрізняють зовнішній фіброзний і внутрішній серозний шари з гладкою, блискучою, блідою поверхнею, покритою мезотелієм. Серозний шар перикарда складається з парієтальної та вісцеральної пластинок, які покривають поверхню серця, за винятком зони впадання легеневих вен і невеликої ділянки задньої поверхні правого передсердя між устями верхньої та нижньої порожнистих вен. Між парієтальним листком перикарда і епікардом існує кілька пазух, найбільшими з яких є поперечна, біля початкових відділів аорти і легеневого стовбура, коса, розміщена в нижній частині заднього відділу перикарда, в ділянці термінального сегмента нижньої порожнистої вени, і передньонижня в зоні кута між передньою грудною стінкою та діафрагмою.
Кровопостачання перикарда здійснюється численними артеріальними гілками, що виходять в основному з внутрішньої грудної артерії, відгалуженнями грудної аорти й артерій, що живлять навколишні органи і тканини (тимус, стравохід, бронхіальне дерево та ін.). Венозна кров відтікає через сплетення, які утворюються венами перикарда, і по венозних судинах сусідніх органів.
Іннервація перикарда здійснюється відгалуженнями блукаючих і симпатичних нервів з поверхневого і глибокого екстракардіального, артеріального, переднього, заднього легеневого і стравохідного сплетень. В іннервації перикарда беруть участь також гілки лівого зворотного гортанного і міжреберних нервів.
Численні шляхи лімфовідтоку проходять через верхні та нижні лімфатичні вузли переднього середостіння, навколостравохідні, біфуркаційні та прикореневі вузли легень.
Топографія серця
Серце — м’язовий порожнинний чотирикамерний орган, розміщений у грудній порожнині у складі органів середнього середостіння. За формою нагадує неправильний конус, основа якого повернена вгору і дещо назад, а верхівка — косо зверху вниз, справо наліво і ззаду наперед. Розрізняють три основні форми серця: конусоподібну, при якій горизонтальна вісь більше вертикальної, що характерно для астенічного типу статури; кулясту, що відзначають при гіперстенічному типі, коли горизонтальна вісь довша вертикальної; перехідну, або змішану, при середньотиповій конституції.
В орієнтації вертикальної осі серця розрізняють три основні варіанти: поперечна, або горизонтальна, коли її кут з поздовжньою віссю тіла становить 55–65°, діагональна, або коса (45–55°), і поздовжня (вертикальна), якщо цей кут дорівнює 35–45°. Варіабельність форми серця поєднується з варіабельністю його розмірів. Середня довжина вертикальної вісі серця від верхівки до основи коливається в межах 10–16 см, ширина біля основи — 8–12 см, а передньозадній розмір (товщина) на цьому ж рівні — 6–8,5 см. Середня маса серця також має індивідуальні коливання, становить 0,5–0,57% маси тіла і досягає у дорослої людини 300 г.
АНАТОМІЯ СЕРЦЯ
Серце має 3 поверхні: передню (грудиннореберну), латеральну (реберну) і нижню (діафрагмальну). На грудиннореберній поверхні розташована коронарна борозна, вище якої знаходиться праве передсердя і його вушко, що прикривають висхідний відділ аорти та загальний легеневий стовбур, вушко лівого передсердя, що лежить за легеневим стовбуром. На цій же поверхні зліва від передньої міжшлуночкової борозни розміщені ділянка ЛШ і верхівка лівого передсердя. Легенева, чи латеральна, поверхня серця прикрита легенями, її можна побачити лише при їх відведенні. Вона представлена задньою стінкою лівого передсердя і ЛШ. Нижня, чи діафрагмальна, поверхня серця трохи сплощена порівняно з передньою. Її утворюють стінка ЛШ разом із розміщеними справа та дещо позаду від нього ділянками правого передсердя і ПШ. Лівий заокруглений, більш масивний, так званий тупий край серця сформований його ЛШ, а загострений правий — переважно тонкостінним ПШ.
На поверхні серця, крім коронарної борозни, що розмежовує передсердя та шлуночки, розрізняють передню і задню (нижню) міжшлуночкові борозни, що відповідають границі шлуночків. Коронарна борозна (sulсus coronarius cordis) на передній поверхні серця має ширину 5–7 мм, на задній — 5–10 мм. Попереду вона проходить по основі ПШ, далі — під аортою та загальним легеневим стовбуром і по основі лівого вушка.
Передня міжшлуночкова борозна (sulcus interventricularis anterior), що починається біля легеневого стовбура від зовнішньої чверті коронарної борозни, є орієнтиром переднього краю міжшлуночкової перегородки. Вона ділить грудиннореберну поверхню серця на дві нерівні частини — праву, більш велику, утворену ПШ, і меншу, що належить ЛШ. Продовжуючись, ліва міжшлуночкова борозна (sulcus interventricularis posterior) в ділянці вирізки верхівки з’єднується із задньою міжшлуночковою борозною, що є проекцією заднього краю міжшлуночкової перегородки на діафрагмальній поверхні серця. Початок задньої міжшлуночкової борозни відповідає місцю впадання коронарного синуса у праве передсердя.
Передня і задня міжпередсердні борозни (sulcus interventricularis anterior et posterior) також добре помітні. Перша розташована за аортою у вигляді вузької смужки м’язового втягнення від кореня аорти до медіального краю устя порожнистої вени, а задня — між устями верхньої та нижньої порожнистої вен біля кореня правої легені. Борозни заповнені шаром жирової клітковини, вираженість якого залежить від маси тіла людини.
З правого і лівого передсердь кров переміщається в ПШ і ЛШ, звідки викидається відповідно в легеневий стовбур, який починає мале коло кровообігу, і в аорту, від якої відходять численні артерії великого кола до органів, стінок тіла і кінцівок. Передсердя сполучаються з ПШ і ЛШ передсердно-шлуночковими (AV) отворами, які закриваються три- і двостулковим клапанами (рис. 1.13). На початку аорти і легеневого стовбура є клапани із напівмісячних заслонок.
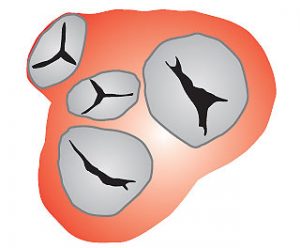
Рис. 1.13. Клапани серця
Камери серця
Праве передсердя (atrium dextrum) має форму неправильного циліндра чи куба зі згладженими кутами (рис. 1.14).
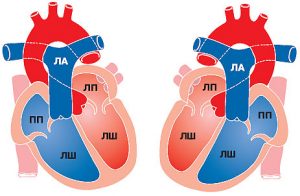
Рис. 1.14. Порожнини серця
Об’єм правого передсердя у людини віком 18–25 років становить 100–105 см3, залишаючись стабільним до 60 років, після чого збільшується ще на 5–10 см3. У дорослих жінок він на 3–6 см3 більший, ніж у чоловіків. При подовженій формі серця передсердя також витягнуте зверху вниз, при кулястій — у передньо-задньому напрямку. Тиск крові у правому передсерді становить 6–15 мм рт. ст.
Лінійні розміри правого передсердя серця, що повністю сформувалося, становлять: передньозадній — 1,1–4,2 см, сагітальний — 1,2–3,5 см, вертикальний — 1,3–3,7 см, які визначаються в кожному конкретному випадку індивідуальними особливостями форми серця. Товщина стінки правого передсердя досягає 2–3 мм, а його середня маса у дорослих — 17–27 г, що становить 7,2–9,6% загальної маси серця.
У правому передсерді виокремлюють 3 відділи — власне передсердя, праве вушко і синус порожнистих вен, а також верхню, передню, задню, латеральну і медіальну стінки. На перегородці (septum interatriale), що розділяє передсердя, є поглиблення овоїдної форми, овальна ямка (fossa ovalis), дно якої стоншене і складається з листків ендокарда. Зверху і спереду краї овальної ямки потовщені (перешийок В’єссена). Відкритий овальний отвір, що зазвичай заростає на 5–7-му місяці внутрішньоутробного розвитку плода, відзначають майже в половині випадків вроджених пороків серця.
Порожнину правого передсердя обмежують разом із медіальною стінкою ще чотири стінки. Верхня, розташована між устями порожнистих вен, має гладку внутрішню поверхню. Передня, гладка з середини, що знаходиться нижче усть порожнистих вен, прилягає до задньої поверхні висхідної аорти. На задній стінці правого передсердя, що стикається з правим бронхом і правою ЛА, є численні трабекули. Зовнішня, на якій розташоване праве вушко, також має характерну трабекулярну структуру.
Праве вушко об’ємом 10–35 мл має трикутну форму. М’язові трабекули, що формують його стінку, мають різну спрямованість. У задньому сегменті вушка розміщений м’язовий валик (пограничний гребінь), що відокремлює венозний синус від порожнини правого передсердя. Порожнина вушка переходить у праве передсердя, не утворюючи шийки, а його діаметр, як і розміри самого вушка, широко варіюють і можуть становити 0,5–4,5 см.
Праве передсердя приймає кров із верхньої і нижньої порожнистих вен, а також із коронарного синуса серця і його численних малих вен. У місцях впадання порожнистих вен міокард передсердя потовщений за рахунок кільцеподібних м’язових валиків. Устя верхньої порожнистої вени перебуває на межі верхньої та передньої стінок передсердя. Його діаметр становить 1,6–2,3 см. Місце впадання нижньої порожнистої вени, розташоване між верхньою, задньою та внутрішньою стінками передсердя, обмежене напівмісячною складкою епікарда — євстахієвою заслінкою шириною близько 1 см. Діаметр устя нижньої порожнистої вени досягає 2,1–3,3 см; в опуклій ділянці стінки між устями порожнистих вен, що позначується як синус порожніх вен, є міжвенозний горбок.
Коронарний синус відкривається попереду від заслінки нижньої порожнистої вени отвором, діаметр якого може досягати 1,3 см. Спереду і ззовні воно прикрите заслінкою коронарного синуса — перфорованою складкою ендокарда шириною до 1 см, задній кінець якої іноді з’єднаний із заслінкою нижньої порожнистої вени. Коронарний синус — колектор вен серця і важлива рефлексогенна зона. Навколо його устя розташовані численні отвори вен серця, що самостійно впадають у порожнину правого передсердя.
ПШ (ventriculus dexter) за формою нагадує неправильну тригранну піраміду. В основі його порожнини, що звернена вгору до правого передсердя, розміщені два отвори. Попереду і дещо зліва направо — артеріальне, що відкривається в легеневий стовбур, справа та ззаду — передсердно-шлуночкове. До 18–25 років у систолу ПШ має об’єм біля 45 см3, в діастолу — 150–240 см3 і збільшується після 45–60 років ще на 10–15 см3. Лінійні розміри порожнини ПШ становлять: довжина 5,3–10,2 см, передньозадній розмір — 4,5–6,9 см, ширина — 2,7–5,6 см, у осіб віком старше 55 років збільшуючись ще на кілька міліметрів. Середні показники маси ПШ у чоловіків становлять 73–75 г, у жінок — 63–65 г (біля 27% загальної маси серця) і дещо зменшуються з віком. Тиск у порожнині ПШ, під яким кров виштовхується в легеневий стовбур, досягає 45–65 мм рт. ст.
Порожнина ПШ обмежена трьома стінками: передньою, задньою (діафрагмальною) і внутрішньою, медіальною (перегородковою). Їх товщина в різних зонах стінки неоднакова і становить в ділянці верхівки та середньої третини 0,4–0,8 см, дещо зменшуючись до основи шлуночка. Товщина медіальної стінки, утвореної міжшлуночковою перегородкою, значно більша і наближається до товщини стінки ЛШ. Вона має нижню м’язову частину і меншу верхню мембранозну, розміщену між септальною стулкою правого AV-клапана і надшлуночковим гребенем. Останній є межею між безпосередньо порожниною шлуночка і артеріальним конусом.
Довжина медіальної стінки, що за формою, як і дві інші, наближається до прямокутного трикутника, відповідає довжині шлуночка. Її ширина становить залежно від форми серця 4,5–6,4 см. Поверхня нижнього м’язового і верхнього перетинчастого сегментів медіальної стінки неоднакова. Майже гладка, з дрібними трабекулами біля заднього та передньонижнього країв у верхній частині, вона переходить у складнорельєфну сітку на м’язовому сегменті, а також на передній та задній стінках шлуночка.
У верхньому відділі медіальної стінки знаходиться міжшлуночковий гребінь, в якому виділяють стовбур, що переходить на передню стінку шлуночка і закінчується двома-трьома і більше ніжками, що зливаються з трабекулами. Трохи нижче гребеня розміщені сосочкові м’язи, кількість яких може досягати п’яти. При короткій та широкій кулястій формі серця сосочкових м’язів більше, ніж при подовженій. Вони мають, як правило, конусоподібну чи рідше циліндроподібну форму, а їх верхівки з’єднані зі стулкою AV-клапана сухожильними нитками — хордами товщиною 0,2–1,5 мм.
Довжина сосочкових м’язів збільшується з віком і залежно від анатомічних особливостей серця становить 0,8–2,3 см. Хорди, кількість яких варіює від 1 до 13, можуть фіксуватися до стулки клапана як по вільному краю, так і вздовж всієї її нижньої поверхні, аж до фіброзного кільця.
Найбільш протяжна передня стінка ПШ також має форму прямокутного трикутника, прямий кут якого утворений основою шлуночка і латеральним краєм стінки, а гострі кути знаходяться біля артеріального конуса і верхівки. Передня стінка становить значну частину передньої та легеневої поверхонь серця і має більшу площу, ніж інші стінки шлуночка, займаючи ділянку від передньої міжшлуночкової борозни до гострого краю серця. Її межа із задньою стінкою проходить по гострому краю правої легеневої поверхні шлуночка і становить 3,7–8,8 см, а з медіальної — позначена добре вираженою борозною.
Складний рельєф внутрішньої поверхні стінки визначається м’ясистими трабекулами, які діляться, створюючи багатошарові сітки, краще виражені біля верхівки серця. Трабекулярна сітка повністю формується до 20 років, згладжуючись з віком. По відношенню до стінки трабекули можуть бути пристінковими або мостоподібними, а за ступенем вираженості розрізняють дрібно-, середньо- і великопетлисту трабекулярність.
Орієнтація трабекул у верхній третині стінки переважно перпендикулярна до правого передсердно-шлуночкового отвору, а потім коса, направлена зліва направо до правого артеріального конусу, який відмежовується від іншої порожнини ПШ спереду м’язовим надшлуночковим гребінцем, ззаду — надкрайовою трабекулою. На передній стінці ПШ розташована еластична напівпрозора передня стулка правого передсердно-шлуночкового клапана (сuspis anterior valvula tricuspidalis), верхній зовнішній край якої на всьому протязі міцно фіксований до фіброзного кільця, а вільний внутрішній край, що опускається вниз, є місцем прикріплення 5–16 сухожильних хорд, що відходять від верхівок передніх сосочкових м’язів.
Задня стінка ПШ, найменша за площею із всіх трьох, бере участь в утворенні нижньої, діафрагмальної поверхні серця. Її межа з медіальною стінкою шлуночка відповідає правому краю задньої міжшлуночкової борозни; з передньою стінкою — лінії гострого краю серця, що проходить між верхівкою шлуночка та латеральним сегментом отвору верхньої порожнистої вени. Довжина задньої стінки ПШ біля міжшлуночкової перегородки становить 3,7–9 см, ширина — 4,3–4,8 см. Трабекули, менші за обсягом, ніж на передній стінці, в цілому формують подібний рельєф. На рівні середньої третини довжини стінки розташовуються 1–3 сосочкових м’язи неправильної конусоподібної чи циліндричної форми і дещо меншого розміру, ніж на передній стінці шлуночка. У верхній частині стінки до фіброзного кільця прикріплена задня стулка AV-клапана (cuspis posterior valvula tricuspidalis), вільний край якої з’єднаний з верхівками сосочкових м’язів 4–16 тонкими сухожильними хордами. Іноді частина з них бере початок безпосередньо від м’ясистих трабекул.
Порожнина ПШ серця функціонально розмежована на власне порожнину і розташоване вище її воронкоподібне продовження — правий артеріальний конус (conus arteriosus dexter). Нижній відділ шлуночка функціонує як приймач крові, що заповнюється через розміщений в його основі правий передсердно-шлуночковий отвір, а верхній забезпечує відтік крові через устя легеневого стовбура. М’язове кільце, утворене надшлуночковим гребенем, надкрайовою трабекулою і гребінцем, захищає порожнину від перерозтягнення надлишком крові, що поступає, з’єднує найбільш великі у правому шлуночку передній і задній сосочкові м’язи.
Правий передсердно-шлуночковий отвір (ostium atrioventricularie dextrum) перекриває одноіменний клапан (valvula tricuspidalis), що складається з трьох стулок. Вони фіксовані на сполучнотканинному фіброзному кільці, щільна тканина якого продовжується в еластичні напівпрозорі стулки, що за зовнішнім виглядом наближаються до трикутних пластинок. Передня стулка клапана закріплена на передньому півколі кільця, задня — на його задньолатеральному сегменті, медіальна (найменша за площею) — на ділянці, що відповідає міжшлуночковій перегородці.
Рухливість вільного краю стулок, звернених у просвіт шлуночка, обмежується фіброзними хордами, закріпленими на сосочкових м’язах, які в систолу утримують клапани від вивертання в порожнину передсердя. При скороченні передсердя стулки клапана, що притискаються до стінок шлуночка течією крові, не перешкоджають швидкому заповненню його порожнини. Інший клапан, що визначає напрямок потоку крові, знаходиться безпосередньо на початку легеневого стовбура, який утворює тут розширення (bulbus trunci pulmonale). Він також складається з трьох напівмісячних заслінок — лівої, правої та передньої, розташованих по колу.
Нижня опукла поверхня стулок клапана легеневого стовбура (valvulae semilunares a. pulmonalis) звернена в порожнину ПШ, а ввігнута — у просвіт судини, яка перекривається. Більш щільному змиканню стулок в діастолу сприяють щільні фіброзні вузлики напівмісячних заслінок, розміщених на середині вільного краю кожної з них. Невеликі кишені між заслінками і стінкою легеневого стовбура забезпечують досить щільне прилягання до неї стулок, що притискаються течією крові. Завдяки цьому в систолу кров вільно переміщується в легеневий стовбур, а легка рухливість клапана забезпечує надійне блокування її ретроградного повернення в порожнину шлуночка за допомогою змикання стулок.
Ліве передсердя (atrium sinistrum) за формою нагадує неправильний циліндр, розміщений поперечно між устями легеневих вен; його стінки не мають чітких границь. Ліве передсердя перебуває в кутку між артеріальними стовбурами і правим передсердям, обмежуючись передньою коронарною і задньою міжпередсердною борознами. Об’єм лівого передсердя у дорослої людини в діастолу становить 90–135 см3 з тенденцією до збільшення у осіб старших вікових груп. При скороченні серця він зменшується до 45–80 см3. Тиск, що дорівнює в діастолу 2–4 мм рт. ст., у систолу підвищується до 9–12 мм рт. ст. Лінійні розміри, як й інших камер серця, залежать від його форми. Передньозадній розмір варіює в межах 1,3–3,7 см, ширина камери становить 1,4–2,2 см, висота — 1,3–3,9 см. При цьому більші значення горизонтальних параметрів коротких і широких сердець відповідають меншим значенням вертикальних; зворотні відносини відзначають у серцях подовженої форми.
У лівому передсерді розрізняють верхню, латеральну, медіальну, передню і задню стінки і три відділи: синус легеневих вен (sinus vv. pulmonales), власне передсердя і ліве вушко (auricula sinistra). Межа верхньої стінки з передньою проходить по лінії, що з’єднує краї верхніх легеневих вен, із задньою — по лінії між задніми краями усть нижніх легеневих вен, з латеральною — по лінії між медіальними та латеральними краями усть лівих легеневих вен, з медіальною — по міжпередсердній борозні. Верхня стінка, розміщена між устями легеневих вен (vv. pulmonales), має гладку поверхню, як і у інших стінок лівого передсердя. Розмір цієї стінки у дорослих становить 2–3 см при ширині 1,8–3 см. Вона злегка ввігнута з боку порожнини передсердя, що зумовлено синусом легеневих вен, що перебуває тут. Місця їх впадання не мають різкого відмежування від міокарда передсердя, що переходить на стінки цих судин.
Устя легеневих вен позбавлені клапанного апарату і містять кільцеподібні потовщення міокарда, скорочення яких попереджує зворотну течію крові. Відстань між їх устями не перевищує 1 см, між фіброзним кільцем і устями нижніх легеневих вен справа вона коливається у межах 2–6 см, а зліва — 1,5–5 см. Окрім розміщених по кутках порожнини отворів легеневих вен, на поверхні верхньої стінки лівого передсердя виявляються дрібні (до 1 мм діаметром) отвори найменших вен серця, що впадають у нього.
Латеральна стінка лівого передсердя за формою нагадує неправильний, витягнутий зверху вниз чотирикутник. Він відмежований від передньої стінки умовною вертикальною лінією, що йде від зовнішнього краю основи лівого вушка до коронарної борозди, а від задньої — лінією, що з’єднує зовнішній край нижньої лівої легеневої вени також із коронарною борозною, що позначає нижню межу стінки. Розміри стінки корелюють з його формою і коливаються за висотою в межах 1,5–3,9, за шириною — 1,3–3,7 см. У її передньоверхній частини знаходиться щілиноподібний чи овальний отвір основи лівого вушка діаметром від 0,5 до 4 см.
Форма, розміри й об’єм порожнини лівого вушка, яке часто використовується як доступ у порожнину серця при хірургічних втручаннях, надзвичайно варіабельні. Його довжина по зовнішній поверхні варіює в межах 1–5 см, поперечний розмір у середній частині тіла становить 0,8–4 см, товщина — 0,5–2 см, а внутрішній об’єм — 1–12 см3. Згідно з цим виокремлюють дві крайні форми будови вушка: вузьке і коротке або широке і подовжене. Рельєф внутрішньої поверхні ускладнений численними трабекулами з переважно круговим розташуванням. Порожнини передсердя і вушка в ділянці його шийки відмежовані потовщенням, утвореним м’язовими пучками.
ЛШ (ventriculus sinister) має близьку до конусу форму зі зверненою вгору основою і вершиною, що орієнтована вниз, вліво і вперед. Об’єм ЛШ у діастолу дорівнює 140–210 см3, у систолу — 30–65 см3, довжина в ділянці медіальної стінки становить 5,5–10,4 см, передньозадній розмір — 3,6–6 см, ширина біля основи — 2,1–4,7 см. Об’єм ЛШ із віком збільшується, як і ПШ. Товщина стінки ЛШ біля верхівки становить 0,7–1,3 см: у середній її третині — 1,1–1,7 см, поблизу фіброзного кільця — 1–1,7 см. Середні показники маси ЛШ у дорослих чоловіків коливаються в межах 148–151 г, у жінок — 130–133 г. Тиск в його порожнині в систолу становить 120 мм рт. ст., в діастолу — 4 мм рт. ст.
Порожнину ЛШ обмежують передня, медіальна і задня стінки. Передня і задня стінки внаслідок заокругленості лівого краю серця плавно переходять одна в іншу. За формою передня стінка наближається до прямокутного трикутника, коротка сторона якого звернена до основи шлуночка, один гострий кут до верхівки, другий — до місця переходу аортального конуса (conus aortae) в аорту. Залежно від конфігурації серця довжина передньої стінки може становити 5,5–10,4 см, ширина — 2,4–3,8 см. З віком морфометричні параметри передньої стінки і порожнини ЛШ трохи збільшуються. Внутрішній рельєф порожнини визначається розвинутою трабекулярною сіткою, проте менш вираженою порівняно з правим шлуночком. Біля основи лівого передсердно-шлуночкового отвору трабекули і міжтрабекулярні щілини розташовуються вертикально, нижче вони орієнтовані косо, справа наліво.
У нижній половині передньої стінки розміщені 1–3 досить масивних сосочкових м’язи, довжина яких коливається в межах 1,3–4,7 см. У серці подовженої форми є, як правило, лише один передній сосочковий м’яз. Залежно від конституційних особливостей серця і відповідно розмірів сосочкових м’язів відстань між їх верхівкою та фіброзним кільцем може становити 1–5 см.
На передній стінці ЛШ розташована передня стулка лівого двостулкового передсердно-шлуночкового клапана (valvula bicuspidalis seu mitralis), міцно фіксована до переднього і частково медіального сегмента лівого фіброзного кільця, що перекриває доступ в аортальний конус в діастолу і відкриває його під напором крові в систолу. Форма стулки наближається до трикутної, ширина коливається в межах 1,8–3,9 см, а висота — 2,1–4,5 см, вільний край дещо потовщений. Стулка з’єднана з сосочковими м’язами сухожильними хордами, які на шляху проходження діляться на гілки від верхівки, а іноді — від верхньої третини м’яза до вільного краю стулки. В результаті за наявності одного переднього сосочкового м’яза 5–15 хорд, що відходять від нього, закінчуються 18–40 фіброзними нитками біля вільного краю стулки.
Задня стінка за формою відповідає прямокутнику, основа якого спрямована вгору і до фіброзного кільця, а нижній кут — до верхівки шлуночка. У неї немає чіткої межі з передньою стінкою шлуночка, верхня проектується на коронарну борозну, а медіальна (довжиною 4,2–9,8 см) відповідає задній міжшлуночковій борозні. Сагітальний розмір задньої стінки шлуночка біля його основи становить 2,1–4,7 см.
Рельєф поверхні формують трабекулярні м’язи, орієнтовані поблизу основи переважно вертикально, на рівні середньої третини шлуночка — косо. На верхівці вони утворюють сітку м’ясистих і фіброзних трабекул, що оточує основи розташованих тут задніх сосочкових м’язів, від однієї — у вузьких подовжених серцях і до 6 — в коротких та широких. Відповідно до форми шлуночка довжина сосочкових м’язів коливається від 4,5 до 1,2 см, а товщина — в межах 0,5–2,2 см. Їх верхня частина відстоїть від фіброзного кільця відповідно на 5–1 см, а основа від верхівки шлуночка — на 4,4–1,5 см.
На верхній половині стінки розміщена задня стулка передсердно-шлуночкового клапана шириною 2–7,5 см і висотою в межах 0,5–2,5 см залежно від форми і розмірів серця. Іноді замість однієї виявляють до чотирьох взаємодоповнюючих стулок, закріплених на фіброзному кільці з вільним краєм, з’єднаним із задніми сосочковими м’язами сухожильними хордами товщиною 1–2 мм. Кількість хорд варіює в межах 20–70 пропорційно числу сосочкових м’язів, а довжина перебуває у зворотній залежності від довжини м’язів, що їх утворюють.
Медіальна стінка, утворена міжшлуночковою перегородкою, з боку порожнини ЛШ за формою найчастіше наближається до рівностороннього трикутника. Верхня межа стінки має довжину 3,6–6 см, проходить по медіальному півколу фіброзного кільця. Дві інші межі визначаються проекцією передньої та задньої міжшлуночкових борозен, а їх довжина відповідає розмірам інших стінок ЛШ. Сосочкові м’язи на цій стінці шлуночка відсутні. Її внутрішня поверхня на рівні верхніх двох третин гладка, іноді на ній контуруються гілки лівої ніжки передсердно-шлуночкового пучка провідної системи серця. У нижній третині стінки і в ділянці верхівки з’являється сітка тонких м’язових трабекул, що ускладнює рельєф.
Основа конусоподібної порожнини ЛШ орієнтована вгору, вправо і дещо назад. У ньому є два отвори, що мають клапани: зліва і попереду розташоване ліве AV-, справа і назад від нього — отвір аорти. Розташований на межі лівого передсердя і шлуночка двостулковий (мітральний) клапан в нормальних умовах практично не чинить опору при заповненні його порожнини, ефективно блокуючи зворотний потік крові в систолу за допомогою змикання своїх передньої й задньої стулок, загальна кількість яких може коливатися від 2 до 6. У систолу ЛШ передня стулка випинається в бік венозного кільця, разом із ширшою задньою стулкою, закриваючи лівий AV- отвір.
Рухливість стулок у напрямку потоку крові обмежується довжиною прикріплених до їх потовщеного вільного краю сухожильних хорд та пружно-еластичними властивостями сосочкових м’язів. У діастолу стулки клапана прилягають до стінок шлуночка, перекриваючи при цьому аортальний отвір у міжшлуночковій перегородці. Відкритий вниз, вліво і вперед овальний отвір мітрального клапана має площу 11,8–13,12 см2 (за деякими даними — 2,86–17,18 см2), поздовжній діаметр — 1,7–4,7 см, поперечний — 1,7–3,3 см. Периметр окружності лівого передсердно-шлуночкового отвору в місці прикріплення стулок до фіброзного кільця в молодому віці становить 6–9 см, з віком може збільшуватися до 12–15 см. Середньостатистичні показники у чоловіків дещо більші, ніж у жінок.
Гладкостінний лівий артеріальний конус, що завершується виходом в аорту, має лійкоподібну форму. Три його сторони обмежені м’язовими стінками шлуночка, а четверта утворена напівмісячними стулками аортального клапана. Передня, права і ліва стулки клапана фіксуються фіброзним трикутником і фіброзним кільцем.
Як і загальний легеневий стовбур, початковий відділ аорти в місці розташування клапана утворює цибулину аорти (bulbus aortae). Стінка цибулини аорти за будовою відповідає артеріям еластичного типу, додатково посилена ригідним фіброзним кільцем, що забезпечує стійкість до навантаження АТ, що змінюється.
Її діаметр у дорослої людини становить 1,5–3 см, довжина периметра коливається в межах 4,7–9,4 см, а розрахункова площа поперечного перерізу, що перекривається клапаном, знаходиться в межах 4,56±1,12 см2.
Висота цибулини аорти становить 1,7–2,5 см. На її внутрішній поверхні розташовуються синуси аорти з виїмками в судинній стінці глибиною 1,5–3 мм, до нижнього краю яких прикріплені три напівмісячні заслінки (valvula semilunaris sinistra, dextra at posterior aortae), що формують аортальний клапан.
Висота аортальних синусів (1,7–2 см) дещо більша, ніж у відповідних напівмісячних заслінок, які за шириною перевищують синуси. Простори між стінкою аортальних синусів і зверненою до їх поверхні напівмісячних заслінок клапана називаються синуси Вальсальви. У систолу синуси заповнюються прилягаючими до стінки аорти стулками клапана, які в діастолу повертаються у вихідне положення зворотною течією крові, що захлопує клапан і заповнює синуси. На середині потовщеного вільного краю стулок розташовано по одному сполучнотканинному вузлику Аранці, які забезпечують їх повне змикання. Між дугоподібними основами трикутних стулок аортального клапана є невеликі проміжки, які називаються просторами Генле.
Віповідно до маршруту переміщення крові від передсердно-шлуночкового отвору до аорти в ЛШ (рис. 1.15) розрізняють ділянки її припливу і відтоку, межею між якими служить переднє вітрило мітрального клапана. Ділянка припливу включає весь об’єм власне порожнини ЛШ, а ділянка відтоку продовжує власне порожнину ЛШ до аортального конуса, з якого кров надходить у велике коло кровообігу.
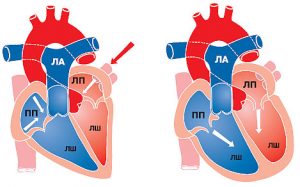
Рис. 1.15. Схема надходження крові у передсердя і шлуночки серця
Передсердно-шлуночкове з’єднання (juncturа atrioventriculare) — основа фіброзного скелета серця, що виконує функцію його опорного апарату. В цьому місці ряд фіброзних утворень кільцеподібної форми об’єднані фіброзними трикутниками в єдине ціле. Анатомічно передсердно-шлуночкове з’єднання включає стабілізуючі його фіброзні пучки, праве і ліве фіброзні кільця, правий і лівий фіброзні трикутники, які разом із міокардом формують передсердно-шлуночкову перегородку, щільні сполучнотканинні кільця, що зміцнюють вхідні отвори легеневого стовбура і аорти (рис.1.16).

Рис. 1.16. Сполучнотканинний каркас серця: 1 – фіброзна основа устя ЛА; 2 – фіброзна основа устя аорти; 3 – передсердна дуга правого фіброзного кільця; 4 – задня дуга правого фіброзного кільця; 5 — задня дуга лівого фіброзного кільця; 6 — передня дуга лівого фіброзного кільця; 7 — лівий фіброзний трикутник; 8 — правий фіброзний трикутник; 9 — передня частина правого фіброзного трикутника; 10 — задня частина правого фіброзного трикутника
Зовнішній край фіброзних кілець, що обмежують передсердно-шлуночкові отвори, служить місцем прикріплення м’язових пучків стінок шлуночків і передсердь, а внутрішній є місцем фіксації стулок AV-клапанів. Фіброзні кільця становлять відгалуження фіброзних трикутників, у кожному з кілець можна виокремити передню і задню гілки.
Внаслідок з’єднання прилеглих ділянок фіброзних кілець і фіброзних трикутників за отвором аорти утворюється фіброзний центр серця, зверху зрощений із міжпередсердною перегородкою, ззаду — з перетинчастою частиною перегородки, що розділяє передсердя. Фіброзний центр є основою пластинки, що розмежовує передсердя і шлуночки. Від фіброзних кілець відходять пучки колагенових волокон, які латерально вплітаються в серцевий м’яз, медіально — у тканину стулок передсердно-шлуночкових клапанів, підвищуючи механічну міцність всієї конструкції.
Окружність лівого передсердно-шлуночкового отвору (ostium atrioventriculare sinistrum) визначається розмірами фіброзного кільця, пов’язаного з лівим фіброзним трикутником, і у віці 20–40 років становить 6–11 см, збільшуючись з віком на 2–3 см. Периметр правого фіброзного кільця і відповідного отвору на 2–3 см перевершує аналогічний параметр лівого кільця.
Фіброзне кільце, від якого починається стінка аорти, розташоване в місці переходу аортального конуса у висхідну аорту. Тут до нього прикріплені стулки аортального клапана, які складаються з колагенових пучків, що належать обом фіброзним трикутникам. Права сторона кільця закріплена сухожиллям артеріального конуса, що з’єднується з його нижнім краєм. Розташування і просторові взаємозв’язки фіброзного кільця легеневого стовбура з відповідними тканинними структурами подібні до тих, які відзначені у фіброзному кільці аорти.
Фіброзні трикутники з’єднані між собою потужним тяжем колагенових волокон, що переднім краєм охоплює заднє півколо аорти. Лівий фіброзний трикутник лежить між лівим передсердно-шлуночковим отвором і лівим переднім аортальним синусом, а пучки його колагенових волокон утворюють передню гілку лівого фіброзного кільця. Могутніший правий фіброзний трикутник розміщений між передсердно-шлуночковими отворами і заднім горизонтальним синусом аорти. Від нього ліворуч і праворуч відходять пучки колагенових волокон, які формують обидві гілки правого і задню гілку лівого фіброзного кільця.
Міокард стінки камер серця міцно пов’язаний із фіброзними кільцями, розміщеними на межі передсердь і шлуночків, які служать йому «точкою опори». У передсерді він складається з двох шарів: поверхневого, загального для обох камер, і глибокого, окремого для кожної з них. М’язові волокна та їх пучки в першому шарі орієнтовані поперечно. У другому одна частина, розташована петлеподібно, подібно до сфінктерів охоплює устя вен, що впадають у передсердя, інша, що бере початок від фіброзних кілець і орієнтована поздовжньо, утворює вертикальні тяжі — трабекули, що місцями виступають всередину порожнини вушок передсердь. Циркулярні волокна, що лежать в основі вушок, формують дугоподібні пучки, які обмежують їх сполучення з порожнинами передсердь.
На відміну від передсердь, міокард шлуночків складається з трьох шарів: поверхневого (зовнішнього, stratum superficiale), середнього (stratum circulare) і внутрішнього (stratum longitudinale). На передній поверхні серця волокна зовнішнього м’язового шару, прикріплені до передніх дуг фіброзних кілець і до сухожилля конуса легеневого стовбура, ідуть косо вниз до бічних країв серця. У ділянці його верхівки утворюють завиток (vortex cordis) і продовжуються у внутрішній, глибокий, розташований поздовжньо м’язовий шар серцевої стінки, що формує папілярні м’язи і міжшлуночкові трабекули. На задній поверхні серця волокна зовнішнього м’язового шару, що також відходять від задніх дуг фіброзних кілець, продовжуються косо вправо, в напрямку, протилежному орієнтації м’язових волокон передньої поверхні серця. Не досягаючи його верхівки, вони закінчуються в папілярних і трабекулярних м’язах ПШ. На відміну від загальних для обох шлуночків поверхневого та внутрішнього м’язових шарів, розташований між ними середній шар окремий для кожного шлуночка. Його циркулярно розміщені волокна проходять паралельно до фіброзних кілець, оточуючи кожен шлуночок безперервним м’язовим кільцем.
М’язові волокна, що беруть участь у формуванні міжшлуночкової перегородки, утворюють у ній S-подібний вигин і з кожної сторони переходять у глибокий м’язовий шар суміжного шлуночка, закінчуючись у його папілярних м’язах і трабекулах. Частина м’язових волокон, що відходять від передньої дуги лівого фіброзного кільця, двічі спіралеподібно охоплює ЛШ серця, утворюючи так звану бульбарну спіраль Маккаллума.
ГІСТО- ТA УЛЬТРАСТРУКТУРА ЕПІКАРДА, МІОКАРДА, ЕНДОКАРДА
Стінка серця складається з трьох оболонок: епікарда (вісцеральна пластинка перикарда), міокарда (м’язова оболонка) і ендокарда (внутрішня оболонка).
Епікард
Ззовні міокард передсердь і шлуночків покритий тонким плівчастим утворенням, що за гістологічною будовою відноситься до серозних оболонок. В епікарді розрізняють п’ять шарів. Зовнішній, звернений у порожнину перикарда, утворений мезотелієм — великими полігональними клітинами одношарового плоского епітелію. У ділянці коренів великих судин мезотелій разом з епікардом переходить на перикард, покриваючи його суцільним шаром і забезпечуючи ковзання вісцеральної та париєтальної поверхонь при рухах серця. Відносна лабільність контактів між клітинами мезотелія допускає утворення стомат- і стигматів-каналів для інтерстиціальної рідини, що полегшують її резорбцію з порожнини перикарда.
Структурну основу епікарда утворюють три шари: поверхневий — колагеновий, середній — еластичний і глибокий — колагеново-еластичний, що безпосередньо переходить в ендомізій міокарда. Нервові елементи розподілені головним чином у пограничній мембрані та поверхневому колагеновому шарі, що є також зоною розподілу лімфатичної сітки.
Кровопостачання епікарда забезпечується дрібними судинними гілками субепікардіальних або інтраміокардіальних артерій. У місцях переходу вісцерального листка перикарда у парієтальний відзначають судинні клубочки, утворені артеріолами з багатою іннервацією, які беруть активну участь в утворенні та резорбції порожнинної рідини. Мікрогемоциркуляторне русло епікарда має сіткоподібну будову і складається із стереотипного набору елементів: артеріол, пре- і посткапілярів, що з’єднують анастомозуючі між собою капіляри, і збірних везикул, що відкриваються у дрібні вени.
Сітка, утворена мікросудинами, тришарова. Складається з поверхневого сплетення, розміщеного безпосередньо під базальною мембраною, і більш глибокого, розташованого у поверхневому колагеновому шарі. Обидва сплетення широко анастомозують між собою. Архітектоніку судинного русла епікарда ускладнюють численні анастомози з судинами добре васкуляризованої жирової тканини, субепікардіальний шар якої може досягати 1,5 см. Щільність судинної сітки в різних зонах епікарда непостійна: вона більш густа над ЛШ, ніж над латеральною зоною ПШ або в ділянці передсердь.
Міокард
Насосна функція серця забезпечується високоспеціалізованими м’язовими клітинами — кардіоміоцитами, які мають неправильну циліндричну форму. Довжина кардіоміоцитів з різних відділів серця коливається в межах 50–120 мкм, ширина — 10–20 мкм. За допомогою контактів «кінець у кінець» кардіоміоцити об’єднані в м’язові волокна з добре вираженою поздовжньою та поперечною смугастістю. Косі поперечні містки між їх бічними поверхнями інтегрують міокард у «функціональний синтицій».
На мікро- та макроскопічному рівні чітко простежується тенденція до групування м’язових волокон у пучки (фасцикули) різної потужності. Ніжні прошарки пухкої сполучної тканини, що обмежують їх, відповідають перимізію скелетних м’язів і є місцем розподілу інтрамуральних судин, елементів лімфатичної сітки та нервової системи. Проте пучкова структура міокарда досить умовна внаслідок широкого обміну фасцикул м’язовими волокнами і мікросудинами, що їх супроводжують (рис. 1.17).
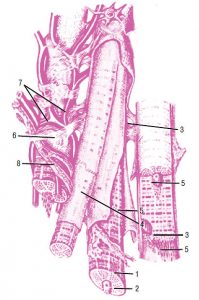
Рис. 1.17. Тканинна структура міокарда (об’ємна схема): 1 — м’язові волокна; 2 — їх ядра; 3 — міофібрили; 4 — сарколема; 5 — вставний диск; 6 — ендомізій; 7 — капіляри; 8 — колаген
Структурна консолідація м’язових волокон і прохідність просвітів капілярів, що забезпечують їх живлення в усі фази серцевого циклу, забезпечується колагеновим каркасом, що має три рівні організації. Колагенова сітка охоплює цілі групи м’язових волокон та інтрамуральні судини, оточує мікросудини, нервові елементи, утворює ендомізій м’язових волокон, міжміоцитарні та міоцитарно-капілярні з’єднання, формуючи складну тривимірну систему.
Ендомізій становить ніжний несуцільний футляр із пучків колагенових філаментів товщиною 120–150 нм, що міцно з’єднаний із кардіоміоцитами на рівні їх Z-ліній. Цей зв’язок здійснюється короткими тяжами, що утворюють навколо клітин манжетки, які контактують за допомогою спеціалізованих молекул адгезії з елементами цитоскелета. Сплетення перимізія об’єднані поперечними колагеновими волокнами і більш грубими поздовжньо орієнтованими звивистими волокнистими структурами. Крім цього, найближчі кардіоміоцити додатково зв’язані короткими «розпірками» товщиною 30–70 нм, а також гранулами і мікронитками з фібронектину, що попереджає їх ковзання відносно один одного. Еластичні волокна в міокарді поодинокі, їх кількість збільшується у людей старших вікових груп.
Інтерстицій міокарда
Простір між кардіоміоцитами шлуночків, передсердь і клітинами провідної системи серця заповнений складноструктурованим середовищем, що інтегрує елементи скоротного міокарда, живить його і координує роботу м’язових волокон. Компоненти інтерстиція співвідносяться у такий спосіб: 55% становлять судинні структури, 5% — елементи нервової системи; на клітини сполучної тканини, її волокна і протеоглікани припадає 7; 4 і 23% обсягу відповідно, а 6%, що залишилися — на оптично порожні зони. Пухка сполучна тканина інтерстиція, що структурно інтегрує міокард, становить поліфункціональну систему взаємозалежних елементів.
Міжклітинна речовина забезпечує формування середовища для нормального функціонування робочих компонентів міокарда. Щодо біофізичних властивостей міжклітинна речовина — це армований композит, що включає сильно гідратований гель, транспортно-трофічні властивості якого визначаються протеогліканами та глікопротеїнами. Їх великі молекули складаються з білка, ковалентно зв’язаного з глікозаміногліканами. Найважливіші з них — гіалуронова кислота, гепарин, сульфатований і несульфатований хондроїтин.
Волокнисті елементи в інтерстиції здорового міокарда малочисленні. Їх основу становить колаген I і в меншій кількості — III типу. Молекули колагену здатні до самозбирання у шаруваті упорядковані структури з властивостями рідких кристалів. Волокна колагену, що армують міжклітинну речовину, орієнтовані, як правило, паралельно до сили, яка її розтягує, що забезпечує максимальну ефективність їх опорно-скелетної функції.
Зв’язані між собою колагенові фібрили, що спіралеподібно обвивають кардіоміоцити, попереджують перерозтягання м’язових волокон та обмежують їх взаємне зміщення під час серцевого циклу. Деформації колагенових структур, що виникають при цьому, генерують додаткове зусилля при поверненні серця до вихідного об’єму.
Субстанції, структуровані в колагенових волокнах, базальних мембранах і основній міжклітинній речовині, продукуються різними клітинами. Синтез глікозаміногліканів і склеропротеїдів здійснюється в ендоплазматному ретикулумі і комплексі Гольджі фібробластів, у судинній стінці — гладком’язовими клітками, гепарин синтезується в тучних клітинах.
У міокарді клітини фібробластичного ряду розрізняються за ступенем зрілості та спеціалізацією. Всі вони здатні до міграції у тривимірному колагеновому гелі, в основі їх енергетичного метаболізму лежить гліколіз. Синтезовані молекули колагену мають здатність до самозбірки, порядок якої визначається розміщенням амінокислот у кінцевих відділах. Процес самозбірки і моделювання волокон, що утворюються, здійснюються на поверхні фібробластів, що, проте, не виключає «дистанційне» фібрилоутворення.
У фізіологічних умовах катаболізм колагену, як і фібрилогенез, здійснюється на клітинній основі. Десмолітичні фактори — катепсини, колагеназа, гіалунідаза, ряд нелізосомних ферментів — продукуються не лише спеціалізованими фібробластами, але й макрофагами, тучними клітинами, лейкоцитами. Ензиматичну дезінтеграцію міжклітинної речовини регулюють зміни рН, концентрація Са2+, гематичні фактори. Клітинна резорбція фібробластами надлишкового чи дефектного колагену імунонезалежна і регулюється «колагенчутливими» рецепторами їх поверхні. Рівновага десмолітичних і десмопластичних процесів — важливий фактор тканинного гомеостазу.
Фібробласти, макрофаги та іноді наявні в інтерстиції формені елементи крові є джерелом численних цитокінів, які не тільки регулюють морфогенез «строми», але й впливають на ендотелій і кардіоміоцити. Проте найпотужніший вплив на морфофункціональний стан всіх тканинних компонентів, що підтримують нормальний баланс строми і скоротного міокарда, здійснюють самі кардіоміоцити. До спектра біологічно активних речовин, синтезованих кардіоміоцитами шлуночків, входять металопротеази, колагенази (стромелін, желатінази А і В) та ряд інших гуморальних факторів.
Структура робочих кардіоміоцитів
В основі функції високоспеціалізованих кардіоміоцитів — процес електромеханічного сполучення. Згідно з цим у кожному кардіоміоциті є такі структурно-функціональні комплекси: контрактильний апарат, система рецепції регуляторних сигналів та підтримки внутрішньоклітинного гомеостазу, включаючи обмін електролітів, система відтворення і транспорту макроергічних фосфатів, система забезпечення пластичної та секреторної функцій клітини, а також система внутрішньоклітинного катаболізму, основним елементом якої є лізосоми.
Розміщення структурних компонентів відображає функціональну спеціалізацію різних відділів клітини, в якій визначають три зони: перинуклеарну, міофібрилярну і підсарколемну (рис. 1.18). Перинуклеарна зона займає 2–5 мкм навколо ядра, в її гіалоплазмі містяться мітохондрії, лізосоми, відкладення ліпофусцина, мікротільця, цитогранули, елементи гладкого і шорсткуватого ретикулума, іноді — вакуолі, ліпідні краплі, що зосереджуються переважно біля полюсів ядра. Будова цієї зони може змінюватися залежно від функціонального стану клітини. Міофібрилярна зона займає більшу частину внутрішньоклітинного простору. Включає міофібрили, мітохондрії, елементи саркотубулярної системи, цитогранули, іноді — інші органели. Під сарколемою у прозорому матриксі розташовані цитогранули, початкові відділи Т- системи, а також мікропіноцитозні везикули, мітохондрії, елементи саркоплазматичного ретикулума і цитоскелета, що зв’язує міофібрили і сарколему.
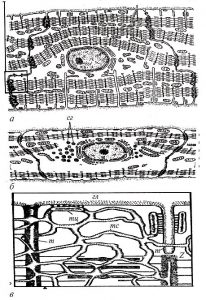
Рис. 1.18. Схематичне зображення міоцитів: (а) шлуночка; (б, в) передсердя дорослого ссавця: сг — специфічні гранули, гл — гліколема, т — трубочка Т-системи, тц — термінальна цистерна, тс — трубочка саркоплазматичної сітки, Z — диски Z
Контрактильний апарат вентрикулярних кардіоміоцитів займає 40–60% внутрішньоклітинного об’єму. Міофібрили, що утворюють його, пронизують клітину від однієї апікальної поверхні до іншої, міцно закріплюючись у плазмолемі, часто утворюючи анастомози. В одному кардіоміоциті міститься до 1000 міофібрил, що складаються з компактних, добре упакованих пучків скоротних ниток — міофіламентів. Кількість міофіламентів у міофібрилах неоднакова — від 200 до 1000, проте, незважаючи на різний обсяг, їх структура стереотипна. У світловому мікроскопі серцевий м’яз виглядає поперечно- смугастим. Вздовж м’язового волокна чергуються регулярно розміщені темні, анізотропні А-диски, що мають постійну довжину, та ізотропні, світлі I-диски, що вкорочуються в систолу.
Елементарною структурою міофібрили є саркомер (рис. 1.19), обмежений двома Z- лініями, кожна з яких ділить відповідний ізотропний I-диск на дві рівні частини. Саркомери клітин міокарда розташовані таким чином, що їх Z-лінії паралельні одна одній не лише в одному, але й у сусідніх кардіоміоцитах. Z-лінія, або телофрагма, має аморфно-фібрилярну структуру, утворену білками десміном, віментіном, філаміном, α-актиніном, які є основними компонентами цитоскелета. Z-лінії суміжних міофібрил з’єднані між собою, а по периферії клітини — із сарколемою та елементами колагенового каркаса міокарда за допомогою спеціалізованих молекул адгезії.
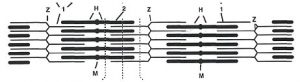
Рис. 1.19. Будова саркомера: 1 — актинові (тонкі) міофіламенти; 2 — міозинові (товсті) міофіламенти; z — Z-лінія; н — Н-зона; м — М-лінія
Скорочення саркомера визначається взаємним переміщенням двох різновидів міофіламентів — товстих, довжиною 1,65 мкм і товщиною 15 нм, утворених міозином, і тонких, основу яких становить актин. Довжина тонких філаментів навіть у межах одного саркомера коливається — від 0,65 до 1,4 мкм, тоді як їх товщина постійна і дорівнює 8 нм. Зовнішні кінці актинових ниток міцно вплетені в телофрагму, а внутрішні розміщуються між товстими філаментами, на периферії утвореного ними А-диска. Ділянка спільного розташування товстих і тонких філаментів релаксованного саркомера помітно світліша від А-диска. Він позначається Н-зоною, що має нечіткі границі внаслідок різної довжини актинових філаментів.
У центрі саркомера розміщений ще один поперечно орієнтований опорний диск — М- лінія, або мезофрагма, шириною 50–80 нм, утворений перемичками, що утримують разом товсті філаменти. Якщо взятий для дослідження матеріал зафіксований у кінці діастоли, по обидва боки мезофрагми можна бачити відносно світлі L-смужки внаслідок відсутності на міозинових філаментах поперечних містків, що забезпечують їх функціональний контакт з актиновими протофібрилами. Довжина максимально розслабленого саркомера — 3–3,5 мкм. У систолу вона зменшується до 1,5 мкм внаслідок ковзання товстих і тонких філаментів один щодо одного. У повністю скороченому саркомері I-диски і L-зони зникають. Таким чином, у зоні Н, границею якої служать кінчики тонких філаментів, що просуваються вперед, містяться лише товсті, а в зоні I — тільки тонкі філаменти. На поперечних зрізах саркомерів через А-диски виявляється гексогональне розташування протофібрил, причому кожна товста нитка оточена 6 тонкими.
Склад і структура протофібрил досить складні. Товста нитка складається із 180–360 поздовжньо-орієнтованих, сплетених між собою молекул міозину. Вона має потовщення – подвійну голівку, рухливо з’єднану з подовженою хвостовою частиною, що складається з двох фрагментів. Початковий фрагмент довжиною 60 нм разом із голівкою утворює компонент протофібрили, що називається важким мероміозином, який також рухливо з’єднаний з легким мероміозином — іншим її фрагментом довжиною близько 90 нм. Голівки міозину з правильними інтервалами розміщуються вздовж товстого філамента, за винятком зони М-лінії саркомера. На електронних мікрофотографіях голівки молекул міозину мають вигляд поперечних містків між тонкими і товстими філаментами.
Тонкі нитки ізотропного диска складаються із глобулярних молекул актину. Обвиваючи один одного, вони утворюють скелет філамента — подвійну спіраль, з боків якої проходять два поздовжні жолобки. У цих жолобках, повторюючи форму актинової спіралі, знаходяться тонкі молекули тропоміозину, до яких із правильним інтервалом приєднані молекули тропоніну, кожна з яких складається із трьох субодиниць. Тропонін і тропоміозин відіграють ключову роль у регуляції взаємодії актину і міозину.
Комплекс тропоніну і тропоміозину діє як молекулярний замикаючий пристрій, що не дозволяє актину тонких фібрил взаємодіяти з голівками міозину. Приєднання Са2+ до тропоніну змінює конформацію тропонін-тропоміозинового комплесу і відкриває актинові ділянки, здатні взаємодіяти з міозином, що ініціює скорочення. Скорочення саркомера відбувається внаслідок утворення та роз’єднання поперечних містків між тонкими і товстими філаментами, що змушує останні ковзати вздовж міозинових протофібрил до центру А-диска. Сила скорочення пропорційна числу актоміозинових містків, вона зростає зі збільшенням площі перекриття філаментів до входу кінців тонких актинових ниток у Н-зону. Довжина саркомера в кінці діастоли дорівнює 2,2 мкм, що відповідає найбільш повному взаємному перекриттю філаментів із максимальною кількістю поперечних актоміозинових містків між ними. І скорочення, і розслаблення саркомера здійснюється з обов’язковою участю АТФ.
Скорочення міофібрил — складний процес, що здійснюється в результаті цілого комплексу умов: наявності відповідного енергетичного потенціалу та концентрації іонів кальцію, адекватної функції ряду ферментів, електрохімічного імпульсу, що запускає цей багатокомпонентний механізм. Координація всіх фаз скорочення і розслаблення кардіоміоцита забезпечується його іон-транспортною системою, функціонування якої можливе завдяки компартменталізації внутрішньоклітинного простору та специфічним властивостям мембран, що здійснюють це. Основними елементами цієї системи є сарколема, саркоплазматичний ретикулум і мітохондрії.
Будова сарколеми відповідає її основним функціям, в ній починається процес електромеханічного сполучення з подальшою мобілізацією всіх органел, що безпосередньо беруть у ньому участь. У сарколемі розрізняють внутрішній шар, плазматичну мембрану (плазмолема) і глікокалікс (базальна мембрана, перимембрана, гліколема).
Глікокалікс, що покриває поверхню кардіоміоцита, вступає у безпосередній контакт із міжклітинним простором, стінками капілярів, колагеновими волокнами, становить опорно-фібрилярний комплекс складних ліпідів, протеогліканів і колагену IV типу. У глікокаліксі розрізняють поверхневу і більш щільну внутрішню пластинки товщиною 20 і 30 нм. Наявність у глікокаліксі сіалових кислот і глікозаміногліканів надає йому поліаніонних властивостей. Глікокалікс стабілізує плазмолему, є основним позаклітинним депо Са2+, що бере участь у регуляції скорочення кардіоміоцита. Між ним і плазмолемою є досить постійна щілина шириною 10 нм. Плазмолема становить елементарну тришарову мембрану товщиною 8 нм. Щодо біофізичних характеристик — це мікрогетерогенно-динамічна система з рідкокристалічними властивостями. У плазмолемі виявляються білкові частки діаметром 7–10 нм, як лише занурені у ліпідний бішар мембрани, так і такі, що перетинають усю її товщу. Структура мембрани підтримується нековалентними, гідрофобними та гідрофільними взаємодіями білків, ліпідів і олігосахаридів. Один з основних компонентів мембрани — білки часто поєднують структурну функцію з рецепторною чи ферментною, прикладами чого є Na+/К+-АТФаза, комплекс β-адренорецептор-аденілатциклаза тощо. Найважливіша особливість плазмолеми, зумовлена присутністю в ній білків, — наявність каналів, що забезпечують повільний електрогенний і швидкий електронейтральний транспорт Са2+. Фіксація сарколеми вільної поверхні робочих кардіоміоцитів до міофібрил на рівні Z-ліній зумовлює її фестончаті вибухання при скороченні клітини.
Сарколема кардіоміоцита має п’ять різних спеціалізованих зон: великі й малі інвагінації, що формують Т-систему і кавеоли, ділянки контактів із саркоплазматичним ретикулумом і вставні диски. Діаметр кавеол — 50–80 нм, вони є динамічними структурами, що нагадують везикули ендотеліоцитів. Їх вміст — гранулярний або дрібнодисперсний матрикс. Кількість кавеол збільшується при навантаженні кардіоміоцитів або при СН.
Т-систему утворюють глибокі розгалужені вдавлення бічної сарколеми, які покриті глікокаліксом. Устя Т-тубул перебувають на рівні Z-ліній. Їх початкові відділи, орієнтовані перпендикулярно міофібрилам, діаметром 150–200 нм. Т-система утворює поздовжні та поперечні відгалуження, поступово стоншується і проникає до границі навколоядерного простору, приблизно на третину збільшуючи сумарну площу сарколеми. Її тісний контакт із саркоплазматичним ретикулумом забезпечує проведення електрохімічного імпульсу в аксіальні відділи клітини.
Вставний диск при світловій мікроскопії помітний як темна лінія неоднакової ширини, що проходить через м’язове волокно. Він утворюється сарколемою двох кардіоміоцитів на рівні Z-ліній одного чи декількох саркомерів (див. рис. 1.19). У межах вставного диска є три види спеціалізованих структур: нексуси, десмосоми і проміжні з’єднання (рис. 1.20).

Рис. 1.20. Контактні зони суміжних кардіоміоцитів (електронограма)
Десмосоми і проміжні з’єднання служать для більш міцного механічного скріплення клітин. Десмосоми — електроннощільні округлі утворення діаметром від 30 до 200 нм. З боку цитоплазми до складу десмосом входять щільні пластинки прикріплення і пов’язані з ними пучки коротких, переплетених, щільно розміщених кератинових тонофіламентів товщиною близько 10 нм. Міжклітинна щілина в ділянці десмосом становить 20–30 нм. Посередині містить смужку багатого білком матеріалу, так званий центральний диск, тонкими перемичками пов’язаний із мембранами сусідніх клітин.
Проміжні з’єднання займають більшу частину горизонтального сегмента вставного диска, що в цій зоні має зигзагоподібний профіль, а щілина між клітинними мембранами шириною до 30 нм заповнена тонкофібрилярним матеріалом, що сприяє їх скріпленню. На внутрішній поверхні плазмолеми цих ділянок наявні компактні відкладення електроннощільного матеріалу, утвореного фосфоліпідами і цитоскелетними білками, характерними для телофрагми. Актинові протофібрили проникають у внутрішню поверхню цих ділянок плазмолеми, переплітаючись із щільною сіткою тонофібрил, що відходять від них. Таким чином, завдяки проміжним з’єднанням мембрана вставних дисків ніби відповідає першій або останній Z-лініям клітини.
Нексуси, або щілинні контакти, що розташовуються переважно вздовж міофібрил на вертикальних сегментах вставного диска, займають 7–10% його поверхні. В електронному мікроскопі високого розрізнення нексус на поперечному зрізі має вигляд семишарової конструкції, по три шари якої належать кожній із контактуючих мембран суміжних клітин, розділених світлою щілиною шириною 2 нм. У складі нексусів виявлені глобулярні структури діаметром близько 7 нм, які розміщуються на відстані 10 нм один від одного, формують гексагональні фігури, що утворюють орієнтовані поперек мембрани канали глибиною близько 9 нм. Можливість прямого міжклітинного обміну іонами через ці структури забезпечує швидку міжклітинну передачу імпульсів, що викликають скорочення. У межах вставного диска розміщуються і вільні від спеціалізованих структур ділянки такої ж будови, що і плазмолема бічних поверхонь клітини, але без глікокалікса і кавеол. У цих місцях мембрани сусідніх клітин м’язового волокна тісно прилягають одна до одної, проте, ніколи не зближаючись між собою до такого ступеня, як у нексусах.
Функція сарколеми щодо підтримки іонного гомеостазу клітини тісно пов’язана із саркоплазматичним ретикулумом. Ці органели становлять складну систему трубочок, що обплітають міофібрили, їх стінка утворена агранулярною цитомембраною. Саркоплазматичний ретикулум включає вільну сітку і термінальні цистерни, структурно і функціонально диференційовані.
Вільна сітка складається з анастомозуючих канальців діаметром 20–60 нм, орієнтованих поперечно і поздовжньо. Вони утворюють два сплетення на рівні М-ліній і в зоні телофрагми, так званий пористий комір. Розміщення тубулярних елементів сітки відносно стабільно завдяки їх фіксації найтоншими щільними нитками цитоскелета. Поперечні трубочки численніші, ніж поздовжні, які через проміжні цистерни поступово переходять у термінальні цистерни у вигляді сліпих мішкоподібних утворень. Цистерни саркоплазматичного ретикулума контактують або із сарколемою, або із Т-тубулами. Залежно від площини зрізу ці контакти можуть утворювати тріади, муфти, складніші фігури із 4 трубочок.
Т-система і саркоплазматичний ретикулум між собою не сполучаються. У ділянці контактів між їх мембранами завжди зберігається зазор шириною близько 10 нм при довжині контакту від 0,1 до 1 мкм. У таких зонах визначають спеціалізовані структури, що складаються з розміщених по осі цистерни щільної смужки, утвореної щільно прилягаючими гранулами та періодичних ущільнень діаметром близько 15 нм, які поділені проміжками у 20 нм.
У діастолу Са2+ із саркоплазми елімінується канальцями вільної сітки, переміщається ними до цистерн, із яких знову викидається при ініціації скорочення. Частина протеїнів мембрани саркоплазматичного ретикулума поєднує функції пластичного матеріалу та ензимів. Перш за все це стосується Ca2+/Mg2+-залежної АТФази — основного компонента кальцієвого насоса, що забезпечує розслаблення міокарда. Крім того, в саркоплазматичному ретикулумі наявні кислі гідролази і фосфоліпази, активування яких може мати критичне значення в патології.
Мітохондрії. Висока інтенсивність механічної роботи міокарда знаходить висвітлення в будові його енергозабезпечуючого апарату. Місцем, де відбуваються процеси тканинного дихання і окисного фосфорилування, є мітохондрії — органели овоїдної форми розміром 0,5–2,5 мкм, основне джерело макроергічних фосфатів. Вони розміщуються між міофібрилами, найчастіше по 1–2 мітохондрії на кожен саркомер, під сарколемою, навколо ядра, займаючи близько 35% об’єму клітини. Іноді суміжні мітохондрії утворюють тісні контакти, в зоні яких міститься дрібнозернистий електроннощільний матеріал. Кількість міжмітохондріальних контактів варіює залежно від функціонального навантаження на клітину.
Мітохондрії складаються із зовнішньої мембрани, що утворює оболонку органел, і внутрішньої, що формує численні, розташовані паралельно, щільно впаковані складки-кристи, звичайно орієнтовані в поперечному напрямку. Простір між кристами заповнений дрібнозернистим матриксом, що містить електроннощільні гранули, більш темним, ніж вузька щілина між зовнішньою та внутрішньою мембранами органели. Зовнішня і внутрішня мембрани мітохондрій мають товщину до 6 нм, але істотно відрізняються за своїм складом, фізико-хімічними властивостями і функціями.
Перша більш насичена холестерином, легко проникна для дрібних молекул, наприклад креатинфосфата. Ензими мембран належать до різних метаболічних ланок. Для внутрішньої мембрани характерний більш високий вміст білка, до 25% якого становлять дихальні ферменти. Мітохондрії кардіоміоцитів містять власну ДНК, що синтезує РНК і до 15% мітохондріальних білків.
Функції мітохондрій не обмежуються відтворенням макроергічних фосфатів і відновленням власної структури, а включають ще й участь в обміні іонів кальцію. Поглинання ними іонізованого кальцію, завдяки найбільшій ємкості цього внутрішньоклітинного депо, ефективно підтримує електролітний баланс саркоплазми. Проте при певних обставинах можливе швидке звільнення цих іонів із мітохондрій із несприятливими наслідками для клітини. Крім окисного фосфорилування, що залежить від киснезалежного тканинного дихання, відтворення деякої частки АТФ забезпечується анаеробним гліколізом, у процесі якого утилізується глюкоза, що доставляється кров’ю чи утворена з депонованого у клітині глікогену.
У загальний енергетичний баланс здорового міокарда гліколіз робить помітно менший внесок, ніж аеробне окиснення. Разом з тим для багатьох процесів, що регулюють рівень іонів кальцію в цитозолі клітини, переважаючим джерелом АТФ є саме гліколіз. Гранули метаболічно лабільного β-глікогену у вигляді округлих частинок помірної електронної щільності діаметром 20–40 нм розсіяні в саркоплазмі, під сарколемою, між мітохондріями, в навколоядерній зоні. Деяку його частину виявляють у складі відносно інертних білково-полісахаридних комплексів — глікосом.
Регенераторний апарат кардіоміоцитів представлений нуклеарними і саркоплазматичними компонентами. Більшість кардіоміоцитів має одне і лише 10–13% — два ядра, що займають осьове положення. На частку ядра припадає 2,8–5,4% об’єму клітини. Довжина міокардіальних ядер коливається від 7 до 12 мкм. Оболонка ядра, каріо- чи нуклеолонема, складається з двох елементарних мембран товщиною близько 7–8 нм, що формують окремі мішкоподібні утворення з вузьким (10–30 нм) перинуклеарним простором між ними, яке сполучається з просвітом саркоплазматичного ретикулума. На гладкій цитоплазматичній поверхні нуклеолонеми іноді виявляють рибосоми.
Сполучення нуклео- і саркоплазми здійснюється за допомогою пор круглої чи октагональної форми, периметр яких утворений стінками зовнішнього і внутрішнього листків нуклеолонеми. Ядерні пори закриті тонкою білковою діафрагмою, що обмежує їх проникність. Ядро заповнене електронно-прозорою нуклеоплазмою, основний вміст якої дезоксинуклеопротеїди — хроматин у неактивній, конденсованій формі (гетерохроматин) або в активному деконденсованому стані (еухроматин). Гетерохроматин має вигляд компактних електроннощільних брилок, розміщених в основному під нуклеолонемою і навколо ядерець. Еухроматин, що зазвичай переважає в ядрах кардіоміоцитів, у вигляді слабоконтрастної сітки заповнює весь інший внутрішньоядерний простір.
Кількість ядерець варіює від 1 до 5–6. Їх структурною основою є ДНК, тонкі нитки якої сплетені в нуклеолонему. Завдяки їй ядерця є місцем зосередження ядерцевих організаторів — місць синтезу рибосомальної РНК (рРНК), що здійснюється деконденсованим хроматином — ділянками хромосом, об’єднаних у петльоподібний шнур — нуклеолонему. На поперечному зрізі нуклеолонеми виявляють її світлу слабоструктуровану серцевину — фібрилярний центр, утворений ДНК ядерцевого організатора. Фібрилярний центр оточений щільним кільцем фібрилярного матеріалу, що структурується в рРНК, і гранулярним компонентом — численними гранулами «готових» рибосом. Це надає ядерцю вигляд петлистого клубочка з темного гранулярного і філаментозного матеріалів, що перемежовуються вузькими більш світлими включеннями — фібрилярними центрами.
Пул саркоплазматичних рибосом досить багаточисленний. Їх гранули мають округлу форму і діаметр близько 15 нм. Рибосоми розміщуються в навколоядерному просторі чи під сарколемою щільніше, ніж між міофібрилами. Іноді вони об’єднані в короткі ланки-полірибосоми, які розташовуються між актиновими нитками саркомера в зоні телофрагми, де синтез білків контрактильного апарату найбільш активний. У саркоплазмі, найчастіше перинуклеарно, виявляють тубули чи спіралеподібні елементи шорсткуватого ендоплазматичного ретикулума, що також має пряме відношення до пластичної функції кардіоміоцита.
Біля полюсів ядра визначають елементи відносно мало розвиненого пластинчастого комплексу Гольджі. Мембрана органели утворює 3–4 сплощені цистерни, оточені кількома десятками дрібних пухирців із вмістом різної електронної щільності. Основна функція пластинчастого комплексу полягає у відтворенні глікопротеїнів і ліпопротеїнів цитомембран.
Помилки при біосинтезі білків у здоровій клітині досягають 15% їх загальної продукції. Крім того, хімічні впливи і конформаційні зміни функціонуючих макромолекул неминуче призводять до їх поступової денатурації. Необхідність звільнення від таких продуктів зумовлює потребу клітини у спеціалізованому апараті їх руйнування та елімінування. Найбільш вивченою його ланкою є лізосоми, які, як і в інших клітинах, відтворюються пластинчастим комплексом і саркоплазматичною сіткою. Їх переважаюче розміщення — перинуклеарна зона.
Первинні лізосоми становлять округлі тільця діаметром 0,5 мкм з електроннощільним матриксом. Вони містять складний набір гідролітичних ферментів і оточені одноконтурною мембраною. Ці органели мають здатність асоціюватися із внутрішньоклітинними структурами, що підлягають розщепленню, з подальшою частковою утилізацією чи видаленням із клітини. Зливаючись з ними, вони утворюють великі вторинні лізосоми розміром до 2 мкм, з поліморфним вмістом, що трансформуються в резидуальні тільця. До останніх належать і гранули ліпофусцину — тільця неправильної форми розміром до 7 мкм, що складаються з аморфної речовини і скупчень осміофільних зерен діаметром 7–50 нм. Їх кількість збільшується з віком і в умовах патології.
Функція лізосом здійснюється в комплексі з різними протеазами. Система внутрішньоклітинного катаболізму кардіоміоцитів включає також рибонуклеази, структуровані безпосередньо в рибосомах, фосфоліпази, які також локалізуються на мембранах мітохондрій, саркоплазматичного ретикулума, плазмолеми в безпосередній близькості від субстратів, які розщеплюють.
До органел, які рідко виявляють у кардіоміоцитах, відносять пероксисоми (мікротільця), що мають відношення до ліпідного та вуглеводного обміну. Це дрібні (0,15×0,25 мкм) тільця овоїдної форми зі щільним гранулярним матриксом, оточеним мембраною. Найчастіша локалізація пероксисом — на границі А–I дисків міофібрил, а також поблизу мітохондрій, термінальних цистерн саркоплазматичного ретикулума, жирових включень, «ліпідних крапель», що іноді виявляються поруч із мітохондріями.
У саркоплазмі у всіх ділянках кардіоміоцита наявні мікрофіламенти діаметром 7–10 нм, які разом із мікротрубочками утворюють цитоскелет клітини і, можливо, визначають внутрішньоклітинні переміщення рідини.
Структурні особливості різних типів кардіоміоцитів
У будові кардіоміоцитів різних відділів серця є деякі відмінності, мінімальні для клітин ЛШ і ПШ. Хоча структура контрактильного апарату і мітохондрій клітин обох шлуночків практично ідентична, у ПШ ядра кардіоміоцитів частіше мають складчасту поверхню, ланцюгоподібне розташування мітохондрій між міофібрилами чергується із гніздоподібним у вигляді скупчень. Т-тубули, що проникають у навколоядерну зону кардіоміоцитів ПШ, утворюють помітні розширення, частіше виявляють фрагменти шорсткуватої ендоплазматичної сітки, ліпідні включення, а елементи більш розвиненого пластинчастого комплексу, крім перинуклеарного простору, частіше визначають і у периферичних відділах клітини. Саркоплазма містить більше цитогранул, причому глікоген утворює розетки навколо мітохондрій і під сарколемою. Ці особливості відображають більш високу здатність ПШ серця до адаптації при ураженні чи перевантаженні порівняно з ЛШ.
Відмінності міокарда шлуночків і передсердь більш істотні. Хід м’язових волокон у передсердях більш звивистий, а проміжки між ними ширші, ніж у шлуночках. У зв’язку з цим їх з’єднання в окремі анастомозуючі пучки досить пухке. За розмірами передсердні кардіоміоцити значно поступаються перед клітинами шлуночків: їх середня довжина — 18–22 мкм, діаметр — 6–9 мкм, зовнішні обриси також помітно ускладнені. Кардіоміоцити передсердь, на відміну від шлуночків, досить неоднорідні за своєю структурою. При меншому ступені диференціації щодо контрактильної функції в їх структурі наявні виражені ознаки секреторної активності. Ультраструктура міофібрил передсердних і шлуночкових кардіоміоцитів однотипна, проте об’єм, який займає контрактильний апарат у клітинах передсердь, приблизно на 40% менший, а імунохімічні тести свідчать про його якісні відмінності від подібних структур робочих клітин шлуночків. Внаслідок меншої кількості міофібрил зона їх прикріплення у проміжних з’єднаннях вставного диска помітно коротша і містить менше електроннощільного матеріалу.
Вставні диски мають вигляд рівної лінії, перпендикулярної довгій осі клітини, без ступінчастості, характерної для м’язових волокон шлуночків. Десмосоми наявні не лише у вставному диску, але й на бічних поверхнях апікальних відділів контактуючих клітин, зливаючись із щільним матеріалом Z-ліній. Нексуси, навпаки, розміщуються між десмосомами і проміжними з’єднаннями вставного диска.
Меншому обсягу міофібрил відповідає і менша кількість мітохондрій, що структурно не відрізняються від вищеописаних, а також значно менш розвинутий саркоплазматичний ретикулум, в якому переважають поздовжні елементи, а діаметр канальців менший, ніж у клітинах шлуночків. Т-система в передсердних кардіоміоцитах також виражена слабко і наявна не у всіх клітинах. Її будова значно спрощена, а менш численні канальці орієнтовані вздовж міофібрил. Сарколема передсердних кардіоміоцитів, що не мають Т-системи, утворює численні кавеоли, що, можливо, компенсує відсутність Т-тубул. Водночас для кардіоміоцитів передсердь характерний більший розвиток елементів пластинчастого комплексу Гольджі, шорсткуватого ендоплазматичного ретикулума, більш висока щільність рибосом у саркоплазмі.
Специфічною особливістю передсердних кардіоміоцитів є наявність в них секреторних гранул, або «щільних тілець», які майже не визначаються у шлуночках (рис. 1.21).
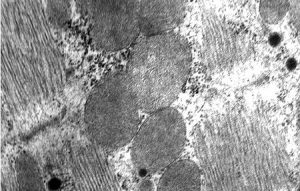
Рис. 1.21. Секреторні гранули в кардіоміоциті передсердя
Кількість щільних тілець корелює зі ступенем розвитку пластинчастого комплексу та гранулярної ендоплазматичної сітки. Секреторні гранули неоднорідні за будовою та складом вмісту. Розрізняють декілька різновидів цих округлих, вкритих мембраною тілець: розміщені біля ядра, темні, аргентофінні діаметром 100–450 нм; світлі, що переважають у лівому передсерді, розміром 200–450 нм, а також аргентофінні гранули, що локалізуються поруч із міофібрилами.
Кількість специфічних гранул, як і клітин без Т- системи, у правому передсерді значно більша, ніж у лівому. Значна кількість і різноманітність секреторних гранул відповідають функції серця як ендокринного органа, в якому містяться катехоламіни, ренін, ангіотензин, передсердний НУП і цілий ряд інших речовин, що мають як внутрішньо-, так і екстраорганний вплив. Крім специфічних «атріальних» гранул, у навколоядерній зоні наявні лізосоми, більші за розмірами.
За потужністю контрактильного апарату, органел, що забезпечують його роботу, їх розподілу, наявності у клітині морфологічних еквівалентів секреторної активності передсердні кардіоміоцити можуть бути розподілені, принаймні, на два різновиди: робочі та м’язово-секреторні. Перші за своєю структурою нагадують кардіоміоцити шлуночків, тоді як у другого різновиду секреторна функція, очевидно, домінує над контрактильною. Про це свідчать слабше розвинені міофібрилярні структури, менша кількість і розміри мітохондрій і водночас добре розвинений комплекс органел, що здійснюють пластичні процеси та забезпечують секреторну функцію: комплекс Гольджі, гранулярна ендоплазматична сітка. Їх відрізняє також велика кількість специфічних гранул у світлій саркоплазмі та відсутність Т-системи. Кількість світлих м’язово-секреторних клітин у правому передсерді значно більша, ніж у лівому. Вони концентруються ближче до епікарда та у клітинах провідної системи серця (пучках Бахмана). Морфологічні та імунохімічні дані дозволяють припустити подібний онтогенез цих передсердних кардіоміоцитів і структурно-гомологічної популяції клітин провідної системи шлуночків.
Ендокард
Порожнини серця і всі структури, що в них виступають — трабекули, сосочкові м’язи, сухожильні нитки і клапани — покриває ендокард (його внутрішня оболонка). Товщина ендокарда обернено пропорційна потужності міокарда — в передсердях, особливо в лівому, вона більша, ніж у шлуночках, особливо на трабекулах або сосочкових м’язах, проте скрізь зберігається тришарова будова. З боку порожнин серця ендокард вкритий ендотеліальним моношаром, що безпосередньо продовжується із судинних стовбурів.
Ендотеліальне покриття ендокарда зазнає більше функціональне навантаження внаслідок коливального за силою гемодинамічного впливу та активного обміну метаболітами між плазмою крові та субендотеліальною тканиною. Неоднакові умови функціонування відображуються на морфологічних характеристиках ендотеліоцитів, зумовлюючи їх помітні відмінності в різних відділах серця. У ЛШ це сплощені полігональні клітини з відносно рівними контурами, тоді як у ПШ і передсерді вони більші, місцями різко відрізняються розмірами та формою.
Ендотеліоцити псевдосухожиль — це багатогранники, які не мають орієнтації чи витягнуті впоперек сухожилля. Міжклітинні щілини ендотелію фіброзних ниток і клапанів серця більш тонкі й складніші за конфігурацією, ніж трабекулярного ендокарда, і не мають певної орієнтації.
Поверхня ендотелію, що контактує з кров’ю, вкрита глікокаліксом з атромбогенними властивостями. Він повторює мікрорельєф ендотеліального моношару і контурує потовщені зони клітин, що містять ядро, короткі маргінальні складки в зоні міжклітинних стиків, мікровиступи, краще виражені там, де кровотік має турбулентний характер, наприклад на папілярних м’язах або на серцевих клапанах. Передсердя мають більш рівну ендотеліальну поверхню.
Ендотелій ендокарда лежить на тонкому субендотеліальному шарі, відмежовуючись базальною мембраною. Субендотеліальний шар утворений густим тонкофібрилярним сітчастим колагеновим компонентом, зануреним в основну міжклітинну речовину з невеликою кількістю клітин камбіального типу. Ендотелій і субендотеліальний шар порожнин серця переходять і покривають стінку судин В’єссена — Тебезія, які в них відкриваються.
Глибше розташований найтовстіший еластично-м’язовий середній шар ендокарда, утворений щільною сполучною тканиною з великою кількістю еластичних волокон, між якими у найтовстіших ділянках простежуються шари колагенових елементів. У глибині цього шару серед еластичних волокон розміщені нечисленні гладком’язові клітини.
Найбільш глибокий шар ендокарда утворений пухкою сполучною тканиною, безпосередньо пов’язаною з ендомізієм міокарда. У цьому шарі розміщені нечисленні кровоносні судини, що утворюють широкі петлі, лімфатична сітка та елементи нервової системи, жирові клітини і розгалуження провідної системи серця, що складаються із клітин Пуркіньє.
Стулки серцевих клапанів утворені складками ендокарда. Стулки обох AV- клапанів мають подібну будову. Їх основу утворює середній опірний шар щільної сполучної тканини, що виходить із фіброзних кілець. За своєю структурою нагадує апоневроз, утворений пучками колагену, найбільш потужними в основі стулки. Тканина клапанів еластична, що багато в чому зумовлено наявністю численних переплетених еластичних волокон. Опірний шар поступово стоншується і досягає краю стулки, продовжуючись у сухожильні нитки. Кількість волокнистих структур біля вільного краю значно зменшується, а кількість сполучнотканинних клітин і основної проміжної речовини збільшується.
Ендокард, що покриває опірний шар стулки клапана, має подібну будову з ендокардом камери серця, з якої він виходить, різко стоншуючись у фіброзних нитках. Відповідно ендокард, що покриває клапани, з боку передсердь помітно товстіший і має краще виражену пошарову структуру, ніж на поверхні, зверненій до шлуночків, де еластичний шар, що знаходиться під ендотелієм, у 4–6 разів тонший і практично не містить гладком’язових клітин.
В основі клапанів кількість гладком’язових елементів збільшується. Тут наявні дрібні судини і капіляри, що поширюються на стулки, відзначаються жирові клітини. Трофіка основної функціональної частини клапанів відбувається за допомогою дифузії з крові, що їх омиває. Іноді в зоні прикріплення стулки відзначають волокна кардіоміоцитів, що ніби спускаються у субендотеліальний шар клапана з боку стінки передсердя.
Стулки «випускних» клапанів серця — аорти і легеневого стовбура — тонші, ніж антріовентрикулярних і, незважаючи на відсутність фіброзних ниток, зберігають в основному подібну структуру. Їх основа, як і у передсердно-шлуночкових клапанів, утворена тонким, але міцним та еластичним середнім шаром із більшою кількістю колагенових волокон, дещо потовщена з боку вільного краю. З боку шлуночків напівмісячні стулки також покриті ендокардом, товстішим в основі клапана, який стоншується аж до неможливості розрізнити шари на самих стулках. Він багатий еластичними волокнами і не містить м’язових клітин.
Шар на поверхні стулок, звернений до аорти чи до легеневого стовбура, складається з поперечно орієнтованих колагенових волокон із незначною домішкою еластичних елементів, які продовжуються з інтими та медії цих судин. Розширена основа клапанів має переріз трикутника, що прилягає до відповідних кілець фіброзного скелета серця. Тут наявна пухка сполучна тканина, в якій розміщені судинні та нервові елементи, що не проникають у стулки клапанів.
СУДИННА СИСТЕМА СЕРЦЯ
Транспортно-трофічне забезпечення функції серця здійснюється складною судинною системою, що включає артерії, мікроциркуляторне русло, систему відтоку венозної крові та лімфи.
Анатомія артерій серця
Головне джерело кровопостачання серця — коронарні артерії (рис. 1.22).
Рис. 1.22. Система кровопостачання серця: 1 — висхідна аорта; 2 — верхня порожниста вена; 3 — права коронарна артерія; 4 — ЛА; 5 — ліва коронарна артерія; 6 — велика вена серця
Ліва і права коронарні артерії відгалуджуються від початкової частини висхідної аорти в лівому і правому синусах. Розміщення кожної коронарної артерії варіює як за висотою, так і за окружністю аорти. Устя лівої коронарної артерії може перебувати на рівні вільного краю напівмісячної заслінки (42,6% спостережень), вище або нижче її краю ( 28 і 29,4% відповідно). Для устя правої коронарної артерії найчастіше розташування вище вільного краю напівмісячної заслінки (51,3% спостережень), на рівні вільного краю (30%) або нижче нього (18,7%). Зміщення устів коронарних артерій вгору від вільного краю напівмісячної стулки становить до 10 мм для лівої і 13 мм — для правої коронарної артерії, вниз — до 10 мм для лівої та 7 мм — для правої коронарної артерії. У поодиноких спостереженнях відзначають і більш значні вертикальні зміщення устів коронарних артерій, аж до початку дуги аорти.
По відношенню до середньої лінії синуса устя лівої коронарної артерії у 36% спостережень виявляється зміщеним до переднього чи заднього краю. Значне зміщення початку коронарних артерій по окружності аорти призводить до відходження однієї чи обох коронарних артерій від невластивих їм синусів аорти, а зрідка обидві коронарні артерії виходять з одного синуса. Зміна розташування устів коронарних артерій за висотою і окружністю аорти не впливає на кровопостачання серця.
Ліва коронарна артерія розміщена між початком легеневого стовбура і лівим вушком серця, ділиться на огинаючу артерію та передню міжшлуночкову гілки. Остання направляється до верхівки серця, розміщуючись у передній міжшлуночковій борозні. Гілка огинаючої артерії направляється під лівим вушком у коронарній борозні на діафрагмальну (задню) поверхню серця. Права коронарна артерія після виходу з аорти проходить під правим вушком між початком легеневого стовбура і правим передсердям. Далі повертає по коронарній борозні вправо, потім — назад, досягає задньої поздовжньої борозни, по якій спускається до верхівки серця, називаючись вже задньою міжшлуночковою гілкою. Коронарні артерії та їх великі гілки лежать на поверхні міокарда, розміщуючись на різній глибині в підепікардіальній клітковині.
Основні стовбури коронарних артерій поділяють на три типи — магістральний, розсипний і перехідний. Магістральний тип розгалуження лівої коронарної артерії спостерігається у 50% випадків, розсипний — у 36% і перехідний — у 14%. Останній характеризується поділом її основного стовбура на 2 постійні гілки — артерія огинаюча і передня міжшлуночкова. До розсипного типу належать випадки, коли основний стовбур артерії віддає міжшлуночкову, діагональну, додаткову діагональну і огинаючу гілки на одному чи майже на одному рівні. Від передньої міжшлуночкової гілки, як і від огинаючої, відходять 4–15 гілок. Кути відходження як первинних, так і наступних судин різні й знаходяться в межах 35–140°.
Відповідно до Міжнародної анатомічної номенклатури, прийнятої на Конгресі анатомів у Римі в 2000 р., розрізняють такі судини, що кровопостачають серце:
- Ліва коронарна артерія (arteria coronaria sinistra)
- Передня міжшлуночкова гілка (r. interventricularis anterior)
- Діагональна гілка (r. diagonalis)
- Гілка артеріального конуса (r. coni arteriosi)
- Латеральна гілка (r. lateralis)
- Перегородкові міжшлуночкові гілки (rr. interventricularis septales)
- Огинаюча гілка (r. circumflexus)
- Анастомотична передсердна гілка (r. atrialis anastomicus)
- Передсердно-шлуночкові гілки (rr. atrioventricularis)
- Ліва крайова гілка (r. marginalis sinister)
- Проміжна передсердна гілка (r. atrialis intermedius).
- Задня гілка ЛШ (r. posterior ventriculi sinistri)
- Гілка синусно-передсердного вузла (r. nodi sinoatrialis)
- Гілка передсердно-шлуночкового вузла (r. nodi atrioventricularis)
- Права коронарна артерія (arteria coronaria dextra)
- Гілка артеріального конуса (ramus coni arteriosi)
- Гілка синусно-передсердного вузла (r. nodi sinoatrialis)
- Передсердні гілки (rr. atriales)
- Права крайова гілка (r. marginalis dexter)
- Проміжна передсерцева гілка (r. atrialis intermedius)
- Задня міжшлуночкова гілка (r. interventricularis posterior)
- Перегородкові міжшлуночкові гілки (rr. interventriculares septales)
- Гілка передсердно-шлуночкового вузла (r. nodi atrioventricularis).
У віці 15–18 років діаметр коронарних артерій (табл. 1.1) наближається до показників дорослих. У віці старше 75 років спостерігається деяке збільшення діаметра цих артерій, пов’язане із втратою еластичних властивостей артеріальної стінки. У більшості людей діаметр лівої коронарної артерії більше правої. Кількість артерій, що відходять від аорти до серця, може зменшуватися до 1 або збільшуватися до 4 за рахунок додаткових коронарних артерій, яких немає в нормі.
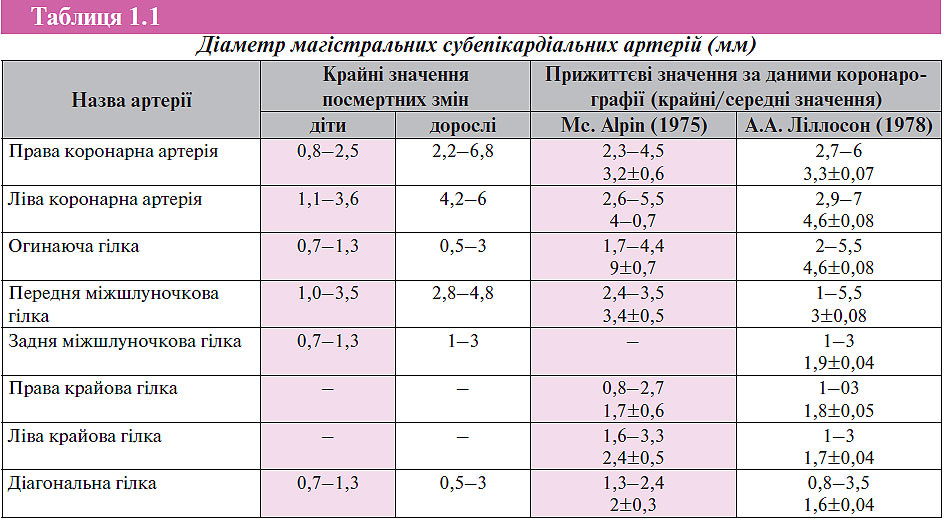
Ліва коронарна артерія (ЛКА) бере початок у задньовнутрішньому синусі цибулини аорти, проходить між лівим передсердям та ЛА і приблизно через 10–20 мм ділиться на передню міжшлуночкову гілку та огинаючу гілку.
Передня міжшлуночкова гілка — пряме продовженням ЛКА — проходить у відповідній борозні серця. Від передньої міжшлуночкової гілки ЛКА відходять діагональні гілки (від 1 до 4), які беруть участь у кровопостачанні бічної стінки ЛШ і можуть анастомозувати з огинаючою ЛШ гілкою. ЛКА віддає від 6 до 10 перегородкових гілок, які кровопостачають передні 2/3 міжшлуночкової перегородки. Власне передня міжшлуночкова гілка ЛКА досягає верхівки серця, постачаючи його кров’ю. Іноді передня міжшлуночкова гілка переходить на діафрагмальну поверхню серця, анастомозуючи із задньою міжшлуночковою артерією серця, здійснюючи колатеральний кровотік між лівою та правою коронарною артеріями (при правому чи збалансованому типах кровопостачання серця).
Таким чином, передня міжшлуночкова гілка ЛКА кровопостачає передньобокову стінку ЛШ, його верхівку, більшу частину міжшлуночкової перегородки, а також передній сосочковий м’яз (за рахунок діагональної артерії).
Огинаюча гілка відходить від ЛКА, розташовуючись в AV (коронарній)-борозні, огинає серце ліворуч, досягає перехрестя і задньої міжшлуночкової борозни. Вона може як закінчитися з тупого краю серця, так і продовжитися до задньої міжшлуночкової борозни. Проходячи у коронарній борозні, огинаюча гілка посилає великі гілки до бічної та задньої стінок ЛШ. Крім того, від огинаючої гілки відходять важливі передсердні артерії (серед них — r. nodi sinoatrialis). Ці артерії, особливо артерія синусного вузла, рясно анастомозують з гілками правої коронарної артерії (ПКА). Тому гілка синусного вузла має «стратегічне» значення при розвитку атеросклерозу в одній із магістральних артерій.
ПКА починається в передньовнутрішньому синусі цибулини аорти. Відходячи від передньої поверхні аорти, ПКА розміщується у правій частині коронарної борозни, підходить до гострого краю серця, огинає його й направляється до перехрестя і далі — до задньої міжшлуночкової борозни. У ділянці перетинання задньої міжшлуночкової та коронарної борозен (перехрестя), ПКА віддає задню міжшлуночкову гілку, що йде в напрямі до дистальної частини передньої міжшлуночкової гілки, анастомозуючи з нею. Рідко ПКА закінчується біля гострого краю серця.
ПКА своїми гілками кровопостачає праве передсердя, частину передньої та всю задню поверхню ЛШ, міжпередсердну перегородку і задню третину міжшлуночкової перегородки. З важливих гілок ПКА слід зазначити гілку конуса легеневого стовбура, гілку синусного вузла, гілку правого краю серця, задню міжшлуночкову гілку.
Гілка конуса легеневого стовбура часто анастомозує з конусною гілкою, що відходить від передньої міжшлуночкової гілки, утворюючи кільце В’єссена. Проте приблизно в половині випадків, артерія конуса легеневого стовбура відходить від аорти самостійно.
Гілка синусного вузла у 60–86% випадків відходить від ПКА, проте є дані, що у 45% випадків вона може відходити від гілки, що огинає ЛКА і навіть від самої ЛКА. Гілка синусного вузла розташовується по стінці ПШ і досягає місця впадання верхньої порожнистої вени у праве передсердя.
Біля гострого краю серця ПКА віддає досить постійну гілку — гілку правого краю, що йде вздовж гострого краю до верхівки серця. Приблизно на цьому рівні відходить гілка до правого передсердя, що постачає кров’ю передню та бічну поверхні правого передсердя.
У місці переходу ПКА в задню міжшлуночкову артерію від неї відходить гілка AV-вузла, що кровопостачає цей вузол. Від задньої міжшлуночкової гілки перпендикулярно відходять гілки до ПШ, а також короткі гілки до задньої третини міжшлуночкової перегородки, які анастомозують з подібними гілками, що відходять від передньої міжшлуночкової артерії ЛКА.
Таким чином, ПКА постачає кров’ю передню і задню стінки ПШ, частково — задню стінку ЛШ, праве передсердя, верхню половину міжпередсердної перегородки, синусний і AV-вузли, а також задню частину міжшлуночкової перегородки та задній сосочковий м’яз.
Типи кровопостачання серця
Із вищезазначеного зрозуміло, що ЛКА постачає кров’ю значно більший як за обсягом, так і за значенням масив серця. Проте прийнято враховувати, який тип кровопостачання (лівокоронарний, правокоронарний чи рівномірний) у хворого. Йдеться про те, з якої артерії в конкретному випадку сформована задня міжшлуночкова артерія, зоною кровопостачання якої є задня третина міжшлуночкової перегородки; тобто за наявності правокоронарного типу задня міжшлуночкова гілка сформована з ПКА, що розвинена більш виражено, ніж гілка, що огинає ЛКА. Проте це не означає, що ПКА кровопостачає більший, порівняно з ЛКА, масив серця.
Правокоронарний тип васкуляризації характеризується тим, що права коронарна артерія заходить за задню поздовжню борозну і постачає своїми гілками праву та більшу частину лівого серця, а огинаюча гілка лівої коронарної артерії закінчується на тупому краю серця. При лівокоронарному типі огинаюча гілка лівої коронарної артерії заходить за задню поздовжню борозну, віддаючи задню міжшлуночкову гілку, що зазвичай відходить від правої коронарної артерії і постачає своїми гілками не лише задню поверхню лівого серця, але й більшу частина правого, а права коронарна артерія закінчується на гострому краю серця. При рівномірному типі кровопостачання серця обидві коронарні артерії розвинені однаково. Деякі автори, крім цих трьох типів кровопостачання серця, виокремлюють ще два проміжні, позначаючи їх «середньоправим» і«середньолівим».
Переважання правої коронарної артерії серця відзначається лише у 12% випадків, у 54% випадків переважає ліва коронарна артерія і в 34% — обидві артерії розвинені рівномірно. При домінуванні правої коронарної артерії ніколи не буває такої різкої відмінності у розвитку обох коронарних артерій, яка спостерігається при лівокоронарному типі. Це пов’язане з тим, що передня міжшлуночкова гілка, завжди утворена лівою коронарною артерією, постачає кров’ю значні ділянки ЛШ і ПШ.
Коронарні артерії та їх гілки, що розміщуються підепікардіально, оточені пухкою сполучною тканиною, кількість якої збільшується з віком. Однією із особливостей топографії коронарних артерій є наявність над ними у 85% випадків м’язових перемичок у вигляді містків або петель. М’язові містки є частиною міокарда шлуночків і частіше виявляються в передній міжшлуночковій борозні над ділянками однойменної гілки лівої коронарної артерії. Товщина м’язових перемичок — у межах 2–5 мм, їх ширина по ходу артерій варіює в межах 3–69 мм. За наявності містків артерія має значний інтрамуральний сегмент і здобуває «пірнаючий» хід. При прижиттєвій коронарографії їх наявність виявляється в систолу конічним звуженням артерії чи різким її вигином перед перемичкою, а також недостатнім наповненням судини під перемичкою. У діастолу зазначені зміни зникають.
До додаткових джерел кровопостачання серця належать внутрішні грудні, верхні діафрагмальні, міжреберні артерії, бронхіальні, стравохідні та медіастинальні гілки грудної частини аорти. Із гілок внутрішніх грудних артерій мають значення перикардіально-діафрагмальні артерії. Іншим провідним джерелом додаткової васкуляризації серця є бронхіальні артерії. Середня сумарна площа поперечного перерізу всіх екстракардіальних анастомозів у віці 36–55 років і старше 56 років становить 1,176 мм2.
Будова стінки коронарних артерій та їх гілок
Структура стінки цих судин відповідає розподільним судинам м’язового типу і включає 3 добре виражені шари-оболонки: внутрішній (інтима), середній (медія) і зовнішній (адвентиція). Внутрішній шар з боку просвіту судини покритий клітинами ендотелію. Його клітини мають сплощену витягнуту форму, поздовжня вісь яких орієнтована вздовж судини. Міжклітинні границі мають вигляд тонких, злегка звивистих ліній. Чим дистальніше розміщений артеріальний сегмент і чим менший його діаметр, тим більше витягнуті ендотеліоцити, що його покривають і тим менший кут їх відхилення від осі судини. У місцях відходження гілок ця закономірність порушується: розташування ендотеліоцитів стає хаотичним, а форма — полігональною. Розміри артеріальних ендотеліоцитів досить варіабельні. Довжина клітин становить 25–50 мкм, ширина — 7–15 мкм, товщина вибухаючої у просвіт частини, що містить ядро — до 3 мкм, а по периферії — 1 мкм. В ендотеліоцитах виділяють контактну, периферичну, яку займають органели, і ядерну зони, що досить умовно розмежовані між собою.
Ядро, що займає центральну ділянку, сплощеної овоїдної форми, виповнене філаментозним еу- і гранулярно-глибчастим гетерохроматином. Ядерця невеликі і їх рідко буває більше одного. В зоні перикаріона, що оточує ядро, зосереджена основна маса органел, що забезпечують енергетичні та пластичні потреби клітин. Комплекс Гольджі зазвичай розміщений ближче до люмінальної поверхні. Його профілі мають вигляд плоских порожнин, утворених елементарною мембраною, оточених нечисленними великими вакуолями та групами дрібних везикул, іноді з ущільненим вмістом.
Гладка і гранулярна ендоплазматична сітка становить різноспрямовано-орієнтовані канальці. Мембрана гранулярного ретикулума засіяна РНП-гранулами (рибонуклеопротеїдні частки). Нечисленні мітохондрії мають округлу чи овоїдну форму діаметром 0,1–1 мкм, внутрішня мембрана утворює 3–6 коротких крист. Кількість лізосом та їх розміри також невеликі, вони мають типову будову. Мітохондрії та лізосоми містять весь набір ферментів, характерних для цих органел. Цитоспецифічним елементом ультраструктури ендотеліоцитів є тільця Вейбеля — Паладе довжиною 2–3 мкм і діаметром 0,15 мкм. Електронна щільність їх вмісту змінюється від незначної до високої згідно з функціональним станом.
Форма ендотеліальної клітини підтримується елементами цитоскелета, об’єднаними в сітку. У цій сітці розрізняють цитокортекс, позбавлений органел, розміщений безпосередньо під плазмолемою і краще виражений у контактній зоні клітини, мікротрабекулярні ґрати ендоплазми і волокна напруження, що перетинають цитоплазму в різних напрямках. Філаменти цієї сітки утворені актином, який може переходити з глобулярної Г-форми у фібрилярну Ф-форму чи знову деполімеризуватися. Елементами цитоскелета також є орієнтовані вздовж клітини мікротрубочки, що досить рідко виявляються у зрізах, і так звані проміжні фібрили для з’єднання елементів фібрилярного каркаса.
Структурування фібрил актину потребує витрат АТФ. При взаємодії з молекулами міозину і Са2+ Ф-актин генерує силу, впливаючи на розміщення органел і рельєф клітинної поверхні. Зв’язок міофібрил із плазмолемою в зонах міжендотеліальних стиків дає підстави думати про залежність їх проникності від стану цитоскелета, а контакти із вбудованими у плазматичну мембрану рецепторами — про можливість регуляторного впливу ендотеліоцитів на процеси ультрафільтрації.
Плазматична мембрана ендотеліоцита — типова тришарова біологічна мембрана з білковими комплексами, зануреними в ліпідний біошар. Їх виступаючі полярні частини з боку цитоплазми входять до складу субмембранного, а зовні — параплазмолемного шарів клітинної оболонки. Люмінальна поверхня ендотелію покрита глікокаліксом, у якому наявні сіалові кислоти, гліколіпіди, гепарин, моно- і полісахариди, білки. Весь цей матеріал організований у вигляді пухкого позаклітинного шару, просоченого водою з іонами, дрібнодисперсними білками, білками плазми крові.
Важливим структурно-функціональним елементом ендотеліального моношару є міжклітинні контакти. Периферичні й контактні зони суміжних клітин можуть просто накладатися один на одного чи формувати інтердигітації, що значно ускладнюють контури міжклітинної щілини. При цьому край однієї із клітин вільно звисає у просвіт судини, утворюючи так звану маргінальну складку. Простір між клітинами шириною в середньому 2–3 нм на всьому протязі заповнено міжклітинним «цементом», близьким за своїми фізико-хімічними властивостями до глікокаліксу. Зони різкого зближення поверхонь клітин, що примикають, можуть перемежовуватися локальними розширеннями контактної щілини.
Спеціалізованими структурами, що підтримують цілісність ендотеліального покриття судини, є щільні та щілеподібні контакти в ділянці латерального примикання ендотеліоцитів. Щільний або замикаючий контакт, утворений злиттям зовнішніх листків плазмолеми суміжних клітин, становить пенталамілярний комплекс, укріплений сіткою контактних фібрил. Щілеподібні міжендотеліальні контакти відзначають значно рідше. Вони мають певну структурну подібність із подібними утвореннями вставних дисків кардіоміоцитів. Незважаючи на наявність цих спеціалізованих структур, міжклітинна щілина забезпечує ультрафільтрацію рідини і невеликих гідрофільних молекул за гемотканинним градієнтом тиску.
Відмінною рисою поверхні ендотеліоцитів є лабільність, що проявляється формуванням численних виступів і втягнень, які відшнуровуються у вигляді мікропіноцитозних везикул. Вони здатні знову вбудовуватися у плазмолему чи зливатися між собою, утворюючи поліморфні гроноподібні або ланцюжкові комплекси з декількох елементів. Мікропіноцитозні везикули становлять округлі утворення діаметром 50–70 мм, покриті зсередини слабкоосміофільним аморфним або гранулярним матеріалом. Основна їх функція — трансендотеліальний «контейнерний» перенос грубодисперсних речовин. Процес відділення навантаженого такими речовинами пухирця від плазмолеми, як і наступне злиття з нею і випорожнення на протилежній поверхні клітини, здійснюється значно швидше, ніж його переміщення через цитоплазму. У зв’язку з цим мікровезикула більшу частину часу існує у вигляді більш- менш глибокого інвагіната плазмолеми або не пов’язаного з нею мембранного утворення.
Асоціюючись, мікровезикули можуть формувати динамічні трансендотеліальні канальці, діафрагмовані, якщо між ними зберігаються везикулярні перегородки, або вільні за їх відсутності. У першому випадку вони стають додатковим маршрутом міграції низькомолекулярних ліпотропних речовин, у другому — канальцями для ультрафільтрації за градієнтом тиску.
Популяція мікровезикул ендотеліоцита неоднорідна. Деяка частина з них має відношення до секреторного процесу, інші є, очевидно, мембранним резервом клітини і активно не беруть участі у транспортному процесі. Частина везикул у фазу формування завантажується вільно, а фактором, що лімітує розмір дифундуючих у везикулу речовин, є ширина її устя. В інших воно перекрито діафрагмою товщиною 3–5 мм, яка є фільтром, що здійснює селекцію матеріалу, який завантажує везикулу, з урахуванням розмірів і заряду його часток.
Так звані облямовані везикули, оточені з боку цитоплазми спеціалізованим білком — клатрином, пов’язаним із цитоскелетом, беруть участь не лише в рецептор-опосередкованому ендоцитозі ліпопротеїнів, грубодисперсних білків і позитивно заряджених частинок, але і в переносі матеріалу з ендоплазматичного ретикулума у пластинчастий комплекс.
Судинний ендотелій — поліфункціональна система, що проявляє регуляторний вплив як на судини, так і на систему крові, створює тромборезистентну поверхню, бере участь у гемотканинному обміні, забезпечуючи його селективність, синтезує і катаболізує цілий ряд біологічно активних речовин, бере участь у ліпідному обміні та регуляції тонусу судинної стінки. Завдяки наявності рецепторного апарату, ендотелій чутливий до ацетилхоліну, катехоламінів, гормонів гіпофіза, вазопресину і окситоцину, гістаміну, факторів, що виділяються тромбоцитами, — серотоніну, тромбоксану А2, брадикініну. Ендотеліальні клітини артерій беруть участь у метаболізмі таких речовин, як норадреналін, серотонін, аденозин, в них міститься АПФ, утворюються метаболіти арахідонової кислоти, лейкотрієни, а саме простациклин (ПГІ2), що має вазодилататорні та антиагрегантні властивості.
Клітини ендотелію виділяють ендотеліальний релаксуючий фактор, ідентифікований як NO, а також ангіотензин, ендотелін — поліпептид вазоконстрикторної природи, що підвищує рівень АТ. Секреція ендотеліального фактора росту детермінує новоутворення судин.
Ендотелій є природною границею між тканинами і кров’ю, утворює і зв’язує на своїй поверхні широкий спектр антитромботичних, антикоагулянтних і прокоагулянтних факторів, регулює агрегатний стан пристінкового шару плазми крові. Глікокалікс ендотелію, як і поверхня формених елементів крові, має негативний заряд, що також багато в чому визначає тромборезистентність судинної стінки. Нерівномірний, «доменний» розподіл цього заряду в глікокаліксі впливає на його неспецифічну адгезивність і транспортну функцію, що ґрунтується на електростатичній взаємодії.
В ендотеліоцитах наявний набір ферментів, необхідних для руйнування фібрину, синтезу біологічно активних речовин, компонентів базальної мембрани та міжклітинної речовини. Ензими інтегровані з мембранами мітохондрій та інших органел, з плазмолемою, утримуються в лізосомах, адсорбовані глікокаліксом, пов’язані з рецепторами — глікопротеїн-ферментними комплексами, вбудованими у плазмолему. Глікопротеїновий компонент рецептора, що взаємодіє із специфічним подразником, структурований у глікокаліксі. Отриманий сигнал передається на протеїдний компонент рецептора і далі на вбудований у товщу мембрани G-білок, послідовно викликаючи в них конформаційні зміни. При цьому G-білок набуває здатності взаємодіяти з гуанозинтрифосфатом, додатково змінюючи свою просторову конфігурацію. Це служить сигналом для активування аденілциклази, гуанілциклази чи фосфоліпази — ферментів, локалізованих на внутрішній поверхні плазмолеми і функціонально сполучених із відповідним рецептором. Внаслідок цього у клітині підвищується концентрація вторинних месенджерів: цАМФ, NO, цГМФ, діацилгліцеролу й інозитолтрифосфату, які змінюють концентрацію Са2+, стимулюють різноманітні ферментні системи і тим самим різні види клітинної активності.
Ендотеліальний моношар лежить на базальній мембрані, зв’язуючись з нею напівдесмосомами і адгезивними білками, зокрема фібронектином. У всіх відділах судинного русла серця базальна мембрана має тришарову будову і тонкофібрилярну сітчасту основу, осередки якої виповнені глікопротеїнами і гепаринсульфатовмісними протеогліканами. Поряд із приграничною і опірною функціями, вона виконує роль бар’єра з електростатичними властивостями, проникність якого для субстратів, що фільтруються, залежить від їх розміру та заряду.
Ендотеліальний шар механічно неміцний і легко травмується, наприклад під впливом високого напруження зрушення, проте мікродефекти, що виникли, швидко усуваються завдяки високій регенераторній здатності ендотеліоцитів.
До базальної мембрани прилягає субендотеліальний шар, що становить приблизно 1/6 товщини всієї стінки і в магістральних субепікардіальних артеріях розвинений краще, ніж у різнокалібрових судинах інших відділів. Утворений по-різному орієнтованими колагеновими волокнами, зануреними в основну міжклітинну речовину, багатий глікозаміногліканами. У ньому виявляють також нечисленні фібробласти, низькодиференційовані секреторно активні гладком’язові клітини, зрідка — макрофаги. У місцях розгалуження судин та інших ділянках, що зазнають сильного впливу потоку крові, відзначають м’язово-еластичні потовщення, в яких розрізняють поверхневий і більш багатий волокнистими елементами глибокий шар.
Середній шар
Границя інтими — внутрішнього шару судинної стінки — внутрішня еластична мембрана. Вона становить гладку пластинку, утворену з розгалужених еластичних волокон, з отворами діаметром 2–5 мкм, через які в субендотеліальний простір з медії проникають відростки гладком’язових клітин. Еластична мембрана і еластичний колагеновий каркас визначають механічні властивості судинної стінки. Зрілі еластичні волокна складаються з двох компонентів: аморфного, утвореного еластином, що розтягується, і фібрилярного, що складається із структурних глікопротеїнів і обмежує розтяжність еластинового матрикса.
Медія коронарних артерій складається в основному з гладком’язових клітин, що утворюють ≥15 шарів. Їх орієнтація в зовнішньому сегменті медії коронарних артерій наближається до поздовжньої, в інших ці шари розміщуються спіралеподібно. Гладком’язові клітини мають сплощену веретеноподібну форму, їх поверхня з частими і глибокими інвагінатами сарколеми, найбільш вираженими в апікальних відділах клітин.
Органели кардіоміоцитів і гладком’язових клітин стереотипні при якісно відмінній внутрішньоклітинній організації. Більшу периферичну частину гладком’язових клітин займає контрактильний апарат, який складається переважно з актинових філаментів, що групуються в пучки товщиною 5–8 нм. Водночас товсті (15–19 нм) міозинові нитки розподілені нерегулярно і не завжди виявляються.
Актинові філаменти фіксовані у клітині «щільними тілами» — подовженими електроннощільними аналогами телофрагм кардіоміоцитів, а на сарколемі — нерегулярно розташованими поверхневими ущільненнями, відповідно до проміжних зон вставних дисків робочих клітин міокарда.
У центральній зоні клітин розташоване велике паличкоподібне ядро довжиною близько 20 мкм, що містить 1–2 ядерця. Навколоядерна зона вільна від контрактильних елементів і зайнята різними органелами, зосередженими в основному біля полюсів ядра. Це пластинчастий комплекс Гольджі, що має невеликий обсяг і типову будову, центріолі, що виявляються рідко, фрагменти гранулярної ендоплазматичної сітки, вільно розсіяні гранули рибонуклеопротеїдів і глікогену.
Мітохондрії гладком’язових клітин значно менші за обсягом, ніж у вентрикулярних кардіоміоцитах, з нечисленними кристами. Мають округлу чи подовжену форму і також зосереджені в перинуклеарній зоні вздовж довгої осі клітини. Тут же систематично визначаються первинні лізосоми з гомогенним електроннощільним вмістом і одноконтурною мембраною, а також їх вторинні форми. Вони містять світлі й темні компоненти, які беруть активну участь у видаленні продуктів внутрішньоклітинного катаболізму за допомогою екзоцитозу.
Саркоплазматичний ретикулум гладком’язових клітин артерій розвинений досить добре і представлений периферичним та центральним компартментами. На ультратонких зрізах він має вигляд численних везикул і в різних напрямках орієнтованих тубул, утворених гладкою цитомембраною. У їх розподілі відзначається певний зв’язок із щільними тілами, що краще простежується в кортикальній зоні клітини. Елементи периферичного відділу саркоплазматичного ретикулума досить часто утворюють функціональні контакти із сарколемою та її інвагінатами, оточуючи їх відгалуженнями своїх канальців.
Характерною рисою гладком’язових клітин є добре розвинений опорний цитоскелет, елементи якого розподілені в саркоплазмі нерівномірно. Сарколема гладком’язових клітин утворена типовою тришаровою цитомембраною, покритою шаром глікокалікса. Його товщина в місцях зближення клітин становить 30–50 нм і значно збільшується на вільній поверхні клітин. Загальну площу сарколеми істотно збільшують прості кавеоли і більш складні, що складаються з декількох таких елементів інвагінати, так звані бусоподібні тубули, що відповідають Т-системі кардіоміоцитів.
Гладком’язові клітини артеріальної стінки інтегровані між собою за допомогою міжклітинних контактів і мембранного каркаса медії. Контакти між ними різноманітні: це може бути як невелика за довжиною щілина між ущільненими ділянками плазматичних мембран суміжних клітин шириною 17–20 нм без електроннощільного вмісту, так і структури, що нагадують десмосоми чи нексуси. Наявність вікон у внутрішній еластичній мембрані робить можливими також міоендотеліальні контакти у вигляді простого прилягання невеликого виступу, утвореного однією з клітин, до поверхні іншої з вузьким вільним проміжком між ними.
Шари медії та гладком’язових клітин розділені невеликою кількістю колагенових та еластичних волокон. Пучки колагенових фібрил оточують еластичні волокна і гладком’язові клітини, поєднуючи їх в єдину систему з обома еластичними мембранами судинної стінки. Така стереоархітектоніка м’язово-волокнистих елементів забезпечує її односпрямоване розтягнення, що лімітується колагеновими волокнами і регулюється тонусом гладком’язових клітин.
Зовнішня оболонка
Адвентиція коронарних артерій відділена від медії зовнішньою еластичною мембраною, тоншою і більш перфорованою, ніж внутрішня. Адвентиція складається з пухкої сполучної тканини із значною кількістю поздовжньо-орієнтованих еластичних волокон. За товщиною не поступається медії. Зовнішня границя адвентиціального шару поступово зливається з навколишньою тканиною, що утворює навколо коронарних артерій та їх великих гілок сполучнотканинні футляри — фіброзні артеріальні піхви, які стоншуються і розпушуються в дистальних відділах судин.
В адвентиції розміщені елементи нервової системи та лімфатичного русла, а також дрібні кровоносні судини, «судини судин» (vasa vasorum), розгалуження яких, як і нервові закінчення, розміщуються в медії. Судини, що живлять артеріальну стінку, утворюють сплетення в адвентиції великих субепікардіальних та інтрамуральних артерій серця, що за архітектонікою відрізняються від периферичних розгалужень, що живлять міокард. Воно побудоване за «класичним типом» у вигляді сітки мікросудин, які, часто анастомозуючи, послідовно зливаються в короткі посткапіляри і венули. Живлення різних шарів стінки коронарних артерій здійснюється диференційовано: в інтимі та приблизно третині медії, що прилягає, забезпечується за рахунок дифузійних процесів із просвіту судини, тоді як розміщені глибше гладком’язові клітини і адвентиція кровопостачаються vasa vasorum.
Внутрішньоорганне артеріальне русло серця
У товщу стінки шлуночків серця артерії проникають, як правило, перпендикулярно чи косо до його поверхні, а потім розгалужуються в міокарді (рис. 1.23).

Рис. 1.23. Розгалуження інтрамуральної артерії серця людини (ін’єкційний препарат)
У зовнішніх шарах міокарда вони розгалужуються на артерії меншого калібру (0,1–0,2 мм), що проходять в основному горизонтально, відповідно до орієнтації м’язових пучків. У внутрішньому поздовжньому шарі міокарда артеріальне русло стає густішим. Воно утворене резистивними судинами діаметром 20—100 мкм, орієнтованими переважно вертикально, паралельно до пучків м’язових волокон і трабекул. У м’язових трабекулах проходять артеріоли діаметром 50–60 мкм. Міокард передсердь містить артеріальні судини двох напрямків відповідно до орієнтації пучків м’язових волокон. У зовнішніх пучках артерії проходять і розгалужуються в горизонтальному напрямку, у внутрішньому — у вертикальному.
Зі зменшенням калібру артерій будова їх стінки стає менш складною. Великі транспортні інтрамуральні артерії міокарда є гілками коронарних артерій III–IV порядку. Їх діаметр рідко перевищує 1,5–2 мм, а медія складається з 4–5 шарів гладком’язових клітин. Транспортні артерії діаметром >0,6 мм, орієнтовані від епікарда до ендокарда, діляться і утворюють розподільні й термінальні артерії. Їх діаметр — 100–150 мкм, медія складається з 2–3 шарів гладком’язових клітин, орієнтація яких часто не збігається. М’язові волокна зовнішнього і внутрішнього шарів можуть розміщуватися у поздовжньому, а середнього — в косопоперечному напрямках, причому тільки центральний шар гладком’язових клітин утворює замкнуту оболонку на всьому протязі судини. В середньому шарі судин 7–8-го порядку діаметром 40–60 мкм, що досягають ендокарда, наявні вже не більше 2 шарів гладком’язових клітин, які мають переважно спіралеподібне розташування.
Ультраструктура гладком’язових клітин медії артерій такого калібру спрощується. Поверхня клітин, огорнених базальною мембраною товщиною близько 80 нм, стає більш гладкою, вони більш щільно притиснуті одна до одної, частіше утворюють функціональні контакти. Зона органел розширюється, апарат пластичного забезпечення представлений краще, а кількість контрактильних структур дещо зменшується.
Колагенові та еластичні волокна, як і гладком’ язові клітини, ідуть гвинтоподібно, перехрещуючись по ходу. У міру зменшення гладком’язового шару середньої оболонки артерій її колагеново- еластична основа стає ніжнішою, поступово трансформуючись у тонковолокнисту сітку. Внутрішня еластична мембрана інтрамуральних артерій краще розвинена, ніж зовнішня, яка зі зменшенням калібру судин розпадається на окремі фрагменти і нарешті зливається з іншими волокнистими структурами судинної стінки. Внутрішня еластична мембрана при цьому також стоншується, її вікна стають ширші, і в термінальних артеріях вона перетворюється в ніжну сітку еластичних волокон.
Інтима транспортних інтрамуральних артерій міокарда утворена основною аморфною речовиною і тонкими фібрилярними структурами, кількість яких помітно зменшується при розгалуженнях судини. У поєднанні з рарифікацією внутрішньої еластичної мембрани це полегшує формування міоендотеліальних контактів. Ендотелій, що суцільним шаром покриває внутрішню поверхню інтрамуральних артерій серця, в цілому зберігає ті ж тканинноспецифічні ознаки, що і в коронарних артеріях. Його клітини мають дещо сплощену і більш округлу форму, розташовані в один шар, частково перекриваючи одна одну своїми краями. Цитоскелет ендотеліоцитів навіть у дрібних судинах добре розвинений, в них відзначається висока інтенсивність везикулярного транспорту, міжендотеліальні контакти часто укріплені щільними з’єднаннями або утворюють складні взаємні виступи за типом «ключ-замок».
Адвентиція найбільш диференційована у транспортних артеріях, що зберігають у міокарді свою органну відокремленість, тоді як розподільні артерії та їх гілки поступово стають інтегральним компонентом його строми. На всьому протязі адвентиція складається з нещільно розташованих тонких колагенових волокон, що місцями збираються в ексцентрично розташовані пучки. Серед них іноді виявляють розрізнені гладком’язові клітини або групи волокон, орієнтованих спірально або косопоздовжньо. Гладком’язові включення найбільш характерні для артерій сосочкових м’язів і трабекул міокарда. Сполучнотканинне оточення інтрамуральних артерій простежується аж до їх термінальних розгалужень, зливаючись із їх зовнішньою оболонкою.
Крім наявності гладком’язових клітин в адвентиції, артерії міокарда відрізняє від судин інших органів цілий комплекс адаптаційних структур. До них належать неоднакова товщина та асиметрія медії по ходу судини; осередкові потовщення інтими в місці відходження гілок різного порядку, м’язові гніти, розташовані в місцях відгалуження артеріол від дрібних артерій міокарда, а на рівні мікрогемоциркуляторного русла — прекапілярні сфінктери. У ПШ медія дрібних артерій товстіша, ніж у ЛШ, а в лівому передсерді виявляють артерії, гладком’язові клітини, медії яких становлять два шари, розташовані в косопоперечному напрямку по відношенню один до одного і поздовжньої осі судини. Ці утворення забезпечують резистентність судинної стінки до нерівномірного впливу пульсової хвилі і беруть участь у регуляції кровотоку.
Термінальні артерії і артеріоли, що від них відгалужуються — головна ділянка судинної системи, де відбувається зниження АТ, гасіння пульсової хвилі і корекція потоку крові у відповідності до регіональних потреб.
Мікрогемоциркуляторне русло
Мікрогемоциркуляторне русло в міокарді, як і в інших тканинах, становить п’ятикомпонентний комплекс, утворений артеріолами, прекапілярами, капілярами, посткапілярами і венулами (рис. 1.24).
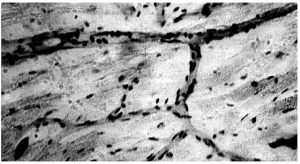
Рис. 1.24. Елементи мікрогемоциркуляторного русла міокарда
Ангіоархітектоніка мікрогемоциркуляторного русла
Інтрамуральні артерії, розгалужуючись переважно дихотомічно, розпадаються на гілки, які васкуляризирують окремі м’язові пучки — фасцикули. Кожен м’язовий пучок кровопостачається декількома «інтрафасцикулярними судинами». Внутрішньопучкові артерії діляться на артеріоли діаметром 20–25 мкм, розміщені під кутом 10–30° до подовжньої осі фасцикули, які є початком мікрогемоциркуляторного русла. Від артеріол під гострим кутом відходять короткі прекапіляри шириною 12–15 мкм, які безпосередньо розгалужуються на капіляри, орієнтовані вздовж м’язових волокон. Кожен із них кровопостачається 3–5 капілярами; кожен капіляр водночас прилягає до декількох м’язових волокон.
Кров із капілярів потрапляє в посткапіляри і далі — у венули. Від м’язового пучка її відводять кілька дрібних гілочок, що впадають у різні інтрамуральні вени. З анатомічної точки зору мікрогемоциркуляторне русло міокарда становить систему кровопостачання окремого м’язового пучка, у якій ясно позначені артеріальний, венозний і капілярний відділи (рис. 1.25).
Рівномірна трофіка кардіоміоцитів на території всього м’язового пучка досягається розміщенням окремих ланок мікрогемоциркуляторного русла, насамперед — капілярів. Артеріоли частіше орієнтовані вздовж фасцикули; прекапіляри, відгалужуючись від артеріол нерівномірно, розміщуються частіше під гострим кутом до м’язових волокон. У кожному пункті фасцикули капіляри несуть кров у протилежних напрямках, що забезпечується характером розподілу прекапілярів у м’язовому пучку, а також здатністю артеріол віддавати мікросудини в обидва боки.

Рис. 1.25. Реконструкція фрагмента мікрогемоциркуляторного русла ЛШ серця людини за серійними гістологічними зрізами: А — артеріола, В — венулярний синус
Сусідні капіляри однаково орієнтовані, взаємно зміщені на 1/3–1/2 своєї довжини. Завдяки цим особливостям до кожного м’язового волокна належать як проксимальні, так і дистальні відділи капілярів. Іноді капіляри додатково діляться в артеріальному сегменті; від них під кутом, близьким до прямого, відходить коротка перемичка. Вона дає початок двом новим мікросудинам, які розходяться у протилежних напрямках. Це імітує «місток» між паралельними капілярами, створюючи ілюзію частого їх анастомозування в міокарді, що справедливо лише для посткапілярів.
Венозні відділи мікрогемоциркуляторного русла побудовані за двома типами. У першому посткапіляри, орієнтуючись вздовж м’язового пучка, досягають подовжених конусоподібних венул біля його полюсів. У другому венули починаються ампулами, до яких із товщі фасцикули сходяться посткапіляри подібно до пензлика.
Артерії та вени проходять вздовж м’язового пучка. Не анастомозуючи і лише переплітаючись, вони транспортують кров як від полюсів м’язового пучка до його середини, так і від центра до периферії.
В результаті кожне м’язове волокно одержує живлення з декількох відносно незалежних джерел, а у кожного м’язового волокна функціонально поєднані артеріальні й венозні відділи декількох суміжних капілярів.
Описані особливості кровопостачання міокарда є найважливішим пристосуванням для забезпечення відносно постійного складу внутрішньотканинного середовища, а отже, оптимальних умов функціонування кардіоміоцитів.
Венулярні синуси (рис. 1.26), зливаючись, утворюють збірні венули другого порядку подовженої мішкоподібної форми з діаметром у найширших сегментах 100–200 мкм і устям, що конусоподібно звужується.
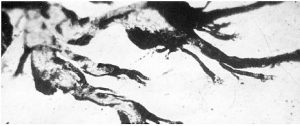
Рис. 1.26. Венулярний синус міокарда людини (ін’єкційний препарат)
У більших, діаметром до 300 мкм, інтрамуральних вен, які приймають від них кров, часто спостерігаються округлі чи веретеноподібні розширення, що утворюються не лише в ділянці впадання гілок, але й по ходу судини. Таким чином, для інтрамуральних джерел венозної системи міокарда характерні множинність злиття мікросудин, можливість впадання посткапілярів другого, і навіть першого порядку, відразу в значно більший за об’ємом венулярний синус, а також структура початкових відділів венозного русла у вигляді лакуноподібних елементів, що послідовно з’єднуються. Подібна будова цього відділу кровоносної системи серця найбільш характерна для ЛШ, значно менше — для ПШ, не відзначається в передсердях, де загальна архітектоніка мікрогемоциркуляторного русла ближча до площинних структур, в яких мікросудини формують багатошарові сітки.
Будова стінки елементів мікрогемоциркуляторного русла міокарда
Структурні особливості різних ланок мікрогемоциркуляторного русла залежать від їх калібру і відповідно функції. Зовнішня оболонка артеріол, як і термінальних артерій, утворена розпушеними волокнистими структурами та поодинокими клітинами і без видимої межі переходить у сполучну тканину периваскулярної зони. Ендотеліоцити артеріолярної стінки подовжені й потовщені, мають зубчасті краї, в міжендотеліальних стиках наявні зони оклюзії. Зональне диференціювання цитоплазми ендотеліальних клітин дещо згладжене, проте основна маса органел концентрується поруч із клітинним ядром.
Конфігурація ендотеліального шару залежить від функціонального стану судини. Розширення його просвіту супроводжується різким сплощенням периферичних зон ендотеліоцитів, при скороченні судинної стінки вони набувають ромбоподібної форми з вибуханням у просвіт відділів, що містять ядро. Базальний шар, що покриває ендотеліоцити, добре розвинений і повторює нерівності їх плазмолеми. Еластична мембрана, утворена аморфним і фібрилярним компонентом, тонка, з широкими вікнами, на поперечних зрізах часто має вигляд дрібних розрізнених фрагментів. Вузька субендотеліальна зона становить гомогенну слабкоосміофільну речовину.
Гладком’язові клітини становлять один не завжди суцільний шар і розміщені циркулярно, під кутом до осі судини. Вони дещо бідніші органелами, ніж у магістральних артеріях. Характерною рисою резистивних судин міокарда, є міо-міоцитарні і міоендотеліальні контакти. За ходом судинного русла міокарда, від артеріального рівня до капілярів, виявляють зони, де постійно розміщуються скупчення гладком’язових клітин. У прекапілярах на місці гладком’язових клітин можуть бути масивні перицити, що охоплюють більшу частину периметра судини.
Кровоносні капіляри міокарда ЛШ класифікуються як «типово соматичні». Їх діаметр коливається в межах 5–7 мкм, збільшуючись із віком до 7–9 мкм. Стінка утворена суцільним шаром ендотеліоцитів, що тісно контактують, і базальним шаром, що складається з неклітинного компонента (базальної мембрани) і перицитів. Добре розвинена базальна мембрана виконує опорну функцію і є важливим елементом гістогематичного бар’єра.
Проксимальні ділянки капілярів мають порівняно невелику величину просвіту і диференціюються на відкриті, плазматичні й резервні, а за функцією — на переважно фільтруючі, резорбуючі або ті, що беруть участь рівною мірою в обох процесах. Здатність до зміни об’єму найбільш виражена у клітин із краще розвиненим цитоскелетом, розміщених в устях капілярів.
Ендотеліоцити оточені тонкими параплазмалемальним шаром, що заповнює міжклітинні щілини. Поліаніонна природа глікозаміногліканів, що входять до складу параплазмалемального шару і базальної мембрани, визначає характер їх участі у функції гістогематичного бар’єра за допомогою зміни умов дифузії та ультрафільтрації через міжендотеліальні стики.
В ультраструктурі артеріальних і венозних сегментів капілярів існує ряд відмінностей. Найбільш характерні полягають в ортоградному розширенні просвіту із збільшенням кількості ендотеліоцитів, що формують стінку капіляра, частішій наявності в його дистальному відділі мікроворсин і вільно звисаючих маргінальних складок, менш складній структурі контактів між ендотеліоцитами.
Особливість дистальних відділів мікрогемоциркуляторного русла — зменшення діаметра просвітів у місцях впадання капілярів у посткапіляри і далі — у венули. Прохідність устів капілярів залежить від розміщених тут спеціалізованих ендотеліоцитів, що мають здатність реагувати на зміни навколишнього середовища змінами об’єму і структуалізацією цитоскелета, а також від клапаноподібних цитоплазматичних виступів і дуплікатур мікросудинної стінки.
Стінка посткапілярів не набуває нових рис будови, і лише більший діаметр та більша кількість ендотеліоцитів відрізняють їх від венозних відділів капілярів. Для венулярних синусів, що завершують функціональну одиницю мікрогемоциркуляторного русла міокарда, як і для конусоподібних венул, характерні сплощені та більш округлі ендотеліоцити листоподібної конфігурації з великою периферичною зоною. Міжклітинні границі прорізані, стики, як правило, формуються простим накладенням або стикуванням контактних зон ендотеліоцитів, прохідність міжклітинної щілини обмежена одиничними плямами облітерації. Базальна мембрана суцільна, добре контурується, перицити відзначаються частіше, ніж у капілярах і посткапілярах, не утворюючи, проте, суцільного шару. Периваскулярна зона організована по-різному. Стінка широких сегментів венулярного синуса близько підходить до м’язових волокон, а більш вузьких сегментів — оточена розрізненими, розпушеними волокнистими елементами. Тут же визначають фіброцити, зрідка — макрофаги та інші клітини сполучної тканини.
У будові венулярної ланки мікрогемоциркуляторного русла міокарда поєднані ознаки, характерні для трофічної та ємнісної функцій. Невелика товщина стінки мікросудин, спрощена конструкція міжклітинних стиків ендотелію сприяє їх активній участі в гемотканинному обміні. Водночас відсутність структур, що зумовлюють ригідність стінки, визначає залежність тонусу венул від співвідношення внутрішньо- і зовнішньосудинного тиску, градієнт якого, як і конфігурація просвіту мікросудини, змінюється при скороченні та розслабленні міокарда. Це повністю відповідає уявленням про винятково важливу роль дистальних відділів мікрогемоциркуляторного русла, венулярних синусів для згладження нерівномірностей нутритивного кровотоку.
Анатомія вен серця
У венозній системі серця виділяються три основні функціонально пов’язані відділи, що мають морфологічні й топографічні особливості: систему коронарного синуса серця, вени обох передсердь і вени В’єссена — Тебезія.
Кров, пройшовши капілярну мережу, вливається у венули, злиття яких утворює густе сплетення в субендокарді. Венозна система міокарда шлуночків починається синусоїдами або венулярними синусами, наявність яких пояснює феномен «мармуровості міокарда». У глибоких і середніх шарах міокарда шлуночків вени утворюють розгалуження сітчастого характеру, а в глибоких — впадають у трабекулярні вени і вени сосочкових м’язів. У ділянці верхівки деякі сосочкові вени ідуть від стулок клапанів через сухожильні нитки. Внутрішньом’язові венозні сітки перебувають у різних шарах міокарда, напрямок широко анастомозуючих вен міокарда відповідає напрямку м’язових волокон. Розрізняють під- і внутрішньоендокардіальну, внутрішньокардіальну, внутрішньом’язову, внутрішньоепікардіальну і найбільш потужну підепікардіальну венозну сітку, що формується з вен усіх зазначених сплетень.
Вени серця, як правило, поодинокі, їх розміщення не пов’язане з розташуванням артерій, а сумарний об’єм венозного русла серця набагато перевищує артеріальний. У перегородці шлуночків містяться два потужні венозні пучки, які формуються у передньо- і задньоверхньому відділах міжшлуночкової перегородки на межі з передсердями. Вони вважаються основними венозними колекторами, по яких відтікає кров від перегородки шлуночків серця і ніжок пучка Гіса.
Завершальна ланка венозної системи серця — коронарний синус (sinus coronarius cordis). Це колектор, що збирає кров від стінок шлуночків і частково — передсердь, є залишком ембріональної лівої протоки (протоки Кюв’є) і розміщений на задній поверхні серця в лівій коронарній борозні. Довжина коронарного синуса коливається від 1,4 до 5,8 см, ширина — від 0,5 до 1,4 см. У коронарний синус серця впадають, як правило, чотири судини: велика вена серця, задня вена ЛШ, коса вена правого передсердя і середня вена серця.
Велика вена серця піднімається по передній міжшлуночковій борозні, проходить у коронарній борозні під лівим вушком серця, далі переходить на задню поверхню серця і продовжується безпосередньо в коронарну пазуху. Велика вена серця збирає кров від передніх відділів ЛШ, частково — ПШ і міжшлуночкової перегородки, а також приймає в себе вену лівого краю серця. Задня вена ЛШ утворюється з вен задньої стінки ЛШ на верхівці серця і впадає у коронарний синус. Коса вена лівого передсердя бере початок на задній поверхні лівого передсердя, проходить косо вниз і вправо, впадає у початковий відділ коронарного синуса чи у велику вену серця. Середня вена серця розміщується в задній міжшлуночковій борозні й збирає кров від задньої поверхні обох шлуночків.
У правій частині коронарної борозни міститься мала вена серця, що формується з вен передньої та частково задньої поверхні ПШ і правого передсердя. Частіше впадає в середню вену серця, іноді — безпосередньо в коронарний синус. У деяких випадках у малу вену серця впадає права крайова вена, що є єднальною ланкою між віддаленими системами середньої та великої вен серця.
Існують два типи венозного відтоку. При першому типі розвинена переважно система великої вени серця (44,2%), по якій здійснюється відтік крові від ЛШ і майже всього ПШ. При іншому типі переважно розвинена система передніх вен серця (42,5%), по яких кров відводиться не лише від всього ПШ, але й частини ЛШ серця. У цих випадках зазвичай значно розвинена і мала вена серця.
Існує велика кількість анастомозів між венами серця, вони добре виражені як у товщі серцевої стінки, так і між основними магістральними стовбурами.
Судини В’єссена — Тебезія
Ці судини наявні в усіх відділах серця, впадають безпосередньо в його порожнини. У правому передсерді таких вен більше, ніж у лівому, де їх устя розміщуються головним чином на медіальній стінці навколо краю овальної ямки. У ЛШ судини В’єссена — Тебезія найчисленніші в ділянці верхівки та основи сосочкових м’язів. У правому шлуночку найбільша їх кількість міститься в зоні артеріального конуса.
У передсердях судини В’єссена — Тебезія представлені типовими венозними стовбурами. Шлуночкові судини В’єссена — Тебезія побудовані за типом синусоїдів, які переходять у капілярну сітку або змикаються як з артеріями, так і з венами й артеріовенозними анастомозами у неглибоких субендокардіальних шарах. Через судини В’єссена — Тебезія здійснюється надзвичайно складний кровотік у м’язі серця, оскільки ці судини прохідні в обох напрямках: як у бік порожнин серця, так і з порожнин у товщу міокарда. Близько 40% всієї венозної крові, що відтікає від серцевої стінки, надходить у порожнину серця по тебезієвих венах, а відтік крові у коронарний синус серця становить 56–60% загальної кількості крові, що притікає по коронарних артеріях.
У системі вен В’єссена — Тебезія розрізняють дві групи судин: видимі під епікардом неозброєним оком інтрамуральні вени першого порядку, що широко анастомозують із субендокардіальною та іншими венозними сітками серця, і мікроскопічні інтрамуральні вени другого порядку (тебезієві вени), які ніколи не анастомозують із периферичною венозною сіткою серця.
Передбачається можливість зворотного току крові з порожнин серця через судинні зв’язки у міокард і участь останніх у кровопостачанні серця, особливо при порушеннях коронарного кровообігу, що настають раптово. Описано два типи таких судин: невеликі артерії та артеріоли, розміщені під епікардом, які відкриваються безпосередньо в порожнини серця (артеріолюмінальні судини), і невеликі гілки артерій і артеріол, які впадають у «синусоїди», що знаходяться між м’язовими пучками (артеріосинусоїдальні судини).
Будова стінки венозних судин серця
Починаючи з венулярних синусів другого порядку у судинній стінці з’являється тонкий прошарок пухкої сполучної тканини. Перицити набувають полігональної форми, в них більше фібрилярних елементів цитоскелета та інших органел, ніж у типових перикапілярних клітинах. Перицити щільно прилягають до базальної мембрани ендотелія і разом із волокнистими структурами повністю ізолюють ендотеліальне покриття від периваскулярного простору. Ендотеліоцити набувають ще більш округлої або неправильної полігональної форми і розміщуються без чіткої орієнтації щодо потоку крові. Площа, яку займає клітина, збільшується, головним чином за рахунок сплощених периферичних відділів.
У міру збільшення діаметра вен, разом із більш щільним приляганням волокнистих структур сполучної тканини, у судинній стінці виявляють фібробласти і розрізнені сплощені клітини веретеноподібної форми. Ці клітини часто групуються в устях синусоїд, вони оточені базальною мембраною, що переривається лише в зонах міжклітинних контактів. У цитоплазмі цих клітин наявні пучки актинових мікрофібрил, орієнтованих паралельно до їх поверхні, і електроннощільні структури, що нагадують щільні тільця гладком’язових клітин. Сукупність цього з більшим, ніж у перицитах, вмістом РНП-гранул і краще розвиненим гранулярним ретикулумом дозволяє ідентифікувати ці клітини як примітивні міоцити. У стінці великих інтрамуральних вен з’являються окремі гладком’язові волокна. Будова стінок тебезієвих судин ідентична структурі відповідних їм за калібром інтрамуральних вен, що несуть кров у систему коронарного синуса.
У субепікардіальній венозній системі синусоподібні ектазії відсутні, а судинна стінка має відносно рівні контури. Чітке пошарове розмежування, характерне для артеріальної стінки, відсутнє, і в цілому стінка значно тонша, ніж у артерій такого ж калібру, внаслідок малої вираженості її середнього і зовнішнього шарів.
Ендотелій інтрамуральних і субепікардіальних вен подібний, проте в контактній зоні частіше відзначають спеціалізовані структури, що зв’язують ендотеліоцити. Субендотеліальна зона маловиражена, заповнена в основному міжклітинною речовиною з поодинокими тонкими волокнами колагену, між якими іноді виявляють низькодиференційовані полігональні й веретеноподібні фібробласти. Еластична мембрана не сформована і представлена окремими еластичними волокнами та пластинами.
Гладком’язові клітини медії вен подібні до артеріальних, відрізняються від них лише більш сплощеною формою і меншою кількістю міжклітинних контактів. У невеликих гілках вони утворюють спіралеподібно розміщені скупчення, розділені волокнистими елементами. Клітини оточені базальною мембраною і тонкофібрилярними футлярами, пов’язаними між собою. Зі збільшенням калібру судини скупчення гладком’язових клітин стають більш потужними, досягаючи у великих венах 4–5 шарів, які проте не стають суцільними. Орієнтація клітин досить варіабельна, особливо у внутрішніх шарах медії.
Зовнішню оболонку судин становлять розрізнені, по-різному орієнтовані колагенові волокна та їх пучки, часто з наявністю фібробластів. При збільшенні калібру судин вона стає грубішою, формує досить щільні сполучнотканинні футляри навколо термінальних відділів великих вен серця. В адвентиції великих венозних стовбурів серця, як і артерій, є власна судинна сітка. Остання обплетена колагеновими фібрилами, що оточують судини у вигляді чохла. У стінці капілярів часто виявляють перицити, а в навколишній сполучній тканині — фібробласти і тучні клітини.
Цей відділ венозного русла серця відрізняє також наявність нерівномірно розміщених клапанів, що полегшують їх звільнення від надміру крові. У дрібних судинах це одностулкові кишеньоподібні заслінки, що представляють собою дублікатуру ендотелію з тонким прошарком сполучної тканини в основі. У більших венах клапани утворені складками судинної стінки, мають 2–3 стулки з потовщеним вільним краєм. Їх основа утворена сполучною тканиною із включенням гладком’язових волокон, що зумовлює активну участь у регуляції кровотоку.
Лімфатичне русло серця
У лімфатичному руслі серця розрізняють ендокардіальний, міокардіальний, субепікардіальний, епікардіальний відділи. Лімфа, що збирається ними, транспортується з більш глибоких шарів серцевої стінки у поверхневі і далі — в загальну лімфотечію по екстраорганних колекторах.
Топографія лімфатичного русла серця
Ендокардіальний відділ становить одношарову дрібнопетлисту сітку в зовнішньому сполучнотканинному шарі ендокарда. Вона утворена численними сліпими капілярами діаметром 15–25 мкм, що проникають ближче до його покритої ендотелієм поверхні. В ендокарді сосочкових м’язів ця сітка найгустіша, діаметр капілярів, що зливаються з лакуноподібними розширеннями, становить 30–60 мкм. Ендотеліоцити капілярів неправильної подовженої форми і за розмірами помітно переважають клітини інших відділів лімфатичного русла.
Міокардіальний відділ лімфатичного русла серця є ніби продовженням субендокардіального. Складається з капілярів діаметром 15–40 мкм і більш широких посткапілярів, локалізованих у міжфасцикулярних прошарках сполучної тканини. Вони об’єднані у тривимірну сітку, великі полігональні осередки якої витягнуті вздовж м’язових пучків, що оточені ними. У цій сітці капіляри чергуються з резервуароподібними, діаметром до 150 мкм посткапілярами, що мають клапани. Вони накопичують лімфу в діастолу і звільняються від неї при подальшому скороченні серцевого м’яза. З міокарда лімфа посткапілярами та відвідними судинами першого порядку направляється до епікарда. В ділянці провідної системи серця, і особливо в зоні передсердно-шлуночкового вузла, елементи лімфатичного русла розміщені густіше, ніж в інших регіонах.
Субепікардіальна лімфатична сітка складається з широких капілярів діаметром 40–80 мкм, посткапілярів судин першого порядку, розміщених у підепікардіальній сполучній тканині, які часто анастомозують. Власне епікардіальна лімфатична сітка складається з поверхневого та глибокого шарів, останній залягає на рівні глибокого колагеново-еластичного шару епікарда. Його широкі осередки, утворені посткапілярами та дрібними судинами, найчастіше мають ромбоподібну форму і діаметр 25–150 мкм.
Поверхнева лімфатична сітка, найгустіша з усіх, розміщена в колагеновому шарі епікарда ближче до його поверхні. Складається з широких судинних петель, заповнених дрібнішою сіткою з капілярів і посткапілярів, що впадають у них. Капіляри діаметром 15–45 мкм, зливаючись, часто утворюють зірчасті лакуни шириною 75–150 мкм. Лімфатична сітка епікарда, крім відведення лімфи з глибших шарів серцевої стінки, бере активну участь у резорбції перикардіальної рідини. Як і елементи кровоносної системи, лімфатичне русло серця утворює в адвентиції магістральних артерій і вен великопетлисту периваскулярну сітку, яка спрямовує лімфу в його субепікардіальний відділ.
Лімфатичну сітку епікарда і серця в цілому завершують судини зростаючого калібру, що збираються у два лімфатичні колектори. Діаметр судин першого порядку — у межах 350 мкм, другого — 650 мкм, третього — 750 мкм, а четвертого порядку — 1,5 мм. Правий лімфатичний колектор, що відповідає четвертому порядку, залишає серце в периартеріальній клітковині, лівий, більший — по передньобоковій поверхні загального легеневого стовбура, перериваючись у регіональних медіастинальних лімфовузлах, які приймають також лімфу від легень.
Будова елементів лімфатичного русла серця
Структуру лімфатичного русла серця відрізняє ряд особливостей. Це «розімкнутість» із початком у вигляді сліпих трубок або петель, сітчаста конструкція, численні клапани вже в посткапілярах, значна об’ємна диспропорція між її коріннями і судинами, що відводять лімфу. Лімфатичні капіляри порівняно із кровоносними мають значно більший просвіт при відносно меншій товщині стінки, що зазвичай утворена декількома ендотеліоцитами, які за величиною переважають ендотеліальні клітини кровоносних капілярів приблизно в 4 рази.
Незважаючи на складчастість ендотеліального шару, внутрішня плазматична мембрана ендотеліоцитів не утворює мікроворсин. Міжендотеліальні контакти лімфатичних капілярів відрізняються підвищеною рухливістю, чому сприяють стропні філаменти. Вплітаючись у плазмолему, вони фіксують край ендотеліоцита до колагенових протофібрил, які завжди наявні в перикапілярному просторі. Сполучення капілярного просвіту з інтерстицієм полегшується відсутністю базальної мембрани і перицитів.
Розмір периферичної зони ендотеліоцита значно більший розміру зони, що містить ядро і органели. У зв’язку з цим ендотеліоцити лімфатичних капілярів виявляються відносно біднішими на органели, ніж ендотеліоцити кровоносних капілярів. У ендотеліоцитах лімфатичних капілярів досить добре розвинений лізосомний апарат, тоді як мікропіноцитозні везикули нечисленні й не грають істотної транспортної ролі, незважаючи на здатність захоплювати електроннощільні маркери.
З переходом капілярів у посткапіляри і судини, що відводять лімфу, в їх стінці, поряд із клапанами, виявляється ніжнофібрилярний, місцями фрагментований базальний шар, змінюється будова міжклітинних стиків. Накладення контактуючих країв доповнюють інтердигітації, іноді скріплені плямами облітерації. На внутрішній плазматичній мембрані з’являються виступи і нечисленні мікроворсини, навколо ендотеліальної трубки починається формування адвентиції, проте медія ще відсутня. У стінках лімфатичних судин серця будь-якого калібру повноцінні гладком’язові клітини не ідентифіковані, функцію ортоградного просування лімфи виконує міокард, що скорочується. Ригідність стінок лімфатичних судин забезпечується пучками переплетених колагенових волокон, що утворюють суцільні футляри у великих судинах.
У формуванні характерних для лімфатичної системи двостулкових клапанів беруть участь всі структури судинної стінки. У посткапілярах це ендотеліоцити, а в міру зростання калібру судин в їх стінці з’являється основа, що складається з волокон сполучної тканини. Численні клапани зумовлюють наявність виражених перетяжок по ходу лімфатичних судин, надаючи їм чіткоподібної форми. Сітчаста побудова лімфатичного русла робить клапани функціонально необхідною структурою, що координує течію лімфи.
Іннервація серця та його судин
Серце іннервується трьома видами нервів: симпатичними, парасимпатичними (еферентними або моторними) і сенсорними (аферентними). Джерелами їх є серцеві нерви і гілки, що прямують до серця, поверхневе і глибоке нервові сплетення, розміщені біля дуги аорти і легеневого стовбура, а також внутрішньоорганне сплетення, елементи якого розподілені у всіх шарах серцевої стінки (рис. 1.27).
Рис. 1.27. Формування грудного аортального сплетення (схема): 1 — нижній вузол блукаючого нерва; 2 — верхні шийні серцеві гілки блукаючого нерва; 3 — верхній шийний вузол симпатичного стовбура; 4 — верхній шийний серцевий нерв; 5 — гілки до щитовидної залози; 6 — щитовидний хрящ; 7 — міжвузлова гілка; 8 — середній шийний серцевий нерв; 9 — середня шийна серцева гілка; 10 — змішані гілки, утворені шляхом з’єднання верхньої серцевої гілки і середнього серцевого нерва; 11 — щитовидна залоза; 12 — нижня шийна серцева гілка; 13 — трахея; 14 — зірчастий вузол; 15 — дуга аорти; 16 — лівий поворотний гортанний нерв; 17 — верхній грудний вузол симпатичного стовбура; 18 — нижній шийний вузол симпатичного стовбура; 19 — нижні шийні серцеві нерви
Топографія екстракардіального відділу
Екстракардіальні нервові сплетення прийнято розділяти на поверхневі та глибокі, які формуються в основному гілками шийного відділу пограничного симпатичного стовбура, а також гілками, що відходять від шийної та грудної частини блукаючих нервів.
Симпатична (адренергічна) іннервація забезпечується нервовими сплетеннями, які утворюються відростками нервових клітин, зосереджених у шийно-грудному (зірчастому) і верхньо-шийному симпатичних вузлах. Постгангліонарні пучки адренергічних нервових волокон, що виходять із них, проникають під епікард
передсердь і формують густу субепікардіальну сітку, що поширюється по ходу коронарних судин (рис. 1.28).
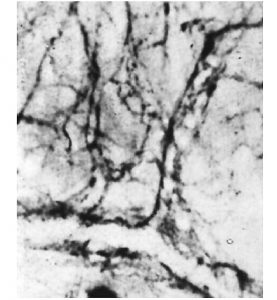
Рис. 1.28. Адренергічна іннервація тканин і судин серця
Від пограничного симпатичного стовбура беруть початок три серцеві нерви — верхній, середній і нижній. Верхній серцевий нерв відходить найчастіше від верхнього шийного вузла пограничного симпатичного стовбура, направляється вниз вздовж безіменної (справа) і сонної артерії (зліва), бере участь в утворенні загального екстракардіального сплетення. Як правило, одержує додаткові гілки від верхнього гортанного чи блукаючого нервів і від різних ділянок шийного пограничного стовбура. В результаті цей нерв може бути представлений або одним стовбуром, або декількома гілками, які з’єднуються каудально в один нервовий стовбур.
Середній серцевий нерв наявний не у всіх випадках. Зазвичай він відходить від середнього шийного вузла, а якщо цей шийний вузол не виражений, то безпосередньо від симпатичного стовбура на рівні VI–VII шийних хребців. Від середнього вузла відходять два стовбурці, один з яких є продовженням пограничного стовбура, інший охоплює дугу підключичної артерії, утворюючи петлю (петля В’єссана), що віддає нервові стовбурці до серця. Петля В’єссана утворюється між середнім шийним і зірчастими вузлами, але також може бути розміщена між краніальним шийним та зірчастими вузлами. Іноді зліва замість неї відзначають сильно розвинене нервове сплетення. Нижній серцевий нерв постійний, але варіює за величиною, відходить від нижнього вузла пограничного симпатичного стовбура.
У будові і розміщенні пограничних симпатичних стовбурів і блукаючих нервів правого та лівого боків спостерігається асиметрія. Для серцевих нервів ця особливість виражається в неоднаковій кількості гілок, які відходять справа і зліва від пограничних симпатичних стовбурів. В утворенні екстракардіального сплетення у 15% випадків також бере участь безіменний серцевий нерв, що починається двома корінцями. Правий є гілкою правого колатерального стовбура чи правого верхнього шийного вузла, а лівий відходить від лівого блукаючого нерва.
Парасимпатична (холінергічна) частина серцевих сплетень представлена верхніми та нижніми серцевими гілками, які виходять від блукаючого нерва і його гілок як в ділянці шиї, так і в межах середостіння. Верхні серцеві гілки відходять від шийного відділу блукаючого нерва нижче пучкоподібного вузла, а також від верхнього гортанного нерва.
По ходу блукаючого нерва і його гілок розміщені внутрішньостовбурні скупчення вегетативних нервових клітин. Нижні серцеві гілки в кількості від 4 до 10 формуються від стовбура блукаючого нерва в ділянці шиї та середостіння, а також від поворотних нервів. Крім того, виявлені правий і лівий додаткові поворотні нерви, від яких відходять серцеві гілки, що беруть участь в утворенні екстракардіального нервового сплетення. Ряд авторів описують серцеві гілки, що відходять від діафрагмальних нервів і беруть участь в утворенні екстракардіального нервового сплетення, а також відходять до серця від петлі під’язичного нерва.
Серцеві гілки з численних джерел широко з’єднуються між собою ще в ділянці шиї, і продовжуючись до основи серця, формують єдине потужне екстракардіальне сплетення, в якому виокремлюють глибоку і поверхневу частини. Глибока частина, локалізована біля поверхні біфуркації трахеї, формується з великої кількості серцевих нервів і значно потужніша, ніж поверхнева, розміщена перед дугою аорти. До складу цього сплетення входять нервові стовбури, які широко варіюють за формою, кількістю і розміщенням.
По ходу серцевих нервів розміщені екстракардіальні гангліозні вузли. Великі серцеві нервові вузли зв’язані нервовими стовбурами в ланцюги, які у вигляді двох замкнутих кілець оточують серце (рис. 1.29).
Рис. 1.29. Схема розподілу нервових гангліїв (позначені чорними крапками) в субепікардіальних нервових сплетеннях
Одне із цих кілець знаходиться під прямим кутом до основи серця і відповідає зовнішній окружності перегородки передсердь, інше розміщене під прямим кутом до першого, в AV-борозні. Від гангліозних кілець у м’язи передсердь і шлуночків відходять тонкі гілочки у вигляді петель, що містять дрібні вузли і окремо розміщені нервові клітини.
Більшість вузлів лежить біля місця впадання в серце великих вен, де серцеві нерви вступають у серце на межі передсердь і шлуночків. Вузли ніколи не проникають у глибокі шари серцевого м’яза, розміщуючись зазвичай на поверхні серця. Вздовж гілок субепікардіального нервового сплетення передсердь лежать групи вузлових нервових клітин. Поруч із ними у передсердях і основі шлуночків постійно відзначають окремі клітини, що прилягають до нервових стовбурів або розміщуються між ними.
Гістоархітектоніка інтракардіального відділу
Інтракардіальну нервову систему серця формують гілки екстракардіального нервового сплетення, що переходять на серце, які, поряд з епікардіальним сплетенням, включають підепікардіальне, міжм’язове, підендокардіальне, ендокардіальне і сплетення коронарних судин. Під епікардом містяться:
1. Праве переднє сплетення, що утворюється як із глибокого, так і з поверхневого серцевих сплетень і постачає переважно ПШ і праве передсердя.
2. Ліве переднє сплетення, що складається переважно з гілок глибокого сплетення, посилає гілки, головним чином, до верхівки, лівої передньої та бічної поверхонь ЛШ.
3. Ліве заднє сплетення забезпечує іннервацію лівого краю ЛШ, задньої поверхні лівого передсердя і ЛШ.
4. Праве заднє сплетення розміщується між правими легеневими венами, верхньою і нижньою порожнистими венами, проходить до верхівки серця. Від нього виходять гілки до задньої поверхні медіальної частини ЛШ і ПШ.
5. Сплетення на передній поверхні стінок обох передсердь, від якого відходять гілки до м’язів передсердь, передньої частини міжпередсердної і міжшлуночкової перегородок.
6. Сплетення синуса Галлера розміщене на задній стінці лівого передсердя та іннервує ділянку між чотирма легеневими венами.
Іннервація відділів серця і шарів його стінки характеризується нерівномірністю. У передсердях і під ендокардом, навколо судин, у вузлах і по ходу провідних шляхів вона більше виражена, ніж у міокарді, і практично відсутня в ендокарді. Внутрішньосерцева нервова система побудована за «кабельним» типом із шваннівських протоплазматичних тяжів, включає м’якотні та безм’якотні нервові волокна, що виходять із змішаних нервів, які вступають у серце.
Симпатичні (адренергічні) сплетення судин і міокарда анатомічно тісно пов’язані. Розміщуючись в адвентиції судин у вигляді густої сітки, вони дають часті відгалуження в медію, утворюючи в ній суцільні сіткоподібні структури. Ажурні чохли з адренергічних нервових волокон огортають всі розгалуження судинного русла. Зустрічаючись з інтрамуральними нервовими гангліями, більша частина яких зосереджена по ходу судин або нервових стовбурів, вони утворюють як кінцеві, так і транзиторні синапси. У нервових гангліях серця, поряд із парасимпатичними нейронами, наявна і деяка частина адренергічних, аксони яких вплітаються в загальну симпатичну мережу.
Будова різних елементів
Нервові пучки, що проникають із судинної стінки в міокард, розділяються на окремі аксони і формують сіткоподібний кінцевий синаптичний нервово-м’язовий апарат. За ходом таких аксонів спостерігаються невеликі варикозні потовщення, в яких зосереджені запаси нейромедіатора норадреналіна. Нервові пучки та їх моноаксоанальна термінальна сітка — єдині структури в серці, що здійснюють його синтез та збереження. Згідно з локалізацією в міокарді розрізняють паракапілярні закінчення, що лежать біля кардіоміоцитів, і «вільні» закінчення, розміщені в інтерстиції.
Парасимпатична іннервація серця здійснюється через серцеві ганглії, локалізовані переважно під епікардом в ділянці основи серця, задньої стінки передсердь, виносного тракту. На їх холінергічних нейроцитах закінчуються ефекторні волокна блукаючих нервів. Нейрити цих клітин складають пучки нервових волокон, які часто діляться, стоншуються і анастомозують, утворюючи поліаксональне сплетення. Аксони внутрішньосерцевих нейроцитів беруть участь в іннервації кровоносних судин робочого міокарда, провідної системи серця, досягаючи в останній найвищої щільності. Нервові волокна прегангліонарних нервових стовбурів, що йдуть із довгастого мозку до серця, значно менші за протяжністю, постгангліонарні відділені від навколишньої тканини тілами шваннівських клітин.
Полі- та моноаксональні структури передсердного сплетення найгустіше розподілені у міжпередсердній перегородці й досягають найбільшої щільності в ділянці AV-вузла, в якому вони безпосередньо контактують із кардіоміоцитами. Концентрація холінергічних волокон по ходу провідних шляхів вища, ніж у навколишньому міокарді, де вони розміщуються вздовж м’язових пучків.
Парасимпатична іннервація міокарда і судин здійснюється диференційовано. Нервові волокна, що оточують судини і проникають в їх медію, виходять із пучків, утворених аксонами нейронів інтрамуральних гангліїв. На ділянці до їх відокремлення вони прямують у шваннівському (провідному плазмодії) разом із симпатичними волокнами. Щільність утворюваної ними пара- та інтравазальної сітки пропорційна калібру судини. Після виходу з поліаксональних анастомозуючих тяжів парасимпатичні аксони утворюють вторинну сітку з вільних моноаксональних структур із нерівномірно розподіленою за їх довжиною активністю ацетилхолінестерази, що надає їм чіткоподібний, «варикозний» вид.
Парасимпатичний компонент еферентної іннервації серця, як і симпатичний, є у периферичному, переважно моноаксональному відділі сіткоподібним і частково незамкнутим утворенням. Він не має спеціальних закінчень, подібних до синаптичних бляшок прегангліонарних волокон, на інтрамуральних нейронах серця. Локуси підвищеної активності ацетилхолінестерази в кінцевій холіненергічній нервово-м’язовій синаптичній структурі відповідають зонам концентрування і виділення нейромедіатора — ацетилхоліну.
Аферентна (сенсорна) іннервація серця забезпечується волокнами вагусного і спинномозкового походження. Чутливі нейрорецептори виявлені у всіх оболонках серцевої стінки. Переважна зона їх розподілу — епікард і субепікардіальний шар, де кількість чутливих нервових закінчень досягає декількох сотень на 1 см2.
Нервові термінали на більшості своєї протяжності вкладені в тонку оболонку з гліальних клітин- сателітів. Вона відсутня лише в ділянці варикозних розширень аксонів, що містять скупчення синаптичних пухирців. Єдиним бар’ єром між плазмолемою аксона та інтерстицієм у таких місцях стає базальна мембрана клітин-сателітів, що не перешкоджає дифузії вмісту синаптичних везикул до міоцитів міокарда чи судинної стінки, розміщених на відстані 50–150 нм. Взаємодія відповідних ланок симпатичної та парасимпатичної іннервації серця здійснюється в місцях зближення холінергічних і адренергічних терміналей, не розмежованих відростками гліальних клітин.
Товсті мієлінові еферентні нервові волокна, що вступають в серце у складі екстракардіальних нервів, спочатку утворюють внутрішньосерцеві сплетення, які складаються з великих нерозгалужених нервових пучків, які не анастомозують із безм’якітними волокнами, що йдуть поруч. У прямуючих далі дрібніших пучках сплетення вони багаторазово розгалужуються і, залишаючи їх, закінчуються рецепторами. Провідні волокна супроводжуються шваннівськими клітинами, які у проксимальних відділах щільно прилягають до волокна, розміщуючись в один, іноді у два, ряди. У претермінальних і термінальних відгалуженнях кількість клітин істотно зменшується і вони розподіляються зі значними проміжками.
Аферентні сплетення передсердь, стінки шлуночків, клапанів і судин серця морфологічно принципово подібні. Їх термінальні відділи становлять безм’якітні відгалуження м’якітних аферентних волокон, поодинокі чи у вигляді скупчень — рецепторних полів. У міокарді аферентні нервові термінали розподілені в основному в сполучнотканинних прошарках, що оточують м’язові пучки і великі судини, на кардіоміцитах і серед елементів провідної системи серця.
Відмінна риса чутливих терміналів — велика кількість мітохондрій, наявність осміофільних ламелярних тілець та поліморфних везикул, хоча в цілому на ультраструктурному рівні елементи чутливої іннервації серця досліджені ще недостатньо.
Кардіальні вегетативні ганглії — спеціалізовані структури, що забезпечують передачу імпульсу до кардіоміоцитів. Кількість нейроцитів, що утворюють ганлії, варіює від одиничних до декількох сотень клітин. Ганглії найчастіше мають неправильну округлу форму й органоїдну будову. Кожен із них оточений тонкою сполучнотканинною капсулою, має строму, утворену відростками та тілами гліальних, шваннівських клітин та деякою кількістю сполучнотканинних елементів, а також свою регіональну «систему» кровопостачання і лімфовідтоку.
Нейрони кардіальних гангліїв відрізняє велике відрощате тіло. Дендрити значно збільшують сприймаючу поверхню клітини і розширюють її комунікаційні можливості, аксон забезпечує передачу імпульсу на інші нейрони чи еферентні клітини. В одних випадках відростки більш-менш рівномірно розподілені по всій поверхні нейроцита, в інших групуються біля одного з полюсів, надаючи клітинам зірчасту, овоїдну чи грушоподібну форму. Переважають мультиполярні клітини, проте у дрібних гангліях відзначають бі- та уніполярні нейрони.
Основні функції цих клітин — сприйняття, трансформація і передача нервових імпульсів — здійснюються за участю кінцевих і транзиторних синаптичних контактів на їх тілах і відростках. При цьому кількість холінергічних терміналів значно переважає над симпатичними, які виявляються лише у великих гангліях. У пресинаптичній частині аксона, що має вигляд варикозного розширення, утримуються дрібні мітохондрії, синаптичні везикули, гранули глікогену, великі гранулярні пухирці. Часто подібні закінчення одночасно контактують із декількома дендритами нейроцитів.
Високоспеціалізовані синаптичні контакти встановлюються не лише між нейроцитами, але між ними і малими гранулярними клітинами. Крім того, в серцевих гангліях існують також дендродендричні й дендросоматичні контакти несимпатичного походження.
Нервові клітини мають більші округлі ядра із двошаровою каріолемою, дифузно розподіленим малогранульованим хроматином і 1–2 досить великими ядерцями. Цитоспецифічна структура нервових клітин становить компактно розміщені ділянки гранулярного ендоплазматичного ретикулума у вигляді тілець Ніссля, що в поєднанні з наявністю добре розвиненого пластинчастого комплексу, численних гранул рибонуклеопротеїнів, які лежать вільно чи об’єднані у полісоми, свідчить про інтенсивність внутрішньоклітинних пластичних процесів.
Непрямою ознакою секреторної активності нервових клітин є наявність у них значної кількості гладких і облямованих мікровезикул, розміщених поруч із цистернами апарата Гольджі. Також в зоні перикаріона часто виявляють великі гранулярні пухирці, мультивезикулярні тільця, лізосоми. Мітохондрії численні, різноманітні за розмірами і формою, з рідкими короткими кристами, зануреними у слабкоосміофільний матрикс. Органели визначаються як у тілі, так і у відростках нейронів, де вони набувають подовженої форми і поздовжньої орієнтації крист. Плазмолема нервових клітин утворена типовою тришаровою цитомембраною з субплазмолемальними осміофільними зонами у проміжках між клітинами-сателітами, що їх оточують.
Гліальні клітини-сателіти значно дрібніші від нейронів, навколо яких вони розміщені. Їх багаті хроматином ядра мають неправильну форму, в цитоплазмі, крім стереотипного набору органел, міститься велика кількість філаментозних структур. Міжклітинні контакти часто укріплені десмосомами. Проміжки у шарі клітин-сателітів підвищують доступність нейронів для медіаторів, які виділяються вариксами холінергічних чи адренергічних нервових волокон і циркулюють у міжклітинних просторах гангліїв.
У просторах між компактно розміщеними нервовими клітинами перебувають їх дендрити і аксони, відростки нейронів з інших ділянок нервової системи і відростки шваннівських клітин і клітин-сателітів, утворюючи у сукупності так звану нейропіль гангліїв. Інтрагангліонарні нервові пучки, що іноді нараховують десятки аксонів, найчастіше не мають мієлінової оболонки, розмежовуються гліальними клітинами і тонкими прошарками сполучної тканини.
Важливою популяцією регуляторних клітин міокарда є малі гранулярні клітини (МГ-, МІФ- або SiF-), що значно поступаються за розмірами перед нейроцитами гангліїв. Кластери МГ-клітин, що інтенсивно флуоресціюють при гістохімічному тесті на катехоламіни, супроводжують ганглії всіх розмірів, розміщуються, як правило, в безпосередній близькості від обмінних мікросудин, але іноді поза останніми. В їх цитоплазмі виявляють численні везикули діаметром 100–200 нм з ізоосміофільною серцевиною, електронна щільність якої варіює залежно від концентрації катехоламінів, які синтезуються, депонуються і виділяються МГ-клітиною.
Поверхні суміжних МГ-клітин досить часто стикаються, утворюючи десмосомоподібні контакти. Вони перебувають в аферентних симпатичних зв’язках із холінергічними нервовими терміналями, а також формують еферентні синапси і впливають на постсинаптичну плазмолему нервової терміналі катехоламінами, які вивільняються з великих гранулярних пухирців. Як і нейрони, МГ-клітини і відростки їх плазмолеми досить щільно оточені гліальними елементами. В основному це тіла клітин-сателітів; у проміжках між ними перебуває лише базальна мембрана глії, що полегшує секреторну функцію МГ-клітин, дифузію медіатора, що виділяється ними і надходить у внутрішньоклітинне середовище і розміщені поруч капіляри з фенестрованим ендотелієм.
Серцеві ганглії рясно васкуляризовані. Густі термінальні розгалуження артеріол або посткапілярів утворюють навколо вузлів перигангліонарний футляр із численними різноспрямовано орієнтованими відгалуженнями, що відходять вглиб вузла і проходять повз нервові клітини чи утворюють навколо них петлі. Характерним компонентом гістогематичного бар’єра в кардіальних гангліях є клітини-сателіти, які оточують цитоспецифічні клітини ганглія, але іноді відсутні на невеликих ділянках мікросудини, що їх живить.
Провідна система серця
Міокард передсердь і шлуночків, розділений фіброзними кільцями, синхронізується у своїй роботі провідною системою серця, єдиною для всіх його відділів (рис. 1.30).
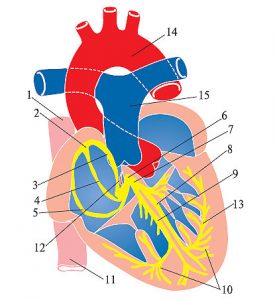
Рис. 1.30. Схематичне зображення провідної системи серця: 1 — верхня порожниста вена; 2 — синусно-передсердний вузол; 3 — передній міжвузловий і міжпередсердний тракт Бахмана; 4 — середній міжвузловий тракт Венкебаха; 5 — задній міжвузловий тракт Горіла; 6 — передсердно-шлуночковий вузол; 7 — передсердно-шлуночковий пучок; 8 — ліва ніжка передсердно-шлуночкового пучка; 9 — права ніжка пучка Гіса; 10 — субендокардіальна сітка волокон Пуркіньє; 11 — нижня порожниста вена; 12 — коронарний синус; 13 — передня гілка лівої ніжки пучка Гіса; 14 — аорта; 15 — задній легеневий стовбур
Структури, які генерують і передають імпульси до передсердних та вентрикулярних кардіоміоцитів, що регулюють та координують скоротну функцію серця, спеціалізовані й складні. Провідна система серця за своєю гістоструктурою і цитологічними характеристиками істотно відрізняється від інших відділів серця. Анатомічно провідна система включає синусно-передсердний і передсердно-шлуночковий вузли, міжвузлові та міжпередсердні провідні шляхи, передсердно-шлуночковий пучок (пучок Гіса) спеціалізованих м’язових клітин, що віддають ліву і праву ніжки, субендокардіальну сітку волокон Пуркіньє.
Синусно-передсердний вузол
Синусно-передсердний вузол розміщується з латерального боку над основою правого вушка в місці впадання верхньої порожнистої вени у праве передсердя, від ендокарда якого його відокремлює тонкий прошарок сполучної та м’язової тканини. Має форму сплощеного еліпса чи півмісяця, горизонтально розміщеного під епікардом правого передсердя. Довжина вузла 10–15 мм, висота — до 5мм, товщина — близько 1,5 мм. Візуально вузол мало відрізняється від міокарда, що його оточує, незважаючи на капсулоподібне скупчення сполучної тканини по периферії.
Тканина синусно-передсердного вузла майже на 30% складається з пучків колагенових фібрил, що переплітаються в різних напрямках, різної товщини з невеликою кількістю еластичних волокон та клітин сполучної тканини. Тонкі м’язові волокна із спеціалізованих клітин діаметром 3–4,5 мк розміщені безладно з нерівномірними проміжками, що заповнені інтерстицієм, мікросудинами, нервовими елементами, орієнтовані за окружністю судини лише поблизу центральної артерії, що живить вузол. По периферії вузол оточений значною кількістю фіброеластичної тканини з великою сіткою капілярів, тут же розміщені нервові ганглії, поодинокі гангліозні клітини і нервові волокна, що у великій кількості проникають у тканину вузла.
Синусно-передсердний вузол дає початок великій кількості шляхів, які проводять імпульси, що генеруються спеціалізованими клітинами. Від нього відходять латеральні пучки до правого вушка, нерідко — горизонтальний пучок до лівого вушка, задній горизонтальний пучок до лівого передсердя і устів легеневих вен, пучки до верхньої та нижньої порожнистої вени, медіальні пучки до міжвенозного м’язового пучка міокарда. Ці м’язові пучки провідної системи — факультативні анатомічні утворення, відсутність того чи іншого з них не має помітного впливу на роботу серцевого м’яза.
Міжвузлові шляхи проведення імпульсів
Найбільш функціонально значимі низхідні шляхи. Передній міжвузловий тракт, пучок Бахмана, бере початок від переднього краю синусно-передсердного вузла, проходить попереду і вліво від верхньої порожнистої вени в напрямку до лівого передсердя, прямуючи до рівня лівого вушка. Від пучка Бахмана відгалужується передній міжвузловий пучок, що далі самостійно продовжується в міжпередсердній перегородці до передсердно-шлуночкового вузла. Середній міжвузловий тракт, пучок Венкебаха, відходить від верхнього і заднього країв синусно-передсердного вузла. Проходить єдиним пучком позаду верхньої порожнистої вени, розділяючись потім на дві нерівні частини, менша з яких прямує до лівого передсердя, а основна продовжується по міжпередсердній перегородці до передсердно-шлуночкового вузла.
Задній міжвузловий тракт, пучок Тореля, виходить із заднього краю синусно-передсердного вузла. Він розглядається як основний шлях міжвузлового проведення імпульсів, його волокна спрямовані по прикордонному гребінці, утворюють основну частку волокон євстахієвого гребеня, випливаючи далі до передсердно-шлуночкового вузла по міжпередсердній перегородці. Частина волокон перегородкової частини всіх трьох трактів переплітається в безпосередній близькості від передсердно-шлуночкового вузла, проникаючи в нього на різних рівнях. Окремі волокна міжпередсердних та міжвузлових трактів за структурою подібні до волокон Пуркіньє шлуночків, інші складаються зі звичайних передсердних кардіоміоцитів.
Передсердно-шлуночковий вузол
Передсердно-шлуночковий вузол зазвичай локалізований під ендокардом правого передсердя на правому фіброзному трикутнику в нижній частині міжпередсердної перегородки, над кріпленням септальної стулки правого AV-клапана і дещо попереду від устя коронарного синуса. Найчастіше овоїдної, веретеноподібної, дископодібної чи трикутної форми, його розміри варіюють у межах від 6х4х0,5 до 11х6х1 мм.
У структурі передсердно-шлуночкового вузла, як і в робочому міокарді, м’язовий компонент переважає над сполучною тканиною. На відміну від синусно-передсердного вузла, він є м’язовим утворенням із менш розвиненим сполучнотканинним скелетом. Тканина вузла ніби розмежована на дві частини артерією, що кровопостачає його, та пластинкою сполучної тканини, що з’єднує стінку цієї судини і фіброзне кільце. Від тканини правого передсердя вузол відокремлює прошарок жирової клітковини. Між передсердно-шлуночковим вузлом і устям коронарного синуса компактно розміщені численні парасимпатичні ганглії. У м’язових волокон товщиною до 5 мкм поздовжній, косий і поперечний напрямок. Тісно переплітаючись, вони утворюють лабіринти, що впливають на електрофізіологічні властивості тканини.
Пучок Гіса
Від передсердно-шлуночкового вузла відходять верхній, задній і передсердно-шлуночковий пучки Гіса, причому тільки останній виявляють у 100% спостережень. Границею між пучком Гіса, що відходить від передньої частини передсердно-шлуночкового вузла, є його звужена ділянка, що перфорує правий фіброзний трикутник у місці з’єднання з верхньою перетинчастою частиною міжшлуночкової перегородки. Довжина пучка коливається у межах 8–20 мм при ширині 2–3 мм, товщині 1,5–2 мм і корелює з формою серця.
За довжиною пучок Гіса складається з двох частин: короткої інтрафіброзної, що проходить крізь тканину правого фіброзного трикутника, і більш протяжної перегородкової, яка залягає в міжшлуночковій перегородці у вигляді сірувато-блідого тяжа, що з віком набуває жовтуватого відтінку у зв’язку з накопиченням жирової тканини. На поперечних розрізах м’язові волокна, що його складають, поділені сполучнотканними прошарками на групи, консолідовані у вигляді неправильного трикутника чи фігури овоїдної форми. Передсердно-шлуночковий пучок Гіса по периметру оточений щільною фіброзною тканиною, розмір його клітин зростає в міру віддалення від вузла.
Під перетинчастою частиною, на рівні правого синуса аорти, пучок Гіса роздвоюється на дві ніжки, ніби «сідлаючи» гребінь м’язової ділянки міжшлуночкової перегородки. Більш потужня права ніжка, що зберігає вид пучка, проходить по правошлуночковій стороні міжшлуночкової перегородки, віддаючи гілки всім стінкам ПШ. У більшості випадків її вдається простежити до основи переднього сосочкового м’яза, і лише в окремих спостереженнях вона губиться вже на рівні середини міжшлуночкової перегородки.
Топографічно права ніжка пучка Гіса ділиться на верхню, що становить третину довжини до основи перегородкових сосочкових м’язів, середню — до перегородково-крайової трабекули, і нижню, розміщену в ній і в основі переднього сосочкового м’яза. Верхня частина цієї ніжки проходить субендокардіально, наступна — інтрамурально, а нижня знову повертається під ендокард. Нижня ділянка ніжки дає початок дистальним гілкам: переднім, що йдуть до передньої стінки шлуночка, заднім — до трабекул задньої стінки шлуночка, і латеральним, які прямують до правого краю серця.
Ліва ніжка передсердно-шлуночкового пучка з̓являється під ендокардом лівого боку міжшлуночкової перегородки з-під задньонижнього краю перетинчастої частини перегородки між шлуночками на рівні синусів аорти. У лівій ніжці розрізняють стовбурну і розгалужену частини. Стовбурна розділяється на передню гілку, що йде до передньої стінки ЛШ і розміщеного на ній сосочкового м’яза, задня — до його задньої стінки і сосочкового м’яза. При поділі ніжки на більшу кількість гілок додаткові відгалуження прямують до верхівки серця.
На периферії вторинні гілки лівої ніжки розсипаються на більш дрібні пучки, які входять у трабекули і утворюють сіткоподібні зв’язки між собою. Пучкова будова менш компактної лівої ніжки і обох її гілок, що направляються до переднього і заднього сосочкових м’язів, як і її межа із тканиною робочого міокарда, виражені значно слабше, ніж правої. Сполучнотканинний і судинний компонент у них виражений гірше, ніж в інших ділянках провідної системи. Клітини провідної системи утворюють під ендокардом розгалужену мережу, елементи якої розмежовуються сполучнотканинними прошарками, що включають судинні й нервові структури.
Структура клітинних елементів
Будова клітин провідної системи серця визначається їх функціональною спеціалізацією. В її неоднорідному клітинному складі за морфофункціональними ознаками виокремлюють три типи спеціалізованих кардіоміоцитів. Клітини I типу — П-клітини, типові нодальні або провідні пейсмейкерні — неправильної подовженої форми. Ці невеликі міоцити діаметром 5–10 нм, із світлою саркоплазмою і досить великим центрально розміщеним ядром віддають численні цитоплазматичні відростки, що звужуються до кінців і щільно переплітаються між собою. П-клітини утворюють невеликі групи — кластери, розмежовані елементами пухкої сполучної тканини. Кластери П-клітин оточені загальною базальною мембраною товщиною 100 нм, що глибоко проникає у міжклітинні щілини. Їх сарколема утворює численні кавеоли, а замість Т-системи — глибокі тунельні інвагінації, що визначаються не регулярно, діаметром 1–2 мкм, в які проникає інтерстицій та іноді — нервові елементи.
Контрактильний апарат П-клітин складається з рідких, хаотично перехрещених міофібрил або довільно орієнтованих вільно розміщених тонких і товстих протофібрил та їх пучків, нерідко в комплексі з полірибосомами. Тонкі міофібрили складаються з нещільно упакованих філаментів з невеликою кількістю саркомерів, диски яких виражені нечітко, Z-лінії неоднакової товщини, іноді переривчасті, а електронно-оптично щільна речовина часто виходить за межі міофібрил. Обсяг, який займають міофібрили в П-клітинах, становить не більше 25% такого у вентрикулярних кардіоміоцитах. Рідкі мітохондрії неоднакового розміру і форми із внутрішньою структурою, значно спрощеною порівняно з клітинами робочого міокарда, безладно розкидані у світлій саркоплазмі, яка оточує відносно велике ядро, розміщене в центральній зоні. Гранули глікогену нечисленні.
Незначно розвинений саркоплазматичний ретикулум розподілений переважно по периферії клітини, причому його термінальні цистерни іноді формують типові функціональні контакти з плазмолемою. У цитоплазмі містяться вільні гранули рибонуклеопротеїдів, елементи гранулярного ретикулума, комплексу Гольджі, лізосоми. Стабільність форми цих досить збіднених органелами клітин підтримують численні хаотично розміщені елементи цитоскелета — так звані проміжні філаменти діаметром близько 10 нм, що часто закінчуються у щільній речовині десмосом.
Клітини II типу — перехідні чи латентні пейсмейкери — неправильної подовженої відрощатої форми. Вони коротші, але товстіші робочих кардіоміцитів передсердь, часто містять два ядра. Сарколема перехідних клітин часто утворює глибокі інвагінації діаметром 0,12–0,16 мкм, покриті глікокаліксом, як і в Т-тубулах. Ці клітини багаті органелами і мають менше недиференційованої саркоплазми, ніж П-клітини, їх міофібрили орієнтовані вздовж довгої осі, товстіші і складаються з більшої кількості саркомерів, у яких маловиражені Н- і М-смужки. Мітохондрії, розміщені між міофібрилами, за своєю внутрішньою організацією наближаються до органел клітин робочого міокарда, кількість глікогену непостійна.
Клітини III типу подібні до клітин Пуркіньє — провідні міоцити, на поперечних зрізах на вигляд більш об’ємні, ніж інші кардіоміоцити. Їх довжина становить 20–40 мкм, діаметр — 20–50 мкм, утворені ними волокна мають більший поперечний переріз, ніж у робочому міокарді, але неоднакову товщину.
Клітини Пуркіньє відрізняє велика вільна від міофібрил перинуклеарна зона, заповнена світлою вакуолізованою саркоплазмою, велике округле ядро, або ядро, що нагадує прямокутник, з помірною концентрацією хроматину. Їх контрактильний апарат розвинений менше, а система пластичного забезпечення — краще, ніж у вентрикулярних кардіоміоцитах. Сарколема утворює численні кавеоли, подинокі, нерегулярно розміщені Т-тубули і глибокі, сягаючі аксіальної зони, клітини-тунелі діаметром до 1 мкм, покриті базальною мембраною.
Міофібрили, розміщені в субсарколемній зоні, іноді розгалужуються і анастомозують. Незважаючи на нечітку орієнтацію вздовж осі клітини, вони, як правило, закріплені в обох вставних дисках. Упакування міофіламентів у міофібрилах досить пухке, гексагональне розміщення товстих і тонких протофібрил не завжди витримується, в саркомерах маловиражені Н- смужки і мезофрагма, відзначається поліморфізм у структурі Z-ліній.
У саркоплазмі простежуються вільно завислі, розрізнені й зібрані в комплекси товсті й тонкі філаменти цитоскелета, пов’язані з полісомами, мікротрубочки, лептофібрили з періодом 140–170 нм, рибосоми і гранули глікогену, що нерідко заповнюють всю вільну саркоплазму. Нечисленні елементи саркоплазматичного ретикулума розміщуються навколо міофібрил і під сарколемою, іноді утворюють субсарколемні цистерни. Мітохондрії помітно менші, ніж у робочих кардіоміоцитах, розміщені як вздовж міофібрил, так і перинуклеарно у вигляді невеликих скупчень. Тут же визначаються профілі гранулярного ретикулума, пластинчастого комплексу, лізосоми, облямовані везикули.
Загалом П-клітини провідної системи, що генерують імпульси, відрізняються найбільш низьким рівнем морфологічного диференціювання, що поступово підвищується в міру наближення до робочих кардіоміоцитів шлуночків, досягаючи тут максимального значення. Об’єднання різних типів клітини в єдину систему генерації та проведення імпульсу визначається необхідністю синхронізації цього процесу у всіх відділах серця.
Міоцити провідної системи серця мають не лише цитоморфологічні, але й імуно- та гістохімічні відмінності від клітин робочого міокарда. Всі міоцити провідної системи, за винятком П-клітин передсердно-синусного вузла, містять більше глікогену, наявного в них не лише у формі, що легко метаболізується, але й у вигляді більш стійкого комплексу з білками — десмоглікогену, що виконує пластичні функції. Активність гліколітичних ферментів і глікогенсинтетази у провідних кардіоміоцитах відносно вища, ніж ензимів циклу Кребса і дихального ланцюга, тоді як у робочих кардіоміоцитах це співвідношення має зворотний характер відповідно до вмісту мітохондрій. Внаслідок цього міоцити передсердно-шлуночкового вузла, пучка Гіса та інших відділів провідної системи більш стійкі до гіпоксії, ніж інший міокард, незважаючи на більш високу активність АТФази. У тканині провідної системи відзначається інтенсивна реакція на холінестеразу, відсутня в міокарді шлуночків, і значно вища активність лізосомальних гідролаз.
Розподіл міоцитів різних типів, характер і будова контактів клітин у різних відділах провідної системи визначається їх функціональною спеціалізацією. У серединній зоні синусно-передсердного вузла розміщені П-клітини, що найраніше активуються — пейсмейкери, що генерують імпульс. Його периферію займають перехідні клітини II типу, П-клітини контактують лише з ними. Перехідні клітини опосредковують проходження імпульсу до міоцитів передсердь, сповільнюючи його поширення. Контакти П-клітин малочисленні, мають спрощену будову і досить довільну локалізацію. Контакти в більшості випадків є простим зближенням плазмолеми суміжних клітин, що фіксуються поодинокими десмосомами. Цитологічний склад передсердно-шлуночкового вузла більш різноманітний. У ньому наявні клітини, за структурою дуже близькі до пейсмейкерних, краніодорсальну частину займають міоцити II типу, а дистальні відділи складаються з Пуркіньє-подібних провідних міоцитів III типу, що швидко проводять імпульс.
Деякі дослідники виокремлюють у складі вузла три зони, що відрізняються за морфологічними та електрофізіологічними характеристиками: АN, перехідну від передсердного міокарда до вузлової тканини, що складається в основному з перехідних клітин, і NН-зону, пограничну з пучком Гіса, що переважно формується поліморфними перехідними Пуркіньє-подібними клітинами.
Контакти перехідних міоцитів із типовими нодальними П-клітинами мають простішу будову, ніж їх з’єднання між собою, з передсердними робочими міоцитами або клітинами III типу. Міжклітинні стики утворюють лише невеликі й бідні на осміофільний матеріал проміжні зони, а десмосоми й мініатюрні нексуси відзначають досить рідко.
Міжклітинні контакти міоцитів III типу між собою і з навколишніми скорочувальними кардіоміоцитами організовані складніше і за своєю структурою ближче до характерних для робочого міокарда. Внаслідок більш впорядкованого розміщення міофібрил вони орієнтовані поперек довгої осі клітин і помітно рідше утворюються бічними поверхнями їх апікальних зон. Поперечно розміщені вставні диски відрізняє більша довжина добре виражених проміжних зон. Наявність протяжних нексусів при бічних контактах значно підвищує провідність цих м’язових волокон і полегшує передачу імпульсів на робочий міокард. Вставні диски між клітинами Пуркіньє іноді мають косе розташування або V-подібну форму. Подібна орієнтація і слабка звивистість проміжних зон відповідають більш примітивній будові їх вставних дисків порівняно з робочими клітинами.
Кровопостачання
Транспортно-трофічне забезпечення передсердних відділів провідної системи серця здійснюється значною мірою диференційовано від навколишнього міокарда. Синусно-передсердний вузол живлять одна чи дві судини, стінки яких мають будову типових інтрамуральних транспортних артерій III–IV порядку. Характерною ознакою вузла є непропорційно велика артерія, що забезпечує живлення, яка проходить по довгій осі через його середину. Вона є однією з перших гілок правої коронарної артерії або, рідше, відходить від проксимального сегмента огинаючої гілки ЛКА. Її подальші розгалуження на короткі проміжні ланки включають термінальні артерії, артеріоли, прекапіляри, що дають початок густій сітці капілярів того ж типу, що і в міокарді, частка яких у тканині вузла більша у 2 рази, ніж в оточуючій його тканині правого передсердя. Їх стінка утворена 1–3 ендотеліоцитами, що лежать на базальній мембрані, в якій досить часто визначають перицити. Посткапіляри анастомозують перед злиттям у конусоподібні венули, що утворюють досить густу венозну сітку. Кровоносне русло синусно-передсердного вузла завершується двома групами дрібних інтраміокардіальних вен.
Кровопостачання передсердно-шлуночкового вузла найчастіше здійснюється гілкою ПКА, що відходить безпосередньо від неї чи від проксимального сегмента задньої міжшлуночкової артерії. Іноді вузол одержує кров із огинаючої гілки лівої коронарної артерії. Власна дрібна інтрамуральна артерія м’язового типу, що живить передсердно-шлуночковий вузол, послідовно розпадається на артеріоли діаметром 20–25 мкм. Прекапіляри, які віддають артеріоли, розміщуються під різними кутами щодо м’язових волокон, їх діаметр не перевищує 18 мкм. Капіляри діаметром близько 6 мкм формують густу тривимірну сітку з подовженими поліморфними осередками, петлі якої охоплюють по 1–2 м’язових волокна.
У деяких капілярах AV-вузла виявляють фенестри — невеликі локальні діафрагмоподібні стоншення периферичної зони ендотеліоцита, аж до злиття плазмолеми люмінальної та базальної поверхні клітини. Капілярна сітка завершується короткими широкими посткапілярами діаметром 20–22 мкм, що зливаються в поодинокі венули шириною 45 мкм, які розміщуються у сполучнотканинних прошарках між групами м’язових волокон, приймаючи численні притоки. Інші відділи провідної системи одержують живлення разом із оточуючою їх тканиною.
Іннервація
Провідна система серця іннервується більш інтенсивно порівняно з іншими ділянками міокарда. Найпотужніша іннервація характерна для її початкових відділів. Синусно-передсердний і передсердно-шлуночковий вузли кровопостачаються та іннервуються також більш інтенсивно, ніж інший міокард. У потужному нервовому сплетенні AV-пучка виділяють зовнішнє і глибоке нервові сплетення. Безм’якотні нервові волокна глибокого сплетення утворюють закінчення на м’язових волокнах AV-пучка. Терміналі, що мають вигляд маленьких кілець, вважаються моторними закінченнями.
Провідна система серця має власний гангліозний апарат, в ділянці AV-вузла розміщена значна кількість великих і дрібних нервових вузлів. Нервові клітини цих вузлів за морфологічними характеристиками можуть бути віднесені до системи блукаючого нерва. Аксони цих клітин закінчуються на м’язових волокнах пучка. В інтерцелюлярних сплетеннях вузлів провідної системи розгалуження одного м’якотного нервового нейрона контактують із декількома нервовими клітинами. М’якотне волокно у вузлах розпадається на тонкі нитки інтерцелюлярного сплетення, які закінчуються на тілі декількох нервових клітин.
ЛІТЕРАТУРА
- Анатомія людини (2006) Підруч. для студ. вищ. мед. навч. закл. IV рівня акредитації: У 3 т. Т. 1. За ред. А.С. Головацького, В.Г. Черкасова. Нова книга, Вінниця, 365 с.
- Атлас микроскопического и ультрамикроскопического строения клеток, тканей и органов (2004) Учеб. пособие для студентов мед. вузов. В.Г. Елисеев, Ю.И. Афанасьев, Е.Ф. Котовский, А.Н. Яцковский. Медицина, Москва, 447 с.
- Атлас сканирующей электронной микроскопии клеток, тканей, органов (1987) Под ред. О.В. Волковой, В. А. Шахламова, А.А. Миронова. Медицина, Москва, 464 с.
- Быков В.Л. (2000) Цитология и общая гистология. Сотис, Санкт-Петербург, 519 с.
- Большакова Г.Б. (1991) Межтканевые взаимоотношения в развитии сердца. Наука, Москва, 88 с.
- Воробьев В.П. (2003) Большой атлас анатомии человека. Харвест, Минск, 1312 с.
- Гайворонский И.В. (2004) Нормальная анатомия человека. Учеб. для мед. вузов. 4-е изд. СпецЛит, Санкт-Петербург, Т. 1. 560 с.
- Гайворонский И.В. (2004) Нормальная анатомия человека: Учеб. для мед. вузов. 4-е изд. СпецЛит, Санкт-Петербург, Т. 2. 424 с.
- Гартнер Л.П. (2008) Цветной атлас гистологии. Л.П. Гартнер, Дж. Л. Хайатт; Под ред. В.П. Сапрыкина. Логосфера, Москва, 463 с.
- Караганов Я.Л., Кердиваренко Н.В., Левин В.Н. (1982) Микроагиология. Под ред. В.В. Куприянова. Штиинца, Кишинев, 248 с.
- Кузнецов С.Л. (2002) Атлас по гистологии, цитологии и эмбриологии. Учеб. пособие для студентов мед. вузов, мед. фак. ун-тов. С.Л. Кузнецов, Н.Н. Мушкамбаров, В.Л. Горячкина. Медицинское информационное агентство, Москва, 373 с.
- Кузнецов С.Л. (2005) Гистология, цитология и эмбриология. Учеб. для мед. вузов. С.Л. Кузнецов, Н.Н. Мушкамбаров. МИА, Москва, 600 с.
- Кульчицкий К.И., Роменский О.Ю. (1985) Сравнительная анатомия и эволюция кровеносных сосудов. Здоров’я, Киев, 176 с.
- Куприянов В.В., Бородин Ю.И., Караганов Я.Л., Выренков Ю.Е. (1983) Микролимфология. Медицина, Москва, 288 с.
- Луцик О.Д., Іванова А.Й., Кабак К.С., Чайковський Ю.Б. (2003) Гістологія людини. Підруч. для студ. вищ. мед. навч. закл. III–IV рівнів акредитації. Книга плюс, Киев, 592 с
- Микроморфология человека (2007) Учеб. пособие для студентов мед. вузов. Под ред. С.Ю. Масловского, Е.В. Мирошниченко. 3-е изд., испр. и доп. Ткани, Харьков, 126 с.
- Михайлов С.С. (1987) Клиническая анатомия сердца. Медицина, Москва, 228 с.
- Привес М.Г. (2005) Анатомия человека. Учеб. для рос. и иностр. студентов мед. вузов и факультетов. М.Г. Привес, Н.К. Лысенков, В.И. Бушкович. 12-е изд., перераб. и доп. Изд. дом СПбМАПО, Санкт-Петербург, 720 с.
- Румянцев П.П. (1982) Кардиомиоциты в процессах репродукции, дифференцировок и регенерации. Ленинград, 288 с.
- Самойлова C.Д. (1970) Анатомия кровеносных сосудов сердца. Под ред. А.П. Надеина. Медицина, Ленинград, 217 с.
- Синев А.Ф., Крымский Л.Д. (1985) Хирургическая анатомия проводящей системы сердца. Медицина, Москва, 272 с.
- Синельников Р.Д. (1958) Атлас анатомии человека. Т 2. Медгиз, Москва, 627 с.
- Сосудистый эндотелий (1986) Под ред. В.В. Куприянова, И.И. Бобрика, Я.Л. Караганова. Здоров’я, Киев, 248 с.
- Хэм А., Кормак Д. Гистология (1982) Пер с англ. Т. 2. Мир, Москва, 254 с.
- Чайковский Ю.Б. (2006) Гістологія, цитологія та ембріологія. Атлас для самостійної роботи студентів. Луцьк.
- Чернух А.М., Александров П.Н., Алексеев О.В. (1984) Микроциркуляция. Медицина, Москва, 432 с.
- Шаров В.Г., Иргашев Ш.Б. (1988) Ультраструктура сердца. Медицина, Ташкент, 242 с.
- Шахламов В.А., Цамерян А.П. (1982) Очерки по ультрастуктурной организации сосудов лимфатической системы. Наука, Новосибирск, 120 с.
- Grant J.C.B. (1956) An atlas of anatomy. J.C.B. Grant. 4-th ed. Williams and Wilkins, Baltimore, I–X, 800 p.