Уровень нейтрализующих антител хорошо коррелирует со степенью защиты от COVID-19. Авторы исследования выявили «удивительно сильную нелинейную связь между средним уровнем нейтрализации и зарегистрированной защитой для разных вакцин». Для этого анализа были использованы данные об иммуногенности и предварительные результаты исследований ІІІ фазы 7 вакцин (мРНК-1273 от «Moderna», NVX-CoV2373 от «Novavax», BNT162b2 от «Pfizer»/«BioNTech», rAd26-S + rAd5-S (Sputnik-V), ChAdOx1 nCoV-19 от «Astrazeneca», Ad26.COV2.S от «Johnson & Johnson» и CoronaVac от «Sinovac»).
Основные результаты
По расчетам авторов, уровень нейтрализующих антител, обеспечивающий 50% защиту от инфекции SARS-CoV-2 составляет 20,2% от среднего уровня реконвалесцентов (95% доверительный интервал (ДИ) 14,4–28,4%). Расчетный уровень нейтрализации, необходимый для 50% защиты от тяжелой инфекции, был значительно ниже (3% от среднего уровня реконвалесцентов; 95% ДИ 0,7–13%, р = 0,0004). Моделирование спада титра нейтрализации в течение первых 250 дней после иммунизации позволяет предположить выраженное уменьшение защищенности от инфекции SARS-CoV-2, хотя защита от тяжелого заболевания в значительной степени сохранится. Разработанная модель также описывает взаимосвязь между нейтрализацией и эффективностью защиты против вирусных вариантов.
Предпосылки
У выздоровевших серопозитивных субъектов отмечали 89% защиту от повторного заражения [2], а эффективность вакцины составляла от 50 до 95% [3]. Однако продолжительность защитного иммунитета в настоящее время неясна, первичные иммунные ответы неизбежно ослабевают [4, 5, 6], и продолжается распространение вызывающих все большее беспокойство вирусных вариантов, которые могут ускользать от иммунного контроля [7].
Например, при инфекции гриппа титр ингибирования гемагглютинации 1:40, как полагают, обеспечивает 50% защиту от инфекции гриппа [8], хотя оценки варьируют от 1:17 до 1: 110 [9, 10]. Этот анализ используется для прогнозирования эффективности вакцины и при ежегодном пересмотре вакцин против сезонного гриппа.
Хотя противовирусная Т- и В-клеточная память, безусловно, вносит определенный вклад, существуют убедительные доказательства защитной роли нейтрализующих сывороточных антител. Например, пассивный перенос нейтрализующих антител может предотвратить тяжелую инфекцию SARS-CoV-2, в том числе у людей, по сообщению «Regeneron» [11]. К сожалению, в исследованиях І–ІІ фаз использованы разные методы определения титров нейтрализации вируса in vitro.
Полученные результаты
Для обеспечения большей сопоставимости результатов различных анализов титры нейтрализации после вакцинации были нормализованы к среднему титру реконвалесцентов в том же исследовании. Затем эти нормализованные уровни нейтрализации сопоставили с соответствующей защитной эффективностью, о которой сообщалось в 7 клинических исследованиях ІІІ фазы [12–22]. Несмотря на известные несоответствия между исследованиями, сравнение нормализованных уровней нейтрализации и эффективности вакцин демонстрирует удивительно сильную нелинейную связь (коэффициент Спирмена r = 0,905; р = 0,0046) (рис. 1).
Оценка уровня защитной нейтрализации COVID-19
Для дальнейшего анализа взаимосвязи между иммуногенностью и защитой при SARS-CoV-2 авторы рассмотрели параллели с использованными ранее подходами к оценке «50% защитного титра» при инфекции гриппа [8–10]. Согласно результатам моделирования расчетный 50% защитный уровень нейтрализации составляет 20,2% (95% ДИ 14,4–28,4%) от среднего уровня у реконвалесцентов. Уровень нейтрализации для 50% защиты от тяжелой инфекции составлял 3,0% от среднего уровня реконвалесцентов (95% ДИ 0,71–13%), что было значительно ниже уровня 20%, необходимого для защиты от любой симптоматической инфекции (р = 0,00039). Однако возможно, что ответы Т- или В-клеток памяти также могут быть важны для защиты от тяжелого заболевания.
Таким образом, предполагаемый уровень нейтрализации для защиты от тяжелой инфекции примерно в 6 раз ниже уровня, необходимого для защиты от любой симптоматической инфекции. Авторы предположили, что иммунитет к тяжелой инфекции может быть намного более устойчивым, чем общий иммунитет к любой инфекции. Долгосрочные исследования ответов антител на вакцину, корь, эпидемический паротит или краснуху показывают, что они обычно стабилизируются с периодом полураспада >10 лет. Вероятно, даже без иммуностимуляции значительная часть людей сможет поддерживать долгосрочную защиту от тяжелой инфекции антигенно подобного штамма.
Моделирование продолжительности иммунной защиты
В недавних исследованиях выявили снижение титра нейтрализации со временем до 8 мес после заражения SARS-CoV-2 [4, 5, 6]. Главный вопрос заключается в том, могут ли реакции, вызванные вакциной, быть более стойкими, чем реакции, измеренные после заражения. В ограниченных исследованиях была проанализирована траектория снижения нейтрализационного титра после вакцинации [23].
Сравнение титров нейтрализации, измеренных между 26-м и 115-м днями (самый длительный период времени, доступный для наблюдения) после вакцинации мРНК-вакциной [23] и после инфицирования [4] позволило выявить аналогичную продолжительность периодов полужизни антител (65 дней против 58 дней соответственно). Хотя это сравнение основано на ограниченных данных, оно предполагает подобие траекторий снижения титров нейтрализации после вакцинации и естественной инфекции SARS-CoV-2.
Моделирование, предпринятое авторами, имеет важные ограничения: 1) не учитывает память В-клеток и ответы Т-клеток, которые могут быть более устойчивыми [4, 5, 6]; 2) применяет данные о снижении титров нейтрализации у реконвалесцентов к вакцинированным; 3) предполагает, что скорость снижения не зависит от начального титра.
Согласно результатам моделирования, даже если снижение титра нейтрализации с течением времени одинаково для разных вакцин, это снижение будет иметь нелинейные эффекты на уровне защиты от инфекции SARS-CoV-2 в зависимости от начальной эффективности вакцины. Например, вакцина, начальная эффективность которой составляет 95%, предположительно сохранит эффективность на уровне 77% на 250-е сутки (рис. 2а). Однако прогнозируется, что ответ, начинающийся с начальной эффективности 70%, уменьшится до 33% спустя 250 дней. Этот анализ также можно использовать для оценки того, сколько времени потребуется от начальной эффективности определенного уровня до 50% (или 70%), что может быть полезно для определения сроков введения бустерных доз (рис. 2б).
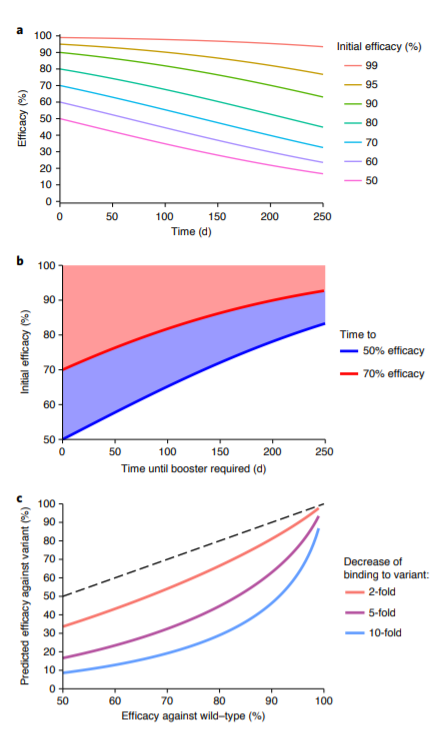
Подводя итоги, авторы отметили, что полученные результаты согласуются с исследованиями как гриппа, так и сезонной коронавирусной инфекции, повторное заражение которыми возможно через 1 год после первоначального, хотя обычно оно приводит к легкой инфекции. Аналогичным образом считается, что после вакцинации против гриппа защитная эффективность снижается примерно на 7% в месяц [24]. Разработка стандартизированных тестов для измерения нейтрализации и других иммунных ответов, а также стандартизированных протоколов клинических исследований позволят продолжить исследования с подтверждением других потенциальных иммунных коррелятов защиты. Тем не менее, в ходе исследования разрабатывали структуру моделирования для интеграции имеющихся, хотя и несовершенных, данных исследований вакцинации и выздоровления, чтобы предоставить инструмент для прогнозирования напряженности иммунитета против SARS-CoV-2.
Как бы отвечая на данное исследование, Управление по контролю за пищевыми продуктами и лекарственными средствами (Food and Drug Administration — FDA) в пресс-релизе от 19 мая предостерегло от использования тестов на антитела к SARS-CoV-2 для оценки иммунитета или защиты от COVID-19, в том числе после вакцинации.
