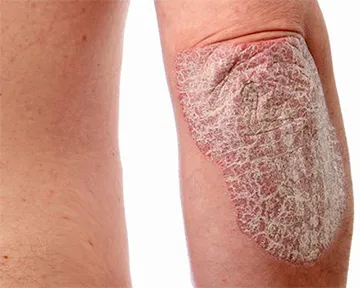
Согласно заявлению производителя, бимекизумаб был одобрен Европейской комиссией для лечения бляшечного псориаза средней и тяжелой степени у взрослых.
Бимекизумаб (Bimzelx), гуманизированное моноклональное антитело IgG1, является первым одобренным лекарственным средством для лечения бляшечного псориаза от умеренной до тяжелой степени, которое избирательно ингибирует интерлейкин (ИЛ)-17A и ИЛ-17F, отмечено в заявлении UCB (это многонациональная биофармацевтическая компания со штаб-квартирой в Брюсселе, Бельгия).
15 октября в США Управление по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA), как ожидается, примет решение об одобрении бимекизумаба для лечения псориаза. Одобрение в ЕС было основано на данных 3 исследований ІІІ фазы, в которых участвовало в общей сложности 1480 взрослых с умеренно выраженными симптомами заболевания. В результате исследования было зафиксировано, что у пациентов, получавших бимекизумаб, по данным компании, наблюдалось значительно большее очищение кожи по сравнению с плацебо, устекинумабом и адалимумабом при благоприятном профиле безопасности.
Во всех 3 исследованиях (BE VIVID, BE READY и BE SURE) более 80% пациентов, получавших бимекизумаб, продемонстрировали улучшение очищения кожи через 16 нед, что значительно больше, чем у больных, получавших плацебо, устекинумаб или адалимумаб, что базируется на улучшении по крайней мере на 90% в соответствии с индексом площади и тяжести симптомов псориаза (Psoriasis Area & Severity Index — PASI 90) и глобальной оценкой исследователя (Investigator’s Global Assessment — IGA) для чистой или почти чистой кожи (IGA 0/1). Во всех 3 исследованиях клинические ответы сохранялись через 1 год.
Рекомендуемая доза бимекизумаба составляет 320 мг, которую вводят 2 подкожными инъекциями каждые 4 нед в течении до 16 нед, затем каждые 8 нед. Однако, согласно заявлению компании, для некоторых пациентов с массой тела 120 кг и более, которые не достигли полного очищения кожи через 16 нед, введение 320 мг препарата каждые 4 нед после этого времени могут улучшить терапевтический эффект.
Наиболее частыми побочными эффектами, связанными с лечением, в исследованиях были инфекции верхних дыхательных путей (большинство из которых были ринофарингитом), о которых сообщили 14,5% пациентов, а также кандидоз полости рта, о которых сообщили 7,3% больных.
Результаты исследований BE READY и BE VIVID опубликованы в «The Lancet». Результаты исследования BE SURE были представлены в «Медицинском журнале Новой Англии» (The New England Journal of Medicine — NEJM).
Бимекизумаб противопоказан пациентам с клинически важными активными инфекциями, такими как туберкулез, а также пациентам с любой гиперчувствительностью к действующему веществу. Более подробная информация о бимекизумабе доступна на веб-сайте Европейского агентства по лекарственным средствам (European Medicines Agency — EMA).
По материалам www.medscape.com