Иксджева (Xgeva®)
Иксджева инструкция по применению
Состав
1 мл раствора содержит 70 мг деносумаба; 1 флакон (1,7 мл) содержит 120 мг деносумаба;
другие составляющие: сорбит (E420), кислота уксусная ледяная, натрия гидроксид, полисорбат 20, вода для инъекций.
Деносумаб - 70 мг/мл
Фармакологические свойства
фармакодинамика. Механизм действия. RANKL существует в виде трансмембранного или растворимого белка. RANKL необходим для формирования, функционирования и выживания остеокластов — единственного вида клеток, ответственных за резорбцию костной ткани. Повышенная активность остеокластов, стимулируемая RANKL, является главным медиатором деструкции костей при их метастатическом поражении и миеломной болезни. Деносумаб — моноклональное антитело человека (IgG2), которое с высокой аффинностью и специфичностью направляется и связывается с RANKL, предупреждая возникновение взаимодействия RANKL/RANK и приводя к уменьшению количества и ослаблению функции остеокластов, таким образом уменьшая резорбцию и деструкцию костей, индуцированную раком .
Гигантоклеточные опухоли костей характеризуются экспрессией лиганда RANK неопластическими стромальными клетками и RANK остеокластоподобными гигантскими клетками. У пациентов с гигантоклеточной опухолью костей деносумаб связывается с лигандом RANK, существенно уменьшая количество или элиминируя остеокластоподобные гигантские клетки. Вследствие этого уменьшается остеолиз и пролиферативная опухолевая строма замещается непролиферативной дифференцированной плотнотканной новой костью.
Фармакодинамические эффекты. В клинических исследованиях II фазы у пациентов с поздней стадией злокачественных опухолей, поражающих кости, п/к введение препарата Иксджева каждые 4 нед (Q4W) или каждые 12 нед приводило к быстрому снижению маркеров резорбции костей (uNTx/Cr, сывороточный CTx) со средним снижением на уровне примерно 80% для uNTx/Cr, которое возникало в течение 1 нед независимо от предыдущего лечения бисфосфонатом или от исходного уровня uNTx/Cr. В клинических исследованиях III фазы у пациентов с поздней стадией злокачественных опухолей, поражающих кости, среднее снижение uNTx/Cr на уровне примерно 80% поддерживалось до включительно 49-й недели лечения препаратом Иксджева (по 120 мг каждые 4 нед (Q4W)).
Иммуногенность. В клинических исследованиях не выявлено нейтрализующих антител к деносумабу у пациентов с развитой стадией рака или гигантоклеточной опухолью костей. При применении иммуноферментного анализа <1% пациентов, получавших деносумаб до 3 лет, были положительными в отношении ненейтрализующих связующих антител без доказательств нарушения фармакокинетики, токсичности или клинической реакции.
Клиническая эффективность и безопасность у пациентов с метастазами солидных опухолей в костях. Эффективность и безопасность препарата Иксджева в дозе 120 мг после п/к введения каждые 4 нед или золедроновой кислоты в дозе 4 мг (коррекция дозы при нарушении функции почек) после в/в введения каждые 4 нед сравнивались в трех рандомизированных двойных слепых активно контролируемых исследованиях у пациентов, ранее не получавших в/в бифосфонат и имевших позднюю стадию злокачественной опухоли с поражением костей: взрослые с раком молочной железы (исследование 1), другие солидные опухоли или миеломная болезнь (исследование 2) и рак предстательной железы, резистентный к кастрации (исследование 3). В этих активно контролируемых клинических исследованиях безопасность оценивалась у 5931 больного. Пациенты с остеонекрозом челюсти (ОНЧ) в анамнезе или остеомиелитом челюсти, пациенты с активным заболеванием зубов или челюстей, которым необходимо стоматологическое хирургическое вмешательство, больные, у которых не зажили раны после стоматологического вмешательства/хирургического вмешательства в ротовой полости, или пациенты с любыми запланированными инвазивными процедурами не удовлетворяли критериям для включения в эти исследования. Первичные и дополнительные конечные точки оценивали появление одного или более костных событий (КС). В исследованиях, демонстрирующих высокую эффективность препарата Иксджева по сравнению с золедроновой кислотой, пациентам предлагали открытый режим применения препарата Иксджева в предварительно определенной 2-летней расширенной фазе лечения. КС определялись следующим образом: патологический перелом (вертебральный или невертебральный), лучевая терапия костей (в т.ч. с применением радиоизотопов), хирургическое вмешательство на костях или компрессия спинного мозга.
Препарат Иксджева снижал риск развития КС и развитие множественных КС (первого и последующих) у пациентов с метастазами солидных опухолей в кости (табл. 1).
Таблица 1. Результаты исследования эффективности у пациентов с поздними стадиями злокачественных опухолей, поражающих кости
| Название патологии/ Показатель | Исследование 1 Рак молочной железы | Исследование 2 Другие солидные опухоли** или миеломная болезнь | Исследование 3 Рак предстательной железы | Распространенный рак (комбинированные данные) | ||||
|---|---|---|---|---|---|---|---|---|
| Вещество | Иксджева | Золедроновая кислота | Иксджева | Золедроновая кислота | Иксджева | Золедроновая кислота | Иксджева | Золедроновая кислота |
| N | 1026 | 1020 | 886 | 890 | 950 | 951 | 2862 | 2861 |
| Первое КС | ||||||||
| Медиана времени (мес) | НД | 26,4 | 20,6 | 16,3 | 20,7 | 17,1 | 27,6 | 19,4 |
| Разница медиан времени (мес) | ДО | 4,2 | 3,5 | 8,2 | ||||
| ОР (95% ДИ)/СОР (%) | 0,82 (0,71; 0,95)/18 | 0,84 (0,71; 0,98)/16 | 0,82 (0,71; 0,95)/18 | 0,83 (0,76; 0,90)/17 | ||||
| Р-значения не меньшей эффективности/большей эффективности | < 0,0001†/0,0101† | 0,0007†/0,0619† | 0,0002†/0,0085† | <0,0001/<0,0001 | ||||
| Пропорция пациентов (%) | 30,7 | 36,5 | 31,4 | 36,3 | 35,9 | 40,6 | 32,6 | 37,8 |
| Первое и последующие КС* | ||||||||
| Среднее количество/пациенты | 0,46 | 0,60 | 0,44 | 0,49 | 0,52 | 0,61 | 0,48 | 0,57 |
| Коэффициент отношения (95% ДИ)/СОР (%) | 0,77 (0,66; 0,89)/23 | 0,90 (0,77; 1,04)/10 | 0,82 (0,71; 0,94)/18 | 0,82 (0,75; 0,89)/18 | ||||
| Р-значение большей эффективности | 0,0012† | 0,1447† | 0,0085† | <0,0001 | ||||
| РКС в год | 0,45 | 0,58 | 0,86 | 1,04 | 0,79 | 0,83 | 0,69 | 0,81 |
| Первое КС или ГКЗ | ||||||||
| Медиана времени (мес) | НД | 25,2 | 19,0 | 14,4 | 20,3 | 17,1 | 26,6 | 19,4 |
| ОР (95% ДИ)/СОР (%) | 0,82 (0,70; 0,95)/18 | 0,83 (0,71; 0,97)/17 | 0,83 (0,72; 0,96)/17 | 0,83 (0,76; 0,90)/17 | ||||
| Р-значение большей эффективности | 0,0074 | 0,0215 | 0,0134 | <0,0001 | ||||
| Первое облучение костей | ||||||||
| Медиана времени (мес) | НД | НД | НД | НД | НД | 28,6 | НД | 33,2 |
| ОР (95% ДИ)/СОР (%) | 0,74 (0,59; 0,94)/26 | 0,78 (0,63; 0,97)/22 | 0,78 (0,66; 0,94)/22 | 0,77 (0,69; 0,87)/23 | ||||
| Р-значение большей эффективности | 0,0121 | 0,0256 | 0,0071 | <0,0001 | ||||
НД — не достигнуто; ДО — данные отсутствуют; ГКЗ — гиперкальциемия при злокачественной опухоли; РКС — распространенность костных событий; ОР — отношение рисков; СОР — снижение относительного риска; † — скорригированные р-значения представлены по исследованиям 1, 2 и 3 (первое КС, а также конечные точки первого и последующих КС); *учитывает все КС в динамике; подсчитываются только события, которые возникли за ≥21 день после предыдущего события; **включая НМРЛ (немелкоклеточный рак легкого), почечноклеточный рак, колоректальный рак, мелкоклеточный рак легкого, рак мочевого пузыря, рак головы и шеи, рак ЖКТ/мочеполовой системы и других локализаций, за исключением рака молочной железы и рака предстательной железы.
Графики Каплана — Мейера для времени первого КС, возникшего в ходе исследования
n — количество рандомизированных пациентов; *статистически существенно для большей эффективности; **статистически существенно для не меньшей эффективности; ЗК — золедроновая кислота 4 мг каждые 4 нед (Q4W); Дмаб — деносумаб 120 мг каждые 4 нед (Q4W).
Прогрессирование заболевания и общая выживаемость при метастазах солидных опухолей в кости. Прогрессирование заболевания было аналогичным в группах препарата Иксджева и золедроновой кислоты во всех трех исследованиях и в предварительно определенном объединенном анализе трех исследований.
Во исследованиях 1; 2 и 3 общая выживаемость была сопоставимой в группах препарата Иксджева и золедроновой кислоты у пациентов с распространенными стадиями злокачественных опухолей с поражением костей: больные раком молочной железы (ОР при 95% ДИ 0,95 [0,81–1,11]), больные раком предстательной железы (ОР при 95% ДИ 1,03 [0,91–1,17]) и пациенты с другими солидными опухолями или миеломной болезнью (ОР при 95% ДИ 0,95 [0,83–1,08]). Post-hoc анализ в исследовании 2 (пациенты с другими солидными опухолями или миеломной болезнью) определял общую выживаемость при наличии одной из трех типов опухолей с использованием стратификации (немелкоклеточный рак легкого, миеломная болезнь и другие опухоли). Общая выживаемость была выше в группе препарата Иксджева при немелкоклеточном раке легкого (ОР при 95% ДИ 0,79 [0,65–0,95]; n=702), в группе золедроновой кислоты при миеломной болезни (ОР при 95% ДИ 2,26 [1,13–4,50]; n=180) и аналогичной в группе препарата Иксджева и золедроновой кислоты при других типах опухолей (ОР при 95% ДИ 1,08 [0,90–1,30]; n=894). Это исследование не контролировалось в отношении прогностических факторов и противоопухолевого лечения. В объединенном предварительно определенном анализе исследований 1; 2 и 3 общая выживаемость была аналогичной в группе препарата Иксджева и золедроновой кислоты (ОР при 95% ДИ 0,99 [0,91–1,07]).
Влияние на боль. Время до уменьшения выраженности боли (то есть снижение на ≥2 балла от начальных значений по шкале оценки боли модифицированного короткого опросника оценки боли BPI-SF) было аналогичным для деносумаба и золедроновой кислоты в каждом исследовании и в интегрированных анализах. В post-hoc анализе комбинированных данных медиана времени до усиления боли (>4 баллов усиление по шкале боли) у пациентов с легкой болью или без боли на исходном уровне была больше для препарата Иксджева по сравнению с золедроновой кислотой (198 против 143 дней) (p=0,0002).
Клиническая эффективность у пациентов с миеломной болезнью. В международном рандомизированном (1:1) двойном слепом исследовании с активным контролем препарат Иксджева сравнивали с золедроновой кислотой у пациентов с впервые диагностированной миеломной болезнью (исследование 4).
В этом исследовании 1718 пациентов с миеломной болезнью с минимум одним костным очагом были рандомизированы для п/к введения препарата Иксджева в дозе 120 мг каждые 4 нед (Q4W) или в/в введения золедроновой кислоты в дозе 4 мг каждые 4 нед (коррекция дозы проводилась с учетом функции почек). Первичной конечной точкой исследования была демонстрация неменьшей эффективности препарата Иксджева относительно появления первого КС по сравнению с золедроновой кислотой. К вторичным конечным точкам относились более высокая эффективность относительно времени до первого КС, до первого и следующего КС и общая выживаемость. КС определялись следующим образом: патологический перелом (вертебральный или невертебральный), лучевая терапия костей (в т. ч. с применением радиоизотопов), хирургическое вмешательство на костях или компрессия спинного мозга.
В обеих группах исследования 54,5% пациентов должны были пройти аутологическую трансплантацию стволовых клеток пуповинной крови (PBSC), 95,8% применяли/планировали применять новый противомиеломный препарат (бортезомиб, леналидомид или талидомид) в качестве терапии первой линии, а 60,7% уже имели КС ранее. В обеих группах количество пациентов с миеломной болезнью на I, II и III стадии по Международной системе стадирования (ISS) на момент установления диагноза составило 32,4%, 38,2% и 29,3% соответственно.
Медиана количества введенных доз составляла 16 для препарата Иксджева и 15 — для золедроновой кислоты.
Результаты эффективности в исследовании 4 представлены на рис. 2 и табл. 2.
Рис. 2. Графики Каплана — Мейера для периода до первого КС, возникшего у пациентов с впервые диагностированной миеломной болезнью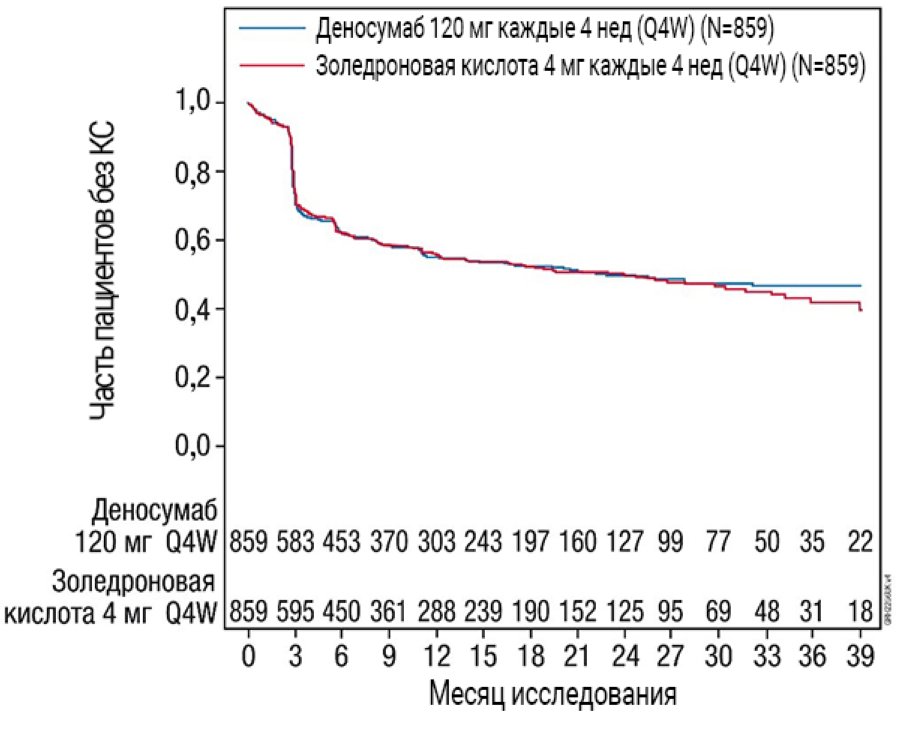
N — количество рандомизированных пациентов.
Таблица 2. Результаты эффективности для препарата Иксджева по сравнению с золедроновой кислотой у пациентов с впервые диагностированной миеломной болезнью
| Показатель | Иксджева (N=859) | Золедроновая кислота (N=859) |
| Первое КС | ||
| Количество пациентов с КС (%) | 376 (43,8) | 383 (44,6) |
| Медиана времени до КС (мес) | 22,8 (14,7; НО) | 23,98 (16,56; 33,31) |
| ОР (95% ДИ) | 0,98 (0,85; 1,14) | |
| Первое и следующее КС | ||
| Среднее количество событий/пациент | 0,66 | 0,66 |
| Коэффициент отношения (95% ДИ) | 1,01 (0,89; 1,15) | |
| Распространенность КС в год | 0,61 | 0,62 |
| Первое КС или ГКЗ | ||
| Медиана времени (мес) | 22,14 (14,26; НО) | 21,32 (13,86; 29,7) |
| ОР (95% ДИ) | 0,98 (0,85; 1,12) | |
| Первое облучение костей | ||
| ОР (95% ДИ) | 0,78 (0,53; 1,14) | |
| Общая выживаемость | ||
| ОР (95% ДИ) | 0,90 (0,70; 1,16) | |
Клиническая эффективность для взрослых и подростков с созревшей костной системой, с гигантоклеточной опухолью костей. Безопасность и эффективность препарата Иксджева исследовали в двух открытых несравнительных исследованиях II фазы (исследование 5 и 6), включавших 554 пациента с гигантоклеточными нерезектабельными опухолями костей или для которых хирургическое вмешательство связывалось с тяжелой заболеваемостью. Препарат Иксджева вводили п/к в дозе 120 мг каждые 4 нед с нагрузочной дозой 120 мг на 8-й и 15-й дни. После прекращения лечения препаратом Иксджева пациенты переходили к следующей фазе продолжительностью по меньшей мере 60 мес касательно дальнейшего наблюдения состояния пациентов для оценки безопасности лекарственного средства. Восстановление лечения препаратом Иксджева в период наблюдения для оценки безопасности разрешалось проводить тем участникам исследования, у которых наблюдался первоначальный ответ на применение препарата Иксджева (например, в случае рецидива заболевания).
Исследование 5 включало 37 взрослых пациентов с гистологически подтвержденными нерезектабельными или рецидивирующими гигантоклеточными опухолями костей. Основной конечной точкой исследования был объективный ответ у пациентов, который определялся как элиминация гигантских клеток по крайней мере на 90% по сравнению с исходным уровнем (или полная элиминация гигантских клеток, если их часть составляла менее 5% опухолевых клеток), или как отсутствие прогрессирования целевого опухолевого очага, подтвержденная результатами рентгенологического исследования при отсутствии данных гистопатологического исследования.
Из 35 пациентов, включенных в анализ эффективности, 85,7% (95% ДИ 69,7–95,2) отвечали на лечение препаратом Иксджева. Критериям ответа на лечение соответствовали все 20 пациентов (100%), у которых были получены данные гистопатологического исследования. Из 15 пациентов у оставшихся 10 (67%) не выявлено прогресса целевого опухолевого очага по результатам рентгенологических исследований.
Исследование 6 включало 535 взрослых или подростков с созревшей костной системой, с наличием гигантоклеточной опухоли костей. Возраст 28 пациентов этой группы составлял от 12 до 17 лет. Пациенты были распределены в одну из трех когорт: в когорту 1 входили пациенты с неоперабельным заболеванием (например, крестцовые, позвоночные или множественные опухолевые очаги, в частности с метастазами в легкие); в когорту 2 входили пациенты с операбельным заболеванием, у которых запланированное хирургическое вмешательство связывалось с тяжелыми последствиями (например, резекция сустава, ампутация конечности или гемипельвэктомия); в когорту 3 входили пациенты, которые перешли в это исследование после участия в исследовании 5. Главная цель заключалась в оценке профиля безопасности деносумаба у пациентов с гигантоклеточной опухолью костей. К вторичным конечным точкам исследования относились: для когорты 1 — время до прогрессирования заболевания (по оценке исследователя); для когорты 2 — доля пациентов, которым до 6-го месяца не проводили ни одного хирургического вмешательства.
По результатам заключительного анализа данных в когорте 1 прогрессирование заболевания зафиксировано у 28 из 260 пациентов, получивших лечение (10,8%). В когорте 2 до 6-го месяца не проводили хирургическое вмешательство у 219 из 238 (92,0% ДИ, 95% ДИ: 87,8%, 95,1%) пациентов, подлежащих оценке и которым проводили лечение препаратом Иксджева. В когорте 2 у 82 (34,3%) из 239 пациентов, у которых на исходном уровне или в период участия в исследовании целевой опухолевый очаг локализовывался не в легких и не в мягких тканях, хирургическое вмешательство в ходе исследования не проводилось. В общем полученные результаты эффективности у подростков с созревшей костной системой и взрослых были схожими.
Влияние на боль. В заключительном анализе данных в объединенной группе из 1-й и 2-й когорт сообщалось о клинически существенном ослаблении выраженности сильной боли (т.е. снижение на ≥2 балла от исходного уровня) у 30,8% пациентов группы риска (т.е. у имевших худший бал по шкале сильной боли ≥2 от исходного уровня) в течение 1 нед лечения и ≥50% на 5-й неделе. Это ослабление боли поддерживалось во всех последующих оценках.
Дети. Европейское агентство лекарственных средств временно воздержалось от обязательства передать результаты исследований препарата Иксджева во всех подгруппах детей для предупреждения КС у пациентов с метастазами в костях и в подгруппах детей в возрасте до 12 лет при гигантоклеточных опухолях костей (см. ПРИМЕНЕНИЕ для получения информации по применению у детей).
В исследовании 6 препарат Иксджева оценивался в подгруппе из 28 подростков (в возрасте от 13 до 17 лет) с гигантоклеточными опухолями костей с созревшей костной системой. Зрелость определяли по завершении созревания менее 1 трубчатой кости (например, закрытая пластинка эпифизарного роста плечевой кости) и массы тела ≥45 кг. У одного подростка с неоперабельным заболеванием (n=14) произошел рецидив при начальном лечении. До 6-го месяца хирургическое лечение не проходили 13 из 14 пациентов с операбельным заболеванием, у которых запланированное хирургическое вмешательство связывалось с тяжелыми последствиями.
Фармакокинетика
Абсорбция. После п/к введения биодоступность составляла 62%.
Метаболизм. Деносумаб состоит исключительно из аминокислот и углеводов, как и природный иммуноглобулин. Поэтому маловероятно, что он будет выводиться путем печеночного метаболизма. Считается, что его метаболизм и выведение происходят теми же путями, что и клиренс иммуноглобулина, приводя к распаду небольших белков до отдельных аминокислот.
Выведение. У пациентов с распространенным раком при применении многократных доз по 120 мг каждые 4 нед отмечали повышение концентрации в сыворотке крови деносумаба почти в 2 раза, а равновесное состояние достигалось через 6 мес согласно фармакокинетике, не зависящей от времени. У лиц с миеломной болезнью, получавших 120 мг каждые 4 нед, медианы минимальных остаточных концентраций отличались менее чем на 8% на 6-м и 12-м месяцах. У пациентов с гигантоклеточными опухолями костей, которые получали 120 мг каждые 4 нед с нагрузочной дозой на 8-й и 15-й день, равновесные уровни достигались в течение первого месяца лечения. На 9-й и 49-й неделях медианы минимальных остаточных концентраций отличались менее чем на 9%. У пациентов, прекративших получать 120 мг каждые 4 нед, Т½ составил 28 дней (диапазон — 14–55 дней).
Анализ популяционной фармакокинетики не указал на клинически существенные изменения системного влияния деносумаба в равновесном состоянии в зависимости от возраста (18–87 лет), расы/этнической группы (исследованы пациенты с темным цветом кожи, выходцы из Латинской Америки, лица монголоидной и европеоидной расы), пола или типов солидной опухоли или наличия у пациента миеломной болезни. Увеличение массы тела связывалось со снижением системного воздействия и наоборот. Изменения не считались клинически существенными, поскольку фармакодинамические эффекты на основе маркеров костного ремоделирования соответствовали в широком диапазоне показателю массы тела.
Линейность/нелинейность. Деносумаб отражал нелинейную фармакокинетику в широком диапазоне доз, но почти дозопропорциональное увеличение влияния для доз ≥60 мг (≥1 мг/кг). Нелинейность, скорее всего, связана с важным путем выведения, опосредованным мишенью, насыщаемой при низких концентрациях.
Почечная недостаточность. В исследованиях деносумаба у пациентов (60 мг, n=55 и 120 мг, n=32) без поздней стадии рака, но с разной степенью функции почек, включая пациентов на диализе, степень почечной недостаточности не влияла на фармакокинетику деносумаба; таким образом, нет необходимости в коррекции дозы при почечной недостаточности. При лечении препаратом Иксджева мониторинг почечной функции не требуется.
Печеночная недостаточность. Не проводили специальных исследований с участием пациентов с печеночной недостаточностью. В общем моноклональные антитела не выводятся путем печеночного метаболизма. Не ожидается, что печеночная недостаточность будет влиять на фармакокинетику деносумаба.
Пациенты пожилого возраста. У лиц пожилого и молодого возраста вообще не наблюдалось различий относительно безопасности или эффективности. В контролируемых клинических исследованиях с участием пациентов, получающих препарат Иксджева, с поздними стадиями злокачественных опухолей с поражением костей и возрастом >65 лет выявили аналогичную эффективность и безопасность как у старших, так и у более молодых пациентов. Для пациентов пожилого возраста нет необходимости в коррекции дозы.
Дети. У подростков с созревшей костной системой (в возрасте от 12 до 17 лет) с гигантоклеточной опухолью костей, получавших 120 мг каждые 4 нед с нагрузочной дозой на 8-й и 15-й дни, фармакокинетические параметры деносумаба не отличались от аналогичных показателей у взрослых пациентов с гигантоклеточной опухолью костей.
Данные доклинических испытаний по безопасности. Поскольку биологическая активность деносумаба у приматов специфическая, для оценки фармакодинамических свойств деносумаба на моделях грызунов использовались генно-модифицированные мыши (технология knockout) или другие биологические ингибиторы пути RANK/RANKL, такие как OPG-Fc и RANK-Fc.
В моделях мышей с костными метастазами эстроген рецепторположительного и негативного рака молочной железы, рака предстательной железы и немелкоклеточного рака легкого человека OPG-Fc уменьшал остеолитические, остеобластические и остеолитические/остеобластические разрушения, задерживал формирование de novo костных метастазов и сдерживал рост опухолей в костях. Если OPG-Fc сочетался с гормональной терапией (тамоксифен) или химиотерапией (доцетаксел), отмечали дополнительное подавление роста костных ячеек рака молочной железы, предстательной железы или рака легкого соответственно. В модели мыши с индуцированной опухолью молочной железы RANK-Fc снижал опосредованную гормоном пролиферацию эпителия молочной железы и задерживал формирование опухоли.
Стандартные тесты для определения потенциала генотоксичности деносумаба не выполнялись, поскольку такие тесты не являются релевантными для этой молекулы. Однако маловероятно, что деносумаб имеет какой-либо потенциал к генотоксичности.
Канцерогенный потенциал деносумаба не оценивали в длительных исследованиях на животных.
В исследованиях токсичности однократной и многократных доз у яванских макак дозы деносумаба, которые приводили к системному ответу, выше в 2,7–15 раз, чем рекомендуемая доза для человека, не имели влияния на физиологию сердечно-сосудистой системы, репродуктивной функции самцов или самок или на возникновение специфической токсичности для органов-мишеней.
В исследовании на яванских макаках, которые получали деносумаб в течение периода, эквивалентного I триместру беременности, дозы деносумаба, которые приводили к системному ответу, выше в 9 раз, чем рекомендуемая доза для человека, не вызывали токсического действия у матери или вреда для плода в течение периода, эквивалентного I триместру беременности, хотя лимфатические узлы плода не исследовали.
В другом исследовании на яванских макаках, которые получали деносумаб в течение беременности с системным воздействием, в 12 раз выше, чем доза для человека, отмечали увеличение мертворождений и постнатальной смертности; патологический рост костей, который приводил к снижению прочности костей, сниженный гемопоэз и неправильный прикус; отсутствие периферических лимфоузлов; замедление неонатального роста. Максимальная доза, не приводившая к возникновению наблюдамых побочных эффектов, не установлена. Через 6 мес после рождения изменения, связанные с костями, устранились и показатели нормализовались, не отмечалось влияния на прорезывание зубов. Однако воздействие на лимфатические узлы и прикус оставалось, а у одного животного отмечена минимальная или средняя минерализация многочисленных тканей (связь с лечением не очевидна). Не существует доказательств вреда для матери до родов; нежелательные реакции у матери нечасто возникали во время родов. Развитие молочной железы матери было нормальным.
В доклинических исследованиях качества костей на обезьянах при длительном лечении деносумабом замедление ремоделирования связывалось с улучшением прочности костей и нормальными гистологическими параметрами костей.
У самцов мышей, у которых путем генной модификации получена экспрессия huRANKL (технология knock-in mice) и подвергавшиеся транскортикальному перелому, деносумаб тормозил организацию хрящевой ткани и ремоделирование костной мозоли по сравнению с контролем, но биохимическая прочность не подвергалась нежелательному воздействию.
В доклинических исследованиях у мышей с заблокированным геном RANK или RANKL не было лактации в связи с угнетением созревания молочных желез (лобуло-альвеолярное развитие желез в период беременности) и выявлено нарушение образования лимфоузлов. Новорожденные мыши с заблокированным геном RANK/RANKL демонстрировали уменьшение массы тела, ослабление роста костной ткани, нарушение зон роста и отсутствие прорезывания зубов. Ослабление роста костной ткани, нарушение зон роста и отсутствие прорезывания зубов также отмечали в испытаниях на новорожденных крысах, которым вводили ингибиторы RANKL, и эти изменения были частично обратимы после отмены ингибитора RANKL. У приматов подросткового возраста, получавших деносумаб в дозе, в 2,7 и 15 раз (доза 10 и 50 мг/кг массы тела) превышающей клиническую дозу, были патологически измененные зоны роста. Таким образом, лечение деносумабом может нарушать рост костной ткани у детей с открытыми зонами роста и подавлять прорезывание зубов.
Показания Иксджева
предупреждение КС (патологический перелом, облучение костей, компрессия спинного мозга или хирургическое вмешательство на костях) у взрослых пациентов с поздней стадией злокачественных опухолей, поражающих кости (см. Фармакодинамика).
Лечение подростков с созревшей костной системой с наличием гигантоклеточной опухоли костей, которая не может быть удалена, или у которых хирургическая резекция, скорее всего, приведет к тяжелым последствиям.
Применение Иксджева
препарат Иксджева следует применять под наблюдением врача.
Дозировка. Необходимо ежедневное добавление в рацион питания не менее 500 мг кальция и 400 МЕ витамина D, за исключением случаев гиперкальциемии (см. ОСОБЫЕ УКАЗАНИЯ).
Предупреждение КС у взрослых с поздней стадией злокачественных опухолей, поражающих кости. Рекомендуемая доза препарата Иксджева составляет 120 мг, которую вводят в виде п/к инъекции 1 раз каждые 4 нед в область бедра, брюшной стенки или плеча.
Гигантоклеточная опухоль костей. Рекомендуемая доза препарата Иксджева составляет 120 мг, которую вводят в виде п/к инъекции 1 раз каждые 4 нед в область бедра, брюшной стенки или плеча, с дополнительными дозами по 120 мг в 8-й и 15-й день лечения в течение первого месяца терапии.
Пациенты в исследовании II фазы, которым была проведена полная резекция гигантоклеточной опухоли костей, получали дополнительное лечение в течение 6 мес после операции согласно протоколу исследования.
Необходимо регулярно проводить оценку состояния пациентов с гигантоклеточной опухолью костей, чтобы определить, продолжают ли они получать пользу от лечения. У пациентов с заболеванием, контролируемым препаратом Иксджева, эффект от прерывания или временного прекращения лечение не оценивался, однако ограниченные данные для этих больных не указывают на эффект рикошета после временного прекращения лечения.
Почечная недостаточность. У лиц с почечной недостаточностью нет необходимости в коррекции дозы (см. ОСОБЫЕ УКАЗАНИЯ для получения рекомендаций по проверке уровня кальция, ПОБОЧНЫЕ ЭФФЕКТЫ и Фармакокинетика ).
Печеночная недостаточность. Безопасность и эффективность применения деносумаба не исследовали у пациентов с печеночной недостаточностью (см. Фармакокинетика).
Пациенты пожилого возраста (≥65 лет). Нет необходимости в коррекции дозы для пациентов пожилого возраста (см. Фармакокинетика).
Способ применения. Для п/к введения.
– Перед введением препарата Иксджева р-р необходимо визуально проверить. Р-р может содержать незначительное количество прозрачных или белых белковоподобных частиц. Не вводить р-р, если он помутнел или изменил цвет.
– Не встряхивать.
– Чтобы избежать дискомфорта в месте введения, флакон следует нагреть до комнатной температуры (до 25 °C). Препарат вводится медленно.
– Вводить все содержимое флакона.
– Для введения деносумаба рекомендуется игла калибра 27.
– Не вводить иглу во флакон повторно.
Любой неиспользованный препарат или отходы необходимо утилизировать в соответствии с местными требованиями.
Противопоказания
повышенная чувствительность к действующему веществу или к любому вспомогательному веществу, указанному в разделе СОСТАВ И ФОРМА ВЫПУСКА.
Нелеченная гипокальциемия тяжелой степени (см. ОСОБЫЕ УКАЗАНИЯ).
Поражение после стоматологических или хирургических вмешательств в полости рта, которые не заживают.
Побочные эффекты
резюме профиля безопасности
Общий профиль безопасности является одинаковым при всех утвержденных показаниях для лекарственного средства Иксджева.
Очень часто сообщалось о гипокальциемии, возникавшей после введения препарата Иксджева, главным образом в течение первых 2 нед. Гипокальциемия могла быть тяжелой и симптоматической (см. Описание отдельных побочных реакций). Как правило, снижение уровня кальция в плазме крови эффективно устранялось путем добавления препаратов кальция и витамина D. Наиболее частой побочной реакцией при применении препарата Иксджева была скелетно-мышечная боль. У пациентов, получавших препарат Иксджева, часто сообщалось о случаях остеонекроза челюсти (см. ОСОБЫЕ УКАЗАНИЯ и Описание отдельных побочных реакций).
Безопасность препарата Иксджева оценивали у:
Табличный перечень побочных реакций. Классификация частоты побочных реакций, о которых сообщалось в 4 клинических исследованиях III фазы и двух клинических исследованиях II фазы, а также в период послерегистрационного применения (см. табл. 3): очень часто (≥1/10), часто (≥1/100–<1/10), нечасто (≥1/1000–<1/100), редко (≥1/10 000–<1/1000) и очень редко (<1/10 000). В каждой группе по частоте возникновения и классу системы органов побочные реакции представлены в порядке убывания тяжести.
Таблица 3. Побочные реакции, о которых сообщалось у пациентов с поздними стадиями злокачественных опухолей, поражающих кости, с миеломной болезнью или гигантоклеточной опухолью костей
| Системы классов органов по MedDRA | Категория частоты возникновения | Побочные реакции |
|---|---|---|
| Доброкачественные, злокачественные и неопределенные новообразования (в т.ч. кисты и полипы) | Часто | Новое первичное злокачественное новообразование1 |
| Нарушения со стороны иммунной системы | Редко | Повышенная чувствительность к препарату1 Анафилактическая реакция1 |
| Нарушения со стороны метаболизма и питания | Очень часто | Гипокальциемия1,2 |
| Часто | Гипофосфатемия | |
| Нечасто | Гиперкальциемия после прекращения лечения у пациентов с гигантоклеточной опухолью костей3 | |
| Нарушения со стороны дыхательной системы, органов грудной клетки и средостения | Очень часто | Диспноэ |
| Нарушения со стороны ЖКТ | Очень часто | Диарея |
| Часто | Удаление зубов | |
| Нарушения со стороны кожи и подкожных тканей | Часто | Гипергидроз |
| Нечасто | Лишаеподобная сыпь, вызванная лекарственным средством1 | |
| Нарушения со стороны костно-мышечной и соединительной ткани | Очень часто | Скелетно-мышечная боль1 |
| Часто | Остеонекроз челюсти1 | |
| Нечасто | Атипичный перелом бедра1 | |
| Частота неизвестна | Остеонекроз наружного слухового прохода3, 4 | |
1См. Описание отдельных побочных реакций.
2См. Другие особые группы пациентов.
3См. ОСОБЫЕ УКАЗАНИЯ.
4Эффект, характерный для данного класса лекарственных средств.
Описание отдельных побочных реакций
Гипокальциемия. Более высокая частота развития гипокальциемии наблюдалась в клинических исследованиях предупреждения КС у пациентов, получавших деносумаб, по сравнению с пациентами, получавшими золедроновую кислоту.
Наиболее высокая частота развития гипокальциемии наблюдалась в ходе исследования III фазы у пациентов с миеломной болезнью. Случаи гипокальциемии были у 16,9% больных, получавших препарат Иксджева, и у 12,4% пациентов, получавших золедроновую кислоту. Снижение уровня кальция в сыворотке крови 3-й степени возникло у 1,4% и 0,6% пациентов, применявших препарат Иксджева и золедроновую кислоту соответственно, а 4-й степени — у 0,4% и 0,1% соответственно
В трех клинических исследованиях III фазы с активным контролем с участием пациентов с поздними стадиями злокачественных опухолей с поражением костей о гипокальциемии сообщалось у 9,6% пациентов, получавших препарат Иксджева, и у 5,0% пациентов, получавших золедроновую кислоту.
Снижение 3-й степени уровней кальция в сыворотке крови возникало у 2,5% пациентов, получавших препарат Иксджева, и у 1,2% пациентов, получавших золедроновую кислоту. Снижение 4-й степени уровней кальция в сыворотке крови возникало у 0,6% пациентов, получавших препарат Иксджева, и у 0,2% пациентов, получавших золедроновую кислоту (см. ОСОБЫЕ УКАЗАНИЯ).
В двух клинических исследованиях II фазы с одной группой среди участников с гигантоклеточной опухолью костей о гипокальциемии сообщалось у 5,7% пациентов. Ни одна из побочных реакций не считалась серьезной.
В период послерегистрационного применения сообщалось о тяжелой симптоматической гипокальциемии (включая летальные случаи), при этом большинство случаев возникали в первые недели после начала лечения. Примеры клинических проявлений тяжелой симптоматической гипокальциемии включали пролонгацию интервала Q–T, тетанию, судороги и нарушение психического состояния (включая кому) (см. ОСОБЫЕ УКАЗАНИЯ). Симптомы гипокальциемии в клинических исследованиях включали парестезии или ригидность мышц, мышечные подергивания, спазмы и мышечные судороги.
Остеонекроз челюсти (ОНЧ). В клинических исследованиях частота ОНЧ была выше при более длительном воздействии препарата; ОНЧ также диагностировался после прекращения лечения препаратом Иксджева, при этом большинство случаев возникало в течение 5 мес после введения последней дозы. Пациенты с ОНЧ или остеомиелитом челюсти в анамнезе, активными заболеваниями зубов или челюстей, требующими хирургического вмешательства, не зажившими ранами после стоматологического/хирургического вмешательства в ротовой полости или лица с любыми запланированными инвазивными стоматологическими вмешательствами исключались из клинических исследований.
Более высокая частота возникновения ОНЧ наблюдалась в ходе клинических исследований предупреждения КС у пациентов, получавших деносумаб, по сравнению с золедроновой кислотой. Высокая частота возникновения ОНЧ была в исследовании ІІІ фазы у пациентов с миеломной болезнью. В двойной слепой фазе лечения этого исследования ОНЧ был подтвержден у 5,9% пациентов, получавших препарат Иксджева (медиана применения 19,4 мес; диапазон: 1–52), и у 3,2% пациентов, получавших золедроновую кислоту. На момент завершения двойной слепой фазы терапии исследования скорректированная для показателя пациенто-лет частота возникновения подтвержденных случаев ОНЧ в группе препарата Иксджева (медиана применения 19,4 мес; диапазон: 1–52) составляла 2,0 на 100 пациенто-лет во время первого года лечения, 5,0 — второго года и 4,5 в последующие годы. Медиана времени до возникновения ОНП составляла 18,7 мес (диапазон: 1–44).
В первичных фазах лечения трех активно контролируемых клинических исследований III фазы среди лиц с поздней стадией злокачественных опухолей с поражением костей ОНЧ был подтвержден у 1,8% пациентов, получавших препарат Иксджева (среднее влияние — 12,0 мес, диапазон — 0,1–40,5), и у 1,3% пациентов, получавших золедроновую кислоту. Клинические характеристики этих случаев были аналогичными в группах лечения. Среди пациентов с подтвержденным ОНЧ у большинства (81% в обеих группах лечения) в анамнезе было удаление зубов, плохая гигиена полости рта и/или установление зубных протезов. К тому же большинство пациентов получали или уже прошли процедуру химиотерапии.
Исследование среди больных раком молочной железы или предстательной железы включали расширенную фазу лечения препаратом Иксджева (среднее общее влияние — 14,9 мес, диапазон — 0,1–67,2). ОНЧ подтвержден у 6,9% больных раком молочной железы или предстательной железы во время расширенной фазы лечения.
Скорригированная для показателя пациенто-лет частота возникновения подтвержденных случаев ОНЧ составила 1,1% на 100 пациенто-лет в первый год лечения, 3,7% — во второй год и 4,6% — в последующие годы. Медиана времени до возникновения ОНЧ составила 20,6 мес (диапазон — 4–53).
Данные нерандомизированного ретроспективного обсервационного исследования с участием 2877 пациентов со злокачественными опухолями, получавших лечение препаратом Иксджева или золедроновой кислотой в Швеции, Дании и Норвегии, показали, что 5-летняя частота возникновения подтвержденного ОНЧ составила 5,7% (95% ДИ 4,4–7,3; медиана времени наблюдения: 20 мес (диапазон 0,2–60)) в когорте пациентов, получавших Иксджева, и 1,4% (95% ДИ 0,8–2,3; медиана времени наблюдения: 13 мес (диапазон 0,1–60)) в отдельной когорте применения золедроновой кислоты. Пятилетняя частота возникновения ОНЧ у пациентов, перешедших на лечение Иксджева после приема золедроновой кислоты, равнялась 6,6% (95% ДИ 4,2–10,0; медиана времени наблюдения: 13 мес (диапазон 0,2–60)).
В клиническом исследовании ІІІ фазы у пациентов с неметастатическим раком предстательной железы (пациенты, для которых препарат Иксджева не показан для применения) с длительной экспозицией в течение периода до 7 лет лечения скорректированная для показателя пациенто-лет частота подтвержденного ОНП составила 1,1 на 100 пациенто-лет в течение первого года лечения, 3,0 — в течение второго года и 7,1 — в последующие годы.
В длительном открытом клиническом исследовании II фазы у пациентов с гигантоклеточной опухолью костей (исследование 6, см. Фармакодинамика) ОНЧ был подтвержден у 6,8% пациентов, в частности у одного подростка (медиана количества доз: 34; диапазон: 4–116). На момент завершения исследования медиана продолжительности участия в исследовании, в частности в фазе дальнейшего наблюдения, составила 60,9 мес (диапазон: 0–112,6). Скорректированная для показателя пациенто-лет общая частота подтвержденного ОНЧ составила 1,5 на 100 пациенто-лет (0,2 на 100 пациенто-лет в течение первого года лечения, 1,5 — в течение второго года, 1,8 — в течение третьего года, 2,1 — в течение четвертого года, 1,4 — в течение пятого года и 2,2 — в последующие годы). Медиана времени до возникновения ОНЧ составила 41 мес (диапазон: 11–96).
Реакции повышенной чувствительности, связанные с применением препарата. В условиях послерегистрационного применения у пациентов, получавших препарат Иксджева, сообщалось о явлениях повышенной чувствительности, включая редкие явления анафилактических реакций.
Атипичные переломы бедра. В программе клинического исследования у пациентов, получавших препарат Иксджева, нечасто сообщалось об атипичных переломах бедра, риск возникновения которых возрастал с увеличением продолжительности лечения. Эти явления возникали в ходе лечения и до 9 мес после прекращения лечения (см. ОСОБЫЕ УКАЗАНИЯ).
Скелетно-мышечная боль. В условиях послерегистрационного применения у пациентов, получавших препарат Иксджева, сообщалось о скелетно-мышечной боли, включая тяжелые случаи. В клинических исследованиях о скелетно-мышечной боли очень часто сообщалось в группах деносумаба и золедроновой кислоты, однако к отмене препарата это приводило нечасто.
Новое первичное злокачественное новообразование. На первичных фазах двойного слепого лечения из четырех активных контролируемых клинических исследований III фазы с участием пациентов с поздней стадией злокачественных опухолей, поражающих кости, первичные злокачественные новообразования наблюдались у 54 из 3691 (1,5%) пациентов, получавших препарат Иксджева (медиана применения 13,8 мес; диапазон: 1,0–51,7), и 33 из 3688 (0,9%) пациентов, получавших золедроновую кислоту (медиана применения 12,9 мес; диапазон: 1,0–50,8).
Кумулятивная частота через год составила 1,1% для деносумаба и 0,6% для золедроновой кислоты.
Не обнаружено какого-либо явления, связанного с лечением, для отдельных видов рака и рака с распределением по группам.
Лишаеподобная сыпь, вызванная лекарственным средством. Лишаеподобная сыпь, вызванная лекарственным средством (например реакции, подобные плоскому лишаю), отмечались у пациентов в постмаркетинговый период.
Дети. Препарат Иксджева изучали в открытом исследовании, включавшем 28 подростков с созревшей костной системой с гигантоклеточной опухолью костей. На основе этих ограниченных данных профиль побочных реакций оказался аналогичным профилю для взрослых.
В послерегистрационный период сообщалось о клинически значимой гиперкальциемии после прекращения лечения у детей (см. ОСОБЫЕ УКАЗАНИЯ).
Другие особые группы пациентов
Почечная недостаточность. В клиническом исследовании у пациентов без поздней стадии рака с почечной недостаточностью тяжелой степени (клиренс креатинина <30 мл/мин) или пациентов, находящихся на диализе, наблюдался более высокий риск развития гипокальциемии при отсутствии употребления кальциевых добавок. Риск развития гипокальциемии во время лечения препаратом Иксджева растет с повышением степени почечной недостаточности. В клиническом исследовании с участием пациентов без поздней стадии рака у 19% участников с почечной недостаточностью тяжелой степени (клиренс креатинина <30 мл/мин) и у 63% пациентов, находящихся на гемодиализе, возникала гипокальциемия, несмотря на прием кальциевых добавок. Общая частота возникновения клинически значимой гипокальциемии составила 9%.
Сопутствующие подъемы уровней паратиреоидного гормона также отмечали у пациентов, получавших препарат Иксджева и имевших почечную недостаточность тяжелой степени или находившихся на диализе. Мониторинг уровня кальция и достаточное поступление кальция и витамина D особенно необходимы для пациентов с почечной недостаточностью (см. ОСОБЫЕ УКАЗАНИЯ).
Сообщение о подозреваемых побочных реакциях. Важно сообщать о подозреваемых побочных реакциях, которые выявлены после регистрации лекарственного средства. Это позволяет продолжать наблюдать за соотношением польза/риск применения лекарственного средства. Необходимо сообщать о любых подозреваемых побочных реакциях через национальную систему.
Особые указания
добавление кальция и витамина D необходимо для всех пациентов, за исключением случаев гиперкальциемии (см. ПРИМЕНЕНИЕ).
Гипокальциемия. Существующую гипокальциемию необходимо корригировать до начала лечения препаратом Иксджева. Гипокальциемия может возникнуть в любое время в течение терапии препаратом Иксджева. Мониторинг уровня кальция следует проводить перед введением начальной дозы препарата Иксджева, в течение 2 нед после введения начальной дозы, если возникают симптомы с подозрением на гипокальциемию (см. ПОБОЧНЫЕ ЭФФЕКТЫ для ознакомления с симптомами). Необходимо рассмотреть дополнительный мониторинг уровня кальция во время лечения у пациентов с факторами риска развития гипокальциемии или в других случаях в зависимости от клинического состояния пациента.
Пациенты должны сообщать о симптомах, указывающих на гипокальциемию. Если гипокальциемия возникает во время лечения препаратом Иксджева, может возникнуть потребность в дополнительном употреблении кальциевых добавок и дополнительном мониторинге уровней кальция.
В период послерегистрационного применения сообщалось о тяжелой симптоматической гипокальциемии (включая летальные случаи) (см. ПОБОЧНЫЕ ЭФФЕКТЫ), при этом большинство случаев возникало в течение первых недель после начала лечения, но могли возникать и позже.
Почечная недостаточность. Лица с тяжелой почечной недостаточностью (клиренс креатинина <30 мл/мин) или пациенты, находящиеся на диализе, относятся к группе риска развития гипокальциемии. Риск развития гипокальциемии и сопутствующего подъема уровня паратиреоидного гормона растет с увеличением степени почечной недостаточности. Постоянный мониторинг уровня кальция особенно важен для этих пациентов.
ОНЧ. У пациентов, получавших препарат Иксджева, часто сообщалось о возникновении ОНЧ (см. ПОБОЧНЫЕ ЭФФЕКТЫ).
Начало лечения/новый курс лечения следует отложить у пациентов с незажившими открытыми поражениями мягких тканей в полости рта. Рекомендуется стоматологический осмотр с соответствующим профилактическим стоматологическим лечением и индивидуальная оценка соотношения польза/риск перед началом применения деносумаба.
При оценке риска развития ОНЧ у пациента следует иметь в виду следующие факторы риска:
- эффективность лекарственного средства, приводящего к торможению костной резорбции (более высокий риск в случае применения сильнодействующих лекарственных средств), путь введения (более высокий риск в случае парентерального введения) и суммарная доза лекарственных средств, применяемых для торможения костной резорбции;
- рак, сопутствующие заболевания (например анемия, коагулопатия, инфекция), курение;
- сопутствующая терапия: кортикостероиды, химиотерапия, ингибиторы ангиогенеза, лучевая терапия головы и шеи;
- плохая гигиена полости рта, заболевания пародонта, плохо прилегающие зубные протезы, наличие стоматологического заболевания, инвазивное стоматологическое вмешательство, например удаление зуба.
Все пациенты должны поддерживать достаточную гигиену ротовой полости, проходить периодические стоматологические осмотры и немедленно сообщать о любых симптомах со стороны ротовой полости, таких как подвижность зубов, боль или отек, не заживающие или прорывающиеся язвы во время лечения Иксджева. Во время лечения инвазивные стоматологические процедуры следует проводить только после тщательного рассмотрения, таких процедур следует избегать непосредственно перед началом введения препарата Иксджева.
План ведения отдельных пациентов с ОНЧ должен быть разработан в тесном сотрудничестве лечащим врачом и стоматологом или челюстно-лицевым хирургом, который имеет опыт лечения ОНЧ. Временное прекращение лечения препаратом Иксджева необходимо рассматривать до момента завершения болезни и по возможности уменьшать провоцирующие факторы.
Остеонекроз наружного слухового прохода. В случае применения деносумаба сообщалось об остеонекрозе наружного слухового прохода. Возможными факторами риска воспаления являются применение стероидов и химиотерапия, а также локальные факторы риска, такие как инфекции и травмы. Достоверность остеонекроза наружного слухового прохода следует учитывать у пациентов, получающих деносумаб и имеющих симптоматику со стороны органа слуха, в т.ч. хронические инфекции уха.
Атипичные переломы бедра. Об атипичных переломах бедра сообщалось у пациентов, получавших деносумаб (см. ПОБОЧНЫЕ ЭФФЕКТЫ). Атипичные переломы бедра могут возникать при незначительной травме или при ее отсутствии в субтрохантерной или диафизарной области бедра. Специфические результаты рентгенологического исследования характеризуют эти явления. Также об атипичных переломах бедра сообщалось у пациентов с определенными сопутствующими состояниями (такими как дефицит витамина D, ревматоидный артрит, гипофосфатазия) и при применении определенных лекарств (например бифосфонатов, глюкокортикоидов, ингибиторов протонной помпы). Эти явления также возникали без антирезорбтивной терапии. Аналогичные переломы, о которых сообщалось в связи с приемом бифосфонатов, часто являются билатеральными; таким образом, необходимо обследовать противоположное бедро у пациентов, получающих деносумаб, с подтвержденным переломом тела бедренной кости. Требуется рассмотреть отмену препарата Иксджева для пациентов с подозрением на атипичный перелом бедра при оценке пациента на основе индивидуального соотношения польза/риск. Во время лечения препаратом Иксджева пациентам необходимо рекомендовать сообщать о новой или необычной боли в бедре, тазобедренном суставе или паховой области. Пациентов с такими симптомами требуется проверять на наличие неполного перелома бедра.
Гиперкальциемия после прекращения применения препарата у пациентов с гигантоклеточными опухолями костей, а также с растущей костной системой. О клинически значимой гиперкальциемии, которая нуждалась в госпитализации и осложнялась острым поражением почек, сообщалось при применении препарата Иксджева у пациентов с гигантоклеточными опухолями костей через недели или месяцы после прекращения лечения.
После прекращения лечения необходимо контролировать состояние пациентов в отношении признаков и симптомов гиперкальциемии с периодическим определением уровня кальция в сыворотке крови и повторной оценкой необходимости дополнительного применения препаратов кальция и витамина D (см. ПОБОЧНЫЕ ЭФФЕКТЫ).
Препарат Иксджева не рекомендуется пациентам с развивающейся костной системой (см. ПРИМЕНЕНИЕ). Также сообщалось о клинически существенной гиперкальциемии у этой группы пациентов, возникавшей через промежуток времени от недель до месяцев после прекращения применения препарата.
Другие патологии. Пациенты, получающие препарат Иксджева, не должны одновременно использовать другие лекарственные средства, содержащие деносумаб (в связи с остеопорозом).
Пациенты, получающие препарат Иксджева, не должны одновременно применять бифосфонаты.
Злокачественность гигантоклеточной опухоли или прогрессирование метастазированием возникает нечасто и является известным риском у пациентов с гигантоклеточной опухолью костей. Необходимо проводить контроль состояния пациентов на наличие рентгенологических признаков злокачественности, новых участков просветления или остеолиза. Доступные клинические данные не указывают на повышенный риск злокачественности у пациентов с гигантоклеточной опухолью костей, получающих препарат Иксджева.
Предостережение относительно вспомогательных веществ. Это лекарственное средство содержит сорбит. Пациенты с редкими наследственными проблемами, связанными с непереносимостью фруктозы, не должны применять это лекарственное средство.
Это лекарственное средство содержит менее 1 ммоль натрия (23 мг) на 120 мг, то есть практически свободно от натрия.
Применение в период беременности и кормления грудью
Беременность. Отсутствуют достаточные данные о применении деносумаба беременным. В исследованиях на животных была продемонстрирована репродуктивная токсичность (см. Данные доклинических исследований по безопасности).
Препарат Иксджева не рекомендуется для применения у беременных и женщин репродуктивного возраста, не пользующихся методами контрацепции. Женщинам следует рекомендовать избегать беременности в процессе лечения Иксджева и не менее 5 мес после этого. Любые эффекты препарата Иксджева скорее всего будут сильнее во II и III триместр беременности, поскольку моноклональные антитела свободнее проходят через плаценту в линейном порядке с развитием беременности, при этом наибольшее количество проходит в III триместр.
Грудное вскармливание. Неизвестно, выводится ли деносумаб с грудным молоком человека. Не может быть исключен риск для новорожденных/младенцев. Испытания на мышах с нокаутным геном показали, что отсутствие RANKL в период беременности может влиять на созревание молочных желез, приводя к нарушению лактации после родов (см. Данные доклинических исследований по безопасности). Необходимо принять решение об отказе от грудного вскармливания или отказе от терапии препаратом Иксджева, учитывая пользу грудного вскармливания для новорожденного/ребенка, находящегося на грудном вскармливании, и пользу лечения препаратом Иксджева для женщины.
Репродуктивная функция. Данные о влиянии деносумаба на репродуктивную функцию у человека отсутствуют. Исследования на животных не показали прямых или косвенных вредных воздействий на репродуктивную функцию (см. Данные доклинических исследований по безопасности).
Способность влиять на скорость реакции при управлении транспортными средствами или работе с другими механизмами. Препарат Иксджева не влияет или оказывает незначительное влияние на скорость реакции при управлении транспортными средствами или работе с другими механизмами.
Взаимодействия
исследований взаимодействия не проводили. В клинических исследованиях препарат Иксджева применяли в комбинации со стандартной противоопухолевой терапией и в случаях предварительного лечения бифосфонатами. Не было клинически значимых изменений минимальной концентрации в плазме крови и фармакодинамики деносумаба (N-телопептид мочи с поправкой на показатели креатинина — uNTx/Cr) при одновременном применении химиотерапии и/или гормональной терапии или при предыдущем в/в введении бифосфоната.
Несовместимость. Поскольку исследований совместимости с другими средствами не проводили, этот препарат нельзя применять вместе с другими лекарственными средствами.
Передозировка
опыт передозировки в клинических исследованиях отсутствует. Препарат Иксджева вводили в клинических исследованиях в дозе до 180 мг каждые 4 нед и 120 мг — каждые 3 нед.
Условия хранения
в холодильнике при температуре 2–8 °С в оригинальной упаковке для защиты от света. Не замораживать. Не встряхивать. Хранить в недоступном для детей месте. После извлечения из холодильника хранить при комнатной температуре (до 25 °С) в оригинальной упаковке не более 30 дней и следует использовать в течение этих 30 дней.