Джардинс таблетки, покрытые пленочной оболочкой 10 мг блистер №30
Джардинс инструкция по применению
Состав
Эмпаглифлозин - 10 мг
Фармакологические свойства
фармакодинамика
Механизм действия. Эмпаглифлозин является обратимым высокоактивным (IC50 1,3 нмоль) селективным и конкурентным ингибитором натрий-глюкозного котранспортера 2-го типа (SGLT2). Эмпаглифлозин не ингибирует другие переносчики глюкозы, которые играют важную роль в доставке глюкозы к периферическим тканям; его селективность в 5000 раз выше по сравнению с SGLT1, основным переносчиком, ответственным за абсорбцию глюкозы в кишечнике. SGLT2 в высокой степени экспрессируется в почках, тогда как его экспрессия в других тканях отсутствует или очень низкая. Он отвечает как основной переносчик за реабсорбцию глюкозы из просвета канальцев в кровоток. У пациентов с сахарным диабетом (СД) 2-го типа и гипергликемией фильтруется и абсорбируется большее количество глюкозы.
Эмпаглифлозин улучшает гликемический контроль у пациентов с СД 2-го типа за счет уменьшения реабсорбции глюкозы в почках. Количество глюкозы, выделяемое почками с помощью указанного механизма, зависит от концентрации глюкозы в крови и скорости клубочковой фильтрации (СКФ). Ингибирование SGLT2 у пациентов с СД 2-го типа и гипергликемией способствует выделению избытка глюкозы почками. Кроме того, эмпаглифлозин повышает экскрецию натрия, что ведет к осмотическому диурезу и уменьшению интраваскулярного объема.
У пациентов с СД 2-го типа выведение глюкозы увеличивалось сразу после применения первой дозы эмпаглифлозина, данный эффект сохранялся в течение 24 ч. Увеличение выделения глюкозы почками сохранялось до конца 4-недельного периода лечения и в среднем составило около 78 г/сут. Увеличение выделения глюкозы почками способствовало немедленному снижению уровня глюкозы в плазме крови у пациентов с СД 2-го типа.
Эмпаглифлозин снижает уровень глюкозы в плазме крови как натощак, так и после приема пищи. Механизм действия эмпаглифлозина не зависит от функционального состояния β-клеток и метаболизма инсулина, что способствует снижению риска развития гипогликемии. Отмечен позитивный эффект в отношении маркеров функции β-клеток, в том числе гомеостатической модели оценки функции β-клеток (HOMA-β). Кроме того, выделение глюкозы почками вызывает потерю калорий, что сопровождается уменьшением объема жировой ткани и массы тела. Глюкозурия, отмечаемая при применении эмпаглифлозина, сопровождается умеренным диурезом, что может способствовать долговременному умеренному снижению АД. Глюкозурия, натрийурез и осмотический диурез, которые наблюдаются при применении эмпаглифлозина, могут способствовать улучшению сердечно-сосудистых прогнозов.
Клиническая эффективность и безопасность. Улучшение гликемического контроля и снижение уровня сердечно-сосудистой заболеваемости и смертности является неотъемлемой частью лечения СД 2-го типа.
Применение эмпаглифлозина в качестве монотерапии и в комбинации с метформином, пиоглитазоном, сульфонилмочевиной, ингибиторами DPP-4 и инсулином приводило к клинически значимому снижению уровня HbAlc, глюкозы в плазме крови натощак, массы тела, систолического и диастолического АД. При применении эмпаглифлозина в дозе 25 мг увеличилась доля пациентов, достигших целевого уровня HbA1c <7%, и уменьшилось количество пациентов, нуждающихся в гликемической терапии, по сравнению с применением эмпаглифлозина в дозе 10 мг и плацебо. Чем выше был исходный уровень HbA1c, тем в большей степени происходило его снижение под действием препарата. Кроме того, добавление эмпаглифлозина к стандартной терапии снижает уровень сердечно-сосудистой заболеваемости и смертности у пациентов с СД 2-го типа.
Сердечно-сосудистые прогнозы. В двойном слепом плацебо-контролируемом исследовании EMPA-REG OUTCOME сравнивали эффективность применения эмпаглифлозина в дозе 10 и 25 мг и плацебо в качестве дополнения к стандартной терапии у пациентов с СД 2-го типа и установленными сердечно-сосудистыми заболеваниями.
Эмпаглифлозин продемонстрировал преимущество по сравнению с плацебо относительно основного критерия оценки — снижения частоты случаев смерти в результате сердечно-сосудистых заболеваний, нефатального инфаркта миокарда или нефатального инсульта. Эффект обусловлен значительным снижением сердечно-сосудистой смертности без существенных изменений в отношении нефатального инфаркта миокарда или нефатального инсульта. Снижение сердечно-сосудистой смертности сопоставимо для эмпаглифлозина в дозе 10 и 25 мг (рисунок) и подтверждено улучшением общей выживаемости (табл. 1).
Эффективность предотвращения сердечно-сосудистой смертности не была окончательно установлена у пациентов, принимавших ингибиторы DPP-4, или у пациентов негроидной расы, поскольку представленность этих групп в исследовании EMPA-REG OUTCOME была ограниченной.
Таблица 1. Эффект терапии согласно основным критериям оценки, их компонентам и смертностиа
| Показатель | Плацебо, N=2333 | Эмпаглифлозинb, N=4687 |
|---|---|---|
| Время до возникновения первого летального исхода вследствие сердечно-сосудистых заболеваний, нефатального инфаркта миокарда или нефатального инсульта, N (%) | 282 (12,1) | 490 (10,5) |
| Соотношение рисков по сравнению с плацебо (95,02% ДИ)* | 0,86 (0,74; 0,99) | |
| P-значение для преимущества | 0,0382 | |
| Смерть в результате сердечно-сосудистых заболеваний, N (%) | 137 (5,9) | 172 (3,7) |
| Соотношение рисков по сравнению с плацебо (95% ДИ) | 0,62 (0,49; 0,77) | |
| P-значение | <0,0001 | |
| Нефатальный инфаркт миокарда, N (%) | 121 (5,2) | 213 (4,5) |
| Соотношение рисков по сравнению с плацебо (95% ДИ) | 0,87 (0,70; 1,09) | |
| P-значение | 0,2189 | |
| Нефатальный инсульт, N (%) | 60 (2,6) | 150 (3,2) |
| Соотношение рисков по сравнению с плацебо (95% ДИ) | 1,24 (0,92; 1,67) | |
| P-значение | 0,1638 | |
| Общая смертность, N (%) | 194 (8,3) | 269 (5,7) |
| Соотношение рисков по сравнению с плацебо (95% ДИ) | 0,68 (0,57; 0,82) | |
| P-значение | <0,0001 | |
| Смертность, не связанная с сердечно-сосудистыми заболеваниями, N (%) | 57 (2,4) | 97 (2,1) |
| Соотношение рисков по сравнению с плацебо (95% ДИ) | 0,84 (0,60; 1,16) | |
aДанные, полученные у пациентов, проходивших лечение (то есть лиц, получивших хотя бы одну дозу исследуемого лекарственного средства).
bОбъединенные дозы эмпаглифлозина 10 и 25 мг.
*Поскольку результаты исследования включены в промежуточный анализ, применяется двусторонний доверительный интервал 95,02%, который соответствует значениям p<0,0498 для значимости.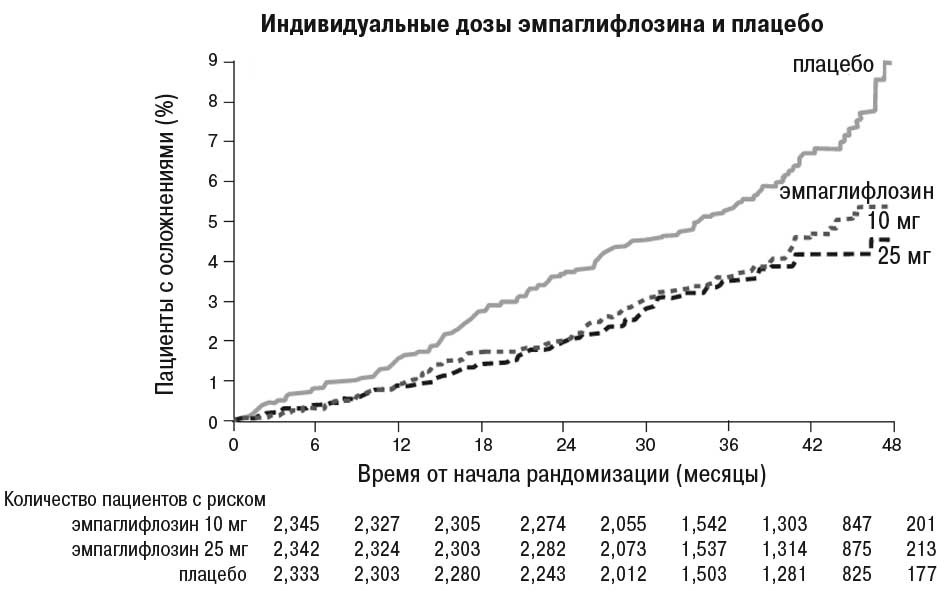
Рисунок. Время до наступления летального исхода в результате сердечно-сосудистых заболеваний в исследовании EMPA-REG OUTCOME
Фармакокинетика
Всасывание. Фармакокинетика эмпаглифлозина подробно описана у здоровых добровольцев и пациентов с СД 2-го типа. После приема эмпаглифлозин быстро всасывался, Cmax в плазме крови достигалась при среднем tmax 1,5 ч после приема препарата. Затем концентрация в плазме крови двухфазно снижалась: с быстрой фазой распределения и относительно медленной конечной фазой. При приеме 1 раз в сутки средние показатели AUC в период устойчивой концентрации в плазме крови составляли 1870 нмоль/ч и Cmax 259 нмоль/л для эмпаглифлозина в дозе 10 мг и 4740 нмоль/ч и 687 нмоль/л для эмпаглифлозина в дозе 25 мг. Выраженность системного действия эмпаглифлозина увеличивалась пропорционально дозе. Фармакокинетические параметры эмпаглифлозина после введения однократной дозы и в период устойчивой концентрации в плазме крови были подобными, что указывает на линейность фармакокинетики во времени. Клинически достоверной разницы в фармакокинетике эмпаглифлозина между здоровыми добровольцами и пациентами с СД 2-го типа не отмечалось.
Введение эмпаглифлозина в дозе 25 мг после приема высококалорийной пищи с высоким содержанием жиров обусловило некоторое снижение его воздействия; AUC снизилась примерно на 16%, а Cmax — примерно на 37% по сравнению с приемом натощак. Это влияние приема пищи на фармакокинетику эмпаглифлозина нельзя считать клинически значимым. Эмпаглифлозин можно принимать независимо от приема пищи.
Распределение. Объем распределения в период устойчивой концентрации в плазме крови составляет 73,8 л. После введения перорального р-ра [14C]-эмпаглифлозина здоровым добровольцам связывание с эритроцитами составляло около 37%, а связывание с белками плазмы крови — 86%.
Биотрансформация. Основные метаболиты эмпаглифлозина в плазме крови человека не выявляли. Наиболее часто выявляемые метаболиты — три конъюгата глюкуронида (2-, 3- и 6-O-глюкуронид). Системное воздействие каждого метаболита составляет менее 10% общего воздействия препарата. Исследования in vitro указывают, что основным путем метаболизма эмпаглифлозина у человека является глюкуронидация с участием уридин-5'-дифосфоглюкуроносилтрансфераз UGT2B7, UGT1A3, UGT1A8 и UGT1A9.
Выведение. Конечный Т½ эмпаглифлозина составляет 12,4 ч, а очевидный пероральный клиренс — 10,6 л/ч. Межсубъектная и остаточная вариабельность клиренса приема эмпаглифлозина составляла 39,1 и 35,8% соответственно. При применении 1 раз в сутки устойчивая концентрация эмпаглифлозина в плазме крови достигалась к 5-й дозе. Соответственно Т½, в период устойчивой концентрации наблюдалось до 22% накопления (относительно AUC в плазме крови). После введения перорального р-ра [14C]-эмпаглифлозина здоровым добровольцам около 96% меченого вещества выводилось с калом (41%) или мочой (54%). Большая часть меченого вещества в неизмененном виде выводилась с калом и примерно половина меченого вещества в неизмененном виде — с мочой.
Особые категории пациентов
Пациенты с почечной недостаточностью. У пациентов с почечной недостаточностью легкой, средней и тяжелой степени тяжести (расчетная скорость клубочковой фильтрации (рСКФ) <30–90 мл/мин/1,73 м2) и у пациентов с почечной недостаточностью/терминальной стадией хронической почечной недостаточности (ТСХПН) значения AUC эмпаглифлозина увеличивались примерно на 18; 20; 66 и 48% соответственно по сравнению с субъектами с нормальной функцией почек. Cmax эмпаглифлозина в плазме крови у пациентов с умеренным нарушением функции почек и почечной недостаточностью/ТСХПН была подобной таковой у субъектов с нормальной функцией почек. Cmax эмпаглифлозина в плазме крови была примерно на 20% выше у пациентов с почечной недостаточностью легкой и тяжелой степени тяжести по сравнению с субъектами с нормальной функцией почек. Исходя из анализа фармакокинетики у субъектов, очевидный пероральный клиренс эмпаглифлозина уменьшается со снижением рСКФ, что обусловливает усиление действия препарата.
Пациенты с печеночной недостаточностью. У пациентов с печеночной недостаточностью легкой, умеренной и тяжелой степени тяжести согласно классификации Чайлда — Пью значения AUC эмпаглифлозина увеличивались примерно на 23; 47 и 75%, а Cmax — примерно на 4; 23 и 48% соответственно по сравнению с субъектами с нормальной функцией печени.
Индекс массы тела (ИМТ). ИМТ не оказывает клинически значимого влияния на фармакокинетику эмпаглифлозина. Значения AUC были на 5,82; 10,4 и 17,3% меньше у пациентов с ИМТ 30; 35 и 45 кг/м2 соответственно по сравнению с пациентами с ИМТ 25 кг/м2.
Пол. Пол не оказывает клинически значимого влияния на фармакокинетику эмпаглифлозина.
Раса. Значения AUC были на 13,5% больше у пациентов монголоидной расы с ИМТ 25 кг/м2 по сравнению с пациентами других рас с таким же ИМТ.
Пациенты пожилого возраста. Возраст не оказывает клинически значимого влияния на фармакокинетику эмпаглифлозина.
Дети. Начато проведение клинических исследований применения эмпаглифлозина у детей в возрасте 10–18 лет с СД 2-го типа. Полученные на сегодня данные по фармакокинетике и фармакодинамике сопоставимы с таковыми у взрослых.
Показания Джардинс
лечение СД 2-го типа у взрослых, если соблюдение диеты и физические упражнения не обеспечивают адекватного контроля гликемии:
- в качестве монотерапии при непереносимости метформина;
- в комбинации с другими гипогликемическими лекарственными средствами.
В отношении результатов исследования комбинированной терапии, контроля гликемии и сердечно-сосудистых осложнений см. ОСОБЫЕ УКАЗАНИЯ, ВЗАИМОДЕЙСТВИЯ и ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА.
Применение Джардинс
дозы. Рекомендованная начальная доза составляет 10 мг эмпаглифлозина 1 раз в сутки в качестве монотерапии и в составе комбинированной терапии с другими лекарственными средствами, применяемыми при СД. У пациентов, которые хорошо переносят эмпаглифлозин в дозе 10 мг 1 раз в сутки, имеют рСКФ ≥60 мл/мин/1,73 м2 и нуждаются в более строгом гликемическом контроле, доза может быть повышена до 25 мг 1 раз в сутки. Максимальная суточная доза составляет 25 мг (см. ОСОБЫЕ УКАЗАНИЯ).
Если эмпаглифлозин применяют в сочетании с сульфонилмочевиной или инсулином, для снижения риска гипогликемии следует рассмотреть возможность применения сульфонилмочевины или инсулина в низких дозах (см. ВЗАИМОДЕЙСТВИЯ и ПОБОЧНЫЕ ЭФФЕКТЫ).
Особые группы пациентов
Пациенты с почечной недостаточностью. Учитывая механизм действия, эффективность эмпаглифлозина зависит от функции почек. Коррекции дозы не требуется для пациентов с рСКФ ≥60 мл/мин/1,73 м2 или клиренсом креатинина (КК) ≥60 мл/мин.
Эмпаглифлозин не следует применять пациентам с рСКФ <60 мл/мин/1,73 м2 или КК <60 мл/мин. Пациентам, которые хорошо переносят эмпаглифлозин и у которых рСКФ стабильно <60 мл/мин/1,73 м2 или КК — <60 мл/мин, дозу эмпаглифлозина следует скорректировать или поддерживать на уровне 10 мг 1 раз в сутки. Эмпаглифлозин следует отменить, если рСКФ стабильно <45 мл/мин/1,73 м2 или КК — <45 мл/мин (см. ОСОБЫЕ УКАЗАНИЯ, ПОБОЧНЫЕ ЭФФЕКТЫ, ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА).
Эмпаглифлозин не следует применять пациентам с ТСХПН или пациентам, получающим диализ, поскольку предполагается, что препарат не будет эффективным у таких пациентов (см. ОСОБЫЕ УКАЗАНИЯ, ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА).
Пациенты с печеночной недостаточностью. Пациентам с печеночной недостаточностью коррекции дозы не требуется. Действие эмпаглифлозина усиливается у пациентов с тяжелой печеночной недостаточностью. Опыт применения эмпаглифлозина у пациентов с тяжелой печеночной недостаточностью ограничен, поэтому препарат не рекомендуется применять у этой категории пациентов (см. ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА).
Пациенты пожилого возраста. Коррекции дозы в связи с возрастом пациента не требуется. У пациентов в возрасте старше 75 лет следует учитывать повышенный риск развития гиповолемии (см. ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА, ПОБОЧНЫЕ ЭФФЕКТЫ). Пациентам в возрасте старше 85 лет применение эмпаглифлозина не рекомендуется ввиду ограниченного опыта применения (см. ОСОБЫЕ УКАЗАНИЯ).
Способ применения. Таблетки можно принимать с едой или независимо от приема пищи, запивая водой, не разжевывая. В случае пропуска дозы ее необходимо принять сразу, как только пациент об этом вспомнит. Не следует принимать двойную дозу препарата в один и тот же день.
Противопоказания
повышенная чувствительность к активному веществу или любому из вспомогательных веществ.
Побочные эффекты
наиболее частой побочной реакцией была гипогликемия при применении с сульфонилмочевиной или инсулином.
Побочные реакции, возникавшие у пациентов, получавших эмпаглифлозин в ходе плацебо-контролируемых исследований, представлены в табл. 2.
Побочные реакции классифицированы по системам органов (согласно MedDRA) и частоте возникновения. Частота возникновения определяется как очень часто (>1/10), часто (>1/100 — <1/10), нечасто (>1/1000 — <1/100), редко (>1/10 000 — <1/1000) или очень редко (<1/10 000) и частота неизвестна (невозможно оценить на основе имеющихся данных).
Таблица 2. Побочные реакции (по данным плацебо-контролируемых исследований)
| Классификация по органам и системам органов | Очень частые | Частые | Нечастые | Редкие | Неизвестные |
|---|---|---|---|---|---|
| Инфекции и инвазии | Вагинальный кандидоз, вульвовагинит, баланит и другие инфекции половых органовa. Инфекции мочевыводящих путей (включая пиелонефрит и уросепсис)a | ||||
| Нарушения обмена веществ и системы пищеварения | Гипогликемия (при применении с препаратами сульфонилмочевины или инсулином)a | Ощущение жажды | Диабетический кетоацидоз* | ||
| Нарушения со стороны кожи и подкожной клетчатки | Зуд (генерализованный) Сыпь | Крапивница | Ангионевротический отек | ||
| Сосудистые нарушения | Уменьшение объема межклеточной жидкостиa | ||||
| Нарушения со стороны почек и мочевыводящих путей | Повышенное выделение мочиa | Дизурия | |||
| Исследования | Повышение уровня липидов в сыворотке кровиb | Повышение уровня креатинина в крови/снижение СКФa Повышение гематокритас | |||
aДополнительную информацию см. в следующих подразделах ниже.
bУвеличение средней доли исходного уровня ХС составило 4,9 и 5,7% для эмпаглифлозина в дозе 10 и 25 мг соответственно по сравнению с 3,5% для плацебо; ХС ЛПВП — 3,3 и 3,6% по сравнению с 0,4%; ХС ЛПНП — 9,5 и 10,0% по сравнению с 7,5%; ТГ — 9,2 и 9,9% по сравнению с 10,5%.
cИзменение среднего значения базового уровня гематокрита составило 3,4 и 3,6% для эмпаглифлозина в дозе 10 и 25 мг соответственно по сравнению с 0,1% для плацебо. В ходе клинических исследований значение гематокрита возвращалось к базовому значению через 30 дней после прекращения приема.
*См. ОСОБЫЕ УКАЗАНИЯ.
Описание отдельных побочных реакций
Гипогликемия. Частота гипогликемии зависела от фоновой терапии при соответствующих исследованиях и была подобной при применении эмпаглифлозина и плацебо в качестве монотерапии, а также в случае добавления эмпаглифлозина к метформину, в случае добавления к пиоглитазону с метформином или без него, в случае добавления к линаглиптину и метформину, а также в случае применения комбинации эмпаглифлозина с метформином у пациентов, впервые получавших лечение, по сравнению с пациентами, которые применяли эмпаглифлозин и метформин как отдельные компоненты ранее. Повышение частоты легкой гипогликемии наблюдалось при введении эмпаглифлозина и плацебо в дополнение к метформину и сульфонилмочевине (эмпаглифлозин 10 мг: 16,1%, эмпаглифлозин 25 мг: 11,5%, плацебо: 8,4%) и в случае добавления к базальному инсулину с метформином или без него и с препаратом сульфонилмочевины или без него (эмпаглифлозин 10 мг: 19,5%, эмпаглифлозин 25 мг: 28,4%, плацебо: 20,6% во время первых 18 нед лечения, когда дозу инсулина нельзя было скорректировать, эмпаглифлозин 10 мг: 36,1%, эмпаглифлозин 25 мг: 36,1%, плацебо: 35,3% в ходе 78-недельного исследования), а также в случае добавления к инсулину в дозированном шприце с метформином или без него (эмпаглифлозин 10 мг: 39,8%, эмпаглифлозин 25 мг: 41,3%, плацебо: 37,2% в течение первых 18 нед лечения, когда дозу инсулина нельзя было скорректировать, эмпаглифлозин 10 мг: 51,1%, эмпаглифлозин 25 мг: 57,7%, плацебо: 58% в ходе 52-недельного исследования).
Тяжелая гипогликемия (гипогликемия, требующая медицинского вмешательства). Повышение частоты тяжелой гипогликемии не выявлено при применении эмпаглифлозина в сравнении с плацебо в виде монотерапии, в случае добавления к метформину, в случае добавления к метформину и препарату сульфонилмочевины и в случае добавления к пиоглитазону с метформином или без него, в случае добавления к линаглиптину и метформину, а также в случае применения комбинации эмпаглифлозина с метформином у пациентов, впервые получавших лечение, по сравнению с пациентами, которые применяли эмпаглифлозин и метформин как отдельные компоненты ранее. Повышение частоты тяжелой гипогликемии отмечали при введении эмпаглифлозина и плацебо в дополнение к базальному инсулину с метформином или без него и с препаратом сульфонилмочевины или без него (эмпаглифлозин 10 мг: 0%, эмпаглифлозин 25 мг: 1,3%, плацебо: 0% в течение первых 18 нед лечения, когда дозу инсулина нельзя было скорректировать; эмпаглифлозин 10 мг: 0%, эмпаглифлозин 25 мг: 1,3%, плацебо: 0% в ходе 78-недельного исследования) и как дополнение к инсулину в дозированном шприце с метформином или без него (эмпаглифлозин 10 мг: 1,6%, эмпаглифлозин 25 мг: 0,5%, плацебо: 1,6% в течение первых 18 нед лечения, когда дозу инсулина нельзя было скорректировать в ходе 52-недельного исследования).
Вагинальный кандидоз, вульвовагинит, баланит и другие инфекции половых органов. Вагинальный кандидоз, вульвовагинит, баланит и другие инфекции половых органов возникали чаще у пациентов, получавших эмпаглифлозин (эмпаглифлозин 10 мг: 4,0%, эмпаглифлозин 25 мг: 3,9%), по сравнению с приемом плацебо (1,0%). Эти инфекции возникали чаще у женщин, получавших эмпаглифлозин, по сравнению с приемом плацебо; у мужчин разница в частоте была менее выраженной. Инфекции половых путей были легкой или умеренной степени тяжести.
Повышенное выделение мочи. Повышенное выделение мочи (оценивались такие симптомы, как поллакиурия, полиурия и никтурия) чаще наблюдалось у пациентов, получавших эмпаглифлозин (эмпаглифлозин 10 мг: 3,5%, эмпаглифлозин 25 мг: 3,3%), по сравнению с приемом плацебо (1,4%). Интенсивность повышения выделения мочи была в основном легкой или умеренной. Частота случаев никтурии была сходной для плацебо и эмпаглифлозина (<1%).
Инфекции мочевыводящих путей. Общая частота инфекций мочевыводящих путей, о которых сообщалось как о нежелательных явлениях, была подобной у пациентов, получавших эмпаглифлозин в дозе 25 мг и плацебо (7,0 и 7,2%), и выше при применении эмпаглифлозина в дозе 10 мг (8,8%). Так же, как и в случае применения плацебо, инфекции мочевыводящих путей чаще возникали при применении эмпаглифлозина у пациентов с хроническими или рецидивирующими инфекциями мочевыводящих путей в анамнезе. Интенсивность (легкая, умеренная, тяжелая) инфекций мочевыводящих путей была подобной у пациентов, получавших эмпаглифлозин и плацебо. Инфекции мочевыводящих путей возникали чаще у женщин, получавших эмпаглифлозин, по сравнению с приемом плацебо; у мужчин разницы не было.
Уменьшение объема межклеточной жидкости. Общая частота уменьшения объема межклеточной жидкости (которая выражалась снижением АД (амбулаторно), систолического АД, обезвоживанием, артериальной гипотензией, гиповолемией, ортостатической гипотензией и обмороком) была подобной у пациентов, получавших эмпаглифлозин (эмпаглифлозин 10 мг: 0,6%, эмпаглифлозин 25 мг: 0,4%) и плацебо (0,3%). Частота случаев гиповолемии была повышенной у пациентов в возрасте старше 75 лет, получавших эмпаглифлозин в дозе 10 мг (2,3%) или эмпаглифлозин в дозе 25 мг (4,3%), по сравнению с приемом плацебо (2,1%).
Повышение уровня креатинина в крови/снижение СКФ. Общая частота повышения уровня креатинина в крови и снижения СКФ была подобной при применении эмпаглифлозина и плацебо (повышение уровня креатинина в крови: эмпаглифлозин в дозе 10 мг: 0,6%, эмпаглифлозин в дозе 25 мг: 0,1%, плацебо: 0,5%, снижение СКФ: эмпаглифлозин в дозе 10 мг: 0,1%, эмпаглифлозин в дозе 25 мг: 0%, плацебо: 0,3%).
Как правило, у пациентов, получавших эмпаглифлозин, при длительном лечении начальное повышение уровня креатинина и снижение СКФ было временным или обратимым после прекращения терапии.
Сообщения о подозреваемых побочных реакциях. Сообщения о побочных реакциях после регистрации лекарственного средства являются важными. Это позволяет продолжать мониторинг соотношения польза/риск применения лекарственного средства. Работники учреждений здравоохранения обязаны сообщать о любых подозреваемых побочных реакциях в соответствии с действующим законодательством.
Особые указания
препарат Джардинс не следует применять у пациентов с СД 1-го типа или для терапии диабетического кетоацидоза.
Диабетический кетоацидоз. Во время клинических исследований и постмаркетингового применения ингибиторов SGLT2 (включая эмпаглифлозин) сообщали о редких случаях диабетического кетоацидоза (ДКА), в том числе представляющих угрозу для жизни. В нескольких случаях ДКА проявлялся атипично, только умеренным повышением уровня глюкозы в крови (<14 ммоль/л (250 мг/дл)). Неизвестно, влияет ли повышение дозы эмпаглифлозина на вероятность возникновения ДКА.
Необходимо учитывать риск ДКА в случае появления таких неспецифических симптомов, как тошнота, рвота, отсутствие аппетита, боль в животе, чрезмерная жажда, затруднение дыхания, спутанность сознания, необычная усталость или сонливость. При возникновении этих симптомов пациентов нужно немедленно обследовать на наличие кетоацидоза независимо от уровня глюкозы в крови.
Если у пациента подозревается или диагностирован ДКА, следует немедленно прекратить применение эмпаглифлозина.
В случае госпитализации пациента для значительных хирургических процедур или при возникновении серьезных острых заболеваний лечение необходимо прекратить. В обоих случаях терапию эмпаглифлозином можно возобновить после стабилизации состояния пациента.
Перед началом применения эмпаглифлозина следует установить наличие в анамнезе пациента факторов, которые могут свидетельствовать о склонности к кетоацидозу.
Высокий риск кетоацидоза отмечают у пациентов с ослабленной функцией β-клеток (например в случае СД 2-го типа с низким уровнем С-пептида, латентного аутоиммунного СД у взрослых или панкреатита в анамнезе); пациенты с состояниями, которые приводят к ограничению приема пищи или сильному обезвоживанию; пациенты, которым снижают дозу инсулина, и пациенты с повышенной потребностью в инсулине в связи с острым заболеванием, хирургическим вмешательством или злоупотреблением алкоголем. У этих пациентов ингибиторы SGLT2 следует применять с осторожностью.
Восстановление терапии ингибиторами SGLT2 у пациентов с ДКА, который наблюдался ранее во время лечения ингибиторами SGLT2, не рекомендуется, если точно не установлен и не устранен другой фактор, провоцирующий ДКА.
Безопасность и эффективность применения эмпаглифлозина для пациентов с СД 1-го типа не были установлены. Эмпаглифлозин не следует применять в лечении пациентов с СД 1-го типа. Ограниченные данные клинических исследований позволяют предположить, что ДКА часто возникает при лечении ингибиторами SGLT2 у пациентов с СД 1-го типа.
Применение у пациентов с почечной недостаточностью. Препарат Джардинс не следует применять у пациентов с рСКФ <60 мл/мин/1,73 м2 или КК <60 мл/мин. У пациентов, которые хорошо переносят эмпаглифлозин и у которых рСКФ стабильно <60 мл/мин/1,73 м2 или КК — <60 мл/мин, дозу эмпаглифлозина следует скорректировать или поддерживать на уровне 10 мг 1 раз в сутки. Эмпаглифлозин следует отменить, если рСКФ стабильно <45 мл/мин/1,73 м2 или КК — <45 мл/мин.
Эмпаглифлозин не следует применять у пациентов с ТСХПН или у пациентов, получающих диализ, поскольку ожидается, что препарат не будет эффективным у этой категории пациентов (см. ПРИМЕНЕНИЕ и Фармакокинетика).
Мониторинг функции почек. Учитывая механизм действия, эффективность эмпаглифлозина зависит от функции почек.
Рекомендуется провести оценку функции почек следующим образом:
- до начала применения эмпаглифлозина и периодически во время лечения, то есть по крайней мере 1 раз в год (см. ПРИМЕНЕНИЕ, Фармакодинамика и Фармакокинетика);
- до начала применения любого сопутствующего лекарственного средства, которое может оказать неблагоприятное влияние на функцию почек.
Поражение печени. Во время клинических исследований при применении эмпаглифлозина отмечались сообщения о поражении печени. Причинно-следственная связь между применением эмпаглифлозина и поражением печени не установлена.
Повышение гематокрита. Во время лечения эмпаглифлозином наблюдается повышение гематокрита (см. ПОБОЧНЫЕ ЭФФЕКТЫ).
Пациенты пожилого возраста. Влияние эмпаглифлозина на выделение глюкозы почками связано с осмотическим диурезом, что может повлиять на состояние гидратации. У пациентов в возрасте старше 75 лет отмечают повышенный риск гиповолемии. У большинства таких пациентов, получавших эмпаглифлозин, отмечались побочные реакции, связанные с уменьшением объема межклеточной жидкости, по сравнению с приемом плацебо (см. ПОБОЧНЫЕ ЭФФЕКТЫ). Поэтому необходимо обратить особое внимание на объем межклеточной жидкости в случае одновременного применения лекарственных средств, которые могут привести к гиповолемии (таких как диуретики, ингибиторы АПФ).
Опыт применения у пациентов в возрасте старше 85 лет ограничен. Применение эмпаглифлозина у этой категории пациентов не рекомендуется (см. Способ применения и дозы).
Применение у пациентов с риском уменьшения объема межклеточной жидкости. Исходя из механизма действия ингибиторов SGLT2, осмотический диурез, сопровождающий лекарственную глюкозурию, может привести к незначительному снижению АД (см. Фармакодинамика). Препарат следует применять с осторожностью у пациентов, для которых снижение АД, обусловленное эмпаглифлозином, может представлять опасность, например пациентам с сердечно-сосудистыми заболеваниями, пациентам, которые применяют антигипертензивные лекарственные средства и имеют артериальную гипотензию в анамнезе, или пациентам в возрасте старше 75 лет.
В случае развития состояний, которые могут привести к потере жидкости (например желудочно-кишечные заболевания), пациентам, получающим эмпаглифлозин, рекомендуется тщательный мониторинг степени уменьшения объема межклеточной жидкости (например проведение физического осмотра, измерение АД, лабораторные тесты, включая уровень гематокрита) и применения электролитов. Следует рассмотреть необходимость временного прекращения лечения эмпаглифлозином до восполнения потери жидкости.
Инфекции мочевыводящих путей. Общая частота инфекций мочевых путей, зарегистрированных как нежелательные явления, была подобной у пациентов, получавших эмпаглифлозин в дозе 25 мг и плацебо, и выше у пациентов, которые получали эмпаглифлозин в дозе 10 мг (см. ПОБОЧНЫЕ ЭФФЕКТЫ). В постмаркетинговых исследованиях наблюдались случаи осложнений в виде инфекций мочеполовых путей, включая пиелонефрит и уросепсис, у пациентов, получавших лечение эмпаглифлозином. Следует рассмотреть необходимость временного прекращения терапии эмпаглифлозином для пациентов с осложненными инфекциями мочевыводящих путей.
Ампутация нижних конечностей. В ходе исследования с другим ингибитором SGLT2 наблюдалось увеличение числа случаев ампутации нижних конечностей (в первую очередь пальца ноги). Неизвестно, является ли это эффектом, присущим данному классу лекарственных средств. Пациентам с СД необходимо рекомендовать проведение профилактики заболеваний стоп.
Сердечная недостаточность. Опыт применения эмпаглифлозина у пациентов с сердечной недостаточностью класса I–II по классификации NYHA ограничен, и опыт клинических исследований применения эмпаглифлозина у пациентов с сердечной недостаточностью класса ІІI–IV по NYHA отсутствует. В ходе клинических исследований сообщалось о 10,1% пациентов с сердечной недостаточностью в начальной стадии. Снижение кардиоваскулярной смертности у этих пациентов было сопоставимо с таковым в общей популяции.
Лабораторные анализы мочи. У пациентов, которые принимают Джардинс, тест на определение глюкозы в моче будет положительным в связи с механизмом действия препарата.
Лактоза. Данное лекарственное средство содержит лактозу. Пациентам с редкой наследственной непереносимостью галактозы, лактазной недостаточностью или глюкозо-галактозной мальабсорбцией данный препарат принимать не следует.
Применение в период беременности и кормления грудью.
Беременность. Данных по применению эмпаглифлозина у беременных нет. В качестве меры предосторожности желательно избегать применения препарата Джардинс в период беременности.
Период кормления грудью. Неизвестно, проникает ли эмпаглифлозин в человеческое грудное молоко. Препарат Джардинс не следует применять в период кормления грудью.
Репродуктивная функция. Исследования влияния препарата Джардинс на фертильность у людей не проводились.
Дети. Безопасность и эффективность применения эмпаглифлозина у детей (в возрасте до 18 лет) не изучались, препарат не применяют у этой категории пациентов.
Способность влиять на скорость реакции при управлении транспортными средствами или другими механизмами. Препарат Джардинс оказывает незначительное влияние на способность управлять транспортными средствами и работать с другими механизмами. Однако пациентов следует информировать о риске гипогликемии, если Джардинс применяют в сочетании с препаратами сульфонилмочевины и/или инсулином.
Взаимодействия
фармакодинамические взаимодействия
Диуретики. Эмпаглифлозин может усиливать мочегонный эффект тиазидных и петлевых диуретиков и повысить риск развития дегидратации и артериальной гипотензии (см. ОСОБЫЕ УКАЗАНИЯ).
Инсулин и стимуляторы секреции инсулина. Инсулин и стимуляторы секреции инсулина, такие как сульфонилмочевина, могут повысить риск гипогликемии. Для снижения риска гипогликемии может быть рекомендовано снижение дозы инсулина или стимулятора секреции инсулина при применении в комбинации с эмпаглифлозином (см. ПРИМЕНЕНИЕ и ПОБОЧНЫЕ ЭФФЕКТЫ).
Фармакокинетические взаимодействия
Влияние других лекарственных средств на эмпаглифлозин. Данные іn vitro указывают, что основным путем метаболизма эмпаглифлозина у человека является глюкуронидация с участием уридин-5-дифосфоглюкуроносилтрансфераз UGT1A3, UGT1A8, UGT1A9 и UGT2B7. Эмпаглифлозин является субстратом транспортеров поглощения у человека OAT3, OATP1B1 и OATP1B3, но не OAT1 и OCT2. Эмпаглифлозин транспортируется при участии Р-гликопротеина (P-gp) и белка резистентности рака молочной железы (BCRP).
Одновременное применение эмпаглифлозина с пробенецидом, ингибитором ферментов уридиндифосфат-глюкуронилтрансферазы (UGT) и OAT3, привело к увеличению Cmax эмпаглифлозина на 26% и AUC на 53%. Эти изменения не считались клинически значимыми.
Влияние индукции UGT на эмпаглифлозин не изучали. Одновременное применение с известными индукторами ферментов UGT не рекомендуется вследствие потенциального риска снижения эффективности.
Исследование in vitro взаимодействия с гемфиброзилом, ингибитором транспортеров OAT3 и OATP1B1/1B3, показало, что после сочетанного применения Cmax эмпаглифлозина повышалась на 15%, а AUC уменьшалась на 59%. Эти изменения не считались клинически значимыми.
Ингибирование транспортеров OATP1B1/1B3 при одновременном применении с рифампицином обусловило повышение Cmax на 75% и увеличение AUC эмпаглифлозина на 35%. Эти изменения не считались клинически значимыми.
Влияние эмпаглифлозина при одновременном применении с верапамилом, ингибитором P-gp, и отдельно было подобным. Это указывает на то, что ингибирование P-gp не оказывает клинически значимого влияния на эмпаглифлозин.
Исследования взаимодействия, проведенные с участием здоровых добровольцев, указывают на то, что на фармакокинетику эмпаглифлозина не влияет сопутствующее введение метформина, глимепирида, пиоглитазона, ситаглиптина, линаглиптина, варфарина, верапамила, рамиприла, симвастатина, торасемида и гидрохлоротиазида.
Влияние эмпаглифлозина на другие лекарственные средства. По данным исследований in vitro, эмпаглифлозин не ингибирует, не инактивирует и не индуцирует изоформы CYP 450. Эмпаглифлозин не ингибирует UGT1A1, UGT1A3, UGT1A8, UGT1A9 или UGT2B7. Межлекарственные взаимодействия с участием основных изоформ CYP 450 или UGT с эмпаглифлозином и параллельно введенными субстратами этих ферментов считаются маловероятными.
Эмпаглифлозин не ингибирует P-gp в терапевтических дозах. По данным исследований in vitro, маловероятна способность эмпаглифлозина вступать во взаимодействия с препаратами, которые являются субстратами P-gp. Одновременное применение дигоксина, субстрата P-gp, и эмпаглифлозина обусловило увеличение AUC дигоксина на 6% и Cmax на 14%. Эти изменения не считались клинически значимыми.
Эмпаглифлозин не ингибирует in vitro транспортеры поглощения у человека, такие как OAT3, OATP1B1 и OATP1B3, в клинически значимых концентрациях, то есть межлекарственное взаимодействие с субстратами этих транспортеров поглощения считается маловероятным.
Исследования взаимодействия, проведенные с участием здоровых добровольцев, указывают на то, что эмпаглифлозин не оказывает клинически значимого эффекта в отношении фармакокинетики метформина, глимепирида, пиоглитазона, ситаглиптина, линаглиптина, симвастатина, варфарина, рамиприла, дигоксина, диуретиков и пероральных контрацептивов.
Передозировка
симптомы. В ходе контролируемых клинических исследований разовые дозы эмпаглифлозина до 800 мг (эквивалентно 32-кратной максимальной рекомендуемой суточной дозе) у здоровых добровольцев и несколько ежедневных доз эмпаглифлозина до 100 мг (эквивалентно 4-кратной максимальной рекомендуемой суточной дозе) у пациентов с СД 2-го типа не вызвали каких-либо токсических явлений. Эмпаглифлозин усиливал выделение глюкозы почками, что вело к увеличению объема мочи. Выявленное увеличение объема мочи не зависело от дозы и не было клинически значимым. Опыт применения доз выше 800 мг у людей отсутствует.
Лечение. В случае передозировки лечение следует начинать в соответствии с клиническим состоянием пациента. Выведение эмпаглифлозина путем гемодиализа не изучалось.
Условия хранения
при температуре не выше 25 °С.
