Форма випуску
Склад i формула
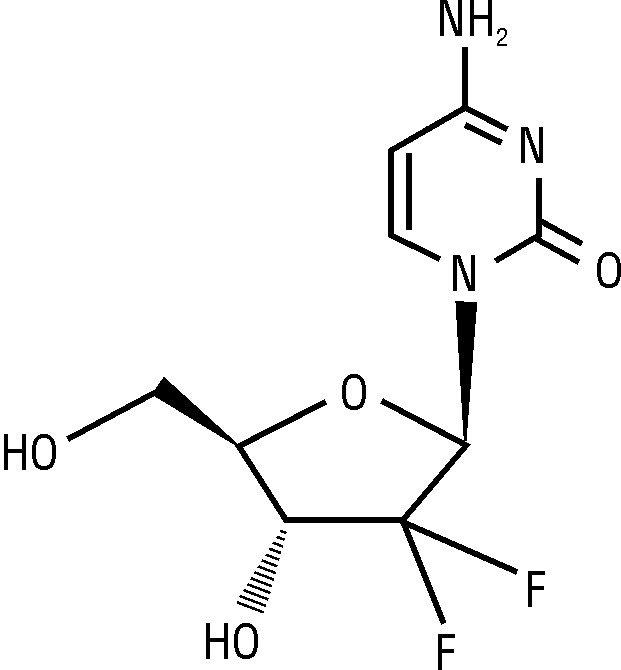
NLM: 2’,2’-дифлуородеоксицитидин.
Фармакологічні властивості
має клітинно-фазову специфічність, знищуючи клітини, що проходять фазу синтезу ДНК (S-фаза), за певних умов блокує проходження клітин через межу фази G1/S; dFdC піримідиновий антиметаболіт, метаболізується внутрішньоклітинно під впливом нуклеозидкінази до активних дифосфатних (dFdCDP) і трифосфатних (dFdCTP) нуклеозидів; цитотоксична дія гемцитабіну зумовлена інгібуванням синтезу ДНК двома активними метаболітами-дифосфатним і трифосфатним нуклеозидами; дифосфатний нуклеозид інгібує рибонуклеотидредуктазу, яка каталізує реакції, внаслідок чого утворюються дезоксинуклеозидтрифосфати (dCTP) для синтезу ДНК, що спричиняє зменшення концентрації дезоксинуклеозидів узагалі і особливо концентрації dCTP; dFdCTP конкурують з dCTP при побудові ДНК; зменшення внутрішньоклітинної концентрації dCTP посилює приєднання трифосфатних нуклеозидів до ланцюга ДНК; іпсилон ДНК-полімерази неспроможні усувати гемцитабін і відновлювати ланцюги ДНК, що синтезуються; після приєднання внутрішньоклітинних метаболітів гемцитабіну до ланцюгiв ДНК, які синтезуються, долучається один додатковий нуклеотид, що призводить до повного інгібування подальшого синтезу ДНК (приховане закінчення ланцюга) і зaпрограмованої загибелі клітини, відомої як апоптоз.
Показання
у комбінації з цисплатином для лікування локально рецидивуючого чи метастатичного раку сечового міхура; локально прогресуючої чи метастатичної аденокарциноми підшлункової залози; у комбінації з цисплатином як препарат першої лінії для лікування пацієнтів з локально прогресуючим чи метастатичним недрібноклітинним раком легень; як монотерапія для лікування пацієнтів літнього віку та пацієнтів із другим функціональним статусом; у комбінації з карбоплатином для лікування локально прогресуючої чи метастатичної епітеліальної карциноми яєчників; рецидив епітеліальної карциноми яєчників після періоду ремісії, що становив не менше 6 міс. після попередньої терапії у першій лінії препаратами платини; у комбінації з паклітакселом для лікування хворих на неоперабельний, локально рецидивуючий чи метастатичний рак молочної залози після попередньої ад’ювантної/неоад’ювантної хіміотерапії, попередня хіміотерапія повинна включати антрациклін, якщо немає протипоказань; лікування хворих на рак жовчних протоків.
Застосування
застосування у дорослих: рак сечового міхура: комбіноване застосування - рекомендована доза - 1000 мг/м2, вводити шляхом в/в 30-хв. інфузії у 1-й, 8-й і 15-й дні кожного 28-денного циклу у комбінації з цисплатином, що дається рекомендованою дозою 70 мг/м2 у 1-й день після гемцитабіну або в 2-й день кожного 28-денногo циклу; потім цей 4-тижневий цикл повторюється. Рак підшлункової залози - рекомендована доза 1000 мг/м2, в/в вливання впродовж 30 хв. 1 р/тиждень впродовж 7 тижнів, після чого - тижнева перерва; наступні цикли складаються зі щотижневиx інфузій впродовж 3 тижнів поспіль з перервою кожного 4-го тижня. Рак легенів недрібноклітинний: монотерапія - рекомендована доза - 1000 мг/м2 вводити шляхом 30-хв. в/в інфузії 1 р/тиждень впродовж 3 тижнів, після чого робиться однотижнева перерва; чотиритижневий цикл повторюється; комбіноване застосування - рекомендована доза - 1250 мг/м2 поверхні тіла, в/в інфузія впродовж 30 хв. у 1-й та 8-й дні кожного 21-денного циклу; цисплатин вводити рекомендованою дозою 75-100 мг/ м2 1 р/3 тижні циклу. Рак молочної залози: комбіноване застосування - паклітаксел (175 мг/м ) вводити у 1-й день впродовж 3-годинної в/в інфузії, після нього вводити гемцитабін (1250 мг/м ) впродовж 30-хв.в/в інфузії у 1-й і 8-й дні кожного 21-денного циклу. Рак яєчників: комбіноване застосування - рекомендовано вводити гемцитабін 1000 мг/м шляхом 30-хв. в/в вливання у 1-й та 8-й дні 21-денного циклу; у 1-й день циклу після гемцитабіну вводити карбоплатин у дозі, що забезпечує AUC 4 мг/мл/хв. Рак жовчних протоків: монотерапія - рекомендована доза - 1000 мг/м2, в/в впродовж 30 хв.; інфузію проводити 1 р/тиждень 3 тижні поспіль, потім 1 тиждень перерва; цей чотиритижневий цикл повторювати. Комбіноване застосування - цисплатин 70 мг/м2 у 1-й день циклу шляхом в/в інфузії, далі вводити гемцитабін у дозі 1250 мг/м2, в 1-й та 8-й дні кожного 21-денного циклу шляхом 30-хв.в/в інфузії; цей 3-тижневий цикл повторювати.
Протипоказання
підвищена чутливість до діючої речовини або до будь-якої з допоміжних речовин; період годування груддю.
Побічна дія
нудота, блювання, підвищення рівня печінкових трансаміназ (АлАт, АсАт), лужної фосфатази, підвищення рівнів білірубіну; протеїнурія, гематурія, задишка; алергічні висипання, свербіж; гpипоподібні симптоми, пропасниця, головний біль, озноб, міалгія, біль у спині; астенія, анорексія, діарея, стоматит, запор; кашель, риніт, нездужання, пітливість, розлади сну; облисіння, набряки; лейкопенія, пригнічення кісткового мозку, тромбоцитопенія, анемія, фебрильна нейтропенія, тромбоцитоз; анафілактоїдні реакції, порушення мозкового кровообігу, с-м зворотної задньої енцефалопатії, аритмії, СН, ІМ, периферичний васкуліт, гангрена, артеріальна гіпотензія, с-м «капілярного просочування»; інтерстиціальний пневмоніт, бронхоспазм, набряк легень, дистрес-синдром; ішемічний коліт, гепатотоксичність, печінкова недостатність, підвищення рівнів гамма-глутамілтрансферази (GGT); токсичний епідермальний синдром, с-м Стівенса-Джонсона; ниркова недостатність. гемолітичний уремічний с-м, шкірні реакції у місці ін’єкції; радіотоксичність, «радіаційна пам’ять».