Пароксизмальные нарушения сердечного ритма — одна из наиболее острых проблем современной кардиологии. По данным ACC они ежегодно уносят от 300 до 600 тыс. жизней, что составляет 1 смерть каждую минуту. Большинство больных — лица трудоспособного возраста. Как правило, к такому фатальному исходу, как остановка кровообращения, приводят желудочковая фибрилляция (75%), асистолия (20%) и электромеханическая диссоциация (5%), причем доля выживших пациентов, перенесших хотя бы однократно эпизод вышеуказанных ситуаций, достаточно невелика — 19% общего количества. С другой стороны, относительно более благоприятное течение пароксизмальных нарушений сердечного ритма может осложнять множество заболеваний. Пароксизмальные суправентрикулярные тахиаритмии составляют 4/5 общего числа тахикардий. Они занимают промежуточное место между потенциально летальными аритмиями и доброкачественными нарушениями сердечного ритма.
Пароксизмальные суправентрикулярные тахиаритмии имеют следующие характеристики:
1) внезапное начало и окончание приступа;
2) обычно регулярный ритм с незначительными колебаниями частоты;
3) ЧСС 100–250 уд./мин, обычно — 140–220 уд./мин;
4) частота сокращений желудочков соответствует частоте сокращений предсердий или меньше при наличии АV-блокады;
5) комплексы QRS, как правило, узкие, но при аберрантном проведении могут расширяться. Основные механизмы развития пароксизмальных аритмий включают re-entry, эктопический автоматизм и триггерную активность.
ТАХИКАРДИИ С УЗКИМИ КОМПЛЕКСАМИ QRS
В основе тахиаритмий лежит один или несколько механизмов, включая нарушение формирования импульса и нарушение проведения импульса (циркуляция волны возбуждения — re-entry). Ткани с аномальным автоматизмом, лежащим в основе механизма наджелудочковых тахиаритмий, могут находиться в предсердиях, AV-соединении или в мышечных муфтах сосудов, которые непосредственно вступают в контакт с предсердиями, таких как верхняя и нижняя полые вены или легочные вены. Клетки с повышенным автоматизмом обладают более высокой скоростью 4 фазы диастолической деполяризации и, следовательно, повышенной скоростью формирования импульса по сравнению с основным водителем ритма — синусовым узлом. Если скорость формирования импульса в эктопическом очаге превышает таковую в синусовом узле, то эктопический очаг становится доминирующим очагом автоматизма сердца, подавляя активность синусового узла. Активность эктопического очага может быть устойчивой (доминирует большую часть времени в течение суток) или неустойчивой.
Пусковой (триггерный) механизм тахикардии связан с нарушением фазы реполяризации. Триггерные ритмы возникают в результате прерывания фазы реполяризации сердечной клетки, это явление называется «постдеполяризацией». Если величина постдеполяризации достигает «порогового» значения, то возникает ранний ПД в фазу реполяризации.
Наиболее распространенный механизм аритмии — повторный вход импульса в один и тот же участок миокарда, который может проявляться в различных формах. Самая простая форма — это циркуляция электрического импульса вокруг определенного участка миокарда. Этот механизм возникновения повторного входа возбуждения называют «re-entry». Для возникновения и поддержания re-entry требуется ряд условий. Для возникновения кругового движения тахикардии необходим однонаправленный блок проведения в одном из участков круга re-entry. Однонаправленный блок может быть следствием повышения ЧСС или возникновения преждевременного импульса (экстрасистолы), который изменяет рефрактерный период одного из участков петли re-entry. Замедление проведения необходимо как для инициации, так и для поддержания кругового движения импульса. В случае ортодромной АV-реципрокной тахикардии (то есть антероградное проведение импульса происходит через АV-узел, а ретроградное проведение — по дополнительному пути), замедление проведения через АV-узел дает возможность дополнительному пути восстановиться, то есть выйти из периода рефрактерности.
Тахикардия с узкими комплексами QRS (комплекс QRS <120 мс) может быть вызвана формированием импульсов в синусовом узле (синусовая тахикардия), петлей re-entry в синусовом узле или прилежащем участке предсердия (синусовая реципрокная тахикардия), в предсердии (предсердная тахикардия, трепетание и фибрилляция предсердий, в области АV-узел — пучок Гиса (тахикардия АV-соединения), а также в результате re-entry, возникающего в АV-узле или в переходной зоне по периметру АV-узла — АV-узловая реципрокная тахикардия (АВУРТ), или re-entry, при котором АV-узел и пучок Гиса образуют путь антероградного АV-проведения, а дополнительный АV-путь обеспечивает ретроградное проведение ортодромная АV-реципрокная тахикардия. Реже замедление проведения импульса во внутрижелудочковой специализированной проводящей системе может приводить к формированию желудочковой тахикардии с комплексами продолжительностью <120 мс (фасцикулярная тахикардия). Довольно часто тщательный анализ ЭКГ в 12 отведениях, особенно если удается зарегистрировать ее в ходе массажа каротидного синуса или другой вагусной пробы, облегчает установление правильного диагноза. Правильная идентификация места возникновения предсердной активности, ее частоты и связи с желудочковым ритмом имеет важное значение.
В ходе типичной предсердной тахикардии предсердная активность предшествует каждому комплексу QRS. Поскольку интервал P–R может меняться в соответствии со способностью АV-узла к проведению и частотой предсердной тахикардии, обычно волна Р расположена во второй половине цикла тахикардии, при этом интервал P–R короче, чем интервал R–P’. Важно, что предсердная тахикардия может продолжаться, несмотря на развитие АV-блокады, поскольку активация желудочков не является обязательной частью петли тахикардии. Четыре других вида тахикардии с узкими комплексами QRS, при которых интервал R–P’ обычно превышает интервал P–R, включают синусовую реципрокную тахикардию, неправильную синусовую тахикардию, атипичную АV-реципрокную тахикардию, а также перманентную (непароксизмальную) форму реципрокной тахикардии АV-соединения. АV-блокада при продолжающейся тахикардии может возникать в случае re-entry в синусовом узле, синусовой тахикардии и атипичном АV-узловом re-entry. Антероградное проведение через быстрый проводящий путь АV-узла и ретроградное проведение через медленный проводящий путь АV-узла образуют петлю повторного входа для атипичного АV-узлового reentry, в то время как антероградное проведение через АV-узел и ретроградное проведение через медленный дополнительный проводящий путь обеспечивают петлю дпя непароксизмальной АV-реципрокной тахикардии. У некоторых пациентов, у которых волна Р’ расположена в середине сердечного цикла, отмечается АV-узловое re-entry с двумя медленными проводящими путями, один антероградный, а другой ретроградный, так называемое медленно-медленное (slow-slow) АV-узловое проведение.
При типичной тахикардии АV-узлового reentry предсердия и желудочки активируются одновременно в связи с антероградным проведением через медленный проводящий путь и ретроградным проведением через быстрый проводящий путь. Ретроградная волна Р’ «скрывается» комплексом QRS или прорисовывается в конечной части комплекса QRS. Может отмечаться АV-блокада при продолжающейся тахикардии. При ортодромной АV-реципрокной тахикардии петля тахикардии формируется антероградным проведением через АV-узел и ретроградным проведением через дополнительный АV-путь. Ретроградная активация предсердий следует за комплексом QRS, а волна Р’ расположена на сегменте ST. Тахикардия не может продолжаться при наличии АV-блокады. В обоих случаях, при АV-узловом re-entry и АV-реципрокной тахикардии, ретроградные волны Р’ отмечаются в первой половине цикла тахикардии, так что интервал R–P короче интервала P–R.
При тахикардии с узкими комплексами QRS может отмечаться АV-диссоциация. Если это происходит, тахикардия чаще всего исходит из АV-узла — пучка Гиса или дистальных отделов пучка Гиса.
Дифференциальная диагностика тахикардии с узкими комплексами QRS
Пациентам необходимо выполнить ЭКГ в 12 стандартных отведениях в состоянии покоя. Выявление синдрома предвозбуждения желудочков (дельта-волны) на ЭКГ у пациентов с анамнезом пароксизмов ритмичного сердцебиения достаточно для постановки диагноза WPW-синдрома, и нет необходимости регистрации спонтанных эпизодов тахикардии для назначения терапии (схема 5.1).
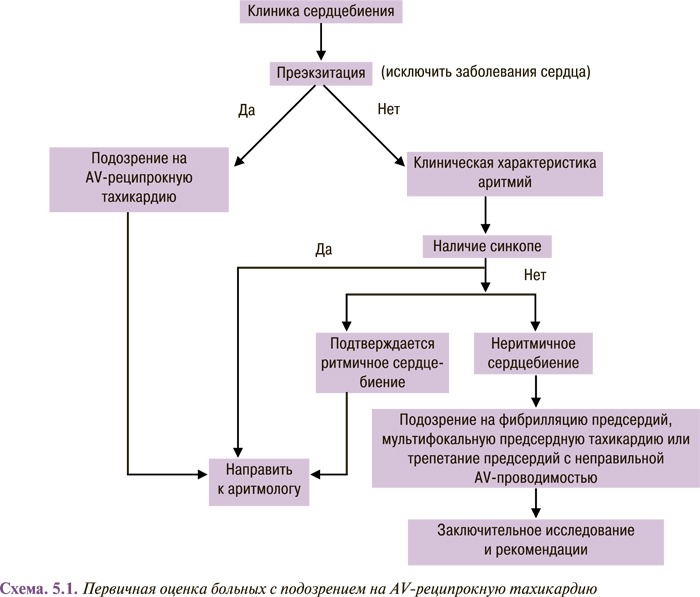
Клинический анамнез ритмичных и неритмичных сердцебиений у пациентов с установленным синдромом предвозбуждения желудочков указывает на эпизоды фибрилляции предсердий, что требует проведения ЭФИ, поскольку у этих пациентов отмечают высокий риск внезапной смерти. В других случаях диагноз устанавливают на основании тщательного анализа ЭКГ (в 12 отведениях), снятой во время тахикардии. Поэтому пациентам с длительной аритмией в анамнезе целесообразно иметь, по крайней мере, одну ЭКГ В 12 отведениях, снятую во время пароксизма аритмии. Автоматические системы анализов ЭКГ ненадежны, что затрудняет установление точного аритмического диагноза.
При узких комплексах QRS (<120 мс) тахикардия почти всегда является наджелудочковой (схема 5.2). Если отсутствуют зубцы Р или имеются явные признаки предсердной активности, а интервалы R–R одинаковы, то, вероятнее всего, это АV-узловая реципрокная тахикардия. Зубец Р’ при АV-узловой реципрокной тахикардии может частично скрываться внутри комплекса QRS или деформировать комплекс QRS, имитируя псевдозубец R в отведении V1 и/или псевдозубец S в нижних отведениях. Если зубец Р’ выявляется на сегменте ST и отстоит от комплекса QRS >70 мс, то скорее всего, это AV-реципрокная тахикардия. Если при тахикардии интервал R–P длиннее интервала P–R, то более вероятный диагноз — «атипичная АV-узловая реципрокная тахикардия» (постоянная форма узловой реципрокной тахикардии либо АV-реципрокная тахикардия через медленно проводящий дополнительный путь) или «предсердная тахикардия».
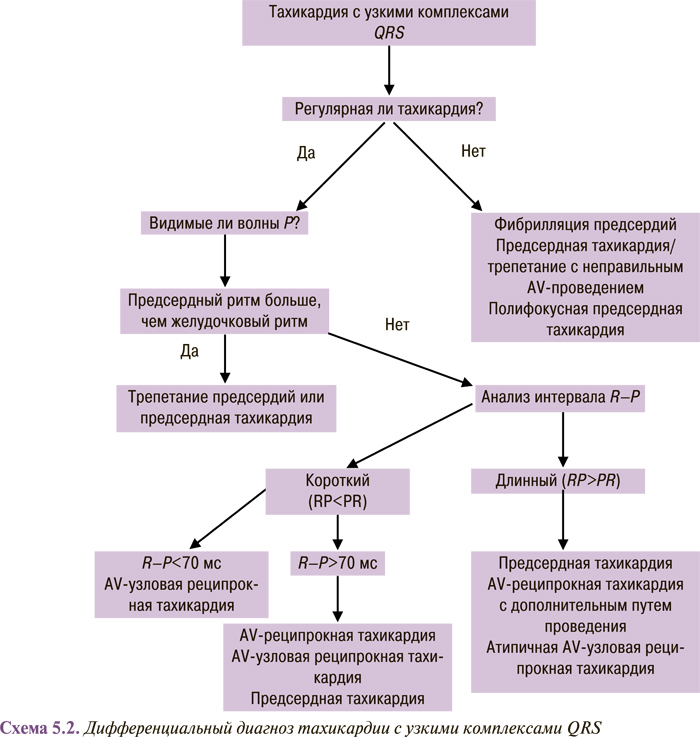
В дифференциальной диагностике могут помочь реакции тахикардии с узкими комплексами QRS на аденозин фосфат или массаж каротидного синуса. При введении аденозин фосфата и массаже каротидного синуса желательно снятие ЭКГ в 12 отведениях. Если зубцы Р’ не видны, то может также оказаться полезным использование пищеводных электродов.
Фокусная узловая тахикардия у пациентов может имитировать образец АV-узловой реципрокной тахикардии и может демонстрировать АV-диссоциацию и/или при этом отмечается регулярный ритм.
Неотложная терапия при тахикардии с узкими комплексами QRS
Для купирования тахикардии с узкими комплексами QRS следует начать с вагусных приемов (проба Вальсальвы, массаж каротидного синуса, погружение лица в холодную воду и т.д.), влияющих на АV-проводимость. При отсутствии положительного эффекта пациентам со стабильной гемодинамикой следует начать внутривенное введение противоаритмических лекарственных средств. Препаратами выбора являются аденозин фосфат или антагонисты кальциевых каналов негидропиридинового ряда. Преимущество аденозин фосфата по сравнению с блокаторами кальциевых каналов или блокаторами β-адренорецепторов при внутривенном введении состоит в его быстром начале действия и коротком периоде полувыведениия. Поэтому чаще всего предпочтение отдается внутривенному введению аденозин фосфата, исключая пациентов с тяжелой формой БА. Больным, получающим теофиллин, для достижения эффекта может потребоваться применение аденозин фосфата в более высоких дозах, а дипиридамол потенцирует действие аденозин фосфата. Кроме того, может нарастать степень АV-блокады в тех случаях, когда аденозин фосфат назначают пациентам, принимающим карбамазепин. Применение препаратов длительного действия (блокаторы кальциевых каналов или блокаторы β-адренорецепторов) предпочтительнее у пациентов с частыми предсердными или желудочковыми экстрасистолами, которые являются пусковым механизмом непароксизмальных желудочковых тахикардий. Аденозин фосфат или электроимпульсная терапия (кардиоверсия) является методом выбора у лиц с гемодинамически значимой непароксизмальной желудочковой тахикардией. Аденозин фосфат может спровоцировать фибрилляцию предсердий в 1–15% случаев, которая обычно носит временный характер, но может быть угрожающей для жизни у пациентов с синдромом предвозбуждения желудочков. Необходимо соблюдать крайнюю осторожность при одновременном внутривенном назначении блокаторов кальциевых каналов и блокаторов β-адренорецепторов, поскольку существует опасность появления гипотензии и/или брадикардии. Во время выполнения вагусных приемов или введения препаратов целесообразна регистрация ЭКГ, поскольку реакция на них может помочь в диагностике, даже если аритмия не прекратилась. Купирование тахикардии с зубцом Р’, расположенным после комплекса QRS, предполагает диагноз АV-реципрокной тахикардии или АV-узловой реципрокной тахикардии. Предсердная тахикардия часто нечувствительна к аденозин фосфату. Трансформация в тахикардию с АV-блокадой фактически указывает на предсердную тахикардию или трепетание предсердий (в зависимости от интервала Р–Р или F–F), исключает АV-реципрокную тахикардию и делает АV-узловую реципрокную тахикардию маловероятной (табл. 5.1).
Таблица 5.1
Рекомендации по неотложной помощи при гемодинамически стабильной суправентрикулярной тахикардии
| ЭКГ-признаки | Рекомендации | Эффективность |
| Узкий комплекс QRS | Вагусные пробы
Аденозин фосфат Верапамил, дилтиазем Блокаторы β-адренорецепторов |
Высокоэффективно
Высокоэффективно Высокоэффективно Малоэффективно Малоэффективно Малоэффективно |
Тахикардии с широкими комплексами QRS
|
Вагусные пробы
Аденозин фосфат Верапамил, дилтиазем Блокаторы β-адренорецепторов Амиодарон Дигоксин Электрическая кардиоверсия Прокаинамид Ибутилид Прокаинамид Амиодарон Электрическая кардиоверсия Аденозин фосфат Блокаторы β-адренорецепторов |
Высокоэффективно
Высокоэффективно Высокоэффективно Малоэффективно Малоэффективно Высокоэффективно Высокоэффективно Высокоэффективно Высокоэффективно Высокоэффективно Высокоэффективно Высокоэффективно Высокоэффективно Высокоэффективно Малоэффективно Малоэффективно Не показаны Не показан |
| Тахикардии с широким комплексом QRS неизвестного происхождения у пациентов с нарушенной функцией ЛЖ | Амиодарон
Электрическая кардиоверсия |
Высокоэффективно
Высокоэффективно Высокоэффективно |
Синоатриальная (СА) тахикардия возникает по механизму re-entry с циркуляцией волны возбуждения в синоатриальной зоне (синусовый узел, миокард правого предсердия). Представляет собой приступообразное учащение ритма с ЧСС 100-200 уд./мин, характеризуется внезапным началом и внезапным прекращением.
Критериями СА тахикардии являются:
1) правильный ритм с ЧСС 100–200 уд./мин;
2) зубец Р на ЭКГ практически не отличается от синусового Р.
Предсердная тахикардия — это нарушение ритма, возникающее по механизму эктопического автоматизма.
ЭКГ-критерии:
1) правильный ритм с частотой сокращения предсердий 150–250 уд./мин;
2) зубцы Р по конфигурации отличаются от синусовых;
3) начало тахикардии характеризуется в ряде случаев постепенным учащением ритма.
Наибольшее клиническое значение имеют АV-узловые реципрокные тахикардии. Электрофизиологической основой пароксизмальной АV-узловой тахикардии является наличие внутри узла двух путей проведения, обладающих различными функциональными свойствами. Один из этих путей (быстрый) проводит импульсы от предсердий к желудочкам с большей скоростью и имеет большую продолжительность эффективного рефрактерного периода. Другой путь (медленный) проводит импульс с меньшей скоростью и имеет меньшую продолжительность эффективного рефрактерного периода. Эти два пути замыкают кольцо циркуляции волны возбуждения. При нормальном синусовом ритме импульс обычно проводится через быстрый путь, поэтому функционирование медленного пути АV-узла на ЭКГ не проявляется. При возникновении пароксизмальной АV-узловой тахикардии импульс проводится по медленному пути к желудочкам и возвращается к предсердиям по быстрому пути. В связи с тем, что возбуждение желудочков и предсердий во время пароксизма тахикардии наступает почти одновременно, на ЭКГ редко удается зарегистрировать зубцы Р. Они, как правило, сливаются с желудочковыми комплексами. Если зубцы Р все же удается определить, то они отрицательны во II, III и aVF-отведениях, что указывает на ретроградное возбуждение предсердий.
Пароксизмальная АV-реципрокная тахикардия с участием дополнительных путей проведения возникает на фоне синдромов преэкзитации и рассматривается в аритмологии как классическая естественная модель тахикардии, протекающей по электрофизиологическому механизму re-entry. Синдром преэкзитации заключается в том, что во время одного сердечного цикла желудочки возбуждаются как импульсом, проведенным из предсердий по дополнительному (аномальному) пути, так и по нормально функционирующей проводящей системе, причем при проведении импульса по дополнительному пути проведения часть миокарда или весь желудочек возбуждается ранее, то есть преждевременно. ЭКГ-проявления синдрома преэкзитации на фоне синусового ритма широко варьируют, что зависит от степени преэкзитации и постоянства проведения по дополнительному пути проведения. Возможны следующие варианты:
- на ЭКГ постоянно имеются признаки преэкзитации (манифестный синдром преэкзитации);
- на ЭКГ признаки преэкзитации имеют преходящий характер (интермиттирующий или преходящий синдром преэкзитации);
- ЭКГ в обычных условиях нормальная, признаки преэкзитации появляются только в период пароксизма или при провокационных пробах — нагрузке, вагусных или медикаментозных пробах, ЭФИ (скрытый синдром преэкзитации).
ЭКГ-регистрация пароксизма тахикардии является одним из важнейших условий верификации синдрома преэкзитации и правильного выбора лечения. В то же время кардиологам нередко приходится сталкиваться с клиническими случаями заболевания, когда ЭКГ-регистрация пароксизма тахикардии затруднена по тем или иным причинам. В данной ситуации объективную информацию можно получить с использованием ЭФИ как неинвазивного (чреспищеводная электрокардиостимуляция), так и инвазивного (эндокавитарное ЭФИ).
Особенно часто выявляют вариант АV-реципрокной тахикардии, при которой волна возбуждения распространяется антероградно через АV-узел в систему Гиса — Пуркинье, ретроградно — через дополнительные пути проведения к предсердию. Эту тахикардию называют ортодромной. Значительно реже отмечают вариант АV-реципрокной тахикардии, при котором волна возбуждения совершает круговое движение по той же петле: антероградно через дополнительный путь проведения, ретроградно через систему Гиса — Пуркинье и АV-узел к предсердию. Эту тахикардию называют антидромной.
Пароксизм ортодромной суправентрикулярной тахикардии характеризуется частыми (140–250 уд./мин), лишенными признаков преэкзитации нормальными (узкими) комплексами QRS. В ряде случаев после комплекса QRS наблюдаются инвертированные зубцы Р, что указывает на ретроградную активацию предсердий.
Антидромная суправентрикулярная тахикардия проявляется на ЭКГ частым регулярным ритмом (150–200 уд./мин), желудочковыми комплексами по типу максимально выраженной преэкзитации (QRS >0,1 с), после которых иногда выявляются инвертированные зубцы Р.
Уточнение диагноза «пароксизмальная АV-узловая тахикардия», как правило, требует применения метода клинического ЭФИ. Пароксизмальная наджелудочковая тахикардия при скрытом WPW-синдроме имеет определенное сходство с АV-узловой тахикардией, но отличается структурой цепи re-entry. Поэтому дифференциальная диагностика между ними строится на признаках, выявляющих участие различных структур в цепи re-entry. Наиболее полезная информация при дифференциации АV-узловой тахикардии и реципрокной тахикардии с участием дополнительных путей проведения может быть получена на чреспищеводной электрограмме при пароксизме тахикардии. Величина интервала V–А по данным пищеводного отведения <100 мс в 90% случаев указывает на АV-узловую тахикардию. При этом зубец Р на наружной ЭКГ не виден, поскольку он накладывается на комплекс QRS или начало сегмента ST.
СИНУСОВЫЕ ТАХИКАРДИИ
Синусовая тахикардия, как правило, возникает в ответ на соответствующий физиологический (например, физическая нагрузка) или патологический (например, гипертиреоз) стимул. Нарушение механизмов контроля синусового ритма может привести к синусовой тахикардии. Синусовая тахикардия может также возникать при переходе тела из горизонтального положения в вертикальное (синдром постуральной ортостатической тахикардии). Петли re-entry могут находиться внутри или рядом с синусным узлом, приводя к так называемой реципрокной синусовой тахикардии, которую иногда называют синоатриальное re-entry.
В норме синусовый узел генерирует приблизительно от 60 до 90 импульсов в минуту и отвечает на автономные воздействия. Синусовый узел — сложная структура, на которую влияют многие факторы, включая гипоксию, ацидоз, температуру и гормоны (например трийодтиронин, серотонин).
Синусовая тахикардия определяется как учащение синусового ритма >100 уд./мин в ответ на соответствующую степень физического, эмоционального, патологического или фармакологического стресса. К патологическим причинам синусовой тахикардии относят гипертермию, гиповолемию или анемию, которые могут быть результатом инфекции, злокачественных процессов, ишемии миокарда, застойной СН, эмболии легких, шока и тиреотоксикоза. К провоцирующим факторам синусовой тахикардии относятся стимуляторы: кофеин, алкоголь, никотин; лекарственные средства (сальбутамол, аминофиллин, атропин, катехоламины и др.), а также определенные наркотические препараты (амфетамины, кокаин, экстази и др.). Противораковые препараты, особенно антрациклинового ряда, такие как доксорубицин и даунорубицин, могут также вызвать синусовую тахикардию как результат острого или отсроченного кардиотоксического эффекта, индуцированного катехоламинами и гистамином. Синусовая тахикардия может сигнализировать о серьезных патологических состояниях и часто требует тщательной оценки. Предсердную и синусовую тахикардию довольно трудно дифференцировать.
Синусовая тахикардия возникает в результате нейрогуморальных воздействий на пейсмейкерные клетки и морфологических изменений в самом синусовом узле.
В норме при синусовом ритме зубец Р на ЭКГ в 12 отведениях положительный в отведениях I, II и aVF и отрицательный в aVR. Его ось во фронтальной плоскости лежит между углом 0° и +90°; в горизонтальной плоскости ось направлена вперед и немного влево, и поэтому зубец Р может быть отрицательным в отведениях V1 и V2, но положительным — в отведениях V3–V6. При нарастании амплитуды зубец Р может стать заостренным. Синусовая тахикардия — непароксизмальная, что отличает ее от других re-entry.
Патологическая (аномальная) синусовая тахикардия
Патологическая синусовая тахикардия — это персистирующее повышение ЧСС в состоянии покоя, не соответствующее уровню физического, эмоционального, патологического или фармакологического стресса.
Патологическая основа аномальной синусовой тахикардии, вероятно, включает многие факторы, однако, предполагается два основных механизма:
- Повышенный автоматизм синусового узла;
- Нарушение автономной регуляции синусного узла с повышением симпатического и снижением парасимпатического тонуса.
Большая часть больных с аномальной синусовой тахикардией — женщины. Средний возраст больных — 38±12 лет. Хотя наиболее частой жалобой является учащенное сердцебиение, могут быть и такие симптомы, как боль в грудной клетке, затруднение дыхания, головокружение; описываются также предобморочные состояния. Степень нетрудоспособности может значительно варьировать — от полного отсутствия симптомов во время медицинского обследования до случаев, когда пациенты полностью нетрудоспособны. Клинические и инструментальные методы обследования, проведенные в установленном порядке, позволяют устранить вторичную причину — тахикардию, однако редко помогают установить диагноз.
Синусовую тахикардию диагностируют на основании критериев, полученных с помощью инвазивных и неинвазивных исследований:
- Персистирующая синусовая тахикардия (ЧСС >100 уд./мин) в течение дня с чрезмерным учащением пульса в ответ на физическую активность и нормализацией ЧСС в ночное время, подтвержденная результатами 24-часового холтеровского мониторирования.
- Тахикардия (и симптомы) носят непароксизмальный характер.
- Морфология зубца Р на ЭКГ и эндокардиальных ЭКГ при тахикардии идентична таковой на синусовом ритме.
- Исключение вторичных причин (например гипертиреоз, феохромоцитома, физическая нетренированность).
Лечение при аномальной синусовой тахикардии в основном симптоматическое. Нет данных о развитии аритмогенной кардиомиопатии, вызванной этой тахикардией у пациентов, не проходивших лечение. Вероятнее всего, риск развития аритмогенной кардиомиопатии невысок.
Хотя нет проведенных рандомизированных, плацебо-контролируемых клинических исследований, блокаторы β-адренорецепторов могут быть эффективны и должны назначаться в качестве терапии первой линии у большинства пациентов с данной тахикардией (табл. 5.2). Есть данные, позволяющие полагать, что блокаторы кальциевых каналов, такие как верапамил и дилтиазем, также эффективны.
Таблица 5.2
Рекомендации для лечения синусовой тахикардии
| Методы терапии | Рекомендации | Эффективность |
| Медикаментозный (неинвазивный) | Блокаторы β-адренорецепторов
Верапамил, дилтиазем |
Высокоэффективно
Эффективно |
| Инвазивный | Катетерная абляция — модификация/устранение синусного узла | Малоэффективно |
Модификация синусного узла методом катетерной абляции потенциально может быть использована при лечении большинства рефракторных случаев аномальной синусовой тахикардии. Возможными осложнениями процедуры катетерной абляции являются перикардит, повреждение диафрагмального нерва, синдром верхней полой вены, деструкция синусового узла с необходимостью имплантации системы постоянной электрокардиостимуляции. В ряде случаев сообщалось об успешной радиочастотной модификации синусного узла. Перед тем как выполнить радиочастотную абляцию, необходимо исключить диагноз «синдром постуральной ортостатической тахикардии». По данным ретроспективного анализа 29 случаев модификации синусного узла по поводу аномальной синусовой тахикардии положительный эффект был достигнут в 22 (76%) случаях. Отдаленная эффективность составила 66%.
Синусно-предсердная узловая re-entry тахикардия
В основе синусовой re-entry тахикардии лежит возникновение петли re-entry внутри синусного узла с индукцией пароксизмальных, часто неустойчивых залпов тахикардии с зубцами Р, которые похожи, если не идентичны, с аналогичными при синусовом ритме. Она обычно запускается и прерывается предсердной экстрасистолой.
Гетерогенность проводимости внутри синусового узла способствует возникновению reentry, однако до сих пор неизвестно, возникает ли петля re-entry изолированно внутри самого синусного узла, вовлечена ли перинодальная предсердная ткань, а также может ли существовать re-entry вокруг участка crista terminalis. Однако тот факт, что данная форма аритмии, как и АV-узловая реципрокная тахикардия, отвечает на вагусные приемы и аденозин фосфат, дает возможность предполагать, что ткань синусового узла вовлечена в круг re-entry.
Распространенность синусовой re-entry тахикардии среди пациентов, которым проводили ЭФИ в связи с суправентрикулярной тахикардией, колеблется в пределах 1,8–16,9% и до 27% у пациентов с очаговой предсердной тахикардией. Отмечается высокая частота случаев органических заболеваний сердца у пациентов с синусовой re-entry тахикардией. Пациенты предъявляют жалобы на сердцебиение, легкое головокружение и предобморочное состояние. Обмороки крайне редки, частота тахикардии обычно не более 180 уд./мин. Важное значение в диагностике имеет пароксизмальный характер тахикардии.
Диагноз синусовой re-entry тахикардии устанавливается на основании критериев, полученных с помощью инвазивных и неинвазивных исследований. Следующие клинические характеристики позволяют заподозрить диагноз данной формы аритмии:
- Тахикардия и связанные с ней симптомы — пароксизмальные.
- Морфология зубца Р’ идентична таковой при синусовом ритме, при этом его вектор имеет направление сверху вниз и справа налево.
- Эндокардиальная предсердная активация имеет вид сверху вниз и справа налево, а последовательность активации подобна таковой при синусовом ритме.
- Индукция и/или купирование аритмии вызывается преждевременными предсердными стимулами.
- Купирование происходит при выполнении вагусных приемов или введении аденозин фосфата.
- Индукция аритмии не зависит от времени синоатриального проведения или времени проведения через АV-узел.
Контролируемых исследований по лекарственной профилактике синусовой re-entry тахикардии не проводилось. Клинические симптомы, позволяющие заподозрить синусовую re-entry тахикардию, могут отвечать на вагусные приемы, аденозин фосфат, амиодарон, блокаторы β-адренорецепторов, блокаторы кальциевых каналов и даже на дигоксин. Пациентам, у которых тахиаритмия переносится и хорошо контролируется вагусными приемами и/или иной терапией, проведение ЭФИ не показано. ЭФИ показано лицам с частыми или плохо переносимыми приступами тахикардии, которые не отвечают на лекарственную терапию, а также пациентам, у которых точная природа тахикардии не известна, а ЭФИ может оказать помощь в выборе соответствующей лекарственной терапии. Радиочастотная катетерная абляция персистирующей синусовой re-entry тахикардии, выявленной во время ЭФИ, обычно эффективна.
AV-узловая реципрокная тахикардия
AV-реципрокная тахикардия — самая частая форма непароксизмальных желудочковых тахикардий. Чаще выявляют у женщин; сопровождается сердцебиением, головокружением, пульсацией в области шеи и обычно не связана со структурным заболеванием сердца. Пульс при тахикардии, как правило, в пределах 140–250 уд./мин.
Вначале считали, что круг re-entry ограничивается компактной частью AV-узла, но позднее появились данные о том, что перинодальная предсердная ткань является составляющей петли re-entry. Однако установлено, что АV-узловая реципрокная тахикардия может существовать и без участия предсердной ткани. Для возникновения АV-узловой реципрокной тахикардии необходимо два функционально и анатомически различных канала. В большинстве случаев быстрый путь (fast pathway) располагается рядом с верхушкой треугольника Коха. Медленный путь расположен сзади и ниже компактной части АV-узла и проходит вдоль септального края фиброзного кольца трехстворчатого клапана на уровне или чуть выше коронарного синуса.
Во время типичной АV-узловой реципрокной тахикардии медленный путь (slow pathway) выступает в качестве антероградного участка петли, в то время как быстрый (fast) канал — это ретроградное колено (то есть slow-fast re-entry АV-узла). Импульс по медленному каналу проводится через пучок Гиса к желудочкам, а по быстрому каналу проведение идет назад к предсердиям, в результате чего появляется зубец Р продолжительностью 40 мс, который накладывается на комплекс QRS или возникает сразу после него (<70 мс), что часто приводит к появлению псевдо-r’ в отведении V1. В редких (5–10%) случаях петля тахикардии имеет обратное направление, то есть проведение осуществляется антероградно по быстрому каналу и ретроградно по медленному каналу (fast-slore-entry АV-узла или атипичная АV-узловая реципрокная тахикардия), приводя к появлению длинного интервала R–P. Зубец Р, отрицательный в отведениях III и aVF, регистрируется перед комплексом QRS. Бывают редкие случаи, когда оба участка круга тахикардии состоят из медленно проводящей (slow-slow re-entry АV-узла), зубец Р’ регистрируется после QRS (то есть интервал R–P >70 мс). Для лечения пациентов с частыми и устойчивыми приступами АV-узловой реципрокной тахикардии, которые предпочитают постоянную пероральную терапию и отказываются от катетерной абляции, может использоваться ряд противоаритмических препаратов. Стандартная терапия включает блокаторы кальциевых каналов, блокаторы β-адренорецепторов и дигоксин. При лечении пациентов без структурной патологии миокарда, резистентных к препаратам, замедляющим АV-проводимость, предпочтение отдается антиаритмическим препаратам класса IС — флекаиниду и пропафенону. В большинстве случаев препараты класса III, такие как соталол или амиодарон, не применяют; препараты класса IА — хинидин, прокаинамид и дизопирамид используют ограниченно, поскольку они требуют длительного применения, оказывают умеренную эффективность и обладают проаритмогенным действием.
Значительно ограничивает оценку эффективности противоаритмических препаратов при лечении АV-узловой реципрокной тахикардии отсутствие крупных многоцентровых, рандомизированных, плацебо-контролируемых исследований.
Профилактическая фармакологическая терапия
Блокаторы кальциевых каналов, блокаторы β-адренорецепторов и дигоксин. Комментарии относительно эффективности длительного перорального приема блокаторов кальциевых каналов, блокаторов β-адренорецепторов и дигоксина при лечении АV-узловой реципрокной тахикардии ограничены небольшим количеством рандомизированных исследований данной группы пациентов. Результаты рандомизированного плацебо-контролируемого исследования небольшой группы из 11 пациентов свидетельствуют, что пероральный прием верапамила уменьшает количество и продолжительность приступов (как по сообщениям пациентов, так и по данным ЭФИ). Эти данные были получены при применении верапамила в дозе 360–480 мг/сут. Тенденция к более выраженному положительному эффекту отмечалась при применении препарата в более высоких дозах.
Дигоксин (0,375 мг/сут), верапамил (480 мг/сут) и пропранолол (240 мг/сут), назначаемые перорально 11 пациентам (по данным рандомизированного исследования), оказывали одинаковую эффективность. При этом не получено различий по частоте возникновения или продолжительности непароксизмальных желудочковых тахикардий при применении этих препаратов.
Препараты I класса
Данные, свидетельствующие об эффективности прокаинамида, хинидина и дизопирамида, взяты из старых литературных источников и ограничены небольшим количеством исследований. В настоящее время эти препараты редко применяют при лечении пациентов с АV-узловой реципрокной тахикардией. Отдаленный эффект перорального применения флекаинида при АV-узловой реципрокной тахикардии сначала был показан в открытом исследовании. Флекаинид в дозах 200–300 мг/сут полностью подавляет пароксизмы тахикардии у 65% пациентов. Несколько рандомизированных двойных слепых исследований подтвердили эффективность флекаинида в предотвращении пароксизмов. По сравнению с плацебо количество приступов уменьшилось, при этом увеличилось среднее время до возникновения первого пароксизма, увеличивался межприступный интервал. Открытые продолжительные исследования свидетельствуют о хорошей переносимости и безопасности препарата. Среди пациентов без структурных заболеваний сердца 7,6% прекратили применение препарата в связи с отсутствием жалоб, а 5% — в связи побочными действиями флекаинида (как правило, со стороны ЦНС). Препараты класса IС (флекаинид и пропафенон) противопоказаны пациентам со структурными заболеваниями сердца. Более того, препараты класса IС часто назначают в сочетании с блокаторами β-адренорецепторов, чтобы повысить эффективность и снизить риск АV-проведения 1:1 в случае возникновения трепетания предсердий.
Флекаинид обладает большей эффективностью при постоянной терапии, чем верапамил. Несмотря на то, что оба препарата (средние дозы 200 и 240 мг/сут соответственно) показали одинаковое снижение частоты приступов, у 30% пациентов, получавших флекаинид, полностью отсутствовала клиническая симптоматика, тогда как при применении верапамила — только у 13%. Доля пациентов, прекративших применение препаратов из-за побочных реакций, была почти одинаковой — 19 и 24% соответственно.
Пропафенон также эффективен при профилактике АV-узловой реципрокной тахикардии. В двойном слепом плацебо-контролируемом исследовании анализировали временные периоды, при которых лечение становилось неэффективным. Относительный риск неэффективности лечения для плацебо по сравнению с пропафеноном составлял 6,8. В другом исследовании показано, что пропафенон (300 мг 3 раза/сут) снижает частоту возникновения пароксизмов на 1/5 по сравнению с плацебо.
Препараты III класса
Имеются только предположительные данные относительно применения препаратов III класса (амиодарон, соталол, дофетилид). Хотя многие из них были эффективны в применении для профилактики пароксизмов, тем не менее рутинного применения этих препаратов следует избегать из-за проаритмогеннго действия (torsades de pointes — веретенообразная желудочковая тахикардия). Результаты плацебо-контролируемого исследования свидетельствуют о том, что соталол по сравнению с плацебо увеличивает межприступный период АV-узловой реципрокной тахикардии. Как показало следующее многоцентровое исследование, у пациентов с непароксизмальными желудочковыми тахикардиями, получавших дофетилид (500 мкг 2 раза в сутки), в 50% случаев полностью исчезали симптомы при 6-месячном динамическом наблюдении, в то время как в контрольной группе устранение симптомов составило 6% (р<0,001). Проаритмических эффектов не наблюдали. В этом же исследовании установлено, что дофетилид обладает такой же эффективностью, как и пропафенон (150 мг 3 раза в сутки). Имеются ограниченные данные относительно эффектов амиодарона при АV-узловой реципрокной тахикардии. По данным одного открытого исследования, проводимого в ходе эндокавитарного ЭФИ, внутривенное введение амиодарона (5 мг/кг массы тела в течение >5 мин) купировало тахикардию у 7 из 9 пациентов. Пероральное применение амиодарона (в поддерживающей дозе 200–400 мг/сут) в течение 66±24 дня предотвращало пароксизмы у всех пациентов; при этом его основным действием было замедление проводимости по быстрому пути в ретроградном направлении. Следует отметить, что применение амиодарона безопасно у пациентов со структурной патологией сердца, особенно при снижении ФВ ЛЖ.
Очаговая (фокусная) АV-узловая тахикардия
Патологический ускоренный ритм из АV-узла обозначался разными терминами, каждый из которых имеет свои недостатки. Например, некоторые называют это нарушение ритма «узловой эктопической тахикардией». Неточность этого термина в том, что все очаги автоматизма вне синусового узла фактически являются эктопическими. Термин «автоматическая узловая тахикардия» предполагает, что основным механизмом является нарушение автоматизма; однако эта тахикардия может возникать и по другим механизмам.
Отличительная черта очаговых узловых тахикардий — их происхождение из АV-узла или пучка Гиса. Это местонахождение начала аритмии приводит к возникновению разных ЭКГ-признаков, поскольку для существования аритмии не требуется участия ни предсердий, ни желудочков. К ЭКГ-признакам очаговой узловой тахикардии относятся ЧСС 110–250 уд./мин, узкие комплексы QRS или морфология типичной блокады ножек пучка Гиса. Часто отмечается АV-диссоциация, хотя транзиторно может наблюдаться ретроградное проведение в соотношении 1:1. Иногда узловой ритм бывает совсем неправильный, напоминая фибрилляцию предсердий. Наконец, изолированные скрытые узловые экстрасистолы, которые не проводятся на желудочки, могут вызывать эпизоды АV-блокады, приводя к интермиттирующей рефрактерности АV-узла.
При ЭФИ каждому желудочковому потенциалу предшествует потенциал пучка Гиса. Считается, что электрофизиологическим механизмом такой аритмии является либо нарушение автоматизма, либо триггерная активность, обусловленные β-адренергической стимуляцией и блокадой кальциевых каналов.
Очаговая узловая тахикардия, известная также как автоматическая или пароксизмальная узловая тахикардия, — очень редкая форма аритмии. Она редко развивается у детей и еще реже — у взрослых. Понятие «очаговая узловая тахикардия» включает несколько отдельных клинических синдромов. Наиболее распространенные среди них — «врожденная узловая эктопическая тахикардия» и «послеоперационная узловая эктопическая тахикардия», которые развиваются исключительно у детей и поэтому не будут рассматриваться в настоящем пособии.
Очаговая узловая тахикардия, как правило, развивается в раннем юношеском возрасте. Считается, что эта форма аритмии — проявление патологии, дебютирующей в детском возрасте и обычно называется «врожденной узловой эктопической тахикардией». Характер этой аритмии у взрослых более доброкачественный, чем у детей. Данная форма аритмии, как правило, провоцируется физической нагрузкой или эмоциональным стрессом и может развиваться у лиц без патологии сердца и у больных с врожденными пороками, такими как дефект межпредсердной или межжелудочковой перегородки. В случае, если не проводить лечения, может развиться СН, особенно если тахикардия носит постоянный характер.
Имеется относительно мало информации о реакции очаговой узловой тахикардии на медикаментозную терапию (табл. 5.3). Некоторые пациенты чувствительны к блокаторам β-адренорецепторов. Тахикардия может быть замедлена или купирована внутривенным введением флекаинида; некоторый положительный эффект достигается при длительном приеме препарата внутрь. Лекарственная терапия не всегда эффективна и процедура радиочастотной абляции показана для лечения тахикардии. Катетерная абляция приводит к деструкции очагов, прилегающих к АV-узлу, но связана с риском развития АV-блокады (в 5–10% случаев).
Таблица 5.3
Рекомендации для лечения при синдромах эктопической и непароксизмальной узловой тахикардии
| Тахикардия | Рекомендации | Эффективность |
| Эктопическая узловая тахикардия | Блокаторы β-адренорецепторов
Флекаинид Пропафенон Соталол Амиодарон Катетерная абляция |
Эффективно
Эффективно Эффективно Эффективно Эффективно Эффективно |
| Непароксизмальная узловая тахикардия | Устранение интоксикации препаратами наперстянки
Коррекция гипокалиемии Лечение ишемии миокарда Блокаторы β-адренорецепторов Блокаторы кальциевых каналов |
Высокоэффективно
Высокоэффективно Высокоэффективно Эффективно Эффективно |
Непароксизмальная узловая тахикардия
Непароксизмальная узловая тахикардия — доброкачественная форма аритмии, характеризующаяся тахикардией с узкими комплексами с ЧСС 70–120 уд./мин. Механизмы аритмии — повышение автоматизма из верхних отделов АV-узла или триггерный механизм. Тахикардия имеет период «разогрева» и «охлаждения» и не может быть купирована при электрической стимуляции. Характерной особенностью данной формы тахикардии является то, что она может быть проявлением серьезного патологического состояния, такого как дигиталисная интоксикация, состояние после операции на сердце, гипокалиемия или ишемия миокарда. Часто эта тахикардия развивается при ХОБЛ с гипоксией и миокардите. В отличие от очаговой узловой тахикардии, имеющей более частый ритм, при данной форме обычно наблюдается АV-ассоциация с соотношением 1:1. В некоторых случаях, особенно при интоксикации препаратами наперстянки, может появляться антероградная АV-блокада с периодами Самойлова — Венкебаха.
Необходимо проводить дифференциальную диагностику с другими видами тахикардии с узкими комплексами, включая предсердную тахикардию, АV-узловую реципрокную тахикардию, АV-реципрокную тахикардию. Как правило, данные ЭКГ позволяют клиницисту предположить механизм аритмии. Однако в некоторых случаях его удается определить только с помощью инвазивного ЭФИ.
Главный принцип лечения при непароксизмальной узловой тахикардии — коррекция основной патологии. Если узловая тахикардия является проявлением интоксикации препаратами наперстянки, то достаточно отменить препараты наперстянки. Однако в случае возникновения желудочковой аритмии или АV-блокады высокой степени показано назначение антидота наперстянки. Довольно часты случаи, когда автоматизм АV-узла превышает автоматизм синусового узла, приводя к потере АV-синхронизации. К этому явлению надо относиться как к физиологическому состоянию, никакой специфической терапии при этом не требуется. Персистирующая узловая тахикардия может быть купирована применением блокаторов β-адренорецепторов или блокаторов кальциевых каналов. В редких случаях возникновение узлового ритма является результатом дисфункции синусового узла. Симпатическая стимуляция АV-соединения может вызвать ускоренный узловой ритм, превышающий по частоте синусовый ритм. В таких случаях симптомы имитируют «пейсмейкерный синдром», в связи с ретроградным проведением из АV-соединения на предсердия, что приводит к сокращению предсердий на фоне закрытых АV-клапанов. Появляются волны А, и возможна гипотензия. Эффективным лечением при данном состоянии является электрическая стимуляция предсердий.
АV-реципрокная тахикардия (дополнительные предсердно-желудочковые соединения)
Дополнительными предсердно-желудочковыми соединениями являются экстранодальные пути, которые соединяют миокард предсердия и миокард желудочка через АV-борозду. Дельта-волна на ЭКГ определяется у 0,15–0,20% общей популяции. Проведение по дополнительному предсердно-желудочковому соединению может быть прерывистым. Дополнительные АV-соединения можно классифицировать на основании их расположения относительно фиброзных колец митрального или трикуспидального клапанов, типа проводимости (декрементное — нарастающее замедление проведения по дополнительному пути в ответ на повышение частоты стимуляции или недекрементное — без существенного уменьшения величины проведения), а также в зависимости от того, способны они на антероградное, ретроградное проведение, их сочетание или нет. Обычно дополнительные предсердно-желудочковые соединения имеют быстрое недекрементное проведение, аналогичное таковому нормальной ткани системы Гиса — Пуркинье и миокарда предсердий или желудочков. Приблизительно 8% дополнительных путей имеют декрементное антероградное или ретроградное проведение. Термин «постоянная форма узловой реципрокной тахикардии» относится к редкому клиническому синдрому, подразумевающему замедленное скрытое проведение, как правило, по заднесептальному (нижнесептальному) дополнительному предсердножелудочковому соединению. Данный синдром характеризуется постоянной наджелудочковой тахикардией, обычно с отрицательными зубцами Р в отведениях II, III aVF, удлиненным интервалом R–P’ (R–P’ >P–R).
Дополнительные пути, способные только на ретроградное проведение, считаются «скрытыми», а те дополнительные предсердно-желудочковые соединения, которые способны на антероградное проведение,— «манифестирующими», с возникновением предвозбуждения желудочков на ЭКГ в стандартных отведениях. Степень предвозбуждения определяется соотношением проведения на желудочки через АV-узел и систему Гиса — Пуркинье. У некоторых пациентов антероградное проведение выявляется только при предсердной стимуляции из участков, близких к дополнительному предсердно-желудочковому соединению, например при левых латеральных дополнительных предсердно-желудочковых соединениях. «Манифестирующие» дополнительные предсердно-желудочковые соединения обычно могут проводить импульсы в обоих направлениях — антероградном и ретроградном. Дополнительные пути только с антероградной проводимостью выявляют редко, а с ретроградной — наоборот часто.
Диагноз «WPW-синдром» устанавливают пациентам при наличии сочетания синдрома предвозбуждения желудочков с тахиаритмией. Среди пациентов с WPW-синдромом самая распространенная аритмия — АV-реципрокная тахикардия, составляющая 95% реципрокных тахикардий с участием дополнительного предсердно-желудочкового соединения.
АV-тахикардия по механизму re-entry подразделяется на ортодромную и антидромную АV-реципрокную тахикардию. Во время ортодромной АV-реципрокной тахикардии импульсы проводятся антероградно по АV-узлу и специализированной проводящей системе из предсердия в желудочки, а ретроградно — из желудочков на предсердия по дополнительному предсердно-желудочковому соединению. Во время антидромной АV-реципрокной тахикардии импульсы идут в обратном направлении с антероградным проведением из предсердий в желудочки через дополнительное предсердно-желудочковое соединение и ретроградным проведением через АV-узел или второе дополнительное предсердно-желудочковое соединение. Антидромную АV-реципрокную тахикардию выявляют лишь у 5–10% пациентов с WPW-синдромом. Тахикардии с предвозбуждением желудочков могут возникать и у лиц с предсердной тахикардией, трепетанием предсердий, фибрилляцией предсердий или АV-узловой реципрокной тахикардией, при этом дополнительный путь выступает в качестве «свидетеля» (то есть не является критической частью круга тахикардии).
Фибрилляция предсердий является жизнеугрожающей у пациентов с WPW-синдромом. Если дополнительный путь имеет короткий антероградный рефрактерный период, то проведение импульсов на желудочки с высокой частотой во время фибрилляции предсердий может привести к фибрилляции желудочков. Приблизительно у 1/3 пациентов с WPW-синдромом отмечают фибрилляцию предсердий. Дополнительные предсердно-желудочковые соединения играют патофизиологическую роль в развитии фибрилляции предсердий у данной категории больных; большинство из них лица молодого возраста без структурной патологии сердца. АV-реципрокная тахикардия с высокой частой ритма может играть определенную роль в индукции фибрилляции предсердий. Хирургические методы лечения и катетерная абляция дополнительных путей способны устранить фибрилляцию предсердий так же, как и АV-реципрокную тахикардию.
Частота случаев внезапной смерти среди пациентов с WPW-синдромом варьирует в пределах 0,15–0,39% в течение периода динамического наблюдения от 3 до 10 лет. Остановка сердца редко является первым симптоматическим проявлением WPW-синдрома. В противоположность почти в половине случаев остановка сердца у пациентов с WPW-синдромом является первым проявлением АV-реципрокной тахикардии. С целью предупреждения развития фибрилляции предсердий у пациентов с WPW-синдромом и риска внезапной смерти в результате фибрилляции предсердий имеет значение проведение катетерной абляции.
В исследованиях пациентов с WPW-синдромом, перенесших остановку сердца, ретроспективно определили ряд критериев, с помощью которых можно выявить пациентов с повышенным риском внезапной смерти. К ним относятся:
1) укороченный R–R <250 мс при предвозбуждении желудочков во время спонтанной или индуцированной фибрилляции предсердий;
2) симптоматическая тахикардия в анамнезе;
3) множественные дополнительные пути;
4) аномалия Эбштейна.
Сообщалось о высокой частоте внезапной смерти при семейном WPW-синдроме, хотя семейные формы WPW-синдрома крайне редки. Предлагался ряд неинвазивных и инвазивных исследований, помогающих стратифицировать риск внезапной смерти. Выявление интермиттирующего синдрома предвозбуждения желудочков, характеризующегося внезапным исчезновением дельта-волны и нормализацией комплекса QRS, свидетельствует о том, что дополнительный путь имеет относительно длинный рефрактерный период и возникновение фибрилляции желудочков маловероятно. Исчезновение предвозбуждения после введения антиаритмического препарата прокаинамида также использовалось для того, чтобы определить подгруппу низкого риска. Считается, что неинвазивные методы исследования уступают инвазивной электрофизиологической оценке риска внезапной смерти. Поэтому в настоящее время неинвазивные методы не имеют большого значения при исследовании пациентов.
Медикаментозная антиаритмическая терапия может использоваться при лечении аритмий с участием дополнительного предсердно-желудочкового соединения, однако катетерная абляция стала методом выбора при лечении данных аритмий. К антиаритмическим препаратам, непосредственно модифицирующим проведение по АV-узлу, относятся дигоксин, верапамил, блокаторы β-адренорецепторов, аденозин фосфат и дилтиазем. Противоаритмические препараты, подавляющие проведение через дополнительный путь, включают препараты I класса, такие как прокаинамид, дизопирамид, пропафенон и флекаинид, а также препараты III класса — ибутилид, соталол и амиодарон (табл. 5.4).
Таблица 5.4
Рекомендации для длительной терапии пациентов с аритмией при наличии дополнительных путей проведения
| Вид аритмии | Рекомендации | Эффективность |
| WPW-синдром (преэкзитация и симптоматические аритмии), хорошо переносимые | Катетерная абляция
Флекаинид, пропафенон, соталол, амиодарон Блокаторы β-адренорецепторов Верапамил, дилтиазем, дигоксин |
Высокоэффективно
Эффективно Малоэффективно Не показано |
| WPW-синдром (с фибрилляцией предсердий и быстропроводимой или плохо переносимой АV-реципрокной тахикардией)
АV-реципрокная тахикардия, плохо переносимая (без преэкзитации) |
Катетерная абляция
Флекаинид, пропафенон, соталол, амиодарон Блокаторы β-адренорецепторов Верапамил, дилтиазем, дигоксин |
Высокоэффективно
Эффективно Малоэффективно Не показано |
| Единичные или редкие эпизоды АV-реципрокной тахикардии (без преэкзитации) | Терапию не проводить
Вагусные пробы Верапамил, дилтиазем Блокаторы β-адренорецепторов Катетерная абляция Соталол, амиодарон Флекаинид, пропафенон Дигоксин |
Высокоэффективно
Высокоэффективно Высокоэффективно Эффективно Эффективно Малоэффективно Малоэффективно Не показано |
| Преэкзитация, асимптоматическая | Терапию не проводить
Катетерная абляция |
Высокоэффективно
Эффективно |
Крупные рандомизированные исследования по лекарственной профилактике у пациентов с АV-реципрокной тахикардией не проводили, однако имеются данные ряда небольших нерандомизированных исследований (в каждое из которых вошли <50 пациентов), показывающих безопасность и эффективность лекарственной терапии по поддержанию синусового ритма у пациентов с непароксизмальными желудочковыми тахикардиями. В этих исследованиях в одну из подгрупп вошли пациенты с АV-реципрокной тахикардией. Полученные данные не позволяют провести сравнение эффективности этих препаратов между собой. Препараты, применяемые при лечении АV-реципрокной тахикардии, включают любые лекарственные средства, которые либо меняют проведение через АV-узел (блокаторы кальциевых каналов, блокаторы β-адренорецепторов, дигоксин), либо проведение по предсердиям, желудочкам или дополнительному предсердно-желудочковому соединению (противоаритмические препараты классов IА, IС или III) (табл. 5.5). Примечательно, что ни в одном из исследований не изучали эффективность постоянного перорального применения блокаторов β-адренорецепторов при лечении АV-реципрокной тахикардии и/или WPW-синдрома. Отсутствие исследований, специально изучающих роль блокаторов β-адренорецепторов в профилактике пароксизмов тахикардии при WPW-синдроме, связано с тем, что для таких пациентов методом выбора лечения является катетерная абляция. Несмотря на отсутствие данных клинических исследований, можно утверждать, что постоянную пероральную терапию блокаторами β-адренорецепторов можно использовать при лечении больных с WPW-синдромом, особенно если в результате ЭФИ выявлена неспособность дополнительного пути к быстрому проведению в антероградном направлении.
Таблица 5.5
Рекомендации для длительной терапии возвратной AV-реципрокной тахикардии
| Клинические данные | Рекомендации | Эффективность |
| Нестойкая АV-реципрокная тахикардия с гемодинамической нестабильностью | Катетерная абляция
Верапамил, дилтиазем Блокаторы β-адренорецепторов Соталол, амиодарон Флекаинид, пропафенон |
Высокоэффективно
Эффективно Эффективно Эффективно Эффективно |
| Возвратная симптоматическая АV-реципрокная тахикардия | Катетерная абляция
Верапамил, дилтиазем Блокаторы β-адренорецепторов Дигоксин |
Высокоэффективно
Высокоэффективно Высокоэффективно Малоэффективно |
| Возвратная АV-реципрокная тахикардия, устойчивая к β-блокаторам, блокаторам кальциевых каналов и у пациентов, не желающих проводить радиочастотную абляцию | Флекаинид, пропафенон
Соталол, амиодарон |
Эффективно
Малоэффективно |
| Редкие или одиночные эпизоды АV-реципрокной тахикардии у пациентов, желающих полного контроля аритмии | Катетерная абляция | Высокоэффективно |
| Пароксизмальная суправентрикулярная тахикардия, которая проявляется только двунаправленным проведением по АV-узлу, зарегистрированная при ЭФИ, и нет никаких других признаков аритмии | Верапамил, дилтиазем
Блокаторы β-адренорецепторов Флекаинид, пропафенон Катетерная абляция |
Высокоэффективно
Эффективно Эффективно Высокоэффективно |
| Медленная устойчивая АV-узловая реципрокная тахикардия | Без лечения
Вагусные пробы Верапамил, дилтиазем Блокаторы β-адренорецепторов таблетках Катетерная абляция |
Высокоэффективно
Высокоэффективно Высокоэффективно Эффективно Высокоэффективно |
ЭКТОПИЧЕСКАЯ (ОЧАГОВАЯ) ПРЕДСЕРДНАЯ ТАХИКАРДИЯ
Очаги предсердной тахикардии локализуются в предсердиях и характеризуются ритмичностью распространения импульсов в центробежном направлении. Очаговая предсердная тахикардия, как правило, возникает с частотой 100–250 уд./мин, в редких случаях — до 300 уд./мин. Ни синусовый, ни AV-узел не принимают участия в инициации и поддержании тахикардии.
Неустойчивая предсердная тахикардия часто регистрируется во время холтеровского мониторирования ЭКГ и редко проявляется клинической симптоматикой. Устойчивые очаги предсердной тахикардии относительно редки; они диагностируются приблизительно у 10–15% пациентов с непароксизмальной желудочковой тахикардией во время эндоскопической ЭФИ и радиочастотной абляции. Распространенность очаговой предсердной тахикардии невелика; она определяется у 0,34% пациентов без симптомов и у 0,46% пациентов с симптомами.
У пациентов с очаговой предсердной тахикардией обычно благоприятный прогноз, исключая постоянно рецидивирующие формы, которые могут привести к аритмогенной кардиомиопатии. Очаговая предсердная тахикардия может возникнуть как у пациентов с ИМ, так и у пациентов с органическим поражением сердца. Предсердная тахикардия, часто в сочетании с АV-блокадой, может быть вызвана передозировкой сердечных гликозидов. Гипокалиемия обусловливает развитие аритмии. Очаговые предсердные тахикардии могут носить либо пароксизмальный, либо постоянный характер.
При предсердной тахикардии зубцы Р обычно появляются во второй половине цикла тахикардии. Поэтому зубцы Р часто скрыты внутри волны Т предшествующего комплекса QRS. Длительность интервала P–R зависит от частоты тахикардии. Появление АV-блокады во время тахикардии исключает АV-реципрокную тахикардию и делает маловероятным диагноз «АV-узловая реципрокная тахикардия». Во время предсердной тахикардии изоэлектрическая линия четко определяется между зубцами Р, что помогает дифференцировать предсердную тахикардию от типичного или атипичного трепетания предсердий. Однако, если предсердная тахикардия имеет высокую частоту и/или при наличии нарушения внутрипредсердной проводимости, зубцы Р могут быть очень широкими, что приводит к исчезновению изоэлектрической линии имитации трепетания предсердий. Следует подчеркнуть, что модель ЭКГ при предсердной тахикардии с дискретными зубцами Р и четкой изоэлектрической линией не позволяет исключить тахикардию по механизму macro-re-entry, особенно у пациентов с сочетанной структурной патологией сердца и/или после хирургической коррекции врожденного порока сердца. Точный диагноз «предсердная тахикардия» может быть установлен только в процессе эндокавитарного ЭФИ, включающего картирование тахикардии и вхождение в цикл тахикардии (entrainment).
Точная локализация фокуса предсердной тахикардии определяется при интракардиальном картировании. Однако поверхностная ЭКГ в 12 стандартных отведениях позволяет по морфологии отличить зубцы Р синусового происхождения от зубцов Р фокусного происхождения, что также делает возможным локализовать очаг предсердной тахикардии. При отрицательных зубцах Р в отведениях I или aVL или положительных зубцах Р в отведении V1 очаг располагается в левом предсердии. Кроме того, отрицательные зубцы Р в нижних отведениях предполагают нижнепредсердное происхождение фокуса, в то время как положительные зубцы Р в этих отведениях — его верхнепредсердную локализацию. Отметим, что зубцы Р во время синусового ритма могут быть похожи по конфигурации на зубцы Р, исходящие из верхней части crista terminalis или правой верхней легочной вены. В последнем случае зубцы Р чаще всего положительны в отведении V1, что позволяет предположить локализацию очага предсердной тахикардии в правой верхней легочной вене. Следовательно, определение полярности зубца Р в различных отведениях дает возможность предположить локализацию очага предсердной тахикардии. Поверхностное ЭКГ-картирование также может помочь локализовать очаг тахикардии.
Очаги предсердной тахикардии возникают в определенных анатомических зонах. Большинство правосторонних предсердных тахикардий локализуются в области crista terminalis, между синоатриальным и АV-узлами. В левом предсердии очаги часто выявляют в легочных венах, предсердной перегородке или фиброзном кольце митрального клапана; во многих случаях они являются пусковым фактором фибрилляции предсердий.
Очаговые предсердные тахикардии характеризуются радиальным распространением возбуждения из очага, при этом активация эндокарда завершается раньше предсердного цикла. Рутинными клиническими методами установить механизм очаговых предсердных тахикардий трудно. Вероятными механизмами этой аритмии являются аномальный или повышенный автоматизм, триггерная активность или micro-re-entry. При предсердной тахикардии, в основе которой лежит механизм повышенного автоматизма, отмечается постепенное нарастание частоты предсердного ритма вначале тахикардии (период «разогрева»), перед окончанием пароксизма предсердной тахикардии наблюдается постепенное снижение частоты интервалов Р–Р (период «охлаждения»). Автоматические предсердные тахикардии носят, как правило, непрерывно-рецидивирующий характер, особенно у детей, в то время как триггерные предсердные тахикардии могут иметь как непрерывно-рецидивирующий, так и пароксизмальный характер.
Дигоксин наиболее часто вызывает индукцию очаговой предсердной тахикардии, при этом отмечается развитие АV-блокады. Поэтому частота желудочковых сокращений не бывает высокой. Определение концентрации дигоксина в сыворотке крови помогает установить диагноз. Лечение заключается в отмене препаратов наперстянки. В случае персистирующей АV-блокады может потребоваться назначение специфического антидота.
Эффективность противоаритмических препаратов невысока, поскольку очаговую предсердную тахикардию диагностируют редко. Нами не выявлено ни одного крупного исследования по определению эффективности фармакологической терапии у пациентов с очаговыми предсердными тахикардиями, однако следует отметить, что как пароксизмальные, так и непрерывнорецидивирующие предсердные тахикардии трудно поддаются лекарственной коррекции.
В редких случаях предсердные тахикардии можно купировать вагусными приемами. Значительная часть предсердных тахикардий купируется аденозин фосфатом, при этом часто после введения аденозин фосфата отмечается ее трансформация в предсердную тахикардию с АV-блокадой. Аденозинчувствительные предсердные тахикардии, как правило, имеют фокусное происхождение. Сообщалось, что предсердные тахикардии могут быть чувствительны к верапамилу или блокаторам β-адренорецепторов при их внутривенном введении. Очевидно, что механизм предсердной тахикардии у таких пациентов связан либо с micro-re-entrу, либо с триггерной активностью. Антиаритмические препараты класса IА или IС, подавляющие автоматизм или увеличивающие длительность ПД, могут быть эффективными у некоторых пациентов с предсердной тахикардией.
Предсердная стимуляция (или введение аденозин фосфата) может привести к транзиторному постстимуляционному замедлению частоты предсердной тахикардии, в основе которой лежит аномальный автоматизм, но не к полному ее купированию. Это относится к электрической кардиоверсии, которая тоже редко купирует автоматическую предсердную тахикардию. Но у пациентов с предсердной тахикардией по механизму micro-re-entrу или триггерной активностью — кардиоверсия эффективна. Электрическая кардиоверсия может быть предпринята у пациентов с аритмией, резистентной к лекарственным препаратам.
Как правило, экстренная терапия предсердной тахикардии включает парентеральное введение блокаторов β-адренорецепторов или блокаторов кальциевых каналов, которые хоть и редко купируют ее, но снижают ЧСС вследствие развития АV-блокады. Непосредственного подавления очага тахикардии можно достичь путем внутривенного введения препаратов класса IА и IС или III (соталол, амиодарон). Противопоказанием для назначения антиаритмических препаратов классов IА или IС является СН, при которой предпочтительнее применение амиодарона.
Существует сложность точного дифференцирования очаговой предсердной тахикардии от тахикардии, развивающихся по другим механизмам (АV-реципрокная тахикардия или АV-узловая реципрокная тахикардия) или от других форм предсердной тахикардии. Обзор имеющихся данных поддерживает рекомендации о том, что терапию следует начинать с применения блокаторов кальциевых каналов или блокаторов β-адренорецепторов, поскольку эти препараты могут оказаться эффективными и имеют минимальные побочные действия. При их неэффективности следует применять препараты класса IА и IС (флекаинид, пропафенон) в сочетании с блокаторами кальциевых каналов или блокаторами β-адренорецепторов или препараты класса III (соталол и амиодарон). При назначении данных препаратов следует помнить о потенциальном риске их проаритмогенного действия и побочных эффектах. Поскольку предсердные тахикардии чаще всего выявляют у лиц пожилого возраста со структурной патологией сердца, препараты класса IС следует назначать только после исключения ИБС.
Политопная (полиморфная) предсердная тахикардия
Диагноз «политопная предсердная тахикардия» устанавливают, если на ЭКГ при аритмичной тахикардии регистрируют зубцы Р трех (и более) видов морфологии при разных интервалах сцепления. Ритм сердечных сокращений всегда неправильный, однако частота тахикардии не слишком высока. Этот вид нарушений ритма чаще всего определяется при хронических заболеваниях легких, но может быть связан также с метаболическими или электролитными нарушениями. Передозировка сердечных гликозидов редко приводит к развитию политопной предсердной тахикардии. Антиаритмическая терапия малоэффективна; описана незначительная эффективность блокаторов кальциевых каналов, блокаторы β-адренорецепторов обычно противопоказаны вследствие имеющегося у пациента тяжелого заболевания легких. Целью терапии является компенсация патологии легких или коррекция электролитных нарушений. Блокаторы кальциевых каналов часто назначают в качестве постоянной терапии, поскольку электрическая кардиоверсия, противоаритмические препараты и катетерная абляция неэффективны.
Трепетание предсердий
Трепетание предсердий характеризуется регулярным ритмом с частотой сокращений предсердий 250–350 уд./мин. По данным ЭФИ, по поверхностной ЭКГ можно предположить различные круги re-entry. Часто круги re-entry занимают значительные области миокарда предсердий и поэтому называются macro-re-entry. Классический тип трепетання предсердий (то есть типичное трепетание) зависит от области кавотрикуспидального перешейка, расположенного между нижней полой веной и кольцом трикуспидального клапана. Зависимость типа трепетания от конкретного перешейка — важные данные для катетерной абляции, однако она не меняет подходов к медикаментозной терапии.
Признаки истмусзависимого трепетания
Основой патофизиологии истмусзависимого трепетания является циркуляция возбуждения вокруг трехстворчатого кольца. Сrista terminalis и венозный синус, то есть область между верхней и нижней полой веной, по-видимому, является функциональным барьером для формирования круга re-entry. При типичном трепетании предсердий возбуждение циркулирует вокруг истмус-зоны против часовой стрелки, реже отмечают трепетания, при которых движение возбуждения происходит по часовой стрелке. Трепетание предсердий с re-entry против часовой стрелки на ЭКГ характеризуется отрицательными волнами f в нижних отведениях, положительными волнами f в V1, и отрицательным в V6 при частоте 250–350 уд./мин. При трепетании предсердий по часовой стрелке наблюдается противоположная ЭКГ-картина. Периодически картина ЭКГ может быть нетипичной, поэтому наличие истмусзависимого трепетания может быть установлено только с помощью инвазивного ЭФИ.
Истмусзависимое трепетание может развиваться по так называемому механизму двухволнового и нижнепетлевого re-entry. Двухволновое re-entry представляет собой круг, по которому одновременно движутся два фронта возбуждения. Такая аритмия носит временный характер и обычно прекращается в пределах 3-6 комплексов, редко переходит в фибрилляцию предсердий. При нижнепетлевом re-entry циркуляция фронта волны происходит вокруг нижней полой вены вследствие возможности проведения импульсов через crista terminalis. Образующаяся в результате петля re-entry может дать необычную ЭКГ-картину; но поскольку в одном из колен фронт re-entry проходит через кавотрикуспидальный перешеек, целесообразно выполнение абляции нижнего перешейка.
Клиника
Пациенты с трепетанием предсердий жалуются на одышку, быструю утомляемость, боль в груди. В то же время, эта аритмия может характеризоваться более серьезными симптомами, например, резкой слабостью, ощущением остановки сердца или отеком легких. Трепетание предсердий бывает у 25–30% пациентов с фибрилляцией предсердий и может быть связано с более выраженными симптомами, вследствие более частых желудочковых сокращений. В большинстве случаев трепетание предсердий характеризуется AV-проведением 2:1. Частота сокращений предсердий — приблизительно 300 уд./мин, желудочков — 150 уд./мин (трепетание с неправильным AV-проведением может проявляться чрезвычайно нерегулярным ритмом). В редких случаях, при нагрузках, может регистрироваться AV-проведение 1:1, что может приводить к угрожающим жизни состояниям. Антиаритмические препараты класса IC могут замедлять предсердную частоту, но не способствовать улучшению AV-проведения. Поэтому антиаритмические препараты класса IC следует применять сочетанно с препаратами, замедляющими AV-проведение. Пациенты с дополнительными AV-проводящими путями склонны к AV-проведению 1:1, что является опасным для жизни. Пациенты с СН, при которой скоординированное предсердное сокращение является гемодинамически значимым, могут испытывать ухудшение даже при небольшой частоте желудочковых сокращений.
Трепетание предсердий с неконтролируемой частотой желудочковых сокращений может самостоятельно усугублять кардиомиопатию. Нарушения гемодинамики из-за трепетания предсердий часто являются поздним осложнением оперативного лечения по методике Senning и Fontan врожденного порока сердца. У этих пациентов трепетание является маркером плохого прогноза.
Лечение
Класс IA антиаритмических препаратов показан с целью снижения скорости проведения в цепи re-entry, а в целом эти вещества имеют свойства сокращать период возбудимости; класс IC снижает проведение и замедляет трепетание. И напротив, III класс антиаритмических препаратов (амиодарон) увеличивает период реф-рактерности и может купировать трепетание, поскольку фронт импульса наталкивается на рефрактерную ткань. Частая предсердная стимуляция может купировать трепетание при создании функционального блока в ортодромном или антидромном плече круга re-entry. Кроме того, эффективность стимуляции может быть повышена антиаритмической терапией, которая облегчает создание зоны абсолютной рефрактерности. Электрическая кардиоверсия очень эффективна из-за моментальной гомогенной деполяризации венозного синуса. Практические значения этих эффектов освещаются в соответствующих разделах терапии.
Неотложная терапия при трепетании предсердий
Неотложная терапия для пациентов с трепетанием предсердий зависит от клинического состояния. Если у больного гемодинамический коллапс или застойная СН, то показана синхронизированная электрическая кардиоверсия (схема 5.3). Успешное восстановление синусового ритма возможно разрядом <50 Дж при использовании однофазных разрядов и даже меньшей энергией при использовании двуфазных разрядов. В большинстве случаев пациенты с трепетанием 2:1 или с более сильной AV-блокадой гемодинамически стабильны. Поэтому врач может применять препараты, замедляющие AV-проведение для контроля частоты ритма. Адекватного контроля частоты особенно важно достигнуть, если восстановление синусового ритма откладывается, например, для проведения антикоагулянтной терапии. Чреспищеводная или предсердная стимуляция является методом выбора для восстановления синусового ритма, поскольку медикаментозная кардиоверсия малоэффективна при трепетании предсердий. Независимо от метода восстановления после 48 ч трепетания предсердий необходимо применение антикоагулянтов.
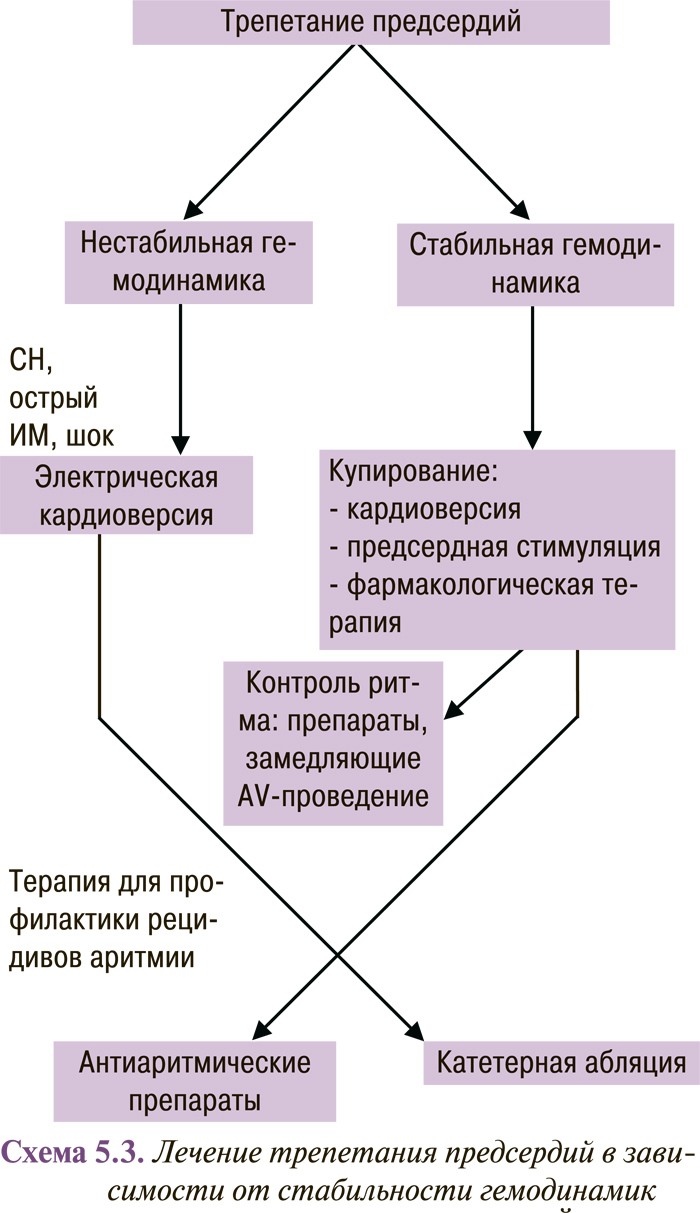
Если запланирована острая фармакологическая кардиоверсия, то контроль частоты сокращения желудочков необходим. Антиаритмические препараты класса IС могут замедлить частоту предсердных сокращений и улучшить AV-проведение, что приведет к парадоксальному увеличению желудочковых сокращений. У 60% пациентов трепетание предсердий происходит как осложнение основного заболевания, при острых заболеваниях легких, в послеоперационный период после хирургических вмешательств на легких и сердце, на фоне ИМ. Если трепетание предсердий является осложнением основного заболевания, то в большинстве случаев после восстановления ритма нет необходимости в проведении поддерживающей терапии. В случаях неотложной терапии трепетания предсердий методом выбора являются стимуляция предсердий, электрическая или фармакологическая кардиоверсия и препараты, замедляющие АV-проведение.
Проведенные исследования по применению препаратов, замедляющих АV-проведение, включают пациентов и с трепетанием предсердий, и с фибриляцией предсердий. Из них невозможно выделить данные только для трепетания предсердий, но, по мнению большинства авторов, контроль ЧСС труднее осуществлять при трепетании предсердий. В 2 рандомизированных плацебо-контролируемых двойных слепых исследованиях оценивали применение дилтиазема у больных с трепетанием и фибриляцией предсердий. Оба исследования показали снижение частоты сокращения желудочков, но дилтиазем показывал более высокую эффективность у пациентов с фибриляцией предсердий. Артериальная гипотензия была основным побочным эффектом, выявляемым у 10% больных. В проспективном открытом рандомизированном клиническом исследовании сравнивали дилтиазем и дигоксин по эффективности контроля ЧСС. Контроль ЧСС был достигнут в течение 30 мин в результате применения дилтиазема и болеее чем через 4 ч при применении дигоксина.
В большом исследовании по сравнению действия дигоксина с амиодароном установлено предпочтение внутривенного введения амиодарона при применении его для контроля частоты ритма. Внутривенное введение амиодарона оказалось менее эффективным, чем применение антагонистов кальция или блокаторов β-адренорецепторов, поскольку адекватный контроль ЧСС не был достигнут в течение 6 ч. Однако применение блокаторов β-адренорецепторов, амиодарона и антагонистов кальция редко обусловливало восстановление ритма.
Нефармакологическая неотложная терапия
Эффективность электрической кардиоверсии составляет 95–100%. Восстановление ритма может быть достигнуто разрядом от 5 до 50 Дж, особенно при использовании двуфазных волн. Для больных с нестабильной гемодинамикой рекомендуются более высокие разряды. Электроимпульсная терапия рекомендована для быстрого восстановления синусового ритма.
Использование и эффективность предсердной или трансэзофагеальной сверхчастой стимуляции для купирования трепетания предсердий давно доказаны, последняя составляет в среднем 82%. Предсердная стимуляция более эффективна в случае трепетания предсердий после операции на сердце, поскольку эти пациенты зачастую имеют эпикардиальные проводники для стимуляции. Кроме того, доказано, что прокаинамид, ибутилид, пропафенон повышают эффективность электрокардиостимуляции. Еще более эффективна стимуляция экстрастимулами. Эта стимуляция используется в современных искусственных водителях ритма. Стимуляция может заканчиваться фибрилляцией предсердий, предшествующей восстановлению синусового ритма.
Роль антикоагулянтной терапии для пациентов с трепетанием предсердий
Роль антикоагулянтной терапии для пациентов с фибрилляцией предсердий доказана во многих рандомизированных исследованиях, но такие исследования не проводились для больных с трепетанием предсердий. Основываясь на данных наблюдений, изначально считали, что риск развития эмболии при трепетании предсердий невысокий. Результат исследований свидетельствуют, что риск возникновения эмболии при трепетании предсердий значительный (в пределах 1,7–7%). Кроме того, во многих исследованиях доказано, что частота внутрисердечного тромба варьирует от 0 до 34% у пациентов без применения антикоагулянтной терапии при трепетании предсердий длительностью >48 ч. Другой причиной для беспокойства является образование тромбов в полости сердца после кардиоверсии, риск которого сохраняется в течение нескольких недель. По результатам проведенных нескольких исследований трепетания предсердий коэффициенты риска развития эмболии подобны таковым при фибрилляции предсердий. В общем, риск возникновения эмболии у больных с трепетанием предсердий во время кардиоверсии составляет 2,2%, что значительно ниже, чем при фибрилляции предсердий (5–7%). Рандомизированные исследования по трепетанию предсердий не проводились. По нашему мнению, ведение больных с трепетанием предсердий должно быть подобно ведению пациентов с фибрилляцией предсердий. Электрическую или фармакологическую кардиоверсию следует проводить у больных, которым проведена антикоагулянтная терапия и у которых МНО составляет 2–3 или аритмия существует <48 ч и по данным трансэзофагеальной эхоКГ не выявлены внутриполостные тромбы. При отрицательных результатах трансэзофагеальной эхоКГ следует проводить антикоагулянтную терапию с профилактической целью.
Катетерная абляция при истмусзависимом трепетании предсердий
Эффективность применения катетерной абляции при истмусзависимом трепетании предсердий составляет 90–100%. Рецидив фибрилляции предсердий после катетерной абляции зависит от наличия фибрилляции предсердий перед абляцией. После катетерной абляции фибрилляция предсердий возникает у 8% пациентов, у которых перед абляцией было только трепетание предсердий. Напротив, у тех больных, у которых до абляции трепетание предсердий доминировало над фибрилляцией предсердий, рецидив фибрилляции предсердий после абляции составлял до 38%. Если до катетерной абляции фибрилляция предсердий преобладала, то на протяжении 14–20 мес после ее проведения фибрилляция предсердий рецидивировала в 86%. Следовательно, следует считать более эффективной катетерную абляцию для пациентов, у которых было только трепетание предсердий, или оно доминировало над фибрилляцией предсердий.
Фибрилляция предсердий является наиболее частым нарушением ритма после операций на сердце и легких. Частота развития фибрилляции предсердий после операции на сердце составляет 20–50% в зависимости от вида операции, наиболее высока она при операциях на легочном стволе и трикуспидальном клапане.
Истмуснезависимое трепетание предсердий чаще всего связано с послеоперационным рубцом на стенках предсердий, который создает условия для циркуляции возбуждения. Обычно такому нарушению ритма предшествует операция на сердце, восстанавливающая полость, типа протезирования митрального клапана при врожденном его пороке или процедура нанесения лабиринта на предсердие. Эти аритмии прекращаются при разрушении круга macro-re-entry. Трепетание предсердий после операций на сердце может сопровождаться наличием нескольких кругов re-entry, для выявления которых необходимо проведение ЭФИ. Абляция истмуснезависимого трепетания более сложная, чем при истмусзависимом трепетании. В табл. 5.6 и 5.7 изложены рекомендации по купированию трепетания предсердий.
Таблица 5.6
Рекомендации по неотложному лечению пациентов с трепетанием предсердий
| Клиническая ситуация/стратегия терапии | Рекомендации | Эффективность |
Гемодинамически значимое трепетание предсердий:
|
Неотложная кардиоверсия
Блокаторы β-адренорецепторов Верапамил или дилтиазем Сердечные гликозиды Амиодарон |
Высокоэффективно
Эффективно Эффективно Малоэффективно Малоэффективно |
Трепетание предсердий без гемодинамических нарушений:
|
Предсердная чреспищеводная стимуляция
Электрическая кардиоверсия Ибутилид Флекаинид Пропафенон Соталол Прокаинамид Амиодарон Дилтиазем или верапамил Блокаторы β-адренорецепторов Сердечные гликозиды |
Высокоэффективно
Высокоэффективно Эффективно Малоэффективно Малоэффективно Малоэффективно Малоэффективно Малоэффективно Высокоэффективно Высокоэффективно Малоэффективно |
Таблица 5.7
Рекомендации длительного лечения при трепетании предсердий
| Клиническая ситуация/стратегия терапии | Рекомендации | Эффективность |
| Первый и хорошо переносимый пароксизм трепетания предсердий | Чреспищеводная стимуляция
Электрическая кардиоверсия Ибутилид Флекаинид Пропафенон Соталол Прокаинамид Амиодарон |
Высокоэффективно
Высокоэффективно Эффективно Малоэффективно Малоэффективно Малоэффективно Малоэффективно Малоэффективно |
| Рецидивирующее и хорошо переносимое трепетание предсердий | Катетерная абляция
Дофетилид Амиодарон Соталол Флекаинид Хинидин Пропафенон Прокаинамид Дизопирамид |
Высокоэффективно
Эффективно Малоэффективно Малоэффективно Малоэффективно Малоэффективно Малоэффективно Малоэффективно Малоэффективно |
| Плохо переносимое трепетание предсердий | Катетерная абляция | Высокоэффективно |
| Трепетание предсердий, возникшее при лечении фибрилляции предсердий антиаритмическими препаратами класса IС или амиодароном | Катетерная абляция
Отменить назначенный препарат и применить другой |
Высокоэффективно
Эффективно |
| Истмуснезависимое трепетание предсердий, рефрактерное к антиаритмической терапии | Катетерная абляция | Эффективно |
ТАХИКАРДИЯ С ШИРОКИМИ КОМПЛЕКСАМИ QRS
По широким комплексам QRS (>120 мс) важно дифференцировать наджелудочковые тахикардии от желудочковой тахикардии (схема 5.4). При лечении пациентов с наджелудочковыми тахикардиями назначаемые парентерально препараты, особенно верапамил или дилтиазем, являются потенциально опасными, поскольку могут обусловить развитие коллапса у больных с желудочковыми тахикардиями. Устойчивые симптомы тахикардии не позволяют отличить наджелудочковую тахикардию от желудочковой. Если диагноз «наджелудочковая тахикардия» невозможно подтвердить или отвергнуть, то тахиаритмию следует расценивать как желудочковую тахикардию и лечить соответственно.
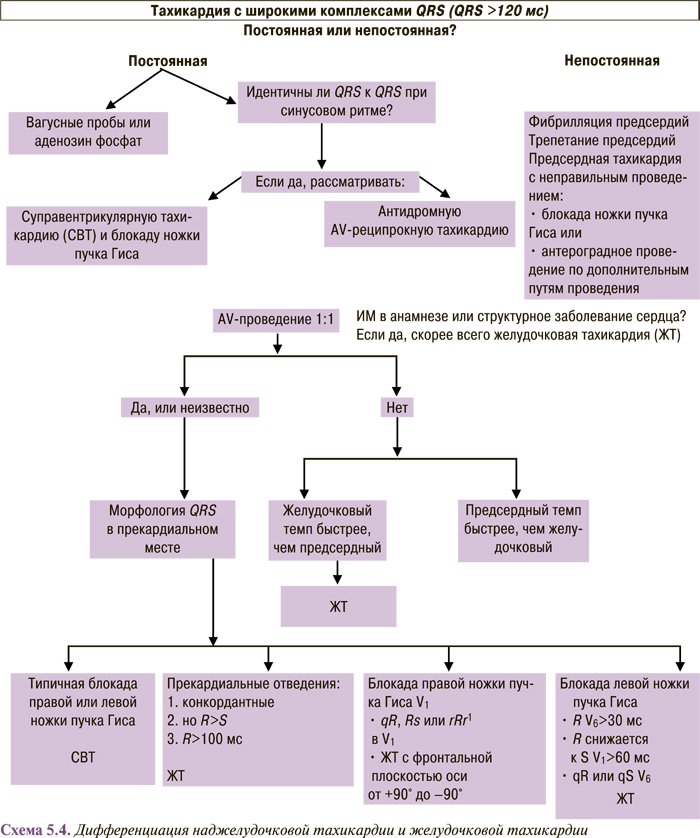
Тахикардия с широкими комплексами QRS может быть разделена на 3 группы:
- наджелудочковая тахикардия с блокадой ножек пучка Гиса;
- наджелудочковая тахикардия с проведением по дополнительному предсердно-желудочковому соединению;
- желудочковая тахикардия.
Наджелудочковая тахикардия с блокадой ножек пучка Гиса
Блокада ножек пучка Гиса может определяться исходно или возникать только во время тахикардии, когда одна из ветвей пучка Гиса находится в рефрактерном периоде из-за частого ритма. Возникновение большинства блокады ножек пучка Гиса зависит не только от частоты ритма, но также от последовательности интервалов R–R — «длинный–короткий». Блокада ножек пучка Гиса может возникнуть при любой наджелудочковой тахикардии. Если во время ортодромной АV-реципрокной тахикардии развивается блокада ножек пучка Гиса, то частота тахикардии может снизиться, если блокированная ножка пучка Гиса расположена на той же стороне (ипсилатеральная блокада), что и дополнительное предсердно-желудочковое соединение.
Наджелудочковая тахикардия с проведением по дополнительному предсердно-желудочковому соединению
Наджелудочковая тахикардия с участием дополнительного предсердно-желудочкового соединения может возникнуть во время предсердной тахикардии, трепетания предсердий, фибрилляции предсердий, АV-узловой реципрокной тахикардии или антидромной АV-реципрокной тахикардии. Последняя возникает при антероградном проведении по дополнительному предсердно-желудочковому соединению и ретроградном проведении по АV-узлу или второму дополнительному предсердно-желудочковому соединению. Широкий комплекс QRS с морфологией блокады левой ножки пучка Гиса возможен при антероградном проведении по другим видам дополнительных путей, таким как атриофасцикулярный, нодофасцикулярный или нодовентрикулярный.
Желудочковая тахикардия
Существуют некоторые ЭКГ-критерии, позволяющие дифференцировать основной механизм тахикардии с широким комплексом QRS (см. схему 5.4).
Тахикардии с широкими комплексами QRS >120 мс у взрослых могут быть вызваны наджелудочковыми аритмиями с постоянным или частотнозависимым аберрантным внутрижелудочковым проведением, наджелудочковыми аритмиями с антероградным предвозбуждением, а также желудочковыми аритмиями. Несмотря на предложенные многими авторами ЭКГ-критерии для диференциации наджелудочковой тахикардии с абберантным проведением и желудочковой тахикардии, эти различия могут вызывать затруднения, даже если для анализа доступны полные записи ЭКГ. Аритмии с антероградным предвозбуждением могут вызывать особые трудности при дифференциации с желудочковой тахикардией на основании только морфологических критериев комплексов QRS. При некоторых аритмиях, таких как re-entry, с вовлечением ветвей пучка Гиса, или тахикардии при наличии атриофасцикулярных трактов, конфигурация QRS не отличается от более распространенных форм наджелудочковой тахикардии с аберрантным проведением. Наконец, некоторые виды желудочковой тахикардии могут иметь комплексы QRS продолжительностью 120 мс при аномальной морфологии QRS, а у детей продолжительность комплексов QRS при желудочковых тахикардиях может составлять <120 мс. ЭФИ позволяет точно диагностировать практически все тахикардии с широкими комплексами, а также определить последовательность и взаимоотношения между активацией предсердий и желудочков. При этом можно зарегистрировать электрограммы от структур, не отражающихся на стандартной ЭКГ (таких как пучок Гиса или дополнительные пути проведения), а также могут быть проанализированы ответы на различные пробы со стимуляцией. Поскольку знание механизма аритмии обычно имеет критическое значение для выбора надлежащей терапии, ЭФИ часто занимают важное место в клинической диагностике у пациентов, имеющих тахикардии с широкими комплексами.
Неотложная терапия тахикардии с широкими комплексами QRS
Экстренная электроимпульсная терапия показана при гемодинамически значимых тахикардиях. Если тахикардия не приводит к гемодинамическим нарушениям и является наджелудочковой, то лечение такое же, как и при тахикардии с узкими комплексами QRS (схема 5.5). Для купирования тахикардии с широкими QRS-комплексами при отсутствии нарушений гемодинамики можно применять прокаинамид или соталол в парентеральных формах (рекомендации даны на основании малочисленных рандомизированных исследований). Также может быть использован амиодарон. Ему отдается предпочтение, по сравнению с прокаинамидом и соталолом при лечении пациентов со сниженной ФВ ЛЖ или с признаками СН. В отдельных случаях может потребоваться альтернативная терапия (например тахикардия с предвозбуждением желудочков и желудочковая тахикардия при дигиталисной интоксикации). Для купирования тахикардии с широким комплексом QRS (фибрилляция предсердий с проведением по дополнительному предсердно-желудочковому соединению) рекомендуется электроимпульсная терапия. Если у пациента нет гемодинамических нарушений, можно прибегнуть к фармакологической кардиоверсии с внутривенным введением ибутилида или флекаинида.
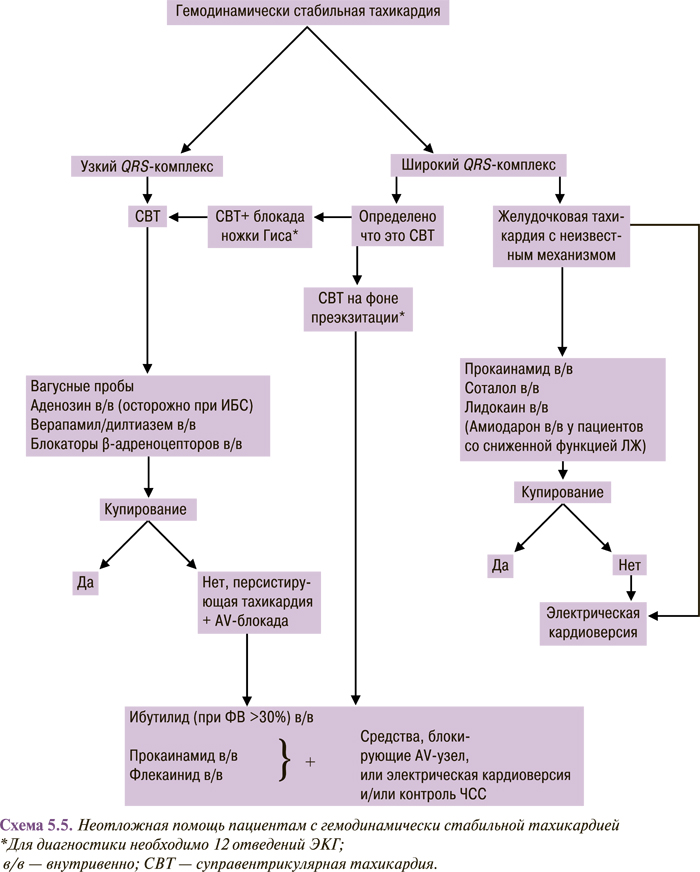
После успешного купирования тахикардии с широкими комплексами QRS неизвестной этиологии пациента следует направить к аритмологу. Пациентам с гемодинамически незначимой тахикардией с узкими комплексами QRS, сохранной функцией ЛЖ и нормальной ЭКГ во время синусового ритма (отсутствие синдрома предвозбуждения желудочков) специфическая терапия может не потребоваться. Консультация врача-специалиста показана пациентам, резистентным к медикаментозной терапии или плохо ее переносящим, а также лицам, не желающим постоянно принимать антиаритмические препараты. При необходимости лечения должен быть сделан выбор: катетерная абляция или медикаментозная терапия. В связи с риском летального исхода всем больным с WPW-синдромом (синдром предвозбуждения желудочков в сочетании с аритмией) показано проведение дальнейшего обследования.
ПОМОЩЬ ПАЦИЕНТАМ С ГЕМОДИНАМИЧЕСКИ СТАБИЛЬНОЙ ТАХИКАРДИЕЙ
Суправентрикулярная тахикардия у беременных
Предсердные экстрасистолы регистрируются в период беременности у 50% пациенток и достаточно хорошо переносятся. Пароксизмы суправентрикулярных тахикардий относительно редки, регистрируются в 3–4 на 10 тыс. наблюдений. Усугубление пароксизмальной суправентрикулярной тахикардии происходит у 20% пациенток в период беременности.
Основной риск при лечении суправентрикулярной тахикардии у беременных обусловлен неблагоприятным воздействием антиаритмических препаратов на плод, поскольку все антиаритмические препараты проникают через ГЭБ. Первые 8 нед беременности — наиболее терратогенный период. Во II и III триместр беременности антиаритмические препараты смогут вызывать нарушение роста и развития плода, а также проаритмогенный эффект у матери. К усугублению клиники аритмии в период беременности приводят следующие физиологические изменения:
- повышается нагрузка на сердце;
- увеличивается ОЦК;
- уменьшается количество белка в сыворотке крови;
- изменяется желудочная секреция и моторика кишечника;
- изменяется активность ферментов печени;
- изменятся биоэквивалентность антиаритмических препаратов.
В 1994 г. в США разработана классификация US Food and Drug Administration (FDA) антиаритмических средств по степени риска их применения у беременных: А — при адекватных хорошо контролируемых исследованиях у беременных риск для плода не установлен; В — сведений о риске у беременных нет; С — риск не определен (при отсутствии соответствующих данных у человека, в исследованиях на животных зарегистрировано как наличие, так и отсутствие негативного влияния на плод); D — наличие достоверного риска для плода (выявлен риск при проведении специальных маркетинговых исследований, однако в ряде наблюдений положительный эффект препарата превышает возможный риск его применения); X — назначение препаратов при беременности противопоказано.
Согласно данной классификации все антиаритмические препараты необходимо рассматривать как потенциально опасные для плода, применения которых необходимо избегать в I триместр беременности. В настоящее время антиаритмические средства, применяемые при купировании суправентрикулярной тахикардии, относятся к классу С, и только соталол относится к классу В, а амиодарон и атенолол — к классу D.
Катетерную абляцию необходимо проводить до наступления беременности. Имеющийся опыт по проведению катетерной абляции в период беременности не дает однозначного ответа, хотя потенциально опасная доза облучения для плода рассчитана. Проведение катетерной абляции показано при неэффективности антиаритмической терапии и должно быть выполнено во II триместр беременности. Из-за потенциальной вероятности рецидивов аритмии не следует прерывать применение антиаритмических средств в период беременности, кроме отдельных ситуаций.
Неотложная терапия при AV-узловой тахикардии
Терапию по купированию АV-узловой реципрокной тахикардии следует начинать с вагусных проб, при их неэффективности препаратом выбора является аденозин фосфат. Его успешно применяют у беременных во II и III триместр беременности. Если аденозин фосфат неэффективен, следует использовать блокаторы β-адренорецепторов (пропранолол или метопролол). Внутривенное введение верапамила рисковано в связи с возможным развитием гипотензии у матери с последующей гипоксией плода. Имеются сообщения в литературе о том, что электрическая кардиоверсия — наиболее безопасное восстановление ритма в любой период беременности.
Профилактическая терапия
При необходимости профилактической терапии средствами первой линии являются дигоксин, блокаторы β-адренорецепторов (пропанолол, метопролол). Большой опыт применения дигоксина у беременных указывает на его безопасность в течение беременности по сравнению с другими антиаритмическими препаратами. Пропранолол и метопролол более эффективны и безопасны, но их следует избегать в I триместр беременности. Среди известных неблагоприятных воздействий блокаторов β-адренорецепторов (а именно, брадикардия, гипогликемия, преждевременные роды) наиболее часто отмечают метаболические нарушения и гипотрофию плода. Однако результаты больших исследований свидетельствуют, что частота осложнений при применении блокаторов β-адренорецепторов идентична плацебо. Пропранолол при применении в I триместр задерживает внутриутробное развитие плода. Кардиоселективные блокаторы β-адренорецепторов более безопасны, поскольку меньше влияют на периферическую вазодилатацию и тонус матки и оказывают большую эффективность и длительность действия. Если блокаторы β-адренорецепторов неэффективны, следует применять соталол. Его успешно используют при других нарушениях ритма (фибрилляции предсердий и желудочковых аритмиях) в период беременности. Опыт его применения недостаточен, поэтому применение его должно быть строго по показаниям и в минимально эффективных дозах.
Флекаинид относится к препаратам, противопоказанным при беременности, и применение его при суправентрикулярных нарушениях ритма нецелесообразно. Пропафенон противопоказан к применению в I триместр беременности, однако неблагоприятные эффекты на плод не зарегистрированы при применении его во II и III триместр. Хинидин является относительно хорошо переносимым препаратом, но с ним связывают ряд неблагоприятных эффектов: тромбоцитопению у плода, токсическое поражение VIII пары черепно-мозговых нервов. Прокаинамид применяют только для оказания неотложной помощи. Амиодарон относится к классу D и его применение в период беременности ограничивается аритмиями, не купирующимися другими медикаментозными средствами и угрожающими жизни пациентки. Возможно применение его короткими курсами до стабилизации состояния пациентки. Табл. 5.8 содержит рекомендации по лечению суправентрикулярной тахикардии у беременных.
Таблица 5.8
Рекомендации по стратегии лечения суправентрикулярной тахикардии у беременных
| Стратегия лечения | Рекомендации | Эффективность | |||
| Неотложное восстановление пароксизмальной суправентрикулярной тахикардии
|
Вагусные пробы
Аденозин фосфат Электрическая кардиоверсия Метопролол, пропранолол Верапамил
|
Высокоэффективно
Высокоэффективно Высокоэффективно Эффективны Малоэфективно
|
|||
| Профилактическое лечение
|
Дигоксин
Метопролол Пропранолол Соталол, флекаинид Хинидин, пропафенон Верапамил Прокаинамид Катетерная абляция Атенолол
Амиодарон |
Высокоэффективно Высокоэффективно Эффективно Эффективно Малоэффективно Малоэффективно Малоэффективно Малоэффективно Не показан
Не показан
|
|||
ТАХИКАРДИИ У ПАЦИЕНТОВ С ВРОЖДЕННЫМ ПОРОКОМ СЕРДЦА
С каждым годом все больше пациентов с врожденным пороком сердца доживают до совершеннолетия. У пациентов, которым не проводили оперативное лечение, наиболее частыми нарушениями ритма являются трепетание и фибрилляция предсердий. Причиной аритмии может быть повышение давления в предсердиях. У пациентов, которым проведено оперативное лечение, послеоперационный рубец на стенке предсердия предрасполагает к рубецзависимому трепетанию предсердий в поздний послеоперационный период. Появление аритмии может свидетельствовать об ухудшении гемодинамики, такая ситуация требует тщательного обследования, а иногда и последующего оперативного лечения. Возникновение суправентрикулярной тахикардии ухудшает гемодинамику. Усиленная или спровоцированная антиаритмическими препаратами, хирургическим лечением дисфункция синусного узла требует имплантации стимулятора. Врожденные кардиальные пороки затрудняют установление искусственного водителя ритма и катетерную абляцию. Дефекты перегородок создают риск развития системной эмболии тромбами, которые могут формироваться при стимуляции, даже если электроды находятся только в правых отделах сердца.
Дефект межпредсердной перегородки
Фибрилляция и трепетание предсердий происходят приблизительно у 20% совершеннолетних пациентов с неоперированным дефектом межпредсердной перегородки. Фибрилляцию предсердий выявляют чаще, чем трепетание предсердий, частота случаев пароксизмов повышается с возрастом пациентов. Хирургическая или эндокардиальная коррекция порока сердца при соотношении легочного и системного кровотока >1,5 в возрасте младше 40 лет может вызывать предсердные нарушения ритма, а старше 40 лет — неэффективна.
Лечение при трепетании предсердий проводят согласно рекомендациям, изложенным в предыдущих разделах. У неоперированных пациентов трепетание, очевидно, является истмусзависимым, а значит, и чувствительным к катетерной абляции. Если закрытие порока оперативным путем не показано в связи с состоянием гемодинамики, то показана абляция, которая наверняка прекратит трепетание предсердий, в отличие от оперативного лечения. У пациентов с пороком после оперативного лечения может быть как истмусзависимое, так и истмуснезависимое рубецзависимое трепетание. Обе эти формы могут сочетаться у одного пациента. Лечение проводят при этом как и в предыдущих случаях: если показана катетерная абляция, то необходимо рассматривать возможность того, что трепетание может остаться после абляции. В подобных случаях абляция должна выполняться после предварительного трехмерного ЭФИ.
Транспозиция магистральных сосудов
Предсердные тахикардии очень часто бывают после оперативного лечения по поводу транспозиции магистральных сосудов. После оперативной коррекции порока по методу Mustard & Senning венозная кровь попадает в морфологический ЛЖ. Он сообщается с ЛА, по которой кровь попадает в морфологический ПЖ, который сообщается с аортой. Хирургическое вмешательство на предсердиях значительно, поэтому очень часто отмечают послеоперационную дисфункцию синусного узла. Потеря предсердного выброса и повышение частоты сокращения желудочков может дестабилизировать гемодинамику у данных пациентов.
Развитие предсердной аритмии всегда сопровождается нарушением ФВ. Подобные аритмии часто рецидивируют, и удерживать синусовый ритм не рекомендовано, поэтому по данным большинства исследований развитие предсердных аритмий всегда связано с риском внезапной смерти. Нарушение ФВ, риск внезапной смерти и дисфункция синусного узла ограничивают выбор антиаритмического препарата. Катетерная абляция обычно эффективна, но выполняется труднее, чем у пациентов без порока. Ее следует проводить в специализированном центре.
Тетрада Фалло
Предсердные разрезы, производимые во время оперативного лечения, предрасполагают к возникновению рубецзависимого трепетания предсердий. У большинства пациентов на ЭКГ синусовый ритм сопровождается полной блокадой правой ножки пучка Гиса. Следовательно, суправентрикулярная тахикардия возникает при замедлении проведения импульса по правой ножке пучка Гиса. Трепетание предсердий ухудшает гемодинамику у некоторых пациентов. Неотложную помощь проводят в зависимости от стабильности гемодинамики пациента. Правильная диагностика нарушения ритма очень важна для подбора терапии. Показаны ЭФИ и консультация аритмолога. Трепетание предсердий может быть истмусзависимым и рубецзависимым. Развитие трепетания предсердий может быть признаком митральной и трикуспидальной функциональной регургитации. В таком случае рекомендовано повторное оперативное лечение. Постоянную антиаритмическую терапию проводят так же, как и в вышеизложенных случаях.
Аномалия Эбштейна
Наличие дополнительных путей проведения диагностируют у 25% больных, наиболее часто они располагаются справа. При этой патологии регистрируются АV-реципрокная тахикардия, предсердная тахикардия, фибрилляция предсердий и эктопическая предсердная тахикардия. Блокада правой ножки пучка Гиса указывает на наличие дополнительного проводящего пути в правых отделах, но также может и маскировать наличие предвозбуждения на ЭКГ. Признаки блокады правой ножки пучка Гиса могут быть при антидромной тахикардии с участием дополнительных путей проведения, при желудочковой тахикардии, АV-реципрокной тахикардии или трепетании предсердий. Порок может быть незначительным и не проявляться симптоматикой. Напротив, регургитация на трикуспидальном клапане может быть причиной цианоза и ухудшения гемодинамики, которое могут усугублять нарушения ритма. В зависимости от значимости порока и вида аритмии нарушения ритма могут приводить к смерти. Внезапная смерть может быть следствием частых желудочковых сокращений при фибрилляции предсердий на фоне дополнительных путей проведения. Если данный порок требует оперативного лечения, а у пациента зарегистрирована суправентрикулярная тахикардия, хирургическое лечение аритмии следует рассматривать как этап коррекции порока. Показано предоперационное ЭФИ. Неудача при пересечении дополнительных путей проведения может быть причиной реципрокной тахикардии и нестабильности пациента в периоперационный период, поэтому катетерная абляция показана перед операцией. Наличие врожденного порока сердца и дополнительных путей проведения затрудняют диагностику и точное определение локализации дополнительных путей проведения. По данным Pediatric Radiofrequency Ablation Registry, из 65 пациентов лишь у 75–89% абляция была успешной в зависимости от локализации дополнительных путей проведения (на перегородке, на свободной стенке). Рецидивы аритмии регистрировали после абляции у 32%.
Реконструкции предсердно-легочного шунта по методу Fontan
Рубецзависимое трепетание или фибрилляция предсердий бывают у 57% пациентов в зависимости от специфики операции. Предсердные нарушения ритма могут вызывать быстрое ухудшение гемодинамики и приводить к остановке сердца. Неотложная помощь при трепетании предсердий изложена выше. Катетерная абляция может быть эффективной, но при наличии нескольких цепей вращения возбуждения проведение ее затруднено. Операцию необходимо выполнять только в высокоспециализированных центрах. В дополнение к низкой эффективности самой катетерной абляции при реконструкции предсердно-легочного шунта по методу Fontan достаточно высока частота рецидивов после первоначально успешной абляции, что снижает эффективность этого вида лечения. Табл. 5.9 содержит рекомендации по лечению суправентрикулярных тахикардий при врожденных пороках сердца у совершеннолетних пациентов.
Таблица 5.9
Рекомендации по лечению суправентрикулярных тахикардий у взрослых с врожденными пороками сердца
| Клиническая ситуация | Рекомендации | Эффективность |
| Неэффективная терапия антиаритмическими и симптоматическими средствами | ||
| Прооперированный ДМПП* | Катетерная абляция в специализированном центре | Высокоэффективно |
| Прооперированная по методике Mustard или Senning транспозиция магистральных сосудов | Катетерная абляция в специализированном центре | Высокоэффективно |
| Неоперированный бессимптомный ДМПП гемодинамически незначимый | Закрытие ДМПП для лечения аритмии | Неэффективно |
| Неоперированный гемодинамически значимый ДМПП с трепетанием предсердий** | Закрытие ДМПП с абляцией зоны перешейка | Высокоэффективно |
| Пароксизмальная суправентрикулярная тахикардия и аномалия Эбштейна с гемодинамическими нарушениями и показаниями для хирургического лечения | Хирургическая абляция дополнительных путей проведения во время оперативного лечения в специализированном центре | Высокоэффективно |
*ДМПП — дефект межпредсердной перегородки;
**терапия для восстановления и профилактики такая же, как и при трепетании предсердий.
ЛИТЕРАТУРА
- Ардашев В.Н., Стеклов В.И. (1998) Лечение нарушений сердечного ритма. М., 165 с.
- Бунин Ю.А. (2003) Лечение тахиаритмий сердца. М., 114 с.
- Ди Марко Дж. (1996) Нарушения ритма и проводимости сердца. Кардиология в таблицах и схемах. Под ред. М. Фрида и С. Грайнса. М.: Практика, с. 201-235.
- Дощицин В.Л. (1993) Лечение аритмий сердца. М., Медицина, 320 с.
- Дощицин В.Л., Чернова Е.В. (1996) Неотложная помощь больным с нарушениями сердечного ритма. Российский кардиологический журнал, № 6, с. 13-17.
- Кушаковский М.С. (1992) Аритмии сердца. С-Пб.: Гиппократ, 544 с.
- Кушаковский М.С. (1998) Аритмии сердца. 2-е изд., С-Пб., Фолиант, 640 с.
- Мазур Н.А. (1992) Пароксизмальные тахикардии. М.: Медицина,. 205 с.
- Мандел В.Дж. (1996) Аритмии сердца. М.: Медицина, т. 1, с. 453-507.
- Миклашевич И.М., Школьников М.А., Сыркин А.Л. (2002) Естественное течение суправентрикулярных тахиаритмий, манифестировавших в детском возрасте. Вестник аритмологии, № 12 (15), с. 60-65.
- Прохорович Е.А., Талибов О.Б., Тополянский А.В. (2002) Лечение нарушений ритма и проводимости на догоспитальном этапе. Лечащий врач, № 3, с. 56-60.
- Рекомендации Всероссийского научного общества специалистов по клинической электрофизиологии, аритмологии и кардиостимуляции по проведению клинических электрофизиологических исследований, катетерной абляции и имплантации антиаритмических устройств. М.: Золотой абрикос, 238 с.
- Руда М.Я., Меркулова И.Н., Драгнев А.Г. и др. (1996) Клиническое изучение нового антиаритмического препарата III класса нибентана. Сообщение 2: эффективность у больных с суправентрикулярными нарушениями ритма. Кардиология, № 6, с. 28-37.
- Фомина И.Г. (2003) Нарушения сердечного ритма. М., Русский врач, 192 с.
- Фролов А.И. (1997) Пароксизмальные суправентрикулярные тахикардии. Ліквання та діагностика, № 3, с. 55
- ACC/AHA/ESC guidelines for management of patients with atrial fibrillation (2001) European Heart J., 22, 1852-1923.
- Blomström-Lundqvist С. and Scheinman М.М. et al. ACC/AHA/ESC Guidelines for the Management of Patients With Supraventricular Arrhythmias — Executive Summary. A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Develop Guidelines for the Management of Patients With Supraventricular Arrhythmias).