Легочная гипертензия
Содержание
ОПРЕДЕЛЕНИЕ
Легочная (артериальная) гипертензия (ЛГ) — синдром, связанный с группой разных по своей природе заболеваний, при котором отмечают сложные нарушения функции эндотелия легочных сосудов, его пролиферацию и ремоделирование легочных сосудов. Течение заболевания характеризуется прогрессивным повышением легочного сосудистого сопротивления (ЛСС), приводящего к нарушению функции ПЖ, СН и преждевременной смерти. Основным клиническим признаком ЛГ является уровень среднего АД в ЛА выше 25 мм рт. ст. в покое и 30 во время нагрузки. ПЖ — насос системы низкого давления, который хорошо адаптируется к нагрузке объемом, но очень плохо — к нагрузке давлением, что приводит к его гипертрофии и дисфункции. Легочное сердце (cor pulmonale) определяют при развитии дисфункции ПЖ вследствие ЛГ, ассоциированной с хроническими заболеваниями паренхимы легких.
КЛАССИФИКАЦИЯ
ЛГ включает идиопатическую или первичную форму ЛГ, в том числе так называемую семейную форму, ЛГ при поражении сосудов при системных заболеваниях соединительной ткани, при врожденных пороках сердца вследствие шунтирования крови из большого круга кровообращения в малый, портальной гипертензии, ВИЧ-инфекции, хронической рецидивующей ТЭЛА, поражения левой половины сердца и заболеваний легких. Все эти болезни имеют общие патофизиологические механизмы, включающие прогрессивные изменения легочной микроциркуляции.
Современная клиническая классификация ЛГ (Venice expert meeting, 2003) представлена в табл. 1.1.
Согласно МКБ-10 первичная ЛГ кодируется I27.0, другие уточненные формы ЛГ — I27.8, другие формы ЛГ неуточненные — I27.9, а ЛГ после ТЭЛА — I26.
Таблица 1.1
Клиническая классификация ЛГ
| 1. ЛГ
1.1. Идиопатическая ЛГ 1.2. Семейная ЛГ 1.3. ЛГ, ассоциированная с: — заболеваниями соединительной ткани; — врожденными пороками сердца с шунтированием крови слева направо; — портальной гипертензией; — ВИЧ-инфекцией; — лекарственными средствами или токсинами; — другими заболеваниями (болезни щитовидной железы, гликогенопатии, болезнь Гоше, врожденная геморрагическая телеангиэктазия, гемоглобинопатии, миелопролиферативные заболевания, спленэктомия) 1.4. ЛГ, ассоциированная с болезнями вен или капилляров: — легочная веноокклюзивная болезнь; — гемоангиоматоз легочных капилляров 1.5. Персистентная ЛГ новорожденных |
| 2. ЛГ при заболеваниях левой половины сердца
2.1. ЛГ при заболевании левого предсердия или ЛЖ 2.2. ЛГ при клапанных пороках левой половины сердца |
| 3. ЛГ при заболеваниях легких и/или гипоксии
3.1. ЛГ при ХОБЛ 3.2. ЛГ при интерстициальных заболеваниях легких 3.3. ЛГ при нарушениях сна 3.4. ЛГ при гиповентиляционной патологии альвеол 3.5. ЛГ при хроническом пребывании на высокогорье 3.6. ЛГ при пороках развития легких |
| 4. ЛГ вследствие хронического тромбоза или эмболии
4.1. ЛГ вследствие тромбоэмболической обструкции проксимальных ветвей ЛА 4.2. ЛГ вследствие тромбоэмболической обструкции дистальных ветвей ЛА 4.3. ЛГ вследствие нетромботической эмболизации ЛА (опухоль, паразиты, инородные материалы) |
| 5. Редкие формы (саркоидоз, гистоцитоз Х, лимфоангиоматоз легочных сосудов, вследствие компрессии ЛА — аденопатия, опухоль, фиброзирующий медиастенит) |
ЭПИДЕМИОЛОГИЯ
Данные относительно распространенности ЛГ имеют разнородный характер из-за практического отсутствия четких регистров и значительного количества нозологических форм, отнесенных к этому синдрому. В Украине официальных статистических данных по распространенности ЛГ нет. По данным американских регистров, идиопатическую ЛГ выявляют в 1–4 случаях на 1 млн населения. В то же время эксперты отмечают, что указанная частота может быть большей при более агрессивном использовании диагностических инструментальных методик. Соотношение мужчины/женщины среди больных с ЛГ составляет 1:2. Средний возраст при установлении диагноза — 36 лет. Средняя продолжительность симптомов заболевания до установления диагноза составляет приблизительно 2 года, выживание в течение 1 года — 68%, на протяжении 3 лет — 48%, 5 лет — 34%. Средняя продолжительность жизни после установления диагноза составляет 2,8 года.
ЭТИОЛОГИЯ
Семейная форма ЛГ составляет 6–10% всех случаев этого заболевания. Развитие семейных форм ЛГ связывают с мутациями рецепторов семейства факторов роста TGF-β. Более 50% больных с семейной формой ЛГ и до 20% спорадичных случаев оказываются редкими мутациями рецепторов морфогенетического протеина костного мозга. Этот цитокин является мощным регулятором и индуктором роста гладкомышечных клеток сосудистой стенки и апоптоза.
Более редким врожденным вариантом ЛГ является наследственная геморрагическая телеангиэктазия. Это заболевание обусловлено мутацией другого гена — ALK 1. Знания о генетических мутациях, ассоциированных с ЛГ, постоянно расширяются, возможно, будут выявлены и другие гены, играющие роль в развитии этого заболевания.
При системных заболеваниях соединительной ткани могут отмечать ЛГ как с поражением паренхимы легких, так и без него. По данным разных регистров только около 40% больных системными заболеваниями соединительной ткани не имеют поражения паренхимы или сосудов легких. Среди других 60% больных 19% имеют изолированную ЛГ, 22% — поражение паренхимы легких и 19% — сочетанную патологию. ЛГ выявляют у 37% пациентов с системной склеродермией, у 14% — системной красной волчанкой и у 5% — с ревматоидным артритом. По этим данным, еще около 13% пациентов с системными заболеваниями соединительной ткани имеют недиагностированную ЛГ.
Распространенность ЛГ вследствие врожденных пороков сердца с шунтированием крови слева направо точно не установлена, но учитывая, что частота врожденных пороков сердца составляет около 0,8% всех живорожденных, в Украине это означает появление 5 тыс. случаев врожденных пороков сердца ежегодно. Количество таких больных продолжает увеличиваться, в том числе и вследствие улучшения оказания им помощи, усовершенствования хирургического лечения. Размер и локализация шунта, а также генетические факторы и реакция системы нейроэндокринной регуляции определяют скорость и степень развития ЛГ. По данным американских исследователей, выживание таких больных несколько лучше, чем пациентов с другими типами ЛГ; при условии хирургической коррекции 1-летнее выживание составляет 92%, 2-летнее — 89%, 3-летнее — 77%, и 5-летнее — 77%.
Легочно-печеночные сосудистые нарушения на поздних стадиях поражения печени включают гепатопульмональный синдром и портопульмональную АГ. Гепатопульмональный синдром, который отмечают у 20% пациентов с болезнями печени, характеризуется прогрессивной гипоксемией вследствие вазодилатации внутрилегочных сосудов. Это состояние не вызывает ЛГ и проходит после трансплантации печени. Портопульмональный тип ЛГ характеризуется повышением давления в ЛА без снижения оксигенации крови, его выявляют приблизительно у 20% больных на поздних стадиях поражения печени.
Выделяют три гемодинамических типа:
(а) гипердинамический тип, при котором отмечают умеренное повышение давления в ЛА (при этом значительно увеличивается сердечный выброс), нормальное легочное капиллярное давление (давление заклинивания) и сниженное ЛСС;
(б) гиперволемический тип, при котором увеличивается ОЦК, умеренно возрастает давление в ЛА, увеличивается сердечный выброс, повышается давление в легочных капиллярах при нормальном ЛСС;
(в) вазопролиферативный тип — наиболее редкий и связанный со значительным повышением давления в ЛА и ЛСС, умеренным снижением легочного капиллярного давления и умеренным увеличением, с дальнейшим уменьшением в динамике, сердечного выброса. Вообще после трансплантации печени ЛГ уменьшается или исчезает, но в ряде случаев проведение операции связано с высоким риском.
ЛГ, ассоциированная с ВИЧ-инфекцией, составляет 0,5% всех случаев. Некоторые эксперты усматривают ассоциацию ЛГ со смешанным инфицированием человека ВИЧ и вирусом герпеса 8-го типа, при котором развивается саркома Капоши. Выживание составляет 58% на 1-м году, 39% — за 2 года и 21% — в течение 3 лет.
Препараты и токсины, связанные с развитием ЛГ, включают анорексигенные препараты — аминорекс, амфетамины и кокаин. Использование этих лекарственных средств на протяжении более чем 3 мес повышает риск развития ЛГ в 30 раз по сравнению со здоровым населением. Считают, что развитие ЛГ может быть опосредовано нарушением функционирования транспортера серотонина, который локализуется в гладких мышцах сосудов легочного бассейна.
Установлено, что 20–40% пациентов с β-таласемией и серповидно-клеточной анемией склонны к развитию ЛГ. Развитие ЛГ ухудшает прогноз заболевания: смертность при серповидно-клеточной анемии с ЛГ значительно выше, чем при серповидно-клеточной анемии без ЛГ.
Развитие ЛГ часто отмечают у пациентов с тяжелыми заболеваниями бронхов и легких. Согласно современным представлениям, ХОБЛ — состояние, которое характеризуется прогрессирующей необратимой обструкцией дыхательных путей с патологическим воспалительным ответом и фиброзом легких вследствие воздействия вредных частичек и газов. Прогрессирование обструкции дыхательных путей наступает вследствие как воспаления бронхиол, так и снижения эластичности паренхимы легких из-за ее воспалительной деструкции, эластолизиса и потери соответствующих альвеол. Морфологически это проявляется хроническим бронхитом, бронхиолитом и эмфиземой. Воспаленные участки легочной и бронхиальной ткани выделяют реактивные продукты перекисного окисления, которые в свою очередь высвобождают провоспалительные цитокины. При ХОБЛ в легочной сосудистой сети также повышена экспрессия эндотелина-1, особенно в период обострения заболевания.
Поражение паренхимы легких может быть следствием системных заболеваний соединительной ткани, которые описаны выше, или вследствие идиопатического легочного фиброза (фиброзирующий альвеолит), и очень редко — саркоидоз легких.
В зависимости от этиологии, распространенность ЛГ при ХОБЛ может варьировать. Так, ЛГ выявляют у 31% больных с идиопатическим легочным фиброзом. Наличие ЛГ приводит к более значительному функциональному ограничению и сопровождается более высокой смертностью. Отмечают линейную обратную корреляцию между давлением в ЛА и клиническим прогнозом. Смертность при наличии симптомов ЛГ в 3 раза выше, чем без ЛГ.
Синдром ночного апноэ — наиболее опасная форма нарушения сна: его выявляют у 5–15% взрослого населения. Следствием синдрома ночного апноэ являются АГ, инсульт, аритмии и блокады сердца, а также ЛГ, особенно у больных с ХОБЛ. Точной патогенетической связи между синдромом ночного апноэ и ЛГ не выявлено. Возможно, что развитию ЛГ способствуют те же факторы, что и в отношении других упомянутых патологических состояний: гипоксемия, нарушение вегетативной регуляции, гиперсимпатикотония, дисфункция эндотелия, гиперагрегация тромбоцитов, активация провоспалительных и протромботических факторов и другие. По мнению большинства авторов, ведущим фактором для формирования ЛГ при синдроме ночного апноэ является нарушение функции эндотелия и гиперсекреция эндотелина-1. Обычно пациенты с синдромом ночного апноэ и ЛГ — это лица старшего возраста, имеющие сниженную функцию легких. При синдроме ночного апноэ ЛГ имеет умеренный характер и, как правило, отмечают положительный ответ на применение специфического лечения синдрома ночного апноэ — использование дыхания с положительным давлением в конце выдоха.
ЛГ вследствие хронического тромбоза или эмболии развивается у 0,1–4% больных, перенесших острую легочную эмболию. Тем не менее, по мнению многих авторов, ее распространенность недооценена. Тромбоэмболические события отмечают в анамнезе у 60% больных с ЛГ, а нарушение коагуляции (наиболее часто положительный титр волчаночного антикоагулянта) — у 30% пациентов. Полиморфизм гена транспортера серотонина выявляют у 30% больных с хронической тромбоэмболической ЛГ. Наличие этого генетического полиморфизма, возможно, неблагоприятно модулирует клиническое течение болезни. Правильный диагноз этой формы ЛГ крайне важен, потому что некоторые пациенты могут быть излечены методом хирургической тромбэктомии.
Хроническая ЛГ может быть следствием поражения левой половины сердца — СН вследствие приобретенных пороков сердца и/или нарушения его сократительной способности (ИХС, ДКМП и миокардит) или наполнения (АГ, ГКМП и рестриктивная кардиомиопатии). Около 2/3 больных c левосторонней СН имеют нарушение систолической функции ЛЖ и 1/3 — диастолической функции. Хроническую СН с систолической дисфункцией ЛЖ отмечают приблизительно у 1% населения, которое в Украине составляет около 500 тыс. Количество таких больных увеличивается из года в год. Это связано как с естественным процессом старения населения, так и повышением эффективности лечения и выживания больных с хронической СН. Чаще при этих состояниях ЛГ имеет мягкий характер, но приблизительно у 1/3 больных она может быть тяжелой. Прогноз целиком зависит от прогноза основного заболевания. Соответственно следует проводить более тщательное обследование всех больных с хронической СН с целью выявления у них ЛГ.
ПАТОГЕНЕЗ
Патогенез ЛГ до настоящего времени недостаточно исследован. Участие основных патогенетических механизмов в формировании ЛГ представлено на рис. 1.1. В процесс формирования ЛГ в различной степени на разных стадиях процесса вовлекаются системы регуляции кровообращения, вазоактивные субстанции, факторы роста, медиаторы воспаления, тромбоцитарные факторы, компоненты свертывающей системы крови.
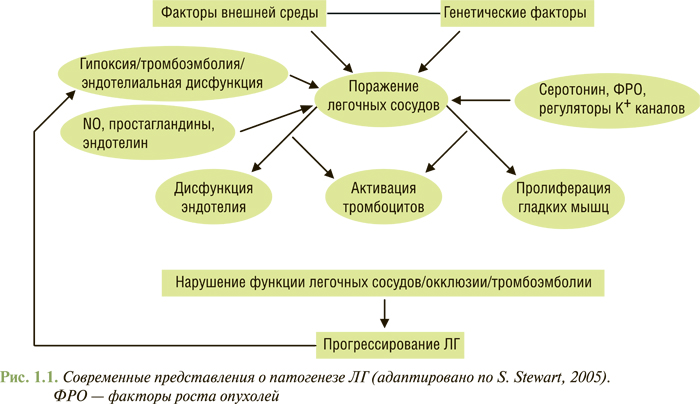
Ключевым моментом патогенеза ЛГ является дисфункция эндотелия легочных сосудов. Она может возникнуть из-за наследственных механизмов и под влиянием факторов внешней среды, изменяющих естественный баланс метаболизма оксида азота, с одной стороны, и эндотелина и тромбоксана — с другой. Это приводит к нарушениям вазореактивности легочных сосудов и их вазоконстрикции. Вследствие такого дисбаланса активируются внутриклеточные механизмы, запускающие гиперплазию и гипертрофию гладкомышечных элементов, апоптоз, пролиферацию фибробластов, воспаление и ангиогенез.
Одним из ключевых моментов патогенеза АГ является активация рецепторов к эндотелину. Эта активация может иметь острые и хронические последствия. К острым относят вазоконстрикцию и воспаление, к хроническим — пролиферацию фибробластов, чрезмерный синтез компонентов экстрацеллюлярного матрикса, ремоделирование легочных сосудов, повышение секреции ренина и альдостерона, образование ангиотензина II, гипертрофию кардиомиоцитов. Причиной роста концентрации эндотелина может быть как увеличение его продукции, так и уменьшение его утилизации в легких. Значительное повышение содержания эндотелина отмечают при идиопатической форме ЛГ, врожденных пороках сердца, заболеваниях соединительной ткани. Эффекты эндо-телина реализуются посредством эндотелиновых рецепторов А- и В-типов. А-тип локализуется на клетках гладких мышц, а В-тип — на клетках эндотелия. Блокада эффектов эндотелина может включать как уменьшение его образования (ингибиция эндотелин-конвертирующего фермента), так и блокаду его рецепторов (селективную или неселективную).
Другим важным механизмом в патогенезе является нарушение синтеза и/или доступности NO. Проявлением нарушения функции эндотелия при ЛГ является снижение синтеза оксида азота. С одной стороны, это следствие снижения активности эндотелиальной NO-синтазы. С другой — отмечают снижение биодоступности оксида азота в связи с гипоксией, оксидантным стрессом и снижением содержания L-аргинина вследствие роста активности аргиназы в клетках эндотелия и эритроцитах. У больных с ЛГ ингаляции NO приводят к снижению давления в ЛА и клиническому улучшению. Вторым клинически значимым механизмом повышения концентрации оксида азота в легочных сосудах является снижение его распада под влиянием ФДЭ, особенно ее изоэнзима-5. В легочном сосудистом бассейне выявляют значительное количество этого типа ФДЭ и соответственно влияние на нее является важным терапевтическим механизмом.
Весомый элемент в патогенезе заболевания — нарушение или снижение нормальной функции вольтажзависимых калиевых каналов гладкомышечных клеток легочных сосудов. В результате таких нарушений дополнительно выводится калий и увеличивается внутриклеточное содержание кальция, что приводит к вазоконстрикции. Активация тромбоцитов сопровождается освобождением целого ряда биологически активных субстанций: тромбоцитарного фактора роста, серотонина, факторов свертываемости крови и проагрегации. Следствием этого является прокоагулянтное состояние в системе ЛА и возникновение тромботических осложнений. Указанные изменения приводят к тому, что дисфункция эндотелия легочных сосудов прогрессирует.
Еще один важный компонент в патогенезе ЛГ — снижение синтеза простациклина. При ЛГ отмечают снижение экспрессии простациклинсинтетазы в ЛА малого и среднего диаметра. Соответственно повышается концентрация антагониста простациклина — тромбоксана. Описанные нарушения чаще выявляют у больных с идиопатической ЛГ и c ЛГ при заболеваниях соединительной ткани.
Поражение миокарда ЛЖ и его структурно-функциональная перестройка (ремоделирование) являются основными компонентами развития СН. Ведущее участие в формировании СН принимают нейрогуморальные системы регуляции кровообращения: РААС, альдостерон, симпатоадреналовая система, эндотелиновая, кининовая, оксида азота, простагландиновая и прочие. Взаимодействие систем нейрогуморальной регуляции запускает определенные механизмы, которые приводят к дополнительному нарушению регуляции сосудистого тонуса в системе ЛА. Следствием этого каскада реакций является формирование стойкой ЛГ с ремоделированием легочных сосудов, гипертрофией и ремоделированием ПЖ: порочный круг замыкается. При врожденных пороках сердца ремоделирование легочных сосудов является следствием влияния сил стресса растяжения (shear-stress) под действием высокого давления в ЛА. На поздних стадиях процесса, по мере его хронизации, ЛГ идиопатического генеза патофизиологически не будет отличаться от ЛГ вследствие коллагеновых заболеваний, врожденных пороков или левожелудочковой СН.
КЛИНИКА И ДИАГНОСТИКА
Без надлежащего лечения при ЛГ отмечают быстрое развитие и прогрессирование гипертрофии ПЖ, его дилатации и правожелудочковой СН. Это является основной причиной смерти. При проведении патогенетической терапии скорость прогрессирования заболевания значительно замедляется, развитие правожелудочковой СН замедляется и соответственно снижается смертность.
Диагностический подход при ЛГ требует проведения серии исследований с целью подтверждения ЛГ, определения функциональных изменений (клинический класс), выяснения причины возникновения ЛГ и оценки реакции на назначенное лечение. Этот последовательный подход используют, даже если некоторые исследования дают противоречивую информацию.
Для практических целей могут быть рекомендованы следующие 4 этапа установления диагноза ЛГ:
- подозрение на наличие заболевания;
- выявление;
- определение ФК;
- оценка гемодинамических изменений и реакции на назначенное лечение.
1. Подозрение на наличие ЛГ
Специфических симптомов для ЛГ нет. Начальные проявления ЛГ могут быть минимальными, что может привести к запаздыванию диагностики на ранней стадии заболевания. Чаще всего при подозрении на ЛГ используют скрининговый метод. Подозрение на ЛГ должно возникнуть при появлении таких общих симптомов, как одышка, усталость, слабость, боль в груди (по типу стенокардии), сердцебиение, синкопальное состояние, кашель (иногда кровохарканье), тяжесть в правом подреберье и увеличение объема живота. Симптомы в состоянии покоя отмечают, как правило, в острых или запущенных случаях, а также при очень быстром прогрессировании ЛГ. В других случаях симптомы смазаны и неспецифичны и часто приводят к неправильной диагностике других заболеваний сердца и легких.
ЛГ может быть выявлена у пациентов без каких-либо симптомов при скрининговых исследованиях, особенно среди больных группы риска или с предрасположенностью к развитию ЛГ: системные заболевания соединительной ткани, портальная гипертензия, ВИЧ-инфекция, врожденные пороки сердца, ХОБЛ, левожелудочковая СН.
Иногда подозрение на наличие ЛГ возникает при случайном обследовании: рентгенографии, ЭКГ, эхоКГ.
2. Выявление ЛГ
Диагностика ЛГ требует проведения нескольких рутинных исследований, таких как общее клиническое обследование, ЭКГ, рентгенологическое исследование органов грудной клетки и трансторакальной эхоКГ с допплеровским датчиком.
При общем клиническом обследовании у больных с развитой ЛГ определяют расширение границ сердца вправо, прослушивают акцент II тона на ЛА, пансистолический шум регургитации на трикуспидальном клапане, диастолический шум недостаточности клапана ЛА, а также III тон. Выявляют расширение шейных вен, гепатомегалию, периферические отеки, асцит и похолодение конечностей. Указанные симптомы характерны для больного с уже развитыми симптомами правожелудочковой недостаточности. Часто это сопровождается центральным и периферическим цианозом. При перкуссии и аускультации легких все звуковые феномены обычно нормальные.
ЭКГ. Рутинное ЭКГ-исследование может указать на подозрение или дополнительно подтвердить диагноз ЛГ: виявляют гипертрофию ПЖ, признаки его растяжения или перенагрузки (чаще всего полная блокада правой ножки пучка Гиса). Подобные феномены могут быть выявлены и для правого предсердия. Тем не менее отсутствие изменений на обычной ЭКГ в покое не исключает наличие ЛГ.
Рентгенологическое исследование органов грудной клетки позволяет выявить патологические изменения в 90% случаев. Среди наиболее частых симптомов: расширение корня ЛА, которое контрастирует с потерей рисунка периферических кровеносных сосудов в легких. Возможно выявление расширения теней, относящихся к правому предсердию и ПЖ. При рентгенографии четко определяют сопутствующие заболевания легких — ХОБЛ или застойные явления в легочных венах вследствие левожелудочковой недостаточности, соответствующие изменения тени сердца при наличии врожденных пороков и т.д.
Трансторакальная эхоКГ с допплеровским датчиком — наиболее информативное неинвазивное скрининговое исследование больных с подозрением на ЛГ. Метод разрешает исследовать скорость потока регургитации на трикуспидальном клапане и вычислить САД в ЛА и ПЖ. Согласно данным, у здоровых лиц мягкую ЛГ можно определить при САД в ЛА около 36–50 мм рт. ст. или скорости потока регургитации на трикуспидальном клапане 2,8–3,4 м/с (при предположении, что нормальное давление в правом предсердии составляет 5 мм рт. ст.). Несмотря на высокую информативность метода, следует отметить, что существуют категории больных с ложно-положительным диагнозом по данным эхоКГ: лица пожилого и преклонного возраста при наличии симптомной СН высокого ФК. В таких случаях рекомендуют проводить верификацию диагноза методом катетеризации правых отделов сердца и ЛА.
Метод эхоКГ дает возможность оценить размеры полостей сердца и полой вены, функциональное состояние желудочков, наличие выпота в перикарде, наличие пороков сердца с шунтированием крови, степень дисфункции клапанов сердца. Для ЛГ характерно увеличение полости ПЖ, предсердия и полой вены, снижение функциональной способности ПЖ, уменьшение размера ЛЖ. Исследование может быть дополнено внутривенным введением контрастного для ультразвука вещества с целью лучшего выявления потоков крови при наличии порока сердца.
Обследование больных с подозрением на ЛГ должно включать проведение функциональных исследований легких: исследование функции внешнего дыхания и газового состава крови (в том числе для определения ХОБЛ). У больных с ЛГ обычно выявляют снижение легочной диффузии СО (на 40–80% должного уровня) и умеренное снижение дыхательного объема легких. Парциальное давление кислорода в артериальной крови (PaO2) при дыхании атмосферным воздухом, как правило, нормальное, парциальное давление углекислоты в артериальной крови (PaCO2) — нормальное или несколько снижено вследствие гипервентиляции.
Важным методом обследования для выявления больных с хронической ТЭЛА является вентиляционно-перфузионное сканирование легких. У больных с идиопатической ЛГ показатели вентиляционно-перфузионного сканирования, как правило, в норме. Могут отмечать небольшие периферические дефекты перфузии, которые анатомически не соответствуют легочным сегментам. При хронической ТЭЛА типичным является определение дефектов перфузии, которые соответствуют сегментарным или долевым участкам при нормальных показателях вентиляции. При ХОБЛ, наоборот, — типично выявление дефектов перфузии, сопровождающихся соответствующими дефектами вентиляции.
КТ легких может более точно выявить заболевание паренхимы легких, наличие утолщений плевры (особенно междолевой), локального выпота и патологии лимфоузлов. Также с помощью этого метода исследования можно лучше диагностировать тип поражения легких при наличии признаков усиления интерстициального рисунка на обычной рентгенограмме легких и отсутствии признаков левожелудочковой СН. Проведение КТ с контрастированием сосудов помогает диагностировать хроническую ТЭЛА. В таких случаях определяют окклюзии и стенозы, признаки реканализации тромба, дефекты перфузии. Окончательное показание для проведения эндартерэктомии определяют при прямой ангиографии ЛА.
Объективная оценка функционального состояния больных невозможна без проведения нагрузочных тестов. Наиболее простым для практического использования является тест с 6-минутной ходьбой. Для проведения теста необходимо провести оценку дистанции, которую больной сможет пройти на протяжении указанного промежутка времени. Более сложным является метод эргоспирометрии, при котором можно оценить не только способность больного к выполнению физической нагрузки, но и показатели газообмена и, главное, — потребление кислорода. Метод намного более сложный и его использование ограничено специализированными стационарами. Данные о соответствии результатов нагрузочных тестов функциональному состоянию приведены в следующем разделе в табл. 1.2.
Таблица 1.2
Объективизация ФК по данным нагрузочных тестов
| ФК | Дистанция ходьбы, которую способен преодолеть больной за 6 мин, м | Максимальное потребление кислорода, мл/м2 за 1 мин |
| I | 426–550 | 18,1–22,0 |
| II | 300–425 | 14,1–18,1 |
| III | 150–300 | 10,1–14,0 |
| IV | <150 | <10 |
Золотым стандартом в установлении диагноза ЛГ является катетеризация правых отделов сердца и ЛА. При этом подтверждается диагноз и непосредственно устанавливается степень ЛГ, а также появляется возможность определить вазореактивность легочных сосудов в ответ на применение лекарственных средств. При катетеризации определяют давление в ЛА, сердечный выброс, ЛСС, давление в правом предсердии, давление заклинивания в легочных капиллярах. ЛГ определяют при повышении АД в ЛА >25 мм рт. ст. в состоянии покоя или >30 мм рт. ст. при нагрузке, при уровне давления заклинивания в легочных капиллярах <15 мм рт. ст. и уровне ЛСС >3 мм рт. ст./л/мин. При катетеризации берут кровь из разных полостей сердца и ЛА для определения газового состава и насыщения крови кислородом. Это может помочь в определении локализации шунтов. Кроме того, показатели гемодинамики имеют прогностическое значение: низкая величина сердечного выброса, высокое давление в ЛА и правом предсердии, низкое насыщение центральной венозной крови кислородом ассоциируется с очень плохим прогнозом. В случае необходимости при катетеризации возможно проведение ангиопульмонографии.
При катетеризации ЛА возможно проведение тестов с вазодилататорами. К сожалению, такое тестирование можно проводить только с препаратами короткого действия. Для этих целей используют внутривенное введение простациклина или аденозина фосфата и ингаляции оксида азота. Положительным считают ответ, когда отмечают снижение САД в ЛА на 10 мм рт. ст., достижение абсолютного значения давления меньше 40 мм рт. ст. при увеличении или неизменной величине сердечного выброса. Установлено, что у больных с положительным тестом есть стойкий продолжительный ответ при лечении вазодилататорами, в первую очередь — антагонистами кальция. Именно у таких больных продолжительная монотерапия антагонистами кальция сопровождается улучшением ФК и, возможно, повышением выживаемости. Обычно положительный ответ выявляют только у 10–15% больных с идиопатической ЛГ. Эмпирическое назначение антагонистов кальция в высоких дозах без определения вазореактивности часто сопровождается ухудшением состояния или тяжелыми побочными эффектами такой терапии.
В соответствии с рекомендациями Американской коллегии специалистов по торакальной медицине в согласованных Рекомендациях по АГ считается, что этот тест необходимо рутинно использовать у всех больных с ЛГ. В то же время его не следует применять у больных, которым не показана терапия антагонистами кальция, как правило, это больные IV ФК.
Последним шагом при диагностике ЛГ является определение ее типа и ассоциированных заболеваний или состояний. Как уже отмечалось, данные эхоКГ позволяют определить наличие врожденных пороков сердца с шунтированием крови, дисфункции ЛЖ, степень нарушения функции ПЖ. Биохимическое и иммунологическое исследование сыворотки крови позволяет выявить системные заболевания соединительной ткани и СПИД; рентгенологическое исследование (рутинное, а при необходимости — КТ) — подтвердить наличие ХОБЛ. Биохимическое исследование сыворотки крови в соединении с УЗИ органов брюшной полости позволяет выявить больных с поражением печени и портальной гипертензией. КТ с контрастированием, вентиляционно-перфузионное сканирование и ангиопульмонография дают возможность выявить больных с хронической ТЭ ЛА.
3. Определение ФК при ЛГ
По рекомендациям экспертов ВОЗ (1998), для больных с ЛГ была адаптирована функциональная классификация NYHA, которая изначально была предложена для больных с ХСН (табл. 1.3).
Таблица 1.3
Функциональная классификация ЛГ по ВОЗ (1998)
| ФК | Симптоматика |
| I | Больные с ЛГ без ограничения физической активности. Обычные физические нагрузки не приводят к появлению одышки, усталости, боли в груди и синкопальных состояний |
| II | Пациенты с ЛГ и незначительным ограничением в выполнении физической нагрузки. В состоянии покоя симптомы отсутствуют. Обычная физическая нагрузка вызывает одышку, усталость, боль в груди или синкопальные состояния |
| III | Больные с ЛГ и значительным ограничением физической активности. В состоянии покоя они ощущают себя комфортно. Физическая нагрузка меньше, чем обычная, вызывает у них значительную одышку или усталость, боль в груди или синкопальные состояния |
| IV | Больные с ЛГ, которые не могут выполнять никакую физическую нагрузку без возникновения симптомов. У больных имеются симптомы правосторонней СН. Одышку и слабость отмечают в состоянии покоя. Дискомфорт усиливается при любой физической активности |
Как правило, у больных с IV ФК отмечают симптомы развитой правосторонней СН. Вполне понятно, что прогрессирование ФК от I к IV отражает эволюцию/прогрессирование правожелудочковой СН.
4. Лечение ЛГ
Цель лечения ЛГ — уменьшение выраженности симптомов, замедление прогрессирования заболевания, улучшение качества жизни больных и увеличение ее продолжительности. Лечение необходимо начинать сразу после установления диагноза.
Больные с ЛГ должны избегать чрезмерных физических нагрузок, резких изменений позы тела (риск ортостатических реакций и синкопе), курения, чрезмерного потребления поваренной соли. Не следует использовать противозачаточные средства, содержащие эстрогены, а также необходимо предохраняться от беременности в связи с высоким риском материнской смертности (50%). Рекомендуется избегать приема препаратов (в том числе растительного происхождения), содержащих потенциальные вазоконстрикторные вещества. Желательно предотвращать простудные заболевания, проводить вакцинацию против гриппа. Больным с ЛГ следует исключить подъем в горы (более 1 тыс. м), а при перелетах в самолете быть готовыми к пользованию кислородными масками.
При длительном путешествии рекомендуется делать короткие перерывы для непродолжительных прогулок каждые 2 ч. В самолетах рекомендуется вставать из кресла и ходить по салону.
При проведении хирургического лечения следует помнить, что общая анестезия и интубация трахеи связаны с очень высоким риском развития вагусных осложнений.
Основной алгоритм лечения был включен в заключительный документ Всемирного симпозиума по ЛГ (Венеция, 2003). В 2007 г. ведущие эксперты США его несколько дополнили в соответствии с новыми данными доказательной медицины (рис. 1.2).
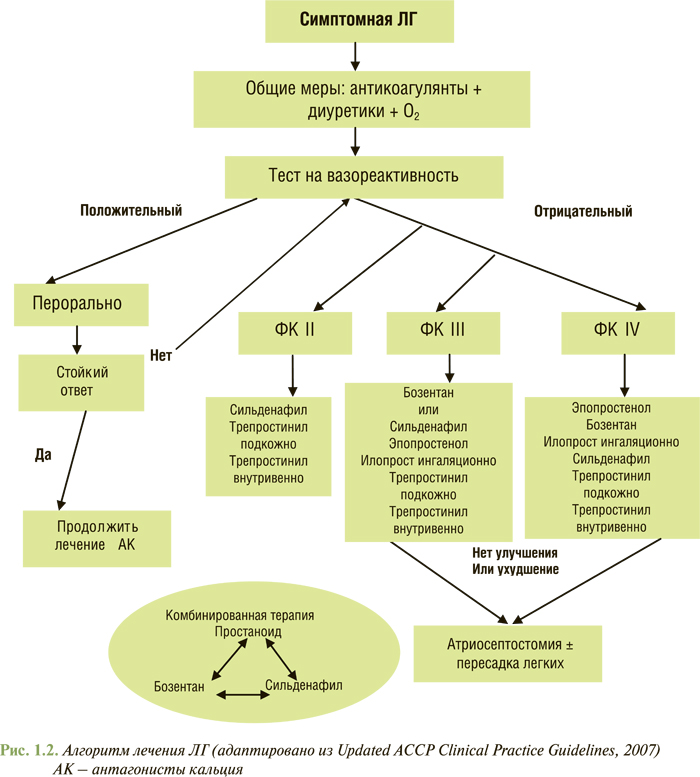
Общая терапия больных с ЛГ включает прием антикоагулянтов, диуретиков и дигоксина, а также ингаляции кислорода. Результаты кратковременных исследований свидетельствуют об уменьшении выраженности симптомов и снижении содержания катехоламинов в крови при применении дигоксина в терапии ЛГ. Дигоксин также показан с целью улучшения контроля ЧСС при фибрилляции предсердий.
Диуретики рекомендованы как для лечения, так и профилактики застойных явлений. Ответ на прием диуретиков может значительно изменяться, поэтому дозы препаратов подбирают индивидуально. Следует тщательно мониторировать функцию почек и показатели электролитного обмена для предотвращения развития осложнений хронической диуретической терапии. Антагонисты альдостерона (спиронолактон) можно использовать при развитии хронической СН III–IV ФК.
Применение кислорода способствует улучшению оксигенации крови. Цель лечения — поддержка насыщения гемоглобина кислородом не менее 90%. В некоторых случаях длительное применение кислорода, особенно в высоких дозах, может вызвать легочную вазоконстрикцию и привести к ухудшению состояния больного. Использование кислорода особенно эффективно у больных c ХОБЛ, в то же время при врожденных пороках сердца его применение будет практически неэффективным.
Использование непрямых антикоагулянтов (варфарина) при ЛГ, по данным ретроспективных анализов, привело к улучшению результатов лечения больных с идиопатической ЛГ. Результатов проспективных исследований эффективности варфарина при этой патологии нет. Также есть определенные доказательства эффективности кумариновых производных у больных с ЛГ вследствие ТЭЛА. Рутинное применение варфарина при ЛГ, связанной с коллагенозами или врожденными пороками сердца, может значительно повышать риск желудочно-кишечных кровотечений и гемоптоза.
Целевым уровнем при назначении кумаринов является уровень МНО 1,5–2,5.
Обзор основных медикаментозных средств для терапии ЛГ и их эффективность по данным доказательной медицины приведены в табл. 1.4.
Таблица 1.4
Современные лекарственные средства для лечения ЛГ
| Средство лечения | Показание | Противопоказание | Комментарий |
| Антикоагулянты: варфарин (класс рекомендаций IIА) | Предупреждение тромбозов ЛА | Ограничение при системных заболеваниях соединительной ткани | Ассоциируется с удлинением жизни у больных с идиопатической и семейной ЛГ. Данных относительно эффективности варфарина при других формах ЛГ практически нет |
| Кислород (класс рекомендаций IIА) | Особенно при ЛГ у больных с ХОБЛ. Рекомендовано применять низкие концентрации О2 (2 л/мин) | Может вызвать вазоконстрикцию. Следует применять осторожно, проводя мониторинг | Является интегрированным компонентом лечения всех форм ЛГ |
| Поддерживаемая симптоматическая терапия: диуретики (класс рекомендаций I), дигоксин (класс рекомендаций IIВ) | Применяют при правожелудочковой СН. Дигоксин улучшает сердечный выброс у больных с сохраняющимися симптомами на фоне стандартного лечения | У больных пожилого возраста дигоксин применяют с осторожностью в связи с повышением риска токсичности | Дигоксин остается золотым стандартом лечения правосторонней СН с признаками перенагрузки жидкостью. При других формах СН более эффективны ингибиторы АПФ и блокаторы β-адренорецепторов |
| Антагонисты кальция: дилтиазем, нифедипин, амлодипин (класс рекомендаций I) | Снижают давление в ЛА. Снижают смертность у больных с положительной реакцией на лечение. Терапию следует начинать в стационаре, тщательно титровать дозу под контролем АД, оксигенации крови и толерантности к нагрузкам | Антагонисты кальция не назначают без теста на вазодилатацию. У больных с отрицательным ответом антагонисты кальция не имеют положительных эффектов и часто вызывают побочные. При низком давлении в ЛА (‘<10 мм рт. ст.) и низкой величине сердечного выброса (<2,1 л/мин/м2) антагонисты кальция противопоказаны | Часть больных со стойкой положительной реакцией на лечение антагонистами кальция составляет около 10% |
| Продолжительная терапия простагландинами: эпопростенол (класс рекомендаций I), илопрост (внутривенно или ингаляции) (класс рекомендаций IIА), трепростинил (класс рекомендаций IIА) | Ремоделирование сосудов в системе ЛА, уменьшение поражения клеток и гиперкоагуляции. Показана всем больным с ЛГ, у которых отсутствует ответ на обычное лечение. Терапия перед трансплантацией | Очень дорогостоящее. Обычное лечение необходимо продолжать. Антагонисты кальция следует отменить. Отмечают эффект рикошета при отмене (резкий рост давления в ЛА). Дозу простагландинов титруют до уменьшения выраженности симптомов | Терапия простагландинами была первым доказанным способом улучшения прогноза у больных с ЛГ. Следует проводить в специальных центрах, где есть опыт ее применения |
| Антагонисты эндотелиновых рецепторов: бозентан (класс рекомендаций I), ситаксентан (класс рекомендаций IIА), амбризентан (класс рекомендаций IIА) | Для лечения идиопатической ЛГ или ЛГ при системных заболеваниях соединительной ткани у больных III или IV ФК | Противопоказано при беременности, умеренной или тяжелой дисфункции печени, во время приема циклоспорина, глибенкламида и гиперчувствительности | Терапия вызвала уменьшение выраженности симптомов, повышение толерантности к нагрузке, улучшение показателей гемодинамики и структурных изменений в легочных сосудах. Отмечено замедление прогрессирования заболевания, повышение качества жизни и увеличение ее продолжительности |
| Ингибиторы фосфодиэстеразы-5: сильденафил (класс рекомендаций I) | Для лечения идиопатической ЛГ у больных II–IV ФК (для других типов ЛГ — класс рекомендаций IIА) | Противопоказан больным, принимающим органические нитраты или донаторы оксида азота. При длительном приеме отмечают нарушение цветовосприятия | Доказаны уменьшение выраженности симптомов, снижение давления в ЛА, повышение толерантности к нагрузке, замедление прогрессирования заболевания |
Антагонисты кальция показали высокую эффективность относительно снижения давления в ЛА, улучшения симптомов и качества жизни, а также удлинения выживания у больных с идиопатической ЛГ. Этот эффект лечения проявляется только у больных с положительным ответом теста на вазодилатацию. Доля таких пациентов составляет около 10% всех больных с идиопатической ЛГ. У больных без положительного ответа при проведении функционального теста назначение антагонистов кальция может вызвать ухудшение, снижение оксигенации крови, тяжелую системную гипотензию. Считают, что достоверный результат теста возможно получить только при инвазивном исследовании, данные УЗИ в этом случае являются неинформативными. Антагонисты кальция нужно использовать в высоких дозах. Считают, что эффективность антагонистов кальция увеличивается при одновременном назначении с варфарином. У больных с СН преимущество следует отдать амлодипину. В то же время считается, что при IV ФК антагонисты кальция не показаны. Терапию нужно начинать в стационаре, тщательно титровать дозу под контролем АД, контролировать показатели оксигенации крови и толерантность к нагрузкам.
Антагонисты рецепторов эндотелина-1. Как было указано ранее, эндотелин-1 играет одну из ведущих ролей в формировании и прогрессировании ЛГ при ее идиопатической форме, при заболеваниях соединительной ткани и при врожденных пороках сердца. Это предопределяет важную роль блокаторов рецепторов эндотелина-1 в терапии ЛГ. Бозентан стал первым блокатором рецепторов эндотелина-1 А- и В-типов для перорального приема. В проспективных рандомизованных исследованиях установлена его способность снижать давление в ЛА, ЛСС и улучшать сердечный выброс у больных III–IV ФК. Это сопровождалось значительным улучшением ФК, уменьшением выраженности симптомов и ростом толерантности к нагрузке, повышением качества жизни. Также отмечали замедление прогрессирования заболевания, снижение степени ремоделирования ПЖ. Основным результатом терапии бозентаном стало повышение выживаемости на протяжении года (96%) и 2 лет (89%) по сравнению с контрольной группой (69 и 57% соответственно). Таким образом, бозентан показан для лечения ЛГ идиопатического генеза, при системных заболеваниях соединительной ткани, врожденных пороках сердца, действии токсичных веществ, а также при ВИЧ-инфекции. Доза бозентана в начале лечения составляет 62,5 мг 2 раза в сутки, через 4 нед терапии при хорошей переносимости дозу удваивают. При ухудшении состояния больных бозентан отменяют и назначают альтернативную терапию. Исследование эффективности бозентана при ЛГ II ФК к моменту написания руководства еще не закончено. На протяжении последних лет получены положительные результаты клинических исследований относительно других блокаторов рецепторов эндотелина-1 — ситаксентана и амбризентана.
Простагландины (простаноиды). Как было отмечено выше, простаноиды принимают активное участие в регуляции функции эндотелия, адгезии и агрегации, воспалении и пролиферации клеток в легочных сосудах. Соответственно недостаточность простациклина (абсолютная или относительная) может играть значимую роль в патогенезе ЛГ. Следовательно, назначение экзогенного простациклина (парентерально или ингаляционно) при ЛГ является патогенетически обоснованным.
Наиболее исследованный препарат и соответственно имеющий наибольшую доказательную базу среди простаноидов — эпипростенол (синтетический аналог простациклина). Внутривенная терапия эпипростенолом в течение 12 нед улучшала гемодинамику, симптомы заболевания, качество жизни больного и расстояние 6-минутной ходьбы. Прогрессивное ремоделирование ПЖ уменьшалось, и этот положительный результат сохранялся в отдаленный период. В некоторых исследованиях было установлено повышение выживаемости больных, получающих данную терапию, по сравнению со стандартной терапией ЛГ. Внутривенная терапия эпипростенолом эффективна у больных с идиопатической ЛГ, при диффузных заболеваниях соединительной ткани, действии токсинов, врожденных пороках сердца с шунтированием крови справа налево III–IV ФК. Начальная доза составляет 2 нг/кг/мин с дальнейшим ее повышением при хорошей переносимости до 30 нг/кг/мин. Могут использоваться и более высокие дозы, но при этом увеличивается вероятность развития побочных эффектов. Побочные эффекты терапии эпипростенолом включают гиперемию с приливами, тошноту, рвоту, диарею, боль в области челюсти, скелетно-мышечную боль, кожные высыпания эритематозного характера, а также осложнения, связанные с длительным применением центрального катетера. Учитывая сложность проведения, данную терапию необходимо назначать только в центрах, имеющих соответствующий опыт.
Другой препарат простаноидов с доказанной эффективностью — илопрост, который можно использовать в ингаляционной форме. Ингаляционная терапия илопростом также улучшает гемодинамику, увеличивает дистанцию ходьбы в минутах, снижает ФК заболевания, симптомы и качество жизни после 12 нед ее применения. Побочные эффекты включают кашель, приливы с покраснением, головную боль, боль в челюсти, тошноту и гипотензию. Эта терапия эффективна у больных с идиопатической ЛГ, при диффузных заболеваниях соединительной ткани, действии токсинов, врожденных пороках сердца с шунтированием крови справа налево, тромбоэмболической болезни и III–IV ФК ЛГ. Рекомендованная доза — 6–9 ингаляций 2,5 мкг илопроста ежедневно с использованием портативного распылителя. Дозу можно повышать до 5 мкг при хорошей переносимости. Такой способ терапии простагландинами имеет определенные преимущества, но отдаленная эффективность (влияние на смертность) ее не доказана. Внутривенная терапия илопростом мало отличается от применения эпипротенола.
Еще один препарат простаноидов — трепростинил — бензидиновый аналог простациклина, который можно вводить внутривенно или подкожно. Неблагоприятный профиль эффектов внутривенной терапии трепростинилом подобен таковому эпипростенолу. Начальная доза составляет 5 нг/кг/мин с постепенным повышением до 60 нг/кг/мин. Непрерывное подкожное введение трепростинила на протяжении 12 нед вызывало клиническое улучшение с увеличением дистанции 6-минутной ходьбы. Это сопровождалось положительной динамикой симптомов, показателей гемодинамики и качества жизни. Подкожное введение трепростинила показано больным с идиопатической ЛГ, при заболеваниях соединительной ткани, врожденных пороках сердца при II–IV ФК. Побочные эффекты этой терапии включают боль в месте инъекции, диарею, боль в челюсти и отеки. Начальная доза составляет 1,25 нг/кг/мин с постепенным повышением до 22,5 нг/кг/мин. Технология введения включает использование специального инфузионного микронасоса, который создает дополнительное давление для постоянного введения. Это лекарственное средство нужно также применять только в центрах с достаточным опытом применения данной терапии.
Ингибиторы фосфодиэстеразы-5 (ФДЭ-5). Учитывая важную роль дисфункции эндотелия в патогенезе ЛГ, применение препаратов, оказывающих непосредственное влияние на продукцию оксида азота, стало еще одним перспективным направлением в лечении этого заболевания. Первый из них — сильденафил — специфический ингибитор ФДЭ-5. Этот фермент отвечает за распад цГМФ, посредством которого реализуются эффекты оксида азота. Он широко представлен в легочном сосудистом русле. Основным показанием для назначения сильденафила до последнего времени была эректильная дисфункция. В то же время было установлено, что этот препарат после 12 нед приема способен снижать давление и сосудистое сопротивление в ЛА, увеличивать сердечный выброс у пациентов с ЛГ. В этот период отмечали уменьшение выраженности симптомов, увеличение дистанции 6-минутной ходьбы и снижение ФК, кроме этого отмечено увеличение периода клинического улучшения состояния больных. Эффект препарата не зависит от дозы. Он хорошо переносится, наиболее частые побочные явления — носовое кровотечение, головная боль и заложенность носа. Эффективность сильденафила была доказана у пациентов II–IV ФК с идиопатической ЛГ, при диффузных заболеваниях соединительной ткани, врожденных пороках сердца с шунтированием крови справа налево. Предполагают, что препарат может быть эффективным у больных с ЛГ тромбоэмболического происхождения. Рекомендованная доза составляет 20 мг 3 раза в сутки. Препарат противопоказан больным, принимающим органические нитраты или донаторы оксида азота.
В прямых сравнительных исследованиях эффективности по суррогатным точкам с бозентаном (дистанция 6-минутной ходьбы, масса миокарда ПЖ) установлена практически одинаковая эффективность на протяжении 12-недельного курса лечения. Эффективность других блокаторов ФДЭ-5 (в том числе тадалафила) при ЛГ к моменту написания руководства находится на этапе исследования.
Комбинированная медикаментозная терапия. В клинической практике для достижения большего эффекта рационально использовать лекарственные средства с различными механизмами действия, которые могут влиять на разные звенья патогенеза и, таким образом, потенцировать эффекты друг друга. Однако в терапии ЛГ комбинация разных классов препаратов имеет более интуитивный характер, чем базируется на данных доказательной медицины.
Существуют единичные пилотные исследования, в которых изучали эффективность и безопасность различных комбинаций: эпопростенола и бозентана, илопроста и бозентана. Несколько небольших исследований проведено для оценки эффективности и безопасности комбинированной терапии простаноидами и ингибиторами ФДЭ-5. Установлен более значительный гемодинамический эффект комбинации по сравнению с монотерапией. Но до настоящего времени отдаленные результаты такой терапии остаются неопределенными: есть сведения как о положительных, так и отрицательных последствиях. Не выявлено клинически значимых взаимодействий между перечисленными лекарственными средствами при их одновременном назначении.
Комбинированная терапия бозентаном и сильденафилом приводит к более значительному, чем монотерапия, увеличению дистанции 6-минутной ходьбы, этот эффект сохраняется на протяжении 6–12 мес. Это сопровождалось также положительной динамикой показателя максимального потребления кислорода. Проспективных исследований эффективности такой терапии к моменту написания руководства нет. В то же время известно, что бозентан значительно снижает концентрацию сильденафила в плазме крови, но клинические последствия такого взаимодействия остаются неизученными.
Возможно, в ближайшем будущем комбинированное лечение пероральными и ингаляционными препаратами сможет вытеснить необходимость применения продолжительной парентеральной терапии у больных с ЛГ. Для этого необходимо провести тщательно спланированные клинические испытания. Однако следует учитывать фармакоэкономические факторы. Все современные препараты для лечения ЛГ — дорогостоящие, и необходимо определить не просто эффективность, а реальное соотношение стоимость/эффективность с целью определения перспективных стратегий комбинированной терапии ЛГ.
Интервенционное и хирургическое лечение ЛГ. Существует несколько типов интервенционного и хирургического лечения ЛГ. Обзор основных типов вмешательств и их эффективность, по данным доказательной медицины, приведены в табл. 1.5.
Таблица 1.5
Хирургическое лечение ЛГ
| Способ лечения | Показание | Противопоказание | Комментарий |
| Предсердная септостомия: паллиативная процедура, создающая отверстие для сбрасывания крови, что приводит к снижению давления в правых отделах сердца, особенно у больных с тяжелыми формами ЛГ (класс рекомендаций IIА) | Тяжелая форма ЛГ, рефрактерная к терапии простагландинами, сопровождающаяся повторными синкопальными состояниями | Не показана больным в терминальной стадии правожелудочковой СН или у больных со значительной левожелудочковой СН | Вмешательство следует проводить в специализированных центрах и соответственно подготовленными специалистами |
| Тромбоэндартериэктомия: хирургическое удаление организованных тромботических материалов и внутренней оболочки артерии начиная со ствола к сегментарным ветвям ЛА (класс рекомендаций IIА) | Для больных с посттромбоэмболической формой ЛГ. Рекомендована больным всех возрастных категорий | Противопоказана при тяжелых заболеваниях легких | Прогноз у больных с ЛГ вследствие хронической тромбоэмболии неблагоприятный: 5-летняя выживаемость составляет 10% |
| Трансплантация сердца и легких (класс рекомендаций I) | При прогрессирующей ЛГ, когда несмотря на адекватное медикаментозное лечение состояние пациента соответствует III–IV ФК | Кандидаты должны отвечать международным стандартам трансплантации сердца и легких | Трансплантация органов является лимитированной операцией и ее проведение возможно только в соответствующих центрах |
Предсердная септостомия (паллиативная процедура) — создание отверстия в межпредсердной перегородке для сброса крови, что приводит к снижению давления в правых отделах сердца, особенно у больных с тяжелыми формами ЛГ (IV ФК). У ряда пациентов наблюдается спонтанное открытие овального отверстия с соответствующим клиническим эффектом. Процедуру проводят с помощью специального баллонного катетера. Показана больным с рефрактерными формами ЛГ, когда продолжительная патогенетическая терапия (бозентан или простагландины) не приводит к улучшению их клинического состояния. Не показана больным с терминальными стадиями правожелудочковой СН или со значительной левожелудочковой СН. Риск смертности при проведении данной процедуры — 5–6%, выполнять ее следует только в соответствующих центрах. Отдаленные результаты баллонной предсердной септостомии неизвестны.
Легочная тромбоэндартериэктомия — это эффективный метод лечения ЛГ вследствие хронического тромбоза и/или эмболии ЛА. Важным элементом успешного проведения оперативного вмешательства является отбор пациентов. Важно, чтобы именно тяжесть тромботической окклюзии определяла тяжесть ЛГ. При этом сама величина давления в ЛА не имеет значения для проведения оперативного вмешательства, поскольку у пациентов с наиболее высоким уровнем давления будет достигнут наибольший эффект от такого вмешательства. Для отбора больных следует использовать данные катетеризации правых отделов сердца и ангиопульмонографии. Операционная смертность в лучших медицинских центрах варьирует от 5 до 11%. Хотя сегодня не проведены контролируемые исследования эффективности такого оперативного лечения, пользу от него выявляют почти сразу: у большинства больных регрессируют симптомы, увеличивается переносимость нагрузки, повышаются гемодинамические показатели и качество жизни. По данным ретроспективного анализа, 5-летняя выживаемость после удачно проведенного оперативного лечения достигает 75%.
Пересадка легких или пересадка легких и сердца являются радикальным хирургическим методом лечения больных с ЛГ. Операция показана при прогрессирующей ЛГ, когда несмотря на адекватное медикаментозное лечение состояние пациента соответствует III–IV ФК. Все больные по результатам теста 6-минутной ходьбы <400 м могут рассматриваться в качестве кандидатов для проведения трансплантации. При пересадке только легких рекомендуют проводить пересадку обоих легких, а при наличии значительных структурно-функциональных изменений ПЖ — операцией выбора является трансплантация сердца и легких. Трансплантация органов — лимитированная операция, ее проведение возможно только в соответствующих центрах. Больные после операции должны получать иммуносупрессивную терапию. Выживаемость после пересадки сердца и легких у больных с идиопатической ЛГ в лучших центрах составляет: через 1 год — 64% (в последние годы до 74%), через 3 года — 54% и через 5 лет — 44%. У пациентов с врожденными пороками сердца результаты операции, как правило, хуже. Отбор кандидатов для пересадки сердца и легких значительно варьирует в различных центрах. В то же время желательно, чтобы больные были младше 50 лет, без наличия системных заболеваний, таких как неконтролируемый сахарный диабет с поражением органов, выраженный атеросклероз, злокачественные новообразования.
Лечение других форм ЛГ. В настоящее время с точки зрения доказательной медицины не определена приоритетная терапия лечения ЛГ у больных с ХОБЛ. Целью терапии таких пациентов является максимальное сохранение функции легких и предупреждение прогрессирования бронхообструкции. Стандартная терапия может включать производные эуфиллина, стимуляторы β-адренорецепторов, антигистаминные препараты и стероидные гормоны. Следует бороться с развитием фибрилляции предсердий. При ее развитии возможно назначение дигоксина для контроля ЧСС. Имеются сведения о положительном влиянии статинов, которые предупреждают деструкцию легочной ткани.
Больным с идиопатическим легочным фиброзом показана терапия иммунодепрессантами и цитостатиками согласно стандартам лечения этой болезни. Пациенты с левожелудочковой СН должны получать стандартную терапию диуретиками, ингибиторами АПФ и блокаторами β-адренорецепторов, антагонистами альдостерона и при необходимости дигоксином. Возможно, у таких больных будет положительный ответ на назначение антагонистов рецепторов эндотелина-1.
Наблюдение больных с ЛГ. После установки диагноза и назначения патогенетической терапии больным с ЛГ рекомендовано находиться на диспансерном учете по месту жительства. Терапию ЛГ назначают пожизненно. Целью наблюдения являются определение эффекта назначенного лечения и его своевременная коррекция, формулирование трудового и жизненного прогноза. Следует максимально использовать неинвазивные процедуры в динамике наблюдения: тест с 6-минутной ходьбой (1 раз в 3 мес) и эхоКГ (1 раз в 6 мес). Ухудшение состояния и отсутствие эффекта проводимой терапии является показанием для госпитализации и проведения катетеризации сердца с определением дальнейшей тактики лечения.
Прогноз. Прогноз при ЛГ значительно отличается в зависимости от ее этиологии. Прогноз идиопатической ЛГ неблагоприятный, в среднем продолжительность жизни больного составляет 2,8 года. Для ЛГ при системной склеродермии продолжительность жизни составляет только 1 год. Прогноз зависит от сроков присоединения СН. При ее наличии прогноз крайне неблагоприятный. Считается, что современное рациональное лечение способно продлить срок жизни таких пациентов; проводимая терапия в отдельных случаях дает время для подготовки для трансплантации сердца и легких. Это положение было отражено в заключительном документе Всемирного симпозиума по ЛГ (Venice expert meeting, 2003).
ЛИТЕРАТУРА
- Рекомендации Украинской ассоциации кардиологов по профилактике и лечению артериальной гипертензии (2004): 84 с.
- Abman S.H. (2007) Recent advances in the pathogenesis and treatment of persistent pulmonary hypertension of the newborn. Neonatology, 91: 283-290.
- Badesch D.B., Abman S.H., Simmoneau G. et al. (2007) Medical therapy for pulmonary arterial hypertension. Updated ACCP Evidence-based clinical practice guidelines. Chest, 131: 1917-1928.
- Barst R.J., McGoon M., Torbicki A. et al. (2004) Diagnosis and differential assessment of pulmonary arterial hypertension (World Symposium on Pulmonary Arterial Hypertension in Venice, 2003). J. Am. Coll. Cardiol., 43, Suppl. S.: 40S-47S.
- Badesch D.B., Abman S.H., Simmoneau G. et al. (2007). Medical therapy for pulmonary arterial hypertension. Updated ACCP Evidence-based clinical practice guidelines. Chest., 131.: 1917-1928.
- Benza R.L., Park M.H., Keogh A.et al. (2007) Management of pulmonary arterial hypertension with a focus on combination therapies. J. Heart Lung Transplant., 26: 437-446.
- Gaine S.P., Rubin L.J. (1998) Primary pulmonary hypertension. Lancet, 352: 719-725.
- Galie N., Torbicki A., Barst R. et al. (2004) Guidelines on diagnosis and treatment of pulmonary arterial hypertension. The Task Force on Diagnosis and Treatment of Pulmonary Arterial Hypertension of the European Society of Cardiology. Eur. Heart. J., 25: 2243-2278.
- Gaynor S.L., Maniar H.S., Bloch J.B. et al. (2005) Right atrial and ventricular adaptation to chronic right ventricular pressure overload. Circulation., 112: I-12-I218.
- Gibbs J.S.R., Higenbottam T.W. for British Cardiac Society Guidelines and Medical Practice Committee (2001) Recommendation on the management of pulmonary hypertension in clinical practice. Heart., 86, Suppl. 1: i1-i13.
- Ishida K., Masuda M. (2007) Thromboendarterectomy for severe chronic thromboembolic pulmonary hypertension. Asian Cardiovasc. Thorac. Ann., 3: 229-233.
- Keogh A.M., McNeil K.D., Williams T. et al. (2003) Pulmonary artery hypertension: a new era in management. M.J.A., 178: 564-567.
- Law M.A., Grifka R.G., Mullins C.E. et al. (2007) Atrial septostomy improves survival in select patients with pulmonary hypertension. Am. Heart J., 153: 779-784.
- Macchia A., Marchioli R., Marfisi R. et al. (2007) Meta-analysis of trials of pulmonary hypertension: a clinical condition looking for drugs and research methodology. Am. Heart J., 153: 1037-1047.
- McGoon M., Gutterman D., Steen V. et al. (2004) Screening, early detection, and diagnosis of pulmonary arterial hypertension. ACCP evidence-based clinical practice guidelines. Chest., 126: 14S-34S.
- McLaughlin V.V., Presberg K.W., Doyle R.L. et al. (2004) Prognosis of pulmonary arterial hypertension. ACCP evidence-based clinical practice guidelines. Chest, 126: 78S-92S.
- Rubin L.J. (2004) Diagnosis and management of pulmonary arterial hypertension: ACCP evidence-based clinical practice guidelines. Chest., 126: 7S-10S.
- Simonneau G., Galie N., Rubin L.J. et al. (2004) Clinical classification of pulmonary hypertension. J. Am. Coll. Cardiol., 43, Suppl S.: 5S-12S.
- Stewart S. (2005) Pulmonary arterial hypertension. London and New York: Taylor&Francis: 56.
- The American Society for Transplant Physicians/The American Thoracic Society/European respiratory Society/International Society for Heart Lung Transplantation (1997) International guidelines for the selection of lung transplantation. Am. J. Resp. Crit. Care. Med., 158: 335-339.
- World Health Organisation: Primary Pulmonary Hypertension — executive summary (ed. S. Rich) (1998).
- Guidelines for the management of arterial hypertension (2007) J. Hypertension, Vol. 25: 1105-1187.