Тромбоэмболия легочной артерии
Содержание
Тромбоэмболия легочной артерии (ТЭЛА) — это окклюзия основного ствола или ветвей ЛА частицами тромба, которые формируются в венах большого круга кровообращения или полостях правых отделов сердца и переносятся в малый круг кровообращения с током крови. Тромбоз ЛА — локальное тромбообразование в системе легочных артерий. Иногда очень сложно отличить локальное тромбообразование в малом круге кровообращения (у больных с сердечной недостаточностью, опухолями и др.) от эмболизации из других сосудистых регионов, поэтому чаще всего их рассматривают вместе как единый симптомокомплекс.
Легочная эмболия, код по МКБ-10: I26.
ТЭЛА не является самостоятельным заболеванием, а представляет собой распространенное и прогностически весьма неблагоприятное осложнение разных болезней, травм и оперативных вмешательств.
ЭПИДЕМИОЛОГИЯ
ТЭЛА — одно из наиболее распространенных осложнений многих заболеваний, представляющее угрозу для жизни больного. В мире ТЭЛА считается третьей из наиболее частых причин смерти. Ежегодно от ТЭЛА погибает 0,1% населения земного шара. По данным Европейского общества кардиологов, во Франции ежегодно регистрируют до 100 тыс. случаев ТЭЛА, в Англии и Шотландии — 65 тыс., в Италии — 60 тыс., а в США — около 650 тыс. Большинство случаев ТЭЛА развивается в стационарах, причем 70–80% составляют больные терапевтического профиля. Среди пациентов терапевтического профиля наиболее часто ТЭЛА развивается при инсульте (56%), ИМ (22%), острых терапевтических заболеваниях (16%), новообразованиях (более чем в 15% случаев), а также у лиц преклонного возраста (9%). При общей хирургической патологии частота тромбоза глубоких вен составляет 32%, при переломах головки бедренной кости — 45%, множественных травмах — 50%, при гинекологических операциях по поводу злокачественных образований — 22%, при гинекологических операциях по поводу доброкачественных образований — 14%.
По данным Фремингемского исследования, смертность от ТЭЛА составляет 15,6% всей госпитальной смертности, причем 18% — больные хирургического профиля, а 82% — с терапевтической патологией. Большие различия эпидемиологических данных обусловлены отсутствием точной статистики распространенности ТЭЛА, что обусловлено объективными причинами: в большинстве случаев эпизоды ТЭЛА остаются незамеченными, поскольку ее клинические симптомы сходны с другими заболеваниями легочной и сердечно-сосудистой системы, а при аутопсии часто только тщательное исследование ЛА позволяет выявить тромбы или остаточные признаки перенесенной ТЭЛА.
Точные статистические данные о частоте случаев ТЭЛА в Украине отсутствуют, а вероятная частота заболевания составляет около 50 тыс. случаев в год, в том числе с летальным исходом — более 10 тыс. В Украине развитие ТЭЛА осложняет 0,1–0,3% оперативных вмешательств и является причиной 20–40% смерти в послеоперационный период. Не менее часто ТЭЛА выявляют и у больных терапевтического профиля.
По данным Европейского общества кардиологов, прижизненно ТЭЛА диагностируют приблизительно в 25% случаев. Уровень смертности при нелеченной ТЭЛА достигает 30%, тем не менее проведение адекватной антикоагулянтной терапии позволяет снизить его до 2–8%. Вероятность рецидивов ТЭЛА у нелеченных больных составляет около 50%, половина из которых также имеют неблагоприятный прогноз.
ЭТИОЛОГИЯ
Венозный тромбоз любой локализации может осложниться развитием ТЭЛА. Наибольшую угрозу представляет бассейн нижней полой вены, с тромбообразованием в котором связано около 90% всех эпизодов ТЭЛА. Частой причиной ТЭЛА (70%) является острый тромбоз глубоких вен илеофеморального сегмента и проксимальных отделов вен нижних конечностей (подколенно-бедренный сегмент).
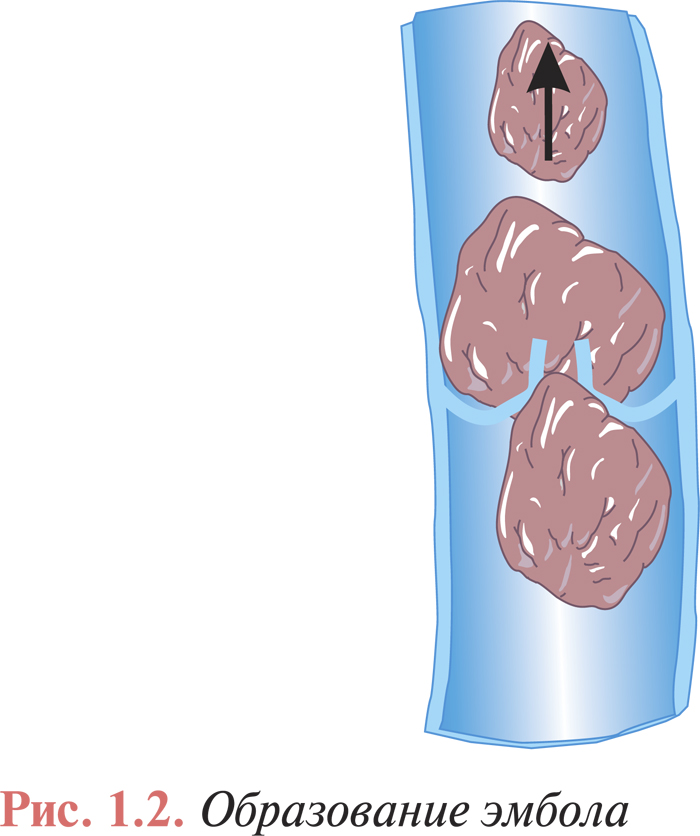
Венозный тромбоз с локализацией в дистальных отделах глубоких вен нижних конечностей (голень) осложняется ТЭЛА с частотой 1–5%, а тромбоз поверхностных вен почти никогда не приводит к развитию ТЭЛА. Часто отмечают тромбоз одновременно глубоких и поверхностных вен голени (рис. 1.1). Наибольшую угрозу представляют так называемые флотирующие тромбы. Они имеют единственную точку фиксации в дистальном отделе, а длина их иногда достигает 15–20 см. Возникновение флотирующих тромбов часто обусловлено распространением процесса из вен небольшого калибра в крупные венозные сосуды. При окклюзивном флеботромбозе флотирующая верхушка тромба может стать потенциальным эмболом (рис. 1.2). Следует отметить, что при флотирующем тромбе не отмечают каких-либо клинических проявлений, поскольку кровоток в пораженной вене сохраняется.
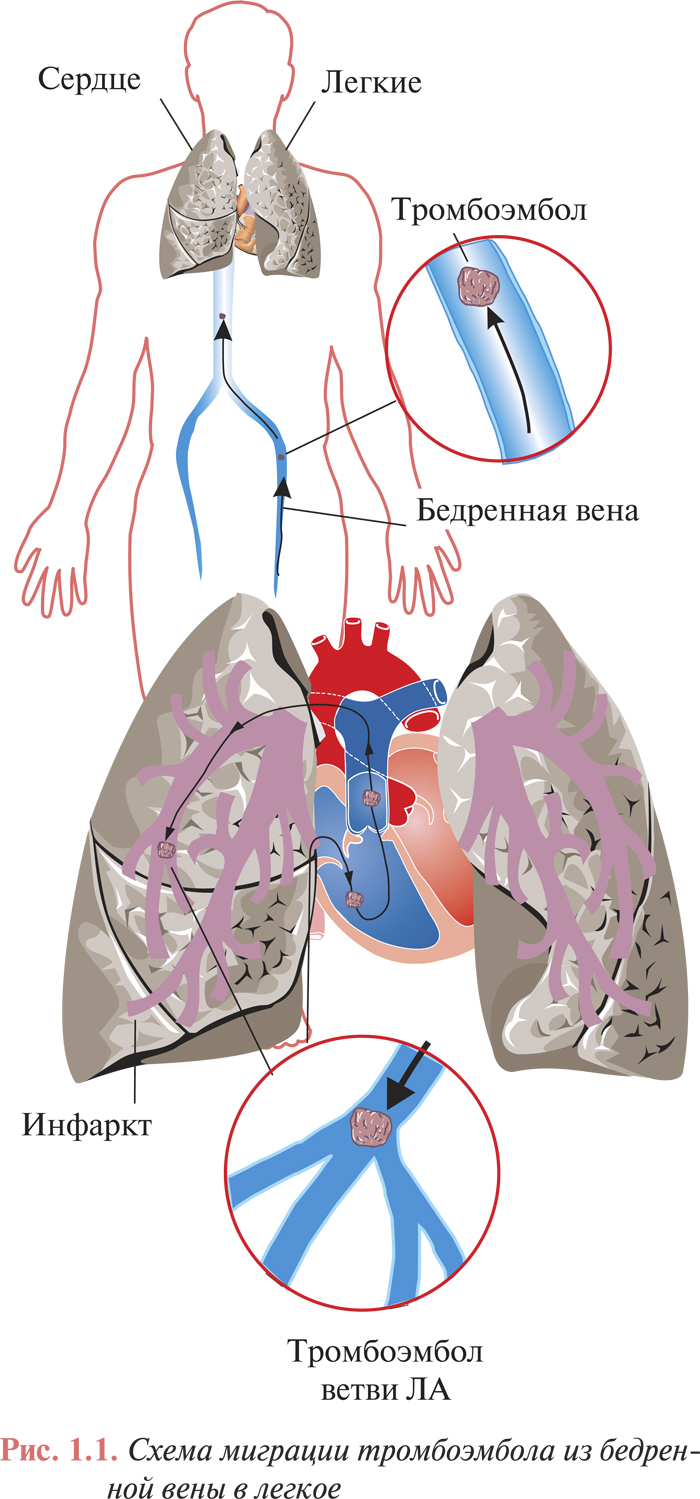
При тромбах, которые полностью закрывают просвет сосуда, ТЭЛА не развивается. Есть сообщения о случаях ТЭЛА из бассейна верхней полой вены (до 3,5%) в результате введения венозных катетеров в отделениях реанимации и блоках интенсивной терапии. Значительно реже к развитию ТЭЛА приводят тромбы с локализацией в правом предсердии при условии его дилатации или фибрилляции предсердий.
Оторвавшись от венозной стенки у места образования, тромбы с потоком крови относятся в ЛА. Локализация тромбоэмболов в сосудистом русле легких во многом зависит от их размеров. Обычно эмболы задерживаются в местах разветвления артерий, вызывая частичную или, что случается реже, полную окклюзию дистальных ветвей. В 65% случаев поражаются ЛА обеих легких, в 20% — только правого легкого, в 10% — только левого легкого, причем нижние сегменты поражаются в 4 раза чаще, чем верхние. У больных с открытым овальным окном при наличии высокой легочной гипертензии тромбоэмболы могут попасть в артерии большого круга кровообращения (парадоксальная тромбоэмболия) и привести к эмболии артерий мозга, брюшного отдела аорты, магистральных артерий нижних конечностей и др.
По данным Французского регистра, в 50% ТЭЛА источник эмболии и факторы риска установить не удается. Вероятно, во многих случаях имеет место локальное тромбообразование в системе ЛА. Первичный тромбоз ЛА чаще развивается при застойных явлениях в малом круге кровообращения при тяжелых заболеваниях сердца и легких, а также врожденной склонности к тромбозу. Важное значение имеют изменения в системе гемостаза, спонтанного фибринолиза, ретракции и организации венозных тромбов.
ФАКТОРЫ РИСКА
Поскольку тромбоз магистральных вен и ТЭЛА — проявления одной патологии, они имеют общие факторы риска. В последних рекомендациях Европейского общества кардиологов (2000 г.) выделяют первичные (наследственные) и вторичные (приобретенные) факторы риска тромбоза глубоких вен нижних конечностей и ТЭЛА (табл. 1.1). Многие пациенты имеют наследственную склонность к тромбозу, которая развивается под воздействием провоцирующих факторов. Разные факторы риска могут сочетаться друг с другом, хотя у значительной части больных классические способствующие факторы отсутствуют.
Таблица 1.1
Факторы риска тромбозов (Рекомендации Европейского кардиологического общества, 2000)
| Первичные | Вторичные |
|
|
Врожденную склонность к тромбозу как самостоятельный фактор риска считают редчайшим состоянием, хотя реальная ее распространенность неизвестна. Предполагать наличие генетических дефектов следует в случае развития необъяснимого тромбоза в возрасте до 40 лет, рецидивирования тромбоза глубоких вен или ТЭЛА и отягощенного анамнеза. Частота тромбоэмболических осложнений повышается с возрастом, хотя эта тенденция может отражать развитие заболеваний, являющихся объективными факторами риска тромбоза.
Один из ведущих факторов, способствующих тромбообразованию в глубоких венах нижних конечностей, — гиподинамия. Значительное уменьшение работы мышц нижних конечностей приводит к замедлению кровотока в венах, что способствует образованию тромбов. Тромбоэмболии часто выявляют при сердечно-сосудистых заболеваниях, в том числе у 30–60% больных с инсультом, 5–35% — с острым ИМ и у 12% — с хронической СН. Развитию тромбоза глубоких вен и ТЭЛА способствует иммобилизация пациента, даже непродолжительная (на 1 нед), и хирургические вмешательства (например, после оперативных вмешательств по поводу перелома бедренной кости частота тромбоэмболии при отсутствии профилактической терапии составляет 50–75%).
Отдельно необходимо указать, что весомым фактором риска развития ТЭЛА являются путешествия на большие расстояния. Так, при продолжительных перелетах, начиная с 2500 км, вероятность развития ТЭЛА повышается с увеличением расстояния (рис. 1.3).
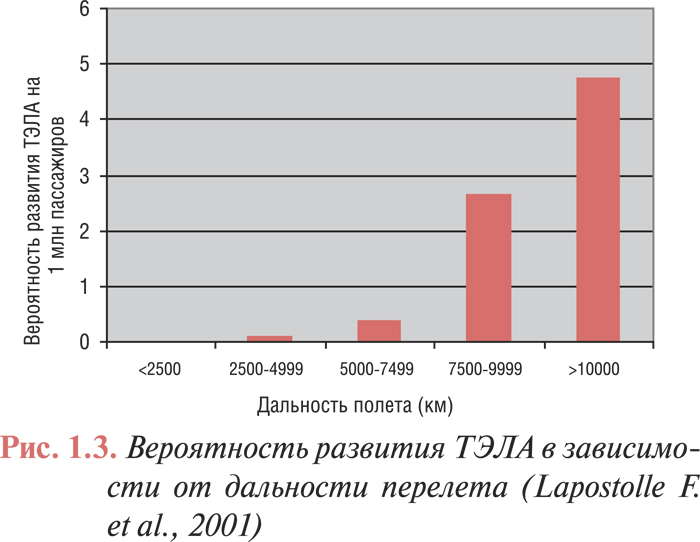
Поэтому при длительности полета более 6 ч всем пассажирам рекомендуется избегать пережатия одеждой нижних конечностей и развития дегидратации, а при наличии дополнительных факторов риска ТЭЛА — проводить профилактическую компрессию ног с помощью медицинских трикотажных изделий или эластичного бинта. Альтернативный метод — однократное введение перед полетом низкомолекулярного гепарина в профилактической дозе. Профилактическое использование ацетилсалициловой кислоты не рекомендуется.
К важным факторам риска ТЭЛА (около 30%) относятся злокачественные новообразования, которые сопровождаются синдромом гиперкоагуляции и угнетением системы фибринолиза. Нередко ТЭЛА осложняет течение послеоперационного периода (оперативные вмешательства на матке, яичниках, предстательной железе, мочевом пузыре, желудке, толстой кишке и т.д.), особенно при наличии гнойно-септических осложнений.
В период беременности риск развития тромбоэмболии повышается в 5 раз. Заместительная гормональная терапия после менопаузы приводит к повышению риска тромбозов и эмболии в 3 раза. К самостоятельным факторам риска относят также курение и ожирение. В клинических исследованиях и во время аутопсий установить источник тромба при ТЭЛА удавалось в 50–70% случаев. Из них в 70–90% источником ТЭЛА был тромбоз сосудов, впадающих в нижнюю полую вену, а в 10–20% — в верхнюю полую вену.
ПАТОГЕНЕЗ
Более столетия назад, в 1856 г., Рудольф Вирхов установил, что к развитию венозного тромбоза приводят три фактора:
- локальное повреждение эндотелия;
- повышение свертывающей способности крови;
- локальное замедление кровотока (стаз).
Начальным этапом тромбогенеза в большинстве случаев является повреждение эндотелия сосудистой стенки. Известно, что эндотелий обладает мощным влиянием на состояние коагуляционного гемостаза. В норме клетки эндотелия синтезируют эндотелин, простациклин, оксид азота — вещества, которые предупреждают спазм сосудов и тромбообразование, тормозят адгезию и агрегацию тромбоцитов. Кроме этого, эндотелиальные клетки выделяют тканевой активатор плазминогена, инициирующий фибринолиз в ответ на тромбообразование. При повреждении наряду с угнетением защитного влияния эндотелия на свертывающие свойства крови происходит высвобождение в кровоток прокоагулянтных веществ, в частности фактора Виллебранда, который образует мостик между тромбоцитами и коллагеном, микрофибриллами субэндотелия. Кроме того, обнаженный субэндотелиальный слой сосудов сам становится мощным стимулятором адгезии и агрегации тромбоцитов, из которых высвобождается ряд биологически активных веществ (АДФ, серотонин, фактор III, тромбопластин и др.). Активация тромбоцитов стимулирует запуск коагуляционного каскада при участии всех факторов свертывания крови с образованием тромбина, который превращает фибриноген в фибрин и приводит к формированию фибрин-тромбоцитарного тромба.
Тромб от места возникновения переносится с током крови в ПЖ, где частично разрушается и в виде отдельных фрагментов попадает в малый круг кровообращения. Поэтому в большинстве случаев отмечают множественную окклюзию нескольких ветвей ЛА разного калибра, часто двустороннюю — немассивную ТЭЛА. Значительно реже происходит массивная тромбоэмболия главных ветвей или ствола ЛА, сопровождающаяся острым развитием клинической картины тяжелой тромбоэмболии, в частности быстро наступающей внезапной сердечной смертью. При субмассивной ТЭЛА эмболизируются долевые и сегментарные ветви ЛА.
Механическая обструкция артериального русла легких тромбоэмболом, в которой большую роль играет спазм ЛА в ответ на механическое раздражение, и нейрогуморальная реакция, возникающая в ответ, имеют ведущее значение в генезе респираторных и гемодинамических расстройств, выраженности клинических проявлений и степени тяжести ТЭЛА. Действие гуморальных факторов не зависит от размеров тромба, поэтому эмболия даже мелкой ветви ЛА может привести к значительным нарушениям гемодинамики. Это объясняет частое несоответствие между объемом эмболической окклюзии легочных сосудов и тяжестью клинической картины ТЭЛА.
Гемодинамические расстройства
Вследствие частичной или полной механической обструкции легочно-артериального русла тромбоэмболом происходит резко выраженный генерализованный спазм артериол малого круга (прекапиллярная гипертензия), преимущественно за счет барорефлекса и высвобождения вазоконстрикторных субстанций (тромбоксана А2, серотонина, гистамина и др.) из тромбоцитов, которые оседают на поверхности тромбоэмбола. В результате этого легочное сосудистое сопротивление значительно возрастает и развивается легочная гипертензия. У больных без сопутствующих заболеваний сердца и легких острая гипертензия малого круга кровообращения возникает при обструкции около 40–50% легочного артериального русла. Окклюзия 60–75% легочной циркуляции является критической и приводит к развитию острой правожелудочковой недостаточности и резкому уменьшению объема циркулирующей крови. Необходимо отметить, что при ТЭЛА степень окклюзии просвета сосуда со временем может увеличиваться за счет присоединения вторичного местного тромбоза, который увеличивает размеры тромбоэмбола относительно объема кровотока. Нередко это приводит к трансформации немассивной ТЭЛА в массивную (табл. 1.2).
Таблица 1.2
Гемодинамические последствия легочной эмболии (рекомендации Европейского кардиологического общества, 2000)
| Патологические изменения | Клинические следствия |
| А. Нарушение легочной гемодинамики | |
| Прекапиллярная гипертензия | Уменьшение сосудистого русла, бронхоконстрикция, артериолоконстрикция |
| Раскрытие коллатералей | Бронхопульмональные артериальные анастомозы, легочные артериовенозные шунты
Перераспределение кровотока |
| Нарушение кровотока | Восстановление кровотока (лизис тромба) |
| Б. Нарушение системного кровотока и функции сердца | |
| Артериальная гипотензия | |
| Тахикардия | |
| Перегрузка и дилатация ПЖ сердца | |
| Повышение центрального венозного давления | |
| Изменения геометрии ЛЖ сердца | |
| В. Нарушение коронарного кровотока | |
| Снижение транскоронарного градиента давления | Системная артериальная гипотензия
Повышение давления в правом предсердии |
| Уменьшение миокардиального кровотока | |
| Относительная гипоперфузия субэндокардиального слоя миокарда ПЖ | |
При первом эпизоде субмассивной и даже массивной ТЭЛА, которая не приводит к внезапной смерти, систолическое давление в ЛА зачастую остается относительно невысоким (40–50 мм рт. ст.). Негипертрофированный ПЖ не может обеспечить систолическое давление более 70 мм рт. ст. Высокие значения этого показателя, как правило, свидетельствуют о постепенном формировании легочной гипертензии в результате нескольких эпизодов ТЭЛА или о наличии хронической легочной гипертензии иного генеза.
Повышение легочного сосудистого сопротивления сопровождается возрастанием напряжения в стенке ПЖ сердца и его дилатацией, в результате чего межжелудочковая перегородка выпячивается в полость ЛЖ и суживает его просвет, а сжатие правой коронарной артерии вызывает ишемию, а иногда и ИМ ПЖ сердца.
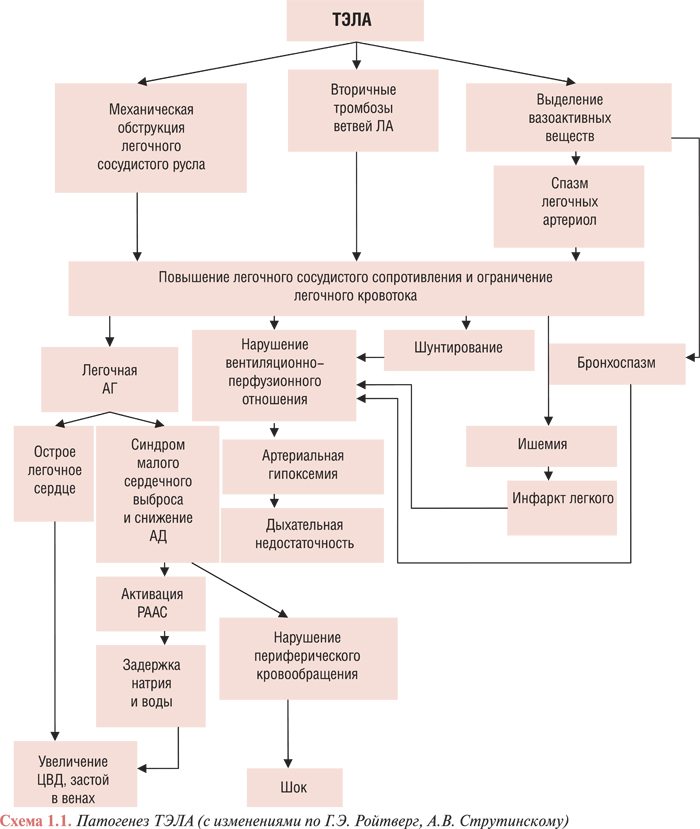
Повышение легочного сосудистого сопротивления и чрезмерная нагрузка на ПЖ сердца (повышение постнагрузки) на фоне значительного уменьшения вместимости артериального русла (снижение преднагрузки) приводит к значительному ограничению венозного притока крови в левые отделы сердца и развитию синдрома малого сердечного выброса: уменьшаются минутный объем, сердечный индекс, снижается уровень АД, нарушается кровоснабжение жизненно важных органов (головного мозга, сердца, почек). Нарушения центральной гемодинамики при ТЭЛА могут быть разной степени выраженности: от умеренно выраженной дилатации ПЖ сердца с компенсаторной гиперфункцией и без существенного уменьшения сердечного выброса в состоянии покоя до обструктивного кардиогенного шока с высоким центральным венозным давлением и сниженным АД вследствие нарушения наполнения ЛЖ сердца в диастолу. Это может привести к уменьшению коронарного кровотока и ухудшить перфузию миокарда, преимущественно ПЖ сердца. В некоторых случаях возможно развитие острого отека легких, имеющего сложный патофизиологический механизм. Большое значение имеет рефлекторный выброс норадреналина в ответ на повреждение большого объема легочной ткани, которое вызывает спазм легочных артериол и перегрузку ЛЖ сердца. Кроме того, резкая дилатация ПЖ сердца приводит к сдавливанию ЛЖ и повышению давления в левом предсердии и, таким образом, усугубляет легочную гипертензию. В патогенезе отека легких при эмболиях мелких ветвей ЛА существенную роль играет повышение проникаемости альвеолярно-капиллярной мембраны в сочетании с увеличением легочного кровотока по неокклюзированным ветвям ЛА (схема 1.1).
Респираторные расстройства
Полное или частичное прекращение легочного кровотока в результате ТЭЛА приводит к выраженному нарушению вентиляционно-перфузийного соотношения, вследствие чего развивается дыхательная недостаточность и артериальная гипоксемия. В результате прекращения кровотока в хорошо вентилируемых альвеолах происходит увеличение внутрилегочного «мертвого пространства» и ухудшение газообмена. Нарушение вентиляционно-перфузионного соотношения усиливается выраженным бронхоспазмом, связанным с действием на гладкие мышцы мелких бронхов биологически активных веществ, которые выделяются из тромбоцитов (тромбоксан А2, серотонин и др.). Кроме того, в результате ишемии альвеол, обусловленной их недостаточной перфузией, нарушается не только их вентиляция, но и продукция сурфактанта, что может привести к развитию ателектазов на 1–2-е сутки после тромбоэмболии.
Вследствие недостаточности кровоснабжения альвеол может развиться инфаркт легкого. Кроме того, снижение вентиляции альвеол с сохраненной перфузией еще больше нарушает газообмен в легких и приводит к усилению артериальной гипоксемии. Наконец, в результате повышения давления проксимальнее области окклюзии приоткрываются артериоло-венозные анастомозы и происходит шунтирование крови из артериол в вены, что также увеличивает артериальную гипоксемию.
При альвеолярно-интерстициальном отеке легких происходит стимуляция юкстакапиллярных рецепторов в альвеолярно-капиллярной мембране. Это приводит к повышению вагусной афферентной активности с последующей стимуляцией респираторных нейронов продолговатого мозга, в результате чего возникает гипервентиляция и гиперкапния (табл. 1.3).
Таблица 1.3
Респираторные последствия легочной эмболии (рекомендации Европейского кардиологического общества, 2000)
| Патологические изменения | Клинические последствия |
| А. Нарушение легочной вентиляции | |
| Гипервентиляция |
|
| Повышение сопротивления дыхательных путей |
|
| Б. Нарушение альвеолярной вентиляции | |
| Альвеолярная гипервентиляция (гипокапния, алкалоз) | |
| Относительная альвеолярная гиповентиляция | |
| В. Нарушение легочной механики | |
| Снижение динамической податливости легких |
|
| Г. Нарушение диффузных свойств легких | |
| Уменьшение объема капиллярной крови | |
| Уменьшение проницаемости альвеолярно-капиллярной мембраны | |
| Д. Нарушение вентиляционно-перфузионного соотношения | |
Следует подчеркнуть, что далеко не всегда при ТЭЛА отмечают все нарушения гемодинамики и альвеолярной вентиляции. Это зависит, прежде всего, от массивности тромбоэмболии, локализации тромбоэмбола и исходного кардиопульмонального статуса больного. Рецидивирующая окклюзия крупных ЛА вызывает развитие тяжелой гипертензии малого круга кровообращения и развитие хронического легочного сердца. Степень выраженности хронической легочной гипертензии зависит от многих факторов: полноты спонтанного или медикаментозного лизиса тромба, рецидивирования ТЭЛА, образования тромбов вокруг области первичной тромбоэмболии, процессов организации и внутрисосудистого ремоделирования тромбов, перестройки микроциркуляторного русла легких.
КЛАССИФИКАЦИЯ ТЭЛА
Согласно МКБ 10-го пересмотра ТЭЛА относится к заболеваниям сердечно-сосудистой системы.
Международная классификация, разработанная Европейским обществом кардиологов в 2000 г., предусматривает выделение 2 основных групп ТЭЛА — массивную и немассивную.
ТЭЛА считают массивной, если у пациентов развиваются явления кардиогенного шока и/или артериальная гипотензия (снижение САД ниже 90 мм рт. ст., или снижение на 40 мм рт. ст. и более от изначального уровня, которое длится дольше 15 мин и не связано с гиповолемией, сепсисом, аритмией). Массивная ТЭЛА развивается при обструкции более 50% сосудистого русла легких.
Немассивную ТЭЛА диагностируют у пациентов со стабильной гемодинамикой без выраженных признаков правожелудочковой недостаточности. Немассивная ТЭЛА развивается при обструкции менее 50% сосудистого русла легких.
Среди пациентов с немассивной ТЭЛА, при условии выявления признаков гипокинезии ПЖ (при проведении эхоКГ) и стабильной гемодинамики, выделяют подгруппу субмассивной ТЭЛА. Субмассивная ТЭЛА развивается при обструкции не менее 30% сосудистого русла легких.
По остроте развития патологического процесса выделяют такие формы ТЭЛА:
- острая — характеризуется внезапным началом, болью за грудиной, одышкой, снижением АД, признаками острого легочного сердца, возможно развитие обструктивного шока;
- подострая — характерны прогрессирование дыхательной и правожелудочковой недостаточности, признаки тромбоинфарктной пневмонии;
- хроническая рецидивирующая — характерны повторные эпизоды одышки, симптомы тромбоинфарктной пневмонии, появление и прогрессирование ХСН с периодами обострений, появление и прогрессирование признаков хронического легочного сердца.
КЛИНИКА
Клиническая картина заболевания неспецифическая и характеризуется полиморфизмом симптомов — от выраженных гемодинамических нарушений и развития острой правожелудочковой недостаточности до бессимптомного течения заболевания. Выраженность клинических проявлений определяется объемом эмболизации легочного сосудистого русла, локализацией тромбоэмбола, уровнем легочной АГ, степенью гемодинамических расстройств, исходным кардиопульмональным статусом больного, наличием инфаркта легких, тромбоинфарктной пневмонии и другими факторами. В 90% случаев ТЭЛА можно заподозрить на основании наличия таких клинических симптомов: одышка, боль в грудной клетке и потеря сознания. Совокупность одышки, тахипноэ и боли в грудной клетке выявляют у 97% больных.
При анализе данных международного регистра ICOPER установлено, что из 2454 пациентов у большинства (89%) отмечали клинические признаки ТЭЛА при сохранении стабильной гемодинамики, у 4% — нестабильную гемодинамику (САД ниже 90 мм рт. ст.), а у 7% — бессимптомное течение заболевания. Частота регистрации основных клинических признаков ТЭЛА приведена в табл. 1.4.
Таблица 1.4
Частота регистрации основных клинических симптомов у больных с ТЭЛА по данным регистра ICOPER (n=2454), (с изменениями по Coldhaber S. et al., 1999 г.)
| Клинические признаки | Частота выявления признака, % |
| Одышка | 82 |
| Тахипноэ (частота дыхания более 20/мин) | 60 |
| Тахикардия (ЧСС более 100 уд./мин) | 40 |
| Боль в грудной клетке | 49 |
| Кашель | 20 |
| Потеря сознания | 14 |
| Кровохарканье | 7 |
ОСНОВНЫЕ КЛИНИЧЕСКИЕ СИНДРОМЫ
Кардиальный синдром
Острая недостаточность кровообращения (преимущественно правожелудочковая) проявляется артериальной гипотензией. Артериальная гипотензия (транзиторная или стойкая) — характерный признак ТЭЛА, обусловлена резким снижением сердечного выброса, которое развивается вследствие острой перегрузки правых отделов сердца и резкого уменьшения притока крови к левым отделам сердца. Выраженная артериальная гипотензия, как правило, свидетельствует о наличии массивной ТЭЛА.
Обструктивный шок развивается приблизительно у 20% больных.
Синдром острого легочного сердца возникает при массивной ТЭЛА. При объективном исследовании определяется набухание шейных вен, патологическая пульсация в эпигастральной области, расширение правой границы сердца, акцент и раздвоение II тона над ЛА, систолический шум над мечевидным отростком или в четвертом межреберье по левому краю грудины; в пятом межреберье по левому краю грудины прослушивается патологический III тон (правожелудочковый протодиастолический ритм галопа). Почти всегда отмечают повышение центрального венозного давления, увеличение печени и абдоминально-югулярный рефлюкс.
Ангинозная боль за грудиной, напоминающая стенокардию, связана с дилатацией выносного тракта ПЖ, легочного конуса и резким уменьшением коронарного кровотока вследствие снижения ударного и минутного объемов сердца.
Тахикардия обычно бывает синусовой, возможно возникновение тахисистолической формы фибрилляции или трепетания предсердий, суправентрикулярной тахикардии. Часто развивается острая блокада правой ножки пучка Гиса. Могут возникать угрожающие жизни нарушения ритма: желудочковая тахикардия и фибрилляция желудочков.
Острый отек легких при ТЭЛА возникает редко, преимущественно при наличии сопутствующей патологии сердечно-сосудистой системы.
Легочно-плевральный синдром
Одышка — ведущий и наиболее характерный симптом ТЭЛА, который является проявлением дыхательной недостаточности. Одышка возникает внезапно в состоянии покоя, имеет инспираторный характер и бывает разной степени выраженности. Остро возникающая изолированная одышка обычно является результатом массивной ТЭЛА, нередко сопровождающейся болью за грудиной и выраженными гемодинамическими нарушениями. Иногда, при немассивной ТЭЛА, одышка развивается постепенно на протяжении нескольких недель. При отсутствии хронических бронхолегочных и сердечно-сосудистых заболеваний одышка не сопровождается дистанционными хрипами, клокочущим дыханием и не зависит от локализации ТЭЛА, ортопноэ не отмечают. Обычно одышка сопровождается тахипноэ и тахикардией, степень выраженности которых зависит от массивности ТЭЛА и исходного кардиопульмонального статуса больного. Повышение показателей частоты дыхания более 40/мин и ЧСС выше 120 уд./мин имеет неблагоприятное прогностическое значение.
Боль в грудной клетке плеврального характера, усиливается при дыхании, кашле, обусловлена развитием инфаркта легкого, инфарктной пневмонии или сухого плеврита (легочноплевральный синдром) и не является ведущим диагностическим критерием. Кашель непродуктивный. У 10–30% больных выявляют кровохарканье, обусловленное развитием инфаркта легких, часто в виде прожилок крови в мокроте, возможно легочное кровотечение. Характерна бледность кожных покровов, приобретающих пепельный оттенок. При массивной ТЭЛА появляется выраженный «чугунный» цианоз области шеи и верхней половины туловища.
Притупление перкуторного звука, усиление голосового дрожания, влажные хрипы и крепитацию отмечают при инфаркте легкого и инфарктной пневмонии. В период формирования инфаркта легкого появляется шум трения плевры, который прослушивается на протяжении нескольких часов или дней и исчезает при уменьшении выраженности явлений фибринозного плеврита или накоплении экссудата в плевральной полости. Экссудативный плеврит развивается у 50% больных с инфарктом легкого. Иногда выявляют стойкий экссудативный плеврит, способствующий затяжному течению заболевания. Могут также отмечать умеренно выраженный бронхообструктивный синдром.
Температура тела повышается, как правило, с 1–2-го дня болезни, сохраняется несколько дней (реже — 1–3 нед). Она обычно субфебрильная, а при развитии инфарктной пневмонии повышается до 38,5–39 °С.
Церебральный синдром
При массивной ТЭЛА могут отмечать нарушения со стороны ЦНС (потеря сознания, судороги, рвота, кома), в основе которых лежит гипоксия головного мозга.
Почечный синдром
Иногда течение ТЭЛА осложняется развитием ОПН, в патогенезе которой ведущая роль принадлежит резкому снижению уровня АД в сочетании с констрикцией юкстагломерулярных сосудов, что приводит к снижению фильтрационного давления в клубочках.
Абдоминальный синдром
Могут отмечать резкую боль в правом подреберье, которая сопровождается парезом кишечника, икотой, симптомами раздражения брюшины. Она связана с острым увеличением печени при правожелудочковой недостаточности или с развитием обширного инфаркта правого легкого.
Массивная ТЭЛА развивается при обструкции более 50% легочного артериального русла. Течение заболевания характеризуется бурной симптоматикой и часто заканчивается внезапной смертью. Клиническая картина тромбоэмболии ствола или крупных ветвей ЛА в большинстве случаев характеризуется острым началом заболевания, бурным прогрессированием симптомов эмболии, развитием дыхательной и правожелудочковой недостаточности, снижением АД и нарушением перфузии внутренних органов.
Выделяют три формы массивной ТЭЛА:
- мгновенная — заканчивается внезапной смертью;
- циркуляторная — характеризуется развитием кардиогенного шока с выраженной картиной правожелудочковой недостаточности;
- респираторная — характеризуется выраженной одышкой, тахипноэ, диффузным цианозом.
Субмассивная ТЭЛА развивается при обструкции более 30% легочного артериального русла. Характеризуется дисфункцией ПЖ и стабильной гемодинамикой. Однако такие больные имеют высокий риск развития осложнений, в том числе фатальных (острое легочное сердце, кардиогенный шок). Протекает с выраженными клиническими симптомами.
Немассивная ТЭЛА обычно развивается при обструкции менее 30% легочного артериального русла. Часто протекает с менее выраженными симптомами или бессимптомно и остается нераспознанной. В большинстве случаев немассивная ТЭЛА протекает под маской других заболеваний и синдромов. В клинической картине на первый план выступают явления тромбоинфарктной пневмонии. Манифестирует одышкой, которая возникает остро и усиливается при принятии пациентом вертикального положения, кровохарканьем, тахикардией, болью в грудной клетке в месте поражения легкого (в результате вовлечения в патологический процесс плевры).
Следует подчеркнуть, что нередко тяжесть клинической картины заболевания не соответствует объему тромбоэмболической окклюзии. Так, эмболия мелких ветвей ЛА может протекать с отчетливо выраженными симптомами инфаркта легкого, интенсивной плевральной болью, признаками дыхательной недостаточности и артериальной гипотензией, тогда как некоторые случаи массивной ТЭЛА могут проявляться лишь умеренно выраженной одышкой и тахикардией.
Инфаркт легкого
В 10–30% случаев течение ТЭЛА осложняется развитием инфаркта легкого. Инфаркт легкого развивается преимущественно при тромбоэмболии долевых и сегментарных ветвей ЛА. Большое значение в распространении инфаркта легкого имеет угнетение эндогенного фибринолиза. Необходимым условием его развития, наряду с окклюзией ветвей ЛА, является снижение кровотока в бронхиальных артериях, развитие коллатералей и нарушение проходимости бронхов. Поэтому наиболее часто инфаркт легкого развивается при ТЭЛА, осложняющей течение застойной СН, митрального стеноза, пневмонии, ХОБЛ. Обычно инфаркт легкого имеет геморрагический характер за счет кровоизлияния из бронхиальных артерий в легочную ткань и обратного тока крови из легочных вен. Формирование инфаркта легкого начинается через 24 ч после начала заболевания, а полное его развитие происходит через 5–6 сут. Инфицирование инфаркта легкого приводит к развитию перифокальной пневмонии.
Клинические признаки инфаркта легкого — внезапность возникновения, острая боль в грудной клетке, кровохарканье, одышка, тахикардия, крепитация и влажные хрипы при аускультации над соответствующим участком легкого, повышение температуры тела.
Боль, обусловленная реактивным плевритом над поврежденным участком легкого, появляется в соответствующей половине грудной клетки и характеризуется усилением при глубоком дыхании, кашле, иногда при нажатии на соответствующие межреберные промежутки. При накоплении экссудата в плевральной полости боль исчезает. В случае вовлечения в патологический процесс диафрагмальной плевры могут отмечать псевдосимптомы острого живота. Кровохарканье при инфаркте легкого возникает у 10–56% больных, в большинстве случаев незначительное. Повышение температуры тела, как правило, отмечают с 1–2-го дня болезни. Температура тела субфебрильная, при развитии инфарктной пневмонии повышается до 38,5–39 °С. Притупление перкуторного звука, усиление голосового дрожания, влажные хрипы и крепитацию отмечают только при обширных инфарктах легкого и инфарктных пневмониях. В период формирования инфаркта легкого появляется шум трения плевры. Экссудативный плеврит развивается у половины больных инфарктом легкого при его субплевральной локализации. Серозный или геморрагический экссудат имеет небольшой объем. Иногда развивается стойкий экссудативный плеврит, который способствует затяжному течению заболевания. В редких случаях инфаркт легкого может осложняться развитием абсцедирующей пневмонии, эмпиемы плевры и спонтанного пневмоторакса.
Рецидивирующая ТЭЛА
Больные, перенесшие первый эпизод ТЭЛА, имеют высокий риск рецидива в ближайшие годы. Рецидивирующее течение заболевания отмечают у 9,4–34,6% больных с ТЭЛА. У трети больных с массивной ТЭЛА ее развитию предшествуют эмболии мелких ветвей ЛА, а на протяжении 4–6 нед после первого эпизода существует высокий риск повторной ТЭЛА. Этот риск приблизительно в 2,5 раза выше у мужчин, чем у женщин. Кроме того, риск рецидива ТЭЛА в 2 раза выше у женщин, принимающих гормональные контрацептивы, и у пациентов с идиопатической формой заболевания. Рецидивирующая ТЭЛА чаще всего возникает на фоне сердечно-сосудистых заболеваний, протекающих с нарушениями ритма и СН, злокачественных новообразований, а также после оперативных вмешательств на органах брюшной полости. В большинстве случаев рецидивирующая ТЭЛА не имеет ярких клинических проявлений, протекает латентно, под маской других заболеваний, что создает значительные трудности при диагностике, особенно если не удается выявить факторы риска тромбоза.
Рецидивы ТЭЛА могут проявляться:
- немотивированной одышкой (эпизоды, которые внезапно возникают и быстро проходят);
- повторными пневмониями, часть которых протекает как плевропневмония;
- быстропреходящим сухим плевритом, экссудативным плевритом, особенно с геморрагическим выпотом;
- повторными «немотивированными» обмороками, коллапсом, которые нередко сочетаются с ощущением нехватки воздуха и тахикардией;
- внезапно возникающим чувством сжатия в грудной клетке;
- лихорадкой неустановленного происхождения, устойчивой к лечению антибактериальными препаратами;
- пароксизмальной одышкой с ощущением нехватки воздуха и тахикардией;
- появлением или прогрессированием СН, резистентной к лечению;
- появлением и прогрессированием симптомов подострого или хронического легочного сердца при отсутствии анамнестических указаний на хронические заболевания бронхолегочного аппарата.
Рецидивирующее течение ТЭЛА приводит к развитию пневмосклероза, эмфиземы легких, легочной гипертензии, прогрессирующей правожелудочковой недостаточности. Очередной рецидив заболевания может привести к внезапной смерти больного от массивной эмболии.
ДИАГНОСТИКА
Своевременная диагностика ТЭЛА до настоящего времени представляет значительные трудности в связи с неспецифичностью и полиморфизмом развивающихся клинических синдромов, внезапностью развития, катастрофической быстротой течения заболевания и невозможностью использования во многих лечебных учреждениях высокоинформативных методов исследования (перфузионная сцинтиграфия легких, ангиопульмонография). При жизни заболевание диагностируют в 50–70% случаев, гипердиагностика — в 65%. Огромное значение в своевременной диагностике ТЭЛА имеет настороженность врача, основанная на оценке факторов риска и клинических симптомов заболевания.
Определение клинической вероятности ТЭЛА
Определение клинической вероятности — важный компонент ведения пациентов с подозрением на ТЭЛА. В клинической практике наиболее часто используют правило (шкалу) P.S. Wells и женевский счет. Так, в 2000 г. P.S. Wells и M. Rodger предложили шкалу оценки выявленных клинических признаков в баллах (табл. 1.5).
Таблица 1.5
Шкала оценки вероятности ТЭЛА на основании клинических признаков (Wells P.S., Rodger M., 2000)
| Признак | Баллы* |
| Клинические симптомы тромбоза глубоких вен нижних конечностей (как минимум — их отечность и болезненность при пальпации по ходу глубоких вен) | +3 |
| При проведении дифференциального диагноза ТЭЛА более вероятна, чем альтернативный диагноз | +3 |
| Тахикардия (ЧСС более 100 уд./мин) | +1,5 |
| Иммобилизация или хирургическое вмешательство на протяжении последних 4 нед | +1,5 |
| Тромбоз глубоких вен нижних конечностей или ТЭЛА в анамнезе | +1,5 |
| Кровохарканье | +1 |
| Онкологические заболевания в настоящее время или давностью до 6 мес | +1 |
*Если сумма баллов по шкале не больше 2, вероятность ТЭЛА низкая; при 2–6 — умеренная; более 6 баллов — вероятность высокая.
Недостатком использования этого теста является введение в счет нестандартизированного 5-го клинического суждения о более вероятном альтернативном диагнозе. В свою очередь, шкала женевского счета (табл. 1.6) очень сложна. В ней предусмотрено определение газового состава артериальной крови, что нередко недоступно в реальной клинической практике и не рекомендовано Европейским обществом кардиологов ввиду незначительной информативности и неспецифичности изменений при ТЭЛА.
Таблица 1.6
Женевский счет клинической вероятности ТЭЛА (Wicki J. et al., 2001)
| Показатель | Баллы* |
| Возраст: | |
| 60–79 лет | +1 |
| >80 лет | +2 |
| Предшествующие ТЭЛА или тромбоз глубоких вен | +2 |
| Недавнее хирургическое вмешательство | +3 |
| ЧСС >100 уд./мин | +1 |
| РаСО2 (кПа) | |
| <4,8 | +2 |
| 4,8–5,19 | +1 |
| РаО2 (кПа) | |
| <6,5 | +4 |
| 6,5–7,99 | +3 |
| 8–9,49 | +2 |
| 9,5–10,99 | +1 |
| Рентгенограмма органов грудной клетки: | |
| дисковидные ателектазы легких | +1 |
| подъем купола диафрагмы | +1 |
*При сумме баллов <4 клиническая вероятность считается низкой (10,3% в оригинальном исследовании), при 5–8 — промежуточной (38%), при ≥9 — высокой (81%).
Учитывая вышеизложенное, швейцарские и французские ученые, принимавшие участие в разработке женевского счета, создали новое прогностическое правило для оценки клинической вероятности ТЭЛА, основанное исключительно на доступных клинических данных (табл. 1.7). Шкала пересмотренного женевского счета основана на ретроспективном анализе 965 пациентов, поступивших в стационар с подозрением на ТЭЛА.
Таблица 1.7
Пересмотренный женевский счет клинической вероятности ТЭЛА (Le Gal G. et al., 2006)
| Показатель | Баллы* |
| Возраст старше 70 лет | +1 |
| Предшествующие ТЭЛА или тромбоз глубоких вен | +3 |
| Хирургическое вмешательство (под общей анестезией) или травма (нижних конечностей) в течение предшествующего месяца | +2 |
| Активное злокачественное новообразование | +2 |
| Кровохарканье | +2 |
| ЧСС | |
| 75–94 уд./мин | +3 |
| >94 уд./мин | +5 |
| Односторонняя боль в нижних конечностях | +3 |
| Боль при пальпации по ходу глубоких вен и односторонний отек нижней конечности | +4 |
*При сумме 0–3 балла клиническая вероятность ТЭЛА низкая, 4–10 — промежуточная, ≥11 — высокая.
Работоспособность этого правила была проверена на независимой когорте участников (n=749), включенных в проспективное исследование. Период наблюдения составил 3 мес. Точность прогноза оказалась сходной с ретроспективными данными первоначальной когорты больных, на которых правило разрабатывали. Пересмотренный женевский счет имеет большое клиническое значение и рекомендован для использования Европейским обществом кардиологов в качестве первого этапа диагностики ТЭЛА.
Лабораторная диагностика
В настоящее время существуют различные маркеры тромбообразования: тромбин-антитромбиновый комплекс, фибринопептид А, растворимые фибрин-мономерные комплексы, однако наибольшее значение имеет определение D-димера в плазме крови.
D-димер
У большинства больных с венозным тромбозом отмечают эндогенный фибринолиз, который недостаточно эффективен для открытия сосуда, но вызывает разрушение определенного количества фибрина с образованием продукта распада перекрестносвязанного фибрина — D-димера. Повышение концентрации D-димера, установленного методом иммуноферментного анализа (ELISA), больше 500 мкг/л свидетельствует о спонтанной активации фибринолитической системы крови в ответ на тромбообразование в венозной системе. Метод характеризуется высокой чувствительностью (96–99%) и отрицательной предсказательной ценностью (99,6%), однако низкой специфичностью (около 50%). Это связано с тем, что концентрация продуктов распада фибрина повышается при многих состояниях, в том числе и при сепсисе, остром ИМ, злокачественных новообразованиях, воспалении, после оперативных вмешательств, при некоторых системных заболеваниях и др. Необходимо подчеркнуть, что у многих пациентов после перенесенной ТЭЛА уровень D-димера в периферической крови остается повышенным в течение нескольких месяцев несмотря на антикоагулянтную терапию. Поэтому при рецидивирующей ТЭЛА повышение уровня D-димера не является маркером повторного тромбообразования, хотя нормальные значения показателя позволяют исключить рецидив заболевания (чувствительность около 100%).
Таким образом, нормальный уровень D-димера в периферической крови больного с высокой вероятностью позволяет исключить ТЭЛА, а повышенный — требует продолжения обследования пациента с использованием инструментальных методов диагностики.
Исследование газового состава крови
При массивной ТЭЛА могут выявлять развитие гипоксемии, гипокапнии и дыхательного алкалоза. Однако проспективное изучение методов диагностики ТЭЛА (исследование PIOPED) показало, что вопреки классической точке зрения анализ исследования газового состава крови не имеет диагностической ценности. В ходе испытания не выявлено корреляции между изменениями РаО2, РаСО2 и результатами ангиопульмонографии.
Инструментальная диагностика
Электрокардиография
Наиболее часто отмечают и корригируют с тяжестью ТЭЛА остро возникшие изменения на ЭКГ, отражающие острую перегрузку правых отделов сердца и легочную гипертензию:
- появление зубца Q в III отведении, одновременное увеличение амплитуды зубца S в I отведении и отрицательного зубца Т в III отведении (синдром МакДжина — Уайта, или синдром SI–QIII);
- появление отрицательных симметричных зубцов Т в отведениях V1–V3;
- подъем сегмента ST в отведениях III, aVF, aVR и V1–V3;
- блокада правой ножки пучка Гиса;
- Р-pulmonale;
- смещение переходной зоны влево к отведениям V5–V6;
- синусовая тахикардия и/или другие нарушения ритма (фибрилляция/трепетание предсердий, экстрасистолия и др.) (рис. 1.4).
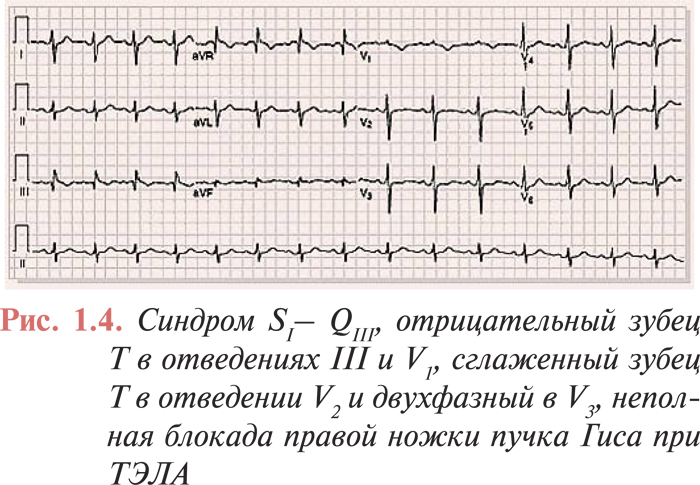
После эффективного лечения ТЭЛА и нормализации давления в ЛА выраженность этих явлений быстро уменьшается и они исчезают.
Признаки острой перегрузки ПЖ чаще наблюдают при эмболии ствола и главных ветвей ЛА, чем при поражении долевых и сегментарных ветвей. Следует отметить, что у 20–25% больных с ТЭЛА изменения на ЭКГ вообще могут отсутствовать. Кроме того, все указанные ЭКГ-признаки не являются специфичными для ТЭЛА, поскольку могут регистрироваться при других заболеваниях, сопровождающихся явлениями острой гемодинамической перегрузки ПЖ.
Рентгенография органов грудной клетки
В большинстве случаев ТЭЛА сопровождается появлением на рентгенограмме непостоянных и малоспецифичных рентгенологических признаков. Наиболее специфичными являются симптомы острого легочного сердца: увеличение правых отделов сердца, расширение верхней полой вены, выбухание легочного конуса по левому контуру сердечной тени. Частый признак — увеличение размера центральных ЛА. Обеднение легочного рисунка (симптом Вестермарка) — специфичный, но относительно редкий признак ТЭЛА (выявляют не более чем в 5% случаев), свидетельствующий о массивной эмболии ЛА. Высокое и малоподвижное стояние купола диафрагмы в области поражения легкого отмечают в 40% случаев, наиболее вероятно, это обусловлено рефлекторным сморщиванием легкого в ответ на эмболию. В развитии этого синдрома возможно также участие и других факторов: поражение диафрагмальной плевры, уменьшенное кровенаполнение пораженного сегмента или доли, увеличение объема печени, рефлекторное влияние на диафрагмальный и возвратный нервы, уменьшение легочного объема в результате появления ателектазов и воспалительных инфильтратов.
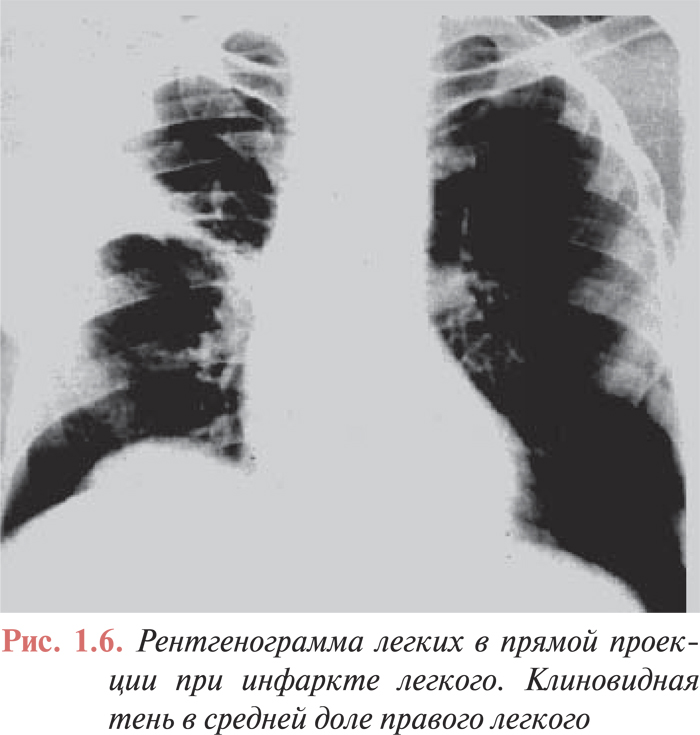
Дисковидные ателектазы легких обычно предшествуют развитию инфаркта легкого. Инфильтраты легочной ткани — часто двусторонние, характерны для инфарктной пневмонии и могут сопровождаться плевральным выпотом. Довольно редко можно выявить классические признаки инфаркта легкого — клиновидную тень в легочном поле, основанием обращенную к плевре (симптом Хемптона) (рис. 1.5). Однако из-за инфильтрации окружающей зону инфаркта легочной ткани затемнение чаще принимает округлую или неправильную форму. У ряда больных можно выявить признаки застоя в малом круге кровообращения. Корни легких могут быть расширены вследствие повышения давления в ЛА проксимальнее места ее окклюзии.
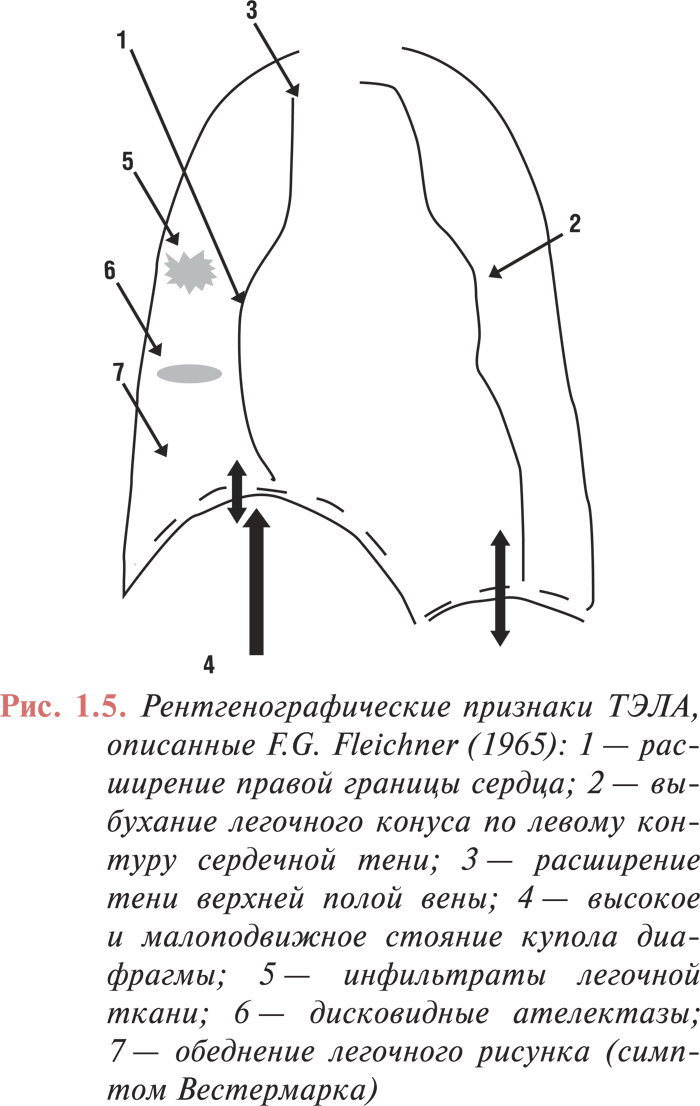
Все описанные рентгенологические признаки лишь с определенной степенью вероятности могут быть ассоциированы с возникновением ТЭЛА, причем только в тех случаях, когда они сочетаются с клиническими симптомами заболевания. Следует подчеркнуть, что отсутствие изменений на рентгенограмме органов грудной клетки не исключает диагноза ТЭЛА. Так, в исследовании ICOPER, при анализе рентгенограмм 2322 пациентов с доказанной ТЭЛА, у 24% из них рентгенологических изменений не выявлено. Наиболее частыми патологическими изменениями на обзорной рентгенограмме органов грудной клетки были: расширение тени сердца (27%), плевральный выпот (23%), высокое стояние купола диафрагмы (20%), расширение ЛА (19%), ателектазы (18%) и инфильтраты легочной ткани (17%), симптомы застоя в легких (14%). Обеднение легочного рисунка выявлено в 8% случаев, инфаркт легкого — в 5% (рис. 1.6).
Эхокардиография
Длительное время катетеризация правых отделов сердца являлась единственным методом, позволявшим оценивать состояние правых отделов сердца, получать характеристики внутрисердечного кровотока, определять давление в правых отделах сердца и ЛА. Однако инвазивность данной методики определяет ряд ограничений и трудностей в ее использовании. ЭхоКГ-исследование позволяет неинвазивным способом в режиме реального времени оценить размеры и движение сердечных структур, получить характеристики внутрисердечной гемодинамики, определить давление в камерах сердца и ЛА, при этом доказана хорошая сопоставимость результатов эхоКГ с данными, полученными при катетеризации полостей сердца.
ЭхоКГ-исследование при ТЭЛА позволяет также исключить ряд заболеваний, которые имеют сходные клинические симптомы и могут быть причиной острой легочной гипертензии: ИМ, острая декомпенсированная СН, острый миокардит, перикардит, расслаивающая аневризма аорты и т.д. Несмотря на это, не стоит переоценивать значение данного метода, так как во многих случаях у больных с ТЭЛА изменения при проведении эхоКГ выявить не удается.
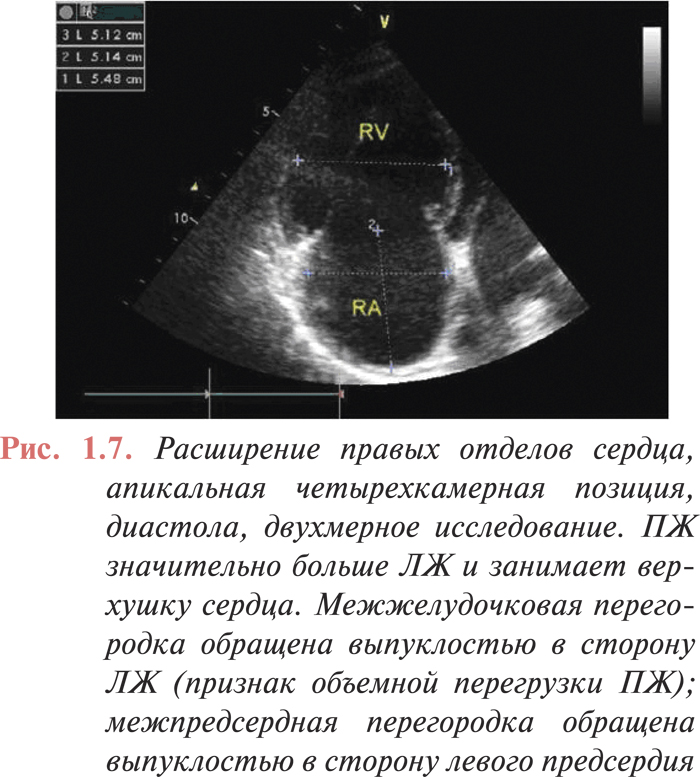
Основные изменения при эхоКГ-исследовании при ТЭЛА относятся к правым отделам сердца.
ЭхоКГ признаками ТЭЛА являются:
- гипокинезия и дилатация ПЖ (рис. 1.7);
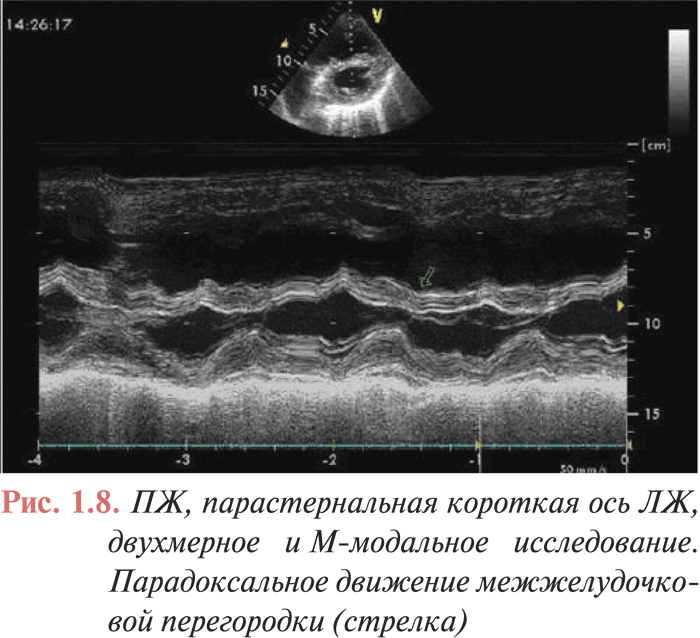
- парадоксальное движение межжелудочковой перегородки (рис. 1.8);
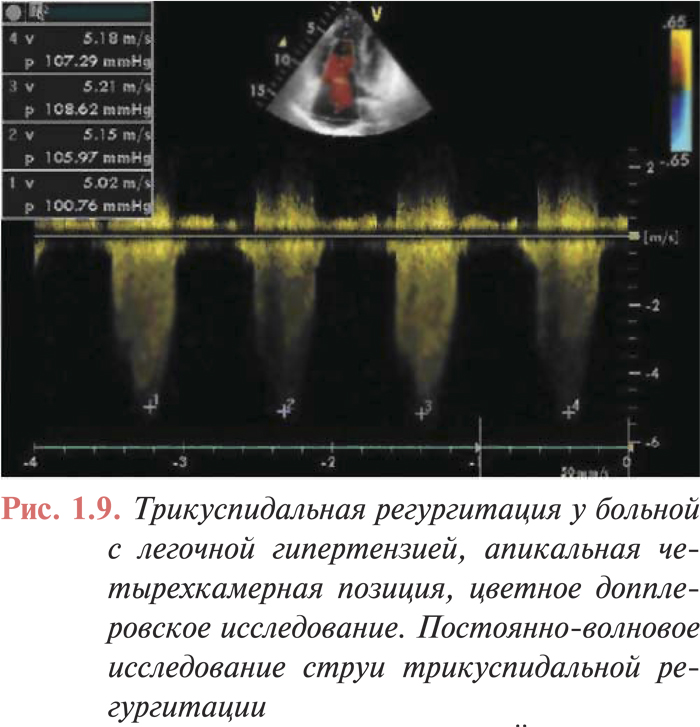
- трикуспидальная регургитация (рис. 1.9);
- отсутствие/уменьшение инспираторного спадения нижней полой вены;
- дилатация ЛА;
- признаки легочной гипертензии;
- тромб в полости правого предсердия и желудочка;
- могут отмечать перикардиальный выпот, шунтирование крови справа налево через открытое овальное окно.
Структурная перестройка сердца и изменения внутрисердечной гемодинамики, выявляемые при ТЭЛА, могут вызывать нарушения систолической функции как ПЖ, так и ЛЖ сердца. Выраженная перегрузка ПЖ давлением приводит к снижению сердечного выброса, что клинически проявляется гемодинамической нестабильностью.
Вероятность выявления дисфункции ПЖ при эхоКГ-исследовании связана со степенью обтурации легочных сосудов. Так, ее определяют более чем в 90% случаев при закрытии эмболом больше 1/3 общей площади легочных сосудов. В то же время дисфункция ПЖ у больных с нормальной перфузией более чем в 70% легочных сегментов маловероятна (менее 15% больных). Особенностью дисфункции ПЖ при ТЭЛА является выраженное нарушение сократимости свободной стенки ПЖ (базальные и средние сегменты) при сохраненной или незначительно нарушенной сократимости верхушки ПЖ (признак МакКонелла). Этот признак имеет высокую чувствительность и специфичность в отношении ТЭЛА и позволяет проводить дифференциальную диагностику с первичной легочной гипертензией, при которой отмечают равномерное снижение сократимости ПЖ сердца.
Применение допплеровских режимов исследования повысило диагностические возможности эхоКГ, что особенно информативно в отношении определения степени легочной гипертензии. Допплеровская регистрация скорости потока в ЛА позволяет не только качественно, но и количественно оценить выраженность легочной гипертензии, определить среднее давление в ЛА. Однако наибольшее значение для выявления легочной гипертензии имеет выраженность трикуспидальной регургитации. Использование струи трикуспидальной регургитации лежит в основе неинвазивного определения систолического давления в ЛА. Для расчета давления необходимо к градиенту давления на трикуспидальном клапане прибавить таковое в правом предсердии. Этот метод оценки давления в ЛА, среди неинвазивных, является наиболее точным.
Надо отметить, что в некоторых случаях давление в ЛА, измеренное по потоку трикуспидальной регургитации, может быть недооценено, поскольку систолическое давление в ЛА зависит от ударного объема ПЖ сердца.
По величине систолического давления в ЛА выделяют такие степени легочной гипертензии:
- умеренной гипертензии соответствует систолическое давление в ЛА, составляющее 30–50 мм рт. ст.;
- значительной гипертензии — 50–80 мм рт. ст.;
- выраженной гипертензии — >80 мм рт. ст.
По скорости струи регургитации на створках клапана ЛА можно рассчитать конечно-диастолическое давление в ЛА. Оно складывается из градиента давления между ЛА и ПЖ сердца в конце диастолы, рассчитанного по скорости струи легочной регургитации и диастолического давления в правом предсердии.
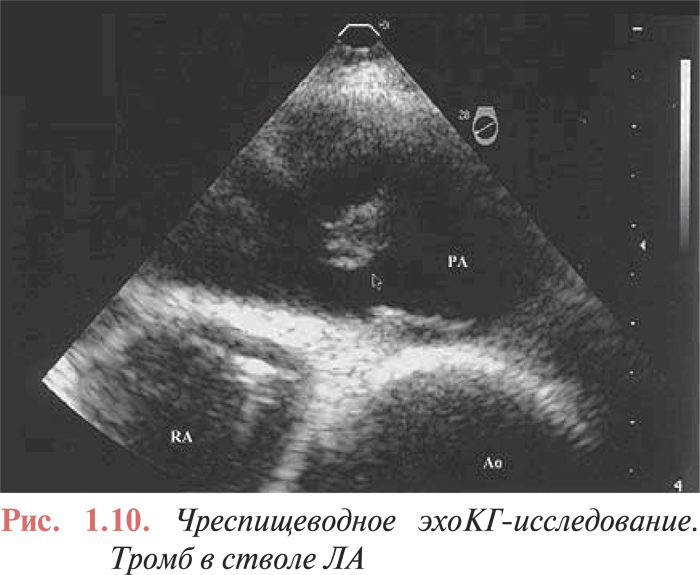
В последнее время все большее распространение получает проведение чреспищеводного эхоКГ-исследования (рис. 1.10). Целью этого диагностического метода в большей степени является выявление тромба в основных ветвях ЛА, чем определение вторичных признаков легочной гипертензии. В проведенных исследованиях показана положительная роль чреспищеводной эхоКГ у больных с необъяснимой остановкой кровообращения или с признаками электромеханической диссоциации. Это исследование также помогает выявить тромбы-наездники и проводить отбор пациентов для проведения тромболитической терапии, катетерной или хирургической эмболэктомии.
Большое значение придают также использованию эхоКГ-исследования для стратификации риска, выбора оптимальной тактики лечения и контроля проведенной терапии у больных с ТЭЛА. Выявление дисфункции ПЖ сердца при ТЭЛА по данным эхоКГ в различных исследованиях ассоциировалось с шестикратным повышением госпитальной смертности и двукратным повышением риска смерти в течение 90 дней наблюдения. Неблагоприятное прогностическое значение в отношении 5-летней выживаемости у больных с ТЭЛА имело также исходное повышение уровня систолического давления в системе ЛА выше 50 мм рт. ст. (по данным допплеровского эхоКГ-исследования).
Таким образом, эхоКГ — удобный и безопасный метод исследования, который позволяет в кратчайшие сроки получить представление о влиянии эмболии ЛА на функцию ПЖ, а также определить степень риска развития осложнений и осуществить дифференцированный подход к лечению данной категории больных. Успех или неудача того или иного метода лечения также могут быть оценены при помощи эхоКГ-исследования. Однако эхоКГ имеет целый ряд ограничений и ее роль в диагностике и определении риска больных с ТЭЛА не следует переоценивать.
Катетеризация правых отделов сердца
Катетеризация ЛА позволяет получить наиболее точную и полную информацию о нарушениях гемодинамики в правых отделах сердца. Метод позволяет измерить давление в ЛА, правом предсердии, ПЖ, оценить давление в левом предсердии по давлению заклинивания в ЛА (ДЗЛА), определить легочное сосудистое сопротивление, сердечный выброс (методом термодилюции) и насыщение смешанной венозной крови кислородом.
Для катетеризации ЛА используют катетер Свана — Ганца, который снабжен баллончиком и термистором. Катетер вводят через одну из центральных вен в полую вену и правое предсердие. Здесь баллончик раздувают и катетер проводят в ПЖ, а затем в ЛА, где продвигают до точки заклинивания. Положение катетера определяют по форме кривой давления, а если это не удается, то рентгенологически (рис. 1.11).

Катетеризация ЛА позволяет выявить гемодинамические нарушения и определить степень их выраженности при ТЭЛА (табл. 1.8). В типичных случаях выявляют повышение давления в правом предсердии, среднего давления в ЛА, снижение сердечного индекса, нормальное ДЗЛА, повышение легочного сосудистого сопротивления.
Таблица 1.8
Характер гемодинамических расстройств при ТЭЛА по данным катетеризации правых отделов сердца (Савельев В.С., 1985)
| Параметры гемодинамики | Выраженность гемодинамических расстройств | ||
| Умеренные | Выраженные | Резко выраженные | |
| Давление в аорте, мм рт. ст. | >100 | >100 | <100 |
| САД в ПЖ, мм рт. ст. | <40 | 40–59 | ≥60 |
| Конечно-диастолическое давление в ПЖ, мм рт. ст. | <10 | 10–14 | ≥15 |
| Среднее давление в ПЖ, мм рт. ст. | <19 | 19–24 | ≥25 |
| САД в стволе ЛА, мм рт. ст. | <25 | 25–34 | ≥35 |
| ДЗЛА, мм рт. ст. | 6–12 | 6–12 | 6–12 |
| Сердечный индекс, л/(мин·м2) | ≥2,5 | ≥2,5 | <2,5 |
Вентиляционно-перфузионная сцинтиграфия легких
Ключевую роль в диагностике ТЭЛА имеет вентиляционно-перфузионная сцинтиграфия легких (ВПСЛ), которая представляет собой сочетание радионуклидного исследования региональных нарушений легочной вентиляции (пневмосцинтиграфии) и перфузии легких (пульмоносцинтиграфии).
Наибольшее значение имеет методика перфузионной пульмоносцинтиграфии с внутривенным введением микросфер альбумина, меченных 99mTc. При окклюзии ветвей ЛА нарушается заполнение капиллярного русла радиоактивным препаратом ниже участка сужения (рис. 1.12). Метод перфузионной сцинтиграфии отличается высокой чувствительностью, однако недостаточно специфичен, поскольку многие патологические процессы в легких сопровождаются региональным снижением перфузии (опухоли легкого, пневмонии, обструктивные заболевания легких, пневмосклероз и т.д.). Одновременная оценка вентиляции легких путем ингаляции изотопа инертного радиоактивного газа (обычно ксенона или криптона) повышает специфичность метода. В свою очередь, информативность ВПСЛ значительно возрастает при сопоставлении ее результатов с данными рентгенографии.
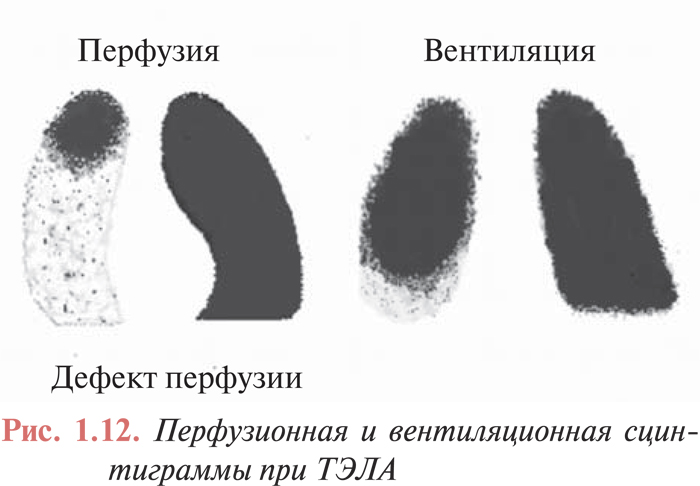
Высоковероятным критерием ТЭЛА является сегментарное отсутствие кровотока в легких, не сопровождающееся изменениями вентиляции в этом сегменте и изменениями на обзорной рентгенограмме грудной клетки (рис. 1.13). При отсутствии строгой сегментарности и множественности перфузионных дефектов на сцинтиграммах вероятность диагноза ТЭЛА средняя. В таких случаях требуется проведение дифференциального диагноза между пневмонией, ателектазом, опухолью, туберкулезом и другими заболеваниями легких. Как правило, для установления диагноза необходимо проведение ангиопульмонографии. Если результаты перфузионной сцинтиграфии легких соответствуют норме, то вероятность ТЭЛА низка и проведение вентиляционной сцинтиграфии нецелесообразно.
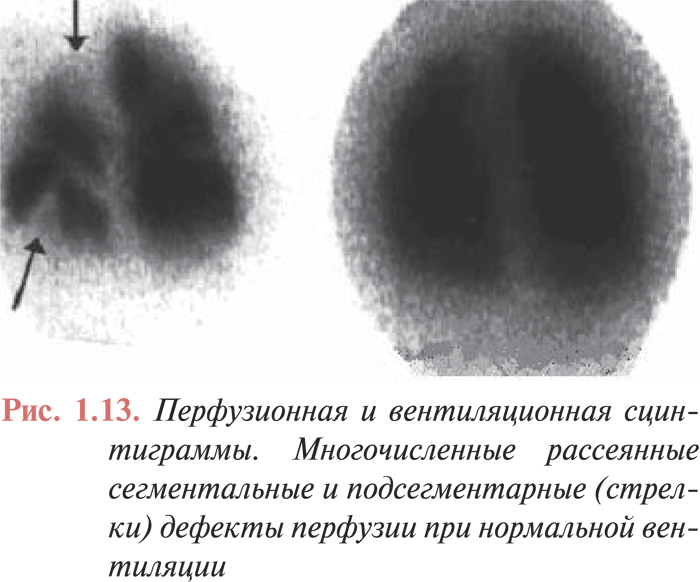
Сложности диагностики ТЭЛА методом ВПСЛ возникают, если тромбоэмболия осложняется развитием инфаркта легкого. В таких случаях вместе со снижением перфузии, как правило, происходит и локальное уменьшение вентиляции, а на рентгенограмме появляются признаки уплотнения легочной ткани. При наличии нарушений вентиляции в зоне перфузионных дефектов подтвердить или исключить диагноз ТЭЛА трудно, в связи с чем необходимо проведение ангиопульмонографии.
В результате проведения ВПСЛ можно определить перфузионный дефицит. Так, легкая степень нарушения перфузии характеризуется перфузионным дефицитом до 29%, средняя — 30–40%, тяжелая — 45–59%, крайне тяжелая — 60% и более.
Необходимо подчеркнуть, что диагностика ТЭЛА, по данным ВПСЛ, возможна только при сопоставлении ее результатов с клинической картиной заболевания. Если результаты анализа данных ВПСЛ противоречат клиническим (низкая клиническая вероятность ТЭЛА и высокая — по данным ВПСЛ, или высокая клиническая вероятность при норме по данным ВПСЛ), то обязательным является дальнейшее обследование пациента.
В проспективном исследовании по изучению методов диагностики ТЭЛА (PIOPED) была предпринята попытка разработать сцинтиграфические критерии ТЭЛА. В результате их использования при высокой вероятности ТЭЛА диагноз подтверждали ангиопульмонографией в 87% случаев, при средней — в 30%, при низкой — в 14%, при нормальной сцинтиграмме — лишь в 4% случаев. Впоследствии в исследовании PISAPED диагностические критерии ВПСЛ были пересмотрены, что позволило повысить чувствительность и специфичность метода в диагностике ТЭЛА (до 92 и 87% соответственно). Однако у больных с хроническими легочными заболеваниями значимость ВПСЛ в диагностике ТЭЛА существенно ниже, что обусловлено исходными нарушениями вентиляции легких. Так, в исследовании COPD у больных с хроническими заболеваниями легких проведение сцинтиграфии легких позволило подтвердить диагноз ТЭЛА у 25% пациентов, а у 25% — исключить. У остальных 50% больных результаты были признаны сомнительными. У таких пациентов требуется проведение ангиопульмонографии.
Ангиопульмонография
Селективная ангиопульмонография — это рентгенологический метод исследования сосудов легких и легочного кровотока, при котором контрастное вещество вводится непосредственно в легочное сосудистое русло. Метод дает возможность получить максимальную информацию об анатомическом и функциональном состоянии сосудов легких. Селективная ангиопульмонография сегодня остается эталонным методом диагностики ТЭЛА.
Выделяют специфические и неспецифические ангиографические критерии ТЭЛА.
Специфические ангиографические критерии:
- Дефект наполнения в просвете сосуда — наиболее характерный ангиографический признак ТЭЛА.
- Полная обструкция сосуда (ампутация сосуда, обрыв его контрастирования). При массивной ТЭЛА этот симптом на уровне долевых артерий отмечают в 5% случаев, чаще (в 45%) его выявляют на уровне долевых артерий, дистальнее тромбоэмбола, расположенного в главной ЛА.
Неспецифические ангиографические критерии:
- Расширение главных ЛА.
- Уменьшение количества контрастированных периферических ветвей (симптом мертвого или подрезанного дерева).
- Деформация легочного рисунка.
- Отсутствие или задержка венозной фазы контрастирования.
Информативность неспецифических признаков не установлена. Диагноз ТЭЛА считается подтвержденным только при наличии специфических критериев (рис. 1.14).

Следует отметить, что локальное отсутствие контрастирования дистальных разветвлений ЛА (зоны отсутствия васкуляризации) и формирование культи артерии выявляют не только при ТЭЛА, но и при других патологических состояниях (рак легкого, абсцесс, крупная воздушная полость и т.п.). В этих случаях для установления правильного диагноза необходимо учитывать данные других методов исследования (рентгенологического, ВПСЛ, спиральной КТ), в сопоставлении с клинической картиной заболевания. Ангиопульмонография позволяет не только подтвердить диагноз ТЭЛА и установить ее локализацию, но также оценить объем поражения сосудистого русла легких с помощью ангиографического индекса.
Целесообразность проведения ангиографии определяется доступностью неинвазивных методов, состоянием больного и необходимостью установления точного диагноза.
Проведение ангиопульмонографии показано:
- при неопределенных данных, полученных при сцинтиграфии легких, и отсутствии признаков флеботромбоза по результатам ультразвуковой диагностики, флебографии или плетизмографии; при подозрении на развитие ТЭЛА, основанном на клинических данных;
- при решении вопроса о проведении тромбоэмболэктомии у больных с острым легочным сердцем и/или кардиогенным шоком (в том числе и при наличии противопоказаний к тромболитической и/или антикоагулянтной терапии);
- при рецидивирующей ТЭЛА (результаты ВПСЛ в этих случаях могут не отражать остроту процесса и объем поражения сосудов легких).
Следует учитывать, что, хотя безопасность ангиопульмонографии ЛА значительно повысилась за последние годы, все же при проведении исследования возможны серьезные осложнения:
- аллергическая реакция на контрастное вещество (возможно проведение исследования под прикрытием кортикостероидных и антигистаминных препаратов);
- прогрессирование почечной недостаточности как реакция на контрастное вещество;
- перфорация сердца (в 0,3% случаев);
- нарушения ритма сердца;
- развитие СН у больных с дисфункцией ЛЖ (при введении большого объема контрастного вещества);
- нарастание легочной гипертензии во время проведения процедуры;
- усугубление тяжести состояния больного (в 2–4% случаев);
- летальный исход (менее 0,2%).
Чувствительность ангиопульмонографии в диагностике ТЭЛА составляет около 98%, а специфичность — 95–98%. Следует отметить, что надежность диагностики ТЭЛА при проведении ангиопульмонографии снижается при уменьшении калибра сосудов. При ТЭЛА ниже субсегментарных артерий интерпретация полученных результатов затруднена. Снижается чувствительность метода и у больных с хроническими легочными и сердечно-сосудистыми заболеваниями.
КТ
В последние годы в диагностике ТЭЛА все чаще используют спиральную КТ с внутривенным введением рентгеноконтрастного препарата, позволяющую получать высококачественное изображение легочных сосудов и определять точную локализацию тромбоэмболов. При сопоставлении результатов спиральной КТ и ангиопульмонографии у больных с ТЭЛА, чувствительность КТ составила 100%, специфичность — 96%, а отрицательная предсказательная ценность — 99%. Метод позволяет не только подтвердить диагноз ТЭЛА, но и получить информацию об альтернативных заболеваниях. Кроме того, при проведении КТ есть возможность получить ценную информацию о размерах и функции ПЖ сердца. Если раньше считали, что КТ полезна только для диагностики тромбоэмболии центральных и долевых артерий, то с помощью мультидатчиков последних поколений могут выявлять структуры размером от 0,5 мм, тем самым значительно повышая выявляемость тромбоэмболов в сегментарных, субсегментарных и более мелких сосудах легочного сосудистого русла.
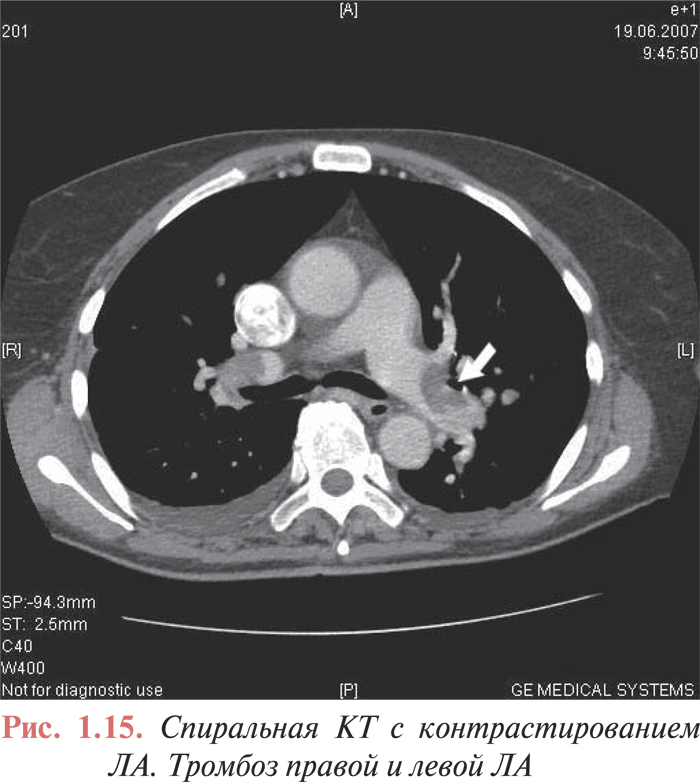
О роли КТ в диагностике ТЭЛА ведутся дискуссии до настоящего времени. Исследование PIOPED 2, на которое возлагали большие надежды, не дало однозначного ответа на этот вопрос. Его результаты пересматривают и переоценивают: экспертной комиссией высказывается мнение, что КТ может быть более чувствительным методом в диагностике ТЭЛА, чем ангиопульмонография. Несомненно то, что спиральная КТ — более щадящий для пациентов и в то же время более дешевый метод диагностики ТЭЛА (рис. 1.15). КТ все шире используют в клинической практике в качестве метода скрининга ТЭЛА или в комбинации со сцинтиграфией легких и эхоКГ.
Магнитно-резонансная ангиография (МРА)
Значение МРА легких в диагностике ТЭЛА сегодня не определено. Однако по сравнению с ангиографией и КТ метод имеет ряд преимуществ: обеспечивает лучшую визуализацию сосудов, проводится без облучения пациента и введения контрастного вещества, практически не вызывает осложнений, позволяет оценить размеры и функцию желудочков сердца. МРА можно использовать у пациентов с нарушенной функцией почек, при непереносимости рентгенконтрастных веществ. Кроме того, возможно одновременное проведение магнитно-резонансной венографии (МРВ), что повышает значимость метода. В настоящее время (с апреля 2006 г.) проводится многоцентровое исследование PIOPED 3, целью которого является изучение диагностической ценности проведения МРА самостоятельно и в комбинации с МРВ в выявлении пациентов с ТЭЛА.
ДИАГНОСТИКА ТРОМБОЗА ГЛУБОКИХ ВЕН НИЖНИХ КОНЕЧНОСТЕЙ (ТГВ)
По данным аутопсий, источником ТЭЛА в 90% случаев являются тромбы в глубоких венах нижних конечностей. Диагностика ТГВ при подозрении на ТЭЛА имеет важное значение, так как наличие тромба в венах нижних конечностей само по себе обосновывает применение антикоагулянтной терапиии и снижает необходимость в проведении дополнительных (в частности инвазивных) исследований.
К ранним клиническим признакам ТГВ, в частности, относятся:
- спонтанная боль в области стопы и голени, усиливающаяся при ходьбе;
- появление боли в икроножных мышцах при тыльном сгибании стопы (симптом Хоманса);
- локальная болезненность при пальпации по ходу вен;
- односторонний отек голени, стопы и бедра, выявляемый при осмотре в горизонтальном и вертикальном положении пациента.
Существует шкала оценки вероятности наличия ТГВ (Wells P.S., 1995) на основании основных и дополнительных прогностических признаков, в том числе клинико-анамнестические данные и результаты объективного осмотра.
Прогностические признаки, позволяющие определить претестовую вероятность наличия ТГВ
Основные прогностические признаки:
- рак (лечение, проводимое в настоящее время; проведенное в течение предшествующих 6 мес; паллиативная терапия);
- паралич, парез, недавняя иммобилизация нижних конечностей с помощью гипсовой повязки;
- недавнее заболевание с соблюдением постельного режима в течение более 3 дней и/или обширное оперативное вмешательство в предшествующие 4 нед;
- локальная болезненность по ходу глубоких вен;
- отечность бедра и голени (следует измерить окружность);
- окружность отечной голени, измеренная на 10 см ниже мыщелка большеберцовой кости, на 3 см больше окружности непораженной голени;
- выраженная семейная предрасположенность к ТГВ (наличие ТГВ в анамнезе у 2 и более ближайших родственников).
Дополнительные прогностические признаки:
- недавняя (менее 60 дней) травма отечной конечности;
- отек, при надавливании на который образуется ямка, выявляют только на пораженной конечности;
- неварикозное расширение поверхностных вен отмечают только на пораженной конечности;
- пребывание в стационаре предшествующие 6 мес;
- эритема.
Претестовая вероятность наличия ТГВ
Высокая (80% и больше):
- наличие 3 и более основных признаков и отсутствие альтернативного диагноза;
- наличие 2 и более основных признаков, 2 и более дополнительных признаков, отсутствие альтернативного диагноза.
Низкая (19% и менее):
- наличие одного основного, 1–2 дополнительных признаков и альтернативного диагноза;
- наличие одного основного, одного дополнительного признаков и отсутствие альтернативного диагноза;
- отсутствие основных признаков, наличие 1–3 дополнительных признаков и альтернативного диагноза;
- отсутствие основных признаков и альтернативного диагноза, наличие 1–2 дополнительных признаков.
Умеренная (20–79%):
- все остальные сочетания.
Следует отметить, что отчетливые клинические признаки ТГВ нижних конечностей выявляют лишь у 20% больных с подтвержденными результатами флебографии и радионуклидных исследований. В 80% случаев ТГВ характеризуется бессимптомным течением. Отсутствие клинических проявлений ТГВ может быть обусловлено неокклюзирующим характером тромбоза или сохранением оттока крови по другим венам. Поэтому проведение инструментальных исследований вен нижних конечностей обязательно для всех больных с подозрением на ТЭЛА.
В прошлом для диагностики тромбоза использовали импендансную плетизмографию, однако чувствительность этого метода оказалась низкой (около 60%), поэтому в настоящее время основным методом диагностики ТГВ является УЗИ с допплерографией вен нижних конечностей.
УЗИ вен нижних конечностей
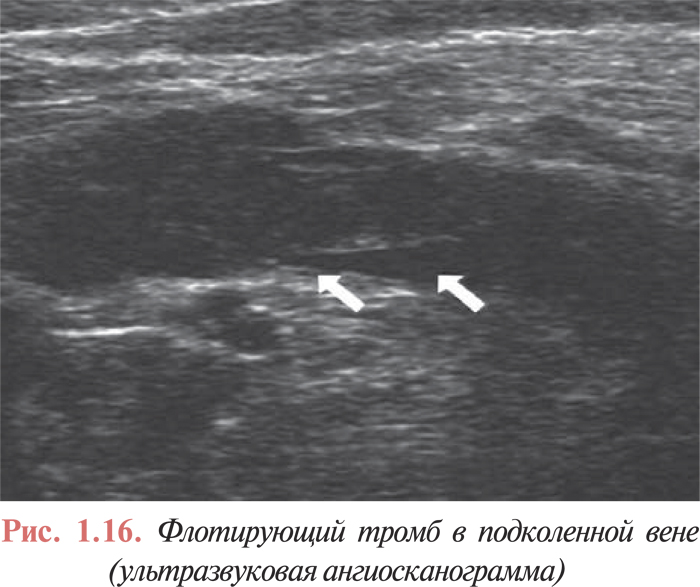
Ультразвуковое дуплексное ангиосканирование с цветным картированием кровотока позволяет оценить состояние стенок и просвета вен, наличие в них тромботических масс, характер тромба (окклюзивный, пристеночный, флотирующий), его дистальную и проксимальную границы, проходимость глубоких и перфорантных вен, и даже ориентировочно судить о давности процесса по степени организации тромба и выраженности воспалительной инфильтрации подкожной клетчатки (рис. 1.16, 1.17).

Признаками тромбоза при УЗИ вен нижних конечностей считают неподатливость стенок вены при сдавлении и повышенную эхогенность по сравнению с движущейся кровью. Критериями ТГВ при ультразвуковой допплерографии являются: отсутствие или снижение скорости кровотока, отсутствие или ослабление кровотока при дыхательных пробах, увеличение кровотока при сдавлении ноги дистальнее исследуемого сегмента, появление ретроградного кровотока при сдавлении ноги проксимальнее исследуемого сегмента.
УЗИ позволяет надежно диагностировать проксимальный ТГВ при наличии клинических симптомов (специфичность 97%), но обладает низкой чувствительностью при выявлении бессимптомного тромбоза. Нормальный результат УЗИ не исключает наличия ТЭЛА, поскольку ТГВ удается выявить только у 30–50% пациентов с подтвержденной ТЭЛА. Однако, учитывая простоту, доступность и отсутствие побочных эффектов, УЗИ является обязательным методом исследования у больных с подозрением на ТЭЛА.
Рентгеноконтрастная флебография
При диагностике флеботромбоза нижних конечностей используют также радионуклидную флебографию с применением макроагрегата альбумина, меченного 99mТс, который вводят в поверхностные вены стоп. Сегодня рентгеноконтрастная флебография является эталоном диагностики венозного тромбоза и редко вызывает осложнения. Ее используют при сомнительных результатах неинвазивных исследований вен нижних конечностей, а также при распространении тромбоза выше проекции паховой связки, когда точному определению локализации верхушки тромба с помощью ультразвукового ангиосканирования препятствует наличие газа в кишечнике. Чувствительность и специфичность метода приближаются к 100%.
Альтернативными методами выявления ТГВ могут быть КТ нижней конечности или МРВ.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Выраженный полиморфизм клинических симптомов, отсутствие специфических признаков заболевания при общедоступных исследованиях (ЭКГ, рентгенография, лабораторные показатели) определяют сложность диагностики ТЭЛА и необходимость проведения дифференциальной диагностики со многими заболеваниями.
Заболевания, с которыми приходится дифференцировать ТЭЛА:
- ИМ, нестабильная стенокардия;
- пневмония, бронхит, ХОБЛ в фазе обострения;
- СН;
- БА;
- перикардит;
- первичная легочная гипертензия;
- пневмоторакс, перелом ребра;
- синдром Титце, артралгия и миалгия.
ДИАГНОСТИЧЕСКИЕ СТРАТЕГИИ
Ни один из лабораторных и инструментальных методов, применяемый по отдельности, не обладает достаточно высокой чувствительностью и специфичностью при диагностике ТЭЛА. Поэтому помимо клинических проявлений, которые могут свидетельствовать о низкой, умеренной или высокой вероятности наличия ТЭЛА, в большинстве случаев для подтверждения или исключения данного диагноза необходимо провести ряд исследований.
Ангиопульмонография пока остается эталоном диагностики ТЭЛА. Однако это дорогостоящий метод исследования, связанный с риском развития осложнений, а его результаты иногда трудно интерпретировать, особенно при поражении мелких ветвей ЛА. Поэтому необходимо провести комплекс лабораторных и неинвазивных инструментальных исследований, который позволит уменьшить количество показаний для проведения ангиографии и в то же время будет достаточно надежен в диагностике этого тяжелого заболевания.
В клинической практике необходимо определить, каким пациентам какие исследования и в какой последовательности проводить. От полученных результатов зависит объем неотложных лечебных мероприятий и дальнейшая тактика ведения больных.
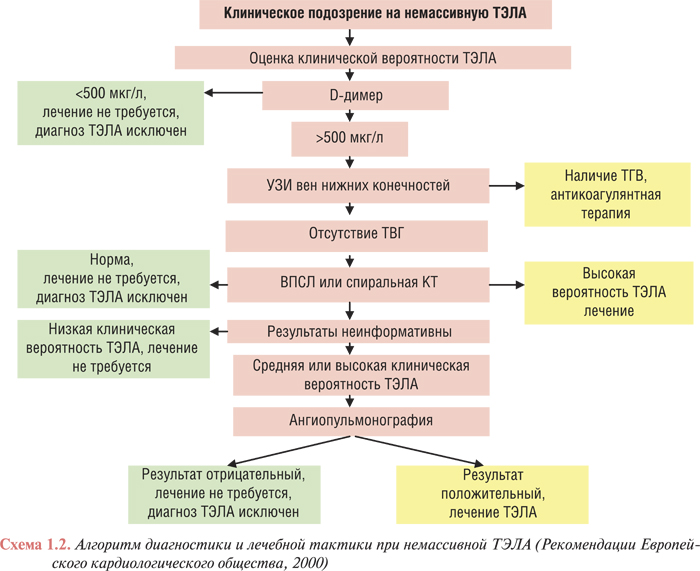
Предполагаемая немассивная ТЭЛА в отделении реанимации и интенсивной терапии
После изучения жалоб пациента и его объективного статуса необходимо провести оценку вероятности ТЭЛА по выявленным клиническим признакам, предпочтительно с использованием шкалы пересмотренного женевского счета или разработанной P. Wells. Следующим этапом диагностики является определение уровня D-димера в периферической крови пациента (методом иммуноферментного анализа — ELISA). При нормальном значении этого показателя антикоагулянтная терапия не требуется. Если уровень D-димера составляет >500 мкг/л, то проводят дополнительное обследование, включающее эхографию вен нижних конечностей и сцинтиграфию легких. Комбинация трех методов позволяет установить диагноз примерно в 65% случаев. При выявлении ТГВ с помощью УЗИ показано назначение антикоагулянтов. После начала терапии для подтверждения диагноза таким больным могут понадобиться другие инструментальные исследования. Если в результате УЗИ не получено убедительных данных о наличии ТГВ, больному сразу же необходимо провести ВПСЛ. При отрицательном результате ВПСЛ антикоагулянтную терапию можно не проводить, а при высокой вероятности ТЭЛА по данным ВПСЛ — начать ее проведение.
Если результаты ВПСЛ сомнительны, то при низкой клинической вероятности ТЭЛА лечение не требуется, а при средней или высокой — следует провести ангиопульмонографию, результаты которой и определяют необходимость назначения антикоагулянтов. Во многих центрах сцинтиграфия легких и ангиопульмонография могут быть заменены спиральной КТ. Алгоритм диагностики и лечебной тактики при немассивной ТЭЛА представлен на схеме 1.2.
Предполагаемая массивная ТЭЛА
При подозрении на массивную ТЭЛА у больных с шоком или артериальной гипотензией первым и наиболее информативным методом является эхоКГ. Этот неинвазивный метод исследования позволяет выявить признаки острой легочной гипертензии и перегрузки ПЖ, характерные для ТЭЛА, а также исключить шок другого генеза, тампонаду сердца и расслоение аорты. Если состояние больного на фоне начатой симптоматической терапии остается нестабильным, то тромболитическая терапия может быть начата на основании данных эхоКГ. Если же симптоматическая терапия позволяет стабилизировать состояние, то диагноз следует подтвердить с помощью ВПСЛ, спиральной КТ или чреспищеводной эхоКГ. Отсутствие изменений на сцинтиграмме является основанием для поиска другой причины шока.
Предполагаемая немассивная ТЭЛА у госпитализированных больных
Диагностика ТЭЛА у больных, находящихся в хирургических и терапевтических отделениях, представляет собой серьезную проблему, учитывая недостаточную настороженность врачей относительно возможности ТЭЛА у их пациентов и низкую информативность некоторых неинвазивных методов у этой категории больных. Так, уровень D-димера, повышающийся при многих состояниях, позволяет исключить ТЭЛА лишь у 10% таких больных. Клиническая оценка вероятности ТЭЛА часто менее полезна, так как у подавляющего большинства прооперированных больных имеется по крайней средний риск развития тромбоэмболических осложнений. Любая ступень диагностического алгоритма может быть исключена, кроме ангиопульмонографии (схема 1.3).

Стратификация риска
Проявления ТЭЛА могут варьировать от незначительно выраженной одышки до шока, однако большинство пациентов имеют среднюю степень выраженности симптомов. Быстрая и точная стратификация риска имеет очень важное значение, поскольку пациентам с высоким риском требуется более агрессивная лечебная тактика. Поэтому в обследование больных со стабильной гемодинамикой необходимо включать оценку риска неблагоприятного исхода.
Прогноз заболевания зависит от обширности эмболии, исходного состояния сердечно-сосудистой и дыхательной систем, множества других факторов.
Несомненно, определяющее значение для течения и исхода заболевания имеет объем поражения и выраженность гемодинамических нарушений. Закономерно, что у пациентов с массивной ТЭЛА прогноз значительно хуже по сравнению с немассивной. По данным регистра ICOPER, у больных с массивной ТЭЛА 90-дневная летальность составила 52,4%, а у больных с немассивной — 14,7%. Кроме того, при массивной ТЭЛА чаще отмечают тромбоз ПЖ и выраженную сопутствующую патологию. Возраст старше 70 лет, выраженная сердечная недостаточность, злокачественные новообразования, предшествующие хронические заболевания легких были независимыми предикторами неблагоприятного 3-месячного прогноза у как больных с массивной, так и у больных с немассивной ТЭЛА.
Большое значение для прогноза заболевания имеют многие клинические признаки. Выраженная одышка, потеря сознания, снижение уровня АД, тахикардия, набухание шейных вен, увеличение размеров печени являются клиническими проявлениям систолической дисфункции ПЖ и, соответственно, свидетельствуют о неблагоприятном прогнозе. У больных с выраженными проявлениями гемодинамических нарушений достоверно чаще развиваются госпитальные кровотечения, рецидив ТЭЛА. При этом повторный эпизод эмболии является независимым предиктором 90-суточной смертности. Кроме того, в результате изучения данных регистра RIETE (3391 пациент с ТЭЛА без сопутствующей патологии) установлено, что у больных с гемодинамическим коллапсом или изолированной одышкой (без боли плеврального характера и кровохарканья) летальность была в 2 раза выше, чем у больных с инфарктом легкого и сопутствующей одышкой, болью в грудной клетке и кровохарканьем. Более того, тяжесть последующих рецидивов ТЭЛА у больных с эпизодом гемодинамического коллапса или наличием изолированной одышки также оказалась серьезнее.
Традиционно для оценки прогноза у больных с ТЭЛА используют женевскую оценочную шкалу (табл. 1.9). Эта шкала предопределяет риск развития смерти, повторной эмболизации ЛА или клинически значимого кровотечения у больных с ТЭЛА. Учитывают 6 показателей, причем наличие сопутствующего злокачественного новообразования и артериальной гипотензии имеют наибольшее значение. Эта модель разработана для выявления больных низкого риска.
Таблица 1.9
Оценочная шкала для оценки прогноза у больных с ТЭЛА (Wicki S. et al., 2000)
| Показатель | Баллы |
| Злокачественное новообразование | +2 |
| СН | +1 |
| Предшествующий ТГВ | +1 |
| Артериальная гипотензия | +2 |
| Гипоксемия | +1 |
| ТГВ при УЗИ | +1 |
Если сумма не превышает 2 балла, вероятность ТЭЛА низкая; при сумме баллов 2–6 — умеренная; более 6 баллов — высокая.
ЭКГ в 12 отведениях также помогает выделять больных с высоким риском неблагоприятных событий при ТЭЛА. Так, инверсия зубца T в отведениях V2 и V3 и псевдоинфарктный зубец Qr в V1, как правило, появляются при дисфункции и дилатации ПЖ сердца и являются маркерами неблагоприятного прогноза, включая летальный исход.
Дилатация и дисфункция ПЖ сердца, выявленные при эхоКГ, являются независимыми предикторами последующих тромбоэмболических событий и смерти. Даже у пациентов со стабильной гемодинамикой (САД ≥90 мм рт. ст.) гипокинезия ПЖ — независимый фактор развития ранней смерти (в 2 раза повышается риск летального исхода в 30-дневный период). Этот факт имеет важное клиническое значение, поскольку позволяет выявить пациентов с высоким риском (смертность 17%), кажущихся гемодинамически стабильными из-за отсутствия артериальной гипотензии.
Неблагоприятным фактором является развитие легочной гипертензии. Так, систолическое давление в ЛА более 50 мм рт.ст. в острый период ТЭЛА в 3 раза повышает риск персистирующей легочной гипертензии и дисфункции ПЖ сердца, легочной гипертензии в течение года после развития заболевания. У таких больных может произойти дальнейшее ухудшение заболевания с развитием хронической легочной гипертензии.
В обследование больных ТЭЛА с целью выявления группы высокого риска необходимо включать определение уровня тропонина (Тn) и мозгового натрийуретического пептида (BNP). Вследствие ишемии миокарда ПЖ в крови выявляют повышение уровня Тn I и Т, которые являются чувствительными маркерами необратимо поврежденных кардиомиоцитов. Необходимо отметить, что при ТЭЛА, по сравнению с острым ИМ, уровнень тропонинов в периферической крови значительно ниже и определяется в более короткий промежуток времени. Повышение уровня Тn тесно коррелирует с выраженностью дисфункции ПЖ, увеличением летальности, осложнений и рецидивов ТЭЛА. Так, отрицательная предсказательная ценность развития внутригоспитальной смерти при обнаружении ТnТ составляет от 97 до 100%, при уровне показателя от ≥0,04 до 0,09 нг/мл по данным различных авторов.
Из множества проведенных исследований наиболее убедительными являются данные К. Janata и соавторов (2003), где уровнень ТnТ ≥0,09 нг/мл предсказывал госпитальную смерть с чувствительностью 80%, специфичностью 92%, причем отрицательная предсказательная ценность достигла 99%, а положительная — 34%.
Другой важный маркер неблагоприятного прогноза — уровень МНУП (BNP) в крови. В ответ на перерастяжение кардиомиоцитов ПЖ сердца вследствие его перегрузки и дилатации уже через несколько часов в миокарде ПЖ начинает вырабатываться прогормон BNP (проВNP), который индуцирует появление биологически активного BNP и конечной части проВNP (NТ-проВNP). Повышение в крови уровня этих биомаркеров является предиктором дисфункции ПЖ сердца, развития правожелудочковой недостаточности и повышения смертности. Так, уровень BNP менее 50 пкг/мл, определенный в периферической крови больного, свидетельствует о низком риске развития СН у больных с ТЭЛА (отрицательная предсказательная ценность — около 100%), тогда как уровень 90 пкг/мл и более — о высоком риске.
Уровень тропонина и МНУП следует определять через 6–12 ч с момента развития заболевания. Результаты используют, в основном, для разграничения групп низкого и среднего риска среди гемодинамически стабильных пациентов. Больные с нормальным уровнем биомаркеров Тп и ВNP относятся к группе низкого риска по госпитальной смертности (отрицательная предсказательная ценность — 97–100%). Повышенные уровни Тn и BNP являются независимыми маркерами неблагоприятного госпитального и отдаленного прогноза. Таким пациентам обязательно следует проводить эхоКГ. При выявлении дисфункции ПЖ этих больных относят к группе высокого риска развития госпитальной смерти. Им необходимо проведение более агрессивной терапии.
ЛЕЧЕНИЕ БОЛЬНЫХ С ТЭЛА
Терапию больных с ТЭЛА следует проводить в соответствии с клиническим статусом пациента, объемом эмболизации, наличием сопутствующей сердечно-легочной патологии, уровнем маркеров некроза миокарда (тропонин), а также со степенью дисфункции правых отделов сердца, которую оценивают на основании физикального обследования, ЭКГ и эхоКГ. Пациентам с высоким риском развития неблагоприятных событий необходимо проводить тромболитическую терапию или эмболэктомию для восстановления проходимости магистральных ЛА на фоне введения гепарина для профилактики повторной эмболизации. В то же время пациенты с низким риском нуждаются только в проведении адекватной антикоагулянтной терапии. Чрескожные катетерные вмешательства (интервенционные процедуры) могут стать альтернативой хирургической эмболэктомии у пациентов с высоким риском развития осложнений или у больных с противопоказаниями для тромболитической терапии.
Тромболитическая терапия
Тромболитическая терапия позволяет спасти жизнь больным с кардиогенным шоком на фоне ТЭЛА. Физическое растворение тромба, закрывающего просвет магистральной ЛА, приводит к предотвращению быстропрогрессирующего развития правожелудочковой недостаточности и уменьшению высвобождения серотонина и других нейрогуморальных факторов, способствующих усилению легочной гипертензии. У больных с легочной гипертензией и низким сердечным выбросом на фоне ТЭЛА проведение тромболитической терапии сопровождается снижением среднего давления в ЛА на 30% и повышением сердечного индекса на 15% уже через 2 ч от ее начала. Через 72 ч повышение сердечного индекса достигает уже 80%, а снижение среднего давления в ЛА — 40%. Отмечено также значительное уменьшение конечно-диастолического размера ПЖ через 3 ч после начала тромболитической терапии. В то же время назначение только гепарина не приводит к изменению вышеуказанных параметров. Системная тромболитическая терапия также способствует растворению тромбов в малом тазу и/или глубоких венах нижних конечностей, которые могут быть источниками рецидивирования ТЭЛА.
Идеальное лекарственное средство прежде всего должно обеспечивать максимальную клиническую эффективность при минимальном риске побочных эффектов. Идеальный фибринолитический препарат для применения у больных с ТЭЛА должен иметь четко определенные показания для применения, отличаться быстротой развития терапевтического эффекта в сочетании с низкой частотой побочных реакций, среди которых наиболее значимыми являются кровотечения, а также оказывать положительное влияние на дальнейший прогноз заболевания. Кроме того, важно, чтобы препарат был удобен и прост в применении, в том числе при подборе режима дозирования, а также обеспечивал разумное соотношение эффективность/стоимость. Такого фибринолитического агента в нашем арсенале сегодня нет. В клинических исследованиях проведено тестирование нескольких фибринолитических препаратов (альтеплаза, стрептокиназа, урокиназа) для лечения больных с ТЭЛА. Несмотря на некоторые отличия между различными препаратами и режимами их введения в отношении влияния на показатели центральной гемодинамики в ранние сроки, не было установлено достоверных различий между отдельными режимами по влиянию на смертность. По данным последних исследований, введение альтеплазы (100 мг в течение 2 ч) позволяет быстрее достичь тромболитического и гемодинамического эффекта, чем введение урокиназы (4400 МЕ кг/ч в течение 12–24 ч), стрептокиназы (1,5 млн МЕ в течение 2 ч) или альтеплазы (0,6 мг/кг в течение 15 мин). При этом различия между режимами достоверны только в течение первого часа после начала терапии.
В отличие от ИМ терапевтическое окно для эффективного проведения тромболитической терапии у больных с ТЭЛА намного шире и составляет до 14 дней от развития симптомов заболевания. Такая эффективность, вероятно, обусловлена существованием коллатерального бронхиального кровообращения. Таким образом, больных с подозрением на ТЭЛА следует рассматривать в качестве потенциальных кандидатов для проведения тромболитической терапии при развитии новых симптомов заболевания в течение 2 нед, предшествующих госпитализации.
Проведено несколько рандомизированных контролируемых клинических исследований, в которых оценивали эффективность и безопасность тромболитической терапии на фоне назначения гепарина по сравнению с введением гепарина в режиме монотерапии у больных с острой ТЭЛА. Метаанализ 9 из них (суммарно включен 461 больной) не выявил достоверного снижения смертности (рис. 1.18) или повторной эмболизации ЛА при применении фибринолитических средств. Однако снижение частоты развития каждого из неблагоприятных событий практически на 40% при применении тромболитической терапии позволяет предположить необходимость включения большего количества больных для достижения статистически достоверных отличий. Хотя показания к проведению тромболитической терапии при ТЭЛА до сих пор строго не определены, пациенты c массивной ТЭЛА (гемодинамическая нестабильность и дисфункция ПЖ) теоретически должны иметь максимальные преимущества от ее проведения.
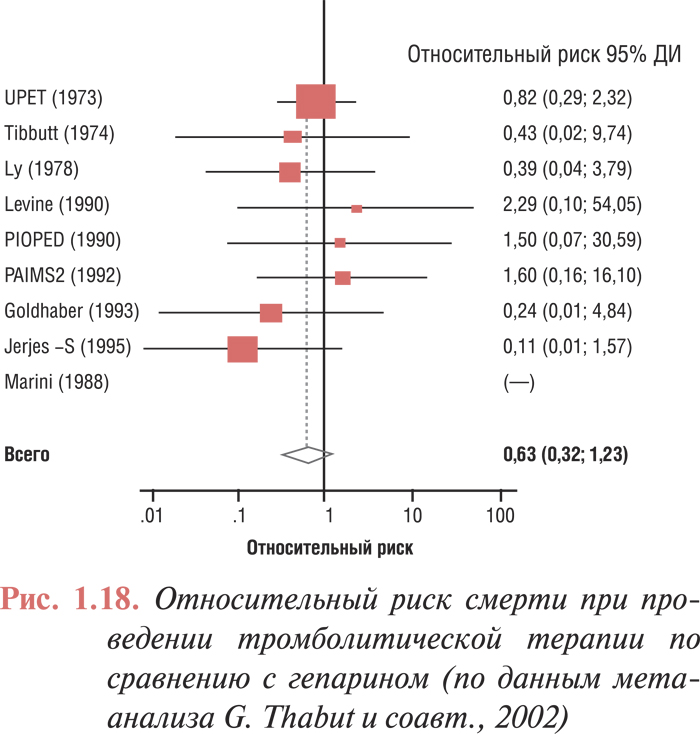
Небольшое исследование, в которое было включено 8 больных с массивной ТЭЛА и шоком, является сегодня единственным, в котором продемонстрировано достоверное снижение смертности вследствие применения фибринолитических препаратов при данной патологии. Это исследование было прекращено по этическим соображениям после того, как 4 больных, которым проводили тромболитическую терапию (стрептокиназа в дозе 1 500 000 МЕ внутривенно в течение 1 ч на фоне антикоагулянтной терапии гепарином), остались живы, а 4 пациентов, получавших только гепарин, умерли. В 2004 г. опубликован анализ 5 исследований, включавших больных с массивной ТЭЛА.
Применение тромболитической терапии у этой категории пациентов сопровождалось снижением риска развития смерти или повторной эмболизации на 55% (табл. 1.10).
Таблица 1.10
Частота смерти/рецидива ТЭЛА у больных, получавших тромболитическую терапию или гепарин по результатам контролируемых рандомизированных исследований
| Исследование | Смерть/рецидив ТЭЛА | Отношение рисков | 95% доверительный интервал | |
| Тромболизис | Гепарин | |||
| UPET (1973) | 10/82 | 14/78 | 0,63 | 0,26–1,53 |
| Тиббут и соавт. (1974) | 0/13 | 1/17 | 0,41 | 0,02–0,83 |
| Ли и соавт. (1978) | 1/14 | 2/11 | 0,35 | 0,03–4,42 |
| Доттер и соавт. (1979) | 1/15 | 3/16 | 0,31 | 0,03–3,36 |
| Джерджес — Санчес и соавт. (1995) | 0/4 | 4/4 | 0,01 | 0,00–0,77 |
| Всего | 12/128 | 24/126 | 0,45 | 0,22–0,92 |
В 1997 г. S. Konstantinides и соавторы при анализе данных неконтролируемого обсервационного исследования установили снижение смертности при использовании тромболитических препаратов в группе гемодинамически стабильных больных с ТЭЛА и перегрузкой ПЖ (субмассивная ТЭЛА). В более позднем контролируемом исследовании эти данные не подтвердились, однако было отмечено уменьшение потребности в проведении ургентных инвазивных вмешательств у этой категории больных после тромболитической терапии. По данным украинских авторов (Поливенок И.В. и соавт., 2002), проведение тромболитической терапии стрептокиназой (в дозе 1,5 млн МЕ в течение 60–90 мин) позволяло достоверно снизить смертность больных с субмассивной ТЭЛА (на 21,3%). Однако повышение частоты больших кровотечений ставит под сомнение преимущества фибринолитической терапии у больных с субмассивной ТЭЛА. Только проведение большого рандомизированного, контролируемого исследования может окончательно решить этот вопрос. Применение тромболитических средств у больных со стабильной гемодинамикой без признаков перегрузки ПЖ сердца не приводит к улучшению клинического течения заболевания и поэтому считается необоснованным.
По данным отдельных исследований и проведенных метаанализов, применение тромболитических препаратов приводит примерно к двукратному увеличению количества больших кровотечений (внутричерепные, ретроперитонеальные или наружные кровотечения, потребовавшие переливания крови) (рис. 1.19). Риск развития кровотечений после фибринолиза для больных, после проведения ангиографии составляет около 14%. При этом около 40% общего их количества являются кровотечения из места пункции, а внутричерепные кровоизлияния составляют 1,9% общего количества геморрагических осложнений. Вероятность развития геморрагий у больных с неинвазивной диагностикой ТЭЛА изучена плохо, хотя в двух проведенных исследованиях больших кровотечений у этой категории больных не отмечено. Таким образом, у каждого больного перед проведением тромболитической терапии следует оценивать степень риска геморрагических осложнений. Это также обусловлено тем, что большинство больных с ТЭЛА имеют целый ряд сопутствующих заболеваний.

В целом вероятность кровотечения у больных с массивной ТЭЛА является высокой независимо от того, проводится ли только антикоагулянтная терапия или совместно антикоагулянтная и тромболитическая терапия. Вероятность кровотечений повышается с возрастом больного. Так, средний возраст больных, у которых отмечали развитие большого кровотечения после проведения тромболитической терапии, составил 63 года, тогда как средний возраст больных без геморрагических осложнений был 56 лет (p=0,005). Было установлено, что каждый год жизни повышает вероятность кровотечения примерно на 4%. Повышение (ИМТ более 30 кг/м2) или снижение (менее 70 кг) массы тела, женский пол, АГ и проведение ангиографии также являются независимыми факторами риска геморрагий. Абсолютные и относительные противопоказания к проведению тромболитической терапии у больных с ТЭЛА приведены в табл. 1.11.
Таблица 1.11
Противопоказания к проведению тромболитической терапии у больных с ТЭЛА
| Абсолютные противопоказания |
| Активное внутреннее кровотечение |
| Внутричерепное кровоизлияние |
| Относительные противопоказания |
| Обширное хирургическое вмешательство, родоразрешение, органная биопсия или пункция не подлежащего прижатию сосуда на протяжении ближайших 10 дней |
| Геморрагический инсульт, перенесенный в предшествующие 2 мес |
| Перенесенное в предшествующие 10 дней желудочно-кишечное кровотечение |
| Травма, перенесенная в предшествующие 15 дней |
| Нейро- или офтальмологическое хирургическое вмешательство в течение ближайшего месяца |
| Неконтролируемая АГ (САД >180 мм рт. ст.; ДАД >110 мм рт. ст.) |
| Проведение сердечно-легочной реанимации |
| Количество тромбоцитов <100 000/мм3, протромбиновое время менее 50% |
| Период беременности |
| Бактериальный эндокардит |
| Диабетическая геморрагическая ретинопатия |
До настоящего времени ни один из тромболитических препаратов не продемонстрировал преимуществ перед остальными в плане эффективности лечения больных с ТЭЛА. Однако риск прогрессирования артериальной гипотензии при применении стрептокиназы у больных с массивной ТЭЛА делает назначение альтеплазы и урокиназы более предпочтительным. При применении урокиназы (4400 МЕ/кг/ч в течение 12–24 ч) риск развития больших кровотечений составляет около 28%, при введении альтеплазы в дозе 100 мг в течение 2 ч — 21–24%, а в дозе 0,6 мг/кг в течение 15 мин — 11%.
Ввведение альтеплазы (100 мг в течение 2 ч) позволяет быстрее достигнуть тромболитического и гемодинамического эффекта, чем проведение других режимов тромболитической терапии. В связи с этим единственным фибринолитическим режимом, одобренным Управлением по контролю за пищевыми продуктами и лекарственными средствами США (FDA) для использования у больных с массивной ТЭЛА, является введение альтеплазы (тканевой аткиватор плазминогена) в дозе 100 мг в течение 2 ч. По существующим рекомендациям перед введением альтеплазы инфузия гепарина должна быть прекращена. После окончания тромболитической терапии определяется АЧТВ. При его значении >80 с возобновляется инфузия гепарина без предварительного болюсного введения, а при значении АЧТВ более 80 с — антикоагулянтная терапия не проводится. При этом АЧТВ повторно определяют через 4 ч. В подавляющем большинстве случаев повторный анализ позволяет возобновить терапию гепарином (АЧТВ менее 80 с).
Относительно новым тромболитическим препаратом, который может применяться у больных с ТЭЛА, является тенектеплаза (TNK-tPA). Тенектеплаза имеет ряд существенных преимуществ перед своими предшественниками, которые заключаются в большей фибриноспецифичности, резистентности к инактивации, а также возможности в/в болюсного введения (за 5–10 с) и дозирования на кг массы тела больного. Болюсное введение этого препарата на фоне гепаринотерапии по сравнению с назначением только гепарина в настоящее время изучается в проспективном рандомизированном двойном слепом плацебо-контролируемом исследовании (Tenecteplase Pulmonary Embolism Italian Study) у больных с субмассивной ТЭЛА. В этом исследовании принимают участие около 30 центров по всей Италии. Ожидается набор около 180 пациентов с субмассивной ТЭЛА — 90 человек в группе для получения тенектеплазы и 90 человек в группе антикоагулянтной терапии.
Таким образом:
- Терапевтическое «окно» для проведения тромболитической терапии у больных с ТЭЛА составляет до 14 дней от развития симптомов
- Тромболитическая терапия показана всем больным с массивной ТЭЛА
- Большинство противопоказаний для проведения тромболитической терапии при массивной ТЭЛА являются относительными
- С учетом эффективности и безопасности предпочтительным режимом тромболитической терапии при ТЭЛА является системное введение 100 мг альтеплазы в течение 2 ч
- Эффективность тромболитических препаратов у больных с субмассивной ТЭЛА (гипокинезия ПЖ) не доказана, однако ввиду клинической целесообразности может проводиться по усмотрению лечащего врача
- Тромболитическая терапия не показана гемодинамически стабильным больным без признаков перегрузки/дисфункции ПЖ.
Хирургическая эмболэктомия
Несмотря на отсутствие больших рандомизированных клинических исследований, которые продемонстрировали бы уменьшение летальности при проведениии тромболитической терапии у больных с ТЭЛА, по существующим рекомендациям эта методика проведения реперфузии остается предпочтительной. В то же время по данным целого ряда международных регистров в реальной клинической практике количество больных с противопоказаниями для проведения фибринолитической терапии и частота ее осложнений существенно выше, чем в тщательно контролируемых клинических исследованиях. Так, по данным регистра MAPPET (Management Strategies and Prognosis in Patients with Pulmonary Embolism), у 40% больных с ТЭЛА, которым проводилась фибринолитическая терапия, имелось хотя бы одно относительное противопоказание. При этом около трети пациентов с массивной ТЭЛА имеют абсолютные противопоказания для фибринолитической терапии. В регистре ICOPER из 304 больных, которым проводилась тромболитическая терапия, у 66 (21,7%) больных отмечались большие, а у 9 (3%) — внутричерепные кровотечения. Такие неутешительных данные привели к поиску новых методов лечения ТЭЛА и возрождению методов хирургической коррекции.
Высокая частота периоперационных осложнений и высокая смертность больных при проведении хирургической эмболэктомии на протяжении ряда лет ограничивали использование этого метода лечения. Однако усовершенствование техники оперативного вмешательства и методов анестезиологической поддержки позволило несколько улучшить результаты хирургического лечения. В настоящее время хирургическая эмболэктомия является методом лечения больных с массивной ТЭЛА, пациентов с противопоказаниями к проведению тромболитической терапии, а также при неэффективности последней. Наличие тромба в правых отделах сердца или незаращение овального отверстия в межпредсердной перегородке служат дополнительными критериями в пользу хирургического вмешательства. Результаты оперативного лечения значительно лучше при возможности его проведения до развития стойкого снижения АД и/или кардиогенного шока.
В настоящее время используют несколько методик эмболэктомии из ЛА. Эмболэктомия в условиях временной окклюзии полых вен не требует сложного технического обеспечения, и ее может в случае экстренной необходимости успешно выполнить опытный хирург общего профиля. Одним из наиболее опасных этапов подобного вмешательства является вводный наркоз, когда может наступить брадикардия, гипотензия и асистолия. Усугубление гемодинамических расстройств связано с тем, что резко дилатированные правые отделы сердца чрезвычайно чувствительны к значительным колебаниям внутриплеврального давления, которые возникают во время искусственной вентиляции легких. Все манипуляции по удалению эмболов после пережатия полых вен должны длиться не более 3 мин, так как этот интервал является критическим для больных, операцию которым проводят в условиях тяжелой исходной гипоксии. К сожалению, подобная операция сопровождается очень высокой смертностью.
Проводится также эмболэктомия в условиях искусственного кровообращения с использованием чресстернального доступа. Вспомогательную веноартериальную перфузию проводят на первом этапе оперативного вмешательства (до вводного наркоза) путем канюлирования бедренных сосудов. Искусственное кровообращение позволяет в значительной степени обезопасить проведение эмболэктомии у больных с тяжелейшими гемодинамическими расстройствами. Все же смертность после подобных вмешательств достигает от 20 до 50%.
Проведение оперативного вмешательства на работающем сердце без пережатия аорты с экстракцией только видимого тромба из основных ветвей ЛА позволяло снизить смертность до 11%.
По относительным показаниям при одностороннем поражении возможно проведение хирургической дезобструкции сосудистого русла из бокового торакотомного доступа в условиях пережатия соответствующей ЛА.
Чрескожная эмболэктомия, катетерная фрагментация и тромбэктомия
Больные с ТЭЛА зачастую имеют целый ряд сопутствующих заболеваний, которые не позволяют провести им тромболитическую терапию или хирургическое удаление тромба. Доступность круглосуточной хирургической помощи таким больным в Украине, как и в мире в целом, также ограничена. Единственным альтернативным методом лечения в таком случае является чрескожная катетерная тромбэктомия.
Идеальный катетер для проведения чрескожной тромбэктомии при ТЭЛА должен обладать такими свойствами:
1) высокая маневренность, позволяющая осуществить его быстрый пассаж по правым отделам сердца с последующей постановкой в магистральные ЛА;
2) высокая эффективность в удалении обтурирующего тромба из магистральных ЛА, позволяющая быстро улучшить гемодинамику, устранить недостаточность ПЖ и кардиогенный шок;
3) высокая безопасность, которая заключается в отсутствии повреждающего действия на структуры сердца или ЛА.
В настоящее время разработан целый ряд различных катетеров для лечения ТЭЛА. Некоторые предназначены для извлечения, другие — для фрагментации, третьи — аспирации тромба.
Большинство доступных сегодня катетеров не устраняют тромб полностью, а разбивают его на осколки, которые мигрируют в более мелкие разветвления ЛА (рис. 1.20). Поперечное сечение периферических сосудов малого круга кровообращения примерно в 2 раза больше, чем магистральных ЛА. Таким образом, перераспределение большого центрального тромба по дистальным сосудам может быстро улучшить гемодинамику с существенным увеличением общего легочного кровотока и улучшением функции ПЖ.
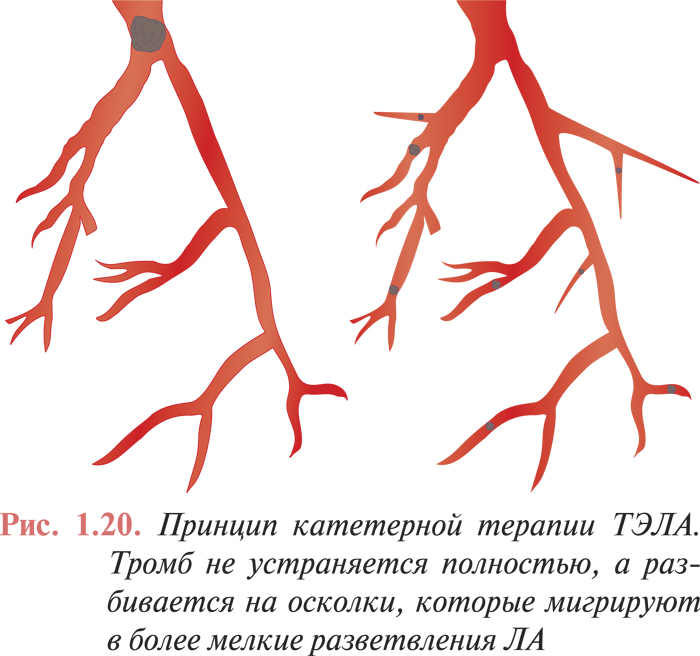
Успех тромболитической терапии, механической тромбэктомии или катетерной фрагментации тромба тем выше, чем более свежим и рыхлым является окклюзирующий тромб. Тромбэктомию можно применять у пациентов с «возрастом» тромба до 3 нед.
На основании анамнеза заболевания и данных ангиографии принято выделять три группы больных с различной эффективностью катетеризационных вмешательств:
Тип 1 — пациенты со «свежим» тромбом, который привел к недавней эмболизации ЛА — хороший результат вмешательства с восстановлением периферического легочного кровотока и оксигенации крови.
Тип 2 — пациенты со старым организованным тромбом, который привел к недавней эмболизации ЛА — низшая эффективность тромбэктомии, но несмотря на высокую вероятность наличия резидуальных тромбов, шансы на улучшение легочного кровотока хорошие.
Тип 3 — пациенты с ТЭЛА в анамнезе и повторным ухудшением самочувствия в связи с рецидивирующей эмболизацией — плохой результат механической тромбэктомии.
Первым катетером, разработанным для лечения массивной ТЭЛА и использующимся в клинике уже на протяжении 3 десятилетий, является катетер Greenfield. Устройство предназначено для удаления неорганизованных «свежих» тромбов ручным способом при помощи большого шприца. В большинстве случаев процедура проводится путем многократного повторного извлечения частей тромба для восстановления адекватного кровотока в ЛА. Эффективность тромбэктомии при помощи этого катетера составляет 76% по данным его изобретателя и значительно ниже по данным других авторов.
Другие механические или реолитические устройства для тромбэктомии в долевых и сегментарных ветвях ЛА изучали в небольших клинических исследованиях.
Высокоэффективным устройством для механической катетерной тромбэктомии при массивной ТЭЛА является устройство Aspirex. Основной частью катетера является защищенный вращающийся с большой скоростью змеевик, через L-образное отверстие в наконечнике которого происходит аспирация, мацерация и удаление тромба (рис. 1.21).

В настоящее время используют также фрагментацию тромба без эмболэктомии путем баллонной ангиопластики или с использованием ротационного катетера. Механическая фрагментация тромба при помощи баллонной ангиопластики, проводимая одновременно с фармакологическим тромболизисом (введение урокиназы в дозе 80–100 тыс. МЕ/ч на протяжении 8–24 ч) у больных с массивной ТЭЛА, оказалась достаточно эффективной. В отдельных случаях применяют также стентирование ЛА.
В некоторых случаях катетеры используют для направленного введения фибринолитического препарата, что позволяет ускорить лизис тромба и быстрее восстановить легочной кровоток. Данные последних лет свидетельствуют, что системная инфузия тромболитических препаратов иногда не приводит к необходимому эффекту в связи с плохим контактом лекарственного средства с тромбом в окклюзированной ветви ЛА (рис. 1.22). Тромболитическую терапию в случае катетеризации проводят путем внутривенного болюсного введения препарата с последующей его инфузией в течение 12–24 ч на фоне системной антикоагулянтной терапии.
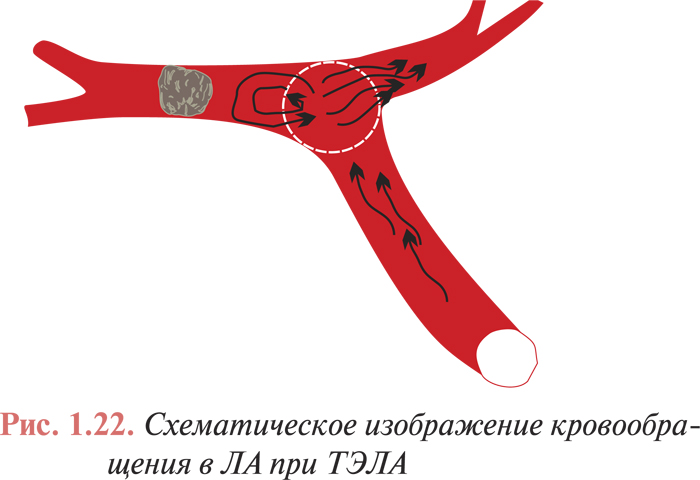
Режимы катетерной тромболитической терапии:
- урокиназа: внутривенная инфузия со скоростью 250 тыс. МЕ/ч одновременно с 2000 МЕ гепарина в течение 2 ч с последующим введением урокиназы со скоростью 100 тыс. МЕ/ч на протяжении 12–24 ч;
- альтеплаза:
- болюсное внутривенное введение в дозе 10 мг с последующей инфузией в дозе 40 мг в течение 2 ч;
- внутривенная инфузия в дозе 100 мг в течение 7 ч;
- болюсное внутривенное введение в дозе 20 мг с катетерной фрагментацией тромба и последующей инфузией в дозе 80 мг в течение 2 ч.
При проведении катетерных процедур и, в частности, катетерной тромбэктомии, возможно развитие целого ряда осложнений, которые включают перфорацию или диссекцию центральных сосудов и стенок сердца, гемотампонаду, легочное кровотечение и эмболизацию сосудов большого круга кровообращения. Возможно также развитие нарушений ритма и блокад сердца, кровопотери, контраст-индуцированной нефропатии, анафилактических реакций и целого ряда осложнений в месте пункции сосуда (гематома, фистула, псевдоаневризма и т.д.). Для снижения риска перфорации или диссекции, тромбэктомию следует проводить только в основных и долевых ЛА и не применять данную методику в сегментарных артериях. Процедуру следует прекращать при достижении адекватного гемодинамического эффекта независимо от результатов ангиографии.
Антикоагулянтная терапия
Антикоагулянтная терапия — основной метод лечения больных с ТЭЛА уже более 40 лет, со времени опубликования результатов исследования Barrit и Jordan (1960). Нефракционированный гепарин связывается с антитромбином III и повышает активность последнего, что предотвращает тромбообразование и способствует растворению уже сформировавшихся тромбов путем активации эндогенных фибринолитических механизмов. Таким образом, гепаринотерапия в основном направлена на источник тромбоэмболии, а не на тромбэмбол в ЛА, а основной ее целью является профилактика повторных тромбозов и эмболизации. Актуальность такой профилактики объясняется тем, что при отсутствии антикоагулянтной терапии у больных, перенесших эпизод ТЭЛА, вероятность повторной эмболии с летальным исходом колеблется от 18 до 30%.
Гепарин должен быть назначен всем больным с подозрением на ТЭЛА (при отсутствии противопоказаний) еще на этапе диагностики. После подтверждения диагноза большинство противопоказаний для гепаринотерапии, таких как активное кровотечение, врожденные или приобретенные нарушения гемостаза, неконтролируемая АГ или недавно перенесенное хирургическое вмешательство должны рассматриваться как относительные. Начинать антикоагулянтную терапию при ТЭЛА с самостоятельного назначения пероральных антикоагулянтов без предварительного введения гепарина менее эффективно, а в некоторых случаях может привести к ухудшению клинического состояния больного (начальный протромбогенный эффект непрямых антикоагулянтов).
В рекомендациях Европейского общества кардиологов приведена следующая схема введения нефракционированного гепарина при ТЭЛА. Вначале внутривенно струйно (болюсно) вводят 5–10 тыс. МЕ гепарина. Затем начинают внутривенное капельное введение препарата. Начальная скорость инфузии зависит от массы тела больного и рассчитывается по номограмме, однако не должна быть ниже 1250 МЕ/ч. Гепаринотерапия проводится под обязательным контролем показателя АЧТВ. Первое определение АЧТВ проводится через 4–6 ч от начала терапии, а скорость последующей инфузии корригируется в зависимости от достигнутого антикоагулянтного эффекта. Рекомендовано поддержание показателя АЧТВ на уровне 1,5–2,5 раза выше, чем контрольное значение для данной лаборатории (табл. 1.12).
Таблица 1.12
Номограмма для проведения гепаринотерапии при ТЭЛА (Raschke и соавт., 1993)
| Начальная доза | 80 МЕ/кг внутривенно болюсно, затем со скоростью 18 МЕ/кг/ч |
|
|
Поводом к назначению гепарина в таких высоких дозах является эмпирическое набюдение недостаточной антикоагулянтной эффективности стандартных доз, при этом отсутствие адекватной антикоагуляции может быть фатальным для больного. У больных с массивной ТЭЛА тактика гепаринотерапии должна быть еще более агрессивной. При этом рекомендуют для болюсного введения использовать дозу не менее 10 тыс. МЕ, а целевой уровень АЧТВ при инфузионной терапии должен составлять не менее 80 с. Гепаринотерапию необходимо проводить в течение 7–10 дней, поскольку именно в эти сроки происходит лизис и/или организация тромба.
Использование гепарина сопряжено с повышенным риском развития кровотечений. Проведение инвазивных вмешательств, тромболитической терапии, наличие сопутствующих местных повреждений или врожденных, или приобретенных нарушений гемостаза в свою очередь также повышают вероятность кровотечений. Поэтому тщательный контроль АЧТВ является обязательным условием адекватности и безопасности антикоагулянтной терапии гепарином.
Вторым по частоте осложнением гепаринотерапии является гепарин-индуцированная тромбоцитопения (ГИТ). Описаны два типа ГИТ, которые характеризуются различными проявлениями и подходами к терапии. ГИТ I типа отмечается чаще и протекает благоприятно. Механизм ее развития обусловлен неиммунным взаимодействием между гепарином и тромбоцитами, что вызывает появление тромбоцитопении с первых дней гепаринотерапии. При этом количество тромбоцитов редко уменьшается ниже 100 тыс. в 1 мкл и часто возвращается к норме, несмотря на продолжение использования гепарина. Пациентам с ГИТ I типа не требуется назначения специфического лечения. ГИТ II типа отмечают у 1–5% всех больных, получающих гепарин. Критерием ее диагностики является уменьшение количества тромбоцитов ниже 100×109/л, либо более чем на 50% их исходного уровня. В среднем количество тромбоцитов при этом типе тромбоцитопении уменьшается до 40–60 тыс./мкл. Патогенез ГИТ II типа связан с иммунными механизмами и поэтому она развивается на 5-е сутки после начала гепаринотерапии. Имунную реакцию в большинстве случаев запускает комплекс гепарина с IV фактором тромбоцитов ОУФТ), который стимулирует образование антител, преимущественно IgG. Иммунные комплексы (гепарин/IVФТ/IgG) адсорбируются на поверхности тромбоцитов. IgG взаимодействуют с тромбоцитарными Fc-рецепторами (FcγRIIA) и приводят к активации, агрегации и последующей деструкции тромбоцитов с высвобождением большого количества биологически активных веществ. В результате образуются тромбоцитарные микрочастицы, богатые фосфолипидами с выраженной прокоагулянтной активностью. IgG также активируют клетки эндотелия, связываясь с IVФТ/ гепаринсульфатным комплексом на их поверхности, вследствие чего синтезируется большое количество тканевого фактора (тканевой тромбопластин), который инициирует внешний путь свертывающей системы крови. Поэтому наиболее частыми и клинически значимыми проявлениями ГИТ II являются тромбозы и тромбоэмболии, которые отмечают в 30–55% случаев. Особенно часто при ГИТ выявляют тромбозы глубоких вен нижних конечностей и рецидивы ТЭЛА. Тромбозы артериальных сосудов чаще проявляются в виде ишемии нижних конечностей, нарушений мозгового кровообращения, ИМ. При этом применение непрямых антикоагулянтов (аценокумарол, варфарин и др.) у больных с ГИТ II парадоксально повышает риск развития тромботических осложнений. В настоящее время нет оптимального лабораторного метода диагностики ГИТ, а большинство существующих методик имеют ограниченное использование в клинической практике (табл. 1.13).
Таблица 1.13
Лабораторные методы диагностики ГИТ (по T.E. Warkentin, 1997)
|
|
|
При ГИТ II типа требуется немедленная отмена гепарина, а в большинстве случаев — назначение альтернативной антикоагулянтной и антитромбоцитарной терапии. Для профилактики и лечения тромбозов используют прямые ингибиторы тромбина (гирудин, бивалирудин) и антитромбоцитарные препараты, при необходимости — хирургические вмешательства (тромбэктомия, фрагментация и т.д.). С целью профилактики ГИТ при проведении гепаринотерапии необходимо проводить контроль количества тромбоцитов в крови через день. Значительного снижения вероятности ГИТ добиваются также при использовании низкомолекулярных гепаринов и пентасахарида (фондапаринукс натрий).
В последние годы для лечения больных с ТЭЛА успешно используют низкомолекулярные гепарины (НМГ). Они имеют ряд преимуществ перед нефракционированным гепарином. Для НМГ характерны повышенная биодоступность при подкожном введении, более продолжительный период полувыведения, низкая частота развития тромбоцитопении и остеопороза. НМГ имеют также более предсказуемый антикоагулянтный эффект, так как в меньшей степени, чем нефракционированный гепарин, связываются с белками плазмы крови. Это обусловливает возможность их назначения с учетом массы тела больного. Необходимость в специальном лабораторном контроле при их применении в большинстве случаев отсутствует.
В 2004 г. проведен метаанализ всех рандомизированных исследований, в которых сравнивали безопасность и эффективность применения нефракционированного гепарина и НМГ у больных с симптомной и бессимптомной (тромбоз глубоких вен) ТЭЛА. Не было выявлено существенных отличий между двумя видами терапии по частоте развития повторных симптомных венозных тромбоэмболических осложнений и смерти как на момент прекращения лечения, так и по результатам 3-месячного наблюдения (табл. 1.14).
Таблица 1.14
Частота развития повторных симптомных венозных тромбоэмболических осложнений и смерти (%) у больных с ТЭЛА на фоне различных режимов антикоагулянтной терапии
| Осложнения | НМГ | Нефракционированный гепарин | Отношение рисков (95% ДИ) |
| На момент окончания терапии | |||
| Повторный тромбоз глубоких вен | 0,1 | 0,8 | 0,47 (0,17–1,26) |
| Повторная ТЭЛА | 1,4 | 1,7 | 0,91 (0,45–1,85) |
| Смерть от всех причин | 1,4 | 1,2 | 1,20 (0,59–2,45) |
| Через 3 мес наблюдения | |||
| Повторный тромбоз глубоких вен | 1,7 | 2,4 | 0,64 (0,33–1,25) |
| Повторная ТЭЛА | 1,8 | 2,5 | 0,78 (0,41–1,47) |
| Смерть от всех причин | 4,7 | 6,1 | 0,77 (0,52–1,15) |
У пациентов с симптомной ТЭЛА развитие повторных венозных тромбоэмболий и смерти также не отличалось и составило для нефракционированного гепарина и НМГ — 2,3% против 1,7% на момент окончания лечения и 4,3% против 3,3% через 3 мес наблюдения (p>0,05) соответственно. Вероятность развития больших и малых кровотечений на фоне применения разных видов гепаринотерапии было одинаковым. Таким образом, применение НМГ как минимум столь же эффективно и безопасно для лечения острой немассивной ТЭЛА, как и нефракционированного гепарина. Удобство применения, низкая вероятность развития аллергических реакций и ГИТ в свою очередь делают НМГ более привлекательными для лечения данной категории пациентов. В то же время применение нефракционированного гепарина остается единственным методом антикоагулянтной терапии, рекомендованным для применения у больных с массивной ТЭЛА. При применении НМГ следует помнить, что основной путь их выведения — через почки, в то время как нефракционированный гепарин в основном метаболизируется в печени. У пациентов с хроническими заболеваниями почек, выраженным ожирением, непредвиденными кровотечениями, а также повторными ТЭЛА (несмотря на проводимую терапию НМГ в адекватных дозах), и беременным следует проводить лабораторное мониторирование при терапии НМГ.
Целый ряд НМГ тестировали для лечения и профилактики тромбоза глубоких вен и ТЭЛА (эноксапарин натрий, дальтепарин натрий, надропарин кальций, тинзапарин, ревипарин, цертопарин, ардепарин и др.). Согласно данным описанного выше метаанализа, не было отмечено преимуществ того или иного НМГ для лечения ТЭЛА. Из зарегистрированных в настоящее время в Украине НМГ наиболее изученным для терапии больных с тромбозом глубоких вен и ТЭЛА является эноксапарин натрий (зарегистрирован FDA для лечения ТЭЛА). Его применяют в дозе 1 мг/кг через 12 ч или 1,5 мг/кг 1 раз в сутки. Продолжительность лечения больных с ТЭЛА низкомолекулярными гепаринами составляет 5–10 дней.
Одновременно с применением гепарина больным с ТЭЛА назначают непрямые антикоагулянты, механизм действия которых заключается в нарушении нормального метаболизма витамина К в печени. Витамин К необходим для синтеза целого ряда факторов свертывающей системы крови (II, VII, IX, Х). Витамин К также играет роль в активации протеинов С и S, обладающих антикоагулянтными свойствами. Поскольку период полувыведения протеинов С и S меньше, чем у факторов свертывающей системы крови, то в первые несколько дней приема пероральные антикоагулянты могут вызывать временное парадоксальное состояние гиперкоагуляции. В связи с этим, а также исходя из необходимости 4–5-дневного периода для достижения адекватного антикоагулянтного эффекта, прием непрямых антикоагулянтов следует начинать уже с первых дней гепаринотерапии.
Из препаратов этой группы в Украине зарегистрированы варфарин, аценокумарол, фениндион. Эти препараты хорошо абсорбируются в кишечнике и при попадании в кровь связываются с белками плазмы крови (на 97–99%), метаболизируются в печени и затем экскретируются с мочой. Период полувыведения варфарина составляет 42 ч, аценокумарола — 9 ч, фениндиона — 5 ч. Установлено, что с увеличением периода полувыведения снижаются колебания антикоагулянтного эффекта и кратность приема препарата, в то же время увеличивается продолжительность действия препарата после его отмены, что становится актуальным в случае развития геморрагических осложнений. Период полувыведения варфарина позволяет назначать препарат 1 раз в сутки и обеспечивает незначительные колебания его антикоагулянтного эффекта. Поэтому именно варфарин получил наиболее широкое распространение в мировой клинической практике и успешно используется на протяжении уже более 50 лет.
Начальная доза варфарина у больных с ТЭЛА обычно составляет 5 мг. Существуют различные схемы насыщения варфарином, при этом наибольшее распространение получила схема, представленная в табл. 1.15.
Таблица 1.15
Схема насыщающей терапии варфарином (Kovacs M.J. et al., 2003)
| День | Показатель МНО (INR) | Доза варфарина, мг/сут |
| 1 | — | 5 |
| 2 | — | 5 |
| 3 | <1,5 | 10 |
| 1,5–1,9 | 5 | |
| 2,0–2,9 | 2,5 | |
| >3,0 | 0 | |
| 4 | <1,5 | 10 |
| 1,5–1,9 | 7,5 | |
| 2,0–2,9 | 5 | |
| >3,0 | 0 | |
| 5 | <2,0 | 10 |
| 2,0–2,9 | 5 | |
| >3,0 | 0 | |
| 6 | <1,5 | 10 |
| 1,5–1,9 | 7,5 | |
| 2,0–2,9 | 5 | |
| >3,0 | 0 |
Время появления противотромботического эффекта одинаково для всех непрямых антикоагулянтов и в среднем составляет 3–5 дней. Это связано с тем, что полноценное противотромботическое действие наступает только тогда, когда снижается концентрация всех четырех витамин К-зависимых факторов. При этом фактор VII, имеющий самый короткий период полувыведения, начинает исчезать из плазмы крови уже через несколько часов после начала приема препаратов. Именно эти наблюдения позволили отказаться от применения ударных доз непрямых антикоагулянтов для насыщения, которые не дают дополнительных преимуществ, а могут привести к резкому снижению уровня фактора VII в первые 48 ч, вызывая геморрагические осложнения и некрозы кожи.
Производные индандиона (фениндион) оказывают подобное кумаринам антикоагулянтное действие, но не должны быть препаратами первого ряда в связи с высокой частотой вызываемых ими побочных эффектов (многообразные кожные проявления и гепатотоксическое действие). Исключение составляют больные с гиперчувствительностью к производным кумарина и хорошо переносящие длительный прием индандионов.
На протяжении всего периода клинического применения непрямых антикоагулянтов основным методом контроля является определение протромбинового времени (ПВ). Этот метод основан на активации свертывания крови тканевым экстрактом — тромбопластином. В данную реакцию вовлекаются факторы «внешнего» каскада фибринообразования, содержание которых главным образом снижается под действием препаратов этого ряда.
Сегодня для активации свертывания крови или плазмы при выполнении данного теста используют около 30 тромбопластинов. Их получают из различных источников (трупный мозг человека, мозг кролика или быка и др.). Они различаются по чувствительности к изменениям свертывания крови под действием антикоагулянтов, в неодинаковой степени ингибируются PIVKA (белками, образующимися в отсутствие витамина К). Это определяет значительные расхождения в результатах исследований ПВ, проводимых различными лабораториями, и затрудняет выработку единого оптимального уровня гипокоагуляции. На основании предложения ВОЗ были прокалиброваны наиболее распространенные в мире тромбопластины и создана единая стандартная шкала выражения интенсивности гипокоагуляции (относительно Британского сравнительного тромбопластина). Единый показатель результатов определения ПВ получил название Международного нормализующего отношения (МНО). Для проверки уровня гипокоагуляции стали применять референтные плазмы, как приготовленные искусственно, так и полученные из крови больных, принимающих непрямые антикоагулянты. Установленные в процессе стандартизации тромбопластинов калибровочные константы, так называемый международный индекс чувствительности (МИЧ), позволили сравнивать результаты ПВ независимо от используемого тромбопластина. Как правило, в инструкции к тромбопластину сейчас указывают МИЧ, с помощью которого по формуле можно определить МНО: [МНО = (ПВ больного/ПВ донора)МИЧ].
После насыщения варфарином дальнейшую коррекцию дозы осуществляют в зависимости от МНО, которое должно оставаться на уровне 2,0–3,0.
Следует помнить, что целый ряд продуктов питания и лекарственных средств могут влиять на антикоагулянтный эффект варфарина, являясь источником поступления витамина К или влияя на метаболизм варфарина. Продукты, содержащие витамин К в большом количестве, и тем самым снижающие эффективность кумариновых производных, а также препараты, которые снижают/повышают их эффективность, представлены в табл. 1.16.
Таблица 1.16
Продукты питания и лекарственные средства, влияющие на эффективность пероральной антикоагулянтной терапии варфарином
| Продукты, содержащие большое количество витамина К | Лекарственные средства, изменяющие эффективность терапии варфарином | |
| Снижающие | Повышающие | |
|
|
|
Общая длительность лечения непрямыми антикоагулянтами должна составлять не менее 3 мес. В некоторых случаях, например, у больных с отчетливо выраженным гиперкоагуляционным синдромом, непрямые антикоагулянты применяют в течение года и более. Схема проведения антикоагулянтной терапии у больных с ТЭЛА представлена на рис. 1.23.
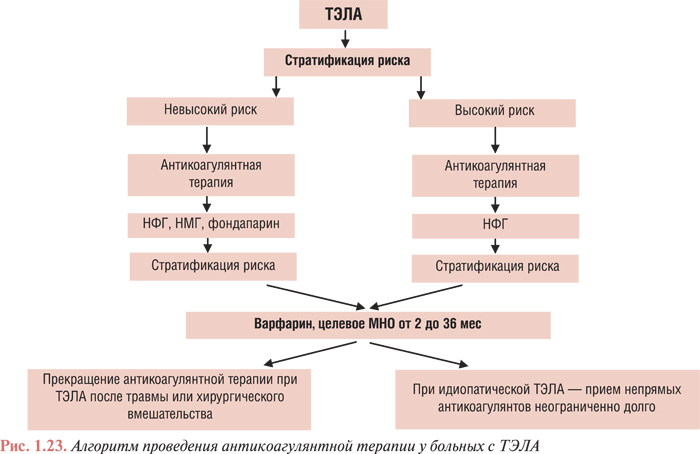
К наиболее частым осложнениям терапии непрямыми антикоагулянтами относятся кровотечения, поэтому их применение противопоказано пациентам с пептической язвой желудка и двенадцатиперстной кишки, неспецифическим язвенным колитом, геморрагическими диатезами и другими заболеваниями, характеризующимися повышенным риском геморрагий. При возникновении кровотечений на фоне приема непрямых антикоагулянтов необходимо отменить прием этих препаратов. Внутривенно вводят антагонист непрямых антикоагулянтов — витамин К в дозе 5–10 мг ежедневно. Следует помнить, что максимальную эффективность препарата отмечают только через 20–24 ч после введения. Поэтому при необходимости срочной остановки кровотечения следует провести трансфузию свежезамороженной плазмы крови в дозе 10–20 мл/кг, одновременно начав терапию витамином К.
Профилактика тромбоэмболических осложнений у больных, находящихся на лечении в стационаре
Профилактика ТЭЛА и тромбоза глубоких вен нижних конечностей является одной из основных задач в тактике ведения пациентов, находящихся на лечении в стационаре. Именно этот пункт занимает 1-е место среди 79 основных профилактических мероприятий, которые могут повысить безопасность больного, согласно последнему отчету Агентства по изучению качества здравоохранения США (The Agency for Healthcare Research and Quality, США). Однако несмотря на наличие эффективных и безопасных методов профилактики, использование их в повседневной клинической практике остается не на должном уровне. Парадоксально, но сегодня у больных терапевтического, а не хирургического, профиля чаще выявляют развитие тромбоза глубоких вен нижних конечностей, что объясняется, вероятно, более адекватной его профилактикой в хирургических клиниках. По данным Goldhaber и соавторов, у 33 из 100 больных, находившихся в отделении интенсивной терапии терапевтического профиля более 48 ч, при помощи УЗИ выявлен тромбоз глубоких вен нижних конечностей.
Вопрос о необходимости профилактики и выборе ее метода основывается на классификации больных по степени риска развития данных осложнений, а основные ее принципы заключаются в следующем:
- у каждого больного должна быть оценена степень риска развития тромбоэмболических осложнений;
- при установлении риска у всех больных необходимо проводить профилактику в зависимости от его степени;
- профилактику следует осуществлять до тех пор, пока имеется риск развития тромбоэмболических осложнений (табл. 1.17).
Таблица 1.17
Факторы риска венозных тромбоэмболических осложнений у госпитализированных больных
| Степень риска | Перечень факторов |
| Высокий |
|
| Вероятный |
|
| Возможный |
|
У пациентов, у которых выявлены факторы риска развития ТГВ, нужно ежедневно проводить осмотр нижних конечностей с определением симптомов Хоманса и Мозеса, а при необходимости — УЗИ вен нижних конечностей. С целью профилактики ТГВ/ТЭЛА проводят немедикаментозные (механические), медикаментозные мероприятия, возможна также их комбинация у больных с высоким риском.
Немедикаментозные меры профилактики включают раннюю активизацию больных в послеоперационный период, при ИМ, инсульте головного мозга; эластическую компрессию ног (эластические бинты, противотромбозные чулки и гольфы, прерывистая пневматическая компрессия).
Наложение эластичных бинтов проводят при поступлении больного, поскольку пребывание в стационаре всегда связано с ограничением двигательной активности. Бинт растягивают в начале каждого тура и накладывают от уровня плюснефаланговых суставов в положении стопы под прямым углом к голени и ее супинации, захватывая половину ширины предыдущего тура и постепенно снижая компрессию от лодыжек до верхней трети бедра. Следует стремиться, чтобы давление, оказываемое бинтом, составляло в нижней-средней трети голени 15–20 мм рт. ст., на уровне нижней трети бедра — 8–10 мм рт. ст. Проще в использовании и эффективнее специальные чулки дозированной компрессии, самостоятельно обеспечивающие необходимый градиент давления. Однако требуется предварительный их подбор, и они не всегда обеспечивают адекватную степень компрессии в ближайший послеоперационный период. Чулки дозированной компрессии создают градиент давления до 30–40 мм рт. ст. с максимальным давлением в области носка и минимальным — в области бедра, что сопровождается уменьшением (примерно на 70%) объема венозного сосудистого русла и повышением скорости венозного кровотока в нижних конечностях. Применение чулок дозированной компрессии после полостных, гинекологических и нейрохирургических вмешательств позволяет снизить риск тромбоза глубоких вен более чем в 3 раза, а также наряду с использованием НМГ является наиболее эффективным методом профилактики у больных после операций на тазобедренном суставе. Возможно применение перемежающейся пневматической компрессии ног, для проведения которой используют специальное устройство. Эластическая компрессия нижних конечностей помимо ускорения венозного кровотока и уменьшения стаза крови приводит к стимуляции эндогенных фибринолитических механизмов за счет незначительного повреждения клеток эндотелия, а также изменения реологических характеристик и перфузионного давления в сосудах нижних конечностей. Проводить эластическую компрессию следует до восстановления обычного двигательного режима больного, продолжая ее в амбулаторных условиях.
Важную роль играет лечебная физкультура (ЛФК), занятия которой также проводят у всех без исключения больных. ЛФК приводит к увеличению объемной скорости кровотока и оттока по венам, являясь важным фактором профилактики тромбозов. Кроме того, регулярная физическая активность является одним из стимуляторов синтеза и высвобождения в кровоток простациклина, снижающего вероятность пристеночного тромбообразования. Применяют и другие средства неспецифической профилактики, направленные на активизацию кровотока в нижних конечностях. Определенный эффект может дать горизонтальное положение больного с приподнятыми голенями (чтобы угол сгибания в коленных и тазобедренных суставах составлял 20–30°). Эффективна также интраоперационная электромиостимуляция, требующая наличия специальной аппаратуры, поэтому она пока не получила широкого распространения.
Методы фармакологической профилактики
С целью медикаментозной профилактики применяют антикоагулянтную (нефракционированный гепарин/НМГ, фондапаринукс натрий, непрямые антикоагулянты) и антиагрегантную терапию.
Большой шаг вперед в отношении предупреждения ТГВ/ТЭЛА был сделан после появления НМГ, а впоследствии и фондапаринукса натрия. В трех рандомизированных двойных слепых плацебо-контролируемых исследованиях у больных нехирургического профиля было установлено, что использование НМГ (эноксапарина натрия или дальтепарина натрия) или синтетического пентасахарида (фондапаринукса натрия) 1 раз в сутки является безопасным и позволяет практически наполовину снизить риск тромбоза глубоких вен по сравнению с плацебо. Основные данные этих исследований приведены в табл. 1.18.
Таблица 1.18
Основные исследования по профилактике тромбоэмболических осложнений у больных нехирургичесого профиля
| MEDENOX | PREVENT | ARTEMIS | |
| Количество пациентов, включенных в исследование | 1102 | 3706 | 849 |
| Препарат | Эноксапарин натрий | Дальтепарин натрий | Фондапаринукс натрий |
| Режим дозирования | 20 мг в сутки
40 мг в сутки |
5000 МЕ в сутки | 2,5 мг в сутки |
| Длительность терапии, дни | 6–14 дней | 14 дней | 6–14 дней |
| Диагностика ТГВ | Венография | УЗИ | Венография |
| Первичная конечная точка | Тромбоэмболические осложнения | Тромбоэмболические осложнения + внезапная смерть | Тромбоэмболические осложнения |
| Период наблюдения | 3 мес | 90 дней (первичную конечную точку оценивали на 21-й день) | 32 дня (первичную конечную точку оценивали на 15-й день) |
| Снижение риска развития первичной конечной точки, % | 63 (в дозе 40 мг в сутки) | 45 | 49 |
| Большие кровотечения (препарат), % | 1,7 | 0,5 | 0,2 |
| Большие кровотечения (плацебо), % | 1,1 | 0,2 | 0,2 |
При этом в исследовании ARTEMIS терапия фондапаринуксом натрия приводила к достоверному снижению частоты фатальной ТЭЛА (р=0,029), а также отмечена тенденция к снижению общей смертности в группе, получавшей фондапаринукс натрий через 32 дня наблюдения (табл. 1.19).
Таблица 1.19
Результаты исследования ARTEMIS
| Фондапаринукс натрий (n=425) | Плацебо (n=414) | |
| Фатальная ТЭЛА | 3 (0,7%) | 7 (1,7%) |
| Фатальное кровотечение | 2 (0,5%) | 1 (0,2%) |
| Смерть, не связанная с ТЭЛА или кровотечением | 9 (2,1%) | 17 (4,1%) |
| Общая смертность | 14 (3,3%) | 25 (6,0%) |
В течение длительного времени с целью профилактики тромбоэмболических осложнений применяли нефракционированный гепарин в дозе 5000 МЕ 2–3 раза в сутки. Однако данные различных исследований относительно эффективности и безопасности нефракционированного гепарина противоречивы. В 2003 г. обнародованы результаты исследования THE-PRINCE, в котором было установлено, что введение нефракционированного гепарина в дозе 5000 МЕ 3 раза в сутки по эффективности и безопасности эквивалентно 40 мг эноксапарина натрия 1 раз в сутки.
Больным хирургического профиля антикоагулянтную терапию и механическую профилактику тромбоза глубоких вен следует проводить в зависимости от вида хирургического вмешательства (табл. 1.20).
Таблица 1.20
Рекомендации по медикаментозной и немедикаментозной профилактике тромбоэмболических осложнений у больных хирургичесого профиля
| Профиль больных | Методы антикоагулянтной профилактики | Методы механической профилактики |
| Общая хирургия |
|
|
| Ортопедия |
|
|
| Нейрохирургия |
|
Чулки дозированной компрессии/прерывистая пневматическая компрессия |
| Онкологическая хирургия | Эноксапарин натрий 40 мг 1 раз в сутки подкожно | |
| Торакальная хирургия | Нефракционированный гепарин 5000 МЕ 3 раза в сутки подкожно | Чулки дозированной компрессии/прерывистая пневматическая компрессия |
| Терапевтический профиль |
|
Чулки дозированной компрессии/прерывистая пневматическая компрессия:
|
Длительность лечения нефракционированным гепарином/НМГ — не менее 7–10 дней (до полной мобилизации пациента). При ургентных операциях, а также при опасности возникновения интраоперационного кровотечения гепаринотерапию начинают после завершения вмешательства, но не позже, чем через 12 ч. Во время операции используют средства ускорения венозного кровотока. В случае применения спинальной или эпидуральной анестезии при назначении НМГ соблюдают такие правила (рекомендации FDA США): 1) спинальную пункцию можно проводить только через 10–12 ч после введения начальной профилактической дозы НМГ; 2) перед началом введения гепарина, если возможно, следует удалить спинальный катетер; 3) если катетер остается на месте, его удаляют через 10–12 ч после последней инъекции НМГ и за 2 ч до следующей; 4) необходимо отложить применение антикоагулянтов при травматичной спинальной/ эпидуральной пункции; 5) следует соблюдать осторожность при применении НПВП.
Введение нефракционированного гепарина/ НМГ с профилактической целью отменяют, как правило, без последующего назначения непрямых антикоагулянтов.
Вторичная профилактика ТГВ/ТЭЛА. Всем пациентам, перенесшим ТГВ/ТЭЛА, показано лечение непрямыми антикоагулянтами:
- при первичном эпизоде ТГВ/ТЭЛА, причина развития которых установлена, продолжительность лечения должна составлять 3 мес;
- при первичном эпизоде идиопатического ТГВ длительность терапии — 3–6 мес (у больных моложе 50 лет необходимо исключить наличие тромбофилии);
- при первичном эпизоде ТГВ/ТЭЛА у лиц с тромбофилией лечение необходимо проводить пожизненно;
- при повтором развитии ТГВ/ТЭЛА, за исключением случаев транзиторного существования их явной причины, лечение проводят пожизненно;
- при терапевтическом значении МНО 2,0–3,0 основными методами хирургической профилактики являются тромбэктомия, в том числе с использованием эндоваскулярных методов, перевязка магистральных вен (бедренной вены ниже устья глубокой вены бедра), пликация нижней полой вены и имплантация кава-фильтра (КФ). В настоящее время наиболее широко применяют чрескожную имплантацию КФ, показаниями к которой являются:
- наличие противопоказаний к антикоагулянтной терапии или тяжелые геморрагические осложнения при ее применении;
- рецидив ТЭЛА или проксимальное распространение флеботромбоза на фоне адекватной антикоагулянтной терапии;
- тромбоэмболэктомия из ЛА;
- протяженный флотирующий тромб в илео-кавальном венозном сегменте;
- ТГВ/ТЭЛА у больных с низким кардиопульмональным резервом и тяжелой легочной гипертензией;
- высокий риск развития ТГВ/ТЭЛА (обширные оперативные вмешательства, переломы костей и позвоночника) у больных, перенесших ТЭЛА;
- ТЭЛА у беременных (как дополнение к терапии гепарином или при наличии противопоказаний к применению антикоагулянтов);
- безуспешность ранее использованных методов лечения ТГВ/ТЭЛА;
- тромбэндартерэктомия, проведенная больным с постэмболической легочной гипертензией;
- ТГВ/ТЭЛА у больных, перенесших трансплантацию почки или сердца.
Противопоказаниями к имплантации КФ являются: тяжелая коагулопатия при наличии риска возникновения кровотечения; обструктивный тромбоз той части вены, в которую должен быть имплантирован КФ; септическая эмболизация и септикопиемия. При септической тромбоэмболии КФ не препятствует прохождению мелких бактериальных эмболов, поэтому в таких случаях прибегают к перевязке нижней полой вены. При септическом тромбофлебите малого таза, кроме того, перевязывают левую яичниковую вену. Техника выполнения чрескожной имплантации КФ различных конструкций (зонтичный Мобина — Уддина, Гринфильда, Амплатца, «птичье гнездо», «тюльпан Гюнтера», РЭПТЭЛА, «песочные часы») имеет много общего. Имплантацию КФ производят в рентгеноперационной. Для оценки состояния нижней полой вены и получения информации об эмбологенности тромба вначале осуществляют ретроградную или антеградную илеокаваграфию. Выбор доступа (ретроградный — яремный, подключичный; антеградный — бедренный) зависит от предполагаемой локализации тромба: проведение катетера через тромбированные вены может привести к фрагментации тромба с развитием ТЭЛА.
КФ имплантируют непосредственно ниже устьев почечных вен. При низком положении фильтра вследствие образования между ним и устьями почечных вен мертвого пространства повышается риск тромбообразования и развития ТЭЛА. После имплантации КФ проводят контрольную рентгенографию для установления его месторасположения. В течение 2 суток больному показан постельный режим; назначают антибиотики на 5–6 дней, проводят лечение гепарином. Противоэмболические КФ надежно предотвращают ТЭЛА: частота развития послеоперационной эмболии не превышает 1,2%. Результаты рандомизированного клинического исследования PREPIC, в ходе которого оценивали ранние и отдаленные последствия применения КФ с целью профилактики развития ТЭЛА у больных с проксимальным ТГВ, свидетельствуют, что имплантация КФ предупреждает развитие ТЭЛА в течение первых 12 суток, но повышает риск возникновения ТГВ в течение следующих 2 лет. За время наблюдения смертность в обеих группах была одинаковой. С учетом результатов этого исследования перспективным следует признать применение таких конструкций КФ, которые можно извлекать из нижней полой вены по мере ликвидации угрозы развития ТЭЛА. В настоящее время в клинической практике с успехом используют съемный кава/фильтр «Зонтик».
ЛИТЕРАТУРА
- Adapted from Goldhaber S.Z., Visani L., De Rosa M., for ICOPER (1999) Acute pulmonary embolism: Clinical outcomes in the International Cooperative Pulmonary Embolism Registry (ICOPER). Lancet 353: 1386.
- Snow V,, Quaseem A., Barry P. et al. Management of Venous Thromboembolism: A Clinical Practice Guideline from the American College of Physicians and the American Academy of Family Physicians. Ann. Fam. Med, Jan 2007; 5: 74-80.
- Fleischner F.G.: Observations on the radiologic changes in pulmonary embolism. In Sasahara A.A., and Stein M. (eds.): Pulmonary Embolic Disease. New York, Grune & Stratton, 1965, p 312.
- Greenspan R.H. (1994) Pulmonary angiography and the diagnosis of pulmonary embolism. Prog. cardiovasc. dis, Vol. 37, 2: 93-106.
- Gregory Elliott C., Goldhaber Samuel Z., Luigi Visani and Marisa DeRosa Chest Radiographs in Acute Pulmonary Embolism (2000) Results From the International Cooperative Pulmonary Embolism Registry. Chest, 118: 33-38
- Grifoni S., Vanni S., Magazzini S. et al. (2006) Association of Persistent Right Ventricular Dysfunction at Hospital Discharge After Acute Pulmonary Embolism With Recurrent Thromboembolic Events. Arch Intern Med., October 23, 166: 2151-2156.
- Kovacs M.J., Rodger M., Anderson D.R. et al. Comparison of 10-mg and 5-mg warfarin initiation nomograms together with low-molecular-weight heparin for outpatient treatment of acute venous thromboembolism. A randomized, double-blind, controlled trial. Ann Intern Med 2003; 138:715.
- Kucher N., Goldhaber S.Z. (2003) Cardiac biomarkers for risk stratification of patients with acute pulmonary embolism. Circulation, 108: 2191-2194.
- Kucher N., Rossi E., De Rosa M., Goldhaber S.Z. (2005) Prognostic Role of Echocardiography Among Patients With Acute Pulmonary Embolism and a Systolic Arterial Pressure of 90 mm Hg or Higher. Arch Intern Med., August 8, 165: 1777-1781.
- Kucher N., Rossi E., De Rosa M. et al. (2006) Massive Pulmonary Embolism. Circulation, Jan. 31, 113: 577-582.
- Le Gal G., Righini M., Roy P.-M. et al. (2006) Prediction of Pulmonary Embolism in the Emergency Department: The Revised Geneva Score. Ann Intern Med. Feb., 7, 144: 165-171.
- Le Gal G., Righini M., Roy P.-M. et al. (2006) Value of D-Dimer Testing for the Exclusion of Pulmonary Embolism in Patients With Previous Venous Thromboembolism. Arch Intern Med., Jan. 23, 166: 176-180.
- Lesser B.A., Leeper K.V., Stein P.D. et al. (1992) The diagnosis of acute pulmonary embolism in patients with chronic obstructive pulmonary disease. Chest, 102: 17-22.
- Lobo J.L., Zorrilla V., Aizpuru F. et al. (2006) Clinical Syndromes and Clinical Outcome in Patients With Pulmonary Embolism. Findings From the RIETE Registry. Chest. December,130: 1817-1822.
- Ribeiro A., Lindmarker P., Johnsson H. et al. (1999) Pulmonary embolism: one-year follow-up with echocardiography doppler and five-year survival analysis. Circulation, 99: 1325-1330.
- Stein P., Athanasoulis C., Alavi A. et al. (1992) Complications and Validity of Pulmonary Angiography in Acute Pulmonary Embolism. Circulation, 85: 462-468.
- Task Force Report (2000) Guidelines on diagnosis and management of acute pulmonary embolism. European Society of Cardiology. Europ. Heart J., Vol. 21: 1301-1336.
- Thabut G., et al. Thrombolytic therapy of pulmonary embolism: A meta-analysis. J. Am. Coll. Cardiol. 2002;40;1660-1667.
- The PIOPED investigators: value of the ventilation/per/ fusion scan in acute pulmonary embolism (1990) J.A.M.A, Vol. 263: 2753-275.
- The PISA-PED Investigators (1996) Value of perfusion lung scan in the diagnosis of pulmonary embolism: results of the prospective study of acute pulmonary embolism diagnosis (PISA-PED). Am J Respir Crit Care Med, 154: 1387-1393.
- van Strijen M.J., de Monye W., Schiereck J. et al. (2003) Single-detector helical computed tomography as the primary diagnostic test in suspected pulmonary embolism: a multicenter clinical management study of 510 patients. Ann Intern Med., 138: 307-314.
- Wells P.S., Anderson D.R., Rodger M. et al. (2000) Derivation of a simple clinical model to categorize patients probability of pulmonary embolism: Increasing the models utility with the SimpliRED D-dimer. Thromb Haemost, 83:416.
- Wells P.S., Hirsh J., Anderson D.R. et al. (1995) Accuracy of clinical assessment of deep-vein thrombosis. Lancet, Vol. 345: 1326-1330.
- Wicki J., Perrier A., Perneger T.V. et al. (2000) Predicting adverse outcome in patients with acute pulmonary embolism: A risk score. Thromb Haemost, 84: 548.