Фазлодекс раствор для инъекций 250 мг шприц 5 мл №2
Фазлодекс инструкция по применению
Состав
Фулвестрант - 50 мг/мл
Фармакологические свойства
фармакодинамика
Механизм действия и фармакодинамические эффекты
Фулвестрант — конкурентный антагонист эстрогеновых рецепторов (ЭР), сродство к которым сравнимо с эстрадиолом. Фулвестрант блокирует трофическое действие эстрогенов, не проявляя частичной агонистической (эстрогеноподобной) активности. Механизм действия связан с отрицательной регуляцией уровня белков ЭР. Клинические исследования с участием женщин в период постменопаузы с первичным раком молочной железы показали, что фулвестрант по сравнению с плацебо значительно снижает уровень белков ЭР при опухолях с положительными ЭР. Наблюдалось также значительное уменьшение экспрессии прогестероновых рецепторов, что согласуется с отсутствием характерных агонистам эстрогенов эффектов. Также показано, что фулвестрант в дозе 500 мг в большей степени, чем фулвестрант в дозе 250 мг, подавляет ЭР и маркер пролиферации Ki67 в опухолях молочной железы при неоадъювантном лечении женщин в период постменопаузы.
Клиническая безопасность и эффективность применения на поздних стадиях рака молочной железы
Два клинические исследования 3-й фазы были проведены в целом с участием 851 женщины в период постменопаузы с поздними стадиями рака молочной железы, у которых отмечали рецидив заболевания на фоне или после адъювантной гормональной терапии или прогрессирование после гормональной терапии по поводу поздних стадий заболевания. 77% популяции исследования болели раком молочной железы с положительными ЭР. В ходе этих исследований сравнивали безопасность и эффективность ежемесячного введения Фазлодекса в дозе 250 мг с ежедневным введением 1 мг анастрозола (ингибитора ароматазы). В целом Фазлодекс в ежемесячной дозе 250 мг был по крайней мере столь же эффективным, как анастрозол, в отношении выживаемости без прогрессирования (ВБП) заболевания, объективного ответа и времени до смерти. Между двумя группами лечения не было статистически значимой разницы в одной из этих конечных точек. Главной конечной точкой была ВБП заболевания. Объединенный анализ обоих исследований показал, что прогрессирование наблюдалось у 83% пациенток, получавших Фазлодекс по сравнению с 85% пациенток, получавших анастрозол. В ходе объединенного анализа обоих исследований было установлено, что соотношение рисков для Фазлодекса в дозе 250 мг и анастрозола по параметру ВБП заболевания составило 0,95 (95% ДИ 0,82–1,10). Уровень объективного ответа для Фазлодекса в дозе 250 мг составил 19,2% по сравнению с 16,5% для анастрозола. Медиана времени до смерти составила 27,4 мес для пациенток, получавших Фазлодекс, и 27,6 мес для пациенток, получавших анастрозол. Соотношение рисков Фазлодекса в дозе 250 мг и анастрозола по времени до смерти составило 1,01 (95% ДИ 0,86–1,19).
Клиническое исследование 3-й фазы CONFIRM проведено с участием 736 женщин в постменопаузальный период с поздними стадиями рака молочной железы, у которых отмечали рецидив заболевания на фоне или после адъювантной гормональной эндокринной терапии или прогрессирования после гормональной терапии по поводу поздних стадий заболевания. В исследование были включены 423 пациентки, у которых болезнь прогрессировала или отмечался рецидив на фоне антиэстрогеновой терапии (подгруппа АЭ), и 313 пациенток, у которых болезнь прогрессировала или рецидивировала на фоне лечения ингибитором ароматазы (подгруппа АИ). В ходе этого исследования сравнивали эффективность и безопасность Фазлодекса в дозе 500 мг (n=362) с Фазлодексом в дозе 250 мг (n=374). Главной конечной точкой была ВБП, ключевые вторичные конечные точки эффективности включали частоту объективного ответа (ЧОО), частоту клинической эффективности (ЧКЭ) и общую выживаемость (ОВ). Результаты эффективности для исследования CONFIRM приведены ниже в табл. 1.
Таблица 1. Обобщенные результаты главной конечной точки эффективности (время до прогрессирования заболевания) и ключевых второстепенных точек в исследовании CONFIRM
| Переменная | Тип оценки: сравнение лечения | Фазлодекс 500 мг (n=362) | Фазлодекс 250 мг (n=374) | Сравнение между группами Фазлодекс 500 мг/Фазлодекс 250 мг | ||
|---|---|---|---|---|---|---|
| Соотношение рисков | 95% ДИ | р | ||||
| ВБП | Медиана К–М (мес); соотношение рисков | |||||
| Все пациенты | 6,5 | 5,5 | 0,8 | 0,68 0,94 | 0,006 | |
| подгруппа АЭ (n=423) | 8,6 | 5,8 | 0,76 | 0,62 0,94 | 0,013 | |
| подгруппа АИ (n=313)a | 5,4 | 4,1 | 0,85 | 0,67 1,08 | 0,195 | |
| ОВb | Медиана К–М (мес); соотношение рисков | |||||
| Все пациенты | 26,4 | 22,3 | 0,81 | 0,69 0,96 | 0,016с | |
| подгруппа АЭ (n=423) | 30,6 | 23,9 | 0,79 | 0,63 0,99 | 0,038с | |
| подгруппа АИ (n=313)a | 24,1 | 20,8 | 0,86 | 0,67 1,11 | 0,241с | |
| Переменная | Тип оценки; сравнение лечения | Фазлодекс 500 мг (n=362) | Фазлодекс 250 мг (n=374) | Сравнение между группами Фазлодекс 500 мг/Фазлодекс 250 мг | ||
| Абсолютная разница в% | 95% ДИ | |||||
| ЧООd | Доля пациентов с ОВ; абсолютная разница в% | |||||
| Все пациенты | 13,8 | 14,6 | –0,8 | –5,8 6,3 | ||
| подгруппа АЭ (n=296) | 18,1 | 19,1 | –1,0 | 8,2 –9,3 | ||
| подгруппа АИ (n=205)a | 7,3 | 8,3 | –1,0 | –5,5 9,8 | ||
| ЧКЭе | Доля пациентов с КЭ; абсолютная разница в% | |||||
| Все пациенты | 45,6 | 39,6 | 6,0 | –1,1 13,3 | ||
| подгруппа АЭ (n=423) | 52,4 | 45,1 | 7,3 | –2,2 16,6 | ||
| подгруппа АИ (n=313)a | 36,2 | 32,3 | 3,9 | –6,1 15,2 | ||
аФазлодекс показан пациенткам, у которых болезнь рецидивировала или прогрессировала на фоне антиэстрогеновой терапии. Результаты в подгруппе АИ не являются окончательными.
bЗначение ОВ представлено для окончательного анализа выживаемости при 75% обработке.
сНоминальное р-значение без каких-либо корректировок, сделанных для повторяемости между первичными анализами общей выживаемости при 50% обработке и обновленными анализами выживаемости при 75% обработке.
dЧОО проанализирована у пациенток, ответ которых оценивался на исходном уровне (то есть у них отмечали проявления заболевания, которые можно было оценить на исходном уровне: 240 пациенток в группе применения Фазлодекса в дозе 500 мг и 261 пациентка в группе применения Фазлодекса в дозе 250 мг).
eПациенты с лучшим объективным ответом, полным ответом, частичным ответом или стабилизацией заболевания в течение ≥24 нед.
ОО — объективный ответ; КЭ — клиническая эффективность; К–М: Каплан–Мейер; ДИ — доверительный интервал; АИ — ингибитор ароматазы; АЭ — антиэстрогены.
Были проведены рандомизированные двойные слепые с двойной маскировкой мультицентровые исследования 3-й фазы по изучению эффективности Фазлодекса 500 мг по сравнению с анастрозолом 1 мг у женщин в период постменопаузы с местно-распространенным или метастатическим раком молочной железы с положительными эстроген- и или прогестерон-рецепторами, которые ранее не получали гормонотерапии. В общем 462 пациентки были последовательно рандомизированы 1:1 в группу фулвестранта 500 мг и анастрозола 1 мг.
Рандомизация была стратифицирована по признакам заболевания (местно-распространенный рак или метастатический), предварительно проведенной химиотерапии в случае распространенного заболевания и клиническим проявлениям заболевания.
Первичной конечной точкой эффективности была ВБП, по оценке исследователя в соответствии с RECIST1.1 (Response Evaluation Criteria in Solid Tumors). Ключевыми вторичными точками эффективности были приняты ОВ и ЧОО.
Медиана возраста пациенток, вовлеченных в это исследование, составляла 63 года (в диапазоне от 39 до 90 лет). У большинства пациенток (87,0%) наблюдалась метастатическая форма заболевания в начале исследования. У 55% пациенток отмечали метастазы во внутренние органы в начале исследования. В общем 17,1% пациенток получали химиотерапию ранее в связи с распространенным заболеванием; у 84,2% пациенток были измеряемые проявления заболевания.
Достоверные результаты наблюдались у большинства пациенток с предварительно определенных подгрупп. В подгруппе пациенток с метастазами не во внутренние органы (n=208), получавших Фазлодекс, ОР составило 0,592 (95% ДИ=0,419–0,837) по сравнению с пациентками, которые получали анастрозол. В подгруппе пациенток с метастазами во внутренние органы (n=254), получавших Фазлодекс 500 мг, ОР составил 0,993 (95% ДИ=0,740–1,331) по сравнению с пациентками, которые получали анастрозол. Результаты эффективности исследования FALCON приведены в табл. 2 и на рисунке.
Таблица 2. Обобщение результатов анализа главной конечной точки эффективности (ВБП) и ключевых вторичных конечных точек эффективности в исследовании FALCON (оценка исследователем, выборка «все рандомизированные пациенты согласно назначенному лечению»)
| Фазлодекс 500 мг (n=230) | Анастрозол 1 мг (n=232) | |
|---|---|---|
| ВБП | ||
| Количество случаев ВБП (%) | 143 (62,2%) | 166 (71,6%) |
| ВБП ОР (95% ДИ) и р-значения | ОР=0,797 (0,637–0,999) р=0,0486 | |
| ВБП в серднем [месяц (95% ДИ)] | 16,6 (13,8, 21,0) | 13,8 (12,0, 16,6) |
| Количество случаев ЗВ* | 67 (29,1%) | 75 (32,3%) |
| ОВ ОР (95% ДИ) та р-значения | ОР=0,875 (0,629–1,217) р=0,4277 | |
| ЧОО** | 89 (46,1%) | 88 (44,9%) |
| ЧОО ОР (95% ДИ) та р-значения | ОР=1,074 (0,716–1,614) р=0,7290 | |
| Медиана продолжительности ответа (месяцев) | 20,0 | 13,2 |
| ЧКЭ | 180 (78,3%) | 172 (74,1%) |
| ЧКЭ ОР (95% ДИ) та p-значения | ОР=1,253 (0,815–1,932) р=0,3045 | |
*(31% обработка) — не финальный анализ ЗВ.
**Для пациенток с измеряемыми проявлениями болезни.
Рисунок. Кривая ВБП по К–М (оценка исследователя, выборка «все рандомизированные пациенты согласно назначенному лечению») — исследование FALCON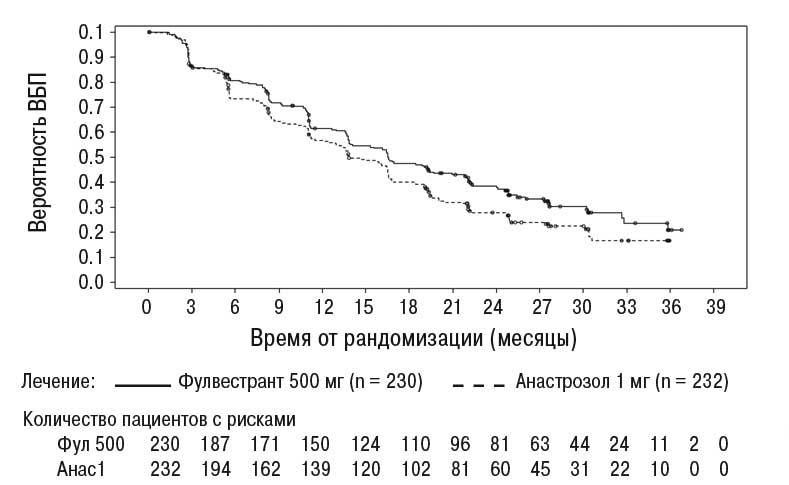
Влияние на эндометрий в постменопаузальный период
Доклинические данные свидетельствуют об отсутствии стимулирующего влияния фулвестранта на эндометрий в постменопаузальный период. Двухнедельное исследование с участием здоровых добровольцев в постменопаузальный период, которым вводили этинилэстрадиол по 20 мкг/сут, показало, что по сравнению с предыдущим применением плацебо предварительное лечение Фазлодексом в дозе 250 мг приводило к значительному уменьшению стимулирующего влияния на эндометрий в постменопаузальный период по данным ультразвукового измерения толщины эндометрия.
Неоадъювантное лечение продолжительностью до 16 нед у больных раком молочной железы, получавших лечение или Фазлодексом в дозе 500 мг, или Фазлодексом в дозе 250 мг, не приводило к клинически значимым изменениям в толщине эндометрия, что указывало на отсутствие агонистического влияния. В настоящее время нет доказательств отрицательного влияния на эндометрий при лечении пациенток с раком молочной железы. Нет доступных данных относительно морфологической структуры эндометрия.
В двух кратковременных исследованиях (1 и 12 нед) с участием пациенток в период пременопаузы с доброкачественными гинекологическими заболеваниями между группами фулвестранта и плацебо не наблюдалось статистически значимых различий толщины эндометрия по данным ультразвукового исследования.
Влияние на кости
Долгосрочные данные о влиянии фулвестранта на кости отсутствуют.
Неоадъювантное лечение продолжительностью до 16 нед у больных раком молочной железы, получавших лечение или Фазлодексом в дозе 500 мг, или Фазлодексом в дозе 250 мг, не приводило к клинически значимым изменениям в уровнях маркеров костного ремоделирования в плазме крови.
Педиатрическая популяция. Фазлодекс не показан для применения у детей.
В открытом исследовании 2-й фазы исследовали безопасность, эффективность и фармакокинетику фулвестранта у 30 девочек в возрасте 1 года — 8 лет с нарастающим преждевременным половым созреванием, связанным с синдромом Олбрайта — Мак-Кьюна — Штернберга (MAS). Дети получали ежемесячно в/м 4 мг/кг массы тела фулвестранта. В этом 12-месячном исследовании изучали спектр конечных точек по эффективности применения препарата при MAS. Результаты исследования показали снижение частоты вагинальных кровотечений и снижение темпов созревания костного возраста. Минимальные равновесные концентрации фулвестранта у детей в этом исследовании соотносились с концентрациями препарата у взрослых (см. Фармакокинетика). Новых вопросов, связанных с безопасностью применения препарата, не возникло в ходе проведения этого небольшого исследования, однако пятилетние данные еще недоступны.
Фармакокинетика. Всасывание. После введения Фазлодекса в виде в/м инъекции пролонгированного действия фулвестрант медленно абсорбируется, а Cmax достигается через 5 дней. При режиме введения Фазлодекса в дозе 500 мг уровни экспозиции равновесного состояния или близкие к нему достигаются в течение 1-го месяца лечения (среднее значение [коэффициент вариации]: AUC 475 [33,4%] нг∙сут/мл, Cmax 25,1 [35,1%] нг/мл, Cmin 16,3 [25,9%] нг/мл соответственно). В равновесном состоянии концентрация фулвестрана в плазме крови сохраняется в пределах относительно узкого диапазона с примерно трехкратной разницей между максимальной и низкой концентрацией. После в/м введения в диапазоне дозирования от 50 до 500 мг экспозиция приблизительно пропорциональна дозе.
Распределение. Фулвестрант экстенсивно и быстро распределяется. Значительный кажущийся объем распределения в равновесном состоянии (Vdss), что составляет примерно 3–5 л/кг массы тела, свидетельствует о преимущественно экстраваскулярном распределении. Фулвестранту присуща высокая степень (99%) связывания с белками плазмы крови. Главными связующими компонентами являются фракции ЛПОНП, ЛПНП и ЛПВП. Исследований взаимодействия в отношении конкурентного связывания белков не проводили. Роль глобулина, связывающего половые гормоны, не установлена.
Биотрансформация фулвестранта полностью не изучена, но включает комбинацию многочисленных возможных метаболических путей биотрансформации эндогенных стероидов. Идентифицированные метаболиты (включая метаболиты 17-кетон, сульфон, 3-сульфат, 3- и 17-глюкуронид) в антиэстрогенных моделях более или менее активны либо демонстрируют подобную фулвестранту активность. Исследования с применением препаратов человеческой печени и рекомбинантных человеческих ферментов показывают, что CYP 3A4 является единственным изоферментом Р450, участвующим в окислении фулвестранта; однако считается, что in vivo преобладают не связанные с Р450 пути. In vitro данные свидетельствуют, что фулвестрант не ингибирует изоферменты CYP 450.
Выведение. Фулвестрант выводится преимущественно в метаболизированной форме. Основной путь выведения — с калом, при этом <1% выводится с мочой. Фулвестрант имеет высокий клиренс, 11±1,7 мл/мин/кг, что свидетельствует о высоком печеночном коэффициенте экстракции. Конечный Т½ после введения определяется скоростью всасывания и оценен в 50 дней.
Отдельные категории пациентов. При популяционном фармакокинетическом анализе данных исследований 3-й фазы не выявлено различий в фармакокинетическом профиле фулвестранта в силу возраста (диапазон от 33 до 89 лет), массы тела (от 40 до 127 кг) или расовой принадлежности.
Почечная недостаточность. Степень влияния легкой или умеренной почечной недостаточности на фармакокинетику фулвестранта не имеет клинически существенного значения.
Печеночная недостаточность. Фармакокинетику фулвестранта оценивали в клиническом исследовании с использованием однократной дозы, проведенном с участием пациенток с легкой и умеренной печеночной недостаточностью (классы А и В по Чайлд — Пью). Непродолжительно применялась высокая доза препарата для инъекций. По сравнению со здоровыми лицами у пациенток с печеночной недостаточностью наблюдалось увеличение AUC в 2,5 раза. Ожидается, что увеличение экспозиции до такой величины у пациенток, которым вводится Фазлодекс, будет хорошо переноситься. Пациенток с тяжелой печеночной недостаточностью (класс С по Чайлд — Пью) не оценивали.
Педиатрическая популяция. Фармакокинетику фулвестранта оценивали в клиническом исследовании, проведенном с участием 30 девочек с нарастающим преждевременным половым созреванием, связанным с синдромом MAS (см. Фармакодинамика). Пациенты педиатрического профиля были в возрасте 1 года — 8 лет и получали в/м фулвестрант в дозе 4 мг/кг/мес. Геометрическая средняя (стандартное отклонение) минимальная концентрация в равновесном состоянии (Cmin, ss) и AUCss составляли 4,2 (0,9) нг/мл и 3680 (1020) нг·ч/мл соответственно. Хотя полученные данные ограничены, равновесные минимальные концентрации фулвестранта у детей, вероятно, согласуются с таковыми у взрослых.
Показания Фазлодекс
Фазлодекс показан для лечения рака молочной железы с эстроген-положительными рецепторами, местно-распространенного или с метастазами у женщин в период постменопаузы:
- ранее не получавших гормональную терапию;
- в случае рецидива болезни во время или после адъювантной антиэстрогенной терапии или прогрессирования заболевания при антиэстрогенной терапии.
Применение Фазлодекс
дозирование. Взрослые женщины (включая лиц пожилого возраста). Рекомендованная доза составляет 500 мг с интервалом 1 мес, через 2 нед после первой инъекции вводят дополнительную дозу 500 мг.
Отдельные категории пациентов. Нарушение функции почек. При легкой или средней тяжести (клиренс креатинина ≥30 мл/мин) коррекции дозы не требуется. Эффективность и безопасность лекарственного средства не оценивали для пациентов с тяжелой почечной недостаточностью (клиренс креатинина <30 мл/мин), поэтому у таких больных препарат применяют с осторожностью (см. ОСОБЫЕ УКАЗАНИЯ).
Нарушение функции печени. Коррекции дозы для пациенток с легкой и умеренной печеночной недостаточностью не требуется. Однако у таких пациентов Фазлодекс применяют с осторожностью, учитывая возможный рост экспозиции фулвестранта. Данные относительно лиц с тяжелой печеночной недостаточностью отсутствуют (см. ОСОБЫЕ УКАЗАНИЯ, Фармакокинетика).
Способ применения. Фазлодекс следует вводить в виде двух последовательных, медленных (1–2 мин на инъекцию), в/м инъекций по 5 мл, по одной в каждую ягодицу.
Из-за близости расположения седалищного нерва следует соблюдать осторожность при введении препарата Фазлодекс в верхний наружный квадрант ягодичной области.
Инструкция по введению.
Препарат следует вводить в соответствии с местными правилами проведения внутримышечных инъекций большого объема.
Примечание. Из-за близости расположения седалищного нерва следует соблюдать осторожность при введении препарата Фазлодекс в верхний наружный квадрант ягодичной области (см. ОСОБЫЕ УКАЗАНИЯ).
Предостережение — не стерилизовать в автоклаве безопасную иглу (покрытую колпачком подкожную иглу «BD SafetyGlideтм») перед использованием.
В течение всего времени использования и удаления руки находятся позади иглы.
Для каждого из двух шприцев
- Вытащить стеклянный цилиндр шприца из картриджа и проверить, не поврежден ли он.
- Открыть внешнюю упаковку безопасной иглы (SafetyGlide™).
- Р-ры для парентерального введения перед применением следует проверить визуально на наличие твердых частиц и изменение цвета.
- Держать шприц ребристой частью вверх (С). Другой рукой взять колпачок (А) и осторожно наклонять вперед и назад до тех пор, пока колпачок отсоединится, и его можно будет снять, не крутить.
- Снять колпачок в прямом направлении вверх. Для сохранения стерильности не касаться наконечника шприца.
- Присоединить безопасную иглу к насадке Люэра и прокрутить до плотного прилегания.
- Проверить, чтобы игла была закреплена на наконечнике шприца Люэра, перед перемещением с вертикальной плоскости.
- Вытащить защитный колпачок с иглы прямо, чтобы избежать повреждения кончика иглы.
- Приблизить наполненный шприц к точке введения.
- Снять с иглы колпачок.
- Удалить из шприца избыток воздуха.
- Вводить медленно внутримышечно (1–2 мин/инъекцию) в ягодицу (ягодичную область). Для удобства пользователя срез иглы должен быть направлен на плечо рычага.
- Сразу после извлечения иглы нажать одним пальцем на плечо рычага, чтобы активировать защитный поршневой механизм.
Примечение: при активации держать иголку направленной в сторону от себя и других. Прислушаться к щелчку и визуально убедиться, что кончик иглы полностью закрыт.
Утилизация. Предварительно наполненные шприцы предназначены исключительно для одноразового применения.
Весь неиспользованный препарат или отходы следует утилизировать в соответствии с местными требованиями.
Противопоказания
гиперчувствительность к действующему веществу или любому вспомогательному компоненту препарата; период беременности и кормления грудью (см. ОСОБЫЕ УКАЗАНИЯ); тяжелая печеночная недостаточность (см. ОСОБЫЕ УКАЗАНИЯ и Фармакокинетика).
Побочные эффекты
побочными реакциями, о которых сообщается чаще всего, являются реакции в месте инъекции, астения, тошнота и повышение уровня печеночных ферментов (АлАТ, АсАТ, ЩФ).
Следующие категории частоты побочных реакций были рассчитаны на основании данных группы лечения Фазлодексом 500 мг с объединенного анализа безопасности исследований, в которых сравнивались Фазлодекс 500 мг и Фазлодекс 250 мг [CONFIRM (исследование D6997C00002), FINDER 1 (исследование D6997C00004), FINDER 2 (исследование D6997C00006) и NEWEST (исследование D6997C00003)], или отдельного исследования FALCON (исследование D699BC00001), в котором сравнивались Фазлодекс 500 мг и анастрозол 1 мг. Если частота побочных реакций в объединенном анализе безопасности и в FALCON отличалась, то брали самую высокую частоту. Частота в приведенной таблице была определена на основании данных по всем побочным реакциям, о которых сообщалось, независимо от оценки исследователем причинной связи.
Нижеприведенные побочные реакции (табл. 3) классифицированы по частоте и классам систем органов. Группировка по частоте проводилась согласно следующему порядку: очень часто (≥1/10), часто (≥1/100 до <1/10), нечасто (≥1/1000 до <1/100). В рамках группы по частоте побочные реакции представлены в порядке уменьшения их серьезности.
Таблица 3. Побочные реакции, классифицированные в соответствии с частотой и классами систем органов
| Класс систем органов | Частота | Побочные реакции |
|---|---|---|
| Инфекции и инвазии | Часто | Инфекции мочевыводящих путей |
| Со стороны иммунной системы | Очень часто | Реакции гиперчувствительностиe |
| Нечасто | Анафилактические реакции | |
| Со стороны метаболизма и питания | Часто | Анорексияа |
| Со стороны нервной системы | Часто | Головная боль |
| Со стороны сосудов | Очень часто | Приливыe |
| Часто | Венозная тромбоэмболияa | |
| Со стороны пищеварительного тракта | Очень часто | Тошнота |
| Часто | Рвота, диарея | |
| Со стороны печени и желчевыводящих путей | Очень часто | Повышение уровня печеночных ферментов (АлАТ, АсАТ, ЩФ)а |
| Часто | Повышение уровня билирубинаa | |
| Нечасто | Печеночная недостаточностьс, f, гепатитf, повышение уровня гамма-глутамилтрансферазы ГГТf | |
| Со стороны кожи и подкожной клетчатки | Очень часто | Сыпьe |
| Со стороны костно-мышечной системы и соединительной ткани | Очень часто | Боль в суставах и скелетных мышцахd |
| Часто | Боль в спинеа | |
| Со стороны репродуктивной системы и молочных желез | Часто | Вагинальное кровотечениеe |
| Нечасто | Вагинальный кандидозf, лейкореяf | |
| Общие нарушения и состояния в месте введения препарата | Очень часто | Астенияа, реакции в месте инъекцииb |
| Часто | Периферическая нейропатияe, ишиасe | |
| Нечасто | Геморрагии в месте инъекцииf, гематомы в месте инъекцииf, невралгияc,f | |
| Со стороны крови и лимфатической системы | Часто | Снижение количества тромбоцитовe |
aВключены побочные реакции на препарат, для которых связь с Фазлодексом не может быть установлена из-за основного заболевания.
bТермин «реакции в месте инъекции» не включает в себя термины «геморрагии в месте инъекции» и «гематома в месте инъекции», «ишиас», «невралгия», «периферическая нейропатия».
cРеакция наблюдалась в крупных клинических исследованиях (CONFIRM, FINDER 1, FINDER 2, NEWEST).
Частота была рассчитана с использованием верхней границы 95% доверительного интервала для оценки точки. Она рассчитывалась как 3/560 (где 560 — это количество пациентов в крупных клинических исследованиях), что соответствует частоте категории «редко».
dВключает артралгию и менее часто — мышечно-костную боль, миалгию и боль в конечностях.
eИмеют место некоторые различия между частотой побочных реакций в соответствующих категориях в отношении органов и систем органов в исследовании по безопасности и исследовании FALCON.
fНежелательные реакции не наблюдали в исследовании FALCON.
Описание отдельных побочных реакций.
Приведенное описание базируется на анализе безопасности группы из 228 пациенток, получивших не менее 1 дозы фулвестранта, и группы из 232 пациенток, получивших не менее 1 дозы анастрозола в исследовании 3-й фазы FALCON.
Боль в суставах и костно-мышечная боль.
По данным исследования FALCON, количество пациентов, которые сообщили о боли в суставах и костно-мышечной боли, составляла 65 (31,2%) и 48 (24,1%) при приеме фулвестранта и анастрозола соответственно. Из 65 пациенток, получавших Фазлодекс, 40% (26/65) пациенток отмечали суставную и костно-мышечную боль в течение первого месяца лечения, 66% (43/65) пациенток — в течение первых 3 мес лечения. Ни одна из пациенток не сообщила о случаях степени ≥3 по CTCAE или о случаях, требовавших снижения дозы препарата, временного прекращения приема или отмены лечения в связи с этими побочными реакциями.
Сообщения о подозреваемых побочных реакциях
Важно сообщать о подозреваемых побочных реакциях после регистрации лекарственного средства. Это позволяет продолжать контроль за соотношением польза/риск при применении лекарственного средства. Медицинских работников просят сообщать о любых подозреваемых побочных реакциях.
Особые указания
Фазлодекс следует с осторожностью применять у пациентов с нарушением функции печени легкой и средней степени тяжести (см. ПРИМЕНЕНИЕ, ПРОТИВОПОКАЗАНИЯ и Фармакокинетика).
Фазлодекс следует с осторожностью применять у пациентов с тяжелыми нарушениями функции почек (клиренс креатинина <30 мл/мин).
Учитывая в/м путь введения, Фазлодекс следует с осторожностью применять при лечении пациентов с геморрагическим диатезом, тромбоцитопенией или применяющих антикоагулянты.
Тромбоэмболические явления обычно отмечают у женщин, больных прогрессирующим раком молочной железы, и зарегистрированы в клинических исследованиях Фазлодекса (см. ПОБОЧНЫЕ ЭФФЕКТЫ). Это следует учитывать при назначении Фазлодекса пациентам, которые входят в группу риска.
При введении препарата Фазлодекс сообщали о реакциях, связанных с местом инъекции, включая ишиас, невралгию, нейропатическую боль и периферическую нейропатию. Из-за близости расположения седалищного нерва следует соблюдать осторожность при введении препарата Фазлодекс в верхний наружный квадрант ягодичной области (см. ПРИМЕНЕНИЕ и ПОБОЧНЫЕ ЭФФЕКТЫ).
Нет данных долгосрочных исследований влияния фулвестранта на кости. Ввиду механизма действия фулвестранта существует потенциальный риск развития остеопороза.
Влияние на исследование эстрадиола с помощью антител. Из-за структурного сходства фулвестранта и эстрадиола фулвестрант может влиять на результаты исследований уровня эстрадиола, проводимых на основе реакции с антителами, и вызывать получение ложно повышенных уровней эстрадиола.
Педиатрическая популяция. Фазлодекс не рекомендуется для применения у детей и подростков, поскольку его безопасность и эффективность для этой возрастной группы не установлены (см. Фармакодинамика).
Применение в период беременности и кормления грудью. Женщины репродуктивного возраста. Пациенткам репродуктивного возраста следует рекомендовать использовать эффективные средства контрацепции во время лечения.
Беременность. Фазлодекс противопоказан в период беременности (см. ПРОТИВОПОКАЗАНИЯ). Показано, что фулвестрант проникает через плацентарный барьер после однократного в/м введения препарата у крыс и кроликов. Исследования на животных свидетельствуют о репродуктивной токсичности, включая рост частоты аномалий и смерти плода. Если пациентка забеременела в период лечения Фазлодексом, ее следует проинформировать о потенциальной опасности для плода и потенциальном риске прерывания беременности.
Кормление грудью. Во время лечения Фазлодексом грудное вскармливание следует прекратить. Фулвестрант проникает в молоко у кормящих крыс. В настоящее время неизвестно, проникает ли фулвестрант в грудное молоко у человека. Учитывая возможность возникновения у младенцев, находящихся на грудном вскармливании, серьезных нежелательных реакций, вызванных фулвестрантом, кормление грудью противопоказано в период применения этого лекарственного средства (см. ПРОТИВОПОКАЗАНИЯ).
Фертильность. Влияние лечения Фазлодексом на фертильность у человека не исследовано.
Дети. Безопасность и эффективность Фазлодекса для детей в возрастной категории от рождения до 18 лет не установлены. Доступная в настоящее время информация приведена в разделах Фармакокинетика и Фармакодинамика, однако рекомендаций относительно дозирования сделать нельзя.
Способность влиять на скорость реакции при управлении транспортными средствами и работе с другими механизмами. Фазлодекс не влияет или оказывает незначительное влияние. Однако, поскольку при лечении Фазлодексом сообщалось об очень частых случаях астении, пациентам, у которых во время управления транспортными средствами или работе с механизмами развилась эта нежелательная реакция, следует соблюдать осторожность.
Взаимодействия
исследования клинического взаимодействия с мидазоламом (субстрат CYP 3A4) показали, что фулвестрант не ингибирует CYP 3А4.
Исследования клинического взаимодействия с рифампицином (индуктором CYP 3А4) и кетоконазолом (ингибитором CYP 3А4) не показали клинически значимых изменений в клиренсе фулвестранта. Таким образом, у пациентов, одновременно применяющих фулвестрант и ингибиторы или индукторы CYP 3А4, коррекции дозы не требуется.
Несовместимость. Поскольку исследования по изучению совместимости отсутствуют, Фазлодекс не следует смешивать с другими препаратами.
Передозировка
существуют отдельные сообщения о случаях передозировки препаратом Фазлодекс у людей. В случае передозировки рекомендуется проводить симптоматическое поддерживающее лечение. В исследованиях на животных высокие дозы фулвестрант не оказывал других эффектов, кроме прямым или косвенным образом связанных с антиэстрогенным действием.
Условия хранения
предварительно заполненные шприцы хранить в оригинальной упаковке для защиты от света при температуре от 2 до 8 °С.
Температурные колебания вне диапазона от 2 до 8 °С должны быть ограничены. При этом следует избегать хранения при температуре более 30 °C и не превышать 28-дневного периода, при котором средняя температура хранения препарата составляет не менее 25 °C (но не более 2–8 °С). После колебаний температуры препарат должен быть немедленно возвращен в рекомендуемые условия хранения (хранение и транспортировка в холодильнике при температуре от 2 до 8 °С). Температурные колебания оказывают кумулятивный эффект на качество препарата, и 28-дневный период не должен превышаться в течение 4-летнего срока годности Фазлодекса. Влияние температуры ниже 2 °С не приводит к повреждению препарата при условии, что препарат не хранится при температуре ниже –20 °C.