Триксео аеросфера (Trixeo aerosphere) (568078) - инструкция по применению ATC-классификация
- Инструкция
- Аналоги

Триксео аеросфера инструкция по применению
Фармакологические свойства
фармакодинамика. Механизм действия. Лекарственное средство Триксео Аэросфера содержит будесонид, ГКС и два бронхолитика — гликопироний, антагонист мускариновых рецепторов длительного действия (антихолинергическое лекарственное средство), и формотерол, β2-агонист длительного действия.
Будесонид — это ГКС, который в случае ингаляционного применения оказывает быстрое (в течение нескольких часов) и противовоспалительное действие в дыхательных путях.
Гликопироний — это антагонист мускариновых рецепторов длительного действия, часто называемый антихолинергическим лекарственным средством. Основными мишенями для антихолинергических лекарственных средств являются рецепторы мускарина, содержащиеся в дыхательных путях. В дыхательных путях гликопироний проявляет фармакологические эффекты за счет угнетения М3-холинорецепторов в гладких мышцах, что приводит к бронходилатации. Антагонизм носит конкурентный и обратимый характер. В исследовании профилактика бронхоконстрикторных эффектов, вызванных метилхолином и ацетилхолином, была дозозависимой и длилась более 12 ч.
Формотерол — это селективный агонист β2-адренорецепторов, который в случае ингаляционного применения приводит к быстрой и длительной релаксации гладких мышц бронхов у пациентов с обратимой обструкцией дыхательных путей. Бронхолитический эффект зависит от дозы; наступление эффекта происходит в течение 1–3 мин после ингаляции. Продолжительность эффекта после применения одной дозы составляет не менее 12 ч.
Клиническая эффективность. Эффективность и безопасность применения лекарственного средства Триксео Аэросфера оценивали у пациентов с ХОБЛ умеренной, тяжелой или очень тяжелой степени в ETHOS и KRONOS, двух рандомизированных исследованиях с параллельными группами. Оба исследования были многоцентровыми и двойными слепыми. Пациенты имели балл симптомов ≥10 в соответствии с тестом по оценке ХОБЛ (CAT) и ежедневно применяли два или более поддерживающих лекарственных средств в течение по меньшей мере 6 нед до скрининга.
ETHOS представляло собой 52-недельное исследование (N=8588 рандомизированных участников; 60% составили мужчины, средний возраст 65 лет), в котором сравнивали две ингаляции дважды в сутки лекарственного средства Триксео Аэросфера, ДАИ формотерола фумарата дигидрата/гликопирония (ФОРМ/ГЛИ) 5/7,2 мкг и ДАИ формотерола фумарата дигидрата/будесонида (ФОРМ/БУД) 5/160 мкг. Пациенты имели ХОБЛ умеренной, тяжелой или очень тяжелой степени (ОФВ1 после применения бронхолитика от ≥25% до <65% от прогнозируемого значения); они должны были иметь в анамнезе одно или несколько обострений ХОБЛ умеренной или тяжелой степени в течение предшествующего скринингу года. Часть пациентов с умеренным, тяжелым или очень тяжелым ХОБЛ составила 29%, 61% и 11% соответственно. Средний исходный ОФВ1 во всех группах был равен 1,021–1,066 мл; к моменту скрининга среднее значение ОФВ1 после применения бронхолитика составляло 43% от прогнозируемого, а средний балл по тесту CAT равнялся 19,6. Первоначальной конечной точкой исследования ETHOS была частота обострений ХОБЛ умеренной или тяжелой степени на фоне применения лекарственного средства Триксео Аэросфера по сравнению с ДАИ ФОРМ/ГЛИ и ДАИ ФОРМ/БУД.
KRONOS — это 24-недельное исследование (N=1902 рандомизированных участника; 71% составляли мужчины, средний возраст 65 лет), в котором сравнивали две ингаляции дважды в сутки лекарственного средства Триксео Аэросфера, ДАИ ФОРМ/ГЛИ 5/7,2 мкг, ДАИ ФОРМ/БУД 5/160 мкг и в открытом режиме сравнения с турбухалером формотерола фумарата дигидрата/будесонида (ТБХ ФОРМ/БУД) 6/200 мкг. У пациентов была ХОБЛ умеренной, тяжелой или очень тяжелой степени (ОФВ1 после применения бронхолитика от ≥25% до <80% от прогнозируемого значения). Часть пациентов с умеренной, тяжелой или очень тяжелой ХОБЛ составила 49%, 43% и 8% соответственно. Средний исходный ОФВ1 во всех группах составлял 1,050–1,193 мл, а к моменту скрининга среднее значение ОФВ1 после применения бронхолитика составляло 50% от прогнозируемого; более 26% пациентов сообщили об одном или нескольких обострениях ХОБЛ умеренной или тяжелой степени за последний год и средний балл оценки симптомов по тесту CAT составил 18,3. В подгруппе участников лечение было продлено на 28 нед, то есть до 52 нед. Первичными конечными точками исследования KRONOS были значения ОФВ1 с момента времени 0 до 4 ч после применения лекарственного средства (согласно площади под фармацевтической кривой концентрация/время AUC0–4 ОФВ1) для группы применения лекарственного средства Триксео Аэросфера по сравнению с группой ДАИ ФОРМ/БУД и изменение минимального утреннего ОФВ1, измеряемого до применения препарата, по сравнению с исходным значением для группы применения лекарственного средства Триксео Аэросфера по сравнению с группой ДАИ ФОРМ/ГЛИ за 24 нед.
На момент зачисления в исследование наиболее распространенными видами лечения пациентов с ХОБЛ, о которых сообщалось в исследованиях ETHOS и KRONOS, были ингаляционный ГКС (ИГКС) + агонист β2-адренорецепторов длительного действия (БАДД) + антагонист мускариновых рецепторов длительного действия (МХДД 27% соответственно), ИГКС+БАДД (31%, 38% соответственно) и МХДД+БАДД (14%, 20% соответственно).
Воздействие на обострение
Обострение умеренной или тяжелой степени. В 52-недельном исследовании ETHOS у пациентов, применявших лекарственное средство Триксео Аэросфера, было зафиксировано значимое снижение годового показателя обострений умеренной/тяжелой степени во время лечения на 24% (95% ДИ: 17; 31; p<0,0001) по сравнению с ДАИ ФОРМ/ГЛИ (частота; 1,08 против 1,42 события на пациента в год) и на 13% (95% ДИ: 5; 21; p=0,0027) по сравнению с ДАИ ФОРМ/БУД (частота; 1,08 против 1,24 события на пациента в год).
Наблюдаемая польза по годовому показателю обострений ХОБЛ умеренной/тяжелой степени в течение 24 нед в исследовании KRONOS в целом соответствовала отмеченной в исследовании ETHOS. В группе лекарственного средства Триксео Аэросфера улучшения по сравнению с ДАИ ФОРМ/ГЛИ были статистически значимыми, однако по сравнению с ДАИ ФОРМ/БУД и ТБХ ФОРМ/БУД не достигли статистической значимости.
Тяжелые обострения (приведшие к госпитализации или смерти). В исследовании ETHOS у пациентов, применявших лекарственное средство Триксео Аэросфера, было зафиксировано численное снижение годового показателя тяжелых обострений при лечении на 16% (95% ДИ: −3; 31; p=0,0944) по сравнению с ДАИ ФОРМ/ГЛИ (частота; 0,13 против 0,15 события на пациента в год) и значимое снижение годового показателя тяжелых обострений во время лечения на 20% (95% ДИ: 3; 34; p=0,0221) по сравнению с ДАИ ФОРМ/БУД (частота: 0,13 против 0,16 события на пациента в год).
В обоих исследованиях при применении лекарственного средства Триксео Аэросфера польза по влиянию на обострение наблюдалась у пациентов с умеренным, тяжелым или очень тяжелым ХОБЛ.
Воздействие на функцию легких. В исследовании ETHOS и KRONOS у пациентов, применявших лекарственное средство Триксео Аэросфера, было зафиксировано улучшение функции легких (ОФВ1) при лечении по сравнению с ДАИ ФОРМ/ГЛИ и ДАИ ФОРМ/БУД (см. табл. 1 для ETHOS и табл. 2 для KRONOS). В обоих исследованиях наблюдался стойкий эффект в течение 24-недельного периода лечения и в течение 52 нед в ETHOS.
Таблица 1
Анализ функции легких — ETHOS (спирометрическое подисследование)
| Показатель | Триксео Аэросфера (N=747) | ДАИ ФОРМ/ ГЛИ (N=779) | ДАИ ФОРМ/ БУД (N=755) | Средняя разница, 95% ДИ | |
| Сравнение Триксео Аэросфера и ДАИ ФОРМ/ГЛИ | Сравнение Триксео Аэросфера и ДАИ ФОРМ/БУД | ||||
| Минимальный ОФВ1 (мл) за 24 нед, изменение среднего значения, вычисленного по МНК, в сравнении с исходным уровнем (СП) | 129 (6,5) | 86 (6,6) | 53 (6,5) | 43 мл (25; 60) р<0,0001 | 76 мл (58; 94) р<0,0001# |
| ОФВ1 AUC0–4 за 24 нед; изменение среднего значения, вычисленного по МНК, в сравнении с исходным уровнем (СП) | 294 (6,3) | 245 (6,3) | 194 (6,3) | 49 мл (31; 66) р<0,0001# | 99 мл (82; 117) р<0,0001 |
# p-значение не скорректировано с учетом множественности в иерархическом плане тестирования.
МНК — метод наименьших квадратов, СП — стандартная погрешность, ДИ — доверительные интервалы, N — количество человек в выборке «все рандомизированные пациенты в соответствии с назначенным лечением» (ITT-популяция).
Таблица 2
Анализ функции легких — KRONOS
| Показатель | Триксео Аэросфера (N=639) | ДАИ ФОРМ/ГЛИ (N=625) | ДАИ ФОРМ/БУД (N=314) | ТБХ ФОРМ/БУД (N=318) | Средняя разница, 95% ДИ | ||
| Сравнение Триксео Аэросфера и ДАИ ФОРМ/ГЛИ | Сравнение Триксео Аэросфера и ДАИ ФОРМ/БУД | Сравнение Триксео Аэросфера и ТБХ ФОРМ/БУД | |||||
| Минимальный ОФВ1 (мл) за 24 тиж, изменение среднего значения, вычисленного по МНК, в сравнении с исходным уровнем (СП) | 147 | 125 | 73 (9,2) | 88 (9,1) | 22 мл | 74 мл | 59 мл |
| (6,5) | (6,6) | (4; 39) р=0,0139 | (52; 95) р<0,0001 | (38; 80) р<0,0001# | |||
| ОФВ1 AUC0–4 за 24 нед, изменение среднего значения, вычисленного по МНК, в сравнении с исходным уровнем (СП) | 305 | 288 | 201 | 214 | 16 мл | 104 мл | 91 мл |
| (8,4) | (8,5) | (11,7) | (11,5) | (−6; 38) р=0,1448# | (77; 131) р<0,0001 | (64; 117) р<0,0001 | |
# p-значение не скорректировано с учетом множественности в иерархическом плане тестирования.
МНК — метод наименьших квадратов, СП — стандартная погрешность, ДИ — доверительные интервалы, N — количество человек в выборке «все рандомизированные пациенты в соответствии с назначенным лечением» (ITT-популяция).
Облегчение выраженности симптомов. В исследовании ETHOS исходные средние показатели одышки колебались от 5,8 до 5,9 в группах лечения. У пациентов, применявших лекарственное средство Триксео Аэросфера, было зафиксировано значимое уменьшение выраженности одышки (измеренное с помощью динамического индекса одышки (TDI) за 24 нед) по сравнению с ДАИ ФОРМ/ГЛИ (0,40 единицы; 95% ДИ: 0,24 ;0,55; p<0,0001) и по сравнению с ДАИ ФОРМ/БУД (0,31 единицы; 95% ДИ: 0,15; 0,46; р<0,0001). Улучшение поддерживалось в течение 52 нед. В исследовании KRONOS исходные средние баллы одышки колебались от 6,3 до 6,5 в группах лечения. У пациентов, применявших лекарственное средство Триксео Аэросфера, было зафиксировано значительное уменьшение выраженности одышки за 24 нед по сравнению с ТБХ ФОРМ/БУД (0,46 единицы; 95% ДИ: 0,16; 0,77; р=0,0031). Улучшение по сравнению с ДАИ ФОРМ/ГЛИ и ДАИ ФОРМ/БУД не достигло статистической значимости.
Качество жизни, обусловленное состоянием здоровья. В исследовании ETHOS у пациентов, применявших лекарственное средство Триксео Аэросфера, было зафиксировано значимое улучшение состояния здоровья, связанного с болезнью (в соответствии с общим баллом по опроснику госпиталя Святого Георгия для пациентов с респираторными заболеваниями (SGRQ)) за 24 нед. по сравнению с ДАИ ФОРМ/ГЛИ (улучшение −1,62; 95% ДИ: −2,27; −0,97; p<0,0001) и по сравнению с ГАИ ФОРМ/БУД (улучшение −1,38; 95% ДИ: −2,02; −0,73]; р<0,0001). Улучшение поддерживалось в течение 52 нед. В исследовании KRONOS улучшение по сравнению с ДАИ ФОРМ/ГЛИ, ДАИ ФОРМ/БУД и ТБХ ФОРМ/БУД не достигло статистической значимости.
Частота использования лекарственного средства для неотложной помощи. В исследовании ETHOS у пациентов, применявших лекарственное средство Триксео Аэросфера, было зафиксировано значительное снижение частоты применения лекарственного средства для неотложной помощи в ходе лечения за 24 нед по сравнению с ДАИ ФОРМ/ГЛИ (разница между видами терапии: −0,51 ингаляции/сутки 95% ДИ: −0,68; −0,34; p<0,0001) и ДАИ ФОРМ/БУД (разница между видами терапии: −0,37 ингаляции/сутки; 0,20; р<0,0001). Снижение поддерживалось в течение 52 нед. В исследовании KRONOS различия по сравнению с ДАИ ФОРМ/ГЛИ, ДАИ ФОРМ/БУД и ТБХ ФОРМ/БУД не были статистически значимыми.
Фармакокинетика. После ингаляции комбинации формотерола, гликопирония и будесонида фармакокинетика каждого компонента была похожа на фармакокинетику, которая наблюдается при введении каждого действующего вещества отдельно.
Использование со спейсером. После применения здоровыми добровольцами этого лекарственного средства со спейсером Aerochamber Plus Flow-Vu увеличивалась общая системная экспозиция (измеренная по AUC0–t) будесонида и гликопирония на 33% и 55% соответственно, тогда как экспозиция формотерола оставалась неизменной.
Всасывание
Будесонид. После ингаляционного применения этого лекарственного средства пациентами с ХОБЛ Cmax будесонида наблюдалась в течение 20–40 мин. Равновесное состояние достигается через 1 сут повторного применения этого лекарственного средства, а степень экспозиции примерно в 1,3 раза выше, чем после первой дозы.
Гликопироний. После ингаляционного применения этого лекарственного средства пациентами с ХОБЛ Cmax гликопирония наступала через 6 мин. Равновесное состояние достигается за 3 сут повторного применения этого лекарственного средства, а степень экспозиции примерно в 1,8 раза выше, чем после первой дозы.
Формотерол. После ингаляционного применения этого лекарственного средства пациентами с ХОБЛ Cmax формотерола наблюдалась в течение 40–60 мин. Равновесное состояние достигается за 2 сут повторного приема этого лекарственного средства, а степень экспозиции примерно в 1,4 раза выше, чем после первой дозы.
Распределение
Будесонид. Согласно популяционному фармакокинетическому анализу расчетный кажущийся объем распределения будесонида в равновесном состоянии составляет 1200 л. Связывание будесонида с белками плазмы крови составляет примерно 90%.
Гликопироний. Согласно популяционному фармакокинетическому анализу, расчетный кажущийся объем распределения гликопирония в равновесном состоянии составляет 5500 л. В диапазоне концентраций 2–500 нмоль/л связывание гликопирония с белками плазмы крови колебалось в пределах 43–54%.
Формотерол. Согласно популяционному фармакокинетическому анализу расчетный кажущийся объем распределения формотерола в равновесном состоянии составляет 2400 л. В диапазоне концентраций 10–500 нмоль/л связывание формотерола с белками плазмы крови колебалось в пределах 46–58%.
Биотрансформация
Будесонид испытывает значительную (приблизительно до 90%) биотрансформацию во время первого прохождения через печень с образованием метаболитов с низкой глюкокортикостероидной активностью. Глюкокортикостероидная активность основных метаболитов, 6-β-гидрокси-будесонида и 16-α-гидрокси-преднизолона, составляет менее 1% от глюкокортикостероидной активности будесонида.
Гликопироний. Согласно данным научной литературы и исследованиям гепатоцитов человека in vitro метаболизм играет незначительную роль в общем выведении гликопирония. Было обнаружено, что CYP 2D6 является предпочтительным ферментом, участвующим в метаболизме гликопирония.
Формотерол. Основной метаболизм формотерола осуществляется путем прямого глюкуронирования и О-деметилирования с последующей конъюгацией с неактивными метаболитами. Вторичные метаболические пути включают деформирование и конъюгацию с сульфатами. Было установлено, что CYP 2D6 и CYP 2C в первую очередь ответственны за О-деметилирование.
Выведение
Будесонид выводится путем метаболизма, преимущественно под действием катализатора, которым выступает фермент CYP 3A4. Метаболиты будесонида выводятся с мочой в чистом виде или в конъюгированной форме. В моче были обнаружены лишь незначительные количества неизмененного будесонида. Эффективный конечный Т½ будесонида, определенный с помощью фармакокинетического популяционного анализа, составлял 5 ч.
Гликопироний. После в/в введения 0,2 мг гликопирония, меченного радиоактивным изотопом, 85% дозы выводилось с мочой через 48 ч после введения; определенная часть радиоактивности также выводилась с желчью. Эффективный терминальный Т½ гликопирония, определенный с помощью популяционного фармакокинетического анализа, составлял 15 ч.
Формотерол. Выведение формотерола изучалось у шести здоровых лиц после одновременного перорального и в/в введения формотерола, меченного радиоактивным изотопом. В этом исследовании 62% радиоактивности выводилось с мочой, а 24% — с калом. Эффективный Т½ формотерола, определенный с помощью популяционного фармакокинетического анализа, составлял 10 ч.
Особые группы пациентов
Возраст, пол, раса/этническая принадлежность и масса тела. Коррекция дозы не требуется в связи с отсутствием влияния возраста, пола или массы тела пациента на фармакокинетические параметры будесонида, гликопирония и формотерола. Среди здоровых участников японского, китайского и европейского/американского происхождения не было обнаружено значимых отличий в общей системной экспозиции (AUC) всех компонентов препарата. Недостаточно фармакокинетических данных для других этнических групп или рас.
Печеночная недостаточность. Фармакокинетические исследования этого лекарственного средства у пациентов с печеночной недостаточностью не проводились. Однако поскольку будесонид и формотерол выводятся преимущественно с участием печеночного метаболизма, то у пациентов с тяжелым циррозом печени можно ожидать роста концентрации лекарственного средства в плазме крови. Гликопироний обычно выводится из системного кровотока путем почечной экскреции, поэтому не ожидается, что печеночная недостаточность повлияет на его системную экспозицию.
Почечная недостаточность. Исследования по оценке влияния почечной недостаточности на фармакокинетику будесонида, гликопирония и формотерола не проводились.
Влияние почечной недостаточности на экспозицию будесонида, гликопирония и формотерола в течение периода до 24 нед оценивали в популяционном фармакокинетическом анализе. Расчетная скорость клубочковой фильтрации (рСКФ) колебалась в пределах 31–192 мл/мин, что соответствует диапазону от умеренной почечной недостаточности до полного отсутствия почечной недостаточности. Моделирование системной экспозиции (AUC0–12) у пациентов с ХОБЛ с умеренной почечной недостаточностью (рСКФ 45 мл/мин) указывает на приблизительное повышение уровня гликопирония на 68% по сравнению с пациентами с ХОБЛ с нормальной функцией почек (рСКФ >90 мл/мин). Выявлено, что функция почек не влияет на экспозицию будесонида или формотерола. У пациентов с ХОБЛ с низкой массой тела и с умеренной или тяжелой почечной недостаточностью системная экспозиция гликопирония может быть примерно вдвое больше.
Показания Триксео аеросфера
Триксео Аэросфера показана как поддерживающая терапия для взрослых пациентов с ХОБЛ умеренной и тяжелой степени, которые не отвечают в достаточной степени на терапию комбинацией ингаляционного кортикостероида и агониста β2-адренорецепторов длительного действия или комбинацией агониста β2-адренорецепторов длительного действия и антагонистов мускариновых рецепторов длительного действия (информацию о влиянии на контроль симптомов и профилактику обострений см. в разделе Фармакодинамика).
Применение Триксео аеросфера
дозировка
Рекомендуемая и максимальная доза составляет две ингаляции два раза в сутки (две ингаляции утром и две ингаляции вечером).
При пропуске дозы ее следует принять как можно быстрее, а следующую дозу принять в обычное время. Не следует принимать дополнительную дозу лекарственного средства для компенсации пропущенной дозы.
Особые группы пациентов
Пациенты пожилого возраста. Пациентам пожилого возраста коррекция дозы не требуется (см. Фармакокинетика).
Почечная недостаточность. Это лекарственное средство можно назначать в рекомендуемой дозе пациентам с легкой и умеренной почечной недостаточностью. Его также можно назначать в рекомендуемой дозе пациентам с тяжелой почечной недостаточностью или терминальной стадией почечной недостаточности, нуждающимся в диализе, только если ожидаемая польза превышает потенциальные риски (см. ОСОБЫЕ УКАЗАНИЯ И Фармакокинетика).
Печеночная недостаточность. Это лекарственное средство можно назначать в рекомендуемой дозе пациентам с легкой и умеренной печеночной недостаточностью. Его также можно назначать в рекомендуемой дозе пациентам с тяжелой печеночной недостаточностью, только если ожидаемая польза превышает потенциальные риски (см. ОСОБЫЕ УКАЗАНИЯ И Фармакокинетика).
Способ применения
Для ингаляционного использования.
Указания по применению. Для обеспечения правильного введения лекарственного средства Триксео Аэросфера врач или другой медицинский работник должен показать пациенту, как правильно пользоваться ингалятором; этот специалист также должен регулярно проверять правильность техники проведения ингаляции пациентом. Следует рекомендовать пациенту внимательно прочитать инструкцию по медицинскому применению и следовать указаниям по применению, приведенным в ней.
Примечание. Важно проинформировать пациента:
– Не использовать ингалятор, если влагопоглотитель, находящийся внутри мешочка из фольги, высыпался из своей упаковки. Для достижения наилучших результатов перед использованием ингалятор должен находиться определенное время при комнатной температуре.
– Подготовить ингалятор, встряхнув его и, направляя распыление в воздух, нажать на контейнер под давлением четыре раза перед первым применением или дважды, если ингалятор не использовался дольше семи дней, после еженедельного мытья или если ингалятор падал на пол.
– Прополоскать полость рта водой после ингаляции, чтобы минимизировать риск развития орофарингеального кандидоза. Не глотать.
Во время ингаляции лекарственного средства Триксео Аэросфера часть суспензии выталкивается из аэрозольного контейнера. Когда пациент вдыхает воздух через мундштук, одновременно нажимая на ингалятор, доза лекарственного средства перемещается за вдыхаемым воздухом в дыхательные пути.
Пациенты, которым тяжело скоординировать действия нажатия на ингалятор с вдыханием, могут применять лекарственное средство Триксео Аэросфера со спейсером, чтобы обеспечить правильное введение лекарственного средства. Триксео Аэросфера можно использовать со спейсерными устройствами, включая Aerochamber Plus Flow-Vu (см. Фармакокинетика).
Прочтите перед использованием ингалятора.
Внимательно прочтите эту инструкцию.
Ваш ингалятор Триксео Аэросфера (далее — ингалятор) может отличаться от ранее используемых ингаляторов.
Важная информация
Только для ингаляционного применения.
Подготовьте ингалятор для первого использования.
Промывайте еженедельно желтый дозатор.
Применяйте 2 ингаляции утром и 2 ингаляции вечером.
Части ингалятора
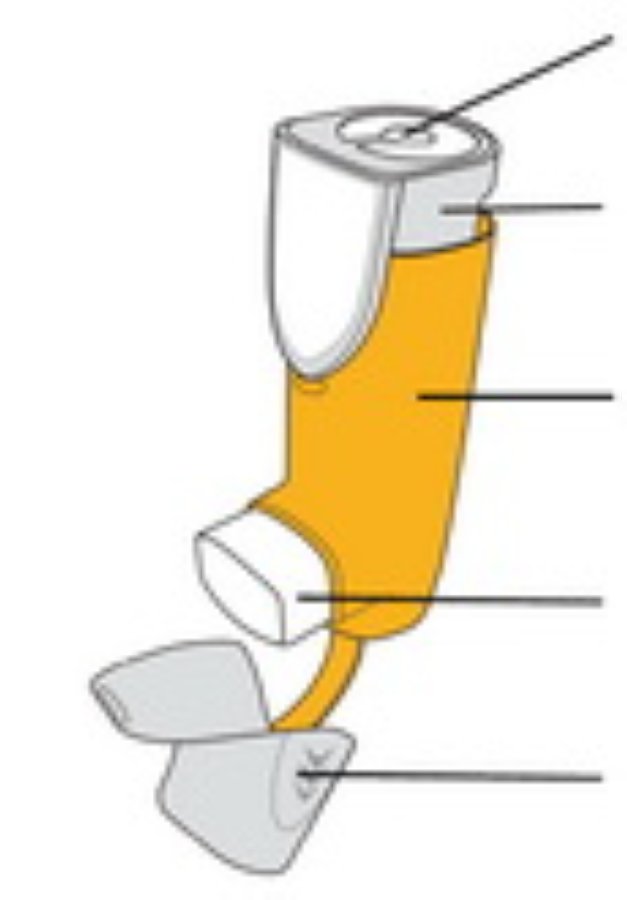 | Индикатор количества ингаляций Прикреплен к верхней части контейнера под давлением. |
Контейнер под давлением (внутри) Содержит лекарственное средство | |
Дозатор Содержит контейнер под давлением | |
Мундштук Распыляет лекарственное средство | |
Колпачок мундштука Защищает мундштук, когда ингалятор не используется | |
Показание индикатором количества ингаляций
Индикатор количества ингаляций будет отсчитывать 1 дозу каждый раз, когда вы распыляете лекарственное средство.
| Показатель доз Указывает на количество оставшихся ингаляций. | 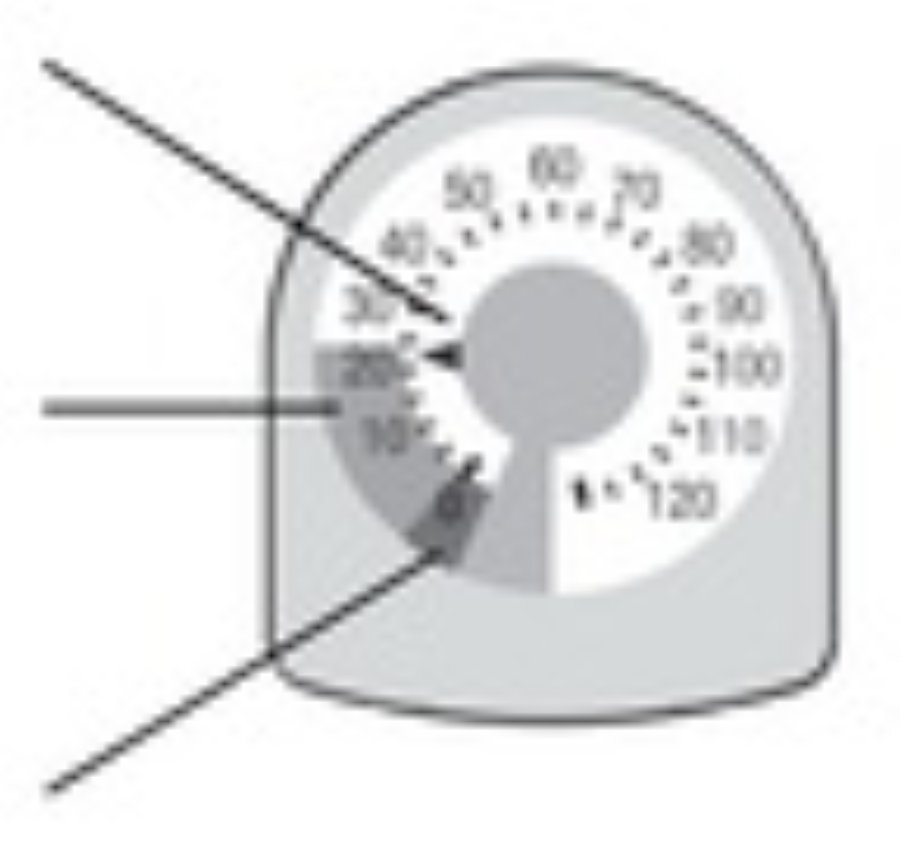 |
| Желтая зона Закажите новый ингалятор, когда указатель находится в желтой зоне. | |
| Красная зона Выбросьте ингалятор, когда указатель находится на отметке 0 в красной зоне | |
Не пытайтесь произвести ингаляцию, когда указатель находится на отметке 0, поскольку вы не получите полную дозу.
Заказ нового ингалятора
Закажите новый ингалятор, когда указатель индикатора количества ингаляций находится в желтой зоне.
Выброс ингалятора
Выбросьте ингалятор, следуя местным инструкциям, если:
– индикатор количества ингаляций показывает 0
или
– через 3 мес после того, как ингалятор был извлечен из мешочка из фольги.
Не используйте повторно и не используйте дозатор с контейнерами из других ингаляторов.
Не прокалывайте и не бросайте контейнер под давлением в огонь или мусоросжигатель.
Перед первым использованием ̶
Перед первым использованием ингалятор необходимо активировать 4 раза.
Перед первым использованием ингалятора активируйте его, чтобы получить необходимое количество лекарственного средства во время его использования.
| Активация. Шаг 1 |
| Снимите колпачок мундштука. |
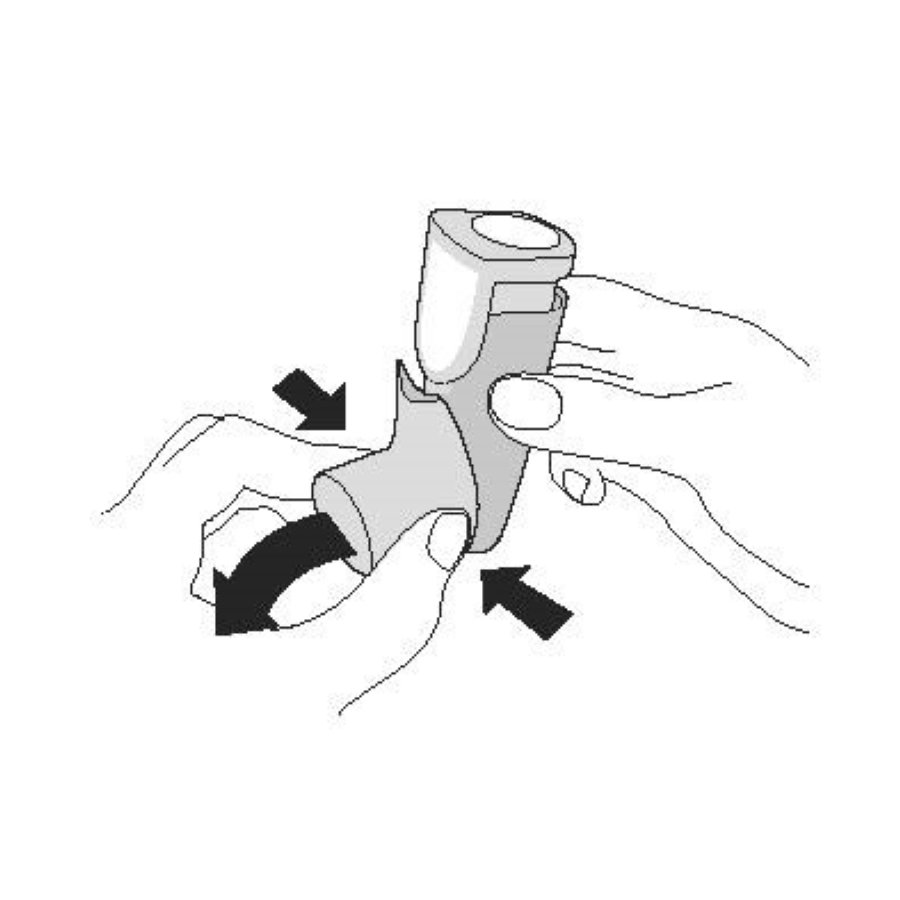 |
| Активация. Шаг 2 | |
| Хорошо встряхните ингалятор и произведите 1 тестовое распыление в воздух в направлении от себя. Повторите 4 тестовых распыления, встряхивая ингалятор перед каждым тестовым распылением. | |
| ×4 всего Встряхните ингалятор и сделайте тестовые распыления | 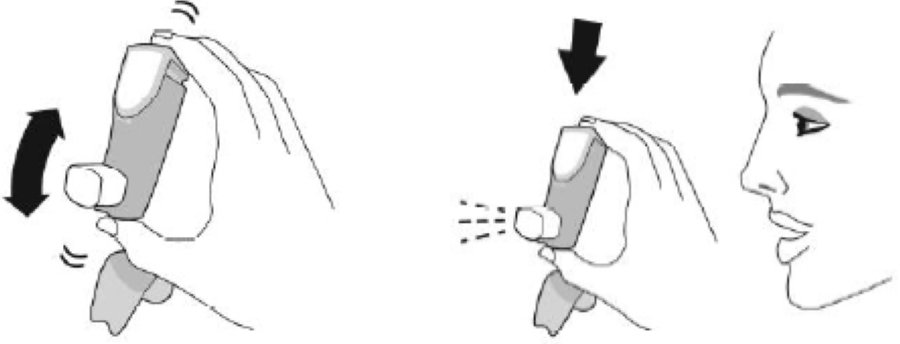 |
| Дополнительные дозы предназначены для подготовки ингалятора. Не пропускайте этап подготовки. | |
| Повторно подготовьте ингалятор к использованию: после промывания дозатора | Для повторной подготовки распылите 2 тестовых распыления, встряхивая ингалятор перед каждым тестовым распылением. |
| если ингалятор увпал | ×2 всего Встряхните ингалятор и сделайте тестовые распыления |
| если не использовали его более 7 дней | |
Ежедневное использование. Утром и вечером применяйте лекарственное средство.
Суточная доза: 2 ингаляции утром и 2 ингаляции вечером.
Прополощите ротовую полость водой после 2 ингаляций, чтобы предотвратить грибковую инфекцию.
| Шаг 1 |
| Снимите колпачок мундштука. Проверьте мундштук на наличие посторонних предметов и удалите предметы перед использованием. |
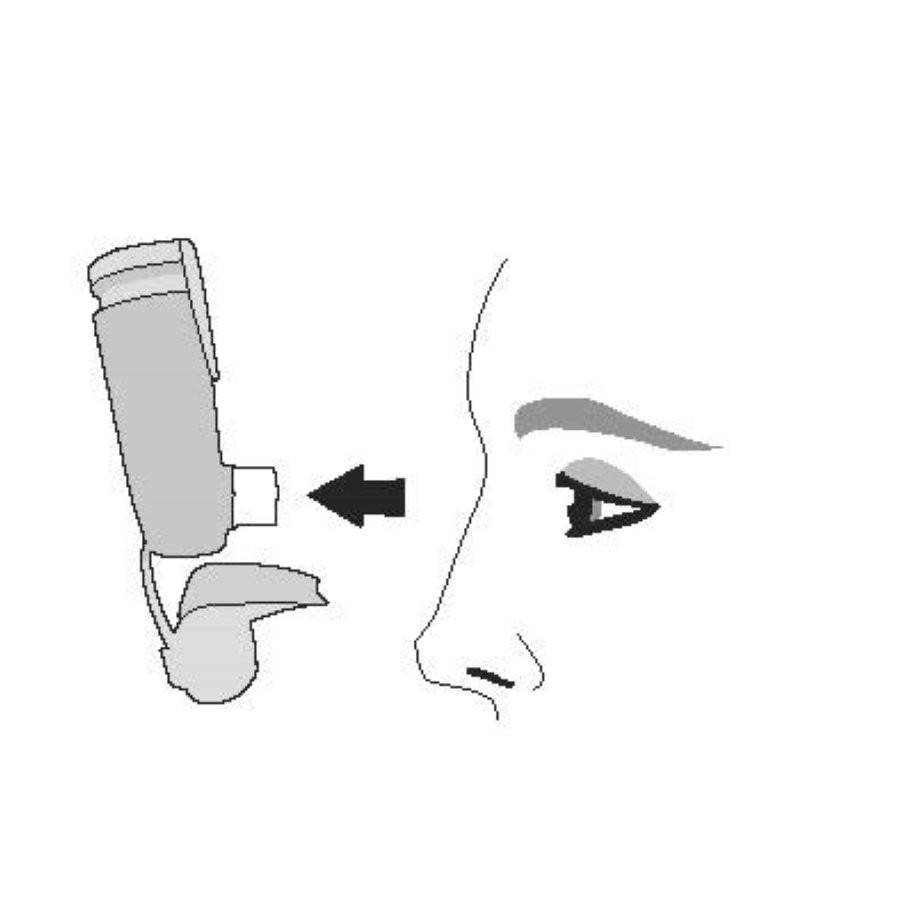 |
| Шаг 2 | ||||
| Перед каждой ингаляцией хорошо встряхните ингалятор. | Полностью выдохните. | Поместите мундштук в рот и сомкните губы вокруг мундштука. Наклоните голову назад, удерживая язык под мундштуком. | Начните глубоко и медленно вдыхать, делая 1 ингаляцию. Продолжайте вдыхать, пока не сможете вдохнуть. | Задержите дыхание как можно дольше, до 10 с. |
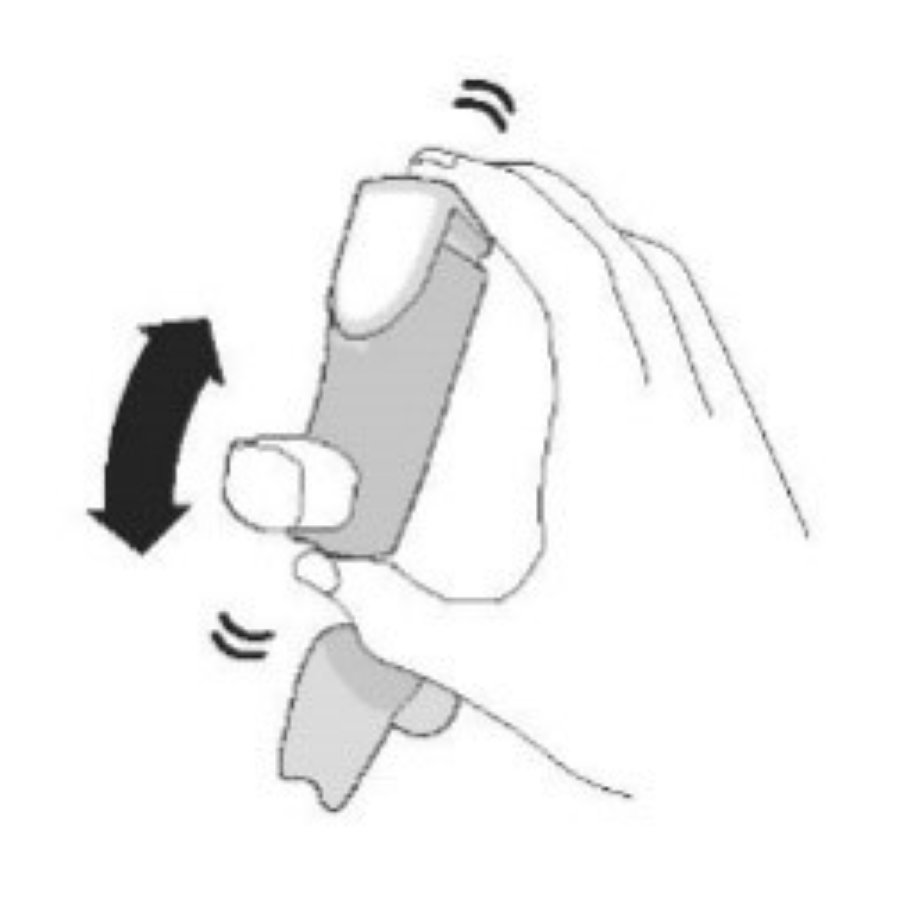 | 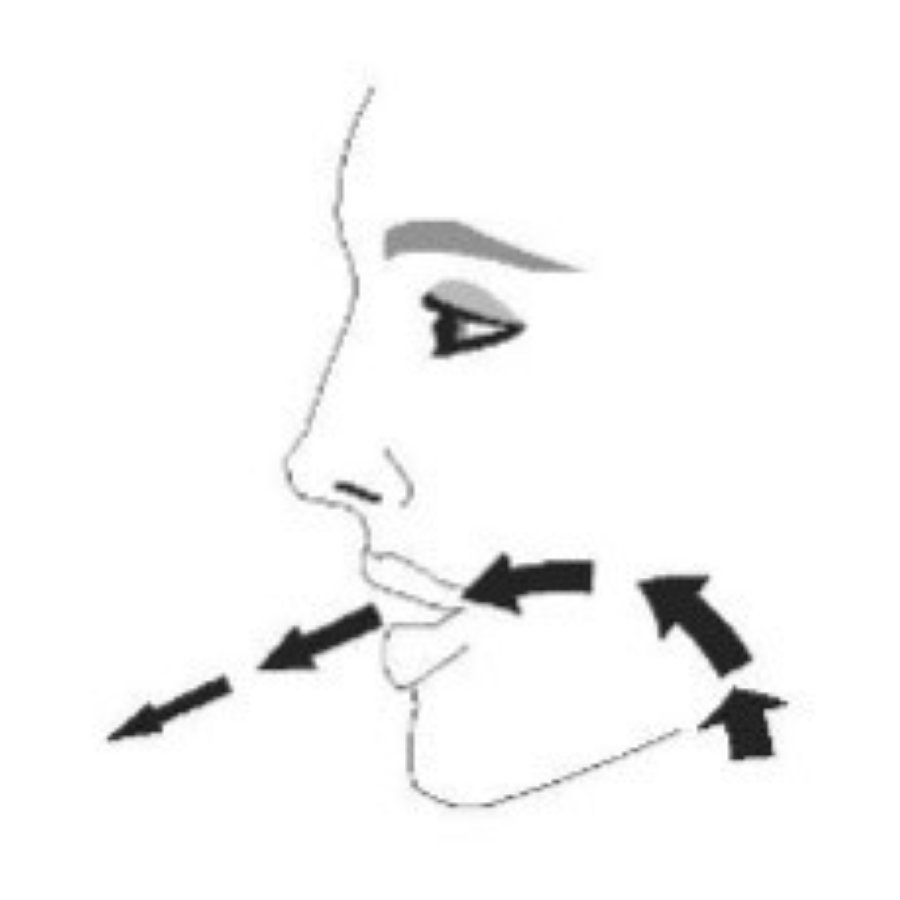 |  |  |  |
| Шаг 3 | Шаг 4 | Шаг 5 |
 | Снова наденьте колпачок на мундштук. | Прополощите ротовую полость водой. Выплюньте воду. Не глотайте. |
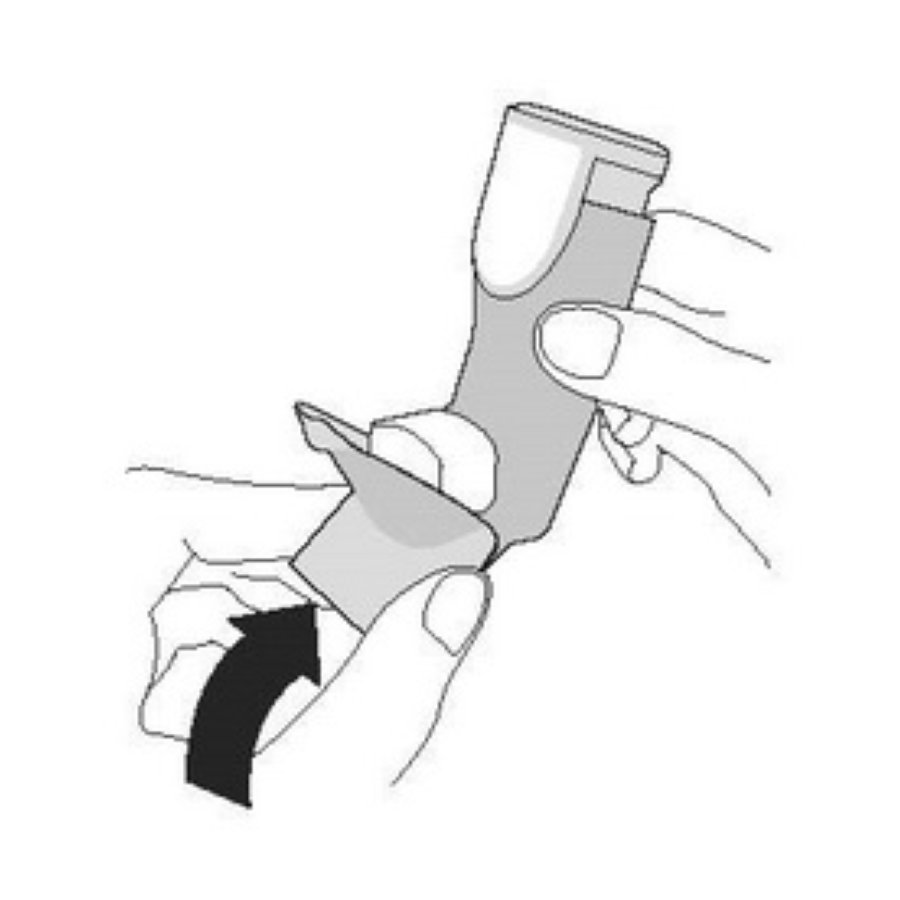 |  | |
Еженедельное промывание. Промывайте дозатор раз в неделю.
Еженедельно промывайте желтый дозатор, чтобы лекарственное средство не накапливалось и не блокировало распыление через мундштук.
Не допускайте намокания контейнера.
Повторно подготовьте ингалятор для использования после промывания.
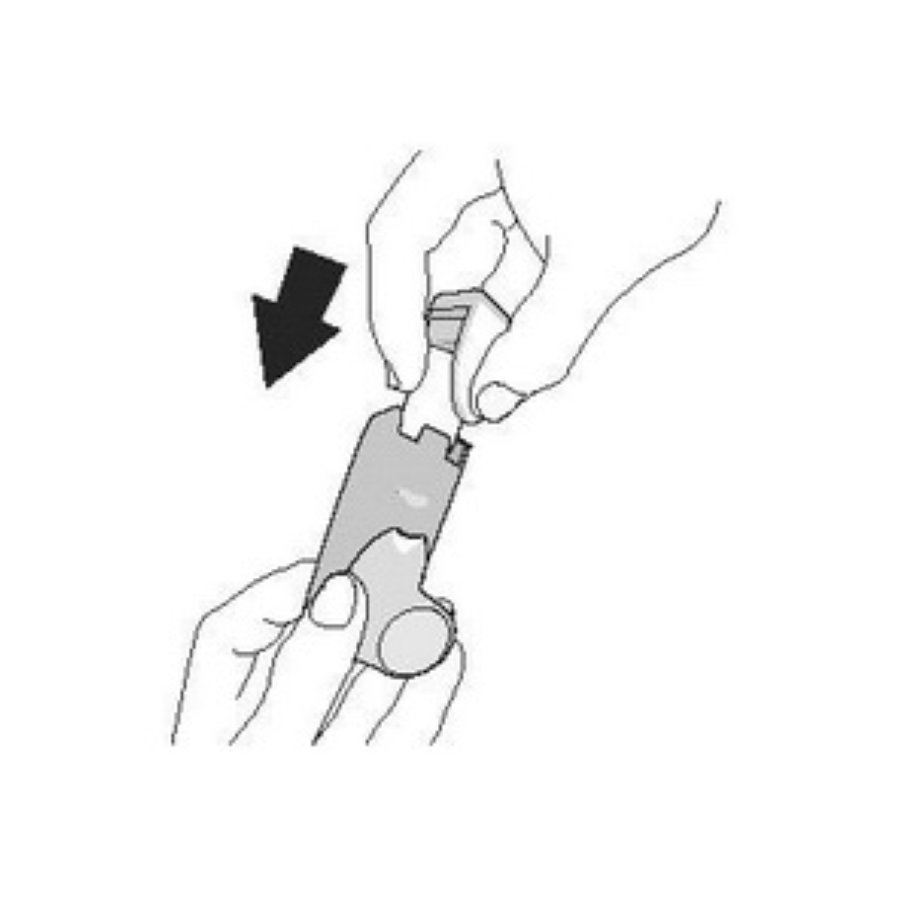
| Промыванне. Шаг 1 | Промыванне. Шаг 2 |
| Снимите контейнер и отложите. Не допускайте намокания контейнера. | Снимите колпачок мундштука. |
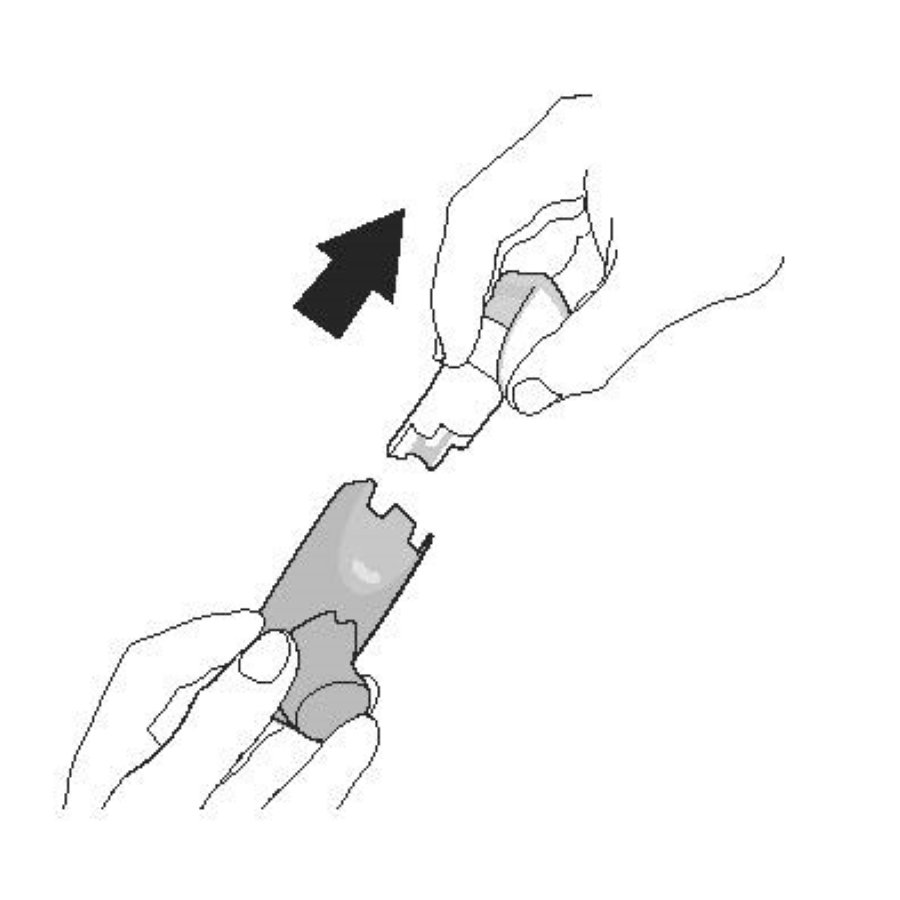 |  |
| Промыванне. Шаг 3 | Промыванне. Шаг 4 |
Пропустите теплую воду через мундштук в течение 30 с, а затем через верхнюю часть дозатора в течение 30 с. Промывайте всего 60 с.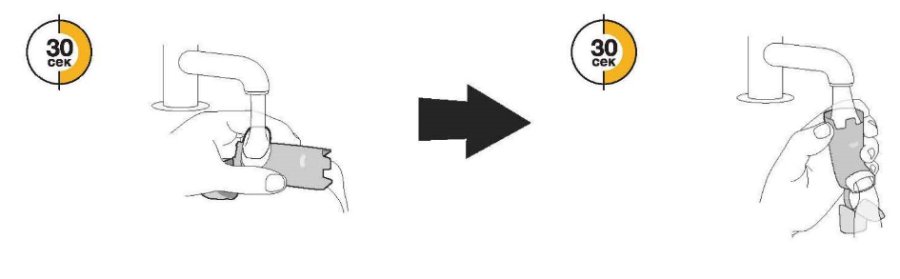 | Стряхните столько воды, сколько сможете.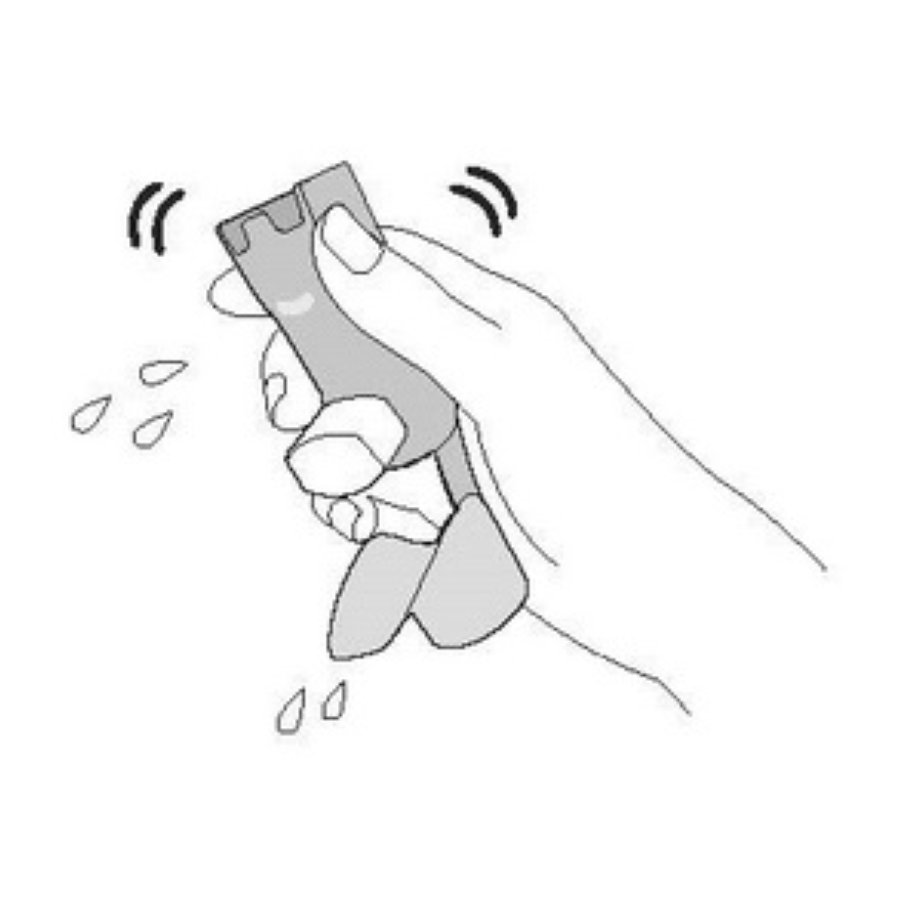 Не сушите полотенцем или салфеткой. |
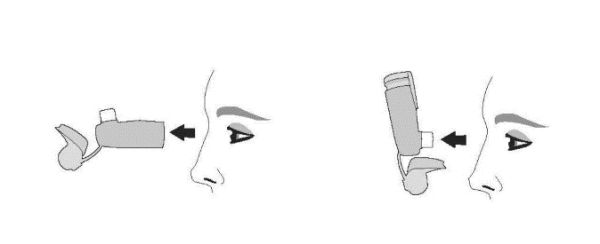
| Промыванне. Шаг 5 | Промыванне. Шаг 6 |
| Посмотрите внутрь дозатора и мундштука по поводу накопления лекарственного средства. Если имеются какие-либо накопления, повторите шаги промывания с 3 по 5. | Высушите на воздухе, лучше в течение ночи. Не вставляйте контейнер в дозатор, если он все еще влажный. |
 |  |
| Промыванне. Шаг 7 | Промыванне. Шаг 8 |
| Когда он высохнет, сначала установите колпачок мундштука, затем осторожно вставьте контейнер в дозатор. | Осуществите повторную подготовку путем проведения 2 тестовых распылений, встряхивая ингалятор перед каждым тестовым распылением. |
 | ×2 всего Встряхните ингалятор и сделайте тестовые распыления |
Дети. Применение лекарственного средства Триксео Аэросфера детям (в возрасте до 18 лет) по показаниям ХОБЛ не предусмотрено.
Противопоказания
гиперчувствительность к действующим веществам или к любым вспомогательным веществам, перечисленным в разделе СОСТАВ И ФОРМА ВЫПУСКА.
Побочные эффекты
резюме профиля безопасности
Профиль безопасности этого лекарственного средства характеризуется эффектами, характерными для кортикостероидов, антихолинергических средств и агонистов β2-адренорецепторов, так как к таким классам лекарственных средств относятся отдельные компоненты этого комбинированного лекарственного средства. Наиболее частыми побочными реакциями у пациентов, применявших это лекарственное средство, были пневмония (4,6%), головная боль (2,7%) и инфекция мочевыводящих путей (2,7%).
Список побочных реакций в форме таблицы основывается на опыте применения этого лекарственного средства в клинических испытаниях и опыте применения его отдельных компонентов.
Представленные ниже побочные реакции приведены по классам систем органов и по частоте их проявления: очень часто (≥1/10), часто (≥1/100 до <1/10), нечасто (≥1/1000 до <1/100), редко (≥1/10 000 до <1/1000), очень редко (<1/10 000), частота неизвестна (невозможно оценить ввиду имеющихся данных).
Таблица 3
Побочные реакции, классифицированные в группы по частоте и классу системы органов
| Класс системы органов | Побочная реакция на применение лекарственного средства | Частота |
| Инфекционные и паразитарные заболевания | Кандидоз ротовой полости, пневмония | Часто |
| Со стороны иммунной системы | Гиперчувствительность | Нечасто |
| Ангионевротический отек | Частота неизвестна | |
| Со стороны эндокринной системы | Признаки или симптомы системного воздействия ГКС, например гипофункция надпочечников | Очень редко |
| Со стороны обмена веществ и питания | Гипергликемия | Часто |
| Психические нарушения | Тревожность, бессонница | Часто |
| Депрессия, ажитация, беспокойство, повышенная возбудимость | Нечасто | |
| Ненормальное поведение | Очень редко | |
| Со стороны нервной системы | Головная боль | Часто |
| Головокружение, тремор | Нечасто | |
| Со стороны органа зрения | Нечеткость зрения (див. ОСОБЫЕ УКАЗАНИЯ), катаракта, глаукома | Частота неизвестна |
| Со стороны сердца | Усиленное сердцебиение | Часто |
| Стенокардия, тахикардия, нарушения ритма сердца (например, фибрилляция предсердий, наджелудочковая тахикардия и экстрасистолия) | Нечасто | |
| Со стороны органов дыхания, грудной клетки и средостения | Дисфония, кашель | Часто |
| Раздражение горла, бронхоспазм | Нечасто | |
| Со стороны ЖКТ | Тошнота | Часто |
| Сухость во рту | Нечасто | |
| Со стороны кожи и подкожной клетчатки | Образование гематом | Нечасто |
| Со стороны скелетно-мышечной и соединительной ткани | Мышечные спазмы | Часто |
| Со стороны почек и мочевыводящих путей | Инфекции мочевыводящих путей | Часто |
| Задержка мочи | Нечасто | |
| Нарушения общего характера и реакции в месте введения | Боль в грудной клетке | Нечасто |
Описание отдельных побочных реакций. Пневмония
KRONOS — это 24-недельное исследование, в котором приняли участие 1896 пациентов с ХОБЛ умеренной, тяжелой или очень тяжелой степени (на момент скрининга средний ОФВ1 после применения бронхолитика составлял 50% прогнозируемого значения, стандартное отклонение (СО) 14%), 26% из которых перенесли обострение ХОБЛ в течение года, предшествовавшего зачислению в исследование. Частота подтвержденных случаев пневмонии, зарегистрированных за 24 нед, равнялась 1,9% (12 пациентов) в группе Триксео Аэросфера (n=639), 1,6% (10 пациентов) в группе дозирующего аэрозольного ингалятора (ДАИ) формотерола фумарата дигидрата/гликопирония (ФОРМ/ГЛИ) 5/7,2 мкг (n=625), 1,9% (6 пациентов) в группе ДАИ формотерола фумарата дигидрата/будесонида (ФОРМ/БУД) 5/160 мкг (n=314) и 1,3% (4 пациента) в группе турбухалера формотерола фумарата дигидрата/будесонида (ФОРМ/БУД) 6/200 мкг (n=318). В исследовании KRONOS не было летальных случаев пневмонии во время применения лекарственного средства Триксео Аэросфера.
ETHOS — это 52-недельное исследование, в котором приняли участие 8529 пациентов (в популяции для оценки безопасности) с ХОБЛ умеренной, тяжелой или очень тяжелой степени или тяжелыми обострениями в анамнезе в течение предыдущих 12 мес (на момент скрининга средний ОФВ1 после применения бронхолитика составил 43% от прогнозируемого значения, СО 10%). Частота подтвержденных случаев пневмонии равнялась 4,2% (90 пациентов) в группе Триксео Аэросфера (n=2144), 3,5% (75 пациентов) в группе ДАИ формотерола фумарата дигидрата/гликопирония/будесонида (ФОРМ/ГЛИ/БУД) 7,2/80 мкг (n=2124), 2,3% (48 субъектов) в группе ДАИ ФОРМ/ГЛИ 5/7,2 мкг (n=2125) и 4,5% (96 субъектов) в группе ДАИ ФОРМ/БУД 5/160 мкг (n=2136). В исследовании ETHOS было зарегистрировано пять летальных случаев пневмонии во время этапа лечения (два в группе ДАИ ФОРМ/ГЛИ/БУД 5/7,2/80 мкг, три в группе ДАИ ФОРМ/ГЛИ и ни одного в группе Триксео Аэросфера).
Сообщение о побочных реакциях после регистрации лекарственного средства имеет важное значение. Это позволяет проводить мониторинг соотношения польза/риск при применении этого лекарственного средства. Медицинским и фармацевтическим работникам, а также пациентам или их законным представителям следует сообщать обо всех случаях подозреваемых побочных реакций и отсутствии эффективности лекарственного средства через Автоматизированную информационную систему по фармаконадзору по ссылке: https://aisf.dec.gov.ua.
Особые указания
это лекарственное средство не предназначено для лечения острых состояний.
Это лекарственное средство не показано для лечения острых эпизодов бронхоспазма, то есть для неотложной помощи.
Парадоксальный бронхоспазм. Применение формотерола/гликопирония/будесонида может вызвать парадоксальный бронхоспазм с внезапным свистящим дыханием и одышкой после введения дозы; такое состояние может быть опасно для жизни. Терапию этим лекарственным средством следует немедленно прекратить в случае возникновения парадоксального бронхоспазма. Пациента, у которого возник парадоксальный бронхоспазм, следует обследовать и в случае необходимости назначить альтернативную терапию.
Ухудшение течения заболевания. Не рекомендуется резко прекращать терапию этим лекарственным средством. Если пациенты считают лечение неэффективным, следует продолжить лечение, обратившись за медицинской помощью. Если пациенту приходится все чаще применять бронхолитик для облегчения симптомов, это указывает на ухудшение основного заболевания и необходимость пересмотра схемы лечения. Внезапное и прогрессирующее ухудшение симптомов ХОБЛ потенциально чревато для жизни, поэтому пациенту нужно срочно пройти медицинское обследование.
Воздействие на сердечно-сосудистую систему. После введения антагонистов мускариновых рецепторов и симпатомиметиков, включая гликопироний и формотерол, могут наблюдаться сердечно-сосудистые эффекты, такие как нарушения сердечного ритма, например фибрилляция предсердий и тахикардия. Это лекарство нужно применять с осторожностью пациентам с клинически значимыми неконтролируемыми и тяжелыми сердечно-сосудистыми заболеваниями, такими как нестабильная ИБС, острый инфаркт миокарда, кардиомиопатия, нарушения ритма сердца и тяжелая сердечная недостаточность.
Следует также быть осторожными, назначая лечение пациентам с известным или подозреваемым удлинением интервала Q–Tc (Q–Tc >450 мс у мужчин или >470 мс у женщин), независимо от того, является ли это нарушение врожденным или вызванным лекарственными средствами.
Системные эффекты кортикостероидов. Системные эффекты могут возникать при применении любых ингаляционных кортикостероидов, особенно при высоких дозах в течение длительного периода. Вероятность возникновения таких эффектов намного меньше при применении ингаляционных форм кортикостероидов по сравнению с пероральными. К возможным системным эффектам относятся синдром Кушинга, кушингоидные признаки, угнетение функции надпочечников, снижение минеральной плотности костной ткани, катаракта и глаукома. Следует учитывать возможное влияние лекарственного средства на минеральную плотность костной ткани, особенно у пациентов, применяющих лекарственное средство в высоких дозах в течение длительного периода и имеющих сопутствующие факторы риска остеопороза.
Нарушение зрения. При системном и местном применении кортикостероидов могут быть зарегистрированы случаи нарушения зрения. Если у пациента есть такие симптомы, как размытость зрения или другие нарушения зрения, его следует направить на консультацию к офтальмологу для установления возможной причины, которой может быть катаракта, глаукома или редкие заболевания, в частности центральная серозная хориоретинопатия; такие нарушения зрения были зарегистрированы после применения системных и местных кортикостероидов (см. ПОБОЧНЫЕ ЭФФЕКТЫ).
Переход с пероральной терапии. Особое внимание необходимо при лечении пациентов, которые переходят с перорального применения кортикостероидов, поскольку у них в течение значительного периода может сохраняться риск нарушения функции надпочечников. Пациенты, нуждающиеся в высокодозовой терапии кортикостероидами или длительном лечении ингаляционными кортикостероидами в наивысшей рекомендуемой дозе, также могут быть в группе риска. У таких пациентов при сильном стрессе могут возникать симптомы надпочечниковой недостаточности. В период стресса или в случае плановых хирургических вмешательств следует рассмотреть возможность дополнительного лечения системными кортикостероидами.
Пневмония у пациентов с ХОБЛ. У пациентов с ХОБЛ, получающих ингаляционные кортикостероиды, наблюдалось повышение частоты случаев пневмонии, включая пневмонию, требующую госпитализации. Существует ряд доказательств повышенного риска возникновения пневмонии при повышении дозы кортикостероида, однако это не было окончательно продемонстрировано ни в одном из исследований.
Для ингаляционных кортикостероидов отсутствуют исчерпывающие клинические доказательства разногласий по величине риска развития пневмонии.
Врачам следует быть внимательными относительно возможного развития пневмонии у пациентов с ХОБЛ, поскольку клинические признаки этого инфекционного заболевания совпадают с симптомами обострения ХОБЛ.
Факторы риска развития пневмонии у пациентов с ХОБЛ включают курение, пожилой возраст, низкий индекс массы тела и тяжелую ХОБЛ.
Гипокалиемия. При применении терапии агонистами β2-адренорецепторов возможно развитие потенциально серьезной гипокалиемии. Она может привести к побочным реакциям со стороны сердечно-сосудистой системы. Особая осторожность рекомендуется при тяжелом ХОБЛ, поскольку этот эффект может усиливаться гипоксией. Гипокалиемия также может усиливаться при одновременном применении этого лекарственного средства с другими лекарственными средствами, которые могут вызывать гипокалиемию, такими как производные ксантина, стероиды и диуретики (см. ВЗАИМОДЕЙСТВИЯ).
Гипергликемия. Ингаляция агонистов β2-адренорецепторов в высоких дозах может приводить к повышению уровня глюкозы в плазме крови. Поэтому во время лечения следует контролировать уровень глюкозы в крови в соответствии с установленными рекомендациями для пациентов с сахарным диабетом.
Сопутствующие заболевания. Это лекарственное средство следует с осторожностью применять пациентам с тиреотоксикозом.
Антихолинергическая активность. Вследствие антихолинергической активности это лекарственное средство следует с осторожностью применять пациентам с симптоматической гиперплазией предстательной железы, задержкой мочи или закрытоугольной глаукомой. Пациенты должны быть проинформированы о признаках и симптомах острой закрытоугольной глаукомы, а также о необходимости прекращения применения этого лекарственного средства и немедленном обращении к врачу в случае появления каких-либо из указанных признаков или симптомов.
Одновременное применение этого лекарственного средства с другими антихолинергическими лекарственными средствами не рекомендуется (см. ВЗАИМОДЕЙСТВИЯ).
Почечная недостаточность. Поскольку гликопироний выводится преимущественно почками, пациентам с тяжелой почечной недостаточностью (клиренс креатинина <30 мл/мин), в том числе пациентам с терминальной стадией почечной недостаточности, нуждающимся в диализе, нужно назначать это лекарственное средство только в том случае, если ожидаемая польза превышает потенциальные риски (см. Фармакокинетика).
Печеночная недостаточность. Пациентам с тяжелой печеночной недостаточностью следует назначать это лекарственное средство только в том случае, если ожидаемая польза превышает потенциальные риски (см. Фармакокинетика). Такие пациенты должны находиться под наблюдением в связи с возможными побочными реакциями.
Применение в период беременности или кормления грудью
Беременность. Данные по применению будесонида, гликопирония и формотерола беременными отсутствуют или ограничены.
Данные о применении ингаляционного будесонида более 2500 беременными женщинами указывают на отсутствие повышенного тератогенного риска, связанного с будесонидом. Клинические исследования разовой дозы показали, что очень небольшое количество гликопирония преодолевает плацентарный барьер.
Отсутствует опыт или данные о проблемах безопасности при использовании пропеллента норфлурана (HFA 134a) в период беременности или кормления грудью. Однако исследование влияния HFA 134a на репродуктивную функцию и эмбриофетальное развитие у животных не выявило клинически значимых побочных реакций.
Исследования репродуктивной токсичности этого лекарственного средства на животных не проводились. Было показано, что будесонид влечет за собой эмбриофетальную токсичность у крыс и кроликов; этот эффект присущ лекарственным средствам класса глюкокортикоидов. В очень высоких дозах/при очень высоких уровнях системной экспозиции формотерол вызывал выкидыши, а также снижение массы тела младенца при рождении и постнатальной выживаемости в ранних сроках, тогда как гликопироний не оказывал существенного влияния на репродуктивную функцию.
Назначение этого лекарственного средства беременным следует рассматривать только в том случае, если ожидаемая польза для матери оправдывает потенциальный риск для плода.
Кормление грудью. Клинико-фармакологическое исследование показало, что будесонид выводится с грудным молоком. Однако он не был обнаружен в плазме крови младенцев. На основании фармакокинетических параметров концентрация будесонида в плазме крови младенца составляет менее 0,17% от концентрации в плазме крови матери. Таким образом, при кормлении грудью детей, матери которых получают терапевтические дозы этого лекарственного средства, не ожидается каких-либо эффектов будесонида. Неизвестно, выводятся ли гликопироний и формотерол с грудным молоком. Имеются данные о проникновении гликопирония и формотерола в материнское молоко у крыс.
Назначение этого лекарственного средства кормящим грудью следует рассматривать только в случае, если ожидаемая польза для матери преобладает над любым возможным риском для ребенка.
Фертильность. Исследования на крысах показали неблагоприятное влияние формотерола на фертильность только в дозах, превышающих максимальные дозы для человека. Будесонид и гликопироний не оказывали неблагоприятного влияния на фертильность крыс. Маловероятно, что это лекарственное средство, назначенное в рекомендованных дозах, повлияет на фертильность у людей.
Способность влиять на скорость реакции при управлении транспортными средствами или другими механизмами. Лекарственное средство Триксео Аэросфера не влияет или оказывает незначительное влияние на способность управлять транспортными средствами и работать с другими механизмами. Однако головокружение является нечастой побочной реакцией, которую следует учитывать при управлении транспортными средствами или работе с другими механизмами.
Взаимодействия
фармакокинетические взаимодействия
Клинические исследования взаимодействия этого лекарственного средства с другими лекарственными средствами не проводились, однако вероятность метаболических взаимодействий считается низкой из исследований in vitro (см. Фармакокинетика).
Формотерол не ингибирует ферменты CYP 450 в терапевтически значимых концентрациях (см. Фармакокинетика). Будесонид и гликопироний не ингибируют и не индуцируют ферменты CYP 450 в терапевтически значимых концентрациях.
Метаболизм будесонида в первую очередь опосредуется действием фермента CYP 3A4 (см. Фармакокинетика). Ожидается, что при сопутствующем применении мощных ингибиторов CYP 3A, таких как итраконазол, кетоконазол, ингибиторы протеазы ВИЧ и лекарственные средства, содержащие кобицистат, повышается риск развития системных побочных реакций; такого сопутствующего применения следует избегать, если польза не преобладает над повышенным риском развития системных побочных реакций на кортикостероиды. Если все-таки принимается решение о таком сопутствующем применении, пациенты должны находиться под наблюдением касательно системных побочных реакций на кортикостероиды. Это наблюдение имеет ограниченное клиническое значение при краткосрочном (1–2 нед) лечении.
Ограниченные данные по указанным выше видам взаимодействия при применении высоких доз ингаляционной формы будесонида указывают на то, что возможно значительное повышение плазменных уровней (в среднем в 4 раза), если итраконазол в дозе 200 мг 1 раз в сутки применяется вместе с ингаляционной формой будесонида (разовая доза 1000 мкг).
Поскольку гликопироний выводится в большинстве своем почками, возможно взаимодействие этого препарата с лекарственными средствами, влияющими на механизмы почечной экскреции. In vitro гликопироний представляет собой субстрат для почечных транспортеров OCT2 и MATE1/2K. Исследование влияния циметидина, маркерного ингибитора OCT2 и MATE1, на распределение ингаляционной формы гликопирония показало ограниченное увеличение его общей системной экспозиции (AUC0–t) на 22% и незначительное снижение почечного клиренса на 23% из-за одновременного введения циметидина.
Фармакодинамические взаимодействия
Другие антимускариновые средства и симпатомиметики. Совместное применение этого лекарственного средства с другими лекарственными средствами, содержащими антихолинергические лекарственные средства и/или агонисты β2-адренорецепторов длительного действия, не изучалось и не рекомендуется, так как оно может усиливать известные побочные реакции на ингаляционные антагонисты мускариновых рецепторов или β2-адренорецепторов. (см. ОСОБЫЕ УКАЗАНИЯ и ПЕРЕДОЗИРОВКА).
При одновременном применении других β-адренергических лекарственных средств могут отмечаться потенциально аддитивные эффекты; поэтому следует соблюдать осторожность, назначая другие β-адренергические лекарственные средства одновременно с формотеролом.
Гипокалиемия, вызванная лекарственными средствами. Возможна начальная гипокалиемия, которая может усиливаться при сопутствующем применении лекарственных средств, включая производные ксантина, кортикостероиды и диуретики, не являющиеся калийсберегающими (см. ОСОБЫЕ УКАЗАНИЯ). Гипокалиемия может усилить склонность к аритмии у пациентов, получающих гликозиды наперстянки.
Блокаторы β-адренорецепторов (в том числе глазные капли) могут ослаблять или угнетать действие формотерола. Следует избегать одновременного применения блокаторов β-адренорецепторов, за исключением случаев, когда ожидаемая польза превышает потенциальные риски. Если нужны блокаторы β-адренорецепторов, предпочтение отдается кардиоселективным средствам этого класса.
Остальные фармакодинамические взаимодействия. При одновременном применении хинидина, дизопирамида, прокаинамида, антигистаминных лекарственных средств, ингибиторов МАО, трициклических антидепрессантов и фенотиазина может удлиняться интервал Q–T и повышаться риск возникновения желудочковых аритмий. Кроме того, L-допа, L-тироксин, окситоцин и алкоголь могут ухудшать толерантность сердца к β2-симпатомиметикам.
Сопутствующее применение ингибиторов МАО, включая лекарственные средства с подобными свойствами, такими как фуразолидон и прокарбазин, может провоцировать гипертонические реакции.
У пациентов, получающих сопутствующую анестезию с использованием галогенированных углеводородов, существует повышенный риск аритмии.
Передозировка
передозировка лекарственным средством Триксео Аэросфера может привести к усилению признаков и симптомов, являющихся побочными реакциями на антихолинергические лекарственные средства и/или агонисты β2-адренорецепторов. Наиболее частыми из них являются нечеткость зрения, сухость во рту, тошнота, мышечный спазм, тремор, головная боль, усиленное сердцебиение и систолическая АГ. При длительном применении в чрезмерных дозах возможно возникновение системных эффектов ГКС.
Специфическое лечение при передозировке этим лекарственным средством отсутствует. При передозировке пациенту необходимо проводить поддерживающую терапию с надлежащим контролем при необходимости.
Условия хранения
при температуре не выше 30 °С. Не подвергать воздействию температуры выше 50 °С. Не прокалывать контейнер под давлением острыми предметами.
Хранить в сухом месте.
