Калквенс (Calquence®)
Калквенс инструкция по применению
Состав
Вспомогательные вещества: силиконизированная микрокристаллическая целлюлоза; частично прежелатинизированный крахмал; натрия крахмалгликолят, тип A; магния стеарат; состав твердой желатиновой оболочки капсулы: оболочка (желатин, железа оксид желтый (E172), индиготин — FD&C Blue 2 (E132), титана диоксид (E171); чернила (поливальный сироп с шеллаком — 45% (20% этерифицированный) в этаноле, железа оксид черный (Е172), пропиленгликоль, аммония гидроксид 28%)).
Акалабрутиниб - 100 мг
Фармакологические свойства
механизм действия. Акалабрутиниб — это селективный ингибитор тирозинкиназы Брутона (ТКБ). ТКБ представляет собой сигнальную молекулу антигенных рецепторов В-клеток и рецептора цитокинов. В B-клетках передача сигналов с помощью ТКБ способствует выживанию и пролиферации B-клеток и необходима для клеточной адгезии, миграции и хемотаксиса. Акалабрутиниб и его активный метаболит АСР-5862 формируют ковалентную связь с цистеиновым остатком в активном центре ТКБ, что приводит к необратимой инактивации ТКБ с минимальными нецелевыми взаимодействиями.
Фармакодинамика. У пациентов с В-клеточными лимфопролиферативными заболеваниями при получении акалабрутиниба в дозе 100 мг дважды в сутки медиана связывания ТКБ в равновесном состоянии в периферической крови более 95% сохранялась более 12 ч, что приводило к инактивации ТКБ в течение рекомендованного интервала.
Кардиоэлектрофизиология. Влияние акалабрутиниба на интервал Q–Tc было оценено у 46 здоровых мужчин и женщин в рандомизированном двойном слепом тщательном исследовании Q–T с применением плацебо и положительного контроля. В сверхтерапевтической дозе, которая в 4 раза превышала максимальную рекомендованную дозу, Калквенс не приводил к клинически значимому увеличению интервала Q–T/Q–Tc (например не превышал или равнялся 10 мс) (см. ОСОБЫЕ УКАЗАНИЯ И ПОБОЧНЫЕ ЭФФЕКТЫ).
Клиническая эффективность и безопасность. Пациенты с ранее не леченным хроническим лимфоцитарным лейкозом (ХЛЛ). Безопасность и эффективность применения лекарственного средства Калквенс для лечения пациентов с ранее не леченным ХЛЛ были оценены в рандомизированном мультицентровом открытом исследовании ІІІ фазы (ELEVATE-TN) с участием 535 человек. Больные получали лекарственные средства по следующим схемам лечения: Калквенс + обинутузумаб, Калквенс в качестве монотерапии или обинутузумаб + хлорамбуцил. В исследование ELEVATE-TN были включены пациенты в возрасте от 65 лет или в возрасте 18–65 лет с сопутствующими заболеваниями, при этом у 27,9% участников отмечали клиренс креатинина <60 мл/мин. У 16,1% пациентов в возрасте до 65 лет средний балл по шкале CIRS-G составлял 8. Участникам исследования разрешалось принимать антитромботические лекарственные средства. Из исследования были исключены пациенты, нуждавшиеся в получении антикоагулянтной терапии с применением варфарина или аналогичных антагонистов витамина К. Пациенты были рандомизированы в соотношении 1:1:1 на 3 группы и получали:
– Калквенс + обинутузумаб: Калквенс принимали в дозе 100 мг сутки, начиная с 1-го дня цикла 1, до прогрессирования заболевания или возникновения неприемлемого токсического эффекта. Обинутузумаб применяли с 1-го дня цикла 2 в течение максимум 6 циклов терапии: в общей дозе 1000 мг — в дни 1 и 2 (100 мг в 1-й день и 900 мг в 2-й день), 8 и 15 цикла 2, затем 1000 мг в 1-й день циклов 3–7. Каждый цикл длился 28 дней;
– Калквенс в качестве монотерапии: Калквенс принимали в дозе 100 мг дважды в сутки до прогрессирования заболевания или возникновения неприемлемого токсического эффекта;
– обинутузумаб + хлорамбуцил: обинутузумаб и хлорамбуцил применяли в течение максимум 6 циклов терапии: обинутузумаб в общей дозе 1000 мг — в дни 1 и 2 (100 мг в 1-й день и 900 мг на 2-й день, 8 и 15 цикла 1, а затем 1000 мг в 1-й день циклов 2–6; хлорамбуцил в дозе 0,5 мг/кг — в дни 1-й и 15-й циклов 1–6. Каждый цикл длился 28 дней.
Пациенты были стратифицированы по мутационному статусу делеции участка хромосомы 17p (по наличию или отсутствию), функциональному статусу по шкале ECOG (0 или 1 против 2) и географическому региону (Северная Америка и Западная Европа против других регионов). После подтверждения прогрессирования заболевания 45 пациентов, рандомизированных для получения комбинации обинутузумаб + хлорамбуцил, перешли на Калквенс в качестве монотерапии. В табл. 1 приведены основные демографические данные и характеристики заболевания изучаемой популяции.
Таблица 1. Характеристики пациентов с ранее не леченным ХЛЛ (в исследовании ELEVATE-TN)
| Характеристика | Калквенс + обинутузумаб, N=179 | Калквенс как монотерапия, N=179 | Обинутузумаб + хлорамбуцил, N=17 |
| Медиана возраста в годах (диапазон) | 70 (41–88) | 70 (44–87) | 71 (46–91) |
| Мужчины, % | 62 | 62 | 59,9 |
| Представители европеоидной расы, % | 91,6 | 95 | 93,2 |
| Функциональный статус по шкале ECOG 0–1, % | 94,4 | 92,2 | 94,4 |
| Медиана времени с момента установления диагноза (мес) | 30,5 | 24,4 | 30,7 |
| Генерализованная лимфаденопатия с узлами ≥5 см, % | 25,7 | 38 | 31,1 |
| Цитогенетический профиль/хромосомная аномалия, исследованная методом флуоресцентной гибридизации in situ, % | |||
| Делеция участка 17p хромосомы | 9,5 | 8,9 | 9 |
| Делеция участка 11q хромосомы | 17,3 | 17,3 | 18,6 |
| Мутация гена TP53 | 11,7 | 10,6 | 11,9 |
| Немутированный ген вариабельных тяжелых цепей иммуноглобулина | 57,5 | 66,5 | 65,5 |
| Сложный кариотип (≥3 аномалий) | 16,2 | 17,3 | 18,1 |
| Стадия ХЛЛ по Rai, % | |||
| 0 | 1,7 | 0 | 0,6 |
| I | 30,2 | 26,8 | 28,2 |
| II | 20,1 | 24,6 | 27,1 |
| III | 26,8 | 27,9 | 22,6 |
| IV | 21,2 | 20,7 | 21,5 |
Первичной конечной точкой была выживаемость без прогрессирования (ВБП) в группе пациентов, получавших Калквенс + обинутузумаб, по сравнению с группой, получавшей обинутузумаб + хлорамбуцил, по оценке независимой экспертной комиссии (НЭК) в соответствии с критериями Международного семинара по ХЛЛ (International Workshop on Chronic Lymphocytic Leukemia — IWCLL), проведенного в 2008 г., с включением разъяснения по поводу лимфоцитоза, связанного с лечением (Cheson 2012). При медиане последующего наблюдения 28,3 мес ВБП пациентов с ранее не леченным ХЛЛ по оценке НЭК в группе применения Калквенс + обинутузумаб показала статистически значимое снижение риска прогрессирования заболевания или смерти на 90% по сравнению с группой применения обинутузумаба + хлорамбуцила. Результаты оценки эффективности приведены в табл. 2. Кривые Каплана — Мейера для ВБП приведены на рис. 1.
Таблица 2. Эффективность применения для лечения пациентов с ХЛЛ по оценке НЭК (в исследовании ELEVATE-TN)
| Показатель | Калквенс + обинутузумаб, N=179 | Калквенс, монотерапия, N=179 | Обинутузумаб + хлорамбуцил, N=177 |
| ВБП* | |||
| Количество событий (%) | 14 (7,8) | 26 (14,5) | 93 (52,5) |
| ПЗ, n (%) | 9 (5) | 20 (11,2) | 82 (46,3) |
| Летальные исходы (%) | 5 (2,8) | 6 (3,4) | 11 (6,2) |
| Медиана (95% ДИ), мес | н. д. | н. д. (34,2–н. д.) | 22,6 (20,2–27,6) |
| ОР† (95% ДИ) | 0,10 (0,06–0,17) | 0,20 (0,13–0,30) | — |
| P-значение | <0,0001 | <0,0001 | — |
| Расчет за 24 мес, % (95% ДИ) | 92,7 (87,4–95,8) | 87,3 (80,9–91,7) | 46,7(38,5–54,6) |
| ОВa | |||
| Летальные исходы (%) | 9 (5) | 11 (6,1) | 17 (9,6) |
| ОР (95% ДИ)† | 0,47 (0,21–1,06) | 0,60 (0,28–1,27) | — |
| Наилучшая ОЧО* (ПО + ПОн + ЧОn + ЧО) | |||
| ОЧО, n (%) | 168 (93,9) | 153 (85,5) | 139 (78,5) |
| (95% ДИ) | (89,3–96,5) | (79,6, 89,9) | (71,9–83,9) |
| P-значение | <0,0001 | 0,0763 | — |
| ПО, n (%) | 23 (12,8) | 1 (0,6) | 8 (4,5) |
| ПОн, n (%) | 1 (0,6) | 0 | 0 |
| ЧОn, n (%) | 1 (0,6) | 2 (1,1) | 3 (1,7) |
| ЧО, n (%) | 143 (79,9) | 150 (83,8) | 128 (72,3) |
ОР — отношение рисков; ДИ — доверительный интервал; ОВ — общая выживаемость; ОЧО — общая частота ответа; н. д. — не достигнуто; ПО — полный ответ; ПОн — полный ответ с неполным восстановлением параметров крови; ПЗ — прогрессирование заболевания; ЧОn — частичный нодулярный ответ; ЧВ – частичный ответ.
*По оценке НЭК.
†На основе стратифицированной модели пропорциональных рисков Кокса.
aМедиана ОВ не была достигнута в обеих группах.
Рис. 1. Кривая Каплана — Мейера для ВБП у пациентов с ХЛЛ (ITT-популяция) по оценке НЭК (в исследовании ELEVATE-TN).
Результаты ВБП для схем лечения, включающие Калквенс с обинутузумабом или без него, были аналогичными во всех подгруппах, в том числе в подгруппах с признаками высокого риска. В популяции ХЛЛ с высоким риском (с делецией 17p, делецией 11q, мутацией гена TP53 и немутированным геном вариабельных тяжелых цепей иммуноглобулина) ОР для ВБП для схем лечения, включавших Калквенс с обинутузумабом или без него, составляло 0,08 (95% ДИ 0,04–0,15) по сравнению с 0,13 (95% ДИ 0,08–0,21) для схемы обинутузумаб + хлорамбуцил.
Таблица 3. Анализ ВБП в подгруппах (в исследовании ELEVATE-TN)
| Показатель | Калквенс, монотерапия | Калквенс + обинутузумаб | ||||
| N | ОР | 95% ДИ | N | ОР | 95% ДИ | |
| Все пациенты | 179 | 0,20 | (0,13–0,30) | 179 | 0,10 | (0,06–0,17) |
| Делеция 17р | ||||||
| Да | 19 | 0,20 | (0,06–0,64) | 21 | 0,13 | (0,04–0,46) |
| Нет | 160 | 0,20 | (0,12–0,31) | 158 | 0,09 | (0,05–0,17) |
| Мутация гена ТР53 | ||||||
| Да | 19 | 0,15 | (0,05–0,46) | 21 | 0,04 | (0,01–0,22) |
| Нет | 160 | 0,20 | (0,12–0,32) | 158 | 0,11 | (0,06–0,20) |
| Делеция 17р и/или мутация ТР53 | ||||||
| Да | 23 | 0,10 | (0,03–0,34) | 25 | (0,03–0,34) | (0,09–0,48) |
| Нет | 156 | 0,10 | (0,05–0,18) | 154 | (0,05–0,18) | (0,21–0,61) |
| Мутация гена вариабельных тяжелых цепей иммуноглобулина | ||||||
| С мутацией | 58 | 0,69 | (0,31–1,56) | 74 | 0,15 | (0,04–0,52) |
| Без мутации | 119 | 0,11 | (0,07–0,19) | 103 | 0,08 | (0,04–0,16) |
| Делеция 11q | ||||||
| Да | 31 | 0,07 | (0,02–0,22) | 31 | 0,09 | (0,03–0,26) |
| Нет | 148 | 0,26 | (0,16–0,41) | 148 | 0,10 | (0,05–0,20) |
| Сложный кариотип | ||||||
| Да | 31 | 0,10 | (0,03–0,33) | 29 | 0,09 | (0,03–0,29) |
| Нет | 117 | 0,27 | (0,16–0,46) | 126 | 0,11 | (0,05–0,21) |
Пациенты с ХЛЛ, получившие по крайней мере один курс терапии. Безопасность и эффективность применения лекарственного средства Калквенс для лечения пациентов с рецидивирующим или рефрактерным ХЛЛ были оценены в рандомизированном мультицентровом открытом исследовании ІІІ фазы (ASCEND) с участием 310 пациентов, получивших по меньшей мере один курс терапии, не включавший ингибиторы BCL-2 или ингибиторы рецепторов B-клеток. Участникам применяли лекарственные средства по следующим схемам лечения: Калквенс в качестве монотерапии или иделалисиб + ритуксимаб или бендамустин + ритуксимаб по выбору исследователя. Пациентам не разрешалось принимать антитромботические лекарственные средства. Из исследования были исключены лица, нуждавшиеся в антикоагулянтной терапии с применением варфарина или аналогичных антагонистов витамина К.
Пациенты были рандомизированы в соотношении 1:1 и получали:
– Калквенс в дозе 100 мг дважды в сутки до прогрессирования заболевания или развития неприемлемой токсичности, или
– по выбору исследователя:
· иделалисиб в дозе 150 мг дважды в сутки в комбинации с ритуксимабом в дозе 375 мг/м2 в/в в 1-й день первого цикла, затем в дозе 500 мг/м2 в/в каждые 2 нед до получения 4 доз, а затем каждые 4 нед до получения 3 доз, что в целом соответствует 8 инфузиям;
· бендамустин в дозе 70 мг/м2 (в 1-й и 2-й день каждого 28-дневного цикла) в комбинации с ритуксимабом (375 мг/м2/500 мг/м2) в 1-й день каждого 28-дневного цикла в течение до 6 циклов.
Пациенты были стратифицированы по мутационному статусу делеции участка хромосомы 17p (по наличию или отсутствию), функциональному статусу по шкале ECOG (0 или 1 против 2) и количеству полученных курсов терапии (1–3 против ≥4). После подтверждения прогрессирования заболевания 35 пациентов, которые были рандомизированы по выбору исследователя для получения комбинации иделалисиб + ритуксимаб или бендамустин + ритуксимаб, перешли на Калквенс в качестве монотерапии. В табл. 4 приведены демографические данные и характеристики заболевания изучаемой популяции.
Таблица 4 Характеристики пациентов с ХЛЛ (в исследовании ASCEND)
| Характеристика | Калквенс, монотерапия, N=155 | Иделалисиб + ритуксимаб или бендамустин + ритуксимаб на выбор исследователя, N=155 |
| Медиана возраста в годах (диапазон) | 68 (32–89) | 67 (34–90) |
| Мужчины, % | 69,7 | 64,5 |
| Представители европеоидной расы,% | 93,5 | 91,0 |
| Функциональный статус по шкале ECOG, % | ||
| 0 | 37,4 | 35,5 |
| 1 | 50,3 | 51,0 |
| 2 | 12,3 | 13,5 |
| Медиана времени с момента установления диагноза (мес) | 85,3 | 79,0 |
| Генерализованная лимфаденопатия с узлами ≥5 см, % | 49,0 | 48,4 |
| Медиана количества полученных курсов терапии ХЛЛ (диапазон) | 1 (1–8) | 2 (1–10) |
| Количество полученных курсов терапии ХЛЛ, % | ||
| 1 | 52,9 | 43,2 |
| 2 | 25,8 | 29,7 |
| 3 | 11,0 | 15,5 |
| ≥ 4 | 10,3 | 11,6 |
| Цитогенетический профиль/хромосомная аномалия, исследованная методом флуоресцентной гибридизации in situ, % | ||
| Делеция участка 17p хромосомы | 18,1 | 13,5 |
| Делеция участка 11q хромосомы | 25,2 | 28,4 |
| Мутация гена TP53 | 25,2 | 21,9 |
| Немутированный ген вариабельных тяжелых цепей иммуноглобулина | 76,1 | 80,6 |
| Сложный кариотип (≥3 аномалий) | 32,3 | 29,7 |
| Стадия ХЛЛ по Rai, % | ||
| 0 | 1,3 | 2,6 |
| I | 25,2 | 20,6 |
| II | 31,6 | 34,8 |
| III | 13,5 | 11,6 |
| IV | 28,4 | 29,7 |
Первичной конечной точкой была ВБП по оценке НЭК в соответствии с критериями Международного семинара по хроническому лимфоцитарному лейкозу (IWCLL), проведенному в 2008 г., с включением разъяснения относительно лимфоцитоза, связанного с лечением (Cheson 2012). При медиане последующего наблюдения 16,1 мес ВБП показало статистически значимое снижение риска смерти или прогрессирования заболевания на 69% в группе пациентов, получавших Калквенс. Результаты оценки эффективности приведены в табл. 5. Кривые Каплана — Мейера для ВБП приведены на рис. 2.
Таблица 5 Эффективность применения для лечения пациентов с ХЛЛ по оценке НЭК (в исследовании ASCEND)
| Показатель | Калквенс, монотерапия, N=155 | Иделалисиб + ритуксимаб или бендамустин + ритуксимаб на выбор исследователя, N=155 |
| ВБП* | ||
| Количество событий (%) | 27 (17,4) | 68 (43,9) |
| ПЗ, n (%) | 19 (12,3) | 59 (38,1) |
| Летальные исходы (%) | 8 (5,2) | 9 (5,8) |
| Медиана (95% ДИ), мес | н. д. | 16,5 (14,0–17,1) |
| ОР† (95% ДИ) | 0,31 (0,20, 0,49) | |
| P-значения | <0,0001 | |
| Расчет за 15 мес, % (95% ДИ) | 82,6 (75,0, 88,1) | 54,9 (45,4–63,5) |
| ООa | ||
| Летальные исходы (%) | 15 (9,7) | 18 (11,6) |
| ОР (95% ДИ)† | 0,84 (0,42, 1,66) | — |
| Наилучший ОЧО* (ПО + ПОн + ЧОn + ЧО)** | ||
| ОЧО, n (%) | 126 (81,3) | 117 (75,5) |
| (95% ДИ) | (74,4, 86,6) | (68,1, 81,6) |
| P-значение | 0,2248 | — |
| ПО, n (%) | 0 | 2 (1,3) |
| ЧОn, n (%) | 126 (81,3) | 115 (74,2) |
| ДО | ||
| Медиана (95% ДИ), мес | н.д. | 13,6 (11,9–н.д.) |
ДО — длительность ответа.
*По оценке НЭК.
aМедиана ОВ не была достигнута в обеих группах. P-значение для ОВ составляло <0,6089.
**ПОн и ЧОn составляют 0.
†На основе стратифицированной модели пропорциональных рисков Кокса.
На основе долгосрочных данных медиана последующего наблюдения составляла 22,1 мес в группе пациентов, получавших Калквенс, и 21,9 мес в группе, получавшей иделалисиб + ритуксимаб или бендамустин + ритуксимаб. Медиана ВБП не была достигнута в группе пациентов, получавших Калквенс, и составила 16,8 мес в группе пациентов, получавших иделалисиб + ритуксимаб или бендамустин + ритуксимаб. ОР для оцененной исследователем ВБП в группе пациентов, получавших Калквенс, составило 0,27 (95% ДИ 0,18–0,40) по сравнению с группой, в которой применяли иделалисиб + ритуксимаб или бендамустин + ритуксимаб, что на 73% снижает риск смерти или прогрессирование заболевания в группе пациентов, получавших Калквенс. Результаты выполненной исследователем оценки эффективности приведены в табл. 6.
Таблица 6 Эффективность применения для лечения пациентов с ХЛЛ по оценке исследователя, выполненной во время длительного последующего наблюдения (в исследовании ASCEND)
| Показатель | Калквенс, монотерапия, N=155 | Иделалисиб + ритуксимаб или бендамустин + ритуксимаб на выбор исследователя, N=155 |
| ВБП* | ||
| Количество событий (%) | 35 (22,6) | 90 (58,1) |
| ПЗ, n (%) | 23 (14,8) | 79 (51) |
| Летальные исходы (%) | 12 (7,7) | 11 (7,1) |
| Медиана (95% ДИ), мес | н. д. | 16,8 (14,1–22,4) |
| ОР† (95% ДИ) | 0,27 (0,18–0,40) | |
| Расчет за 21 мес, % (95% ДИ) | 79,1 (71,5–84,8) | 45,3 (36,9–53,4) |
| ОВa | ||
| Летальные исходы (%) | 21 (13,5) | 26 (16,8) |
| ОР (95% ДИ)† | 0,78 (0,44–1,40) | — |
| Наилучшая ОЧО* (ПО + ПОн + ЧОn + ЧО)** | ||
| ОЧО, n (%) | 124 (80) | 130 (83,9) |
| (95% ДИ) | (73, 85,5) | (77,3–88,8) |
| P-значение | 0,3516 | — |
| ПО, n (%) | 5 (3,2) | 6 (3,9) |
| ЧОn, n (%) | 114 (73,и) | 122 (78,7) |
| ДО | ||
| Медиана (95% ДИ), мес | Н. д. | 18 (11,9–19,8) |
*По оценке исследователя.
aМедиана ОВ не была достигнута в обеих группах.
P-значение для ОВ составляло <0,4094.
**ПОн и ЧОn составляют 2 и 5 соответственно.
†На основе стратифицированной модели пропорциональных рисков Кокса.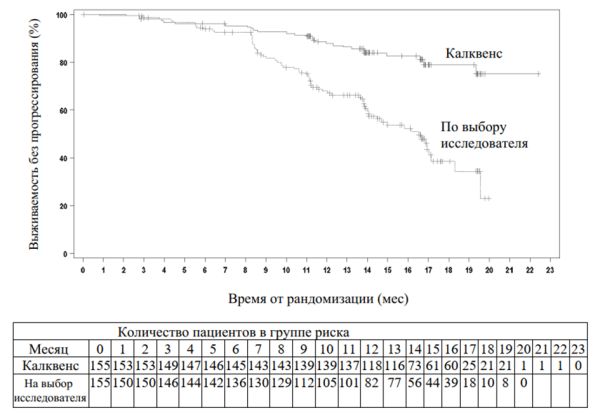
Рис. 2. Кривая Каплана — Мейера для ВБП у пациентов с ХЛЛ (ITT-популяция) по оценке НЭК (в исследовании ASCEND).
Результаты ВБП для лекарственного средства Калквенс были аналогичными во всех подгруппах, в том числе в подгруппах с признаками высокого риска. В популяции ХЛЛ с высоким риском (с делецией 17p, делецией 11q, мутацией гена TP53 и немутированным геном вариабельных тяжелых цепей иммуноглобулина) ОР для ВБП составило 0,25 (95% ДИ 0,16–0,38).
Таблица 7 Анализ ПБП в подгруппах (в исследовании ASCEND)
| Показатель | Калквенс, монотерапия | ||
| N | ОР | 95% ДИ | |
| Все пациенты | 155 | 0,27 | (0,18–0,40) |
| Делеция 17p | |||
| Да | 28 | 0,18 | (0,07–0,43) |
| Нет | 127 | 0,30 | (0,19–0,47) |
| Мутация гена TP53 | |||
| Да | 39 | 0,17 | (0,08–0,37) |
| Нет | 113 | 0,33 | (0,21–0,52) |
| Делеция 17p или мутация TP53 | |||
| Да | 45 | 0,16 | (0,08–0,34) |
| Нет | 108 | 0,34 | (0,22–0,55) |
| Мутация гена вариабельных тяжелых цепей иммуноглобулина | |||
| С мутацией | 33 | 0,30 | (0,12–0,76) |
| Без мутации | 118 | 0,28 | (0,18–0,43) |
| Делеция 11q | |||
| Да | 39 | 0,35 | (0,16–0,75) |
| Нет | 116 | 0,26 | (0,16–0,41) |
| Сложный кариотип | |||
| Да | 50 | 0,28 | (0,15–0,53) |
| Нет | 97 | 0,25 | (0,15–0,44) |
Пациенты детского возраста. Европейское агентство по лекарственным средствам позволило не подавать результаты исследований по применению лекарственного средства Калквенс во всех подгруппах пациентов детского возраста с ХЛЛ (см. ПРИМЕНЕНИЕ для получения информации о применении у детей).
Фармакокинетика акалабрутиниба и его активного метаболита АСР-5862 была изучена в исследованиях с участием здоровых лиц и пациентов с В-клеточными лимфопролиферативными заболеваниями. Для акалабрутиниба характерна дозозависимость, причем фармакокинетические показатели как для акалабрутиниба, так и для ACP-5862 почти линейны в диапазоне доз 75–250 мг. По данным популяционного фармакокинетического моделирования, фармакокинетика акалабрутиниба и АСР-5862 сходна у пациентов с различными B-клеточными лимфопролиферативными заболеваниями. У пациентов с В-клеточными лимфопролиферативными заболеваниями (в том числе у лиц с ХЛЛ) среднее геометрическое AUC при достижении равновесного состояния в расчете за сутки (AUC24h) для акалабрутиниба и АСР-5862 составляло 1679 нг·ч/мл и 438 нг/мл, а Cmax акалабрутиниба в плазме крови — 4166 нг·ч/мл и 446 нг/мл соответственно при приеме препарата в рекомендованных дозах 100 мг дважды в сутки.
Абсорбция. Время достижения Cmax акалабрутиниба и АСР-5862 в плазме крови составляло 0,5–1,5 ч и 1 ч соответственно. Абсолютная биодоступность лекарственного средства Калквенс составила 25%.
Влияние употребления пищи на акалабрутиниб. У здоровых лиц прием однократной дозы 75 мг акалабрутиниба с пищей с высоким содержанием жиров и калорий (приблизительно 918 ккал, 59 г углеводов, 59 г жиров и 39 г белков) не влиял на среднее значение AUC по сравнению с приемом натощак. При этом Сmax снизилась на 69%, а время достижения Cmax увеличилось на 1–2 часа.
Распределение. Обратимое связывание с белками плазмы крови человека составило 97,5% для акалабрутиниба и 98,6% для АСР-5862. Среднее соотношение концентраций в крови и плазме крови in vitro составило 0,8 для акалабрутиниба и 0,7 для АСР-5862. Средний объем распределения акалабрутиниба в равновесном состоянии составлял примерно 34 л.
Биотрансформация. In vitro акалабрутиниб преимущественно метаболизируется с участием ферментов CYP 3A и в меньшей степени путем конъюгации с глутатионом и гидролиза амидов. АСР-5862 является основным метаболитом в плазме крови, который в дальнейшем метаболизируется преимущественно за счет CYP 3A-опосредованного окисления и среднее геометрическое экспозиции (AUC) которого примерно в 2–3 раза больше, чем таковое акалабрутиниба. АСР-5862 примерно на 50% менее эффективно угнетает ТКБ, чем акалабрутиниб.
Результаты исследований in vitro свидетельствуют о том, что акалабрутиниб не ингибирует CYP 1A2, CYP 2B6, CYP 2C8, CYP 2C9, CYP 2C19, CYP 2D6, UGT1A1 или UGT2B7 в клинически значимых концентрациях. Его влияние на клиренс субстратов этих CYP маловероятно.
Результаты исследований in vitro свидетельствуют о том, что ACP-5862 не ингибирует CYP 1A2, CYP 2B6, CYP 2C8, CYP 2C9, CYP 2C19, CYP 2D6, CYP 3A4/5, UGT1A1 или UGT2B7 в клинически значимых концентрациях. Его влияние на клиренс субстратов этих CYP маловероятно.
Взаимодействие с транспортными белками. Результаты исследований in vitro свидетельствуют о том, что акалабрутиниб и ACP-5862 являются субстратами P-gp и BCRP. Однако маловероятно, что сопутствующее применение с ингибиторами BCRP приведет к клинически значимым взаимодействиям с другими лекарственными средствами. Сопутствующее применение с ингибитором OATP1B1/1B3 (600 мг рифампицина, однократная доза) приводило к повышению Cmax и AUC акалабрутиниба в 1,2 и 1,4 раза (N=24, здоровые добровольцы) соответственно, что не является клинически значимым. Акалабрутиниб и ACP-5862 не ингибируют P-gp, OAT1, OAT3, OCT2, OATP1B1, OATP1B3 и MATE2-K в клинически значимых концентрациях. В клинически значимых концентрациях акалабрутиниб может ингибировать BCRP в кишечнике, тогда как ACP-5862 может ингибировать MATE1 (см. ВЗАИМОДЕЙСТВИЯ). Акалабрутиниб не ингибирует MATE1, а ACP-5862 не ингибирует BCRP в клинически значимых концентрациях.
Выведение. После однократного перорального применения акалабрутиниба в дозе 100 мг его Т½ составлял 1–2 ч. Т½ активного метаболита ACP-5862 составлял примерно 7 ч. Средний воображаемый пероральный клиренс (CL/F) у пациентов с B-клеточными лимфопролиферативными заболеваниями составлял 134 л/ч и 22 л/ч для акалабрутиниба и АСР-5862 соответственно. После однократного применения у здоровых добровольцев 100 мг акалабрутиниба, меченного радиоактивным изотопом 14С, 84% принятой дозы выводилось с калом, 12% — с мочой; менее 2% — в неизмененном виде.
Особые категории пациентов. По данным популяционного фармакокинетического анализа возраст (от 18 лет), пол, раса (европеоидная, негроидная) и масса тела пациента не оказывали клинически значимого влияния на фармакокинетику акалабрутиниба и его активного метаболита АСР-5862.
Дети. Фармакокинетические исследования лекарственного средства Калквенс с участием пациентов в возрасте до 18 лет не проводились.
Пациенты с почечной недостаточностью. Акалабрутиниб выводится с мочой в минимальном объеме. Исследование фармакокинетики с участием пациентов с почечной недостаточностью не проводились. По данным популяционного фармакокинетического анализа не выявлено клинически значимых различий в фармакокинетике между 408 пациентами с почечной недостаточностью легкой степени (расчетная скорость клубочковой фильтрации (рСКФ) 60–89 мл/мин/1,73 м2), 109 лицами с умеренной почечной недостаточностью (рСКФ 30–59 мл/мин/1,73 м2) и 192 пациентами с нормальной функцией почек (рСКФ ≥90 мл/мин/1,73 м2). Фармакокинетика акалабрутиниба не изучалась у лиц с тяжелой почечной недостаточностью (рСКФ <29 мл/мин/1,73 м2) и пациентов с почечной недостаточностью, нуждавшихся в проведении диализа. В клинические исследования не включали лиц с уровнем креатинина в 2,5 раза выше установленной верхней границы нормы (ВГН) (см. ПРИМЕНЕНИЕ).
Пациенты с печеночной недостаточностью. Акалабрутиниб метаболизируется в печени. В специальных исследованиях фармакокинетики акалабрутиниба у пациентов с легкой (n=6, класс А по классификации Чайлда — Пью), умеренной (n=6, класс В по классификации Чайлда — Пью) и тяжелой (n=8, класс С по классификации Чайлда — Пью) печеночной недостаточностью было отмечено увеличение AUC соответственно в 1,9; 1,5 и 5,3 раза по сравнению с лицами с нормальной функцией печени (n=6). Однако не выявлено значительных изменений с точки зрения выведения препарата у пациентов с умеренной печеночной недостаточностью, поэтому его влияние, вероятно, было недооценено в данном исследовании. По данным популяционного фармакокинетического анализа, не выявлено клинически значимых различий между пациентами с легкой (n=79) или умеренной (n=6) печеночной недостаточностью (с концентрацией билирубина в 1,5–3 раза выше ВГН при какой-либо активности АсАТ) и лицами с нормальной функцией печени (n=613) (с концентрацией общего билирубина и активностью АсАТ в пределах ВГН) (см. ПРИМЕНЕНИЕ).
Показания Калквенс
Калквенс показан в качестве монотерапии или в комбинации с обинутузумабом для лечения взрослых пациентов с ранее не леченным ХЛЛ.
Калквенс показан в качестве монотерапии для лечения взрослых пациентов с ХЛЛ, получивших по крайней мере один курс терапии.
Применение Калквенс
это лекарственное средство должен назначать врач, имеющий опыт применения противоопухолевых препаратов. Применять только под наблюдением врача.
Дозы. Рекомендуемая доза составляет 100 мг акалабрутиниба дважды в сутки (что соответствует общей суточной дозе 200 мг). См. информацию о дозировке в инструкции по медицинскому применению обинутузумаба.
Интервал между дозами должен составлять примерно 12 ч.
Терапию лекарственным средством Калквенс необходимо продолжать до прогрессирования заболевания или возникновения неприемлемого токсического эффекта.
Коррекция дозы
Побочные реакции. Рекомендации по коррекции дозы лекарственного средства Калквенс при побочных реакциях 3-й степени тяжести и выше приведены в табл. 8.
Таблица 8 Рекомендации по коррекции дозы при возникновении побочных реакций*
| Побочная реакция | Количество случаев возникновения побочной реакции | Коррекция дозы (начальная доза – 100 мг примерно каждые 12 ч) |
| Тромбоцитопения 3-й степени тяжести с кровотечением. Тромбоцитопения 4-й степени тяжести или нейтропения 4-й степени тяжести продолжительностью более 7 дней. Негематологическая токсичность 3-й степени тяжести и выше | Впервые или повторно | Временно прекратить терапию лекарственным средством Калквенс. После снижения токсического эффекта до 1-й степени тяжести или исходного уровня терапию лекарственным средством Калквенс можно продлить в дозе 100 мг каждые 12 ч |
| Трижды | Временно прекратить терапию лекарственным средством Калквенс. После снижения токсического эффекта до 1-й степени тяжести или исходного уровня терапию лекарственным средством Калквенс можно продолжить с понижением дозы до 100 мг один раз в сутки | |
| Четыре раза | Полностью прекратить терапию лекарственным средством Калквенс | |
*Классификация побочных реакций согласно версии 4.03 Общих терминологических критериев побочных реакций Национального института рака США (National Cancer Institute Common Terminology Criteria for Adverse Events — NCI CTCAE).
Взаимодействия. Рекомендации по применению лекарственного средства Калквенс с ингибиторами или индукторами CYP 3A или лекарственными средствами, снижающими кислотность желудочного сока, приведены в табл. 9 (см. также ВЗАИМОДЕЙСТВИЯ).
Таблица 9 Применение с ингибиторами или индукторами CYP 3A и лекарственными средствами, снижающими кислотность желудочного сока
| Сопутствующее лекарственное средство | Рекомендации по применению лекарственного средства Калквенс | |
| Ингибиторы CYP 3A | Сильный ингибитор CYP 3A | Избегать сопутствующего применения. Временно прекратить терапию препаратом Калквенс, если предполагается кратковременное применение таких лекарственных средств (например противоинфекционных, в течение не более 7 дней) |
| Умеренный ингибитор CYP 3A | Коррекция дозы не требуется. Контролировать состояние пациентов с целью выявления побочных реакций при приеме умеренных ингибиторов CYP 3A | |
| Слабый ингибитор CYP 3A | Коррекция дозы не нужна | |
| Индукторы CYP 3A | Сильный индуктор CYP 3A | Избегать сопутствующего применения |
| Лекарственные средства, снижающие кислотность желудочного сока | Ингибиторы протонной помпы | Избегать сопутствующего применения |
| Антагонисты Н2-гистаминовых рецепторов | Принимать Калквенс за 2 ч до или через 10 ч после применения антагониста Н2-гистаминовых рецепторов | |
| Антацидные лекарственные средства | Интервал между приемом этих лекарственных средств должен составлять не менее 2 ч | |
Пропуск приема дозы лекарственного средства. Если пациент пропустил прием Калквенса и с момента планового приема прошло более 3 ч, следующую дозу лекарственного средства следует принять в следующее обычное запланированное время. Не следует принимать дополнительную дозу лекарственного средства для компенсации пропущенной.
Особые категории пациентов
Пациенты пожилого возраста. Пациентам пожилого возраста (≥65 лет) не требуется коррекция дозы (см. Фармакокинетика).
Пациенты с почечной недостаточностью. Специальные исследования применения лекарственного средства у пациентов с почечной недостаточностью не проводились. В клинических исследованиях лекарственного средства Калквенс принимали участие пациенты с легкой или умеренной почечной недостаточностью. Пациентам с легкой или умеренной почечной недостаточностью (клиренс креатинина ≥30 мл/мин) не требуется коррекция дозы. Следует поддерживать необходимую гидратацию и периодически контролировать уровень креатинина в плазме крови. Калквенс следует назначать пациентам с тяжелой почечной недостаточностью (клиренс креатинина <30 мл/мин), только если потенциальная польза превышает риск. Такие пациенты нуждаются в тщательном наблюдении с целью выявления признаков токсичности. Отсутствуют данные относительно лиц с тяжелой почечной недостаточностью или пациентов, находившихся на диализе (см. Фармакокинетика).
Пациенты с печеночной недостаточностью. Пациентам с легкой или умеренной печеночной недостаточностью (класс А или В по классификации Чайлда — Пью или при концентрации общего билирубина в 1,5–3 раза выше ВГН, при любой активности AсАT не требуется коррекция дозы. Однако за состоянием пациентов с умеренной печеночной недостаточностью требуется тщательно наблюдать с целью выявления признаков токсичности. Не рекомендуется применять Калквенс у пациентов с тяжелой печеночной недостаточностью (класс С по классификации Чайлда — Пью или при концентрации общего билирубина в три раза выше ВГН, при любой активности AсАT) (см. Фармакокинетика).
Пациенты с сердечными заболеваниями тяжелой степени. В клинические исследования лекарственного средства Калквенс не включали пациентов с сердечными заболеваниями тяжелой степени.
Способ применения. Калквенс предназначен для перорального применения. Капсулы следует глотать целиком, запивая водой, примерно в одно и то же время суток и независимо от приема пищи (см. ВЗАИМОДЕЙСТВИЯ). Капсулы не следует разжевывать, растворять в жидкости или вскрывать, поскольку это может повлиять на абсорбцию лекарственного средства.
Дети. Безопасность и эффективность применения лекарственного средства Калквенс у детей (возраст до 18 лет) не установлены. Данные отсутствуют.
Противопоказания
повышенная чувствительность к действующему веществу или любому из вспомогательных веществ, указанных в СОСТАВ И ФОРМА ВЫПУСКА.
Побочные эффекты
лекарственное средство находится под дополнительным мониторингом. Это позволит быстро получать новую информацию о безопасности. Специалистов в области здравоохранения просят сообщать о любых подозреваемых побочных реакциях.
Резюме профиля безопасности. Наиболее частыми (≥20%) побочными реакциями любой степени, о которых сообщалось у 1040 пациентов, получавших Калквенс в качестве монотерапии, были инфекция (66,7%), головная боль (37,8%), диарея (36,7 %), образование гематом (34,1%), мышечно-скелетная боль (33,1%), тошнота (21,7%), утомляемость (21,3%), кашель (21%) и сыпь (20,3%). Наиболее частыми (≥5%) побочными реакциями 3-й степени тяжести и выше были инфекция (17,6%), лейкопения (14,3%), нейтропения (14,2%) и анемия (7,8%).
Наиболее частыми (≥20%) побочными реакциями любой степени, о которых сообщалось у 223 пациентов, получавших Калквенс в составе комбинированной терапии, были инфекция (74%), мышечно-скелетная боль (44,8%), диарея (43,9%), головная боль (43%), лейкопения (31,8%), нейтропения (31,8%), кашель (30,5%), утомляемость (30,5%), артралгия (26,9%), тошнота (26,9%), головокружение (23,8%) и запор (20,2%). Наиболее частыми (≥5%) побочными реакциями 3-й степени тяжести и выше были лейкопения (30%), нейтропения (30%), инфекция (21,5%), тромбоцитопения (9%) и анемия (5,8%).
Сводная таблица побочных реакций. Ниже представлен перечень побочных реакций, о которых сообщалось в ходе клинических исследований, проведенных с участием пациентов, получавших Калквенс для лечения гемобластозов. Средняя продолжительность лечения лекарственным средством Калквенс в наборе объединенных данных составила 26,2 мес.
Побочные реакции приведены по классам систем органов с использованием терминов Медицинского словаря по вопросам регуляторной деятельности (MedDRA). В пределах каждого класса систем органов побочные реакции отмечены в порядке снижения частоты. Категории частоты побочных реакций представлены следующим образом: очень часто (≥1/10), часто (от ≥1/100 до <1/10), нечасто (от ≥1/1000 до <1/100), редко (от ≥1/10 000 до <1/1000), очень редко (<1/10 000), частота неизвестна (нельзя установить по имеющимся данным). В пределах каждой категории частоты побочные реакции представлены в порядке убывания серьезности.
Таблица 10 Побочные реакции* у пациентов с гемобластозами, получавших монотерапию акалабрутинибом (n=1040)
| Класс органов и систем по MedDRA | Термин по MedDRA | Общая частота возникновення побочных реакций (всех степеней по CTCAE) | Частота возникновення побочных реакций 3-й степени тяжести и выше по CTCAE† |
| Инфекционные и паразитарные заболевания | Инфекция верхних дыхательных путей | Очень часто (22%) | 0,8% |
| Синусит | Очень часто (10,7%) | 0,3% | |
| Пневмония | Часто (8,7%) | 5,1% | |
| Инфекция мочевыводящих путей | Часто (8,5%) | 1,5% | |
| Назофарингит | Часто (7,4%) | 0% | |
| Бронхит | Часто (7,6%) | 0,3% | |
| Герпесвирусные инфекции† | Часто (5,9%) | 0,7% | |
| Аспергиллез† | Нечасто (0,5%) | 0,4% | |
| Реактивация вируса гепатита В | Нечасто (0,1%) | 0,1% | |
| Доброкачественные, злокачественные и неуточненные новообразования | Другое первичное злокачественное новообразование† | Очень часто (12,2%) | 4,1% |
| Немеланомный рак кожи† | Часто (6,6%) | 0,5% | |
| Другое первичное злокачественное новообразование (кроме немеланомного рака кожи)† | Часто (6,5%) | 3,8% | |
| Со стороны крови и лимфатической системы | Нейтропения† | Очень часто (15,7%) | 14,2% |
| Анемия† | Очень часто (13,8%) | 7,8% | |
| Тромбоцитопения† | Часто (8,9%) | 4,8% | |
| Лимфоцитоз | Нечасто (0,3%) | 0,2% | |
| Со стороны обмена веществ и питания | Синдром лизиса опухоли± | Нечасто (0,5%) | 0,4% |
| Со стороны нервной системы | Головная боль | Очень часто (37,8%) | 1,1% |
| Головокружение | Очень часто (13,4%) | 0,2% | |
| Нарушения сердечной деятельности | Фибрилляция/мерцание предсердий† | Часто (4,4%) | 1,3% |
| Со стороны сосудистой системы | Образование гематом† | Очень часто (34,1%) | 0% |
| Кровоподтеки | Очень часто (21,7%) | 0% | |
| Петехии | Очень часто (10,7%) | 0% | |
| Экхимозы | Часто (6,3%) | 0% | |
| Кровотечение/гематома† | Очень часто (12,6%) | 1,8% | |
| Желудочно-кишечное кровотечение | Часто (2,3%) | 0,6% | |
| Внутричерепное кровоизлияние | Часто (1%) | 0,5% | |
| Носовое кровотечение | Часто (7%) | 0,3% | |
| Со стороны ЖКТ | Диарея | Очень часто (36,7%) | 2,6% |
| Тошнота | Очень часто (21,7%) | 1,2% | |
| Запор | Очень часто (14,5%) | 0,1% | |
| Рвота | Очень часто (13,3%) | 0,9% | |
| Боль в животе† | Очень часто (12,5%) | 1% | |
| Со стороны кожи и подкожной клетчатки | Сыпь† | Очень часто (20,3%) | 0,6% |
| Со стороны скелетно-мышечной системы и соединительной ткани | Мышечно-скелетная боль† | Очень часто (33,1%) | 1,5% |
| Артралгия | Очень часто (19,1%) | 0,7% | |
| Общие нарушения и реакции в месте введения | Утомляемость | Очень часто (21,3%) | 1,7% |
| Астения | Часто (5,3%) | 0,8% | |
| Отклонения от нормы (обнаружены по результатам анализов) | Снижение уровня гемоглобина§ | Очень часто (42,6%) | 10,1% |
| Уменьшение абсолютного количества нейтрофилов§ | Очень часто (41,8%) | 20,7% | |
| Уменьшение количества тромбоцитов§ | Очень часто (31,1%) | 6,9% | |
*По классификации побочных реакций согласно версии 4.03 Общих терминологических критериев побочных реакций Национального института рака США (NCI CTCAE).
†Включает много терминов, обозначающих побочные реакции на лекарственные средства.
±В группе акалабрутиниба в исследовании ASCEND зарегистрирован один случай развития синдрома лизиса опухоли, обусловленного приемом лекарственного средства.
§Представляет частоту отклонений лабораторных показателей, а не частоту зарегистрированных побочных реакций.
¶Представлены как степени отклонения от нормы согласно CTCAE.
Таблица 11 Побочные реакции* у пациентов с гемобластозами, получавших комбинированную терапию акалабрутинибом (n=223)
| Класс органов и систем по MedDRA | Термин по MedDRA | Общая частота возникновения побочных реакций (всех степеней по CTCAE) | Частота возникновения побочных реакций 3-й степени тяжести и выше по CTCAE† |
| Инфекционные и паразитарные заболевания | Инфекция верхних дыхательных путей | Очень часто (31,4%) | 1,8% |
| Синусит | Очень часто (15,2%) | 0,4% | |
| Назофарингит | Очень часто (13,5%) | 0,4% | |
| Инфекция мочевыводящих путей | Очень часто (13%) | 0,9% | |
| Пневмония | Очень часто (10,8%) | 5,4% | |
| Бронхит | Часто (9,9%) | 0% | |
| Герпесвирусные инфекции† | Часто (6,7%) | 1,3% | |
| Прогрессирующая мультифокальная лейкоэнцефалопатия (ПМЛ) | Нечасто (0,4%) | 0,4% | |
| Реактивация вируса гепатита В | Нечасто (0,9%) | 0,1% | |
| Аспергиллез† | Очень редко (<0%) | 0% | |
| Доброкачественные, злокачественные и неуточненные новообразования | Другое первичное злокачественное новообразование† | Очень часто (13%) | 4,0% |
| Немеланомный рак кожи† | Часто (7,6%) | 0,4% | |
| Другое первичное злокачественное новообразование (кроме немеланомного рака кожи)† | Часто (6,3%) | 3,6% | |
| Со стороны крови и лимфатической системы | Нейтропения† | Очень часто (31,8%) | 30% |
| Тромбоцитопения† | Очень часто (13,9%) | 9% | |
| Анемия† | Очень часто (11,7%) | 5,8% | |
| Лимфоцитоз | Нечасто (0,4%) | 0,4% | |
| Со стороны обмена веществ и питания | Синдром лизиса опухоли± | Нечасто (1,8%) | 1,3% |
| Со стороны нервной системы | Головная боль | Очень часто (43%) | 0,9% |
| Головокружение | Очень часто (23,8%) | 0% | |
| Нарушения сердечной деятельности | Фибрилляция/мерцание предсердий† | Часто (3,1%) | 0,9% |
| Со стороны сосудистой системы | Образование гематом† | Очень часто (38,6%) | 0% |
| Кровоподтеки | Очень часто (27,4%) | 0% | |
| Петехии | Очень часто (11,2%) | 0% | |
| Экхимозы | Часто (3,1%) | 0% | |
| Кровотечение/гематома† | Очень часто (17,5%) | 1,3% | |
| Желудочно-кишечное кровотечение | Часто (3,6%) | 0,9% | |
| Внутричерепное кровоизлияние | Нечасто (0,9%) | 0% | |
| Носовое кровотечение | Часто (8,5%) | 0% | |
| Со стороны ЖКТ | Диарея | Очень часто (43,9%) | 4,5% |
| Тошнота | Очень часто (26,9%) | 0% | |
| Запор | Очень часто (20,2%) | 0% | |
| Рвота | Очень часто (19,3%) | 0,9% | |
| Боль в животе† | Очень часто (14,8%) | 1,3% | |
| Со стороны кожи и подкожной клетчатки | Сыпь† | Очень часто (30,9%) | 1,8% |
| Со стороны скелетно-мышечной системы и соединительной ткани | Мышечно-скелетная боль† | Очень часто (44,8%) | 2,2% |
| Артралгия | Очень часто (26,9%) | 1,3% | |
| Общие нарушения и реакции в месте введения | Утомляемость | Очень часто (30,5%) | 1,8% |
| Астения | Часто (7,6%) | 0,4% | |
| Отклонения от нормы (обнаружены по результатам анализов) | Уменьшение абсолютного количества нейтрофилов§ | Очень часто (57,4%) | 35% |
| Уменьшение количества тромбоцитов§ | Очень часто (46,2%) | 10,8% | |
| Снижение уровня гемоглобина§ | Очень часто (43,9%) | 9% | |
*По классификации побочных реакций согласно версии 4.03 Общих терминологических критериев побочных явлений Национального института рака США (NCI CTCAE).
†Включает много терминов, обозначающих побочные реакции на лекарственные средства.
±В группе акалабрутиниба в исследовании ASCEND был зарегистрирован один случай развития синдрома лизиса опухоли, обусловленного приемом лекарственного средства.
§Представляет частоту отклонений лабораторных показателей, а не частоту зарегистрированных побочных реакций.
¶Представлены как степени отклонения от нормы согласно CTCAE.
Описание некоторых побочных реакций Снижение дозы или прекращение терапии вследствие развития побочных реакций. Из 1040 пациентов, получавших Калквенс в качестве монотерапии, 9,3% прекратили лечение вследствие развития побочных реакций. Основные побочные реакции включали пневмонию, тромбоцитопению и диарею. 4,2% пациентов нуждались в снижении дозы препарата в связи с развитием побочных реакций. Основные побочные реакции включали реактивацию вируса гепатита В, сепсис и диарею.
Из 223 пациентов, получавших Калквенс в составе комбинированной терапии, 10,8% прекратили лечение вследствие развития побочных реакций. Основные побочные реакции включали пневмонию, тромбоцитопению и диарею. 6,7% пациентов нуждались в снижении дозы препарата в связи с развитием побочных реакций. Основные побочные реакции включали нейтропению, диарею и рвоту.
Пациенты пожилого возраста. Из 1040 участников клинических исследований применения лекарственного средства Калквенс в качестве монотерапии 41% составляли пациенты в возрасте >65 лет и <75 лет, а 22% — в возрасте >75 лет. Клинически значимых различий с точки зрения безопасности или эффективности терапии между пациентами старше 65 лет и младшими больными выявлено не было.
Из 223 участников клинических исследований применения лекарственного средства Калквенс в комбинации с обинутузумабом 47% составляли пациенты в возрасте >65 лет и <75 лет, а 26% — в возрасте >75 лет. Клинически значимых различий с точки зрения безопасности или эффективности терапии между лицами старше 65 лет и младшими пациентами выявлено не было.
Сообщения о побочных реакциях. Важно сообщать о подозреваемых побочных реакциях в послерегистрационный период применения лекарственного средства. Это позволяет осуществлять непрерывный мониторинг соотношения польза/риск применения лекарственного средства. Специалисты в области здравоохранения обязаны сообщать о любых случаях подозреваемых побочных реакций через национальную систему отчетности.
Особые указания
кровотечения. У пациентов с гемобластозами, получавших Калквенс в качестве монотерапии и в комбинации с обинутузумабом, наблюдались массивные кровотечения, в том числе кровотечения с поражением ЦНС и ЖКТ, некоторые с летальным исходом. Эти кровотечения наблюдались как у пациентов с тромбоцитопенией, так и без нее. В целом кровотечения, включая образование гематом и петехии, были менее тяжелыми (см. ПОБОЧНЫЕ ЭФФЕКТЫ).
Механизм развития кровотечений до конца не изучен.
У пациентов, принимающих антитромботические лекарственные средства, может быть повышен риск развития кровотечений. В случае необходимости одновременного применения акалабрутиниба и антитромботических препаратов это следует делать с осторожностью, а пациенты должны находиться под контролем для выявления признаков кровотечения. Варфарин или другие антагонисты витамина К не следует принимать одновременно с лекарственным средством Калквенс.
Следует учитывать пользу и риски временного прекращения приема лекарственного средства Калквенс на период не менее 3 дней до и после хирургического вмешательства.
Инфекции. У пациентов с гемобластозами, получавших Калквенс в качестве монотерапии и в комбинации с обинутузумабом, наблюдались инфекции (бактериальные, вирусные или грибковые) тяжелой степени, в том числе с летальным исходом. Эти инфекции преимущественно возникали при отсутствии нейтропении 3-й или 4-й степени тяжести, при этом нейтропеническая инфекция наблюдалась у 1,9% пациентов. Отмечали случаи инфекций, вызванных реактивацией вируса гепатита В, опоясывающего герпеса, аспергиллез, а также случаи ПМЛ (см. ПОБОЧНЫЕ ЭФФЕКТЫ).
Реактивация вирусов. У пациентов, получавших Калквенс, наблюдались случаи реактивации вируса гепатита B. До начала применения лекарственного средства Калквенс необходимо установить статус вируса гепатита B. Пациентам с положительными результатами серологических исследований вируса гепатита В перед началом лечения следует проконсультироваться с гепатологами. Состояние таких лиц следует контролировать и лечить согласно местным медицинским стандартам для профилактики реактивации вируса гепатита В.
У пациентов, получавших Калквенс на фоне предварительной или сопутствующей иммуносупрессивной терапии, наблюдались случаи ПМЛ, некоторые с летальным исходом. Врачам следует учитывать риск развития ПМЛ при дифференциальной диагностике пациентов с новыми неврологическими, когнитивными или поведенческими признаками или симптомами или на фоне их ухудшения. В случае подозрения на развитие ПМЛ следует провести соответствующие диагностические обследования и приостановить терапию лекарственным средством Калквенс, пока наличие ПМЛ не будет исключено. При наличии каких-либо сомнений следует рассмотреть возможность направления к неврологу и проведение соответствующих диагностических обследований на ПМЛ, включая магнитно-резонансную томографию, желательно с контрастированием, анализ СМЖ на ДНК JC-вируса (полиомавирус) и повторные неврологические обследования.
Для пациентов с повышенным относительно нормы риском возникновения оппортунистических инфекций следует рассмотреть возможность проведения профилактических мероприятий. Состояние пациентов следует контролировать касательно появления признаков и симптомов инфекции и проводить необходимую терапию в соответствии с принятой практикой.
Цитопения. У пациентов с гемобластозами, которые получали лекарственное средство Калквенс в качестве монотерапии и в комбинации с обинутузумабом, наблюдались случаи цитопении 3-й или 4-й степени тяжести, включая нейтропению, анемию и тромбоцитопению, обусловленные лечением. Необходимо проводить развернутые анализы крови в соответствии с медицинскими показаниями (см. ПОБОЧНЫЕ ЭФФЕКТЫ).
Другие первичные злокачественные новообразования. У пациентов с гемобластозами, получавших Калквенс в качестве монотерапии и в комбинации с обинутузумабом, наблюдались другие первичные злокачественные новообразования, включая кожные и не связанные с кожей. Часто отмечали случаи развития рака кожи. Следует наблюдать за состоянием пациентов с целью выявления симптомов рака кожи. Необходимо рекомендовать пациентам избегать длительного пребывания на солнце (см. ПОБОЧНЫЕ ЭФФЕКТЫ).
Фибрилляция предсердий. У пациентов с гемобластозами, получавших Калквенс в качестве монотерапии и в комбинации с обинутузумабом, наблюдалась фибрилляция/мерцание предсердий. Состояние пациентов следует контролировать с целью выявления симптомов фибрилляции/мерцания предсердий (например пальпитация, головокружение, обморок, боль в грудной клетке, одышка) и проводить электрокардиографию в соответствии с медицинскими показаниями (см. ВЗАИМОДЕЙСТВИЯ). У пациентов, у которых на фоне терапии лекарственным средством Калквенс развивается фибрилляция предсердий, следует провести тщательную оценку риска тромбоэмболической болезни. Для лиц с высоким риском развития тромбоэмболической болезни следует рассмотреть проведение тщательно контролируемой терапии антикоагулянтами и альтернативные лекарственному средству Калквенс варианты терапии.
Прочие лекарственные средства. Сопутствующее применение сильных или умеренных ингибиторов CYP 3A с лекарственным средством Калквенс приводит к увеличению экспозиции акалабрутиниба в плазме крови и, соответственно, повышает риск токсичности. И, напротив, сопутствующее применение индукторов CYP 3A приводит к уменьшению экспозиции лекарственного средства Калквенс в плазме крови, поэтому существует риск недостаточной эффективности лечения. Следует избегать сопутствующего применения с сильными ингибиторами CYP 3A. Необходимо временно прекратить терапию лекарственным средством Калквенс, если предполагается кратковременное применение таких ингибиторов (например, противоинфекционных препаратов в течение не более 7 дней). За состоянием пациентов, принимающих умеренный ингибитор CYP 3A, следует внимательно наблюдать с целью выявления признаков токсичности (см. ПРИМЕНЕНИЕ И ВЗАИМОДЕЙСТВИЯ). Следует избегать сопутствующего применения с сильными индукторами CYP 3A4 ввиду риска недостаточной эффективности лечения.
Калквенс содержит натрий. В 1 дозе этого лекарственного средства содержится менее 1 ммоль натрия (23 мг), то есть его можно считать не содержащим натрий.
Применение в период беременности или кормления грудью
Применение у женщин репродуктивного возраста. Женщинам репродуктивного возраста рекомендуется избегать беременности при терапии лекарственным средством Калквенс.
Применение в период беременности. Данные по применению акалабрутиниба у беременных отсутствуют или ограничены. Результаты исследований на животных свидетельствуют о том, что экспозиция акалабрутиниба в период беременности может представлять опасность для плода. У крыс наблюдалась дистоция (тяжелые или длительные роды), а введение беременным кроликам приводило к замедлению роста плода. Калквенс не следует применять в период беременности, за исключением случаев, когда клиническое состояние женщины требует лечения именно акалабрутинибом.
Применение в период кормления грудью. Неизвестно, попадает ли акалабрутиниб в женское грудное молоко. Данные о влиянии акалабрутиниба на детей, находящихся на грудном вскармливании, или на выработку грудного молока отсутствуют. Акалабрутиниб и его активный метаболит были обнаружены в грудном молоке крыс. Нельзя исключить риск для ребенка, находящегося на грудном вскармливании. Женщинам рекомендуется избегать кормления грудью в период приема лекарственного средства Калквенс и в течение 2 дней после получения последней дозы.
Воздействие на репродуктивную функцию. Данные о влиянии лекарственного средства Калквенс на репродуктивную функцию человека отсутствуют. Результаты доклинического исследования акалабрутиниба на самцах и самках крыс не показали негативного влияния на их репродуктивную функцию.
Способность влиять на скорость реакции при управлении транспортными средствами или другими механизмами. Калквенс не влияет или оказывает незначительное влияние на способность управлять транспортными средствами и работать с другими механизмами. Однако во время терапии акалабрутинибом могут возникать утомляемость и головокружение, и при наличии этих симптомов пациенты должны быть осторожны при управлении транспортными средствами или работе с другими механизмами.
Взаимодействия
акалабрутиниб и его активный метаболит предпочтительно метаболизируются ферментом 3A4 цитохрома P450 (CYP 3A4), и оба вещества являются субстратами P-гликопротеина (P-gp) и белка резистентности рака молочной железы (BCRP).
Действующие вещества, которые могут приводить к повышению концентрации акалабрутиниба в плазме крови
Ингибиторы CYP 3A/P-gp. Сопутствующее применение акалабрутиниба с сильным ингибитором CYP 3A/P-gp (200 мг итраконазола один раз в сутки в течение 5 дней) у здоровых добровольцев (n=17) приводило к повышению Cmax акалабрутиниба в 3,9 раза, а AUC в 5 раз.
Следует избегать сопутствующего применения с сильными ингибиторами CYP 3A/P-gp. Необходимо временно прекратить терапию лекарственным средством Калквенс, если предполагается кратковременное применение сильных ингибиторов CYP 3A/P-gp (например кетоконазола, кониваптана, кларитромицина, индинавира, итраконазола, ритонавира, телапревира, позаконазола, вориконазола (см. ПРИМЕНЕНИЕ).
Одновременное применение лекарственного средства с умеренными ингибиторами CYP 3A (400 мг флуконазола в качестве однократной дозы или 200 мг изавуконазола в режиме многократной дозы в течение 5 сут) у здоровых добровольцев увеличивало Cmax и AUC акалабрутиниба от 1,4 до 2 раз, тогда как Cmax и AUC его активного метаболита ACP-5862 уменьшились от 0,65 до 0,88 раза по сравнению с тем, когда акалабрутиниб применялся отдельно. При применении комбинации с умеренными ингибиторами CYP 3A коррекция дозы не требуется, однако следует контролировать состояние пациентов с целью выявления побочных реакций (см. ПРИМЕНЕНИЕ).
Действующие вещества, которые могут приводить к снижению концентрации акалабрутиниба в плазме крови
Индукторы CYP 3A. Сопутствующее применение акалабрутиниба с сильным индуктором CYP 3A (600 мг рифампицина один раз в сутки в течение 9 дней) у здоровых добровольцев (n=24) приводило к снижению Cmax акалабрутиниба на 68%, а AUC — на 77%.
Следует избегать сопутствующего применения с сильными индукторами CYP 3A (например фенитоином, рифампицином, карбамазепином). Следует избегать сопутствующего применения зверобоя, поскольку он может непредсказуемо снизить концентрацию акалабрутиниба в плазме крови.
Лекарственные средства, снижающие кислотность желудочного сока. Растворимость акалабрутиниба уменьшается с повышением pH. Сопутствующее применение акалабрутиниба с антацидом (1 г кальция карбоната) у здоровых добровольцев приводило к уменьшению AUC акалабрутиниба на 53%. Сопутствующее применение с ингибитором протонной помпы (40 мг омепразола в течение 5 дней) уменьшает AUC акалабрутиниба на 43%.
В случае необходимости применения лекарственного средства, снижающего кислотность желудочного сока, следует рассмотреть возможность назначения антацидного лекарственного средства (например, карбоната кальция) или антагониста Н2-рецепторов (например, ранитидина или фамотидина). При сопутствующем применении с антацидными лекарственными средствами интервал между приемами лекарственных средств должен составлять не менее 2 ч (см. ПРИМЕНЕНИЕ). Калквенс следует принимать за 2 ч до или через 10 ч после применения антагонистов Н2-рецепторов.
Раздельное применение ингибиторов протонной помпы и лекарственного средства Калквенс может не устранить взаимодействие между ними из-за длительного действия ингибиторов протонной помпы, поэтому следует избегать их сопутствующего применения (см. ПРИМЕНЕНИЕ).
Действующие вещества, концентрация которых может изменяться в плазме крови в связи с применением лекарственного средства Калквенс
Субстраты CYP 3A. На основании данных исследований in vitro нельзя исключить, что акалабрутиниб ингибирует CYP 3A4 в кишечнике и может увеличивать экспозицию субстратов CYP 3A4, чувствительных к метаболизму CYP 3A, в кишечнике. Следует соблюдать осторожность при сопутствующем применении акалабрутиниба с пероральными субстратами CYP 3A4 с узким терапевтическим диапазоном (например циклоспорин, эрготамин, пимозид).
Влияние акалабрутиниба на субстраты CYP 1A2. Исследования in vitro свидетельствуют о том, что акалабрутиниб индуцирует CYP 1A2. Сопутствующее применение акалабрутиниба с субстратами CYP 1A2 (например теофиллином, кофеином) может снизить их экспозицию.
Влияние акалабрутиниба и его активного метаболита ACP-5862 на транспортную систему лекарственного средства. При сопутствующем применении субстратов BCRP (например, метотрексата) акалабрутиниб может повышать их экспозицию из-за угнетения этого белка в кишечнике (см. Фармакокинетика). Чтобы свести к минимуму возможность взаимодействия в ЖКТ, пероральные субстраты BCRP с узким терапевтическим диапазоном, такие как метотрексат, следует принимать по крайней мере за 6 ч до или после приема акалабрутиниба.
АСР-5862 может повышать экспозицию субстратов белка экструзии лекарственных средств и токсинов 1 (МАТЕ1) (например, метформина) при их сопутствующем применении, в связи с угнетением МАТЕ1 (см. Фармакокинетика). В случае сопутствующего приема лекарственных средств с MATE1-зависимым распределением (например, метформин) необходимо тщательное наблюдение за состоянием пациента по выявлению изменений переносимости вследствие повышения экспозиции сопутствующего лекарственного средства на фоне приема препарата Калквенс.
Передозировка
симптомы и специфическое лечение при передозировке акалабрутиниба не определены. В случае передозировки пациенты должны находиться под пристальным контролем для выявления возможных признаков или симптомов побочных реакций и в случае необходимости получать симптоматическое лечение.
Условия хранения
при температуре выше 30 °C. Хранить в недоступном для детей месте.