Лантус® Солостар® раствор для инъекций 100 ЕД/мл картридж 3 мл вложенный в шприц-ручку, без иглы №5
Лантус Солостар инструкция по применению
Состав
Вспомогательные вещества: цинка хлорид, м-крезол, глицерин (85%), кислота хлористоводородная концентрированная, натрия гидроксид, вода для инъекций
Инсулин гларгин - 3,6378 мг/1мл
Фармакологические свойства
фармакодинамика. Инсулин гларгин разработан как аналог инсулина человека, который имеет низкую растворимость в нейтральной среде. В препарате Лантус® СолоСтар® он полностью растворимым благодаря кислой среде р-ра для инъекций (рН 4). После введения в подкожные ткани кислый р-р нейтрализуется, что приводит к возникновению микропреципитатов, из которых постоянно высвобождается небольшое количество инсулина гларгина, что обеспечивает плавный (без пиков) и предполагаемый профиль AUC, а также более длительное действие препарата.
Инсулин гларгин метаболизируется до 2 активных метаболитов — М1 и М2 (см. Фармакокинетика).
Связывание с инсулиновым рецептором. Результаты исследований in vitro свидетельствуют о том, что аффинность инсулина гларгина и его метаболитов М1 и М2 к инсулиновому рецептору человека подобна аффинности человеческого инсулина.
Связывание с рецептором инсулиноподобного фактора роста 1 (ИФР-1): аффинность инсулина гларгина к рецептору ИФР-1 примерно в 5–8 раз выше сродства человеческого инсулина (но примерно в 70–80 раз ниже, чем сродство ИФР-1 к этому рецептору), в то время как метаболиты М1 и М2 связываются с рецептором ИФР-1 с аффинностью, которая несколько ниже аффинности человеческого инсулина.
Общая терапевтическая концентрация инсулина (инсулина гларгина и его метаболитов), которая определялась у пациентов с сахарным диабетом І типа, была значительно ниже той, которая была бы необходима для полумаксимального связывания с рецептором ИФР-1 и для последующей активации митогенно-пролиферативного механизма, который запускается рецептором ИФР-1. Эндогенный ИФР-1 в физиологических концентрациях может активировать митогенно-пролиферативный механизм, однако терапевтические концентрации инсулина, которые используются при инсулинотерапии, в том числе при терапии инсулином Лантус® СолоСтар®, значительно ниже фармакологических концентраций, которые необходимы для активации ИФР-1-опосредованного механизма.
Важнейшим действием инсулина, в том числе инсулина гларгина, является регуляция метаболизма глюкозы. Инсулин и его аналоги снижают уровень глюкозы в крови за счет стимуляции ее потребления периферическими тканями, в частности скелетными мышцами и жировой тканью, а также угнетения образования глюкозы в печени. Инсулин подавляет липолиз в адипоцитах и протеолиз, одновременно усиливая синтез белка.
Клинико-фармакологические исследования доказали эквивалентность одинаковых доз инсулина гларгина и инсулина человека после введения этих препаратов. Как и при применении любых инсулинов, на характер действия инсулина гларгина во времени могут влиять физическая активность и другие факторы.
Исследования с применением метода фиксации гликемического состояния, которые проводились с участием здоровых добровольцев и больных сахарным диабетом I типа, показали, что в отличие от нейтрального протамина Xaгeдорна (НПХ) инсулина человека, начало действия инсулина гларгина после п/к введения наступает позже, препарат действует плавно, не вызывая появления пиков концентрации глюкозы в крови, а продолжительность его действия пролонгированная.
Профиль активности у больных сахарным диабетом І типа:
*Определена как количество глюкозы, введенной для поддержания постоянного уровня глюкозы в плазме крови (ежечасные средние показатели).
Большая продолжительность действия п/к введенного инсулина гларгина непосредственно связана с медленной абсорбцией, что позволяет применять препарат 1 раз в сутки. Характер действия во времени инсулина и его аналогов, таких как инсулин гларгин, может иметь значительную межиндивидуальную и интериндивидуальную вариабельность.
В клиническом испытании после введения инсулина гларгина и инсулина человека симптомы гипогликемии или контррегуляции гормонального ответа были аналогичными у здоровых добровольцев и больных сахарным диабетом І типа.
Влияние инсулина гларгина (который вводили 1 раз в сутки) на течение диабетической ретинопатии оценивалось в открытом 5-летнем исследовании, препаратом сравнения в котором служил НПХ-инсулин (вводили 2 раза в сутки), проводившемся среди 1024 пациентов с сахарным диабетом II типа, у которых наблюдалось прогрессирование ретинопатии на 3 и более пункта по шкале, применяемой в исследовании «Раннее лечение диабетической ретинопатии» (Early Treatment Diabetic Retinopathy Study — ETDRS). Прогрессирование оценивалось с помощью фотографирования глазного дна, статистически значимой разницы между прогрессированием диабетической ретинопатии при введении инсулина Лантус и НПХ-инсулина не было выявлено.
Исследование ORIGIN (Outcome Reduction with Initial Glargine INtervention, «Снижение риска неблагоприятных клинических исходов при первичном назначении гларгина») было многоцентровым рандомизированным исследованием с факториальным дизайном 2x2, проводившимся с участием 12 537 пациентов с высоким сердечно-сосудистым риском, у которых наблюдалась нарушенная гликемия натощак или нарушенная толерантность к глюкозе (12% участников) или сахарный диабет ІІ типа, по поводу которого они получали ≤1 перорального противодиабетического препарата (88% участников). Участники исследования были рандомизированы (1:1) для получения или инсулина гларгина (n=6264), доза которого титрировалась до достижения уровня глюкозы в плазме крови натощак <95 мг/дл (5,3 ммоль/л), или стандартной терапии (n=6273).
Первым показателем в составе комбинированной первичной конечной точки было время до первого наступления смерти от сердечно-сосудистых причин, нефатального инфаркта миокарда или нефатального инсульта, а вторым показателем в составе комбинированной первичной конечной точки было время до первого наступления какого-либо из этих событий комбинированной первичной конечной точки или проведения процедуры реваскуляризации (коронарных, сонных или периферических сосудов), или госпитализации по поводу сердечной недостаточности.
К вторичной конечной точке относилась смерть по любой причине и комбинированная конечная точка микроваскулярных событий.
Инсулин гларгин не изменял относительный риск сердечно-сосудистых заболеваний и смерти по сердечно-сосудистой причине по сравнению со стандартной терапией. Не было отмечено разницы между инсулином гларгином и стандартной терапией по обоим показателям в составе комбинированной первичной конечной точки; ни по одной составляющей конечной точки, которая включает эти неблагоприятные клинические последствия; по смертности по всем причинам; или комбинированной конечной точке микроваскулярных событий.
Средняя доза инсулина гларгина в конце исследования составила 0,42 Ед/кг, в начале исследования средний показатель HbA1c у участников составлял 6,4%, а на фоне исследуемого лечения показатели HbA1c варьировали в пределах 5,9–6,4% в группе применения инсулина гларгина и 6,2–6,6% в группе применения стандартной терапии в течение всего периода наблюдения.
Частота возникновения тяжелой гипогликемии (представлена в виде количества участников исследования, у которых наблюдались такие эпизоды, на 100 пациенто-лет лечения) составляла 1,05 в группе применения инсулина гларгина и 0,30 в группе применения стандартной терапии, а частота подтвержденных эпизодов нетяжелой гипогликемии составила 7,71 в группе применения инсулина гларгина и 2,44 в группе применения стандартной терапии. В течение этого 6-летнего исследования у 42% пациентов в группе применения инсулина гларгина вообще не наблюдалось эпизодов гипогликемии.
На последнем визите, выполненном на фоне исследуемого лечения, наблюдалось увеличение массы тела по сравнению с исходным уровнем в группе применения инсулина гларгина в среднем на 1,4 кг и ее снижение в среднем на 0,8 кг в группе применения стандартной терапии.
Дети и подростки
Во время рандомизированного контролируемого клинического исследования дети (в возрасте 6–15 лет), больные сахарным диабетом I типа (n=349), в течение 28 нед получали инсулинотерапию в базально-болюсном режиме, при котором перед каждым приемом пищи вводился обычный человеческий инсулин. Инсулин гларгин вводили 1 раз на ночь, а НПХ-инсулин — 1 или 2 раза в сутки. В обеих группах влияние на уровень гликозилированного гемоглобина и частоту возникновения гипогликемии, что сопровождалось клиническими проявлениями, было аналогичным, однако снижение уровня глюкозы в плазме крови натощак по сравнению с исходным показателем было большим в группе, получавшей инсулин гларгин, по сравнению с группой, которая получала НПХ. Также в группе, получавшей инсулин гларгин, тяжесть гипогликемии была меньше. 143 пациента из тех, которые получали инсулин гларгин во время этого исследования, продолжили лечение инсулином гларгином в пределах неконтролируемого продолжения этого исследования, средняя продолжительность последующего наблюдения в котором составляла 2 года. При продолжении терапии инсулином гларгином никаких новых сигналов, свидетельствующих об опасности, не было получено.
Также было проведено перекрестное сравнительное исследование инсулина гларгина + инсулин лиспро и НПХ-инсулина + обычный человеческий инсулин (каждый вид лечения применялся в течение 16 нед случайным образом) у 26 подростков с сахарным диабетом II типа в возрасте 12–18 лет. Как и в описанном выше исследовании, среди детей снижение уровня глюкозы в крови натощак по сравнению с исходным уровнем было выше в группе, получавшей инсулин гларгин, по сравнению с группой, в которой вводился НПХ/обычный человеческий инсулин. Изменение уровня HbA1c по сравнению с исходным уровнем было аналогичными в обеих группах, однако ночные гликемические показатели были достоверно выше в группе, получавшей инсулин гларгин/инсулин лиспро, чем в группе НПХ-инсулин/обычный инсулин, при этом средние низкие показатели составляли 5,4 и 4,1 ммоль. Соответственно, и частота возникновения ночной гипогликемии составляла 32% в группе, получавшей инсулин гларгин/инсулин лиспро, и 52% в группе НПХ-инсулин/обычный инсулин.
Было проведено 24-недельное исследование в параллельных группах, в котором приняли участие 125 детей с сахарным диабетом I типа в возрасте 2–6 лет, где инсулин гларгин, который назначали 1 раз в сутки утром, сравнивался с НПХ-инсулином, который назначали 1 или 2 раза в сутки в качестве базального инсулина. Участники обеих групп исследования получали болюсные инъекции инсулина перед приемом пищи.
Главная цель исследования — показать, что НПХ-инсулин по крайней мере не имеет преимуществ перед инсулином гларгином по совокупному риску гипогликемии — достигнута не была, и на фоне применения инсулина гларгина наблюдалась тенденция к повышению частоты гипогликемических событий [соотношение частоты в группах применения инсулина гларгина: НПХ ( 95% ДИ) = 1,18 (0,97–1,44)].
Изменение показателей уровней гликозилированного гемоглобина и глюкозы в крови в обеих исследуемых группах было сходным. Никаких новых данных по безопасности исследуемых препаратов в этом исследовании не наблюдалось.
Фармакокинетика. Сравнение концентрации инсулина в плазме крови у здоровых лиц и у больных сахарным диабетом указывало на более медленную и длительную абсорбцию, а также продемонстрировало отсутствие пика концентрации после введения препарата инсулина гларгина по сравнению с НПХ-инсулином человека. Таким образом, полученные концентрации инсулина гларгина полностью соответствовали профилю фармакодинамической активности препарата во времени. На графике, приведенном выше, продемонстрирован профиль активности инсулина гларгина и НПХ-инсулина во времени.
При введении инсулина гларгина 1 раз в сутки равновесная концентрация достигается уже через 2–4 дня после первой инъекции.
При в/в введении T½ инсулина гларгина и инсулина человека были вполне сопоставимыми.
После п/к инъекции инсулина Лантус® СолоСтар® у пациентов с сахарным диабетом инсулин гларгин быстро метаболизируется на карбоксильном конце β-цепи с образованием 2 активных метаболитов — М1 (21А-глицин-инсулин) и М2 (21А-глицин-дес-30В-треонин-инсулин). В плазме крови главным циркулирующим соединением является метаболит М1. Экспозиция М1 растет пропорционально введенной дозе инсулина Лантус® СолоСтар®. Фармакокинетические и фармакодинамические данные свидетельствуют о том, что эффект п/к инъекции инсулина Лантус® СолоСтар® связан преимущественно с экспозицией М1. Инсулин гларгин и метаболит М2 у большинства участников исследований не определялись, а когда их содержание можно было определить, их концентрация не зависела от введенной дозы инсулина Лантус® СолоСтар®.
В клинических исследованиях при анализе подгрупп, сформированных по возрасту и полу, не было выявлено разницы в показателях безопасности и эффективности между пациентами, получавшими инсулин гларгин, и исследуемой популяцией в целом.
Дети и подростки
Фармакокинетика препарата у детей в возрасте 2–6 лет с сахарным диабетом І типа оценивалась в 1 клиническом исследовании (см. Фармакодинамика). У детей, получавших инсулин гларгин, проводилось определение минимальных уровней инсулина гларгина и его основных метаболитов (М1 и М2) в плазме крови, по результатам которого было установлено, что закономерности изменения концентраций в плазме крови подобны у взрослых, и не было выявлено никаких доказательств в пользу кумуляции инсулина гларгина или его метаболитов при длительном применении препарата.
Доклинические данные по безопасности
Доклинические данные, полученные в рамках стандартных исследований по изучению фармакологической безопасности, токсичности при многократном применении препарата, генотоксичности, канцерогенного потенциала и токсичности для репродуктивной функции, не выявили особой опасности для человека.
Показания Лантус Солостар
лечение сахарного диабета у взрослых, подростков и детей в возрасте старше 2 лет.
Применение Лантус Солостар
дозирование
Лантус® СолоСтар® содержит инсулин гларгин — аналог инсулина длительного действия. Препарат вводят 1 раз в сутки в любое время, но каждый раз в одно и то же время.
Режим дозирования Лантус® СолоСтар® (доза и время введения) следует подбирать индивидуально. Пациентам с сахарным диабетом II типа Лантус® СолоСтар® можно применять одновременно с пероральными гипогликемизирующими лекарственными средствами. Сила действия этого препарата выражается в единицах. Эти единицы применяются исключительно для препарата Лантус® СолоСтар® и отличаются от МЕ или единиц, в которых выражается сила действия других аналогов инсулина (смотрите раздел ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА).
Дети и подростки. Безопасность и эффективность инсулина Лантус® СолоСтар® доказаны при его применении у подростков и детей от 2 лет (см. ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА). Применение препарата Лантус® СолоСтар® в детей в возрасте до 2 лет не изучали.
Пациенты пожилого возраста (старше 65 лет)
У лиц пожилого возраста возрастное прогрессирующее ухудшение функции почек может стать причиной постоянного снижения потребности в инсулине.
Почечная недостаточность
У пациентов с почечной недостаточностью потребность в инсулине может быть снижена из-за ослабления метаболизма инсулина.
Печеночная недостаточность
У пациентов с печеночной недостаточностью потребность в инсулине может снижаться из-за снижения способности к глюконеогенезу и замедления метаболизма инсулина.
Переход от других инсулинов на препарат Лантус® СолоСтар®. При переходе от схемы лечения инсулинами средней продолжительности действия или длительного действия на схему лечения Лантус® СолоСтар® может возникнуть необходимость в изменении дозы базального инсулина, а также в коррекции сопутствующей противодиабетической терапии (доз и времени введения дополнительно применяемых обычных (регуляр) инсулинов или аналогов инсулина быстрого действия, или доз пероральных противодиабетических лекарственных средств).
Переход с двукратного введения НПХ-инсулина (нейтрального протамина Хагедорна) на препарат Лантус® СолоСтар®. Чтобы снизить риск развития гипогликемии в ночные или в ранние утренние часы, пациентам, которые меняют режим применения базального инсулина с двукратного введения НПХ-инсулина на однократное введение Лантус® СолоСтар®, нужно уменьшить дозу базального инсулина на 20–30% в течение первых недель лечения.
Переход с инсулина гларгина 300 ЕД/мл на препарат Лантус® СолоСтар®. Лантус® СолоСтар® и Тожео® СолоСтар® (инсулин гларгин 300 ЕД/мл) не являются биоэквивалентными и не могут применяться как непосредственно взаимозаменяемые. Чтобы снизить риск развития гипогликемии, пациентам, которые меняют режим применения базального инсулина с однократного введения инсулина гларгина 300 ЕД/мл на однократное введение препарата Лантус® СолоСтар®, нужно снизить дозу базального инсулина примерно на 20%
В течение этого периода снижение дозы должно быть по крайней мере частично компенсировано повышением дозы инсулина, введение которого связано с приемом пищи. После завершения этого периода режим дозирования следует корректировать индивидуально.
При переходе на другой препарат и в течение первых недель после этого рекомендуется тщательно контролировать метаболические показатели.
Улучшение метаболического контроля и связанное с этим повышение чувствительности к инсулину могут потребовать дополнительной коррекции режима дозирования. Коррекция дозы также может потребоваться, например, при изменении массы тела больного или его образа жизни, изменении времени суток, когда осуществляется ввод инсулина, или при возникновении других факторов, способствующих повышению предрасположенности к развитию гипо- или гипергликемии (см. ОСОБЫЕ УКАЗАНИЯ).
У пациентов, получающих высокие дозы инсулина вследствие наличия антител к человеческому инсулину, при переходе на Лантус® СолоСтар® может наблюдаться улучшение ответа организма на введение инсулина.
Способ введения
Лантус® СолоСтар® следует вводить п/к.
Лекарственное средство нельзя вводить в/в. Длительное воздействие препарата Лантус® СолоСтар® обусловлено его введением в подкожно-жировую ткань. Введение обычной п/к дозы может привести к возникновению тяжелой гипогликемии.
Нет клинически значимой разницы в уровнях инсулина или глюкозы в плазме крови после введения Лантус® СолоСтар® в абдоминальный участок, участок дельтовидной мышцы или бедра. При каждой последующей инъекции место укола следует менять в пределах участка тела, рекомендованного для введения инсулина.
Лантус® СолоСтар® нельзя смешивать с любым другим инсулином или разводить. При смешивании или разведении может измениться профиль действия препарата во времени. Кроме этого, смешивание с другими инсулинами может привести к образованию осадка.
Перед применением шприц-ручки СолоСтар внимательно прочитать раздел «Инструкция по использованию шприц-ручки Лантус® СолоСтар®».
Перед первым применением шприц-ручку следует выдержать при комнатной температуре в течение 1–2 ч. Проверить картридж перед использованием. Его можно применять только тогда, когда р-р в нем является прозрачным, бесцветным, без видимых твердых частиц и имеет такую же консистенцию, как вода. Поскольку Лантус® СолоСтар® представляет собой р-р, он не требует ресуспендирования перед применением.
Пустые шприц-ручки нельзя использовать повторно, они должны быть надлежащим образом уничтожены.
Чтобы предотвратить инфицирование, каждую шприц-ручку может применять только 1 человек.
Перед каждой инъекцией проверять этикетку на инсулине, чтобы избежать ошибочного введения вместо инсулина гларгина других инсулинов (см. ОСОБЫЕ УКАЗАНИЯ).
Инструкция по использованию шприц-ручки Лантус® СолоСтар®
Внимательно и полностью прочитать инструкцию перед первым использованием шприц-ручки. При необходимости перечитать инструкцию перед последующим применением шприц-ручки. Хранить данную инструкцию, так как может понадобиться перечитать ее в будущем.
Перед началом использования шприц-ручки СолоСтар® внимательно ознакомиться с этими инструкциями. Если пациент не способен самостоятельно полностью следовать всем инструкциям, то необходимо пользоваться СолоСтар® только при помощи человека, который может следовать инструкциям. Держать шприц-ручку так, как указано в этой инструкции. Чтобы убедиться в том, что правильно установлена доза, необходимо держать шприц-ручку горизонтально иглой в левую сторону, а селектором дозы в правую.
Можно устанавливать дозы от 1 до 80 единиц с шагом в 1 единицу. В каждой шприц-ручке содержится несколько доз.
Важная информация по использованию шприц-ручки Лантус® СолоСтар®
- Для каждой инъекции использовать новую иглу, совместимую только со шприц-ручкой Лантус® СолоСтар®.
- Тест на безопасность выполнять перед каждой инъекцией.
- Шприц-ручка предназначена только для 1 пациента, и не следует передавать ее другим лицам.
- Если инъекцию проводит другое лицо, это лицо должно принять специальные меры безопасности во избежание несчастных случаев, связанных с применением иглы и перенесения инфекции.
- Не использовать шприц-ручку Лантус® СолоСтар® в случае ее повреждения или при наличии сомнений в правильности ее функционирования.
- Всегда необходимо иметь запасную шприц-ручку Лантус® СолоСтар® на случай потери или повреждения.
Стадия 1. Контроль инсулина
A. Внимательно прочитать этикетку на экземпляре шприц-ручки для того, чтобы убедиться в введении соответствующего инсулина. Лантус® СолоСтар® серого цвета с фиолетовой кнопкой для введения инъекции.
B. Снять колпачок шприц-ручки.
C. Проконтролировать внешний вид инсулина. Лантус является прозрачным инсулином. Не использовать шприц-ручку Лантус® СолоСтар®, если инсулин мутный, окрашенный или имеет посторонние частицы.
Стадия 2. Присоединение иглы
Для каждой инъекции всегда использовать новую стерильную иглу. Это поможет предотвратить загрязнение, а также возможное засорение иглы.
А. Снять защитную этикетку с контейнера иглы.
В. Установить иглу на одной линии со шприц-ручкой, а потом удерживать на одной прямой до ее присоединения (навинчивают или насаживают в зависимости от типа иглы).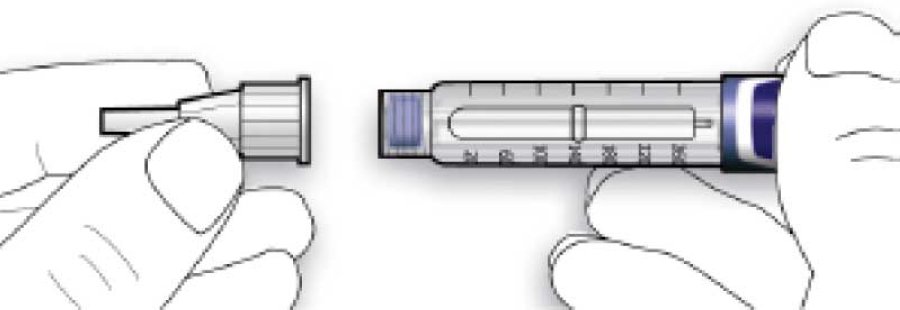
- Если игла не находится на одной линии со шприц-ручкой в момент присоединения, это может привести к нарушению изолирующего слоя резины и вызвать утечку жидкости или перелом иглы.
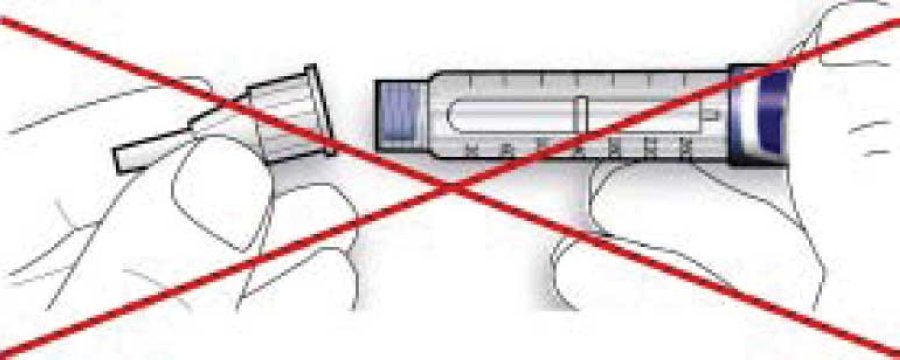
Стадия 3. Тест на безопасность
Во всех случаях выполнять тест безопасности перед каждой инъекцией. Этим обеспечивается получение точной дозы при помощи следующего:
- гарантия того, что шприц-ручка и игла функционируют правильно;
- удаления пузырьков воздуха.
А. Отмерить дозу, равную 2 единицам, вращая дозировочный селектор.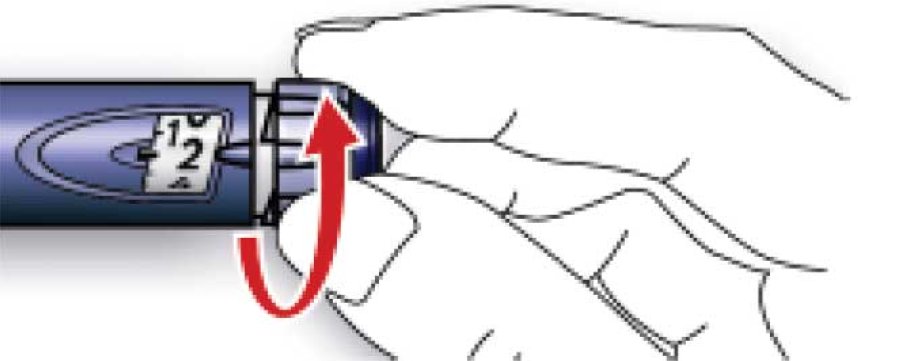
В. Снять внешний колпачок иглы и хранить, чтобы потом поместить в него использованную после введения инъекции иглу. Снять внутренний колпачок иглы и выбросить его.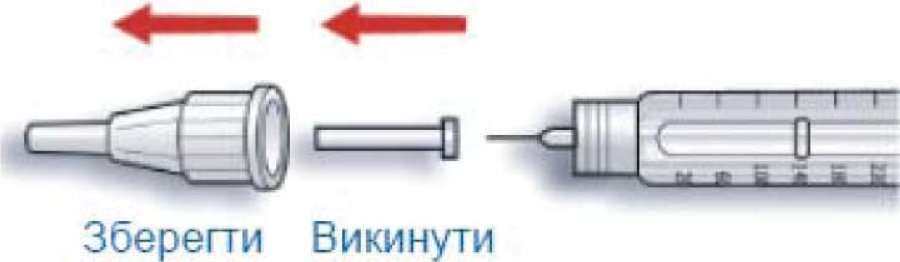
С. Разместить шприц-ручку иглой вверх.
D. Кончиками пальцев осторожно постучать по емкости для инсулина, чтобы все пузырьки воздуха поднялись вверх к игле.
Е. Нажать на кнопку ввода инъекции до упора. Проверить, появляется инсулин на кончике иглы.
Можно провести испытания на безопасность несколько раз, пока не появится инсулин.
- Если инсулин не появился, провести контроль наличия пузырьков воздуха и повторно провести испытания на безопасность еще 2 раза до их удаления.
- Если появления инсулина не наблюдается, это может быть вызвано засорением иглы. Заменить иглу и повторить испытание.
- Если появления инсулина не наблюдается после замены иглы, шприц-ручка может быть испорченной. Не используйте ее.
Стадия 4. Выбор дозы
Можно установить дозу с точностью до 1 единицы (от минимальной дозы — 1 единица до максимальной — 80 единиц). Если необходимо ввести дозу, превышающую 80 единиц, нужно провести 2 или более инъекций.
A. Проверить, чтобы дозирующее окошко показывало «0» после завершения испытания на безопасность.
B. Выбрать необходимую дозу. Если установлена доза, превышающая необходимую, следует вернуть дозировочный селектор в исходное положение.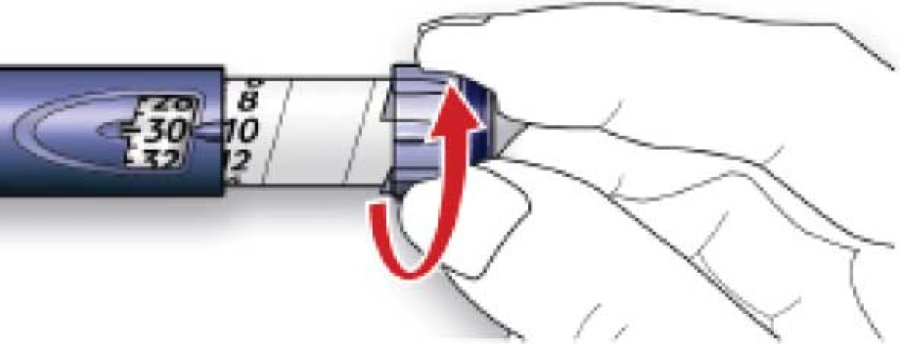
- Не нажимать на кнопку введения инъекции при вращении селектора, иначе инсулин вытечет.
- Невозможно вернуть дозировочный селектор до числа единиц, которое превышает количество, оставшееся в шприц-ручке. Не пытаться силой вернуть дозировочный селектор. В этом случае следует либо ввести остаток инсулина гларгина и дополнить необходимую дозу из новой шприц-ручки, или использовать новый Лантус® СолоСтар® для введения полной дозы.
Стадия 5. Техника введения инъекции
A. Придерживаться техники введения инъекции, с которой пациента ознакомит врач.
B. Ввести иглу в кожу.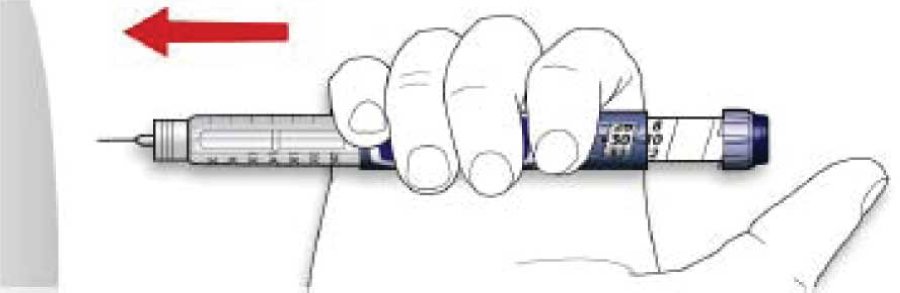
С. Ввести дозу с помощью нажатия на кнопку введения инъекции до упора. После введения инъекции в дозирующем окошке должен установиться «0».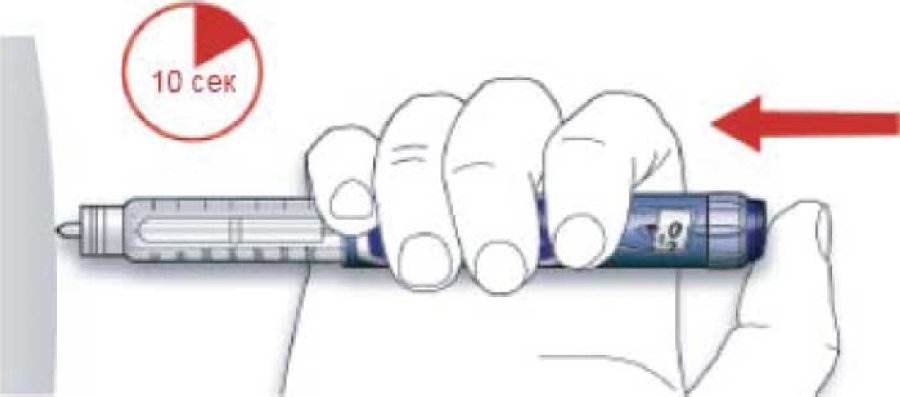
D. Оставить кнопку ввода инъекции в нажатом положении. Медленно считать до 10 перед извлечением иглы из кожи. При этом обеспечивается введение полной дозы.
Стадия 6. Удаление и утилизация иглы
Во всех случаях удалять иглу после каждой инъекции и хранить шприц-ручку без прикрепленной иглы. Этим обеспечивается профилактика:
- загрязнения и/или попадания инфекции;
- попадания воздуха в емкости для инсулина и утечки инсулина, что может привести к неправильному дозированию.
A. Надеть внешний колпачок иглы назад на иглу и использовать его для свинчивания иглы со шприц-ручки. Для снижения риска несчастных случаев, связанных с использованием иглы, никогда не одевать назад внутренний колпачок иглы.
∙ Если инъекцию проводило другое лицо, оно должно принять специальные меры при удалении и утилизации иглы (например техника закрывания колпачка одной рукой) для снижения риска несчастных случаев, связанных с использованием иглы, а также распространения инфекционных заболеваний.
B. Осторожно утилизировать иглу (в соответствии с установленными инструкциями).
С. Во всех случаях необходимо закрывать колпачком шприц-ручку и хранить шприц-ручку до следующей инъекции.
Инструкции по хранению
Внимательно ознакомиться с информацией по хранению шприц-ручки Лантус® СолоСтар®.
Если шприц-ручка Лантус® СолоСтар® хранится в холодильнике, вынуть ее оттуда за 1–2 ч перед введением препарата, чтобы она нагрелась до комнатной температуры. Инъекционное введение охлажденного инсулина более болезненное.
Использованная шприц-ручка Лантус® СолоСтар® подлежит уничтожению в соответствии с установленными правилами.
Эксплуатация
Беречь шприц-ручку Лантус® СолоСтар® от пыли и грязи.
Очистить внешнюю сторону шприц-ручки Лантус® СолоСтар® можно, протирая его влажной тканью.
Не погружать в жидкость, не промывать и не смазывать шприц-ручку, поскольку этим можете повредить ее.
Шприц-ручка Лантус® СолоСтар® предназначена для точной и безопасной работы.
Ее необходимо использовать с осторожностью. Избегать ситуаций, при которых возможно повреждение шприц-ручки. Если вы подозреваете, что Лантус® СолоСтар® поврежден, необходимо использовать новую шприц-ручку.
Дети. Безопасность и эффективность препарата Лантус® СолоСтар® установленные для подростков и детей 2 лет и старше.
Противопоказания
повышенная чувствительность к действующему веществу или любому вспомогательному веществу, входящему в состав препарата.
Побочные эффекты
общий обзор профиля безопасности препарата. Гипогликемия, как правило, является наиболее частой побочной реакцией, которая наблюдается при инсулинотерапии. Она возникает тогда, когда доза введенного инсулина намного превышает потребность в нем (см. ОСОБЫЕ УКАЗАНИЯ).
Нежелательные реакции, связанные с применением препарата, наблюдались во время клинических исследований, и приводятся ниже по классам органов и систем в порядке снижения частоты возникновения (очень часто (>1/10), часто (>1/100– <1/10 ), нечасто (>1/1000–<1/100); редко (>1/10 000–<1/1000), очень редко (<1/10 000).
В каждой из этих групп побочные реакции приведены в порядке снижения степени их тяжести.
| Класс органов и систем MedDRA | Очень часто | Часто | Нечасто | Редко | Очень редко | Частота неизвестна |
|---|---|---|---|---|---|---|
| Со стороны иммунной системы | Аллергические реакции | |||||
| Метаболические и алиментарные расстройства | Гипогликемия | |||||
| Со стороны нервной системы | Дисгевзия | |||||
| Со стороны органа зрения | Нарушение зрения, ретинопатия | |||||
| Со стороны кожи и подкожных тканей | Липогипертрофия | Липоатрофия | Амилоидоз кожи | |||
| Нарушения со стороны опорно-двигательной системы и соединительной ткани | Миалгия | |||||
| Нарушение общего состояния и реакции в месте введения | Реакции в месте инъекционного введения препарата | Отек | ||||
Описание отдельных нежелательных реакций
Метаболические и алиментарные нарушения. Тяжелые эпизоды гипогликемии, особенно если они возникают неоднократно, могут стать причиной поражения нервной системы. Длительная или тяжелая гипогликемия может представлять угрозу для жизни больного.
У многих пациентов появлению симптомов, свидетельствующих о недостаточном поступлении глюкозы к тканям головного мозга (нейрогликопения), предшествуют признаки адренергической контррегуляции. Как правило, чем больше и быстрее снижается уровень глюкозы в крови, тем более выраженной является адренергическая контррегуляция и интенсивнее проявляются симптомы, характерные для нее (см. ОСОБЫЕ УКАЗАНИЯ).
Нарушения со стороны иммунной системы. Реакции гиперчувствительности немедленного типа на инсулин возникают редко. Проявлениями таких реакций на инсулин (в том числе на инсулин гларгин) или вспомогательные вещества могут быть, например, генерализованные кожные реакции, ангионевротический отек, бронхоспазм, гипотензия и шок, которые могут представлять угрозу для жизни больного.
Введение препаратов инсулина может привести к образованию антител к нему. Во время клинических исследований у групп пациентов, получавших лечение НПХ-инсулином и инсулином гларгином, образование антител, которые перекрестно реагировали с человеческим инсулином, наблюдалось с одинаковой частотой. В редких случаях из-за наличия антител к инсулину может возникать потребность в коррекции дозы, чтобы предупредить возникновение гипо- или гипергликемии.
Нарушения со стороны органа зрения. Значительное изменение уровня глюкозы в крови может привести к временному нарушению зрения вследствие временного изменения тургора и индекса рефракции хрусталика.
Риск прогрессирования диабетической ретинопатии снижается при достижении длительной нормализации уровня глюкозы в крови. Однако интенсификация инсулинотерапии с внезапным улучшением гликемического контроля может сопровождаться временным ухудшением течения диабетической ретинопатии. У больных пролиферативной ретинопатией, особенно у тех, которым не проводили фотокоагуляцию, эпизоды тяжелой гипогликемии могут привести к возникновению временной потери зрения.
Нарушения со стороны кожи и подкожных тканей. Как и при применении любых других препаратов инсулина, в месте инъекционного введения может возникать липодистрофия, вследствие чего скорость всасывания инсулина в месте инъекции снижается. Постоянное изменение места проведения инъекции в пределах отдельного инъекционного участка позволяет уменьшить эти явления или предупредить их появление (см. ОСОБЫЕ УКАЗАНИЯ).
Нарушение общего состояния и реакции в месте введения. К реакциям, возникающим в месте введения, относятся гиперемия кожи, боль, зуд, крапивница, припухлость или воспаление. Большая часть нетяжелых реакций на инсулин, которые возникают в месте введения препарата, обычно исчезает в течение периода от нескольких дней до нескольких недель. Изредка инсулин может приводить к задержке в организме натрия и появлению отеков, особенно в случаях, когда благодаря усилению интенсивности инсулинотерапии удается улучшить гликемический контроль, который до этого не был адекватным.
Дети и подростки. В общем профиль безопасности препарата у детей и подростков (в возрасте младше 18 лет) не отличается от такового у взрослых пациентов.
В отчетах о побочных реакциях, полученных во время постмаркетингового наблюдения, сообщалось об относительно частом возникновение реакций в месте введения препарата (боль, реакция в месте введения), а также реакций со стороны кожи (сыпь, крапивница) у детей и подростков по сравнению со взрослыми. Данные клинических исследований по безопасности применения препарата у детей в возрасте до 2 лет пока отсутствуют.
Особые указания
Лантус® СолоСтар® не является препаратом выбора для лечения диабетического кетоацидоза. Вместо него в таких случаях рекомендуется введение обычного (регуляр) инсулина. Если в результате лечения не удается достичь достаточного контроля уровня глюкозы или наблюдаются эпизоды гипо- или гипергликемии, прежде чем изменять дозировку препарата, следует проверить, соблюдается ли больным назначенный режим терапии, указанные места введения лекарственного средства, надлежащая техника инъекционного введения, а также оценить другие важные факторы, влияющие на эффективность лечения.
Перевод пациента на другой тип или марку инсулина должен происходить под тщательным контролем. Изменения силы действия, марки (производителя), типа (регуляр, НПХ, ленте, длительного действия и т.д.), происхождения (животный, человеческий, аналог человеческого инсулина) и/или метода производства могут привести к необходимости изменить дозу инсулина.
Введение препаратов инсулина может вызывать образование антител к нему. В редких случаях из-за наличия антител к инсулину может возникать потребность в коррекции дозы для профилактики гипо- или гипергликемии (см. ПОБОЧНЫЕ ЭФФЕКТЫ).
Пациентов следует предупредить о необходимости постоянно менять место инъекции, чтобы уменьшить риск развития липодистрофии и амилоидоза кожи. Есть потенциальный риск задержки абсорбции инсулина и ухудшения гликемического контроля после инъекций инсулина в местах этих реакций. Сообщается, что изменение места инъекции на непораженный участок кожи приводит к гипогликемии. Рекомендуется проводить мониторинг уровня глюкозы в крови после смены места введения и учесть корректировку дозы противодиабетических препаратов.
Гипогликемия. Время, через которое развивается гипогликемия, зависит от профиля действия инсулинов, которые применяются, и поэтому может изменяться при изменении режима лечения. Вследствие более стабильного поступления в организм базального инсулина при применении препарата Лантус® СолоСтар® следует ожидать меньшей вероятности возникновения гипогликемии в ночное время, тогда как в ранние утренние часы гипогликемия более вероятна.
Соблюдать особую осторожность и усиленно контролировать уровень глюкозы в крови необходимо больным, у которых приступы гипогликемии могут быть особенно опасными с клинической точки зрения, например, пациентам с выраженным стенозом коронарных артерий или кровеносных сосудов, снабжающих кровью головной мозг (риск сердечных или мозговых осложнений гипогликемии), а также пациентам с пролиферативной ретинопатией, которым не проводилась фотокоагуляция (риск возникновения транзиторной постгипогликемической слепоты).
Больные должны знать о том, что при определенных обстоятельствах первые симптомы гипогликемии могут быть менее заметными. Симптомы, указывающие на развитие гипогликемии, могут изменяться, становиться менее выраженными или вообще отсутствовать у пациентов, принадлежащих к определенным группам риска.
Среди них больные:
- у которых наблюдается значительное улучшение гликемического контроля;
- у которых гипогликемия развивается постепенно;
- пожилого возраста;
- перешедшие с инсулина животного происхождения на человеческий инсулин;
- с автономной (вегетативной) нейропатией;
- с сахарным диабетом в течение длительного периода времени;
- с психическими расстройствами;
- которые одновременно получают терапию другими лекарственными средствами (см. ВЗАИМОДЕЙСТВИЯ).
В таких ситуациях может возникать тяжелая гипогликемия (возможно, с потерей сознания) еще до того, как пациент поймет, что у него снизился уровень глюкозы в крови.
Поскольку инсулин гларгин при п/к введении действует в течение длительного периода времени, это может привести к тому, что для нормализации гликемического состояния потребуется больше времени.
Если у больного наблюдается нормальный или сниженный уровень гликозилированного гемоглобина, это может указывать на возникновение у него периодических недиагностированных (особенно ночных) эпизодов гипогликемии.
Для снижения риска возникновения гипогликемии очень важно соблюдение пациентом дозы препарата, режима питания, правильное введение инсулина, а также осведомленность больного относительно симптомов гипогликемии. Существует ряд факторов, которые повышают склонность к гипогликемии и требуют тщательного наблюдения за состоянием больного, а иногда и коррекции дозы препарата. К ним относятся:
- изменение места введения инсулина;
- повышение чувствительности к инсулину (например при устранении стрессовых факторов);
- необычная, чрезмерная или длительная физическая нагрузка;
- сопутствующее заболевание (например рвота, понос);
- нерациональное питание;
- пропуск приема пищи;
- употребление алкоголя;
- некоторые нарушения эндокринной системы (нарушение функции щитовидной железы, недостаточность аденогипофиза или коры надпочечников) в стадии декомпенсации;
- одновременное применение других лекарственных средств.
Сопутствующие заболевания. Наличие сопутствующего заболевания требует усиления контроля метаболических показателей. Во многих случаях показано проведение анализа мочи на присутствие кетоновых тел и часто возникает необходимость в коррекции дозы инсулина. Потребность в инсулине нередко может возрастать. Пациентам с сахарным диабетом I типа необходимо продолжать регулярно употреблять хотя бы небольшое количество углеводов, даже если они способны принимать лишь незначительное количество пищи или вовсе не могут принимать пищу, или у них возникает рвота. Они никогда не должны прекращать применение инсулина полностью.
Антитела к инсулину. Введение препаратов инсулина может привести к образованию антител к нему. В редких случаях из-за наличия антител к инсулину может возникать потребность в коррекции дозы, чтобы предупредить возникновение гипо- или гипергликемии (см. ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА).
Применение шприц-ручки. Перед использованием шприц-ручки СолоСтар® следует внимательно прочитать инструкцию по ее применению. СолоСтар® нужно использовать в соответствии с рекомендациями, содержащимися в этих инструкциях (см. Инструкция по использованию шприц-ручки Лантус® СолоСтар®).
Ошибочное введение другого препарата. Поступали сообщения о ложном введении препаратов, когда вместо инсулина гларгина случайно вводили другие инсулины, в частности инсулины короткого действия. Перед каждой инъекцией необходимо проверять этикетку на инсулине, чтобы избежать ошибочного введения вместо инсулина гларгина других инсулинов.
Комбинация препарата Лантус® СолоСтар® с пиоглитазоном. О случаях сердечной недостаточности сообщалось при применении пиоглитазона в сочетании с инсулином, особенно у пациентов с риском развития сердечной недостаточности. Это следует учитывать при рассмотрении возможности проведения лечения комбинацией пиоглитазона и препарата Лантус® СолоСтар®. При применении этой комбинации пациенты должны находиться под наблюдением из-за возможности возникновения признаков и симптомов сердечной недостаточности, увеличения массы тела и отека. При любом ухудшении кардиологических симптомов применение пиоглитазона необходимо прекратить.
Вспомогательные вещества. Это лекарственное средство содержит менее 1 ммоль натрия (23 мг) на одну дозу, то есть практически не содержит натрия.
Применение в период беременности и кормления грудью
Беременность. Не существует клинических данных, полученных в ходе контролируемых клинических исследований, по применению инулина гларгина в период беременности. Значительный объем данных по применению препарата у беременных (более 1000 случаев беременности), полученных во время постмаркетингового наблюдения, указывает на то, что инсулин гларгин не оказывает вредного влияния на течение беременности, а также не вызывает ни пороков развития у плода/новорожденного, ни токсического воздействия на него. Исследования на лабораторных животных не выявили признаков репродуктивной токсичности. Препарат Лантус® СолоСтар® можно назначать во время беременности, если в этом есть необходимость.
Пациенткам с сахарным диабетом, возникшим до беременности, или с гестационным диабетом в течение всего периода беременности очень важно поддерживать надлежащий метаболический контроль для предотвращения развития нежелательных клинических последствий, ассоциированных с гипергликемией. Потребность в инсулине может уменьшаться в течение I триместра беременности и, как правило, расти в течение II и III триместра. Сразу после родов потребность в инсулине стремительно снижается (повышается риск возникновения гипогликемии). Поэтому очень важное значение имеет тщательный контроль уровня глюкозы в крови.
Кормление грудью. Пока неизвестно, выделяется ли инсулин гларгин в грудное молоко. Возникновения любых метаболических эффектов, вызванных проникновением инсулина гларгина в организм новорожденного/младенца с грудным молоком, не ожидается, поскольку инсулин гларгин является пептидом, который в ЖКТ человека расщепляется на аминокислоты. Однако женщине во время кормления грудью может потребоваться коррекция дозы и диеты.
Репродуктивная функция. Исследования на лабораторных животных не выявили непосредственного вредного влияния на репродуктивную функцию.
Способность влиять на скорость реакции при управлении транспортом или другими механизмами. Способность пациента к концентрации внимания и скорость его реакции могут нарушаться вследствие возникновения гипогликемии или гипергликемии или, например, вследствие зрительных нарушений. Это может быть опасным в тех ситуациях, когда эти качества особенно важны (при управлении транспортными средствами или работе с механизмами).
Пациентам необходимо посоветовать принимать необходимые меры предосторожности во избежание гипогликемии во время управления транспортным средством. Это особенно важно для тех больных, у которых первые признаки развития гипогликемии слабо выражены или вообще отсутствуют, а также для тех, у кого гипогликемия возникает довольно часто. Пациенту следует тщательно взвесить, стоит ли управлять транспортными средствами или работать с механизмами в таком состоянии.
Взаимодействия
существует ряд веществ, которые влияют на метаболизм глюкозы, а следовательно, их применение может потребовать коррекции дозы инсулина гларгина.
К веществам, которые могут усиливать гипогликемический эффект инсулина и повышать предрасположенность к гипогликемии, относятся пероральные противодиабетические лекарственные средства, ингибиторы АПФ, дизопирамид, фибраты, флуоксетин, ингибиторы МАО, пентоксифен, пропоксифен, салицилаты и сульфаниламидные противомикробные препараты.
К веществам, которые могут ослаблять гипогликемический эффект инсулина, относятся кортикостероиды, даназол, диазоксид, мочегонные препараты, глюкагон, изониазид, эстрогены и прогестагены, производные фенотиазина, соматропин, симпатомиметики (эпинефрин (адреналин), сальбутамол, тербуталин), гормоны щитовидной железы, атипичные антипсихотические лекарственные средства (например клозапин и оланзапин) и ингибиторы протеаз.
Блокаторы β-адренорецепторов, клонидин, соли лития или алкоголь могут как усиливать, так и ослаблять гипогликемическое действие инсулина. Пентамидин может вызвать гипогликемию, после которой иногда наступает гипергликемия.
Кроме того, под действием симпатолитических препаратов, таких как блокаторы β-адренорецепторов, клонидин, гуанетидин и резерпин, признаки адренергической контррегуляции могут ослабевать или совсем исчезать.
Несовместимость. Это лекарственное средство нельзя смешивать с другими препаратами.
Передозировка
симптомы. Передозировка инсулина может привести к тяжелой, а иногда длительной гипогликемии, которая может быть опасной для жизни больного.
Лечение. Нетяжелые случаи гипогликемии обычно могут быть скорригированы пероральным применением углеводов. Может потребоваться также коррекция дозы препарата и внесение изменений в режим питания или физической активности.
Более тяжелые эпизоды гипогликемии, сопровождающиеся комой, судорогами или неврологическими нарушениями, требуют в/м или п/к введения глюкагона или введения концентрированного р-ра глюкозы. Поскольку гипогликемия может повториться даже после явного улучшения клинического состояния больного, необходимым является длительный прием углеводов и наблюдение за пациентом.
Условия хранения
срок годности после первого использования шприц-ручки.
Это лекарственное средство следует хранить в течение максимум 4 нед при температуре не выше 30 °С в защищенном от источников прямого тепла и прямого света месте.
Шприц-ручки, которые находятся в использовании, не должны храниться в холодильнике.
После каждой инъекции на шприц-ручку следует снова одевать колпачок для защиты от света.
Шприц-ручки, которые не находятся в использовании, хранить при температуре 2–8 °С. Не замораживать! Не допускать контакта с морозильным отделением или накопителями холода.
Хранить шприц-ручку во внешней картонной упаковке для защиты от света.