Нарушения водно-электролитного баланса
Общий запас воды в теле, содержание электролитов и кислотно-основное соотношение очень жестко взаимосвязаны и находятся в четко заданных границах. В разные возрастные периоды, в зависимости от количества жировой ткани, человеческий организм на 55–70% состоит из воды. Наименее гидратирована жировая ткань. Поэтому относительное содержание воды в теле меньше у женщины (55%), лиц с ожирением, а также у лиц старческого возраста. Из общего количества воды в нашем теле 2/3 жидкости приходится на внутриклеточное пространство, 1/3 — на внеклеточное. Внеклеточная жидкость состоит из внутрисосудистой (5% массы тела), интерстициальной (15% массы тела) и жидкости «третьего пространства» — трансцеллюлярной. Эта жидкость содержится в серозных полостях, железах, мочевыводящей системе, спинномозговом пространстве и в кишечнике. В физиологических условиях «третье пространство» практически не учитывают, но при заболеваниях оно может достигать большого объема. В норме человек принимает за сутки около 2–2,5 л жидкости (1–1,5 л супы, напитки и т. д. + 0,7 л прочее питание + 0,3 л метаболически образованная, то есть оксидантная вода). Выделяется эквивалентный объем = 1–1,5 л мочи + 0,5 л через кожу + 0,4 л через легкие (при банальном рините может возрастать до литра) + 0,4 л с экскрементами. Повышение температуры тела ведет к потере воды 50–75 мл/сут на каждый градус.
Соотношение электролитов во вне- и внутриклеточной жидкости прямо противоположно, но осмотическое давление в нормальных условиях равное. Осмолярность плазмы крови определяется уровнем натрия и четко корреллирует с этим значением. Осмолярность сыворотки крови (в мосм/л) может быть рассчитана как: (натрий в сыворотке крови в мвал/л +5)⋅2. У здоровых людей рассчитанная осмолярность и реальные показатели практически равны и составляют 285–295 мосм/л. Если разница составляет более 10 мосм/л, то говорят о дефиците осмолярности, что может быть обусловлено употреблением алкоголя, глюкозы или других осмотически активных веществ. Вне- и внутриклеточная жидкость разграничены клеточными мембранами, полностью проницаемыми для воды. Но ионный насос делает мембрану практически функционально непроницаемой для воды. При изменении осмотического давления во внеклеточном пространстве, то есть при изменении уровня натрия, вода по законам осмоса устремляется в сторону высокой концентрации натрия до выравнивания осмотического давления. Распределение воды между внутрисосудистым руслом и межклеточным пространством регулируется гидростатическим и коллоидно-осмотическим давлением в капиллярах. Постоянство осмотического давления и объема жидкости регулируется комплексом механизмов. Поскольку основным катионом внеклеточного пространства, определяющим объем, является натрий, то регуляция внеклеточного объема осуществляется изменением экскреции натрия в ответ на его меняющееся поступление в организм. Колебания объема внеклеточной жидкости сопровождаются параллельными изменениями выделения натрия почками. Например, увеличение объема внеклеточной жидкости тут же обусловливает выделение натрия почками (натрийурез). Многочисленные рецепторы в сердце, сосудах, почках обеспечивают слаженность работы этого механизма. Рецепторы объема находятся в предсердиях, артериях, легочных венах, печени и в почках. Они воспринимают объем внутрисосудистой жидкости (эффективный объем циркулирующей крови) и через симпатическую нервную систему, предсердный натрийуретический фактор, систему ренин — ангиотензин — альдостерон и внутрипочечные механизмы регулируют почечную экскрецию натрия.
Нарушения водно-солевого соотношения можно классифицировать как внеклеточный дефицит жидкости при нормальном уровне натрия в сыворотке крови, увеличение объема внеклеточной жидкости при нормальном уровне натрия в сыворотке крови, гипо- и гипернатриемия. Пропорциональное изменение натрия и воды ведет соответственно к дефициту или избытку жидкости во внеклеточном пространстве, что известно как эксикоз или гипергидратация.
Гипонатриемия (ниже 135 ммоль/л) указывает на то, что количество воды во внеклеточном пространстве по отношению к натрию повышено. Объем внеклеточной жидкости при этом может быть повышен (гиперволемическая гипонатриемия), нормален (эуволемическая гипонатриемия) или понижен (гиповолемическая гипонатриемия). Состояния со значительно измененным уровнем натрия (<120 ммоль/л и >160ммоль/л) во внеклеточной жидкости ведут к осмотически обусловленному перераспределению жидкости между вне- и внутриклеточным пространством. Это приводит к сморщиванию или набуханию клеток, что проявляется прежде всего неврологическими знаками: заторможенностью, дезориентацией, спутанностью сознания, судорогами, комой). Объемы внеклеточной и внутрисосудистой жидкости изменяются параллельно. Исключения представляют случаи потери жидкости в «третье пространство» (уменьшение внутрисосудистого объема) или нефротического синдрома, при котором увеличение объема внеклеточной, интерстициальной, жидкости протекает с уменьшением внутрисосудистого объема.
Для клинициста при врачебной трактовке симптомов изменения объема жидкости в организме и соотношения солей большое значение имеют сведения о ранее существовавших заболеваниях эндокринной системы, почек, состояние сердца, уровни показателей АД и пульса, ежедневные объемы потребляемой жидкости и выделяемой мочи, изменения массы тела. Все эти сведения позволяют говорить о причинах и механизмах нарушения водно-электролитного баланса.
Клинические исследования. Симптомы гипонатриемии возникают, когда осмолярность плазмы крови составляет 240 мосм/кг массы тела и ниже. Признаками дефицита объема являются жажда, сухие кожа и слизистые оболочки, сниженный тургор кожи, запавшие мягкие глазные яблоки, ортостатическая гипотензия с падением АД на 15–20 мм рт. ст. при переходе из положения лежа в положение стоя с одновременным учащением пульса на 15–20 уд./мин и более (в тяжелых случаях — потеря сознания). Спадение яремных вен при подъеме туловища на 45° у лежащего пациента. Крайне тяжелое состояние развивается при концентрации натрия ниже 115 ммоль/л. Возможны судороги, ступор, кома. Описана демиелинизация структур мозга (центральный понтинный миелинолиз). Особенно тяжело переносят острую гипонатриемию в период пременопаузы женщины, предрасположенные к отеку мозга. Это связано с тем, что эстрогены и прогестерон блокируют Na+, К+-АТФазу в мозгу.
Дефицит объема внеклеточной жидкости при нормальном содержании натрия в сыворотке крови развивается в случаях одновременной потери воды и натрия (при условии недостаточного их применения перорально или внутривенно). Это отмечают при диарее, рвоте, длительной аспирации желудочного сока, кровотечениях, массивной мочегонной терапии, некомпенсированном сахарном диабете (самостоятельный осмотический диурез), при недостаточности коры надпочечников и заболеваниях почек, при ожогах и усиленном потоотделении, при потере жидкости в «третье пространство»: илеус, перитонит, кровотечения, панкреатит.
Увеличение объема внеклеточной жидкости проявляется бледностью пациента, одутловатостью, отеками на нижерасположенных участках тела, увеличением массы тела, АГ, 3-м тоном сердца, положительным гепатоюгуллярным рефлюксом, влажными застойными хрипами в легких. Центральное венозное давление повышено. Рентгенологически отмечают расширение корней легких, гипергидратацию легких, выпот в серозные полости (надежнее выявляет эхоГ). Повышение внеклеточного объема при нормальном содержании натрия развивается при сердечной недостаточности, нефротическом синдроме, недостаточности почек, циррозе печени, идиопатических отеках. Но если при дефиците внеклеточной жидкости при нормальном уровне натрия патогенетические механизмы едины для всех вызывающих это состояние синдромов, то при увеличении количества внеклеточной жидкости с нормальным уровнем натрия, они различны. При заболеваниях почек с их недостаточностью основным является задержка воды и солей. Если не ограничивается поступление воды и соли, то прогрессирует гиперволемия с развитием отеков. Система ренин — ангиотензин — альдостерон подавляется, АД и минутный объем сердца повышаются. При непочечных заболеваниях механизм развития гиперволемической нормнатриемии другой. Развивается повышение гидростатического давления в капиллярах при одновременном снижении онкотического давления, только потом присоединяется почечная задержка солей и воды, поддерживающая гиперволемию. Поэтому внепочечные заболевания могут протекать с низким сердечным объемом, что запускает почечный механизм задержки солей и воды. Отсюда понятно, почему у этих больных, несмотря на гиперволемию, отмечают ортостатическую гипотензию. Низкий эффективный артериальный выброс у отечных больных ведет к неосмотической стимуляции антидиуретического гормона. Далее активируется выделение антидиуретического гормона. Усиливается жажда, что при неконтролируемом употреблении жидкости на фоне ее слабого выведения почками приводит к гипонатриемии.
Лабораторные исследования особенно плодотворны при дефиците объема внеклеточной жидкости. Внепочечная потеря жидкости по законам компенсаторной регуляции приводит к олигурии с увеличением удельного веса мочи более 1200 ммоль/л (осмолярность — более 600 ммоль/л) и снижению экскреции натрия и хлоридов до 20 ммоль/л и значительней. Этот компенсаторный механизм не срабатывает при сахарном диабете (осмотический диурез), при лечении мочегонными, при недостаточности коры надпочечников, при ранее существовавшей патологии почек. Повышение гематокрита и изменение уровня альбуминов в сыворотке крови надежно отражают дефицит экстрацеллюлярного объема только при динамических исследованиях.
ДД состояний, приводящих к отекам, рассмотрена в соответствующих главах и обычно не вызывает затруднений.
Гипонатриемия (<135 ммоль/л) развивается в случаях увеличения объема воды в организме относительно общего содержания натрия в организме. Концентрация натрия <120 ммоль/л — жизнеугрожающая.
Гипонатриемию подразделяют на три подгруппы:
- гиповолемическая гипонатриемия (дефицит общего объема воды в организме, еще больший дефицит натрия, клинически проявляется дегидратацией);
- эуволемическая гипонатриемия (умеренное увеличение объема воды без признаков отека или дегидратации);
- гиперволемическая гипонатриемия (резкое увеличение объема воды в организме), клинически протекает с отеками.
Снижение концентрации натрия в сыворотке крови ведет к снижению ее осмолярности и переходу жидкости в клетки. При снижении уровня натрия в сыворотке крови до <125 ммоль/л развивается отек мозга.
Ложную гипонатриемию отмечают при наличии в сыворотке крови других веществ, повышающих ее осмолярность (маннит, глюкоза, этанол и др.) с возникновением «осмотического провала». При парапротеинемии и выраженной гиперлипопротеидемии ложная гипонатриемия с нормальной осмолярностью возникает из-за того, что большие молекулы белков и липидов занимают объем в плазме крови, взятой на анализ. Эту проблему ложных результатов не может решить ни один из существующих методов с применением ионселективных электродов.
Гиповолемическая гипонатриемия протекает с уменьшением и воды, и натрия, но снижение концентрации натрия более значительно. Потери солей могут быть при заболеваниях почек или вне- почечными. Установление клинического диагноза «гиповолемическая гипонатриемия» не вызывает сложностей, если в анамнезе есть указания на рвоту, понос, прием мочегонных средств. Определение уровня натрия в моче позволяет разграничить почечные (>20 ммоль/л) и внепочечные (<10 ммоль/л) механизмы потери натрия.
Экстрапочечными причинами гиповолемической гипонатриемии (уровень натрия в моче <10 ммоль/л) являются чаше всего рвота и понос, затем потери солей в «третье пространство» при перитоните, панкреатите, илеусе, ожогах. Гипонатриемия обусловлена в этих ситуациях неосмотической стимуляцией антидиуретического гормона (АДГ) с развивающемся нарушением выделения воды почками.
Гиповолемическая гипонатриемия в результате почечных потерь натрия (уровень натрия в моче >20 ммоль/л) развивается при:
- лечении мочегонными средствами. Особенно выраженные симптоматические случаи гиповолемической гипонатриемии известны при применении тиазидных диуретиков;
- различные интерстициальные, клубочковые или кистозные заболевания почек, преимущественно при клубочковой фильтрации <10 мл/мин и бессолевой диете и/или одновременным применением мочегонных средств;
- недостаток минералкортикоидов при болезни Аддисона;
- осмотический диурез с потерей объема жидкости и солей. Чаще всего отмечают за счет глюкозурии при неадекватно леченнии пациентов с сахарным диабетом.
Эуволемическая гипонатриемия протекает без отеков и с признаками дегидратации. Обусловлена поступлением большого количества воды во внеклеточное пространство и нарушенным выведением жидкости почками. Развивается как:
- побочное влияние приема некоторых лекарственных препаратов;
- при неадекватной секреции антидиуретического гормона (синдром Шварца — Барттера);
- при гипотиреоидизме, при истощении коры надпочечников;
- при полидипсии, стрессах, операциях, длительной сильной боли.
Что делать врачу?
- Прежде всего в каждом случае эуволемической гипонатриемии необходимо исключить прием соответствующих медикаментов. Гипонатриемию вызывают следующие препараты: 1) аналоги АДГ (окситоцин); 2) стимуляторы выброса АДГ (хлорпропамид, карбамазепин, винкристин, антидепрессанты и антипсихотические средства); 3) препараты, усиливающие действие АДГ на почки (циклофосфамид, НПВП, хлорпропамид).
- Синдром неадекватной секреции АДГ — очень частая причина нормоволемической гипонатриемии. Обусловлен ограниченной дилютационной способностью почек с задержкой воды при повышенной секреции АДГ. Диагноз «синдром неадекватной секреции АДГ» может быть установлен при следующих условиях: нет сведений в анамнезе о применении антидиуретических препаратов, нет сведений о болезнях печени, сердца, гипофиза, щитовидной железы, коры надпочечников, гипонатриемия с низкой осмолярностью сыворотки крови, эуволемия без отеков, осмолярность мочи выше 200 ммоль/л несмотря на низкую осмолярность плазмы крови, уровень натрия в моче выше 20 ммоль/л, гипоурикемия. Синдром неадекватной секреции АДГ отмечают при заболеваниях ЦНС (опухоли, энцефалит, менингит, абсцесс мозга, травма черепа, кровоизляния в мозг, субдуральные и субарахноидальные кровотечения, острые психозы, синдром Гийена — Барре), при острой интермиттирующей порфирии, при заболеваниях легких (пневмонии, туберкулез, аспергиллез, абсцесс легкого, дыхательная недостаточность), при опухолевых заболеваниях (прежде всего рак бронхов, поджелудочной железы, лимфомы).
ДД синдрома Шварца — Барттера проводят с синдромом Барттера, или первичным простагландинизмом, или гипокалиемическим алкалозом (см. Гипокалиемия).
- Эндокринные заболевания (гипотиреоз и дефицит минералкортикоидов при болезни Аддисона) могут вызвать эуволемическую гипонатриемию из-за усиленной секреции АДГ и по интраренальному механизму.
- Эмоциональный стресс и боль способны вызвать гипонатриемию при стимуляции выброса АДГ и введении жидкости перорально или внутривенно без соответствующей коррекции солей. Этим же обусловлена послеоперационная гипонатриемия. Полидипсия при здоровых почках крайне редко приводит к гипонатриемии, поскольку воды требуется не менее 15–20 л/сут. Полидипсия способна вызвать гипонатриемию только в случаях превышения выделительной способности почек и неосмотической стимуляции выброса АДГ.
Гиперволемическая гипонатриемия может развиться у больных с нефротическим синдромом, застойной сердечной недостаточностью, циррозом печени. При отеках общее содержание натрия в организме повышено, но в еще большей степени повышено содержание воды. Уменьшение эффективного кровотока приводит к неосмотической стимуляции выброса АДГ. Это ведет к усиленной задержке воды в организме с гипонатриемией.
Этапы ДД при гипонатриемии (<135 ммоль/л) сводятся к следующему. Прежде всего определяют характеристики объема. Гиперволемическую гипонатриемию легко дифференцируют от других состояний по наличию отеков и асцита. Если отеков нет, то ищут клинические признаки гиповолемии (спавшиеся яремные вены, сухие кожа и слизистые оболочки, ортостатическая гипотензия). Если эти признаки выявляют, то есть основания говорить о гиповолемической гипонатриемии и на основании анамнеза, клинической картины, по концентрации натрия в моче судить о почечной или внепочечной потере натрия. При отсутствии отеков и признаков гиповолемии возникает мысль об эуволемическом состоянии. Если при этом гипоосмолярность сыворотки крови соответствует гипонатриемии, то имеется небольшая ренальная или экстраренальная потеря натрия без дефицита объема, что отмечают при синдроме неадекватного выброса АДГ. Если, несмотря на гипонатриемию, осмолярность сыворотки крови не изменена, то говорят о псевдогипонатриемии. Это возникает, если соотношение между натрием и водой нарушается за счет других мелких осмотически активных молекул, что отмечают при гиперпротеинемии, гиперлипидемии, гипергликемии.
Гипернатриемия
Определяют при концентрации натрия >145 ммоль/л. Концентрация натрия >160 ммоль/л — критическая.
Основными клиническими проявлениями гипернатриемии являются жажда, спутанность сознания, слабость, олигурия при гиповолемии.
Гипернатриемия развивается реже чем гипонатриемия. Дефицит воды во внеклеточном пространстве при гипернатриемии отмечают сравнительно редко, ибо возникающая жажда тут же приводит к приему жидкости и восполнению дефицита воды. Но у детей, тяжелобольных, у пациентов с органическими изменениями мозга, то есть у людей, которые не могут свободно регулировать поступление жидкости, ее потери с дыханием, с потом, через кишечник, почки могут приводить к гипернатриемии. Гипернатриемия приводит к гиперосмолярности сыворотки крови и переходу жидкости из клеток в межклеточное пространство. При повышении концентрации натрия >150 ммоль/л появляются неврологические симптомы. Гипернатриемия, являясь одной из важных составляющих так называемого метаболического синдрома, особенно опасна для новорожденных и улиц пожилого возраста. В этих возрастных группах смертность при гипернатриемии достигает 40—60%. В зависимости от соотношения натрия и воды, а также клинической картины гипернатриемию подразделяют на гиперволемическую, гиповолемическую и эуволемическую.
- Гиперволемическая гипернатриемия носит прежде всего ятрогенный характер и развивается при вливании гипертонических растворов натрия, при передозировке бикарбоната натрия (коррекция метаболического ацидоза или реанимационные мероприятия), полном парентеральном питании, а также при опухолях надпочечников с секрецией дезоксикортикостерона, врожденной гиперплазии надпочечников (дефект 11-гидроксилазы).
- Гиповолемическая гипернатриемия развивается при одновременной потере воды и солей. При этом дефицит воды превосходит дефицит натрия. Развивается при поносе, рвоте, наружных желудочно-кишечных свищах, длительной аспирации желудочного содержимого, при ожогах, усиленном потоотделении, лечении петлевыми диуретиками. Особенно часто это состояние развивается при осмотическом диурезе в случаях диабетического кетоацидоза, при гиперосмолярной некетоацидотической коме, при применении маннитола. Признаками внепочечной потери жидкости и солей с неадекватной почечной регуляцией является олигурия с повышением осмолярности мочи выше 10 ммоль/л.
- Эуволемическая гипернатриемия развивается при внепочечной (через кожу при интенсивном потоотделении, через легкие с дыханием при гипервентиляции или высокой температуре тела) и почечной (центральный и почечный несахарный диабет) потере воды. Внепочечные потери воды проявляются олигурией, повышением осмолярности мочи более 800 ммоль/л (= мосм/л), в то время как при почечной потере воды осмолярность мочи оказывается ниже осмолярности плазмы крови и отмечают выраженную полиурию. Центральный несахарный диабет развивается при менингите, энцефалите, аневризмах сосудов мозга, при туберкулезе и саркоидозе, после травм мозга, при опухолях или метастазах.
Почечный тип несахарного диабета может быть врожденным или приобретенным. Последний вариант выявляют при применении амфотеррицина, солей лития, тетрациклина, анальгетиков, при гиперкальцемии и гипокалиемии, при множественной миеломе и саркоидозе почек, при кистозных почках, обструктивной нефропатии. ДД центрального и почечного несахарного диабета проводят с помощью применения интраназального спрея АДГ или подкожной инъекции 5 ед. окситоцина. Если осмолярность мочи после этого повышается более чем на 50%, то говорят о центральном несахарном диабете. При почечном несахарном диабете осмолярность мочи не меняется, ее осмолярность остается ниже осмолярности плазмы крови. Это описание не применимо к пациентам с так называемым неполным несахарным диабетом, для больных с осмотическим диурезом, у которых осмолярность мочи выше, чем осмолярность плазмы крови.
Следует помнить, что признаки гиповолемии развиваются при сравнительно массивной потере воды, поэтому при незначительной гиповолемии пациентов нередко ошибочно относят в группу эуволемических. При истинной некомпенсированой потере воды из межклеточного пространства вначале развивается гипернатриемия.
Этапы ДД при гипернатриемии (>145 ммоль/л)
Определение осмолярности мочи необходимо для разграничения почечных и внепочечных потерь воды. Внепочечные потери воды или вливания гипертонических растворов хлорида натрия или бикарбоната натрия, сопровождаясь повышением осмолярности сыворотки крови, ведут к усиленному освобождению адиурекрина. Осмолярность мочи повышается более 800 мосм/л. Внепочечные потери воды при ее недостаточном поступлении ведут к признакам объемного дефицита. Гипернатриемия с гиперволемией чаще всего ятрогенна. Наличие полиурии с выделением мочи, чья осмолярность оказывается ниже осмолярности сыворотки крови, свидетельствует о центральном или почечном несахарном диабете. Их разграничение проводят с помощью введения окситоцина (вазопрессина).
Нарушения обмена калия
Калий является основным внутриклеточным катионом. Участвует во многих биохимических реакциях, особенно в процессе нейромышечной передачи. Поэтому изменение концентрации калия достоверно коррелирует с изменениями ЭКГ, что используется для целей практической диагностики, хотя абсолютной корреляции может и не быть.
Во внутриклеточном пространстве содержится до 98% всего калия (160 ммоль/л), в то время как во внеклеточном пространстве всего 2% (3,5–5 ммоль/л). Внутриклеточный калий поддерживает осмотическое давление, участвует в синтезе белков и гликогена, сказывается на активности многих ферментов, осуществляет нервно-мышечную передачу. Содержание калия в организме пропорционально массе тела. Так, при массе тела 70 кг организм содержит К+ 3500 мэкв.
Ежедневно в организм поступает 75–100 ммоль калия, 75–100 ммоль выделяется почками, около 10 ммоль/сут через кишечник. При гипо- или гиперкалиемии во внеклеточном пространстве перед врачом возникают следующие вопросы:
- Нарушен ли баланс внеклеточного калия? То есть гипо- или гиперкалиемии обусловлены пероральным или парэнтеральным нарушением поступления калия, снижением всасывания в кишечнике, или усиленным выделением почками.
- Нарушен ли баланс внутриклеточного калия? То есть перемещение ионов калия из или внутрь клеток изменило показатели концентрации калия во внеклеточном пространстве. Баланс внутриклеточного калия определяют по нескольким факторам. Ацидоз приводит к поступлению ионов водорода в клетки. Для выравнивания электрического заряда ионы калия устремляются наружу, во внеклеточную жидкость. Таким образом ацидоз приводит к гиперкалиемии. При алкалозе ионы водорода устремляются из клеток. Для компенсации возникшего электрического дисбаланса ионы калия входят в клетки. Возникает гипокалиемия. Инсулин, катехоламины и альдостерон способствуют переходу калия во внутриклеточное пространство. Влияние каждого отдельного гормона на транспорт калия сравнительно незначительно. Но при совокупном действии, как, например при гипоренинемическом гипоальдостеронизме в случаях диабетической нефропатии, развивается гиперкалиемия. Повышение осмолярности внеклеточной жидкости ведет к выходу внутриклеточной воды и соответственно калия из клеток.
Гипокалиемия (<3,5 ммоль/л)
Причинами гипокалиемии являются недостаточное поступление калия, его усиленное выведение (внешний баланс) и нарушения внутреннего баланса при алкалозе, при гипокалиемических периодических параличах, при инсулинотерапии некомпенсированного сахарного диабета, при лечении пациентов с пернициозной анемией витамином В12. При условии сохранения pH плазмы крови снижение концентрации калия в ней с 4 до 3 ммоль/л соответствует дефициту К+ в 100–200 мэкв. Снижение уровня калия в плазме крови ниже 3 ммоль/л соответствует дефициту К+ в 200–400 мэкв. Снижение калия <3 ммоль/л — критическое.
Клиническая картина дефицита калия не всегда полностью коррелирует со степенью снижения уровня калия в сыворотке крови. Чем быстрее развивается недостаток калия в организме, тем ярче выражена клиническая картина. Общими симптомами являются повышенная утомляемость, адинамия, апатия, затем появляются симптомы нарушения нейромышечной передачи: слабость скелетных мышц вплоть до вялых параличей. В итоге возможен рабдомиолиз с повышением уровня КФК. Слабость гладких мышц приводит к развитию парезов кишечника (запор), атонии мочевого пузыря. Ритм сердца нарушен, чувствительность к сердечным гликозидам чрезмерно высока. Зубец Т сглажен, сегмент ST снижен относительно изолинии, появляется зубец U, который может сливаться с зубцом Т. Снижается концентрационная способность почек, появляется устойчивость сосудов к вазопрессину.
Одним из наиболее ярких наследственных синдромов, протекающих с дефицитом калия, является синдром Барттера. Передается а/p, чаще спорадический. Обусловлен повышенным синтезом простагандина Е2. Последний ведет к расширению сосудов, стимулирует ренин — ангиотензин — альдостероновую систему. В итоге блокируется K–Na-АТФаза, подавляется реабсорбция натрия в дистальных почечных канальцах. Секреция ионов К+ и Н+ усиливается. Итогом являются устойчивость сосудов к действию ангиотензина и норадреналина, почечная потеря калия, гипостенурия, повышение внутриклеточного натрия.
Клинически: дети отстают в массе тела и росте. Адинамия, диффузная мышечная боль. Интермиттирующие гипокалиемические параличи, парестезии, тетанически подобные состояния, головная боль, говокружение, обмороки. Преходящие отеки лица и ног, ночная полиурия. Запоры вплоть до илеуса. АД снижено или нормальное. Сосуды резистенты к действию норадреналина и ангиотензина. Возможны дебильность, нейросенсорная тугоухость. При дополнительных исследованиях: гипогликемия, гипернатриемия, метаболический алкалоз, гиперхлоремия. Значительно повышены активность ренина в плазме крови, концентрация норадреналина и кинина. В моче — гиперальдостеронурия, ацидурия, гипостенурия, гиперкалликреинурия. На ЭКГ — признаки гипокалиемии. Биопсия почек — гипертрофия и гиперплазия юкстагломерулярного аппарата.
ДД проводят с синдромом Шварца — Барттера, первичным альдостеронизмом, отеками идиопатическими, калийдефицитными состояниями, периодическими параличами, синдром Лидля. Синдром Лидля — редкое а/д состояние, напоминающее первичный гиперальдостеронизм, протекающее с АГ и гипокалиемическим метаболическим алкалозом. Мутация находится в гене, кодирующем субъединицы эпителиального натриевого канала почек. В итоге в дистальной части нефрона, несмотря на нормальные уровни альдостерона и кортизола и сниженный уровень ренина, усиленно всасывается натрий. Компенсаторно теряется калий.
Недостаточное поступление калия редко является самостоятельной и единственной причиной гипокалиемии. Выявляют при стенозах верхних отделов желудочно-кишечного тракта, при нейрогенной анорексии и хроническом алкоголизме, особенно в сочетании с рецидивирующей рвотой, приемом слабительных или мочегонных средств, вливаниях бес- калиевых инфузионных растворов.
Усиленная потеря калия возможна через почки или желудочно-кишечный тракт. Потеря калия через почки (калий мочи >20 ммоль/л, несмотря на гипокалиемию) может быть первично почечной или при экстраренальных состояниях, протекающих с повышенной канальцевой секрецией калия. Первично почечные потери калия при заболеваниях почек отмечают редко. Развиваются при хроническом интерстициальном нефрите, при дистальном (I тип) и проксимальном (II тип) тубулярном ацидозе. Значительно чаще причинами усиленной потери калия через почки являются экстраренальные состояния. Чаще всего это длительная терапия мочегонными препаратами, затем применение кортикостероидов, обусловливающих усиленную секрецию калия в дистальных канальцах. При аденоме или двусторонней гиперплазии надпочечников развивается первичный альдостеронизм. Клинически наряду с гипокалиемией первичный альдостеронизм проявляется АГ, а лабораторно повышением уровня альдостерона и снижением активности ренина. Эти признаки может симулировать прием солодкового (лакричного) корня, но уровень альдостерона при этом не меняется.
Все заболевания, протекающие с тяжелым вторичным альдостеронизмом, характеризуются гипокалиемией: декомпенсированные цирроз печени и сердечная недостаточность, нефротический синдром, злокачественная АГ, синдром Барттера (см. выше).
Потери калия через желудочно-кишечный тракт характеризуются низким содержанием калия в моче. Все состояния, протекающие с усиленной потерей желудочно-кишечных соков (хроническая диарея, рвота, дренажи, зонды, потери в «третье пространство»), приводят к гипокалиемии.
Нарушения внутреннего баланса калия соответствует переходу калия из внеклеточного пространства в клетки. В итоге возникает гипокалиемия без дефицита калия как такового. Метаболический и респираторный алкалоз приводят к переходу катионов водорода из клеток в экстрацеллюлярное пространство. В обмен в клетки устремляется калий. Гипокалиемия развивается при лечении диабетической гипергликемии инсулином, поскольку этот гормон усиливает переход калия в клетки. Аналогичный эффект возникает при лечении пернициозной анемии фолиевой кислотой и витамином В12. Резко усилившийся эритропоэз требует усиленного включения калия в клетки. Переход калия внутрь клеток отмечают при семейных периодических параличах, особенно после усиленного потребления углеводов.
Диагностические этапы при гипокалиемии
Решающим для классификации гипокалиемических состояний являются анамнез, уровень АД, масса тела, лабораторные изменения (уровень калия и хлоридов в моче). На основании анамнестических сведений устанавливают такие причины, как понос, рвота, прием слабительных и мочегонных, злоупотребление солодкой. Низкое АД отмечают при желудочном алкалозе, приеме мочегонных и слабительных средств, синдроме Барттера. Высокое АД типично при любых причинах повышенной концентрации минералкортикоидов. Недостаточная масса тела может быть при желудочном алкалозе (рвота), при приеме слабительных средств и диуретиков. Заболевания с нарушенным балансом калия дифференцируют по содержанию калия, натрия и хлоридов в моче, что позволяет быстро выявить почечные и внепочечные механизмы потери калия.
Гиперкалиемия (>5,5 ммоль/л)
Причинами гиперкалиемии являются повышенный приток калия, снижение его экскреции, нарушения внутреннего баланса с переходом внутриклеточного калия во внеклеточное пространство, псевдогиперкалиемия. Уровень калия >6,5 ммоль/л — жизнеугрожающий. Всегда необходимо исключать ложную гиперкалиемию (см. ниже).
В клинической картине доминирует нарушения нервно-мышечной передачи. Вначале рефлексы повышены, затем в случаях блокады реполяризации отмечают парестезии, арефлексии, вялые парезы, в том числе дыхательных мышц. АД снижено. Брадикардия и аритмии могут смениться мерцанием предсердий и остановкой сердца. Зубец Т гигантский, островерхий, расширяется зубец Р, комплекс QRS, появляется AV-блокада, блокада ножек пучка Гиса.
Усиленное поступление калия с пищей редко приводит к гиперкалиемии, поскольку здоровые почки выводят лишние катионы. При сниженной функции почек вливание растворов калия, переливания крови, особенно при большой скорости вливаний и долго хранившихся растворов, высокие дозы калиевой соли пенициллина (10 млн ME содержат 17,4 ммоль калия), заменители поваренной соли, используемые при диетотерапии гипертонической болезни, могут привести к тяжелой гиперкалиемии. Поэтому введение калийсодержащих препаратов возможно только под контролем функции почек.
Снижение выделения калия — наиболее частая причина гиперкалиемии. Первично почечное нарушение выделения калия отмечают при острой олиго-/анурии. При анурии ежедневно уровень калия в плазме крови повышается на 1 ммоль/л, поскольку клеточный катаболизм приводит к переходу калия во внеклеточное пространство, что усиливается почечным ацидозом. При хронической почечной недостаточности ренальные и экстраренальные механизмы длительное время предотвращают развитие гиперкалиемии. При умеренной недостаточности с уровнем креатинина до 700–800 мкмоль/л развитие гиперкалиемии малореально и наступает только при наличии сопутствующих факторов. Лишь в терминальной стадии почечной недостаточности при олигурии возможно развитие тяжелой гиперкалиемии. Развитие гиперкалиемии обусловливает применение взамен поваренной соли калийсодержащих солей, применение калийсберегающих диуретиков, блокаторов бета-адренорецепторов, гепарина, НПВП, развитие метаболического ацидоза и гипоренинемического гиперальдостеронизма.
Переход внутриклеточного калия во внеклеточное пространство (внутренний дисбаланс — нарушения распределения) развивается при метаболическом и респираторном ацидозе за счет обмена калия на катионы водорода, что обусловлено реакцией организма по выравниванию pH во внеклеточном пространстве. Гиперкалиемию обусловливает массовая гибель клеток с выходом калия при миолизе, ожогах, цитостатической терапии при злокачественных опухолях, особенно при снижении функции почек. Гиперкалиемия развивается при дигиталисной интоксикации, при лечении аргинином, сукцинилхолином, на фоне гипергликемии и одновременного дефицита инсулина. Гиперкалиемия развивается при периодических параличах, провоцируемых калиевой перегрузкой, мышечной работой, охлаждением, голодом, и проявляется атаками вялых параличей мышц туловища и конечностей.
Псевдогиперкалиемию выявляют при гемолизе взятой для исследования пробы крови, а также при разрушении тромбоцитов при тромбоцитозе или лейкоцитов (при миелозе). Гиперкалиемию, обусловленная застоем крови, определяют при исследовании крови, взятой из длительно работавшей руки (сжатие и раскрытие кулака), или при длительно наложенной манжетке при заборе крови.
ДД-этапы при гиперкалиемии
Необходимо прежде всего исключить техническую ошибку забора крови и хранения пробы (псевдогиперкалиемия). По данным анамнеза исключить применение определенных лекарственных средств, калиевых солей, а также наличие сахарного диабета, семейного паралича. Определить функцию почек по данным креатинина. Исключить ацидоз, гипоальдостеронизм.
Нарушения обмена кальция
Широкий спектр клинических симптомов гипо- или гиперкальциемии обусловлен разнообразием физиологических реакций, в которых участвует кальций. Кальций расходуется на построение костей, участвует в нейромышечной передаче, в сократимости мышц, электрической активности сердца, в синтезе соединительной ткани, в секреции экзо- и эндокринных желез, в ферментных реакциях, в свертывании крови и активации комплемента. Несмотря на такое важное биохимическое значение кальция, 99% этого элемента связаны в костной ткани, где он в сочетании с другими ионами участвует в построении гидроксиапатита. Около 1% кальция, находящегося в костях, подвижно, то есть может поступать во внеклеточную жидкость для регуляции кальциевого баланса.
Кальций в сыворотке крови содержится в 3 биологически значимых соединениях.
Ионизированный кальций биологически активен, составляя 55–65% всего кальция в сыворотке крови. Именно этот кальций имеет клиническое значение и уровень его поддерживается в достаточно узких пределах. Гиперкальциемия и гипокальциемия обусловлены «выскальзыванием» ионизированного кальция за четко определенные границы.
Около 35–40% составляет кальций, связанный с белками. Из этого количества 90% кальция связано с альбуминами и не более 10% с глобулинами. Снижение уровня альбумина в плазме крови на 10 г/л влечет за собой снижение кальция на 0,2 ммоль/л.
Не более 5% кальция образует комплексные соединения. В основном это соединения с фосфором. Они плохорастворимы. Поэтому повышение уровня фосфатов во внеклеточной жидкости может вести к отложению кальция в тканях.
В норме в сыворотке крови содержится 2,1–2,6 ммоль/л кальция. Этот уровень зависит от всасывания кальция в кишечнике, экскреции его почками, скорости утилизации в костной ткани и от высвобождения из костей. Ключевыми органами обмена кальция являются кишечник, почки и костная ткань. Обычно в день с пищей в организм поступает около 20–25 ммоль (до 1000 мг) кальция. Из этого количества 3–5 ммоль (150–200 мг) всасываются в кишечнике и выделяются почками. Регуляция движения кальция осуществляется паратгормоном и витамином D. Витамин D известен в форме D2 (эргокальциферол, получаемый из растительных источников) и D3 (холекальциферол — из животных продуктов). При биосинтезе холестерина в качестве промежуточного продукта образуется 7-дегидрохолестерин. Под действием ультрафиолетового излучения превращается в коже в витамин D3. В печени витамин D3 гидроксилируется, затем переносится в почки, где подвергается повторному гидроксилированию, что приводит к образованию активных форм витамина D. Ответом на гипокальциемию является усиление секреции паратгормона, а при гиперкальциемии секреция паратгормона снижается. Колебания уровня кальция в сыворотке крови определяют по нарушениях гормонального звена регуляции (изменение секреции паратиреоидного гормона или 1,25-OH3-D3), заболеваниям кишечника, почек и костей как органов-мишеней кальциевого обмена, нарушениями всасывания витамина D в кишечнике и нарушениями обмена витамина D в печени. Физиологическое действие витамина D состоит в стимуляции абсорбции кальция в кишечнике, его реабсорбции костной тканью, подавлении секреции паратиреоидного гормона, в дифференцировке клеток костного мозга, кожи и эндокринных желез. Витамин D3 может стимулировать или ингибировать синтез и РНК в клеточном ядре, что проявляется через регуляцию синтеза физиологически активных белков. Механизм действия витамина D3 сходен с действием стероидных гормонов.
Гипокальциемия (<2,1 ммоль/л)
Снижение концентрации ионизированного кальция вызывает прежде всего такие неврологические изменения, как гиперрефлексия, симптомы Хвостека, Труссо, вплоть до тетанических судорог. На ЭКГ увеличивается интервал Q–Т за счет сегмента ST без изменения продолжительности зубца Т. Гипокальциемия может возникнуть при недостатке паратгормона и/или витамина D. В ДД гипокальциемии учитывают гипоальбуминемию и нарушения обмена витамина D.
Гипоальбуминемия при нефротическом синдроме, циррозе печени, экссудативной энтеропатии и синдроме мальабсорбции обусловливает снижение уровня кальция в сыворотке крови. Снижение содержания альбумина на 10 г/л приводит к снижению кальция на 0,2 ммоль/л.
Нарушения обмена витамина D
Витамин D образуется частично в коже под действием ультрафиолетового облучения как производное холестерина, а также поступает из кишечника. Если ребенок проводит на солнце 2 ч в незапыленной атмосфере и у него открыты только личико и кисти рук, то образующегося за этот период витамина D хватает для покрытия суточной в нем потребности. Но соблюсти все условия инсоляции сложно. Поэтому большое значение имеет поступление витамина D с пищей. Витамин, поступающий из кишечника и кожи, гидроксилируется в печени и почках. Нарушения обмена витамина D могут произойти на нескольких этапах:
- Нарушение всасывания витамина в кишечнике. Однообразное питание белыми крупами, связывающими витамин D и кальций, недостаточное употребление витамина в пищу, все синдромы мальабсорбции, нарушение функции эпителия после кишечных инфекций, стеаторея при панкреатите или хроническом дефиците желчи (билиарный цирроз), при злоупотреблении слабительными средствами.
- Нарушение гидроксилирования холекальциферола в печени отмечают при уменьшении объема ее функционально активной паренхимы при хроническом гепатите, циррозе. Терапия барбитуратами и производными дифенилгидантоина активирует микросомальные ферменты печени, и образуются неактивные производные витамина При нефротическом синдроме значительное количество витамина D выводится с мочой, что ведет к гипокальциемии.
- Уменьшение объема физиологически активной паренхимы почек при хронической почечной недостаточности обусловливает образование неактивной формы витамина D.
- Возможна невосприимчивость органов-мишеней к витамину D в его обычных дозах.
- Результатом нарушения обмена витамина D является снижение поступления кальция из кишечника, рахитически остеомаляционные изменения костей. Как итог активации остеобластов — повышение активности щелочной фосфатазы.
- Хроническая почечная недостаточность является одной из наиболее частых причин дефицита витамина D с развитием гипокальциемии и задержкой фосфатов.
- Синдром спру и другие синдромы мальабсорбции ведут к гипокальциемии за счет нарушенного всасывания кальция и витамина D, а также за счет гипоальбуминемии.
- Острый панкреатит с выходом протео- и липолитических ферментов в брюшную полость приводит к отложению кальция на месте некрозов с развитием гипокальциемии.
- Гипопаратиреоидизм и псевдогипопаратиреоидизм протекают с ведущими для них симптомами — гипокальциемией и гиперфосфатемией. При гипопаратиреоидизме недостаток паратгормона ведет к уменьшению выхода кальция из костей и снижению канальцевой реабсорбции кальция. Поскольку дефицит паратгормона вызывает усиление обратного всасывания фосфатов в почечных канальцах, то развивается гиперфосфатемия.
Причинами гипопаратиреоидизма являются удаление паращитовидной железы при струмэктомии, дефицит магния у алкоголиков и при синдромах мальабсорбции, идиопатический (синдром Ди Джорджи, Х-связанный гипопаратиреоидизм, болезнь Аддисона, кандидоз кожи и слизистых оболочек), спорадический или семейный гипопаратиреоидизм, иногда сочетающийся с пернициозной анемией или недостаточностью коры надпочечников. Транзиторный гипопаратиреоидизм часто развивается после субтотального удаления щитовидной железы. У 3% больных после тиреоидэктомии развивается постоянный гипопаратиреоз. Гипокальциемия появляется через 24–48 ч после операции, но может проявиться спустя месяцы и годы.
Гипопаратиреоз чаще возникает после радикального удаления щитовидной железы по поводу рака, или после операций на собственно паращитовидных железах (например субтотальная паратиреидэктомия). Факторами риска дефицита паратиреоидного гормона с тяжелой гипокальциемией после субтотальной паратиреидэктомии являются предшествующая операции выраженная гипокальциемия, удаление большой аденомы, повышение активности щелочной фосфатазы.
- Псевдогипопаратиреоидизм — снижение чувствительности органов-мишеней к паратгормону. В противоположность истинному гипопаратиреоидизму уровень паратгормона даже повышен. Синдром отмечают у людей с низким ростом, сниженным интеллектом, ожирением, укорочением III и IV метатарзальных и метакарпальных костей.
- Пероральное или внутривенное поступление неорганического фосфата в больших количествах, освобождение фосфата при разрушении клеток (цитостатическая терапия), снижение экскреции фосфатов почками при хронической почечной недостаточности ведет к образованию комплексных нерастворимых соединений с кальцием и его отложению в тканях.
- Гипокальциемию отмечают при множественных остеопластических метастазах опухолей грудной железы, рака бронхов, предстательной железы, медуллярной тиреокарциноме, продуцирующей кальциотонин. Вторично гипокальциемия может развиться при цитостатической терапии лимфом и лейкозов по механизму: разрушение клеток — освобождение фосфатов — образование фосфаткальциевых соединений — отложение кальция в тканях.
Гиперкальциемия (>2,6 ммоль/л)
Симптомами гиперкальциемии являются повышенная утомляемость, разбитость, кожный зуд, жажда, полиурия, рвота, анорексия, запоры, уменьшение массы тела, боль в животе, язва двенадцатиперстной кишки, панкреатит, снижение нейромышечной передачи, гипорефлексия, мышечная гипотония, психозы, кома, нефрокальциноз, почечная недостаточность, АГ, аритмия, кальцификация сосудов, отложение кальция в конъюнктиве (синдром красных глаз), укорочение интервала S–T на ЭКГ. Этот интервал иногда может полностью исчезать, и зубец Т тогда начинается сразу за комплексом QRS.
Гиперкальциемия развивается при первичном гиперпаратиреоидизме, при опухолях костей или метастазировании в кости, при передозировке витаминов D или А, лечении тиазидными диуретиками, литием, молочно-щелочном синдроме, кальцийсодержащих ионообменных препаратах, при гипертиреозе, акромегалии, недостаточности коры надпочечников, феохромоцитоме, при острой и хронической почечной недостаточности, после трансплантации почек, при саркоидозе, туберкулезе и после инъекций силикона, при иммобилизации.
Гиперкальциемия при первичном гиперпаратиреоидизме
Диагноз «первичный гиперпаратиреоидизм» имеет особое значение, поскольку хирургическое вмешательство может привести к полному излечению. Гиперкальциемия развивается у 20–25% всех больных с первичным гиперпаратиреоидизмом. До 1970-х годов гиперпаратиреоидизм диагностировали крайне редко, в 1970–1990 — у 1:1000 населения. После внедрения многоканальных скрининговых тестов — у 5:1000. такой рост заболеваемости за последние 30 лет обусловлен внедрением высокочувствительных методик и регистрацией субклинических случаев. Первичный гиперпаратиреоидизм отмечают в различных возрастных категориях, но у детей крайне редко. Пик заболеваемости приходится на 50–60 лет. Женщины болеют в 3 раза чаще чем мужчины. Гиперпаратиреоидизм обусловлен в 90% случаев солитарной аденомой паращитовидной железы, в 9% случаев гиперплазией паращитовидных желез, в 1% случаев выявляют в сочетании с эндокринными опухолями других эндокринных желез. Множественный первичный эндокринный аденоматоз I типа включает опухоли паращитовидных желез, гипофиза, островкового аппарата поджелудочной железы. Тип ПА— сочетание рака паращитовидной железы, медуллярной карциномы щитовидной железы и феохромоцитомы. Редко выявляют семейный гипокальцийурический гиперкальцемический синдром. Передается а/д. Возможна гиперплазия паращитовидных желез, но уровень паратгормона при этом не меняется. Чаще протекает бессимптомно.
Клиническая картина гиперпаратиреоидизма многообразна: от полностью бессимптомного течения до полиморфной симптоматики. Возможны депрессия, апатия, мышечная слабость, тошнота и рвота, полидипсия, полиурия, запор, язва двенадцатиперстной кишки, холелитиаз, панкреатит, нефрокальциноз и уролитиаз, почечная недостаточность, А Г, боль в костях и в суставах. Рентгенологически отмечают резорбцию субпериостальных отделов, акроостеолиз, гранулярность структуры покровных костей черепа с «исчезновением» внутренней и наружной пластинки. Биохимически выявляют гиперкальциемию, гипофосфатемию, а при радиоиммунных исследованиях — повышенный уровень паратгормона. Лабораторные данные соответствуют влиянию паратгормона на почки, кишечник и кости. Гиперкальциемия объясняется освобождением кальция из костей, его усиленным всасыванием из кишечника и повышенной реабсорбцией в почечных канальцах. Одновременно паратгормон блокирует обратное всасывание фосфатов, почему и развивается гипофосфатемия. Но при недостаточности функции почек гипофосфатемии может не быть. Опорными точками для поиска первичного гиперпаратиреоидизма является сочетание гиперкальциемии, гипофосфатемии, нефролитиаза.
При диагнозе «первичный гиперпаратиреоидизм» необходимо установить локализацию опухоли паращитовидной железы и, возможно, опухолей других желез. Это достигается данными эхоГ, КТ, ЯМР и др.
Критериями для «передачи» пациентов хирургам являются:
- Уровень кальция в сыворотке крови >120 мг/л.
- Гиперкальциурия (>400 мг/сут).
- Другие манифестации первичного гиперпаратиреоидизма (нефролитиаз, остеолиз, фиброзные изменения костей, нейромышечные нарушения).
- Резкое снижение плотности кортикального слоя костей.
- Снижение клиренса креатинина (при исключении других причин).
- Возраст пациента <50 лет.
Гиперкальциемия при злокачественных опухолях
Гиперкальциемия развивается приблизительно у 20–24% больных со злокачественными опухолями. Плоскоклеточный рак бронхов и крупноклеточный анапластический рак в 15–20% случаев протекает с гиперкальциемией. Среди больных с гиперкальциемией при злокачественных опухолях чаще всего пациенты с раком бронхов (25%), затем раком молочной железы (18%), почти так же часто миеломой (16%), реже раком пищевода (7%), гипернефромой (4%). Остальные опухоли (рак желудка, толстой кишки, рак шейки матки, яичников и др.) как причина опухолевой гиперкальциемии составляют по 1–3% и менее. Для прогноза и лечения гиперкальциемии при опухолях большое значение имеет выяснение причин гиперкальциемии. Гиперкальциемия при малигномах может быть обусловлена сочетанием первичного гиперпаратиреоидизма и опухоли, метастазами в костях с усиленным освобождением кальция, образованием костерезорбирующих медиаторов (простагландины, паратгормон-рилизинг пептид), образованием остеобластактивирующего фактора при миеломе, образованием 1,25-OH2-D3 при лимфоме.
Гиперкальциемия при метастазах в костях обусловлена деструкцией костной ткани. Метастазы являются причиной 80% всех случаев гиперкальциемии при опухолях. Полной корреляции между объемами метастазирования в кости и степенью гиперкальциемиии нет. Возможны значительное повышение уровня кальция в крови при маленьких метастазах и отсутствие гиперкальциемии при больших и множественных метастазах. Особенно часто гиперкальциемия развивается при метастазах рака бронхов, молочной железы, предстательной железы, гипернефромы, рака щитовидной железы. Метастазы локализуются преимущественно в позвонках, костях таза, черепа, в проксимальных отделах длинных трубчатых костей. Клинически метастазы проявляются болью, патологическими переломами, нарушениями гемопоэза. Метастазы выявляют рентгенологически и изотопными методами исследования.
Гиперкальциемия при злокачественных лимфомах может быть обусловлена продукцией в них 1,25-OH2-D3.
Гиперкальциемия при множественной миеломе обусловлена продукцией остеокластактивирующего фактора.
- Сочетание первичного гиперпаратиреоидизма и опухолей. Вероятность выявления опухоли у больных с первичным гиперпаратиреоидизмом составляет 0,1%.
- Гиперкальциемия без метастазов (гуморальная гиперкальциемия). При этом гиперкальциемия обусловлена продукцией костерезорбирующих медиаторов, прежде всего простагландинов и паратгормонподобных пептидов. Они связываются с соответствующими рецепторами клеток и оказывают действие, аналогичное паратгормону. Уровень паратгормона при опухолевой гиперкальциемии нормален или даже снижается.
Другие причины гиперкальциемии
Эндокринные заболевания. Гиперкальциемия развивается при гиперфункции щитовидной железы, акромегалии, феохромоцитоме, острой недостаточности надпочечников. Гиперкальциемия при этих состояниях очень умеренная и является случайным выявлением.
Лекарственные средства. Гиперкальциемию обусловливает прием эргокальциферола (витамин D2), холекальциферола (D3), дигидротахистерола (D10), гидроксилированных метаболически активных производных витамина D. Действие витамина D усиливается при одновременном применении тиазидных диуретиков. Опасность передозировки витамина D повышается у женщин в менопаузальный период, поскольку исключается влияние эстрогенов, блокирующих влияние витамина D на костную ткань. Повышенную чувствительность к витамину D выявляют у больных саркоидозом и туберкулезом.
Изредка гиперкальциемия развивается при передозировке витамина А.
При лечении тиазидными диуретиками и солями лития возможно развитие гиперкальциемии. Однако чаще под влиянием этих препаратов ранее не диагностированные нормокальциемические аденомы паращитовидной железы переходят в клинически значимые гиперкальциемические состояния.
Молочно-щелочной синдром и прием кальцийсодержащих ионообменных препаратов характеризуется гиперкальциемией, возможным повышением уровня фосфора в сыворотке крови, метаболическим алкалозом, снижением уровня паратгормона и почечной недостаточностью. Обусловлен интенсивным поступлением щелочей и кальция, чаще в виде карбоната. В норме повышенный приток кальция с антацидами нивелируется кишечником, но при молочно-щелочном синдроме этот барьер нарушается. Повышенное поступление кальция через кишечник ведет к развитию гиперкальциемии, снижению уровня паратгормона в крови. В результате снижения синтеза паратгормона повышается реабсорбция фосфатов с развитием гиперфосфатемии. Возможны нефрокальциноз и почечная недостаточность. Последнее еще более снижает выделение кальция почками. Аналогично гиперкальциемия развивается при лечении гиперкалиемии кальцийсодержащими ионообменными препаратами.
Гиперкальциемия при заболеваниях почек. В полиурической, реже олигурической стадии острой почечной недостаточности, особенно обусловленной рабдомиолизом, достаточно типично развитие гиперкальциемии. Причинами является выход кальция из разрушенных мышц и преходящий гиперпаратиреоидизм.
При хронической почечной недостаточности гиперкальциемия обусловлена третичным гиперпаратиреоидизмом, применением витаминов D при нефрогенных остеопатиях, кальцийсодержаших ионообменных препаратов при гиперкалиемии, применением ацетата и карбоната кальция.
Гиперкальциемия при гранулематозных заболеваниях особенно типична для саркоидоза (у 1–15% больных). Значительно чаще выявляют гиперкальциурию. Установлено, что при саркоидозе внепочечно в гранулемах вырабатывается 1,25-OH2-D3. Аналогичные процессы возможны в туберкулезных гранулемах, при более редких гранулематозных заболеваниях и после инъекций силикона в молочную железу или половой член.
Иммобилизация, особенно у детей и людей молодого возраста, вызывает гиперкальциурию и гиперкальциемию.
Тактика ДД при гиперкальциемии
Прежде всего исключается медикаментозная гиперкальциемия. Затем проводят определение уровня паратгормона, креатинина, тиреотропных гормонов, щелочной и кислой фосфатазы, простатспецифического ракового антигена, определение уровня витамина D. Данные эхоГ, рентгеновских исследований, сцинтиграфии скелета позволяют исключить у пациентов с низким уровнем паратгормона опухолевые заболевания с и без метастазов. При подозрении на гуморальную, не метастазную, гиперкальциемию, желательно определить наличие паратгормонподобного полипептида.
Нарушения обмена магния
Магний содержится преимущественно в костях (50%), мышцах и внутриклеточной жидкости. Внеклеточная жидкость содержит 1% общих запасов магния, которые у взрослого составляют около 2000 мэкв. Важно знать, что уровень магния в плазме крови, определенный по концентрации свободного иона, может не отражать истинное содержание магния во внутриклеточной жидкости или в костях. Наряду с калием является основным внутриклеточным катионом. Играет важнейшую роль в нейромышечной передаче, участвует в массе ферментных реакций.
В плазме крови содержится в небольших количествах и на 20% связан с белками в сыворотке крови.
Гипермагниемия (выше 1,3 ммоль/л) развивается при недостаточности коры надпочечников или при почечной недостаточности. Лечение магнийсодержащими антацидами больных с нарушенной функцией почек также приводит к развитию гипермагниемии. Интоксикация магнием клинически проявляется мышечной слабостью, гипо- или арефлексией (при уровне магния 5 ммоль/л), брадикардией и блокадой сердца, расширением комплекса QRS и увеличением амплитуды зубца Т, запором, атонией мочевого пузыря.
Гипомагниемия (ниже 0,8 ммоль/л) развивается при недостаточном поступлении магния или его недостаточном всасывании в кишечнике при хроническом алкоголизме, недостаточном однообразном питании, хронической диарее и рвоте (болезнь Крона), при синдроме мальабсорбции. Гипомагниемия при усиленной потере магния развивается в случаях диабетического кетоацидоза, при лечении мочегонными средствами, при гиперальдостеронизме. Дефицит магния изредка развивается при первичной гиперфункции щитовидной или паращитовидных желез. Гипомагниемию из-за стимуляции почечной экскреции катиона обусловливает прием аскорбиновой кислоты и аминогликозидов. Особенно тяжело переносят гипомагниемию дети. Клиническая картина характеризуются анорексией, тошнотой, рвотой, общей слабостью, изменениями личности, тремором, фасцикуляцией, тетанией. Последняя коррелирует с сопутствующими гипокальциемией и гипокалиемией. И дело не только в возможных общих механизмах развития недостаточности минералов (например мальабсорбция). Известно, что магний очень плотно внедрен в метаболизм кальция и калия, но эта связь изучена очень слабо.
Нарушения обмена фосфора
Фосфор — важнейший внутриклеточный элемент. В организме содержится в виде фосфатов. До 85% фосфатов организма содержатся в костной ткани, 10% — в мышцах и 5% — в других клетках и во внеклеточной жидкости. Фосфор в клетках связан с углеводами, жирами и белками. Фосфор — элемент промежуточного гликолиза гликогена (2,3-дифосфоглицерат) и энергетического вещества— АТФ. 2,3-дифосфоглицерат эритроцитов определяет сродство гемоглобина к кислороду, то есть позицию волны диссоциации. Недостаток 2,3-дифосфоглицерата, проявляющийся при тяжелой гипофосфатемии, приводит к левому смещению волны диссоциации, что нарушает оксигенацию тканей. АТФ образуется из аденозиндифосфата, потребляя энергию. Затем эта энергия макроэргических связей может быть высвобождена по мере необходимости.
Гипофосфатемия (<1 ммоль/л)
Несущественное снижение уровня фосфатов часто выявляют случайно и не имеет клинического значения. Тяжелые изменения свойственны значительной гипофосфатемии (<0,3 ммоль/л), что отмечают при переводе экстрацеллюлярного фосфата во внутриклеточное пространство миоцитов на фоне легкой гипофосфатемии. Острая гипофосфатемия возникает при избыточном парентеральном питании, при обильном углеводистом питании после длительного голодания (нейрогенная анорексия), приеме инсулина при диабетическом кетоацидозе, при остром респираторном алкалозе. Хроническая гипофосфатемия развивается при хроническом алкоголизме и нейрогенной анорексии, при синдроме мальабсорбции и приеме антацидов, при усиленном выведении фосфатов почками (витамин D-резистентный рахит, длительный прием мочегонных, первичный гиперпаратиреоидизм, гипофосфатемические заболевания костей). Таким образом, регулярное определение уровня фосфатов в крови необходимо при лечении пациентов с диабетическим кетоацидозом, выведении пациентов из длительного качественного или количественного голодания и при многих других заболеваниях.
Острый переход экстрацеллюлярных фосфатов во внутриклеточное пространство мышечных клеток обусловливает энергетический дефицит в других клетках. Возникают нарушения ЦНС, эритроцитов, тромбоцитов, лейкоцитов, рабдомиолиз. Клинически гипофосфатемия проявляется мышечной слабостью, гемолизом, нарушением аффинитета гемоглобина к кислороду, склонностью к развитию сепсиса, повышенной кровоточивостью, повышением креатинфосфокиназы, парестезиями, судорогами, комой.
Гиперфосфатемия (>1,5 ммоль/л)
Гиперфосфатемия развивается при усиленном пероральном или внутривенном поступлении фосфатов, интенсивном разрушением клеток, снижении экскреции фосфатов почками. Усиленное поступление фосфатов отмечают нечасто, возможно при вливании внутривенных растворов или при злоупотреблении фосфорсодержащими слабительными. Тяжелая гиперфосфатемия вплоть до кальцификации внутренних органов и почечной недостаточности развивается при лечении цитостатиками пациентов с лимфомой и лейкозом за счет быстрой массовой гибели опухолевых клеток. Наиболее частой причиной гиперфосфатемии является сниженная почечная экскреция при почечной недостаточности. Повышение концентации фосфатов крови начинается со снижения клубочковой фильтрации ниже 30 мл/мин. Почечная экскреция фосфатов снижена при гипотиреозе, гипопаратироидизме, акромегалии.
Нарушения кислотно-основного равновесия
Решающим фактором постоянства всех функций организма является стабильный уровень ионов водорода в жидкостях тела. Он поддерживается соотношением кислот (донаторы протонов) и оснований (акцепторы протонов). Уровень катионов водорода в плазме артериальной крови находится в пределах 37–43 нмоль/л (37⋅10–6–43⋅10–6 мэкв/л). Но в практической работе концентрация ионов водорода выражается в показателях pH (отрицательный логарифм концентрации катионов водорода). Возможные изменения показателя pH удерживаются организмом в постоянных и очень узких пределах тремя механизмами:
- Буферными соединениями — белковый буфер, гемоглобиновый буфер, фосфатный буфер, бикарбонат/рСО2 буфер.
- Дыхательной регуляцией выделения двуокиси углерода.
- Почечной регуляцией путем изменения реабсорбции бикарбоната, образованием и выделением титруемых кислот и аммиака.
Важнейшими показателями при оценке кислотно-основного равновесия являются:
- pH крови (7,36–7,44);
- уровень бикарбоната в сыворотке крови (22–27 ммоль/л);
- рСО2 артериальной крови (37–45 мм Hg).
Соотношение этих трех показателей определяется формулой Гендерсона — Хассельбаха: рН=6,1+log[HC03–(pC02⋅0,03)].
То есть при измерении pH и рСО2 крови всегда можно рассчитать НСО3–. Но из этого вытекает, что показатель pH определяется парциальным напряжением углекислого газа и концентрацией бикарбоната.
Кроме того, для оценки кислотно-основного состояния, дополнительно к определению pH, рСО2 и НСО3– необходимо выяснить концентрацию анионов, электролитов (натрий, калий, кальций, хлориды) в сыворотке крови, электролитов мочи (натрий, калий, хлор) и ее pH.
Нарушения кислотно-основного равновесия могут быть обусловлены первичным повышением или снижением рСО2 (респираторный ацидоз или алкалоз соответственно) или первичным повышением или понижением уровня бикарбонатов во внеклеточной жидкости (метаболический ацидоз или алкалоз соответственно).
Простые нарушения кислотно-основного равновесия легко диагностируют по показателям газового состава крови (табл. 34.1).
Таблица 34.1
Показатели газового состава крови при простых декомпенсированных нарушениях кислотно-основного состояния
| Тип нарушения | pH | рСО2 | НСО3– |
| Метаболический ацидоз | <7,36 | <37 | +! |
| Респираторный ацидоз | <7,36 | +! | + |
| Метаболический алкалоз | >7,44 | + | +! |
| Респираторный алкалоз | >7,44 | <37 | Снижено |
+ — повышение; ! — определяющее значение.
Клинические состояния, при которых вероятно развитие вполне определенных нарушений кислотно-основного равновесия приведены в табл. 34.2.
Таблица 34.2
Клинический статус пациента и развивающиеся нарушения кислотно-основного равновесия
| Клиническое состояние | Характер нарушения кислотноосновного равновесия |
| Беременность | Респираторный алкалоз |
| Гипотензия | Метаболический ацидоз |
| Диарея тяжелая | Метаболический ацидоз |
| Диуретики | Метаболический алкалоз |
| Почечная недостаточность | Метаболический ацидоз |
| Рвота | Метаболический алкалоз |
| Сепсис | Респираторный алкалоз, метаболический ацидоз |
| Хроническая обструктивная болезнь легких | Респираторный ацидоз |
| Цирроз печени | Респираторный алкалоз |
| Эмболия легких | Респираторный алкалоз |
Изменения рСО2 и НСО3– содружественны. Так, при метаболическом ацидозе первичное снижение НСО3– нивелируется снижением рСО2 при гипервентиляции. При метаболическом алкалозе первичное повышение НСО, коррелируется уменьшением вентиляции и повышением рСО2.
Ацидоз и алкалоз, раз возникнув, являются достаточно устойчивыми состояниями. Для полной коррекции первичных метаболических нарушений требуется около 6–11 ч, а для компенсации первичного респираторного нарушения требуется 2–5 дней (SIC!). Механизмы компенсации простых нарушений кислотно-основного равновесия представлены в табл. 34.3.
Таблица 34.3
Первичные* и сопутствующие нарушения при простом кислотно-основном дисбалансе и механизмы их компенсации
| Дисбаланс | [Н*] | pH | [НСО3–] | рСО2 | Компенсация |
| Метаболический ацидоз | Т | 4 | ф | 4 | Снижение рСО2 на 11–13 мм Hg на каждые 10 ммоль снижения (НСО3– |
| Метаболический алкалоз | 4 | Т | t | Т | Повышение рСО2 на 6–7 мм Hg на каждые 10 ммоль повышения НСО3– |
| Респираторный ацидоз | t | 4 | I | t | Острый: повышение [НСО3–] на 1 ммоль на каждые 10 мм Hg повышения рСО2 Хронический: повышение [НСО3–] на 3,5 ммоль на каждые 10 мм Hg повышения рСО2 |
| Респираторный алкалоз | 4 | Т | 4 | 4 | Острый: снижение [НСО3–] на 1 ммоль на каждые 10 мм Hg снижения рСО2 Хронический: снижение [НСО3–] на 3,5 ммоль на каждые 10 мм Hg снижения рСО2 |
*Первичные нарушения показаны жирной стрелкой.
Известны еще и так называемые смешанные нарушения кислотно-основного равновесия. Они обусловлены действием многих факторов, ведущих к смещению pH. Смешанные респираторно-метаболические нарушения, в отличии от вышеописанных простых, возникают при одновременном одностороннем изменении рСО2 и НСО3–. Поэтому оценить их можно только по специальным номограммам в совокупности с анамнестическими и клиническими сведениями.
Респираторный ацидоз
Респираторный ацидоз появляется при обструктивных (БА или хронический эозинофильный бронхит, деформирующий хронический бронхит) и рестриктивных (инфильтрат, пневмоторакс, ателектаз, пневмофиброз, отек легкого) заболеваниях легких, при нарушениях подвижности грудной клетки (кифосколиоз), при высоком стоянии диафрагмы (ожирение, паралич диафрагмы, терапии кортикостероидами), нейромышечных заболеваниях (миопатия, миозит, миастения, гипокалиемический паралич), при центрально обусловленном угнетении дыхательного центра (травмы, опухоли, кровотечения, прием наркотиков, опиатов, седативных средств, барбитуратов). К угнетению дыхательного центра ведет и неконтролируемое вдыхание смеси с избытком кислорода при хронической альвеолярной гипоксии как стимулятора дыхательного центра.
При нарушениях альвеолярной вентиляции снижается выведение катионов водорода с углекислотой. Соотношение НСО3–/рСО2 уменьшается из-за повышения рСО2. Это приводит к снижению pH, то есть закислению крови. Компенсаторно почки начинают усиленно выводить кислоты и реабсорбировать бикарбонаты. Если этот механизм истощается, развивается декомпенсированный респираторный ацидоз. Он проявляется повышением рСО2, снижение pH <7,36 и повышением бикарбонатов в сыворотке крови. Свойственная патологии легких гипоксемия усиливает анаэробный гликолиз, конечным продуктом которого является молочная кислота, и через эти метаболические нарушения, благодаря возникновению лактоацидоза, переводит респираторный ацидоз в смешанный. При смешанном ацидозе значения pH могут оказаться очень низкими, хотя уровни рСО2 и НСО3– изменены умеренно.
Основное клиническое проявление респираторного ацидоза — метаболическая энцефалопатия с головной болью, расширением вен глазного дна, отеком сосочка зрительного нерва, миоклонусом. Симптоматика развивается медленно, параллельно дыхательной недостаточности. Резкая отрицательная динамика провоцируется седативными средствами, легочной инфекцией, вдыханием обогащенных кислородом газовых смесей.
Респираторный алкалоз
Респираторный алкалоз развивается при психогенной гипервентиляции (синдром Эффорта, страх, боль) и в этом варианте чаше выявляют у женщин, при раздражении дыхательного центра травмами, опухолями, воспалением, а также возможен при передозировке салицилатов, при токсикозе в условиях сепсиса, вызванного грамотрицательной флорой, при гипервентиляции у больных с анемией, высокой лихорадкой, сердечной недостаточностью, пороками сердца с шунтом, поражениями легких, при высотной болезни.
Усиленная альвеолярная гипервентиляция выводит избыточное количество СО2. Соответственно уменьшается количество углекислоты в крови. Почки частично компенсируют это усиленным выведением бикарбонатов и задержкой экскреции кислот.
Острая альвеолярная гипервентиляция не представляет диагностических сложностей. Она развивается среди полного здоровья, чаще под влиянием страха, эмоций и хорошо отвечает на седативную терапию. Наряду с головокружением, оглушенностью, потемнением в глазах могут отмечать нейромышечные симптомы: парестезии, мышечная дрожь, карпопедальный спазм. Они обусловлены снижением концентрации ионизированного кальция и гипервентиляционной тетанией, увеличением концентрации лактата и пирувата.
Для клинициста важно отличие первичной гипервентиляции с респираторным алкалозом от вторичной гипервентиляции при метаболическом ацидозе.
Метаболический ацидоз
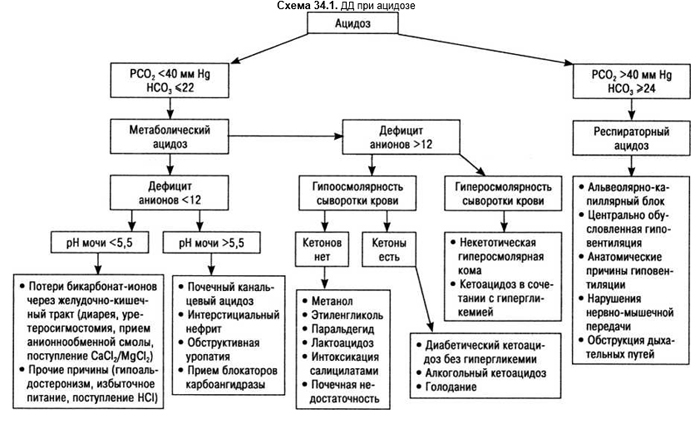
Метаболический ацидоз, снижение pH крови, бывает при первичном уменьшении бикарбонатов. Это может быть обусловлено избыточным поступлением извне или усиленным образованием в организме кислот, нейтрализация которых осуществляется бикарбонатами, снижением почечной экскреции кислот, потерей бикарбонатов через кишечник или почки. Снижение pH крови приводит к возбуждению дыхательного центра. Гипервентиляция ведет к уменьшению углекислоты крови за счет выдыхания углекислого газа. То есть для метаболического ацидоза типично снижение всех трех (pH, НСО3–, рСО2) показателей кислотно-основного равновесия. Если компенсаторное усиление дыхания протекает по типу глубоких длительных дыхательных движений, то говорят о дыхании типа Куссмауля. ДД первичной гипервентиляции, ведущей к респираторному алкалозу, и вторичной гипервентиляцией при метаболическом ацидозе проводят на основании анамнеза и клинической картины. Лабораторным подтверждением заключения является измерение pH: ацидоз обозначает наличие компенсационной гипервентиляции, алкалоз указывает на первичную гипервентиляцию. При метаболическом ацидозе необходимо исключить ряд состояний:
- Ацидоз при избыточном поступлении кислот или их усиленном образовании в организме
Избыточное поступление кислот свойственно отравлению салицилатами, метанолом, этиленгликолем, паральдегидом и некоторыми другими препаратами.
Диабетический кетоацидоз характеризуется повышением бета-оксибутирата и уксусной кислоты и наблюдается при диабетической коме.
Умеренный кетоацидоз отмечают у больных хроническим алкоголизмом и при хроническом голодании.
Лактатацидоз — типичное последствие анаэробного дыхания при различных формах тканевой гипоксии (тяжелая дыхательная гипоксемия, отравление окисью углерода, генерализованные судороги, остановка сердца, шок). Лактатацидоз выявляют при отравлениях этанолом, при циррозе печени, панкреатите, почечной недостаточности, токсикозе беременных, при тяжелом дисбактериозе кишечника и при лейкозах.
- Метаболический ацидоз при потере бикарбонатов почками или через кишечник
Почечную потерю НСО< отмечают при проксимально-канальцевом ацидозе или при применении блокаторов карбоангидразы (за счет медикаментозной блокады абсорбции бикарбонатов).
Обратное всасывание бикарбонатов в почечных канальцах тормозится и паратгормоном, поэтому при первичном гиперпаратиреоидизме развивается умеренно выраженный метаболический ацидоз.
Усиленная потеря бикарбонатов через кишечник характерна при диарее, свищах, уретеросигмостоме. При ацидозе, обусловленном патологией почек или кишечника, развивается гиперхлоремия, поэтому анионный резерв не изменяется.
- Метаболический ацидоз при снижении выведения кислот почками
Острая или хроническая почечная недостаточность характеризуется неспособностью почек выводить кислоты, образующиеся в процессе постоянного обмена веществ в организме. Снижение уровня бикарбонатов в сыворотке крови обусловлено при этом их расходыванием на нейтрализацию (буферная функция бикарбонатов) задерживающихся в организме органических кислот, фосфорной и серной кислот. Сохраняющиеся в крови анионы этих кислот ведут к увеличению анионного резерва.
Почечный дистальный клубочковый ацидоз (I тип) обусловлен нарушением секреции протонов водорода в дистальных канальцах. Возможны первичные генетически обусловленные варианты и вторичные при гипергаммаглобулинемии, болезни Шегрена, постанальгетической нефропатии, гипертиреозе, гиперпаратиреозе. Нередко одновременно отмечают значительную потерю калия и кальция. Клинически дистальный канальцевый ацидоз проявляется полиурией, остеопатией, нефролитиазом, нефрокальцинозом.
Почечный проксимальный канальцевый ацидоз (И тип) обусловлен нарушением реабсорбции аниона HCO3–. Потеря бикарбонатов, натрия, калия ведет к развитию метаболического ацидоза, гипокалиемии и гиповолемии. При проксимальном варианте канальцевого ацидоза нефрокальциноз и нефролитиаз (в противоположность дистальному почечному ацидозу) не отмечают. На первое месте в клинической картине выдвигается остеомаляция с нарушением роста. Оба варианта почечного ацидоза протекают с гиперхлоремией, поэтому анионный резерв не меняется.
Минералкортикоиды стимулируют секрецию протонов водорода в дистальных отделах почечных канальцев, поэтому при гипоренинемическом гипоальдостеронизме и хронической недостаточности коры надпочечников развивается невыраженный метаболический ацидоз.
Таблица 34.4
ДД метаболического ацидоза в зависимости от анионного резерва
| Вид ацидоза | Основное состояние | Механизм возникновения |
| Гиперхлоремический ацидоз (анионов 11–15 ммоль/л) | Диарея | Потеря бикарбонатов через желудочно-кишечный тракт |
| Проксимальный канальцевый ацидоз | Нарушение резорбции бикарбонатов в проксимальных канальцах | |
| Дистальный канальцевый ацидоз | Усиленная секреция Н+ в дистальных канальцах | |
| Терапия блокаторами карбоангидразы | Блокада резорбции бикарбонатов в проксимальных канальцах | |
| Первичный гиперпаратиреоидизм | Блокада резорбции бикарбонатов паратгормоном | |
| Усиленное поступление кислот (HCl, NH4Cl1 аргинин-Сl) | Поступление кислот превышает экскрецию протонов водорода | |
| Нормохдоремический ацидоз (анионов >15 ммоль/л) | Диабетический кетоацидоз | Повышение концентрации кетонов |
| Уремический ацидоз | Сниженная экскреция почками кислот, усиленная экскреция анионов РО43–, SО43– | |
| Лактоацидоз | Усиленное образование лактата | |
| Интоксикация салицилатами | Передозировка салицилатов | |
| Интоксикация метанолом | Прием метанола (прежде всего у больных хроническим алкоголизмом) | |
| Этиленгликоль | Отравление антифризами | |
| Паральдегид | Метаболизируется в уксусную кислоту | |
| Голодный ацидоз | Усиленное образование кетонов | |
| Хронический алкоголизм | Повышение уровня кетонов и лактата |
Кровь является электрически нейтральной, поскольку концентрация катионов (ионов с положительным зарядом) равна концентрации анионов (ионов с отрицательным зарядом). Около 95% катионов в сыворотке крови составляют ионы натрия и калия. Ионы хлора и карбоната составляют только 85% анионов в сыворотке крови. Остальные анионы представлены SO42–, РО43–, отрицательно заряженными белками и лактатом. Именно эти отрицательно заряженные ионы и составляют так называемый анионный резерв. Анионный резерв (ммоль/л) рассчитывается как разница между концентрацией катионов натрия (140 ммоль/л) и суммой концентраций анионов хлора (102 ммоль/л) и анионов НСО3– (25 ммоль/л). При проведении простейших арифметических подсчетов видно, что анионный резерв составляет у здорового человека 13 ммоль/л. Допустимые колебания не превышают ±2 ммоль/л. На основании расчета анионного резерва метаболический ацидоз подразделяется на гиперхлоремический (с нормальным анионным резервом) и нормохлоремический (с увеличенным анионным резервом).
При метаболическом ацидозе с увеличенной потерей катионов водорода или НСО3– почки компенсаторно задерживают анионы хлора. Развивается гиперхлоремический ацидоз (с нормальным анионным резервом), свойственный диареи и усиленной потере бикарбонатов через желудочно-кишечный тракт, проксимальному или дистальному канальцевому ацидозам, последствиям применения блокаторов карбоангидразы, первичному гиперпаратиреоидизму с потерей карбонатов через почки, экзогенному избыточному поступлению кислот (соляной), хлорида аммония.
При метаболическом ацидозе II типа нет необходимости в почечной задержке анионов хлора, поскольку одновременнно усиленно образуются или поступают извне протоны водорода (диабетический и лактатный ацидозы). В этом случае анионный резерв увеличен. Нормохлоремический ацидоз с увеличенным анионным резервом отмечают при хроническом алкоголизме, длительном голодании, отравлениях салицилатами, метанолом, этиленгликолем, уремии, диабетическом и лактатном ацидозе.
ДД метаболического ацидоза в зависимости от анионного резерва представлена на схеме 34.1.
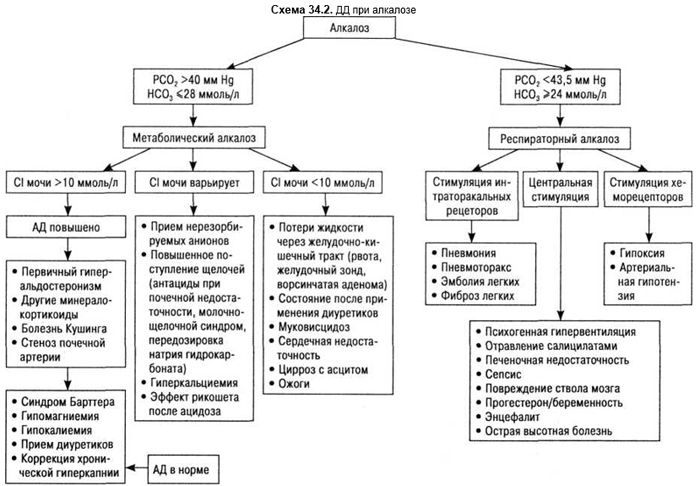
Метаболический алкалоз
Метаболический алкалоз (повышение показателей pH крови) — повышение содержания бикарбонатов в крови. Повышение концентрации анионов НСО3– может происходить либо за счет усиленной потери катионов водорода через почки и желудочно-кишечный тракт, либо за счет повышенного поступления бикарбонатов или веществ (например цитрат), из которых в итоге образуются бикарбонаты. Компенсаторно организм пытается предотвратить избыточное образование бикарбоната путем поверхностного дыхания, снижением альвеолярной вентиляции. В результате замедления выведения углекислого газа в крови повышается показатель pH. Почечные компенсаторные механизмы обычно запаздывают и оказываются недостаточными. Особенно это ощутимо при дефиците хлоридов, так называемой парадоксальной ацидурии, когда кислоты выделяются почками (кислая моча при алкалозе). Метаболический ацидоз требует выделения нескольких этиологических групп.
Гастритический алкалоз — состояния, протекающие с потерей кислого желудочного сока. Им присущи гипокалиемический алкалоз, гипохлоремия, почечная потеря калия, низкое содержание хлоридов в моче. Развивается при наличии зондов, длительно находящихся в желудке у тяжелобольных или при наличии стеноза выходного отдела желудка, а также при булимии (постпрандиальная рвота после переедания) или скрываемая от окружающих рвота при нейрогенной анорексии. У пациентов с булимией или со скрываемой рвотой ведущим симптомом может быть случайно выявленная гипокалиемия. Больные жалуются на АГ, обморочные состояния, алкалоз (тетания), мышечную слабость как проявление гипокалиемии. Нередко одновременно пациенты злоупотребляют слабительными и мочегонными средствами. Лабораторно выявляют гипокалиемию, гипохлоремию, в моче — гипернатрий- и калийурию, pH мочи повышен (защелачивание), хлоридов в моче очень мало. При ДД необходимо исключить синдром Барттера (уровень хлоридов в моче существенно повышен), передозировку слабительных средств (снижено содержание натрия, калия и хлоридов в моче, кислотно-основное равновесие чаще не изменено), злоупотребление мочегонными средствами (уровень хлоридов в моче повышен).
Едва ли не самой частой причиной гипокалиемического алкалоза является применение тиазидных диуретиков. Особенно легко алкалоз развивается при передозировке мочегонных или предшествующих предрасполагающих к нему факторов в виде усиленной почечной экскреции протонов водорода: вторичный гипоальдостеронизм при отеках. Поэтому в каждом случае неясного алкалоза необходимо исключить тайный прием мочегонных средств. Особенно это касается пациентов, чрезмерно озабоченных «лишним весом» или страдающих идиопатическими отеками. Такой прием препаратов выявляется по колебаниям количества и удельного веса мочи, по изменениям выделения натрия, калия, хлоридов, по результатам токсикологических исследований.
Избыточный выброс в кровь минералкортикоидов при первичном гиперальдостеронизме, синдроме Барттера, синдроме Кушинга, передозировке солодки обусловливает усиленное выделение почками катионов калия и водорода, что приводит к гипокалиемическому алкалозу.
При выявлении метаболического алкалоза его причины чаще всего выясняют из анамнеза (рвота, прием мочегонных средств). Если причина остается неустановленной, то необходимо определить содержание хлоридов в суточной моче и попытаться корригировать алкалоз инфузией раствора натрия хлорида. Если алкалоз обусловлен дефицитом хлоридов (рецидивирующая рвота, прием мочегонных средств), то уровень хлоридов мочи <10ммоль/л (после отмены мочегонных средств). Это вариант метаболического алкалоза легко устраняется внутривенной инфузией раствора натрия хлорида и коррекцией водного баланса. Если алкалоз оказывается устойчив к такому лечению, а уровень хлоридов в моче выше 20 ммоль/л, то можно думать об избыточном выбросе в кровь минералкортикоидов.