Биосинтез и основные пути метаболизма холестерина, липопротеидов и их кометаболитов
Содержание
- Экзогенный путь метаболизма липидов
- Эндогенный путь биосинтеза липидов
- Обратный транспорт ХС
- Регуляция плазменного содержания апо-B-липопротеина в норме и при нарушениях липидного обмена
- Пути эндогенного биосинтеза кометаболитов ХС
- Пренилированные протеины
- Биологическая роль семейства пренилированых коротких ГТФаз
- Биологическая роль пренилированных ламининов
- Биологическая роль селен-цистеин-содержащей тРНК и селенсодержащих протеинов
- Долихолы
- Убихинон
- Литература
В зависимости от источника поступления субстратов окисления выделяют два основных пути метаболизма липидов и липопротеидов: экзогенный (с пищей) и эндогенный.
Экзогенный путь метаболизма липидов
Более 95% липидов, поступающих с пищей, представлены ТГ, остальное количество составляют фосфолипиды, СЖК, ХС, который присутствует в пищевых продуктах преимущественно в виде эстерифицированного ХС, а также жирорастворимые витамины. В желудке и двенадцатиперстной кишке под влиянием солей желчных кислот осуществляется процесс эмульгирования липидов (рис. 2.1). Натриевые соли желчных кислот, располагаясь на поверхности капелек липидов, снижают их поверхностное натяжение и способствуют дисперсии последних, увеличивая их суммарную поверхность. Образующаяся тонкодисперсная эмульсия липидов в воде облегчает их взаимодействие с панкреатической липазой. Под действием последней ТГ превращаются в моноглицериды и СЖК. Эфиры ХС, содержащиеся в пище, подвергаются деэстерификации в свободный ХС также под влиянием липаз. Моноглицериды, СЖК и свободный ХС эмульгируются желчными кислотами и затем абсорбируются энтероцитами, после чего конденсируются с ТГ и вместе с ХС включаются в состав хиломикронов. Кроме того, моноглицериды и СЖК вместе с солями желчных кислот в тонком кишечнике образуют мицеллы, размеры которых сопоставимы с размерами молекул липидов. Мицеллы всасываются энтероцитами тонкого кишечника посредством эндоцитоза. В энтероцитах осуществляется ресинтез ТГ из моноглицеридов и СЖК мицелл. Ресинтезированные ТГ энтероцитарного происхождения в дальнейшем инкорпорируются в хиломикроны. Таким образом, хиломикроны являются основной транспортной формой экзогенных ТГ, осуществляя их трансфер из энтероцитов тонкого кишечника в системный кровоток через воротную вену и грудной лимфатический проток. В качестве главного структурного протеина хиломикроны содержат апо-В48-протеин, а период их полужизни обычно не превышает 5–20 мин. Необходимо отметить, что плазма крови здоровых людей при взятии крови натощак практически не содержит хиломикронов.
После секреции хиломикроны получают аполипопротеины классов Е, С-I, C-II и C-III от ЛПВП. В плазме крови апо-C-II-липопротеин активирует эндотелиальную липопротеинлипазу. Под действием последней большинство ТГ в хиломикронах расщепляется до глицерина и свободных НЭЖК. Белково-липидный комплекс, ответственный за их транспорт, отличается очень высокой плотностью и малыми размерами. НЭЖК используются в жировой и мышечной ткани в качестве энергетического субстрата. В то же время хиломикроны подвергаются так называемому метаболическому ремоделированию с образованием остатков (ремнантов) с более низкой плотностью: ЛПОНП и ЛППП. Ремнанты хиломикронов, содержащие апо-В48-липопротеин и обогащенные апо-Е-липопротеином, захватываются гепатоцитами с помощью специфических рецепторов, имеющих высокое сродство к последнему. В дальнейшем ТГ, ассоциированные с ремнантами хиломикронов, подвергаются воздействию внутрипеченочной липопротеинлипазы. В результате ресинтезируются СЖК и глицерин, которые используются для продукции липидов, либо вовлекаются в процессы β-окисления.
Желчные кислоты, всасывающиеся в тонком кишечнике, по системе воротной вены транспортируются в гепатоциты, а затем секретируются в желчные капилляры вместе с ресинтезированными желчными кислотами. Подобная внутрипеченочная рециркуляция предотвращает экзогенные потери желчных кислот и поддерживает синтез ХС в гепатоцитах на относительно стабильном уровне.
Экзогенный ХС в ограниченном количестве (не более 0,5 г/сут) всасывается в кишечнике в составе липидных мицелл. Далее он в составе хиломикронов достигает гепатоцитов, где подвергается эстерификации, либо превращается в соли желчных кислот. Причем интенсивность секреции ХС в желчный капилляр и ретенция в гепатоците, регулируемая специфическими молекулами ABCG5 и ABCG8 (ATP (adenosine triphosphate)-binding cassette (ABC) transporter G5 и G8 — АТФ (аденозинтрифосфат)-связанный кассетный переносчик G5 и G8), являются взаимо взвешенными процессами (Yu L. et al., 2002).
Биосинтез эндогенного ХС из ацетил-КоА осуществляется в основном в гепатоцитах и в следовых количествах — в энтероцитах тонкого кишечника. Часть ХС выводится с желчью, а другая — подвергается эстерификации.
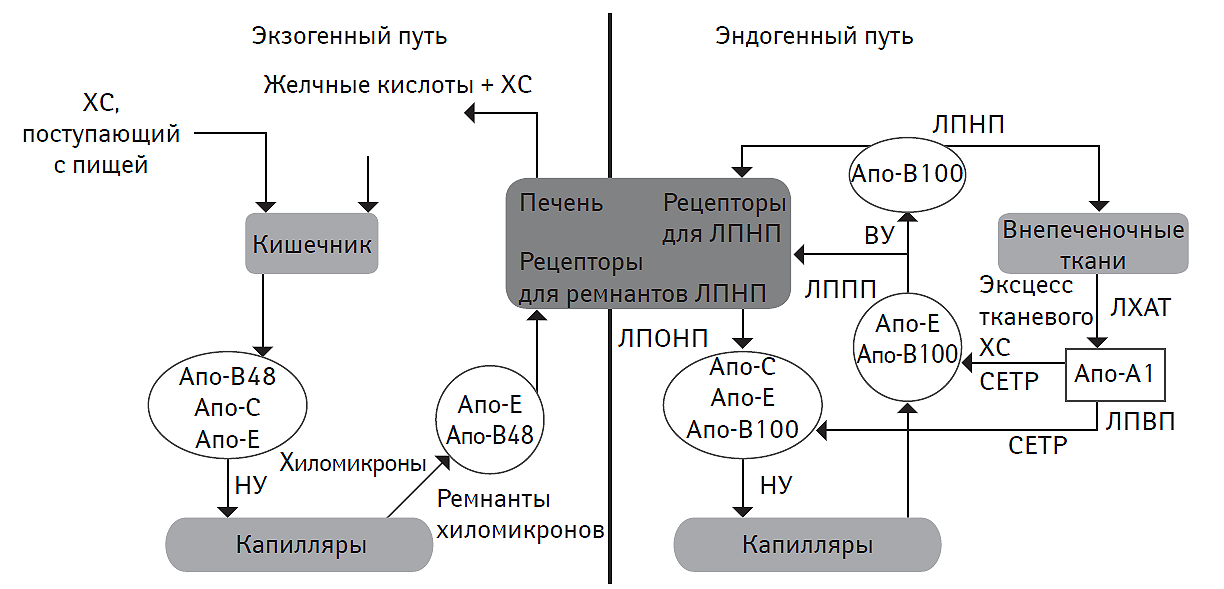
Рис. 2.1. Основные пути метаболизма липидов
На рис. 2.1, 2.2 и 2.3: ЛХАТ — лецитин-холестерин-ацетилтрансфераза, CETP (cholesteryl ester transfer protein) — протеин, транспортирующий эстерифицированный ХС, НУ – низкий уровень, ВУ — высокий уровень.
Эндогенный путь биосинтеза липидов
В гепатоцитах из эндогенных ТГ и ХС синтезируются апо-В100-содержащие ЛПОНП, которые поступают в кровь. Причем гепатоциты способны секретировать как крупные, так и мелкие липопротеиды, обогащенные ТГ, с различной плотностью (рис. 2.2). Вместе с тем, в образцах крови, взятых у пациентов натощак, на долю ЛПОНП приходится около 10–15% общего ХС и практически все ТГ плазмы крови. Таким образом, ЛПОНП являются основной транспортной формой эндогенных ТГ, удельный вес которых составляет около 50–70% массы всей частицы липопротеида. Если апо-В100-протеин является структурной частью ЛПОНП, то апопротеины других классов, таких как Е, С-I, C-II и C-III, обогащают частицы ЛПОНП в кровотоке (Beisiegel U., 1998). Основным донатором последних является ЛПВП (Brunham L.R. et al., 2006).
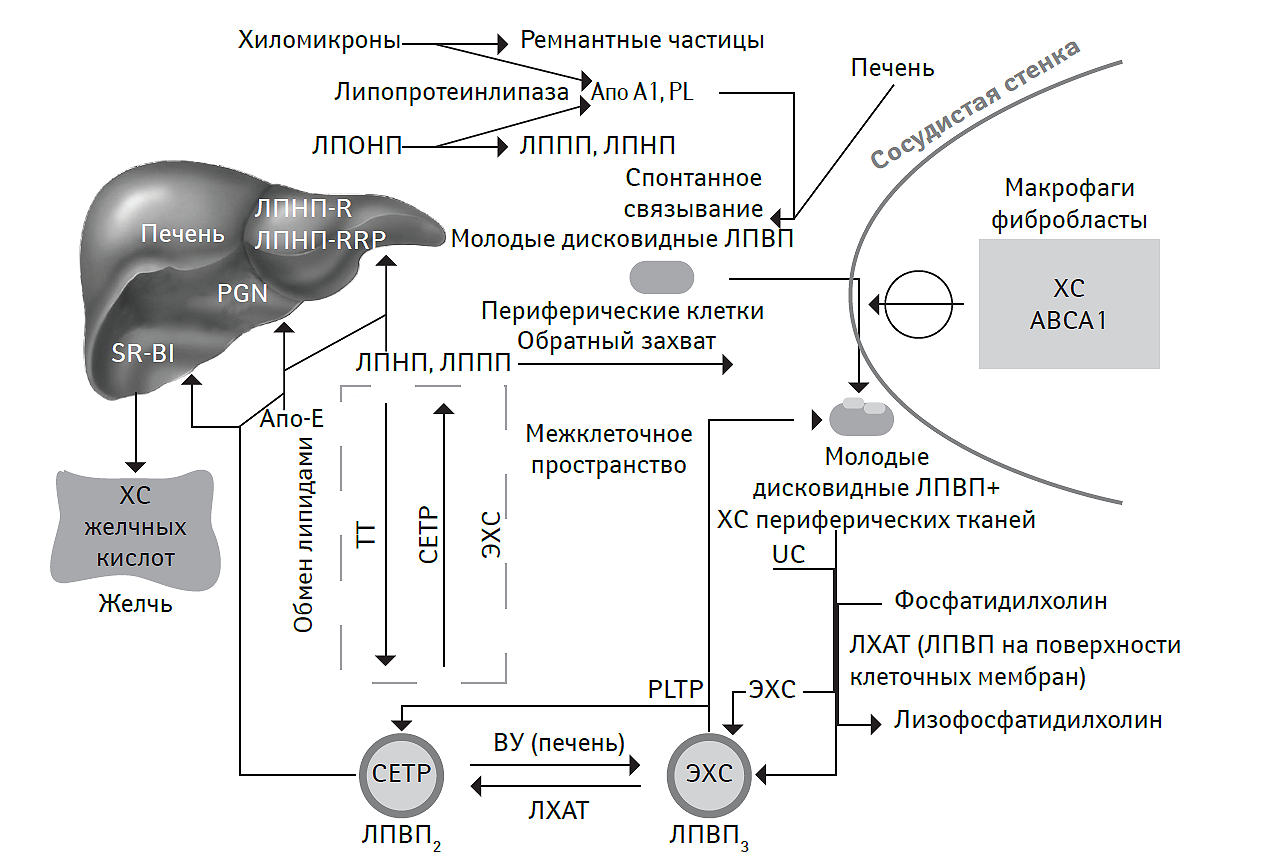
Рис. 2.2. Основные пути метаболизма и реверсивный транспорт ХС
На рис. 2.2 и 2.3: ЛПНП-R — рецепторы к ЛПНП, ЛПНП-RRP — рецепторы к ремнантам ЛПНП, SR-BI — скавенджер-рецепторы; ЭХС – эстерифицированный ХС, PGN (proteoglycans) — протеогликаны, PL (phospholipid) — фосфолипид, PLTP (phospholipid transfer protein) — протеин, транспортирующий фосфолипид, UC (unesterified cholesterol) — неэстерифицированный ХС.
В физиологических условиях ЛПОНП находятся в кровотоке до тех пор, пока ТГ, содержащиеся в них, не поступят в клетки периферических тканей. Причем приблизительно половина пула секретированных ЛПОНП захватывается гепатоцитами (Grundy S.M., Vega G., 1990). Другая половина ЛПОНП после гидролиза ТГ в составе этих частиц под действием фермента липопротеинлипазы преобразуется в апо-Е-содержащие ЛППП, которые, так же как и частицы ЛПОНП, метаболизируются двумя основными путями (Grundy S.M., Vega G., 1990). Часть их активно захватывается гепатоцитами с помощью рецепторов к ЛПНП, а другая подвергается воздействию печеночной липазы, что приводит к гидролизу оставшихся в них ТГ с образованием ЛПНП. В процессе формирования последних большая часть аполипопротеинов классов Е, С-I, C-II и C-III покидает ремнанты ЛПОНП и вновь ассоциируется с ЛПВП (Matsuura F. et al., 2006). Конечным продуктом этого метаболического каскада является ЛПНП, период полужизни которого не превышает 2,5 сут. Его липидное ядро почти полностью состоит из эфиров ХС (O’Connell B.J. et al., 2004). Одна молекула апо-В100-липопротеина на поверхности ЛПНП обеспечивает распознавание, связывание и клиренс около 75% частиц ЛПНП из циркуляции с помощью апо-В/Е-рецепторов гепатоцитов и периферических клеток, в основном миоцитов и фибробластов (Cuchel M., Rader D.J., 2006). В свою очередь, макрофаги/моноциты, нагруженные поглощенным ХС, обладают способностью к активации печеночных X-рецепторов (liver X receptors — LXRs), расположенных на мембранах гепатоцитов (Glomset J.A., Norum K.R., 1973; Wang N. et al., 2000; Tontonoz P., Mangelsdorf D.J., 2003). Результатом этого взаимодействия является повышение экспрессии специфической молекулы ABCA1 (АТФ-связанного кассетного переносчика), а также повышение активности его гена ABCG1 и продукции апо-Е-липопротеина, от активности которого во многом зависит интенсивность обратного транспорта ХС (Brooks-Wilson A. et al., 1999). ABCA1 стимулирует включение ТГ в обедненные последним апо-А1-содержащие липопротеиды, тогда как ABCG1 потенцирует включение свободного и эстерифицированного ХС в состав ЛПВП (Tall A.R., 2008).
В физиологических условиях рецепторассоциированный путь метаболизма ЛПНП обеспечивает клиренс около 75% всего пула последнего (O’Connell B.J. et al., 2004). После проникновения в клетку частицы ЛПНП подвергаются деградации с высвобождением свободного ХС, который играет важную регуляторную роль в метаболизме липидов. При избытке внутриклеточной концентрации ХС посредством взаимодействия с промоутером гена рецептора ЛПНП подавляется синтез рецепторов к ЛПНП, а при низком уровне внутриклеточного ХС синтез рецепторов к последним возрастает (MacArthur J.M. et al., 2007). Альтернативным путем катаболизма частиц ЛПНП является их окисление. Перекисно-модифицированные ЛПНП, образовавшиеся в результате воздействия эндотелиоцитов, гладкомышечных клеток или моноцитов/макрофагов слабо распознаются апо-В/Е-рецепторами, но быстро распознаются и захватываются так называемыми скавенджер-рецепторами SR-BI (Acton S. et al., 1996; Assanasen C. et al., 2005; Tall A.R., 2008). Интенсивность этого механизма деградации ЛПНП, в отличие от рецепторассоциированного пути, не регулируется внутриклеточной концентрацией ХС (Rinninger F. et al., 1994; Acton S. et al., 1996). Освобожденный ХС участвует в синтетических процессах и энергетическом метаболизме. В то время как в клеточных мембранах происходит обмен веществ, неэстерифицированный ХС высвобождается в плазму крови, где связывается с ЛПВП (Kennedy M.A. et al., 2005). Сложные эфиры ХС ЛПВП превращаются в ЛПОНП и, в конечном итоге, в ЛПНП. Посредством этого цикла ЛПНП доставляют ХС в клетки, а ХС возвращается из внепеченочных зон с помощью ЛПВП (Wang N. et al., 2004; Brunham L.R. et al., 2006).
Обратный транспорт ХС
Обратный транспорт ХС — позитивный процесс, с помощью которого он возвращается из периферических тканей в печень для дальнейшего катаболизма (см. рис. 2.2). По современным представлениям, незрелые частицы ЛПВП — хорошие акцепторы свободного ХС. Свободный ХС на поверхности ЛПВП эстерифицируется с образованием эфиров ХС. В роли катализатора эстерификации свободного ХС выступает фермент лецитин-холестерин-ацетилтрансфераза (ЛХАТ), а в качестве кофактора — апопротеин А1, структурный белок ЛПВП (Matsuura F. et al., 2006). Образованные эфиры ХС перемещаются с поверхности частиц ЛПВП в гидрофобное ядро, освобождая, таким образом, дополнительную поверхность для свободного ХС (Tall A.R., 2008). По мере накопления в ядре эфиров ХС, дисковидные частицы ЛПВП преобразуются в сферические, богатые ХС ЛПВП. Эфиры ХС из ЛПВП и содержащих апопротеин В липопротеидов захватываются гепатоцитами через рецептор-опосредованный эндоцитоз или с помощью скавенджер-рецепторов макрофагов/фагоцитов (O’Connell B.J. et al., 2004). Кроме того, эфиры ХС транспортируются от ЛПВП к липопротеидам других классов с помощью специфического белка-переносчика — протеина, транспортирующего эстерифицированный ХС (cholesteryl ester transfer protein — CETP). Мутация гена CETP, приводящая к потере физиологической функции последнего, способствует аккумуляции эфиров ХС в ЛПВП с повышением концентрации последних (Shimoji E. et al., 2004). Кроме того, в молекуле ЛПВП возрастает содержание апо-А1-липопротеина, неэстерифицированного ХС и фосфолипидов. В результате возникает метаболическое ремоделирование ЛПВП, инициирующее интенсивность транспорта ХС с помощью апо-В100-содержащих липопротеидов, в том числе ЛПНП. Это отражает существование тесной взаимосвязи между апо-Е/ABCA1- и CETP-зависимыми процессами транспорта липидов в составе молекул липопротеидов различной плотности (рис. 2.3).
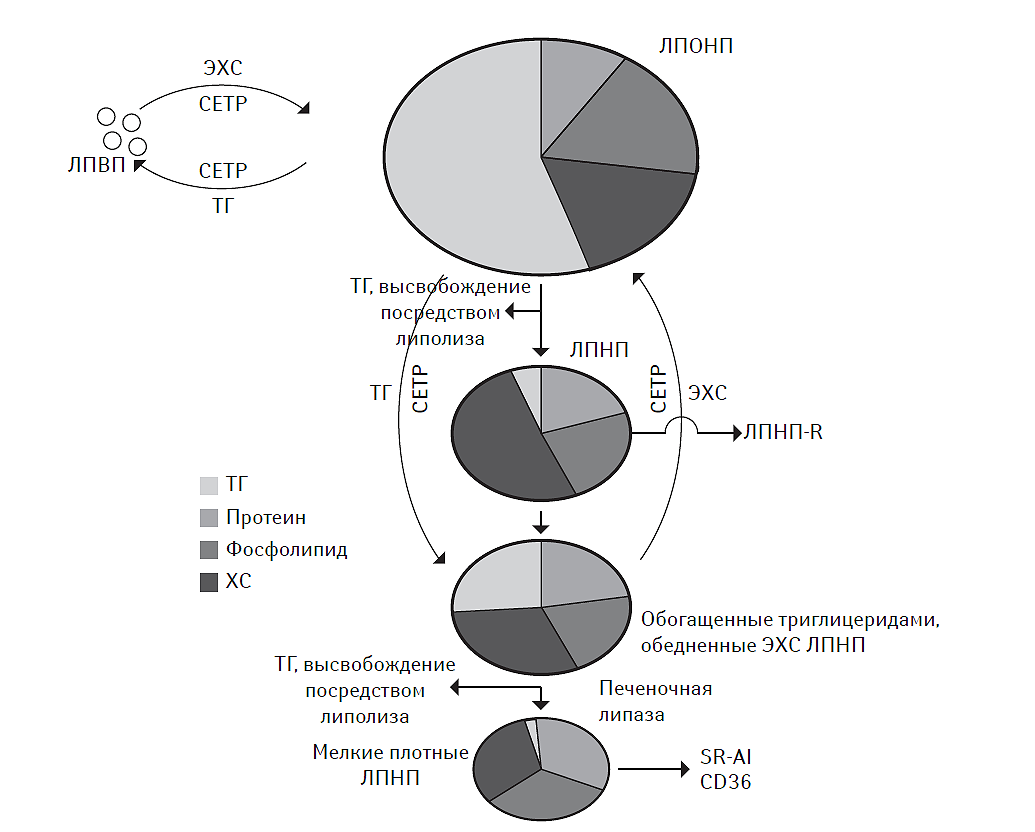
Рис. 2.3. Взаимосвязь между апо-Е-/ABCA1- и CETP-зависимыми процессами транспорта липидов в составе молекул липопротеидов различной плотности
Таким образом, основной детерминантой, обеспечивающей интенсивность транспорта, деградации и модификации липидов в составе липопротеидов, является изменение плотности, формы и архитектоники последних в зависимости от характера метаболического регулирования. В свою очередь, этот процесс тесно ассоциирован с особенностями генотипа, фенотипа, пола, возраста и метаболическими потребностями организма в целом.
Регуляция плазменного содержания апо-B-липопротеина в норме и при нарушениях липидного обмена
Концентрация апо-B-содержащих липопротеидов в плазме крови является результатом метаболического регулирования их продукции, изменения клиренса или конверсии. Наиболее типичные виды метаболического регулирования содержания апо-В представлены на рис. 2.4. В физиологических условиях, ЛПОНП1 являются основными липопротеидами, секретирующимися гепатоцитами. Непосредственно после синтеза ЛПОНП1 конвертируются в ЛПОНП2, а последние — в ЛППП, при этом их концентрация в плазме крови сохраняется достаточно низкой именно за счет высокой скорости конвертации. С другой стороны, ЛПНП значительно медленнее выводятся из циркуляции (период циркуляции составляет 2–4 сут), что приводит к относительному преобладанию этого типа липопротеидов по отношению к другим фракциям. С возрастом продукция апо-В-липопротеина обычно повышается, что ассоциируется со снижением экспрессии рецепторов к ЛПНП (Matthan N.R. et al., 2005). При некоторых состояниях, например, при ожирении, синтез ЛПОНП особенно высок, что способствует увеличению плазменного уровня апо-В и ЛПНП (Chan D.C. et al., 2004). Установлено, что повышение уровня ЛПОНП1 может сопровождаться гиперинсулинемией даже у здоровых лиц (Malmstrom R. et al., 1997). При инсулинорезистентности недостаточная регуляция продукции ЛПОНП негативно отражается на плазменном уровне апо-B-липопротеина, что способствует повышению концентрации ЛПОНП, ЛППП, ЛПНП, формируя проатерогенную гиперлипидемию (Taskinen M.R., 2003).
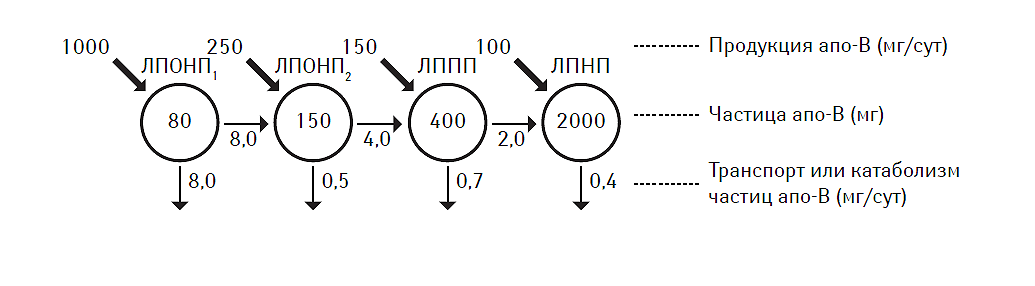
Рис. 2.4. Метаболическая регуляция уровня апо-B-липопротеина в плазме крови. Модифицирован из работы C.J. Packard и соавт., 2000
У лиц со значительным повышением уровня ХС ЛПНП (>4,5 ммоль/л) в плазме крови выявляют увеличение содержания апo-B-липопротеинов преимущественно за счет редукции клиренса рецепторов к ним. Последние представляют собой регулируемые мембранассоциированные протеины, ответственные за распознавание и интернационализацию липопротеинов, а также активное поступление ХС в клетки (Turley S.D., 2004). Снижение экспрессии рецепторов или различные варианты качественного изменения в структуре их субъединиц являются морфологической основой возникновения ряда наследственных нарушений липидного обмена, таких как семейная гиперхолестеринемия (см. главу 6). Необходимо отметить, что концентрация ЛПНП может подвергаться непосредственному метаболическому регулированию со стороны ЛПОНП2, уровень которых, в свою очередь, зависит от ЛПОНП1 (Gaffney D. et al., 2002).
У пациентов с изолированной гипертриглицеридемией обычно отмечают избыточную продукцию ЛПОНП (особенно ЛПОНП1) на фоне неэффективного липолиза (Chan D.C. et al., 2004). Это приводит к повышению содержания апо-В в плазме крови, поскольку последний является транспортной формой как для ЛПОНП1, так и для ЛПОНП2. Кроме того, у таких больных не только существенно снижен клиренс апо-В-содержащих липопротеидов, но и имеется возможность для их более интенсивной модификации. Так, CETP транспортирует ТГ от ЛПОНП к ЛПНП и ЛПВП, тогда как эстерифицированный ХС перемещается в обратном направлении. При этом апо-C-II, апо-C-III и апо-Е поочередно включаются в состав липопротеидов, заменяя друг друга. Все это приводит к тому, что в длительно циркулирующих в плазме крови молекулах ЛПОНП снижается содержание aпo-C-липопротеина, тогда как удельный вес aпo-E и эстерифицированного ХС возрастает. Подобная модификация ЛПОНП способствует появлению резистентности последних к липазе и обусловливает формирование так называемых ремнантных форм ЛПОНП (Havel R.J., 2000).
Пути эндогенного биосинтеза кометаболитов ХС
ХС широко включается в процессы метаболизма, входит в число естественного компонента биологических мембран и рассматривается как основной источник для последующего синтеза стероидных гормонов, витамина D и желчных кислот. Процессы биосинтеза эндогенного ХС осуществляются в эндоплазматическом ретикулуме и цитозоле. Последовательная конденсация трех молекул ацетил-КоА при участии тиолазы и 3-гидрокси-3-метилглутарил-КоА синтетазы (ГМГ-КоА-синтетазы) приводит к образованию ГМГ-КоА. В последующем превращение ГМГ-КоА в мевалонат осуществляется с помощью ГМГ-КоА-редуктазы, а сама реакция рассматривается как ключевая в синтезе эндогенного ХС (рис. 2.5).
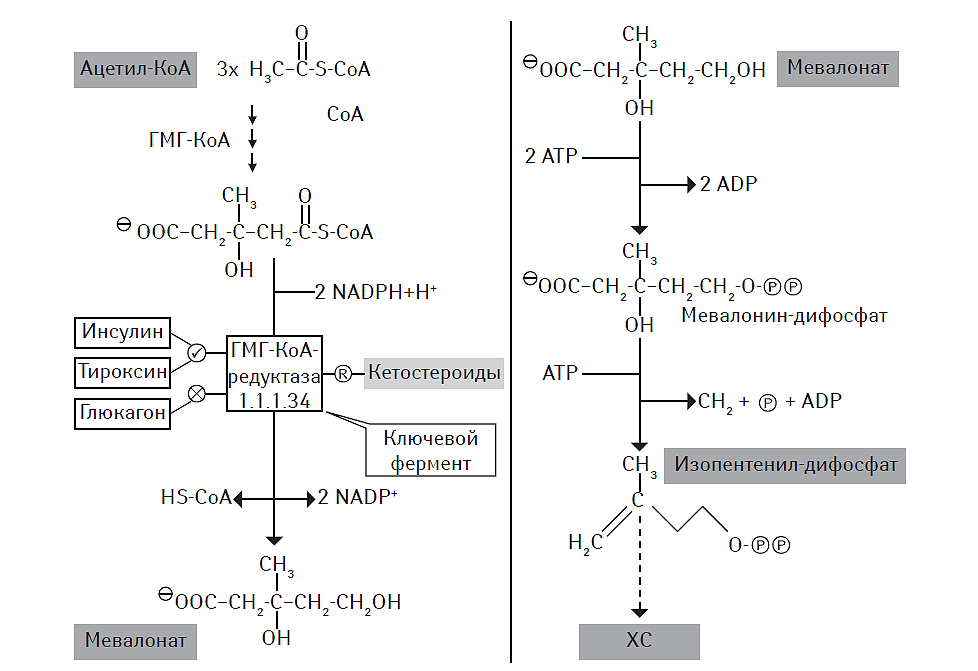
Рис. 2.5. Ключевые этапы биосинтеза эндогенного ХС
Одними из важных промежуточных продуктов этого метаболического пути являются геранилпирофосфат (ГПФ) и фарнезилпирофосфат (ФПФ). Они представляют собой дериваты изопентил пирофосфата и его изомера диметилалил пирофосфата, структурно относящиеся к изопреновым производным (McTaggart S.J., 2006). Кроме биосинтеза ХС, ГПФ и ФПФ вовлечены в посттрансляционную модификацию (то есть прениляцию) различных внутриклеточных протеинов, в свою очередь, являющихся прекурсорами для дальнейшего синтеза важных метаболитов, таких как долихол и убихинон.
Пренилированные протеины
Посттрансляционная модификация (прениляция) белков формируется посредством образования дополнительной ковалентной связи между двумя изопреноидами (ФПФ и ГПФ) и остатками цистеина на С-терминальном конце молекулы. Пренилированные протеины, такие как короткая ГТФаза и ламинины составляют более 2% от общего числа внутриклеточных протеинов (McTaggart S.J., 2006). Липофильный участок молекулы подвергается прениляции, что позволяет модифицированным протеинам прикрепляться к клеточным мембранам. Это в большинстве случаев является необходимым условием для реализации их биологической функции. Селен-цистеин-содержащая тРНК также подвергается посттранскрипционной прениляции, опосредующей функциональную способность молекулы.
Биологическая роль семейства пренилированых коротких ГТФаз
Короткая ГТФаза является пренилированным протеином, обеспечивающим транслокацию гуанозиндифосфата (ГДФ) в гуанозинтрифосфат (ГТФ), а также играет ключевую роль в контроле за функционированием внутриклеточных сигнальных систем (Greenwood J. et al., 2006). Перед активацией рецептора тирозинкиназы фарнезилированная мембрана связывает короткую ГТФазу, что, в свою очередь, сопровождается активацией протеина Ras посредством его ассоциации с молекулой ГТФ. Протеин Ras рассматривается как промежуточный сигнальный трансдуктор, инициализирующий каскад реакций, способствующих процессам клеточного роста. Короткая ГТФаза вовлекается в процессы биосинтеза органелл клетки и внутриклеточного везикулярного обмена. К настоящему времени уже идентифицированы более 60 изоформ этого фермента. Каждая из них имеет специфическую внутриклеточную локализацию (то есть компартментализирована) и регулирует строго определенный участок везикулярного транспорта. Например, Rab1-изоформа вовлекается в процессы трансфера везикул из эндоплазматического ретикулума в аппарат Гольджи, а Rab8-изоформа транспортирует ресинтезируемые трансмембранные протеины из аппарата Гольджи в цитоплазматическую мембрану (Grosshans B.L. et al., 2006). Вообще, все изоформы ГТФазы подвергаются процессу модификации по механизму геранилгераниляции, которая не только определяет их последующую компартментализацию, но и в значительной степени опосредует функциональную способность (Calero M. et al., 2003; Gomes A.Q. et al., 2003).
Биологическая роль пренилированных ламининов
Ламинины являются основными структурными компонентами продольных нитей (филаментов), расположенных во внутренней мембране ядра клетки. Ламинины принимают активное участие как в пространственной организации хроматина, так и в процессах экспрессии генов (Ostlund C., Worman H.J., 2003). Ламинины B1 и B2 подвергаются фарнелизации, тогда как преламинин A, являющийся предшественником молекулы ламинина А, вовлекается в прениляционную модификацию.
Биологическая роль селен-цистеин-содержащей тРНК и селенсодержащих протеинов
Селен-цистеин-содержащая тРНК является производным изопентенилированного аденозина-37 (A37), обычно опосредованного модификацией антикодона в положении 3′ (Moustafa M.E. et al., 2001). Селен-цистеин-содержащая тРНК декодирует UGA, который в физиологических условиях блокирует кодон и обеспечивает включение молекулы селен-цистеин в формирующиеся селенсодержащие пептиды. Отсутствие изопентенилированной тРНК проявляется в снижении эффективности деградации селен-цистеин-содержащей тРНК в декодированных нечувствительных кодонах бактериальных и дрожжевых клеток (Warner G.J. et al., 2000). Таким образом, неточная трансляция сигнала остановки процесса кодирования может привести к преждевременному завершению процесса протеинового синтеза и сборке короткоцепочечных белковых молекул.
Долихолы
Долихолы являются дериватами ФПФ и изопентил-1-пирофосфата, обычно содержащими 16–22 молекулы изопрена, протяженность единственной цепи которых чрезвычайно варьирует в зависимости от типа клеток у организмов разных видов. Долихолы опосредуют N-терминальное гликозилирование образующихся полипептидов, которые участвуют в транспорте и депонировании олигосахаридного ядра, необходимого для последующей гликации белков. Гликозилирование — это достаточно сложный процесс модификации протеинов, являющийся, однако, интегральным компонентом в реализации биологической функции белков.
Убихинон
Убихинон (коэнзим Q10) состоит из гексамерного хинольного кольца (Q) и десяти остатков цепи молекулы изопрена. Он принимает участие как постоянный компонент цикла Кребса в акцепции окисленных остатков от фиксированных флавоноидных комплексов и транспортирует их далее по цитохромам дыхательной цепи митохондрий.
Таким образом, ХС является структурным компонентом биологических мембран, участвует в процессах биосинтеза ряда витаминов, стероидных гормонов, желчных кислот, а также коферментов, играющих важную роль в регуляции процессов пластического и метаболического обмена веществ.
Литература
- Acton S., Rigotti A., Landschulz K.T. et al. (1996) Identification of scavenger receptor SR-BI as a high density lipoprotein receptor. Science, 271: 518–520.
- Assanasen C., Mineo C., Seetharam D. et al. (2005) Cholesterol binding, efflux, and a PDZ-interacting domain of scavenger receptor-BI mediate HDL-initiated signaling. J. Clin. Invest., 115: 969–977.
- Beisiegel U. (1998) Lipoprotein metabolism. Eur. Heart J., 19(Suppl. A): A20–A23.
- Brooks-Wilson A., Marcil M., Clee S.M. et al. (1999) Mutations in ABC1 in Tangier disease and familial high-density lipoprotein deficiency. Nat. Genet., 22: 336–345.
- Brunham L.R., Kruit J.K., Iqbal J. et al. (2006) Intestinal ABCA1 directly contributes to HDL biogenesis in vivo. J. Clin. Invest., 116: 1052–1062.
- Calero M., Chen C.Z., Zhu W. et al. (2003) Dual prenylation is required for Rab protein localization and function. Mol. Biol. Cell, 14(5): 1852–1867.
- Chan D.C., Bennet P.H.R., Watts G.F. (2004) Dyslipidemia in visceral obesity: mechanisms, implications and therapy. Am. J. Cardiovasc. Drugs, 4: 227–246.
- Cuchel M., Rader D.J. (2006) Macrophage reverse cholesterol transport: key to the regression of atherosclerosis? Circulation, 113: 2548–2555.
- Gaffney D., Foster L., Caslake M. et al. (2002) Comparison of apolipoprotein B metabolism in familial defective apolipoprotein B and heterozygous familial hypercholesterolemia. Atherosclerosis, 162: 33–43.
- Glomset J.A., Norum K.R. (1973) The metabolic role of lecithin: cholesterol acyltransferase: perspectives form pathology. Adv. Lipid Res., 11: 1–65.
- Gomes A.Q., Ali B.R., Ramalho J.S. et al. (2003) Membrane targeting of Rab GTPases is influenced by the prenylation motif. Mol. Biol. Cell.,14(5): 1882–1899.
- Greenwood J., Steinman L., Zamvil S.S. (2006) Statin therapy and autoimmune disease: fromprotein prenylation to immunomodulation.Nat. Rev. Immunol., 6(5): 358–370.
- Grosshans B.L., Ortiz D., Novick P. (2006) Rabs and their effectors: achieving specificity in membrane traffic. Proc. Natl. Acad. Sci. USA., 103(32): 11821–11827.
- Grundy S.M., Vega G. (1990) Causes of high blood cholesterol. Circulation, 81: 412–427.
- Havel R.J. (2000) Remnant lipoproteins as therapeutic targets. Curr. Opin. Lipidol., 15: 615–620.
- Kennedy M.A., Barrera G.C., Nakamura K. et al. (2005) ABCG1 has a critical role in mediating cholesterol efflux to HDL and preventing cellular lipid accumulation. Cell. Metab., 1: 121–131.
- MacArthur J.M., Bishop J.R., Stanford K.I. et al. (2007) Liver heparan sulfate proteoglycans mediate clearance of triglyceride-rich lipoproteins independently of LDL receptor family members. J. Clin. Invest., 117: 153–164.
- Malmstrom R., Packard C.J., Watson T.D. et al. (1997) Metabolic basis of hypotrigyceridemic effects of insulin in normal men. Arterioscler. Thromb. Vasc. Biol., 17: 1456–1464.
- Matsuura F., Wang N., Chen W. et al. (2006) HDL from CETP-deficient subjects shows enhanced ability to promote cholesterol efflux from macrophages in an apoE- and ABCG1-dependent pathway. J. Clin. Invest., 116: 1435–1442.
- Matthan N.R., Jalbert S.M., Lamon-Fava S. et al. (2005) TRL, IDL and LDL apolipoprotein B and HDL apolipoprotein AI kinetics as a function of age and menopausal status. Arterioscler. Thromb. Vasc. Biol., 25: 1691–1696.
- McTaggart S.J. (2006) Isoprenylated proteins. Cell. Mol. Life Sci., 63(3): 255–267.
- Moustafa M.E., Carlson B.A., El-Saadani M.A. et al. (2001) Selective inhibition of selenocysteine tRNA maturation and selenoprotein synthesis in transgenic mice expressing isopentenyladenosine-deficient selenocysteine tRNA. Mol. Cell. Biol., 21(11): 3840–3852.
- O’Connell B.J., Denis M., Genest J. (2004) Cellular physiology of cholesterol efflux in vascular endothelial cells. Circulation, 110: 2881–2888.
- Ostlund C., Worman H.J. (2003) Nuclear envelope proteins and neuromuscular diseases. Muscle Nerve, 27(4): 393–406.
- Packard C.J., Demant T., Stewart J.P. et al. (2000) Apolipoprotein B metabolism and the distribution of VLDL and LDL subfractions. J. Lipid. Res., 41: 205–218.
- Rinninger F., Brundert M., Jackle S. et al. (1994) Selective uptake of high-density lipoprotein-associated cholesteryl esters by human hepatocytes in primary culture. Hepatology, 19: 1100–1114.
- Shimoji E., Zhang B., Fan P. et al. (2004) Inhibition of cholesteryl ester transfer protein increases serum apolipoprotein (apo) A-I levels by increasing the synthesis of apo A-I in rabbits. Atherosclerosis, 172: 247–257.
- Tall A.R. (2008) Cholesterol efflux pathways and other potential mechanisms involved in the atheroprotective effect of high density lipoproteins. J. Int. Med., 263(3): 256–273.
- Taskinen M.R. (2003) Diabetic dyslipidaemia from basic research to clinical practice. Diabetologia, 46: 733–749.
- Tontonoz P., Mangelsdorf D.J. (2003) Liver X receptor signaling pathways in cardiovascular disease. Mol. Endocrinol., 17: 985–993.
- Turley S.D. (2004) Cholesterol metabolism and therapeutic targets: rationale for multiple metabolic pathways. Clin. Cardiol., 27: III16–21.
- Wang N., Lan D., Chen W. et al. (2004) ATP-binding cassette transporters G1 and G4 mediate cellular cholesterol efflux to high-density lipoproteins. Proc. Natl. Acad. Sci. USA, 101: 9774–9779.
- Wang N., Silver D.L., Costet P. et al. (2000) Specific binding of ApoA-I, enhanced cholesterol efflux, and altered plasma membrane morphology in cells expressing ABC1. J. Biol. Chem., 275: 33053–33058.
- Warner G.J., Berry M.J., Moustafa M.E. et al. (2000) Inhibition of selenoprotein synthesis by selenocysteine tRNA[Ser]Sec lacking isopentenyladenosine. J. Biol. Chem., 275(36): 28110–28119.
- Yu L., Li-Hawkins J., Hammer R.E. et al. (2002) Overexpression of ABCG5 and ABCG8 promotes biliary cholesterol secretion and reduces fractional absorption of dietary cholesterol. J. Clin. Invest., 110: 671–680.