Интервенционное лечение ишемической болезни сердца
Содержание
- ПРИНЦИПЫ ДОКАЗАТЕЛЬНОЙ МЕДИЦИНЫ В ИНТЕРВЕНЦИОННОЙ КАРДИОЛОГИИ
- ACME (Angioplasty Compared to MEdicine)
- ACIP (Asymptomatic Cardiac Ischemia Pilot study)
- BENESTENT I (BElgian NEtherlands STENT I)
- STRESS (Stent Restenosis Study)
- SAVED (Saphenous Vein Graft De Novo)
- AWESOME (Angina With Extremely Serious Operative Mortality Evaluation, n=2431; randomized 454)
- RITA-2 (Randomised Intervention Treatment of Angina, n=1018)
- FRISC II (Fast Revascularization during Instability in Coronary Artery Disease)
- TACTICS TIMI 18 (Treat angina with Aggrastat and determine Cost of Therapy with an Invasive or Conservative Strategy-Thrombolysis in Myocardial Infarction 18, n=2457)
- RITA 3 (Randomised Intervention Treatment of Angina, n=1810)
- ISAR COOL (Intracoronary Stenting With Antithrombotic Regimen Cooling Off, n=410)
- PAMI (Primary Angioplasty in Myocardial Infarction, n=395)
- Stent-PAMI (Stent-Primary Angioplasty in Myocardial Infarction, n=1458)
- GUSTO IIb (Global Use of Strategies To Open occluded arteries in acute coronary syndromes, n=1138)
- C-PORT (Atlantic Cardiovascular Patient Outcomes Research Team, n=451)
- PRAGUE (PRimary Angioplasty in patients transferred from General community hospitals to specialized PTCA Units with or without Emergency thrombolysis, n=300)
- PRAGUE-2 (PRimary Angioplasty in patients transferred from General community hospitals to specialized PTCA Units with or without Emergency thrombolysis 2, n=850)
- ZWOLLE (Zwolle, The Netherlands, n=498; randomized 224)
- DANAMI (DANish trial in Acute Myocardial Infarction I, n=1008)
- DANAMI-2 (DANish trial in Acute Myocardial Infarction 2, n=1572)
- REACT (Rapid Early Action for Coronary Treatment, n=427)
- SIAM III (Southwest German Interventional study in Acute Myocardial infarction III, n=197)
- GRACIA (Grupo de Analisis de la Cardiopatia Isquemica. Aguda, n=500)
- RAVEL (Randomized Study With the Sirolimus-Eluting Bx Velocity Balloon-Expandable Stent, n=238)
- RAVEL 3 YRS (Randomized Study With the Sirolimus-Eluting Bx Velocity Balloon-Expandable Stent during 3 Years, n=238)
- SIRIUS (SIRolImUS-coated BX VELOCITY® Balloon Expandable Stent in the treatment of patients with de novo coronary artery lesions, n=1058)
- SIRIUS. TWO YEARS RESULTS (n=1058)
- E-SIRIUS (European version of SIRIUS, n=352)
- C-SIRIUS (Canadian version of SIRIUS, n=100)
- TAXUS IV (trial with paclitaxel eluting stent system, n=1314)
- АППАРАТУРА И ИНСТРУМЕНТАРИЙ, ПРИМЕНЯЕМЫЕ ПРИ ИНТЕРВЕНЦИОННОМ ЛЕЧЕНИИ ИБС
- Ангиографическая аппаратура
- Инструментарий, применяемый при перкутанных коронарных вмешательствах
- Инструментарий для лечебных интервенционных процедур
- АНАТОМИЯ КОРОНАРНЫХ АРТЕРИЙ. КОМПЛЕКСНЫЙ АНАЛИЗ КОРОНАРОГРАММ
- Нормальная и коронарографическая анатомия коронарных артерий. коронарографические проекции
- Анализ коронарограмм при коронарном атеросклерозе
- ПРИМЕНЕНИЕ ВНУТРИСОСУДИСТОГО УЛЬТРАЗВУКА ДЛЯ ОЦЕНКИ АТЕРОСКЛЕРОТИЧЕСКИХ ПОРАЖЕНИЙ КОРОНАРНЫХ АРТЕРИЙ И РЕЗУЛЬТАТОВ СТЕНТИРОВАНИЯ
- Инструментарий
- Артефакты, возникающие во время внутрисосудистого УЗИ, и ограничения метода
- Внутрикоронарное УЗИ
- Измерение количественных показателей просвета артерии при ее атеросклеротическом поражении
- Проведение внутрикоронарного УЗИ при выполнении внутрикоронарных вмешательств
- ПЕРКУТАННЫЕ КОРОНАРНЫЕ ВМЕШАТЕЛЬСТВА ПРИ ХРОНИЧЕСКОЙ ИБС
- Перкутанные коронарные вмешательства при единичных дискретных поражениях коронарных артерий, диффузных стенозах, многососудистом поражении при ИБС
- Перкутанные коронарные вмешательства при хронических окклюзиях
- Перкутанные коронарные вмешательства при наличии изгибов в русле коронарных артерий, поражениях устья, кальцинированных поражениях, длинных поражениях
- Медикаментозная поддержка при проведении перкутанного коронарного вмешательства. ведение больных в ранний и поздний период после стентирования
- Перкутанные коронарные вмешательства, медикаментозное лечение и АКШ при хронической форме ИБС
- ИНТЕРВЕНЦИОННЫЕ МЕТОДЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ ОСТРЫХ КОРОНАРНЫХ СИНДРОМОВ
- Перкутанные коронарные вмешательства при остром коронарном синдроме без элевации сегмента ST
- Острый коронарный синдром с элевацией сегмента ST
- Интервенционное лечение острого коронарного синдрома с элевацией сегмента ST
- Фацилитивное перкутанное коронарное вмешательство, спасающее перкутанное коронарное вмешательство, рутинная коронарография и перкутанные коронарные вмешательства после тромболитической терапии
- Ургентное перкутанное коронарное вмешательство при кардиогенном шоке
- Минимизация отсрочки начала лечения
- ЛИТЕРАТУРА
ПРИНЦИПЫ ДОКАЗАТЕЛЬНОЙ МЕДИЦИНЫ В ИНТЕРВЕНЦИОННОЙ КАРДИОЛОГИИ
Принципы доказательной медицины разработаны для того, чтобы врачи, выбирая тот или иной метод лечения конкретного больного, использовали наиболее объективные современные доказательства эффективности и безопасности выбранного метода. Такие доказательства получают на основании анализа результатов различных научных исследований. Понятно, что качество доказательств, полученных в конкретном исследовании (уровень доказательности результатов исследования), зависит как от качества проведения исследования, так и от качества анализа результатов этого исследования.
Научные исследования, в которых определяется эффективность и безопасность препарата или способа лечения, могут быть различными по величине (количеству больных, вошедших в исследование), критериям отбора больных, методам проводимого исследования, срокам его проведения, а также по способу оценки результатов исследования.
Количество больных, включенных в исследование, может варьировать от нескольких десятков до нескольких тысяч; исследования могут проводиться как в одном, так и в нескольких научных центрах, находящихся в разных странах. В самых больших исследованиях (мегаисследованиях) обычно принимают участие от десяти тысяч больных и более. Конечно, результаты таких исследований являются основанием для применения (или неприменения) тех или иных препаратов (способов лечения) в клинической практике. Мегаисследования, в отличие от исследований на малых группах больных, позволяют выявить даже незначительный положительный эффект исследуемого препарата или способа лечения, поскольку на результаты таких исследований крайне мало влияют спонтанные колебания в динамике выбранных показателей. На результаты мегаисследований не оказывает влияния гетерогенность групп отобранных в исследование больных, которая обычно присутствует, несмотря на критерии включения больных в исследование (например различие пациентов по стадиям заболевания).
Для получения доказательств эффективности и безопасности лекарств и способов лечения также применяется методика метаанализа результатов, полученных в ходе нескольких контролируемых исследований, посвященных одной проблеме. Задачей метаанализа является объединение и оценка результатов этих исследований. Для проведения качественного метаанализа необходимо, чтобы все исследования, включенные в него, имели схожие протоколы и конечные точки. Результаты метаанализа, как правило, подтверждаются результатами мегаисследований, хотя имеются случаи их несоответствия. Это обусловлено высокой гетерогенностью групп больных, входящих в различные исследования, не всегда совпадающими конечными точками в малых исследованиях, разным количеством пациентов, входящих в исследуемую и контрольные группы (например в одних исследованиях контрольными группами являются как группа плацебо, так и группа лиц, получающих эффективный препарат сравнения, в других — только одна из этих групп), и другими подобными факторами. Кроме того, для высокой доказательности метаанализа необходима высокая статистическая достоверность различий между сравниваемыми группами (p <0,001). Несмотря на это, доказательность метаанализа является высокой.
Доказательность исследований, сравнительно небольших по объему, также может быть высокой в том случае, если протокол и ход исследования соответствуют современным международным требованиям. Эти требования определены в документах GCP (Good Clinical Practice).
Согласно требованиям GCP научное исследование нового препарата или способа лечения должно быть контролируемым. Контролируемое исследование должно включать следующие этапы:
- этап отбора больных;
- контрольный период (отсутствие в назначениях исследуемого препарата и препаратов схожего действия);
- этап рандомизации больных по группам.
Без контрольного периода и периода рандомизации исследование не может считаться контролируемым, поскольку несоблюдение этих условий не обеспечивает объективности исследования.
Далее следует период применения испытуемого препарата (в исследуемой группе) и препарата сравнения (в контрольной группе). Во многих исследованиях участникам контрольной группы вместо препарата сравнения назначается плацебо (пустышка, от латинского placebo — доставлять удовольствие). Назначение плацебо позволяет отличить объективный эффект лечения как от психологически обусловленного эффекта, так и от спонтанных ремиссий в ходе течения заболевания.
Метод применения как испытуемого препарата, так и препарата сравнения (или плацебо) может быть слепым или двойным слепым. При слепом методе о принимаемом препарате не знает больной; при двойном слепом — не знает ни больной, ни исследователь. Результаты двойного слепого исследования имеют наибольшую объективность.
На уровень доказательности исследования, кроме соблюдения требований к его контролируемости, влияет правильность оценки его результатов. Результаты исследования оценивают на основании сравнения достигнутых конечных точек в группах исследования и контроля. Под термином «конечные точки» подразумеваются критерии исхода заболевания. По мере их убывающей значимости конечные точки подразделяются на первичные, вторичные и третичные. К первичным конечным точкам относят такие показатели, как общая смертность, смертность от сердечно-сосудистых заболеваний (ИМ и инсультов). Ко вторичным конечным точкам относят сердечно-сосудистые заболевания, не приведшие к смерти (нефатальные ИМ и инсульты). К третичным конечным точкам относят показатели, не влияющие напрямую на сроки продолжительности жизни и ее качество, но способные влиять на факторы риска развития заболеваний, например АГ, гиперхолестеринемия. Существует также такое понятие, как «суррогатные конечные точки» — суммарные показатели исходов заболевания, например общая смертность плюс смертность от сердечно-сосудистых заболеваний плюс нефатальные ИМ. Сейчас в большинстве исследований, в которых рассматривается эффективность и безопасность перкутанных коронарных вмешательств, проводится оценка результатов по критерию MACE (Major Adverse Cardiac Events — тяжелые побочные реакции со стороны сердца). В это понятие включены такие показатели, как смертность от сердечно-сосудистых заболеваний, нефатальные ИМ, понадобившаяся повторная реваскуляризация миокарда.
На основании результатов проведенных исследований формируются и издаются рекомендации по лечению различных заболеваний (например рекомендации по ведению больных со стабильной стенокардией, рекомендации по ведению больных с острыми коронарными синдромами). Рекомендации могут также быть посвящены применению определенного способа лечения при какой-либо патологии (например рекомендации по проведению перкутанных коронарных вмешательств при различных клинических формах коронарного атеросклероза).
Для создания подобных документов существуют комитеты по разработке практических рекомендаций при крупных научных обществах (транснациональных, континентальных), таких как ACC и AHA в США, European Society of Cardiology (Европейское кардиологическое общество — ESC) в Европе. Из ведущих в данной отрасли специалистов формируется рабочая группа — группа авторов разрабатываемых рекомендаций.
В 2005 г. Европейским кардиологическим обществом изданы рекомендации по проведению перкутанных коронарных вмешательств. В этом документе рассмотрены показания к перкутанным коронарным вмешательствам при стабильном течении ИБС и острых коронарных синдромах, вспомогательное лечение при перкутанных коронарных вмешательствах. Даны рекомендации по применению дополнительных технологий перкутанных коронарных вмешательств; в отдельной главе рассмотрены возможности имплантации элютинг-стентов.
При работе над рекомендациями по перкутанным коронарным вмешательствам рабочая группа взяла за основу результаты исследований, которые были либо опубликованы к моменту составления рекомендаций, либо представлены на больших кардиологических конференциях.
Ниже приводим те основные исследования, на результаты которых ссылается Европейское кардиологическое общество в рекомендациях по проведению перкутанных коронарных вмешательств.
Перкутанные коронарные вмешательства при стабильной стенокардии: ACME, ACIP, BENESTENT I, STRESS, SAVED, AWESOME, RITA-2.
Перкутанные коронарные вмешательства при острых коронарных синдромах без элевации сегмента ST: FRISC II, TACTICS-TIMI 18, RITA-3, ISAR-COOL.
Перкутанные коронарные вмешательства при острых коронарных синдромах с элевацией сегмента ST: PAMI, Stent-PAMI, GUSTO IIb, C-PORT, PRAGUE 1, 2, DANAMI 2, STOPAMI 1, 2.
Эффективность стентирования (в сравнении с баллонной ангиопластикой): Stent-PAMI, CADILLAC.
Элютинг-стенты: RAVEL, SIRIUS, TAXUS IV, TAXUS VI.
Метаанализы: RESCUE I, II.
ACME (Angioplasty Compared to MEdicine)
Цель: сравнить результаты медикаментозного и интервенционного (ЧТКА) лечения больных с коронарной болезнью при наличии однососудистого поражения за период 6-месячного наблюдения.
Исследование: одноцентровое рандомизированное.
Популяция больных: пациенты со стабильной стенокардией или недавно перенесенным ИМ, с единичным стенозом >70% в проксимальном сегменте одной из коронарных артерий, при наличии депрессии ST на >1 мм во время тестирования с физической нагрузкой или выявленных обратимых дефектов с помощью перфузионной сцинтиграфии.
Период наблюдения: 6 мес.
Конечные точки: повышение толерантности к физической нагрузке; уменьшение приступов стенокардии.
Заключение: при однососудистом поражении выполнение баллонной ангиопластики по сравнению с медикаментозным лечением достоверно снижает интенсивность приступов стенокардии и повышает толерантность к физической нагрузке.
ACIP (Asymptomatic Cardiac Ischemia Pilot study)
Цель: определить, может ли активное медикаментозное лечение по сравнению с реваскуляризацией улучшить исходы заболевания у пациентов с ИБС по данным стресс-тестов и амбулаторного мониторирования ЭКГ.
Исследование: многоцентровое двойное слепое плацебо-контролируемое рандомизированное.
Популяция больных: клинически стабильные больные с ишемией, выявленной с помощью стресс-теста или 48-часового мониторирования ЭКГ. Коронарная анатомия, подходящая для процедуры реваскуляризации: однососудистая (и более) коронарная болезнь при наличии стенозов >50% (без поражения ствола левой коронарной артерии).
Период наблюдения: 2 года.
Конечные точки: общее количество смертей + нефатальные ИМ + случаи повторной госпитализации (включая непротокольные реваскуляризации).
Заключение: стратегия первичной реваскуляризации в сравнении с медикаментозным лечением позволяет улучшить прогноз у выбранной популяции больных с ИБС и немой ишемией.
BENESTENT I (BElgian NEtherlands STENT I)
Цель: сравнить эффективность и безопасность коронарного стентирования и баллонной ангиопластики.
Исследование: многоцентровое рандомизированное.
Популяция больных: пациенты со стабильной стенокардией, отобранные для ангиопластики, у которых были единичные поражения длиной <15 мм, расположенные в сосудах диаметром >3,0 мм.
Период наблюдения: 6 мес.
Конечные точки: клинические — общее количество смертей + нефатальные ИМ + случаи повторной реваскуляризации + цереброваскулярные осложнения. Ангиографические — минимальный диаметр просвета; бинарный уровень рестенозов (сужение сосуда >50%).
Заключение: клинические и ангиографические исходы были лучше у больных, которым проводилось стентирование, по сравнению с больными, которым проводилась стандартная баллонная ангиопластика.
STRESS (Stent Restenosis Study)
Цель: сравнить эффективность стентирования и баллонной ангиопластики по клиническим исходам и количеству рестенозов, определенных ангиографически.
Исследование: многоцентровое рандомизированное.
Популяция больных: пациенты со стабильной стенокардией, отобранные для ангиопластики, у которых были единичные поражения длиной <15 мм, расположенные в сосудах диаметром >3,0 мм.
Конечные точки: ангиографические — бинарный уровень рестенозов (сужение сосуда >50%), минимальный диаметр просвета. Клинические — успешное выполнение процедуры (остаточный стеноз <50% при отсутствии внутрибольничных осложнений); общее количество смертей + нефатальные ИМ + повторная реваскуляризация сосуда в течение 7-месячного наблюдения.
Заключение: имплантация стентов в сравнении с баллонной ангиопластикой повышает уровень успешного проведения процедуры, снижает уровень рестенозов, определенных ангиографически, уменьшает количество клинических неблагоприятных исходов.
SAVED (Saphenous Vein Graft De Novo)
Цель: сравнить клинические и ангиографические результаты стентирования и баллонной ангиопластики при обструкции венозных шунтов.
Исследование: многоцентровое рандомизированное.
Популяция больных: пациенты с вновь возникшими поражениями в венозных шунтах, проявляющихся стенокардией и/или объективными
признаками ишемии миокарда. Сужение просвета >60%. Диаметр сосуда 3–5 мм.
Конечные точки: первичные — бинарные рестенозы (сужение просвета >50%), выявленные на ангиограммах в течение 6-месячного наблюдения. Выживаемость без осложнений (смерть, ИМ, повторная реваскуляризация в шунте) в течение 240-дневного наблюдения. Вторичные — эффективность выполненной процедуры (диаметр стеноза <50% + отсутствие внутрибольничных осложнений).
Заключение: стентирование обструкций в венозных шунтах в сравнении с баллонной ангиопластикой приводит к лучшим исходам процедуры и уменьшает количество кардиальных осложнений. По количеству рестенозов достоверного различия между группами больных не выявлено.
AWESOME (Angina With Extremely Serious Operative Mortality Evaluation, n=2431; randomized 454)
Цель: сравнить кратко- и долгосрочные результаты перкутанных коронарных вмешательств и коронарного шунтирования у больных с медикаментозной возвратной кардиальной ишемией и высоким риском неблагоприятных исходов заболевания.
Исследование: многоцентровое рандомизированное.
Популяция больных: пациенты с медикаментозной возвратной ишемией и по крайней мере одним из факторов риска неблагоприятного исхода заболевания при коронарном шунтировании, к которым относят перенесенные ранее операции на открытом сердце, возраст >70 лет, ФВ <35%, ИМ в пределах 7 дней до вмешательства и проводившаяся ранее баллонная контрпульсация.
Наблюдение: 30 дней; 3 года.
Конечная точка: показатели выживаемости.
Выводы: перкутанная коронарная интервенция является хорошей альтернативой коронарному шунтированию для больных с медикаментозной рефракторной кардиальной ишемией и высоким риском неблагоприятных исходов коронарного шунтирования.
RITA-2 (Randomised Intervention Treatment of Angina, n=1018)
Цель: сравнить долгосрочные результаты медикаментозной терапии и ЧТКА у больных, у которых возможно проведение обоих видов лечения.
Исследование: многоцентровое рандомизированное.
Популяция больных: пациенты с ИБС, подтвержденной ангиографически, имеющие единичный стеноз диаметром >70% или многососудистую болезнь, при которой возможно выполнение ЧТКА или проведение медикаментозной терапии.
Наблюдение: в среднем — 2,7 года.
Конечные точки: суммарное количество смертей и нефатальных ИМ.
Выводы: выполнение ЧТКА приводит к более выраженному уменьшению симптоматики. При выполнении ЧТКА имеется незначительное повышение риска развития нефатальных ИМ и смертей, вызванное осложнениями, связанными с процедурой.
FRISC II (Fast Revascularization during Instability in Coronary Artery Disease)
Цель: сравнить клиническую эффективность раннего инвазивного и неинвазивного видов лечения больных с острыми коронарными синдромами без элевации сегмента ST.
Исследование: многоцентровое рандомизированное.
Популяция больных: пациенты с нестабильной стенокардией, у которых определяется депрессия сегмента ST не менее 1 мм/инверсия зубца T и/или повышение уровня МВ фракции (сердечной) КФК/положительный тест на тропонин T.
Конечные точки: количество смертей, ИМ, повторных госпитализаций, необходимость реваскуляризации после первичных госпитализаций.
Заключение: раннее инвазивное лечение достоверно уменьшает количество смертей, ИМ, повторных госпитализаций и реваскуляризаций. Инвазивное лечение больных с нестабильной стенокардией является предпочтительным по сравнению с медикаментозной терапией.
TACTICS TIMI 18 (Treat angina with Aggrastat and determine Cost of Therapy with an Invasive or Conservative Strategy-Thrombolysis in Myocardial Infarction 18, n=2457)
Цель: сравнить клинические исходы инвазивного (коронарография + реваскуляризация) и медикаментозного лечения у больных с острым коронарным синдромом без элевации сегмента ST.
Исследование: многоцентровое рандомизированное.
Популяция больных: пациенты, госпитализированные по поводу острого коронарного синдрома без элевации сегмента ST (загрудинная боль >20 мин + депрессия сегмента ST >1 мм и/ или положительный тест на тропонин T и/или анамнез ИБС).
Сроки наблюдения: 180 дней.
Конечные точки: смерть, ИМ, повторная госпитализация по поводу острого коронарного синдрома.
Заключение: для больных с острым коронарным синдромом без элевации сегмента ST предпочтительным является инвазивное лечение.
RITA 3 (Randomised Intervention Treatment of Angina, n=1810)
Цель: определить, может ли раннее (<72 ч от начала развития симптомов) интервенционное лечение дать лучшие по сравнению с медикаментозным результаты при 5-летнем наблюдении больных с острым коронарным синдромом без элевации сегмента ST.
Исследование: проспективное многоцентровое рандомизированное.
Популяция больных: пациенты с нестабильной стенокардией класса IIIb при: депрессии или транзиторной элевации сегмента ST, инверсии зубца T, наличии «старого» зубца Q или анамнезом ИБС.
Конечные точки: смерть и ИМ.
Заключение: рутинная инвазивная стратегия дает лучшие результаты (снижение смертности и ИМ) при отдаленном наблюдении больных с острым коронарным синдромом без элевации сегмента ST в основном у больных с высоким риском развития осложнений.
ISAR COOL (Intracoronary Stenting With Antithrombotic Regimen Cooling Off, n=410)
Цель: определить, может ли немедленное (<6 ч от начала симптоматики) перкутанное коронарное вмешательство с прикрытием ацетилсалициловой кислоты, клопидогрела и тирофибана дать лучшие результаты, чем отсроченное (>73 ч) перкутанное коронарное вмешательство с применением указанных лекарственных средств у больных с острым коронарным синдромом без элевации сегмента ST.
Исследование: одноцентровое рандомизированное.
Популяция больных: пациенты с острым коронарным синдромом, отобранные для перкутанного коронарного вмешательства.
Конечные точки: совокупно смерть + нефатальный крупноочаговый ИМ в течение 30 дней.
Заключение: задержка перкутанного коронарного вмешательства на 73 ч ухудшает результаты лечения больных с острым коронарным синдромом без элевации сегмента ST по сравнению с немедленным перкутанным коронарным вмешательством под прикрытием антитромбоцитарной терапии.
PAMI (Primary Angioplasty in Myocardial Infarction, n=395)
Цель: сравнить исходы первичной ангиопластики и тромболитической терапии у больных с острым ИМ.
Исследование: многоцентровое рандомизированное.
Популяция больных: пациенты с острым ИМ (загрудинная боль, элевация сегмента ST) в течение 12 ч от начала симптоматики.
Конечные точки: смертность, нефатальные реинфаркты, показатели ФВ ЛЖ (по данным радионуклидного исследования).
Выводы: немедленная ЧТКА уменьшает количество смертей и ИМ, связана с меньшим количеством внутричерепных кровотечений. ФВ в группах больных схожая.
Stent-PAMI (Stent-Primary Angioplasty in Myocardial Infarction, n=1458)
Цель: сравнить результаты стентирования (стенты Palmas-Schatz) и баллонной ангиопластики у больных с острым ИМ.
Исследование: многоцентровое рандомизированное.
Популяция больных: пациенты с острым ИМ (загрудинная боль, элевация сегмента ST) в течение 12 ч от начала симптоматики.
Наблюдение: 6 мес (с повторной коронарографией).
Конечные точки: первичные — суммарное количество смертей, нефатальных реинфарктов, инсультов, повторных реваскуляризаций в пораженном сосуде в течение 6-месячного наблюдения. Ангиографические — бинарные рестенозы (сужения >50%) на повторных коронарограммах.
Выводы: в сравнении с ЧТКА стентирование улучшает клинические и ангиографические исходы у больных с острым ИМ. В первую очередь это относится к повторным реваскуляризациям.
GUSTO IIb (Global Use of Strategies To Open occluded arteries in acute coronary syndromes, n=1138)
Цель: сравнить клинические исходы у больных с острым ИМ после первичной ангиопластики и тромболитической терапии.
Исследование: многоцентровое рандомизированное.
Популяция больных: пациенты с острым ИМ (элевация ST) в первые 12 ч от начала симптоматики.
Конечные точки: суммарное количество смертей, повторных ИМ, инсультов в течение 30 дней.
Выводы: первичная ЧТКА в сравнении с тромболитической терапией обусловливает некоторое улучшение клинических результатов в период краткосрочного наблюдения в тех клиниках, где имеется достаточный опыт проведения этой процедуры.
C-PORT (Atlantic Cardiovascular Patient Outcomes Research Team, n=451)
Цель: сравнить результаты первичного перкутанного коронарного вмешательства и тромболитической терапии у больных с острым ИМ, проходивших лечение в больницах, в которых отсутствует кардиохирургическая помощь и предварительные программы по проведению перкутанных коронарных вмешательств.
Исследование: многоцентровое рандомизированное (11 больниц общего профиля).
Популяция больных: пациенты с острым ИМ в первые 12 ч от начала симптоматики.
Конечные точки: суммарное количество смертей, повторных ИМ, инсультов в течение 6-месячного наблюдения.
Выводы: выполнение первичного перкутанного коронарного вмешательства в больницах, где отсутствует кардиохирургическая помощь, приводит к лучшим клиническим исходам в течение первых 6 мес после острого ИМ.
PRAGUE (PRimary Angioplasty in patients transferred from General community hospitals to specialized PTCA Units with or without Emergency thrombolysis, n=300)
Цель: определить лучшую стратегию лечения больных с острым ИМ, госпитализированных в больницы, где нет возможности выполнить перкутанные коронарные вмешательства.
Исследование: многоцентровое рандомизированное.
Популяция больных: пациенты с острым ИМ (элевация ST), госпитализированные в первые 6 ч от начала заболевания в больницы, где не оказывается интервенционная кардиологическая помощь (расстояние до ближайшего центра, где выполняется перкутанное коронарное вмешательство — 5–74 км).
Конечные точки: суммарное количество смертей, повторных ИМ, инсультов в течение 30 дней наблюдения.
Выводы: транспортировка больных с острым ИМ, сопровождающегося элевацией сегмента ST, в центры, где есть возможность выполнить первичное перкутанное коронарное вмешательство, является безопасной и выполнимой. Такая стратегия ведения больных приводит к снижению количества повторных ИМ и суммарного количества смертей, повторных ИМ и инсультов.
PRAGUE-2 (PRimary Angioplasty in patients transferred from General community hospitals to specialized PTCA Units with or without Emergency thrombolysis 2, n=850)
Цель: сравнить результаты ранней фибринолитической терапии и первичного перкутанного коронарного вмешательства, для проведения которого потребовалась дальняя транспортировка больных от места их первичной госпитализации.
Исследование: многоцентровое рандомизированное (41 клиника общего профиля; 7 центров, в которых выполнялось первичное перкутанное коронарное вмешательство).
Популяция больных: пациенты с острым ИМ (элевация ST) в течение первых 12 ч от момента поступления в клинику общего профиля. Расстояние до центра, где выполнялось перкутанное коронарное вмешательство, 5–120 км. Противопоказания к проведению тромболизиса отсутствовали.
Конечные точки: первичная — смертность в течение 30 дней. Вторичная — суммарное количество смертей, нефатальных реинфарктов (болевой синдром + рост фракции MB КФК).
Выводы: дальняя транспортировка больных с острым ИМ в центры, где выполнялось первичное перкутанное коронарное вмешательство, не является опасной. В группе перкутанных коронарных вмешательств отмечается тенденция к снижению 30-дневной смертности. Если время от начала симптоматики до момента госпитализации в клинику общего профиля составляло менее 3 ч, то в этих случаях 30-дневная смертность снижалась существенно.
ZWOLLE (Zwolle, The Netherlands, n=498; randomized 224)
Цель: сравнить эффективность первичной баллонной ангиопластики и первичного стентирования у больных с острым ИМ в течение 6-месячного наблюдения.
Исследование: одноцентровое рандомизированное.
Популяция больных: пациенты в возрасте <75 лет с острым ИМ (загрудинная боль, элевация ST) в первые 6 ч от начала симптоматики.
Конечные точки: смерть, нефатальный реинфаркт, повторные реваскуляризационные процедуры; суммарный показатель трех указанных параметров.
Выводы: у отобранной группы больных первичное стентирование уменьшило количество реинфарктов и повторных реваскуляризаций в инфарктобусловивших артериях.
DANAMI (DANish trial in Acute Myocardial Infarction I, n=1008)
Цель: сравнить клинические исходы инвазивной (коронарография + реваскуляризация) и консервативной стратегий у больных с документированной ишемией миокарда в течение 1-й недели после тромболитической терапии, проведенной по поводу острого ИМ.
Исследование: многоцентровое рандомизированное.
Популяция больных: пациенты с Q-ИМ, которым в первые 12 ч проведена тромболитическая терапия и у которых в течение 1-й недели после тромболизиса развилась спонтанная или стресс-индуцированная ишемия миокарда.
Наблюдение: в среднем — 2,4 года.
Конечные точки: суммарное количество смертей, реинфарктов и нестабильных стенокардий, развившихся в период наблюдения.
Выводы: инвазивное лечение больных, у которых после тромболитической терапии развилась рефрактерная ишемия, приводит к уменьшению количества реинфарктов, нестабильной стенокардии, а также уменьшает количество больных со стабильной стенокардией, возникающей в течение 1-го года наблюдения. Пациентов, у которых была проведена тромболитическая терапия по поводу острого ИМ и у которых в течение госпитального периода документирована ишемия миокарда, необходимо направлять на коронарографию с последующей реваскуляризацией.
DANAMI-2 (DANish trial in Acute Myocardial Infarction 2, n=1572)
Цель: сравнить результаты немедленной тромболитической терапии и перкутанных коронарных вмешательств, проведение которых потребовало длительной транспортировки больных с острым ИМ (элевация ST).
Исследование: многоцентровое рандомизированное (24 клиники общего профиля; 5 центров, в которых проводят перкутанные коронарные вмешательства).
Популяция больных: пациенты с острым ИМ в первые 12 ч от начала симптоматики, которые поступали в клиники общего профиля, где проводился их отбор и транспортировка в центры для выполнения перкутанных коронарных вмешательств (в среднем, на расстояние 56 км; время транспортировки <3 ч).
Конечные точки: суммарное количество смертей, нефатальных реинфарктов, инсультов в течение 30-дневного наблюдения.
Выводы: реперфузионная стратегия, включающая транспортировку больных в центры, где проводят перкутанные коронарные вмешательства, является более приемлемым видом лечения, чем тромболитическая терапия, особенно в тех случаях, когда транспортировка занимает не более 2 ч.
REACT (Rapid Early Action for Coronary Treatment, n=427)
Цель: сравнить результаты консервативного лечения, повторного тромболизиса и спасающего перкутанного коронарного вмешательства у больных с острым ИМ (элевация ST) после безуспешной тромболитической терапии.
Исследование: многоцентровое рандомизированное.
Популяция больных: пациенты с ИМ (элевация ST) после безуспешной тромболитической терапии (отсутствие успеха тромболитической терапии определялось на основании снижения элевации ST <50% в том отведении, где она исходно была самой высокой).
Наблюдение: 6 мес.
Конечные точки: суммарное количество значительных кардиальных и цереброваскулярных осложнений (смерть, реинфаркт миокарда, инсульт, тяжелая СН).
Выводы: выживаемость без осложнений была достоверно выше у больных, которым проводили спасающее перкутанное коронарное вмешательство.
SIAM III (Southwest German Interventional study in Acute Myocardial infarction III, n=197)
Цель: сравнить клиническую и ангиографическую (по состоянию инфарктобусловившей артерии) эффективность раннего (выполненного в течение первых нескольких часов после тромболитической терапии) и отсроченного (выполненного в течение 2 нед после тромболитической терапии) стентирования.
Исследование: многоцентровое рандомизированное.
Популяция больных: пациенты с острым ИМ в первые 12 ч от начала заболевания, у которых после тромболитической терапии проводили ангиографию, выявлявшую в инфарктобусловившей артерии стеноз, пригодный для стентирования (стеноз >70% с кровотоком TIMI (Thrombolysis in Myocardial Infarction) <3 в артерии, имеющей диаметр >2,5 мм).
Конечные точки: первичные — суммарное количество смертей, реинфарктов, повторных реваскуляризаций в целевом сосуде, ишемических осложнений (госпитализация и ангиография по поводу стенокардии, развившейся в течение 6 мес наблюдения).
Выводы: раннее стентирование по сравнению с отсроченным обеспечивает лучшие клинические и ангиографические результаты.
GRACIA (Grupo de Analisis de la Cardiopatia Isquemica. Aguda, n=500)
Цель: оценить эффективность стратегии ранней интервенции после тромболизиса, проводимого по поводу острого ИМ (элевация ST) в эпоху стентирования и новых тромботических препаратов.
Исследование: многоцентровое рандомизированное.
Популяция больных: пациенты, у которых в течение первых 12 ч выполнен тромболизис по поводу острого ИМ с элевацией ST (из исследования исключались больные с кардиогенным шоком).
Конечные точки: первичные — суммарное количество смертей, нефатальных реинфарктов, повторных реваскуляризаций по поводу ишемии миокарда в течение 1 года наблюдения после выписки больных из стационара. Другие — реваскуляризация в госпитальный период, проводимая в госпитальный период по поводу спонтанной стенокардии.
RAVEL (Randomized Study With the Sirolimus-Eluting Bx Velocity Balloon-Expandable Stent, n=238)
Цель: оценить эффективность и безопасность стентов BX Velocity, элютинирующих сиролимус, блокирующий клеточный цикл в фазе G1.
Исследование: многоцентровое двойное слепое рандомизированное.
Популяция больных: пациенты с единичным поражением коронарной артерии de novo, суживающим диаметр просвета <100%. Поражения полностью покрывались стентами длиной 18 мм. Диаметр сосуда, содержащего поражение, составлял от 2,5 до 3,5 мм. Больных с острым ИМ и поражением ствола левой коронарной артерии в исследование не включали.
Конечные точки: первичные — уменьшение среднего диаметра просвета на ангиограмме, выполненной через 6 мес после стентирования. Другие — средний диаметр просвета, диаметр стеноза (в процентах), уровень рестенозов, тяжелые побочные реакции со стороны сердца в течение 6 мес и 1 года.
Выводы: имплантация стентов, элютинирующих сиролимус, является безопасной, что подтверждается отсутствием острых, подострых и поздних тромботических осложнений. Имплантация сиролимус — элютинг стентов свела к нулю уровень как клинических, так и ангиографических рестенозов.
RAVEL 3 YRS (Randomized Study With the Sirolimus-Eluting Bx Velocity Balloon-Expandable Stent during 3 Years, n=238)
Цель: определить, сохраняется ли положительный эффект имплантации элютинг-стентов на время более чем 1 год наблюдения.
Исследование: многоцентровое двойное слепое рандомизированное.
Популяция больных: см. RAVEL.
Наблюдение: 3 года.
Конечные точки: тяжелые побочные реакции со стороны сердца.
Выводы: имплантация стентов, элютинирующих сиролимус, в сегменты нативных коронарных артерий, содержащих новые поражения, снижают количество тяжелых побочных реакций со стороны сердца в течение 3-летнего наблюдения.
SIRIUS (SIRolImUS-coated BX VELOCITY® Balloon Expandable Stent in the treatment of patients with de novo coronary artery lesions, n=1058)
Цель: оценить эффективность имплантации сиролимус-элютинг-стентов в отношении профилактики рестенозов.
Исследование: многоцентровое двойное слепое рандомизированное.
Популяция больных: пациенты с единичными поражениями de novo <100% диаметра просвета длиной 15–30 мм. В исследование не включали больных с поражением ствола левой коронарной артерии и острым ИМ.
Конечные точки: коронарная недостаточность в зоне стентированного сосуда (смерть, острый ИМ, реваскуляризация стентированного сосуда) в течение 9 мес наблюдения. Рестенозы внутри стента и в стентированном сегменте (стент + 5 мм дистальнее и проксимальнее стента) по данным ангиографий, проведенных через 8 мес после стентирования.
Выводы: имплантация стентов, элютинирующих сиролимус, достоверно уменьшает количество клинических и ангиографических рестенозов.
SIRIUS. TWO YEARS RESULTS (n=1058)
Цель: оценить эффективность стентов, элютинирующих сиролимус, в отношении профилактики рестенозов на основании 2-летнего наблюдения.
Исследование: многоцентровое двойное слепое рандомизированное.
Популяция больных: см. SIRIUS.
Конечные точки: недостаточность стентированного сосуда (смерть, острый ИМ в зоне стентированного сосуда, повторная реваскуляризация стентированного сосуда).
Выводы: лечение коронарных поражений с помощью стентов Cypher приводит к достоверному уменьшению количества повторных реваскуляризаций в стентированном сегменте и стентированном сосуде. При этом доказательства острых и отдаленных тромбозов в стентированном сегменте отсутствуют.
E-SIRIUS (European version of SIRIUS, n=352)
Цель: оценить эффективность стентов, элютинирующих сиролимус, в отношении предотвращения рестенозов у больных с длинными атеросклеротическими поражениями в артериях малого диаметра.
Исследование: многоцентровое двойное слепое рандомизированное.
Популяция больных: пациенты с единичными поражениями de novo длиной 15–30 мм в сосудах, имеющих диаметр <3 мм. Больных с поражением ствола левой коронарной артерии и острым ИМ в исследование не включали.
Конечные точки: первичные — средний диаметр просвета в стентированном сегменте, определенный на основании коронарографии, выполненной через 8 мес после стентирования. Другие — уровень бинарных рестенозов в стенте и стентированном сегменте (стент + 5 мм проксимальнее и дистальнее стента); тяжелые побочные реакции со стороны сердца (смерть, ИМ, повторная реваскуляризация).
Выводы: в популяции больных с высоким риском развития рестенозов (длинные поражения в сосудах малого диаметра) имплантация стентов, элютинирующих сиролимус, достоверно уменьшает количество клинических и ангиографических рестенозов.
C-SIRIUS (Canadian version of SIRIUS, n=100)
Цель: сравнить результаты имплантации непокрытых металлических и элютинг-стентов в сегменты коронарных артерий малого диаметра, в которых имелись длинные атеросклеротические поражения.
Исследование: многоцентровое двойное слепое рандомизированное.
Популяция больных: пациенты со стабильной, бессимптомной немой и нестабильной стенокардией, имеющие поражения коронарных артерий, суживающих просвет на 50—90%, длиной 15–30 мм в сосудах диаметром 2,5–3,0 мм.
Конечные точки: первичные — средний диаметр просвета в месте имплантации стента по данным ангиографии, выполненной через 8 мес после стентирования. Вторичные — количество ангиографических рестенозов; тяжелые побочные реакции со стороны сердца.
Выводы: имплантация стентов, элютинирующих сиролимус, достоверно уменьшило количество рестенозов и улучшило клинические результаты лечения в исследуемой популяции больных.
TAXUS IV (trial with paclitaxel eluting stent system, n=1314)
Цель: оценить эффективность стентов, элютинирующих паклитаксел, в отношении снижения количества рестенозов при широком спектре поражений коронарных артерии.
Исследование: многоцентровое двойное слепое рандомизированное.
Популяция больных: пациенты с единичными впервые возникшими поражениями коронарных артерий. Сужение просвета <100%; длина стенозов 10–28 мм; диаметр пораженных сегментов коронарных артерий 2,5–3,75 мм. Больных с поражением ствола левой коронарной артерии и острым ИМ в исследование не включали.
Конечные точки: повторная реваскуляризация в стентированных сосудах в течение 9-месячного наблюдения, тяжелые побочные реакции со стороны сердца, количество бинарных рестенозов.
Выводы: имплантация стентов, элютинирующих паклитаксел, достоверно уменьшало количество ангиографических и клинических рестенозов. Результат подтвержден во всех подгруппах исследования.
Приведенные исследования легли в основу классификации пользы и эффективности перкутанных коронарных вмешательств при различных формах ИБС. В классификации рассматриваются такие критерии, как классы рекомендаций и уровни доказательности (табл. 1.1).
Таблица 1.1
Критерии классов рекомендаций и уровней доказательности
| Классы рекомендаций | |
| I | Доказательства и/или общее согласие с тем, что данная диагностическая процедура или вид лечения являются успешными, полезными и эффективными |
| II | Противоречивые доказательства и/или расхождение во мнении об эффективности или пользе данного метода |
| IIa | Преобладание доказательств (мнений) в пользу эффективности данного метода |
| IIb | Польза и эффективность метода недостаточно хорошо определена на основании доказательств или мнений |
| Уровни доказательности | |
| A | Данные, полученные от большого количества рандомизированных клинических исследований или на основании метаанализа |
| B | Данные, полученные от одного рандомизированного или нескольких нерандомизированных исследований |
| C | Согласие во мнении экспертов и/или данные, полученные от малых или ретроспективных исследований, или же от регистров |
Оценка результатов интервенционного лечения ИБС проводится во многих исследованиях (в том числе и мегаисследованиях) и метаанализах. Многие исследования завершены, их результаты опубликованы, однако в настоящее время большое количество исследований еще не завершено. Особенный интерес для интервенционных кардиологов представляют результаты проводимых мегаисследований, в которых определяется эффективность и безопасность имплантации элютинг-стентов. Как отмечается в рекомендациях Европейского общества кардиологов, результаты этих исследований должны существенно расширить показания к применению интервенционных методов лечения при таких поражениях коронарных артерий, стентирование которых может привести к неблагоприятным исходам. К таким поражениям относят поражения коронарных артерий малого диаметра, длинные поражения, коронарный атеросклероз у больных сахарным диабетом и некоторые другие. Особый интерес представляют собой исследования, посвященные интервенционному лечению поражений ствола левой коронарной артерии, незащищенного шунтом.
АППАРАТУРА И ИНСТРУМЕНТАРИЙ, ПРИМЕНЯЕМЫЕ ПРИ ИНТЕРВЕНЦИОННОМ ЛЕЧЕНИИ ИБС
Интервенционные методы лечения коронарного атеросклероза за последние несколько десятилетий существенно упрочили свои позиции в ряду других методов лечения этой патологии. Этому способствовало развитие новых эффективных технологий интервенционной кардиологии, в частности стентов, а также стентов, элютинирующих лекарственные вещества. В то же время два главных принципа интервенционных процедур — рентгеновский контроль и применение катетерной техники — остаются неизменным атрибутом этих процедур.
Ангиографическая аппаратура
Ангиографические установки, используемые в инвазивной кардиологии, состоят из нескольких основных компонентов: рентгеновской трубки, генератора, электронно-оптического преобразователя (усилителя изображения), оптической системы распределения светового потока, систем записи и воспроизведения изображения (рис. 1.1). Совершенствование ангиографической аппаратуры, обусловленное бурным развитием инвазивных катетеризационных методов лечения различных сосудистых заболеваний, не повлияло на принципы получения изображения. Новые технологии производства улучшили характеристики компонентов ангиографических установок, а применение цифровой записи значительно повысило качество ангиограмм, вследствие чего расширились возможности их анализа.
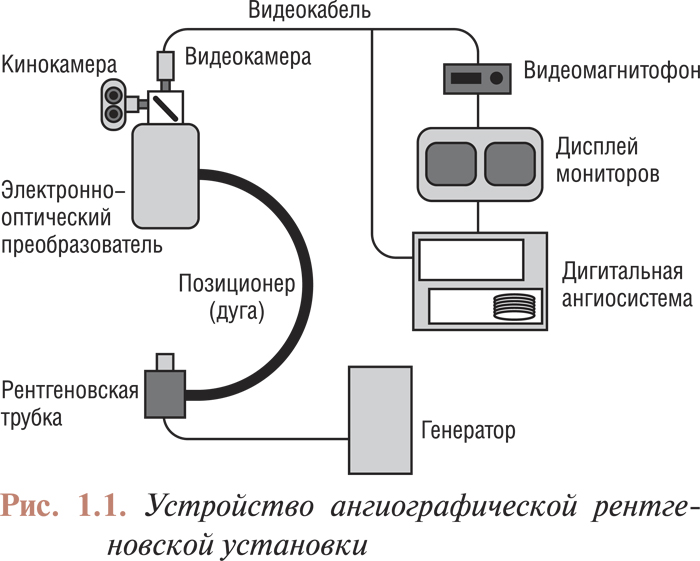
Рентгеновское излучение и его преобразование в поток световых лучей (рентгеновские трубки, генераторы и электронно-оптические преобразователи)
Во всех современных рентгеновских установках радиационное излучение образуется по методу, открытому в конце XIX ст. Рентгеном. Образование радиационного излучения происходит в рентгеновской трубке (рис. 1.2а), содержащей положительно заряженный вольфрамовый электрод (анод), «бомбардируемый» электронами, исходящими из отрицательно заряженного электрода (катода). Электроны, проходя от катода к аноду в электрическом поле, разгоняются до больших скоростей и, попадая на анодную пластинку, взаимодействуют с атомами вольфрама, производя рентгеновские лучи: во время прохождения через плотные положительно заряженные атомы вольфрама электроны резко теряют скорость; при этом энергия торможения преобразуется в поток рентгеновских фотонов.
Скорость, с которой электроны атакуют вольфрамовый анод, зависит от разности потенциалов между электродами. В рентгеновских трубках, применяемых в ангиографии, эта разность потенциалов должна составлять 60–120 тыс. В (60–120 кВ потенциалов; кВп). Уровень энергии рентгеновских фотонов также определяется разностью потенциалов и измеряется в килоэлектронвольтах (кэВ). Пик разности потенциалов между электродами рентгеновской трубки соответствует максимальной энергии рентгеновских фотонов в луче. Объем электронного потока между катодом и анодом определяет количество продуцируемых рентгеновских фотонов и измеряется в миллиамперах (мА). В ангиографической аппаратуре используется принцип пульсирующего образования рентгеновских лучей с короткой (несколько миллисекунд) экспозицией, что соответствует времени открытия створок кинокамеры, которое определяет экспозицию каждого кадра кинофильма.
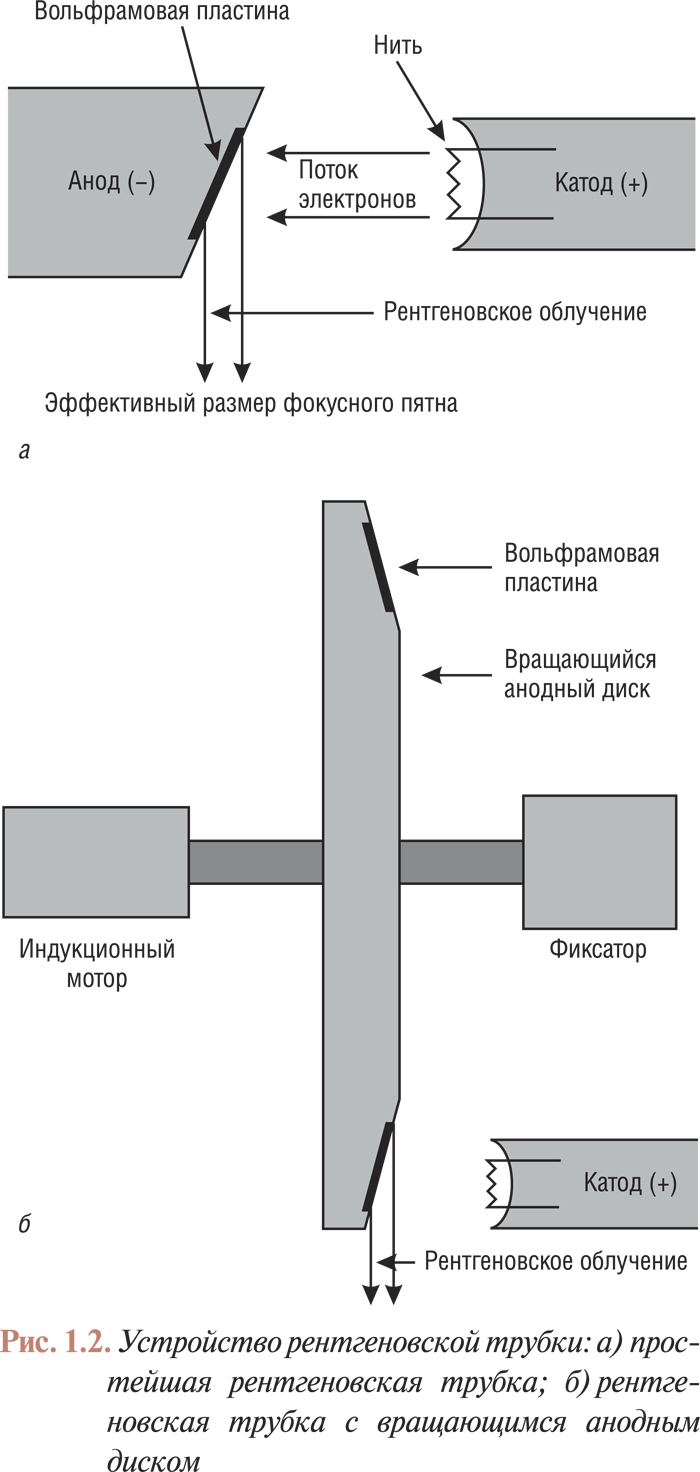
Катодный электронный поток фокусируется на малую зону анода (фокусное пятно), из которой исходит поток рентгеновских фотонов. При сравнительно больших размерах фокусного пятна контуры исследуемого объекта определяются нечетко, что значительно ухудшает качество ангиограмм. Однако уменьшение размера фокусного пятна путем простого сужения пучка электронного потока невозможно. Известно, что при попадании электронов на анод выделяется большое количество тепла и, несмотря на высокую температуру плавления вольфрама, малый размер фокусного пятна при той высокой интенсивности работы трубки, какую требует ангиография, приведет к плавлению анода. Для того чтобы этого не произошло, анод укрепляют на диске, который вращается с такой скоростью, при которой каждый следующий импульс попадает на другую точку анода. Скорость вращения диска при этом должна превышать 10 000 оборотов в 1 мин. Для того чтобы соотношение между истинным и эффективным фокусным пятном было оптимальным, анодную пластинку устанавливают под углом к потоку электронов (рис. 2б). В ангиографических трубках определяют два диаметра эффективной площади фокусного пятна — малый и большой (соответственно 0,6 и 0,9 мм). Мощность рентгеновской трубки должна соответствовать размерам фокусного пятна: 40 кВт — для малого фокусного пятна и 80 кВт — для большого.
Еще одной важной характеристикой рентгеновской трубки является ее способность сохранять и рассеивать тепло. Этот показатель измеряется в тепловых единицах (кВп/мА/с). В современных ангиографических установках применяют керамические или графитовые рентгеновские трубки, которые способны выдерживать большие тепловые нагрузки, что повышает срок эксплуатации таких трубок и оправдывает их высокую стоимость.
Оптимальные характеристики рентгеновских трубок, которые применяют в инвазивной кардиологии, приведены в табл. 1.2.
Таблица 1.2
Характеристика рентгеновских трубок ангиографических установок
| Характеристика | Значение |
| Размер фокусного пятна, мм | |
| малый | 0,5 |
| большой | 1 |
| Мощность рентгеновской трубки, кВт | |
| для малого пятна | 40–60 |
| для большого пятна | 80–100 |
| Анодные характеристики | |
| Углы, ° | |
| для малого пятна | 7 |
| для большого пятна | 7 |
| Тепловая мощность, тепл. ед. | 700 000 |
| Степень охлаждения (макс.), тепл. ед./мин | 150 000 |
| Характеристика корпуса трубки | |
| Тепловая мощность, тепл. ед. | 1 750 000 |
| Степень охлаждения системы | |
| Циркуляция жидкости (макс.), тепл. ед./мин | 150 000 |
Генераторы ангиографических установок выполняют несколько важных функций. Во-первых, трансформируют напряжение бытовой сети до высоковольтного уровня, а во-вторых, преобразуют переменный ток сети в постоянный, что необходимо для образования однонаправленного потока электронов в рентгеновской трубке. От качества выпрямления тока зависит наличие большего или меньшего количества осцилляций на выходе генератора. Современные модели генераторов дают минимальную осцилляцию на выходе, хотя некоторые различия в изготовлении отдельных моделей все еще остаются. Выходная мощность генераторов измеряется в кВт, что должно соответствовать мощности рентгеновской трубки. Так, для трубки мощностью 80 кВт (при большом фокусном пятне) мощность генератора должна составлять 80–125 кВт.
Основные характеристики генераторов, используемых в ангиографических установках, представлены в табл. 1.3.
Таблица 1.3
Характеристика генераторов ангиографических установок
| Характеристика | Значение |
| кВп | |
| мин. | 40 |
| макс. | 150 |
| МА | |
| макс. | 200 |
| Максимальное время экспозиции | |
| пульсовое, мс | 5 |
| Мощность, кВт | |
| при 80 кВп | 100 |
| Автоматический контроль экспозиции, мА — кВп | Комбинированный |
Для преобразования рентгеновского излучения в световые лучи, а также увеличения изображения применяют электронно-оптические преобразователи (усилители изображения) (рис. 1.3). Входной флюоресцентный фосфорный экран абсорбирует каждый рентгеновский фотон, трансформируя его энергию во множество (более тысячи) световых фотонов. Этот экран смонтирован в непосредственной близости от фотокатода (металлического экрана, излучающего фотоэлектроны при его освещении). Фотоэлектроны, направленные фокусирующими пластинами, попадают к аноду, который находится возле выходного флюоресцентного экрана. Анод разгоняет фотоэлектроны до высоких скоростей; выходной флюоресцентный экран начинает излучать световые фотоны после того, как на него попадают значительно ускоренные анодом фотоэлектроны.
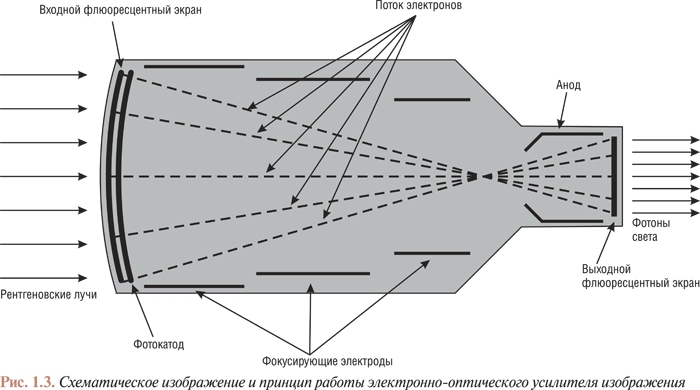
Увеличение размеров изображения по сравнению с натуральными размерами объекта происходит вследствие того, что каждый фотон рентгеновского излучения на входном экране и фотокатоде вызывает излучение большого количества фотоэлектронов, которые ускоряясь в свою очередь вызывают излучение большого количества световых фотонов. Кроме того, размеры выходного флюоресцентного экрана значительно меньше размеров входного, что приводит к концентрации фотонов в меньшем, но зато значительно более ярком поле. Без такого усиления яркости невозможно проведение ангиоскопии и ангиографии. Все ангиографические установки оснащены распределителем светового потока (полупосеребренное зеркало), который дает возможность проводить киноангиографию и флюороскопию одновременно.
Электронно-оптические преобразователи современных ангиографических установок позволяют пошагово увеличивать изображение исследуемого объекта или, другими словами, уменьшать диаметр исследуемого поля. Стандартные диаметры исследуемого поля составляют 22–25 см (минимальное увеличение), 15–17 см (среднее увеличение) и 10–12 см (максимальное увеличение). Режим увеличения выбирают в соответствии с объектом и целью исследования. Так, для исследования крупных сосудов, таких как аорта, магистральные артерии нижних конечностей и т.п., необходимо использовать минимальное увеличение. Для коронарографии и анализа характера атеросклеротического поражения коронарных артерий приемлемым является среднее и максимальное увеличение.
Характеристики рентгеновской трубки и генератора ангиографических установок играют важную роль в инвазивной кардиологии и, в частности, для визуализации стентов при их имплантации.
Рентгеновская визуализация материала зависит от поглощения данным материалом рентгеновских лучей, которое в свою очередь зависит от качества излучения (фотоновой энергии) и атомного числа исследуемого материала (количества электронов). В тканях человека наиболее рентгенопоглощающим материалом является кальций (атомное число — 20). Йодсодержащая контрастная среда имеет атомное число 53.
Большинство стентов, имплантируемых в коронарные артерии, изготовлены из нержавеющей стали (металла с атомным числом около 26), однако некоторые внутрикоронарные стенты изготавливают из металлов с большой атомной массой, например из платины (атомное число — 78) или тантала (атомное число — 73).
Таким образом, количество поглощаемых фотонов, а следовательно, и рентгеноконтрастность стентов, зависит от количества и качества излучения, а также от количества и качества материала, из которого стент изготовлен.
На визуализацию стентов влияет такой фактор, как тучность пациента. При выраженной тучности для визуализации объекта требуется больше фотонной энергии (кВп) (фотонная энергия — качественный рентгенографический показатель). Увеличение кВп приводит к большему рассеиванию радиации; интенсивность серого цвета поля повышается, детали исследуемого объекта утрачиваются, то есть повышение качественного рентгенографического показателя приводит к потере качества визуализации стентов (рис. 1.4, 1.5).


Важным фактором для визуализации стента является однократная доза (количественный рентгенологический показатель) для ангиографии или ангиоскопии. Слишком низкая доза не позволяет визуализировать стент в квантовом шуме; слишком высокая доза делает стент невидимым на фоне поля интенсивного серого цвета. Приемлемыми уровнями дозы радиации для современных ангиографических установок при использовании поля 17 см (7 дюймов) являются следующие. Для ангиоскопии — 32 нГр/кадр; при частоте импульсов 12,5 в 1 с уровень дозы составляет 400 нГр. Для ангиографии — 100 нГр/кадр при цифровой записи и 150 нГр/кадр — для кинозаписи.
На четкость визуализации стентов влияет также размер фокусного пятна. При фокусном пятне размером >1 мм металлические проволочные конструкции с диаметром проволоки <1 мм в некоторых случаях могут не визуализироваться (рис. 1.6 ). Как уже отмечалось выше, размер фокусного пятна в современных ангиографических установках должен быть <0,8 мм при ангиографии и <0,5 мм при ангиоскопии (рис. 1.7 ).

В современных ангиографических установках используют пульсовую ангиоскопию (рис. 1.8–1.10), которая повышает качество изображения и снижает дозу облучения.



Записывающая и воспроизводящая аппаратура
В первых ангиографических установках для записи ангиограмм использовали киноаппаратуру. Качество ангиограмм зависело от качества кинопленки, условий ее обработки и хранения и тому подобных факторов. В прежних руководствах по инвазивной кардиологии этим вопросам уделялось большое внимание. Сейчас же необходимость в этом исчезла, поскольку на смену кинозаписи повсеместно пришли цифровые технологии записи и воспроизведения ангиограмм.
На первых этапах применения цифровой ангиографии существовали трудности в просмотре ангиограмм, записанных на разных ангиографических установках, что было обусловлено разными стандартами в программном обеспечении у разных производителей аппаратуры. Кроме того, имелись ограничения в архивировании цифровых фильмов из-за их больших объемов, поэтому выпускались ангиографические установки, позволявшие проводить как цифровую, так и аналоговую запись ангиограмм. Современные компьютерные системы, обеспечивающие запись и воспроизведение цифровых ангиограмм, не имеют этих недостатков. Вопросы архивации ангиограмм успешно решены с помощью увеличения объема памяти как жестких, так и других цифровых носителей информации.
Качество цифровой видеозаписи, безусловно, выше аналоговой, поэтому применение цифровой записи позволяет врачам получать более полный объем информации и лучше контролировать процессы, происходящие во время эндоваскулярных процедур. Так, появилась возможность цифровой обработки количественных характеристик атеросклеротических поражений коронарного русла, что дает возможность более точно отбирать инструменты для перкутанных коронарных вмешательств. Цифровая запись позволяет более точно оценить качественные характеристики атеросклеротических поражений; улучшение контрастности изображения на цифровых ангиограммах позволяет, например, более точно детализировать признаки пристеночного тромбообразования, диссекции или других видов разрушения исследуемого атеросклеротического поражения, что также определяет выбор тактики интервенционного лечения и отбор инструментов для интервенционных вмешательств в каждом конкретном случае.
Инструментарий, применяемый при перкутанных коронарных вмешательствах
Диагностический инструментарий
Для проведения диагностической коронаровентрикулографии, выполняемой при коронарном атеросклерозе, требуется сравнительно небольшое количество инструментов: иглы для пункции артерий, проволочные проводники, перфораторы, интродюсоры и ангиографические катетеры. Сейчас в связи с широким распространением методов эндоваскулярной реконструкции коронарных артерий при их атеросклеротическом поражении эти инструменты в разных модификациях в большом количестве выпускают разные фирмы-производители. Правильный выбор операционного инструментария значительно облегчает выполнение операции. Поэтому нам представляется необходимым изложить информацию о преимуществах и недостатках различных модификаций инструментов.
Пункционные иглы
Для чрескожного доступа в артериальное русло используют пункционные иглы двух типов, соответствующие двум видам техники пункции сосудов — прямой и сельдингеровской.
Игла Сельдингера (рис. 1.11) состоит из нескольких компонентов: металлической оболочки, не имеющей остроугольного среза, и одного или двух стилетов. Внутренний стилет иглы Сельдингера просвета не имеет; он защищает иглу от блокирования ее просвета кожей и подкожными тканями.

Канюля иглы Сельдингера содержит луеровский коннектор и открылки. Открылки канюли позволяют выполнять пункцию сосуда одной рукой, держа иглу большим, указательным и средним пальцами, как того требует техника Сельдингера; при этом положение иглы контролируется рукой, а не подсоединенным к игле шприцем. Некоторые производители («Argon Inc.») выпускают иглы Сельдингера со съемными пластмассовыми коннекторами разной формы. Это позволяет хирургу выбрать коннектор, наиболее подходящий для каждого конкретного случая.
Иглы Сельдингера нумеруются в соответствии с их наружным диаметром: чем больше наружный диаметр иглы, тем меньше ее номер (табл. 1.4). Для пункции артерий наиболее подходящими являются иглы Сельдингера № 18; внутренний диаметр таких игл пропускает стандартные металлические проводники диаметром 0,035–0,038 дюйма. Современная технология производства игл Сельдингера позволяет, сохраняя необходимый внутренний диаметр иглы, уменьшить ее наружный диаметр, что снижает риск травмы артерии.
Таблица 1.4
Система нумерации игл Сельдингера
| Калибровочный номер иглы | Наружный диаметр, дюймов |
| 13 | 0,095 |
| 14 | 0,083 |
| 15 | 0,072 |
| 16 | 0,065 |
| 17 | 0,058 |
| 18 | 0,049 |
| 19 | 0,042 |
| 20 | 0,035 |
Стандартная длина игл — 2,75–3 дюйма. Выбор длины иглы обычно зависит от выраженности подкожно-жировой клетчатки в скарповском треугольнике. Наконечник стилета должен быть скошен под менее острым углом, чем у обычных инъекционных игл, и в то же время стилет должен быть достаточно острым, чтобы не расслоить стенку пунктируемой артерии. Стилет изготавливается из твердого металла; это является необходимым условием для его свободного прохождения через измененные стенки артерии или рубцовые подкожные ткани.
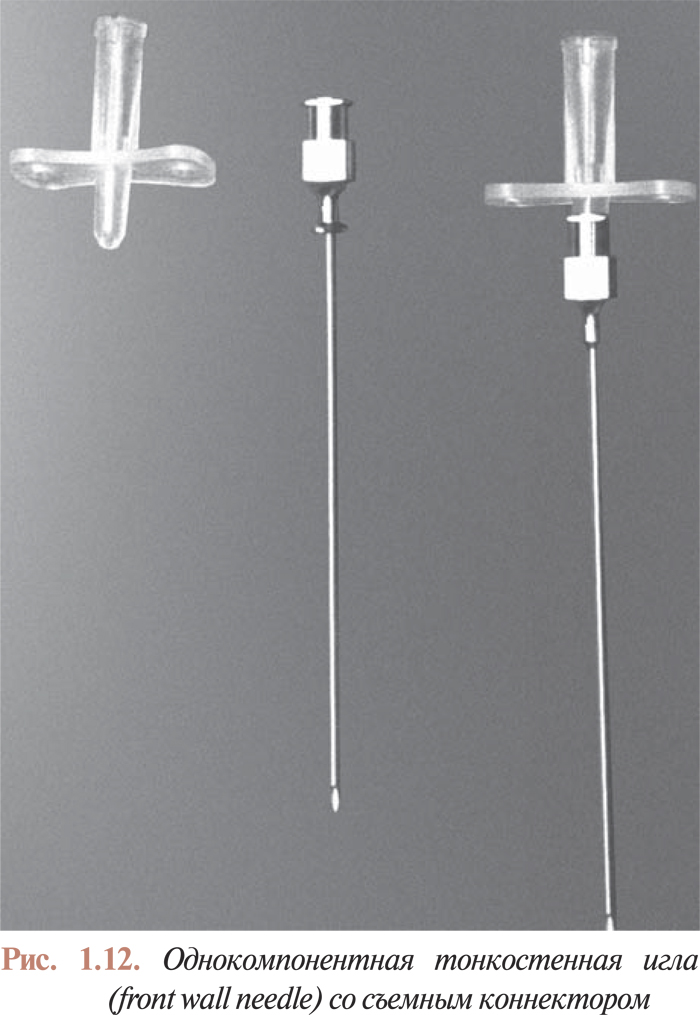
При пункционной технике иглой Сельдингера предполагается прокол задней стенки артерии. При современном методе медикаментозного сопровождения перкутанных коронарных вмешательств дополнительная травма стенки артерии может стать причиной существенных геморрагических осложнений в пункции. Этот факт резко ограничил применение игл Сельдингера. В настоящее время практически всегда используют иглы для прямой артериальной пункции (one touch needle).
Игла, предназначенная для прямой пункции артерий (рис. 1.12), по своей конструкции почти не отличается от обычной пункционной иглы. Отсутствие стилета в этой игле позволяет получить артериальный кровоток через ее просвет при проколе передней стенки артерии без повреждения задней стенки.
Металлические проволочные проводники
Базовая конструкция металлических проводников, используемых при катетеризации артериального русла, представлена на рис. 1.13.
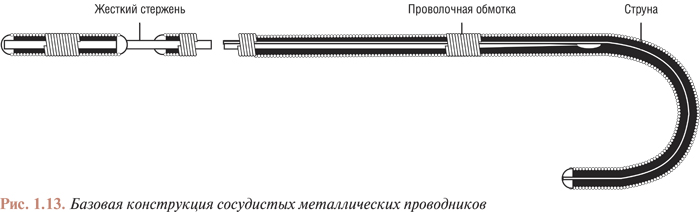
Основу проводника составляет металлический стержень, обмотанный тонкой проволокой с тефлоновым покрытием. Проволочная обмотка проводника, запаянная на дистальном конце, длиннее стержня, что обеспечивает подвижность дистального сегмента проводника. К дистальному концу обмотки припаяна струна, которая располагается между обмоткой и стержнем по всей длине проводника. Длина дистального сегмента проводника, не имеющего стержня, может быть различной; она определяет то расстояние, на которое проводник может пройти за препятствие (стеноз или изгиб артерии) до того, как с этим препятствием встретится стержень проводника. Постепенно суживающийся стержень делает плавным переход от подвижной верхушки проводника к жесткому стержню. Достоинством проводников с постепенно суживающимися стержнями является также то, что вероятность отрыва подвижного сегмента проводника от жесткого стержня значительно снижается.
Наружное тефлоновое покрытие проводника уменьшает трение между проводником и внутренней поверхностью катетера, что снижает вероятность тромбообразования. Однако, несмотря на тефлоновое покрытие, в местах изгибов проводников могут образовываться тромбы, поэтому проводники должны находиться в просвете сосуда в течение только того минимального времени, которое необходимо для установки катетера.
Длина проводников может варьировать от 35 до 300 см. При выборе проводников для эндоваскулярных вмешательств необходимо помнить, что длина проводника должна быть не менее чем на 20 см больше длины катетера. При выполнении обычной коронаровентрикулографии применяют проводники длиной 145 см. Однако бывают ситуации, когда проводник и катетеры с трудом проходят через сегменты артериального русла вследствие чрезмерной извитости или сложного атеросклеротического поражения. В этих случаях применяют проводники большей длины (240–260 см), что позволяет при смене катетеров оставлять дистальный отдел проводника за измененным участком артерии. Такая тактика сводит к минимуму вероятность травмы сосудистой стенки.
Для катетеризации коронарных артерий и ЛЖ используют проводники диаметром 0,035–0,038 дюйма. Хотя все проводники указанных диаметров свободно проходят через иглы Сельдингера № 18 и совместимы с обычными ангиографическими катетерами, в большинстве случаев предпочтение нужно отдавать проводникам меньшего диаметра, поскольку прохождение таких проводников через просвет иглы не создает дополнительного трения, что позволяет ощутить минимальное затруднение движения проводника в измененном сегменте артерии. Применение жестких проводников большего диаметра (0,038 дюйма) оправдано при катетеризации ЛЖ через стенозированное устье аорты.
Дистальный отдел проводника может быть как прямым, так и в форме буквы «J» (рис. 1.14). Проводники «J» маркируются по диаметру кривизны дистального сегмента (например 3 мм). Использование проводников «J» позволяет избежать попадания в боковые ветви сосуда, не допускает диссекции интимы сосуда в месте изгиба артерии или локализации бляшки, что бывает довольно часто в случаях приложения оператором чрезмерного усилия в той ситуации, когда верхушка прямого проводника упирается в препятствие. Единственный недостаток проводников «J» заключается в трудности их введения в просвет пункционной иглы. Этот недостаток легко устраняется за счет применения прямых пластиковых интродюсоров, которые находятся в упаковке всех проводников «J».

Перфораторы и интродюсоры
Одной из самых главных задач при кардиальной катетеризации является постоянная поддержка доступа в артериальное русло через пункционное отверстие, что обеспечивается с помощью специальных ангиографических инструментов — перфораторов («пробойников») и интродюсоров (рис. 1.15).

Перфораторы обеспечивают прохождение тонкостенной пластиковой оболочки — интродюсора через подкожные ткани и стенку артерии в ее просвет. Интродюсор, установленный в просвете артерии, значительно облегчает процедуру катетеризации, сводя к минимуму травмирование сосудистой стенки. Кроме того, в случае выполнения реконструкции коронарной артерии с применением антитромботических препаратов и/или антикоагулянтов, интродюсор можно оставить в просвете артерии после операции на то время, которое необходимо для инактивации этих лекарств. Наличие интродюсора в просвете артерии после операции облегчает повторный ургентный доступ в сосудистое русло в случае раннего тромбоза коронарной артерии после ее реконструкции.
Для кардиальной катетеризации применяют перфораторы различного диаметра и длины, однако все они должны соответствовать общим требованиями и быть изготовлены из жесткого пластика (тефлона или полиэтилена), обеспечивающего их проведение через склерозированные подкожные ткани или кальцинированную стенку артерии. Для того чтобы травма сосуда была минимальной, стенка перфоратора в дистальном отделе должна постепенно истончаться; диаметр же внутреннего просвета при этом должен оставаться одинаковым на всем протяжении. Диаметр внутреннего просвета перфоратора должен точно соответствовать диаметру проводника, чтобы, во-первых, проведение перфоратора по проводнику было свободным, а во-вторых, количество крови между перфоратором и проводником было минимальным. Коннекторы перфораторов соответствуют канюлям луеровских шприцев. На канюле перфоратора указаны его размеры.
Диаметр и длина интродюсоров также значительно варьируют. Интродюсоры изготавливают из нетромбогенного материала (обычно тефлона или полиэтилена), который должен быть прочным, тонким, гибким и рентгеноконтрастным. Во время изготовления интродюсора его верхушку равномерно истончают. Это обеспечивает минимальную травму артерии при введении в ее просвет интро-дюсора, расположенного поверх перфоратора.
Коннекторы интродюсоров имеют особую конструкцию. Они снабжены гемостатическим клапаном и боковой полиэтиленовой трубкой, которая оканчивается краном с несколькими выходами. Наличие боковой трубки и крана с несколькими выходами позволяет одновременно использовать аппаратуру для мониторирования АД, промывать интродюсор и вводить лекарства в артериальное русло. Некоторые коннекторы соединяются с интродюсором по типу гармошки (фирма «Arrow Inc.»), что позволяет изменять угол между коннектором и трубкой интродюсора; другие коннекторы соединены с трубкой интродюсора по типу муфты.
Конструкция гемостатических клапанов интродюсоров может быть различной. Фирма «Cordis» выпускает интродюсоры с одно- и двустворчатыми клапанами, фирма «USCI» — интродюсоры с клапанами, состоящими из О-образного резинового кольца. Недавно налажено производство клапанов с многослойной диафрагмой, состоящей из перекрывающихся резиновых полосок. Фирма «Terumo Radiofocus» выпускает интродюсоры с клапанами в виде силиконовой пробки с поперечными волокнами, которая обеспечивает как герметичность, так и минимальное трение катетера во время манипуляций. Некоторые фирмы выпускают коннекторы интродюсоров со съемными клапанами; это позволяет подсоединить к коннектору луеровский шприц или накидной кран.
Иногда интродюсоры выпускают в комплекте с обтураторами, позволяющими закрыть просвет интродюсора в том случае, если он оставлен в просвете артерии после операции. Обтуратор не только герметично закрывает просвет интродюсора, но и исключает возможность изгиба трубки интродюсора в месте пункции артерии.
Хорошо изготовленные интродюсоры значительно облегчают процедуру кардиальной катетеризации; некачественные же инструменты не только затрудняют выполнение операции, но и могут стать причиной ряда осложнений процедуры, главным из которых является неконтролируемое артериальное кровотечение.
Ангиографические катетеры
Наиболее важными и сложными инструментами, применяемыми при коронаровентрикулографии, являются ангиографические катетеры. Их разнообразие обусловлено в основном различной конфигурацией дистальных сегментов. При этом принципиальная конструкция всех диагностических катетеров одинакова. В коронаро- и вентрикулографических катетерах различают следующие компоненты: коннектор; тело катетера; дистальный сегмент катетера, имеющий один или несколько изгибов; верхушка катетера (рис. 1.16 ).
Порядковое исчисление изгибов дистального сегмента начинается от верхушки катетера. Верхушка катетера может иметь одно (торцевое) или несколько отверстий (торцевое и несколько боковых). Наличие боковых отверстий позволяет увеличить скорость и количество поступающего контраста, снижая при этом отдачу. Коннектор герметично соединен с телом катетера по типу муфты. Имеет либо квадратную конфигурацию, либо открылки. Это облегчает выполнение ротации катетера и другие манипуляции. На коннекторе отмечается спецификация катетера.

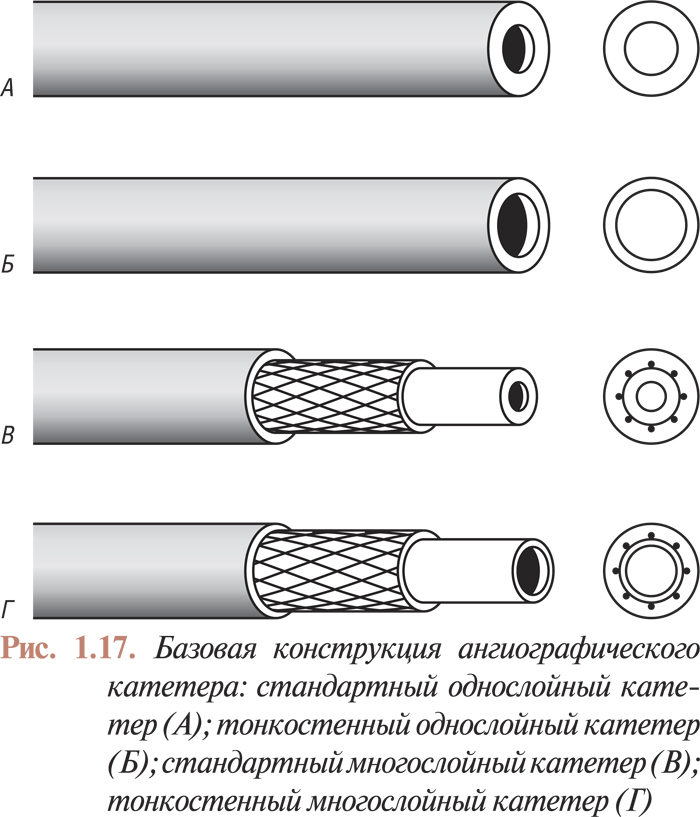
Кардиальные диагностические катетеры могут состоять из одного или нескольких слоев (рис. 1.17). В настоящее время в основном используют многослойные катетеры. Компоненты, составляющие слои стенки катетера, определяют его технические характеристики. Большинство многослойных катетеров содержит внутреннюю тефлоновую трубку, покрытую слоем нейлона или дакрона, в котором имеется оплетка из нержавеющей стали. Для укрепления внутренних слоев поверх них наплавляется третий (наружный) слой из полиэтилена или полиуретана. Внутренний слой должен обеспечить максимально гладкую внутреннюю поверхность катетера для свободного прохождения металлического проводника и контрастной массы. Это условие необходимо не только для облегчения проведения процедуры, но и для предотвращения тромбообразования внутри просвета катетера.
Жесткость катетера зависит от толщины и плотности материала, из которого изготовлен средний слой. Жесткость является важным качеством катетера: чем жестче катетер, тем легче им управлять. Последние модели катетеров имеют более тонкие стенки. Это достигается внедрением оплетки во внутренний слой. Уменьшение толщины стенок катетера позволяет увеличить диаметр внутреннего просвета при сохранении наружного диаметра, однако жесткость катетера при этом снижается. Использование для среднего слоя нейлона (например в катетерах Edwards «Uniweave») повышает жесткость и термоустойчивость катетеров.
Одним из качеств, которым должен обладать наружный слой катетера, является рентгеноконтрастность. Это достигается пропиткой наружного слоя барием или висмутом. Процесс пропитки размягчает наружный слой и может оставлять изъяны на его поверхности, что увеличивает тромбогенность катетера. Для того чтобы максимально уменьшить возможность тромбообразования, катетеры покрываются тонким слоем силикона или другого нетромбогенного материала. Свойства полиэтилена и полиуретана, которые применяются для наружного слоя катетеров, различны. Полиэтилен более устойчив к размягчающему эффекту контрастной пропитки, однако он менее термостоек и может сравнительно легко отделяться от других слоев стенки катетера, поэтому полиэтиленовые катетеры нельзя подвергать термической обработке. Полиуретан является более термостойким материалом, что улучшает «память» катетера. В настоящее время выпускают катетеры одноразового использования, поэтому для наружного слоя применяется полиэтилен.
Ангиографические катетеры характеризуются тремя основными размерами: диаметром просвета, наружным диаметром и длиной катетера. Диаметр просвета определяется максимальным диаметром проводника, который можно провести через данный катетер, и выражается либо в дюймах, либо в миллиметрах. Наружный диаметр катетера определяется в единицах French (F). В табл. 1.5 приведены размеры наружных и внутренних диаметров стандартных и тонкостенных катетеров в единицах French, дюймах и миллиметрах. Данные таблицы свидетельствуют, что применение тонкостенных катетеров значительно уменьшает размер пункционного отверстия артерии при одинаковых диаметрах просвета стандартных и тонкостенных катетеров.
Таблица 1.5
Наружные и внутренние диаметры стандартных и тонкостенных катетеров
| Размер, F | Наружный диаметр | Внутренний диаметр | ||||
| стандартный | тонкостенный | |||||
| дюймы | мм | дюймы | мм | дюймы | мм | |
| 5 | 0,065 | 1,67 | 0,026 | 0,66 | 0,034 | 0,86 |
| 6 | 0,078 | 2 | 0,036 | 0,91 | 0,046 | 1,1 |
| 7 | 0,091 | 2,33 | 0,046 | 1,17 | 0,058 | 1,47 |
| 8 | 0,104 | 2,67 | 0,056 | 1,42 | 0,068 | 1,73 |
| 9 | 0,118 | 3 | 0,064 | 1,63 | 0,078 | 1,98 |
Длина катетеров варьирует в зависимости от цели применения, их конфигурации и места предполагаемой пункции артерии (использование плечевого или бедренного доступа). Например, длина катетеров pigtail обычно составляет 110 см; катетеров Judkins — 100 см; брахиальных катетеров — 80–100 см.
Для катетеризации различных отделов сердечно-сосудистой системы (ЛЖ, крупных сосудов и их ветвей) применяют катетеры различной конфигурации. При атеросклерозе аорты и коронарных артерий выполняют вентрикулографию, аортографию и коронарографию, поэтому в настоящей главе будет рассмотрена конфигурация катетеров, предназначенных для проведения этих исследований.
Для выполнения аортовентрикулографии применяют катетеры (NIH, Gensini, Lehman, pigtail; рис. 1.18) с несколькими (от 4 до 8) отверстиями на верхушке, причем торцевое отверстие может быть как открытым, так и запаянным.
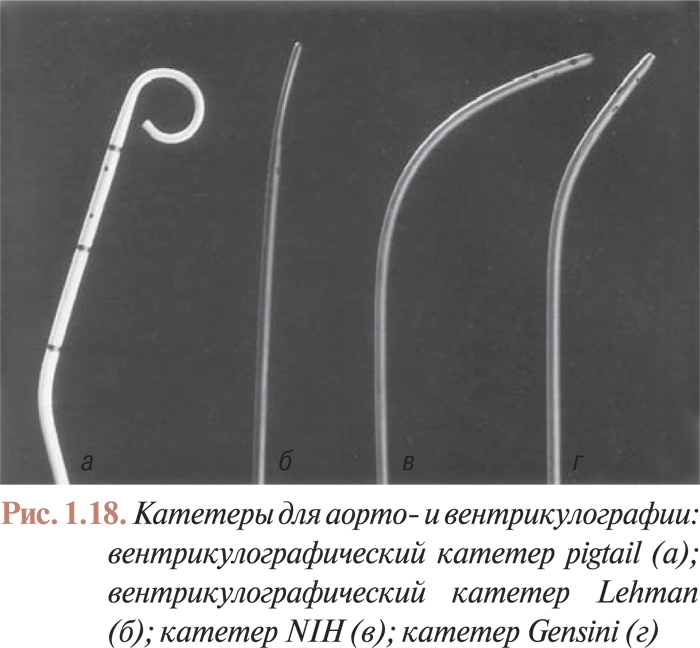
Катетеры NIH — толстостенные катетеры с подвижной верхушкой, имеющей 6 боковых отверстий; торцевое отверстие верхушки этих катетеров запаяно. Катетеры этого типа вводятся в просвет артерии через артериотомное отверстие или интродюсор; при этом обычно используют плечевой доступ. Эти катетеры легко проходят через стенозированное аортальное отверстие. Несмотря на закрытое торцевое отверстие, они сохраняют стабильное положение при введении большого количества контраста с большой скоростью.
Катетеры Lehman — тонкостенные катетеры из плетеного дакрона, имеющие утончающуюся закрытую верхушку с 4 боковыми отверстиями. Эти катетеры применяют для выполнения вентрикуло- и аортографии через плечевой доступ.
Катетеры Gensini также являются тонкостенными дакроновыми катетерами, однако, в отличие от предыдущих катетеров, кроме 6 боковых имеют также и торцевое отверстие. Их применение и способ введения в артериальное русло такие же, как и для катетеров Lehman.
Наиболее часто для аортовентрикулографии применяют катетеры pigtail. Их устойчивое положение при быстром введении большого количества контраста обеспечивается с помощью завитой верхушки, которая имеет торцевое и большое количество боковых отверстий. Дистальный сегмент катетеров pigtail может быть прямым или изогнутым по отношению к телу катетера под углом 145 или 155°, что облегчает катетеризацию ЛЖ при стенозе аортального отверстия в сочетании с горизонтальным положением оси сердца. Количество боковых отверстий может быть различным — от 4 до 6. Большее количество отверстий не дает эффекта повышения скорости введения контраста и вместе с тем повышает вероятность тромбообразования в верхушке катетера, поскольку контраст может не доходить до торцевого отверстия.
Для коронарографии применяют катетеры Sones, Amplatz, Judkins, многоцелевые катетеры и катетеры для шунтов коронарных артерий.
Катетеры Sones (рис. 1.19) так же, как и многоцелевые катетеры Schoonmaker and King (рис. 1.20), предназначены для селективной катетеризации как левой, так и правой коронарной артерии. С помощью многоцелевых катетеров может быть также выполнена вентрикулография. Вначале коронарографию по методике Sones выполняли путем введения катетера через артериотомное отверстие после выделения плечевой артерии, позднее эти катетеры стали вводить в артериальное русло из чрескожного плечевого доступа с использованием интродюсоров. Многоцелевые катетеры, конфигурация которых сходна с конфигурацией катетеров Sones, предназначены для выполнения вентрикулокоронарографии через бедренный доступ. В настоящее время катетеры Sones и многоцелевые катетеры используют редко.


Катетеризация коронарных артерий катетерами Judkins и Amplatz проводится чрескожно из бедренного доступа. Для катетеризации как левой, так и правой коронарной артерии в обоих случаях используют два различных типа катетеров. Техника катетеризации коронарных артерий с помощью катетеров Judkins (рис. 1.21, 1.22) по сравнению с катетерами Amplatz (рис. 1.23, 1.24) представляется более простой, однако катетеры Amplatz можно с успехом применять в тех случаях, когда катетеризация коронарных артерий катетерами Judkins затруднена, особенно тогда, когда устья коронарных артерий расположены высоко. Техника катетеризации коронарных артерий этими катетерами будет подробно изложена ниже.
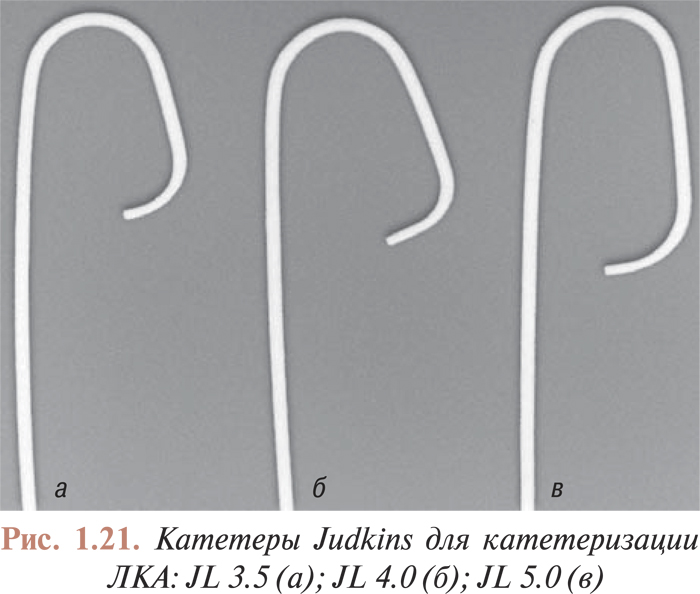

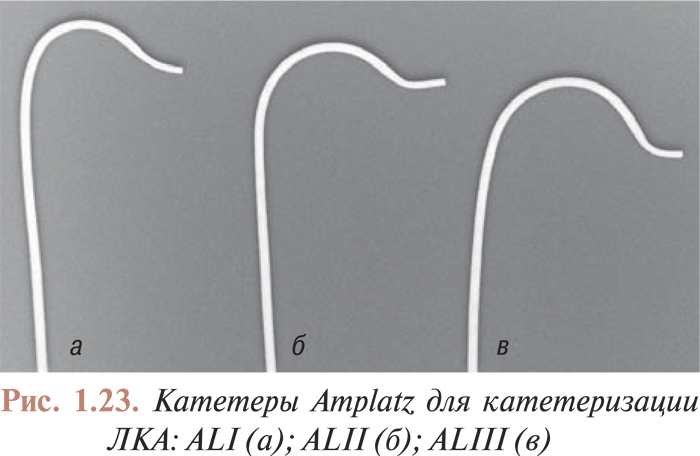
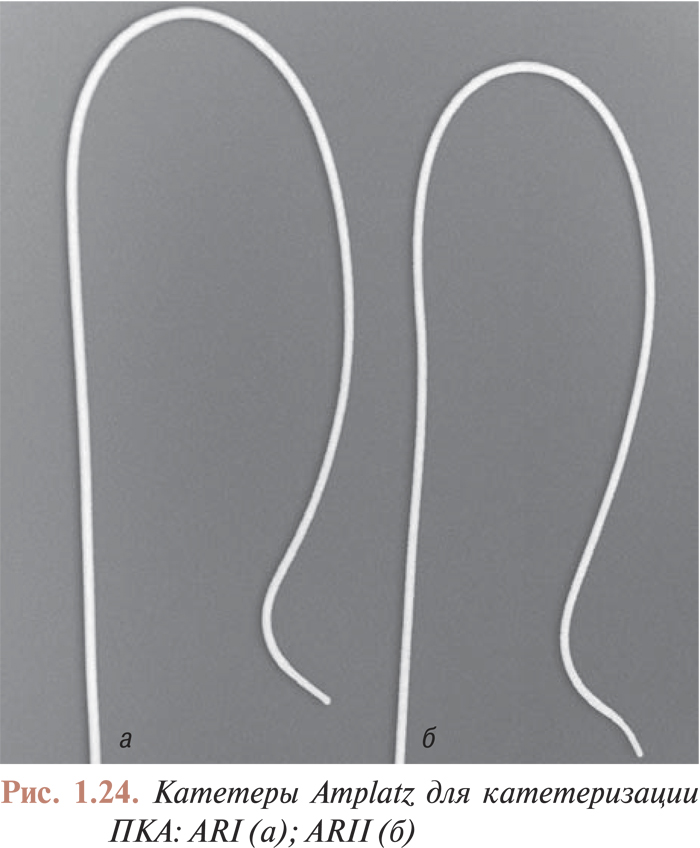
Есть несколько модификаций катетеров, предназначенных для исследования аортокоронарных шунтов и шунтов от левой внутренней грудной артерии (см. рис. 1.20 б, в, г). Техника катетеризации венозных шунтов имеет особенности, поэтому в данных случаях можно использовать катетеры различной конфигурации.
Инструментарий для лечебных интервенционных процедур
Проводниковые катетеры
При проведении коронарных вмешательств используют большое количество различных вариантов проводниковых катетеров (рис. 1.25). Многие компании-производители выпускают проводниковые катетеры различной формы, структуры и размера.

Одной из важных физических характеристик проводникового катетера является соотношение наружного диаметра катетера и его внутреннего просвета (толщины стенки катетера) (табл. 1.6).
Таблица 1.6
Стандартные, большие и очень большие проводниковые катетеры
| Размер, F | Стандарт | Большие | Очень большие |
| 6 | <0,061 | 0,062–0,065 | >0,066 |
| 7 | <0,071 | 0,072–0,075 | >0,076 |
| 8 | <0,079 | 0,080–0,085 | >0,086 |
| 9 | <0,089 | 0,090–0,095 | >0,096 |
| 10 | <0,099 | 0,100–0,107 | >0,108 |
Внутренний диаметр проводникового катетера обеспечивает адекватное прохождение устройства для проведения вмешательств (внутрикоронарный проводник, баллон-катетер, стент на баллоне, ротаблатор, аппарат для атерэктомии и т.д.) (табл. 1.7).
Таблица 1.7
Устройства для коронарных вмешательств и минимальный рекомендованный внутренний диаметр проводникового катетера
| Устройство | Внутренний диаметр | Дюймы |
| Баллон-катетер | Стандартный | 0,060 |
| «Целующиеся баллоны» | 0,086 | |
| Перфузионный | 0,070 | |
| Стенты | GRS 2 мм; 2,5 мм | 0,077 |
| GRS 3 мм | 0,080 | |
| GRS 3,5 мм; 4 мм | 0,086 | |
| PSS | 0,086 | |
| Ротаблатор (размер бура) | 1,25 мм; 1,5 мм | 0,076 |
| 1,75 мм | 0,084 | |
| 2 мм; 2,15 мм | 0,092 | |
| 2,25 мм; 2,38 мм; 2,5 мм | 0,107 | |
| Лазерная коронарная ангиопластика (эксимерный лазер) | 1,4 мм | 0,084 |
| 1,8 мм | 0,084 | |
| 2 мм | 0,092 | |
| DCA Atherocath | 5 F | 0,105 |
| 6 F | 0,105 | |
| 7 F, 7 FG | 0,105 | |
| TEC Catheter | 5,5 F, 6 F | 0,092 |
| 6,5 F, 7 F | 0,100 | |
| 7,5 F | 0,107 | |
| IVUS (катетер для интракоронарного УЗИ) | 0,076 | |
| Ангиоскопический катетер | 0,077 | |
Некоторые производители выпускают проводниковые катетеры «пассивного дизайна». Они достаточно жесткие, но крепкие, однако их нельзя использовать для активных манипуляций во время катетеризации (введение катетера с глубоким фиксированием при устранении суперпроксимальных поражений левой коронарной артерии и правой коронарной артерии, при катетеризации артерий, расположенных нетипично).
Следует отметить, что существуют проводниковые катетеры «активного дизайна». Подобные катетеры характеризуются мягкой, но прочной стенкой, большей подвижностью в просвете аорты и обладают свойствами, которые помогают активно манипулировать ими в устье коронарной артерии.
Все проводниковые катетеры имеют сходную структуру: жесткую основу, состоящую из переплетенных между собой стальных проволок, определяющих как жесткость, так и гибкость катетера; защитную (наружную) оболочку, изготовленную из современного полимера, обладающего всеми необходимыми свойствами, который обеспечивает атромбогенность, связанную с повышенной гладкостью поверхности сосуда; внутреннюю поверхность катетера, покрытую PTFE или силиконом, что обеспечивает беспрепятственное скольжение всех инструментов, необходимых для проведения вмешательства (см. табл. 1.7).
Наиболее важными характеристиками проводникового катетера являются способность обеспечивать коаксиальное расположение верхушки катетера относительно устья коронарной артерии (подобная позиция оптимальна для проведения всех вмешательств) и высокая сопротивляемость катетера продольному скручиванию (kinking control). Особенностью современных проводниковых катетеров также являются атравматичность и рентгеноконтрастность верхушки катетера (обеспечивает безопасное и удобное расположение верхушки катетера относительно устья артерии). Большой просвет артерии дает возможность адекватно контрастировать коронарное русло при расположении в просвете катетера различных инструментов для ангиопластики, а особые (специальные) формы катетера позволяют устойчиво и безопасно катетеризировать устье левой и правой коронарной артерии при любом варианте отхождения из коронарного синуса (см. табл. 1.7; 1.8, рис. 1.26).
Таблица 1.8
Рекомендации по использованию проводниковых катетеров в зависимости от их конфигурации
| Конфигурация | Проводниковый катетер |
Характеристика катетеров |
| Judkins left | JL | Большинство случаев вмешательств на ЛКА |
| Fermoral left | FL | |
| Jadkins «C» left | JCL | Имеет более мягкий переход в изгибах и, следовательно, может использоваться для проведения DCA в ЛКА, при установке билиарных стентов и ротаблатора |
| Voda left | VL | Катетер обладает хорошим «сопротивлением к отталкиванию» с использованием противоположной стенки аорты. Целесообразно использовать при сложных анатомических особенностях (извитые артерии, стенозы на изгибах, кальцинированные стенозы, полные окклюзии и т.д.) в бассейне ЛКА в случаях, когда необходима повышенная «поддержка к отталкиванию» |
| Voda left, high takeoff | VLHT | |
| Extra-backup | XB | Катетер обладает хорошим «сопротивлением к отталкиванию» с использованием противоположной стенки аорты. Целесообразно использовать при сложных анатомических особенностях (извитые артерии, стенозы на изгибах, кальцинированные стенозы, полные окклюзии и т.д.) в бассейне ЛКА в случаях, когда необходима повышенная «поддержка к отталкиванию» |
| Geometic left | GL | Катетер обладает хорошим «сопротивлением к отталкиванию» с использованием противоположной стенки аорты. Целесообразно использовать при сложных анатомических особенностях (извитые артерии, стенозы на изгибах, кальцинированные стенозы, полные окклюзии и т.д.) в бассейне ЛКА в случаях, когда необходима повышенная «поддержка к отталкиванию» |
| Amplatz left | AL | Благодаря многофункциональной конфигурации катетер можно применять при передневерхнем расположении устья ПКА. Целесообразно использовать при сложных анатомических особенностях в бассейне ЛКА (особенно при «неудобном» отхождении огибающей ветви (здесь и далее в рисунках и таблицах — ОВ ЛКА), а также при катетеризации венозных шунтов |
| Judkins right | JR | Используют при катетеризации ПКА, при большинстве катетеризаций венозных шунтов на ЛКА. Может обеспечить коаксиальное расположение верхушки катетера по отношению к устью венозного шунта к ПКА |
| Femoral right | FR | Используют при катетеризации ПКА, при большинстве катетеризаций венозных шунтов на ЛКА. Может обеспечить коаксиальное расположение верхушки катетера по отношению к устью венозного шунта к ПКА |
| No-torque right | NR | |
| Shephеrd Crook right | SCR | При катетеризации ПКА типа Shephеrd Crook можно использовать для катетеризации венозных шунтов на ЛКА |
| Shani right | SHR | При катетеризации ПКА типа Shephеrd Crook можно использовать для катетеризации венозных шунтов на ЛКА |
| Judkins «C» right | JCR | Используют при проведении DCA в ПКА и венозных шунтах на ЛКА с горизонтальным нижним отхождением устья, а также для проведения билиарных стентов |
| Double-loop Arani (75°, 90°) | DA 75,90 | Отличное «сопротивление отталкиванию» во время катетеризации ПКА при наличии сложных анатомических особенностей или типа Shephеrd Crook |
| Voda right | VR | Отличное «сопротивление отталкиванию» во время катетеризации ПКА при наличии сложных анатомических особенностей или типа Shephеrd Crook, или венозных шунтов на ЛКА |
| Voda right, Shephеrd Crook | VRSC | Отличное «сопротивление отталкиванию» во время катетеризации ПКА при наличии сложных анатомических особенностей или типа Shephеrd Crook, или венозных шунтов на ЛКА |
| Amplatz right | AR | Используют для вмешательств на ПКА или венозных шунтах ПКА |
| Amplatz left — right (modified Amplatz) | ALR 1-2 | То же самое, что AL и AR. Немного длиннее, чем AR, и короче, чем AL. Используют как универсальный катетер для катетеризации ПКА и ЛКА |
| Multipurpose | MP | Используют для катетеризации ПКА или венозных шунтов к ПКА, для различных модификаций шунтов к ЛКА, а также для катетеризации ПКА или венозных шунтов к ПКА |
| Sones | SON | Используется для катетеризации ПКА или венозных шунтов к ПКА, а также для различных модификаций шунтов к ЛКА. Используется при катетеризации ПКА или венозных шунтов к ПКА |
| Hockey Stick | HS | Удобный проводниковый катетер для катетеризации устья ПКА при горизонтальном отхождении устья или венозных шунтов на ЛКА |
| Champ | Champ | Удобный проводниковый катетер для катетеризации устья ПКА при горизонтальном отхождении устья или венозных шунтов на ЛКА |
| EL Gamal bypass | ELG | Удобный проводниковый катетер для катетеризации устья ПКА при горизонтальном отхождении устья или венозных шунтов на ЛКА |
| Left coronary bypass | LCB | Используют в тех же случаях, что JR и HS, а также для катетеризации венозных шунтов на ЛКА при горизонтальном расположении устья |
| Right coronary bypass | RCB | Используют для катетеризации венозных шунтов на ЛКА с горизонтальным расположением устья, может обеспечить коаксиальное расположение верхушки катетера по отношению к устью венозного шунта на ПКА |
| Internal mammary | IMA | При проведении коронарных вмешательств на левой и правой грудной артерии или в нативных артериях позади артериальных анастомозов |
| Castillo | CAS | Напоминает конфигурацию левого катетера типа Amplatz. Часто применяют при бронхиальном доступе к ЛКА (то же самое, что Simmons) |
| Doctor’s choice | DS | Многофункциональный катетер для ПКА или ЛКА с хорошим «сопротивлением к отталкиванию» от противоположной стенки аорты |
Коронарная ангиопластика в передней межжелудочковой ветви левой коронарной артерии (см. рис. 1.26, табл. 1.9). Левая коронарная артерия, как правило, отходит от передневерхней части коронарного синуса (позиция anterior — superior). Для катетеризации левой коронарной артерии в большинстве случаев пригоден катетер JL-4 (Judkins-4.0). В ситуациях, когда устье левой коронарной артерии расположено в верхней части коронарного синуса или корень аорты меньше нормального, используют катетер JL-3.5. После катетеризации устья левой коронарной артерии и фиксации верхушки проводникового катетера в стволе левой коронарной артерии необходимо «мягко» ротировать катетер против часовой стрелки, чтобы придать верхушке катетера направление в передней межжелудочковой ветви (направить верхушку катетера в передней межжелудочковой ветви левой коронарной артерии). В случае определения у пациента короткого ствола (менее 1 см) во избежание обструкции огибающей ветви или передней межжелудочковой ветви рационально использовать проводниковые катетеры типа Judkins со специально укороченной верхушкой. Коаксиальное расположение верхушки катетера и ствола левой коронарной артерии оптимально определять в проекции LAO-50° и Caudal-30°. В некоторых случаях можно использовать проекцию RAO-5° и Caudal-20°.
Таблица 1.9
Рекомендации по выбору проводниковых коронарных катетеров
| Сосуд | Конфигурация | Вариант проводникового катетера |
| ПКА | Дуга аорты | |
| нормальная | JR 4.0, AL 1.0, AR 1.0 | |
| дилатированная | JR≥5.0, AL≥2.0, AR≥2.0 | |
| суженная | JR 3.0, AL≤0.75 | |
| Ориентация устья коронарной артерии | ||
| нормальная | JR, AL, AR | |
| передневерхняя | AL, HS, MP, HS | |
| нижняя | MP, AR, JR | |
| типа Shephеrd Crook | AL, SCR, VR, VRSC, DA, ELG, SHR, Champ | |
| горизонтальная | JR, HS | |
| ЛКА | Дуга аорты | |
| нормальная | JR 4.0, AL 2.0, VL 4.0,
GL 4.0 |
|
| дилатированная | JR≥5.0, AL≥2.0, VL≥4.0, GL≥4.0 | |
| суженная | JR 3.5, VL3.5, GL3.5 | |
| Ориентация устья коронарной артерии | ||
| нормальная,
передняя |
JL, AL, VL, GL | |
| задняя | AL, VL, GL | |
| верхняя | JL, VL, GL | |
| суперверхняя | ||
| ПМЖВ ЛКА | JL3.5, JL (передняя) | |
| ОВ ЛКА | JL4.5, AL, JL (задняя) | |
| Венозный шунт к ПКА | Ориентация устья коронарной артерии | |
| нижняя | MP, AL, AR, JR | |
| горизонтальная | JR, AL, MP | |
| Венозный шунт к ЛКА | Ориентация устья коронарной артерии | |
| горизонтальная | JR, HS, MP, AL, RCB, AR | |
| верхняя | HS, ELG, LCB, MP, SCR, Champ, SHR | |
Коронарная ангиопластика в огибающей ветви левой коронарной артерии (см. рис. 1.26, табл. 1.9). Ангиопластика в огибающей ветви левой коронарной артерии часто сочетается со сложностями в проведении внутрикоронарного проводника и баллона-катетера через пораженный сегмент или через сегмент устья огибающей ветви левой коронарной артерии без выраженного сужения. Такая сложность определяется прежде всего отхождением огибающей ветви от ствола левой коронарной артерии (данная анатомическая особенность хорошо визуализируется в дополнительной проекции Spider (LAO-55° и Caudal-20°). Стабильного коаксиального расположения верхушки проводникового катетера относительно устья огибающей артерии можно достичь при помощи «мягкой» ротации проводникового катетера по часовой стрелке при использовании конфигурации катетера JL-4.0 при наличии крупного ствола левой коронарной артерии. Катетер JL-5.0 может быть эффективно использован при дилатированном корне аорты или в случае, если устье левой коронарной артерии отходит в переднем направлении (позиция anterior). Проводниковый катетер типа Amplatz можно эффективно использовать при очень остром угле огибающей ветви от ствола левой коронарной артерии или при нижней позиции (inferior) огибающей ветви левой коронарной артерии. Катетер типа Amplatz обладает выраженным «сопротивлением к отталкиванию», что необходимо при прохождении коронарного проводника через окклюзии, субтотальные стенозы или извитые сегменты коронарных артерий или при слишком дистальном расположении стеноза. Однако при глубокой фиксации верхушки катетера в русле левой коронарной артерии необходимо избегать полной интубации ствола левой коронарной артерии (!) или одной из крупных ветвей левой коронарной артерии. Кроме того, при излишне активном манипулировании даже «мягкой» верхушкой проводникового катетера возможна диссекция стенки ствола, передней межжелудочковой ветви или огибающей ветви левой коронарной артерии еще на этапе катетеризации устья (левой коронарной артерии). Для наиболее опытных кардиологов при проведении вмешательств на огибающей ветви или передней межжелудочковой ветви левой коронарной артерии рекомендуется также использование катетеров типа Voda left или катетеров, схожих по форме (XB, EBU-Medtronic). При применении этих катетеров используется противоположная стенка аорты для усиления «сопротивления к отталкиванию». Необходимость в этом возникает в результате прохождения коронарного проводника, баллона-катетера или системы стент + баллон через резко суженные сегменты, извитые артерии, хронические окклюзии.
Коронарная ангиопластика в правой коронарной артерии. Особенностью катетеризации правой коронарной артерии часто является полная интубация верхушки проводникового катетера просвета устья правой коронарной артерии, что приводит к резкому снижению давления в просвете коронарной артерии (см. рис. 1.26, табл. 1.9; рис. 1.27). Клинически это проявляется резкой ишемией миокарда в соответствующей области, а ангиографически выглядит как длительная задержка контраста в правой коронарной артерии после прекращения его введения через проводниковый катетер. Как правило, для стандартного отхождения правой коронарной артерии и устранения стенозов в средней трети сосуда используют катетеры типа JR-4.0. Однако в случае необходимости усиления «поддержки отталкиванию» проводникового катетера (при прохождении сложных стенозов, окклюзий и т.д.) используют катетеры типа Amplatz left и Hockey Stick при отхождении правой коронарной артерии из верхней части коронарного синуса (позиция Superior, Shepherd Crook). Часто используют катетеры Amplatz left, Hockey Stick, катетер для внутренней грудной артерии, El Gamal, Voda right и катетер Arani с двойной петлей (75°), которые обеспечивают наилучшее коаксиальное расположение верхушки катетера по сравнению со стандартным катетером Judkins. Хотя катетер Arani с двойной петлей обеспечивает отличную «поддержку отталкиванию», однако часто возникают сложности с его установкой в устье коронарной артерии, в то время как катетер Voda right также обеспечивает устойчивую поддержку и значительно легче и безопаснее фиксируется в устье коронарной артерии.
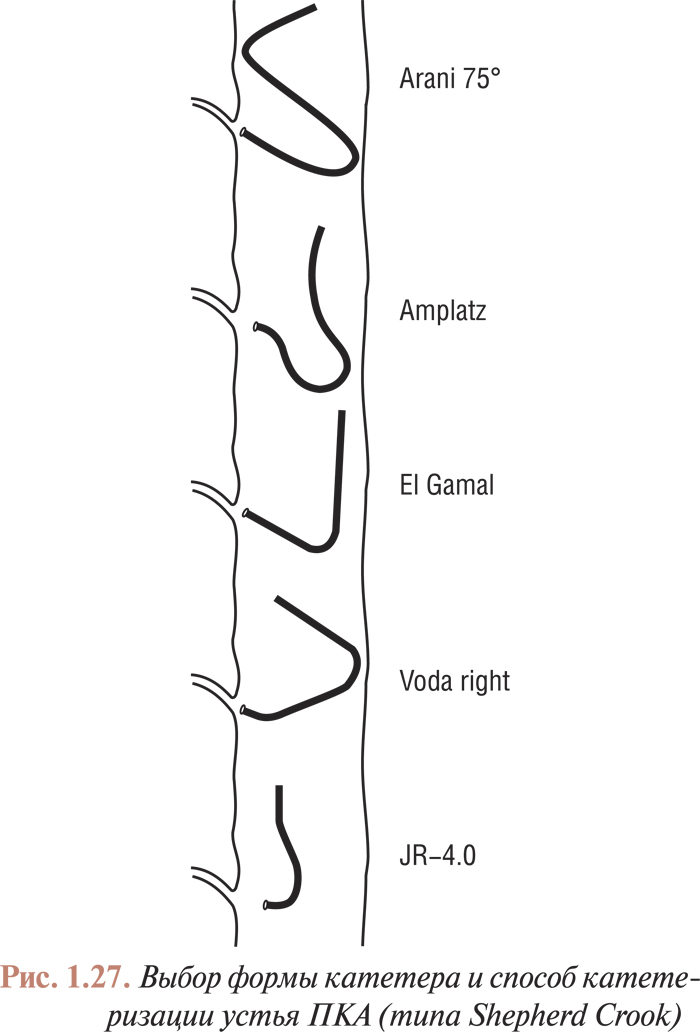
Коронарная ангиопластика в венозных шунтах. Венозные шунты к правой коронарной артерии, как правило, отходят от передней стенки аорты на несколько сантиметров выше корня аорты и удобно катетеризируются JR, многофункциональным катетером или Amplatz (левым или правым). Венозные шунты к передней межжелудочковой ветви левой коронарной артерии и огибающей ветви левой коронарной артерии обычно начинаются выше и латеральнее шунтов к правой коронарной артерии (см. табл. 1.9). Для катетеризации шунтов на передней межжелудочковой ветви и огибающей ветви левой коронарной артерии, кроме правого коронарного катетера, могут понадобиться катетеры El Gamal, катетер для левого венозного шунта Hockey Stick, JR или Amplatz.
Коронарная ангиопластика во внутренней грудной артерии. Внутренняя грудная артерия наилучшим образом катетеризируется с использованием специального проводникового катетера для внутренней грудной артерии. Все проводниковые катетеры могут также иметь или не иметь боковые отверстия, расположенные в верхушке проводникового катетера и обеспечивающие дополнительный кровоток при глубоком фиксировании проводникового катетера в системе коронарных артерий. Именно такие катетеры целесообразно выбирать при проведении вмешательств на окклюзированных сегментах, извитых артериях и дистально расположенных коронарных стенозах, поскольку в процессе катетеризации устья коронарной артерии может понадобиться глубокая фиксация катетера. Наличие боковых отверстий в дистальной части катетера приводит к потере контрастного вещества при контрольном контрастировании, особенно если в просвете катетера расположены различные инструменты (внутрикоронарный проводник, баллон-катетер, баллон + стент). Кроме того, боковые отверстия несколько снижают упругость катетера и приводят к поперечному излому катетера в месте расположения боковых отверстий. Таким образом, расположение боковых отверстий обеспечивает дополнительный коронарный кровоток при сложных катетеризациях во время вмешательства на коронарных артериях, однако это не уменьшает травматизм устья коронарной артерии. Кроме того, их наличие ухудшает качество контрольного контрастирования коронарного русла до и после вмешательства.
Баллоны-катетеры
Типы баллонов-катетеров
В настоящее время для выполнения ЧТКА используют катетеры двух типов: «over-the-wear» (катетеры вокруг проводника) и «rapid exchange», или «monorail» (быстроменяемые катетеры) (рис. 1.28).
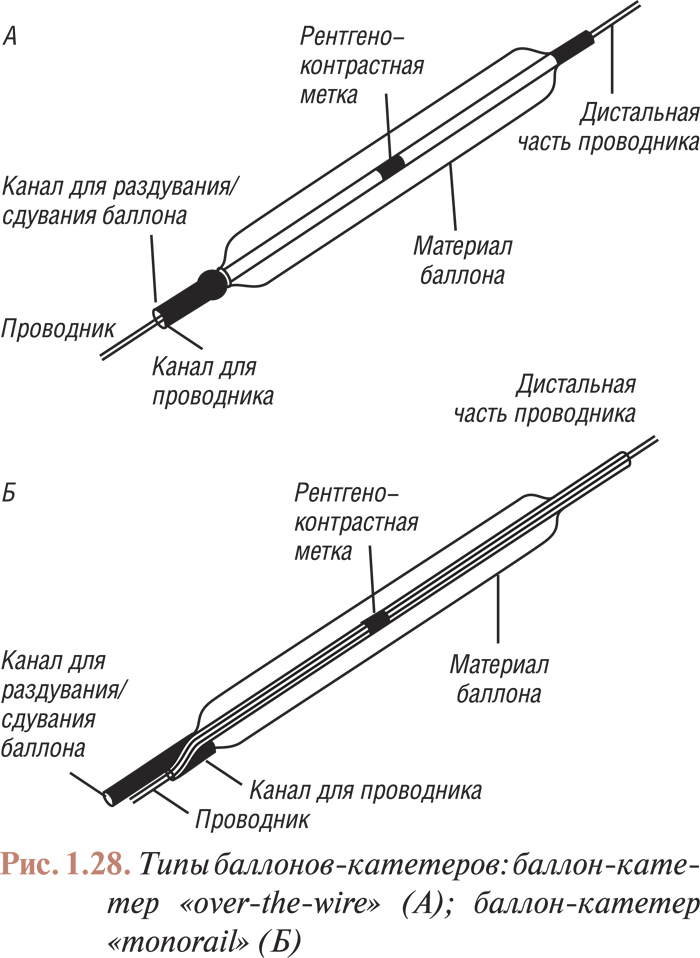
Катетеры «over-the-wire» (рис. 28 А) — стандартные двухпросветные баллоны-катетеры с просветом для проводника по всей длине. В этой системе внутрикоронарный проводник и баллон-катетер двигаются независимо друг от друга, что позволяет оставлять проводник за местом повреждения коронарной артерии, в то время как баллон-катетер удаляется из артерии в просвет проводникового катетера. Эта система позволяет также менять проводники как вне проводниковых катетеров, так и в тех случаях, когда баллон-катетер находится в просвете проводникового катетера.
Недостатком баллонов-катетеров «over-the-wire» является их сравнительно большой профиль, который не позволяет применять их с проводниковыми катетерами малого диаметра.
Эти баллоны требуют значительной поддержки со стороны проводникового катетера при их проведении через поврежденный участок коронарной артерии. Для смены баллона-катетера этого типа с сохранением положения верхушки проводника за поврежденным участком коронарной артерии необходимы проводники, имеющие двойную длину (>3 м). Для управления этой системой требуются два врача.
Строение баллонов-катетеров «monorail» (см. рис. 1.28 Б) позволяет производить их быструю замену в коронарном русле, используя коронарные проводники обычной длины. Эти катетеры по всей своей длине содержат только один просвет, который служит для раздувания баллона, а второй просвет, где содержится проводник и который открывается торцевым дистальным отверстием, занимает только 10—15 см дистального отдела. Вследствие того, что двойной просвет имеется только в дистальной части катетеров «monorail», толщина таких катетеров меньше, чем систем «over-the-wire», что улучшает визуализацию артерии при контрольной коронарографии, которую проводят с остающимся баллоном-катетером внутри проводникового катетера.
Преимущества этих катетеров перед катетерами «over-the-wire» заключаются в том, что, во-первых, они не требуют длинных проводников для смены баллонов-катетеров, а во-вторых, такими системами во время операции может управлять один хирург без помощи ассистента. Недостатком катетеров «monorail» является необходимость значительной поддержки со стороны проводниковых катетеров, причем манипулируя одновременно проводником, проводниковым катетером и баллоном-катетером, врач сталкивается с определенными трудностями. Кроме того, в тех случаях, когда необходима смена проводника, требуется удаление из проводникового катетера всей системы.
Перфузионные баллоны-катетеры являются вариантом катетеров «monorail», которые, в отличие от других систем, имеют боковые отверстия проксимальнее и дистальнее баллона, в просвете, предназначенном для проводника. Это позволяет току крови попадать в коронарную артерию дистальнее раздутого баллона, что допускает увеличение времени его раздувания. Фирмы-изготовители выпускают перфузионные катетеры двух размеров: 60S и 40S. Катетеры 60S перфузируют через баллонную систему 40–50 мл крови в 1 мин. Катетеры 40S более низкопрофильные, однако через них в дистальное русло проходит 30–40 мл крови в 1 мин. Применение этих катетеров показано в тех случаях, когда больной не может перенести длительного раздувания баллона вследствие развивающейся ишемии миокарда. Перфузионные катетеры применяют при тяжелой стенокардии, сниженной функции ЛЖ или в тех случаях, когда морфология атеросклеротического повреждения артерии требует пролонгированного раздувания баллона (кальцинированные или фиброматозные бляшки). Применение перфузионных катетеров ограничивает их сравнительно большая толщина, которая затрудняет или делает невозможным их продвижение по извитым участкам артерии.
Характеристики баллонов-катетеров и выбор баллонных систем для ЧТКА
Баллоны в баллонах-катетерах всех систем изготовлены из материала, который в большей или меньшей степени устойчив к нагнетанию давления. По этой характеристике все баллоны делятся на «податливые» и «неподатливые». Раздувание податливых баллонов выше номинального («паспортного») давления приводит к увеличению диаметра раздутого баллона приблизительно на 10–20% сверх установленного. Неподатливые баллоны сохраняют свой размер даже в тех случаях, когда давление в них превышает номинальное на несколько атмосфер (рис. 1.29).
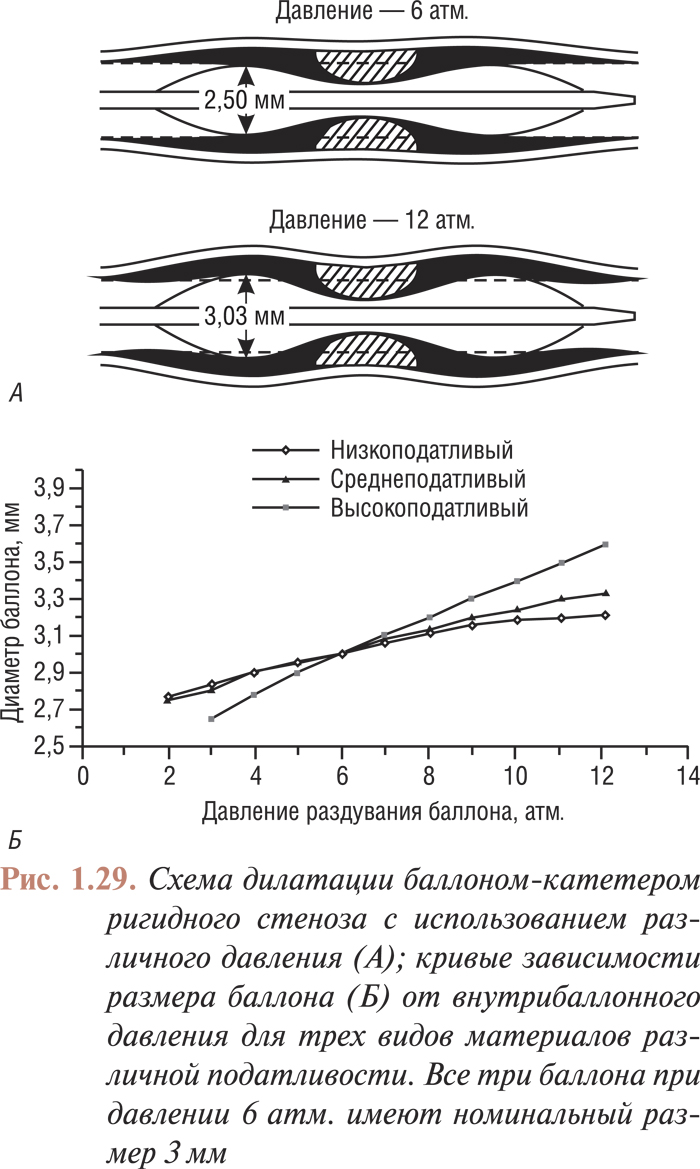
Баллоны, изготовленные из различных материалов, обладают преимуществами и недостатками. Податливые баллоны дешевле; это позволяет использовать несколько баллонов-катетеров при проведении одной операции, однако податливые баллоны при раздуваниях (особенно повторных) под давлением выше номинального превышают заданный размер, что приводит к диссекции интимы. В тех случаях, когда такие баллоны используют для ЧТКА при множественных повреждениях коронарных артерий, ангиопластику необходимо выполнять сначала в сосудах малого диаметра.
Важными характеристиками баллонов-катетеров является их способность легко продвигаться по руслу к месту повреждения коронарных артерий (trackability) и передавать прилагаемую хирургом силу по катетеру к баллону (pushability). Эти характеристики зависят от свойств материала, из которого изготовлен баллон-катетер.
Способность катетера легко продвигаться внутри артерии — функция как баллона-катетера, так и проводника. Тяжелое продвижение баллона внутри сосуда, несмотря на прилагаемые усилия, может быть вызвано трением баллона-катетера либо о проводник, либо о проводниковый катетер, либо о стенку сосуда. Хотя баллоны-катетеры и маркируются по этой характеристике, ее трудно оценить объективно.
Также трудно оценить объективно способность катетера передавать прилагаемую хирургом силу. В большинстве стандартных систем этот показатель приблизительно одинаков.
Большинство баллонов-катетеров пропускают внутрикоронарные проводники толщиной 0,010–0,014 дюйма. Однако при отборе баллона-катетера для ЧТКА необходимо учитывать, что в определенных случаях (например при субтотальных стенозах) могут понадобиться жесткие внутрикоронарные проводники размером 0,018 дюйма. В таких случаях для ангиопластики необходимо выбирать системы «over-the-wire», проводниковый просвет которых способен пропускать подобные проводники.
При выборе диаметра баллона для ЧТКА исходят из того, что соотношение диаметра раздутого баллона и диаметра дилатируемой артерии должно быть 1:1. Соотношение размеров баллона и просвета артерии больше 1,2:1,0 может привести к развитию осложнений. Диаметр просвета артерии определяют по сегменту, который следует за пораженным участком. Для определения диаметра просвета артерии используют известный диаметр проводникового катетера (7 F — 2,31 мм, 8 F — 2,64 мм, 9 F — 2,97 мм, 11 F — 3,63 мм). Простое визуальное определение необходимого размера баллона менее точно, однако большинство хирургов применяют этот метод.
Еще одним важным параметром является длина баллона, которая должна максимально соответствовать длине пораженного сегмента.
При выборе баллона для ангиопластики особое внимание уделяют его профилю (размеру баллона в сжатом состоянии). Низкопрофильные баллоны лучше проходят через извитые и измененные сегменты коронарных артерий. В большинстве современных систем для ЧТКА профиль баллона составляет <1 мм (0,033–0,035 дюйма).
Внутрикоронарные проводники
Внутрикоронарный проводник — управляемая металлическая проволока малого диаметра (0,010–0,018 дюйма), которая проникает по коронарным артериям и их ветвям к атеросклеротическому повреждению и проходит через это повреждение в дистальный отдел пораженного сосуда. Способность внутрикоронарных проводников проникать в различные ветви коронарного русла во многом зависит от вариантов конфигурации их верхушки, которых существует большое количество (табл. 1.10). На характеристики проводника также оказывает влияние конструкция их центрального стержня (рис. 1.30). Более короткое расстояние от дистального конца стержня к верхушке делают проводник более жестким и улучшают возможности управления проводником, однако при большем расстоянии от дистального конца стержня к верхушке увеличивается гибкость проводника, что улучшает его проходимость в извитых и пораженных сегментах коронарных артерий.
Таблица 1.10
Верхушки внутрикоронарных проводников для ЧТКА
| Количество изгибов | Параметры верхушки | Локализация поражения | Характеристика коронарной анатомии | Применение |
| Один изгиб | Изгиб малый или средний.
Диаметр изгиба меньше диаметра ствола ЛКА (подобен J) |
Проксимальные отделы ПМЖВ*, ОВ и ПКА | Сосуды прямые, угол отхождения от ствола небольшой, диаметры ствола и отходящих артерий практически не отличаются | Максимально доступные поражения |
| Два
изгиба |
Проксимальный и дистальный, изгибы малые или средние.
Общий диаметр кривизны приблизительно равен диаметру ствола. Диаметр дистального изгиба равен диаметру ветви |
Проксимальный и средний отделы ПМЖВ, ОВ и ПКА | Извитость сосудов средняя, ветви отходят под малым или средним углом, различие диаметра ствола и отходящих ветвей небольшое | Проксимальный угол улучшает доступ к боковым ветвям крупных сосудов. Дистальный угол облегчает доступ к ветвям малого диаметра |
| Малый дистальный изгиб.
Проксимальный изгиб более крутой |
Проксимальный средний и дистальный отделы ПМЖВ, ОВ и ПКА | Плотные стенозы. Наличие трифуркации или двух ветвей, отходящих в разных направлениях (например септальная и диагональная ветви ПМЖВ) | Малый диаметр дистального изгиба стремится к локализации в центре просвета, не позволяя проводнику попадать в боковые ветви | |
| Крутой дистальный изгиб.
Короткое плечо и малое расстояние между изгибами; проксимальный изгиб такой же |
Дистальные сосуды; преимущественно ветвь тупого края | Сосуды, имеющие выраженные изгибы. Различие диаметров донорского сосуда и ветвей значительное (ветвь отходит под острым углом и изгибом наподобие латинской буквы h) | Крутой дистальный угол позволяет проходить в боковые ветви под нужным углом и по изгибам артерии | |
| Длинное проксимальное плечо | В случаях, когда ствол ЛКА имеет большой диаметр, а угол отхождения ветвей (особенно ОВ) значительный | Длинное проксимальное плечо увеличивает диаметр кривизны, улучшая доступ в крупные ветви | ||
| Очень длинное проксимальное плечо (дистальное — короткое) | Тяжелые стенозы проксимальных отделов ОВ (реже ПМЖВ) | Угол отхождения сосуда от ствола около 90° с последующим изгибом. Стеноз сложный, локализован сразу за изгибом | Очень длинное проксимальное плечо делает дистальный изгиб независимым, что улучшает прохождение места повреждения | |
| Оба плеча длинные | Крупные некоронарные артерии (аорта, подвздошные артерии) | Оба больших плеча необходимы для прохождения по эксцентрическому просвету, часто — в зоне аневризмы | ||
| Тройной или множественный изгиб | Изгибы средние: дистальное плечо короткое, общий диаметр большой | Средний и дистальный отделы всех крупных сосудов | Различие в диаметрах между стволом ЛКА и ветвями очень выражено; крутое отхождение ОВ или ПМЖВ | Переход от длинного к короткому плечу плавный; прохождение проводника по изогнутому проксимальному сегменту артерии гладкое |
*Здесь и далее в таблицах и рисунках: передняя межжелудочковая ветвь.
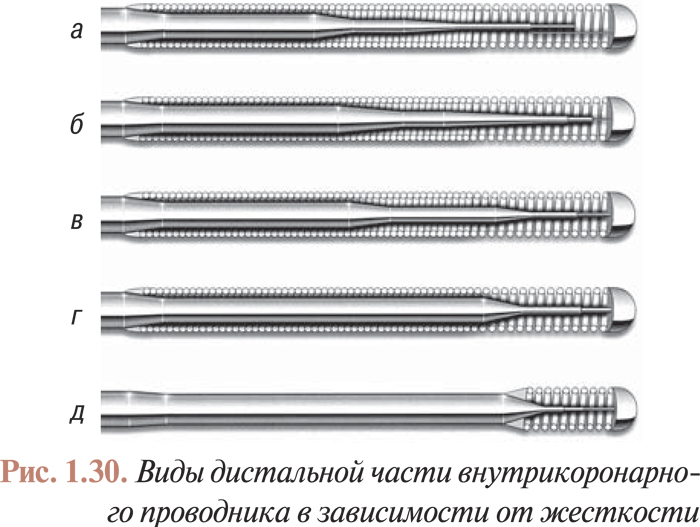
Длина проводника может быть стандартной (140 см) и увеличенной до 280–300 см. Длинные проводники имеют такое же строение, как и стандартные. Их используют для смены баллонов-катетеров системы «over-the-wire» в тех случаях, когда дистальный конец проводника должен оставаться за местом повреждения артерии. Другим способом смены такого катетера является присоединение к начальному проводнику другой проволоки длиной 125–140 см. Катетеры системы «monorail» предполагают их замену с помощью внутрикоронарных проводников обычной длины.
Характеристики внутрикоронарных проводников
При выборе внутрикоронарных проводников обращают внимание на такие характеристики, как жесткость, управляемость и гибкость.
Жесткость. Выбор проводников определенной жесткости зависит от цели, которую преследует хирург. Более мягкие проводники являются более безопасными и легко проходят через извитые участки. Более жесткие проводники лучше поддаются контролю при их вращении и легче проходят через тяжелые стенозы и окклюзии. Сверхжесткие проводники обеспечивают наилучшую внутрикоронарную поддержку при установке стентов.
Управляемость. Движение верхушки проводника, адекватное манипуляциям, выполняемым хирургом, является одной из наиболее важных характеристик проводника.
Гибкость внутрикоронарного проводника зависит от расстояния между его верхушкой и центральным стержнем. От этой характеристики зависит вероятность травмирования стенки сосуда при пересечении проводником места повреждения.
Ясно, что три перечисленные характеристики проводников взаимозависимы. Так, при большей жесткости улучшается управляемость верхушкой проводника, однако теряется ее гибкость, и наоборот.
Еще одной важной характеристикой проводников является рентгеноконтрастность его дистальной части. Рентгеноконтрастное покрытие дистальной части проводника позволяет наблюдать за ее продвижением в коронарном русле, однако чрезмерная контрастность проводника может привести к «скрадыванию» важных ангиографических деталей повреждения артерии, например небольшой диссекции.
Дополнительный инструментарий, используемый при ЧТКА
Y-образные коннекторы. Для того чтобы в проводниковый катетер можно было ввести контраст в то время, когда в нем находится дилатационная система, к проксимальному отверстию проводникового катетера подсоединяют Y-образный коннектор. Один из отделов Y-образного коннектора снабжен ротационным адаптером (Tuohy — Borst). Y-образный коннектор — акцессуарный инструмент, позволяющий свести к минимуму кровотечение, когда дилатационная система находится в проводниковом катетере. Y-образный коннектор позволяет также вводить контрастное вещество и измерять давление в артерии независимо от того, находится баллонная система в проводниковом катетере, или нет. Если Y-образный коннектор присоединить к баллону-катетеру «over-the-wire», можно измерять давление в коронарной артерии дистальнее места ее повреждения.
Шприцы для раздувания баллона. Для раздувания баллона существуют одноразовые шприцы, с помощью которых в баллон под давлением вводят жидкость (обычно — смесь контрастного вещества с 0,9% раствором натрия хлорида). Прибор для измерения давления, имеющийся в шприце, позволяет точно фиксировать давление в раздутом баллоне. Обычно баллон раздувается под давлением 4–12 атм. до полного исчезновения «зубца», который виден в начале раздувания баллона, если последний установлен правильно. Однако некоторые атеросклеротические повреждения содержат кальцификаты или состоят преимущественно из фиброзной ткани, что иногда требует раздувания баллона под давлением выше 14 атм. Перераздувание баллона может привести к диссекции сосуда или разрыву баллона.
Приспособление для управления проводником. На проксимальный отдел внутрикоронарного проводника, который располагается вне баллона-катетера, насаживают и фиксируют небольшой цилиндрический зажим, позволяющий хирургу манипулировать проводником.
Интродюсор для введения внутрикоронарного проводника в просвет баллона-катетера. Этот инструмент представляет собой очень тонкую трубку, похожую на иглу, с суживающимся коническим дистальным отделом. По этой трубке внутрикоронарный проводник вводят в проводниковый просвет баллона-катетера или Y-образный коннектор.
Коронарные стенты
За последние два десятилетия ЧТКА прочно заняла одно из основных мест среди методов лечения больных с коронарным атеросклерозом. Однако имеются данные, что баллонная дилатация разрушенной атеросклеротической бляшки с сопутствующим пристеночным тромбообразованием в 30–40% случаев осложняется острой тромботической окклюзией сосуда; всего же тромботические осложнения выявляют в 2–12% случаев от общего количества коронарных ангиопластик. Эти осложнения существенно ограничивают возможности ЧТКА. Кроме того, несмотря на постоянное совершенствование инструментария и методов медикаментозного ведения больных, которым выполняют ЧТКА, частота рестенозов практически остается неизменной и составляет приблизительно 30% общего количества выполняемых баллонных ангиопластик и значительно повышается в случае дилатации хронической окклюзии коронарных артерий и атеросклеротической деструкции венозных шунтов. Для уменьшения количества неблагоприятных исходов ЧТКА, а также для обеспечения длительной стабильной функции коронарных артерий после проведения баллонной ангиопластики разработана методика имплантации стентов. Коронарный стент представляет собой трубчатый металлический каркас сосудистой стенки, который имплантируют внутрипросветно в место атеросклеротического повреждения коронарной артерии.
Первые экспериментальные работы по имплантации внутрисосудистых протезов проведены еще в конце 60-х годов ХХ ст. В 1969 г. опубликованы результаты имплантации стентов в периферические (бедренную и подколенную) артерии собак, выполненные Ch. Dotter. При проведении этого исследования применяли как пластиковые трубки, так и спиралевидные протезы из нержавеющей стали. Тромботическая окклюзия всех пластиковых стентов происходила в течение первых 24 ч. Имплантация спиралевидных протезов из нержавеющей стали способствовала частичному снижению риска тромбообразования в стентированных сегментах. Однако от первых публикаций работ Dotter до внедрения стентов в кардиологическую практику прошло 18 лет. Такой большой срок потребовался для проведения значительного количества экспериментальных исследований, в которых выбирали материалы, пригодные для имплантации в сосудистое русло, а также разработки оптимальной конструкции стентов. Стенты должны быть достаточно жесткими для того, чтобы оказывать сопротивление силе сжатия стенки артерии, и в то же время достаточно гибкими для того, чтобы их можно было имплантировать в извитые сегменты коронарных артерий или же провести через такие сегменты. Эти свойства обеспечиваются конструкцией стентов и характеристиками материала, из которого они изготовлены. Кроме того, необходимо, чтобы стент был нетромбогенным и устойчивым к коррозии.
В настоящее время материалы, из которых производят стенты, имплантируемые в коронарные артерии, в основном соответствуют вышеперечисленным требованиям. Большинство стентов изготавливают из различных сплавов нержавеющей стали (Wallstent, AVE Microstent, стенты Gianturco — Roubin, Palmaz — Schatz, ACS Multilink, NIR); применяют также и другие металлы: тантал (стенты Wiktor, Cordis, Strecker, Mayo), нитинол — сплав никеля и титана (стенты Angiomed-USCI, SCIMED, INSTENT CardioCoil). Проводятся исследования по использованию полимеров (biodegradable stents). Преимущества и недостатки каждого из перечисленных материалов будут рассмотрены ниже.
Коронарные стенты изготавливают либо в виде трубок, имеющих щелеобразные прорези (стенты Palmaz — Schatz, ACS Multilink, BeStent, NIR, SCIMED), сетчатых трубок (Wallstent), либо в виде кольцеобразных проволочных конструкций (стенты Gianturco — Roubin, Wiktor, Cordis, Strecker, INSTENT CardioCoil). Каждая конструкция имеет свои преимущества и недостатки: трубчатые стенты не обладают такой продольной гибкостью, как стенты, имеющие кольцеобразную проволочную конструкцию, однако они способны оказать большее сопротивление радиальной силе, исходящей от стенки артерии. С этой целью конструкция кольцеобразных проволочных стентов была усовершенствована: разработана конструкция проволочных стентов с соединенными между собой замкнутыми кольцами, имеющими зигзагообразный или синусоидообразный профиль (стенты Wiktor, Strecker, Cordis). Эти стенты, сохраняя гибкость, характерную для проволочных конструкций, могут оказывать достаточное сопротивление радиальной силе сосудистой стенки. Проволочные стенты могут быть изготовлены из цельной проволоки или же из нескольких проволок, сплетенных между собой (Wallstent, стент Angiomed-USCI).
По способу имплантации различают саморасширяющиеся стенты (Wallstent, INSTENT CardioCoil, Angiomed-USCI) и стенты, расширяемые с помощью баллона (стенты Palmaz — Schatz, Gianturco — Roubin, Cordis, Wiktor, ACS Multilink и др.). Саморасширяющиеся стенты подводят к месту поражения коронарной артерии с помощью специальных катетерных систем доставки, имеющих механизм фиксации стента в сжатом состоянии (оболочку). Стент после его доставки к месту поражения коронарной артерии высвобождается из системы доставки и самостоятельно расширяется; система доставки удаляется из коронарного русла. Стенты, расширяемые с помощью баллона, доставляют к месту поражения коронарной артерии в сжатом состоянии на баллоне-катетере и имплантируют после раздувания баллона. Для имплантации стентов как первого, так и второго типа требуется предварительная баллонная дилатация пораженного сегмента коронарной артерии (предилатация). Эта процедура позволяет разрушить атеросклеротические бляшки, имеющие жесткую фиброзную структуру; для этого при необходимости можно применить высокое давление при раздувании баллона. Полного разрушения подобных бляшек при имплантации стента без предилатации может не произойти. Кроме того, предилатация позволяет создать канал, по которому стент будет подведен к месту повреждения коронарной артерии без приложения чрезмерных усилий, что может стать причиной деформации стента.
Морфологические изменения в стенке сосуда после имплантации стентов
Реакция сосудистой стенки на имплантацию стентов изучена в нескольких экспериментальных исследованиях. Стенты диаметром от 3 до 6 мм и длиной от 15 до 50 мм, изготовленные из разных материалов и имеющие различные конструкции, имплантировали различным животным (кроликам, собакам, овцам) в периферические и коронарные сосуды, после чего проводили гистологическое исследование стентированных сегментов в разные периоды после имплантации. Исследования продемонстрировали отсутствие воспалительной и некротической реакции со стороны сосудистой стенки, однако отмечено некоторое истончение и незначительно выраженный фиброз медиальной стенки сосуда. Внедрение стента в сосудистую стенку и процесс эндотелизации происходят в течение 3–8 нед. Уже в течение первых нескольких часов после имплантации поверхность стента покрывается тонким слоем фибрина и тромбоцитов, что создает условия для дальнейшей эндотелизации. Стент постепенно врастает в интиму, его поверхность покрывается неоэндотелием. Количество времени, которое требуется для этого процесса, зависит от типа стента и вида экспериментальных животных. Palmaz и соавторы в эксперименте на кроликах отмечали наличие незрелого эндотелия к концу 1-й недели; завершение эндотелизации наступало к концу 8-й недели. У собак те же стенты покрывались эндотелием в течение 3 нед. По данным электронной микроскопии установлено, что структура эндотелия, покрывающего стент, ничем не отличается от структуры эндотелия нативной сосудистой стенки. Есть некоторые доказательства того, что степень эндотелизации стента находится в обратно пропорциональной зависимости от толщины стенки самого стента. Так, толщина эндотелиального слоя, покрывавшего стенты Palmaz — Schatz, составила около 90 мкм, в то время как толщина эндотелия над стентами Gianturco — Roubin и Wallstent — 150–350 мкм, однако прямо сравнивать данные этих исследований нельзя из-за различий в технологиях, применяемых при их выполнении. Исследования на животных показали, что устья боковых ветвей, отходящих от сегмента артерии, подвергшегося стентированию, остаются открытыми, эти сосуды функционируют нормально.
В одном из ранних исследований по имплантации стентов в коронарные и периферические артерии собак выявлено, что эндоваскулярные стенты обладают низкой тромбогенностью. Несмотря на то что антикоагулянты и антитромботические препараты экспериментальным животным в этом исследовании не вводили, симптомов нарушения кровообращения в русле стентированных артерий у всех собак не отмечено вплоть до окончания эксперимента (9 мес). При исследовании сосудов этих животных наличие необструктивного пристеночного тромба выявили лишь в 1 случае; в остальных артериальных сегментах, подвергшихся стентированию, признаки тромбообразования не выявлены.
В экспериментальных исследованиях при имплантации стентов подбирали различные антикоагулянтные и антитромбоцитарные препараты. Самый низкий уровень тромбогенности определен у животных, которым вводили гепарин, ацетилсалициловую кислоту, дипиридамол и низкомолекулярные декстраны, по сравнению с показателем у контрольных животных, которым медикаментозное лечение не проводили, а также у животных, которые получали только ацетилсалициловую кислоту, гепарин и дипиридамол.
Таким образом, в экспериментальных исследованиях установлено, что стенты могут быть с успехом имплантированы как в периферические, так и коронарные артерии. Выявлено, что стенты обладают низкой тромбогенностью, поэтому острая тромботическая окклюзия в стентированных артериальных сегментах не является серьезной проблемой. Результаты экспериментальных исследований послужили основанием для применения стентов в кардиологической практике.
Саморасширяющийся сетчатый стент Wallstent Medinvent
В 1986 г. в коронарную артерию человека впервые имплантирован саморасширяющийся сетчатый стент Wallstent («Medinvent SA», Швейцария). Этот стент является многоволоконной конструкцией: состоит из 20 металлических прядей, сплетенных в двойную спираль (сеть), каждая из которых диаметром 0,06–0,09 мм (рис. 1.31). Первоначально Wallstent производили из хирургической нержавеющей стали Mediloy («Medinvent»); в настоящее время существуют конструкции Wallstant, изготовленные из неферромагнитного сплава на основе кобальта. Масса такого стента диаметром 5 мм составляла 1,4 мг на 1 мм его длины. Для имплантации в коронарные артерии и венозные шунты применяют стенты длиной от 15 до 30 мм.

Wallstent поставляется в сборке вместе с катетерной системой доставки стента к месту поражения коронарного сосуда. Стент фиксирован в дистальном отделе системы доставки в вытянутом по длине и сжатом по диаметру состоянии и покрыт двухслойной оболочкой (мембраной). Катетерная система доставки стента имеет два просвета: один (открытый) служит для проведения системы по коронарному проводнику, другой (закрытый) соединяется с пространством между наружным и внутренним слоями мембраны. Во время подготовки стента к имплантации пространство между наружным и внутренним слоями мембраны заполняют контрастной средой под давлением 3 атм.; при этом воздух удаляют через микроотверстия, имеющиеся в дистальном отделе наружной мембраны. После наполнения межмембранного пространства контрастным веществом кран этого просвета закрывают и открытый просвет системы промывают 0,9% раствором натрия хлорида. При промывании этого просвета происходит орошение стента через боковые отверстия в стенке, подлежащей к стенту. После установки стента в необходимом сегменте артерии оболочку, покрывающую стент, удаляют, происходит самопроизвольное расширение стента с одновременным уменьшением его длины. Крупные боковые ветви, отходящие от основной артерии, чаще сохраняют свою проходимость (рис. 1.32). Однако первый опыт имплантации сетчатых стентов свидетельствует, что оптимальные результаты можно получить при стентировании венозных шунтов.
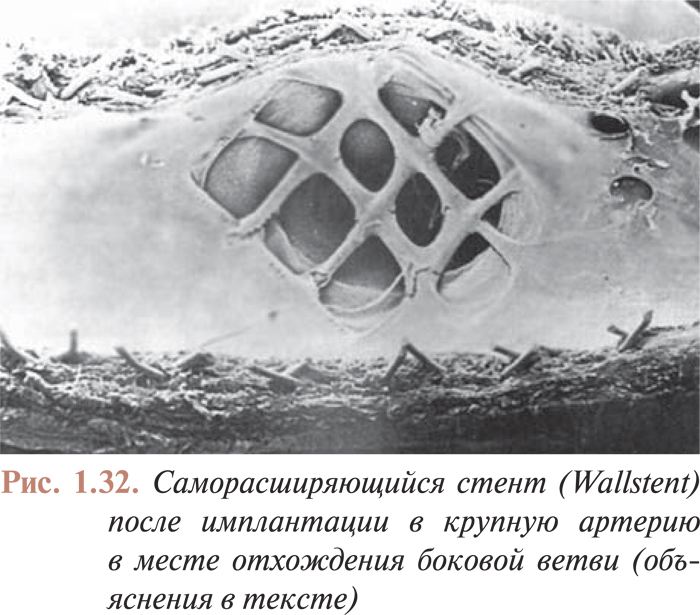
Современные модификации Wallstent имеют угол сплетения, равный 110–130°, что снижает радиальное давление стенки сосуда на 30% и позволяет уменьшить количество металла на единицу длины стента на 7%. Укорочение современных конструкций Wallstent после их расширения значительно меньше по сравнению с классическими конструкциями. Применение полимерных технологий при изготовлении мембран, покрывающих стент, позволило создать низкопрофильные оболочки. Диаметр сжатого и покрытого оболочкой Wallstent составляет 1,57 мм. Перед имплантацией Wallstent выполняют стандартную баллонную ангиопластику повреждения коронарной артерии с использованием проводниковых катетеров 8 F и длинных трехметровых внутрикоронарных проводников (или проводников magnetic). Диаметр стента в расширенном состоянии должен превышать диаметр неповрежденного сегмента артерии, прилегающего к поврежденному сегменту, на 10–20%. Это различие в диаметре способствует более плотному контакту стента с сосудистой стенкой и исключает самопроизвольную миграцию стента. Длина стента должна превышать длину пораженного сегмента: стент должен полностью покрывать участок диссекции. После подготовки, техника которой описана выше, стент по внутрикоронарному проводнику подводят к месту деструкции артерии, после чего удаляют оболочку. В момент начала удаления оболочки и расширения дистального участка стента до того, как произошло соприкосновение стента со стенкой сосуда, хирург должен визуально убедиться в том, что стент установлен в правильной позиции: в этот момент положение стента еще поддается коррекции. Для сведения травмы к минимуму нельзя предпринимать попыток к изменению положения стента после того, как его дистальный конец раскрылся и вступил в контакт со стенкой. Системы нового образца позволяют продвигать оболочку в прежнюю позицию по частично раскрытому стенту, что дает возможность переместить его в другую позицию. Убедившись в том, что стент расположен правильно, производят раздувание просвета между наружной и внутренней мембраной под давлением 4 атм. и плавно извлекают оболочку под рентгенологическим контролем; по мере удаления оболочки стент самопроизвольно расширяется и имплантируется в стенку пораженного сегмента артерии. В конце процедуры к месту имплантации стента по проводнику вводят баллон-катетер и раздувают его, что позволяет расширить стент до заданного диаметра и внедрить металлический каркас в сосудистую стенку (иногда эту процедуру называют «Swiss kiss»).
Саморасширяющиеся сетчатые стенты типа Wallstent являются достаточно гибкими, чтобы проникать в извитые участки артерий и имплантироваться в такие участки. Эти стенты легко визуализируются благодаря мембране, наполняемой контрастным веществом. Эластичные силы стента после его имплантации создают достаточное сопротивление контрактильной силе сосудистой стенки и строго сохраняют заданный диаметр просвета. Проволочная сетчатая трубка является геометрически стабильной конструкцией: перекосов и миграции при установке таких стентов не отмечено — они быстро расширяются до определенного уровня и адаптируются к сегментам сосудов с уменьшающимся диаметром. Таким образом, саморасширяющиеся сетчатые стенты сочетают положительные качества трубчатых и кольцеобразных стентов, хотя являются менее жесткими, чем первые, и менее гибкими, чем вторые.
Имплантацию первых саморасширяющихся стентов в коронарные артерии выполняли в ургентном порядке по поводу острых тромботических осложнений ЧТКА как альтернативу ургентным шунтирующим операциям. Опыт этого исследования показал, что ургентная имплантация стентов в таких ситуациях является более перспективной операцией, чем ургентная операция АКШ: ни один из 17 случаев ургентной имплантации стентов не завершился острой окклюзией, осложнившейся острым ИМ или смертью больного, в то время как внутригоспитальная смертность после ургентной АКШ, выполняемой по поводу острой окклюзии, вызванной ЧТКА, составляет 15%, а частота ИМ в этих случаях колеблется от 31 до 71%. Позже было опубликовано сообщение об имплантации саморасширяющихся сетчатых стентов 38 больным с острой тромботической окклюзией коронарных артерий, развившейся после ЧТКА. Острый или подострый тромбоз стентированных сегментов отмечен у 5 больных, в результате чего наступила смерть 1 больного, еще у 1 диагностирован Q-ИМ; у 2 больных выполняли АКШ. Частота осложнений после ургентного стентирования, выполняемого по поводу острых окклюзий, возникших в результате осложнений ЧТКА, была значительно ниже, чем при ургентных АКШ. У 34 больных этой группы через 5 и 23 мес выполняли контрольную коронарографию, при которой у 4 из них выявлены рестенозы в области имплантации. Таким образом, частота рестенозов при ургентной имплантации стентов значительно ниже таковой после плановых и ургентных ЧТКА. В настоящее время считается, что острая окклюзия коронарных артерий является наиболее документированным показанием к имплантации стентов. Первые плановые имплантации саморасширяющихся сетчатых стентов были проведены в Лозанне по поводу рестенозов коронарных артерий, развившихся после ЧТКА. В этом исследовании у 50 больных с рестенозами после ЧТКА проведена успешная имплантация стентов. В госпитальный период значительные осложнения (Q—ИМ, ургентное АКШ, смерть) развились у 3 больных (1 больной умер во время ургентного АКШ вследствие хирургического осложнения — нераспознанной тампонады сердца). Контрольную коронарографию выполняли у 34 больных этой группы в течение 8 мес наблюдения. Рестенозы в стентированных сегментах выявлены у 4 больных; окклюзия в месте имплантации стента — у 3. В 1991 г. опубликованы результаты многоцентрового исследования имплантации саморасширяющихся стентов. Эти результаты нельзя назвать оптимальными, однако при их оценке необходимо учитывать, что это были первые клинические исследования по имплантации стентов, поэтому показания, техника имплантации, методы послеоперационного ведения больных еще не были окончательно определены.
Первые саморасширяющиеся стенты имплантировали также в стенозированные венозные шунты; немедленные и отсроченные результаты таких имплантаций оказались лучше, чем результаты имплантации стентов в нативные коронарные артерии. Авторы исследований считают, что это связано с тем, что венозные шунты имеют больший диаметр по сравнению с коронарными артериями и, следовательно, в венозные шунты требуются стенты большего диаметра (в исследовании Urban и соавторов средний диаметр стентов, имплантированных в венозные шунты, составил 4,7 мм). Возможно, важную роль играет также отсутствие у венозных шунтов вазомоторного тонуса. Сочетание незначительного количества осложнений и рестенозов при имплантации стентов в венозные шунты свидетельствует о целесообразности использования при этом саморасширяющихся сетчатых стентов.
Таким образом, показаниями к имплантации Wallstent являются острые тромбозы коронарных артерий и рестенозы, развивающиеся после ЧТКА, а также деструкции венозных шунтов.
В настоящее время Wallstent и другие стенты имплантируют с целью профилактики острых тромбозов и рестенозов коронарных артерий во время первичных эндоваскулярных вмешательств, проводимых при острых и хронических клинических формах коронарного атеросклероза. На основании экспериментального и клинического опыта авторы Wallstent определили противопоказания к его имплантации:
- Выраженная воронкообразность сегмента (вследствие цилиндрической формы стентов, изготавливающихся в настоящее время)
- Очень сильный изгиб пораженного сегмента
- Плохой кровоток в пораженном сегменте артерии после имплантации стента вследствие недостаточного дистального оттока или выраженной коллатерализации
- Трудности, возникающие при соблюдении антитромбоцитарного и антикоагулянтного режимов.
Отмечено также, что причиной острого тромбоза являются стенты малого диаметра, поэтому авторы не рекомендуют имплантировать саморасширяющиеся сетчатые стенты в артерии диаметром <3 мм.
Как отмечалось выше, саморасширяющиеся сетчатые стенты стали первыми стентами, имплантированными в сосудистое русло человека. Со времени первых имплантаций разработано большое количество других модификаций стентов, что вызвало уменьшение количества имплантаций Wallstent, однако интенсивные работы по усовершенствованию саморасширяющихся стентов продолжаются. Для производства саморасширяющихся стентов в настоящее время используется нитинол (сплав никеля и титана) — металл, обладающий памятью. Из этого материала изготовлены саморасширяющиеся стенты «Angiomed-USCI», «INSTENT CardioCoil». He все саморасширяющиеся стенты, изготовленные из нитинола, имеют многоволоконную сетчатую конструкцию. Некоторые из них («INSTENT») изготавливают в виде простой одноволоконной нитиноловой спирали. Внедрение нитиноловых стентов в настоящее время находится на стадии клинического тестирования.
Трубчатый стент Palmaz — Schatz
Одними из первых баллон-расширяемых стентов, которые начали применяться в клинической практике, являются стенты Palmaz — Schatz. Работы по конструированию первых баллон-расширяемых стентов начаты в 1981 г. J. Palmaz. В 1986 г. появилась публикация, в которой сообщалось об опыте имплантации больших (6; 8 и 10 мм в диаметре) внутрисосудистых протезов в подвздошные артерии собак. Несмотря на то что в этом исследовании гепарин животным не назначали, просвет подвздошных артерий в 10 случаях из 11 оставался открытым и лишь в одном случае развилась острая тромботическая окклюзия сосуда. Эндотелизация стентов завершалась к 3-й неделе. Такие же результаты получены в экспериментах с имплантацией стентов в атеросклеротически измененную аорту кроликов. Работы по имплантации стентов в коронарные артерии собак выполнены совместно с R. Schatz. При этом применяли стандартные баллоны для коронарной ангиопластики. Диаметр стентов составлял 3–3,5 мм. Первые опыты показали, что стент является слишком ригидным, чтобы проходить через извитые сегменты артерий или устанавливаться в них; такой стент был пригоден только для имплантации в проксимальный отдел правой коронарной артерии. Для создания большей гибкости стент Palmaz длиной 15 мм был разделен на два трубчатых сегмента по 7 мм каждый, соединенных между собой гибкой металлической распоркой длиной 1 мм («сустав» стента). В настоящее время стент в сжатом состоянии представляет собой две трубки с диаметром 1,6 мм и длиной 7 мм каждая, имеющих большое количество щелеобразных прорезей длиной 3,5 мм и соединенных между собой гибкой тонкой проволокой длиной 1 мм. В расширенном состоянии стент по конфигурации напоминает кристаллическую структуру алмаза (рис. 1.33). Современная система доставки стента включает стент Palmaz — Schatz, расположенный на гибком полиэтиленовом баллоне, имеющем рентгеноконтрастные отметки для идентификации проксимальной и дистальной точек стента. Система доставки снабжена также оболочкой, покрывает всю систему (в том числе стент) и обеспечивает сохранность стента во время доставки к поврежденному сегменту коронарной артерии. Дистальная точка оболочки также имеет рентгеноконтрастный маркер. Стенты Palmaz — Schatz изготавливают из нержавеющей стали.
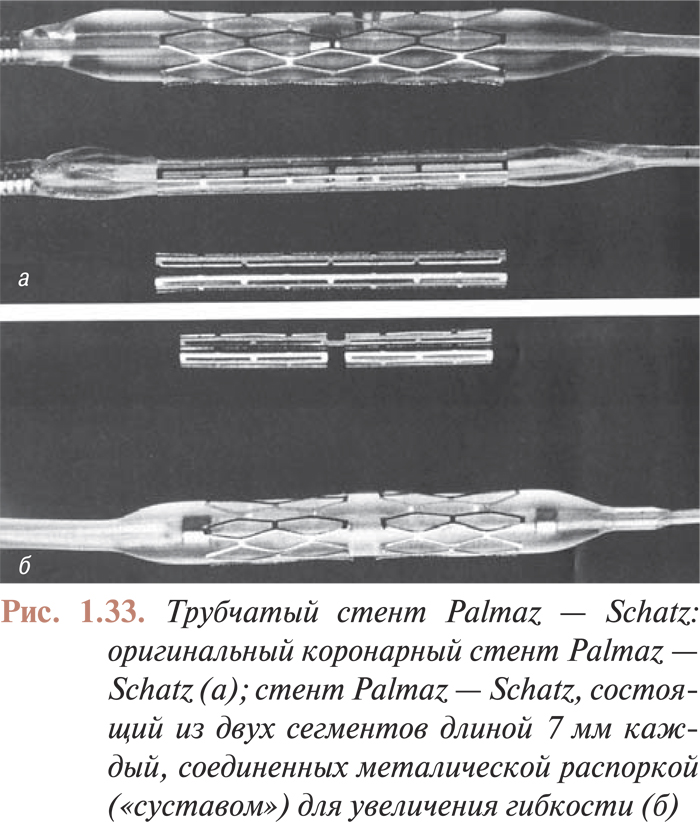
Для имплантации стентов Palmaz — Schatz существуют некоторые анатомические ограничения:
- наличие атеросклеротического повреждения в артериальном сегменте, диаметр которого <3 мм;
- наличие повреждения, длина которого >10 мм;
- наличие больших артериальных ветвей, отходящих от пораженного сегмента.
При имплантации стентов Palmaz — Schatz применяют проводниковые катетеры 8 F с внутренним диаметром 0,079 или 0,084 дюйма. Проводниковые катетеры с внутренним диаметром 0,084 дюйма предпочтительнее, поскольку введение контрастного вещества, необходимое при имплантации стента, по такому проводнику производится легче. После катетеризации устья коронарной артерии выполняют предилатацию стеноза баллоном диаметром 2,5 мм; при этом необходимо использовать коронарные проводники длиной 3 м для замены баллона-катетера на систему доставки с фиксированным на ней стентом. По созданному каналу к месту повреждения артерии подводят стент. Решающим моментом является тщательный выбор положения стента в месте повреждения артерии. Для этого при выборе позиции следует контрастировать русло артерии и, ориентируясь на рентгеноконтрастные маркеры, установить стент так, чтобы центр стеноза совпал с центром стента. Убедившись, что это условие соблюдено, оболочку, покрывающую стент, удаляют и производят раздувание баллона, на котором расположен стент. Поскольку баллон, применяемый в системе доставки, не является достаточно прочным, то полного расширения стента при его раздувании не происходит, поэтому требуется дополнительное расширение стента другим баллоном.
Рестенозы после имплантации стентов Palmaz — Schatz
Имплантацию первых стентов Palmaz — Schatz выполняли в плановом порядке у больных со стабильной стенокардией. Результаты лечения первых 213 больных опубликованы в 1991 г. Имплантация 1 стента выполнена в 88% случаев; остальным пациентам имплантированы >2 стента, поскольку длина повреждений у этих больных превышала 15 мм. У пациентов, которым имплантировали 1 стент, рестенозы отмечены в 20% случаев. Количество рестенозов увеличилось до 50% у больных, которым имплантировано несколько стентов. Fajadet и соавторы сообщили об опыте имплантации стентов Palmaz — Schatz у 79 больных. Общее число рестенозов у этих больных в течение 6-месячного наблюдения составило 15,2%. В 1992 г. появилось сообщение о первичных результатах многоцентрового исследования, в которое вошли 206 больных, 97% из которых находились под наблюдением 6 мес. Рестенозы в популяции больных высокого риска (имплантация 2 стентов или имплантация стентов при рестенозе) наблюдались в 36% случаев; при имплантации единичных стентов при первичных стенозах частота рестенозов составила 16% (если после имплантации стента остаточный стеноз не наблюдался, то в этих случаях частота рестенозов составляла 6%). Сходные данные получены в исследовании Savage и соавторов: имплантация стентов при первичных стенозах осложнилась рестенозом в 14% случаев, в то время как при имплантации стентов при рестенозе повторный стеноз отмечен у 38% больных. В многоцентровом исследовании, проводившемся в Бельгии и Нидерландах (BENESTENT), сравнивали отдаленные результаты ЧТКА (258 пациентов) и имплантации стентов Palmaz — Schatz (262 пациента) при стабильной стенокардии и первичных повреждениях коронарных артерий. Получены отдаленные результаты количественного ангиографического исследования, проведенного у 92% этих больных. Частота рестенозов в группе больных, которым выполняли имплантацию стентов, составила 22%; в группе ЧТКА — 32%. В рандомизированном исследовании Stent Restenosis Study (STRESS) также сравнивали результаты ЧТКА и имплантации стентов Palmaz — Schatz у больных со стабильной стенокардией и объективным подтверждением ишемии. Критерии исследования включали:
- Наличие первичных повреждений нативных коронарных артерий.
- Стенозы длиной <15 мм.
- Диаметр пораженных сегментов >3 мм.
Частота успешно проведенной процедуры при имплантации стентов составила 96,1% (всего — 207 больных); при ЧТКА — 83% (всего — 203 больных). Частота рестенозов в группе пациентов с имплантированными стентами составила 29,1%, а в группе больных, которым выполнена ЧТКА, — 42,7%. Таким образом, по результатам вышеприведенных исследований установлено, что частота рестенозов при оптимальных результатах имплантации стентов в нативные коронарные артерии при их первичном поражении и длине стенозов <15 мм значительно ниже, чем при ЧТКА этих же повреждений.
Стенты Palmaz — Schatz могут быть успешно имплантированы при атеросклеротическом поражении венозных аортокоронарных шунтов. По данным различных исследований общая частота рестенозов при имплантации стентов в венозные шунты находится в пределах от 16 до 29%; при этом отмечено, что при имплантации стентов в сегменты шунтов, ранее подвергшихся дилатации, частота рестенозов повышается до 47%. Однако и этот показатель ниже, чем частота рестенозов после ЧТКА венозных шунтов. По результатам ретроспективного исследования, проведенного Douglas и соавторами, рестенозы после ЧТКА развиваются в 64% случаев, их количество увеличивается до 80% при ЧТКА стенозов аортовенозного соустья.
В публикации о многоцентровом исследовании, проводившемся с 1988 по 1991 г. с участием 1189 больных, сообщается о течении стенокардии вследствие рестенозов после имплантации стентов Palmaz — Schatz. Стенокардия среднего и высокого функционального класса у больных с рестенозом (сужение просвета >50%) после стентирования наблюдалась только в 32,5% случаев. Медикаментозную терапию проводили у 30,3% больных с ангиографически подтвержденным рестенозом (степень сужения составляла в среднем 69%), у 16% больных со степенью сужения просвета в среднем до 80% выполнили плановую АКШ; у этих больных симптоматика была более выражена. Повторную баллонную ангиопластику выполняли у 39,7% пациентов. Осложнений после ЧТКА не отмечено. Данные ангиографического и эндоваскулярного УЗИ подтверждают теорию механизма возникновения рестенозов, развивающихся в месте имплантации стентов. Согласно этой теории рестенозы являются результатом вторичной пролиферации неоинтимы через отверстия трубчатого стента — реакцией на компрессию стенки сосуда, оказываемую стентом.
В клинической практике имплантация трубчатых стентов Palmaz — Schatz при соблюдении условий, о которых говорилось выше, вызывает относительно малое количество тромботических осложнений и рестенозов. О популярности стентов этой конструкции свидетельствует тот факт, что к 1997 г. их продано более четверти миллиона. В 1994 г. стенты Palmaz — Schatz одобрены FDA (США) для лечения пациентов с симптоматической ИБС. К недостаткам применения этих стентов можно отнести их ригидность и анатомические ограничения. Сейчас разрабатываются и внедряются другие конструкции трубчатых стентов с использованием других материалов и с различными вариантами базисного дизайна и длины.
Проволочный стент Gianturco — Roubin
Проволочный кольцеобразный баллон-расширяемый стент Gianturco — Roubin (Cook Inc.) изготавливают из одноволоконной проволоки хирургической нержавеющей стали диаметром 0,006 дюйма. Проволока обернута вокруг очень мягкого баллона-катетера таким образом, что через каждый полный оборот вокруг баллона проволока U-образно «разворачивается назад» на 180° (рис. 1.34, 1.35). Такая конструкция стента позволяет ему свободно расширяться при раздувании баллона без изменения длины. Материал, из которого изготовлен баллон, толще и мягче материала, из которого изготавливают баллоны для обычной ангиопластики. Применение этого материала увеличивает профиль баллона, однако значительно снижает риск повреждения стента при его доставке к поврежденному сегменту. Стенты длиной 12 и 20 мм (размеры определяются от первого до последнего полного кольца) монтируются производителем на баллоны длиной 20 и 30 мм соответственно. На баллон нанесены два рентгеноконтрастных маркера, обозначающие проксимальную и дистальную точки стента. Первое и последнее полные кольца стента располагаются на 2–3 мм кнутри от маркеров.
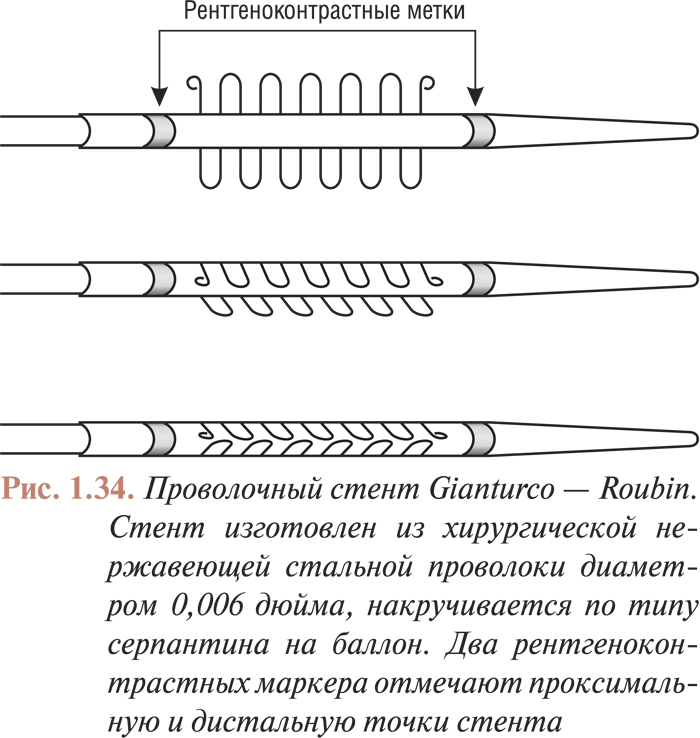
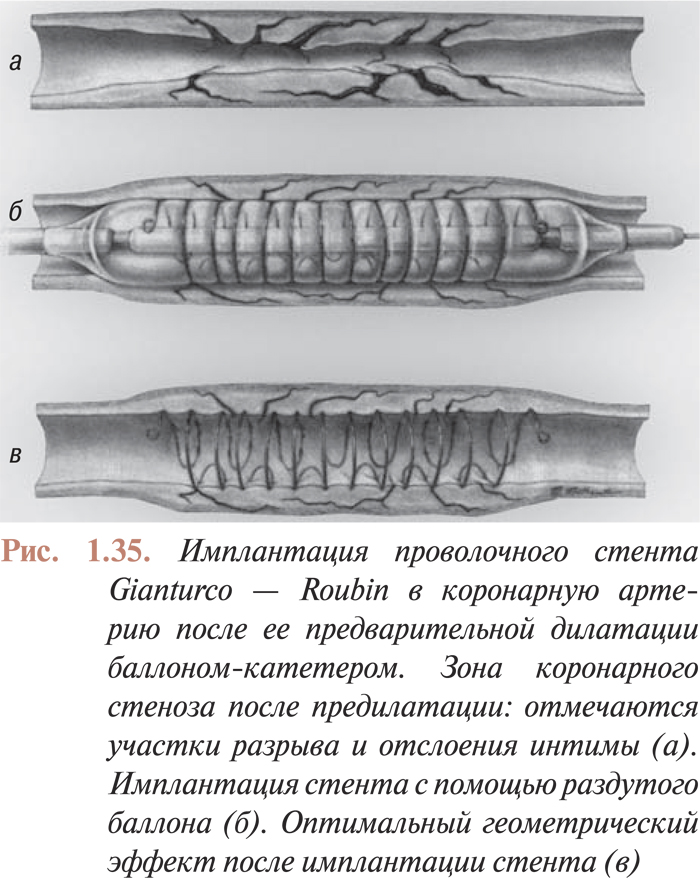
Минимальный диаметр стентов Gianturco — Roubin при их расширении составляет 2 мм; максимальный — 4 мм. Выпускают также стенты диаметром 2,5; 3 и 3,5 мм.
Разработку стента начал C. Gianturco в 1979 г. Автор исследовал возможности применения стента в периферических артериях. В 1985 г. стент адаптирован для использования в коронарном русле в совместной работе с G. Roubin. Первые эксперименты на собаках продемонстрировали возможность легкой имплантации стента в коронарные артерии собак, а также стойкую сохранность функции стентированных сегментов. В 1987 г.
FDA дало согласие на проведение первого этапа исследования стента в клинической кардиологии, спонсируемого автором (G. Roubin). В этом исследовании стент применяли при острых тромботических осложнениях ЧТКА. Развития Q-ИМ у больных, которым был имплантирован стент, не отмечено; к 8-му дню они были выписаны из стационара. На основании результатов первого этапа исследования FDA одобрило проведение дальнейших многоцентровых исследований, спонсируемых владельцем патента и производителями стента. 1 июня 1993 г. FDA разрешило применение стента в широкой клинической практике.
При имплантации стентов Gianturco — Roubin необходимо уделить особое внимание отбору дополнительного инструментария. Для имплантации стентов диаметром <3 мм пригодны проводниковые катетеры 8 F с внутренним диаметром 0,077 дюйма. Для стентов диаметром 3,5 или 4 мм используют проводниковые катетеры 8 F с внутренним диаметром 0,089 дюйма или проводниковые катетеры 9 F. Рекомендуется, чтобы диаметр расширенного стента на 0,5 мм превышал диаметр стентируемого сегмента. Следовательно, в случае поражения сегмента артерии диаметром 3 мм необходим проводниковый катетер с внутренним диаметром 8 F или катетер 9 F. Для проведения баллона со стентом требуются адаптеры Tuohy — Borst с большим просветом (>6 F). Обычно при имплантации стентов Gianturco — Roubin применяют правый и левый катетеры Judkins, отдавая предпочтение катетерам с короткой верхушкой. При низком отхождении устья левой коронарной артерии, при выраженной извитости ее проксимального отдела, а также при катетеризации венозных шунтов, имеющих соустье с левой стенкой аорты, используют катетеры Amplatz left. Для катетеризации венозных шунтов, имеющих соустье с правой стенкой аорты и отходящих низко, применяют многоцелевые катетеры. Необходимо выбирать такие проводниковые катетеры, которые создают достаточную поддержку системе доставки стента при пересечении места повреждения артерии.
Для имплантации стентов Gianturco — Roubin чаще всего пользуются сверхгибкими коронарными проводниками диаметром 0,016 дюйма (USCI Hyperflex). Менее часто применяют проводники диаметром 0,018 дюйма (USCI Hyperflex или ACS High Torque Floppy). Эти проводники необходимы для создания большей силы поддержки при проведении системы доставки стента через коронарное русло в тех случаях, когда повреждение артерии расположено в средних или дистальных отделах за извитыми участками артерий. При имплантации стентов отбирают проводники, длина которых позволяет произвести замену баллона-катетера на систему доставки стента.
Имплантацию стента Gianturco — Roubin выполняют в тех случаях, когда после первичной ЧТКА определяется значительная диссекция интимы, при которой существует риск острой окклюзии артерии. По возможности (в тех случаях, когда длина поврежденного участка не превышает 1 см) предпочтение необходимо отдавать стентам длиной 12 мм, поскольку они содержат меньшее количество металла и, следовательно, являются менее тромбогенными, чем стенты длиной 20 мм. Кроме того, эти стенты легче проходят в извитые участки артерий. В тех случаях, когда имеются затруднения при ангиографической оценке степени диссекции артерии, авторы рекомендуют применять длинные стенты. Опыт показал, что диссекция, не прикрытая стентом, чаще всего является причиной острого тромбоза стентированного сегмента артерии. Результаты долгосрочных наблюдений продемонстрировали, что наилучшие результаты достигаются в тех случаях, когда соотношение диаметра стента и диаметра артерии составляет 0,9±1,1.
При проведении стента по сосудистому руслу с помощью системы доставки не должно возникать ощущения сопротивления, требующего приложения чрезмерного усилия. Если в проксимальном участке артерии имеются сужения, которые будут препятствовать проведению стента, необходимо выполнить предварительную дилатацию этих сегментов. Перед имплантацией хирург должен убедиться в том, что в месте стеноза отсутствуют участки кальцификации, затрудняющие дилатацию, поскольку кальцификаты могут согнуть кольца стента при его расширении. Непосредственно перед расширением стента необходимо увериться в том, что позиция стента выбрана правильно. При этом необходимо помнить, что полные (360°) кольца стента располагаются на 3 мм внутрь от каждого маркера. Контрольная коронарография помогает визуализировать кольца, расположенные между проксимальным и дистальным маркерами, и выбрать точное положение стента. Расположив стент в точном соответствии с повреждением артерии, производят раздувание баллона под давлением 4–5 атм в течение 15–30 с, на котором размещен стент. Вначале раздувают баллон до 4 атм. Если этого недостаточно для полного расширения стента, необходимо раздувать баллон до 5–6 атм. Высокое давление при раздувании стента не рекомендуется, так как это может привести к деформации колец стента: диаметр баллона на 0,5 мм больше диаметра стента, а стенты Gianturco — Roubin изготовлены из достаточно податливого материала. Однако в сосудах диаметром >4 мм (например в венозных шунтах) допускается раздувание баллона под более высоким давлением (максимум 9 атм.). После полного расширения стента баллон в течение 15 с сдувают до минимального профиля и постепенно удаляют в просвет проводникового катетера, оставляя внутрикоронарный проводник за стентированным сегментом; выполняют контрольную коронарографию. В некоторых случаях, несмотря на точную оценку длины поврежденного участка, оказывается, что дистальнее места имплантации стента наблюдается остаточная диссекция. В таких ситуациях может быть выполнена имплантация второго стента в дистальный сегмент. При этом предпочтение необходимо отдавать стенту длиной 12 мм, поскольку такие стенты более свободно проходят через стентированные сегменты. Прохождение второго стента осуществляется легче в тех случаях, когда ранее стентированный участок не изогнут; это исключает соприкосновение первого стента со вторым и их повреждение. Если же изначально было определено, что участок диссекции >20 мм, можно планировать имплантацию двух стентов, однако при этом первый стент имплантируют в дистальный сегмент, а второй — в проксимальный. Вследствие того, что кольца в стентах Gianturco — Roubin не являются замкнутыми, нельзя исключить пролапс отслоившейся интимы в просвет сосуда. Этот дефект может быть исправлен путем повторного раздувания баллона; для этого рекомендуется использовать баллон, способный выдержать высокое давление с увеличенной экспозицией раздувания. Кроме этого, может быть выполнена имплантация второго стента внутри стентированного сегмента.
По данным многоцентрового регистрационного исследования, проведенного с августа 1988 по февраль 1992 г., выполнено 1255 имплантаций стентов Gianturco — Roubin; в 779 случаях имплантировали длинные стенты (20 мм), в 476 — короткие (12 мм). Имплантация длинных стентов проведена успешно в 95% случаев; коротких — в 96,9%. Смертность при имплантации длинных стентов составила 2,7%; Q-ИМ диагностирован в 3% случаев, не-Q—ИМ — в 4,2%. Ургентную ЧТКА выполнили у 4,6% больных. При имплантации коротких стентов эти показатели составили 4,1; 5,6; 4,7 и 3,6% соответственно.
В исследовании, проведенном в Университетском госпитале Алабамы (США), имплантация стентов Gianturco — Roubin выполнена у 118 больных, у 7,6% из них имплантация стентов осложнилась тромбозом. Во всех случаях, кроме одного, ЧТКА была проведена успешно; в одном случае выполнено ургентное АКШ.
Анализ данных другого исследования определил факторы, явившиеся причиной тромбозов стентированных сегментов. К ним относятся:
- остаточный участок диссекции, непокрытый стентом;
- малый (<2,5 мм) диаметр стента.
Остаточная диссекция отмечена в 6,4% случаев без развития тромботических осложнений и в 44% случаев имплантация стентов осложнилась тромбозом. Малый диаметр стента также является значительным и независимым предиктором тромбообразования в стентированном сегменте.
В многоцентровом регистрационном исследовании имеются данные анализа коронарограмм, выполненных 338 больным в отдаленный послеоперационный период (181±47 дней). Средняя степень первичных стенозов составила 46,3±31,3%. Рестенозы, которые определялись как повторные сужения стентированных сегментов артерий на >50%, выявлены у 136 больных. Опубликованы данные отдаленного (5±2 мес) коронарографического обследования больных, которым в Университетском госпитале Алабамы проведена имплантация стентов Gianturco — Roubin в 146 коронарных сегментах. Общее количество рестенозов в этом исследовании составило 45%. При анализе различных коронарографических условий имплантации стентов выявлены некоторые факторы, влияющие на развитие рестенозов. Во-первых, стентирование простых стенозов сопровождалось развитием рестенозов в 14%, а сложных стенозов — в 50% случаев (р<0,002). Во-вторых, имплантация стентов малых (<2,5 мм) диаметров вызывала развитие рестенозов в 55% случаев, в то время как имплантация стентов диаметром >3 мм сопровождалась развитием рестеноза в 31% случаев (р<0,02). В-третьих, в тех случаях, когда соотношение диаметра стента и диаметра сосуда соответствовало 0,9–1,1, количество рестенозов составило 30%; когда же это соотношение было выше или ниже указанных цифр, рестенозы наблюдали соответственно в 48 и 55% случаев (р<0,02). Таким образом, имплантация стентов большого диаметра в артериальные сегменты, в которых локализуются неосложненные атеросклеротические бляшки, при соотношении диаметра стента и стентируемого сегмента 0,9–1,1 максимально уменьшит количество рестенозов. Опубликованы данные, что при имплантации стентов в венозные шунты рестенозы отмечены в 30% случаев. Такое сравнительно небольшое количество рестенозов при имплантации стентов в венозные шунты обусловлено, очевидно, большим диаметром шунтов.
Имплантация стентов Gianturco — Roubin при острых окклюзиях, развивающихся после ЧТКА, значительно уменьшило количество реокклюзий, которые являются причиной внутригоспитальной смертности, развития острых ИМ и требующих выполнения ургентного АКШ. Несмотря на то что количество рестенозов, развивающихся после имплантации стентов Gianturco — Roubin, сравнительно велико, необходимо принимать во внимание тот факт, что выполнение повторной баллонной ангиопластики в этих ситуациях при низкой частоте успешного выполнения этой процедуры приводит к еще большему количеству рестенозов.
Танталовый стент Wiktor
Стенты Wiktor изготавливают из одноволоконной танталовой проволоки диаметром 0,125 мм. Танталовая проволока обеспечивает хорошую визуализацию стента во время рентгеноскопии. После имплантации танталовая проволока окисляется, образуя стабильное биосовместимое соединение, которое не подвержено коррозии. Стенты Wiktor состоят из колец, соединенных между собой и имеющих синусообразный профиль (рис. 1.36). Кольцеобразная проволочная конструкция стентов Wiktor не вызывает выраженного тромбообразования в месте их имплантации, так как стент покрывает <10% поверхности эндотелия в стентируемом сегменте сосуда. Кроме того, такая конструкция значительно увеличила гибкость этих стентов по сравнению со стентами трубчатой конструкции. Вместе с тем синусообразный профиль колец повышает резистентность стента к радиальной силе сосудистой стенки. Стенты Wiktor имеют длину 14–16 мм и поставляются на стандартном баллонном катетере с полиэтиленовым баллоном длиной 25 мм.
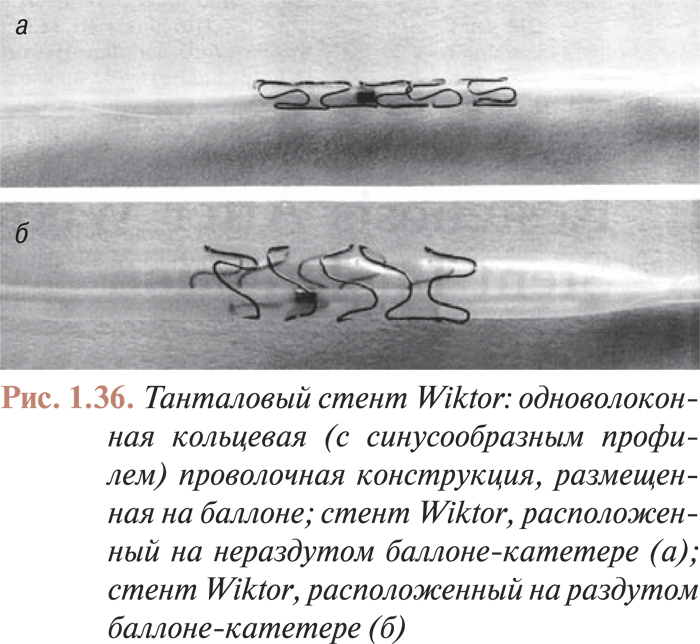
Техника имплантации стента Wiktor сходна с техникой имплантации других стентов, расширяемых с помощью баллона. Профиль стента в сжатом состоянии составляет 1,5 мм. После предилатации пораженного участка коронарной артерии стент по стандартной методике подводят к месту имплантации и расширяют при раздувании баллона под давлением 8 атм.; если необходимо несколько увеличить окончательный просвет стента, давление в баллоне может быть повышено до 10–11 атм. Увеличение диаметра стента не вызывает уменьшения его длины.
Как упоминалось выше, в некоторых европейских клиниках в настоящее время проходит многоцентровое тестирование стентов Wiktor.
С декабря 1990 по июнь 1992 г. в различных медицинских центрах Европы выполнена имплантация стентов Wiktor у 210 больных по поводу острой или угрожающей тромботической окклюзии коронарных артерий. Имплантацию стентов не проводили при хронических окклюзиях, окклюзиях венозных и артериальных шунтов, диффузном поражении коронарного русла (трехсосудистом поражении или наличии нескольких стенозов в одной коронарной артерии), а также при выраженном нарушении функции ЛЖ (ФВ <30%). Кроме того, стентирование не проводили при поражении сосудов, диаметр которых был <3 мм. Противопоказанием также являлись заболевания, которые могли привести к развитию геморрагических осложнений (язвенная болезнь и цереброваскулярные нарушения).
В исследовании предпринята попытка имплантации 231 стента у 210 больных; успешными были 219 из них (198 больных). Стенты имплантировали в передней межжелудочковой ветви левой коронарной артерии в 52%, в правой коронарной артерии — в 34%, в огибающей ветви левой коронарной артерии — в 13%, в ствол левой коронарной артерии (вследствие повреждения устья во время коронарографии) — в 1% случаев. Благоприятные клинические результаты получены в 74,2% случаев. Смертность в этом исследовании составила 3,5%: 4 больных умерли во время ургентного АКШ, 2 — вследствие острых тромбозов стентированных коронарных артерий, 1 — от кардиогенного шока, развившегося после имплантации стента в место диссекции ствола левой коронарной артерии, незащищенного шунтом. АКШ выполнено у 35 больных: 25 из них — в ургентном порядке, 10 — в плановом. Ургентное АКШ проводили после безуспешных попыток имплантации стентов (7 больных), продолжающейся ишемии миокарда (6), тромбоза стентированных сегментов (12). Плановое АКШ выполняли в тех случаях, когда при возможном тромбозе стентированного сегмента артерии под угрозой повреждения оказывалась большая зона миокарда. Q-ИМ развился у 16 больных: у 4 — при неудачной попытке имплантации стентов (зона ишемии миокарда в этих случаях была малой для выполнения АКШ) и у 12 — вследствие тромбоза стентированного сегмента. У 10 больных развился не-Q—ИМ.
Наиболее частым осложнением имплантации стентов Wiktor была острая тромботическая окклюзия стентированных сегментов, отмеченная у 28 больных: у 12 из них это осложнение развилось в течение первых 24 ч, у остальных — в течение последующих 24 дней. Повторную ЧТКА выполнили у 3 больных, ургентное АКШ — у 13. Медикаментозное лечение назначено 12 пациентам.
Контрольную коронарографию проводили через 6 мес после операции у 110 больных, успешно перенесших имплантацию стентов. Рестеноз (сужение стентированных сегментов на >50%) выявлен у 29 пациентов; только у 8 из них рестенозы вызывали симптомы стенокардии. Повторную ЧТКА выполнили у 9 больных, у 1 — плановое АКШ, 12 больных получали медикаментозную терапию, у 7 больных лечение не проводили.
По данным многоцентрового исследования установлено, что по таким показателям, как количество успешных имплантаций, уровень благоприятных клинических исходов, результаты имплантации стентов Wiktor сравнимы с результатами имплантаций стентов других конструкций, которые проводили при острой и угрожающей окклюзии коронарных артерий. Частота ретромбозов хотя и остается достаточно высокой (14%), однако также сравнима с результатами аналогичных исследований, причем во всех исследованиях четко прослеживается такая закономерность: чем меньше диаметр артериального стентированного сегмента, тем больше вероятность его ретромбозов.
Достоинством стентов Wiktor является их рентгеноконтрастность: хорошая визуализация стента во время имплантации сокращает время процедуры. Это обстоятельство особенно ценно при имплантации стентов в ургентных ситуациях. Однако рентгеноконотрастность этих стентов мешает достоверно оценить результаты имплантации: рентгеноконтрастные синусообразные кольца стентов могут «скрадывать» рентгенологическую картину пристеночного тромбообразования или диссекции.
Таким образом, проволочные кольцеобразные стенты Wiktor можно успешно применять в случаях острой и угрожающей окклюзии, развившейся в результате осложнений ЧТКА. Для снижения частоты тромботических осложнений после имплантации этих стентов разрабатываются модели с гепариновым и гирудиновым покрытием. Сейчас налажен выпуск танталовых стентов Cordis. По конструкции эти стенты сходны со стентами Wiktor. Стенты Cordis проходят клинические испытания под контролем FDA (США).
Новые модели внутрикоронарных стентов
Широкое клиническое применение первых образцов внутрикоронарных стентов (эти стенты называют также стентами первой генерации), описание которых приведено выше, продемонстрировало, что стентирование коронарных артерий позволяет существенно уменьшить количество острых тромбозов, значительных кардиальных осложнений, а также рестенозов, развивающихся в результате ЧТКА.
Доказав практическую пользу создания искусственного каркаса стенки артерии в месте ее атеросклеротического поражения, исследователи продолжали и продолжают усовершенствовать конструкцию стентов. Эти усовершенствования направлены в первую очередь на устранение таких недостатков, как низкие гибкость и жесткость стентов. Недостаточная продольная гибкость стентов ограничивает их применение в дистальных отделах коронарных артерий при наличии проксимальных изгибов, а также затрудняет стентирование извитых сегментов. Слабая жесткость стента не позволяет создать достаточное сопротивление стретчинговой силе (силе радиального сжатия в ответ на растяжение) со стороны стенки артерии. На указанные качества влияют такие факторы, как материал, из которого изготавливают стент; конфигурация звеньев или колец стента; использование проволочной или трубчатой конструкции; способ соединения звеньев.
Кроме того, немаловажными характеристиками стентов являются размер их диаметра в сжатом состоянии (профиль стента), а также состояние наружной поверхности стента. Эти характеристики влияют на способность стента свободно передвигаться в просвете коронарных артерий при его доставке к цели.
Улучшение качества стентов, выпускаемых промышленностью в последние годы, расширило спектр показаний к стентированию коронарных артерий. Практически все последние конструкции стентов пригодны для стентирования по перечисленным показаниям.
Рассмотрим характеристики коронарных стентов, конструкции которых разработаны недавно. Несмотря на то что клинические испытания еще продолжаются, эти стенты, в силу того, что на сегодня они обладают наилучшими качествами, широко применяют во многих клиниках мира. Однако, принимая во внимание непрерывное усовершенствование конструкций стентов, есть основания полагать, что в недалеком будущем появятся еще более совершенные образцы.
Стент ACS Multi-link Tristar (Guidant Vascular Intervention Group, Santa Clara, CA, USA)
Стенты ACS Multi-link Tristar (рис. 1.37) состоят из множества звеньев, которые имеют вид рифленых колец. Стенты ACS Multi-link Tristar вырезают лучом лазера из цельной стальной трубки (нержавеющая сталь 316 L). Ширина стальной полоски, остающейся после обработки трубки лазером, составляет 0,10 мм; толщина — 0,14 мм. Стент, диаметр, которого после расширения составляет 3,0 мм, занимает 15% площади стентированной стенки артерии. Длина стентов ACS Multi-link Tristar после их расширения до заданного диаметра уменьшается на 2,7%.

Стенты ACS Multi-link Tristar выпускают длиной 8; 13; 18; 23; 28; 33 и 38 см; диаметр в расширенном состоянии может составлять 2,5; 2,75; 3,0; 3,5 и 4,0 мм. Эти стенты обладают высокой продольной гибкостью, выдерживают силу радиального давления на сжатие до 35 psi.
Стенты ACS Multi-link Tristar расширяются с помощью баллона. Для доставки и имплантации этих стентов используется баллонная система monorail S.T.E.P (Short Transitional Edge Protection). Эта система имеет конфигурацию, которая позволяет использовать минимальное количество баллонного материала (XCELON), располагающегося вне стента, что в свою очередь сводит к минимуму риск диссекции интимы сосуда вне стента (рис. 1.38). Рекомендуемое давление при раздувании баллона — от 8 до 16 атм (при давлении 14 атм и выше диаметр баллона увеличивается на 0,25 мм). На баллоне имеются проксимальный и дистальный рентгенконтрастные маркеры. Система доставки, так же, как и стент, обладает высокой продольной гибкостью.

Сообщение о первых клинических испытаниях стентов ACS Multi-link опубликованы в 1993 г. В 1994 г. начато многоцентровое исследование стентов ACS Multi-link. С 1995 г. стенты ACS Multilink используют в клиниках Европы, Азии и Канады. В 1996 г. получено одобрение FDA для применения этих стентов в США. С 1997 г. выпускают стенты ACS Multi-link Duet, а с 1999 — стенты ACS Multi-link Tristar. В настоящее время эти стенты применяют в клиниках Европы, Азии и Канады.
Клинические исследования стентов ACS Multilink Tristar продолжаются. Ниже мы приводим результаты некоторых из них.
- WEST I (West European Stent Trial I, стент ACS Multi-link). В исследование включены 102 больных. Частота развития серьезных кардиальных осложнений, развившихся в течение 1-го месяца наблюдения, составила 5,9%; в течение 6 мес — 17,6%; в течение 1 года — 18,8%. Частота рестенозов в стентированных сегментах коронарных артерий в течение 1 года наблюдений — 12%.
- WEST II (West European Stent Trial II, стент ACS Multi-link). В исследование включены 165 больных. Частота развития острых послеоперационных тромбозов составила 1,2%, серьезных кардиальных осложнений в течение 1 мес наблюдения — 1,8%; в течение 6 мес — 9,1%. Для оценки результатов применялись коронарографическое и внутрисосудистое УЗИ.
- ASCENT (ACS Multilink Stent Trial). В исследовании проводили сравнение результатов имплантации стентов ACS Multi-link и Palmaz — Schatz у 1040 больных, которых наблюдали в течение 9 мес. Проводили оценку клинических и ангиографических данных. Частота развития острых тромбозов при имплантации стентов Palmaz — Schatz составила 1,7% в сравнении с 0,6% при имплантации стентов ACS Multi-link. Частота серьезных коронарных осложнений, развившихся в течение 9 мес после имплантации стентов Palmaz — Schatz, составила 15,9%; при имплантации стентов ACS MuIti-link — 12,5%. Частота рестенозов при имплантации стентов Palmaz — Schatz составила 22,1%; при имплантации стентов ACS Multi-link — 16,1%.
- ASCENT (Restenosis Registry) (раздел в исследовании ASCENT). Проведено наблюдение 201 больного в течение 9 мес, у которых выполнено стентирование по поводу рестенозов, развившихся в результате ЧТКА. Частота развития серьезных кардиальных осложнений составила 13,9%.
- High ASCENT (раздел в исследовании ASCENT). Проведено 30-дневное наблюдение 101 больного, у которых при имплантации стента ACS Multi-link проводили раздувание баллона под большим давлением. Частота развития серьезных кардиальных осложнений, развившихся за период наблюдения, составила 2,0%.
- Long ASCENT (раздел в исследовании ASCENT). В исследовании проводили 30-дневное наблюдение больных, у которых были имплантированы стенты ACS Multi-link длиной более 10 мм (15; 25 и 35 мм). Частота развития серьезных кардиальных осложнений за время наблюдения составила 3,5%.
- IVUS (Intravascular ultrasonography)(creHTACS Multi-link). Проводили 12-месячное наблюдение 49 больных с применением внутрикоронарного УЗИ. Частота развития серьезных кардиальных осложнений за период наблюдения составила 2%. Отмечено значительное увеличение средних значений ширины просвета в месте имплантации стентов при раздувании баллона до 12 атм (по сравнению с результатами при раздувании баллона под давлением 8 атм).
- Japan (Стент ACS Multi-link). Наблюдали 1123 больных в течение 6 мес после имплантации стента. Частота развития рестенозов в месте имплантации стента составила 14%.
- DUET US (Стент ACS Multi-link Duet). Проведено 6-месячное клиническое и коронарографическое обследование 270 больных. Частота развития серьезных кардиальных осложнений, развившихся в течение 30 дней после вмешательства, составила 2,2%.
- DUET Europe (Стент ACS Multi-link Duet). Проведено 6-месячное наблюдение 210 больных, у которых выполнена имплантация стентов ACS Multi-link Duet в местах атеросклеротических повреждений длиной от 8 до 23 мм. Частота развития серьезных кардиальных осложнений, развившихся в течение первых 30 дней, составила 4,3%; в течение 6-месячного наблюдения — 16,7%. Частота рестенозов за 6 мес наблюдения составила 16,3%.
Ряд исследований, проводящих оценку результатов имплантации стентов ACS Multi-link Duet (CADILLAC (Controlled Abciximab and Device Investigation to Lower Late Angioplasty Complications) — 2000 больных; SOS (Stent or Surgery) — 1000 больных; AMIGO (Atherectomy before MULTI-LINK Improves Lumen Gain and Clinical Outcomes) — 750 больных; DESIRE (DrugEluting Stents for In-Stent Restenosis) — 500 больных), еще не завершены; их результаты не опубликованы. Летом 1999 г. началось исследование SLIDE US, целью которого является оценка результатов имплантации стента ACS Multi-link Tristar у 250 больных.
На рис. 1.39 приведены коронарограммы, выполненные до имплантации стента ACS Multilink (А), непосредственно после операции (Б) и после 6-месячного наблюдения (В). Результат стентирования хороший.
Стент BeStent Brava; модели BES и BEM (Medtronic AVE, Santa Rosa, CA, USA)
Основной особенностью стентов BeStent (рис. 1.40) является их конструкция, исполненная в виде соединяющихся циркулярных и продольных металлических полос, имеющих вид серпантина. Во время расширения стента происходит вращение в местах соединения полос, что приводит к их выпрямлению (рис. 1.41); таким образом, BeStent при расширении совершенно не укорачивается, а ортогональная концентрация стретчинговой силы стенки артерии, направленной радиально, не оказывает деформирующего действия.

BeStent изготавливают из нержавеющей стали. Основой стента является цельный стальной цилиндр, из которого вырезают серпантиновую сеть. Сварка при изготовлении данного стента не применяется. Площадь, которую занимает стент в расширенном состоянии, составляет 12–19% площади сосуда (для модели BES) и 10–14% (для модели BEM). Размеры циркулярных полос: толщина — 0,07 мм; ширина — 0,11 мм. Размеры продольных полос: толщина — 0,07 мм; ширина — 0,75 мм. Размеры расширенных стентов: 2,5–3,8 мм (для модели BES) и 3,0–4,8 мм (для модели BEM).
Стретчинговое давление, выдерживаемое стентом, составляет не менее 450 мм рт. ст. Длина выпускаемых в настоящее время стентов составляет 8; 15 и 25 мм. BeStent модели BES предназначен для стентирования сосудов диаметром от 2,5 до 3,0 мм; BeStent модели BEM — для стентирования сосудов диаметром от 3,0 до 4,5 мм. BeStent обладает хорошей продольной гибкостью. На стенте имеются 2 рентгенконтрастных золотых маркера, указывающих проксимальный и дистальный отделы стента.
BeStent является баллон-расширяемым стентом. Система доставки стента — monorail с фиксированным на баллоне стентом. Минимальный диаметр проводникового катетера, по которому может пройти система доставки BeStent,— 1,6 мм (катетеры 6 F). Диаметр проводникового просвета системы доставки составляет 0,36 мм. Давление, при котором может произойти разрыв баллона, имеющего диаметр 4 мм, — 14 атм. Рекомендуемое давление в баллоне при имплантации стента — 6 атм. (после сдувания баллона рекомендуется его повторное надувание под давлением до 12 атм).
Первые эксперименты по имплантации стента у животных начаты в 1995 г. В 1996 г. выполнены имплантации BeStent у пациентов в Кейптауне (ЮАР), Хайфе (Израиль), Милане (Италия) и Роттердаме (Нидерланды). Пилотные исследования, по которым проводилась оценка стентов BeStent, выполнены в 8 центрах Европы также в 1996 г. В это исследование включили 217 больных как с первичными атеросклеротическими поражениями коронарных артерий различной длины и сложности, так и рестенозами. Опубликованы результаты годичного наблюдения 100 первых больных, у которых была выполнена имплантация стентов BeStent. Отсутствие значительных кардиальных осложнений отмечено у 82% этих больных. В исследование Rose (Registry for Optimal Stent Evaluation) вошли 120 больных как со стабильной, так и нестабильной стенокардией. Проводилась имплантация стентов в сегменты коронарных артерий, имеющих единичные поражения длиной до 15 мм. Диаметр пораженных сегментов составлял 2,85±0,52 мм. Частота развития рестенозов за 6-месячный период наблюдения составила 21%; годичная выживаемость больных при отсутствии значительных кардиальных осложнений — 75%. Исследование результатов имплантации стентов BeStent продолжается в 3 начатых исследованиях: BESMART (BEstent in SMall ARTeries; Франция; 380 больных); SISA (Stanting in Small Arteries; Европа, Азия, Канада; 350 больных); RAPS ( Radial Artery Patency Study; Испания; 440 больных). Во всех этих исследованиях проводится сравнение результатов ЧТКА и имплантации BeStent в сосуды малого диаметра. Во всех 3 исследованиях проводится наблюдение клинического состояния больных, дополняемое ангиографическим контролем. В США проводится исследование, в котором сравниваются результаты имплантации стентов Palmaz — Schatz и BeStent.
Стент BX Velocity (Cordis, A Johnson & Johnson Company, Warren, NJ, USA)
Стенты BX производят из нержавеющей стали. Конструкция состоит из замкнутых ячеек, соединенных между собой гибкими металлическими нитями. Такая конструкция обладает достаточной гибкостью при сохранении значительной жесткости. Ячеистая структура стента обеспечивает хороший доступ к боковым ветвям, отходящим от стентированного сегмента артерии. Площадь, занимаемая стентом, составляет 20% общей площади стенки стентированного сегмента. Толщина нити 0,14 мм; ширина 0,13 мм. Стенты BX выпускают длиной 8; 13; 18; 23; 28 и 33 мм; диаметром — 2,25; 2,5; 2,75; 3; 3,5; 4; 4,5 и 5 мм.
Стенты BX являются баллон-расширяемыми. Для доставки стентов, имеющих диаметр от 2,25 до 4,5 см, требуется проводниковый катетер 6 F; для стента диаметром 5 мм — 7 F. Доставка стентов проводится как системами rapid exchange (monorail), так и системами over-the-wire.
Баллон в системе доставки изготавливают из материала Duralin. Этот материал является достаточно прочным (давление, при котором может произойти разрыв баллона, составляет 16 атм), хотя и податливым (при давлении около 15 атм диаметр баллона может увеличиться на % от заданного).
Система доставки обладает высокой продольной гибкостью. Хорошо удерживает баллон при проведении его к цели, а также легко проходит повторно через стентированные сегменты артерий.
В феврале 1997 г. завершились экспериментальные испытания стента BX. Опыты показали, что стент BX, по сравнению со стентом Palmaz — Schatz, гораздо реже повреждает сосудистую стенку (0,05±0,15 против 0,44±0,44; p<0,01) и вызывает меньшую гиперплазию неоинтимы (1,09±0,25 мм2 для стентов BX по сравнению с 2,92±2,26 мм2 для стентов Palmaz — Schatz). Имплантация первой генерации стентов BX выполнена в клинике Милана в мае 1997 г. После некоторой доработки создана вторая генерация стентов BX (BX Velocity), имплантация которых с января 1999 г. проводится в клиниках Милана и Тулузы. Хотя результаты клинических испытаний стентов BX Velocity в настоящее время не опубликованы, высокие потенциальные возможности (низкий профиль, высокая продольная гибкость при значительной жесткости) свидетельствуют о том, что у этих стентов есть определенное будущее.
Стент Coroflex (Braun Melsungen AG, Berlin, Germany)
Стент Coroflex (рис. 1.42) — баллон-расширяемый, его вырезают из стальной трубки (нержавеющая сталь 316 L) лазерным лучом с последующей электрополировкой. Стент состоит из большого количества синусоидальных колец, соединенных мостиками в средних точках (рис. 1.43); такая конструкция придает стенту исключительную гибкость.

Имплантированный стент Coroflex занимает 12% внутренней поверхности стентированного сегмента. Толщина металлической полоски составляет 0,09 мм. Профиль стента, монтированного на баллоне, — 0,97 мм. Диаметр выпускаемых стентов Coroflex — 2,5; 3; 3,5 и 4,0 мм; длина — 8; 13; 16 и 25 мм. При расширении длина стента уменьшается на 1–3%. Имплантированный стент выдерживает стретчинговую силу до 0,6 атм.
Система доставки состоит из баллона-катетера Larus, на котором монтируется стент. Баллон-катетер относится к типу monorail, изготовлен из высокопрочного материала Pamax, который при раздувании способен выдержать давление до 12 атм при имплантации стентов диаметром 4 мм и 15 атм при имплантации 2,5–3,5-миллиметровых стентов. Рекомендуемое давление в баллоне при имплантации стента Coroflex — 8–12 атм. Проксимальный и дистальный отделы баллона имеют рентгенконтрастные отметки. Проводниковый просвет в баллоне-катетере диаметром 0,36 мм. Для имплантации стентов Coroflex требуются проводниковые катетеры размером 6 F. Продольная гибкость системы доставки, как и стента Coroflex, очень высокая. Клинические испытания стента начались в 1998 г.— в Европе проведено исследование безопасности стента; в 1999 г. открыт международный регистр. С 1999 г. формируется проспективное многоцентровое исследование непосредственных и отдаленных результатов имплантации стентов Coroflex.
Стент Coronary R-Stent (New Medical Technologies, Inc., Ft Coroflex Lauderdale, FL, USA)
Coronary R-Stent изготавливают из стальной трубки (нержавеющая сталь 316 L). Представляет собой конфигурацию двойной спирали и состоит из пяти зон: двух конечных, двух переходных и одной центральной (рис. 1.44). Конечные зоны состоят из двойной выпрямленной решетки, обладают слабой гибкостью, однако наличие выпрямленных краев дает возможность оператору установить стент так, что он не будет захватывать здоровый участок артерии. Переходные зоны обеспечивают плавный переход от жестких конечных зон к очень гибкой центральной зоне. Последняя состоит из двойной спиральной решетки, обеспечивающей стенту достаточную подвижность и жесткость. Размер ячеек расширенного стента не менее 4,5 мм, что разрешает хороший доступ к боковым ветвям в стентированном сегменте артерии.
Имплантированный стент занимает 18% поверхности стентированного сегмента артерии. Ширина металлической полоски — 0,1 мм; толщина — 0,12 мм (у стентов диаметром >3 мм толщина полоски составляет 0,13 мм). R-Stent выпускают как смонтированным на баллоне, так и вне системы доставки. Диаметр стентов — от 2,5 до 3 мм (стенты этих диаметров имеют длину 9; 16; 25 и 35 мм) и от 3 до 4 мм (длина этих стентов 9; 18; 28 и 38 мм). При расширении стенты диаметром 2,5-3 мм сокращаются на 5%; диаметром 3–4 мм — на 0–3%. Рекомендуемое давление при имплантации стентов диаметром 2,5–3 мм — 10 атм, диаметром 3–4 мм — 7–9 атм. Стент выдерживает радиальную силу на сжатие до 25 psi. Профиль свернутого баллона — от 1,5 до 3 мм.
R-Stent относится к баллон-расширяемым. Система доставки rapid exchange (monorail) имеет проводниковый просвет диаметром 0,36 мм. Для системы доставки требуется проводниковый катетер с внутренним диаметром 5 F. Максимальное давление, выдерживаемое баллоном, составляет 16 атм; номинальное рекомендуемое давление для первого раздувания баллона — 6 атм. Система доставки достаточно свободно проходит по артериальному руслу.
В 1997 г. R-Stent прошел доклинические испытания; в этом же году в Роттердаме выполнены первые имплантации у пациентов. В апреле — ноябре 1998 г. проведено исследование, в котором 27 больным (46% — со стабильной стенокардией; 54% — с нестабильной стенокардией) проведены попытки имплантации 33 R-Stents. 80% больных до стентирования перенесли либо острый ИМ, либо хирургическое вмешательство (шунтирующую операцию или ЧТКА) по поводу коронарного атеросклероза. Большинство атеросклеротических повреждений представляли собой либо окклюзии, либо стенозы со сложной анатомией. Имплантация стента проведена успешно в 32 случаях из 33 попыток (у 26 из 27 больных). В ранний послеоперационный период острых тромботических осложнений не было. У всех успешно прооперированных больных кровоток в стентированном сегменте соответствовал Т1М1 3 (Thrombolysis in Myocardial Infarction). В 30-дневный период наблюдения случаев смерти, ИМ, подострого тромбоза, повторных эндоваскулярных вмешательств и шунтирующих операций не было.
Стент InFlow Flex (InFlow Dynamics AG, Munich, Germany)
Стент InFlow Flex изготавливают из стальной трубки (нержавеющая сталь 316 L). Для создания более гладкой наружной поверхности стенты в последнее время покрывают слоем золота толщиной 5 мкм, что также делает стент InFlow Flex высококонтрастным. Конфигурация стента — множественные звенья, имеющие вид синусоидальных колец. Зона, занимаемая имплантированным стентом, составляет в зависимости от диаметра стента от 10 до 20% (зависимость между диаметром стента и занимаемой им зоной обратно пропорциональная; стент диаметром 3,0 мм занимает 14% поверхности стентированного сосуда). Толщина проволоки равна 0,075 мм. Степень сокращения стента — от 1% (при диаметре 2,5 мм) до 17% (при диаметре 5,0 мм); при диаметре стента 3 мм степень сокращения составляет 4%. Стенты InFlow Flex выпускают диаметром от 2,5 до 5 мм; длиной — 8; 12; 16; 20; 24 мм.
Баллон-расширяемые стенты InFlow Flex выпускают без системы доставки. Стент перед его имплантацией в коронарные артерии монтируется на баллон соответствующего размера.
Первая имплантация стента InFlow Flex у человека выполнена в начале 1996 г. К концу 1996 г. проведено 4000 имплантаций этого стента, а к середине 1997 — более 10 тыс. стентирований. В настоящее время выполняется ряд исследований, в которых проводится оценка результатов стентирования стентами InFlow Flex. В этих исследованиях сравниваются результаты стентирования обычным стентом и стентом, имеющим золотое покрытие. Испытываются также стенты InFlow Flex, имеющие биодеградирующее покрытие, высвобождающее гирудин.
Стенты InFlow Flex отличаются высоким уровнем успешных попыток имплантации; в большинстве случаев процедура завершается успешно даже в случае неудачной попытки имплантации стентов другого типа.
Группа коронарных стентов JOSTENT (JOMED AB, Helsingborg, Sweden)
JOSTENT Flex. Стенты JOSTENT Flex (рис. 1.45) разработаны специально для имплантации в сегменты артерий, содержащие сложные стенозы. Эти стенты обладают хорошей продольной гибкостью, свойственной проволочным стентам, и высокой сопротивляемостью силе радиального сдавления, которая характерна трубчатым стентам. Размер ячеек стента достаточно большой для того, чтобы обеспечить свободный доступ к ветвям стентированных сегментов артерий.

Стент вырезают лучом лазера из стальной трубки и полируют. Имплантированный стент занимает 14–19% поверхности стентированного сегмента артерии. Толщина проволоки стента — 0,09 мм. Профиль стента — 1 мм. Степень сокращения для стента диаметром 3,5 мм — <3%. Диаметры изготавливаемых стентов — 2–3,5 мм (конструкции для малых сосудов) и 3–5 мм (стандартные конструкции).
Баллон-расширяемые стенты JOSTENT Flex поставляются с системой доставки. Минимальный внутренний диаметр проводникового катетера, необходимый для системы доставки, — 6 F. Баллон имеет рентгенконтрастные маркеры в его проксимальном и дистальном отделах. Стенты JOSTENT Flex могут поставляться также без систем доставки.
JOSTENT Plus. Конструкция стентов JOSTENT Plus (рис. 1.46) базируется на многоячеечной основе, что оптимизирует сопротивляемость этих стентов силе радиального сдавления. Зона каждого звена намерено увеличена, что позволяет расширять стенты до больших диаметров (от 3 до 6 мм); можно использовать стенты JOSTENT Plus в крупных сегментах, какими, например, являются устья правой и левой коронарной артерии, а также устья крупных эпикардиальных ветвей. Стент сконструирован таким образом, что при максимальном расширении его сокращение минимально.

Стент JOSTENT Plus вырезают из цельной стальной трубки (нержавеющая сталь 316 L). Основные технические характеристики стента сходны с характеристиками стента JOSTENT Plus, за исключением длины (9; 17; 25 и 33 мм) и максимального диаметра (6 мм) моделей. Имеются конструкции JOSTENT Plus для стентирования подвздошных артерий.
JOSTENT Sidebranch. Стент JOSTENT Side-branch (рис. 1.47) является первым стентом, разработанным специально для доступа к боковым ветвям; по этой причине имеет крупноячеистую структуру, которая сводит к минимуму риск окклюзии боковых ветвей, отходящих от стентированного сегмента артерии. Стент JOSTENT Sidebranch является комбинацией конструкций стентов JOSTENT Flex и JOSTENT Plus. Проксимальный и дистальный отделы стента JOSTENT Sidebranch имеют дизайн Plus, который обеспечивает высокую радиальную резистентность, в то время как средняя порция сконструирована по принципу спиральных звеньев (Flex), что позволяет максимально увеличивать размер звеньев.

Стент JOSTENT Sidebranch изготавливают таким же способом, как и другие стенты группы JOSTENT. Зона, занимаемая имплантированным стентом, составляет 14–19% внутренней поверхности стентированного сегмента артерии. Толщина проволоки стента — 0,13 мм; профиль стента — 1 мм. Диаметры выпускаемых стентов JOSTENT Sidebranch — от 3 до 6 мм; длина — 18 и 26 мм.
JOSTENT Bifurcation. Стент JOSTENT Bifurcation (рис. 1.48) представляет собой оригинальную конструкцию, позволяющую имплантировать стенты в места бифуркаций коронарных артерий. Как и в предыдущем случае, конструкция JOSTENT Bifurcation представляет собой комбинацию конструкций Flex и Plus. Конструция дистального отдела JOSTENT Bifurcation основана на конструкции Plus и обладает значительной жесткостью, которая делает дистальный отдел стента устойчивым к силе радиального давления. Проксимальный отдел представляет конструкцию Flex, в которой используются спиральные звенья, позволяющие максимально увеличить доступ к устью сосуда, отходящего от основного ствола. Ячейки крупных размеров позволяют системе доставки второго стента пройти сквозь каркас стента, имплантированного в основной сосуд (рис. 1.49).


Материал и способ изготовления стента JOSTENT Bifurcation такие же, как и других стентов группы JOSTENT. Площадь имплантированного стента — 14–19% поверхности стентированного сегмента артерии. Толщина проволоки стента — 0,13 мм. Профиль стента — 1 мм. Стент обладает высокой продольной гибкостью. Степень сокращения стента диаметром 3 мм — <3%. Диаметры выпускаемых стентов — от 3 до 6 мм; длина — 16 и 28 мм.
JOSTENT Coronary Stent Graft. JOSTENT Coronary Stent Graft (рис. 1.50) представляет собой уникальную конструкцию, соединяющую металлический каркас и тонкий слой материала PTFE, обладающего способностью растягиваться, таким образом эта конструкция сочетает свойства коронарного стента и шунта.

В конструкции JOSTENT Coronary Stent Graft применен «принцип сандвича»: сверхтонкий растягивающийся материал PTFE располагается между двумя стентами, приваренными друг к другу с обоих концов. Стент обладает большой продольной гибкостью и устойчивостью к силе радиального сдавления.
JOSTENT Coronary Stent Graft можно с успехом применять в таких экстремальных ситуациях, как наличие угрожающей жизни диссекции интимы коронарной артерии, перфорации сосуда и аневризмы артерии.
JOSTENT Coronary Stent Graft изготавливают из нержавеющей стали 316 L и сверхтонкой растягивающейся ткани PTFE. Толщина стенки стента — 0,3 мм; профиль стента — 1,6 мм. Диаметр выпускаемых стентов — от 2,5 до 5 мм; длина — 9; 12; 16; 19 и 26 мм. JOSTENT Coronary Stent Graft используют при лечении подвздошных и периферических артерий.
Имеется клинический опыт применения JOSTENT Coronary Stent Graft (Heuser R., Lopez A., Reifart N., Stoerger H.; Phoenix Heart Center, Phoenix, Arizona, USA; Red Cross Hospital, Frankfurt, Germany). В исследование, проведенное этими авторами, включили 76 больных, у которых проводили имплантацию 83 стентов в передней межжелудочковой ветви левой коронарной артерии (20 случаев), огибающей ветви левой коронарной артерии (6 случаев), правой коронарной артерии (26 случаев), венозных шунтов (24 случая). Показаниями к имплантации JOSTENT Coronary Stent Graft были аневризмы (22 случая), рыхлые венозные шунты (15 случаев), тромботические бляшки (7 случаев), перфорации артерий (4 случая), впервые возникшие атеросклеротические повреждения сосудов (20 случаев) и рестенозы (8 случаев, из них 6 — рестенозы в местах имплантации стентов). Имплантация проведена успешно в 97% случаев (74/76), в том числе — во всех 4 случаях перфораций сосудов. В среднем до вмешательства стеноз составлял 81,5±15,4%; после вмешательства — 7,6±18,1%. У 6 больных этой группы через 6 мес была выполнена контрольная коронарография. Рестеноз выявлен у 2 больных: в 1 случае был диффузным и суживал просвет артерии на 60%; в другом случае — локальным в месте края стента.
Стент LP Stent (Internetional Tecnologies Europe Ltd, Republic of Ireland)
LP Stent относится к трубчатым стентам третьего поколения. Для его изготовления используется трубка из нержавеющей стали и уникальная технология химического травления металла, при которой металл приобретает гладкую поверхность и значительную сопротивляемость сдавливающей силе. Оригинальная форма каркаса (трапециевидные ячейки) (рис. 1.51) позволяет не применять значительную силу для расширения стента, что предохраняет стенку сосуда от чрезмерного сдавления. Кроме того, LP Stent практически не укорачивается при расширении, обладает минимальной силой отдачи (уменьшение диаметра после расширения стента) и очень высокой сопротивляемостью силе радиального сдавления.

LP Stent имеет диаметры 2,5; 3; 3,5 и 4 мм; длина стентов — 8; 12; 18 и 24 мм. Профиль LP Stent — 1,2 мм.
Баллон-расширяемый LP Stent поставляется монтированным на баллоне системы доставки, для подведения которой к коронарному руслу требуется проводниковый катетер размером не менее 6 F. Баллон имеет дистальный и проксимальный рентгенконтрастные маркеры.
Первая имплантация LP Stent человеку была выполнена в мае 1998 г. В 1999 г. запланировано внедрение LP Stent в страны Европы и Азии. В ноябре 1999 г. в Бельгии начато исследование результатов лечения коронарного атеросклероза с помощью LP Stent, в которое предполагалось включить до 200 больных.
Стент Nexus (Occam International BV, Eindhoven, The Netherlands)
Стент Nexus (рис. 1.52) — трубчатый баллон-расширяемый, изготавливаемый из высококачественной нержавеющей стали. Стент имеет множественные ячейки, соединяющиеся между собой с помощью V-образных соединений. В стенте сочетаются хорошая продольная гибкость и выраженная сопротивляемость радиальной силе. Имплантированный стент диаметром 3,5 мм занимает 11,7% поверхности стентированного сегмента артерии. Ширина металлической полоски стента составляет 0,105 мм; толщина — 0,12 мм, профиль стента — 0,9–1,0 мм. Укорочение стента диаметром 3 мм при его расширении составляет 2,6%. Диаметр изготавливаемых стентов — 2,5; 3; 3,5 и 4 мм; длина — 8; 12; 18; 23 и 28 мм.
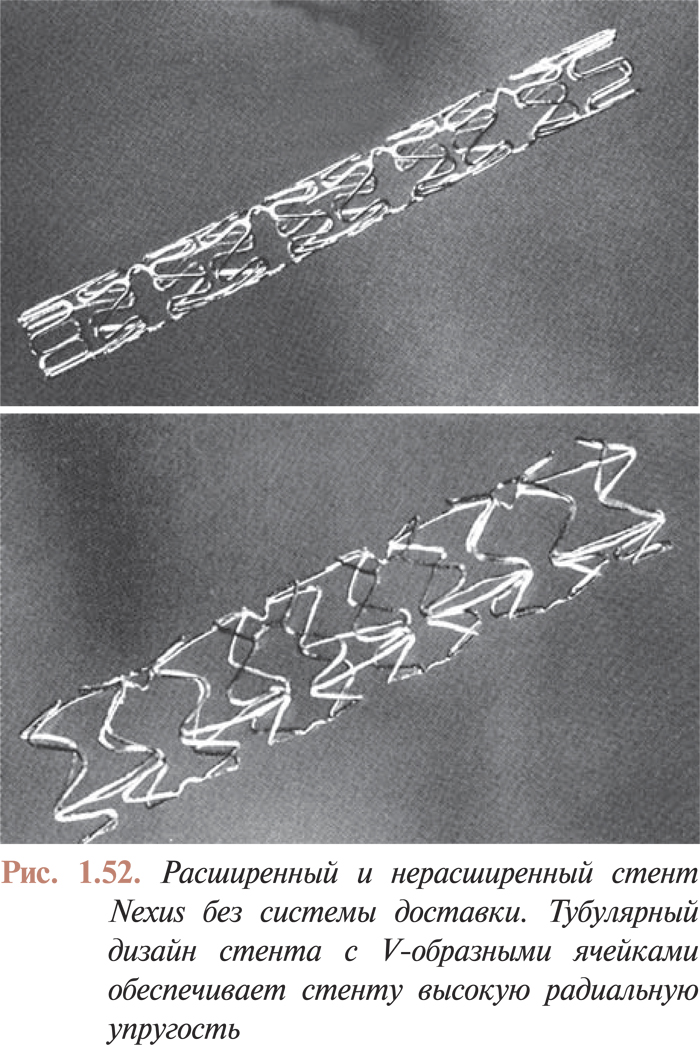
Стенты Nexus поставляются как в виде заранее смонтированных на баллоне систем доставки, так и без систем, а также в «свободном» виде. Система доставки относится к типу monorail. В нее входит баллон, выдерживающий давление до 14 атм и раздувающийся до заданных диаметров (2,5; 3; 3,5 и 4 мм). На проксимальном и дистальном отделах баллона имеются рентгенконтрастные маркеры.
Первые стенты Nexus изготовлены в 1998 г.; в этом же году выполнена первая имплантация стента в клинике. С 1999 г. стент применяется в клиниках Европы. В настоящее время планируются исследования, в которых будет проводиться оценка разультатов имплантации стентов Nexus.
Стент Sorin Carbostent (Sorin Biomedica S.p.A., Saluggia (VC), Italy)
Стент Sorin Carbostent (рис. 1.53) является баллон-расширяемым трубчатым стентом нового поколения, который изготавливают из нержавеющей стали 316 LVM, покрытой тонким слоем (0,3–0,5 мкм) оригинального материала Carbofilm. Стент состоит из ячеек уникальной формы. Sorin Carbostent поставляется смонтированным на системе доставки, относящейся к типу monorail.

Ячейки стента Sorin Carbostent состоят из сегментов, которые имеют искривления различной формы. Каждый сегмент имеет различную толщину металла. Такая конструкция ячеек способствует оптимальному механическому ответу стента на его расширение, сгибание и скручивание (рис. 1.54). Ячейки соединяются в средних точках самых длинных сегментов (рис. 1.55). При такой схеме соединения достигаются два важных преимущества: а) соединения между ячейками эластичны, что повышает продольную гибкость стента; б) при таком соединении укорочение стента при его расширении сводится к нулю. Конструкция Sorin Carbostent делает невозможной концентрацию силы на одном участке стентированного сегмента; при этом также отсутствует эластическая деформация сосудистой стенки, которая стимулирует избыточную пролиферацию неоинтимы.
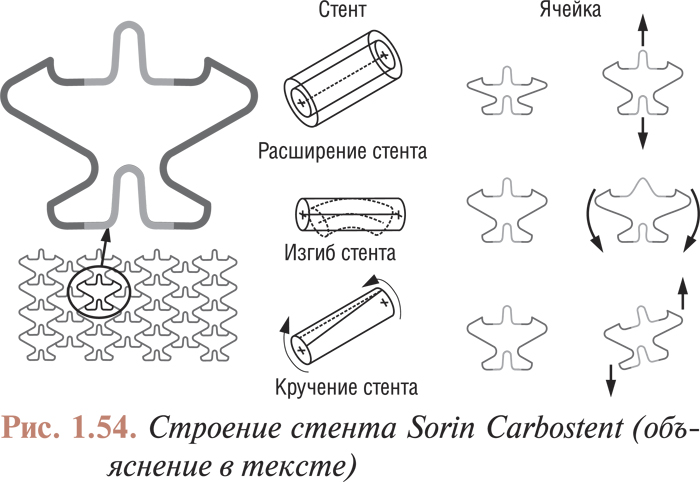
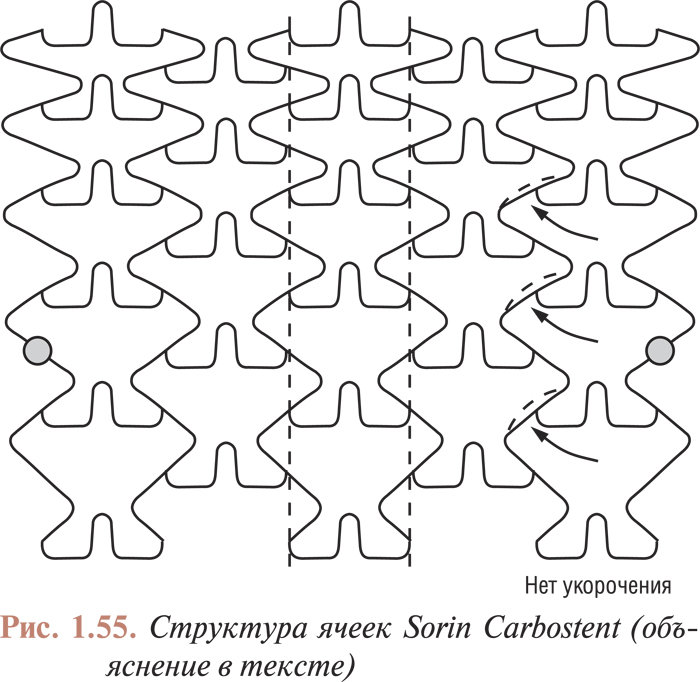
Данная конструкция обеспечивает оптимальный контакт стента с тканями сосудистой стенки. Длина выпускаемых образцов Sorin Carbostent — 9; 15 и 25 мм. Существуют пяти- и шестиячеечные варианты Sorin Carbostent; в первом случае диаметр стента составляет 3 и 3,5 мм, во втором — 4 и 4,5 мм. В точках соединений на обоих краях стента имеются рентгенконтрастные платиновые маркеры, которые позволяют визуализировать конечные точки стента даже в случае наполнения сосуда контрастным веществом. Наружная поверхность стента подвергается алмазной шлифовке до зеркального состояния. Шлифовка также закругляет углы металла. Это значительно облегчает продвижение стента в сосудистом русле и сводит к минимуму возможность повреждения сосудистой стенки.
Sorin Carbostent покрывают тонкой пленкой углерода (покрытие Carbofilm), обладающей турбостатическими свойствами. Это покрытие делает стент тромборезистентным и биосовместимым с тканями сосуда и кровью. В кардиохирургической практике уже более 30 лет применяют прекрасно зарекомендовавшие себя клапаны с углеродным покрытием. Пленочное покрытие Carbofilm не оказывает влияния на физические свойства покрываемого материала. В сосудистых протезах, покрытых Carbofilm, отмечается ослабление адгезии и активации тромбоцитов, что резко снижает риск образования тромбов.
Вследствие своей высокой продольной гибкости Carbostent обладает способностью легко проходить извитые, кальцинированные сегменты, а также стентированные сегменты артерий. Наличие высококонтрастных маркеров, наряду с отсутствием укорочения стента во время его расширения, дает возможность провести имплантацию стента максимально точно. Это свойство стента особенно важно при имплантации Carbostent в устья артерий, в места бифуркации или вблизи отхождения боковых ветвей. Конструкция стента предотвращает концентрацию силы на одном участке стентированного сегмента и эластическую деформацию стенки сосуда, что в конечном счете приводит к уменьшению количества рестенозов. Наконец, высокая гемосовместимость и атромбогенность Carbostent существенно снижают риск острых тромботических осложнений стентирования даже при наличии атеросклеротических бляшек с осложненной морфологической структурой.
В 1997 г. проведены доклинические испытания Carbostent. С апреля 1998 по январь 1999 г. в двух итальянских клиниках проведено открытое проспективное исследование, в котором оценивались результаты имплантации стентов Sorin Carbostent. В исследование включили 112 пациентов, у 55,4% которых отмечали симптомы нестабильной стенокардии. Повреждения коронарных артерий (всего 132), согласно классификации АСС/АНА, относились к повреждениям средней степени сложности. Средняя длина стенозов составила 12,5±7,2 мм; 71,3% стенозов локализовались в сосудах малого диаметра (<2,9 мм). Имплантация стентов проведена успешно в 100% случаев, что подвержено коронарографически. Средний диаметр остаточных стенозов составил 4±7% при исходном среднем диаметре 79±12%. В послеоперационный период все больные получали ацетилсалициловую кислоту и тиклопидин. Значительное кардиальное осложнение (не-Q-ИМ) в госпитальный период отмечено в 1 (0,9%) случае. В течение 6-месячного наблюдения значительные кардиальные осложнения развились у 18% больных. Частота рестенозов составила 11%.
Стент Terumo (Terumo Corpiration, Tokyo, Japan)
Стент Terumo (рис. 1.56) относится к баллон-расширяемым трубчатым стентам. Материал, из которого изготавливают стент Terumo, — нержавеющая сталь 316 L. Особенностью этого стента является его однозвеньевая конструкция в виде кристалла алмаза с единичным коннектором. Такая конструкция обеспечивает стент хорошей продольной гибкостью и высокой сопротивляемостью силе радиального сдавления стента. Полоска металла в стенте Terumo имеет очень низкий профиль (0,08 мм), что (вместе с особенностями конфигурации баллона) сводит к минимуму вероятность повреждения сосудистой стенки в месте имплантации стента.

Стент выпускается смонтированным на баллоне системы доставки. Проксимальнее и дистальнее краев стента имеются пулевидные «пробки», предохраняющие стент от деформации во время его продвижения по артериальному руслу. Баллон цилиндрической формы без сужений по краям. Длина баллона соответствует длине стента. Такая конфигурация баллона сводит к минимуму возможное повреждение эндотелия сосуда вне имплантированного стента.
В настоящее время в странах Дальнего Востока проводятся и планируются исследования, которые позволят оценить результаты имплантаций стента Terumo в коронарные артерии.
Стент V-FLEX Plus (Cook Group Inc., Broomfield, CO, USA)
Стент V-FLEX Plus (рис. 1.57) является баллон-расширяемым трубчатым стентом, сконструированным из зигзагообразных колец, которые скреплены чередующимися V-образными и полоскообразными соединениями, благодаря чему стент обладает высокой гибкостью и жесткостью. Длина стента — 8; 12; 16; 20 и 24 мм; диаметр — от 2,5 до 3,8 мм. Занимаемая площадь в стентированном сегменте — 15% и менее. Профиль стента — <1 мм.

Стент монтируется на системе доставки, которая содержит баллон из полиэтилена, выдерживающий раздувание при давлении 12 атм. Рекомендуемое давление при первом раздувании баллона — 7 атм. Минимальный диаметр требуемого проводникового катетера — 6 F.
Конструкция стента V-FLEX Plus разработана в конце 1996 г. В феврале 1997 г. выполнены первые имплантации стента у животных; в этом же году проведена первая клиническая имплантация стента.
Авторы стента выполнили исследование, позволившее оценить результаты 33 попыток имплантации стента V-FLEX Plus. В этом исследовании 42% повреждений имели тип С по классификации АСС/АНА. Все попытки имплантации стентов V-FLEX Plus были успешными; в госпитальный период тромботические и значительные кардиальные осложнения не были отмечены.
De Scheerder и соавторы сообщили о первом опыте имплантации стентов V-FLEX Plus 100 пациентам, у которых имелось 125 поражений коронарных артерий (44% — тип С по классификации АСС/АНА). Все попытки имплантации (134 стента, из которых 35% имели длину >2 мм) выполнены успешно. Серьезные кардиальные осложнения в период госпитализации не отмечены. Частота рестенозов за 6-месячный период наблюдения составила 18%.
Стенты NIR и NIROYAL (Medinol/SciMed Life Systems, Maple Grove, MN, USA)
Конструкция стента NIR является, на наш взгляд, одной из самых удачных конструкций среди всех стентов, которые применяют в настоящее время. До сих пор при создании стентов использовался принцип компромисса между двумя важнейшими качествами этого инструмента — жесткостью и гибкостью. Некоторые стенты (например проволочные) обладают большой гибкостью в ущерб жесткости; другие (ранние трубчатые) — при значительной жесткости не имеют достаточной гибкости. Авторы стента NIR справедливо отметили, что эти два противоречащие друг другу качества необходимы стенту не одновременно, а на двух разных этапах вмешательства. Гибкость необходима для подведения стента к месту поражения сосуда (то есть до расширения стента), а жесткость требуется уже после имплантации для создания сопротивления силе радиального сжатия со стороны стенки сосуда. Стент NIR сконструирован таким образом, что проходя в сжатом состоянии изогнутый сегмент артерии, его ячейки, расположенные по большой кривизне сосуда, удлиняются (рис. 1.58 А), а те ячейки, которые расположены по малой кривизне, наоборот, укорачиваются (рис. 1.58 Б). После расширения стента с помощью баллона и его имплантации в сосудистую стенку ячейки принимают форму кристаллической решетки алмаза (рис. 1.59), что придает конструкции чрезвычайную жесткость.
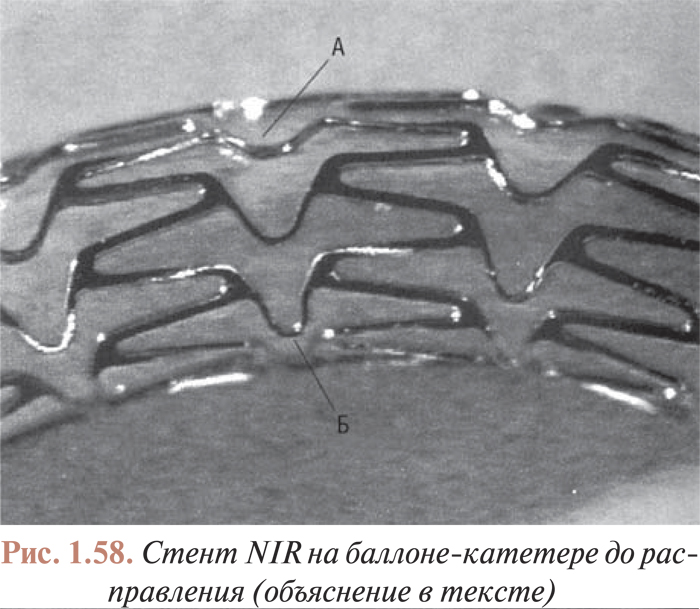
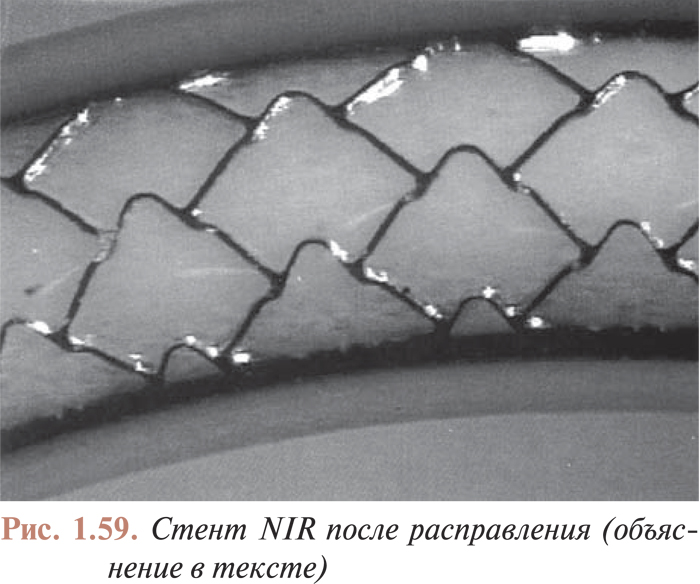
Стенты NIR обладают хорошими общими характеристиками. Их изготавливают из нержавеющей стали. После имплантации занимают 11–18% площади внутренней поверхности стентируемого сегмента. Толщина проволоки — 0,1 мм. Профиль стента в сжатом состоянии — <1 мм. Выпускаемые диаметры — от 2 до 5 мм; выпускаемая длина — 9; 16; 25 и 32 мм. Баллонная система доставки стента требует применения проводникового катетера с внутренним диаметром 6 F. Баллон имеет проксимальную и дистальную рентгенконтрастные отметки.
Стенты NIROYAL от стентов NIR отличаются наличием золотого покрытия, что значительно улучшает их визуализацию. По конструкции и другим характеристикам эти стенты различия не имеют.
В виду того, что стенты NIR и NIROYAL сконструированы совсем недавно, официальных данных о результатах их клинического применения в настоящее время нет.
Элютинг-стенты
Элютинг-стенты находятся в центре внимания интервенционных кардиологов с тех пор, как в сентябре 2001 г. на Конгрессе Европейского кардиологического общества доложены результаты исследования RAVEL. С тех пор исследованы возможности большого количества препаратов, высвобождаемых из различных стентовых платформ как с помощью полимерной основы, так и без таковой. В большом количестве исследований проводили оценку эффекта различных антипролиферативных и противовоспалительных субстанций, таких как сиролимус, паклитаксел, такролимус, эверолимус, и других препаратов, таких как дексаметазон, эстрадиол, батимастат, дактиномицин, метотрексат, ингибиторы тирозинкиназы, винкристин, циклоспорин и C-myc antisense-Technology (Resten-NG, AVI-4126). В качестве препаратов, высвобождающихся из стентов, были также предложены статины, абциксимаб и трапидил. Внутрикоронарная имплантация с помощью элютинг-стентов некоторых антипролиферативных и противовоспалительных препаратов была прекращена, несмотря на благоприятные предварительные экспериментальные и клинические результаты, так как клинические исследования выявили их вред (например дактиномицин в исследовании ACTION (A Coronary disease Trial Investigating Outcome with Nifedipine GITS)) или недостаточную эффективность (например дексаметазон в исследовании STRIDE (Study of Antirestenosis With the BiodivYsio Dexamethasone-Eluting Stent); даже высокие дозы дексаметазона, погруженного на стент, не приводили к существенному снижению пролиферации). Результаты этих исследований показывают, что препараты антипролиферативной группы неоднородно демонстрируют присущие им свойства в отношении предотвращения рестенозов.
Первичные конечные точки рандомизированных исследований элютинг-стентов были как ангиографическими (позднее уменьшение просвета), так и клиническими (повторная реваскуляризация в стентированном сосуде). Для пациентов более важны клинические проявления, чем ангиографические параметры. Поскольку значимость рандомизированных исследований зависит от выбранных конечных точек, исследователи сосредоточили свое внимание на рандомизированных исследованиях, посвященных имплантации элютинг-стентов, изучавших клинические конечные точки. В настоящее время опубликованы результаты только 4 рандомизированных исследований, оценивавших клинические конечные точки и имеющих адекватный интервал наблюдения. Паклитаксел, не имеющий полимерной основы, не достигал клинической первичной конечной точки, в противоположность положительным ангиографическим результатам, продемонстрированным в исследовании DELIVER-I (Drug ELuting coronary stent systems In the treatment of patients with de noVo nativE coronaRy lesions). В противоположность этому, высобождаясь с полимерной основы, паклитаксел значительно улучшил клинические результаты, как это показали исследования TAXUS-IV и TAXUS-VI. Таким образом, не все элютинг-стенты с паклитакселом являются равноценными. Клиническое тестирование сиролимуса проводили только со стентами, имевшими полимерную основу (исследование SIRIUS). Хотя мечта «ни одного рестеноза» пока не реализована, элютинг-стенты привели нас к единичным рестенозам за 9-месячный период наблюдения. В «реальной жизни» (регистр RESEARCH) риск повторной реваскуляризации по клиническим показаниям при имплантации сиролимус-элютинг-стентов составляет 3,7%. По данным регистра Swiss уровень выживаемости без значительных неблагоприятных кардиальных событий в течение 6–9 мес наблюдения составил 95,6%. При имплантации сиролимус-элютинг-стентов в переднюю межжелудочковую ветвь полученные показатели идентичны тем, которые были при реваскуляризации одного сосуда с применением шунтирования. Первые результаты проспективного рандомизированного сравнения стентов Cypher и Taxus (исследование TAXi) показало, что высокие уровни успеха, достигаемые при имплантации обоих стентов, которые получены в ранее проведенных пивотальных рандомизированных исследованиях, могут быть перенесены в повседневную клиническую практику. Результаты этого малого исследования, в которое включили 202 пациента, не продемонстрировали никаких преимуществ одного стента перед другим.
АНАТОМИЯ КОРОНАРНЫХ АРТЕРИЙ. КОМПЛЕКСНЫЙ АНАЛИЗ КОРОНАРОГРАММ
Сердце человека кровоснабжается левой и правой коронарными артериями, которые отходят от восходящего отдела дуги аорты в левом и правом коронарных синусах (рис. 1.60–1.62). Наиболее достоверным методом прижизненной визуализации коронарных артерий в настоящее время является коронарография. Анализ атеросклеротических поражений, выявленных на коронарограммах, определяет тактику лечения больных с коронарным атеросклерозом. Для получения наиболее полноценной информации необходимо иметь знания об анатомической и коронарографической анатомии коронарных артерий, а также владеть методами комплексного коронарографического анализа.
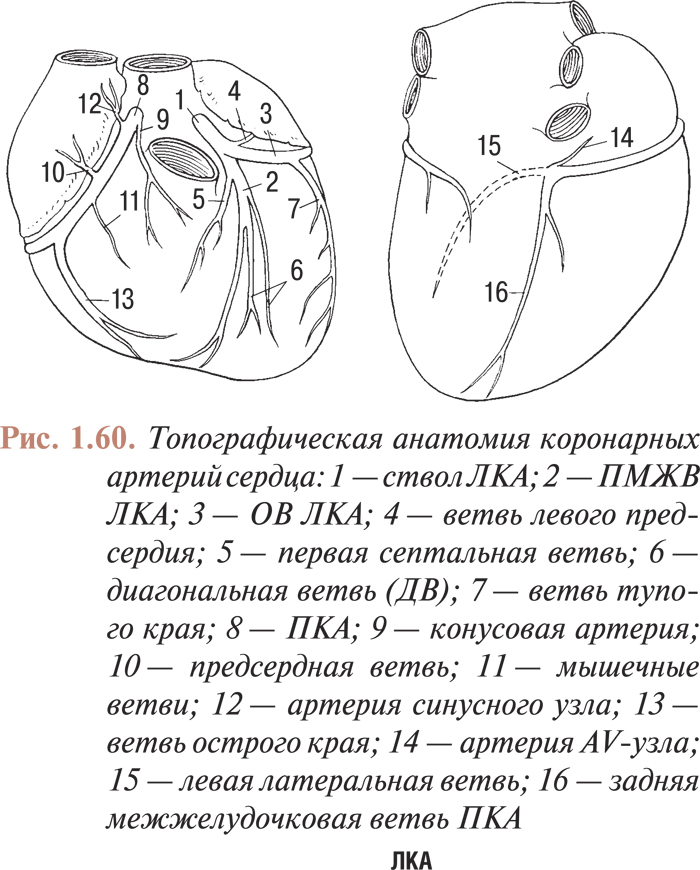
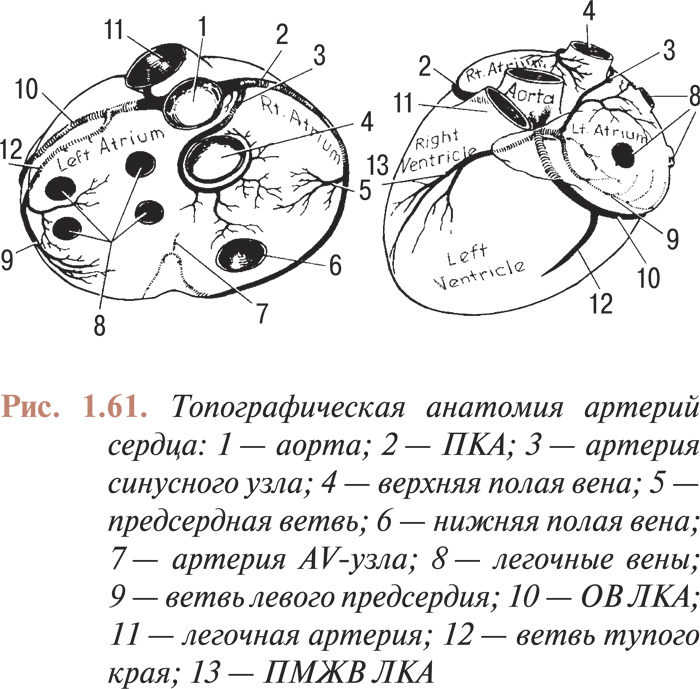
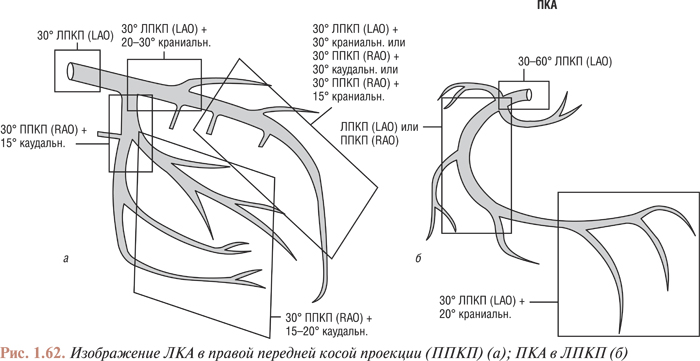
Нормальная и коронарографическая анатомия коронарных артерий. коронарографические проекции
Кровоснабжение сердца человека осуществляется тремя практически равноценными сосудами. Таковыми являются передняя межжелудочковая и огибающая ветви левой коронарной артерии, образующиеся при перекалибровке ствола левой коронарной артерии, а также правая коронарная артерия.
Левая коронарная артерия
Устье левой коронарной артерии открывается в стенке восходящей аорты в верхней части левого коронарного синуса, несколько кпереди, в пространстве между ЛА и ушком левого предсердия. Ствол левой коронарной артерии (сегмент левой коронарной артерии от устья до места ее деления на переднюю межжелудочковую ветвь и огибающую ветвь левой коронарной артерии) может иметь различную длину. Может оканчиваться трифуркацией, включающей, кроме передней межжелудочковой ветви и огибающей ветви, диагональную ветвь, делящую угол между передней межжелудочковой ветвью и огибающей ветвью левой коронарной артерии. Как правило, от ствола левой коронарной артерии не отходят дополнительные ветви. Устье и проксимальный сегмент левой коронарной артерии лучше определяются в проекции «паук». В этой же проекции хорошо визуализируется отхождение огибающей ветви левой коронарной артерии от основной магистрали. Эти особенности проекции можно использовать при определении угла отхождения огибающей ветви левой коронарной артерии при установке стентов (чем острее угол отхождения, тем сложнее доставлять трубчатые стенты в пораженный сегмент огибающей ветви левой коронарной артерии).
Передняя межжелудочковая ветвь левой коронарной артерии
Передняя межжелудочковая ветвь является продолжением ствола левой коронарной артерии, отходя от него кпереди и вниз и располагаясь в передней межжелудочковой борозде. У большинства пациентов эта ветвь продолжается к верхушке и участвует в кровоснабжении ее переднего отдела. Иногда передняя межжелудочковая ветвь левой коронарной артерии располагается интрамиокардиально и тогда во время систолы можно наблюдать прерывистое течение контраста вследствие сдавления этой артерии мышечными мостиками. Проксимальный отдел передней межжелудочковой ветви лучше всего определяется в левой передней косой проекции (LAO) (от 30 до 60°) с краниальной ангуляцией 20–30°. Средняя и дистальная части передней межжелудочковой ветви левой коронарной артерии лучше видны в левой передней косой проекции или правой передней косой проекции (RAO) (от 30 до 60°) без сагиттальной ангуляции. Для того чтобы избежать наложения диагональных ветвей в среднем отделе передней межжелудочковой ветви, можно в правой передней косой проекции использовать небольшую (15–20°) краниальную или каудальную ангуляцию.
Септальные и диагональные ветви
Септальные ветви отходят от передней межжелудочковой ветви под прямым углом и глубоко проникают в межжелудочковую перегородку. Количество септальных ветвей может быть различным. Иногда первая септальная ветвь имеет диаметр, достаточный для проведения ангиопластики и стентирования. Наличие септальных ветвей в крупной артерии подтверждает, что это передняя межжелудочковая ветвь. Часто именно этот признак является дифференциальным в сложных случаях при анализе коронарограмм. Септальные ветви, отходящие от передней межжелудочковой ветви, кровоснабжают ⅔ межжелудочковой перегородки и формируют анастомозы с септальными ветвями от задней межжелудочковой артерии, отходящей либо от правой коронарной артерии, либо от огибающей ветви левой коронарной артерии. Первые септальные ветви лучше всего визуализируются в левой передней косой проекции 30° с краниальной ангуляцией 30° или в правой передней косой проекции 30° с каудальной ангуляцией 15°. Диагональные ветви (см. рис. 1.60–1.62) отходят от передней межжелудочковой ветви под острым углом и, располагаясь под эпикардом, подходят к тупому краю сердца. Количество диагональных ветвей может быть разным, но обычно первые две ветви достаточно велики для проведения ангиопластики и стентирования. Проксимальный отдел первой диагональной ветви лучше всего определяется в левой передней косой проекции 30–45°. Для того чтобы избежать наложения других артерий, лучше использовать правую переднюю косую проекцию 30° с каудальной (15°) или краниальной (30°) ангуляцией.
Огибающая ветвь левой коронарной артерии
Огибающая ветвь левой коронарной артерии отходит от ствола под ушком левого предсердия.
Продолжается влево и кзади в левой части венечной борозды. После отхождения нескольких задних левожелудочковых ветвей, которые опускаются к тупому краю сердца параллельно диагональным ветвям, отходящим от передней межжелудочковой ветви, огибающая ветвь левой коронарной артерии «отдает» ветвь тупого края сердца, которая проходит вдоль него. Дальнейшее продолжение огибающей ветви левой коронарной артерии значительно варьирует. У людей с анатомическим преобладанием огибающей ветви левой коронарной артерии она продолжается выраженной задней межжелудочковой ветвью. В большинстве же случаев огибающая ветвь заканчивается малыми терминальными задними левожелудочковыми ветвями и не переходит в заднюю межжелудочковую борозду. Проксимальный отдел огибающей ветви левой коронарной артерии лучше всего визуализируется в правой передней косой проекции 30° с каудальной ангуляцией 15°, в этой же проекции хорошо видна ветвь тупого края.
Правая коронарная артерия
От правого коронарного синуса отходят 5–6 мелких артерий, питающих переднюю поверхность правого и левого предсердий. Устье правой коронарной артерии открывается в передней стенке восходящей части дуги аорты в средней части правого коронарного синуса и располагается несколько ниже устья левой коронарной артерии. Правая коронарная артерия продолжается вправо и проходит в правой части AV-борозды. Первой ветвью правой коронарной артерии являются конусовая ветвь, кровоснабжающая проксимальный легочный конус и ПЖ. Иногда конусовая ветвь начинается отдельным устьем и при селективной коронарографии правой коронарной артерии не определяется. От правой коронарной артерии кпереди отходят 1–3 правожелудочковые ветви, проходящие по диагонали ПЖ, а кзади — артерия синусного узла, продолжающаяся в краниальном направлении к месту впадения верхней полой вены. На границе средней и нижней трети правой коронарной артерии отходит большая ветвь острого края, которая обычно кровоснабжает только миокард ПЖ. У большинства людей правая коронарная артерия проходит вдоль диафрагмальной поверхности сердца к crux (место соединения правого и левого предсердия, ПЖ и ЛЖ). В большинстве (90%) случаев от правой коронарной артерии отходит артерия AV-узла, после чего правая коронарная артерия проходит в задней межжелудочковой борозде в виде задней межжелудочковой ветви. Диаметр этой артерии значительно варьирует, однако у большинства больных он достаточно большой для выполнения ангиопластики и стентирования. Проходя в задней межжелудочковой борозде, правая коронарная артерия «отдает» септальные ветви, которые, отходя под прямым углом, кровоснабжают нижнюю треть межжелудочковой перегородки. Эти ветви могут обеспечить достаточный коллатеральный кровоток через септальные артерии в систему левой коронарной артерии.
Устье и проксимальный отдел правой коронарной артерии лучше всего видны в левой передней косой проекции 45–60°. Средний отдел правой коронарной артерии хорошо визуализируется как в правой передней косой проекции, так и левой. Иногда используют латеральную проекцию для визуализации средней трети правой коронарной артерии, которая в области crux и задней межжелудочковой борозды определяется в левой передней косой проекции 30° с краниальной (20–30°) ангуляцией или в правой передней косой проекции 30° с небольшой (15–20°) краниальной ангуляцией.
Анализ коронарограмм при коронарном атеросклерозе
Несмотря на то что селективную коронарографию в кардиологической практике применяют уже более 30 лет, методы анализа коронарограмм продолжают развиваться и совершенствоваться. Этот процесс неразрывно связан с внедрением принципиально новых способов лечения больных с коронарным атеросклерозом. Прижизненная визуализация коронарного русла позволила в первую очередь достоверно констатировать сам факт атеросклеротического поражения коронарных артерий и тем самым дифференцированно подойти к лечению пациентов с различными формами ИБС. С развитием кардиальной хирургии (внедрение операций обходного шунтирования коронарных артерий) появилась необходимость в более тщательном анализе коронарограмм: без сведений о локализации атеросклеротических обструкций, степени поражения артерий и распространенности процесса невозможно выполнение шунтирующих операций. Внедрение и широкое распространение инвазивных внутрикоронарных методов лечения коронарного атеросклероза стимулировало развитие новых методов анализа коронарограмм. Так, если для проведения шунтирующих операций сведений о степени, локализации и распространенности атеросклеротического процесса достаточно, то для выполнения внутрикоронарных вмешательств требуется дополнительная информация. Это обусловлено тем, что точкой приложения внутрикоронарных вмешательств является не весь пораженный коронарный сосуд, а непосредственно тот морфологический субстрат, который вызвал критическое уменьшение просвета артерии. После внедрения метода ЧТКА эту операцию выполняли у больных только с хронической клинической формой коронарного атеросклероза и только в тех случаях, когда при коронарографии у них выявляли единичное атеросклеротическое поражение коронарной артерии в виде концентрического дискретного стеноза, суживавшего просвет артерии на 50–95%. Сейчас эту операцию выполняют как при хронической, так и при острой формах коронарной болезни; как при однососудистом, так и при двух-, трехсосудистом поражении коронарного русла; как при стенозах, так и при окклюзиях коронарных артерий. Неудивительно, что при этом увеличилось количество безуспешных попыток и осложнений ЧТКА.
Анализируя первичные (выполненные до ЧТКА) коронарограммы больных, у которых после проведения ангиопластики возникли осложнения, исследователи обратили внимание на то, что атеросклеротические бляшки, подвергшиеся дилатации, имеют нетипичную коронарографическую конфигурацию. Этот факт дал повод думать, что «неправильная» конфигурация стенозов, определяемая на коронарограммах, отражает морфологические изменения, происходящие в этих бляшках, а именно — процессы их разрушения и внутрипросветного тромбообразования. Исследование Levin и Fallon, в котором проведено сравнение данных посмертного коронарографического и патоморфологического исследования коронарных артерий одних и тех же больных, умерших от осложнений коронарного атеросклероза, подтвердили правильность этих предположений. Это исследование, а также ряд других положили начало внедрения метода качественного анализа коронарограмм. Этот метод, в настоящее время усовершенствованный, позволяет с высокой степенью достоверности определить прижизненное морфологическое состояние атеросклеротических обструкций коронарных артерий больных с коронарным атеросклерозом. Прижизненная информация о морфологическом состоянии атеросклеротических повреждений важна как для прогноза течения коронарного атеросклероза (известно, что деструкция атеросклеротических бляшек является основным условием перехода хронической формы коронарного атеросклероза в острые — нестабильную стенокардию и ИМ), так и для определения показаний к ЧТКА и прогнозирования возможных осложнений этой операции.
Таким образом, для того чтобы выбрать правильную тактику лечения больных с коронарным атеросклерозом и определить показания к тому или иному виду оперативного вмешательства, необходимо использовать несколько методик анализа коронарограмм. Во-первых, следует установить общие коронарографические характеристики атеросклеротического поражения коронарных артерий (количество атеросклеротических обструкций и их посегментную локализацию в коронарном русле). Во-вторых, провести количественный коронарографический анализ каждой из обструкций (определить степень сужения просвета и длину обструкции). В-третьих, проанализировать качественные коронарографические характеристики обструкций (определить признаки разрушения атеросклеротических бляшек и внутрипросветного тромбообразования, а также выраженность этих процессов). Кроме того, на результаты интервенционных процедур влияют некоторые анатомические особенности локализации обструкций (расположение обструкции в месте значительного изгиба артерии, дистальнее нескольких изгибов, в месте бифуркации артерии и т.п.). Эти особенности также необходимо учитывать при определении показаний к операциям.
Анализ общих и количественных коронарографических характеристик
При оценке коронарограмм следует проводить анализ общих и количественных коронарографических характеристик атеросклеротического поражения коронарных артерий в полном объеме. Анализируя общие коронарографические характеристики поражения коронарного русла, необходимо определить количество пораженных коронарных артерий, количество повреждений в каждой артерии, посегментную локализацию обструкций в эпикардиальных сосудах, наличие повреждений в артериях второго и третьего порядка, состояние дистального русла.
При выборе тактики лечения больных с коронарным атеросклерозом очень важна правильная оценка общих коронарографических характеристик. Так, наличие многососудистого диффузного поражения является, как правило, показанием к проведению шунтирующей операции (хотя необходимо отметить, что в последнее время при многососудистом поражении все чаще проводят эндоваскулярные вмешательства); наличие же поражений в дистальных (с диаметром просвета <1 мм) отделах артерий обычно является противопоказанием к их шунтированию. При сужении ствола левой коронарной артерии показана как операция обходного шунтирования, так и стентирование. Как уже указано, наличие единичного дискретного поражения в коронарном русле является показанием к проведению ЧТКА или интракоронарного стентирования; выполнение шунтирующих операций в этих случаях нецелесообразно.
Количественный анализ коронарограмм, как и анализ общих коронарографических характеристик коронарного атеросклероза, является одним из первых методов коронарографического анализа, применяемых в кардиологии. Такими критериями являются степень сужения просвета коронарной артерии вследствие каждой атеросклеротической обструкции и длина атеросклеротической обструкции. Степень сужения просвета определяется отношением ширины максимального сужения просвета в зоне поражения к ширине просвета «непораженного» участка артерии, расположенного дистально непосредственно возле обструкции, и выражается в процентах (рис. 1.63). Существует несколько классификаций степени стенозирования коронарных артерий. Наиболее распространенной из них является классификация Conti и соавторов (1977).
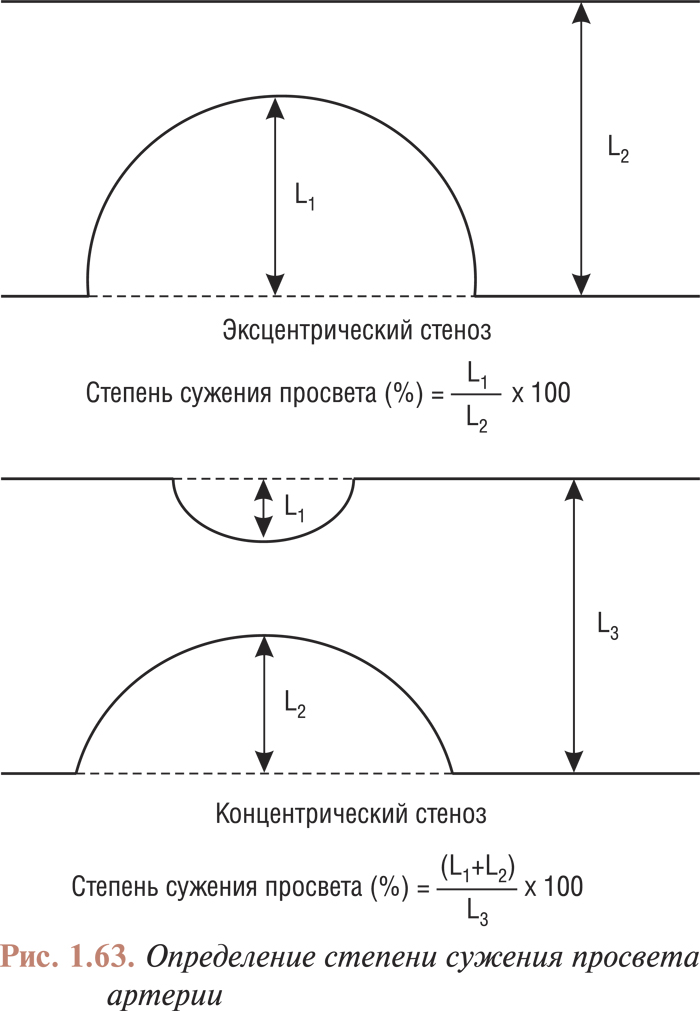
Длина повреждений определяется расстоянием между проксимальной и дистальной точками видимого на коронарограмме изменения просвета артерии и выражается в миллиметрах. Для определения истинной степени сужения просвета, так же, как и истинной длины стеноза, необходимо учитывать погрешность ангиографической и проекционной аппаратуры. Для этого в качестве константной величины используется соотношение между истинной шириной дистальной части коронарографического катетера и шириной этого катетера, видимого на коронарограмме. Как было установлено в исследованиях, в том числе проведенных в Национальном научном центре «Институт кардиологии им. Н.Д. Стражеско», результаты коронарной ангиопластики существенно зависят от длины стеноза: при длине стенозов 2 см и более повышается вероятность их неполной дилатации.
Современная ангиографическая аппаратура оснащена приспособлениями, которые позволяют проводить компьютерную обработку коронарографических данных, что в значительной степени упрощает анализ количественных коронарографических характеристик атеросклеротических поражений коронарных артерий. Однако на основании данных количественного анализа коронарограмм нельзя прогнозировать развитие острых коронарных ишемических синдромов, так как известно, что их развитие зависит не от степени тяжести поражения коронарных артерий, а от процессов, обусловивших осложненный рост атеросклеротических бляшек. Процессы разрушения атеросклеротических бляшек и внутрипросветного тромбообразования при жизни больных с коронарным атеросклерозом можно определить на основании критериев качественного анализа коронарограмм.
Анализ качественных коронарографических характеристик
Прижизненная информация о морфологическом состоянии атеросклеротических обструкций коронарных артерий несомненно важна, поскольку позволяет прогнозировать клиническое течение коронарного атеросклероза и предположить возможные неблагоприятные исходы внутрикоронарных вмешательств. Однако кардиологи не всегда достаточно точно интерпретируют качественные коронарографические характеристики коронарного атеросклероза. Это дает основание более детально описать критерии качественного анализа коронарограмм, которые применяются в современной кардиологии.
Уже упоминалось, что исследование, выполненное Levin и Fallon в 1982 г., стало основополагающим в развитии качественного анализа коронарограмм. Эти авторы выполнили посмертную коронарографию у 39 больных с коронарным атеросклерозом, которые умерли от ИМ или во время проведения шунтирующих операций. Данные посмертной коронарографии сравнивали с гистологическими срезами в местах повреждений коронарных артерий. Проведен анализ 73 стенозов коронарных артерий (от 50 до 99%), выявленных у этих больных. Гистологический анализ срезов коронарных артерий проводили в точном соответствии с каждой зоной сужения, определенного на посмертных коронарограммах.
Все стенозы, выявленные на посмертных коронарограммах, авторы разделили на 2 группы: стенозы типа I (простые), имеющие широкое основание и четкий ровный контур (конфигурация «часового стекла») без выпячиваний внутрь просвета сосуда по контуру стеноза, и стенозы типа II (сложные), имеющие неровный контур в виде язвенных ниш и/или внутрипросветных выпячиваний. По результатам гистологического исследования атеросклеротические обструкции разделили на неосложненные (с интактной интимой) и осложненные (с разрывами и изъязвлениями интимы, кровоизлияниями в ткань бляшки, внутрибляшечными и внутрипросветными тромбами). Ангиографическое и гистологическое исследование простых стенозов и неосложненных обструкций совпало в 88% случаев (31 из 35); сложных стенозов и осложненных обструкций — в 78% случаев (30 из 38). По данным этого исследования, чувствительность метода определения морфологического состояния атеросклеротических бляшек на посмертных коронарограммах составила 88%; специфичность — 79%.
Подобное исследование выполнено в Национальном научном центре «Институт кардиологии им. Н.Д. Стражеско». В этом исследовании, в отличие от работы Levin и Fallon, кроме сопоставления результатов посмертных коронарограмм и патоморфологического исследования, сравнивали также данные прижизненных коронарограмм 28 больных, умерших от осложнений коронарного атеросклероза. При этом особое внимание обращали на возможность прижизненного выявления коронарографических признаков разрушения атеросклеротических бляшек и внутрипросветного тромбообразования, прижизненную дифференциальную диагностику признаков разрушения и признаков тромбообразования, определение коронарографических признаков интенсивности каждого из этих процессов. Кроме того, анализировали возможность прижизненного определения характера окклюзии коронарных артерий (дифференцированная оценка коронарографических признаков острого тромботического и хронического атеросклеротического процессов).
Результаты исследования показали, что анализ прижизненных коронарограмм позволяет с высокой степенью достоверности (чувствительность метода — 92%, специфичность — 83%) определить осложненный рост атеросклеротических бляшек и морфологический характер окклюзии, дифференцировать признаки разрушения бляшек и внутрипросветного тромбообразования, установить интенсивность этих процессов.
На основании данных приведенных морфологических исследований, а также ряда клинических исследований, посвященных применению метода качественного анализа коронарограмм как для прогнозирования клинического течения ИМ и нестабильной стенокардии, так и для определения вероятности возможных неблагоприятных исходов коронарной ангиопластики при острых и хронических клинических формах коронарного атеросклероза, мы предлагаем следующую схему качественного анализа коронарограмм:
- определение морфологического типа стеноза (по классификации Ambrose, 1985);
- дифференцированное определение коронарографических признаков разрушения атеросклеротических бляшек и внутрипросветного тромбообразования, а также установление выраженности каждого из этих процессов;
- вычисление индекса изъязвленности атеросклеротических бляшек (по методике Wilson);
- определение коронарографических признаков морфологического состояния окклюзии (дифференцирование острой тромботической и хронической атеросклеротической окклюзии).
По классификации Ambrose все стенозы, определяемые на коронарограммах, подразделяются на следующие типы (рис. 1.64):
- концентрические;
- эксцентрические типа I;
- эксцентрические типа II;
- стенозы с множественными сужениями.
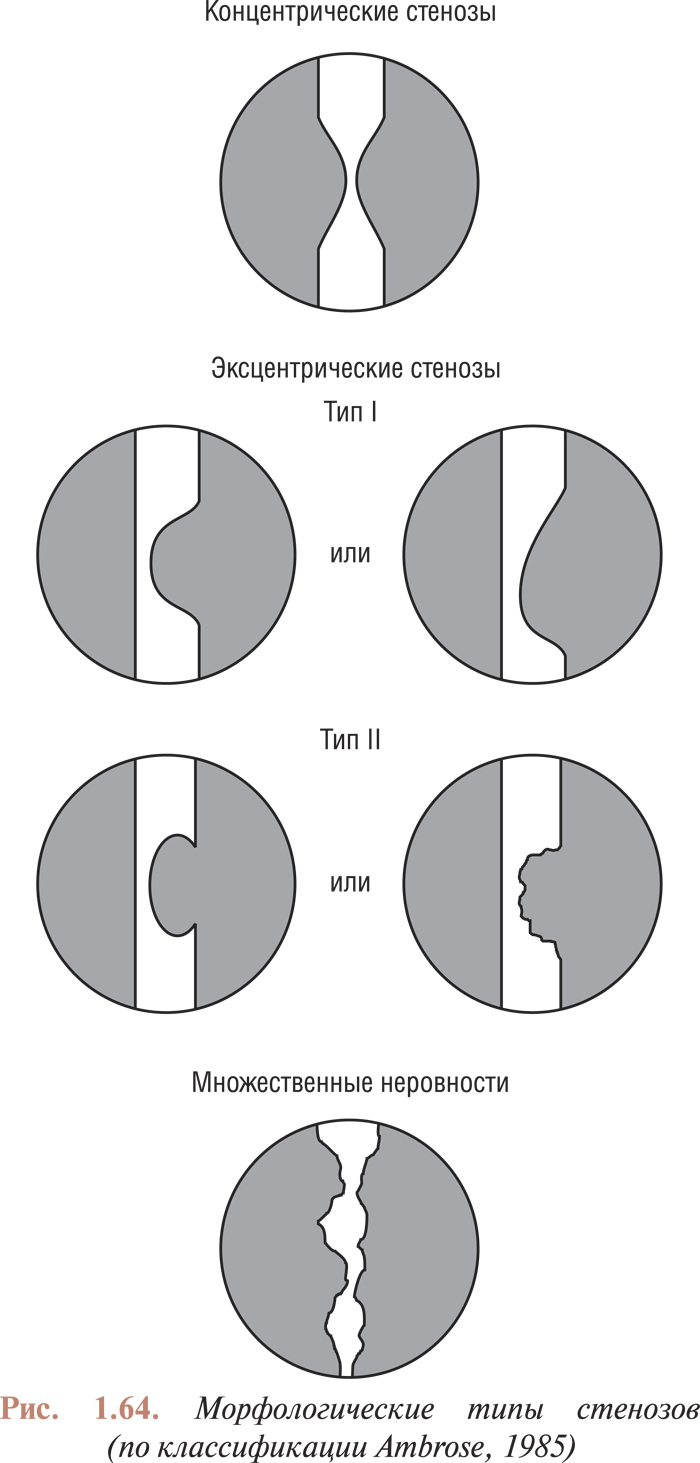
Концентрическими (рис. 1.65) считаются те стенозы, при которых просвет артерии симметрично сужен по контуру обеих стенок сосуда, при этом концентричность стеноза определяется во всех коронарографических проекциях. Эксцентрическими считаются стенозы, суживающие просвет сосуда по контуру одной из его стенок, или если сужение просвета по контуру одной сосудистой стенки значительно превышает сужение по контуру противоположной. Для эксцентрических стенозов типа I (рис. 1.66, 1.67) характерно наличие широкого основания и четкого ровного контура. Эксцентрические стенозы типа II характеризуются либо неровностью контура (при этом сужение просвета артерии чередуется с некоторым его расширением и последующим повторным сужением), либо узким основанием и нависающими над стенкой сосуда проксимальным и/или дистальным краями. Стенозы с множественными сужениями характеризуются несколькими (3 и более) сужениями в пределах одного поражения.
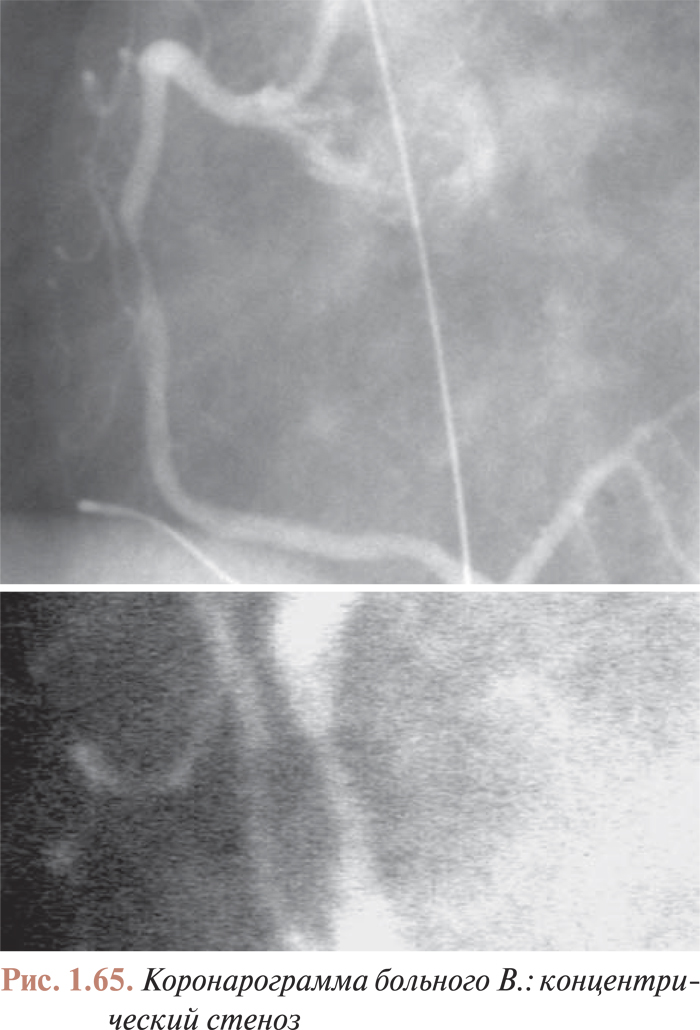
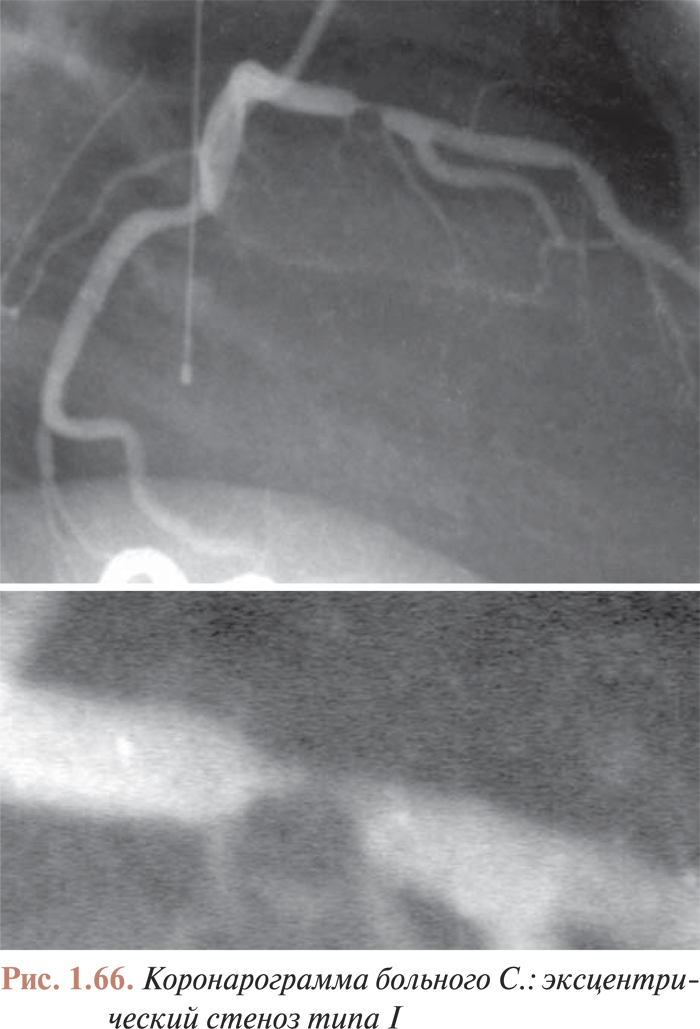
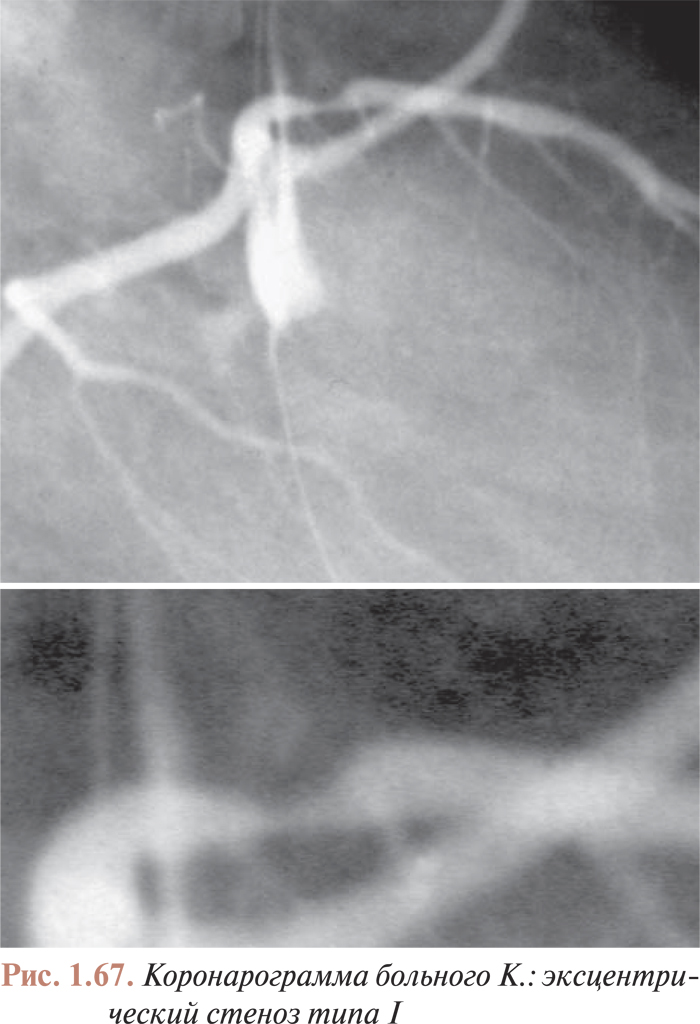
Согласно этой классификации концентрические стенозы и эксцентрические стенозы типа I являются неосложненными (простыми) и отражают отсутствие деструктивных процессов в атеросклеротической бляшке; эксцентрические стенозы типа II, а также стенозы с множественными сужениями считаются осложненными (сложными) и отражают либо процесс разрушения атеросклеротической бляшки, либо более или менее выраженное внутрипросветное тромбообразование в зоне деструкции. Необходимо отметить, что стенозы с множественными сужениями на коронарограммах больных с коронарным атеросклерозом отмечают довольно редко; наличие подобных стенозов, как правило, сопровождается коронарографическими признаками кальциноза в зонах этих обструкций (IV стадия атеросклеротического процесса).
Классификация Ambrose позволяет выявить коронарографические признаки деструкции атеросклеротических бляшек. Однако чтобы прогнозировать осложненное течение коронарного атеросклероза и особенно риск развития возможных осложнений коронарной ангиопластики, необходимо достоверно определить выраженность внутрипросветного тромбообразования в зонах атеросклеротической обструкции. В исследовании Cowley и соавторов предпринята попытка систематизировать коронарографические признаки тромбообразования. В клинико-морфологическом исследовании, выполненном в Национальном научном центре «Институт кардиологии им. Н.Д. Стражеско», установлено, что каждому этапу осложненного течения коронарного атеросклероза соответствует определенная ангиографическая картина. Коронарографическими признаками разрушения атеросклеротических бляшек являются:
- негомогенность контрастирования или нечеткий («размытый») контур стеноза (рис. 1.68);
- неровный контур стеноза, имеющий углубление в виде язвенной ниши (симптом «минус ткань») (рис. 1.69а, б).
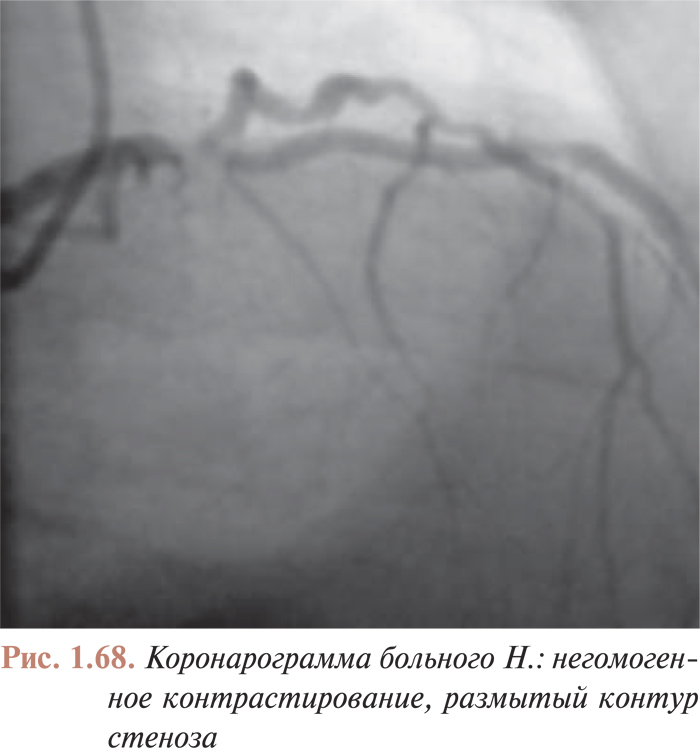
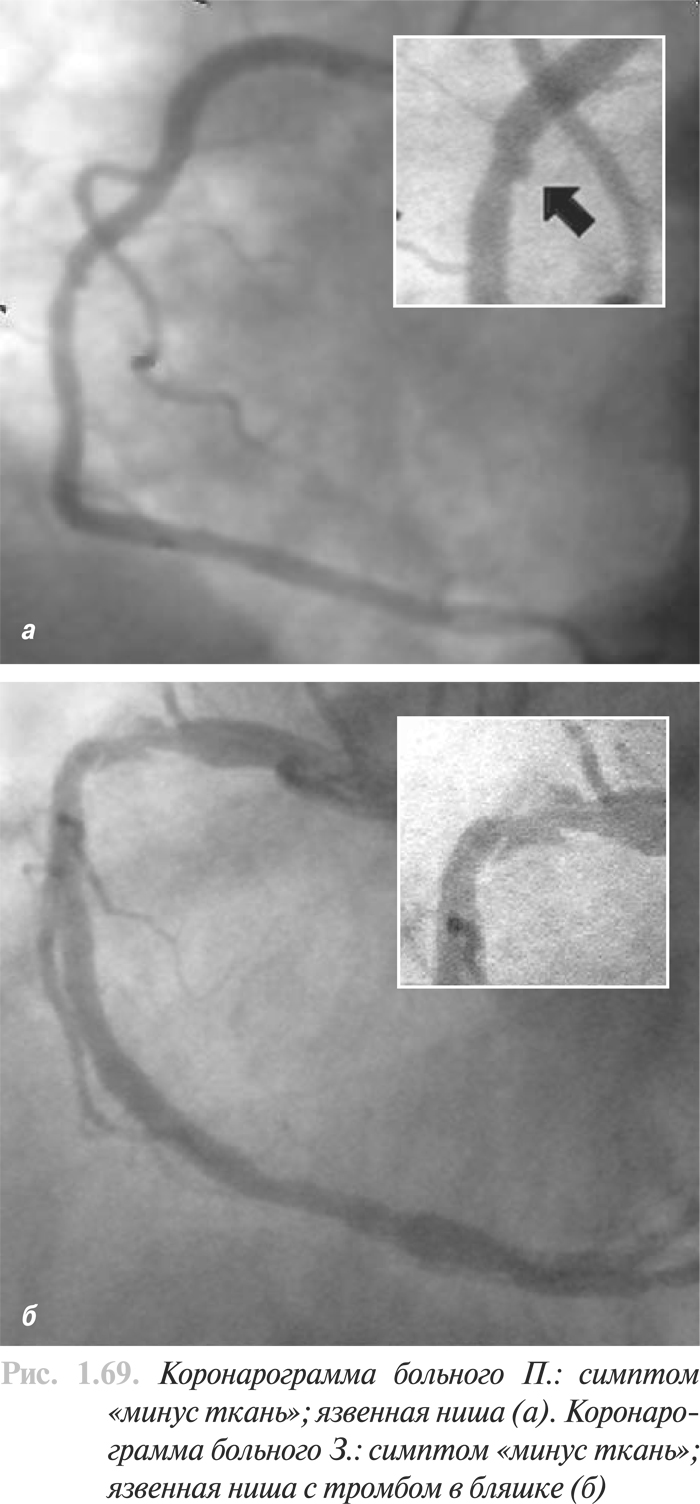
К коронарографическим признакам внутрипросветного тромбообразования относят:
- неровность контура стеноза в виде внутрипросветных выпячиваний (симптом «плюс ткань») (рис. 1.70а, б );
- стенозы с узким основанием и нависающими над стенкой артерии проксимальным и/или дистальным краями (рис. 1.71а, б );
- внутрипросветные дефекты наполнения, проявляющиеся на коронарограммах в виде дискретных внутрипросветных образований, гомогенно окруженных непрозрачным контрастом, которые локализуются на стенозе либо непосредственно рядом с ним (рис. 1.72а, б ).
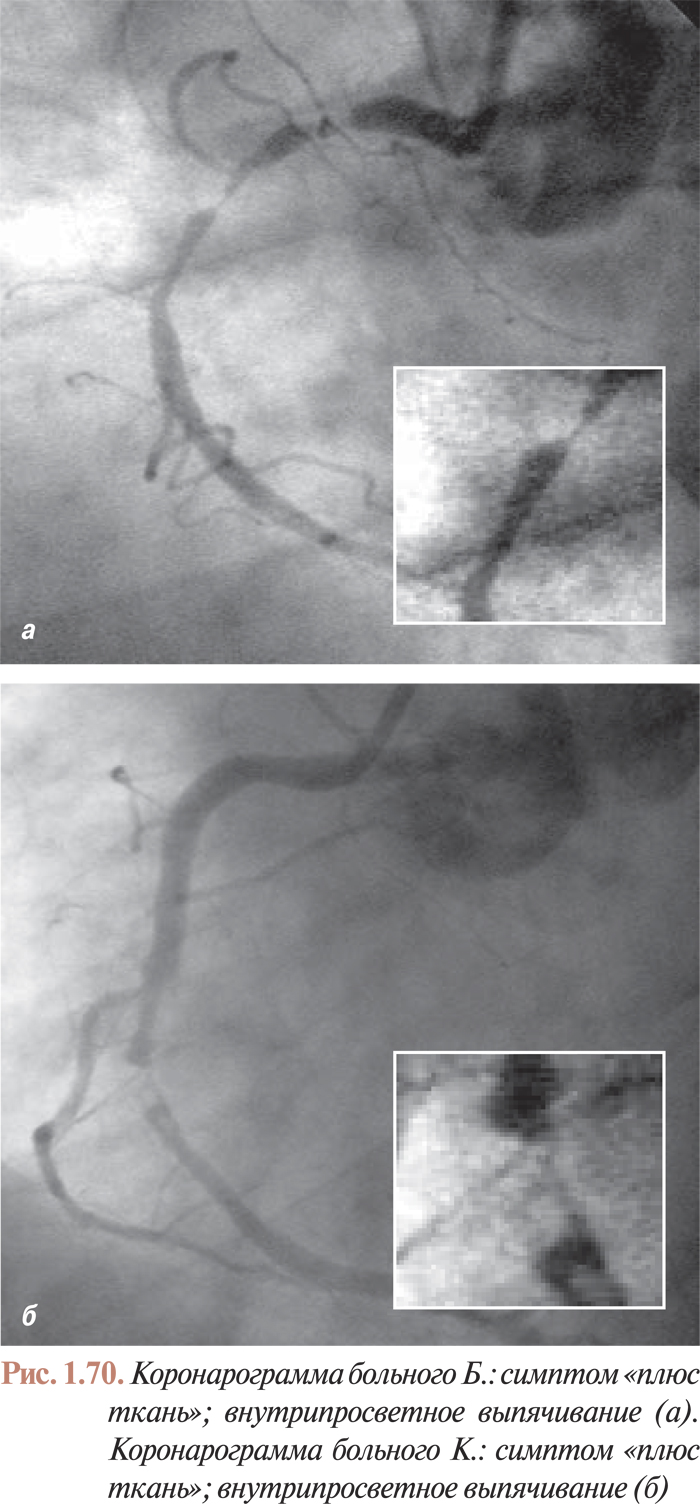
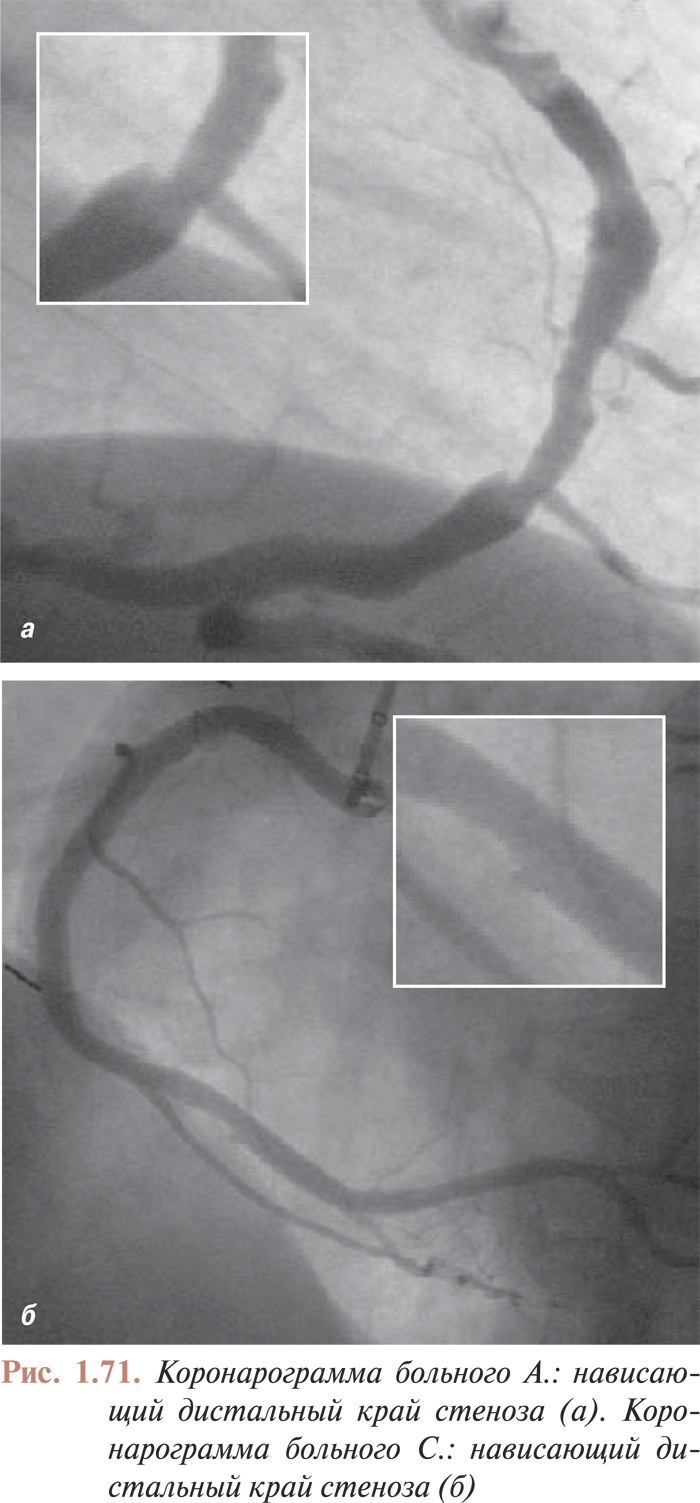
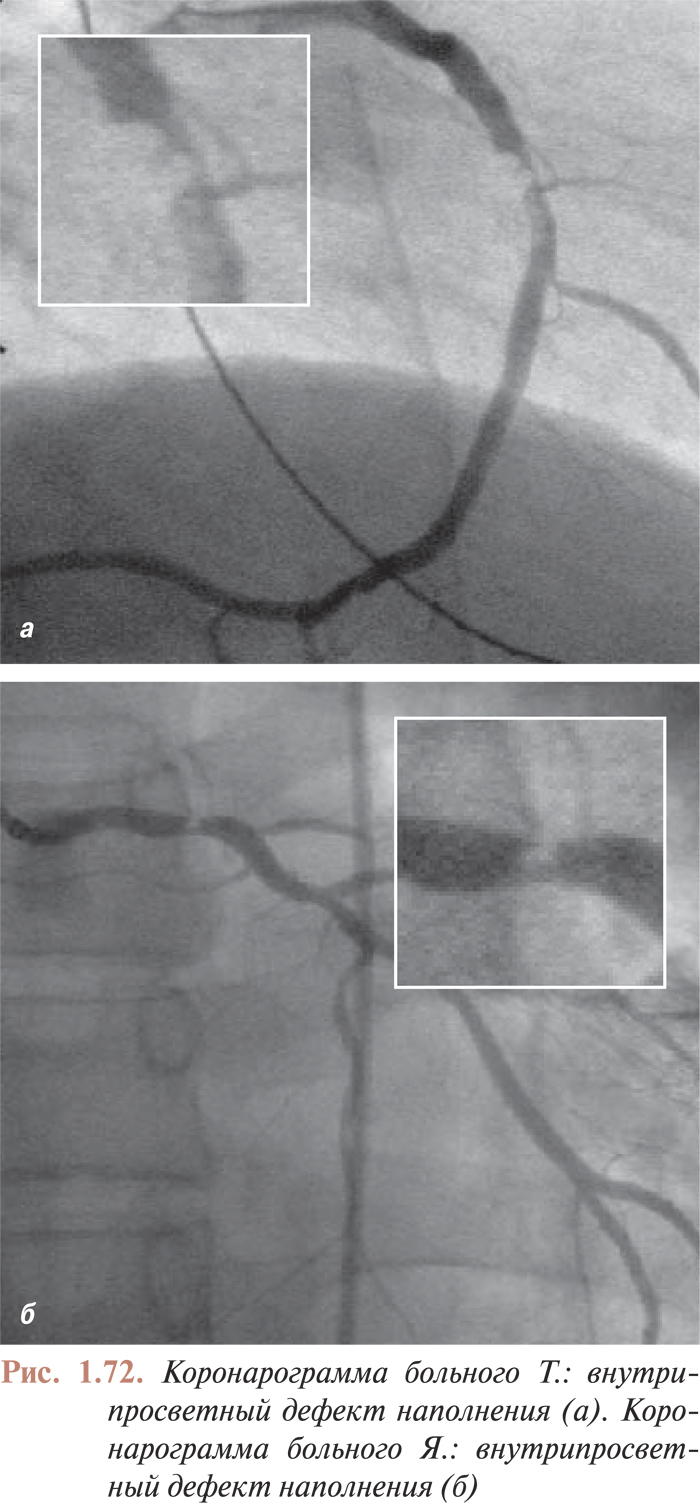
Результаты этого исследования также показали, что негомогенность контрастирования просвета и нечеткий контур стеноза являются признаками незначительного разрушения атеросклеротических бляшек, в то время как наличие язвенной ниши свидетельствует о глубоком разрушении атеросклеротической бляшки с проникновением деструкции в мышечный слой коронарной артерии. Неровность контура в виде внутрипросветных выпячиваний является признаком незначительного внутрипросветного тромбообразования, а наличие стенозов с нависающими краями или внутрипросветных дефектов наполнения — значительного внутрипросветного тромбоза.
Важным показателем качественного анализа коронарограмм является определение индекса изъязвленности по методике Wilson. В исследовании Wilson и соавторов, выполненном в 1986 г., установлено, что при наличии коронарографических признаков значительного разрушения атеросклеротических бляшек (язвенная ниша, симптом «минус ткань») целесообразно определять индекс изъязвленности, поскольку по данным исследования величина этого показателя находится в обратно пропорциональной зависимости от вероятности обострения клинического течения коронарного атеросклероза. Индекс изъязвленности (по Wilson) определяется как отношение ширины просвета в месте меньшего сужения к максимальной ширине просвета в пределах анализируемого стеноза (рис. 1.73). В исследовании Wilson и соавторов выявлено, что при стенозах, которые обусловили развитие ИМ, величина индекса изъязвленности составила 0,61±0,03, в то время как при стенозах, не вызывавших острых нарушений коронарного кровообращения, — 0,90±0,02. Величина индекса изъязвленности в артериях, обусловивших нестабильную стенокардию, составила 0,62±0,05, а у больных со стабильной стенокардией — 0,96±0,05.
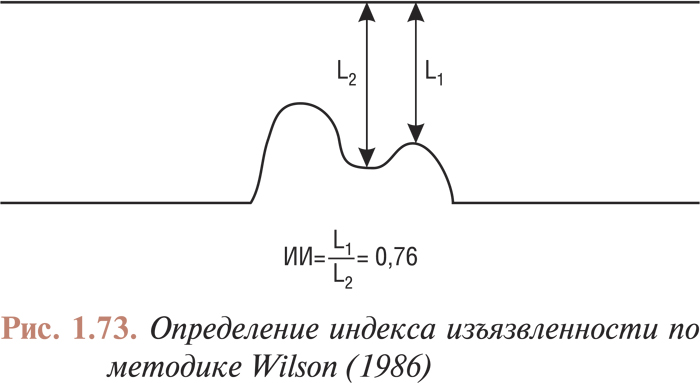
Прижизненное морфологическое определение обструкций коронарных артерий, обусловивших их полную окклюзию, также является важным этапом качественного анализа коронарограмм. В исследованиях Ellis и соавторов, Ryan и соавторов установлено, что при определении показаний к проведению ЧТКА необходимо учитывать характер окклюзии: вероятность успешного выполнения коронарной ангиопластики значительно выше при острой тромботической окклюзии в отличие от хронической атеросклеротической окклюзии.
В исследовании, проведенном Ю.Н. Соколовым и соавторами, установлено, что качественный анализ прижизненных коронарограмм позволяет дифференцировать эти виды окклюзии: острый тромботический характер окклюзии на коронарограмме проявляется в виде резкого обрыва просвета артерии с перпендикулярным стенке или выпуклым в проксимальную сторону ее краем (рис. 1.74); хронический атеросклеротический характер окклюзии проявляется постепенным «конусообразным» сужением просвета артерии до ее полной окклюзии (см. рис. 1.74).
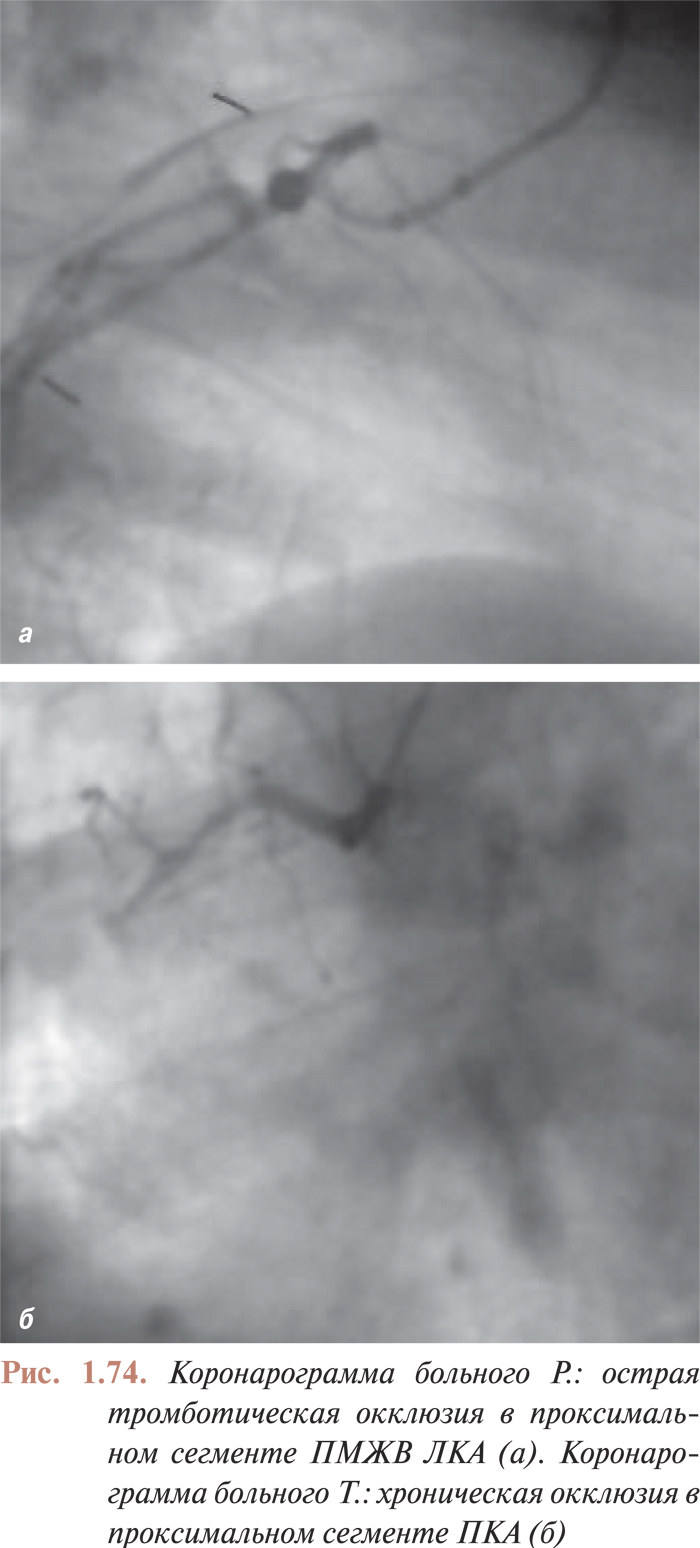
Анализ качественных коронарографических характеристик атеросклеротических поражений коронарных артерий при всей своей информативной ценности является достаточно трудоемкой процедурой. Его проведение требует соблюдения ряда условий. Во время изучения коронарограммы следует выбрать ту проекцию, в которой признаки деструкции анализируемой атеросклеротической бляшки проявляются наиболее явно. Если анализ коронарограммы проводят по кинофильму, то после выбора оптимальной проекции необходимо отобрать 6 кинокадров, соответствующих концу диастолы, коронарографическую картину увеличить в 3 раза по отношению к истинным размерам и по полученному изображению провести качественный анализ коронарограмм. Кроме того, учитывая субъективность метода, рекомендуется, чтобы качественный анализ коронарограмм проводил врач (а лучше — группа врачей), который не знаком с клиническим течением заболевания у данного пациента и который не выполнял коронарографию. Однако несмотря на некоторую громоздкость и субъективность, качественный анализ коронарограмм на сегодня является единственным методом, который с высокой степенью достоверности позволяет определить прижизненное морфологическое состояние атеросклеротических поражений коронарных артерий у больных с коронарным атеросклерозом.
Анализ анатомических особенностей локализации атеросклеротических повреждений в коронарном русле
Опыт выполнения внутрикоронарных лечебных вмешательств при коронарном атеросклерозе показал, что на их результаты значительное влияние оказывают анатомические особенности локализации атеросклеротических обструкций: повреждение дистальнее значительной извитости коронарной артерии (2 изгиба и более) (рис. 1.75); локализация в месте значительного изгиба сосуда (рис. 1.76); в месте бифуркации коронарной артерии (рис. 1.77); в устье эпикардиального сосуда (рис. 1.78).
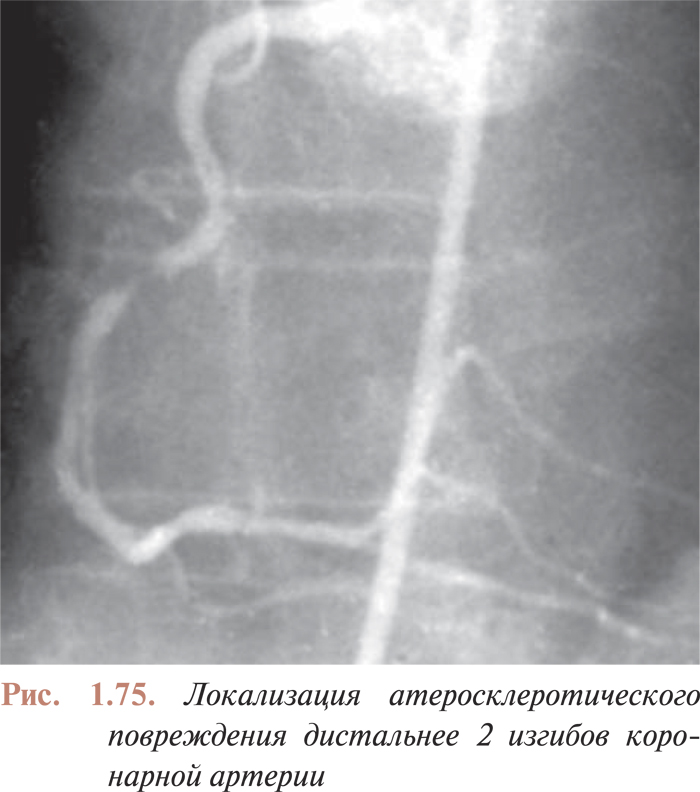
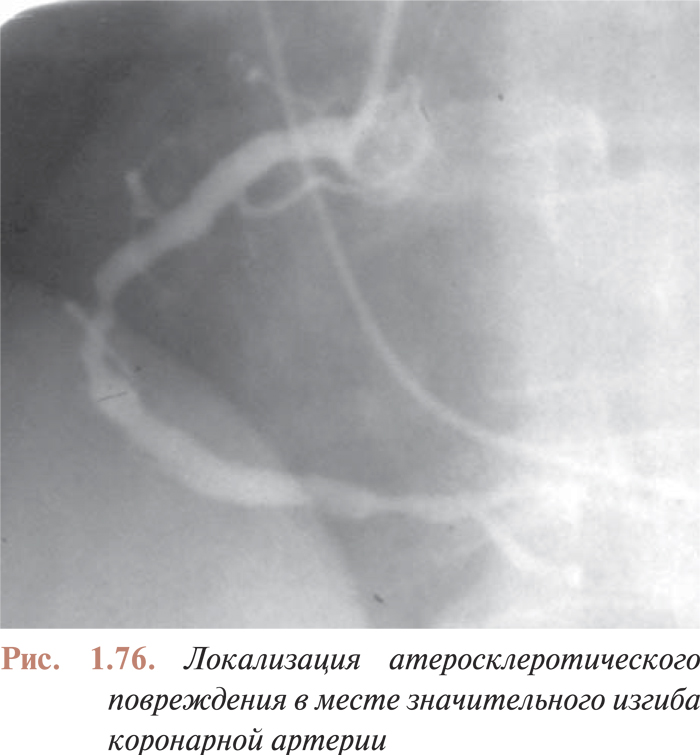

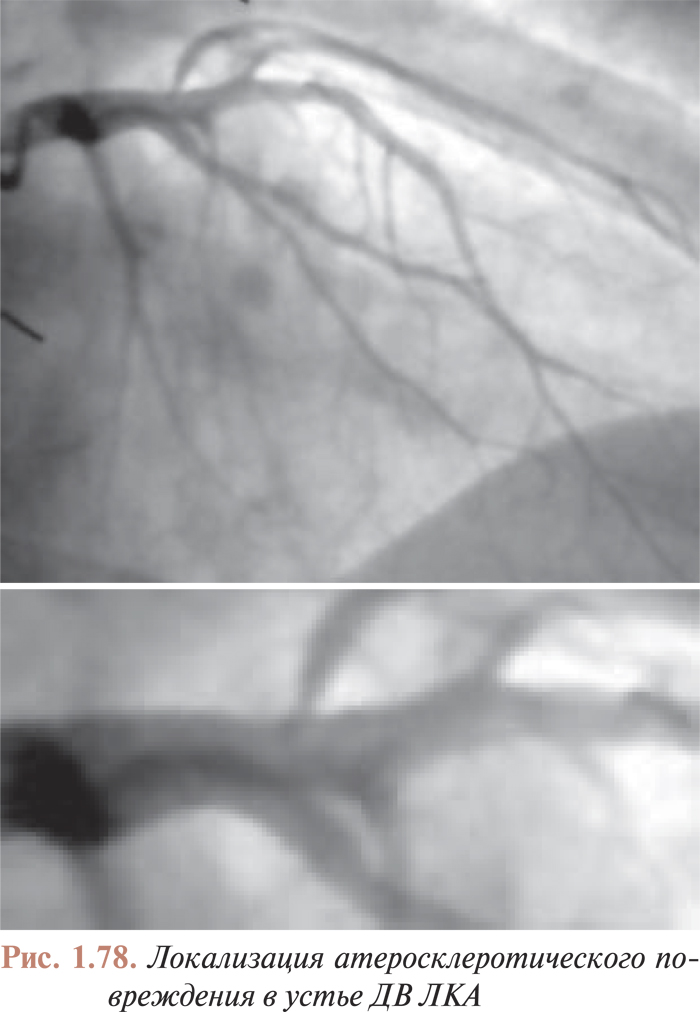
При определении извитости коронарной артерии учитывают количество изгибов, располагающихся проксимальнее атеросклеротической обструкции. Извитость проксимального отдела артерии считается значительной в том случае, если в этом отделе определяют 2 изгиба и более. В случае локализации атеросклеротической обструкции в месте изгиба коронарной артерии необходимо определить его угол. Изгиб артерии определяется углом, который образован отрезком прямой, являющейся продолжением продольной оси отдела артерии, расположенного проксимальнее изгиба, и отрезком продольной оси артерии дистальнее изгиба (рис. 1.79). Изгиб артерии считается значительным, если равен или превышает 60°. Бифуркационными считаются те стенозы, которые локализуются в месте перекалибровки эпикардиальной артерии и поражают устья обеих дочерних артерий. Стенозами устья артерии являются стенозы, располагающиеся в местах перекалибровки коронарной артерии и поражающие устье одной из ветвей.
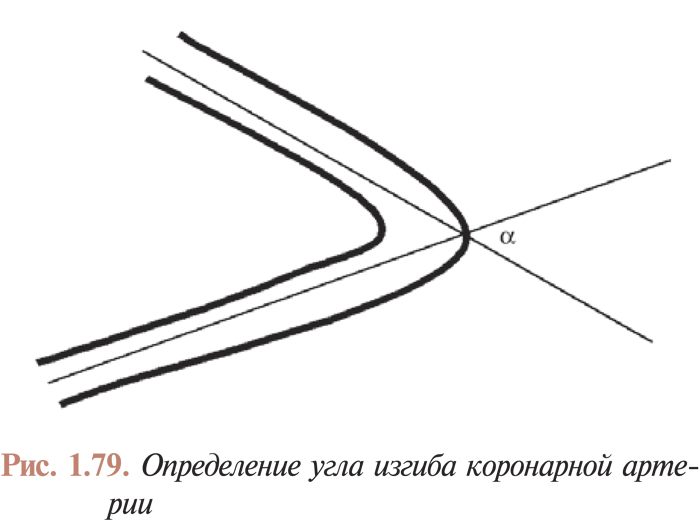
Комплексный анализ коронарограмм
В табл. 1.11 представлены критерии комплексного анализа коронарограмм, которые должны быть отражены в коронарографическом протоколе с учетом общих, количественных, качественных и анатомических характеристик атеросклеротического поражения коронарных артерий. На основании этих критериев определяют вероятность безуспешных попыток и осложнений внутрикоронарных вмешательств. Кроме того, в протоколе коронарографического анализа необходимо приводить изображения стенозов и окклюзий (в случае анализа кинокоронарограмм — срисованные в трехкратном увеличении на миллиметровую бумагу).
Таблица 1.11
Критерии комплексного анализа коронарограмм, которые необходимо отражать в коронарографическом протоколе
| Критерии анализа коронарограмм | |
| количественные | качественные |
|
Стенозы:
|
| Анатомические | |
|
|
Согласно результатам некоторых исследований прогнозировать осложнение клинического течения коронарного атеросклероза можно только на основании комплексного анализа коронарограмм. На основании общего и количественного анализа можно определить тяжесть атеросклеротического поражения коронарного русла, однако предположить возможность развития острых коронарных ишемических синдромов на основании этих данных нельзя. Прогнозировать развитие ИМ и нестабильной стенокардии можно на основании анализа качественных коронарографических характеристик: признаки разрушения атеросклеротических бляшек и внутрипросветного тромбообразования позволяют предположить осложнение клинического течения коронарного атеросклероза. Эта информация позволяет определить сроки проведения внутрисосудистых вмешательств у больных с коронарным атеросклерозом. На основании комплексного анализа коронарограмм можно прогнозировать неудачные попытки и осложнения внутрикоронарных лечебных процедур. Большой процент неудачных попыток коронарной ангиопластики отмечен при дилатации хронической атеросклеротической окклюзии, а также локализации стенозов в местах значительных изгибов артерий или дистальнее значительной извитости сосуда. Осложнения ЧТКА в виде острой тромботической окклюзии в месте частично открытого просвета артерии часто отмечают при дилатации стенозов с коронарографическими признаками выраженного тромбообразования. Таким образом, комплексный анализ коронарограмм дает возможность прогнозировать как клиническое течение коронарного атеросклероза, так и результаты эндоваскулярных вмешательств. Без комплексной коронарографической оценки нельзя выбрать адекватную тактику лечения больных с коронарным атеросклерозом, определить показания и сроки выполнения тех или иных оперативных вмешательств.
ПРИМЕНЕНИЕ ВНУТРИСОСУДИСТОГО УЛЬТРАЗВУКА ДЛЯ ОЦЕНКИ АТЕРОСКЛЕРОТИЧЕСКИХ ПОРАЖЕНИЙ КОРОНАРНЫХ АРТЕРИЙ И РЕЗУЛЬТАТОВ СТЕНТИРОВАНИЯ
Внутрисосудистое УЗИ — инвазивный диагностический метод, обеспечивающий прижизненную визуализацию структур, которые находятся внутри просвета и стенки сосудов. Для выполнения внутрисосудистого УЗИ необходимы инструменты малых размеров. Созданию миниатюрной ультразвуковой аппаратуры, обладающей высокой разрешающей способностью, способствовало развитие пьезоэлектрической и микроэлектронной технологии.
Техника выполнения внутрисосудистого УЗИ заключается в стандартной селективной катетеризации сосуда с последующим подведением ультразвукового датчика к исследуемому объекту (атеросклеротической бляшке). В отличие от ангиографии, при которой достигается силуэтное изображение повреждения сосудистой стенки на фоне заполненного контрастом просвета, внутрисосудистое УЗИ позволяет визуализировать изменения сосудистой стенки в проекции поперечного среза, то есть томографически. Такой способ визуализации дает возможность определить не только линейные параметры (диаметр просвета), но и площадь поперечного сечения просвета в месте сужения артерии. Кроме того, основываясь на различии тканей по их эхогенной плотности, внутрисосудистое УЗИ позволяет получить картину морфологического состава атеросклеротически измененной интимы артерии.
Концепция о возможном УЗИ сосудов со стороны просвета высказана еще в начальный период применения ультразвука в кардиологической практике. В 1960 г. Cieszynski сообщил о первых опытах применения внутрисосудистого ультразвука для определения размеров камер сердца у собак. Проводя это исследование, автор пользовался ультразвуковым датчиком, расположенным на верхушке внутрисосудистого катетера. Прототип современных ультразвуковых внутрисосудистых катетеров разработан Bom и соавторами в 1972 г. Однако в те же годы широкую популярность приобрел метод неинвазивного трансторакального УЗИ сердца (эхоКГ), поэтому метод внутрисосудистого УЗИ оказался временно невостребованным.
В конце 70-х годов ХХ ст. появились и получили всемирное признание новые инвазивные методы лечения больных с атеросклерозом, что способствовало возрождению интереса к внутрисосудистым УЗИ, так как для новых лечебных процедур требовалась особая информация о состоянии сосудистого русла и характере атеросклеротических повреждений. В середине 80-х годов ХХ ст. создано несколько групп, занимавшихся усовершенствованием внутрисосудистой ультразвуковой аппаратуры, и в 1988 г. Yock и его сотрудники представили первые результаты использования нового поколения внутрисосудистой ультразвуковой техники in vivo. Уменьшение размеров и повышение гибкости ультразвуковых катетеров сделало процедуру внутрисосудистого УЗИ рутинной.
Инструментарий
Принцип работы внутрисосудистой и других видов ультразвуковой аппаратуры основан на генерировании и приеме ультразвуковых волн, после чего производится обработка информации и получение изображения. Внутрисосудистое УЗИ отличается частотными параметрами: внутрисосудистая ультразвуковая аппаратура работает в режиме 10–40 МГц, а не в режиме 2–10 МГц, как обычная ультразвуковая аппаратура, с тенденцией к повышению частоты для улучшения пространственного разрешения.
Главным техническим отличием обычной ультразвуковой аппаратуры от внутрисосудистой является то, что в последней ультразвуковые датчики размещаются на катетерах, доставляющих датчики в просвет исследуемого сосуда к месту его повреждения. Диаметр первых образцов внутрисосудистых ультразвуковых катетеров был достаточно большим — 5 F. Современные ультразвуковые катетеры имеют малые диаметры — от 2,9 до 3,5 F. Эти катетеры не только легки в управлении, но и способствуют лучшему качеству изображения.
Для того чтобы получить изображение поперечного сечения сосуда, ультразвуковой импульс от датчика направляют в определенную точку, от которой сигнал отражается и фиксируется. При вращении датчика этот процесс последовательно многократно повторяют до тех пор, пока не достигается изображение поперечного сечения сосуда. Направление, по которому проходит ультразвуковой импульс, принято называть ультразвуковым лучом.
Совершенствование внутрисосудистой ультразвуковой аппаратуры обусловило 2 технически различных дизайна этой аппаратуры: механически вращающиеся и многооболочечные электронные системы (рис. 1.80). Механические ультразвуковые системы производят многие фирмы; многоэлементные электронные катетеры — «Endosonics Corp., Rancho Cordova», США. Электронные катетеры обладают хорошей гибкостью и управляемостью, однако изображение, которое можно получить при использовании этих катетеров, более низкого качества.
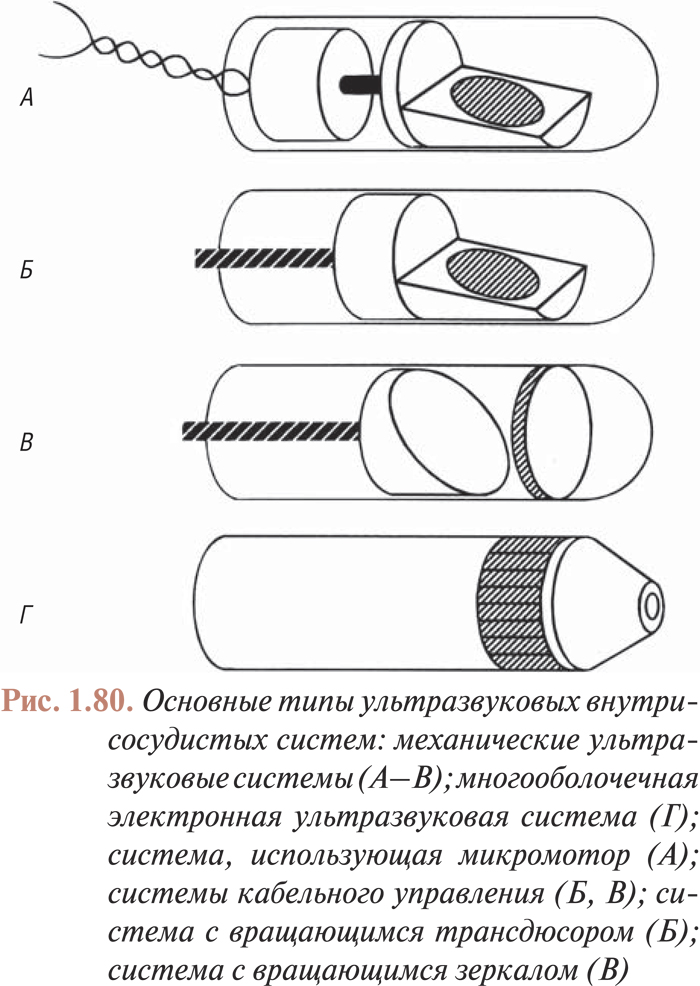
Как и во все катетерные системы, в комплект инструментария, предназначенного для внутрисосудистого УЗИ, входят проволочные проводники. По расположению проводника по отношению к ультразвуковому датчику (стержню катетера) различают 4 типа внутрисосудистых ультразвуковых систем:
- Системы с фиксированными проводниками.
- Системы с концентрически расположенными проводниками (многослойные электронные катетеры).
- Системы с эксцентрическими проводниками (механические катетеры).
- Системы с эксцентрическими проводниками и подвижными датчиками (рис. 1.81).
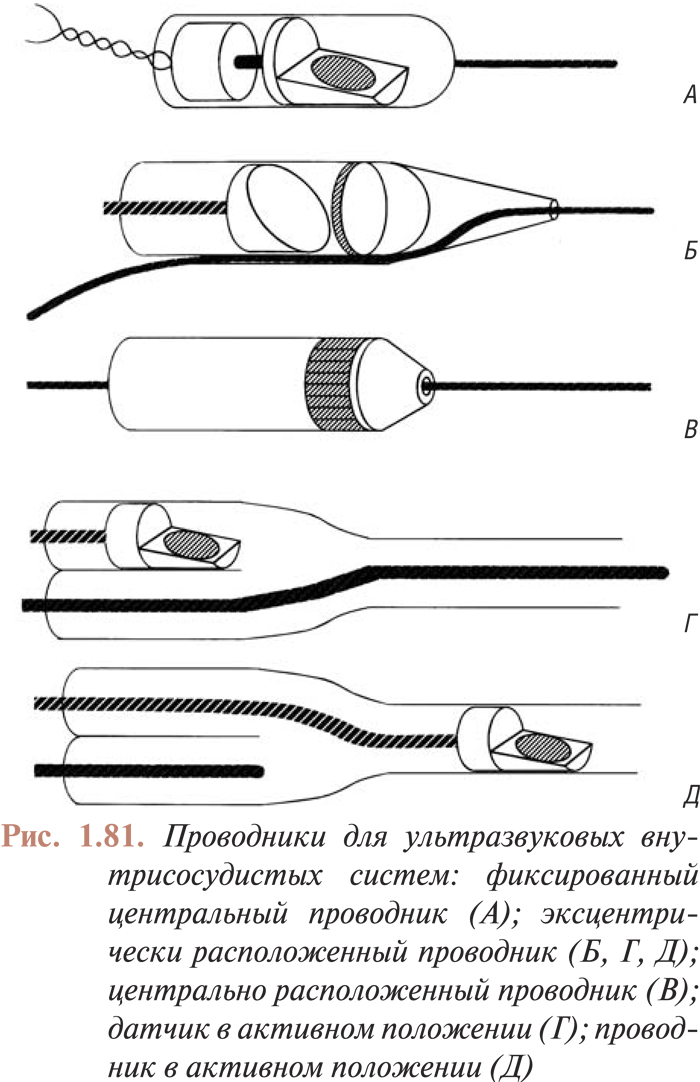
Артефакты, возникающие во время внутрисосудистого УЗИ, и ограничения метода
Использование современной внутрисосудистой ультразвуковой аппаратуры может вызывать артефакты, которые отрицательно сказываются на качестве изображения. Механические датчики во время вращения производят осцилляцию — феномен, известный под названием «неоднородное осцилляционное искажение», которое возникает при механическом торможении управляющего вала катетера во время какой-либо фазы ротационного цикла. Неоднородное ротационное искажение проявляется наиболее сильно, когда вращающий вал катетера находится в извитом сегменте сосуда; при этом изображение имеет вид неправильного овала, растянутого с одной стороны и сжатого — с другой (рис. 1.82).
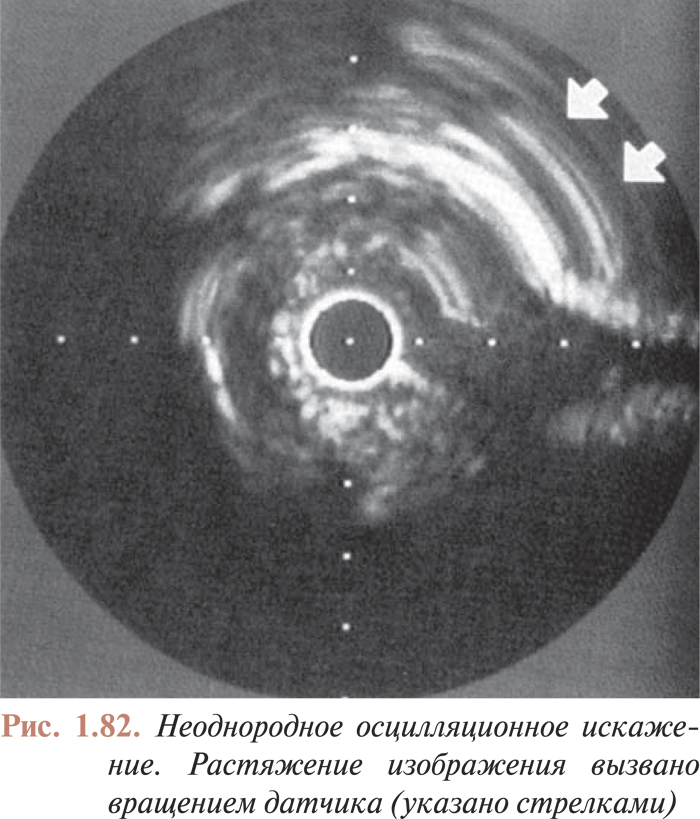
Причиной другого артефакта являются акустические осцилляции, исходящие от пьезоэлектрического материала датчика. Эти осцилляции вызывают высокоамплитудные сигналы, которые делают изображение близлежащего поля тусклым, и его акустические размеры превышают физиологические.
Ограничением информативности всех внутрисосудистых ультразвуковых систем является изогнутое изображение, получаемое вследствие косого расположения датчика по отношению к поперечному сечению сосуда. Когда ультразвуковой поток расположен не ортогонально по отношению к сосудистой стенке, изображение имеет вид эллипса.
Способ получения ультразвукового изображения также является причиной ограничения информативности внутрисосудистого ультразвукового изображения. Действие всех ультразвуковых систем основано на переводе в видеоизображение информации, полученной на основании отражения ультразвука тканями, которые имеют различную акустическую плотность. В результате этого можно получить схожее изображение тканей, которые имеют различную структуру, но обладают одинаковыми акустическими свойствами. Поэтому важно понимать, что внутрисосудистое ультразвуковое изображение демонстрирует эхогенность и акустическую плотность исследуемых структур сосудистой стенки, а не их гистологический состав.
В некоторых исследованиях сообщалось о том, что во время внутрикоронарных УЗИ приблизительно в 5% случаев происходит транзиторная ишемия миокарда, ультразвуковой датчик может временно закрыть или резко уменьшить просвет коронарной артерии во время его продвижения в зоне жесткого стеноза или в ветви артерии малого диаметра. Если катетер быстро удалить, больные обычно не предъявляют жалоб на загрудинную боль. После внутрикоронарного введения нитроглицерина ишемия быстро проходит.
Несмотря на относительную безопасность внутрисосудистого УЗИ, этот метод, как и любой другой, при котором проводятся внутрисосудистые манипуляции, связан с риском повреждения сосудистой стенки. Поэтому во избежание развития клинических осложнений персонал должен быть готов к проведению ургентного перкутанного коронарного вмешательства.
Внутрикоронарное УЗИ
Ультразвуковая морфология коронарных артерий
Ультразвуковое изображение непораженной коронарной артерии имеет вид правильного круга, в котором отсутствуют структуры со значительной акустической плотностью (рис. 1.83). Хотя просвет сосуда звукопроницаем, датчики, в которых используется частота 25 МГц и выше, проявляют внутри просвета некоторую эхогенность. Причиной этой эхогенности является движение крови, что определяется в виде туманной, вихреобразной эхогенной плотности. Нечеткое дымкообразное изображение может затруднить идентификацию элементов сосудистой стенки, особенно в тех случаях, когда эти структуры сообщаются с просветом сосуда, например при диссекции интимы.
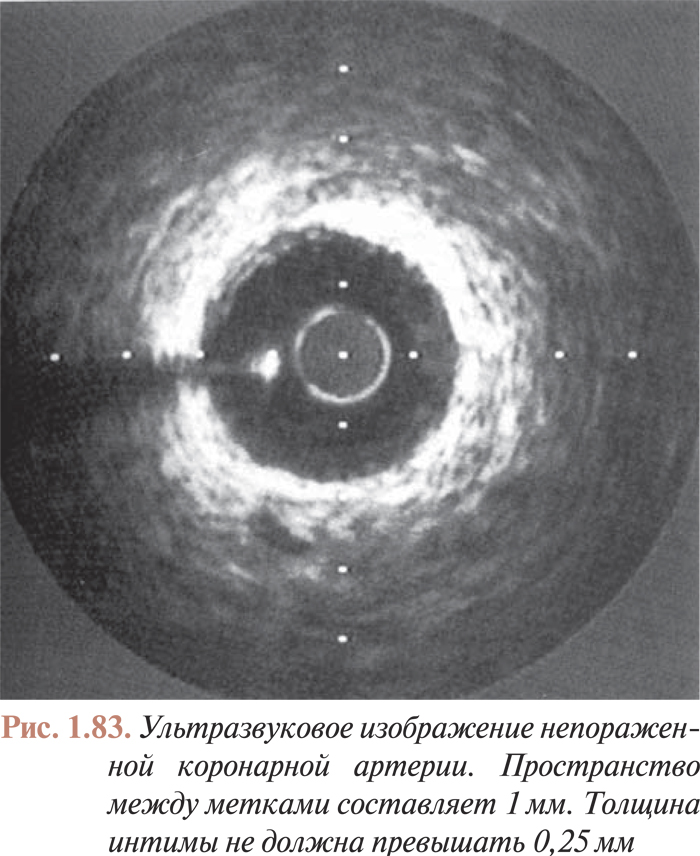
Имеются публикации, в которых описана ультразвуковая картина непораженной стенки коронарной артерии. У большинства людей эндотелий непораженной сосудистой стенки с многослойной структурой. У некоторых пациентов (особенно молодого возраста) при УЗИ выявляют однослойную структуру внутреннего слоя сосудистой стенки; этот факт, вероятно, свидетельствует о том, что эндотелий неповрежденных коронарных артерий является однослойным. Толщина эндотелия в норме составляет 0,15±0,07 мм; предел толщины нормального эндотелия — 0,25–0,3 мм.
Во всех атеросклеротически измененных коронарных артериях на ультразвуковом изображении определяется трехслойное утолщение интимы. Типичная атеросклеротическая бляшка выглядит как эхогенное выпячивание («вторжение») внутрь просвета артерии (рис. 1.84–1.86). Под атеросклеротической бляшкой выявляют звукопроницаемую полосу, которая, как установлено в исследованиях in vitro, соответствует мышечному слою артерии.
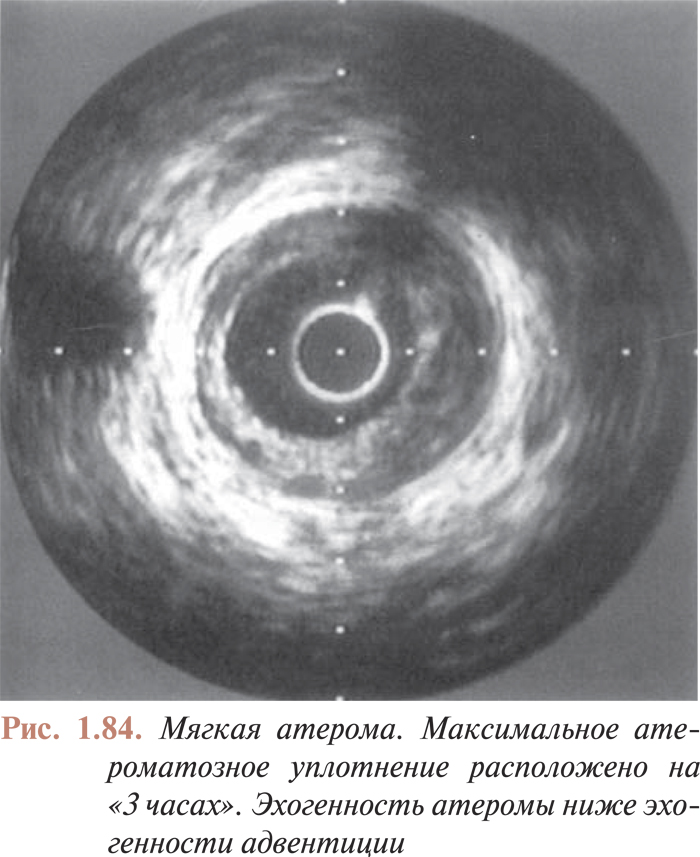
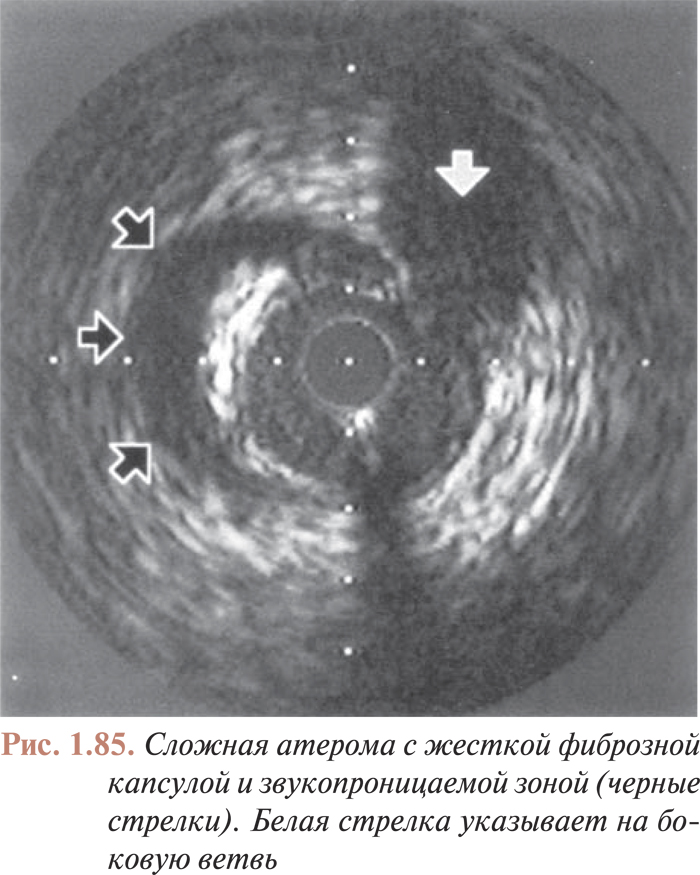
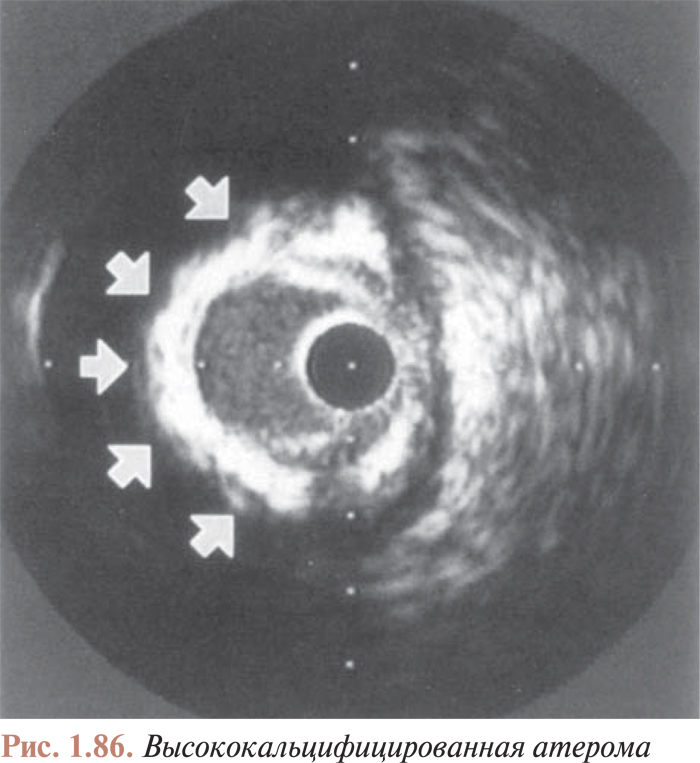
Коронарные атеромы, эхогенная плотность которых ниже плотности адвентиции, называются мягкими бляшками (см. рис. 1.84). Эти бляшки с высокой звукопроницаемостью содержат большое количество липидов. Эхогенная плотность таких бляшек может значительно варьировать. С уменьшением количества липидов и увеличением количества коллагена эхогенность бляшки повышается.
Бляшки с высокой акустической плотностью называются жесткими (см. рис. 1.85). В исследованиях установлено, что в жестких бляшках содержится большое количество фиброзной ткани. Такие бляшки требуют иного подхода во время проведения лечебной процедуры, например более высокого давления при дилатации.
При проведении гистологических исследований в бляшках, содержащих участки крайне высокой эхогенности, выявляли кальцификаты (см. рис. 1.86). Кальцифицированные бляшки имеют выраженную ригидность; при их дилатации необходимо очень высокое давление. Плотная кальцифицированная атерома оказывает выраженное тканевое сопротивление при выполнении направленной атерэктомии, поэтому атеротом Симпсона для устранения подобных повреждений не применяют.
Внутрисосудистое УЗИ позволяет выявить атеросклеротические изменения коронарных артерий даже в тех случаях, когда эти изменения невозможно определить ангиографически. Количественная коронарографическая оценка пораженного сегмента основана на сравнении суженного участка артерии с расположенным рядом здоровым сегментом. Коронарографическая оценка состояния здорового сегмента не всегда бывает достоверной. Glagov и соавторы доказали, что наличие атеросклеротической бляшки в стенке не всегда изменяет ширину просвета сосуда, что объясняется компенсаторным ремоделированием сосудистой стенки, которое позволяет сохранить просвет артерии неизмененным. Кроме того, ангиографический анализ не всегда позволяет достоверно определить степень сужения просвета при наличии диффузного атеросклеротического поражения артерии. В этом случае сосуд сужен на значительном участке и фокальные стенозы на коронарограммах выявляют с трудом.
Измерение количественных показателей просвета артерии при ее атеросклеротическом поражении
Внутрисосудистое УЗИ позволяет определить площадь поперечного сечения просвета в месте сужения артерии, на основании чего можно судить о резерве коронарного кровотока. Этот количественный показатель является более достоверным, чем конкретизация диаметра просвета сосуда на основании ангиографического анализа, даже при использовании нескольких проекций. Было проведено исследование, в котором определяли расхождение в оценке степени сужения просвета коронарных артерий по ульразвуковым и коронарографическим данным. Почти полное совпадение этих данных отмечают при наличии концентрических стенозов (r=0,92). При наличии эксцентрических стенозов расхождение в оценке степени сужения на основании ультразвуковых и коронарографических данных увеличивалось (r=0,78); снижение корреляции в этих случаях может быть объяснено тем, что эксцентрические стенозы часто имеют неправильную томографическую форму. Внутрисосудистое УЗИ позволяет точнее, чем коронарография, определить степень остаточного стеноза после коронарной ангиопластики: оценка остаточного стеноза по данным ко-ронарографического исследования и УЗИ имеет довольно низкую корреляцию: r=0,40–0,60.
Определение размера инструмента (например дилатационного баллона), необходимого для выполнения операции, основывается на оценке просвета в непораженном сегменте артерии, который расположен рядом с пораженным. При оценке непораженного сегмента, по данным коронарографического исследования и УЗИ, установлена средняя корреляция результатов: r=0,70. Сравнение этих данных выявило довольно большую стандартную ошибку — около 0,5 мм. Этот факт представляет собой довольно серьезную проблему для интервенционистов, которые должны выбрать инструментарий для операции предельно точного размера: использование инструментов малых размеров может не дать желаемых результатов, в отличие от инструментов большого диаметра, при применении которых могут развиться различные осложнения.
Проведение внутрикоронарного УЗИ при выполнении внутрикоронарных вмешательств
Рассмотрим критерии внутрикоронарного УЗИ, на основании которых определяют показания к эндоваскулярным вмешательствам, выполняемым при лечении больных с коронарным атеросклерозом, а также проведем ультразвуковую оценку результатов этих вмешательств.
Баллонная ангиопластика. Определение степени остаточного стеноза на основании диаметра суженного сегмента (при силуэтном методе) и площади поперечного сечения (при томографическом методе) является стандартной техникой оценки результатов ангиопластики. В исследовании, проведенном Tobis и соавторами, установлена очень низкая корреляция между ультразвуковой и коронарографической оценкой степени остаточного стеноза (r=0,30). Это несоответствие, как считают авторы, обусловлено разницей оценки как остаточного стеноза, так и расположенного рядом непораженного сегмента артерии.
Причиной несоответствия при оценке остаточного стеноза является форма просвета артерии (рис. 1.87). Внутрисосудистое УЗИ демонстрирует различный спектр морфологических изменений, которые произошли в результате ангиопластики. Эти изменения включают сложные разрывы интимы и диссекцию сосудистой стенки. Максимальное искривление формы просвета, отмечаемое при ангиопластике, может стать причиной самой противоречивой трактовки послеоперационной ангиографической картины. Наличие контрастных экстравазатов в интиме, мышечном слое и под адвентицией может ложно увеличить диаметр просвета сосуда на коронарограмме. В этих случаях определяется широкий просвет сосуда, который, однако, имеет нечеткие контуры. При УЗИ в этих случаях можно выявлять минимальное увеличение просвета сосуда.
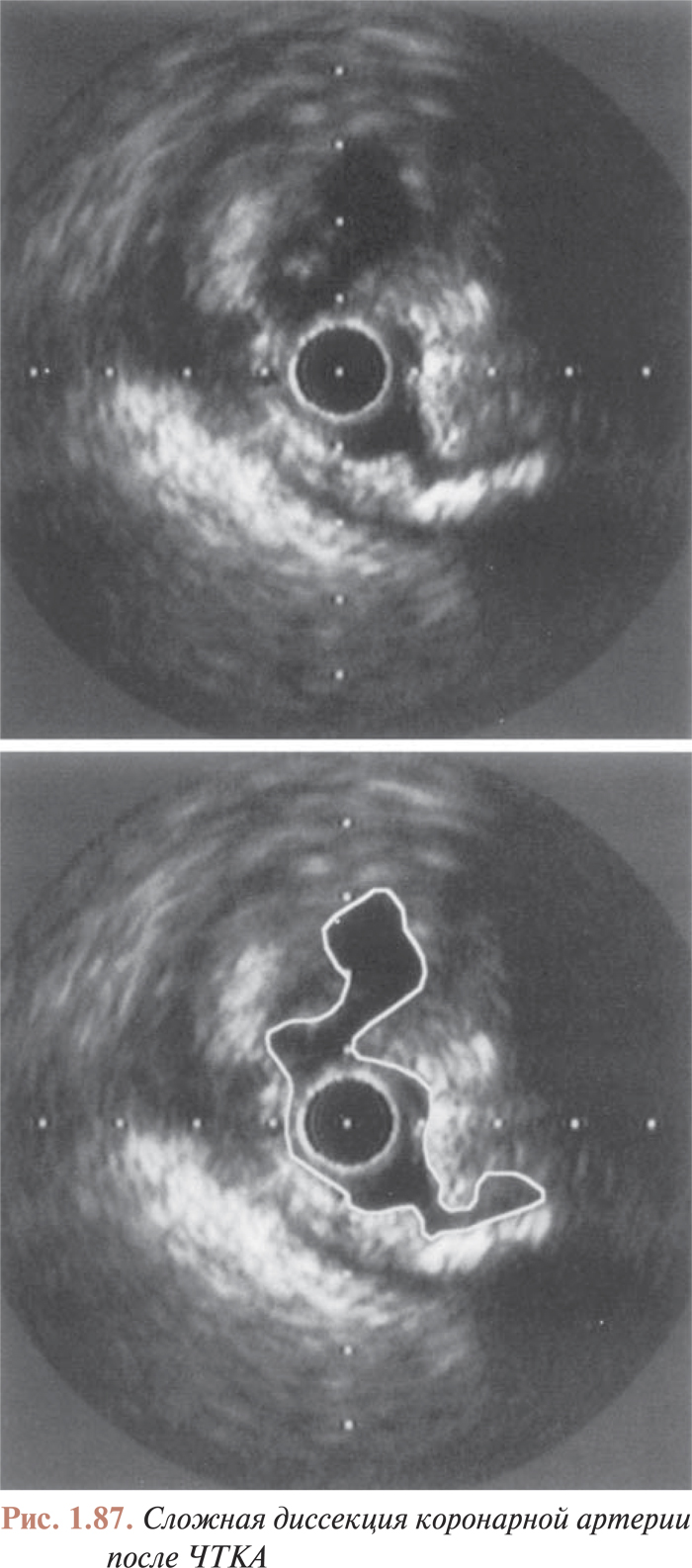
На основании результатов внутрикоронарного УЗИ можно оценить механизм, благодаря которому в каждом конкретном случае происходит увеличение просвета сосуда после дилатации. Во многих случаях главным (а иногда и единственным) механизмом увеличения просвета при ангиопластике является разрыв интимы. При этом по данным УЗИ можно легко определить глубину травматизации, которая варьирует от поверхностного разрыва интимы до выраженного периадвентициального щелеобразования. При диссекции бляшки обычно отмечают единичный разрыв, однако бывают случаи образования нескольких щелей. Типичным местом диссекции обычно является зона соединения жестких и мягких элементов бляшки.
По результатам УЗИ у некоторых больных выявляют альтернативный механизм увеличения просвета сосуда после ангиопластики. Этим механизмом является растяжение (стретчинг) сосудистой стенки. Анализ внутрисосудистой картины подтверждает подобный эффект при увеличении адвентициального диаметра в месте ангиопластики.
У некоторых больных просвет сосуда увеличивается после ангиопластики в результате уменьшения площади поперечного сечения атеросклеротического поражения. Это явление отмечается как вследствие истинного сдавления тканей бляшки, так и из-за осевого перераспределения этих тканей; мнения по этому вопросу противоречивы.
Направленная атерэктомия. УЗИ с успехом применяют при проведении направленной атерэктомии. Оптимальной целью направленной атерэктомии является эксцентрическая бляшка. Однако известно, что распространенность атеромы, определяемая ангиографически, не всегда соответствует ультразвуковой картине. Так, стенозы, которые на коронарограмме выглядят как концентрические, на ультразвуковом изображении могут иметь вид эксцентрических и наоборот. Слабая корреляция распространенности атеросклеротического процесса, по данным коронарографического исследования и УЗИ, отражает недостатки силуэтного метода по сравнению с томографическим.
На результаты направленной атерэктомии и ее выраженность влияет наличие кальцификации сосудистой стенки. Значительная кальцификация коронарной артерии, выявленная во время рентгенологического исследования, традиционно является противопоказанием к выполнению этой операции. Однако в исследованиях, в которых используют внутрикоронарный ультразвук, установлено, что значительная кальцификация происходит чаще, чем ее выявляют во время рентгенологического исследования. В отличие от рентгенографии, УЗИ позволяет определить локализацию кальцификата по окружности сосуда и выявить глубину поражения. Как говорилось выше, обширная кальцификация сосудистой стенки делает выполнение направленной атерэктомии невозможным, однако в сосудах с обширными, но глубоко расположенными кальцификатами проведение атерэктомии возможно. Напротив, при поверхностно расположенных кальцификатах атерэктомия не показана, а именно такие кальцификаты с трудом выявляют на ангиограммах.
По результатам внутрикоронарного УЗИ можно определить локализацию, степень и распространенность атеросклеротического поражения, что позволяет подобрать подходящий размер инструмента и правильно сориентировать атерэктомический нож. Однако использовать эту операционную технику может только опытный хирург с учетом тщательной оценки состояния пациента. Хотя по данным УЗИ можно получить достаточно полную информацию, проблема ориентирования инструмента относительно каких-либо маркеров, определяемых на ультразвуковом изображении, в настоящее время до конца не решена. Опытные исследователи тщательно анализируют пораженный сегмент для выявления анатомических ориентиров с целью их использования во время операции. Например, по данным УЗИ выявлено, что атеросклеротическая бляшка расположена в передней межжелудочковой ветви коронарной артерии в месте отхождения септальной ветви на контралатеральной стенке. Зная это, хирург правильно расположит инструмент по отношению к пораженному участку артерии.
Ротационная абляция. Ультразвуковая оценка пораженного сегмента коронарной артерии позволяет правильно определить показания к ротационной абляции, что положительно отражается на результатах этой операции. Применение ротаблатора особенно эффективно при наличии кальцификатов. Как отмечалось выше, внутрисосудистое УЗИ позволяет определить локализацию и степень кальцификации сосудистой стенки. Установление точного размера просвета сосуда позволяет отобрать для операции бур необходимого размера. УЗИ, проводимое после каждой манипуляции ротаблатором, позволяет выяснить размеры новообразованного просвета и морфологическое состояние оставшейся атеросклеротической бляшки (рис. 1.88). На основании этих сведений хирург для продолжения операции может выбрать инструментарий необходимого размера. Если после первых манипуляций ротаблатором кальцификатов не осталось, то для продолжения операции можно использовать атеротом Симпсона. Напротив, распространенная кальцификация требует продолжения ротационной абляции с возможным дополнением ее ангиопластикой.
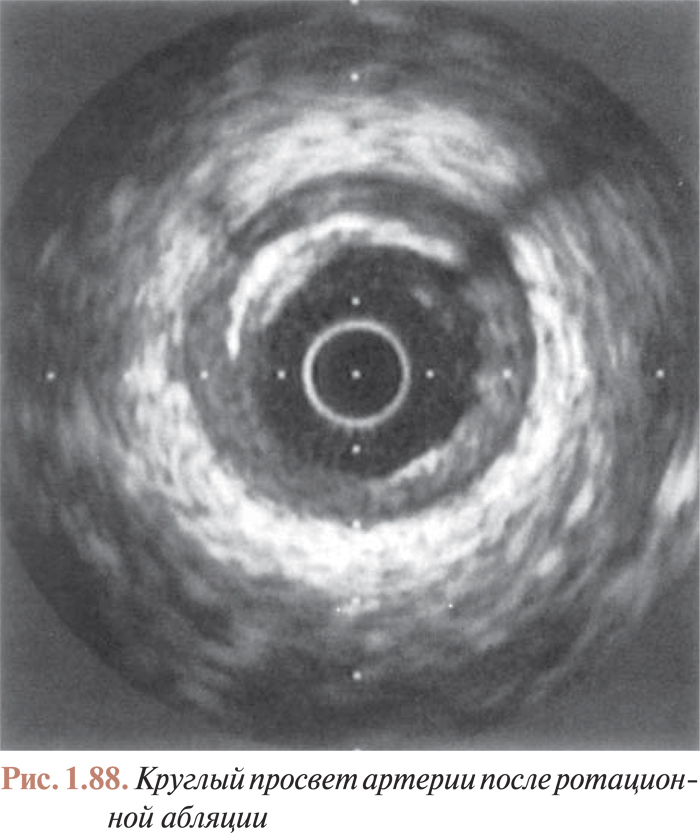
Имплантация стентов. Оценка результатов имплантации стентов на основании анализов коронарограмм не всегда точна, так как просвет артерии может быть искусственно увеличен за счет структуры самого стента. Послеоперационное УЗИ позволяет более точно определить адекватное растяжение стента и внедрение его в сосудистую стенку (рис. 1.89). На этом основании можно сделать вывод о необходимости повторной дилатации в месте стентирования коронарной артерии. УЗИ позволяет определить необходимость проведения интракоронарного стентирования для профилактики осложнений ангиопластики, поскольку это исследование дает возможность достоверно судить об интенсивности послеоперационной диссекции и состоянии просвета после ангиопластики.
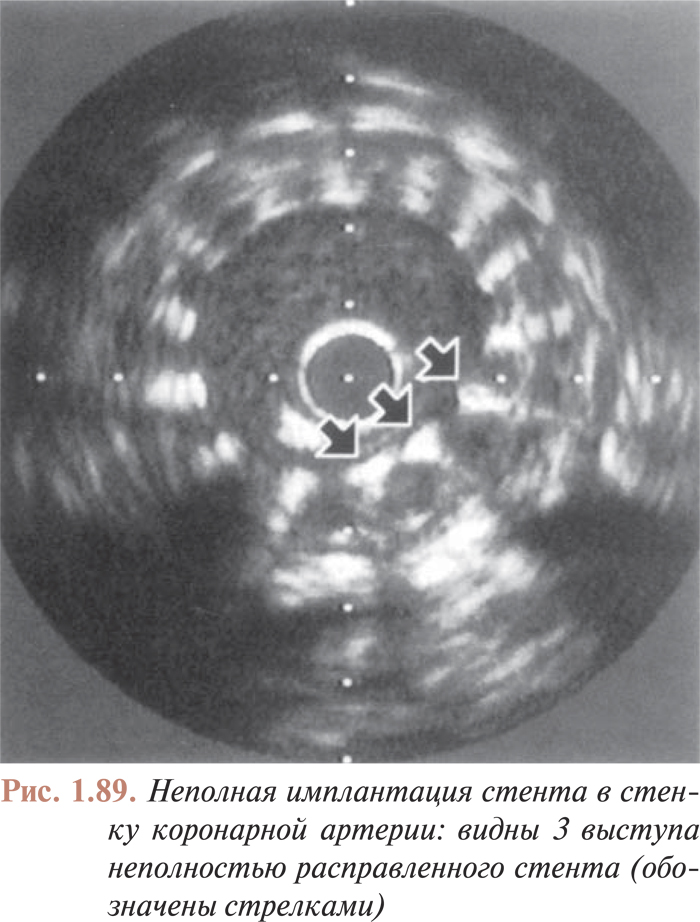
Внутрисосудистое УЗИ позволяет существенно дополнить данные других методов (неинвазивных и инвазивных), проводимых при обследовании больных с коронарным атеросклерозом. Это дает возможность уточнить показания к тем или иным видам интракоронарных вмешательств, выполняемых при атеросклеротическом поражении коронарных артерий. Так, по результатам этого метода обследования, обеспечивающего изображение сегмента артерии в поперечном срезе, можно определить площадь поперечного сечения просвета сосуда, что является более точным количественным показателем, чем диаметр просвета пораженного сегмента, который определяется на силуэтном изображении пораженного сегмента. УЗИ, используя принцип различной акустической плотности тканей, дает возможность определить морфологическую структуру атеросклеротической бляшки. Кроме того, внутрикоронарное УЗИ позволяет оценить результаты вмешательств, выполняемых при атеросклеротическом поражении коронарных артерий. Эта информация особенно ценна при выполнении коронарной ангиопластики, поскольку по данным УЗИ можно уточнить истинные размеры просвета после дилатации, а также оценить интенсивность и глубину диссекции.
К сожалению, на основании этого метода обследования нельзя достоверно определить признаки разрушения атеросклеротической бляшки, а также признаки тромбообразования как в тканях бляшки, так и внутри просвета артерии. Информацию о дестабилизации атеросклеротической бляшки может дать анализ коронарограмм, хотя критерии этого метода являются косвенными, так как они основаны на оценке силуэтного изображения атеросклеротических повреждений коронарных артерий. Безусловно, совершенствование внутрисосудистого ультразвукового инструментария даст возможность получить более детальное изображение атеросклеротического поражения сосудов, что позволит определить прямые признаки дестабилизации бляшки.
ПЕРКУТАННЫЕ КОРОНАРНЫЕ ВМЕШАТЕЛЬСТВА ПРИ ХРОНИЧЕСКОЙ ИБС
Эпоха перкутанных коронарных вмешательств, выполняемых при коронарном атеросклерозе, к сегодняшнему дню занимает чрезвычайно малый исторический отрезок времени: всего около 30 лет со дня первой баллонной ангиопластики, выполненной в клинике A. Gruentzig. За это время процедура нехирургического восстановления просвета коронарных артерий не только получила глобальное признание и пережила небывалый рост распространенности во всем мире, но и значительно усовершенствовалась технически. Сейчас трудно назвать отрасль естественных наук, которая не задействована в создании нового инструментария для перкутанных коронарных вмешательств. Каждый из вновь созданных инструментов решал какую-то проблему, возникавшую на пути развития перкутанных коронарных вмешательств. Так, проблема прохождения коронарного проводника, баллона или системы «стент на баллоне» через поврежденный сегмент коронарной артерии привела к созданию новых проводниковых катетеров, способных увеличить поддержку прохождения, новых коронарных проводников, новых конструкций стентов, обладающих повышенной гибкостью при сохранении необходимой жесткости. Разработан ряд небаллонных систем для механической или термической (в том числе лазерной) ремоделяции атеросклеротических бляшек (хотя практика показала, что основным недостатком применения этих инструментов является чрезмерно высокий уровень последующих рестенозов).
Одной из главных проблем, с которой пришлось столкнуться интервенционным кардиологам при реваскуляризации миокарда, явились тромботические осложнения, возникающие как во время ангиопластики, так и в ранний послепроцедурный период (в течение от первого часа до первых суток после процедуры). Главной причиной острых тромбозов, развивающихся после баллонной ангиопластики, являются микро- или макротрещины (диссекции) интимы, возникающие после раздувания баллона. Механизм образования тромбов в этой ситуации такой же, как и при естественном разрушении атеросклеротических бляшек с последующим тромбозом и, как следствие, развитием острых коронарных синдромов. Необходимо отметить, что баллонная ангиопластика сложных стенозов (то есть таких, которые имеют ангиографические признаки разрушения атеросклеротической бляшки с пристеночным тромбозом) гораздо чаще осложнялась тромбозом, чем дилатация простых стенозов. Так, баллонная ангиопластика нестабильных атеросклеротических бляшек (бляшка с разрушенной поверхностью и пристеночным тромбом при частично сохраненном просвете артерии) часто заканчивалась тотальным тромбозом артерии и развитием острого ИМ, а то и смертью больного на операционном столе. Это обстоятельство стало причиной ограничения применения ангиопластики при нестабильной стенокардии. В настоящее время от перипроцедуральных тромботических осложнений практически удалось избавиться благодаря 2 новшествам: имплантации стентов и принципиально новому медикаментозному сопровождению перкутанных коронарных вмешательств.
Другая серьезная проблема интервенционных процедур, выполняемых при коронарном атеросклерозе, — это рестенозы. Рестенозы (повторные поздние сужения просвета артерии, развивающиеся как естественный ответ на механическое повреждение стенки сосуда гиперплазией ее тканей) развивались в 30–45% случаев баллонной ангиопластики. Перкутанные коронарные вмешательства с применением стентов снизили этот показатель до 12–15%. Однако в некоторых анатомических и клинических ситуациях (хронические окклюзии, поражения в сосудах малого диаметра, длинные поражения, сахарный диабет) уровень рестенозов, развивающихся после стентирования, оставался по-прежнему высоким (40–45%). Для решения этой проблемы разработаны стенты нового поколения. Применение новых стентов, покрытых лекарственным веществом, которое блокирует гиперплазию и способно дозированно выделяться (элютинировать) в стенку артерии, привело к очередному расширению показаний к выполнению перкутанных коронарных вмешательств при коронарном атеросклерозе.
Элютинг-стенты, существенно повлияв на развитие рестенозов, поставили перед учеными новую задачу: выяснилось, что цитостатическое свойство элютинирующих лекарственных веществ является причиной поздних рестенозов, так как наравне с блокированием гиперплазии тканей стенки сосуда блокируется рост эндотелия, покрывающего стент. Сейчас проводятся испытания стентов, которые элютинируют цитостатики и одновременно с этим рассасываются. Есть основания полагать, что в недалеком будущем эти стенты будут широко применяться в клинической практике.
В настоящее время показания к перкутанным коронарным вмешательствам при хронической ИБС рассматриваются в основном в аспекте анатомических и морфологических особенностей атеросклеротического поражения коронарных артерий. Под анатомическими особенностями подразумевается наличие однососудистого или многососудистого поражения коронарного русла, поражение ствола коронарных артерий, бифуркационные поражения, поражения артерий малого диаметра. К морфологическим особенностям относят длинные атеросклеротические поражения, диффузные поражения, поражения со сложной ангиографической морфологией (с признаками разрушения атеросклеротической бляшки и тромбообразования), хронические окклюзии коронарных артерий. Отдельную группу представляют больные с сопутствующим сахарным диабетом.
Перкутанные коронарные вмешательства при единичных дискретных поражениях коронарных артерий, диффузных стенозах, многососудистом поражении при ИБС
Перкутанные коронарные вмешательства при однососудистом поражении при ИБС и единичных дискретных стенозах
С момента выполнения первой коронарной ангиопластики определены основные коронарографические показания к проведению этого вмешательства. К повреждениям, пригодным для проведения баллонной ангиопластики, отнесены единичные проксимальные гемодинамически значимые дискретные некальцифицированные стенозы у пациентов с сохраненной функцией ЛЖ. Подобные поражения, по данным современных исследований, и сейчас являются наиболее благоприятными для перкутанных коронарных вмешательств. Однако редко упоминается о том, что под термином «проксимальные стенозы» А. Gruentzig понимал поражение ствола левой коронарной артерии, то есть именно того сегмента коронарного русла, поражение которого впоследствии явилось противопоказанием к проведению вмешательства. В настоящее время в крупных клиниках проводят ангиопластику стенозов, расположенных в стволе коронарной артерии, как «под прикрытием» коронарного шунта, так и у пациентов без предварительного АКШ. Этот пример иллюстрирует, как динамично, по мере накопления клинического опыта и развития катетерных технологий, изменяются взгляды в инвазивной кардиологии.
У пациентов с однососудистым поражением при ИБС отмечен хороший уровень выживаемости (смертность не более 1% в год). Однако единственный гемодинамически значимый стеноз в коронарной артерии может обусловить развитие выраженной стенокардии напряжения, а иногда и покоя, резко снизить толерантность к физической нагрузке (рис. 1.90а, б; 1.91а, б).
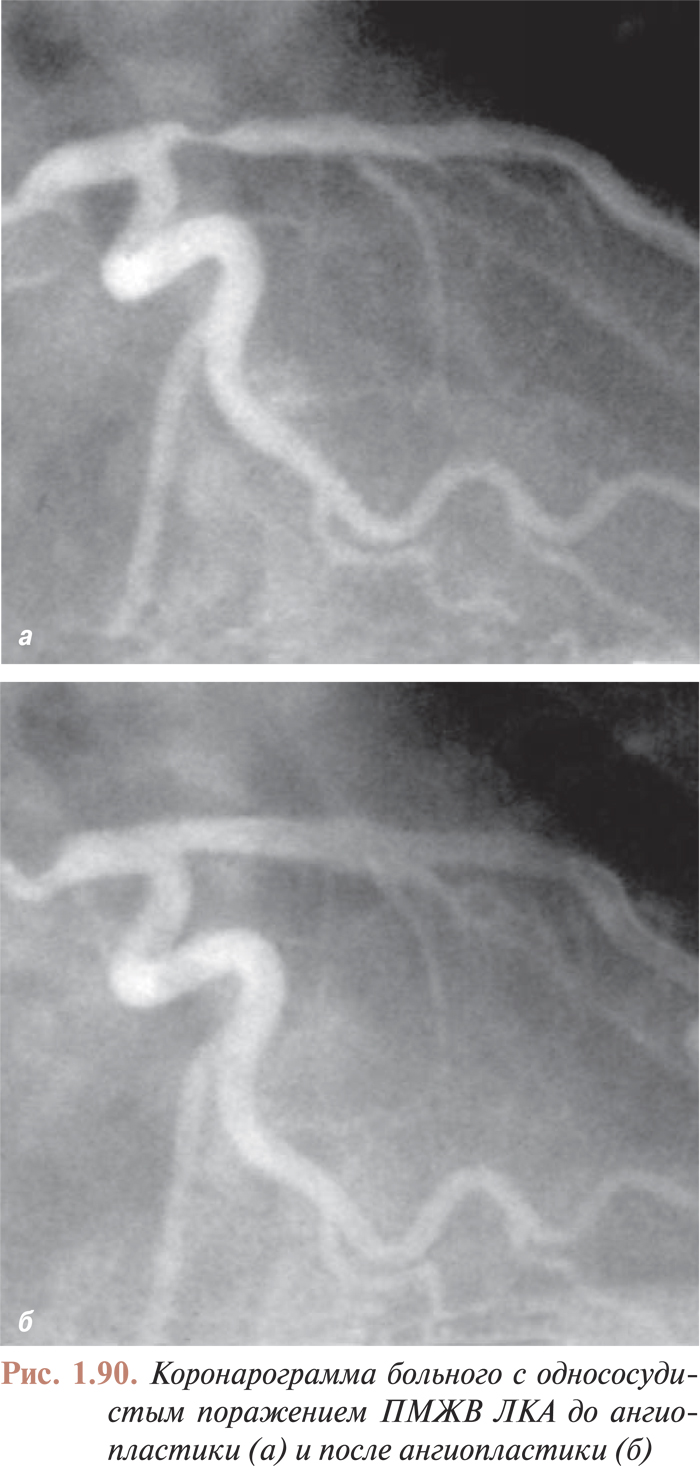
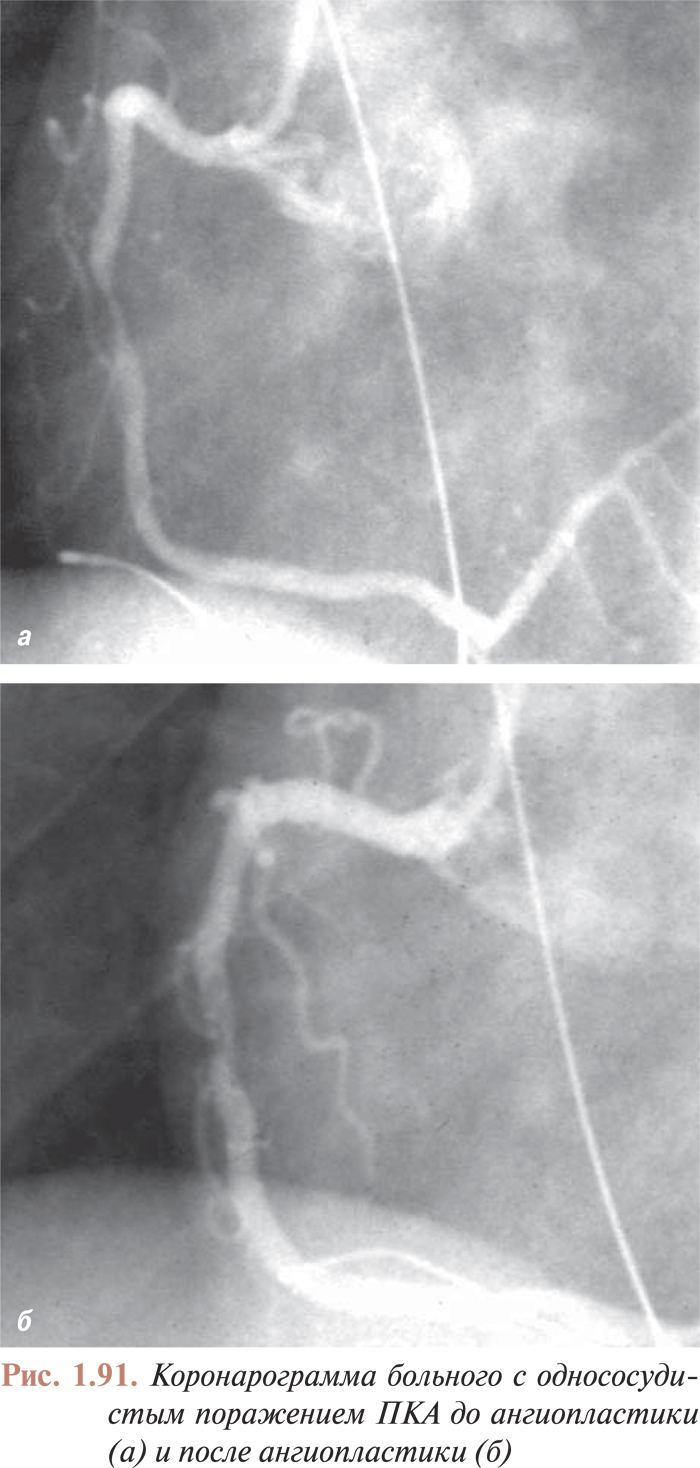
Потенциально единственный стеноз в коронарной артерии может вызвать дестабилизацию больных и, возможно, развитие ИМ в зоне сужения. Следовательно, при наличии одного гемодинамически значимого стеноза в эпикардиальной артерии сердца может развиться резистентность пациента к медикаментозной терапии, что определяет абсолютные показания для проведения коронарной ангиопластики (рис. 1.92а–в; 1.93а–в). В этой ситуации перкутанное коронарное вмешательство дает ранний положительный результат, что делает этот вид лечения у таких больных наиболее предпочтительным.

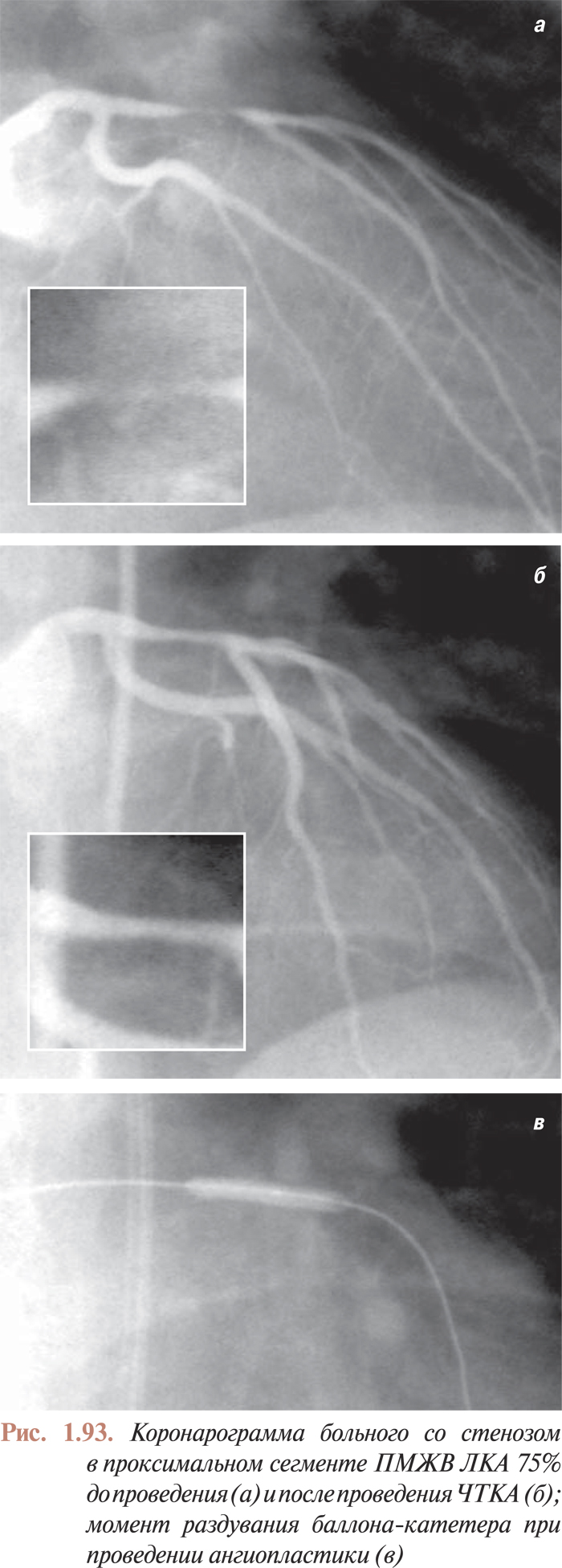
В исследование ACIP (Asymptomatic Cardiac Ischemia Pilot) включили пациентов с тяжелой каждодневной ишемией. Больные, вошедшие в это исследование, разделены на группы стрессиндуктивной стенокардии и немой ишемии (по крайней мере один эпизод немой ишемии, отмеченный во время холтеровского мониторирования в течение 24 ч). В течение 2-годичного наблюдения смертность в группах больных, получавших медикаментозное лечение, составила 6,6% (больные с симптомами стенокардии) и 4,4% (больные с ЭКГ-признаками ишемии миокарда); в группе больных, которым была проведена реваскуляризация, этот показатель был равен 1,1% (рекомендации для проведения перкутанного коронарного вмешательства при объективно выраженной ишемии: I A).
Если однососудистое поражение с единичным дискретным стенозом является абсолютным показанием к перкутанному коронарному вмешательству, то при наличии диффузного поражения даже в одной коронарной артерии не все виды перкутанного коронарного вмешательства являются одинаково безопасными и эффективными. На коронарограммах диффузные поражения проявляются в виде длинных стенозов, имеющих несколько сужений, чередующихся расширениями просвета. По критериям качественного анализа коронарограмм такие стенозы относятся к сложным и отражают наличие атеросклеротических бляшек с застарелым разрушением структур и сформированными ранее пристеночными тромбами, проросшими соединительной тканью и частично кальцифицированными. Подобные поражения могут занимать несколько рядом расположенных сегментов артерии. Выполнение ЧТКА в таких случаях не показано, так как баллонная дилатация в местах таких сложных атеросклеротических бляшек является причиной значительных диссекций стенки сосуда с последующим развитием острых тромботических осложнений. Имплантация непокрытых металлических стентов в подобные сегменты также не показана из-за высокой вероятности развития рестенозов. В этих случаях оптимальным видом перкутанного коронарного вмешательства является имплантация элютинг-стентов большой длины или стентирование несколькими элютинг-стентами по методу «жакетирования» (наложение дистального отдела последующего стента на проксимальный отдел предыдущего). Имплантация элютинг-стентов по методу «жакетирования» проводится также, когда на коронарограмме определяется несколько стенозов, расположенных рядом в одной коронарной артерии, что часто отмечают у больных сахарным диабетом.
Перкутанные коронарные вмешательства при многососудистом поражении при ИБС
Одной из дискуссионных проблем современной интервенционной кардиологии является вопрос проведения многососудистой ангиопластики у пациентов с распространенным коронарным атеросклерозом. Решение этого вопроса требует анализа многих факторов: определение многососудистого поражения, возможность и целесообразность проведения полной и неполной реваскуляризации миокарда, анализ отдаленных результатов многососудистой ангиопластики и т.д. Эти факторы следует учитывать при отборе пациентов для проведения многососудистой коронарной ангиопластики.
Понятие «многососудистое поражение» коронарных артерий в различных исследованиях имеет разную трактовку. Однако существует 3 основных определения многососудистого поражения. Поражение считается многососудистым при наличии:
- стеноза >70% в 2 коронарных артериях (70%–70%);
- стеноза >70% в одной и >50% во второй коронарной артерии (70%–50%);
- стеноза >50% в 2 коронарных артериях (50%–50%).
Безусловно, восстановление коронарного кровотока по всем сосудам сердца является наиболее эффективным способом реваскуляризации миокарда и именно полная реваскуляризация — основная цель ангиопластики и АКШ (рис. 1.94а–г; 1.95а–г). Однако анатомические особенности коронарных артерий, клиническое состояние больного и технические возможности клиники не всегда позволяют восстановить коронарный кровоток во всех пораженных артериях. Основной причиной использования тактики неполной реваскуляризации миокарда является анатомическая невозможность дилатации стеноза или реканализации окклюзии в пораженном сегменте коронарной артерии. Однако обсуждается и иная причина развития неполной реваскуляризации миокарда при многососудистом поражении, связанная прежде всего с рестенозом. У более ⅓ пациентов после коронарной ангиопластики диагностируют рестеноз в ранее пораженном сегменте, что требует повторного обследования и лечения. При многососудистой ЧТКА повышается вероятность образования повторных сужений в ближайший период после лечения. Более того, рестенотическое повреждение пораженных сегментов бывает более гемодинамически значимым, чем ранее имеющийся стеноз (если его первоначальный размер не превышает 75%). В некоторых клиниках не считают обязательным проводить ангиопластику в пораженных сегментах <70%, чтобы не провоцировать повторное, рестенотическое сужение этого сегмента в ближайшие 3–6 мес.
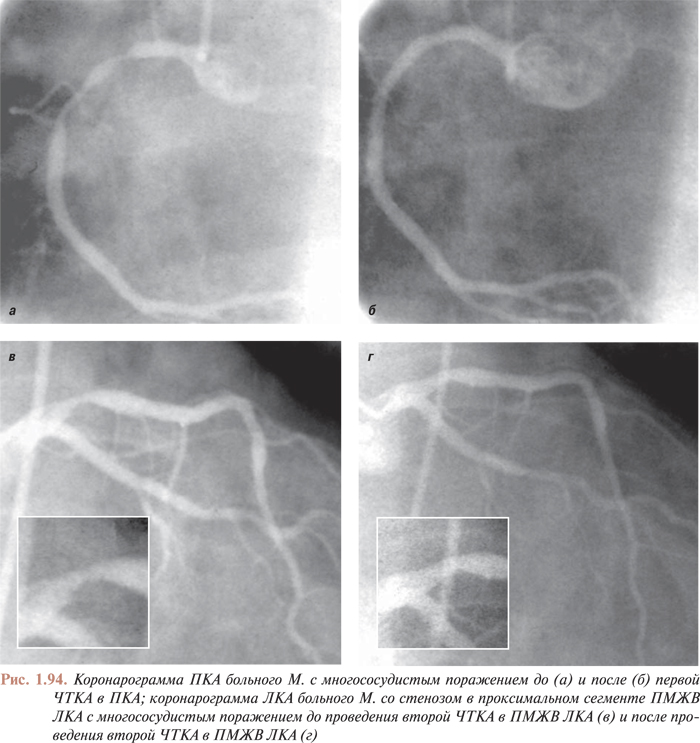
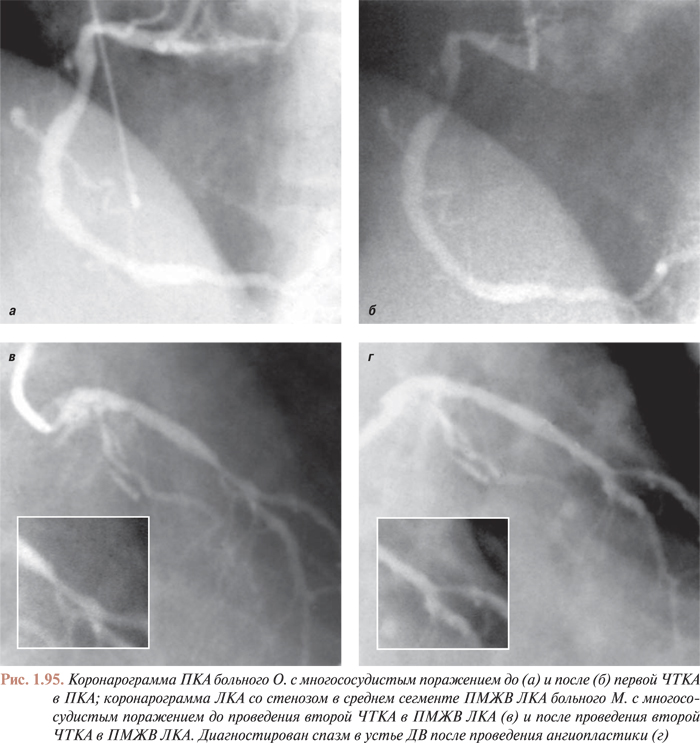
Концепция полной и неполной реваскуляризации впервые предложена и обсуждалась в первые годы появления коронарной хирургии. Использование этих стратегий значительно улучшало состояние пациентов с ИБС, повышало толерантность к физической нагрузке после АКШ.
Впоследствии опыт ЧТКА подтвердил концепцию полной и неполной реваскуляризации. В период развития коронарной ангиопластики неполную реваскуляризацию проводили у пациентов групп высокого риска (возраст, низкая функция ЛЖ, выраженная сопутствующая патология, сложная коронарная морфология). Во многих исследованиях изучали степень реваскуляризации и ее влияние на выживаемость пациентов, но различия в выживаемости пациентов без ИМ при проведении полной реваскуляризации не выявлены. Однако повторные ангиопластики или АКШ в группах неполной реваскуляризации выполняли чаще, чем у пациентов после полной реваскуляризации миокарда.
В настоящее время реваскуляризацию подразделяют на 3 группы: полная анатомическая, полная функциональная и неполная функциональная (табл. 1.12). К сожалению, к настоящему моменту нет точного определения оптимальной реваскуляризационной стратегии, однако можно предположить, что ключевым фактором в выборе стратегии будет функция ЛЖ.
Таблица 1.12
Перкутанная реваскуляризационная стратегия
| Реваскуляризационная стратегия | Определение | Ожидаемый клинический результат |
| Полная анатомическая реваскуляризация | Дилатация всех стенозов >50% в сосудах не менее 1,5 мм в диаметре | Соответствует полной функциональной реваскуляризации |
| Полная функциональная реваскуляризация | Дилатация только тех стенозов, которые могут быть причиной ишемии | Такой же результат, как и при полной анатомической реваскуляризации, у пациентов с сохраненной функцией ЛЖ.
Анатомическая реваскуляризация предпочтительна у пациентов с выраженной дисфункцией ЛЖ |
| Неполная функциональная реваскуляризация | Невозможность дилатировать все стенозы, которые вызывают ишемию | Результат хуже, чем в 2 предыдущих группах |
Итак, полная реваскуляризация миокарда является основной целью коронарной ангиопластики. По мере расширения показаний к интервенционным вмешательствам при ИБС все чаще применяют способ полной функциональной реваскуляризации миокарда, который значительно уменьшает выраженность, а иногда полностью устраняет симптомы заболевания.
Неполную функциональную реваскуляризацию, как правило, используют в тех клинических ситуациях, когда технически невозможно восстановить кровоток по одному (или нескольким, но не всем) из пораженных сегментов коронарного русла. Однако для уменьшения выраженности симптоматики и частичного восстановления кровоснабжения миокарда проводят неполную реваскуляризацию в качестве паллиативного вмешательства (рис. 1.96а). Таким образом, на схеме определяется окклюзия правой коронарной артерии с одновременным наличием субтотального стеноза передней межжелудочковой ветви левой коронарной артерии (см. рис. 1.96а). После инфаркта задней стенки ЛЖ окклюзия правой коронарной артерии привела к акинезии инфарктной зоны при наличии субтотального стеноза в передней межжелудочковой ветви левой коронарной артерии. Восстановление кровотока по передней межжелудочковой ветви левой коронарной артерии в данном случае может привести к полному исчезновению симптомов стенокардии. Это будет полная функциональная реваскуляризация, так как адекватно устранен основной источник, связанный с ишемизацией миокарда (субтотальный стеноз передней межжелудочковой ветви). Однако если окклюзированная правая коронарная артерия у пациента будет обеспечена коллатеральным кровотоком из левой коронарной артерии и будет определяться контрактильность задней стенки ЛЖ, то ангиопластика в передней межжелудочковой ветви будет расценена как неполная функциональная реваскуляризация (рис. 1.96б). Но даже в этом случае адекватность вмешательства может определяться степенью коллатерального кровотока и гемодинамической значимостью правой коронарной артерии. Например, выраженный коллатеральный кровоток из передней межжелудочковой ветви и наличие левого типа кровоснабжения задней стенки ЛЖ может определить данный вариант реваскуляризации как адекватный. Подобный пример коллатерального кровотока третьей степени из передней межжелудочковой ветви в окклюзированную правую коронарную артерию представлен на рис. 1.97а, б.
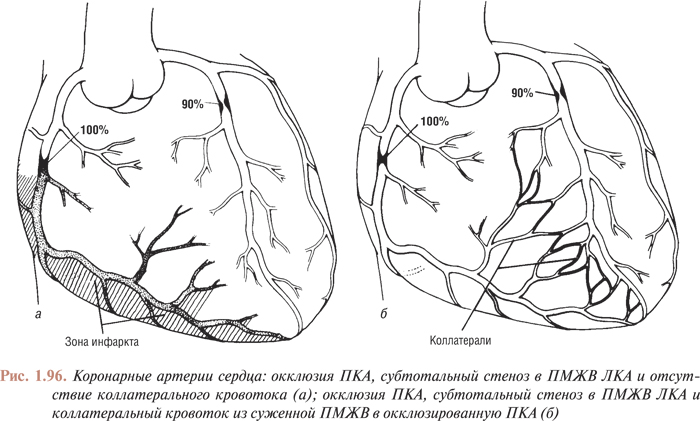
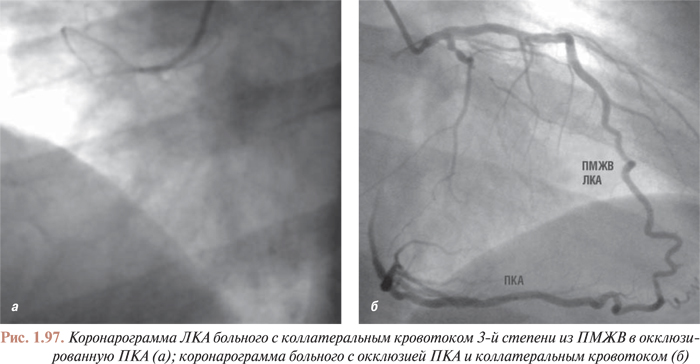
Среди пациентов, у которых ангиопластику выполняют для улучшения отдаленной выживаемости, повышения толерантности к физической нагрузке, неполная, но адекватная реваскуляризация (полная функциональная реваскуляризация) абсолютно оправдана и достигает своей цели. В докладе CASS Registry указано, что не существует разницы в отдаленных клинических результатах АКШ у пациентов с трехсосудистым поражением и проведением полной анатомической и полной функциональной реваскуляризации. У пациентов с выраженной стенокардией и сниженной функцией ЛЖ полная реваскуляризация (шунтирование 3 и более артерий) была связана с улучшением выживаемости при использовании многовариантного анализа. Публикации сотрудников клиники Mayo (Bell, 1990) подтверждают, что у пациентов с тяжелым течением стенокардии после ангиопластики также отмечены лучшие результаты при использовании методики полной реваскуляризации (полная анатомическая), чем у пациентов со стенокардией средней степени тяжести. Среди 867 пациентов с ИБС и многососудистым поражением, у которых успешно проведена коронарная ангиопластика, полная функциональная реваскуляризация не была связана с увеличением количества осложнений в течение нескольких лет после проведения вмешательства. Однако по данным многовариантного анализа установлено, что у 937 пациентов после коронарной ангиопластики с исходной стенокардией покоя тактика неполной реваскуляризации была прямо связана с осложнениями заболевания, которые развились в ближайшие несколько лет после коронарной ангиопластики. Таким образом, клиническое состояние больных, то есть тяжесть стенокардии, может определять отдаленные результаты лечения, если проводят полную функциональную реваскуляризацию миокарда. Чем больше выражены симптомы стенокардии и чем ниже фракция ЛЖ, тем более полную ревакуляризацию необходимо проводить у этих больных для достижения стойкого отдаленного результата лечения. У пациентов со стенокардией средней степени выраженности неполную (но функционально оправданную) реваскуляризацию можно более широко использовать в сложных случаях, когда проведение анатомически полной реваскуляризации миокарда при помощи катетерной техники невозможно.
Влияние количества пораженных артерий на осложнения, которые возникают в период проведения коронарной ангиопластики, проанализированы у 1764 пациентов во втором исследовании (NHLBI (the National Heart, Lung, and Blood Institute) PTCA (Percutaneous Transluminal Coronary Angioplasty) Registry) за период с 1985 по 1986 г. (табл. 1.13).
Таблица 1.13
Зависимость осложнений ЧТКА от количества пораженных артерий, возникающих в период проведения коронарной ангиопластики (NHLBI PTCA Registry за период с 1985 по 1986 г.)
| Осложнение | Поражение | р | ||
| однососудистое (n=838), % | двухсосудистое (n=559), % | трехсосудистое (n=367), % | ||
| Смерть | 2 (0,2) | 5 (0,9) | 8 (2,2) | <0,001 |
| Нефатальный ИМ | 29 (3,5) | 29 (5,2) | 19 (5,2) | Недостоверно |
| Экстренное АКШ | 24 (2,9) | 22 (3,9) | 16 (4,4) | Недостоверно |
Серьезные осложнения (смерть, нефатальный ИМ или экстренное АКШ) отмечены у 5,5% пациентов с однососудистым поражением, у 8,1% — с двухсосудистым и у 9,3% — с трехсосудистым. Периферические осложнения, то есть те, которые связаны с пункцией бедренной артерии и требуют хирургического вмешательства на периферических сосудах, или необходимость в проведении гемотрансфузии возникали приблизительно у 2,5% пациентов с многососудистым поражением после проведения ЧТКА.
Многососудистая ангиопластика у пациентов с сохраненной функцией ЛЖ
Для того чтобы определить оптимальный способ реваскуляризации, обследовали более 4000 пациентов с ИБС и многососудистым поражением коронарного русла, которые были рандомизированы в 6 исследованиях. В каждом исследовании сравнивали результаты многососудистой коронарной ангиопластики (ЧТКА) и АКШ. Критерии включения и исключения пациентов из данных исследований представлены в табл. 1.14, а базовые характеристики — в табл. 1.15 и 1.16.
Таблица 1.14
Рандомизированные исследования ЧТКА в сравнении с АКШ: критерии включения и исключения пациентов из исследования
| Название исследования | n | Критерий |
| RITA | 1011 | Включения: одно-, двух- и трехсосудистое поражение (75% стеноз). Пораженная артерия кровоснабжает не менее 20% миокарда. У всех пациентов есть стенокардия и объективные признаки ишемии миокарда. Реваскуляризация возможна как при ЧТКА, так и при АКШ.
Исключения: предшествующие ЧТКА или АКШ, поражение ствола ЛКА, выраженные гемодинамические поражения клапанов сердца |
| ERACI | 127 | Включения: многососудистая коронарная болезнь (≥2 сосудов с ≥70% стенозом).
Исключения: дилатационная ишемическая кардиомиопатия, выраженное трехсосудистое поражение с ФВ ≤35%, значительное сужение ствола ЛКА, выраженное поражение клапанного аппарата, острый ИМ |
| GABI | 358 | Включения: возраст <75 лет, стенокардия II ФК, многососудистое поражение коронарных артерий (менее ≥2 сосудов со стенозом ≥70%).
Исключения: предшествующая ЧТКА или АКШ, полная окклюзия, стеноз ствола ЛКА ≥30%, ФВ левого желудочка >50%, длина поражения >2 см, диффузная коронарная болезнь, ИМ в течение 4 нед |
| CABRI | 1054 | Включения: возраст до 76 лет, многососудистое поражение (не менее 2 сосудов со стенозом >50%).
Исключения: предшествующая ЧТКА или АКШ, поражение ствола ЛКА ≥50%, первые 10 дней острого ИМ, ФВ — 35%, недавно перенесенный инсульт, различная сопутствующая патология |
| EAST | 392 | Включения: двух- или трехсосудистое поражение, стенокардия, объективно подтвержденная результатами неинвазивных методов диагностики.
Исключения: предшествующая ЧТКА, не более 2 тотальных окклюзий, ФВ — 25%, ИМ в течение первых 5 дней |
| BARI | 1011 | Включения: возраст от 17 до 80 лет, многососудистое поражение (сосуды со стенозом не менее 50%) с клинически подтвержденной стенокардией (ФК III–IV, нестабильная стенокардия). Недавно перенесенный не-Q-ИМ или стенокардия напряжения (I–II ФК) с выраженной ишемией во время нагрузочного тестирования. Недавно перенесенный Q-ИМ или ФВ ЛЖ <50% или без стенокардии, но с выраженной ишемией, которая подтверждена результатами неинвазивного тестирования.
Исключения: экстренная реваскуляризация, стеноз ствола — 50%, первичный коронарный спазм, выраженная аортальная кальцификация |
Таблица 1.15
Рандомизированные исследования ЧТКА в сравнении с АКШ: дизайн исследования и базовые характеристики
| Показатель | RITA | ERACI | GABI | CABRI | EAST | BARI |
| Количество больных | 1011 | 127 | 359 | 1054 | 392 | 1829 |
| Дизайн исследования | ||||||
| Планируемый период наблюдения, лет | 10 | 3 | 1 | 5–10 | 5 | 10 |
| Необходимость в полной реваскуляризации | Да | Нет | Да | Нет | Нет | Нет |
| Включение пациентов с тотальными окклюзиями | Да | Да | Нет | Да | Нет | Да |
| Использование новых устройств | Нет | Нет | Нет | Да | Нет | Да |
| Вмешательства на внутренней грудной артерии (ВГА), % | 74 | 77 | 37 | 81 | 90 | 82 |
| Базовые характеристики | ||||||
| Возраст, лет | 57 | 57 | — | 60 | 61 | 61 |
| Мужчины, % | 81 | 54 | 80 | 78 | 73 | 74 |
| Предшествующий ИМ, % | 43 | 31 | 47 | 43 | 41 | 55 |
| Нестабильная стенокардия, % | 59 | 53 | 14 | 15 | 62 | 65 |
| ФВ ЛЖ, % | — | 61 | 56 | 63 | 62 | 57 |
| 1 пораженная артерия, % | 45 | 0 | 0 | 0 | 0 | 0 |
| 2 пораженные артерии, % | 43 | 55 | 82 | 58 | 60 | 59 |
| 3 пораженные артерии, % | 12 | 45 | 18 | 40 | 40 | 41 |
Таблица 1.16
Рандомизированные исследования ЧТКА в сравнении с АКШ: эффективность ЧТКА и степень реваскуляризации
| Название исследования | Эффективность ЧТКА (%) | Степень реваскуляризации |
| RITA | 87 | Полная функциональная реваскуляризация у пациентов с двух- и трехсосудистым поражением. ЧТКА проведена соответственно в 81 и 63% случаев |
| ERASI | 92 | Полная функциональная реваскуляризация достигнута в 89% случаев |
| GABI | 92 | Полная анатомическая реваскуляризация достигнута в 86% случаев |
| CABRI | 91 | Полная функциональная реваскуляризация |
| EAST | 88 | Полная функциональная реваскуляризация |
| BARI | 88 | Полная функциональная реваскуляризация |
Коронарную ангиопластику проводили, как правило, в сосудах со стенозом >50% и диаметром не менее 1,5 мм. Более того, выживаемость ткани миокарда в зоне пораженного сегмента сосудов определяли с помощью неинвазивных методов. Нестандартные устройства для восстановления кровотока в суженных коронарных артериях такие, как атерэктомия и стенты, применяли только в исследованиях CABRI (Coronary Angioplasty Bypass Revascularization Investigation) и BARI (Bypass Angioplasty Revascularization Investigation). Внутреннюю грудную артерию использовали при проведении АКШ в 75%, кроме исследования GABI (German Angioplasty Bypass Surgery Investigation) — 37%.
Результаты лечения в госпитальный период
Особенности госпитального периода пациентов после многососудистой ангиопластики обусловлены прежде всего тем, что дилатация артерии в пораженном сегменте часто приводит к микроскопическим диссекциям в месте дилатации. Одним из механизмов коронарной ангиопластики, определяющих увеличение просвета артерии после вмешательства, является микроскопическое растрескивание стенки артерии после раздувания баллона. Чтобы снизить риск крупной диссекции, некоторые исследователи используют баллон-катетер по размеру меньше предполагаемого диаметра артерии или давление в баллоне ниже номинального. Однако подобная практика успешна только при наличии очень мягких атеросклеротических бляшек. Чаще всего подобный прием приводит к выраженному остаточному стенозу (рис. 1.98а, б) и возврату клинических проявлений в результате активации «обратной тяги» (стретчинг) артерии.
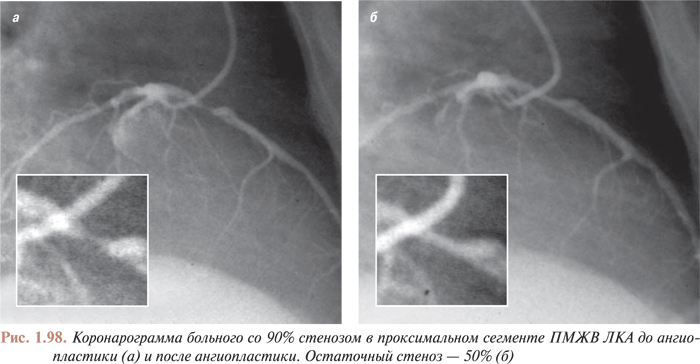
Однако в некоторых случаях диссекция может быть достаточно обширной и видимой на ангиограмме. В этом случае существует опасность резкого нарушения кровотока в данной артерии и возникновения острого тромбоза дилатированного сегмента. Процесс тромбообразования, как правило, происходит на протяжении 1-го часа–1-х суток после вмешательства (то есть в период госпитализации). Именно поэтому очень важно оценивать результаты лечения в госпитальный период после многососудистой ангиопластики.
В рандомизированных исследованиях ЧТКА была успешной в 87–92% случаев, смертность составила 0,7–5%, ИМ развился в 2,3–6,3% случаев (в период госпитализации), экстренное АКШ выполнено у 1,5–10,3% больных (см. табл. 1.16; 1.17). Летальность в группах больных после ангиопластики и АКШ была приблизительно одинаковой, хотя у пациентов после ангиопластики отмечена более низкая частота госпитальных ИМ и более короткий период пребывания в стационаре.
Таблица 1.17
Рандомизированные исследования ЧТКА в сравнении с АКШ: внутригоспитальные результаты
| Название исследования | Метод | Осложнения, % | Комментарии | ||
| Смерть | ИМ | АКШ | |||
| RITA | ЧТКА
АКШ |
0,7
1,2 |
3,5
2,4 |
4,5 | Продолжительность госпитализации: ЧТКА — 4 дня, АКШ — 12 дней |
| ERASI | ЧТКА
АКШ |
1,5
4,6 |
6,3
6,2 |
1,5 | Инсульт: ЧТКА — 1,5%, АКШ — 3,1% |
| GABI | ЧТКА
АКШ |
1,1
2,5 |
2,3
8,1* |
2,8 | Инсульт: ЧТКА — 0%, АКШ — 1,2%; пневмония после ЧТКА — 1,1%, после АКШ — 10,6%, p<0,001; госпитализация: ЧТКА — 5 дней, АКШ — 19 дней; стенокардия после ЧТКА — 18%, после АКШ — 7%, p<0,005 |
| CABRI | ЧТКА
АКШ |
1,3
1,3 |
— | 3,3 | — |
| EAST | ЧТКА
АКШ |
1
1 |
3
10,3* |
10,1 | Инсульт: ЧТКА — 0,5%, АКШ — 1,5% |
| BARI | ЧТКА
АКШ |
1,2
и |
2,1
4,6* |
6,3 | Инсульт: ЧТКА — 0,2%, АКШ — 0,8%; дыхательная недостаточность после ЧТКА — 1%, АКШ — 2,2%, p<0,05 |
*р<0,01.
Отдаленные результаты
В клинических наблюдениях в течение 1 года–3 лет пациентов после АКШ и ангиопластики не отмечены серьезные различия по таким показателям, как смертность, ИМ, толерантность к физической нагрузке. Однако, сравнивая результаты АКШ и коронарной ангиопластики, необходимо отметить, что в группе ЧТКА больше пациентов с рекуррентной стенокардией, чем в группе АКШ (30–40% в сравнении с 20–25%), в 3–10 раз чаще проводили повторную реваскуляризацию той же артерии в группе ЧТКА (32–54% — в группе ЧТКА и 2–13% — в группе АКШ). Проведение АКШ было показано приблизительно у 20% больных после коронарной ангиопластики (табл. 1.18).
Таблица 1.18
Рандомизированные исследования ЧТКА в сравнении с АКШ: отдаленные результаты
| Название исследования | Время наблюдения, лет | Метод | Осложнения, % | |||
| Смерть | ИМ | Повт. реваскуляризация | Отсутствие симптомов заболевания | |||
| RITA | 2,5 | ЧТКА | 3,1 | 3,6 | 35 | 69 |
| АКШ | 3,6 | 3,9 | 3,8 | 79 | ||
| ERASI | 1 | ЧТКА | 3,2 | 3,2 | 32 | — |
| АКШ | 0 | 1,8 | 3,2 | — | ||
| GABI | 3 | ЧТКА | — | 37 | 60 | |
| АКШ | — | — | 3,2 | 80 | ||
| 1 | ЧТКА | 2,6 | 4,5 | 44 | 71 | |
| АКШ | 6,5 | 9,4 | 6 | 74 | ||
| CABRI | 1 | ЧТКА | 3,9 | 4,9 | 35,6 | 67 |
| АКШ | 2,7 | 3,5 | 2,1 | 75 | ||
| EAST | 3 | ЧТКА | 7,1 | 14,6 | 54 | 80 |
| АКШ | 6,2 | 19,6 | 13 | 88 | ||
| BARI | 5 | ЧТКА | 14 | 8 | 54 | — |
| АКШ | 11 | 9 | 8 | — | ||
| Пациенты с сахарным диабетом | ЧТКА | 35 | — | 62 | — | |
| АКШ | 19 | — | 8 | — | ||
Allis и соавторы проанализировали результаты 2-летнего лечения 350 пациентов с ИБС с многососудистым поражением и многососудистой ангиопластикой в целях определения частоты выживаемости. После анализа ангиографических и клинических данных определены независимые предикторы серьезных коронарных событий (смерть, ИМ или необходимость проведения АКШ). Таким образом у всех пациентов без стенокардии покоя, сахарного диабета и стеноза в проксимальном сегменте передней межжелудочковой ветви отмечена 97% 2-летняя выживаемость без приступов стенокардии. В период наблюдения все пациенты этой группы были живы. У пациентов с 2 и более из перечисленных факторов (стенокардия покоя, сахарный диабет и стеноз в проксимальном сегменте передней межжелудочковой ветви) показатель 2-летней смертности составил >25%, а выживаемости с отсутствием стенокардии — <50%. Сниженная функция ЛЖ была наиболее мощным протектором выживаемости.
В работе В. Meier и соавторов частота удовлетворительных отдаленных результатов через 14 мес после ангиопластики составила 84% (критерии: исчезновение приступов стенокардии, значительное улучшение результатов функциональных тестов), однако она была достоверно ниже, чем процент успешных отдаленных результатов после АКШ (94% пациентов без симптомов заболевания через 26 мес после операции АКШ).
Противоположные результаты установлены в исследовании D. Holmes и соавторов. Среди обследованных пациентов через 1 год после ангиопластики у 96% больных не отмечена клиника стенокардии по сравнению с 88% пациентов, у которых было выполнено АКШ. Аналогичные данные приводятся в другом многоцентровом исследовании, проведенном в США.
Функциональное улучшение и исчезновение симптомов стенокардии было отмечено у 88% пациентов через 3–18 мес после ангиопластики. Из них у 9,4% пациентов проводили повторную ЧТКА и у 6,3% — АКШ в тот же период. Согласно данным Американского регистра коронарной ангиопластики у 74% пациентов через 24 мес после коронарной ангиопластики отмечены хорошие и удовлетворительные отдаленные результаты. По результатам исследования М. Bertrand у 86% пациентов через 6 мес после вмешательства не отмечали клинических симптомов стенокардии и объективных признаков ишемии миокарда.
Данные различных центров и результаты многоцентровых исследований в отношении кардиальных осложнений и рецидивов стенокардии в течение 1 года после коронарной ангиопластики представлены в табл. 1.19 .
Таблица 1.19
Результаты исследований в отношении кардиальных осложнений и рецидива стенокардии в течение 1 года после коронарной ангиопластики
| Клинические факторы | NHLBI (США) | Рочестер (Великобритания) | Лилль (Франция) | Средние данные |
| Повторная ангиопластика, % | 12 | 10 | 22 | 14 |
| АКШ, % | 11 | 12 | 1 | 9 |
| ИМ, % | 3 | 3 | 1 | 2 |
Тезис о зависимости отдаленных результатов коронарной ангиопластики от степени реваскуляризации миокарда косвенно подтверждается при сравнении этих результатов после ангиопластики одиночных и множественных поражений коронарного русла. Через 1 год–5 лет после вмешательства при одиночных поражениях у 70–85% пациентов отсутствовали симптомы заболевания, а при множественных поражениях исчезновение симптомов стенокардии через 1 год–6 лет после ангиопластики отмечено у 50–75% пациентов (табл. 1.20, 1.21).
Таблица 1.20
Отдаленные результаты коронарной ангиопластики у пациентов с однососудистым поражением коронарного русла
| Автор (год) | Количество больных, n | Период наблюдения, лет | Смертность, % | ИМ, % | АКШ, % | Коронарная ангиопластика,% | Без симптомов, % |
| Kent et al. (1984) | 1115 | 2 | 2,2 | 3,4 | 12 | 14 | 74 |
| Faxon et al. (1983) | 214 | 1,5 | 2,6 | 9,5 | 38 | 9 | 82 |
| Gruentzig et al. (1987) | 98 | 6 | 3,0 | 12 | 18 | 62 | |
| Talley et al. (1988) | 369 | 5 | 3,5 | 5,5 | 16 | 20 | 84 |
| Mabin et al. (1985) | 87 | 1,2 | 0,1 | 3,0 | 10 | 17 | 74 |
| Detre et al. (1988) | 709 | 1,0 | 1,3 | 1,7 | 5,5 | 21 | 76 |
| Средние данные | 21 | 46 | 15,6 | 18,5 | 75,3 |
Таблица 1.21
Отдаленные результаты коронарной ангиопластики у пациентов с многососудистым поражением коронарного русла
| Автор (год) | Количество больных, n | Период наблюдения, лет | Смертность, % | ИМ, % | АКШ, % | Коронарная ангиопластика,% | Без симптомов, % |
| Hartzler et al. (1983) | 90 | 1,0 | 2,0 | — | 6 | 8 | — |
| Vliestra et al. (1983) | 100 | 0,5 | 2,0 | 12 | 19 | 56 | |
| Kent et al. (1986) | 282 | 2,0 | 6,4 | 6,0 | 38 | 14 | 56 |
| Dorros et al. (1984) | 285 | 1,0 | — | 0,3 | 6 | 20 | — |
| Cowley et al. (1985) | 44 | 2,0 | — | 2 | 18 | 10 | 48 |
| Gruentzig et al. (1987) | 71 | 6,0 | 8 | — | 7 | 13 | 72 |
| DiSciascio et al. (1988) | 50 | 0,5 | 4 | 4,0 | 4 | 30 | 74 |
| Detre et al. (1988) | 703 | 1,0 | 2,6 | 3,4 | 7,4 | — | 76 |
| Средние данные | 26 | 3,0 | 12,3 | 16,3 | 60,7 |
При многососудистом поражении коронарного русла отдаленные результаты после коронарной ангиопластики были несколько хуже (см. табл. 1.21). Несмотря на более высокий процент пациентов без симптомов заболевания после ангиопластики однососудистых поражений, другие показатели, в частности смертность, частота ИМ и повторных вмешательств (ЧТКА или АКШ), сравнимы в группах с одно- и многососудистыми поражениями.
При длительном наблюдении 2271 больного К. Kent и соавторы пришли к выводу, что после 1 года наблюдения отмечена значительная потребность в повторной реваскуляризации миокарда (14% — при повторной ангиопластике и 12% — при АКШ). При этом у 67% больных отмечали стойкое улучшение. Частота смертности на протяжении 1 года составила 1,6%. J. Talley и соавторы получили аналогичные результаты при 5-летнем наблюдении 424 больных после ЧТКА.
К. Detre и соавторы анализировали отдаленные результаты коронарной ангиопластики у больных с одно- (46%) и многососудистым поражением коронарного русла (54%). Более благоприятный исход отмечен у больных с однососудистым поражением. По результатам наблюдения в течение 1 года установлено, что у больных с много- и однососудистым поражением летальность составила соответственно 4,6 и 1,8%, частота нефатального ИМ — 8,8 и 5,4%, частота повторной коронарной ангиопластики — 18,8 и 18,1%, количество операций АКШ — 15,3 и 10,7%. Следует отметить, что подобные исследования проводили также многие другие авторы.
Перкутанные коронарные вмешательства у больных с ИБС и многососудистым поражением и/или сахарным диабетом
У больных с многососудистым поражением и другими признаками высокого риска осложнений выполнение АКШ, по сравнению с перкутанным коронарным вмешательством, дает лучшие показатели выживаемости. Однако различия по стоимости лечения и качеству жизни между результатами АКШ и перкутанного коронарного вмешательства теряются в течение 10–12-летнего наблюдения. Решение о полной реваскуляризации или о восстановлении просвета только в той артерии, которая вызывает ишемию, принимается в индивидуальном порядке.
Хотя формальные данные сравнения результатов перкутанного коронарного вмешательства и АКШ при сахарном диабете отсутствуют, инвариабельный анализ post hoc показал, что исходы перкутанного коронарного вмешательства хуже, чем исходы АКШ. В исследовании ARTS (Artery Revascularization Therapies Study), в котором сравнивали результаты перкутанного коронарного вмешательства и АКШ у больных с многососудистым поражением и сахарным диабетом, выявили, что результаты обоих видов лечения не являются удовлетворительными; при этом результаты перкутанного коронарного вмешательства хуже результатов АКШ. Смертность в течение 3 лет после перкутанного коронарного вмешательства составила 7,1%; после АКШ — 4,2%. Отмечено значимое различие в показателях выживаемости без осложнений: в группе перкутанного коронарного вмешательства этот показатель составил 52,7%; в группе АКШ — 81,3%. В случаях многососудистого поражения, когда имеется 1 или 2 гемодинамически значимых стеноза (фракционный резерв кровотока <0,75), результаты перкутанного коронарного вмешательства такие же благоприятные, как и результаты АКШ, которое выполняется при 3 и более значимых стенозах, несмотря на одинаковую ангиографическую распространенность болезни (Рекомендации для перкутанных коронарных вмешательств при многососудистом поражении и/или сахарном диабете: класс IIb, уровень доказательности C). Поступающие данные о применении элютинг-стентов у больных с многососудистым поражением и/или сахарным диабетом могут изменить эту ситуацию.
Порядок дилатации коронарных стенозов при многососудистом поражении
Очередность, в которой происходит дилатация коронарных стенозов, напрямую связана с безопасностью и эффективностью ангиопластики. Полные окклюзии, которые обеспечиваются коллатералями из других артерий, дилатируют в первую очередь, затем дилатации подвергают гемодинамически значимые стенозы в артериях, которые кровоснабжают другую часть миокарда. Если основной гемодинамический стеноз расположен в артерии, которая кровоснабжает небольшую часть миокарда, мы предлагаем проводить дилатацию стенозированных сегментов в наиболее важных артериях, то есть в тех, которые отвечают за наиболее функциональные участки миокарда (передняя межжелудочковая ветвь левой коронарной артерии и т.д.). Если 2 стеноза расположены в сосудах равного диаметра, то в первую очередь ангиопластику проводят в сегменте артерии с лучшим коллатеральным кровотоком. При наличии проксимального и дистального стеноза одной артерии мы предлагаем сначала проводить ангиопластику дистального стеноза
(это правило не распространяется на стентирование ствола левой коронарной артерии). В этом случае можно ограничиться использованием лишь одного баллона-катетера, который может успешно пройти через проксимальный стеноз, и провести дилатацию в дистальном сегменте, а затем после тракции уже использованного баллона провести ангиопластику в проксимальном сегменте коронарной артерии. Однако в некоторых ситуациях, когда использовать один баллон при дилатации двух стенозов в одной артерии невозможно (значительное изменение калибра сегмента в 2 пораженных участках артерии), очередность ангиопластики не имеет большого значения для клинического и ангиографического эффекта вмешательства.
Редкие случаи многососудистой болезни и ангиопластика: ЧТКА артерии, когда другие артерии окклюзированы
В некоторых исследованиях оценивали результаты коронарной ангиопластики единственной проходимой артерии в том случае, если другие артерии были окклюзированы. Согласно данным табл. 1.22 успех и осложнения этих вмешательств вполне соизмеримы. Тем не менее многие врачи направляют таких пациентов для проведения АКШ, особенно если окклюзированная артерия должна кровоснабжать большую зону миокарда, функция ЛЖ низкая, а подходящий для коронарной ангиопластики стеноз имеет сложную морфологию (пристеночный тромбоз, расположение на изгибе артерии и т.д.). Однако возможно и проведение инвазивных вмешательств (см. табл. 1.22) с достаточной эффективностью и безопасностью. Однако каждый из пациентов должен иметь исчерпывающую информацию о возможности повторных вмешательств и о том, что при успешном проведении коронарной ангиопластики существует реальная возможность повторения реваскуляризации (включая АКШ), которое может возникнуть в 30–40% случаев.
Таблица 1.22
ЧТКА одной крупной артерии при окклюзии других артерий
| Исследователь (год) | Метод лечения | Количество пациентов, n | Госпитальный период,% | Отдаленный период,% | Нет стенокардии, % | |
| Смерть/Q-ИМ/АКШ | Месяцы наблюдения | Смерть/Q-ИМ/ЧТКА/АКШ | ||||
| Lafont (1993) | ЧТКА ПМЖВ ЛКА или ПКА, когда другая артерия окклюзирована | 193 | 0,5/0,5/5,7 | 33 | 4,7/3,7/23,6/13,1 | 76 |
| ЧТКА ПМЖВ+ПКА | 214 | 0,5/0,5/3,3 | 5,3/4,3/11,6/8,2 | 80 | ||
| АКШ ПМЖВ+ПКА | 194 | 1,5/1,0/0 | 8,5/3,7/1,6/2,1 | 74 | ||
| DeBruyne (1991) | ЧТКА ПМЖВ или ОВ ЛКА, когда ПКА окклюзирована | 61 | 0/0/4,9 | 5 | -/-/25/5 | 65 |
| Teirstein (1990) | ЧТКА ЛКА: | |||||
| ПКА окклюзирована | 65 | 1,5/-/0 | 17 | 8/3/-/18 | 61 | |
| ПКА не окклюзирована | 105 | 0/-/1,5 | 7/1/-/9 | 84 | ||
Перкутанные коронарные вмешательства при хронических окклюзиях
В настоящее время частота ЧТКА хронической полной окклюзии составляет до 20% всех ангиопластик (рис. 99 а, б). Хотя во многих клинических ситуациях хорошо развитый коллатеральный кровоток обеспечивает достаточное кровоснабжение соответствующего участка миокарда в состоянии покоя или при умеренной физической нагрузке, тем не менее интра- и интеркоронарные коллатерали часто неадекватно функционируют в периоды резкого повышения потребности миокарда в кислороде, что является причиной возникновения постокклюзионной стенокардии.
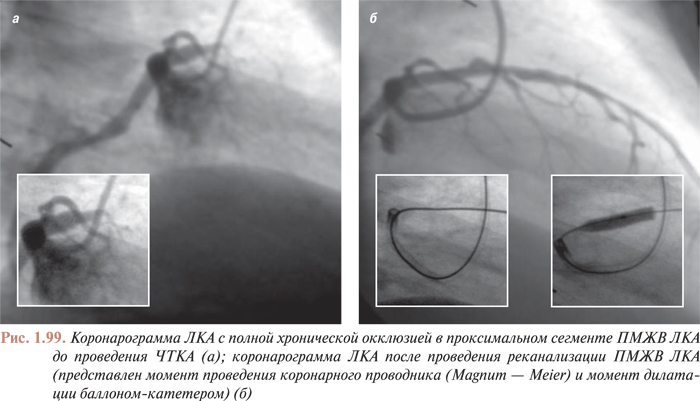
Рассматривая проблему реканализации окклюзированных артерий необходимо четко определить природу окклюзии. Состояние артерии до возникновения полной окклюзии в значительной степени определяет клинические проявления болезни, наличие коллатерального кровотока, выживаемость миокарда и природу коронарной обструкции. Рассмотрим 2 типа образования окклюзии.
Первый тип (табл. 1.23, рис. 1.100) — острая окклюзия, возникшая в результате образования тромба в месте умеренного стеноза коронарных артерий. В большинстве случаев окклюзия такого типа клинически проявляется в виде острого ИМ. Коллатеральный кровоток обычно отсутствует или слабо выражен. Восстановление кровотока по окклюзированной артерии после острой окклюзии в течение 4, 6 или 12 ч способствует значительному улучшению прогноза при ИМ. Патофизиологически тромботическая обструкция состоит из разрушенной бляшки и свежих тромботических масс. Подобного типа окклюзии хорошо реканализируются проводниками обычного типа, успех вмешательства составляет >90%. Эффективность реканализации инфарктобусловившей коронарной артерии со временем (месяцы, годы) снижается, что связано с реорганизацией свежих тромбов, которые подвергаются фиброзу и кальцификации.
Таблица 1.23
Полная коронарная окклюзия: клинические и патоморфологические особенности
| Показатель | Острая окклюзия | Хроническая окклюзия |
| Проявления | Острый ИМ | Изменение ангинозного статуса. Обычно стенокардия напряжения (недостаточность коллатерального кровотока) |
| Гистология | Разрушенный фиброзный колпачок мягкой атероматозной бляшки. Как правило, окклюзирующий тромб в просвете артерии | Сложный комплекс в виде фиброзных и кальцинированных участков атеросклеротической бляшки с организованными тромбами, расположенными послойно |
| Спонтанная реканализация | Достаточно часто | Редко |
| Интракоронарные коллатерали | Редко | Достаточно часто (мостиковые коллатерали) |
| Интеркоронарные коллатерали | Иногда | Как правило |
| Выживаемость ткани миокарда | Очень редко, при наличии коллатерального кровотока | Часто: коллатерали поддерживают выживаемость. Возможна нормальная сократимость стенки левого желудочка в случае очень выраженного коллатерального кровотока в окклюзированной артерии |
| Эффективность ЧТКА | Высокая | Варьирует. Зависит от времени образования и морфологии окклюзии |
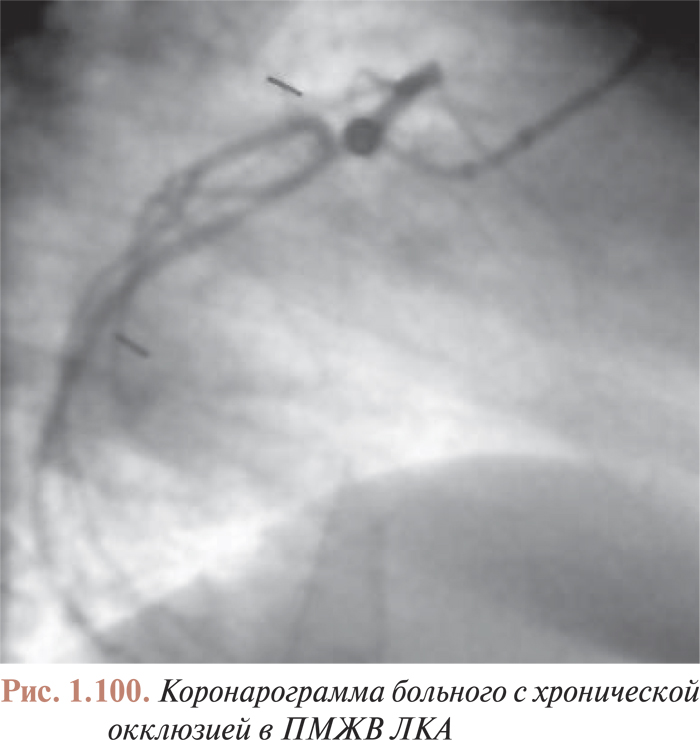
Второй тип (см. табл. 1.23; рис. 1.101) окклюзии коронарной артерии можно определить как полную хроническую окклюзию, образовавшуюся в результате длительного течения заболевания в месте субтотального сужения коронарной артерии. Клинически возникновение хронической окклюзии зачастую проявляется изменением ангинозного статуса и значительно реже — острым ИМ. Как правило, хорошо развитый коллатеральный кровоток может обеспечивать дистальное заполнение артерии, соответствующее стенозу 90–95%. Это приводит к сохранению выживаемости миокардиальной ткани и предотвращает развитие стенокардии покоя. Общая сократительная способность миокарда может быть нормальной (при выраженном коллатеральном кровотоке) или умеренно сниженной, региональная сократимость, как правило, изменена и связана с гибернацией миокарда или субэндокардиальным ИМ. Патофизиологически большинство хронических окклюзий образуется в месте расположения кальцинированной атеросклеротической бляшки. Эти обструкции, как правило, оказываются резистентными к прохождению внутрикоронарного проводника, что обусловливает более низкую (от 50 до 70%) эффективность реканализации.
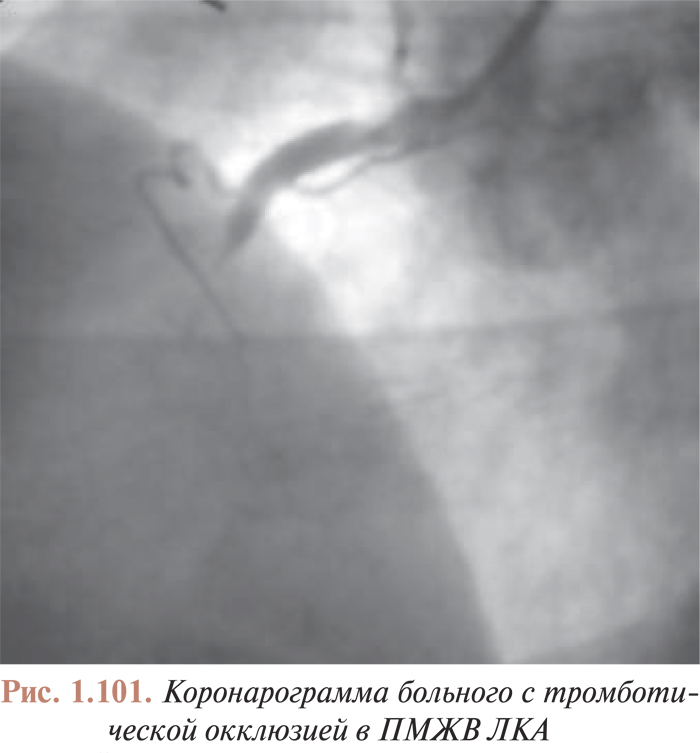
Перкутанная реканализация окклюзированных артерий
Показания и результаты вмешательства
Основные показания:
- стенокардия, рефрактерная к медикаментозной терапии;
- наличие большой площади ишемизированной зоны по данным неинвазивных исследований;
- наличие ангиографических особенностей окклюзии, которые могут способствовать успешной реканализации (рис. 1.102).
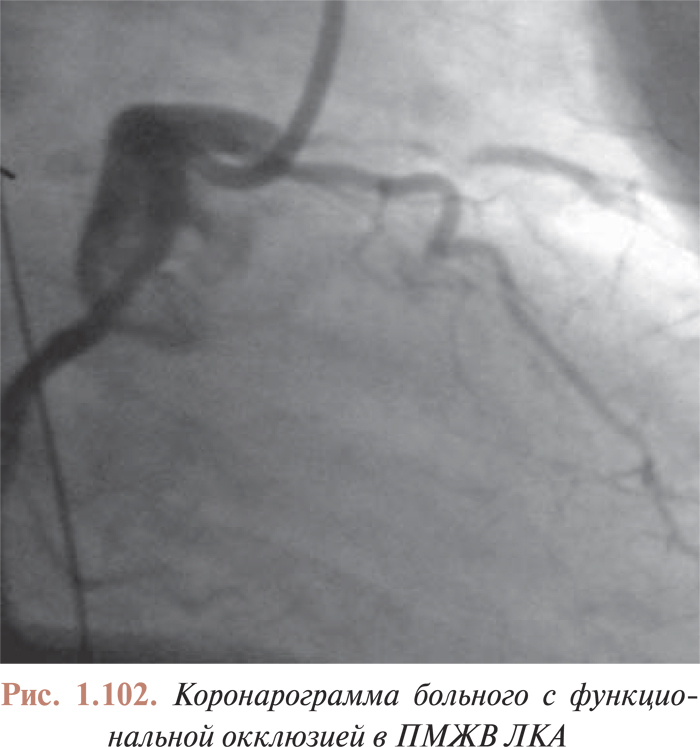
Ожидаемые результаты успешного вмешательства:
- уменьшение выраженности или исчезновение стенокардии напряжения;
- улучшение функции ЛЖ и повышение толерантности к физической нагрузке;
- уменьшение необходимости в проведении АКШ на 50%.
Возможные результаты успешного вмешательства:
- потенциальный источник коллатерального
- кровотока к другим сосудам;
- улучшение процессов ремоделирования ЛЖ после ИМ;
- улучшение выживаемости пациентов без стенокардии.
Успех вмешательства
По данным сравнительного анализа эффективность реваскуляризации функциональных и полных хронических окклюзий, к сожалению, остается невысокой (табл. 1.24). Опубликованные серии исследований, которые в общем составляют 4400 хронических коронарных окклюзий, подтверждают, что в среднем уровень успеха составляет более 69% (от 47 до 81%) (табл. 1.25).
Таблица 1.24
Коронарная ангиопластика неполных, функциональных и полных хронических окклюзий: немедленные результаты
| Автор исследования (год) | Группа | Количество окклюзий, n | Эффективность, % | Осложнения, % Смерть/ИМ/АКШ |
Острая окклюзия, % |
| Berger (1996) | Неполная | 1295 | — | 0/0,14/0 | — |
| Полная | 139 | — | 0/1,5/0,3 | — | |
| Favereau (1995) | Неполная | 2065 | 96 | 1,4 | 1,8 |
| Полная | 292 | 67 | 1,7 | 8 | |
| Tan (1995) | Неполная | 1157 | 93 | 0,4/0,7/2,1 | 3,3 |
| Полная | 91 | 66 | 0/0/0 | 0 | |
| Ruocco (1992) | Неполная | 1429 | 82 | 0,7/4,8/3,5 | 1,5 |
| Полная | 271 | 59 | 1,8/3,6/3,3 | 4,1 | |
| Myler (1992) | Неполная | 779 | 94 | 1,7 | — |
| Полная | 122 | 76 | 1,6 | — | |
| Plante (1991) | Неполная | ||||
| Стабильная стенокардия | 637 | — | 4 | — | |
| Нестабильная стенокардия | 442 | — | 8 | — | |
| Полная | |||||
| Стабильная стенокардия | 44 | 48 | 2,5 | — | |
| Нестабильная стенокардия | 46 | 65 | 2 | — | |
| Stone (1990) | Неполная | 6950 | 96 | 0,9/1,5/1,7 | — |
| Полная | 905 | 72 | 0,8/0,6/0,8 | — | |
| Safian (1988) | Неполная | 711 | 90 | 0,4/3/2 | — |
| Функциональная | 102 | 78 | 1/3/3 | — | |
| Полная | 169 | 63 | 0/0/2 | — | |
Неполная окклюзия — 51–99% (TIMI >2). Функциональная окклюзия — 99% (TIMI=1). Полная окклюзия — 100% (TIMI=0).
Таблица 1.25
Коронарная ангиопластика хронических полных окклюзий: немедленные результаты
| Автор исследования (год) | Количество пациентов, n | Эффективность, % | Осложнения, % Смерть/ИМ/АКШ |
Другие осложнения |
| Berger (1996) | 139 | — | 0/1,4/2,9 | — |
| Favereau (1995) | 367 | 67 | 1,7 | — |
| Kinoshita (1995) | 443 | 81 | 0,3/0/0 | Тампонада сердца (1%) |
| Tan (1995) | 91 | 66 | 0/0/0 | Острая окклюзия (0%) |
| Ishizaku (1994) | 111 | 62 | 0/1,6/0 | Не-Q-ИМ (5%) |
| Tan (1993) | 312 | 61 | 0,3/-/1,6 | — |
| Shimizu (1993) | 468 | 75 | — | |
| Stewart (1993) | 100 | 47 | 1/0/- | Не-Q-ИМ (5%) |
| Maiello (1992) | 365 | 64 | 0/0,6/0,3 | Перфорация 0,6% |
| Myler (1992) | 122 | 76 | 1.6 | — |
| Ivanhoe (1992) | 480 | 66 | 1/2/- | — |
| Ruocco (1992) | 271 | 59 | 2/1/2 | Острая окклюзия (4%) |
| Bell (1991) | 354 | 66 | 0,3/1,7/2,5 | — |
| Stone (1990) | 971 | 72 | 0,8/0,6/0,8 | — |
| Всего | 4450 | 69 |
Наиболее частой (80%) причиной неудачной реканализации коронарной артерии является невозможность проведения коронарного проводника через окклюзию. Одна из причин (15%) неудачной реканализации — невозможность проведения баллона через зону окклюзии, а также невозможность дилатировать окклюзию (5%) в результате ее выраженной кальцификации.
Предикторы успеха (табл. 1.26–1.28). Выбор пациента для проведения реканализации полностью окклюзированной артерии остается наиболее важным предиктором успешной ангиопластики. В зависимости от наличия клинических и ангиографических условий частота реканализации составляет 18–87% (см. табл. 1.26–1.28, рис. 1.102). Важным условием успешной реканализации является «возраст» окклюзии (см. табл. 1.26). Чем «моложе» окклюзия, тем выше вероятность ее успешной реканализации. Оптимальный период для проведения реканализации — 3 мес от предполагаемого момента окклюзии артерии. Не менее важная особенность успешной реканализации полностью окклюзированной коронарной артерии — адекватные рентгеноморфологические условия вмешательства (см. табл. 1.28; рис. 1.103).

Таблица 1.26
Влияние «возраста» окклюзии на результаты коронарной ангиопластики
| Автор исследования (год) | «Возраст» окклюзии | Количество окклюзий, n | Эффективность, % |
| Tan (1995) | <3 мес | 42 | 76 |
| >1 мес | 49 | 57 | |
| Ishizaku (1994) | <1 мес | 11 | 91 |
| >1 мес | 100 | 56 | |
| Myler (1992) | <1 нед | 99 | 87 |
| 1–12 нед | 73 | 88 | |
| >3 мес | 49 | 59 | |
| Bell (1992) | <1 нед | 60 | 74 |
| 1–4 нед | 15 | 93 | |
| 1–3 мес | 243 | 67 | |
| >3 мес | 45 | 64 | |
| Maiello (1992) | <1 мес | 73 | 89 |
| 1–3 мес | 77 | 87 | |
| >3 мес | 110 | 45 | |
| Stone (1990) | <12 нед | 29 | 90 |
| >12 нед | 39 | 74 |
Таблица 1.27
Хроническая полная коронарная окклюзия: предикторы успешной ангиопластики
| Эффективность вмешательства | Неэффективность вмешательства |
| Функциональная окклюзия | Полная окклюзия |
| Окклюзия менее 12 нед | Окклюзия более 12 нед |
| Длина не более 15 мм | Длина более 15 мм |
| Конусовидная культя | «Обрубленная» культя |
| Отсутствует боковая ветвь в месте окклюзии | Присутствует боковая ветвь в месте окклюзии |
| Нет интеркоронарных мостикообразных коллатералей | Выражены мостикообразные коллатерали («голова медузы») |
Таблица 1.28
Влияние различных характеристик окклюзии на результат реканализации
| Автор исследования (год) | Эффективность вмешательства, % | |||||||
| Длина окклюзии | Тип окклюзии | Окклюзия конусовидной культи | «Мостикообразные» коллатерали | |||||
| короткая | длинная | функциональная | полная | Да | Нет | Да | Нет | |
| Kinoshita (1995) | — | — | — | — | — | — | 75 | 83 |
| Tan (1993) | — | — | — | — | 69 | 43 | 70 | 20 |
| Maiello (1992) | 71 | 60 | 68 | 69 | 83 | 51 | 67 | 29 |
| Ivanhoe (1992) | — | — | 78 | 60 | 73 | 60 | — | — |
| Stone (1990) | 85 | 69 | 83 | 74 | 88 | 59 | 18 | 85 |
Функциональная окклюзия
Функциональная окклюзия (рис. 1.102–1.104) — это вариант поражения коронарной артерии, при котором препятствием кровотоку является степень стеноза около 99%, что приводит к частичному заполнению дистальной части артерии контрастным веществом и визуализации постокклюзионного сегмента артерии с задержкой контрастного вещества в дистальной части сосуда (см. рис. 1.104). В разных клинических исследованиях определяли, что вероятность реканализации функциональной окклюзии выше, чем полной окклюзии (76% в сравнении с 67%). Основной дифференциальной особенностью функциональной окклюзии является наличие интракоронарных (внутрибляшечных) каналов (см. рис. 1.104). Основным признаком хронической полной окклюзии могут быть интеркоронарные каналы, которые часто называют мостикообразными коллатеральными сосудами (располагаются вдоль артерии и способствуют заполнению дистального русла окклюзированного сосуда из проксимального сегмента в антеградном направлении).
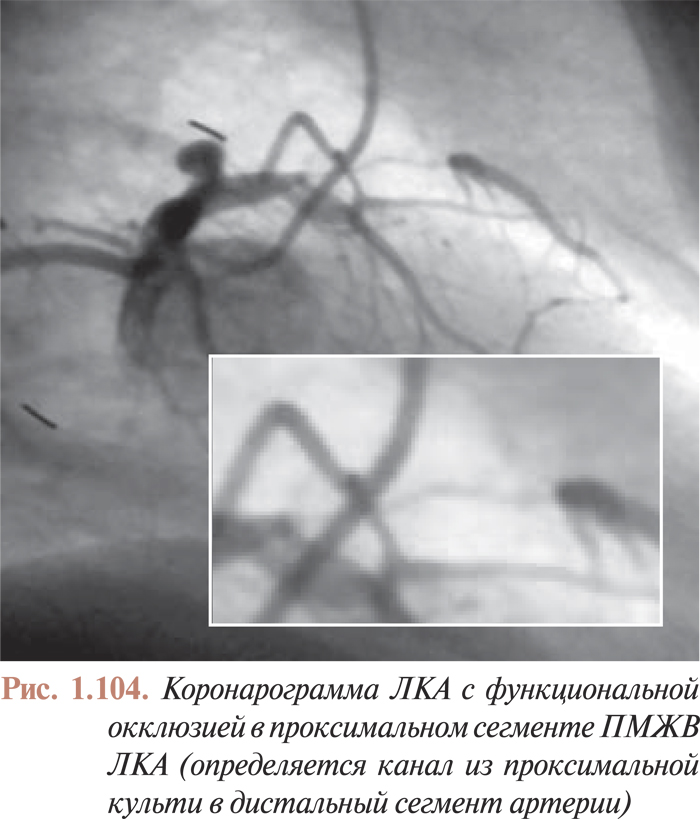
Возраст окклюзии может быть определен как интервал между моментом обследования и появлением выраженных симптомов ишемии миокарда у больного с ИМ, возникновением стенокардии, резким изменением ангинального статуса у пациентов с симптомами ИБС. Наиболее эффективной реканализация была при устранении окклюзии «моложе» 1 нед, промежуточные результаты определяют при лечении окклюзии от 2 до 12 нед, более низкие результаты отмечены при реканализации окклюзии более 3 мес. Нельзя считать «возраст» окклюзии единственным условием успешной реканализации без учета рентгеноморфологических критериев отбора. Более того, «старые» окклюзии не являются бесперспективными для реканализации (вероятность успеха реканализации окклюзии старше 6 мес может составлять 50–75%), однако вероятность успеха вмешательства снижается с «возрастом» окклюзии. В некоторых случаях «возраст» окклюзии определяют по косвенным признакам и он не может считаться абсолютно точным.
Продолжительность окклюзий (длина поражения)
Общим правилом является тот факт, что при длине окклюзии >15 мм эффективность реканализации низкая, хотя и эту характеристику нельзя отделить от других предикторов успешной ангиопластики окклюзии («возраст» окклюзии, анатомические и рентгеноморфологические факторы и т.д.).
Расположение боковой ветви в месте коронарной окклюзии (см. рис. 1.104)
Подобная характеристика окклюзии связана с низкой эффективностью реканализации. Причиной этого может быть то, что проводник по пути прохождения окклюзии уходит в более доступную часть открытой артерии, то есть в боковую ветвь. Более того, если врач использует неоптимальную проекцию, то создается впечатление, что дистальная часть проводника прошла через окклюзию, в то время как проволока расположена в боковой ветви. Важнейшим фактором успешной реканализации является определение адекватности прохождения коронарного проводника через окклюзию с расположением верхушки проводника в просвете дистальной части окклюзированного сосуда.
Наличие конусовидной культи
Конусовидную культю (см. рис. 1.102, 1.103) дилатируют успешнее, в отличие от окклюзии без конусовидной формы. Конусовидные окклюзии состоят из небольших каналов (200 мк в диаметре каждый), которые можно определить при помощи ангиографии, и обеспечивают потенциально более высокую эффективность ангиопластики.
Однако следует учитывать, что культя, как правило, расположена эксцентрично относительно просвета артерии. Поэтому при излишне агрессивном вращении проводника существует вероятность проведения его под интимой. Именно по этой причине необходимо внимательно следить за проекцией проводника, а в случае необходимости изменять ангиографические проекции, используя дополнительные инъекции контрастного вещества для определения реального положения проводника. При несоблюдении этих правил и чрезмерной поступательной активности коронарного проводника можно нарушить целость стенки артерии вплоть до перфорации и возможной тампонады.
В некоторых случаях конусовидная культя может продолжаться в очень тонкий канал (рис. 1.104), что часто обеспечивает контрастирование дистальной части артерии. Подобная особенность повышает успех вмешательства, так как канал способствует правильному направлению проводника в сторону дистальной части окклюзии и более свободной доставке баллона-катетера в окклюзированный сегмент.
Интеркоронарные (мостикообразные) коллатерали
Результаты небольших серий исследования ангиопластики окклюзий подтверждают, что мостикообразные коллатерали (см. рис. 1.103; 1.105) являются наиболее важными детерминантами хронических тотальных окклюзий и снижают вероятность проведения успешных ангиопластик. Однако в недавнем исследовании Kinoshita и соавторов опубликованы практически эквивалентные результаты ангиопластики в 109 тотальных окклюзиях с наличием мостикообразных коллатералей и в 124 окклюзиях без подобных морфологических особенностей (75% в сравнении с 83%, р=0,07). Другие авторы объясняют высокую эффективность реканализации полностью окклюзированных артерий большим опытом врача, который проводит вмешательство, и активным использованием жестких коронарных проводников.
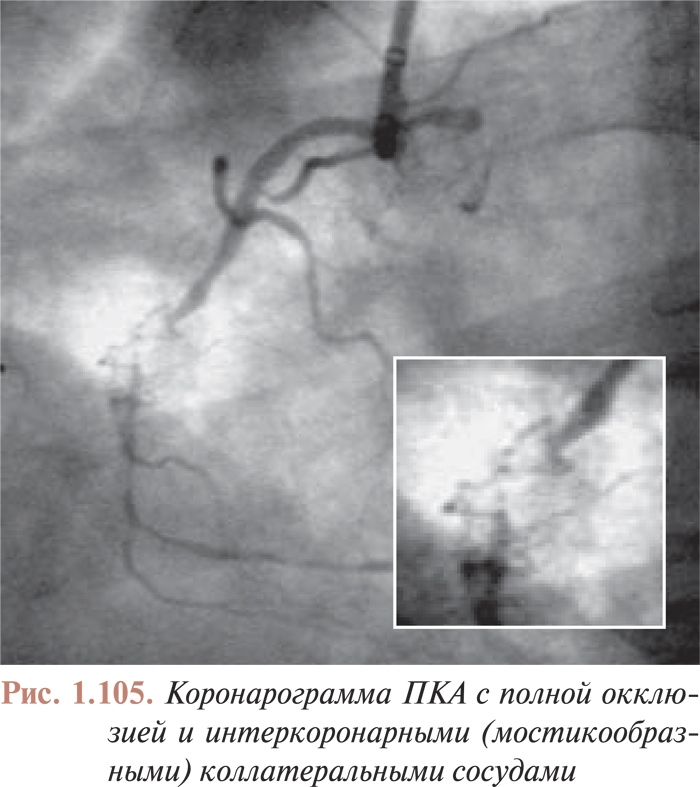
Окклюзии, которые развивались постепенно (о чем свидетельствует выраженный интеркоронарный кровоток в виде мостикообразных коллатералей типа «голова медузы»), редко подвергаются успешной реканализации и мало подходят для проведения коронарной ангиопластики (в среднем эффективность данного вмешательства составляет <20%). Видимые мостикообразные коллатерали — это дилатированные сосуды артерий (vasa vasorum), которые в новых условиях кровоснабжения преобразовались в неоваскулярные каналы с очень хрупкой структурой и малым диаметром.
Другие факторы
Другие факторы, которые обусловливают высокий и низкий уровень реканализации полностью окклюзированных артерий: кальцификация, извитость проксимальной части окклюзированной артерии, дистальная локализация окклюзии, окклюзия правой коронарной артерии или огибающей ветви, ИБС с многососудистым поражением, нестабильная стенокардия.
Осложнения коронарной ангиопластики полностью окклюзированной артерии
Коронарная ангиопластика полной хронической окклюзии, как правило, связана с низким риском вмешательства (но это не значит, что риск не существует вообще!). В нескольких сообщениях определен эквивалентный уровень осложнений в полных окклюзиях и субтотальных стенозах. Более того, наличие полной хронической окклюзии до вмешательства является независимым предиктором острой окклюзии после вмешательства. Частота острой коронарной окклюзии при попытке реканализации хронической окклюзии составляет 5–10%, острого ИМ — 0–2%, экстренного АКШ — 0–3%, смерти — 0–1% (табл. 1.29, 1.30). По данным некоторых исследований 8% успешно дилатированных полных окклюзий (без имплантации коронарных стентов) реокклюзировались в течение 24 ч по сравнению с 1,8% острой окклюзии после ЧТКА субтотальных стенозов. Однако в 87% случаев реокклюзии носили бессимптомный характер (см. табл. 1.29, 1.30). В другом исследовании частота осложнений реканализации полных хронических окклюзий составила 20% у пациентов с нестабильной стенокардией и 2,5% — со стабильной стенокардией. Острые ишемические осложнения коронарной ангиопластики полной хронической окклюзии связаны с диссекцией или тромбозом ранее дилатированного сегмента, с окклюзией боковой ветви или с дистальной эмболизацией. Редкими осложнениями являются перфорация окклюзированной артерии, разрыв или разрушение коронарного проводника или нефропатия в результате передозировки контрастного вещества. Острые окклюзии после успешной реканализации окклюзии могут быть причиной резкой клинической нестабильности в результате возобновления коллатерального кровотока, который прекращается после успешной реканализации и значительно медленнее возобновляется после острой окклюзии.
Таблица 1.29
Ангиопластика полных хронических окклюзий: симптомный статус при отдаленном наблюдении
| Автор исследования (год) | Успешная ангиопластика, случаи | Наблюдения, мес |
Пациенты без симптомов стенокардии, % |
| Berger (1996) | 139 | 6 | 87 |
| Stewart (1993) | 45 | 12 | 68 |
| Ivanhoe (1992) | 264 | 36 | 69 |
| Ruocco (1992) | 160 | 24 | 69 |
| Bell (1991) | 234 | 32 | 76 |
Таблица 1.30
Уровень рестенозов и реокклюзий после реканализации коронарных окклюзий
| Автор исследования (год) | Тип окклюзии | Количество окклюзий, n | Рестеноз, % | Реокклюзия, % |
| Berger (1993) | Полная
Неполная |
193
1295 |
49
42 |
19
7 |
| Kinoshita (1995) | Полная | 433 | 55 | 15 |
| Violaris (1995) | Полная | 266 | 45 | 19 |
| Неполная | 3317 | 34 | 5 | |
| Абсолютная | 109 | 45 | 24 | |
| Функциональная | 157 | 45 | 16 | |
| Ishizaku (1995) | Полная | 62 | 55 | 18 |
| Bell (1995) | Полная | 69 | 59 | 14 |
| Ivanoe (1992) | Полная | 175 | 54 | 16 |
| Anderson (1997) | Полная | 70 | 71 | 34 |
Отдаленные результаты реканализации полной хронической окклюзии
У подавляющего большинства пациентов после успешной ангиопластики полностью окклюзированной коронарной артерии в течение длительного времени отсутствуют симптомы заболевания (см. табл. 1.29). В 3 крупных исследованиях у 76, 69 и 66% пациентов не было симптомов заболевания соответственно в течение 1 года, 2 лет и 4 лет после коронарной ангиопластики. Отсутствие симптомов стенокардии не исключает наличие рестенозов, которые в 40% случаев имеются при отсутствии стенокардии после реканализации полностью окклюзированной артерии (табл. 1.31, 1.32).
Таблица 1.31
ЧТКА неполных и полных хронических коронарных окклюзий: отдаленные результаты
| Автор исследования (год) | Тип окклюзии | Период наблюдения, мес | Смертность, % | ИМ, % | АКШ, % | ЧТКА, % |
| Berger (1996) | Полная
Неполная |
6 | 1,4
0,5 |
2,9
2,4 |
— | — |
| Violaris (1995) | Полная | 6 | 0 | 3,6 | 3,6 | 21 |
| Неполная | 0,2 | 2,8 | 2,4 | 17 | ||
| Ruocco (1992)
|
Полная
Неполная |
2 | 5
9 |
19
15 |
9
20 |
|
| Safian (1988) | Полная
Неполная |
2 | — | — | 14
8 |
— |
Таблица 1.32
Успешная ангиопластика хронической полной окклюзии: отдаленные результаты
| Автор исследования (год) | Результат | Период наблюдения, мес | Смертность, % | ИМ, % | АКШ, % | ЧТКА, % |
| Stewart (1993) | Успех
Неудача |
12 | 2,2
4,1 |
— | 16
45 |
13
16 |
| Ivanhoe (1992) | Успех
Неудача |
4 | — | — | 13
36 |
— |
| Bell (1991) | Успех
Неудача |
5–7 | 18
25 |
11
5 |
18
58 |
— |
| Finci (1990) | Успех
Неудача |
2 | 5
3 |
— | 7
37 |
— |
Функции ЛЖ
Несмотря на то, что данных о функции ЛЖ после эффективной реканализации недостаточно, успешная коронарная ангиопластика улучшает как общую, так и региональную функцию ЛЖ. В одном из исследований у пациентов, которым успешно провели реканализацию с последующей проходимостью в ранее пораженной артерии и нормальным коронарным кровотоком, отмечены лучшая общая ФВ ЛЖ и меньшая дилатация полости ЛЖ по сравнению с пациентами, которым реканализацию не проводили.
В большинстве исследований установлено, что успешная реканализация хронической полной окклюзии уменьшает необходимость в проведении АКШ в 50–75% случаев. Однако коронарная ангиопластика по сравнению с АКШ не имеет ни преимуществ, ни недостатков в отношении выживаемости и развития более поздних ИМ у пациентов этой группы.
Выбор необходимого инструмента для проведения коронарной ангиопластики у пациентов при полной хронической окклюзии
Коронарная ангиопластика полной хронической окклюзии является одним из наиболее сложных вмешательств в интервенционной кардиологии. В сравнении с неполной (функциональной) окклюзией ЧТКА при полной окклюзии является более дорогостоящим вмешательством (что связано с большим количеством необходимых проводниковых катетеров, внутрикоронарных проводников, баллонов и т.д.). Следует отметить, что удлиняется время процедуры и установлены более высокие показатели лучевой нагрузки как для пациента, так и для врача.
Проводниковый катетер
Обязательным условием для выбора проводникового катетера является максимальное сопротивление отталкиванию, что необходимо для прохождения коронарной проволоки, а затем и баллона-катетера через коронарную окклюзию. Для реканализации хронической окклюзии в бассейне левой коронарной артерии наиболее часто используют катетеры типа Voda и Amplatz для левой коронарной артерии, которые обеспечивают их максимально стабильную фиксацию в устье левой коронарной артерии. В бассейне правой коронарной артерии рекомендуется катетер типа Amplatz для левой коронарной артерии и типа Voda — для правой коронарной артерии. Если использовать проводниковый катетер типа Junkins или многофункциональный проводниковый катетер, то мы рекомендуем применять систему глубокой фиксации катетера в устье коронарной артерии для усиления стойкой фиксации верхушки катетера. Размер внутреннего просвета проводникового катетера также определяет жесткость фиксации катетера в устье коронарной артерии. Чем больше диаметр катетера, тем более устойчиво он будет фиксироваться в устье артерии. Компромиссным размером (диаметр — жесткость) является проводниковый катетер 8 F. Однако при использовании проводниковых катетеров размером 8 F и более врач ограничен в продвижении верхушки катетера в просвет коронарной артерии, то есть в применении приема «глубоко фиксированного катетера».
Целью этого приема является создание более жесткой конструкции проводниковый катетер + устье артерии. Этот эффект заключается в более глубоком проникновении дистальной части катетера в устье коронарной артерии и более жесткой фиксации его в просвете (рис. 1.106, А–В). Когда коронарный проводник проведен через пораженный сегмент, при этом баллон, идущий по проводнику, не может пересечь зону поражения (причины: жесткий стеноз, извитой сегмент, полная хроническая окклюзия и др.) (см. рис. 1.106, А), а проводниковый катетер не оказывает достаточной поддержки, возможна тракция баллона-катетера (см. рис. 1.106, Б) в обратном направлении (к проводниковому катетеру) под контролем качественного флюороскопического изображения. Не меняя позиции проводника, одновременно продвигают вперед дистальную часть проводникового катетера (см. рис. 1.106, В). После этой манипуляции верхушку проводникового катетера продвигают несколько вперед и более прочно фиксируют в устье артерии (см. рис. 1.106, Б). После этого необходимо повторить попытку продвижения баллона через зону поражения. Эту методику можно применять при наличии проводникового катетера не более 7 F и боковых перфузионных отверстий в изогнутой части катетера со специальной атравматичной верхушкой. Ствол левой коронарной артерии должен быть достаточно крупным (4 мм и более) и без признаков коронарного атеросклероза (сужение, видимый кальциноз).
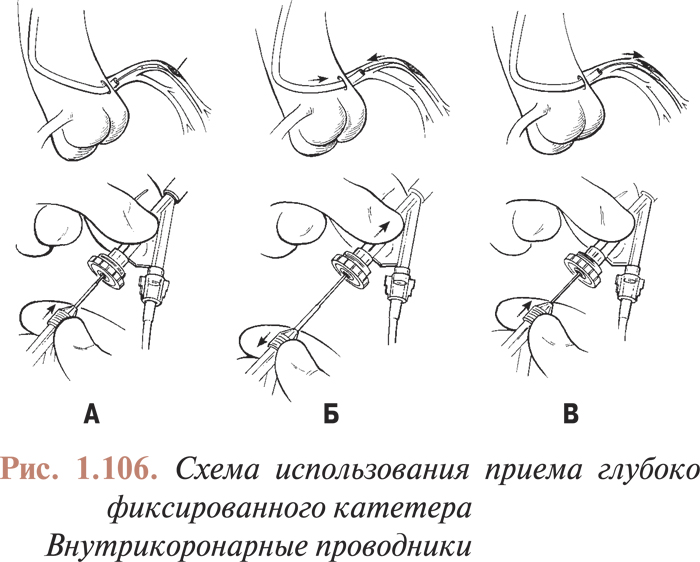
Внутрикоронарные проводники
Серии проводников типа floppy, стандартные и проводники с промежуточными свойствами — наиболее популярные устройства для прохождения хронических полных окклюзий, но некоторые врачи предпочитают использовать жесткие проводники или проводники типа gliadewire (с особым скользящим покрытием).
Мягкие (floppy) коронарные проводники успешно проходят через окклюзию в 30–50% случаев при «возрасте» окклюзии не более 6 мес. Жесткие коронарные проволоки повышают эффективность вмешательства еще на 25%, однако эти дополнительные 25% окклюзированных артерий не могли быть реканализированы с помощью каких-либо других коронарных проводников. Безусловно, для реканализации можно выбрать коронарные проводники размером 0,014 дюйма, однако чаще используют проволоку размером 0,016 или 0,018 дюйма в целях повышения их проходимости. В очень редких случаях используют проводники размером 0,035–0,038 дюйма для прохождения полной окклюзии. Однако мы не рекомендуем использовать проводники размером >0,021 дюйма для прохождения окклюзированного сегмента для предотвращения субинтимального повреждения окклюзированной артерии и перфорации сосуда.
Если при проведении контрольной коронарографии можно визуализировать постокклюзионное заполнение коронарной артерии (при наличии адекватного коллатерального кровотока), то целесообразно использовать стоп-кадр контрольной коронарографии (freeze-frame, подобная возможность существует во всех современных дигитальных ангиографических системах) для того, чтобы определить направление продвижения коронарной проволоки через окклюзию. Дополнительная проходимость коронарной проволоки может быть достигнута при помощи баллона-катетера или специального транспортного катетера (probing catheter, «катетер без баллона», «коронарный буж»), который располагают на 1–2 см позади верхушки коронарного проводника. Если хотя бы один раз удается пройти коронарным проводником через зону окклюзии и подтвердить это прохождение, то нельзя изменять позицию проволоки до проведения ангиопластики (иначе вторая попытка успешного прохождения проволоки может не повториться!). Основными признаками успешного проведения коронарной проволоки через окклюзированный сегмент являются свободная ротация верхушки проводника (видимая на флюороскопическом изображении) и возможность беспрепятственной тракции коронарного проводника в направлении вперед — назад. Наиболее четким подтверждением интралюминального расположения дистальной части коронарного проводника в артерии являются инъекции контрастного вещества через устье основной артерии или просвет транспортного катетера (probing catheter). Возможными признаками неправильной установки коронарного проводника (паравазальная позиция) могут быть отсутствие свободной ротации дистальной части проводника и беспрепятственного движения проводников вперед — назад, невозможность прохождения баллона-катетера через окклюзированный сегмент. Если перечисленные особенности определяются в процессе вмешательства, то коронарный проводник расположен в субинтимальном пространстве или в одной из небольших мостикообразных коллатералей. В этом случае баллонная ангиопластика вне окклюзированного сегмента может привести к развитию коронарных осложнений.
Gliadewire (производитель «Mansfield/Sci-Med») — это коронарный проводник, который был успешно использован при периферических ангиопластиках и установке стентов, а теперь и в кардиологии. Особенностью данного проводника является то, что он изготовлен из титаноникелевого сплава (нитинола) и имеет гидрофильное полиуритановое покрытие, которое придает данному проводнику высокую гибкость и проходимость через очень извитые и окклюзированные сегменты, а также высокую сопротивляемость к излому и деформации. Трехсантиметровая верхушка данного проводника очень мягкая и гибкая, что способствует атравматичному прохождению проволоки в малодоступные сегменты коронарного русла. Небольшие серии исследований подтверждают тот факт, что Gliadewire может быть успешно использована в 36–60% случаев окклюзий, где применение стандартных внутрикоронарных проводников было неэффективным (табл. 1.33).
Размеры проволоки Gliadewire — от 0,016 до 0,025 дюйма. Недостатками данной проволоки являются недостаточная визуализация в коронарном русле и невозможность изменить форму в дистальной части проводника.
Таблица 1.33
Результаты использования различных проводников для реканализации окклюзий
| Автор исследования (год) | Количество окклюзий, n | Эффективность устройства, % | Окончательная эффективность, % | Комментарий |
| Gliadewire | ||||
| Freed (1993) | 59 | 54 | 39 | Нет перфораций |
| Rees (1991) | 33 | 58 | 52 | 52% диссекций, которые не ограничивают кровоток |
| Hosney (1990) | 8 | — | 88 | Проволоки типа gliadewires размером 0,025» и 0,035» |
| Magnum Wire (MW) | ||||
| Pande (1992) | 28 | 45 | 39 | Эффективность реканализации MW после неудачной ЧТКА составляет 39%, эффективность реканализации после неудачной MW — 12% |
| Haerer (1991) | 102 | 32 | 32 | — |
| Lasewire | ||||
| Serruys (1996) | 252 | 58 | — | Коронарная перфорация (21%); тампонада сердца (0,8%); ИМ без зубца Q (1,6%) |
| Ultrasound Wire | ||||
| Rees (1995) | 18 | 89 | 78 | — |
| ROTACS | ||||
| Danchin (1995) | 50 | — | 66 | — |
| Kaltenbach (1991) | 152 | — | 65 | Диссекция ствола ЛКА (1,5%); без смерти или перфорации; рестеноз (54%) |
Проводник для реканализации Magnum — Meier
Особенностью проводниковой системы Magnum — Meier является расположенная на верхушке проводника олива, которая препятствует перфорации коронарных артерий, а жесткость дистальной части проводника обеспечивает хорошую проходимость проволоки через окклюзию, размеры данного устройства колеблются от 0,014 до 0,021 дюйма. Для повышения эффективности реканализации с помощью этого коронарного проводника производитель (фирма «Schneider/SciMed») изготовил специальный баллон Magnum — Meier (Monorail u over-the-wire), адаптированный к проволоке размером 0,021 дюйма. Результаты рандомизированных исследований эффективности реканализации подобной системы варьируют: в одном исследовании получены более высокие результаты, чем при использовании обычного коронарного проводника. В другом исследовании не выявлены особые преимущества проводника Magnum — Meier при реканализации окклюзированных артерий.
Баллон-катетер
Основными качествами баллонов-катетеров, используемых для реканализации полных хронических окклюзий после прохождения коронарного проводника, являются: низкопрофильность, высокая степень проходимости (как правило, эти баллоны обрабатывают специальным скользящим биопокрытием, которое способствует лучшей проходимости через окклюзии и субтотальные стенозы). Средняя и проксимальная части баллона-катетера должны быть достаточно жесткими, чтобы максимально эффективно передавать давление к дистальной части проводника для прохождения резко суженного или окклюзированного сегмента. Наиболее эффективным способом прохождения баллона через окклюзию является постоянное давление в направлении окклюзии. Это более эффективно, чем периодическое «постукивание» (чередование поступательных движений вперед — назад) баллоном в области окклюзированного сегмента.
Если баллон адекватного размера невозможно провести через окклюзию, то его можно заменить баллоном меньшего диаметра для предилатации (2,5–2,0 мм в диаметре), после чего использовать баллон адекватного размера для завершения процесса ангиопластики.
Если существует возможность провести измерение диаметра близлежащего непораженного сегмента коронарной артерии и определить предполагаемый диаметр окклюзированного сегмента, то необходимо использовать баллон с размером предполагаемого диаметра окклюзии в соотношении 1:1. При наличии выраженного кальциноза окклюзированного сегмента рационально использовать баллоны-катетеры высокого давления с низкой податливостью, которые значительно меньше изменяют форму в зависимости от давления и сохраняют диаметр баллона на фоне высокого давления (до 16 атм.).
Дополнительная тромболитическая терапия
С патофизиологической точки зрения в «свежих» полных окклюзиях можно выявить небольшие очаги тромбообразования в наиболее «свежей» части окклюзии. Следовательно, можно использовать тромболитические препараты для проведения коронарного тромболизиса с целью лизирования незначительных тромботических масс в месте окклюзии. Существует данные небольших исследований, в которых больным назначали различные тромболитические препараты и инфузионные режимы и проводили пролонгированный коронарный тромболизис для повышения эффективности реканализации практически полностью окклюзированной артерии. Среди 56 окклюзий (комбинированные данные 3 исследований) постлитическая (частичная) реканализация кровотока в коронарной артерии, а впоследствии и ангиопластика была эффективной в 63–73% случаев (табл. 1.34).
Таблица 1.34
Интеркоронарный тромболизис окклюзии, резистентной к прохождению внутрикоронарного проводника
| Автор исследования (год) | Количество пациентов | Тромболитик, режим введения | Результат | Комментарий |
| Ajluni (1995) | 25 | Урокиназа (100 000–240 000 ЕД/ч в течение 8–25 ч) через инфузионную проволоку + проводниковый катетер | Увеличение коронарного кровотока (28%); успех ЧТКА (52%) | ИМ (8%); выраженное кровотечение (8%); срок госпитализации — 5,1 дня |
| Kaplan (1995) | 60 | Урокиназа (в течение 8 ч) через инфузионную проволоку + проводниковый катетер | Успех ЧТКА 52–56% для всех доз | Больше осложнений при использовании тромболитика в высоких дозах |
| Cecena (1993) | 20 | Урокиназа болюсно 120 000 U–200 000 ЕД/ч в течение 24 ч через инфузионную проволоку + проводниковый катетер | Увеличение коронарного кровотока на 90%; эффективность ЧТКА — 94% | Нет ИМ, экстренного АКШ, переливание крови в 10% случаев |
| Vaska (1991) | 11 | tPA (5–10 мг/ч в течение 6 ч) через инфузионную проволоку | Увеличение коронарного кровотока на 91%; эффективность ЧТКА — 82% | Без смерти, ИМ или экстренного АКШ, острая окклюзия в 10% случаев |
Таким образом, успешная реканализация полной хронической коронарной окклюзии, с одной стороны, приводит к улучшению симптоматического статуса, повышению толерантности к физической нагрузке и уменьшению необходимости проведения АКШ впоследствии на 50%, а с другой — связана с относительно низкой эффективностью вмешательства и высокой стоимостью инструментария. Однако отдаленные результаты вмешательства зачастую обусловлены развитием реокклюзий и стенозов, которые в большинстве случаев протекают бессимптомно. Следует отметить, что частота осложнений при реканализации окклюзий невысока, эффективность вмешательства колеблется от 20 до 80% в зависимости от опыта врачей и используемой техники.
Перкутанные коронарные вмешательства при наличии изгибов в русле коронарных артерий, поражениях устья, кальцинированных поражениях, длинных поражениях
Ангиопластика в извитых артериях и атеросклеротические поражения, расположенные на изгибах артерий
Нет единого определения артерии с проксимальной извитостью, которое бы свидетельствовало о всех возможных осложнениях и проблемах лечения бляшки в этом сегменте. Однако у различных исследователей для описания особенностей данного поражения существуют сходные определения. Артерия с проксимальной извитостью — это сосуд с 2 изгибами или более (>75°) проксимальнее стеноза, которой предполагается дилатировать, и с не менее одним проксимальным изгибом более 90% (рис. 1.107). Стеноз, расположенный на изгибе артерии, представлен на рис. 1.108а, б. Один из вариантов определения извитых проксимальных сегментов связан с наличием значительного изгиба артерии проксимальнее стеноза, который предполагается дилатировать. Устранение стенозов, расположенных в дистальной части извитого сегмента, является одной из немногих особенностей коронарной ангиопластики, связанной с анатомией сосуда, а не с патологическим процессом в его стенке. Другими словами, извитой проксимальный сегмент не является патологической структурой сосудистого русла, однако может значительно осложнить проведение ангиопластики, а в некоторых случаях сделать эту процедуру невозможной.
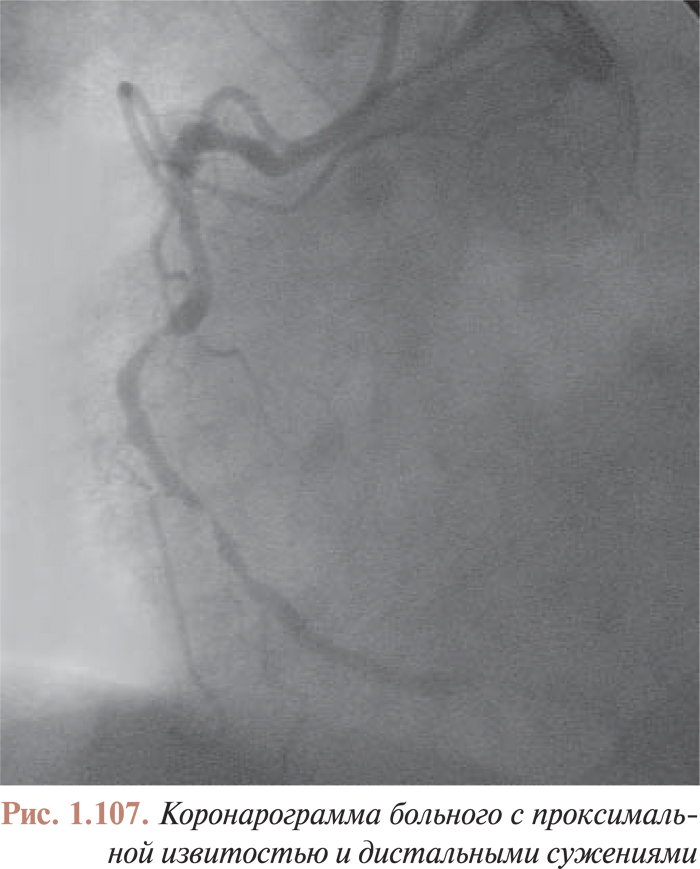
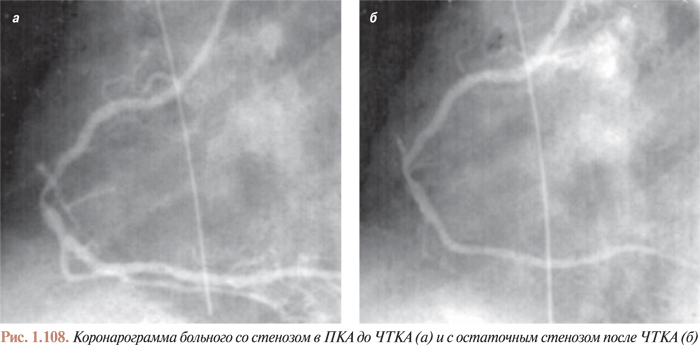
При наличии подобных анатомических особенностей прежде всего возникают трудности при проведении коронарного проводника через извитой сегмент. При наличии субтотального стеноза дистальнее извитого сегмента вероятность адекватного прохождения коронарного проводника резко снижается. Еще одной проблемой, связанной с извитым проксимальным сегментом, является неадекватная установка проводникового катетера. В некоторых случаях невозможно использовать проводниковый катетер стандартной кривизны для адекватной фиксации его в устье коронарной артерии при прохождении проводника через извитой сегмент. В подобных ситуациях показано применение проводниковых катетеров с выраженным «сопротивлением отталкиванию» (Extra Backup Support).
В сложных случаях, когда катетеризация артерии с проксимальной извитостью сочетается с кальцинозом сосуда и тяжелым состоянием пациента, многократные попытки провести внутрикоронарный проводник через извитой сегмент, а затем через патологическое сужение в артерии могут закончиться возникновением осложнений (табл. 1.35).
Таблица 1.35
Влияние проксимальной извитости артерии на результаты коронарной ангиопластики дистально расположенного стеноза
| Автор исследования (год) | Количество пациентов, n | Характеристика | Эффективность, % | Осложнения | |
| Вид | % | ||||
| Tan (1995) | 965 | Нет проксимальной извитости | 93 | Острая окклюзия | 3 |
| 142 | Умеренная извитость | 93 | 4,3 | ||
| 50 | Сильная извитость | 84 | 6 | ||
| Ellis (1990) | 189 | Стеноз типа А | 92 | Острые осложнения | 2 |
| 65 | Проксимальная извитость | 72 | 15 | ||
| Grossman (1988) | 53 | Использование катетера с кривизной Shepherd Crook | 98 | Трудности прохождения проводника через поражение | 13 |
| 51 | Катетер с кривизной Shepherd Crook не использовали | 86 | 33 | ||
При анализе данной таблицы необходимо учитывать, что разные исследователи по-разному определяли степень извитости тех или иных проксимальных сегментов. Однако все 3 автора в исследовании с участием пациентов различных групп убедительно доказали, что чем более извит проксимальный сегмент, тем ниже успех коронарной ангиопластики и тем больше острых коронарных осложнений возникает при проведении вмешательства, наиболее тяжелым из которых является острая окклюзия. Вероятность возникновения окклюзии повышается более чем в 2 раза при наличии извитого проксимального сегмента перед патологически суженым сегментом коронарной артерии.
В большинстве случаев удается пройти коронарным проводником через извитой проксимальный сегмент, а затем провести проводник через зону стеноза в дистальную часть артерии. Однако серьезную проблему может представлять доставка баллона-катетера (или другого устройства) для проведения коронарной ангиопластики. Современные баллоны для коронарной ангиопластики обладают достаточной гибкостью и высокой проходимостью через просвет извитых артерий. В последние время многие производители инструментов для эндоваскулярных вмешательств используют специальное «скользящее» покрытие, которое нанесено на поверхность упакованного баллона (иногда и остальной части катетера). Подобное покрытие способствует значительному снижению трения баллона о стенки извитой артерии и приводит к повышению проходимости баллона через извитые артерии и субтотальные стенозы. Однако необходимо отметить, что в некоторых случаях врачи пытаются использовать такие менее гибкие устройства, как атеротомы, лазерные проволоки и др., которые в меньшей степени обладают гибкостью и проходимостью в подобных случаях. Наиболее адаптированным в этой сложной ситуации является роптаблатор. Активированный бур значительно снижает фрикционное сопротивление устройства при прохождении извитого сегмента и позволяет преодолевать умеренно и даже значительно извитые сегменты коронарной артерии.
Особая проблема, требующая своего решения, это доставка коронарных стентов в пораженные сегменты, расположенные дистальнее извитых участков артерий. Если баллонная ангиопластика может быть успешно проведена с использованием современных низкопрофильных баллонов со специальным скользящим покрытием, то использование фиксированных на баллонах стентов, как правило, сочетается с проблемой прохождения системой баллон + стент через извитые сегменты артерии к месту имплантации. Тубулярные стенты, обладая высокой радиальной резистентностью и относительно низким профилем, иногда осложняют процесс стентирования в связи с недостаточной гибкостью после установки на баллон. Следует отметить, что проволочные стенты обладают большей гибкостью при доставке через извитые сегменты. Однако конструкция проволочных стентов не предполагает выраженной радиальной резистентности после имплантации, а следовательно, их реже устанавливают в жестких и субтотальных стенозах с признаками кальциноза (возможно наличие остаточного стеноза, а впоследствии — тромбоза, обусловленного высоким радиальным сопротивлением кальцинированных стенозов).
Технические особенности и подбор необходимых инструментов для проведения ангиопластики при наличии извитого проксимального сегмента в коронарной артерии
Для успешного проведения ангиопластики в артерии с проксимальной извитостью необходимо подобрать все элементы системы для ангиопластики в соответствии с анатомическими особенностями данной артерии. Прежде всего необходимо правильно выбрать и адекватно установить проводниковый катетер в устье коронарной артерии. Основной особенностью проводникового катетера является стабильная фиксация верхушки проводникового катетера в устье. Наиболее оптимальная позиция — это коаксиальное расположение катетера относительно устья коронарной артерии, то есть угол между устьем артерии и верхушкой катетера должен составлять 180°. Следующей особенностью является способность верхушки катетера к вращению. Это свойство особенно необходимо при глубокой фиксации катетера в устье коронарной артерии. Мягкая верхушка катетера также играет важную роль при адекватной установке проводникового катетера в устье коронарной артерии. В некоторых случаях именно адекватное вращение проводникового катетера (при наличии атравматичной верхушки) может сыграть решающую роль при катетеризации устья или прохождении коронарного проводника через извитой сегмент коронарной артерии. Обязательным условием успешного вмешательства является проводниковый катетер с выраженным «сопротивлением отталкиванию» (Extra Backup Support). Эта особенность проводникового катетера может определить успех вмешательства и, как правило, зависит от формы проводникового катетера и соответствия его размера дуге аорты.
При выборе внутрикоронарного проводника необходимо учитывать его свойства. Существуют принципиальные особенности, связанные с физическими свойствами коронарных проводников и их влиянием на результативность вмешательства. С одной стороны, проводники размером 0,018 дюйма и более обладают великолепной проходимостью через извитые артерии, гибкостью, управляемостью и выраженным «сопротивлением отталкиванию». С другой стороны, низкопрофильные баллоны-катетеры, которые используют при дилатации стенозов дистальной части извитых сегментов, адаптированы под коронарные проводники размером 0,014 дюйма. Таким образом, необходим компромисс при использовании проволоки размером 0,014 дюйма с высокими показателями управляемости, гибкости и выраженным «сопротивлением отталкиванию». Жесткость коронарной проволоки, необходимая для прохождения извитого сегмента, определяется длиной извитого сегмента и количеством изгибов. Чем больше изгибов и чем более продолжительный извитой сегмент коронарной артерии, тем более жесткий проводник рационально использовать. Это связано с тем, что мягкий коронарный проводник теряет свойства проходимости пропорционально количеству извитых сегментов (это свойство определяет длинный мягкий сегмент дистальной части проводника). В том случае, если сегмент артерии имеет один (даже очень извитой) изгиб, рационально использовать мягкий коронарный проводник. При наличии нескольких изгибов и продолжительного извитого сегмента лучше применять жесткий или полужесткий проводник с коротким мягким сегментом, который повысит его проходимость при наличии нескольких изгибов коронарной артерий. После прохождения мягкой части проводника в дистальный сегмент коронарной артерии жесткая часть проводника позволит несколько изменить кривизну коронарной артерии, что в будущем может упростить прохождение баллона-катетера через извитой сегмент коронарной артерии.
Современные баллоны-катетеры изготавливают с учетом возможности использования их при прохождении извитых сегментов артерий. Практически все баллоны-катетеры в своих характеристиках определяются как устройства с высокой степенью гибкости и проходимости через извитые и субтотально суженные коронарные артерии. Однако в клинической практике это бывает далеко не всегда, что связано с тем, что профиль, проходимость и гибкость коронарных баллонов определяют in vitro. Наиболее рационально использовать баллоны системы «Monorail system». Этот выбор связан с меньшим трением в системе баллон + коронарный проводник, возможностью быстрой замены баллона-катетера и удобством использования этой системы одним врачом.
У больных с патологией периферических артерий рациональнее использовать длинные интрадюсоры (30 см), чтобы максимально выпрямить возможные извитые участки подвздошного сегмента, тем самым упростив вращение катетера и усилив «сопротивление отталкиванию» проводникового катетера. Как правило, в подобных ситуациях выбирают размер проводникового катетера 8 F, так как катетеры 6 и 7 F в меньшей степени оказывают «сопротивление отталкиванию» при проведении вмешательства.
Ангиопластика кальцинированных атеросклеротических поражений
В некоторых клинических ситуациях кальцинированные стенозы коронарных артерий (рис. 1.109) могут быть серьезным препятствием к проведению коронарной ангиопластики. Прежде всего видимый без введения контрастного вещества кальциноз в паравазальной области вблизи атеросклеротической бляшки свидетельствует о том, что стеноз имеет более жесткую структуру. Следовательно, любые воздействия давлением (ЧТКА или стентирование) на данный стеноз могут привести к деструкции стеноза в момент вмешательства. Иными словами, при ангиопластике кальцинированных сужений высок риск возникновения сложной диссекции, что усугубляется тем, что для адекватной дилатации стенозов необходимо использовать более высокое давление в баллоне по сравнению со стенозами без признаков кальциноза. Более высокое давление баллона для дилатации стеноза при наличии кальциноза может привести к стойкой глубокой диссекции артерии, а затем и острому тромбозу дилатированного сегмента. Именно поэтому в одной из первых рекомендаций ACC/AHA, опубликованной в 1988 г., отмечено: «Стеноз типа В (это кальцинированный стеноз от умеренного до тяжелого) рассматривается как поражение высокого процедурального риска острой окклюзии».
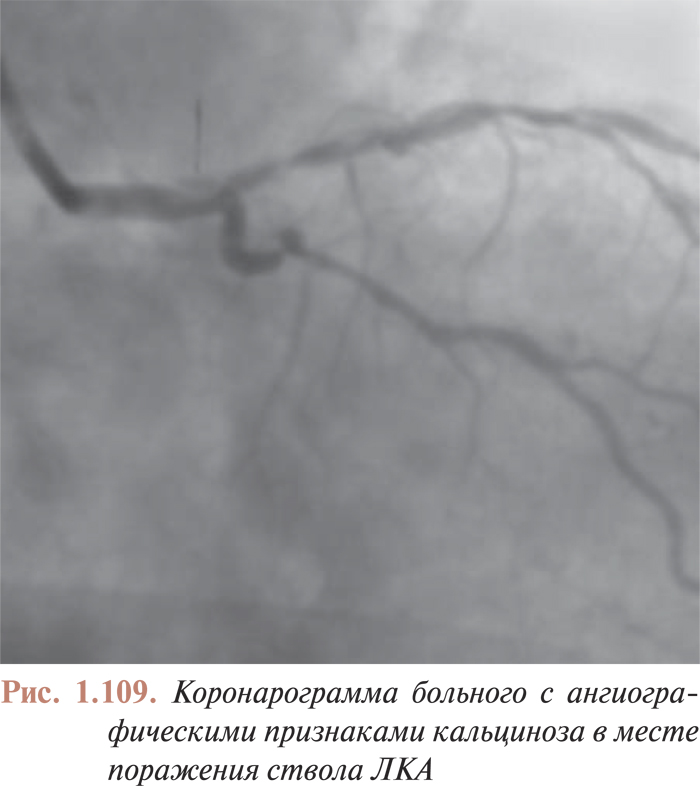
Наиболее доступный метод определения кальцинированных атеросклеротически бляшек коронарных артерий — это коронарография. Однако с помощью этого метода можно выявить только часть кальцинированных бляшек. Оптимальным способом для морфологического анализа атеросклеротической бляшки является интракоронарное УЗИ (IVUS). Именно этот способ позволяет реально оценить глубину, распространенность кальцификации коронарной артерии и подтвердить чувствительность и специфичность коронарографии в определении кальциноза в стенке артерии. Некоторые исследователи приводят данные о том, что после интракоронарного УЗИ, которое позволяет определить распространенность и глубину кальциноза бляшки, у 40% пациентов был изменен план проведения вмешательства.
Ближайшие результаты ангиопластики в кальцинированных стенозах различны. Некоторые авторы считают, что наличие кальция в бляшке снижает успех вмешательства и приводит к развитию выраженных побочных эффектов коронарной ангиопластики. Другие исследователи высказывают мнение о том, что наличие кальциноза не влияет на результат вмешательства (табл. 1.36). Еще одна группа исследователей расценивает кальцинированные стенозы как независимый предиктор выраженных резидуальных стенозов после ангиопластики (исследовали 3679 дилатированных поражений). Одно можно сказать определенно: механизм субоптимальных ангиографических результатов коронарной ангиопластики кальцинированных стенозов включает 2 составные части: невозможность безопасного надрыва стенки артерии для увеличения диаметра сосуда и эластическая возвратная тяга непораженной стенки артерии после коронарной ангиопластики.
Таблица 1.36
Влияние кальцинированных стенозов на эффективность коронарной ангиопластики
| Автор исследования (год) | Морфология стеноза | Количество стенозов, n | Эффективность, % |
| Tan (1995) | Кальцинированный | 81 | 74 |
| Некальцинированный | 1076 | 94 | |
| Myler (1995) | Кальцинированный | 140 | 92 |
| Некальцинированный | 639 | 95 |
Некоторые авторы определяют корреляцию между кальцинированными стенозами и развитием ИМ в момент вмешательства, экстренным АКШ и смертью, другие не выявляют подобных изменений (табл. 1.37 ).
Таблица 1.37
Влияние кальцинированного стеноза на ишемические осложнения коронарной ангиопластики
| Автор исследования (год) | Морфология стеноза | Количество стенозов, n | Осложнения, % | Комментарий |
| Tan (1995) | Кальциноз | 81 | 14 | — |
| Отсутствие кальциноза | 1076 | 2,5 | — | |
| Danchin (1994) | Смерть/ИМ/АКШ | |||
| Кальциноз | 285 | 0,8/3,5/0 | — | |
| Отсутствие кальциноза | 1801 | 0,7/3/1 | — | |
| Hermans (1993) | Кальциноз | 69 | Кальциноз стеноза не определен как предиктор серьезных осложнений | |
| Myler (1992) | Кальциноз | 140 | 3,6 | — |
| Отсутствие кальциноза | 639 | 1,3 | — | |
| Ellis (1990) | Кальциноз | 46 | — | — |
Внутрисосудистое УЗИ дает возможность объективно определить роль отложения кальция в атеросклеротической бляшке в возникновении ишемических осложнений в момент проведения коронарной ангиопластики пораженного сегмента. В одном из исследований оценивали результат коронарной и периферической ангиопластики бляшек с наличием кальциноза и без него. По результатам исследования установлено, что глубокие и опасные диссекции отмечали значительно чаще среди кальцинированных стенозов. Существует предположение, что диссекция бляшки возникает первоначально в промежутке между кальцинированной и некальцинированной частью атеросклеротической бляшки. Возможно, этот процесс связан с распределением силы расширяемого баллона между этими 2 частями пораженного сегмента. Некоторые исследователи приводят данные о кальцинированных стенозах и различных способах их устранения. При использовании устройства, которое не оказывает выраженного давления на стенку артерии — ротаблатора, диссекции стенки артерии выявляют в 22%, а при обычной ангиопластике — в 77% случаев.
Технические особенности ангиопластики при кальцинозе пораженного сегмента
При баллонной ангиопластике кальцинированного стеноза, как правило, необходимо высокое давление в баллоне для того, чтобы провести адекватную дилатацию пораженного сегмента. Именно тот факт, что давление в баллоне для проведения оптимальной ангиопластики выше обычного, объясняет большую травму сосуда в месте раздувания. Следовательно, повышается риск диссекции артерии и возникновения острого тромбоза. Один из исследователей приводит данные о том, что 89% кальцинированных стенозов были успешно дилатированы давлением ниже 10 атм. При более выраженном кальцинозе необходимо повысить давление выше 12 атм. и чаще использовать дополнительные коронарные проводники, которые устанавливают в пространстве между баллоном и стенкой артерии, что способствует более щадящему распространению давления на кальцинированную бляшку. Поэтому в реальной клинической практике целесообразно использовать обычное (6–8 атм.) давление в баллоне-катетере для проведения первой ангиопластики кальцинированного стеноза. В большинстве случаев этого давления достаточно для проведения адекватной ангиопластики. Подобная методика позволяет избежать развития большинства осложнений, связанных с высоким давлением в баллоне, что необходимо для дилатации кальцинированного стеноза. Если первой дилатации обычного давления недостаточно, через несколько минут необходимо провести ЧТКА баллоном высокого давления (баллон «с низкой податливостью») и давления выше номинального, что позволит успешно завершить коронарную ангиопластику кальцинированного стеноза. Если диссекция кальцинированного стеноза возникает, то для адекватного завершения вмешательства необходимо использовать внутрикоронарный стент.
Ангиопластика поражений устья коронарных артерий
ЧТКА устья коронарной артерии можно рассматривать как ангиопластику стеноза, расположенного в месте образования артерии (аортокоронарное соустье) или ее ветви (устье боковой ветви) (рис. 1.110а, б). Например, первая диагональная ветвь, отходящая от передней межжелудочковой ветви левой коронарной артерии и имеющая стеноз в месте отхождения — стеноз устья первой диагональной ветви. Стенозом устья можно также назвать стеноз места образования правой коронарной артерии в синусе аорты (ствол левой коронарной артерии рассматривается в отдельной клинической группе).
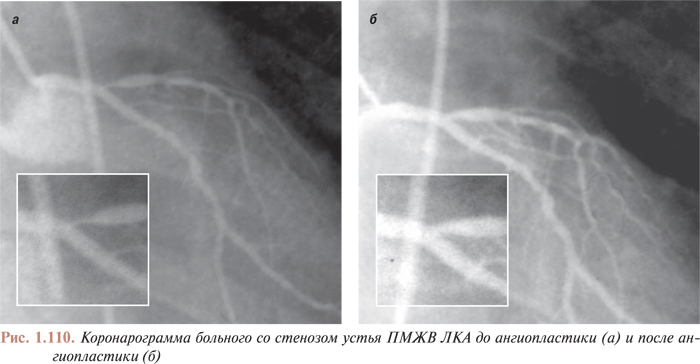
Устранение стенозов устья коронарных артерий — специфическая проблема в интервенционной кардиологии. Основная особенность ЧТКА в устье артерии связана с субоптимальным ангиографическим результатом, который, как правило, зависит от ригидности и эластичной тяги этих сегментов коронарного русла. Для устранения подобных явлений исследователи используют агрессивные подходы в целях увеличения просвета коронарной артерии, что часто приводит к усилению стретчинга, образованию диссекции и высокой частоте развития рестенозов после ангиопластики устья коронарных артерий. Таким образом, чем крупнее сосуд, в котором выявлено атеросклеротическое поражение устья, тем сложнее достичь оптимальных результатов ЧТКА и тем серьезнее могут быть осложнения, связанные с диссекцией устья. Именно поэтому стеноз в устье правой коронарной артерии является наиболее сложным вариантом поражения в устье. По результатам ранних исследований установлено, что коронарная ангиопластика в устье правой коронарной артерии была эффективной в 79% случаев, а необходимость проведения экстренного АКШ возникала в 9% случаев. Эти результаты объяснялись неадекватным использованием проводниковых катетеров, коронарных проводников, большим количеством ригидных поражений и частым стретчингом в устье правой коронарной артерии. Кроме того, негативное влияние на результаты оказывала диссекция, которая возникала в результате использования баллона высокого давления в месте устья правой коронарной артерии.
В настоящее время эффективность вмешательства значительно возросла, а частота осложнений снизилась (табл. 1.38). Улучшение немедленных результатов лечения связано с развитием новых технологий (стенты, коронарные проводники, проводниковые катетеры) и накоплением опыта проведения подобных вмешательств.
Таблица 1.38
Коронарная ангиопластика устья коронарной артерии: немедленные результаты
| Автор исследования (год) | Поражение | n | Эффективность, % | Осложнения, % Смерть/Q-ИМ/АКШ |
Другие особенности |
| Tan (1995) | Устье не поражено | 1080 | 93 | — | Острая окклюзия — 0% |
| Устье ПКА + устье боковой ветви | 77 | 94 | — | Острая окклюзия — 3,5% | |
| Tan (1994) | Устье не поражено | 48 | 90 | 6 | Резидуальный стеноз, количество раздуваний баллона и давление раздувания выше при дилатации устья ПКА |
| Устье ПКА | 34 | 85 | 6 | ||
| Устье боковой ветви | 116 | 87 | 7 | ||
| Boehrer (CAVEAT; 1995) | ПМЖВ | 33 | 87 | 0/0/3 | Рестеноз — 46% |
| Sawada (1994) | ПМЖВ/ОВ | 80 | 90 | Рестеноз — 61%
Повторная реваскуляризация — 58% |
|
| Brown (1993) | Устье ПМЖВ | 40 | 100 | 0/-/0 | — |
| Устье ПМЖВ не поражено | 40 | 98 | 0/-/0 | ||
| Myler (1992) | Устье ПКА + устье боковой ветви | 14 | 93 | 0 | — |
| Bedotto (1991) | Устье ПКА | 60 | 85 | 0 | — |
| Mathias (1991) | Устье боковой ветви | 106 | 74 | 13 | — |
| Topol (1987) | Устье ПКА | 53 | 79 | 9,4 | — |
Следующей по важности особенностью коронарной ангиопластики в устье коронарной артерии является остаточный стеноз. Некоторые исследователи, которые оценивали результат ангиопластики в устьях артерий при помощи количественной ангиографии, определяли размер резидуальных стенозов в месте лечения от 40 до 50% просвета артерии в сравнении с 25–35% при стенозах в стандартных сегментах (без поражения устья) коронарных артерий. Кроме того, стретчинг после вмешательства изменял окончательный результат коронарной ангиопластики, вновь суживая просвет артерии до 50%, причем эластичная обратная тяга в устье артерии часто проявлялась при отсутствии типичных характеристик, обеспечивающих подобный эффект в других сегментах: кальцификация, эксцентрическая морфология стеноза и др. При этом, как правило, не возникали острые ишемические осложнения, но данный результат мог повлиять на более высокую частоту рестенозов в ближайшее время и необходимость повторения коронарной ангиопластики стеноза.
Технические особенности проведения коронарной ангиопластики стенозов устья коронарных артерий
Проводниковые катетеры. Чаще всего устье правой коронарной артерии достаточно успешно катетеризируют при помощи катетеров типа Judkins Right и Amplatz Right или Hockey Stick — для левой коронарной артерии. Для устья левой коронарной артерии, огибающей ветви, боковых ветвей и других основных артерий в системе левой коронарной артерии, как правило, используют проводниковый катетер типа Judkins Left, а иногда и другие формы катетеров, обеспечивающие лучшее «сопротивление отталкиванию» при прохождении коронарного проводника через стенозы в устье (Voda, Extra Backup Support и др.). Если катетер при фиксации в устье артерии резко уменьшает или прекращает адекватный коронарный кровоток, необходимо использовать проводниковые катетеры с боковыми отверстиями, которые обеспечивают доступ крови (дополнительная перфузия) через проводниковый катетер во время вмешательства. Устанавливать проводниковый катетер рекомендуется максимально коаксиально, то есть устье коронарной артерии должно быть продолжением верхушки проводникового катетера. В этом случае врач подвергает минимальному повреждающему воздействию устье коронарной артерии и получает возможность более свободно манипулировать проводниковым катетером в пределах устья коронарной артерии. При ангиопластике устья правой коронарной артерии целесообразно сместить верхушку проводникового катетера (рис. 1.111а, б) перед раздуванием баллона. «Мягкое» раздувание баллона-катетера (1–2 атм) может помочь врачу зафиксировать баллон в устье и одновременно провести тракцию проводникового катетера (см. рис. 1.111б). Баллон не следует полностью раздувать, если часть его еще находится в верхушке проводникового катетера. В некоторых случаях при наличии признаков кальциноза в устье правой коронарной артерии и проведении коронарной ангиопластики стеноза в устье проявляется эффект «арбузного семечка», который заключается в проксимальной или дистальной миграции баллона-катетера во время его раздувания (рис. 1.112а, б). Эта проблема менее существенна в том случае, если используют длинный баллон (30–40 мм) с низкой степенью податливости.
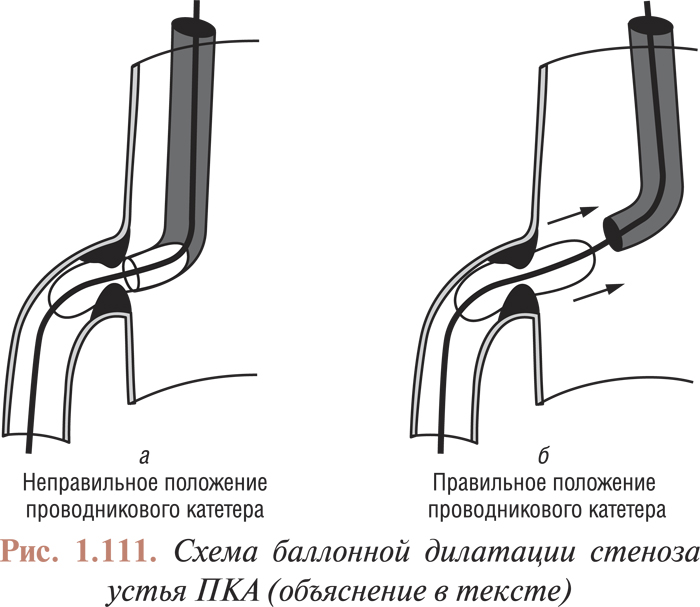
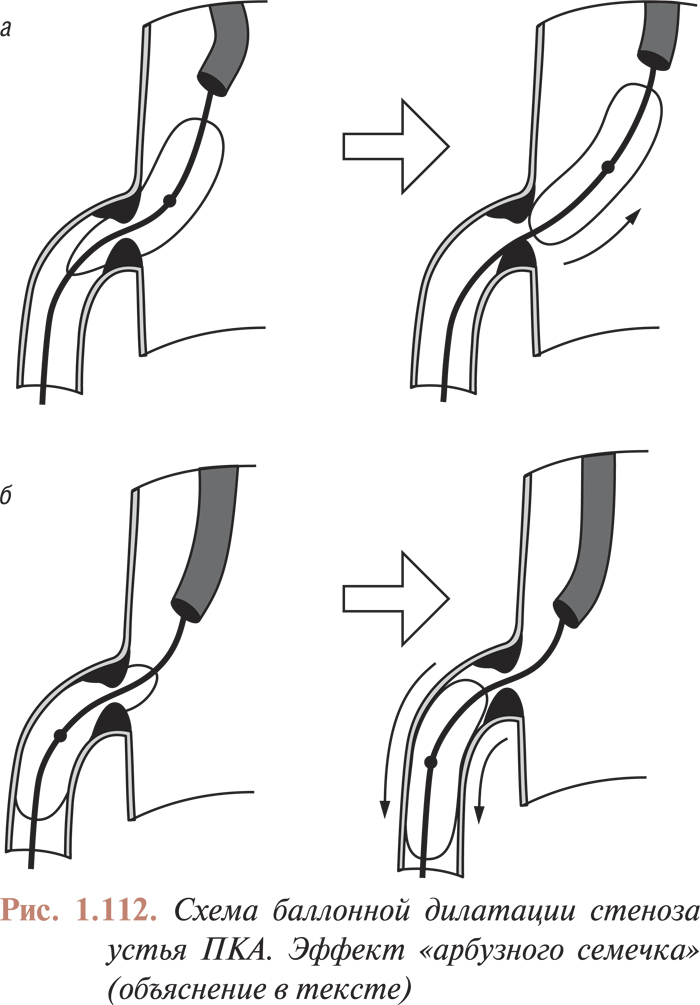
Когда происходит дилатация стеноза в устье боковой ветви (особенно при стенозе в передней межжелудочковой ветви левой коронарной артерии или огибающей ветви) баллон необходимо расположить таким образом, чтобы избежать полной обструкции коронарного кровотока в основной артерии без атеросклеротического поражения, что следует подтвердить инъекцией контрастного вещества во время раздувания баллона.
Длинные стенозы
Длинные стенозы в коронарных артериях — это атеросклеротические поражения протяженностью >20 мм (рис. 1.113). Хотя эффективность ангиопластики при длинных стенозах несколько ниже общих показателей при ЧТКА, реально достичь оптимального эффекта можно в среднем в 87% случаях (от 74 до 97%) при поражениях длиной >20 мм (табл. 1.39). В таблице рассматриваются случаи использования баллонов стандартной длины (20 мм) для проведения ангиопластики длинных стенозов (>20 мм). Однако эти данные не рандомизированы, а в исследованиях использовали различные протоколы.
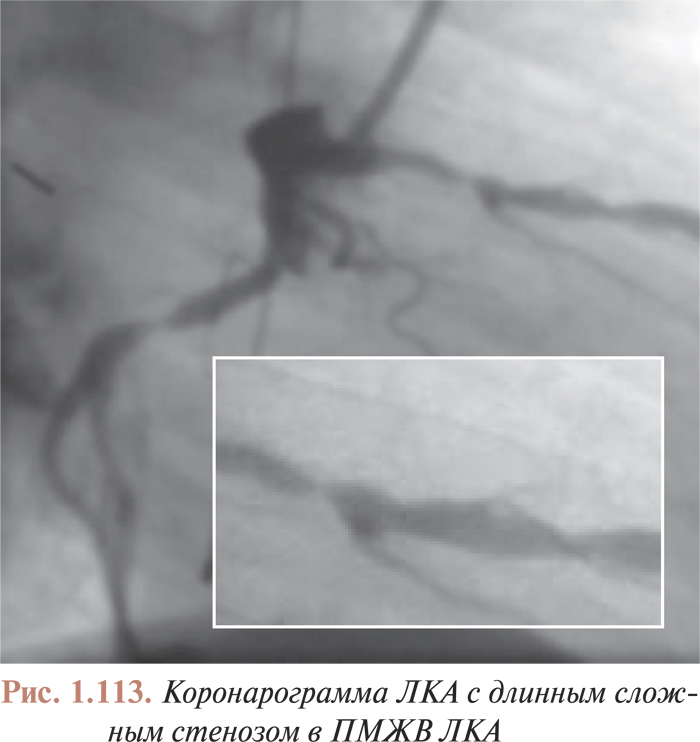
Таблица 1.39
Коронарная ангиопластика длинных стенозов: немедленные результаты
| Автор исследования (год) | Длина баллона, мм | Длина стеноза, мм | Количество стенозов, n | Успех, % | Осложнения, % Смерть/Q-ИМ/АКШ |
Диссекция, % | Острая окклюзия, % |
| Appelman (1996) | — | >10 | 157 | 79 | 0/1,3/1,9 | 55 | 0,6 |
| Tan (1995) | 20–40 | <10 | 959 | 95 | — | — | 1,5 |
| 10–20 | 153 | 85 | — | — | 11 | ||
| >20 | 45 | 74 | — | — | 16 | ||
| Kaul (1995) | 20–40 | 11–20 | 112 | 96 | 1/1/1 | 24 | 3 |
| >20 | 29 | 97 | 0/3/0 | 32 | 3 | ||
| Cates (1994) | 80 | >40 | 54 | 91 | -/-/4 | — | — |
| Mooney (1993) | — | >10 | 327 | 93 | 0/1/1,5 | 29 | 5 |
| Myler (1992) | 10 | 365 | 95 | 2,1 | — | — | |
| 11–20 | 278 | 91 | 0 | — | — | ||
| >20 | 136 | 89 | 0 | — | — | ||
| Zidar (1992) | 20 | <10 | 579 | 95 | 1,2/-/4,8 | 6,6 | 5,9 |
| 20 | >10 | 149 | 90 | 0,7/-/8,1 | 18,1 | 14,1 | |
| 30 | >10 | 90 | 98 | 1,1/-/3,3 | 8,9 | 5,6 | |
| Savas (1992) | 40 | >20 | 109 | 90 | 2 | 35 | 7 |
| 40 | >20 (угол >45°) | 69 | 88 | 1 | 20 | 7 | |
| Goudreau (1991) | 20 | >20 | 39 | 97 | 2,5 | — | — |
В рандомизированном исследовании Amsterdam — Rotterdam (AMRO), в котором определяли эффективность устранения длинных стенозов при помощи лазерной и обычной ангиопластики, эффективность ЧТКА составила только 79%. При проведении интракоронарного УЗИ установлено, что резидуальные стенозы после ЧТКА длинных стенозов определяют значительно чаще, чем при обычной ангиографии. Этот факт объясняется тем, что в нормальном сегменте коронарной артерии, который считается непораженным и не подвергается ангиопластике, существуют выраженные изменения и сужения, которые определяют в процессе интракоронарного УЗИ. Для правильной оценки результатов собственных или опубликованных исследований важно определить разницу между «длинным стенозом» и «диффузным поражением». Эти понятия часто взаимозаменяют друг друга. Однако длинные стенозы — это стенозы длиной >20 мм, а диффузные поражения, как правило, имеют сужения (>50%) не менее, чем в И пораженного сосуда.
Данные о частоте развития осложнений после ангиопластики длинных стенозов различны. Некоторые исследователи указывают на то, что ЧТКА длинных стенозов связана с повышением риска коронарной диссекции и острой окклюзии. В этих исследованиях острую окклюзию отмечали в 1–6% случаев в поражениях длиной <10 мм и в 9–14% — в стенозах длиной >10 мм. Существуют результаты исследований, в которых не установлена связь между длиной поражения, острой окклюзией и серьезными осложнениями. Различие результатов данных исследований можно объяснить клиническими особенностями пациентов, наличием или отсутствием многососудистого поражения, различными морфологическими особенностями стенозов (кроме их длины) и использованием для ангиопластики баллонов различной длины.
Влияние длины стеноза на риск возникновения рестеноза после удачной ангиопластики также различно. В исследовании Multy-Hospital Eastern Atlantic Restenosis Trial (M-HEART) установлена прямая связь между длиной стеноза и рестеноза в дилатированном сегменте. Длина стеноза от 0,3–2,9 мм; 3–4,6 мм; 4,7–7 мм; 7,1–28 мм способствовала возникновению рестенозов соответственно в 32, 33, 42 и 49% случаев. В других исследованиях подобная связь не выявлена. Несмотря на наличие публикаций, в которых подтверждается тот факт, что после ангиопластики длинных стенозов просвет артерии в течение 6 мес суживается несколько больше (не всегда до уровня рестеноза), чем после дилатации стенозов обычной длины, это не всегда коррелирует с клиническими проявлениями рестенозов.
Длинные баллоны (30–40мм). Во многих клинических исследованиях подтвержден тот факт, что при использовании длинных баллонов отмечены лучшие немедленные результаты после коронарной ангиопластики, чем после ангиопластики коротким баллоном в длинном стенозе. Это факт объясняется более равномерным распределением давления баллона по всей длине пораженного сегмента, особенно в месте перехода пораженного сегмента в здоровую ткань сосуда. Именно в этом месте чаще всего происходит диссекция интимы (возможно, медии и т.д.) (рис. 1.114а, б ).
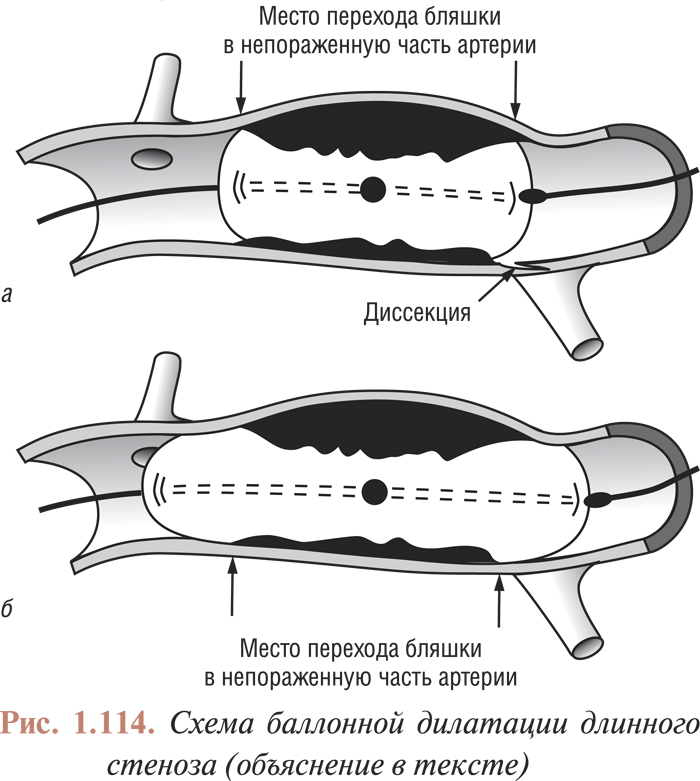
При использовании баллонов большей длины (30–40 мм) в сравнении со стандартными (20 мм) эффективность дилатации длинных стенозов выше, а частота осложнений в виде диссекции и острых окклюзий ниже. Фактически баллонная ангиопластика длинных стенозов длинными баллонами так же эффективна, как и ангиопластика локальных стенозов с помощью стандартных баллонов (10–20 мм). В одном из обзорных исследований 69 длинных (53 мм) и расположенных на изгибе артерии (>45°) поражений были успешно дилатированы при помощи длинных баллонов в 88% случаев и острой окклюзией — в 7%. Частота развития ишемических осложнений составила <1%. В небольшом (n=44) рандомизированном исследовании при использовании длинных баллонов отмечено меньше диссекций (18 в сравнении с 55%) и меньшее количество раздуваний по сравнению с применением баллонов стандартной длины. Таким образом, длинные баллоны по сравнению со стандартными при устранении длинных стенозов имеют преимущество и обеспечивают максимальную эффективность и минимальную частоту «опасной» диссекции, а следовательно, и осложнений.
Конусовидные баллоны. В большинстве коронарных артерий уменьшается диаметр на 0,5 мм на каждые 20 мм длины сосуда (средняя «конусовидность» равна 0,22 мм на каждые 10 мм длины артерии). Значительное и резкое уменьшение калибра артерии может стать препятствием для проведения оптимальной баллонной ангиопластики, особенно длинных стенозов (рис. 1.115, а–г). Для решения этой проблемы Banka и соавторы выполняли ангиопластику специальными конусовидными баллонами (уменьшение диаметра на 0,5 мм каждые 25 мм длины баллона). Эффективность ЧТКА при использовании подобных баллонов составила 80%, а ангиографически доказанную диссекцию определяли только у 2% из 101 пациента с конусовидным сужением артерии и стенозом в ней. Конусовидные баллоны также можно использовать при высоком давлении (12 атм.) для достижения оптимального эффекта при стентировании конусовидных артерий.
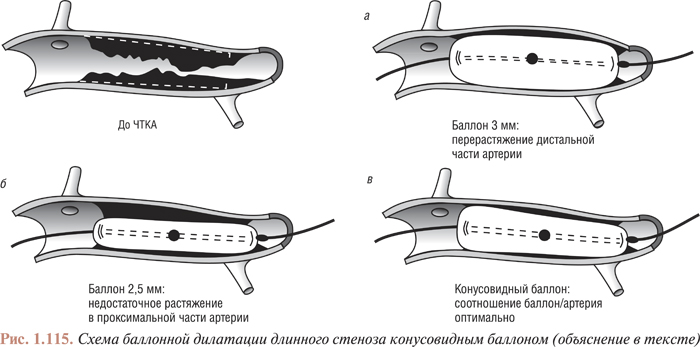
Таким образом, баллонная ангиопластика длинных стенозов может быть эффективна, хотя риск острых окклюзий и рестенозов может быть несколько выше в сравнении с ангиопластикой стенозов обычного размера. Новые инвазивные технологии, такие как лазерная ангиопластика, и атероэктомические устройства с дополнительной ангиопластикой и без таковой, не выявили преимуществ перед ангиопластикой длинными баллонами, а результат стентирования длинных стенозов еще предстоит оценить в ближайшем будущем.
Медикаментозная поддержка при проведении перкутанного коронарного вмешательства. ведение больных в ранний и поздний период после стентирования
До проведения процедуры рекомендуется болюсное внутрикоронарное введение нитроглицерина, что позволяет оценить истинные размеры сосуда и снизить риск вазоспастической реакции во время процедуры (Рекомендации для нитроглицерина: I C). Введение нитроглицерина можно проводить повторно во время процедуры или после нее, учитывая показатели АД. В редких случаях вазоспазма, резистентного к нитроглицерину, можно с успехом применять верапамил.
Имеется несколько сообщений по исследованиям, изучавшим внутрикоронарное введение различных доз верапамила и аденозина при синдроме «no reflow». Прямой донор нитрооксида — нитропруссид также позволяет эффективно и безопасно справиться с ситуацией, при которой уменьшение кровотока связано с выполнением перкутанного коронарного вмешательства. Лечение следует дополнить применением контрпульсатора. Назначение комбинации аденозина и нитропруссида, по сравнению с одним аденозином, более эффективно (Рекомендации по применению верапамила, аденозина и нитропруссида при синдроме «no reflow»: IIa C).
Ацетилсалициловая кислота
От начала развития интервенционной кардиологии антитромбоцитарные препараты являлись краеугольным камнем вспомогательной терапии при перкутанных коронарных вмешательствах, так как любое вмешательство сопровождается травмой эндотелия и более глубоких слоев, что вызывает активацию тромбоцитов. Основные фармакологические свойства антитромботических препаратов и их применение при атеросклеротической сердечно-сосудистой патологии были недавно рассмотрены в согласительном документе Европейского кардиологического общества. Рекомендации по проведению перкутанных коронарных вмешательств адресуют свои показания к более узким проблемам, касающимся применения коронарных интервенций.
Метаанализ «Antithrombotic Trialists» Collaboration показал, что ацетилсалициловая кислота, по сравнению с плацебо, на 22% снижает уровень сосудистых смертей, острых ИМ и инсультов у всех пациентов, имеющих высокий риск развития сосудистых осложнений. Проведено только одно плацебо-контролированное исследование (M-HEART II) с применением при перкутанном коронарном вмешательстве только ацетилсалициловой кислоты, которое показало достоверное улучшение клинических исходов по сравнению с группой плацебо. Применение ацетилсалициловой кислоты приводит к достоверному снижению инфарктов (с 5,7% до 1,2%). Сегодня ацетилсалициловая кислота продолжает играть важную роль в снижении ишемических осложнений, связанных с перкутанными коронарными вмешательствами. В тех случаях, когда больные не получали ацетилсалициловой кислоты предварительно или когда имеются сомнения в этом вопросе, за 3 ч до процедуры дается вводная доза ацетилсалициловой кислоты 500 мг per os и как минимум 300 мг внутривенно непосредственно перед процедурой. В случае установленной аллергической реакции ацетилсалициловая кислота не назначается. Как отмечено в согласительном документе Европейского кардиологического общества, при долгосрочном применении ацетилсалициловой кислоты доза не должна превышать 100 мг/сут (Рекомендации для назначения ацетилсалициловой кислоты при перкутанных коронарных вмешательствах для больных со стабильной стенокардией: I B).
Тиклопидин и клопидогрел
Тиклопидин и клопидогрел являются мощными антитромботическими препаратами. Есть неоспоримые доказательства того, что комбинация ацетилсалициловой кислоты и тиенопиридинов дает лучшие результаты относительно острых и подострых тромботических осложнений перкутанных коронарных вмешательств, чем применение одной ацетилсалициловой кислоты или ацетилсалициловой кислоты в сочетании с пероральными антикоагулянтами (Milan/Tokyo, ISAR (Intracoronary Stenting and Antithrombotic Regimen)), STARS (STent Anti-thrombotic Regimen Study), FANTASTIC (Full Anticoagulation versus Ticlopidine plus Aspirin after Stent Implantation) и MATTIS (Multicenter Aspirin and Ticlopidine Trial after Intracoronary Stenting). По результатам 3 рандомизированных контролированных исследований CLASSICS (Clopidogrel Aspirin Stent International Cooperative Study), TOPPS (Ticlid Or Plavix Post-Stent), Bad Krozingen, а также данным некоторых регистров и метаанализов представляется, что клопидогрел эффективен не менее чем тиклопидин. В то же время клопидогрел не имеет таких побочных действий, как тиклопидин и, кроме того, лучше переносится (Рекомендации для назначения тиклопидина или клопидогрела в дополнение к ацетилсалициловой кислоте в течение 3–4 нед после имплантации непокрытых стентов в случае стабильной стенокардии: I A).
Так как в настоящее время подавляющее большинство перкутанных коронарных вмешательств в конечном счете заканчивается имплантацией стентов, то всем больным, готовящимся к перкутанному коронарному вмешательству, независимо от того, планируется имплантация стента, или нет, в подготовительный период следует назначить клопидогрел. Однако однократного назначения клопидогрела в дозе 300 мг за 2,5 ч до процедуры может быть недостаточно. Для достижения полной антитромботической активности клопидогрел должен назначаться по крайней мере за 6 ч до перкутанного коронарного вмешательства в начальной дозе 300 мг. В идеале клопидогрел назначается за день до планируемого перкутанного коронарного вмешательства (исследование CREDO (Clopidogrel for the Reduction of Events During Observation), анализ TARGET (Do Tirofiban and ReoPro Give Similar Efficacy Outcome)). В случае отсутствия возможности выполнить указанные рекомендации допускается назначение клопидогрела не позднее 2 ч до начала процедуры в начальной дозе 600 мг, однако полностью опубликованных данных по поводу данной дозировки в настоящее время нет. В тех случаях, когда коронарография не выявила изменений, больному не были имплантированы стенты или предполагается выполнение шунтирующей операции, клопидогрел отменяется. Пациенты, которым клопидогрел до перкутанного коронарного вмешательства не назначался, должны получить по возможности наибольшую дозу клопидогрела немедленно после процедуры (Рекомендации для назначения клопидогрела не позже, чем за 6 ч до перкутанного коронарного вмешательства: I C).
Пролонгированное (>4 нед) назначение клопидогрела после имплантации стентов не представляется целесообразным, за исключением тех случаев, когда проводилась брахитерапия или же имплантировались элютинг-стенты (Рекомендации для назначения клопидогрела на 12 мес после брахитерапии или на 6–12 мес после имплантации элютинг-стентов: IC).
Нефракционированный гепарин, гепарины с низкой молекулярной массой, бивалирудин
В интервенционной кардиологии нефракционированный гепарин начал применяться со времени проведения первых перкутанных коронарных вмешательств. Нефракционированный гепарин используется с целью профилактики образования тромбов на инструментарии и максимального уменьшения тромбоза в местах искусственного повреждения сосудистой стенки или разрушения бляшки. Очевидно, что провести плацебо-контролируемые исследования, которые показали бы недостатки проведения любого внутрикоронарного вмешательства при отсутствии антикоагулянтной терапии, не представляется возможным. Нефракционированный гепарин вводится внутривенно болюсно под контролем показателя времени активации тромбоцитов (время активации тромбоцитов должно быть в пределах 250–350 с; в случае назначения ингибиторов гликопротеиновых рецепторов тромбоцитов (GP) IIb/IIIa — 200–250 с). Дозу нефракционированного гепарина можно также вычислить на основании веса тела больного (обычно 100 ЕД/кг или при назначении ингибиторов гликопротеиновых рецепторов тромбоцитов IIb/ IIIa приблизительно 50–60 ЕД/кг). Вследствие значительной вариабельности биологической активности гепарина дозу нефракционированного гепарина лучше определять с помощью оценки времени активации тромбоцитов, особенно в случаях длительных процедур, когда требуется повторное введение гепарина. Терапевтический эффект нефракционированного гепарина трудно предсказать. Есть информация о том, что польза нефракционированного гепарина зависит от эффективной дозы, хотя во время рутинных процедур обычно применяют низкие дозы (5000 ЕД и меньше). Дальнейшая гепаринизация после окончания процедуры, как до удаления интродюсора, так и после этого, не рекомендуется.
Как нефракционированный гепарин, так и гепарины с низким молекулярным весом взаимодействуют с антитромбином III, ускоряя процесс ингибирования тромбина. Однако нефракционированный гепарин имеет некоторые недостатки: вследствие выраженной способности нефракционированного гепарина связываться с белками плазмы крови уровень свободного гепарина является непредсказуемым, вследствие чего нефракционированный гепарин может оказывать различный антитромботический эффект. Нефракционированный гепарин с одинаковой степенью интенсивности ингибирует как фактор Xa, так и тромбин; гепарины с низким молекулярным весом преимущественно и более интенсивно ингибируют фактор Xa. Гепарины с низким молекулярным весом являются более предсказуемым антикоагулянтом вследствие того, что его уровень в плазме крови является более постоянным. Поэтому при назначении гепари-нов с низким молекулярным весом не требуется лабораторного мониторинга.
Информация о применении гепарина с низким молекулярным весом как единственного антикоагулянта при стабильной стенокардии ограничена. Больным, которым в предоперационный период предполагается назначение гепарина с низким молекулярным весом, может дополнительно, с целью безопасности, вводиться нефракционированный гепарин, если эти больные получали гепарины с низким молекулярным весом. Нефракционированный гепарин может назначаться пациентам на догоспитальном этапе в интервале между последним введением гепарина с низким молекулярным весом и предстоящим введением гепарина с низким молекулярным весом в стационаре в зависимости от длительности этого интервала.
В отличие от аналогов гирудина (дезирудина и лепирудина), подавление тромбина бивалирудином обратимо в течение приблизительно 25 мин. Несмотря на то что исследования, проведенные с гирудином, демонстрировали повышение риска кровотечений, результаты применения бивалирудина при перкутанных коронарных вмешательствах вполне обнадеживают. CACHET (Comparison of Abciximab Complications with Hirulog for Ischemic Events Trial) было первым рандомизированным исследованием, которое показало, что при проведении перкутанных коронарных вмешательств результаты применения абциксимаба в качестве однократно используемого препарата в сочетании с бивалирудином как постоянным антитромботическим агентом по крайней мере не хуже, чем при назначении абциксимаба и гепарина. Сегодня считается, что бивалирудин может заменить нефракционированный гепарин, так как бивалирудин дает достоверно меньшее количество кровотечений, чем нефракционированный гепарин (исследование BAT (Bivalirudin Angioplasty Trial)). Более того, в исследовании REPLACE-2 (Randomized Evaluation in PCI Linking Angiomax to Reduced Clinical Events) бивалирудин не прямо, но проспективно сравнивался с гепарином: уровень условной разницы составил 0,62, что удовлетворяет статистические критерии, показывающие преимущество бивалирудина перед гепарином. При назначении бивалирудина восстановление показателя времени активации тромбоцитов к норме происходит быстрее, чем при назначении гепарина, хотя уровень этого показателя при назначении бивалирудина может быть значительно более высоким, а субтерапевтическая доза меньше (Рекомендации для замещения нефракционированного гепарина и гепаринов с низким молекулярным весом на бивалирудин для уменьшения количества кровотечений: IIaC).
В настоящее время бивалирудин, безусловно, рекомендуется для замещения как нефракционированного гепарина, так и гепаринов с низким молекулярным весом в тех ситуациях, когда у больных имеется гепарин-индуцируемая тромбоцитопения (количесво тромбоцитов <150 000/100 мл). Использование бивалирудина у таких больных является безопасным и обеспечивает эффективную антикоагуляцию во время перкутанных коронарных вмешательств у этой подгруппы больных (Рекомендации по замещению нефракционированного гепарина и гепаринов с низким молекулярным весом на бивалирудин у больных с гепарин-индуцируемой тромбоцитопенией: IC).
Ингибиторы гликопротеиновых рецепторов тромбоцитов IIb/IIIa
В исследовании ISAR-REACT (Intracoronary Stenting and Antithrombotic Regimen: Rapid Early Action for Coronary Treatment) больным с ИБС, представляющих группу низкого риска ИБС, рандомизированно назначали абциксимаб или плацебо (были исключены больные с острым коронарным синдромом, инсулинозависимые больные сахарным диабетом и больные с визуализированными тромбами) (табл. 1.40). В этой группе низкого риска ИБС, перенесших плановое коронарное стентирование, абциксимаб не достиг первичной конечной точки. Хотя ретроспективный анализ результатов лечения подгруппы больных сахарным диабетом исследования EPISTENT (Evaluation of Platelet IIb/IIIa Inhibitor for Stenting), в которую были включены больные со стабильной и нестабильной стенокардией, показал прогностическое преимущество назначения абциксимаба больным, у которых проводили стентирование, проспективное исследование ISAR-SWEET (Intracoronary Stenting and Antithrombotic Regimen: Is abciximab a Superior Way to Eliminate Elevated Thrombotic risk in diabetics), проведенное среди больных со стабильной стенокардией, не включавшее больных с острым коронарным синдромом и/или видимым тромбом, не подтверждает эту концепцию. Учитывая общий низкий уровень риска выполнения перкутанных коронарных вмешательств у больных со стабильной стенокардией, ингибиторы гликопротеиновых рецепторов тромбоцитов IIb/IIIa не являются частью стандартной перипроцедуральной терапии для больных группы низкого риска со стабильной стенокардией, принимая во внимание повышенный риск кровотечений, связанный с их применением, а также стоимость этих препаратов.
Таблица 1.40
Данные рандомизированных исследований по использованию ингибиторов гликопротеиновых IIb/IIIа-рецепторов тромбоцитов с одновременным проведением инвазивного лечения у пациентов с острыми коронарными синдромами
| Показатель | CAPTURE | PERSUIT | PRISM-PLUS | Комбинированное использование | ||||
| Абциксимаб | Эптифибатид | Тирофибан | GP Ilb/IIIa | |||||
| не использовали | использовали | не использовали | использовали | не использовали | использовали | не использовали | использовали | |
| Результаты применения препарата при проведении PCI* | ||||||||
| Смертность, % | 0,2 | 0 | 0,8 | 0,4 | 0,6 | 0,3 | 0,7 | 0,4 (р=0,001) |
| Смерть или нефатальный ИМ, % | 2,8 | 1,3 (р=0,032) | 4,4 | 3,2 (р=0,003) | 3,8 | 1,8 (р=0,016) | 3,8 | 2,5 (р=0,006) |
| Результаты использования препарата в течение 48 ч после проведения PCI | ||||||||
| Смертность (%) | 0,5 | 0,3 | 1,1 | 0,7 | 0,7 | 0,7 | 0,8 | 0,5 (р=0,375) |
| Смерть или нефатальный ИМ, % | 5,8 | 2,8 (р=0,009) | 10,3 | 7,6 (р=0,105) | 8,0 | 2,9 | 8,0 | 4,9 (р=0,001) |
*PCI — перкутанное коронарное вмешательство.
Несмотря на результаты большого кумулятивного метаанализа, проведенного на основании данных о 20 186 больных, который предлагает рутинное назначение ингибиторов гликопротеиновых рецепторов тромбоцитов IIb/IIIa, а также несмотря на результаты метаанализа, проведенного недавно (8004 больных), который продемонстрировал снижение смертности при стентировании больных с неострой формой ИБС, применение ингибиторов гликопротеиновых рецепторов тромбоцитов IIb/IIIa при выполнении перкутанных коронарных вмешательств по поводу стабильной стенокардии следует рассматривать от случая к случаю. В тех случаях, когда уровень риска выполнения перкутанного коронарного вмешательства при стабильной стенокардии превышает средний, назначение ингибиторов гликопротеиновых рецепторов тромбоцитов IIb/IIIa представляется целесообразным. Ингибиторы гликопротеиновых рецепторов тромбоцитов IIb/IIIa необходимо назначать больным с нестабильными поражениями в качестве симптоматической терапии при угрожающей/развившейся окклюзии сосуда, видимом тромбе и при синдроме no/slow reflow. Применение ингибиторов гликопротеиновых рецепторов тромбоцитов IIb/IIIa также полезно при сложных вмешательствах (Рекомендации по применению ингибиторов гликопротеиновых рецепторов тромбоцитов IIb/IIIa у больных со стабильной стенокардией при наличии сложных поражений, угрожающей/развившейся окклюзии, видимых тромбов, синдроме no/slow reflow: IIa C).
Перкутанные коронарные вмешательства, медикаментозное лечение и АКШ при хронической форме ИБС
Перкутанные коронарные вмешательства и медикаментозное лечение
Метаанализ рандомизированных контролированных исследований показал, что перкутанные коронарные вмешательства, по сравнению с медикаментозным лечением, приводят к более выраженному уменьшению симптомов стенокардии. В то же время исследования не включали достаточного количества больных для информативной оценки влияния перкутанных коронарных вмешательств на последующее развитие инфарктов, смертей или необходимости проведения повторной реваскуляризации. По данным исследования TIME (Tirofiban In Myocardial Infarction Evaluation) долгосрочная выживаемость у больных со стабильной стенокардией класса II и выше (по Канадской классификации) в возрасте более 75 лет была схожей в группах перкутанных коронарных вмешательств и медикаментозного лечения с применением как минимум 2 антиангинальных препаратов. Хотя в обеих группах отмечали уменьшение симптоматики стенокардии и улучшение качества жизни, нефатальные осложнения чаще отмечали в группе больных, получавших медикаментозное лечение. Метаанализ рандомизированных контролированных исследований показал, что перкутанное коронарное вмешательство по сравнению с медикаментозным лечением приводит к более выраженному уменьшению симптомов стенокардии. В то же время исследования не включали достаточного количества больных для информативной оценки влияния перкутанных коронарных вмешательств на последующее развитие инфарктов, смертей или необходимости проведения повторной реваскуляризации.
Перкутанные коронарные вмешательства и шунтирующие операции
Данные сравнения перкутанных коронарных вмешательств и АКШ представлены в 13 исследованиях, проведенных с 1987 по 1999 г. В этих исследованиях были рандомизированы 7964 больных. На 1-, 3-й и 8-й год 8-летнего наблюдения (за исключением результатов 5-го года) статистически значимого различия по уровню смерти среди групп различной стратегии реваскуляризации не отмечали. На результаты исследований повлияло использование стентов: в ранних исследованиях, в которых стенты не использовали, отмечали тенденцию к лучшим результатам АКШ в течение 3-летнего срока наблюдения; этого не отмечали в более поздних исследованиях, в которых применяли стенты. Тенденция к лучшим результатам АКШ по сравнению с перкутанными коронарными вмешательствами в настоящее время сводится к нулю, несмотря на то что результаты этой операции в последнее время улучшились (смертность в группах АКШ в тех исследованиях, когда стентирование не применялось, составляла 5,2%; в более поздних исследованиях — 3,5%). Стентирование по сравнению с АКШ наполовину снижает риск повторной реваскуляризации. Выполнение перкутанного коронарного вмешательства, так же, как и АКШ, достоверно уменьшает симптоматику стенокардии.
ИНТЕРВЕНЦИОННЫЕ МЕТОДЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ ОСТРЫХ КОРОНАРНЫХ СИНДРОМОВ
Перкутанные коронарные вмешательства при остром коронарном синдроме без элевации сегмента ST
Коронарографическая морфология атеросклеротических поражений при остром коронарном синдроме без элевации сегмента ST
Развитие острого коронарного синдрома напрямую связано с осложненным ростом атеросклеротической бляшки, который сопровождается образованием тромбов различного объема и локализации по отношению к структуре бляшки.
Морфологический состав стабильных атеросклеротических бляшек может различаться по соотношению структур, способствующих ее стабилизации или дестабилизации. При достаточном количестве в структуре бляшки функционирующих гладкомышечных клеток, участвующих в формировании соединительнотканного матрикса, бляшка и ее капсула представляют собой прочное стабильное образование. В том случае, если в структуре атеросклеротической бляшки преобладают элементы, способствующие ее деструкции (клетки воспаления, пенные клетки, окисленные ЛПНП, локализующиеся в липидных озерах), такая бляшка является слабой, предрасположенной к разрушению.
Разрушение структуры бляшки начинается с капсулы. При преобладании в структуре капсулы клеток разрушения, особенно макрофагов, синтезирующих металлопротеиназы, коллагеновая структура капсулы становится неоднородной; образуются ее «слабые места», где и происходит разрыв, сопровождающийся контактом крови с тромбогенными тканями бляшки и последующим тромбообразованием.
Другая причина развития тромбоза — эрозия эндотелия. Такой вариант тромбообразования выявляют приблизительно в 30% случаев; чаще у женщин. Образующиеся при этом тромбы не столь массивны, как при деструкции капсулы. Их основной компонент — тромбоциты, которые, продуцируя тромбоцитарный фактор роста, способствуют пролиферации гладкомышечных клеток и их миграции в структуру бляшки. При небольшой площади эрозии и соответственно небольшом объеме пристеночного тромба происходит преобладание процессов реконструкции капсулы, индуцируемых гладкомышечными клетками, над процессами разрушения. Такой вариант деструкции заканчивается заживлением поврежденной поверхности бляшки и стабилизацией клинического состояния больного. Важную роль в процессе стабилизации играет соотношение систем «тромбообразование/тромболизис».
В любом случае активизация процессов деструкции эндотелия, фиброзной капсулы и других структур бляшки с последующим пристеночным тромбозом приводит к развитию острых коронарных синдромов без элевации ST. Признаки начальной деструкции атеросклеротической бляшки на коронарограммах определяют на основании наличия негомогенности контрастирования в зоне стеноза или незначительной неровности («шероховатости») контура стеноза (симптом «плюс ткань») (рис. 1.116, 1.117). В случае выраженного пристеночного тромбоза, когда тромб является основной составляющей сужения просвета, его легко можно выявить на коронарограмме. Основной признак — это дефект наполнения просвета сосуда. Сюда же относится симптом «нависающего края стеноза над стенкой сосуда», который был описан J. Ambrose в 1986 г. (рис. 1.118–1.119).

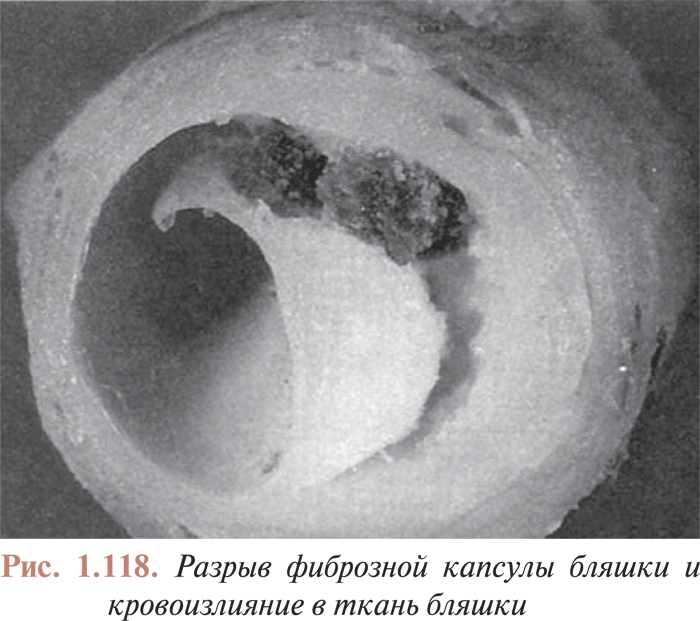
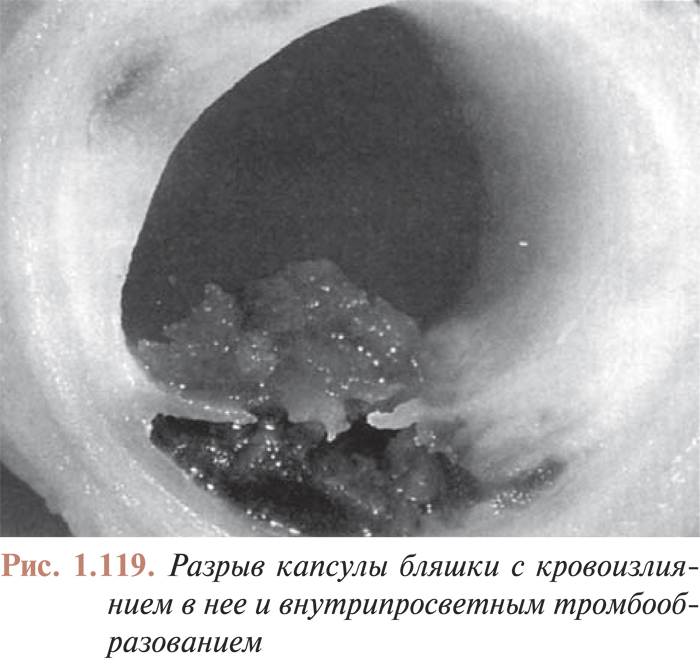
Определение степени риска быстрого прогрессирования болезни при остром коронарном синдроме без элевации сегмента ST
Важность разделения больных с нестабильной стенокардией и ИМ без элевации сегмента ST на группы высокого и низкого риска развития осложнений обоснована тем, что явное преимущество выполнения ранней коронарографии и при необходимости перкутанного коронарного вмешательства определено только у больных группы высокого риска развития осложнений.
В рекомендациях Европейского кардиологического общества по лечению острого коронарного синдрома без элевации ST даются характеристики пациентов, относящихся к группе высокого риска резкого прогрессирования болезни с последующим развитием ИМ или смерти. Коронарография у этих больных должна быть выполнена в течение первых 48 ч. Характеристики больных, относящихся к группе высокого риска развития острых тромботических осложнений острого коронарного синдрома без элевации ST, таковы:
- Повторяющиеся приступы стенокардии
- Динамические изменения сегмента ST
- Повышенные уровни тропонинов
- Нестабильность гемодинамики
- Выраженные аритмии (желудочковые)
- Ранняя постинфарктная стенокардия
- Сахарный диабет.
Кроме этого, при оценке риска возможных осложнений острого коронарного синдрома без элевации ST необходимо принимать во внимание сопутствующие маркеры, влияющие на развитие осложнений в отдаленные сроки заболевания. К этим маркерам относят:
- Возраст >65–70 лет
- Наличие симптомов ИБС, ранее перенесенных инфарктов, перкутанное коронарное вмешательство и АКШ в анамнезе
- Выраженная СН, отек легких, появившиеся шумы, характерные для недостаточности митрального клапана
- Рост маркеров воспаления (СРБ, фибриногена, интерлейкина-6)
- Почечная недостаточность.
Анализ исследования TACTICS-TIMI 18, проведенный post hoc (ретроспективный), показал, что раннее инвазивное лечение больных пожилого возраста с острым коронарным синдромом без элевации ST достоверно уменьшает выраженность ишемии миокарда.
Тактика выполнения перкутанного коронарного вмешательства при остром коронарном синдроме без элевации сегмента ST
Недавно опубликованные обзоры свидетельствуют, что перкутанные коронарные вмешательства проводятся менее чем у 50% больных с острым коронарным синдромом без элевации ST (GRACE (Global Registry of Acute Coronary Events), CRUSADE (Coronary Revascularization UltraSound Angioplasty DEvice trial)). Сторонники медикаментозного лечения пациентов с нестабильной стенокардией и ИМ без элевации сегмента ST основываются на результатах исследований TIMI IIIB (Thrombolysis in Myocardial Infarction IIIB Substudy), MATE (Medicine vs. Angiography in Thrombolytic Exclusion) и VANQWISH (Veterans Affairs Non-Q Wave Infarction Strategies In Hospital). Указанные исследования имеют некоторые методологические недостатки (высокие пересекающиеся уровни, отсутствие или минимальное использование стентов, отсутствие в медикаментозном сопровождении ингибиторов гликопротеиновых рецепторов тромбоцитов IIb/IIIa), что делает заключения этих исследований несоответствующими нынешней ситуации. В исследовании GUSTO IV-ACS (Global Use of Strategies To Open Occluded Coronary Arteries IV — Acute Coronary Syndrome) установлено, что реваскуляризация, проведенная в течение первых 30 дней, улучшает прогноз. Наблюдавшаяся в этом исследовании сравнительно высокая смертность в группе медикаментозного лечения может быть частично связана с отбором больных. Помимо 2 меньших по объему европейских исследований (TRUCS (Treatment of Refractory Unstable Angina in Geographically Isolated Areas Without Cardiac Surgery) и VINO (Value of First Day Coronary Angiography/ Angioplasty in Evolving Non-ST-Segment Elevation Myocardial Infarction)), преимущество раннего инвазивного перед медикаментозным лечением основывается на результатах трех исследований (FRISC II, TACTICS-TIMI 18 и RITA-3), включивших 6487 больных (табл. 1.41, 1.42, рис. 1.120) (Рекомендации для раннего перкутанного коронарного вмешательства — лечения больных группы высокого риска с острым коронарным синдромом без элевации сегмента ST: IA).
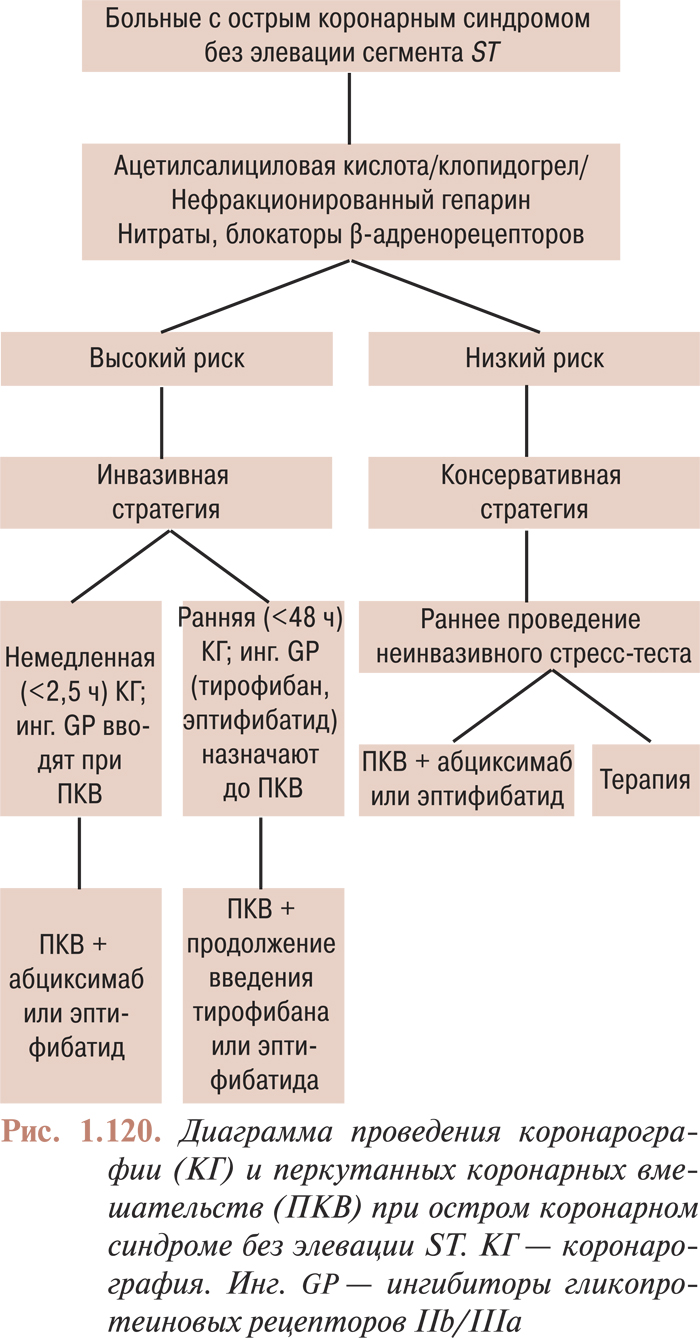
Таблица 1.41
Результаты инвазивного лечения и медикаментозной терапии больных с нестабильной стенокардией: TIMI-3B
| Результат | Инвазивное лечение, % | Медикаментозная терапия, % | p |
| Катетеризация | |||
| Первичная госпитализация | 98 | 57 | 0,001 |
| 6 нед | 98 | 64 | 0,001 |
| 1 год | 99 | 73 | 0,001 |
| ЧТКА | |||
| Первичная госпитализация | 37 | 23 | 0,001 |
| 6 нед | 38 | 26 | 0,001 |
| 1 год | 39 | 32 | 0,001 |
| АКШ | |||
| Первичная госпитализация | 24 | 18 | 0,003 |
| 6 нед | 25 | 23 | 0,17 |
| 1 год | 30 | 30 | 0,50 |
| ЧТКА или АКШ | |||
| Первичная госпитализация | 60 | 40 | 0,001 |
| 6 нед | 61 | 48 | 0,001 |
| 1 год | 64 | 58 | 0,001 |
Таблица 1.42
Результаты ЧТКА в сравнении с АКШ при нестабильной стенокардии
| Исследование | Количество больных | Нестабильная стенокардия, % | Результат |
| CABRI | 1054 | 15 | Отсутствие различий в показателях СН и ИМ в 1-й год наблюдения |
| RITA | 1011 | 59 | Отсутствие различий в показателях СН и ИМ при наблюдении в течение 2 лет |
| EAST | 392 | 60 | Отсутствие различий в показателях СН и ИМ или ишемии миокарда, подтвержденной результатами пробы с 201Tl в течение 3 лет |
| CABI | 359 | 14 | Повышение риска развития ИМ при АКШ |
| ERACI | 127 | 83 | Отсутствие различий в показателях СН и ИМ в 1-й год наблюдения |
| BARI | 1829 | 64 | Отсутствие различий в показателях СН и ИМ в течение 5 лет наблюдения |
| VA | 700 | 100 | Отсутствие различий в показателях СН и ИМ в 1-й год наблюдения |
Имеются данные, что может существовать различие в результатах лечения острого коронарного синдрома без элевации ST в зависимости от пола больных, хотя интерпретация этих данных требует осторожности. В некоторых исследованиях, находящихся в стадии разработки (например ICTUS (Invasive Versus Conservative Treatment in Unstable Coronary Syndromes Investigators)), применяется более мощный антитромбоцитарный режим, позволяющий оспаривать существующую сейчас интервенционную стратегию. В исследовании ISAR-COOL сравнивали терапевтическую («холодную») стратегию (пролонгированная антитромботическая подготовка перед интервенцией) и немедленное выполнение перкутанного коронарного вмешательства у больных группы высокого риска с депрессией сегмента ST (65%) и повышенным уровнем тропонина T (67%). Средний срок катетеризации в группе с «холодной» стратегией составил 86 ч; в группе немедленной катетеризации — 2,4 ч. Первичные конечные точки, определенные как смерть вследствие любой причины и обширный нефатальный ИМ в течение 30 дней, в группе с «холодной» стратегией наблюдались в 11,6%; в группе с немедленной инвазивной стратегией — 5,9% (p=0,04). На этот результат повлияли осложнения, наступившие до катетеризации. Авторы заключают, что у больных с острым коронарным синдромом без элевации ST, которые относятся к группе высокого риска, отсрочка интервенции не дает улучшения результатов, а антитромботическая подготовка должна занимать тот минимум времени, которое требуется для организации кардиальной катетеризации и реваскуляризации (Рекомендации для немедленного, то есть ранее чем через 2,5 ч выполнения перкутанного коронарного вмешательства у больных с острым коронарным синдромом без элевации ST, относящихся к группе высокого риска: IC).
Если по каким-либо причинам время между коронарографией и перкутанным коронарным вмешательством доходит до 24 ч, можно также назначать абциксимаб. Эноксапарин может рассматриваться как препарат, назначаемый вместо нефракционированного гепарина больным группы высокого риска осложнений острого коронарного синдрома без элевации сегмента ST в тех случаях, когда инвазивную тактику лечения применить нельзя.
Итак, больные с острым коронарным синдромом без элевации сегмента ST (нестабильная стенокардия или ИМ без элевации сегмента ST) сначала должны быть стратифицированы по группам риска. Явное преимущество ранней ангиографии и последующей реваскуляризации (перкутанное коронарное вмешательство или АКШ) доказано только для больных группы высокого риска. Отсрочка интервенции не приводит к улучшению результата. Прогнозированность и непосредственная безопасность рутинного стентирования дают основание рекомендовать этот вид лечения.
Острый коронарный синдром с элевацией сегмента ST
Развитие острой тромботической окклюзии коронарной артерии
В неизмененной артерии интактное эндотелиальное покрытие предотвращает контакт тромбоцитов с субинтимальными компонентами, такими как коллаген, фактор Виллебранда и фибринонектин, которые являются стимуляторами тромбоцитарной агрегации. При использовании экспериментальных моделей доказано, что нарушение целости эндотелия играет роль в развитии тромбоза при наличии определенных условий. В ходе экспериментальных исследований установлено, что рост тромба зависел от уровня кровотока и количества имеющейся в области бляшки соединительной ткани без эндотелиальной защиты; чем глубже повреждение интимы, тем выше вероятность тромбообразования, а в клинической практике — чем более глубокая и продолжительная диссекция, тем выше вероятность тромбоза.
В одном из исследований по изучению структуры бляшек (166 коронарных тромбозов на посмертных коронарограммах) установлено, что в 42 (25,3%) случаях интима, покрывающая стеноз, выглядела интактной. В большинстве (74,7%) бляшек, покрытых тромбами, выявляли щели и разрывы интимы с последующим глубоким повреждением. В тех тромбах, в местах образования которых не наблюдалось разрывов бляшек, выявляли потерю эндотелиального покрытия, наличие большого количества макрофагов, более поверхностно прилежащих к интиме на фоне субтотальных стенозов. Однако щелеобразование в бляшке, вызывающее тромбоз, часто происходит в тех случаях, когда исходный стеноз имеет незначительные размеры и часто не является гемодинамически значимым. Этот факт нашел подтверждение в клинических исследованиях, в которых коронарографию выполняли за несколько недель или месяцев до острого ИМ.
Различия между двумя формами коронарных тромбов — поверхностных, расположенных на интактной бляшке, и глубоких, вызванных щелеобразованием, — описаны много лет назад. Глубокие повреждения интимы, при которых разрывы почти достигают медии сосуда, отличаются от поверхностных повреждений интимы по двум значительным параметрам: 1) при глубоком повреждении незащищенным от тромбоцитов оказывается большое количество коллагена, что приводит к образованию тромбов больших размеров; 2) такие тромбы образуются сначала внутри самой бляшки. Эта масса внутриинтимальных тромбов может изменить конфигурацию бляшки, внезапно увеличивая ее размер (что вызывает местное снижение кровотока) и потенциально способствуя дальнейшему тромбозу (уже внутри артериального просвета). Разрывы интимы и отложения тромбов могут индуцировать местный артериальный спазм, что приводит к еще большему снижению кровотока.
Повреждение интимы — от трещин и щелей малых размеров до изъязвления коронарных больших бляшек — можно наблюдать при проведении коронарографии (рис. 1.121, 122). Процесс щелеобразования, разрыва, растрескивания, изъязвления бляшек описан еще в 1926 г. Современные исследования доказывают, что эксцентрические стенозы, наблюдаемые на посмертных коронарограммах и имеющие неровные контуры и внутрипросветные дефекты наполнения, являются разрушенными бляшками. Вскоре стало ясно, что сходные признаки можно выявить на коронарограммах пациентов с ИМ, нестабильной стенокардией, а также у больных, реанимированных при кардиогенном шоке.
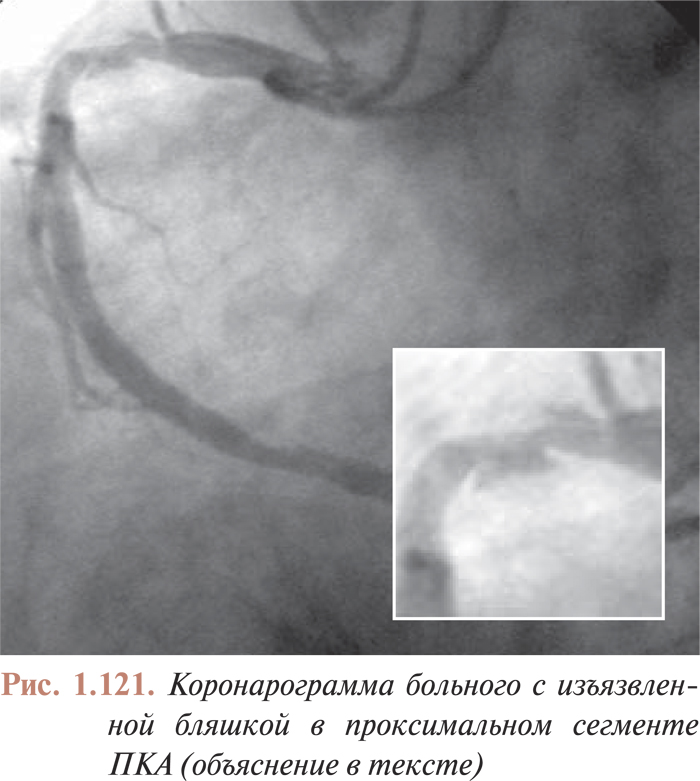
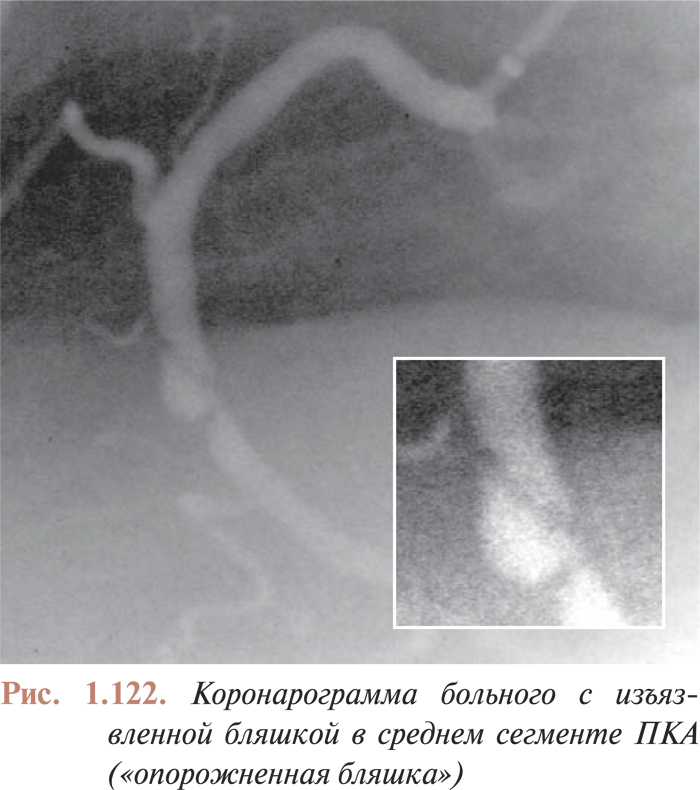
Патогистологические исследования больных, умерших от коронарного атеросклероза, позволили идентифицировать три стадии тромбоза, связанного со щелеобразованием. В ранней стадии наблюдается разрыв интимы, связывающей просвет артерии с богатой липидами бляшкой, что приводит к образованию тромботических масс внутри интимы. Такие тромбы еще не являются внутрипросветными. Следующий этап развития тромба связан c выпячиванием тромботических масс в просвет артерии (рис. 1.123 ).
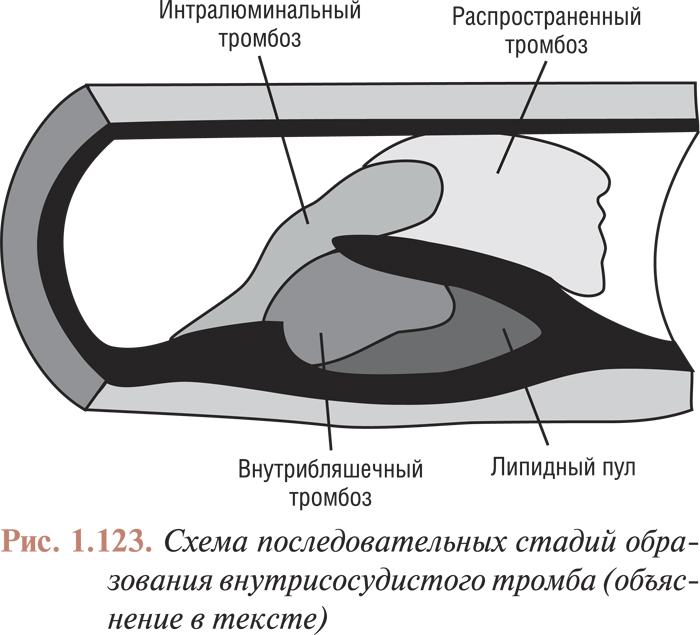
Внутрисосудистый тромботический компонент является пристеночным, и в зоне тромба все еще сохраняется антеградный кровоток. Подобные пристеночные тромбы можно диагностировать при жизни с помощью ангиоскопического исследования у больных с нестабильной стенокардией, а также определить на коронарограммах как внутрипросветные дефекты наполнения вблизи стенозов с неровными контурами или нависающими краями (тип II) при нестабильной стенокардии и ИМ. В последней стадии процесса, которая не является неизбежной при разрыве бляшки, внутрипросветный тромб становится окклюзирующим. В пристеночном компоненте внутрипросветного тромба, когда он закрывает щель бляшки, содержится больше фибрина, чем тромбоцитов, и фактически отсутствуют клетки красной крови. Окклюзирующий компонент внутрипросветного тромба, особенно если он имеет дистальное продолжение, сформирован из фибриновой сети, которая опутывает большое количество эритроцитов и только незначительное — тромбоцитов. Пристеночные неокклюзирующие тромбы являются причиной дистальной эмболии малыми тромбоцитарными тромбами как у экспериментальных животных, так и у людей. Эти эмболы всегда находятся в бассейне артерии, содержащей расщепленную бляшку. Есть данные клинических исследований, полученные с помощью радиомаркирования как фибриногена, так и тромбоцитов, доказывающие, что разрастание тромба продолжается после начала формирования ИМ.
Ангиографическое исследование при ИМ позволяет наблюдать трансформацию тромбов от пристеночных до окклюзирующих и наоборот. При проведении серийного ангиографического исследования при успешной тромболитической терапии тромба в окклюзированной артерии сначала происходит быстрое восстановление антеградного кровотока в зоне краевых тромботических масс (рис. 1.124а, б), располагающихся внутри просвета. После полного устранения внутрипросветного тромба на месте тромботической окклюзии выявляют расщепленную бляшку с нависанием фрагментов стеноза и неровными контурами (рис. 1.125). Это именно то морфологическое образование, которое вызвало агрегацию и образование тромба. И именно эта бляшка может привести к реинфаркту или развитию постинфарктной стенокардии на этапах реабилитации больного.
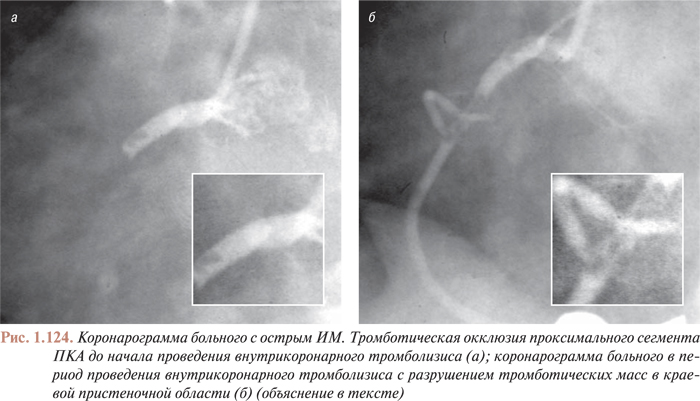
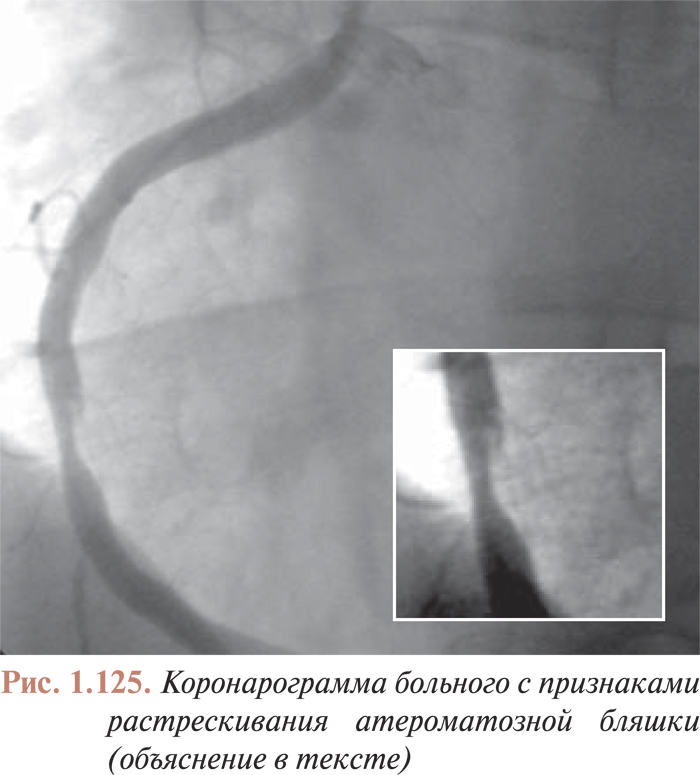
Однако остается неясным, как оценить воздействие тромболитика или первичной ангиопластики на интрамуральные тромбы (рис. 1.126). В случаях когда значительная часть тромба является интраинтимальной, просвет сосуда значительно сдавливается извне или возвышается интимальный клапан (препятствующий кровотоку), который сложно устранить при помощи первичной ЧТКА и еще сложнее лизировать тромболитиком. Однако путем первичного коронарного стентирования в период острого ИМ можно решить эту проблему.
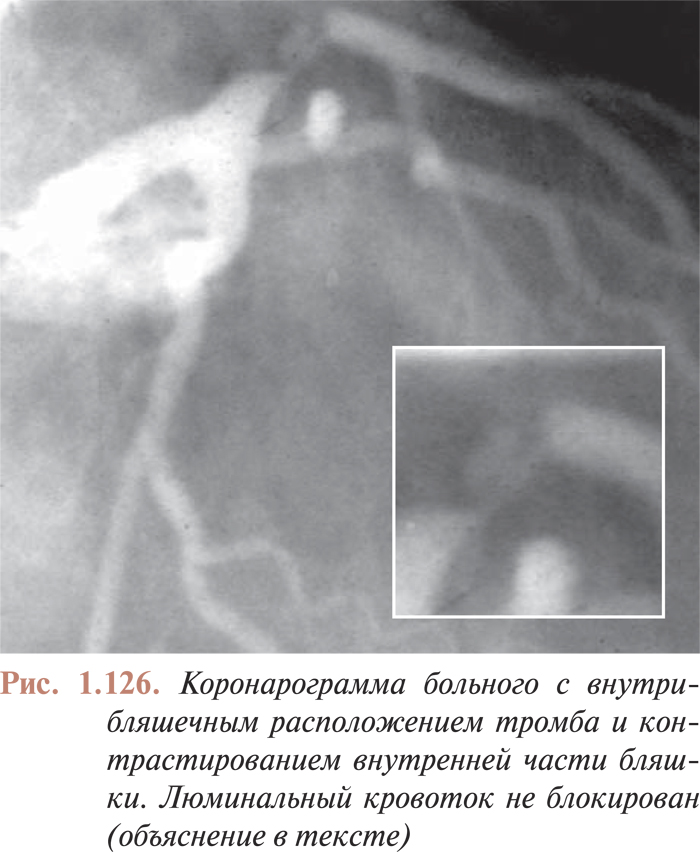
В случаях когда тромболизис комбинировали с ангиопластикой (возможно проведение спасательной или немедленной ЧТКА, см. далее), возможно образование больших субинтимальных гематом, сдавливающих просвет сосуда снаружи. Вероятно, что в некоторых случаях именно этот фактор снижает эффективность спасательной ангиопластики после неудавшегося тромболизиса и приводит к ишемическим осложнениям при проведении немедленной ЧТКА после успешного тромболизиса.
Осложненный рост атеросклеротической бляшки
Разрушение бляшки
При патологоанатомическом исследовании коронарных артерий лиц с коронарным атеросклерозом, которые умерли от некоронарогенных заболеваний (без АГ и сахарного диабета), хотя бы одна разрушенная атеросклеротическая бляшка была выявлена в 8,7% артерий. У тех умерших, в анамнезе которых были указания на сахарный диабет и АГ, количество треснутых бляшек увеличивалось до 16,7%. При внезапной кардиальной смерти лиц, умерших от ИМ и нестабильной стенокардии, количество расщепленных бляшек и внутрикоронарных тромбов значительно увеличивается. Эпизод разрыва бляшки неизбежно приводит к увеличению ее объема. Размер щели в бляшке после растрескивания — одна из детерминант образования внутрипросветных тромбов.
Восстановление бляшки
Репаративные процессы в стенке артерии при растрескивании и ангиопластике очень схожи.
Пролиферация гладкомышечных клеток быстро «пломбирует» малые бляшечные щели, «замыкая в себе» таким образом тромбы внутри бляшки. Организация и преобразование этих «замкнутых» тромбов в соединительнотканное образование сопровождаются прорастанием новых сосудов и фибробластов из соседней медии. Устойчивость тромботического материала внутри просвета артерии является фактором, определяющим в дальнейшем степень резидуального стеноза.
Если в течение 24–28 ч не наблюдается полного лизиса резидуального внутрипросветного тромба, то он является каркасом для увеличения как количества эндотелиальных, так и гладкомышечных клеток, что приводит к новому соединительнотканному образованию внутри просвета. При отдаленных наблюдениях пациентов с острыми коронарными синдромами отмечено, что после стабилизации разрушенной бляшки репаративные процессы принимают хронический характер и на повторных коронарограммах выявляются восстановленные сегменты артерий в месте ранее разрушенных стенозов (рис. 1.127, 1.128). Таким образом, исходами щелеобразования в бляшке могут быть (рис. 1.129):
- повышение степени стеноза;
- остаточные стенозы высокой степени с наличием одноканального просвета;
- наличие нескольких малых каналов (при реканализации внутрипросветного тромба);
- полная хроническая окклюзия
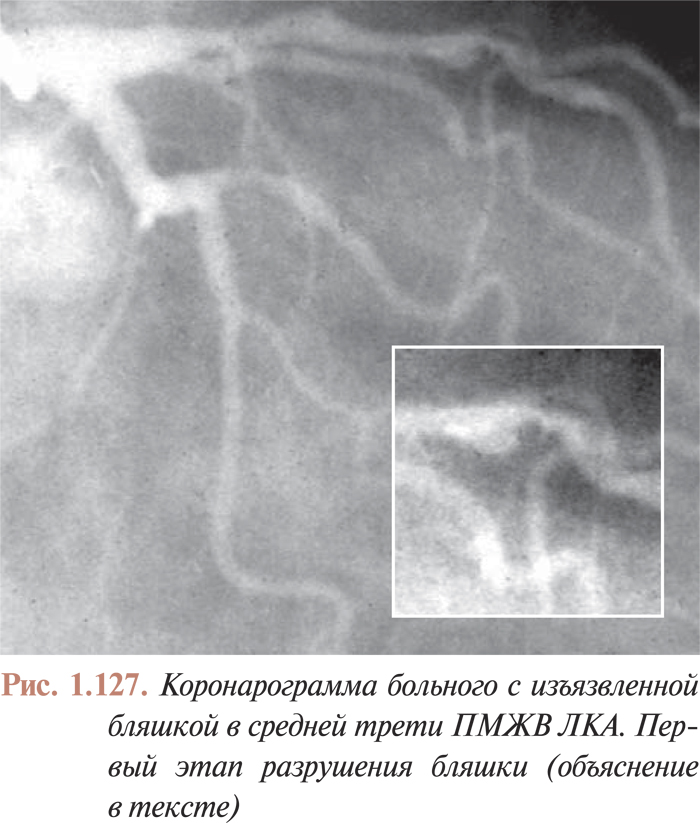
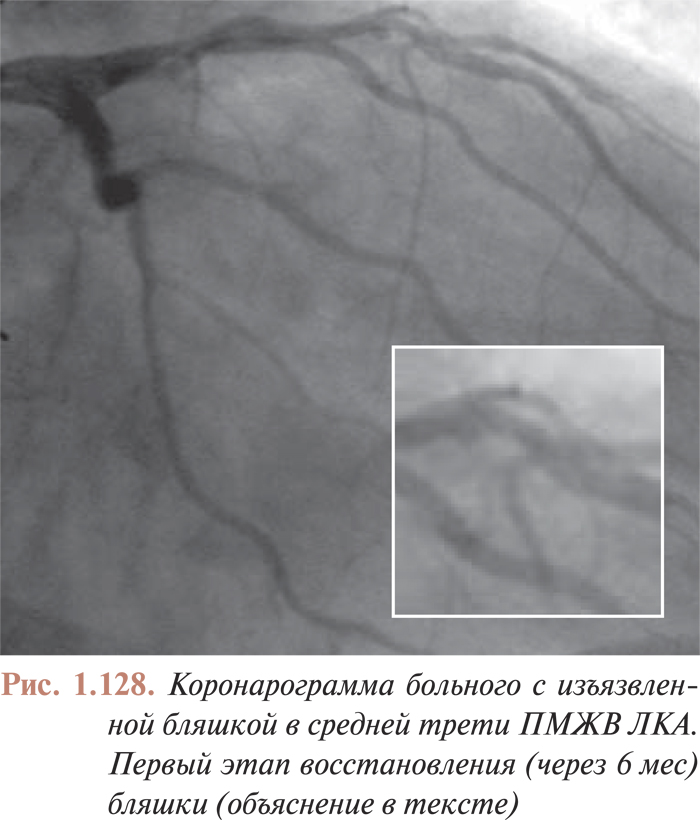
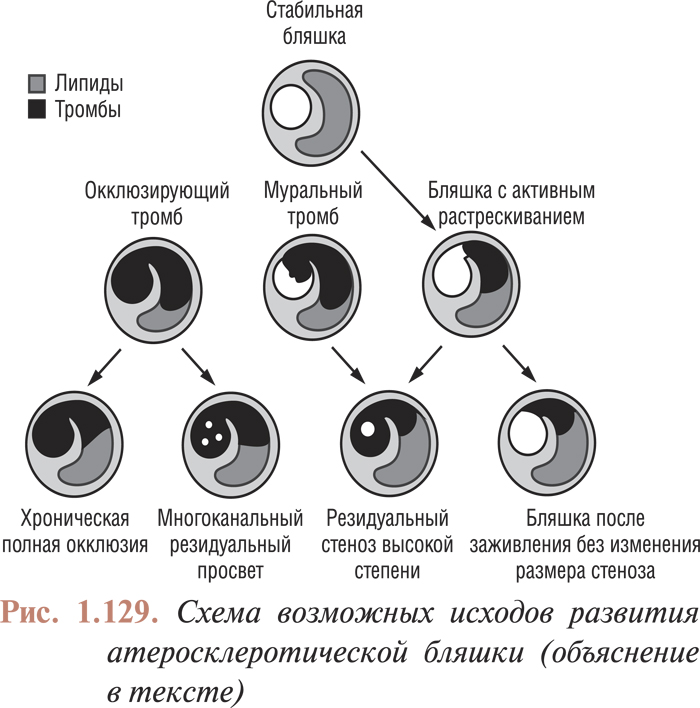
Связь между щелеобразованием в бляшке, кровоизлиянием и васкуляризацией через медию
Щелеобразование в бляшке неизбежно «открывает ворота» для прохождения крови из просвета сосуда в глубину бляшки. При этом в области щели скапливается большое количество тромбоцитов. Морфологические данные свидетельствуют, что внутренние слои бляшки должны быть открыты в просвет достаточно длительное время, необходимое для образования турбулентного тока крови внутри бляшки, чтобы накопить большое количество тромбоцитов.
Освобождение АДФ из эритроцитов является одним из факторов, инициирующих тромбообразование. На аутопсии в бляшках с большим количеством тромбоцитов всегда выявляют щель, соединяющую просвет сосуда с внутренними слоями бляшки. Эта форма кровоизлияния в бляшку больше известна под названием «диссекционное кровоизлияние».
Бляшки с интактным покрытием, без соединения липидных озер и просвета сосуда даже на серийных срезах могут содержать только незначительное количество эритроцитов, но не тромбоциты. Из соседней медии через ткани бляшки проходят тонкостенные капилляры, сквозь стенки которых эритроциты попадают в ткани бляшки. Гематомы внутри бляшки, которые достаточно велики, чтобы значительно сдавить просвет извне, всегда содержат большое количество тромбоцитов, которые проникают внутрь бляшки из просвета артерии через трещины(у) в стенке сосуда. При исследовании 86 разрушенных бляшек выявлено, что в 83% случаев разрыв интимы связывает просвет с озерами внеклеточных липидов. Наиболее частым местом разрыва было то, где покрытие эксцентрически расположенной богатой липидами бляшки соединялось непораженной частью стенки артерии.
Тромбогенез
Триада Вирхова (сосуд, поток и кровь) лежит в основе сложного многофакторного процесса, называемого тромбогенезом. Индивидуальная значимость каждого из этих факторов и их динамическое взаимодействие при образовании коронарного тромба отражены на рис. 1.130.
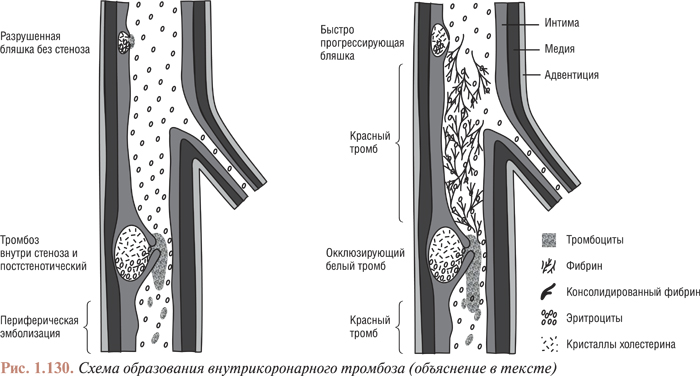
Морфология коронарных атеросклеротических бляшек варьирует в широких пределах, причем на одном краю находится «твердая», богатая коллагеном бляшка с едва определяемыми липидами, а на другом — «мягкая» бляшка с выраженным пулом внеклеточных липидов (полужидких при температуре 36–37 °С), отделенным от артериального просвета колпачком из фиброзной ткани. Мягкие бляшки значительно опаснее, поскольку у них выше чувствительность к повреждению: фиброзный колпачок, покрывающий липидный пул, может треснуть и тромбогенный материал попадает в кровоток.
Разрушение (растрескивание) атероматозной бляшки (см. рис. 1.130) — основную причину фатального коронарного тромбоза выявляют более чем в 75% случаев коронарного тромбоза. Роль разрыва бляшки как пускового механизма очевидна: в месте разрыва тромб состоит главным образом из скопления тромбоцитов, а атероматозный материал бляшки часто вытесняется и оказывается фиксированным глубоко в люминальном тромбе. Такая микроструктура является свидетельством того, что деструкции поверхности стеноза предшествовал процесс образования люминального тромба. Этот же механизм, по-видимому, лежит в основе развития нефатального коронарного тромбоза.
Механизмы, лежащие в основе внезапного разрыва поверхности бляшки, точно неустановлены. Разорванные бляшки часто выявляют в коронарных артериях пациентов, погибших как от коронарогенных, так и от некоронарогенных причин. Этот факт свидетельствует о том, что разрыв поверхности бляшки может быть и случайным событием в развитии и росте атеросклеротического поражения. Разорванные колпачки при патоморфологическом исследовании часто определяются как тонкие структуры с выраженной инфильтрацией пенистыми клетками. Возможно, данный факт определяет чувствительность этой части бляшки к механическим и гемодинамическим стрессам, которые связаны с АД и ЧСС пациента.
Однако разрушенная «мягкая» бляшка необязательно присутствует под коронарными тромбами. Примерно в 20% тромбов, исследуемых после смерти пациентов, выявляют только незначительное и поверхностное повреждение интимы, обычно в сочетании с выраженным атеросклеротическим стенозом. Большинство разрушенных бляшек дают начало небольшому пристеночному тромбу и только иногда развивается окклюзирующий коронарный тромб.
Стимуляторы тромбообразования
В ходе экспериментальных исследований высказано предположение, что количество и характер открывшегося в просвет артерии тромбогенного материала имеют первостепенное значение. Таким образом, можно предположить, что «обнаженные» структуры атеросклеротической бляшки и стенки артерии могут оказывать выраженное тромбогенное действие.
Кровь играет основную роль в равновесии между тромбозом и тромболизисом. Именно этот факт объясняет эффективность использования антитромбоцитарных и антикоагулянтных препаратов (ацетилсалициловой кислоты), тиклопидина и антикоагулянтов (гепарина, варфарина) у пациентов с высоким риском развития тромбоза. Наиболее изученным, наименее токсичным и широко известным препаратом группы антиагрегантов, применяемым при острых и хронических проявлениях ИБС, является ацетилсалициловая кислота. Эффективность этого препарата доказана при лечении больных с нестабильной стенокардией и острым ИМ, а также для профилактики острых осложнений в период проведения коронарной ангиопластики и стентирования. Однако ацетилсалициловая кислота препятствует только одному из существующих путей активации тромбоцитов, связанному с тромбоксаном А2. Таким образом препарат не может полностью предотвратить развития тромботических осложнений. Рациональным является сочетанное назначение ацетилсалициловой кислоты и антикоагулянтов, что тормозит активацию тромбоцитов и влияет на образование тромбина (рис. 1.131). Тромбин сам по себе является не только сильным активатором тромбоцитов, но и усиливает образование и сплетение волокон фибрина, обеспечивающих каркас для роста тромбоцитарных тромбов (см. рис. 1.131).
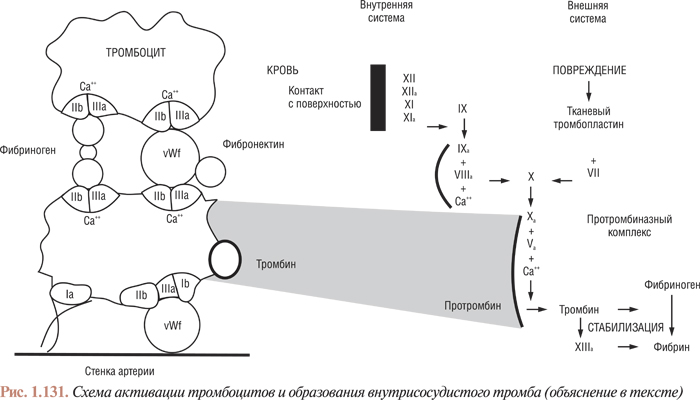
Гемодинамические силы тока крови
Хорошо известно, что стаз обусловливает коагуляцию и венозный тромбоз, но то обстоятельство, что точно такие же условия тока крови обусловливают артериальный тромбоз, не получило общего признания. В экспериментальных исследованиях установлено, что последствия разрыва бляшки зависят от степени исходного стеноза, а вероятность окклюзирующего тромбоза увеличивается с повышением степени стеноза до его разрушения. Однако стаз не всегда имеет решающее значение, поскольку многие атеросклеротические стенозы, которые вызывают тромбоз, не являются гемодинамически значимыми и не вызывают снижение кровотока. Однако при самых незначительных повреждениях стенки бляшки (артерии) наличие рядом расположенного стеноза может резко ухудшить клиническую ситуацию. Часто на ургентных коронарограммах у пациентов в период острого ИМ выявляем два стеноза (один за другим, «гуськом») в инфарктобусловившей коронарной артерии, что усугубляет риск развития тромбоза. Итак, стеноз обусловливает возникновение артериального тромбоза, его причина — большая скорость кровотока, которая повышается в суженном сегменте и приводит к локальному оттеснению тромбоцитов, что способствует их более пристеночному расположению в токе крови и индуцирует агрегацию in vitro и in vivo.
Образование тромба обычно происходит в пределах стеноза с нарушенной поверхностью. Он может также образовываться или распространяться в постстенотическом направлении, где разделение потока рециркуляция — турбулентность создает идеальные условия с точки зрения гемодинамики жидкости для прогрессирующего увеличения тромба за счет дальнейшей агрегации тромбоцитов (см. рис. 1.130). Однако процесс постстенотического тромбообразования, как правило, происходит до ближайшей крупной боковой ветви. Свободно плавающий «хвост» тромба, образованный далее по току крови от места стеноза и состоящий из агрегирующих тромбоцитов, указывает на то, что в основе этого явления лежит не застой крови, а другие тромбогенные факторы (основной из которых — разрушение атеросклеротической бляшки).
Патогенез и клиническая значимость тромбов, образующихся в пределах стенозов или дистальнее их, возможно, отличаются. Относительно небольшой компонент тромба, образовавшийся в пределах стеноза, по-видимому, является наиболее опасной его частью, поскольку самая сильная обструкция току крови происходит в наиболее суженной части стеноза; наиболее активный рост тромба до полной окклюзии наблюдается именно здесь; тромб, образовавшийся в пределах стеноза, является очень стойким образованием и может персистировать даже после успешного тромболизиса (рис. 1.132а, б). С другой стороны, свободно плавающий «хвост» тромба, вытягивающийся по направлению тока крови, имеет значительно более высокий потенциал в отношении эмболизации и периферической окклюзии дистальной части коронарного русла (см. рис. 1.132б).
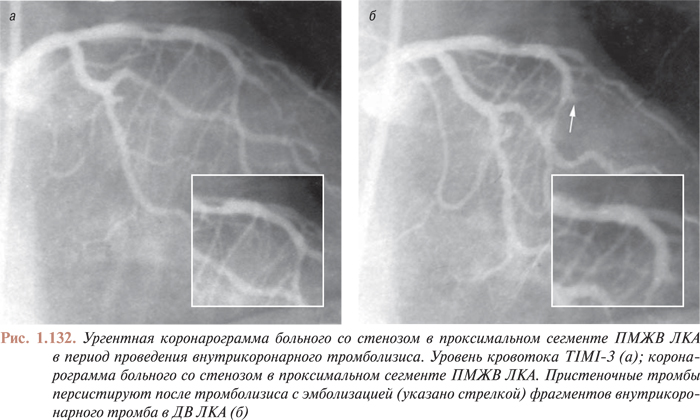
У >80% тромбов, сформированных в пределах стеноза, отмечают слоистую структуру из материалов разного «возраста», что свидетельствует об эпизодическом росте за счет многократных пристеночных отложений. У пациентов, погибших вскоре после начала острого сердечного приступа, тромбоциты являются главным компонентом самой свежей части тромба, расположенной центрально (ранний тромбоцитарный тромб), тогда как более «старые» тромбы располагаются ближе к сосудистой стенке и значительно богаче фибрином (консолидированный тромбоцитарный тромб). Таким образом, и тромбоциты, и фибрин играют роль в эволюции коронарного тромба: первичное препятствие току крови обычно создается вследствие агрегации тромбоцитов, но ранний тромбоцитарный тромб очень нестабилен и может быть легко разрушен током крови, пока фибрин не переплетет тромбоциты и тем самым не стабилизирует тромб. Именно поэтому пациентам с риском развития коронарного тромбоза показано назначение как антитромбоцитарных препаратов, так и антикоагулянтов. Результаты такого временного взаимодействия между тромбоцитами и фибрином согласуются с данными экспериментальных исследований и объясняют, почему «молодые» тромбы легче подвергаются лизису, чем «более старые». Именно по этой причине ранний тромболизис и первичная ЧТКА наиболее эффективны для разрушения тромбов.
Более того, эпизодический рост, по-видимому, чередуется с фрагментацией тромба и периферической эмболизацией, что ангиографически проявляется частым выявлением небольших фрагментов тромба в дистальной части коронарного русла (см. рис. 1.132а, б). Такие микроэмболы особенно часто возникают при внезапной ишемической смерти, которой предшествовала нестабильная стенокардия.
Таким образом, коронарный тромбоз — это динамический процесс, при котором тромбообразование нарастает и затухает в течение определенного периода, создавая интермиттирующую непроходимость коронарной артерии на фоне процессов тромбоза и тромболизиса.
Красный тромб (см. рис. 1.130) может быть длинным (несколько сантиметров), особенно в венозных трансплантатах, где нет боковых ветвей, и в правой коронарной артерии с ее немногочисленными боковыми дочерними артериями. Крупный тромб может оказаться труднолизируемым, что определяет один из механизмов, лежащих в основе безуспешного тромболизиса. Неудачные попытки открыть обтурированную тромбом артерию посредством тромболитической терапии еще не свидетельствует о том, что эта окклюзия является нетромботической. Однако серьезные «бляшечные катастрофы» могут приводить к появлению лоскутов интимы, выступающих в просвет артерии и препятствующих току крови. В данном случае коронарная ангиопластика с последующим стентированием инфарктобусловившей артерии может быть единственным способом восстановления коронарного кровотока.
Интервенционное лечение острого коронарного синдрома с элевацией сегмента ST
Первичное перкутанное коронарное вмешательство
Первичное перкутанное коронарное вмешательство (ПКВ) можно определить как вмешательство, направленное на «виновный» сосуд, выполненное в течение первых 12 ч от начала загрудинной боли или другой симптоматики, без предварительной (полной или фацилитативной) тромболитической или другой тромборастворяющей терапии. Первое первичное перкутанное коронарное вмешательство выполнено в 1979 г., то есть всего через 2 года после внедрения перкутанных коронарных вмешательств. До настоящего времени рандомизированные контролируемые исследования демонстрируют, что в качестве ургентного лечения первичное перкутанное коронарное вмешательство, по сравнению с тромболизисом, является лучшим видом лечения (лучшее раскрытие просвета сосуда, меньше случаев возвратной ишемии миокарда, меньшее количество реокклюзий, меньше повторных инфарктов, лучшая резидуальная функция ЛЖ и лучшие клинические результаты, включая меньшее количество инсультов). Представляется, что выполнение первичного перкутанного коронарного вмешательства обладает особенным преимуществом над тромболизисом у женщин и людей пожилого возраста (рис. 1.133).
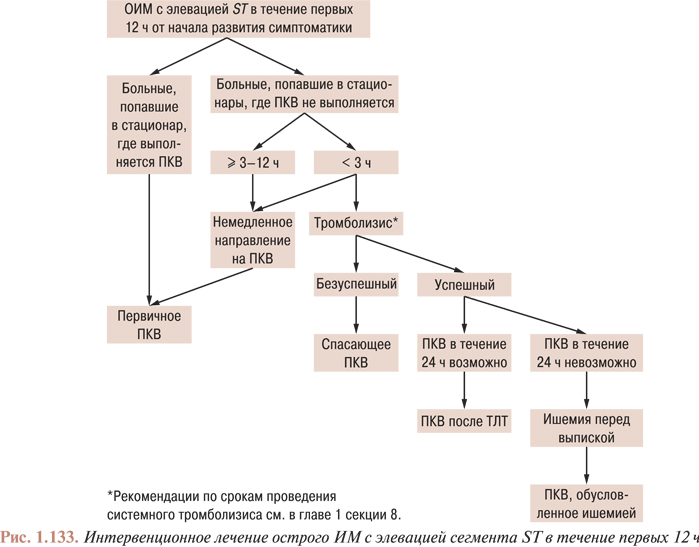
В течение первых 3 ч тромболизис может служить альтернативой перкутанному коронарному вмешательству. Если тромболизис противопоказан или больной относится к группе высокого риска, настоятельно рекомендуется немедленное направление на перкутанное коронарное вмешательство. Преимущество перкутанного коронарного вмешательства над тромболизисом в первые 3 ч заключается в предотвращении инсультов; в сроки от 3 до 12 ч — в лучшей защите миокарда и профилактике инсультов.
Проведен метаанализ 23 рандомизированных исследований, в которые вошли 7739 пациентов с острым ИМ, не имеющих противопоказаний к тромболитической терапии. Больные были разделены на группу первичного перкутанного коронарного вмешательства и группу тромболизиса. Результаты анализа показали, что первичное перкутанное коронарное вмешательство превосходит тромболизис по количеству смертей за короткий (4–6 нед) период наблюдения (9,3% против 7,0%; p=0,0002), количеству нефатальных повторных инфарктов (6,8% против 2,5%; p=0,0001), количеству инсультов (2,0% против 1,0%; p=0,0004) и по комбинированной конечной точке, включающей смерть, нефатальные реинфаркты и инсульты (14,5% против 8,2%; p<0,0001). Долгосрочное наблюдение продемонстрировало такие же результаты: количество смертей 12,8% против 9,6%; количество реинфарктов — 10,0% против 4,8%; комбинированная конечная точка (смерти, реинфаркты, инсульты) — 19% против 12%.
Наиболее выраженное различие между первичным перкутанным коронарным вмешательством и тромболизисом отмечено при сравнении уровней возвратной ишемии при краткосрочном (21% против 6%; p<0,0001) и долгосрочном наблюдении (39% против 22%; p<0,0001) (Рекомендации для первичного перкутанного коронарного вмешательства при остром ИМ с элевацией сегмента ST: IA).
Основными исследованиями, подтвердившими уровень доказательности IA для первичного перкутанного коронарного вмешательства, являлись PAMI, GUSTO-IIb, C-PORT, PRAGUE-1, PRAGUE-2 и DANAMI-2.
Направление больных для выполнения первичного перкутанного коронарного вмешательства
Нет сомнения в том, что пациенты, имеющие противопоказания к тромболизису, в первые 12 ч от начала симптоматики острого ИМ должны быть направлены в тот стационар, в котором возможно проведение коронарографии и первичного перкутанного коронарного вмешательства, поскольку первичное перкутанное коронарное вмешательство является для таких больных единственной возможностью быстро открыть артерию. Абсолютными противопоказаниями к тромболизису являются следующие состояния: диссекция аорты, перенесенный геморрагический инсульт, значительная недавняя травма или операция, желудочно-кишечное кровотечение в течение последнего месяца или другие известные расстройства, вызывающие кровотечение. Известно, что у пациентов, имеющих противопоказания к тромболизису, уровень показателей заболеваемости и смертность выше, чем у остальных. Формальная оценка первичного перкутанного коронарного вмешательства у этой подгруппы больных в рандомизированных контролированных исследованиях отсутствует, однако показано, что эта процедура в большинстве случаев выполняется успешно (Рекомендации для первичного перкутанного коронарного вмешательства у больных, имеющих противопоказания к тромболизису: IC).
Решение о направлении на первичное перкутанное коронарное вмешательство зависит от оценки клинического риска в каждом отдельном случае. Выбор между перкутанным коронарным вмешательством и тромболизисом часто диктуется ограничениями в информированности и задержкой транспорта. Исследованиями, в которых оценивалось возможное преимущество первичного перкутанного коронарного вмешательства перед тромболизисом в тех случаях, когда был необходим перевод больного из одной клиники в другую, являются Limburg (LIMI — LImburg Myocardial Infarction), PRAGUE-1, PRAGUE-2, Air-PAMI и DANAMI-2.
В исследовании DANAMI-2 впервые установлено достоверное преимущество первичного перкутанного коронарного вмешательства по оценке конечных точек (смерть, реинфаркт и инсульт), несмотря на отсрочки с направлением больных. Исследование PRAGUE-2 было досрочно прервано вследствие 2,5-кратного превышения смертности в группе тромболизиса среди больных, которым тромболизис проводили после 3 ч от начала появления симптоматики. Смертность в этой группе больных достигла 15,3%; в группе перкутанных коронарных вмешательств — 6% (p<0,02). Различия по смертности среди больных, которым тромболизис или первичное перкутанное коронарное вмешательство выполнялись до 3 ч, не было (7,4% при тромболизисе и 7,3% при первичном перкутанном коронарном вмешательстве). В этом исследовании у % больных тромболизис или перкутанное коронарное вмешательство были выполнены до 3 ч от начала симптоматики, поэтому шансов достичь конечных точек в исследовании PRAGUE-2 не было.
По данным исследований PRAGUE-2, STOPAMI-1 и -2, MITRA (Maximal Individual Therapy in Acute Myocardial Infarction) и MIR (Myocardial Infarction Registry), а также исследования CAPTIM (Comparison of Angioplasty and Prehospital Thrombolysis in Acute Myocardial Infarction), в котором тромболизис проводили на догоспитальном этапе, ранний тромболизис является жизнеспособной альтернативой. Таким образом, первичное перкутанное коронарное вмешательство и тромболизис, выполненные в первые 3 ч, дают одинаковые результаты по уменьшению зоны инфаркта и снижению смертности. Это подвергнутое сомнению превосходство первичного перкутанного коронарного вмешательства перед тромболизисом, проведенным в первые 3 ч, изучалось на основании комбинированного анализа в исследованиях STOPAMI-1 и -2. «Индекс спасения миокарда» при первичном перкутанном коронарном вмешательстве и тромболизисе, выполненных в первые 165 мин, не имел достоверного отличия (0,45 против 0,56), зато отмечено достоверное преимущество при выполнении этих процедур в сроки от 165 до 280 мин (0,29 против 0,57; р=0,003), а также после 280 мин (0,20 против 0,57).
Преимущество перкутанного коронарного вмешательства перед тромболизисом, связанное со временем (с увеличением времени проведения процедуры количество значительных неблагоприятных кардиальных событий после тромболизиса увеличивается, а при первичном перкутанном коронарном вмешательстве остается относительно стабильным), отмечено также в метаанализе PCAT (Primary Coronary Angioplasty versus Thrombolysis), рассматривавшем результаты лечения 2635 больных, и в регистрах MITRA и MIR, когда догоспитальная отсрочка превышала 3 ч. Таким образом, «поздно» не означает «слишком поздно».
Основная причина, по которой первичное перкутанное коронарное вмешательство имеет преимущество перед тромболизисом даже в первые 3 ч от начала инфаркта, — профилактика инсультов. Метаанализ 23 рандомизированных исследований показал, что количество инсультов после первичного перкутанного коронарного вмешательства в 2 раза ниже, чем после тромболизиса (1,0% против 2,0%). По данным метаанализа PCAT первичное перкутанное коронарное вмешательство, в сравнении с тромболизисом, уменьшает количество инсультов в первые 2 ч на 0,7%; в период от 2 до 4 ч — на 1,2%; в период с 4 до 12 ч — на 0,7%. Эти данные сопоставимы с результатами исследования CAPTIM, в котором количество инсультов при тромболизисе составило 1% (4/419); при первичном перкутанном коронарном вмешательстве — 0% (0/421). Метаанализ исследований, посвященный выбору лечения больных с острым ИМ продемонстрировал достоверное (на 1,2%) уменьшение количества инсультов: 1,88% при тромболизисе и 0,64% при первичном перкутанном коронарном вмешательстве. Таким образом, преимущество первичного перкутанного коронарного вмешательства перед тромболизисом в период от 3 до 12 ч от начала заболевания объясняется не только большей сохранностью миокарда при перкутанном коронарном вмешательстве, но и предотвращением инсультов (Рекомендации для первичного перкутанного коронарного вмешательства при остром ИМ в период от 3 до 12 ч от начала клиники: IC).
Результаты исследований PRAGUE-2 и DANAMI-2 особенно важны, поскольку в этих исследованиях показано, что первичное перкутанное коронарное вмешательство может успешно выполняться в обширных зонах частично урбанизированной Европы. Первичное перкутанное коронарное вмешательство при остром ИМ с элевацией ST и высоким риском осложнений может выполняться в больницах, где кардиальные операции не проводятся, поскольку этот метод является безопасным и эффективным (Рекомендации для стентирования для больных с острым ИМ и элевацией сегмента ST: IA).
Фацилитивное перкутанное коронарное вмешательство, спасающее перкутанное коронарное вмешательство, рутинная коронарография и перкутанные коронарные вмешательства после тромболитической терапии
Фацилитивное перкутанное коронарное вмешательство
Фацилитивное (облегченное) перкутанное коронарное вмешательство — это плановая интервенция, выполняемая в первые 12 ч от начала инфарктной симптоматики, вскоре после проведения тромборастворяющей (clot-dissolving) терапии, которая проводится для того, чтобы соединить разрыв между первым врачебным контактом и первичным перкутанным коронарным вмешательством. Термин «фацилитивное перкутанное коронарное вмешательство» иногда применяется для обозначения других ситуаций, однако должен применяться для обозначения изначально запланированного перкутанного коронарного вмешательства, проводимого вскоре после начала тромболизиса и/или введения ингибиторов гликопротеиновых рецепторов тромбоцитов IIb/IIIa. Таким образом, во всех исследованиях, которые проводят оценку концепции фацилитивного перкутанного коронарного вмешательства, всем больным, независимо от того, проводилось ли у них предварительное лечение, должно быть выполнено плановое первичное перкутанное коронарное вмешательство.
Первичное фацилитивное перкутанное коронарное вмешательство с тромболизисом
Результаты фацилитивного перкутанного коронарного вмешательства определялись в малых группах исследований PRAGUE-1 и SPEED (GUSTO-4 Pilot; SPEED — Strategies for Patency Enhancement in the Emergency Department). Показано, что применение половинной дозы t-PA (активатор тканевого плазминогена) перед плановым первичным перкутанным коронарным вмешательством приводит к увеличению количества пациентов с кровотоком TIMI-3 к моменту их поступления в катетеризационную лабораторию, однако этот результат не переходит в клиническое улучшение после перкутанного коронарного вмешательства (PACT (Pravastatin in Acute Coronary Treatment)). В исследовании BRAVE (Bavarian Reperfusion Alternatives Evaluation) больные перед тем как направляться на плановое первичное перкутанное коронарное вмешательство со стентированием, были рандомизированы на группу половинной дозы ретеплазы + абциксимаб и группу абциксимаба. Показано, что раннее введение ретеплазы и абциксимаба не приводит к уменьшению зоны инфаркта по сравнению с введением одного абциксимаба. Хотя концепция «низкой дозы тромболитика», комбинированного с клопидогрелом и ингибиторами гликопротеиновых рецепторов тромбоцитов IIb/IIIa, вводимых больным с острым ИМ и элевацией ST незадолго до стентирования, представляется интересной, исследования, посвященные фацилитивному перкутанному коронарному вмешательству, не продемонстрировали улучшения результатов или потенциального вреда. Большее количество данных дадут проводимые сейчас исследования ASSENT-4 (The ASsessment of the Safety and Efficacy of a New Treatment Strategy for Acute Myocardial Infarction), рандомизирующее больных на группы фацилитивного перкутанного коронарного вмешательства с применением тенектепласы и первичного перкутанного коронарного вмешательства с применением ингибиторов гликопротеиновых рецепторов тромбоцитов IIb/IIIa по необходимости, и FINESSE (Facilitated Intervention with Enhanced Reperfusion Speed to Stop Events), рандомизирующее больных на группы фацилитивного перкутанного коронарного вмешательства с применением ретеплазы, фацилитивного перкутанного коронарного вмешательства с применением абциксимаба и нефацилитивного первичного перкутанного коронарного вмешательства. Однако в настоящее время нет оснований рекомендовать фацилитивное перкутанное коронарное вмешательство с тромболизисом.
Первичное фацилитивное перкутанное коронарное вмешательство с ингибиторами гликопротеиновых рецепторов тромбоцитов IIb/IIIa
Исследование ADMIRAL (Abciximab before Direct Angioplasty and Stenting in Myocardial Infarction Regarding Acute and Long-term followup) показало, что в группе больных, получавших до проведения перкутанного коронарного вмешательства абциксимаб на догоспитальном этапе или в ургентном отделении, результаты лечения были лучше, чем у больных, которым это лекарство назначалось позднее, что показало преимущества «фацилитирования». В исследовании ON-TIME (Ongoing Tirofiban In Myocardial infarction Evaluation) больные были проспективно рандомизированы на группу раннего догоспитального начала введения тирофибана (ранняя группа) и группу, в которой тирофибан начинали вводить в катетеризационной лаборатории (поздняя группа). Во время первичной коронарографии определено не имеющее достоверности увеличение количества больных с кровотоком TIMI-3 в ранней группе (19% против 15%). Преимуществ после перкутанного коронарного вмешательства по данным коронарографии, а также по клиническим результатам не выявлено. Несмотря на то что исследования TIGER-PA pilot (Tirofiban Given in the Emergency Room before Primary Angioplasty) и BRIDGING (исследовали влияние абциксимаба на раннюю реперфузию при ИМ с элевацией сегмента ST до или во время первичной перкутанной коронарной ангиопластики) показали, что раннее введение тирофибана или абциксимаба улучшают ангиографические результаты лечения больных, которым проводилось первичное перкутанное коронарное вмешательство, и несмотря на то что метаанализ 6 рандомизированных исследований показал, что раннее введение ингибиторов гликопротеиновых рецепторов тромбоцитов IIb/IIIa улучшает проходимость артерий и наблюдается тенденция к улучшению клинических исходов, в настоящее время нет доказательной базы для того, чтобы рекомендовать первичное фацилитивное перкутанное коронарное вмешательство с ингибиторами гликопротеиновых рецепторов тромбоцитов IIb/IIIa.
Спасающее перкутанное коронарное вмешательство после неудачного тромболизиса
Спасающим называется перкутанное коронарное вмешательство, выполняемое в коронарной артерии, которая осталась закрытой, несмотря на проведенную тромболитическую терапию. Безуспешность тромболитической терапии можно предполагать в тех случаях, когда через 45–60 мин от начала тромболизиса больной продолжает жаловаться на боль в грудной клетке и на ЭКГ не определяется снижения элевации сегмента ST. Это впоследствии подтверждается коронарографически: наличие выраженного поражения в эпикардиальной артерии, сопровождающееся снижением коронарного кровотока (<TIMI 3). Ценность спасающего перкутанного коронарного вмешательства после безуспешного тромболизиса определяли в Кливлендском клиническом исследовании. В ЭТОМ исследовании одной группе больных после безуспешного тромболизиса назначали медикаментозное лечение (ацетилсалициловая кислота, гепарин, кардиальные вазодилататоры); больные другой группы получали такую же терапию, однако им было проведено перкутанное коронарное вмешательство. Спасающее перкутанное коронарное вмешательство достоверно снизило результаты в конечных точках (смерть или тяжелая СН) с 17% до 6%. Метаанализ исследований RESQUE I, RESQUE II, а также других клинических исследований продемонстрировал преимущество спасающего перкутанного коронарного вмешательства. С другой стороны, в исследовании MERLIN (Middlesbrough Early Revascularization to Limit INfarction) не выявили улучшения выживаемости в группе спасающего перкутанного коронарного вмешательства, хотя выживаемость без осложнений была выше, в основном за счет меньшего количества повторных реваскуляризаций. Однако серьезные ограничения исследования MERLIN сделали его недостаточно объемным. Недавно завершенное исследование REACT (Rapid Early Action for Coronary Treatment), в которое были включены больные с элевацией ST, не снизившейся в течение 90 мин от начала тромболизиса минимум в 2 раза от исходной, показало, что у больных с отсутствием реперфузии после тромболизиса результаты спасающего перкутанного коронарного вмешательства лучше, чем при проведении повторного тромболизиса или при медикаментозном лечении. В течение 6 мес наблюдения любые осложнения в группе спасающего перкутанного коронарного вмешательства были почти в 2 раза ниже, чем в группе повторного тромболизиса и консервативного лечения (например смерть — 9% против 18%). По сравнению с исследованием MERLIN в этом исследовании стентирование и ингибиторы гликопротеиновых рецепторов тромбоцитов IIb/IIIa применяли чаще; время от начала симптоматики ИМ до проведения спасающего перкутанного коронарного вмешательства было меньше. При спасающем перкутанном коронарном вмешательстве, как и при первичном перкутанном коронарном вмешательстве, стентирование имеет преимущество перед простой баллонной ангиопластикой (Рекомендации для спасающего перкутанного коронарного вмешательства для больных после безуспешного тромболизиса: IB).
Рутинная коронарография в ранний период после тромболизиса
В исследование ALKK (Arbeitsgemeinschaft Leitende Kardiologische Krankenhausarzte — исследование подобное GRACIA, которое проводили в Германии), в котором были рандомизированы 300 больных (первоначально планировалось 800) для проведения перкутанного коронарного вмешательства или медикаментозного лечения. Перед рандомизацией у 63% больных группы перкутанных коронарных вмешательств и у 57% группы медикаментозного лечения был проведен тромболизис. Перкутанные коронарные вмешательства в среднем проводили в течение первых 24 дней от развития ИМ с элевацией ST. Показатель выживаемости без осложнений в течение 1 года в группе перкутанных коронарных вмешательств имел тенденцию к улучшению по сравнению с группой медикаментозного лечения (90% против 82%). Это различие было обусловлено в основном различием в количестве повторных реваскуляризаций (5,4% против 13,2%; p=0,03).
Многоуровневый анализ результатов лечения больных, вошедших в исследование ASSENT-2, продемонстрировал более низкую смертность в тех странах, где уровень перкутанных коронарных вмешательств, выполняемых после тромболизиса, выше. Метаанализ результатов лечения 20 101 больного, вошедших в исследования TIMI 4, 9 и 10B, а также в исследование TIMI-II, показал, что у тех пациентов, которым перкутанное коронарное вмешательство было выполнено в период госпитализации, уровень внутригоспитальных реинфарктов был ниже (4,5% против 1,6%; p<0/001), так же, как и уровень смертности за 1 год (11,6% против 5,6%; p<0,001). Проспективное исследование, проведенное Шведским национальным регистром причин смерти, поддерживает применение инвазивной техники в ранние сроки острого ИМ. По данным исследования GUSTO-I, количество кардиальных катетеризаций и реваскуляризаций, выполненных за период стационарного лечения больных с острым ИМ в США выше, чем в Канаде. 5-летняя смертность среди этих больных в США составляет 19,6%; в Канаде — 21,4% (p=0,02). Таким образом, консервативное лечение таких больных, по сравнению с тактикой ранней реваскуляризации, дает негативный результат по показателю долгосрочной выживаемости.
Необходимость проведения рутинной ангиографии и при необходимости стентирования показана в 4 исследованиях: SIAM III (Southwest German Interventional study in Acute Myocardial infarction ), GRACIA-1, CAPITAL-AMI (Combined Angioplasty and Pharmacological Intervention Versus Thrombolytics Alone in Acute Myocardial Infarction) и LPLS (Leipzig Prehospital Lysis Study). Результаты этих 4 исследований представлены в табл. 1.43.
Таблица 1.43
Клинические исходы и размеры зоны инфаркта у больных, рутинно направляемых на коронарографию (РКГ) и при необходимости ПКВ, после тромболитической терапии (ТЛТ) по сравнению только с тромболизисом и инвазивной стратегией, обусловленной ишемией
| Показатель | SIAM-III | GRACIA-1 | CAPITAL-AMI | LPLS |
| Количество больных | 197 | 500 | 170 | 164 |
| Критерии включения | ОИМ с ST <12 ч | ОИМ с ST <12 ч | ОИМ с ST <6 ч | ОИМ с ST <4 ч |
| Выполнение ТЛТ | В больнице | В больнице | В больнице | До больницы |
| Тромболитический препарат | Ретеплаза (полная доза) | Ретеплаза (ускоренная доза) | Тенектеплас (полная доза) | Полдозы ретеплазы + абциксимаб |
| Время между ТЛТ и РКГ в группе ПКВ | <6 ч | <12 ч | Немедленное направление | Немедленное направление |
| Первичные конечные точки (ПКТ) | Смерть, ре-ИМ,
ишемия, реваскуляризация |
Смерть, ре-ИМ, реваскуляризация | Смерть, ре-ИМ, ишемия, инсульт | Зона инфаркта |
| Период наблюдения, мес | 6 | 12 | 1 | 6 |
| Результаты по ПКТ (ТЛТ/ ТЛТ + РКГ ± ПКВ) | 50,6%/ 25,6%* | 21,9%* | 21,4%/ 9,3%* | 11,6%/ 6,7%* |
| ПКТ достигнуты | Да | Да | Да | Да |
*p<0,05.
Таким образом, исследования SIAM III, GRACIA-1, CAPITAL-AMI и LPLS, а также анализ ASSENT-2, метаанализ исследований TIMI 4, 9, 10B, TIMI-II и GUSTO-1 показали, что реинфаркты являются «ахиллесовой пятой» тромболизиса. Таким образом, тромболизис, даже если он был проведен успешно, не должен рассматриваться как окончательный этап лечения: «сейчас лизис, затем стент» (Рекомендации для рутинной коронарографии и, при необходимости, перкутанного коронарного вмешательства после успешного тромболизиса: IB).
Перкутанные коронарные вмешательства после тромболизиса при наличии ишемии
Исследование DANAMI-1 было первым и единственным проспективным рандомизированным исследованием, в котором сравнивали инвазивную тактику (перкутанные коронарные вмешательства, АКШ) лечения больных с первым ИМ и элевацией ST, у которых до выписки из стационара были признаки кардиальной ишемии, с консервативной тактикой лечения таких больных. Первичные конечные точки (смерть, повторный инфаркт, развитие нестабильной стенокардии) при инвазивной тактике лечения были достоверно ниже: 15,4% против 29,5% в течение 1-го года наблюдения; 23,5% против 36,6% в течение 2 лет наблюдения и 31,7% против 44,0% в течение 4 лет наблюдения. Таким образом, больные с первым острым ИМ с элевацией ST, которым была проведена тромболитическая терапия и у которых до выписки наблюдались проявления миокардиальной ишемии, должны направляться на коронарографию и процедуру реваскуляризации, независимо от интенсивности проводимого медикаментозного лечения (Рекомендации для перкутанного коронарного вмешательства после тромболизиса при наличии ишемии: IB).
Перкутанные коронарные вмешательства для больных, которым процедуры по восстановлению перфузии проводили позже 12 ч
Часто больные обращаются за врачебной помощью поздно, вследствие чего реперфузионное лечение у них либо не проводится, либо неэффективно. Поздним реперфузионным лечением считаются перкутанные коронарные вмешательства или тромболизис, которые начинались после 12 ч от момента развития симптоматики острого ИМ. Тромболитическая терапия, применяемая в поздние сроки острого ИМ с элевацией ST, не уменьшает зоны инфаркта и не сохраняет функцию ЛЖ вследствие своей неэффективности в восстановлении просвета коронарной артерии.
Результаты исследований PCAT, PRAGUE-2 и CAPTIM позволяют с осторожностью заключить, что позднее перкутанное коронарное вмешательство, вероятно, может дать положительные результаты. Однако эти заключения не согласуются с результатами меньшего исследования TOAT (The Open Artery Trial), которое выявило неблагоприятный эффект позднего перкутанного коронарного вмешательства в ремоделировании ЛЖ. В исследовании DECOPI (DEsobstruction COronaire en Post-Infarctus) больные с первым Q-ИМ и закрытой инфарктобусловившей артерией были разделены на группу медикаментозного лечения и группу, в которой перкутанные коронарные вмешательства выполнялось через 2–15 сут от начала развития симптоматики. Первичными конечными точками были кардиальная смерть, нефатальный ИМ и желудочковая тахиаритмия. Хотя в 6-месячном наблюдении выявили достоверную разницу (5%) во ФВ ЛЖ в пользу инвазивной группы, а количество открытых коронарных артерий в инвазивной группе было достоверно больше (82,8% против 34,2%), наблюдение в течение в среднем 34 мес показало почти одинаковые результаты по первичным конечным точкам между группой медикаментозного лечения и группой перкутанных коронарных вмешательств (8,7% против 7,3% соответственно). Поскольку количество больных, участвовавших в исследовании, было меньше запланированного и, следовательно, количество осложнений также было меньше, то достоверность результатов этого исследования существенно снижена. Таким образом, хотя «гипотеза позднего открытия артерии» представляется привлекательной, для окончательных выводов необходимы результаты исследования OAT (Occluded Artery Trial). В настоящее время еще нет полного согласия по лечебным рекомендациям для этой группы больных.
Ургентное перкутанное коронарное вмешательство при кардиогенном шоке
Клинически кардиогенный шок определяется следующими показателями: падением САД <90 мм рт. ст, капиллярным блоком с давлением >20 мм рт. ст или сердечным индексом <1,8 л/мин/м2 (рекомендации Европейского кардиологического общества по ведению острого ИМ с элевацией ST). В этих ситуациях перкутанное коронарное вмешательство или хирургическое вмешательство являются процедурами, спасающими жизнь больного; их необходимо выполнять в кратчайшие сроки. В тех случаях когда обстоятельства не позволяют провести механическую реваскуляризацию или же ее можно выполнить только с большой отсрочкой, необходимо проводить тромболитическую терапию. Независимо от вида проводимого лечения, смертность от кардиогенного шока у женщин выше, чем у мужчин.
В 2 рандомизированных контролированных исследованиях (SHOCK (Should We Emergently Revascularize Occluded Coronary Arteries for Cardiogenic Shock) и SMASH (Swiss Multicenter trial of Angioplasty SHock)) оценивали раннюю (перкутанное коронарное вмешательство или АКШ) реваскуляризацию у больных с кардиогенным шоком, который возник в результате острой дисфункции ЛЖ при остром ИМ с элевацией сегмента S–T. Перкутанное коронарное вмешательство при кардиогенном шоке отличается от перкутанного коронарного вмешательства при остром ИМ, не сопровождающемся кардиогенным шоком, с элевацией ST двумя особенностями: 1) обычное временное окно для проведения перкутанного коронарного вмешательства (12 ч от начала симптоматики) должно быть расширено; 2) при многососудистом поражении обязательно должна быть рассмотрена возможность проведения многососудистого перкутанного коронарного вмешательства. Все исследования, посвященные первичному перкутанному коронарному вмешательству, рассматривали тактику ургентной реваскуляризации только одного инфарктобусловившего сосуда. Только при кардиогенном шоке рекомендуется выполнять перкутанные коронарные вмешательства в местах всех значительных повреждений. Обязательно должен быть рассмотрен вопрос баллонной контрпульсации. Если не удается выполнить сравнительно полную перкутанную реваскуляризацию, в этих случаях следует проводить шунтирующую операцию. В исследовании Benchmark Counterpulsation Outcome Registry (25 136 пациентов) внутрибольничная смертность среди больных, которым проводили только медикаментозное лечение, составила 32,5%; при перкутанном вмешательстве — 18,8%, при хирургическом вмешательстве — 19,2%. Необходимо помнить, что смертность среди больных с кардиогенным шоком при остром ИМ без элевации ST такая же, как и среди больных с кардиогенным шоком при остром ИМ с элевацией ST. Внутригоспитальная смертность у больных с кардиогенным шоком при остром ИМ остается высокой. Среди больных в возрасте старше 75 лет с острым ИМ, осложненном кардиогенным шоком, результаты лечения будут лучше ожидаемых в случае проведения раннего перкутанного коронарного вмешательства. В этой группе пациентов из тех 56%, которые выживают в стационаре, отмечается 75% выживаемость в течение 1 года. В последние годы отмечают увеличение количества реваскуляризаций среди больных с кардиогенным шоком, вероятно, вследствие участившегося направления больных в стационары, где проводят такие процедуры (Рекомендации для проведения ургентного перкутанного коронарного вмешательства больным с кардиогенным шоком: IC).
Минимизация отсрочки начала лечения
Существует единодушное мнение, что для всех видов интервенционного лечения пациентов с острым ИМ с элевацией ST (табл. 1.44), должны быть приложены все усилия, чтобы максимально уменьшить срок от начала развития загрудинной боли и другой симптоматики до начала безопасной и эффективной реперфузионной тактики лечения больных с острым ИМ и элевацией ST. Уменьшение общего времени ишемии является решающим не только при проведении тромболизиса, но и при выполнении первичного перкутанного коронарного вмешательства (рис. 1.134). Уменьшение сроков от начала симптоматики до начала лечения достоверно улучшает клинический исход, в то время как увеличение этих сроков ассоциируется с ухудшением перфузии миокарда, независимо от состояния эпикардиального кровотока. Усилия по минимизации отсрочки должны начинаться с повышения информированности населения и включать улучшение организации скоропомощной службы, как и оптимизацию проведения процедур в больницах и частных клиниках (см. рис. 1.134). Если предполагается выполнение первичного перкутанного коронарного вмешательства, все усилия должны быть направлены на то, чтобы время от первого контакта с врачом (от момента госпитализации) до перкутанного коронарного вмешательства составляло <90 минут, включая время «от двери до баллона». Время «от двери до баллона» может быть уменьшено при прямом направлении больных с острым ИМ и элевацией ST в катетеризационную лабораторию, минуя блок интенсивной терапии. Однако больным с более длительной отсрочкой также должно проводиться первичное перкутанное коронарное вмешательство, даже если время от начала симптоматики составляет 3 ч. Вопрос о проведении реперфузионной терапии с применением фибринолитиков второго — третьего поколения может быть рассмотрен только при вероятной значительной отсрочке начала первичного перкутанного коронарного вмешательства (>2–3 ч от момента поступления).
Таблица 1.44
Показания к ПКВ при ОКС с элевацией ST (острый ИМ с элевацией ST)
| Процедура | Показания | Класс рекомендаций и уровень доказательности | Рандомизированные исследования для уровня A или B |
| Первичное ПКВ | Больные с загрудинной болью или другой симптоматикой <12 ч; время от квалифицированного врачебного контакта до ПКВ <90; опытная процедурная бригада | IA | PAMI, GUSTO-IIB, C-PORT, PRAGUE-1 и -2, DANAMI-2 |
| Первичное стентирование | Стентирование во время первичного ПКВ | IA | Zwolle, Stent-PAMI, CADILLAC |
| Первичное ПКВ | При противопоказаниях к тромболизису | IC | — |
| Первичное ПКВ | Предпочтительнее тромболизиса, если время от начала симптоматики составляет >3 и <12 ч | IC | — |
| Спасающее ПКВ | Если тромболизис безуспешен в течение 45–60 мин от момента его начала | IB | REACT |
| Ургентное (многососудистое) ПКВ | При кардиогенном шоке, даже в сроки >12 ч (до 36 ч) с контрпульсатором | IC | — |
| Рутинная коронарография и, по возможности, ПКВ | До 24 ч после тромболизиса, независимо от наличия боли или других проявлений ишемии | IA | SIAM III, GRACIA-1, CAPITAL-AMI |
| ПКВ при ишемии после успешной ТЛТ | Внутрибольничная стенокардия и/или ишемия при (первом) остром ИМ, леченным с помощью ТЛТ | IB | DANAMI-1 |
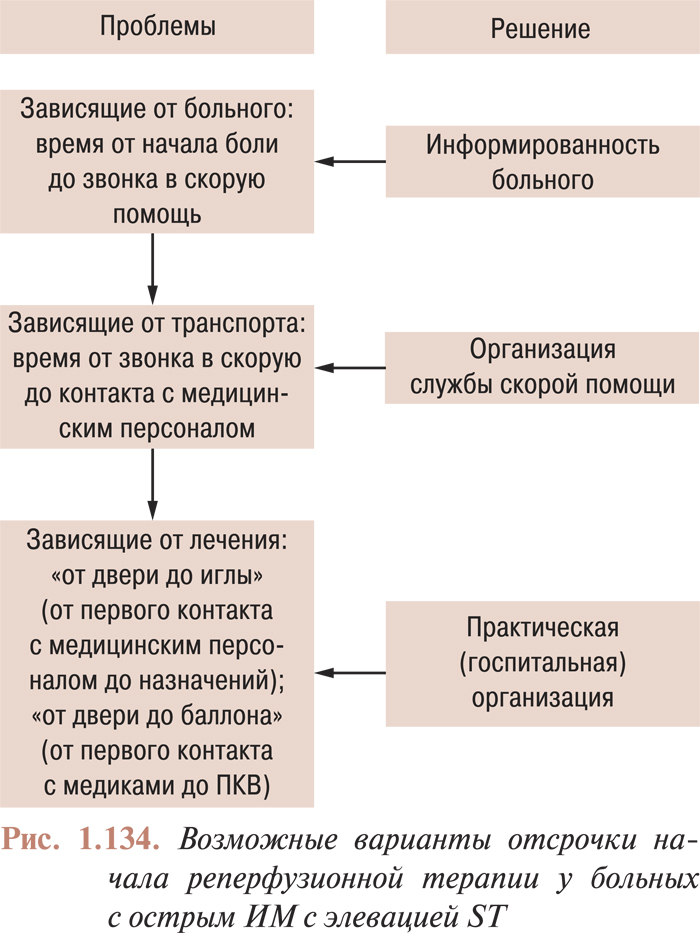
Отсрочка начала лечения зависит не столько от доклинической организации помощи (также как и внутрибольничной помощи), сколько от грамотности больных, которая позволяет минимизировать время от начала заболевания до звонка в скорую помощь.
Показания к перкутанному коронарному вмешательству при остром коронарном синдроме с элевацией ST (острый ИМ с элевацией ST)
Можно сделать вывод, что для больных с острым ИМ и элевацией ST первичное перкутанное коронарное вмешательство является операцией выбора, если пациенты находятся в клинике, где есть возможность выполнить перкутанное коронарное вмешательство и имеется опытный персонал. Больных, имеющих противопоказания к тромболизису, следует немедленно направить на первичное перкутанное коронарное вмешательство, поскольку только эта процедура позволяет открыть у них коронарную артерию. Ургентное перкутанное коронарное вмешательство с полной реваскуляризацией является процедурой, спасающей жизнь больным с кардиогенным шоком, и ее проведение должно быть рассмотрено в самые ранние сроки. В исследованиях, в которых больных направляли на первичное перкутанное коронарное вмешательство в специализированные кардиохирургические отделения, отметили, что, по сравнению с тромболизисом, первичное перкутанное коронарное вмешательство дает лучшие клинические результаты, несмотря на значительную отсрочку начала лечения от момента рандомизации. Преимущество первичного перкутанного коронарного вмешательства перед тромболизисом особенно выражено в тех случаях, когда первичное перкутанное коронарное вмешательство и тромболизис проводят между 3 и 12 ч от начала симптоматики. Это преимущество выражается в лучшей сохранности миокарда при выполнении первичного перкутанного коронарного вмешательства. Более того, при увеличении времени от начала заболевания до начала тромболизиса увеличивается количество значительных неблагоприятных кардиальных событий; увеличение времени при выполнении первичного перкутанного коронарного вмешательства не влияет на уровень значительных неблагоприятных кардиальных событий.
Обе реперфузионные тактики, применяемые в течение первых 3 ч, одинаково эффективно уменьшают зону инфаркта и снижают смертность. Таким образом, тромболизис все еще можно рассматривать как действенную альтернативу первичному перкутанному коронарному вмешательству, если его проводить в течение первых 3 ч от начала симптоматики. Первичное перкутанное коронарное вмешательство, по сравнению с тромболизисом, достоверно уменьшает количество инсультов. Поэтому с целью профилактики инсультов в первые 3 ч от начала симптоматики предпочитают проводить первичное перкутанное коронарное вмешательство, а не тромболитическую терапию. В сроки от 3 до 12 ч также предпочитают выполнять первичное перкутанное коронарное вмешательство, поскольку оно лучше спасает миокард и не осложняется таким количеством инсультов, как тромболизис. В настоящий момент нет доказательств, позволяющих рекомендовать фацилитивное перкутанное коронарное вмешательство.
В тех случаях, когда тромболитическая терапия неэффективна в течение первых 45–60 мин от ее начала, рекомендуется выполнять спасающее перкутанное коронарное вмешательство. Рекомендуется проведение рутинной коронарографии и при возможности перкутанное коронарное вмешательство в течение первых 24 ч после успешного тромболизиса даже при отсутствии симптоматики и доказуемой ишемии, поскольку эта тактика улучшает результаты лечения. Если проведение перкутанного коронарного вмешательства в первые 24 ч было невозможным, а у больных, несмотря на успешную тромболитическую терапию, имеются доказательства спонтанной или нагрузочной ишемии, пациентов необходимо направлять на коронарографию и реваскуляризацию, независимо от максимальной медикаментозной терапии.
ЛИТЕРАТУРА
- Albiero R., Hall P., Itoh A. et al. (1997) Results of a consecutive series of patients receiving only antiplatelet therapy after optimized stent implantation Comparison of aspirin alone versus combined ticlopidine and aspirin therapy Circulation, 95: 1 145-1 156.
- Alcan K.E., Stertzer S.H., Wallsh E. et al. (1983) The role of intra-aortic balloon counterpulsation in patients undergoing percutaneous transluminal coronary angioplasty. Am. Heart J. 105 (3): 527-530.
- Andrade J., Hiady V. (1987) Plasma protein absorption. The big twelve. In: Leonard E., Turitto V., Vroman L. (Eds.) Blood in Contact with Natural and Artificial Surfaces. New York Academy of Science? New York, 158-172.
- Anwar A., Mooney M.R., Stertzer S.H. (1990) Intra-aortic balloon counterpulsation for elective coronary angioplasty in the setting of poor left ventricular function. A two center experience. J. Invas. Cardiol., 1(4): 175-180.
- Ardehali A., Ports T.A. (1990) Myocardial oxygen supply and demand. Chest, 98: 699-705.
- Ayers S.M. (1988) The prevention and treatment of shock in acute myocardial infarction. Chest, 93(Suppl. I): 17S-21S.
- Ballantyne C.M., Verani M.S., Short D. (1987) Delayed recovery of severely «stunned» myocardium with the support of a left ventricular assist device after coronary artery bypass graft surgery. J. Am. Coll. Cardiol., 10 (3): 710-712.
- Barragan P., Samsous J., Silvestn M. et al. (1997) Coronary artery stenting without anticoagulation, aspirin, ultrasound guidance, or high balloon pressure prospective study of 1051 consecutive patients. Cathet. Cardiovasc. Diagn., 42: 367-373.
- Bavaria J.E., Furukawa S., Kreiner G. (1990) Effect of circulatory assists devices on stunned myocardium. Ann. Thorac. Surg., 49: 123-128.
- Bellinger R.L., Califf R.M., Mark D.B. (1988) Helicopter transport of patients during acute myocardial infarction. Am. J. Cardiol., 61: 718-722.
- Berger P.B., Bell M.R., Hasdai D. et al. (1999) Safety and efficacy of ticlopidine for only 2 weeks after successful intracoronary stent placement. Circulation, 99: 248-253.
- Berger R.L., Saini V.K., Long W. (1973) The use of diastolic augmentation with the intra-aortic balloon in human septic shock with associated coronary artery disease. Surgery, 74(4): 601-606.
- Bertrand M.E., Legrand V., Boland J. et al. (1998) Randomized multicenter comparison of conventional anticoagulation versus antiplatelet therapy m unplanned and elective coronary stenting. The Full Anticoagulation versus Aspirin and Ticlopidine (FANTASTIC) Study. Circulation, 98: 1597-1603.
- Bitti J.A., Strony J., Bnnker J.A. et al. (1995) Treatment with bivalirudin (Hirulog) as compared with heparin during coronary angioplasty for unstable or postinfarction angina Hirulog Angioplasty Study Investigators. N. Engl. J. Med., 333: 764-769.
- Bolooki H. (1989) Emergency cardiac procedures in patients in cardiogenic shock due to complications of coronary artery disease. Circulation, 79 (Suppl. l): l-137-l-148.
- Braunwald E., Gurfmkel E. (1999) Advances in unstable angina the role of low molecular weight heparins Introduction and Chairmen’s summary. Heart, 82 (Suppl. 1): II-121.
- Braunwald E., Kloner R.A. (1982) The stunned myocardium: Prolonged, postischemic ventricular dysfunction. Circulation, 66(6): 1146-1149.
- Braunwald E., Rutherford J.D. (1986) Reversible ischemic left ventricular dysfunction: Evidence for the «hibernating myocardium». J. Am. Coll. Cardiol., 8(6): 1467-1470.
- Buchwald A.B., Hammerschmldt S., Stevens J. et al. (1996) Inhibition of neointimal proliferation after coronary angioplasty by low molecular weight heparin (clivarine) and polyethyleneglycol hirudin. J. Cardiovasc. Pharmacol., 28: 481-487.
- Califf R.M., Ohman E.M. (1990) Reocclusion after thrombolytic therapy and percutaneous transluminal coronary angioplasty. Cardiac. Assists., 5(2): 1-6.
- CAPRIE Steering Committee A randomised, blinded trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE) (1996) Lancet, 348: 1329-1339.
- Clinical Application of Infra-Aortic Balloon Pump. Second Edition. Bolooki H. (Ed.) (1984) Futura Publishing Company Inc.
- Cohen M., Demers C., Gurfmkel E.P. et al. (1997) A comparison of low molecular weight heparin with unfractionated heparin for unstable coronary artery disease Efficacy and Safety of Subcutaneous Enoxapann in Non Q Wave Coronary Events Study Group. N. Engl. J. Med., 337: 447-452.
- Coller B. (1992) Platelets in cardiovascular thrombosis and thrombolysis In Fozzard et al. The Heart and Cardiovascular System New York, Raven Press, 219-273.
- Coller B.S. (1985) A new munne monoclonal antibody reports an activation dependent change in the conformation and/or microenvironment of the platelet glycoprotein IIb/IIIa complex. J. Clin. Invest., 76: 101-108.
- Coller B.S., Folts J.D., Scudder L.E. et al. (1986) Antithrombotic effect of a monoclonal antibody to the platelet glycoprotein IIb/IIIa receptor in an experimental animal model. Blood, 68: 783-786.
- Colombo A., Hall P., Nakamura S. et al. (1995) Intracoronary stenting without anticoagulation accomplished with intravascular ultrasound guidance. Circulation, 91: 1676-1688.
- Costa M.A., Sabat M., van der Giessen W.J. et al. (1999) Late coronary occlusion after intracoronary brachytherapy. Circulation, 100: 789-792.
- de Jaegere P., Mudra H., Figulla H. et al. (1998) Intravascular ultrasound guided optimized stent deployment Immediate and 6 months clinical and angiographic results from the Multicenter Ultrasound Stenting in Coronaries Study (MUSIC Study). Eur. Heart J., 19: 1214-1223.
- Demas C., Flancbaum L., Scott G. (1987) The intra-aortic balloon pump as an adjunctive therapy for severe myocardial contusion. Am. J. Emerg. Med., 5(6): 499-502.
- Emmerman C.L., Pinchak A.C., Hagen J.F. et al. (1989) Hemodynamic effects of the intra-aortic balloon pump during experimental cardiac arrest. Am. J. Emerg. Med., 7: 373-383.
- Eow molecular weight heparin during instability in coronary artery disease, Fragmin during Instability in Coronary Artery Disease (FRISC) study group [see comments] (1996) Lancet, 347: 561-568.
- Faxon D.P., Spiro T.E., Minor S. et al. (1994) Low molecular weight heparin in prevention of restenosis after angioplasty Results of Enoxaparin Restenosis (ERA) Trial. Circulation, 90: 908-914.
- Ferguson J., Waly H., Wilson J. (1998) Fundamentals of coagulation and glycoprotein IIb/IIIa receptor inhibition. Eur. Heart J., 19 (Suppl. D): D3-D9.
- Fisch C., DeSanctis R.W., Dodge H.T. et al. (1988) Guidelines for percutaneous transluminal coronary angioplasty. Circulation, 78(2): 486-502.
- Fischman D.L., Leon M.B., Baim D.S. et al. (1994) A randomized comparison of coronary stent placement and balloon angioplasty in the treatment of coronary artery disease. Stent Restenosis Study Investigators. N. Engl. J. Med., 331: 496-501.
- Folts J. (1995) Drugs for the prevention of coronary thrombosis from animal model to clinical trials. J. Cardiovasc. Drugs. Ther, 9: 31-43.
- Fuchs R.M., Brin K.P., Brinker J.A. et al. (1983) Augmentation of regional coronary blood flow by intra-aortic balloon counterpulsation in patients with unstable angina. Circulation, 68: 111-123.
- Funk M., Gleason J., Foell D. (1989) Lower limb ischemia related to the use of the intra-aortic balloon pump. Heart and Lung, 18: 542-552.
- Gawaz M., Neumann F.J., Ott I. et al. (1996) Platelet activation and coronary stent implantation Effect of antithrombotic therapy. Circulation, 94279-94285.
- George B.S. (1988) Thrombolysis and intra-aortic balloon pumping following acute myocardial infarction — Experience in four TAMI studies. Cardiac. Assists., 4(3): 1-6.
- Georgen R.F., Dietrick J.A., Pifarre R. (1989) Placement of intra-aortic balloon pump allows definitive biliary surgery in patients with severe cardiac disease. Surgery, 106(4): 808-814.
- Goods C.M., al Shaibi K.F., Liu M.W. et al. (1996) Comparison of aspirin alone versus aspirin plus ticlopidine after coronary artery stenting. Am. J. Cardiol., 78: 1042-1044.
- Goodwin M., Hartman J., McKeever L. et al. (1989) Safety of intra-aortic balloon counterpulsation in patients with acute myocardial infarction receiving streptokinase intravenously. Am. J. Cardiol., 64: 937-938.
- Gottlieb S.O., Brinker J.A., Borken A.M. et al. (1984) Identification of patients at high risk for complications of intra-aortic balloon counterpulsation: A multivariate risk factor analysis. Am. J. Cardiol., 53: 1135-1139.
- Gottlieb S.O., Chew P.H., Chandra N. (1986) Portable intra-aortic balloon counterpulsation: Clinical experience and guidelines for use. Cath. Cardiovasc. Diag., 12: 18-22.
- Grotz R.L., Yeston N.S. (1989) Intra-aortic balloon counterpulsation in high-risk cardiac patients undergoing non-cardiac surgery. Surgery, 106(1): 1-5.
- Gunnar R.M., Boudillon P.D.V., Dixon D.W. (1990) Guidelines for the early management of patience with acute myocardial infarction. J. Am. Coll. Cardiol., 16: 249-292.
- Gunnar R.M., Loeb H.S. (1983) Shock in acute myocardial infarction: Evolution of physiologic therapy. J. Am. Coll. Cardiol., 1: 154-163.
- Gurfmkel E.P., Manos E.J., Mejail R.I. et al. (1995) Low molecular weight heparin versus regular heparin or aspirin in the treatment of unstable angina and silent ischemia. J. Am. Coll. Cardiol., 26: 313-318.
- Hall P., Nakamura S., Maiello L. et al. (1996) A randomized comparison of combined ticlopidine and aspirin therapy versus aspirin therapy alone after successful intravascular ultrasound guided stent implantation. Circulation, 93: 215-222.
- Haycraft J. (1884) On the action of a secretion from the medicinal leech on the coagulation of blood. Proc. R. Soc. Lond. Ser. B., 36: 478-487.
- Kahn J.K., Rutherford B.D., McConahay D.R. (1990) Supported «high risk» coronary angioplasty intra-aortic balloon pump counterpulsation. J. Am. Coll. Cardiol., 51: 1151-1155.
- Kantrowitz A., Wasfie T., Freed P.S. et al. (1986) Intra-aortic balloon pumping 1967 through 1982: Analysis of complications in 733 patients. Am. J. Cardiol., 57: 976-983.
- Karsch K.R., Preisack M.B., Baildon R. et al. (1996) Eow molecular weight heparin (revipann) percutaneous translummal coronary angioplasty Results of a randomized, double blind, unfractionated heparin and placebo controlled, multicenter trial (REDUCE trial) Reduction of Restenosis After PTCA, Early Administration of Reviparin in a Double Blind Unfractionated Hepann and Placebo Controlled Evaluation. J. Am. Coll. Cardiol., 28: 1437-1443.
- Kereiakes D.J., Emcoff A.M., Miller D.P. et al. (1998) Abciximab therapy and unplanned coronary stent deployment favorable effects on stent use, clinical outcomes, and bleeding complications EPIEOG Trial Investigators. Circulation., 97: 857-864.
- Koch K.T., Piek J.J., de Winter R.J. et al. (1999) Two hour ambulation after coronary angioplasty and stenting with 6 F guiding catheters and low dose heparin. Heart, 81: 53-56.
- Kormos R.L. (1987) The role of the intra-aortic balloon as a bridge to cardiac transplantation. Cardiac. Assists., 3(2): 1-4.
- Kramer R.P. (1988) J. Helicopter- transported intra-aortic balloon pumping: Advanced technology made airborne. Cardiac. Assists., 4(2).
- Kuntz R., Baim D., Popma J. et al. (1997) Late clinical results of the stent anticoagulation regimen study (STARS) (abstract). Circulation, 96(Suppl.): I 594.
- Lablanche J.M., McFadden E.P., Meneveau N. et al. (1997) Effect of nadroparin, a low molecular weight heparin, on clinical and angiographic restenosis after coronary balloon angioplasty the FACT study Fraxiparine Angioplastie Coronaire Translummale. Circulation, 96: 3396-3402.
- Lane A.S., Woodward A.C., Goldman M.R. (1987) Massive propranolol overdose poorly responsive to pharmacologic therapy: Use of the intra-aortic balloon pump. Ann. Emerg. Med., 16 (12): 1381-1383.
- Lefkovits J., Topol E. (1999) Role of platelet inhibitor agents in coronary artery disease: In Topol E., (Ed.) Textbook of Interventional Cardiology 3rd edn Philadelphia WB Saunders, 3-24.
- Lembo N.J. (1989) Failed angioplasty and intra-aortic balloon pumping. Cardiac. Assists., 5(1): 5-7.
- Leon M.B., Baim D.S., Popma J.J. et al. (1998) A clinical trial comparing three antithrombotic drug regimens after coronary artery stenting Stent Anticoagulation Restenosis Study Investigators. N. Engl. J. Med., 339: 1665-1671.
- Leon M.B., Popma J.J., Gordon P.C. et al. (1998) A clinical trial comparing three antithrombotic drug regimens after coronary artery stenting Stent Anticoagulation Restenosis Study Investigators. N. Engl. J. Med., 339: 1665-1671.
- Lincoff A.M., Cahff R.M., Mohterno D.J, et al. (1999) Complementary clinical benefits of coronary artery stenting and blockade of platelet glycoprotein IIb/ IIIa receptors Evaluation of Platelet IIb/IIIa Inhibition in Stenting Investigators. N. Engl. J. Med., 341: 319-327.
- Maalej N., Folts J. (1996) Increased shear stress overcomes the antithrombotic platelet inhibitory effect of aspirin in stenosed dog coronary arteries. Circulation, 93: 1201-1205.
- Maccioli G.A., Lucas W.J., Norfleet E.A. (1988) The intra-aortic balloon pump: A review. J. Cardiother. Anesth., 2: 365-373.
- Mangano D.T., Browner W.S., Hollenberg M. (1990) Association of perioperative myocardial ischemia with cardiac morbidity and mortality in men undergoing noncardiac surgery. N. EngI. J. Med. 323(26): 1781-1788.
- Mehan V.K., Saizmann C., Kaufmann U. et al. (1995) Coronary stenting without anticoagulation. Cathet. Cardiovasc. Diagn., 34: 137-140.
- Mehran R., Popma J., Baim D. et al. (1998) Routine high pressure post stent dilatation did not influence clinical restenosis in STARS (abstract). J. Am. Coll. Cardiol., 31(Suppl.): 80A.
- Mercer D., Doris P., Salerno T.A. (1981) Intra-aortic balloon counterpulsation in septic shock. Can. J. Surg., 24(6): 643-645.
- Moliterno D. (1999) Anticoagulants and their use in acute coronary syndromes: In: Topol E, Textbook of Interventional Cardiology 3rd edn Philadelphia WB Saunders, 25-51.
- Nanns C., Hillegass W., Nelson C. et al. (1996) Relation between activated clotting time during angioplasty and abrupt closure. Circulation, 93: 667-671.
- Ohman M.E., Califf R.M., George B.S. et al. (1991) The use of intra-aortic balloon pumping as an adjunct to reperfusion therapy in acute myocardial infarction. Am. Heart J., 121: 895-901.
- Patrono C. (1994) Aspirin as an antiplatelet drug. N. Engl. J. Med., 330: 12871294.
- Pennington D.G., Swartz M.T. (1990) Mechanical circulatory support prior to cardiac transplantation. Sem. Thor.&Cardiovasc. Surg., 2(2): 125-134.
- Pepme C.J., Holmes D.R. Jr. (1996) Coronary artery stents American College of Cardiology. J. Am. Coll. Cardiol., 28: 782-794.
- Placebo controlled trial Randomised of effect of eptifibatide on complications of percutaneous coronary intervention IMPACT II Integnlin to Minimise Platelet Aggregation and Coronary Thrombosis II (1997) Lancet, 349: 1422-1428.
- Povenmire-lzor K., House M.A. (1989) Acute crack cocaine intoxication: A case study. Focus Crit. Care., 16(2): 112-119.
- Preiss J., Lecompte T., Ainot Y. (1996) Serial antiplatelet effects of combined treatment with ticlopidine and aspirin after stent implantation (abstract). Circulation, 94 (Suppl.)I: 685.
- Qumn M.J., Fitzgerald D.J. (1999) Ticlopidine and clopidogrel. Circulation, 100: 1667-1672.
- Randomised placebo controlled and balloon angioplasty controlled trial to assess safety of coronary stenting with use of platelet glycoprotein IIb/IIIa blockade The EPISTENT Investigators Evaluation of Platelet IIb/IIIa Inhibitor for Stenting (1998) Lancet, 352: 87-92.
- Rodnguez J., Fernandez Jurado A. et al. (1994) Ticlopidine and severe aplastic anemia (letter). Am. J. Hematol., 47: 332.
- Rupprecht H.J., Darius H., Borkowski U. et al. (1998) Comparison of antiplatelet effects of aspirin, ticlopidine, or their combination after stent implantation. Circulation, 97: 1046-1052.
- Schomig A., Neumann F.J., Kastrati A. et al. (1996) A randomized comparison of antiplatelet and anticoagulant therapy after the placement of coronary artery stents. N. Engl. J. Med., 334: 1084-1089.
- Serruys P.W., de Jaegere P., Kiemeneij F. et al. (1994) A comparison of balloon expandable stent implantation with balloon angioplasty in patients with coronary artery disease Benestent Study Group. N. Engl. J. Med., 331: 489-495.
- Serruys P.W., di Mario C., Piek J. et al. (1997) Prognostic value of Intracoronary flow velocity and diameter stenosis in the short- and long-terin outcomes of coronary balloon angioplasty: the DEVATE Study (Doppler Endpoints Balloon Angioplasty Trail Europe). Circulation, 96: 3369-3377.
- Serruys P.W., Herrman J.P., Simon R. et al. (1995) A comparison of hirudin with heparin in the prevention of restenosis after coronary angioplasty Helvetica Investigators. N. Engl. J. Med., 333: 757-763.
- Serruys P.W., van Hout B., Bonnier H. et al. (1998) Randomised comparison of implantation of hepann coated stents with balloon angioplasty in selected patients with coronary artery disease (Benestent II) [published erratum appears in. Lancet 1998, 352 1478]. Lancet, 352: 673-681.
- Shah P.B., Ahmed W.H., Ganz P. et al. (1997) Bivalirudin compared with heparin during coronary angioplasty for thrombus containing lesions. J. Am. Coll. Cardiol., 30: 1264-1269.
- Stemhubl S.R., Lauer M.S., Mukherjee D.P. et al. (1998) The duration of pretreatment with ticlopidine prior to stenting is associated with the risk of procedure related non Q wave myocardial infarctions. J. Am. Coll. Cardiol., 32: 1366-1370.
- Szto G., Lmnemeier T., Lewis S. et al. (1998) Safety of 10 days of ticlopidine after coronary stenting a randomized comparison with 30 days Strategic Alternatives with Ticlopidine in Stenting Study (SALTS) (abstract). J. Am. Coll. Cardiol., 31 (Suppl.): 352A.
- The EPILOG Investigators (1997) Effect of the platelet glycoprotein IIb/IIIa receptor inhibitor abciximab with lower heparin dosages on ischemic complications of percutaneous coronary revascularization. N. Engl. J. Med., 336: 1689-1696.
- Topol E.J., Cahff R.M., Weisman H.F. et al. (1994) Randomised trial of coronary intervention with antibody against platelet IIb/IIIa integrin for reduction of clinical restenosis: results at six months. The EPIC Investigators. Lancet, 343: 881-886.
- Topol E.J., Ferguson J.J., Weisman H.F. et al. (1997) Long term protection from myocardial ischemic events in a randomized trial of brief integrin beta 3 blockade with percutaneous coronary intervention EPIC Investigator Group Evaluation of Platelet IIb/IIIa Inhibition for Prevention of Ischemic Complication. JAMA, 278479-278484.
- Use of a monoclonal antibody directed against the platelet glycoprotem IIb/ IIIa receptor in high risk coronary angioplasty The EPIC Investigation (1994). N. Engl. J. Med., 330: 956-961.
- Van de Loo A., Nauck M., Noory E. et al. (1998) Enhancement of platelet inhibition of ticlopidine plus aspirin versus aspirin alone given prior to elective PTCA. Eur. Heart J., 19: 96-102.
- Van den Bos A.A., Deckers J.W., Heyndnck G.R. et al. (1993) Safety and efficacy of recombinant hirudin (CGP 39 393) versus heparin in patients with stable angina undergoing coronary angioplasty. Circulation, 88: 2058-2066.
- Wolvek S. (1989) The evolution of the intra-aortic balloon: The Datascope contribution. J. Biomaterials. AppI., 3: 527-542.