Холтеровское ЭКГ-мониторирование прочно вошло в клиническую практику. Без него в большинстве случаев невозможна качественная диагностика нарушений ритма сердца и контроль эффективности лечения. Этот метод является составной частью обследования пациентов с ИБС. В последнее время появилось много новых отечественных и зарубежных холтеровских систем, в которых используются разные протоколы исследования. Часто исследователи по-разному трактуют понятие нормы, неодинаково оценивают эффективность терапии и ухудшение состояния больных, как, например проявление проаритмогенного влияния лекарственных препаратов. Все это побуждало авторов разработать отечественные стандарты относительно проведения холтеровского ЭКГ-мониторирования в клинической практике.
СОЗДАНИЕ И РАЗВИТИЕ СИСТЕМ ЭКГ-МОНИТОРИРОВАНИЯ
В 1961 г. Norman J. Holter предложил новый метод регистрации ЭКГ и возможности передачи по радио ЭКГ, обобщив тем самым 25-летний опыт работы. На протяжении последующих 25 лет мы стали свидетелями усовершенствования этого исследовательского метода. За эти годы 40-килограммовый регистратор, который закреплялся на спине больного как рюкзак, претерпел значительные изменения и весит сейчас меньше 0,5 кг. Технические усовершенствования были направлены на улучшение качества записи ЭКГ, появилась возможность одновременной регистрации нескольких отведений ЭКГ, автоматического анализа. Усовершенствование аппаратуры позволило увеличить число параметров, которые регистрируются и анализируются: при проведении анализа нарушений ритма сердца появилась возможность количественного определения депрессии сегмента ST, оценки функции электрокардиостимулятора и вариабельности сердечного ритма в виде различных временных и спектральных параметров, автоматического измерения интервала Q‒T, а в последнее время появились аппараты, регистрирующие усредненные сигналы ЭКГ при большом усилении. Внедряется система передачи сигналов ЭКГ с помощью телефонной связи и запись информации «по требованию» на регистратор.
Учитывая поступление новой информации в отношении модификации метода и появление более широких возможностей интерпретации результатов, потребность в холтеровском мониторировании не может быть определена однозначно. Нами сделана попытка обобщить накопленные знания и кратко изложить показания к проведению холтеровского мониторирования ЭКГ.
ПОКАЗАНИЯ К ПРОВЕДЕНИЮ ХОЛТЕРОВСКОГО МОНИТОРИРОВАНИЯ ЭКГ
1. Наличие у больного жалоб, которые могут быть следствием нарушений ритма сердца (сердцебиение, эпизоды потери сознания, головокружение, перебои в работе сердца).
2. Оценка риска развития опасных для жизни аритмий у пациентов без вышеперечисленных жалоб при следующих патологиях:
а) ГКМП;
б) перенесенный ИМ, осложненный СН или нарушением ритма;
в) синдром удлиненного интервала Q‒T.
3. Оценка эффективности антиаритмической терапии или проявлений проаритмогенных эффектов.
4. Оценка работы электрокардиостимулятора.
5. Оценка эпизодов ишемии миокарда.
6. Оценка вариабельности сердечного ритма.
7. Оценка суточной динамики интервала Q‒T при подозрении на синдром удлиненного интервала Q‒T.
Следует отметить, что для оценки риска развития опасных для жизни аритмий (пункт 2) по мнению экспертов ACC и AHA холтеровское мониторирование малоинформативно:
1) у больных со стабильной стенокардией без нарушений ритма сердца и симптомов СН;
2) у больных с бессимптомным пролапсом митрального клапана;
3) у больных без симптомов с появлениями нарушений ритма сердца, вызывающими потерю сознания во время выполнения профессиональной деятельности, что может представлять угрозу для окружающих. В этих случаях вероятность регистрации нарушений ритма во время 24-часового мониторирования ЭКГ незначительна, то есть результат исследования не позволяет сделать достоверные выводы.
Оценивая эффективность лечения пациентов с аритмией, следует помнить, что существует естественная вариабельность желудочковой эктопической активности, когда количество экстрасистол может существенным образом изменяться в течение суток.
КРАТКИЕ ДАННЫЕ О ТЕХНИЧЕСКИХ АСПЕКТАХ ПРИБОРА ДЛЯ ПРОВЕДЕНИЯ СУТОЧНОГО МОНИТОРИРОВАНИЯ ЭКГ
Аппаратура, предназначенная для холтеровского мониторирования, должна быть обеспечена устройством для регистрации, воспроизведения, анализа и документирования результатов. Можно выделить две основные системы, которые используют для проведения мониторинга: традиционная, то есть с ускоренным анализом, и система анализа в реальном масштабе времени.
Регистрирующее устройство состоит из следующих элементов:
- электроды;
- провода, которые соединяют электроды с главным кабелем;
- главный кабель;
- прижимной сигнализатор;
- регистратор.
Электроды, применяемые для регистрации ЭКГ, должны соответствовать определенным требованиям: с одной стороны, они должны обеспечить стабильный и качественный прием сигнала, а с другой — не вызвать раздражения кожи при продолжительном контакте с ней. Наилучшую и стабильную проводимость имеют электроды из хлорида серебра, у которых их металлический центр соединен с кожей через насыщенную проводящим гелем губку. От каждого электрода отходит экранированный провод, идущий к регистратору. В классических регистраторах используется магнитная лента, в этом случае регистратор выполняет роль магнитофона, который носит во время исследования пациент. Регистраторы используют источники постоянного тока, батарейки или аккумуляторы. Скорость движения ленты в устройстве составляет 1 мм/с. Регистратор оборудован кнопкой сигнала инцидента для активной регистрации пациентом клинических симптомов.
Использование для записи ЭКГ электромагнитной ленты создает некоторые сложности:
1) величина кассеты с лентой ограничивает размеры регистратора;
2) лента требует соответствующей обработки перед каждым исследованием;
3) одна лента может быть использована 6‒7 раз;
4) обязательна постоянная очистка головок регистратора и воспроизводящего прибора;
5) ограниченность диапазона частот;
6) существует возможность фальсифицированной записи в случае нарушения движения ленты или ее низкого качества.
С учетом вышеизложенного в последнее время разработаны регистраторы, в которых магнитная лента заменена дисками с постоянной электронной записью. Цифровая запись гарантирует качество и достоверность данных.
После суточного мониторирования данные, зарегистрированные на ленте или в электронной памяти регистратора, передаются на стационарный прибор, который дает возможность воспроизведения и анализа ЭКГ. Стационарный прибор — это компьютер, который благодаря соответствующей программе предоставляет такие возможности, как:
1) воспроизведение суточной ЭКГ;
2) анализ суточной ЭКГ;
3) разные формы представления и документации суточной ЭКГ;
4) разные формы представления и документации результатов анализа ЭКГ.
Иллюстративно-документальные функции реализуются с помощью так называемых периферийных приборов: мониторов, принтеров и т.д.
В настоящее время используются разные способы проведения анализа ЭКГ:
1) автоматический анализ — использование соответствующей программы, которая самостоятельно, без участия оператора, определяет изменения ЭКГ и проводит оценку нарушений ритма;
2) ретроспективный анализ — изменения ЭКГ определяют автоматически и на первом этапе анализа контролируются и корригируются оператором, после чего происходит новый анализ записи;
3) проспективний анализ — во время анализа компьютер показывает бегущую ЭКГ, которую оператор может подтвердить или опровергнуть.
Окончательная достоверная оценка нарушений ритма не должна опираться только на результаты автоматического анализа.
УСТАНОВЛЕНИЕ РЕГИСТРАТОРА И ИНСТРУКТАЖ ПАЦИЕНТА
Для места наложения электродов выбирается участок грудной клетки с наименьшей подвижностью и небольшим количеством подкожной жировой клетчатки и малой толщиной мышц. Перед наложением регистратора при необходимости следует побрить используемые участки кожи. Электроды необходимо протереть 99% изопропанолом или ацетоном (не рекомендуется использовать спирт), а потом провести обработку кожи. Эта операция выполняется с помощью абразивной пасты. Электроды следует приклеить способом, гарантирующим их хорошее прилежание и не исключающим выдавливание массы электродного геля из губки, расположенной между кожей и металлической частью электрода. Накладывают электроды в местах, где не располагаются большие группы мышц, во избежание деформации сигнала во время обычной активности пациента, сокращения мышц, дыхательных движений.
При холтеровском мониторировании чаще всего используют модифицированные грудные отведения CS-1 и СМ-5. Запись, зарегистрированная в отведении СМ-5 (отрицательный электрод в правой подключичной области, положительный — в положении V5), приблизительно соответствует обычной ЭКГ в отведении V5, иногда также — во II стандартном отведении. В этом отведении лучше всего виден зубец R, который в норме выше, чем зубец Т. Таким образом, в этом отведении лучше всего анализировать нарушения сердечного ритма. В отведении СМ-5 также хорошо видны изменения сегмента ST, который отражает процессы реполяризации в переднебоковой стенке ЛЖ. Отведение CS-1 (отрицательный электрод в левой подключичной области, положительный — в положении V1) соответствует отведению V1. В этом отведении хорошо виден зубец Р, имеющий ключевое значение для диагностики суправентрикулярных нарушений ритма, а также для анализа нарушений AV- и внутрижелудочковой проводимости. Пример расположения электродов на грудной клетке пациента представлен на рис. 3.1.
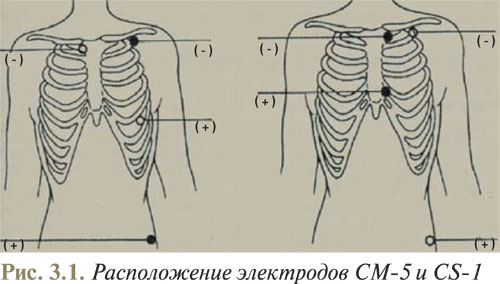
Обычно для диагностики нарушений ритма достаточно двух отведений, оси которых пересекаются под прямым или близким к нему углом. В то же время для диагностики ишемии миокарда необходимо использовать не менее трех отведений, которые могли бы как можно полнее отображать течение процессов реполяризации во всех стенках миокарда ЛЖ.
Места наложения электродов представлены в табл. 3.1.
Таблица 3.1
Места наложения электродов при проведении холтеровского мониторирования ЭКГ
| Отведение | Электрод «‒» | Электрод «+» | Резюме |
| CS-1 | Левая подключичная область по передней подмышечной линии | Положение V1 | Более четкая визуализация зубца Р; напоминает запись стандартной ЭКГ в отведении V1 и используется для анализа нарушений ритма и проводимости |
| CS-2 | Как описано выше | Позиция V2 | Соответствует отведению V2 стандартной ЭКГ и используется для диагностики ишемии миокарда передней стенки ЛЖ |
| CS-2 | Левая подключичная область на расстоянии примерно 1/3 ключицы от грудины | Позиция V2 | Используется для оценки функции двухкамерного электрокардиостимулятора |
| CS-3 | Левая подключичная область по передней подмышечной линии | Позиция V3 | Соответствует отведению V4 стандартной ЭКГ и используется для диагностики ишемии миокарда передней стенки ЛЖ |
| СМ-5 | Рукоятка грудины справа | Позиция V5 | Соответствует отведениям II и V5 стандартной
ЭКГ и используется для диагностики ишемии миокарда нижней (задней) стенки ЛЖ |
| IS | Левая подключичная область | Левый тазобедренный сустав | Соответствует III отведению стандартной ЭКГ и используется для диагностики ишемии миокарда нижней (задней) стенки ЛЖ |
| По Johnson | Паравертебральная область, грудные позвонки VI–VII | Позиция V1 или V2 | Соответствует III отведению стандартной ЭКГ и используется для диагностики ишемии миокарда нижней (задней) стенки ЛЖ |
| S1 | Рукоятка грудины справа | Позиция V6 | Используется для диагностики ишемии миокарда заднебазальных участков ЛЖ (по Слапаку — S1) |
| S2 | Рукоятка грудины слева | Позиция V6 | Используется для диагностики ишемии миокарда заднебазальных отделов ЛЖ (по Слапаку — S2) |
| S3 | Левая подключичная область | Позиция V6 | Используется для диагностики ишемии заднебазальных отделов миокарда ЛЖ (по Слапаку — S3) |
| CS-4 | Левая подключичная область | Левая среднеключичная линия, IV межреберье | Соответствует отведению V4 стандартной ЭКГ (отведение по Небу) и используется для диагностики ишемии миокарда верхушки сердца |
| CM-4 | Рукоятка грудины справа | Позиция V6 | Соответствует отведению II стандартной ЭКГ (отведение по Небу) и используется для диагностики ишемии миокарда передней стенки ЛЖ |
| Y | Левая парастернальная линия, второе межреберье | В области мечевидного отростка | Используется для диагностики ишемии миокарда задней части межжелудочковой перегородки |
К наклеенным электродам следует подключить нужные провода соответствующего цвета. Затем нужно прикрепить провода к грудной клетке пластырем. Дистальные концы проводов вставляют в разъемы на главном кабеле, который в свою очередь присоединяют к регистратору. Последний расположен в футляре, закрепленном на поясе пациента.
Для сопоставления зарегистрированной записи ЭКГ и действий, которые выполнялись пациентом во время исследования, а также изменения самочувствия, каждый больной ведет во время холтеровского мониторирования так называемый дневник пациента.
Дневник пациента
В дневнике необходимо отражать:
- Род занятий (сон, лечение, прогулка, прием пищи, вождение автомобиля, физическая нагрузка, психоэмоциональный стресс и др.)
- Симптомы заболевания (боль, ощущение покалывания, давления, удушье, сердцебиение, головокружение, общее недомогание, слабость).
- Применение лекарственных средств (название препарата и время приема).
- Указать время начала и окончания занятий и симптомов.
Пациенты с болью в области грудной клетки должны обращать внимание на следующие моменты:
- Характер боли: тупая, давящая, колющая.
- Боль появилась во время отдыха, нагрузки, эмоций, ночью.
- Боль исчезла самостоятельно (указать время).
- Боль исчезла после прекращения нагрузки (время).
- Боль исчезла после приема препаратов (время).
- Другие причины.
В начале каждого исследования пациент должен быть ознакомлен со следующей информацией:
- Время обращения в лабораторию для снятия регистрирующего устройства.
- Правила заполнения дневника пациента и показания к использованию кнопочного сигнализатора.
- Запрет на проведение водных гигиенических процедур на время исследования.
- Запрет на использование электрических подушек и покрывал.
- Запрет манипуляций с регистратором.
- Обязательный контроль за состоянием электродов и проводов и устранение дефекта в случае отклеивания электродов или отсоединения проводов.
ИСКАЖЕНИЕ ЭКГ ПРИ МОНИТОРИРОВАНИИ
ЭКГ-кривая является достоверным и (или) искаженным отображением биоэлектрической активности сердца. Не все явления, которые могут наблюдаться при воспроизведении холтеровской записи, являются результатом биоэлектрической активности сердца; часть из них, несущих ошибочную информацию, называется артефактами.
Наиболее частыми причинами артефактов являются:
- Плохая подготовка кожи обследуемого.
- Так называемый сухой электрод (самостоятельное высыхание геля, которым насыщена губка, создающая контакт кожи с металлом или высыхание геля в процессе наложения электрода).
- Плохой контакт между компонентами электрической цепи: кожа обследуемого — электрод — провод — главный кабель — регистратор.
- Нарушение проведения в проводе или в главном кабеле.
- Грязные или изношенные головки.
- Плохое качество магнитной ленты.
- Плохое размагничивание ленты.
- Неисправный источник тока.
- Неисправный регистратор.
Для предотвращения появления артефактов необходимо соблюдение следующих условий:
- Правильное выполнение методики наложения электродов.
- Соответствующая подготовка кожи перед наложением электродов.
- Использование только рекомендуемых электродов.
- Проведение контроля сопротивления на полюсах 2-полюсных электродов.
- Использование экранированных проводов и кабелей с их надежным соединением.
- Контроль надежности соединения системы отведений.
- Прикрепление регистрирующей системы способом, максимально исключающим возможность натяжения электродов, возникающую во время исследования.
- Контроль качества изображения ЭКГ на мониторе перед проведением исследования.
- Использование для записи только специальных, рекомендуемых производителем оборудования магнитных лент (при эксплуатации систем, нуждающихся в их использовании).
- Качественное размагничивание лент, использованных в предыдущих исследованиях.
- Очистка головки регистратора непосредственно перед каждым исследованием, а головки анализирующей системы — каждый день после выполнения анализа холтеровской записи.
- Использование специальных источников электропитания, рекомендуемых производителем.
- Контроль напряжения в источнике тока перед каждым исследованием.
- Ознакомление больного с методикой исследования, его целью и основными условиями.
РИТМ СЕРДЦА ЗДОРОВОГО ЧЕЛОВЕКА
Холтеровский мониторинг ЭКГ произвел революцию в оценке физиологического диапазона
нарушений ритма и проводимости. Оказалось, что границы нормы различаются в зависимости от возраста, пола, степени физической и психической активности исследуемого. Подытоживая выводы различных публикаций, посвященных этому вопросу для разных периодов жизни человека, назовем следующие характерные возрастные особенности сердечного ритма:
- грудные дети: дисфункция синусного узла;
- школьники: AV-блокада;
- лица молодого возраста: брадикардия;
- взрослые лица в возрасте <60 лет: единичные желудочковые экстрасистолы;
- лица в возрасте >60 лет: желудочковая экстрасистолия.
Минимальная частота синусового ритма на протяжении суток, чаще во время сна, отмечается у школьников и в юношеском возрасте, затем постепенно повышается с возрастом. Максимальная ЧСС на протяжении суток у детей грудного возраста достигает 220 уд./мин, у 13-летних детей — 200 уд./мин, у взрослых она снижается. Незначительно выраженная дисфункция синусного узла при проведении холтеровского мониторирования выявляется практически у всех здоровых пациентов. Чаще это наблюдается во время сна в фазу быстрых движений глазных яблок.
AV-блокаду I‒II степени типа Самойлова — Венкебаха довольно часто отмечают у детей, подростков и спортсменов короткими периодами в дневное время во время отдыха и в период ночного сна. Суправентрикулярную экстрасистолию выявляют приблизительно у 3/4 здоровых людей: у детей — в 13% случаев, у лиц молодого возраста — 60%, у лиц в возрасте старше 60 лет — в 90‒100% случаев, и практически у всех пациентов в возрасте >80 лет. У лиц в возрасте >80 лет без заболеваний сердца при холтеровском мониторировании ЭКГ эпизоды суправентрикулярной тахикардии регистрируют у каждого третьего больного.
Выявляемость желудочковой экстрасистолии у здоровых лиц по данным разных авторов колеблется от 40 до 80%. У детей и лиц в возрасте младше 20 лет единичные желудочковые экстрасистолы регистрируются приблизительно в 1/4 исследований, с возрастом частота регистрации желудочковой экстрасистолии и общее их количество в течение суток увеличивается. По мере старения организма повышается частота выявления более сложных желудочковых аритмий: полиморфных и парных желудочковых экстрасистол. По данным литературы, не подтверждается зависимость частоты выявления желудочковых нарушений ритма от курения, физической активности.
Нарушения ритма, регистрируемые у здоровых лиц при холтеровском мониторировании ЭКГ, представлены в табл. 3.2.
Таблица 3.2
Нарушения ритма, регистрируемые у здоровых лиц при проведении холтеровского мониторирования ЭКГ
| Нарушение ритма | Дети | Лица молодого возраста | Взрослые, лет | ||
| 31–40 | 41–60 | >60 | |||
| Ночная брадикардия c ЧСС <40 уд./мин | + | + | + | ||
| Ночная брадикардия c ЧСС 30–40 уд./мин | + | + | — | — | — |
| Синусовая аритмия | +++ | ++ | + | + | + |
| AV-блокада I степени | + | + | + | + | — |
| AV-блокада II степени типа Венкебаха* | + | + | — | — | — |
| Паузы между | |||||
| R–R >2 с* | + | + | + | + | + |
| R–R >3 c* | + | + | — | — | — |
| Желудочковая экстрасистолия: | |||||
| 10–50 экстрасистол за 24 ч | + | + | + | + | + |
| 50–100 экстрасистол за 24 ч | — | — | + | + | + |
| 100–500 экстрасистол за 24 ч | — | — | — | — | + |
| Полиморфные | — | + | + | + | + |
| Парные | — | — | — | — | + |
| Суправентрикулярная экстрасистолия: | |||||
| 50–100 экстрасистол за 24 ч | — | — | — | + | + |
| 100–1000 экстрасистол за 24 ч | — | — | — | — | + |
| Наджелудочковая тахиаритмия | — | — | — | — | + |
+ Симптом может наблюдаться у здоровых лиц; ++ симптом довольно часто наблюдается у здоровых лиц; +++ симптом наблюдается практически у всех здоровых лиц; — у здоровых лиц не наблюдается; *в основном во время сна. Прогностическое значение этих аритмий зависит от вида и степени выраженности.
ОЦЕНКА СИНУСОВОГО РИТМА
Условием распознавания синусового ритма на ЭКГ, зарегистрированной при проведении холтеровского мониторирования, является наличие положительных зубцов P. Изменения амплитуды зубцов P, часто выявляемых на холтеровской записи, являются преимущественно выражением дыхательных или позиционных изменений ЭКГ, но могут быть также признаком миграции водителя ритма по предсердиям. Если изменения амплитуды зубца P сопровождаются изменениями амплитуды других морфологических элементов ЭКГ, следует принять во внимание возможность дыхательных или позиционных влияний. Если изменения амплитуды зубцов P происходят изолированно, это может свидетельствовать о миграции водителя ритма по предсердиям.
Синусовая тахикардия
Синусовая тахикардия — ускорение синусового ритма на протяжении суток в зависимости от естественной активности человека. У здоровых лиц во время значительной физической нагрузки ЧСС может достигать 180 уд./мин. Физическая или психоэмоциональная нагрузка обычно вызывает постепенное ускорение синусового ритма. Внезапное, обычно не связанное с физическим или психоэмоциональным напряжением повышение частоты синусового ритма до 120, а иногда до 200 уд./мин, следует интерпретировать как пароксизм синусовой тахикардии. Характерной особенностью этой формы нарушения синусового ритма является неожиданное начало и неожиданное окончание при идентичности формы зубцов P во время приступа тахикардии и во время основного синусового ритма. Пароксизмальная синусовая тахикардия наблюдается преимущественно у людей среднего и более старшего возраста, обычно при органических заболеваниях сердца.
Синусовая брадикардия
Хотя нет конкретной нижней границы ЧСС при нормальном синусовом ритме, однако у взрослых пациентов замедление ЧСС до уровня <50 уд./мин. в активный период и <40 уд./мин. во время сна указывает на угнетение функции синусного узла, связанное с гиперваготонией или органическим повреждением его анатомической структуры. ЭКГ-картина синусовой брадикардии может быть обусловлена синоаурикулярной блокадой II степени с частотой проведения импульсов 1:2. Диагностика синоаурикулярной блокады в данном случае основывается на внезапном двукратном снижении ЧСС во время возникновения блокады и внезапном двукратном повышении ЧСС после исчезновения блокады.
Критерии диагностики дисфункции синусного узла:
- Постоянная синусовая брадикардия: на протяжении всего 24-часового периода мониторирования ЭКГ ЧСС не должна превышать 50 уд./мин.
- Синусовые паузы должны достигать 3‒6 с.
- Продолжительные или интермиттирующие периоды отказа синусного узла с замещающими ритмами AV-узла.
- Документированный синдром тахибрадикардии, особенно с восстановлением редкого синусового ритма спонтанно за суправентрикулярной тахикардией.
Существуют определенные сложности в дифференциальной диагностике безусловного поражения синусного узла и вегетативной дисфункции синусного узла вследствие повышения тонуса блуждающего нерва или снижения тонуса симпатического нерва. Вегетативная дисфункция синусного узла может быть крайним проявлением повышенного тонуса блуждающего нерва у лиц молодого возраста, особенно у спортсменов. Отличительной особенностью синусовой брадикардии вследствие повышения тонуса блуждающего нерва является наличие синусовой аритмии на вдохе, когда уменьшается интервал R‒R и увеличивается продолжительность интервала P‒Q. В случае поражения синусного узла вдох не влияет на частоту ритма. Важное значение в диагностике имеет изучение циркадного ритма. Отношение ЧСС день/ночь при синусовой брадикардии, вызванной повышением тонуса блуждающего нерва, составляет >1,0, а у больных с синдромом слабости синусного узла <1,0. Также для диагностики синдрома слабости синусного узла используют показатели вариабельности сердечного ритма: SDNN, SDANN, SDNNind., которые при этой патологии снижены (детальная информация о данных показателях приведена в главе 4 секции 5).
Синусовая аритмия
Нерегулярность синусового ритма с укорочением или удлинением интервалов P–P хотя бы на 10% относительно времени предыдущего цикла наблюдается у всех исследуемых пациентов. Изменение длительности интервалов P–P в пределах от 50 до 100% часто появляется во время сна у молодых пациентов, значительно реже — в среднем и старшем возрасте. Для врача, оценивающего холтеровскую запись, синусовая аритмия с большими колебаниями длительности отдельных интервалов P–P представляет сложность при дифференциальной диагностике с кратковременным отказом синусного узла. Если на фоне синусового ритма с длительностью основного цикла, например 0,75 с, возникает пауза 1,7 с между очередными зубцами Р, то согласно критериям, используемым в стандартной ЭКГ, диагностируется отказ синусного узла, поскольку: 1) зубец Р синусового происхождения не зарегистрирован в период больший, чем 2 интервала P–P основного ритма; 2) пауза не была кратной продолжительности основного цикла. Однако, если для синусового ритма в данном исследовании характерны значительные колебания длительности интервала P–P, то синусовая аритмия диагностируется даже тогда, когда появляются периоды удлинения или укорочения основного цикла сердца больше чем на 100% длительности предыдущего цикла.
Синоаурикулярная блокада
Синоаурикулярная блокада характеризуется двумя типами на ЭКГ: по типу Мобитц I и Мобитц II. При проведении холтеровского мониторирования наибольшая сложность заключается в диагностике синоаурикулярной блокады с периодами Венкебаха. ЭКГ-картина синоаурикулярной блокады II степени с периодами Венкебаха зависит от соотношения числа проведенных к предсердиям синусовых импульсов относительно заблокированных синусовых импульсов. ЭКГ-картина синоаурикулярной блокады с периодами Венкебаха должна соответствовать трем основным критериям:
1) постепенное укорочение интервалов P–P перед выпадением комплекса Р–QRS–T, аналогичное постепенному укорочению интервалов R–R в классических периодах Венкебаха в AV-узле;
2) продолжительность интервала с выпадением комплекса Р–QRS–T короче, чем продолжительность двух интервалов P–P основного ритма;
3) продолжительность интервала P–P после периодов Венкебаха больше, чем продолжительность интервала P–P перед выпадением комплекса Р–QRS–T.
При оценке холтеровской записи наибольшие диагностические сомнения вызывают одиночные циклы периодов Венкебаха, появляющиеся спорадически на протяжении суток, обычно в ночное время.
НАРУШЕНИЕ AV-ПРОВОДИМОСТИ
Отображением AV-проводимости на ЭКГ является интервал P–Q. У взрослых пациентов в норме время проведения импульса через правое предсердие, AV-узел, пучок Гиса и волокна Пуркинье находится в пределах 0,12–0,20 с, а у лиц в возрасте старше 50 лет — в пределах 0,12–0,23 с. Внезапное удлинение интервала P–Q более чем на 0,04 мс относительно длительности предыдущего интервала P–Q может быть интерпретировано как появление нарушения AV-проводимости, даже если величина интервала P–Q при этом не превышает верхней границы нормы. Принципы диагностики AV-блокады всех степеней такие же, как при обычной ЭКГ.
Синдром преждевременного возбуждения желудочков
Укороченный, <0,12 с, интервал P–Q в сочетании с Д-волной и расширением комплекса QRS является одной из характерных особенностей синдрома преждевременного возбуждения желудочков. Регистрация во время холтеровского мониторирования периодического укорочения интервала P–Q <0,12 с может быть проявлением:
1) интермиттирующего синдрома преждевременного возбуждения желудочков с периодической блокадой дополнительного пути проведения;
2) повышения тонуса симпатического отдела вегетативной нервной системы и ускорения ритма сердца во время физической и эмоциональной нагрузки;
3) AV-диссоциации; при одинаковой частоте обоих интермиттирующих ритмов комплекс QRS эктопического ритма может регистрироваться непосредственно после зубца Р синусового происхождения;
4) изменения водителя ритма; зубец Р эктопического ритма может быть положительным в отведении СМ-5; незначительные изменения формы зубца Р могут не приниматься во внимание и быть расценены как позиционные.
СУПРАВЕНТРИКУЛЯРНЫЕ АРИТМИИ
При холтеровском мониторировании наличие суправентрикулярных аритмий оценивается по:
1) количеству и времени возникновения эпизодов сердцебиения, вероятно связанных с суправентрикулярной аритмией;
2) характеристике аритмии;
3) функции синусового узла;
4) связи тахикардии с физической активностью;
5) эффективности терапевтических или хирургических методов лечения;
6) AV-проводимости.
Предсердная экстрасистолия
В случае регистрации предсердных экстрасистол необходимо обратить внимание на морфологию зубца Р, который отличается от синусового Р. За зубцом Р предсердной экстрасистолы регистрируется комплекс QRS, похожий на комплекс при синусовом ритме с нормальным проведением. Иногда сложно различить зубец Р предсердной экстрасистолы, поскольку он «спрятан» в предшествующем зубце Т. Интервал P–R предсердной экстрасистолы >0,11 с. Иногда зубец Р не проводится, что сопровождается паузой. Блокированные предсердные экстрасистолы — это наиболее частая причина пауз. Если зубец Р предсердных экстрасистол отделить не удается, ритм может быть принят за синусовую брадикардию.
Предсердная тахикардия
При характеристике наджелудочковых аритмий следует учитывать несколько факторов, характеризующих аритмию. Прежде всего, необходимо охарактеризовать стойкость тахикардии. Пароксизмом тахикардии принято считать >5 последовательных наджелудочковых комплексов с ЧСС >100 уд./мин. Среди наджелудочковых тахикардий принято выделять пароксизмальную предсердную, которая, как правило, характеризуется нормальной AV-проводимостью. Однако возможна пароксизмальная предсердная тахикардия с AV-блокадой I–II степени. Среди пароксизмальных форм предсердной тахикардии выявляют атипичные формы, например экстрасистолическую форму Gallаvardin. Эта форма отличается от классической обратимо-рецидивирующим характером.
При анализе тахикардии следует указать ее продолжительность, общее количество пароксизмов, аберрантность желудочковых комплексов и, по возможности, циркадный характер аритмии.
Критерии диагностики трепетания предсердий
Это организованный, регулярный, быстрый ритм предсердий (около 300 уд./мин при типичной форме). Волны f, указывающие на трепетание, быстрые и регулярные и имеют характерную конфигурацию в виде пилы. Частота таких зубцов в типичных случаях составляет <200 уд./мин, особенно при применении антиаритмической терапии. При типичном трепетании с частотой 300 уд./мин одна из двух волн f обычно блокируется в области AV-соединения, приводя к возникновению регулярного ритма желудочков в пределах 150 уд./мин. Может также существовать более высокая степень блокады: 4:1, 6:1, 8:1 и выше, особенно при приеме препаратов, замедляющих AV-проводимость. Конфигурация комплекса QRS обычно такая же, как и при основном ритме. Если желудочковый комплекс широкий, то это происходит вследствие аберрантной проводимости.
Критерии диагностики фибрилляции предсердий
Диагностика фибрилляции предсердий с помощью метода холтеровского мониторирования основывается на совокупности ряда критериев ЭКГ:
1) отсутствие зубцов Р, которые заменены многочисленными f-волнами различной амплитуды и конфигурации с частотой 400–700 уд./мин;
2) разная продолжительность интервалов R–R;
3) комплексы QRS часто неодинаковы по амплитуде;
4) ЧСС обычно составляет 100–180 уд./мин, но может достигать ≥200 уд./мин. При ЧСС >210 уд./мин и наличии комплексов QRS ≥0,12 с вероятен WPW-синдром (рис. 3.2).
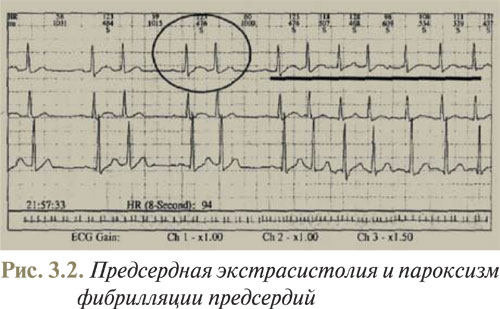
Постоянная форма фибрилляции предсердий
Большинство больных с постоянной формой фибрилляции предсердий требуют снижения частоты желудочковых сокращений. Оптимальной является частота желудочковых сокращений 60–80 уд./мин; тем не менее на практике у большинства пациентов снижение частоты желудочковых сокращений в покое <80 уд./мин. оказывается недостаточным и даже сопровождается ухудшением состояния гемодинамики.
Частота желудочковых сокращений у больных с фибрилляцией предсердий рассматривается как контролируемая, когда:
1) средняя частота желудочковых сокращений в покое не превышает 80–90 уд./мин;
2) во время субмаксимальной нагрузки — 120 уд./мин;
3) при проведении холтеровского мониторирования ЭКГ средняя частота желудочковых сокращений в час не более 80 уд./мин;
4) нет эпизодов, когда на протяжении 1 ч средняя частота желудочковых сокращений превышает 100 уд./мин.
Критерии проаритмогенных эффектов антиаритмических препаратов при лечении наджелудочковых аритмий по данным холтеровского мониторирования ЭКГ:
- При лечении пациентов с фибрилляцией предсердий восстановление аритмии в виде трепетания предсердий с проведением на желудочки 1:1.
- Двунаправленная тахикардия по типу «Torsade de pointes».
- Появление или усиление имеющейся дисфункции синусного узла.
- Появление или повышение степени AV-блокады.
- Развитие внутрижелудочковых блокад.
- Увеличение количества эпизодов пароксизмов суправентрикулярной тахикардии, фибрилляции предсердий, предсердной экстрасистолии.
ДИАГНОСТИКА ПРЕЖДЕВРЕМЕННЫХ ДЕФОРМИРОВАННЫХ КОМПЛЕКСОВ QRS
Деформация комплекса QRS может быть обусловлена тремя основными причинами:
1) преждевременная деполяризация желудочков импульсом из центра, расположенного в проводящей системе или в миокарде желудочков;
2) аберрация нарушения внутрижелудочковой проводимости при суправентрикулярных экстрасистолах;
3) преждевременная деполяризация желудочков в случае преходящего синдрома предвозбуждения, которая проявляется только в предсердных экстрасистолах или единичных комплексах синусового ритма.
Главной проблемой дифференциальной диагностики деформированных комплексов QRS является дифференцировка суправентрикулярных экстрасистол с аберрацией проведения от желудочковых экстрасистол. Критерием распознавания экстрасистол наджелудочкового происхождения является наличие зубца Р перед деформированным комплексом QRS. Если преждевременный зубец Р тяжело распознать в отрезке ТР, то его следует искать в зубце Т предыдущего сердечного сокращения. Деформация зубца Т в виде его расширения, неравномерности или заострения с одновременным увеличением амплитуды позволяет распознать зубец Р, который накладывается на зубец Т.
Если перед деформированным комплексом QRS не регистрируется преждевременный зубец Р, то его следует отнести к желудочковым экстрасистолам. Однако в этом случае нельзя исключить аберрацию проведения экстрасистолы из AV-соединения с невидимым зубцом Р, скрытом в комплексе QRS. В дифференциальной диагностике имеет значение оценка записи в разное время суток. Зубцы Р, скрытые в комплексах QRS, могут быть невидимыми на протяжении дня и при этом могут появляться ночью в связи с угнетающим влиянием парасимпатического отдела вегетативной нервной системы на проведение в AV-узле. При дифференциации желудочковых экстрасистол с суправентрикулярными диагностическое значение имеет оценка зависимости между степенью деформации преждевременных комплексов QRS и их интервалом сцепления с предыдущим комплексом синусового ритма. Аберрация деформированного комплекса QRS уменьшается одновременно с увеличением интервала сцепления, а периодически, при довольно большой величине интервала сцепления, появляются экстрасистолы с недеформированным комплексом QRS. В то же время форма желудочковых экстрасистол не зависит от величины интервала сцепления и широкие деформированные комплексы QRS появляются даже при очень большом интервале сцепления (поздние желудочковые экстрасистолы) (рис. 3.3).
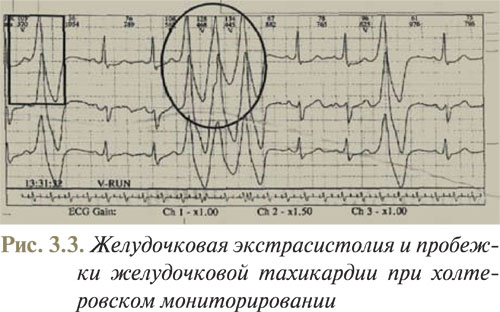
Классификация желудочковых экстрасистол
При интерпретации результатов холтеровского мониторирования под общим названием «желудочковые аритмии высоких градаций» понимают:
- одиночные экстрасистолы;
- политопные экстрасистолы;
- экстрасистолы типа «R на T»;
- ≥2 последовательных желудочковых экстрасистол.
Регистрация ≥3 последовательных желудочковых экстрасистол с частотой ритма >100 уд./мин и исчезающих самостоятельно менее чем за 30 с описывается как «нестойкая желудочковая тахикардия». Желудочковый ритм с частотой >100 уд./мин, сохраняющийся более 30 с, называется стойкой желудочковой тахикардией.
При интерпретации результатов холтеровского мониторирования обычно используется классификация желудочковых экстрасистол, предложенная Lown и Wolff и предназначавшаяся сначала для оценки степени риска внезапной коронарной смерти у пациентов с ИМ. Классификация представлена в табл. 3.3.
Таблица 3.3
Классификация желудочковых экстрасистол по Lown и Wolff
| Класс | Морфологическое описание |
| 0 | Без экстрасистол |
| 1 | <30 экстрасистол в течение 1 ч* |
| 2 | ≥30 экстрасистол в течение 1 ч |
| 3 | Политопные экстрасистолы |
| 4а | Парные экстрасистолы |
| 4в | >3 последовательных экстрасистол |
| 5 | Экстрасистолы типа «R на T» |
*Количество экстрасистол 30 в течение 1 ч дает основание для деления на 1-й и 2-й классы и касается частоты регистрации экстрасистол в критические часы, а не среднего значения регистрации экстрасистол в течение 1 ч, рассчитанного по данным всего суточного мониторирования.
Парасистолический ритм
Парасистолический, или двойной, ритм обозначает аритмию, возникающую за счет сосуществования в миокарде хотя бы двух независимых водителей ритма. На стандартных ЭКГ, зарегистрированных за довольно короткий промежуток времени, распознается обычно только классическая форма желудочковой парасистолии. Она характеризуется постоянной активностью парасистолического центра без блокады выхода.
Если ритм парасистолического центра более медленный, чем синусовый ритм, то на ЭКГ можно распознать классические критерии парасистолии:
- комплекс QRS желудочковой экстрасистолы расширен и деформирован;
- периодически регистрируются сливные комплексы;
- экстрасистолы характеризуются непостоянным интервалом сцепления с комплексом основного ритма;
- длинные промежутки между двумя последовательными экстрасистолами кратны самому короткому промежутку между ними.
Если ритм парасистолического центра более быстрый, чем синусовый ритм, то распознавание парасистолии возможно тогда, когда периодически возникающая деполяризация желудочков синусового происхождения не влияет на парасистолический центр.
ОЦЕНКА ФУНКЦИИ КАРДИОСТИМУЛЯТОРА
Для проведения оценки функции кардиостимулятора необходимо создание технических возможностей регистрации и воспроизведения на ЭКГ экстрастимула, характеризующегося коротким периодом действия (0,25–1 мс) и малой, в случаях двухполюсных приборов, амплитудой. Использование системы записи на магнитную ленту по многим параметрам оказалось неэффективным.
В данное время возможность точной оценки функции кардиостимулятора обеспечивается благодаря использованию регистраторов с цифровым анализом импульсов. В специальных типах регистраторов, оборудованных так называемыми детекторами импульсов стимулятора, эти импульсы постоянно регистрируются и описываются по временным параметрам. Одновременно описываются временные зависимости между импульсами стимуляторов и зубцами R. В итоге оценивается продолжительность последовательных интервалов R–R, R — импульс стимулятора, импульс стимулятора — импульс стимулятора. В стационарном аппарате обязательно есть функция оценки достоверности определенных образцов импульсов стимулятора и после коррекции — нового анализа данных. Конечные результаты, представленные в графическом и статистическом виде, отображают значение и частоту вышеуказанных интервалов. Анализ результатов разрешает выявить некоторые нарушения в работе стимулятора. Отсутствие импульсов стимулятора по заданной программе больше максимально допустимого перерыва (FTP — failure to pace) приводит к удлинению интервала R–R больше запрограммированных значений. Нарушение управления (FTS — failure to sense), то есть отсутствие «чувствительности» к импульсам кардиостимулятора или импульсам сердца находит свое отражение в значении интервалов R — импульс стимулятора или сокращении удлинения до предела.. Неэффективная стимуляция (FTC — faillure to capture) находит свое отображение в гистограмме импульсов стимулятора. Границы значений оцениваемых интервалов обычно устанавливаются автоматически для стандартного стимулятора типа VVI, но могут быть и свободно модифицированными. Данные, представленные графически и статистически, требуют сопоставления с картиной ЭКГ.
Холтеровская техника, позволяющая оценить функции стимулятора, существенно повышает возможности выявления нарушений работы стимулятора при кратковременном характере этих нарушений.
ОЦЕНКА ЭФФЕКТИВНОСТИ И БЕЗОПАСНОСТИ АНТИАРИТМИЧЕСКОЙ ТЕРАПИИ МЕТОДОМ ХОЛТЕРОВСКОГО МОНИТОРИРОВАНИЯ
Оценка эффективности антиаритмической терапии
Сравнение результатов двух исследований, из которых одно выполнено до, а второе — после применения антиаритмических препаратов, позволяет оценить эффективность терапии, выявить проаритмогенные эффекты лекарственных средств. Однако следует отметить, что сравнительная оценка результатов мониторирования затруднена проявлением индивидуальной вариабельности частоты желудочковых нарушений сердечного ритма.
Наиболее обоснованные критерии эффективности лечения желудочковых аритмий предложены Gieca и соавторами. Согласно этим критериям эффективной антиаритмическая терапия считается только тогда, когда выполнено каждое из следующих условий:
1) уменьшение количества желудочковых экстрасистол более чем на 75%;
2) уменьшение количества парных экстрасистол и экстрасистол типа «R на T» более чем на 90%;
3) при полиморфности экстрасистол уменьшение количества мономорфологических типов максимально до 2;
4) полное отсутствие эпизодов желудочковой тахикардии.
С учетом влияния времени на вариабельность суточного количества желудочковых экстрасистол при холтеровском исследовании разработаны критерии оценки эффективности антиаритмической терапии для разных промежутков времени (табл. 3.4).
Таблица 3.4
Критерии оценки эффективности антиаритмической терапии в зависимости от периода между двумя исследованиями
| Период, дней | Уменьшение количества экстрасистол, % | ||
| В общем | Парных | Более 3 подряд | |
| 1–7 | 63 | 90 | 95 |
| 8–90 | 79 | 94 | 98 |
| 91–365 | 92 | 98 | 98 |
| >365 | 98 | 99 | 99 |
Холтеровская оценка антиаритмической терапии имеет ограничения. Она не проводится у пациентов с пароксизмами стойкой желудочковой тахикардии в анамнезе, у которых количество желудочковых экстрасистол <60 в течение 24 ч. В такой ситуации результат лечения можно оценить с помощью инвазивной стимуляции желудочков, выполненной до и после применения лекарственных средств. Полученные другими методами данные об успешном лечении, соответствующие всем вышеприведенным критериям, не являются однозначными показателями эффективной профилактики стойкой желудочковой тахикардии и внезапной смерти. Классические примеры этого — результаты исследования CAST, свидетельствующие о повышении частоты внезапной смерти у пациентов, принимавших флекаинид или энкаинид, несмотря на их достоверную эффективность, подтвержденную на основе результатов холтеровского исследования.
Выявление проаритмогенного действия антиаритмических средств
Любой из используемых антиаритмических препаратов может вызвать усиление активности уже выявленной аритмии или спровоцировать появление новых нарушений ритма сердца. О проаритмогенном влиянии относительно желудочковых нарушений ритма можно говорить тогда, когда при холтеровском мониторировании ЭКГ выявлено:
1) хотя бы 4-кратное увеличение общего суточного количества желудочковых экстрасистол;
2) хотя бы 10-кратное увеличение количества парных экстрасистол и эпизодов нестойкой желудочковой тахикардии;
3) появление не зарегистрированной ранее стойкой желудочковой тахикардии или новой морфологической формы стойкой желудочковой тахикардии.
При выявлении нарушений, соответствующих хотя бы одному из этих 3 критериев, можно говорить о проаритмогенном влиянии проведенной терапии. Проаритмогенное влияние одного препарата не означает, что другой препарат, даже этой же группы, может вызывать проаритмогенную реакцию. При выявлении проаритмогенного влияния препарата следует учитывать факторы, способствующие возникновению проаритмогенной реакции. К провоцирующим факторам относятся: пароксизмы желудочковой тахикардии или фибрилляция желудочков в анамнезе, малая ФВ ЛЖ, увеличение значения корригированного интервала Q–T >0,44 с, применение в лечении сердечных гликозидов.
Частота проявлений проаритмогенной реакции, по данным наиболее значительных в этой области материалов Podrid и соавторов, обследовавших более 400 пациентов, составила в среднем 9% и в зависимости от группы применяемых препаратов — 6–15%. Частота проявлений проаритмогенных реакций в зависимости от применяемого препарата представлена в табл. 3.5.
Таблица 3.5
Частота проявлений проаритмогенных реакций в зависимости от применяемого антиаритмического препарата
| Название препарата | Частота проявления проаритмогенного действия, % | ||
| Podrid и соавторы | Velebit и соавторы | Trusz-Gluse и соавторы | |
| Амиодарон | — | — | 6 |
| Хинидин | 15 | 13 | — |
| Дизопирамид | 16 | 6 | 7 |
| Энкаинид | 15 | — | — |
| Флекаинид | 12 | — | — |
| Лоркаинид | 8 | — | — |
| Мексилетин | 7 | 8 | 6 |
| Прокаинамид | 9 | 9 | — |
| Пропафенон | 8 | — | — |
| Пропранолол | — | 15 | 8 |
| Токаинид | 8 | 16 | — |
Наиболее частым признаком проаритмогенного влияния у этих пациентов были стойкая желудочковая тахикардия или фибрилляция желудочков (63%). 10-кратное увеличение групповых желудочковых экстрасистол наблюдали в 30% случаев, а 4-кратное увеличение общего количества желудочковых экстрасистол — только в 5%. Выявление проаритмогенного влияния имеет важное значение для прогнозирования риска внезапной сердечной смерти при проведении дальнейшей терапии другими антиаритмическими препаратами.
Предикторы проаритмогенного действия для разных классов антиаритмических препаратов по классификации Williams (1970) приведены в табл. 3.6.
Таблица 3.6
Предикторы возникновения аритмогенного действия антиаритмических препаратов
| Препараты IA и III класса | Препараты IC класса |
|
|
ОЦЕНКА ИНТЕРВАЛА Q–T КАК ПРЕДИКТОРА АРИТМИЙ
Еще в первых исследованиях, в начале развития электрокардиографии, была отмечена вариабельность интервала Q–T в зависимости от ЧСС и предприняты попытки найти соответствующие нормальные значения. Для расчета нормальных величин наибольшее распространение получила формула H. Bazett:
Q–Td = k√R–R,
где k — коэффициент, составляющий 0,37 для мужчин и 0,40 — для женщин.
На основании данной формулы предложено вычислять корригированный интервал Q–T как отношение продолжительности интервала Q–T (мс) к корню квадратному величины интервала R–R (с):
Q–Tk = Q–Tи√R–R,
где Q–Tи — измеряемый интервал Q–T.
Удлиненным считается интервал Q–T, превышающий нормальную расчетную величину на 0,03 с, или если величина корригированного интервала Q–T превышает 0,44 с.
Из-за ограниченного числа отведений, постуральных изменений, смещения электродов, артефактов и малоизученного влияния суточных колебаний вегетативной регуляции ритма сердца на динамику интервала Q–T его оценка при холтеровском мониторировании представляется более трудной задачей, чем на ЭКГ в покое. Однако многими авторами продемонстрировано преимущество холтеровского мониторирования, связанное с возможностью автоматического анализа около 100 тыс. интервалов R–R и Q–T. В ряде исследований продемонстрирована высокая корреляция между продолжительностью интервала Q–T, измеренного одновременно на стандартной ЭКГ, и при холтеровском мониторировании. Так, в работе J. Christiansen и соавторов измерение проводилось «вручную» двумя независимыми экспертами в отведениях V1 и V5 у 14 больных в возрасте 4–36 лет при скорости записи 25 мм
·с-1. Всего проанализировано 100 пар измеренных интервалов Q–T. При сравнении двух методов измерения, особенно в отведении V5, отмечена высокая корреляция — от 0,872 до 0,988.
При анализе результатов холтеровского мониторирования интервал Q–T максимальный (Q–Tmax), минимальный (Q–Tmin), корригированный (Q–Tcor) измеряются в основном в отведении СМ5. На основании результатов многих исследований значения данного интервала в норме больше у женщин, чем у мужчин.
Кроме того, при мониторировании наблюдается ослабление взаимосвязи между интервалами Q–T и R–R в ночное время, что связано с определяющей ролью колебаний вегетативной регуляции сердечного ритма в течение суток. Следует отметить, что у больных с трансплантированным сердцем и редуцированием вегетативных влияний на сердце разницы между дневной и ночной динамикой интервала Q–T не выявлено.
Согласно рекомендациям Украинского общества кардиологов по профилактике внезапной сердечной смерти неинвазивными предвестниками тахикардии типа «пируэт» вследствие проаритмогенного действия препаратов являются:
1) продолжительность интервала Q–T >600 мс;
2) удлинение интервала Т–U, наличие T alternans (колебания конфигурации и амплитуды зубца Т);
3) изменение конфигурации T–U в постэкстрасистолическом комплексе;
4) наличие «маленьких пируэтов» (torsadelets).
Анализ и учет особенностей суточной динамики интервала Q–T при холтеровском мониторировании ЭКГ значительно повышает частоту выявления больных, у которых возможно развитие угрожающих жизни желудочковых тахиаритмий и внезапной сердечной смерти.
ИСПОЛЬЗОВАНИЕ ХОЛТЕРОВСКОГО МОНИТОРИРОВАНИЯ ЭКГ В ДИАГНОСТИКЕ ИБС
Использование холтеровского мониторинга, по мнению его автора, предоставляло дополнительные возможности для диагностики ишемии миокарда, возникающей в амбулаторных условиях. Критериями ишемии были признаны динамические сдвиги сегмента ST, сопровождающие стенокардию. Однако действительное признание и широкое использование в клинике метод холтеровского мониторирования получил через 20 лет после публикации работ D. Tzivoni, S. Stern (1974), а затем S. Schang, C. Pepine (1977). Используя холтеровское мониторирование, авторы описали феномен бессимптомной миокардиальной ишемии у пациентов с ИБС. У больных со стенокардией и нормальной ЭКГ покоя во время холтеровского мониторирования исследователи выявили эпизоды депрессии сегмента ST, причем значительная часть из них не сопровождалась болевым синдромом. Появление названных публикаций вызвало дискуссию по поводу диагностической значимости нового метода.
В дальнейшем связь изменений ЭКГ (депрессии сегмента ST) с гипоксией миокарда была доказана целой серией работ. Так, S. Galatius-Jensen и соавторы (1995) в 1-ю неделю острого ИМ исследовали нарушения ритма сердца и эпизоды депрессии сегмента ST по данным холтеровского мониторирования одновременно с проведением пульсоксиметрии. Выявили, что эпизоды ночной десатурации были непосредственно связаны с нарушениями ритма и ишемическими проявлениями на ЭКГ. S. Schang и С. Pepine (1977) у 20 больных с ангиографически доказанной ИБС и положительными результатами нагрузочных тестов проводили холтеровское мониторирование по 10 ч на протяжении 16 мес. Общее время мониторирования составило 2826 ч. При этом было выявлено 411 эпизодов транзиторных изменений сегмента ST, среди которых 308 были бессимптомными. Депрессия сегмента ST развивалась во время сна, в положении сидя, при медленной ходьбе, когда ЧСС была значительно ниже, чем во время нагрузочных тестов. Авторы пришли к однозначному заключению, что безболевые эпизоды депрессии сегмента ST были истинно ишемическими, поскольку их количество значительно уменьшалось на фоне терапии нитратами. В других исследованиях у пациентов с ИБС результаты холтеровского мониторирования сопоставляли с данными коронароангиографии. Бессимптомные нарушения регионарного миокардиального кровотока наряду с аналогичными изменениями, которые сопровождались типичными ангинозными приступами, выявлены во время проведения позитронной томографии. Одновременное проведение сцинтиграфии с 201Т1 и нагрузочной пробы позволило выявить преходящие безболевые дефекты перфузии миокарда в сочетании с депрессией сегмента ST на ЭКГ.
В дальнейшем для определения состояния, при котором выявляются объективные признаки ишемии миокарда и отсутствуют проявления стенокардии или ее эквиваленты, были предложены следующие термины — безболевая, бессимптомная, или немая ишемия миокарда. Благодаря использованию метода холтеровского мониторирования безболевые ишемические изменения выявлены у 50–100% пациентов со стабильной стенокардией. A. Maseri описал бессимптомные элевации сегмента ST у пациентов с вазоспастической стенокардией (до 70% общего количества изменений на ЭКГ). Бессимптомные ишемические эпизоды регистрировали у больных с нестабильной стенокардией, причем в некоторых случаях немая ишемия преобладала.
У 2,5–10% пациентов с ИБС заболевание протекает бессимптомно. По результатам Фремингемского исследования, ИМ без симптомов случайно выявлен у 28% мужчин и у 35% женщин.
Применение в клинической практике метода холтеровского мониторирования позволило документально подтвердить особый вид бессимптомной ишемии миокарда, значительно расширить представления об особенностях течения ИБС, обосновать необходимость всего спектра диагностических и терапевтических мероприятий, направленных на выявление ишемии, выделить отдельную форму заболевания — бессимптомную, или немую ИБС.
Использование холтеровского мониторирования у больных ИБС наиболее обосновано для диагностики безболевой ишемии миокарда и приступов вазоспастической стенокардии (стенокардии Принцметала). С помощью этого метода возможна объективизация клинического состояния больного за счет выявления «тотального бремени ишемии» и результатов терапии. Детальная информация по использованию холтеровского мониторирования у больных с хроническими формами ИБС представлена в секции 8, глава 3.
Ошибки в автоматическом измерении сдвигов сегмента ST
Критерии ишемии миокарда уже приводились ранее. Они полностью определяются при визуальной оценке ЭКГ. Однако при автоматическом анализе ЭКГ во время холтеровского мониторирования нередко случаются ошибки в диагностике ишемии. Ошибки при автоматическом измерении сдвигов сегмента ST неизбежны, поэтому для повышения качества диагностики ишемии миокарда по результатам холтеровского мониторирования необходим обязательный визуальный контроль ЭКГ-изменений при использовании аппаратов с автоматическим анализом записи. Наиболее распространенные ошибки бывают нескольких видов.
1. Ошибки, связанные с плохим качеством записи.
Эти ошибки возможны как при автоматическом компьютерном анализе, так и при визуальном анализе ЭКГ врачом. Они возникают, в частности, в случаях, когда каждый следующий комплекс записывается на новом уровне и вся ЭКГ приобретает вид волнообразной кривой. При этом нет отчетливой связи с дыханием. Такие ошибки часто определяются при проведении физической нагрузки во время холтеровского мониторирования ЭКГ низкого качества, с большим количеством дополнительных осцилляций, регистрируемых при отрыве электрода или пользовании радиотелефоном, когда уровень артефактов очень высок.
2. Компьютерные ошибки , связанные с методикой анализа сегмента ST.
При изменении формы желудочкового комплекса скачкообразно изменяется точка отсчета начала сегмента ST. Неустойчивое положение точки J при измененной форме комплекса QRS чаще всего связано с изменениями ЧСС. Сдвиг сегмента ST оценивается по правилу: точка J + 60 или 80 мс. Относительно изоэлектрической линии эта точка может быть очень непостоянной, поскольку любое изменение формы сегмента ST и зубца S приводит к изменению угла между зубцом S и сегментом ST, что сразу отражается на определении точки J. Поэтому чаще определяют не точку J, а точку, которая отстоит от вершины зубца R на 40 мс, и эту точку принимают за начало отсчета сдвига сегмента ST. Продолжительность сегмента ST (мс) зависит от ЧСС. При тахикардии практически невозможно определить конец желудочкового комплекса (зубец Т). Одним из приемов преодоления этих затруднений является использование формулы Базетта для определения окончания желудочкового комплекса. При таком определении продолжительность депрессии сегмента ST является некоторой заданной частью участка ЭКГ от R + 40 мс до конца зубца Т, например часть от 1/8 до 1/4 этого участка. При тахикардии продолжительность депрессии сегмента ST находится в пределах 50–70 мс, а при брадикардии — 70–90 мс от конца комплекса QRS.
3. Ошибка, связанная с «привязкой» точки J к вершине зубца R.
При динамическом изменении формы желудочкового комплекса, например, из комплекса с высоким зубцом R в комплекс с малым зубцом r или комплекс QS, определение точки J становится невозможным, поскольку ее «привязка» осуществляется по вершине максимально положительного или по вершине максимально отрицательного зубца желудочкового комплекса. Чаще всего такие ошибки происходят при позиционных изменениях.
4. Ошибки при определении изоэлектрической линии.
Изоэлектрической линией принято считать отрезок Т–Р. При тахикардии зубец Т часто наслаивается на зубец Р, поэтому точка отсчета оказывается на зубце Р, или эта точка «наезжает» на следующий комплекс QRS, на зубец Q или R, что не позволяет правильно ориентироваться относительно уровня отсчета начальной изоэлектрической точки. Появляются стойкие ошибки в определении изоэлектрической линии. Вследствие этого неверно определяется величина сдвига сегмента ST. На тренде сегмента ST почти всегда присутствуют явления такого рода. При тахикардии даже при отсутствии действительного изменения сегмента ST определяется его снижение. Уровнем отсчета на тренде принимается изменение положения точки J относительно уровня отсчета, принятого в качестве изоэлектрической линии. В таких случаях нулевая точка оказывается или на зубце Т, или на зубце Р. И то, и другое увеличивает положительное значение точки отсчета и приводит к оценке ложной депрессии сегмента ST.
Клиническая интерпретация изменений сегмента ST, зарегистрированных на протяжении суток, следует проводить с учетом определенных критериев. Проводится анализ следующих параметров:
1) величина депрессии;
2) тип смещения;
3) продолжительность изменения сегмента ST.
Острый ИМ
F. Zanchi и соавторы (1995) при мониторировании ЭКГ в первые 12 дней после перенесенного ИМ у 30% больных выявили эпизоды ишемии. Количество эпизодов транзиторной ишемии миокарда уменьшалось с 20% (на 2-й день) до 5% к 12-му дню наблюдения. Среди общего количества эпизодов ишемии до 80% приходилось на безболевую форму и лишь 20% отклонений ST сопровождались болью. При остром ИМ чаще отмечают транзиторную элевацию сегмента ST — до 60% эпизодов, депрессию сегмента ST выявляют в 40% случаев. Элевация определяется, как правило, в отведениях с зубцом Q или со сниженным зубцом R. В острый период ИМ наличие транзиторной ишемии миокарда не влияет на течение и прогноз заболевания. Около 20% больных как с изменениями сегмента ST, так и без них, входят в группу с осложненным течением заболевания. В подострой стадии ИМ сдвиг сегмента ST является фактором высокого риска развития таких осложнений, как повторный ИМ, отек легких, желудочковая тахикардия, фибрилляция желудочков, сердечная смерть. По данным H. Mickley и соавторов (1995), при длительном наблюдении (до 5 лет) больных, перенесших ИМ и имевших элевацию сегмента ST при холтеровском мониторировании, сохранялась связь между фактом наличия эпизодов элевации и риском смерти и развитием нефатального ИМ. Таким образом, транзиторная ишемия миокарда, особенно немая, часто наблюдается в острую фазу ИМ, однако ее прогностическое значение остается не до конца выясненным. Появление ишемии миокарда в более поздний срок связано с повышением риска развития осложнений независимо от наличия болевого синдрома, что определяет тактику терапевтического вмешательства. Стратификация риска у больных после острого ИМ с учетом комбинированного показателя по результатам холтеровского мониторирования (вариабельность сердечного ритма, наличие желудочковой тахикардии и элевации сегмента ST), выявило его высокую прогностическую значимость.
Что касается нарушений ритма, которые выявляют в острую фазу ИМ методом холтеровского мониторирования ЭКГ, установлено, что количество экстрасистол находится в прямой линейной зависимости от уменьшения ФВ, то есть зависит от сократительной функции миокарда ЛЖ. На развитие аритмии, очевидно, влияет и непосредственно ишемия миокарда, хотя, по данным P. Dorian и соавторов (1995), реперфузия инфарктобусловившей артерии не влияет на количество экстрасистол.
ОЦЕНКА АКТИВНОСТИ ВЕГЕТАТИВНОЙ НЕРВНОЙ СИСТЕМЫ МЕТОДОМ ХОЛТЕРОВСКОГО МОНИТОРИРОВАНИЯ
На стандартной ЭКГ в 12 отведениях можно выделить признаки гиперсимпатикотонии и гиперпарасимпатикотонии. Характерные симптомы преобладания тонуса симпатического отдела вегетативной нервной системы — ускорение синусового ритма, увеличение амплитуды зубца Р, уплощение зубца Т, реже — снижение сегмента ST. Повышение тонуса парасимпатического отдела проявляется замедлением синусового ритма, временами появлением суправентрикулярных ритмов, замедлением AV-проводимости вплоть до блокады II степени типа Венкебаха и увеличением амплитуды зубца Т. Внедрение и распространение 24-часовой регистрации ЭКГ методом Холтера позволило выявить частоту возникновения вышеназванных изменений в разные фазы суточной активности у здоровых лиц и изучить реакцию электрической активности сердца на стресс.
Влияние вегетативной нервной системы на электрическую активность сердца:
1) изменения вариабельности синусового ритма;
2) симпатикотонические и ваготонические нарушения ритма;
3) депрессия сегмента ST;
4) другие нарушения реполяризации.
Вариабельность сердечного ритма определяют как выраженность колебаний ЧСС относительно ее среднего значения. Последовательный ряд кардиоинтервалов не является набором случайных чисел, а имеет сложную структуру, отображающую регуляторное влияние на синусный узел сердца вегетативной нервной системы и различных гуморальных факторов. Поэтому анализ структуры вариабельности сердечного ритма предоставляет важную информацию о состоянии вегетативной регуляции сердечно-сосудистой системы и организма в целом.
Значительное влияние на вариабельность сердечного ритма оказывают циркадные колебания (день-ночь) ритма сердца. Кроме того, на вариабельность сердечного ритма влияют такие факторы, как физическая активность пациента, различные стрессорные воздействия, прием пищи, сон. Поэтому при суточном мониторировании ЭКГ желательно протоколировать воздействие различных факторов, влияющих на ритм сердца. При патологии необходимо отмечать время и выраженность различных симптомов, особенно боли.
Более детальная информация о методах оценки вариабельности сердечного ритма приведена в главе 4 секции 5.
Нарушения ритма и проводимости как проявления вегетативной дисрегуляции
Часто при холтеровском мониторировании выявляют недостаточность, зависимую от повышенного тонуса блуждающего нерва. При этом регистрируют замещающие ритмы, в том числе из наджелудочковых водителей ритма, сочетающиеся с замедлением AV-проводимости, а также с AV-блокадой, не превышающей степени блокады типа Венкебаха. Эта недостаточность появляется у пациентов молодого возраста со здоровым сердцем и не требует лечения. Проблема заключается в дифференциальной диагностике этого состояния со слабостью синусного узла, особенно у лиц пожилого возраста или в случае значительно выраженных изменений, например торможения автоматизма синусного узла, >2 с или AV-блокады типа Мобитц, особенно если эта недостаточность проявляется не только ночью, но и днем.
Депрессия сегмента ST как проявление вегетативной дистонии
К другим изменениям ЭКГ, обусловленным нарушением тонуса вегетативной нервной системы, следует отнести депрессию сегмента ST, которую отмечают при гиперсимпатикотонии. При дифференциальной диагностике учитывается характерная клиническая картина; депрессия сегмента ST, выявленная у молодых людей, особенно женщин, часто с сопутствующей тахикардией, без типичных стенокардитических проявлений. Данная картина может быть расценена как «неспецифические» изменения сегмента ST или еще более однозначно — «признаки гиперсимпатикотонии».
На рис. 3.4 представлен пример депрессии сегмента ST по ишемическому типу в отведении СМ-5 во время синусовой тахикардии с ЧСС 115 уд./мин (а) и неспецифические изменения ST–T в ночное время (б) у 34-летней женщины.
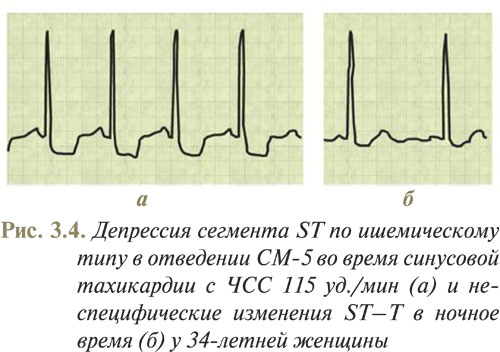
Патогенез симпатикотонической депрессии сегмента ST не установлен; в этом случае диагностируется немая недостаточность кровоснабжения, но только у пациентов с подтвержденной ИБС — перенесенным ИМ или по данным коронаровентрикулографии, свидетельствующим о сужении коронарных артерий. В то же время возможно, что депрессия сегмента ST, вызванная повышенным тонусом симпатического отдела вегетативной нервной системы, также выражает действительную недостаточность кровообращения, обусловленную сужением малых коронарных артерий. Возможно, причиной их сужения во время стресса являются не катехоламины, а, например, нейропептид Y, высвобождающийся окончаниями симпатических нервов под влиянием сильного адренергического влияния, что вызывает сужение малых коронарных артерий.
Другие изменения периода реполяризации на ЭКГ, обусловленные вегетативной дистонией
С гиперсимпатикотонией связывают возникновение на ЭКГ зубца U с амплитудой >1 мм. Зубец U находится на нисходящем колене зубца Т, а иногда и превышает его. В состоянии гиперсимпатикотонии зубцы U и T характеризуются изменчивостью на протяжении часов и даже минут регистрации. Следует помнить, что зубец U несколько другой конфигурации, который регистрируется за высоким зубцом Т, чаще в отведениях V2–V3, является характерным признаком ваготонии.
Влияние вегетативной нервной системы на продолжительность интервала Q–T разноплановое: стимуляция β-адренергических рецепторов укорачивает его, α-адренергических и мускариновых рецепторов — удлиняет. Разница между самым длинным и самым коротким интервалом на протяжении суток обычно не превышает 3% или 0,01–0,02 с.
ОТЧЕТ О ПРОВЕДЕНИИ ХОЛТЕРОВСКОГО МОНИТОРИРОВАНИЯ
Учитывая разные возможности аппаратов, используемых для регистрации ЭКГ на протяжении суток, необходима единая схема заключения, которая отражала бы все аспекты, необходимые для ведения больных.
В отчет о проведении холтеровского исследования необходимо включать следующие обязательные блоки:
1) общая часть;
2) динамика ЧСС (то есть нормальных комплексов QRS);
3) выявление нарушений ритма и проводимости;
4) изменение конечной части желудочкового комплекса (ST–T);
5) кроме того, по возможности, взаимосвязь этих характеристик между собой и связь выявленных нарушений с клинической симптоматикой.
Общая часть заключения должна включать:
- паспортные данные больного;
- условия, в которых проводилось наблюдение (стационарное или амбулаторное);
- терапию в день исследования с указанием того, что исследование проведено до назначения (или на фоне отмены) терапии — «фоновое» наблюдение;
- режим дня больного, возможное включение в режим дня каких-либо проб;
- продолжительность наблюдения, использованные отведения и качество сигнала (например в виде времени, пригодного для анализа).
Максимально подробно должны быть описаны клинически значимые нарушения ритма и проводимости, такие как пароксизмы тахикардии или фибрилляции/трепетания предсердий, эпизоды асистолии, периоды нарушения внутрижелудочковой проводимости и оценены их характеристики:
- количество и продолжительность пароксизмов тахикардии, ЧСС этих пароксизмов, количество и длительность асистолии или эпизодов блокад;
- при частых аритмиях подсчитать их количество за время наблюдения днем и ночью (может быть вычислен циркадный индекс), среднее количество за время наблюдения и разброс;
- полезно дополнить количественное описание аритмии не только за время наблюдения, но и в расчете на 1000 QAS-комплексов.
В случае проведения повторного мониторирования ЭКГ обязательным блоком заключения является оценка динамики полученных данных. Необходимо отметить изменения ЧСС, а если при первом мониторировании фиксировали аритмию или эпизоды ишемии, то и изменения количества и характеристик этих нарушений. В выводах целесообразно провести сопоставление числовых значений выявленных изменений по сравнению с первым обследованием.
По данным мониторирования могут оцениваться эффективность антиаритмической и антиангинальной (антиишемической) терапии, а также возможные побочные эффекты препаратов, о чем обязательно указывают в заключении.
БИФУНКЦИОНАЛЬНОЕ МОНИТОРИРОВАНИЕ ЭКГ И УРОВНЯ АД
Бифункциональное мониторирование ЭКГ и уровня АД — это метод, включающий определение АД в течение суток с синхронной регистрацией ЭКГ.
Проведение бифункционального мониторирования АД и ЭКГ показано пациентам:
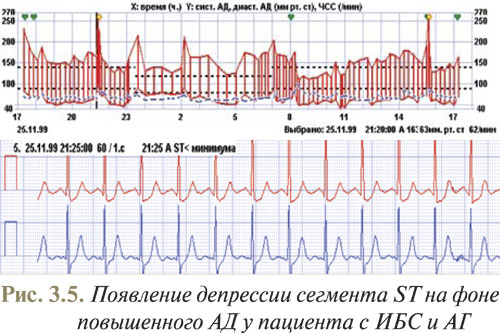
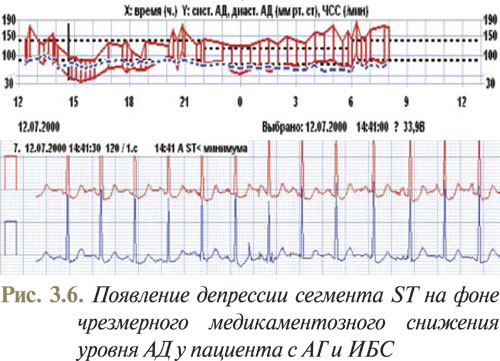
- с ИБС и сопутствующей АГ: для определения влияния повышенного АД на возникновение ишемических изменений на ЭКГ;
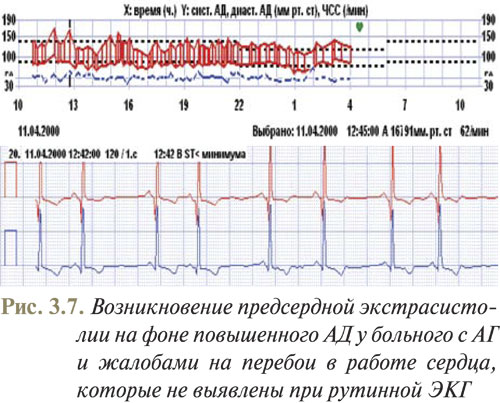
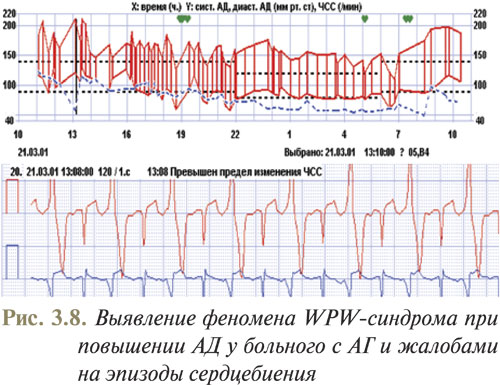
- с АГ и нарушениями сердечного ритма, которые не удается выявить при обычном обследовании;
- с АГ и сопутствующей ИБС и/или нарушениями ритма для проведения оценки адекватности терапии (как антигипертензивной, так и антиишемической и антиаритмической);
- для проведения комплексной оценки вариабельности АД и ритма (до и на фоне терапии).
На сегодня для регистрации АД в бифункциональных мониторах используют аускультативный и осциллометрический методы. Преимуществом аускультативного метода является определенная резистентность к движениям рукой во время мониторирования: на измерение давления практически не влияет выполнение физической работы. К недостаткам метода относят: высокую чувствительность к шуму и точности расположения микрофона относительно артерии (необходимо четко фиксировать манжетку на руке без возможности ее сдвига во время длительного ношения). Кроме того, метод требует непосредственного контакта микрофона (поверхности манжетки) с кожей пациента. Аускультативное измерение АД не обеспечивает точного его измерения при аритмиях.
В основе осциллометрического метода лежит анализ пульсации давления в манжетке, возникающей при передаче на нее пульсации артерии на фоне дозированного снижения давления, накачанного в манжетку воздуха. Зависимость амплитуды пульсаций от давления в манжетке имеет характерную форму звука. За уровень САД принимают давление, при котором наблюдается наиболее резкое увеличение амплитуды пульсации, среднего АД — максимальной амплитуды пульсации, ДАД — резкое ослабление амплитуды пульсации. В некоторых приборах для более точного определения анализируется первая производная от кривой пульсации (тахоосциллометрия). Преимуществами осциллометрического метода являются: высокая устойчивость к внешним шумам (измерение можно проводить даже в кабине вертолета), значение давления практически не зависит от разворота манжетки и ее положения на руке (пока манжетка не достигнет локтевого сустава), измерения без потери точности можно проводить через тонкую ткань одежды. Кроме того, осциллометрический метод позволяет проводить измерения в случаях, когда аускультативный метод неприменим — при феномене «аускультативного провала», «бесконечных» или слабых тонах Короткова. К недостаткам метода относят малую стойкость к движениям рукой — невозможно обеспечить необходимое качество определения АД при нагрузке. Как и аускультативный, осциллометрический метод не обеспечивает необходимой точности измерения АД при нерегулярных сердечных сокращениях (аритмиях), поскольку еще не существует принятой формализованной методики определения АД в таких ситуациях.
При бифункциональном мониторировании АД и ЭКГ определяют как вышеуказанные показатели холтеровского мониторирования, так и показатели суточного мониторирования АД. К последним относят:
- величину среднесуточного АД. Большинство исследователей и программ, заложенных в аппараты для суточного мониторирования АД, используют среднеарифметические значения АД и вычисляют среднее САД и ДАД на протяжении суток, а также отдельно в дневной (среднедневное АД) и ночной (средненочное АД) периоды мониторирования. В наиболее современных программах, сопровождающих приборы суточного мониторирования АД, заложена коррекция на различный интервал измерения АД днем и ночью, а также на некоторые высокоамплитудные артефакты, что значительно повышает точность получаемых средних величин. В ряде аппаратов приводятся гистограммы распределения величин АД на протяжении периода мониторирования:
- временной индекс — процент измерений, во время которых уровень АД превышает нормальные величины. Этот показатель вычисляют для САД, среднего и ДАД, днем и ночью отдельно;
- величину напряжения площади повышенного АД, отражающую площадь под кривой суточного графика АД, которая выше нормальных или «безопасных» величин. Индекс вычисляют отдельно как для САД, так и для ДАД; для всего периода мониторирования и для дневного и ночного периодов отдельно;
- суточный индекс, являющийся важным и надежным показателем суточного ритма АД и представляющий собой степень ночного снижения АД, выраженную в процентах от средней дневной величины;
- вариабельность АД, которая является стандартным отклонением АД от средней величины (STD). Вычисляется индекс вариабельности отдельно для дневного и ночного периодов суточного мониторирования АД.
Нормальные значения указанных показателей представлены в табл. 3.7.
Таблица 3.7
Нормальные значения показателей суточного мониторирования АД
| Показатель | Нормальные значения |
| Среднесуточное АД, мм рт. ст. | <125/80 |
| Среднедневное АД, мм рт. ст. | <135/85 |
| Средненочное АД, мм рт. ст. | <120/75 |
| Временной индекс для АД, %
САД ДАД |
<20
<15 |
| Индекс напряжения площади
АД (мм. рт. ст.) • ч |
Нормальных значений не существует, индекс оценивается в динамике |
| Суточный индекс, % | 10–20 |
| Дневная вариабельность АД, мм рт. ст.
САД ДАД |
15
14 |
| Ночная вариабельность АД, мм рт. ст.
САД ДАД |
15
12 |
Примеры использования метода бифункционального мониторирования АД и ЭКГ, полученные в отделе симптоматических артериальных гипертензий ННЦ «Институт кардиологии им. Н.Д. Стражеско» (руководитель — профессор Ю.Н. Сиренко), приведены на рис. 3.5–3.8.
ЛИТЕРАТУРА
- Домбровски А., Домбровски Б., Пиотрович Р. (2000) Суточное мониторирование ЭКГ. Медпрактика. Москва.
- ACC/AHA Practice Guidelines ACC/AHA Guidelines for Ambulatory Electrocardiography.
- Ambulatory Monitoring (1983) Cardiovascular System and Allied Applications. C. Marchesi (Ed.) Martinus Nijhoff. Publ., Pisa.
- Armstrong W.F., Jordan J.W., Morris S.N. et al. (1982) Prevalence and magnitude of ST segment and Т wave abnormalities in normal during continuons ambulatory electrocardiography. Am. J. Cardiol., 99: 1638-1642.
- Biagini A. et al. (1983) In Acute transient myocardial ischemia. Ambulatory Monitoring. Cardiovascular System and Allied Applications. C. Marchesi (Ed.). Martinus Nyhoff Publ. Pisa, p. 105-113.
- Bjerregaard N. (1982) ST–Т changes in the ambulatory ECG on healthy adult subjects. In: Proceedings 9th World Congress of Cardiol. M: 0133.
- Crawford M.H., Mendoza C.A., O’Rourke R.A. et al. (1978) Limitations of continuous ambulatory electrocardiogram monitorings for detecting coronary artery disease. Ann. Intern. Med, 89: 1.
- Deanfeild J.E. et al. (1983) Myocardial ischemia during daily life in patient with stable angina: its relation to symptoms and heart rate changes. Lancet, 2: 753.
- Deedwania P., Pepine C.J., Cohn P. et al. (1993) For ASIST Study Group The monitoring increase in myocardial ischemia is effectively suppressed by atenolol. Circulation., 88: 1594.
- Dellborg M. et al. (1995) Dynamic on-line vector cardiography improves and simplifies in-hospital ischemia monitoring of patients with unstable angina. J. Am. Coll Cardiol., 26: 1501-1507.
- Djiane P., Eqre A., Bory M. et al. (1977) L’enregistrement electrocardiographique continueriez 50 subjects normaux. In: Fuel P. (Ed.) Troubles du rythme et electrostimulation. Toulouse, 161-167.
- Dorian P., Langer A., Morgan C. et al. (1994) Importance of ST-segment depression as a determinant of ventricular premature complex frequency after thrombolysis for acute myocardial infarction. Am. J. Cardiol., 74: 419-423.
- Ellestad M.H., Lerman S., Thomas L.V. (1989) The limitations of the diagnostic power of exercise testing. Am. J. Noninvas Cardiol., 3: 139-146.
- Engel U.R., Burckhardt D. (1975) Heufigkeitun dart von herz rhythm uss torungen wowie Ekg. Schweiz. Med. Wschr., 105: 1467-1469.
- Galatius-Jensen S. et al. (1995) Nocturnal hypoxemia after myocardial infarction and arrhythmias. Br. Heart J., 73: 488.
- Holier N. (1961) New method for heart studies: continuous electrocardiography of active subjects. Science, 134: 1214-1220.
- Kodama Y. (1995) Evaluation of myocardial ischemia using Holter monitoring. Fukuoka-Igaku-Zasshi, 86: 304-316.
- Mayet J., Shahi M., Poulter N.R. et al. (1995) Ventrciular arrhythmias in hypertension: in which patient do they occur? J. Hypertens, 13: 269-276.
- Mickley H., Nielsen J.R., Berning J. et al. (1995) Characteristics and prognostic importance of ST-segment elevation on Holter monitoring early after acute myocardial infarction. Am. J. Cardiol., 76: 537-542.
- Osterhues H.H., Eggeling T., Kochs M., Hombach V. (1994) Improved detection of transient myocardial ischemia by a new lead combination: value of bipolar Nehb D for Holter monitoring. Am. Heart J., 127: 559-566.
- Palatini P., Maraglino G., Accurso V. et al. (1995) Impaired left ventricular filling in hypertensive left ventricular hypertrophy as a marker of the presence of an arrhythmogenic substrate. Br. Heart J., 73: 258-262.
- Schang S.J., Pepine C.G. (1977) Transient asymptomatic ST segment depression during daily activity. Am. J. Cardiol., 39: 396.
- Scheler S., Motz W., Strauer B.E. (1994) Mechanism of angina pectoris in patients with systemic hypertension and normal epicardial coronary arteries by arteriogram. Am. J. Cardiol., 73: 478-482.
- Stern S., Tzivoni D. (1974) Early detection of silent ischemie heart disease by 24-hour ECG monitoring active subjects. Br. Heart J., 36: 481-486.
- Tannenbaum O., Vesell H., Schack J.A. (1967) Comparison of good orthogonal lead system and the one additional chest lead with the conventional 12-lead electrocardiogram. Circulation, 35: 146-157.
- Tzivoni P., Stern S. (1973) Electrocardiographic pattern during sleep in healthy subjects and in pattern with ischemie heart disease. J. Electrocardiol., 6: 25-229.
- Zanchi F., Piazza V., Prati F. et al. (1995) Transient myocardial ischemia detected by Holter monitoring during the early post-infarction period. Coron. Artery Dis., 6: 389-396.