Метаболический синдром, диабет и сердечно-сосудистые заболевания
Содержание
- ТЕРМИНОЛОГИЯ СОГЛАСНО МКБ-10
- КЛАССИФИКАЦИЯ МЕТАБОЛИЧЕСКОГО СИНДРОМА
- ЭПИДЕМИОЛОГИЯ МЕТАБОЛИЧЕСКОГО СИНДРОМА
- ЭТИОЛОГИЯ И ПАТОГЕНЕЗ МЕТАБОЛИЧЕСКОГО СИНДРОМА
- КЛИНИКА И ДИАГНОСТИКА МЕТАБОЛИЧЕСКОГО СИНДРОМА, САХАРНОГО ДИАБЕТА И ПРЕДИАБЕТА
- ЛЕЧЕНИЕ И ПРОФИЛАКТИКА МЕТАБОЛИЧЕСКОГО СИНДРОМА, ДИАБЕТА И ПРЕДИАБЕТА
- КОРРЕКЦИЯ ДИСЛИПИДЕМИИ
- НОРМАЛИЗАЦИЯ УРОВНЯ АД — ВАЖНЕЙШИЙ АСПЕКТ ЛЕЧЕНИЯ БОЛЬНЫХ САХАРНЫМ ДИАБЕТОМ
- ПРОГНОСТИЧЕСКАЯ ВАЖНОСТЬ АДЕКВАТНОГО ЛЕЧЕНИЯ ИБС У БОЛЬНЫХ САХАРНЫМ ДИАБЕТОМ
- ЛИТЕРАТУРА
ТЕРМИНОЛОГИЯ СОГЛАСНО МКБ-10
Метаболический синдром представляет собой кластер четырех кардиометаболических факторов риска, которые согласно МКБ-10 определены так:
- ожирение — Е65–Е68;
- дислипидемия — Е78;
- АГ — I10–I15;
- нарушенная толерантность к глюкозе или сахарный диабет — E10–E14.
КЛАССИФИКАЦИЯ МЕТАБОЛИЧЕСКОГО СИНДРОМА
В Методическом руководстве по диагностике и лечению сахарного диабета, предиабета и сердечно-сосудистых заболеваний, разработанном Европейским кардиологическим обществом (ESC) совместно с Европейской ассоциацией по изучению сахарного диабета (EASD) в 2007 г. приведены три варианта идентификации метаболического синдрома: в соответствии с рекомендациями ВОЗ (1998), Adult Treatment Panel III (ATP-III, 2001) и Международной Федерации по изучению СД (IDF, 2005).
1. Критерии метаболического синдрома, рекомендуемые ВОЗ:
- Инсулинорезистентность, идентифицируемая по одному из таких состояний:
-
- сахарный диабет II типа;
- гипергликемия натощак;
- нарушение толерантности к глюкозе;
- или при нормальном уровне гликемии натощак (<6,1 ммоль/л (<110 мг/дл), усвоение глюкозы меньше нижнего квартиля для общей популяции в условиях гиперинсулинемии и эугликемии.
- Плюс наличие любых двух факторов из нижеперечисленных:
-
- наличие АГ (САД ≥140 мм рт. ст. или ДАД ≥90 мм рт. ст.) и проведение антигипертензивной терапии;
- уровень ТГ в плазме крови ≥1,7 ммоль/л (≥150 мг/дл) и/или уровень ХС ЛПВП<0,9 ммоль/л (<35 мг/дл) у мужчин или <1,0 ммоль/л (<39 мг/дл) у женщин;
- ИМТ <30 кг/м2 и/или коэффициент объема талия/бедро >0,9 у мужчин и >0,85 у женщин;
- уровень альбуминурии ≥20 мкг/мин или соотношение альбумин/креатинин ≥30 мг/г.
2. Критерии метаболического синдрома, рекомендуемые ATP III (Adult Treatment Panel III или Третьего отчета группы экспертов по выявлению, оценке и лечению гиперхолестеринемии у взрослых в рамках Национальной образовательной программы США/NCEP/пo ХС):
- Абдоминальный тип ожирения, выраженный как окружность талииа, b:
-
- более 102 см (>40 дюймов) для мужчин;
- более 88 см (>35 дюймов) для женщин.
- Уровень ТГ ≥1,7 ммоль/л (≥150 мг/дл).
- Уровень ХС ЛПВП:
-
- менее 1,03 ммоль/л (<40 мг/дл) для мужчин;
- менее 1,29 ммоль/л (<50 мг/дл) для женщин.
- Уровень АД ≥130/≥85 мм рт. ст.
- Уровень глюкозы в плазме крови натощак ≥6,1 ммоль/л (≥110 мг/дл)с.
аналичие избыточной массы тела и ожирения связывают с резистентностью к инсулину и метаболическим синдромом. Тем не менее, ожирение по абдоминальному типу в большей степени коррелирует с метаболическим синдромом, чем повышенный ИМТ. Поэтому обычное измерение окружности талии рекомендуется для выявления «весового» компонента метаболического синдрома;
bу некоторых пациентов мужского пола могут развиваться множественные метаболические факторы риска, если окружность талии погранично увеличена (например, 94–102 см/37–39 дюймов). Такие больные могут иметь значительную генетическую предрасположенность к развитию инсулинорезистентности. Коррекция образа жизни обеспечивает таким пациентам значительное преимущество;
сАмериканской ассоциацией по изучению сахарного диабета (ADA) недавно установлен предельный уровень, составляющий 5,6 ммоль/л или 100 мг/дл, превышение которого свидетельствует о наличии предиабета — нарушения толерантности к глюкозе, или сахарного диабета. Этот новый предельный уровень может быть использован для установления более низкой границы определения уровня глюкозы как одного из критериев метаболического синдрома.
3. Критерии метаболического синдрома, рекомендуемые Международной федерацией по изучению СД (IDF):
- Наличие ожирения центрального типа, определяемого как окружность талии (в см), с учетом специфики для различных этнических групп:
-
- европейцы: ≥94 см у мужчин, ≥80 см у женщин; в США, вероятно, в клинической практике будут по-прежнему использовать критерии, рекомендуемые ATP (102 см у мужчин и 88 см у женщин);
- жители Южной Азии: ≥90 см у мужчин и ≥80 см у женщин;
- жители Китая, Малайзии, азиатско-индейская популяция:
-
-
- китайцы: у мужчин ≥90 см, у женщин ≥80 см;
- японцы: у мужчин ≥85 см, у женщин ≥90 см;
-
-
- этнические центрально- и южноамериканцы — необходимо использование рекомендаций для жителей Южной Азии до получения более специфических данных;
- африканцы, проживающие к югу от Сахары — следует использовать рекомендации для европейцев до получения более специфических данных;
- восточно-средиземноморская и средневосточная (арабы) популяции — следует использовать рекомендации для европейцев до получения более специфических данных.
- Плюс наличие любых двух факторов из четырех нижеперечисленных:
-
- повышенный уровень ТГ: ≥1,7 ммоль/л (150 мг/дл), или проведение специфической гиполипидемической терапии;
- сниженный уровень ХС ЛПВП: <1,03 ммоль/л (40 мг/дл) у мужчин и <1,29 ммоль/л (50 мг/дл) у женщин, или проведение специфической терапии по поводу дислипидемии;
- АГ (уровень САД ≥130 мм рт. ст. или ДАД ≥85 мм рт. ст.), или гипотензивная терапия по поводу ранее диагностированной АГ;
- повышенный уровень глюкозы в плазме крови натощак ≥5,6 ммоль/л (100 мг/дл), или ранее диагностированный сахарный диабет II типа. При значении показателя выше 5,6 ммоль/л или 100 мг/дл настоятельно рекомендуется проведение пероральной пробы толерантности к глюкозе, однако это не является необходимым для определения наличия синдрома.
Кроме классического представления о метаболическом синдроме, изложенного в трех перечисленных выше документах, в 1997 г. C. Spencer и соавторами была выдвинута концепция менопаузального метаболического синдрома. На основании тщательного анализа работ, посвященных влиянию менопаузы на чувствительность к инсулину, показатели липидного и углеводного обмена, распределение жировой ткани и систему гемостаза, а также данных о влиянии заместительной гормональной терапии на перечисленные параметры у женщин, предложено выделять менопаузальный метаболический синдром как патогенетический комплекс факторов риска сердечно-сосудистых заболеваний, и в первую очередь ИБС, в основе которого лежит дефицит эстрогенов.
ЭПИДЕМИОЛОГИЯ МЕТАБОЛИЧЕСКОГО СИНДРОМА
Распространенность метаболического синдрома среди взрослого населения, оцененная даже с помощью более мягких критериев 2001 г, довольно высока и в США составляет 23,7% (24% среди мужчин и 23,4% среди женщин) . При этом в возрастных группах 20–49 лет метаболический синдром чаще отмечают у мужчин, в возрасте 50–69 лет распространенность метаболического синдрома практически одинакова у мужчин и женщин, в то время как у лиц старше 70 лет метаболический синдром чаще выявляют у женщин. Принято считать, что большая по сравнению с мужчинами частота метаболического синдрома у женщин старших возрастных групп обусловлена наступлением менопаузы. Этот вывод подтверждается данными исследования, проведенного в США среди женщин-эмигранток из бывшего СССР. У 25% женщин отмечали метаболический синдром по критериям Национальной образовательной программы по ХС, при этом частота его была выше у женщин в период постменопаузы. При многофакторном анализе у женщин с учетом возраста и менопаузального статуса только постменопауза была независимым предиктором компонентов метаболического синдрома.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ МЕТАБОЛИЧЕСКОГО СИНДРОМА
В начале третьего тысячелетия для человечества, преодолевшего на протяжении многовековой истории эпидемии жизненно опасных инфекций, на 1-е место по актуальности среди всех причин заболеваемости и смертности вышла проблема сердечно-сосудистых заболеваний. Значительную роль в этом сыграла модификация образа жизни, связанная с ограничением физической активности, повышением калорийности пищевых продуктов и неустанным ростом эмоционально-стрессовых нагрузок. Все это потенцировало основные модифицируемые факторы риска возникновения сердечно-сосудистых заболеваний, ставшие отрицательным достоянием прогресса, такие как: повышение АД, дислипидемии, сахарный диабет и ожирение. С 1988 г. после Бантинговской лекции G.Reaven взаимосвязанное сочетание данных патологий принято обозначать единым термином «метаболический синдром Х».
Основная идея создания концепции метаболического синдрома заключается в выделении популяции пациентов с высоким кардиоваскулярным риском, у которых проведение профилактических мероприятий, включающих модификацию образа жизни и применение адекватных лекарственных средств может значимо повлиять на основные показатели здоровья. Выделение пациентов с метаболическим синдромом имеет также большое клиническое значение, поскольку, с одной стороны, это состояние является обратимым, то есть при соответствующем лечении можно добиться исчезновения или, по крайней мере, уменьшения выраженности основных его проявлений, с другой — оно предшествует возникновению такой патологии, как сахарный диабет II типа и атеросклероз, что неразрывно связано с повышением смертности в популяции.
Ключевым моментом формирования метаболического синдрома является инсулинорезистентность, которая запускает порочный круг симптомов, приводящих в итоге к появлению тяжелых сердечно-сосудистых осложнений — ИМ, мозгового инсульта и недостаточности кровообращения. В то же время инсулинорезистентность не возникает спонтанно, а, по современным представлениям, инициирующим моментом как инсулинорезистентности, так и всего метаболического каскада чаще всего служит ожирение, которое, в свою очередь, предрасполагает к развитию АГ и способно вызвать снижение чувствительности периферических тканей к инсулину и последующее накопление избыточной массы тела. Вероятность развития АГ и всей сердечно-сосудистой патологии у лиц с избыточной массой тела на 50% выше, чем у лиц с нормальной массой тела по данным Фремингемского исследования. Согласно критериям ВОЗ, выявление и определение степени избыточной массы тела производится по ИМТ, в норме составляющего 18,5–24,9 кг/м2. Существуют убедительные сведения о том, что ожирение может явиться как независимым фактором риска, так и отягощающим моментом, значительно ухудшающим течение и прогноз как АГ, так и ИБС. Отмечено, что риск развития кардиоваскулярной и общей смертности повышается даже при достижении пределов верхней границы нормы массы тела. По результатам исследования здоровья медицинских сестер (Nurses Health Study), у женщин, ИМТ которых находился в пределах верхних границ нормы (от 23 до 24,9), отмечали в 2 раза более высокий риск развития ИБС, нежели у их коллег с ИМТ менее 21 кг/м2.
Установлено, что у больных АГ с ожирением риск развития ИБС повышен в 2–3 раза, а риск инсульта — в 7 раз. По результатам Фремингемского исследования отмечено, что как САД, так и ДАД повышалось в среднем на 1 мм рт.ст при увеличении массы тела на 1 кг.
Степень кардиоваскулярного риска при ожирении зависит от распределения жировой ткани в организме и значительно выше при так называемом центральном или андроидном типе, то есть при расположении жира преимущественно в области туловища по сравнению с бедрами и ягодицами. У пациентов с ожирением отмечают увеличение сердечного выброса с целью восполнения возросших метаболических потребностей, которое достигается не за счет повышения ЧСС, а за счет увеличения ударного объема. Высокий сердечный выброс ведет к развитию эксцентрической ГЛЖ и диастолической дисфункции. Если же утолщение стенки желудочка происходит несинхронно с дилатацией его полости, то создаются условия для формирования систолической дисфункции с последующим развитием кардиомиопатии ожирения и застойной СН на фоне увеличения внутрисосудистого объема. Предшествование или присоединение к клинической картине АГ усугубляет прогрессирование структурно-функциональных нарушений в миокарде. Формирование же ГЛЖ является самостоятельным предиктором развития внезапной смерти, причем, по данным Фремингемского исследования, половина мужчин старше 45 лет с ЭКГ-признаками ГЛЖ умирала в последующие 8 лет.
Известно, что адипоциты висцеральной жировой ткани секретируют свободные жирные кислоты, попадающие в воротную вену печени. Высокие концентрации свободных жирных кислот подавляют поглощение инсулина печенью, что приводит к гиперинсулинемии и относительной инсулинорезистентности, что сочетается с гипергликемией и гипертриглициридемией. В свою очередь, гиперинсулинемия приводит к развитию АГ посредством усиления реабсорбции натрия в нефронах и задержки жидкости; стимуляции САС; повышения содержания внутриклеточного кальция и ремоделирования артерий с утолщением их медии. Согласно современным представлениям, объединяющей основой всех проявлений метаболического синдрома являются первичная инсулинорезистентность и сопутствующая системная гиперинсулинемия. При этом инсулинорезистентность — это снижение реакции инсулинчувствительных тканей на инсулин при его достаточной концентрации. Наличие сахарного диабета значительно усиливает патогенное влияние основных факторов риска и предъявляет более жесткие требования к максимально допустимым величинам АД, с другой стороны, контроль АД, гиперлипидемии и гипергликемии положительно отражается на прогнозе жизни больного.
Как уже упоминалось, наиболее патогенным в развитии метаболического синдрома является абдоминальный тип ожирения. КТ и МРТ позволили изучить особенности распределения жира при абдоминальном ожирении. На основании полученных данных жировую ткань разделяют на висцеральную (интраабдоминальную) и подкожную. Именно повышение количества висцерального жира, как правило, сочетается с гиперинсулинемией, инсулинорезистентностью, АГ и липидными нарушениями. Строение висцеральной жировой ткани характеризуется морфологическими и функциональными особенностями. Интраабдоминальные адипоциты имеют большую плотность β-адренорецепторов, кортикостероидных и андрогенных рецепторов и относительно меньшую плотность α2-адренорецепторов и рецепторов к инсулину. Это определяет высокую чувствительность висцеральной жировой ткани к липолитическому действию катехоламинов и низкую — к антилиполитическому действию инсулина. Интенсивный липолиз в интраабдоминальных адипоцитах приводит к высвобождению большого количества свободных жирных кислот, которые поступают по воротной вене в печень, а затем в системный кровоток. Печень подвергается мощному и постоянному воздействию свободных жирных кислот, что приводит к целому ряду метаболических нарушений, развивается инсулинорезистентность, а затем системная гиперинсулинемия.
Свободные жирные кислоты в печени утилизируются двумя путями: либо активируют глюконеогенез, способствуя увеличению продукции глюкозы и снижению активности фосфатидил-нозитол-3-киназы инсулинового рецептора, нарушая транспорт глюкозы внутрь клеток, что приводит к развитию гипергликемии (эффект липотоксичности); либо используются для синтеза ТГ. Характер распределения жировой ткани оценивают с помощью отношения окружности талии к окружности бедер (ОТ/ОБ) пациента, измеренных с помощью сантиметровой ленты. При наличии абдоминального ожирения этот показатель превышает 1,0 у мужчин и 0,8 у женщин. Распределение жировой ткани в теле человека подвержено генетическому контролю.
Возникающая благодаря избыточному накоплению адипозной ткани инсулинорезистентность служит связующим звеном между ожирением, нарушением толерантности к глюкозе, АГ и дислипидемией.
Следует указать, что предрасположенность к инсулинорезистентности — это исторически сложившийся механизм адаптации организма человека к изменению внешних условий для поддержания энергетического баланса и нормального функционирования всех органов и систем. Для объяснения этой генетической предрасположенности к инсулинорезистентности J. Neel в 1962 г. выдвинул теорию бережливого генотипа. Согласно этой теории организм человека во времена благополучия и достатка в питании накапливал жиры и углеводы, а в периоды дефицита пищи сохранял нормогликемию и более экономно расходовал энергию за счет снижения уровня утилизации глюкозы в мышечной ткани, усиления глюконеогенеза и липогенеза. Таким образом, инсулинорезистентность способствовала выживанию человека в периоды голода. Инсулинорезистентность в течение определенного времени поддерживает организм в состоянии между здоровьем и болезнью. Однако сегодня в условиях гиподинамии и хронического переедания жиров, а также при наличии других неблагоприятных факторов, этот механизм становится патологическим и приводит к развитию сахарного диабета II типа, АГ, атеросклероза (Himsworth H., 1936; Reaven G., 1988; Warram J. и соавт., 1990).
В современной литературе принято указывать, что в 1988 г. G. Reaven ввел термин «синдром Х» или «метаболический синдром», критерии которого были уточнены в 2001 г. в рекомендациях Национального института здоровья США, и который нередко называют также смертельным квартетом, поскольку он подразумевает:
- ожирение;
- АГ;
- инсулинорезистентность;
- дислипидемию.
Однако рассмотрение проблемы метаболического синдрома началось значительно раньше. В 1966 г. J. Camus предложил проанализировать взаимосвязь между развитием гиперлипидемии, сахарного диабета II типа и подагры. Подобный вид нарушений обмена он назвал метаболический трисиндром (trisyndrome metabolique). В 1968 г. Н. Mehnert и Н. Kuhlmann описали взаимосвязь факторов, приводящих к обменным нарушениям при АГ и сахарном диабете, и ввели понятие «синдром изобилия». Позднее, в 1980 г., M. Henefeld и W. Leonhardt подобный вид нарушений стали описывать как метаболический синдром. А уже в конце 1980-х годов несколько авторов (Christlieb A.R. et al., 1985; Modan М. et al., 1985; Landsberg L., 1986; Ferranini Е. et al., 1987; Lithell Н. et al., 1988) независимо друг от друга отметили взаимосвязь между развитием у пациентов артериальной гипертонии, гиперлипидемии, инсулинорезистентности и ожирения.
И лишь в 1988 г. G. Reaven в своей Бантинговской лекции, впоследствии опубликованной в журнале «Diabetes», предложил термин «синдром X», в который включал тканевую инсулинорезистентность, гиперинсулинемию, нарушение толерантности к глюкозе, гипертриглицеридемию, снижение ХС ЛПВП и АГ. После чего в 1989 г. N. Kaplan показал, что у большинства пациентов с этим синдромом отмечают центральное ожирение, а для развернутой клинической картины данного вида метаболических нарушений предложил термин «смертельный квартет» (ожирение, АГ, сахарный диабет, гипертриглицеридемия). Позже был выявлен целый ряд состояний, которые ассоциируются с синдромом инсулинорезистентности: ГЛЖ с нарушением диастолической дисфункции, повышение внутрисосудистой свертываемости крови и др. В настоящее время наиболее употребляемым термином является «метаболический синдром». Учитывая ведущий патогенетический механизм его развития, нередко в качестве синонима используют термин «синдром инсулинорезистентности».
Золотым стандартом выявления инсулинорезистентности является эугликемическая клэмп-методика с использованием биостатора. Суть ее заключается в том, что пациенту в вену одновременно вводят растворы глюкозы и инсулина. Причем количество инсулина постоянное, а глюкозы — меняется для того, чтобы поддерживать определенный (нормальный) уровень глюкозы в крови. Значения вводимой глюкозы оценивают в динамике. Скорость введения глюкозы отражает биологическую эффективность инсулина. Определение инсулинорезистентности этим методом возможно лишь при наличии соответствующего оборудования. Косвенными показателями инсулинорезистентности можно считать:
- уровень базальной инсулинемии;
- индекс Саго — отношение глюкозы (ммоль/л) к уровню инсулина натощак (мЕд/мл) в норме превышает 0,33;
- критерий Ноmа — (инсулин натощак (мЕд/мл)·глюкоза натощак (ммоль/л):22,5) в норме не превышает 2,77.
M.N. Duncan и соавторы установили, что также можно использовать индекс инсулинорезистентности = (гликемия натощак)·(базальный уровень иммунореактивного инсулина):25.
Повышенное поступление свободных жирных кислот в печень и инсулинорезистентность гепатоцитов приводят к повышению синтеза ТГ и ЛПОНП. При инсулинорезистентности снижается активность липопротеидлипазы, которая контролируется инсулином. Возникает характерный тип дислипидемии, связанный с висцеральным ожирением: повышение концентрации ЛПОНП и ТГ, снижение концентрации ЛПВП и увеличение количества мелких плотных частиц ЛПНП. Таким образом, ожирение и инсулинорезистентность способствуют развитию нарушений липидного профиля, которые наряду с гипергликемией и гипертензией приводят к более раннему и быстрому развитию атеросклероза у больных с нарушениями углеводного обмена и висцеральным ожирением.
По результатам Фремингемского исследования, увеличение массы тела на 10% сопровождалось повышением концентрации ХС в плазме крови на 0,3 ммоль/л.
В то же время, сама концепция метаболического синдрома как кластера факторов риска сахарного диабета и кардиоваскулярных заболеваний претерпела за истекшие годы ряд эволюционных преобразований. До 2005 г. согласно рекомендациям АНА и Европейского общества кардиологов, верификацию метаболического синдрома производили в соответствии с критериями, изложенными в 2001 г. в программе АТР-III. Однако полученные в последнее время данные внесли существенные коррективы в профилактическую концепцию метаболического синдрома. Новая редакция определения метаболического синдрома была представлена в апреле 2005 г. на I Международном конгрессе по предиабету и метаболическому синдрому в Берлине, проводившемся Международной федерацией по сахарному диабету и на 75-м конгрессе Европейского общества по атеросклерозу в Праге.
Основной мотивацией для выдвижения нового консенсуса по метаболическому синдрому стало желание примирить специалистов с различными точками зрения; определить объединенный рабочий диагностический алгоритм и подчеркнуть те области, где больше необходимо накопление научных знаний. Принципиально новой позицией было утверждение абдоминального ожирения как основного критерия диагностики метаболического синдрома с ужесточением нормативных параметров объема талии (<94 см для мужчин и <80 см для женщин), ЛПВП (<0,9 ммоль/л для мужчин и <1,1 ммоль/л для женщин) и гипергликемии натощак (>5,6 ммоль/л). При этом еще раз было подчеркнуто, что макрососудистые осложнения (ИБС, ИМ, церебральный инсульт) являются главной причиной смерти больных с метаболическим синдромом и сахарным диабетом. Риск развития смерти больного с метаболическим синдромом без клинических проявлений коронарной недостаточности вследствие основных сердечно-сосудистых осложнений такой же, как у больных, ранее перенесших ИМ без метаболического синдрома на момент включения в исследование. Кроме того, еще раз была подчеркнута необходимость адекватности выбора патогенетически обоснованного антигипертензивного лечения, способного защитить органы-мишени, поскольку именно контроль АД является первостепенной задачей для терапии данного контингента больных, позволяя на 51% уменьшить количество основных кардиоваскулярных событий, в то время как контроль гиперлипидемии снижает риск смерти от ИБС — на 36%, а коррекция уровня гипергликемии может снизить частоту развития ИМ только на 16%.
Следует отметить, что единой концепции метаболического синдрома для лиц мужского и женского пола не существует, поскольку формирование метаболического синдрома у мужчин находится в прямой зависимости от выраженности абдоминального ожирения, а у женщин такая зависимость от ожирения появляется только с наступлением менопаузы и гипоэстрогенемии. Менопаузальный метаболический синдром мы сознательно выделяем потому, что 50% пациентов с АГ составляют женщины в период менопаузы, частота выявления сахарного диабета II типа у женщин 40–50 лет — 3–5%, а в возрасте 60 лет — 10–20%, то есть с возрастом прогрессируют нарушения углеводного обмена.
Различие степени риска возникновения фатальных сердечно-сосудистых заболеваний нашло свое отражение в системе SCORE, презентованной еще в 2003 г. на конгрессе Европейского общества кардиологов. Оно свидетельствует о том, что у мужчин сердечно-сосудистые заболевания начинают прогрессировать с достижением 40-летнего возраста, тогда как у женщин такая закономерность возникает лишь с достижением возраста 50–55 лет и наступлением менопаузы.
В исследовании DECODE установлено, что повышение АД и нарушение чувствительности к инсулину повышают риск развития сердечно-сосудистых заболеваний у женщин в постменопаузальный период даже при незначительных изменениях АД и чувствительности к инсулину. Наиболее уязвимый период переходного возраста женщин — пременопауза, то есть начальный период снижения функции яичников (в основном в возрасте старше 45 лет и до наступления менопаузы), что сопровождается критическим снижением уровня эстрогенов. Реализация дефицита эстрогенов в период менопаузы включает влияние на метаболизм липопротеинов, прямое влияние на биохимические процессы в стенке сосудов через специфические рецепторы к эстрогенам, а также опосредованное влияние через метаболизм глюкозы, инсулина, гомоцистеина, систему гемостаза и т.д.
Логическим продолжением таких взглядов стала презентация гипотезы о гендерном различии в патогенезе метаболического синдрома у мужчин и женщин в рамках секционных заседаний «Женщины в сердце» в сентябре 2005 г. на очередном Конгрессе европейского общества кардиологов. Основная идея этой гипотезы базируется на постулате о том, что у мужчин ведущим предиктором метаболического синдрома является абдоминальное ожирение независимо от возраста; у женщин основные пусковые механизмы формирования метаболического синдрома — сахарный диабет и менопауза. Высказана мысль о том, что менопауза — это естественная модель иммунорезистентного состояния и эндотелиальной дисфункции.
КЛИНИКА И ДИАГНОСТИКА МЕТАБОЛИЧЕСКОГО СИНДРОМА, САХАРНОГО ДИАБЕТА И ПРЕДИАБЕТА
Неуклонное прогрессирование всемирной эпидемии сахарного диабета и метаболического синдрома не оставило равнодушными большинство практикующих врачей, пришедших к заключению, что только полисистемный подход к решению этой задачи может увенчаться успехом. Сахарный диабет и заболевания сердечно-сосудистой системы часто представляют собой две стороны одной медали: с одной стороны, сахарный диабет можно расценивать как состояние, способствующее развитию ИБС, а с другой — у многих пациентов с уже существующей ИБС отмечают сахарный диабет или предиабетическое состояние. Таким образом, давно назрела необходимость выработать совместный подход к этой проблеме со стороны кардиологов и эндокринологов, что позволит повысить качество диагностики и лечения в рамках единой медицинской помощи миллионам пациентов с сердечно-сосудистыми и метаболическими заболеваниями.
Подобный кардиодиабетологический подход не только крайне важен для пациентов, но и открывает путь для дальнейшего прогресса в области кардиологии и диабетологии. Европейское кардиологическое общество (ESC) и Европейская ассоциация по изучению сахарного диабета (EASD), отвечая на этот призыв, приняли решение о разработке объединенных, основанных на принципах доказательной медицины, рекомендаций по лечению сахарного диабета и сердечно-сосудистых заболеваний. Цель внедрения данных рекомендаций заключается в улучшении лечебно-профилактической помощи пациентам с манифестным сахарным диабетом, больным с нарушенной толерантностью к глюкозе и высоким риском развития сахарного диабета, а также в повышении эффективности терапии сердечно-сосудистых заболеваний в данной популяции.
В рекомендациях были приняты классы рекомендаций и уровни доказательности для оценки терапевтических подходов, ставшие уже традиционными для большинства подобных методических руководств. Суть единого подхода рабочей группы к рассматриваемой проблеме выражена в рис. 4.1.
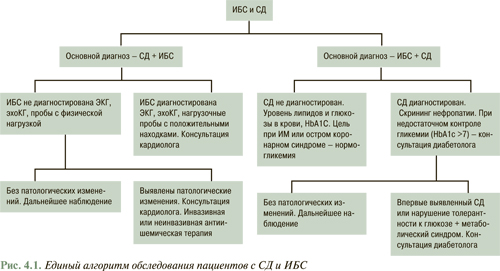
Краеугольный камень терапии любого из патологических состояний — установление диагноза и выбор наиболее адекватной терапии. Для этого необходимым будет знакомство кардиологов с каноническим для диабетологов подходом для верификации основного диагноза в соответствии с критериями ВОЗ (1999) и Американской ассоциации по диабету (ААД) (1997, 2003) (табл. 4.1)
Таблица 4.1
Критерии, используемые в глюкометаболической классификации в соответствии с рекомендациями ВОЗ (1999) и Американской ассоциации по изучению сахарного диабета (ААД) за 1997 и 2003 гг.
| Глюкометаболическая категория | Источник | Классификационные критерии, ммоль/л (мг/дл)* |
| Нормальная регуляция уровня глюкозы в крови | ВОЗ
ААД (1997) ААД (2003) |
FPG < 6,1 (110), 2-h PG <7,8 (140)
FPG <6,1 (110) FPG <5,6 (100) |
| Гипергликемия натощак | ВОЗ
ААД (1997) ААД (2003) |
FPG >6,1 (110), но <7,0 (126); 2-h PG <7,8 (140)
FPG >6,1 (110), но <7,0 (126) FPG >5,6 (100) но <7,0 (126) |
| Нарушение толерантности к глюкозе | ВОЗ | FPG <7,0 (126); 2-h PG >7,8, но <11,1 (200) |
| Нарушение глюкозного гомеостаза | ВОЗ | Как для гипергликемии натощак или нарушения глюкозного гомеостаза |
| Сахарный диабет | ВОЗ
ААД (1997) ААД (2003) |
FPG > 7,0 (126) или 2-h PG >11,1 (200)
FPG > 7,0 (126) FPG > 7,0 (126) |
*Значения приведены для уровня глюкозы в плазме венозной крови; FPG — уровень глюкозы в плазме крови натощак; 2-h PG — уровень глюкозы в плазме крови через 2 ч после нагрузочной пробы (1 ммоль/л соответствует 18 мг/дл).
Учитывая тот факт, что львиная доля в распространенности диабета в популяции принадлежит сахарному диабету II типа, авторы руководства, тем не менее, уделили должное внимание этиологической классификации нарушений углеводного обмена, отдавая себе отчет в том, что внимательное отношение к первопричине заболевания является залогом верного выбора терапевтических лечебных мероприятий.
Этиологическая классификация была представлена таким образом:
- Сахарный диабет I типа (вследствие гибели бета-клеток, обычно ведущей к абсолютной инсулиновой недостаточности):
-
- аутоиммунный:
- идиопатический.
- Сахарный диабет II типа (может варьировать в пределах от преимущественной резистентности к инсулину в сочетании с относительной инсулиновой недостаточностью до преимущественно секреторного дефекта с резистентностью к инсулину или без нее).
- Другие специфические типы сахарного диабета:
-
- обусловленный генетическими дефектами функции бета-клеток;
- обусловленный генетическими дефектами в действии инсулина (например липоатрофический диабет);
- при заболеваниях экзокринного отдела поджелудочной железы (например панкреатит, травма, панкреатэктомия, неоплазия, муковисцидоз);
- при эндокринопатиях (например синдром Кушинга, акромегалия, феохромоцитома, гипертиреоз);
- медикаментозно или химически индуцированный (например вызванный кортизолом, антидепрессантами, тиазидами и др.);
- вызванный инфекцией (цитомегаловирус);
- редкие формы иммунологически обусловленного сахарного диабета;
- другие генетические синдромы, иногда связываемые с сахарным диабетом (например, синдром Дауна, атаксия Фридрейха, синдром Клайнфелтера, синдром Вольфрама).
- Диабет беременных (включает категории гестационного нарушения толерантности к глюкозе и собственно гестационный диабет).
Принимая во внимание трудности в интерпретации уровня глюкозы в различных средах, с которыми сталкивается практикующий врач, целесообразным, на наш взгляд, является использование коэффициентов перерасчета, представленных в табл. 4.2.
Таблица 4.2
Коэффициенты для перерасчета уровня плазменной глюкозы
| N п/п | Перерасчет для вычисления уровня плазменной глюкозы |
| 1 | Глюкоза плазмы крови (ммоль/л) = 0,668+1,119 х глюкоза в цельной крови (ммоль/л) |
| 2 | Глюкоза плазмы крови (ммоль/л) = 0,102+1,066 х глюкоза капиллярной крови (ммоль/л) |
| 3 | Глюкоза плазмы крови (ммоль/л) = –0,137+1,047 х глюкоза сыворотки (ммоль/л) |
Первичный скрининг для выявления потенциальных больных сахарным диабетом II типа наиболее эффективен при использовании шкалы для неинвазивного определения риска (пример подобной шкалы приведен на рис. 4.2) в сочетании с проведением диагностической пероральной пробы толерантности к глюкозе у лиц с высокой степенью риска по данной шкале. Выявление и диагностическая классификация сахарного диабета и предиабетических состояний должны основываться на уровне возможного последующего риска сердечно-сосудистых осложнений. Кардиологам хорошо известна высокая степень кардиоваскулярного риска, характерная для пациентов с сахарным диабетом, в соответствии с которой такие больные, даже без проявлений ИБС, имеют такую же степень риска развития основных кардиоваскулярных событий, как и больные с постинфарктным кардиосклерозом.

Для удобства оценки степени риска заболевания сахарным диабетом в течение 10-летнего периода у взрослых врачам предложено использовать шкалу FINDRISK (FINnish Diabetes Risk Score) (см. рис. 4.2).
Учитывая широкую распространенность нарушений углеводного обмена, необходимо адекватно оценивать эпидемиологию сахарного диабета, а также нарушений толерантности к глюкозе, и их соотношение с риском развития сердечно-сосудистых осложнений. Гипергликемию следует рассматривать в неразрывной связи с ИБС. Каждому повышению уровня HbA1c на 1% соответствует определенный прирост риска ИБС. Риск развития ИБС для пациентов с выраженным сахарным диабетом повышен в 2–3 раза у мужчин и в 3–5 раз у женщин по сравнению с лицами без диабета. Показатель постпрандиальной (постнагрузочной) гликемии более информативен для оценки потенциального риска ИБС, чем показатель уровня глюкозы натощак, а постпрандиальная (постнагрузочная) гипергликемия также является предиктором повышенного сердечно-сосудистого риска у лиц с нормальным уровнем глюкозы в крови натощак. Повышение контроля постпрандиальной гликемии позволяет снизить уровень сердечно-сосудистого риска и смертности. Глюкометаболические нарушения представляют собой особенно высокий риск сердечно-сосудистой заболеваемости и смертности у женщин, которым требуется в этом отношении особое внимание. Риск развития инсульта повышен у пациентов с сахарным диабетом и нарушением толерантности к глюкозе. У пациентов с инсультом нераспознанную гипергликемию по большей части выявляют при проведении перорального глюкозотолерантного теста. Целевой уровень гликемии при лечении больных сахарным диабетом, рекомендуемый различными организациями, представлен в табл. 4.3.
Таблица 4.3
Целевые уровни гликемии при лечении пациентов с СД, рекомендуемые различными организациями
| Организация | HbA, % | Уровень глюкозы в плазме крови натощак, ммоль/л (мг/дл) | Уровень постпрандиальной гликемии, ммоль/л |
| Американская ассоциация по изучению сахарного диабета (ААД) | <7 | <6,7 (120) | Нет данных |
| Международная федерация по изучению сахарного диабета-Европа (IDF-Europe) | ≤6,5 | ≤6,0 (108) | ≤7,5 (135) |
| Американская коллегия эндокринологии | ≤6,5 | <6,0 (108) | ≤7,8 (140) |
Применение перорального глюкозотолерантного теста у пациентов с метаболическим синдромом позволяет идентифицировать лиц с более высоким риском сердечно-сосудистых осложнений, хотя и не может обеспечить более эффективный или надежный прогноз сердечно-сосудистого риска, чем использование шкалы, базирующейся на основных показателях сердечно-сосудистого риска (уровень АД, курение, уровень ХС в плазме крови). Вместе с тем, следует отметить, что определение уровня глюкозы натощак — нечувствительный метод для установления скрытой гипергликемии. Оценка риска предполагаемого развития сахарного диабета II типа должна быть частью общей программы рутинной медицинской помощи, использующей все доступные методы оценки риска. Пациентам без установленного сахарного диабета II типа, но с диагностированной ИБС, следует проводить пероральную пробу толерантности к глюкозе. Лица с высокой степенью риска развития сахарного диабета II типа должны получить консультацию в плане коррекции образа жизни, а при необходимости — получить адекватную фармакотерапию для снижения риска развития сахарного диабета. Эти мероприятия также способны снизить риск развития ИБС. Появление сахарного диабета у лиц с нарушенной толерантностью к глюкозе может быть отсрочено применением некоторых препаратов (например метформина, акарбозы и розиглитазона). Пациенты с сахарным диабетом должны поддерживать достаточную физическую активность для снижения риска сердечно-сосудистых осложнений.
ЛЕЧЕНИЕ И ПРОФИЛАКТИКА МЕТАБОЛИЧЕСКОГО СИНДРОМА, ДИАБЕТА И ПРЕДИАБЕТА
Первостепенная задача, стоящая перед врачами, — своевременно начатое лечение, включающее немедикаментозные и медикаментозные методы коррекции метаболических нарушений и ожирения, а при выборе лекарственных средств необходимо учитывать их метаболические эффекты и органопротекторное действие. Терапия метаболического синдрома подразумевает выполнение 5 основных задач: нормализации массы тела, повышения физической активности, проведения антигипертензивной терапии, применения липидснижающих препаратов и дезагрегационной терапии с использованием ацетилсалициловой кислоты.
Первоначальными должны быть мероприятия, направленные на уменьшение массы тела и нормализацию метаболических нарушений. Влияние уменьшения массы тела на уровень АД было продемонстрировано в ряде крупных многоцентровых исследований, таких как ТОНР-1, TAIM, TOMHS, XENDOS.
Отмечено, что немедикаментозная терапия, связанная с коррекцией образа жизни, улучшает метаболический контроль; самонаблюдение улучшает гликемический контроль; контроль уровня глюкозы периферической крови, обеспечивающий уровень нормогликемии (HbA1c=6,5%), снижает частоту микро- и макрососудистых осложнений; интенсивная инсулинотерапия при сахарном диабете I типа снижает заболеваемость и смертность; ранняя интенсификация терапии для достижения установленных целей лечения улучшает комбинированный показатель заболеваемости и смертности при сахарном диабете II типа; у пациентов с сахарным диабетом II типа при неудачной попытке достичь целевого уровня глюкозы следует рассмотреть возможность раннего назначения инсулинотерапии; метформин рекомендуется как препарат первого ряда у пациентов с избыточной массой тела и сахарным диабетом II типа.
Целесообразность назначения адекватной сахароснижающей терапии подтверждена возможностью ее воздействия на прогностически значимый показатель гликозилированного гемоглобина (HbA1c, %). При этом следует стремиться к достижению целевого уровня HbA1c, который ассоциируется с максимально положительным клиническим эффектом терапии.
Крайне важным является и тот факт, что у больных сахарным диабетом II типа могут отмечать нарушения липидного обмена, повышенное АД, а также высокий риск развития ИБС. Следует проводить модификацию всех основных сердечно-сосудистых факторов риска.
КОРРЕКЦИЯ ДИСЛИПИДЕМИИ
Больным с выраженной дислипидемией, не поддающейся коррекции диетотерапией, назначают гиполипидемические препараты: статины (симвастатин, правастатин, аторвастатин) или фибраты. Решение о медикаметозном лечении дислипидемии базируется как на данных определения уровня липидов после соблюдения гиполипидемической диеты не менее 3–6 мес, так и на результатах определения суммарной степени риска развития атеросклероза. При отсутствии эффекта немедикаментозных методов и сахароснижающей терапии, а в некоторых уже упомянутых случаях — одновременно с этими мероприятиями, используют гиполипидемические средства. Закончен целый ряд исследований, в которых проанализированы результаты применения липидоснижающих средств, прежде всего статинов, в подгруппе больных сахарным диабетом II типа. Так, в исследовании 4S (Scandinavian Simvastatin Survival Study) симвастатин значительно уменьшал количество осложнений ИБС у пациентов с сахарным диабетом II типа и высоким уровнем ЛПНП. Общая смертность под влиянием симвастатина снизилась на 45% в группе больных сахарным диабетом II типа (на 29% — в группе пациентов без сахарного диабета II типа), а риск ИМ — на 55% (на 32% в группе больных без сахарного диабета II типа ).
В исследовании CARE (Cholesterol and Recurrent Events) другой ингибитор ГМГ-КоА-редуктазы — правастатин у больных с ИБС и сахарным диабетом II типа с умеренным повышением ЛПНП также достоверно на 25% предупреждал осложнения ИБС.
В исследовании HPS (Heart Protection Study), в которое были включены более 4 тыс. пациентов с сахарным диабетом II типа без ИБС, симва-статин на 25% снижал риск развития острого коронарного синдрома, инсульта и необходимость в реваскуляризации. И, наконец, в 2004 г. были получены результаты многоцентрового рандомизированного, двойного слепого плацебо-контролируемого исследования CARDS, ставшего первым в изучении применения статинов для первичной профилактики, выполненным исключительно у пациентов с сахарным диабетом II типа. Участники CARDS принимали аторвастатин в дозе 10 мг/день (в группе с повышенным риском сердечно-сосудистой заболеваемости и смертности, но без установленного сердечно-сосудистого заболевания). При этом средний исходный уровень ХС ЛПНП составил 3,0 ммоль/л (117 мг/дл). Согласно полученным результатам, аторвастатин обеспечил положительное влияние у пациентов с сахарным диабетом II типа, у которых не было в анамнезе сердечно-сосудистых заболеваний и был нормальный или слегка повышенный уровень ХС. В результате выявлено снижение частоты серьезных кардиоваскулярных событий на 37% (р=0,001); инсультов — на 48% (р=0,016); смертности от всех причин — на 27% (р=0,059). При этом положительный эффект не зависел от исходного уровня липидов, пола или возраста. Доклад, посвященный исследованию CARDS, заканчивался риторическим высказыванием: «Дебаты относительно того, для всех ли пациентов с сахарным диабетом II типа оправдано лечение статинами, ныне должны сфокусироваться на том, существуют ли пациенты с достаточно низким риском, чтобы не назначать им лечение статинами». Таким образом, статины сегодня — единственные гиполипидемические препараты, зарекомендовавшие себя как эффективные в нескольких многоцентровых контролируемых исследованиях в предупреждении сердечно-сосудистых осложнений у больных сахарным диабетом II типа.
Повышенный уровень ХС ЛПНП и сниженный ХС ЛПВП являются важными факторами риска у лиц с сахарным диабетом. Больным сахарным диабетом при сопутствующей ИБС терапию статинами следует назначать независимо от исходного ХС ЛПНП и проводить, ориентируясь на достижение целевого уровня показателя <1,8–2,0 ммоль/л (<70–77 мг/дл). Следует рассмотреть возможность назначения статинов взрослым пациентам с сахарным диабетом II типа без сопутствующей ИБС, если уровень общего ХС — >3,5 ммоль/л (>135 мг/дл); цель данной терапии — добиться снижения уровня ХС ЛПНП в крови на 30—40%. С учетом высокой степени риска развития ИБС на протяжении жизни предполагается, что терапию статинами следует назначать всем пациентам с сахарным диабетом I типа в возрасте старше 40 лет. У пациентов в возрасте 18–39 лет (с сахарным диабетом как I, так и II типов) целесообразность назначения статинов следует рассмотреть при наличии дополнительных факторов риска (например нефропатии, недостаточно эффективного контроля гликемии, ретинопатии, АГ, гиперхолестеринемии, проявлений метаболического синдрома, при наличии ранних сердечно-сосудистых заболеваний в семейном анамнезе). У больных сахарным диабетом с гипертриглицеридемией >2 ммоль/л (177 мг/дл), сохраняющейся после достижения целевого уровня ХС ЛПНП с помощью статинов, терапия статинами должна быть интенсифицирована для снижения до целевого уровня содержания ХС не-ЛПВП, не связанного с ЛПНП. В некоторых клинических ситуациях целесообразно рассмотреть возможность комбинированной терапии с добавлением эзетимиба, никотиновой кислоты или фибратов.
НОРМАЛИЗАЦИЯ УРОВНЯ АД — ВАЖНЕЙШИЙ АСПЕКТ ЛЕЧЕНИЯ БОЛЬНЫХ САХАРНЫМ ДИАБЕТОМ
Рекомендуемый целевой уровень АД у пациентов с сахарным диабетом и АГ — ниже 130/80 мм рт. ст. Риск развития сердечно-сосудистых осложнений у пациентов с сахарным диабетом и АГ значительно повышен. Этот риск может быть эффективно снижен проведением антигипертензивной терапии. У больных сахарным диабетом для удовлетворительного контроля уровня АД обычно необходимо назначение комбинации нескольких гипотензивных средств. Схема гипотензивной терапии у пациентов с сахарным диабетом должна включать применение ингибитора РААС.
Антигипертензивными препаратами первого выбора у таких больных являются ингибиторы АПФ, поскольку в ряде крупных многоцентровых исследований было достаточно убедительно доказано их метаболически нейтральное и органопротекторное действие. Результаты исследований UKPDS, ABCD, CAPPP, FACET продемонстрировали нейтральное действие ингибиторов АПФ на углеводный и липидный обмен.
В исследованиях HOPE, CAPPP, LIFE установлен положительный эффект использования ингибиторов АПФ и антагонистов рецепторов ангиотензина-II при длительном применении, выражающийся в снижении риска развития сахарного диабета II типа. Такое действие может быть связано с их возможностью блокады образования и действия ангиотензина на функцию эндотелия, на чувствительность периферических тканей к инсулину и снижение инсулинорезистентности.
Целенаправленное выявление микроальбуминурии и адекватная гипотензивная терапия, включающая применение ингибиторов АПФ и блокаторов рецепторов ангиотензина-II, снижает частоту микро- и макроваскулярных нарушений при сахарном диабете I и II типов.
В соответствии с данными субисследования PERSUADE у пациентов с ИБС и сахарным диабетом, проведенного в рамках EUROPA (март 2004 г.), периндоприл в дозе 8 мг в течение 4 лет позволил снизить риск возникновения первичной конечной точки на 19%, ИМ — на 23%, нефатального ИМ — на 34%, СН — на 46%. Отмечено, что абсолютная эффективность ингибитора АПФ периндоприла была большей у пациентов с сахарным диабетом в 2 раза, что подтверждает эффективность и обоснованную целесообразность лечения больных, у которых сердечно-сосудистый риск выше.
Важное место занимают антагонисты кальция пролонгированного действия для лечения АГ у больных с метаболическим синдромом, поскольку доказано их метаболически нейтральное действие на углеводный и липидный обмен (амлодипин в исследовании ALLHAT), а также — кардио- и ренопротекторный эффекты.
Блокаторы β-адренорецепторов с высокой селективностью, способные блокировать избирательно β1-адренорецепторы, такие как бетаксолол, бисопролол, небиволол, могут успешно использовать в лечении метаболического синдрома. Применение диуретиков показано таким больным в связи с наличием в патогенезе АГ при метаболическом синдроме задержки натрия и гиперволемии. Однако не все диуретики безопасны и эффективны у больных с метаболическими нарушениями. В настоящее время широкое применение получили новые тиазидоподобные препараты, значительно отличающиеся своими свойствами, такие как индапамид.
Таблица 4.4
Рекомендуемые цели терапии у пациентов с сахарным диабетом и ИБС (адаптировано из рекомендаций Европейского руководства по профилактике сердечно-сосудистых заболеваний)
| Показатель | Целевой уровень |
| Уровень АД (систолического/диастолического), мм рт. ст. | <130/80 |
| При почечной недостаточности, протеинурии >1 г/24 ч | <125/75 |
| Эффективность контроля гликемии HbA1c, % (определенный DCCT-стандартизованным методом, для формулы пересчета по некоторым европейским национальным стандартам) |
≤6,5 |
| Уровень глюкозы в плазме венозной крови, ммоль/л (мг/дл): | |
| — натощак | <6,0 (108) |
| — максимальная постпрандиальная гликемия | <7,5 (135) при сахарном диабете II типа и 7,5–9,0 (135–160) при сахарном диабете I типа |
| Липидный спектр крови, ммоль/л (мг/дл): | |
| — общий ХС | <4,5 (175) |
| — ХСЛПНП | ≤1,8 (70) |
| — ХС ЛПВП: | |
| мужчины | >1,0 (40) |
| женщины | >1,2 (>46) |
| — ТГ | <1,7 (<150) |
| Соотношение общий ХС/ЛПВП (не рекомендуется для контроля эффективности лечения, однако может быть использован для оценки метаболизма и степени риска) | <3 |
| Отказ от курения | Обязателен |
| Регулярные физические нагрузки, мин/день | >30-45 |
| Нормализация массы тела: | |
| — ИМТ, кг/м2 | <25 |
| — степень похудения при избыточной массе тела, % | 10 |
| Оптимальная окружность талии (с учетом этнической специфики), см: | |
| мужчины | <94 |
| женщины | <80 |
| Диетические особенности: | |
| — суточное потребление поваренной соли, г | <6 |
| — потребление жиров (% общей калорийности суточного рациона): | |
| насыщенных жиров | <10 |
| трансжиров | <2 |
| полиненасыщенных n-6 | 4-8 |
| полиненасыщенных n-3 | 2 г/сут в пересчете на линоленовую кислоту и 200 мг/сут в пересчете на жирные кислоты с очень длинной цепью |
Больным с метаболическим синдромом показано применение препаратов центрального действия, а именно активатора I2-имидазолиновых рецепторов (моксонидин). Эта группа препаратов обладает свойством повышать чувствительность тканей к инсулину, способностью уменьшать ГЛЖ, уступающую только ингибиторам АПФ, оказывает выраженное кардиопротекторное действие. Учитывая то, что в развитии метаболического синдрома основную роль играют активация симпатической нервной системы, инсулинорезистентность, гиперинсулинемия, а также наличие выраженных метаболических нарушений, одним из рекомендуемых классов гипотензивных препаратов являются препараты центрального типа действия, в частности, моксонидин, который приводит к нормализации уровня глюкозы крови, снижению инсулинорезистентности, улучшению показателей липидного обмена. Экспериментальные и клинические исследования показали, что моксонидин действует на ключевые элементы метаболического синдрома. В настоящее время проводится несколько исследований с применением моксонидина у пациентов с метаболическим синдромом. Преимущества моксонидина — простота применения, хорошая эффективность и переносимость как при монотерапии, так и в комбинации, улучшение метаболических показателей.
ПРОГНОСТИЧЕСКАЯ ВАЖНОСТЬ АДЕКВАТНОГО ЛЕЧЕНИЯ ИБС У БОЛЬНЫХ САХАРНЫМ ДИАБЕТОМ
Ранняя стратификация риска должна быть частью оценки состояния пациентов с сахарным диабетом после острого коронарного синдрома. При лечении каждого пациента с сахарным диабетом после перенесенного острого коронарного синдрома следует стремиться достичь целей терапии, перечисленных в табл. 4.4. Пациентам с острым ИМ и сахарным диабетом показано назначение тромболитической терапии на тех же основаниях, что и больным без сахарного диабета. Пациентам с сахарным диабетом и острым коронарным синдромом, по возможности, следует проводить раннюю ангиографию и механическую реваскуляризацию. Применение блокаторов β-адренорецепторов позволяет снизить заболеваемость и смертность у пациентов с сахарным диабетом и острым коронарным синдромом.
Важнейшим лечебным мероприятием по предупреждению тромботических осложнений метаболического синдрома рекомендовано назначение ацетилсалициловой кислоты (HOT, USPHS, ETDRS), достоверно снижающее риск развития основных сердечно-сосудистых осложнений. Полноценная реализация всех вышеперечисленных терапевтических подходов может существенно повлиять на качество жизни пациентов и предотвратить возникновение угрожающих жизни кардиоваскулярных осложнений. Ацетилсалициловую кислоту пациентам с сахарным диабетом назначают по тем же показаниям и в тех же дозах, что и пациентам без этого заболевания. Больным сахарным диабетом с острым коронарным синдромом дополнительно к применению ацетилсалициловой кислоты можно назначать ингибиторы агрегации тромбоцитов, индуцированной активацией АДФ-рецепторов (клопидогрел).
Назначение ингибитора АПФ в дополнение к другой терапии снижает риск развития сердечно-сосудистых осложнений у пациентов с сахарным диабетом и диагностированной ИБС. Жесткий глюкометаболический контроль обеспечивает преимущество пациентам с сахарным диабетом и острым ИМ. Он позволяет максимально эффективно реализовывать различные терапевтические стратегии.
Тщательный учет и анализ факторов риска позволяет выделить контингент больных с высокой угрозой развития основных кардиоваскулярных осложнений. Акцентирование внимания в клинической практике на пациентах с сахарным диабетом, нарушенной толерантностью к глюкозе и избыточной массой тела даст возможность модифицировать факторы риска, а значит, положительно повлиять на прогноз этого серьезного кардиологического контингента пациентов.
ЛИТЕРАТУРА
- World Health Organization — International Society of Hypertension (1999) Guidelines for the Management of Hypertension. J Hypertension; 17 (2): 151-183; 30 (Suppl. 2): 1-7.
- Ackroff K., Sclafani A. (1996) Effects of the lipase inhibitor orlistat on intake and preference for dietary fat in rats. Am J Physiol, 271 (1Pt2): R48-54.
- Adult Treatment Panel III (2002) Third Report of the National Cholesterol Education Programme (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel Ill) Final report. Circulation, 106(25): 3143-3421.
- Alberti K.G., Zimmet P.Z. (1998) Definition, diagnosis and classification of diabetes mellitus and its complications. Part 1: diagnosis and classification of diabetes mellitus provisional report of a WHO consultation. Diabet Med, 15 (7): 539-53.
- Alberti K.G., Zimmet P., Sbaw J. (2005) The metabolic syndrome — a new worldwide definition. Lancet, 366 (9491): 1059-1062.
- Alessi M.C., Perietti F., Morange P. et al. (1997) Production of plasminogen activator inhibitor 1 by human adipose tissue: possible link between visceral fat accumulation and vascular disease. Diabetes, May, 46 (5): 860-7.
- American College of Endocrinology (2002) American College of Endocrinology Consensus Statement on Guidelines for Glycemic Control. Endocr. Pract., 8 (Suppl. 1): 1-82.
- Best J., Nicholson G.O., Neal et al. (1996) Atorvastatin and simvastatin reduce elevated cholesterol in non-insulin dependent diabetes. Diabetes Nutr Metab, 9: 74-80.
- Bjorntop P. (1990) «Portal» adipose tissue as a generator of risk factors for cardiovascular disease and diabetes. Aterosclerosis, 10: 493-496.
- Borkan G.A., Sparrow D., Wisnrewski C. et al. (1986) Body weight and coronary disease risk: patterns of risk factor change associated with lon-term weight change. The normative ageing study. Am J Epidemiol., 124: 410-9.
- Broun A. (1998) Treating patients with documented atherosclerosis to national cholesterol education program-recommended low-density-lipoprotein cholesterol goals with atorvastatin, fluvastatin, lovastatin and simvastatin. JACC, 32: 665-72.
- Collins R., Yusuf S. (2001) HPS-Simvastatin and anti-oxidants. Americal Heart Association Scientific Sessions; November 11-14, Anaheim, California, Plenary Session VII: Late — Breaking Clinical Trials.
- De Backer G., Ambrosioni K., Borch-Johnsen K. et al. Third Joint Task Force of the European and Other Societies (2003) European guidelines on cardiovascular disease prevention. Eur. J. Cardiovasc. Prev. Rehab., 10 (Suppl. 1): Sl-S78.
- Fogari R., Preti P., Banderali A. et al. (1999) ACE-inhibition but not angiotensin II antagonism improves fibrinolisis and sensitivity in hypertensive post-menopausal women. J Hypertens, 17 (Suppl. 3): S143.
- Frithz G. (2001) Influense on plasma-insulin and blood-glucose by treatment with bisoprolol in hypertensive, non-diabetic patients. J Clin Basic Cardiol, 4: 229-30.
- Genuth S., Alberti K.G., Bennett P. et al.; Expert Committee on the Diagnosis and Classification of Diabetes Mellitus (2003) Followup report on the diagnosis of diabetes mellitus. Diabetes Care, 26 (11): 3160-3167.
- Grimm R.H., Grandits G.A., Culter J.A. et al. (1997) Relationship of quality of life measures to long-term lifestyle and drug treatment in the treatment of mild hypertension study (TOMHS). Arch Intern Med, 157: 638-48.
- Hansson L., Zanchetti A., Carruthers S.G. et al. (1998) Effects of intensive blood-pressure lowering and low-dose aspirin in patients with hypertension: principal results of the Hypertension Optimal Treatment (HOT) randomised trial. Lancet, 351: 1755-62.
- Mallion J.M., Gaudemaris R.D. et al. (1990) Day and night blood pressure values in normotensive and essential hypertensive subjects assessed by twenty-four-hour ambulatory monitoring. J Hypertens, 8: 49-55.
- Prichard B.N.S., Simmons R., Rooks M.J. et al. (1992) A double — blind comparison of moxonidine and atenolol in the management of patients with mild — to — moderate hypertension. J Cardiovsc Pharmacol, 20 (Suppl. 4): S45-16.
- Reaven G.M. (1988) Role of insulin resistance in human disease. Diabetes, 37: 1595-607.
- Ryden L., Standi E. еt al. Task Force on Diabetes and Cardiovascular Diseases of European Society of Cardiology (ESC), European Association for the study of Diabetes (EASD) (2007) Guidelines on diabetes, pre-diabetes, and cardiovascular diseases: executive summary. Eur. Heart J., 28 (I): 88-136.
- Schernthaner G., Matthews D.R., CharbonneI B. et al.; Quartet [corrected] Study Group (2004) Efficacy and safety of pioglitazone versus metformin in patients with type 2 diabetes mellitus: a double-blind, randomized trial. J. Clin. Endocrinol. Metab., 89 (12): 6068-6076.
- Standl E., Fuchtenbusch M. (2003) The role of oral antidiabetic agents: why and when to use an early-phase insulin secretion agent in Type II diabetes mellitus. Diabetologia, 46 (Suppl. I): M30-M36.
- Weidmann P. (2001) Metabolic profile of indapamide sustained-release in patients with hypertension. Drug safety, 24: 1155-65.
- WHO Consultation (1999) Definition, diagnosis and classification of diabetes mellitus and its complications. Part 1: diagnosis and classification of diabetes mellitus. Geneva: World Health Organization; Report no. 99.2.
- Мітченко О.І. (2004) Патогенетичні основи метаболічного синдрома. Нова медицина, № 4: 20-24.
- Мітченко О.І. (2005) Менопаузальний метаболічний синдром. Нова медицина, № 4: 18-23.
- Мычка В.Б., Богиева Р.М., Чазова И.Е. (2003) Акарбоза — средство профилактики множественных сердечно-сосудистых факторов риска метаболического синдрома. Клин. фармакол. и тер., 12 (2): 80-83.
- Чазова И.Е., Мычка В.Б. (2003) Метаболический синдром. Кардиоваскулярная терапия и профилактика, 3: 32-38.