ТЕРМИНОЛОГИЯ ПО МКБ-10
Нарушения липидного спектра крови занимают ведущее место в перечне факторов риска основных заболеваний сердечно-сосудистой системы и в соответствии с существующей МКБ 10-го пересмотра они были отнесены к IV классу заболеваний, а именно «Болезни эндокринной системы, расстройства питания и нарушения обмена веществ», обозначенные рубрикой Е78.
E78 Нарушения обмена липопротеинов и другие липидемии
Исключен: сфинголипидоз (E75.0–E75.3)
E78.0 Изолированная гиперхолестеринемия
E78.1 Изолированная гипертриглицеридемия
E78.2 Смешанная гиперлипидемия
Исключено: церебротендинозный холестероз (Ван-Богарт — Шерера — Эпштейна) (E75.5)
E78.3 Гиперхиломикронемия
E78.4 Другие гиперлипидемии
E78.5 Гиперлипидемия неуточненная
E78.6 Недостаточность липопротеинов
E78.8 Другие нарушения обмена липопротеинов
E78.9 Нарушение обмена липопротеинов неуточненные
КЛАССИФИКАЦИЯ ДИСЛИПИДЕМИЙ
На современном этапе для характеристики нарушений липидного спектра крови используют следующую терминологию: дислипидемия, гиперлипопротеинемия и гиперлипидемия.
Термин дислипидемия является наиболее широким, так как включает повышение уровня липидов и липопротеинов выше оптимального значения и/или возможное снижение показателей части липидного спектра, а именно ЛПВП или альфа-липопротеинов.
Термин гиперлипопротеинемия означает любое повышение уровня липидов и липопротеинов в плазме крови выше оптимального уровня.
Термин гиперлипидемия — наиболее простой, так как для его использования достаточно только определения повышения липидов крови (ХС и ТГ) выше оптимального уровня.
Для характеристики гиперлипопротеинемий наиболее употребляемой является классификация ВОЗ (табл. 2.1).
I фенотип характеризуется изолированным повышением уровня ХМ. ХС и ТГ могут быть умеренно повышены. Этот фенотип гиперлипопротеинемий отмечают редко и обычно не ассоциируют с развитием атеросклероза. Однако ремнанты, образующиеся в процессе гидролиза ХМ, могут быть атерогенными.
Таблица 2.1
Классификация гиперлипопротеинемий (ВОЗ) по D. Fredrickson, 1970
| Фенотип | ХС плазмы | ТГ | Изменения липопротеинов | Атерогенность |
| I | Незначительно повышен | Повышены или в норме | ↑ ХМ | Неатерогенный фенотип |
| IIa | Повышен | В норме | ↑ ЛПНП | Высокая |
| IIb | Повышен | Повышены | ↑ ЛПНП и ЛПОНП | Высокая |
| III | Повышен | Повышены | ↑ ЛППП | Высокая |
| IV | Чаще в норме | Повышены | ↑ ЛПОНП | Умеренная |
| V | Незначительно повышен | Повышены | ↑ ХМ и ЛПОНП | Низкая |
↑ повышение концентрации.
Для IIa фенотипа характерно повышение концентрации ХС ЛПНП и ХС, уровень ТГ находится в пределах нормы. Этот фенотип довольно распространен в популяции и тесно связан с развитием атеросклероза коронарных сосудов. При наследственных нарушениях липидного обмена IIa фенотип диагностируется у больных с семейной и полигенной гиперхолестеринемией.
При IIb фенотипе повышены концентрации ХС ЛПНП и ХС ЛПОНП. У лиц с фенотипом IIb отмечают комбинированную гиперлипопротеинемию, так как повышены концентрации ХС и ТГ. Это распространенный и атерогенный тип. В случаях первичной гиперлипопротеинемии IIb фенотип отмечают чаще у больных с семейной комбинированной гиперлипопротеинемией. Нередко комбинированная гиперлипопротеинемия служит проявлением вторичных нарушений липидного обмена.
III фенотип проявляется повышением уровня ЛППП и, как следствие, ХС и ТГ. Это довольно редкий вид нарушения липидного обмена, часто ассоциируется с фенотипом Е2/2 апобелка Е, при котором рецепторы печени хуже, чем при других фенотипах апо-Е, связывают ЛППП. III фенотип обычно выявляют при метаболических нарушениях, в частности у больных с метаболическим синдромом и сахарным диабетом. При подозрении III фенотипа существенную роль в диагностике играет электрофорез сыворотки крови в агарозном геле. На электрофореграмме появляется характерная широкая бета-полоса, отражающая высокое содержание в крови ЛППП. У носителей III фенотипа с вышеуказанными нарушениями высок риск развития атеросклероза.
Для IV фенотипа характерна повышенная концентрация ЛПОНП и гипертриглицеридемия. Это распространенный тип дислипидемии, его выявляют у 40% больных с нарушениями липидного обмена. IV фенотип может быть проявлением семейной гипертриглицеридемии, а также частым проявлением вторичных нарушений липидного обмена. В комбинации с низкой концентрацией ХС ЛПВП этот фенотип характеризуется высокой атерогенностью.
V фенотип отмечают редко. Характеризуется одновременным повышением концентрации ХМ и ЛПОНП, а также гипертриглицеридемией и умеренным повышением содержания ХС. Обычно нет четкой связи между V фенотипом и развитием атеросклероза. Однако выраженная гипертриглицеридемия, характерная для этого фенотипа, опасна развитием острого панкреатита.
Классификация ВОЗ не учитывает фенотип, для которого характерно избирательное снижение ХС ЛПВП (гипо-альфа-липопротеинемия). Этот фенотип чаще отмечают у мужчин, сопровождается поражением коронарных и мозговых сосудов. Важно отметить, что приведенная классификация не позволяет поставить диагноз заболевания, которое вызвало дислипидемию, однако дает возможность установить степень ее атерогенности.
В то же время в медицинской литературе для оценки уровней липопротеинов часто используется классификация компонентов липидного спектра крови, предложенная в Третьем докладе по лечению дислипидемий у взрослых (Adult Treatment Panel — ATP-III) Национальной образовательной программы по холестерину США (табл. 2.2).
Таблица 2.2
Классификация ХС ЛПНП, общего ХС, ХС ЛПВП и ТГ, мг/дл/ммоль/л
| ХС ЛПНП | |
| <100 (<2,6)
100–129 (2,6–3,3) 130–159 (3,4–4,0) 160–189 (4,1–4,8) >190 (>4,9) |
Оптимальный уровень
Выше оптимального Предельно высокий Высокий Очень высокий |
| Общий ХС | |
| <200 (<5,2) | Желаемый |
| 200–239 (5,2–6,1) | Предельно высокий |
| >240 (>6,2) | Высокий |
| ХС ЛПВП | |
| <40 (<1,0) | Низкий |
| >60 (>1,6) | Высокий |
| ТГ | |
| <150 (<1,7) | Нормальный |
| 150–199 (1,7–2,2) | Предельно повышен |
| 200–499 (2,3–4,4) | Высокий |
| >500 (>4,5) | Очень высокий |
В 2003 г. проф. М.И. Лутай предложил Украинскому обществу кардиологов новую Клиническую классификацию дислипидемий, созданную на основе рекомендаций Сингапурского кардиологического общества — Clinical Practice Guidelines «Lipids» (2001) и дополненную шестым вариантом первичных дислипидемий — изолированным снижением ХС ЛПВП (гипо-альфа-липопротеинемией), которое довольно редко диагностируется.
Клиническая классификация первичных дислипидемий Украинского научного общества кардиологов (Лутай М.И., 2003)
В клинической классификации дислипидемий Украинского научного общества кардиологов (2003), приведенной в табл. 2.3, уровень липидов крови рекомендовалось считать патологическим, если показатель общего ХС >6,2 ммоль/л (240 мг/дл), ХС ЛПНП >4,1 ммоль/л (160 мг/дл) и ТГ >2,3 ммоль/л (200 мг/дл).
Диагноз дислипидемии, гиперлипопротеинемии и гиперлипидемии не является самостоятельным, а должен быть включен в основной клинический диагноз сердечно-сосудистого заболевания. Для широкого употребления в клиническом диагнозе в 2007 г. предложено применять упрощенный вариант классификации дислипидемий.
Клиническая классификация дислипидемий Украинского научного общества кардиологов (2007)
- Гиперхолестеринемия (соответствует типу IIa по D. Fredrickson).
- Комбинированная дислипидемия (соответствует типу IIb и типу III по D. Fredrickson).
- Гипертриглицеридемия (соответствует типу IV по D. Fredrickson).
Таблица 2.3
Клиническая классификация первичных дислипидемий Украинского научного общества кардиологов (2003)
Первичные дислипидемии
| Дислипидемии | Повышение концентрации | |
| липопротеинов | липидов в сыворотке крови | |
1. Гиперхолестеринемия. Тип 11А
|
ЛПНП | ХС |
2. Комбинированная (смешанная) дислипидемия. Тип IIb
|
ЛПНП и ЛПОНП | ХС и ТГ |
| 3. Ремнантная дислипидемия (бета-липопротеинемия)
Тип III |
Ремнантные частички ЛПОНП | ХС и ТГ |
4. Гипертриглицеридемия. Тип IV
|
ЛПОНП | ТГ |
5. Тяжелая гипертриглицеридемия
а) Тип I б) Тип V |
ХМ
ХМ и ЛПОНП |
ТГ
ТГ |
| Изолированное снижение уровня ХС ЛПВП | Снижение ХС ЛПВП для мужчин <1,0 ммоль/л (40 мг/дл), для женщин <1,3 ммоль/л (50 мг/дл) при отсутствии значительных изменений уровня ХС ЛПНП и ТГ
Высокий уровень ХС ЛПВП >60 мг/дл (>1,6 ммоль/л) — отрицательный фактор риска атеросклероза и ИБС |
|
Вторичные дислипидемии
| 1. Эндокринные и метаболические заболевания | ||
| Сахарный диабет
Тип IV, редко V |
ЛПОНП и редко ХМ | ТГ |
| Гипотиреоз
Тип IIа, реже IIb или III |
ЛПНП, снижение ЛПВП | ХС |
| Синдром Иценко — Кушинга
Тип Па, IIb или IV |
ЛПОНП и ЛПНП | ХС и ТГ |
| Подагра, тип IV | ЛПОНП | ТГ |
| 2. Заболевание почек | ||
| Нефротический синдром
Тип IIа, IIb |
ЛПОНП и ЛПНП | ХС и ТГ |
| ХПН
Тип IV |
ЛПОНП | ТГ |
| 3. Другие заболевания | ||
| Синдром холестаза
Тип IIа, реже IIb |
ЛПНП, снижение ЛПВП | ХС |
| Эмоциональный стресс
Тип IV |
ЛПОНП | ТГ |
| 4. Влияние токсических и лекарственных веществ | ||
| Алкоголь
Тип IV, редко V |
ЛПОНП и редко ХМ, возможный рост ЛПВП | ТГ |
| Гестагены
Тип IV, редко V |
ЛПОНП и редко ХМ | ТГ |
| Тиазидные диуретики
Тип IIа, IIb или IV |
ЛПОНП и ЛПНП, снижение ЛПВП | ХС и ТГ |
| Блокаторы β-адренорецепторов
Тип IV |
ЛПОНП и редко ХМ, снижение ЛПВП | ТГ |
Следует заметить, что в последнее время подверглись изменениям нормативные величины основных характеристик липидограммы. В соответствии с третьим пересмотром Рекомендаций Европейского общества кардиологов по профилактике сердечно-сосудистых заболеваний (ССЗ) (2007) считают оптимальными следующие характеристики липидов и липопротеинов (табл. 2.4).
Таблица 2.4
Оптимальные характеристики липидов и липопротеинов (Европейское общество кардиологов, 2007)
| Липидные параметры | Значение в ммоль/л | Значение в мг/дл |
| Общий ХС | <5,0 | <190 |
| ХСЛПНП | <3,0 | <115 |
| ХС ЛПВП | >1,0 (муж.);
1,3 (жен.) |
>40 (муж.);
50 (жен.) |
| ТГ | <1,7 | <150 |
При реализации мероприятий первичной и вторичной профилактики сердечно-сосудистых осложнений в соответствии с рекомендациями Европейского общества кардиологов (2007) врачи должны ориентироваться на следующие целевые уровни общего ХС и ХС ЛПНП:
- для общей популяции целевой уровень ХС в плазме крови должен составлять <5,0 ммоль/л (190 мг/дл), а уровень ХС ЛПНП <3 ммоль/л (115 мг/дл);
- целевые уровни для пациентов с ИБС, клиническими проявлениями ССЗ и пациентов с сахарным диабетом: для общего ХС <4,5 ммоль/л (175 мг дл), при возможности <4,0 ммоль/л (155 мг/дл) и для ХС ЛПНП <2,5 ммоль/л (100 мг/дл), при возможности <2,0 ммоль/л (80 мг/дл).
ЭПИДЕМИОЛОГИЯ ДИСЛИПИДЕМИЙ
ССЗ продолжают занимать первое место в структуре смертности граждан Украины (63,4% в 2006 г.), причем в большинстве случаев в основе их патогенеза лежит атеросклеротическое поражение кровеносных сосудов, предопределяющее в 66,6% развитие ИБС, а в 21,5% — цереброваскулярных заболеваний. В Украине на протяжении 2005 г. только по статистике обращений к врачу зарегистрировано более чем 7,9 млн пациентов с ИБС, среди которых лица со стенокардией составили около 36%.
Экспериментальные, эпидемиологические и клинические исследования, выполненные за последние 50 лет, выявили тесную связь между нарушением липидного спектра (дислипидемиями) и развитием атеросклероза. По данным Национального научного центра «Институт кардиологии им. Н.Д. Стражеско» АМН Украины в украинской популяции повышение уровня общего ХС среди населения трудоспособного возраста отмечается в среднем в 40—50% случаев. Тем не менее следует отметить, что все эпидемиологические исследования относительно липидного спектра в популяции, которые проводились до настоящего времени в Украине, выполнены в соответствии с протоколом, согласно которому гиперхолестеринемией считается уровень общего ХС >6,2 ммоль/л и уровень ХС ЛПНП >4,1 ммоль/л, а гипертриглицеридемией — уровни ТГ крови >2,3 ммоль/л, что, безусловно, не соответствует современным европейским требованиям диагностики дислипидемий и приводит к значительному снижению в украинских статистических отчетах процента пациентов с нарушениями липидного спектра крови, маскируя соответственно от 20 до 60% больных с этим прогностически значимым фактором риска.
В то же время выявлена прямая корреляционная связь между заболеваемостью и смертностью от ИБС, с одной стороны, и уровнем ХС в крови — с другой, а гиперхолестеринемия в сочетании с курением, ожирением, АГ, сахарным диабетом и возрастом является основным предиктором развития атеросклероза и его осложнений. Подтверждение прогностического значения гиперхолестеринемии получено в результате многоцентровых исследований, прежде всего таких как MRFIT (Multiple Risk Factor Intervention Trial) и Seven Countries Study, согласно которым в больших популяциях продемонстрирован рост абсолютных и относительных характеристик смертности от ИБС в прямой зависимости от уровня общего ХС (рис. 2.1).
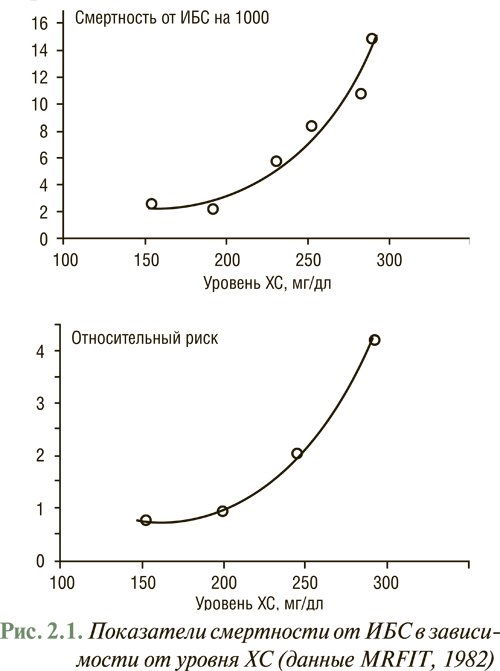
Определяющую роль в создании концепции факторов риска сыграло Фремингемское исследование, его подходы послужили основой для разработки концепции мероприятий как первичной, так и вторичной профилактики ССЗ.
Под первичной профилактикой следует понимать совокупность мероприятий, направленных на предупреждение действия факторов риска (в том числе дислипидемии), приводящих к возникновению клинических симптомов ИБС и других проявлений атеросклероза. Под вторичной профилактикой подразумевается вся совокупность терапевтических мероприятий, направленных на предупреждение осложнений ИБС, улучшение ее клинического течения и прогноза. Такие мероприятия предусматривают влияние на факторы риска путем модификации образа жизни и применения медикаментозного лечения.
Снижение смертности от ССЗ в развитых странах отмечали параллельно со снижением среднего уровня ХС в крови у взрослого населения. В результате реализации Национальной образовательной программы по холестерину в США было продемонстрировано, что снижение на 1% среднего уровня общего ХС у жителей страны приводило к снижению смертности от ССЗ на 2%.
Исследования последних лет показали, что наряду с гиперхолестеринемией целый ряд других нарушений липидного спектра также является фактором риска ИБС и атеросклероза. Это можно отнести к гипертриглицеридемии и низкому уровню ХС ЛПВП в плазме крови. Главная особенность факторов риска заключается в том, что они, как правило, усиливают действие друг друга, то есть при наличии двух факторов риска вероятность развития атеросклероза увеличивается не в 2, а в 3 и более раз. Соответственно любая стратегия профилактики предусматривает комплексное влияние на все факторы риска, имеющиеся у больного, а интенсивность вмешательства и целевые уровни показателей (общего ХС, ХС ЛПНП, ТГ) зависят от суммарного абсолютного риска развития ИБС и ее осложнений на протяжении определенного периода. Следует иметь в виду, что эффект от проведения профилактических мероприятий у определенных категорий лиц тем выше, чем выше абсолютный риск развития ИБС. В связи с этим стратификация риска и определение ближайшего и отдаленного прогнозов у конкретного пациента имеет первостепенное значение для выбора метода влияния на дислипидемию (изменение образа жизни, медикаментозное лечение).
В третьей версии Рекомендаций Европейского общества кардиологов, опубликованных в 2003 г., — «Европейские рекомендации по профилактике сердечно-сосудистых заболеваний в клинической практике» большое внимание уделено вопросам, касающимся гиперхолестеринемии и целевых уровней ХС в зависимости от категорий риска. Среди нововведений обращает на себя внимание система оценки риска SCORE, графическое представление которой напоминает шкалу с цветными «квадратами», принятую в 1998 г. Существенное отличие от предыдущих 1-й и 2-й версий Рекомендаций Европейского общества кардиологов заключается в том, что показатели риска рассчитаны не по данным Фремингемского исследования, а на основании анализа 12 европейских эпидемиологических исследований. В том числе учитывали данные наибольшего международного проекта EUROASPIRE, которые включали 205 178 человек по всей Европе, среди которых зарегистрировано около 7000 смертей от ССЗ. Создано два варианта таблиц для стран с низким и высоким уровнем риска ССЗ, к сожалению, в Украине применяется последний вариант. Кроме того, в отличие от предыдущей версии Рекомендаций в качестве основного прогностического критерия выступает не риск развития основных коронарных событий (нефатального ИМ или смерти от ИБС), а вероятность только фатальных сердечно-сосудистых событий, то есть смерти от любого ССЗ в ближайшие 10 лет жизни пациента. За величину высокого риска принята цифра 5% и более. У молодых пациентов, кроме определения риска на ближайшие 10 лет, предлагается оценивать риск при проекции совокупности факторов риска на возраст 60 лет.
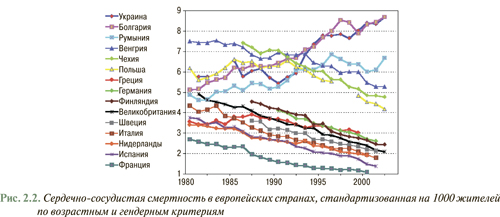
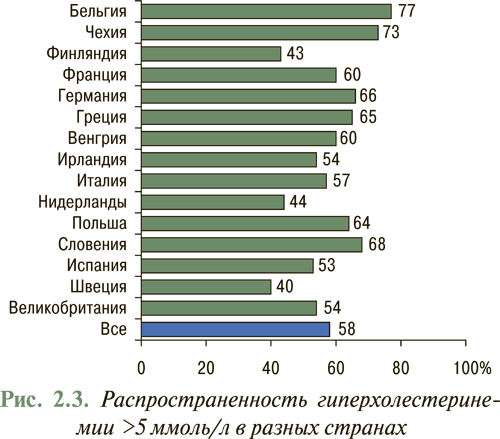
С 1995 г. Европейским обществом кардиологов реализуется Европейская программа по первичной и вторичной профилактике сердечно-сосудистых заболеваний (Euro Heart Survey on Secondary and Primary Prevention of Coronary Heart Disease). В научной литературе данная работа представлена двумя отчетными докладами EUROASPIRE-I (EUROpean Action on Secondary Prevention through Intervention to Reduce Events ), в которой подытожена работа за 1995-1996 гг., и EUROASPIRE-II за период 1999–2000 гг. В соответствии с ними Украина находится среди стран с наиболее неблагоприятным профилем кардиоваскулярной смертности, стандартизованной на 1 тыс. жителей (рис. 2.2). В процессе выполнения Euro Heart Survey, а также принимая во внимание основные цели первичной и вторичной профилактики, выполнен анализ проведенных мероприятий по модификации образа жизни (прекращение курения, прием сбалансированной здоровой пищи, достаточная физическая активность), а также учет адекватности контроля других модифицируемых факторов риска (уровень АД <140/90 мм рт. ст.; уровень общего ХС <5,0 ммоль/л (190 мг/дл); ХЛНП <3,0 ммоль/л (115 мг/дл), а также достижения контрольного уровня глюкозы у пациентов с сахарным диабетом). Согласно полученным данным процент распространенности гиперхолестеринемии с уровнем ХС >5 ммоль/л (190 мг/дл) в странах Европы достаточно высок и составляет приблизительно 58% (рис. 2.3). В это же время в Украине официальная эпидемиологическая статистика учитывает лишь уровни ХС только >6,2 ммоль/л (240 мг/дл). Данные изменения выявлены только у 35% популяции, то есть показатель в соответствии с современными требованиями искусственно занижен.
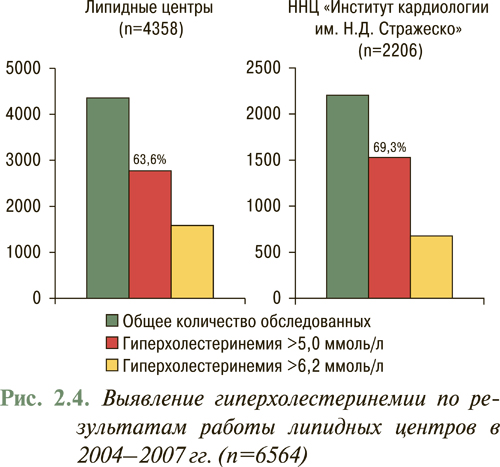
За период с 2004 по 2007 г. по инициативе Национального научного центра «Институт кардиологии им. Н.Д. Стражеско» АМН Украины и Украинской ассоциации кардиологов выполнено многоцентровое исследование по выявлению гиперхолестеринемии, в котором проанализировано количество пациентов с уровнем гиперхолестеринемии >5,0 ммоль/л (190 мг/дл) и уровнем гиперхолестеринемии >6,2 ммоль/л (240 мг/дл). В работе приняли участие липидные центры на базе 19 областных кардиодиспансеров Украины и экспресс-лаборатория Национального научного центра «Институт кардиологии им. Н.Д. Стражеско» АМН Украины. Обследованы 6564 пациента, обратившихся за специализированной помощью, следовательно, речь идет не о популяционном исследовании, а о выявлении гиперхолестеринемии у пациентов на приеме у врача-кардиолога. По результатам обследования всех 6564 пациентов гиперхолестеринемия >5,0 ммоль/л (190 мг/дл) выявлена у 65,5%, а гиперхолестеринемии >6,2 ммоль/л (240 мг/дл) — у 28,0%, причем у 4358 обследованных по результатам работы липидных центров на базе 19 областных кардиодиспансеров гиперхолестеринемия >5,0 ммоль/л (190 мг/дл) выявлена у 63,6%, а гиперхолестеринемия >6,2 ммоль/л (240 мг/дл) — у 27,3%, в то время как у 2206 обследованных в экспресс-лаборатории на базе Национального научного центра «Институт кардиологии им. Н.Д. Стражеско» АМН Украины гиперхолестеринемия >5,0 ммоль/л (190 мг/дл) выявлена у 69,3%, а гиперхолестеринемия >6,2 ммоль/л (240 мг/дл) — у 29,3%, что может свидетельствовать о том, что в Национальный научный центр обращаются за помощью пациенты, относящиеся к более тяжелому контингенту (рис. 2.4).
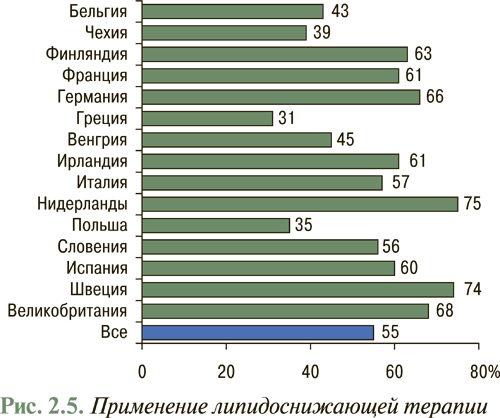
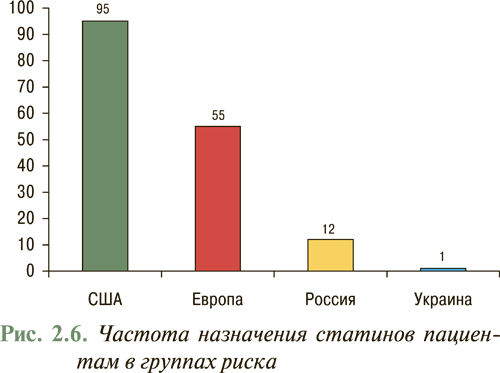
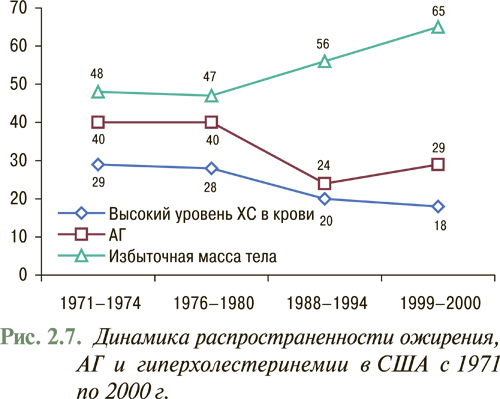
Согласно данным EUROASPIRE-II исследования Euro Heart Survey использование липидоснижающих препаратов в Европе составляет в среднем 55% потребности их назначения (рис. 2.5), в то время как в Украине данный показатель не превышает 1% (рис. 2.6), что указывает на недостаточное использование данного антиатеросклеротического потенциала. В то же время, согласно отчету АНА за 2007 г., проведение медикаментозных и немедикаментозных мероприятий, направленных на нормализацию липидного профиля в рамках реализации Национальной образовательной программы по ХС в США с 1971 по 2000 г., привело к тому, что распространенность среди популяции взрослого населения «высокой гиперхолестеринемии» или уровня общего ХС >6,2 ммоль/л (240 мг/дл) снизилась с 30 до 18% и продолжает снижаться (рис. 2.7). Так, уже в 2004 г. гиперхолестеринемия >6,2 ммоль/л (240 мг/дл) составила 16,8%, а распространенность гиперхолестеринемии >5,2 ммоль/л (200 мг/дл) составила всего 48,4%. При этом отмечено, что снижение уже на 10% уровня общего ХС привело к уменьшению на 30% всех случаев ССЗ.
Важным обстоятельством, установленным в последних исследованиях, является то, что некоторые липидоснижающие препараты, такие как статины, кроме их прямого действия, имеют нелипидные эффекты, с чем, очевидно, связывают их благоприятное воздействие на прогноз ИБС и показатели сердечно-сосудистой смертности у лиц с нормальным уровнем ХС (CARE, HPS). В данное время эффективность липидоснижающей терапии в аспекте ее благоприятного действия на осложнения и смертность от коронарной патологии доказана для широкого спектра пациентов при проведении первичной (WOSCOPS, AFCAPS, ALLHAT-LLT, ASCOT-LLA, CARDS, 4D) и вторичной профилактики (4S, CARE, LIPID, YPS, IDEAL, TNT), а также у пациентов с острым коронарным синдромом (MIRACL, PROV IT-TIMI 22, A to Z). Целесообразность активного влияния на дислипидемию подтверждают недавние исследования, показавшие преимущества агрессивной липидоснижающей терапии наряду с коронарной ангиопластикой (AVERT), а также полученные в последнее время убедительные доказательства возможности достижения регресса атеросклеротических бляшек путем применения агрессивной липидоснижающей терапии (REVERSAL, 2004; ASTEROID, 2006).
Государственные программы по профилактике атеросклероза способствовали уменьшению заболеваемости и смертности от ИБС на 30–50% в большинстве стран Европы и Америки. Следует признать неубедительными возражения о том, что современные липидоснижающие средства (статины и фибраты) дорогие и могут приводить к осложнениям при длительном применении, в то время как известно, что лечение инфаркта или инсульта в несколько раз дороже стоимости первичной и вторичной профилактики. Недостаточно активная тактика коррекции гиперхолестеринемии часто обусловлена неверной информацией о целевых уровнях атерогенных липопротеинов у больных с ИБС и преувеличением возможных неблагоприятных влияний статинов на печень при длительном их применении. В то же время хочется надеяться, что осуществление широкой просветительской работы как среди медицинского персонала, так и среди пациентов, адекватное проведение первичной и вторичной профилактики окажет положительное влияние на показатели здоровья населения Украины.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ ДИСЛИПИДЕМИЙ
Характеристика липидов плазмы крови
Основными липидами плазмы крови являются свободные, то есть неэтерифицированные жирные кислоты, ТГ, фосфолипиды и эфиры ХС.
Большая часть жирных кислот образуется в печени из углеводных предшественников. Лишь линолевая кислота и продукт ее метаболизма — арахидоновая кислота не синтезируются в организме и являются незаменимыми жирными кислотами. Свободные жирные кислоты циркулируют в крови в соединении с альбуминами. Они поступают в кровь из пищи или из жировой ткани, где содержатся в виде ТГ и со временем мобилизируются с помощью липопротеинлипазы. Окисление свободных жирных кислот — важный источник энергии, в частности в сердечной мышце. Скорость их обмена очень высока — каждую минуту утилизируется около 20–40% количества жирных кислот в плазме крови. Они играют важную роль в липидном обмене, этерифицируя ХС и глицерин. Выделяют насыщенные жирные кислоты (пальмитиновая, стеариновая), мононенасыщенные жирные кислоты (олеиновая) и полиненасыщенные жирные кислоты (линолевая, арахидоновая, эйкозапентаеновая, докозагексаеновая). Насыщенность зависит от числа двойных связей в составе жирных кислот. Незаменимые жирные кислоты не синтезируются в организме человека и должны поступать в составе пищевых продуктов. Насыщенные жирные кислоты преобладают в жирах животного происхождения, мононенасыщенные и полиненасыщенные жирные кислоты — в растительных маслах и рыбьем жире.
ТГ — это объединение 3 эфиров жирных кислот и глицерина, который является многоатомным спиртом. Экзогенные или «пищевые» ТГ ресинтезируются в клетках тонкой кишки из моноглицеридов и поступают в кровь в виде ХМ. Эндогенные ТГ синтезируются главным образом в печени из свободных жирных кислот, откуда транспортируются кровью преимущественно в составе ЛПОНП. После приема жирной пищи концентрация ТГ в крови быстро повышается, но в норме уже через 10–12 ч возвращается к исходному уровню. В данное время для оценки нарушения обмена ТГ предложены тесты с пищевой нагрузкой жиром (сливочным маслом, сметаной). У больных сахарным диабетом, метаболическим синдромом и ожирением концентрация ТГ длительное время (>12 ч) не возвращается к норме. Этот феномен в мировой литературе обозначается термином «постпрандиальная дислипидемия». Больные с постпрандиальной дислипидемией более склонны к развитию атеросклероза.
Фосфолипиды — это сложные липиды, состоящие из глицерина, жирных кислот, фосфорной кислоты и азотсодержащих соединений. Синтезируются почти во всех тканях, более всего в печени. Как и ХС, являются составляющими клеточных мембран, а в плазме крови играют важную роль в обеспечении растворимости липопротеиновых частиц. Их содержание в крови не связано с риском развития ИБС, поэтому при назначении гиполипидемической терапии концентрация фосфолипидов в плазме крови, как правило, не принимается во внимание.
ХС относится к группе стероидов (как половые гормоны и желчные кислоты), поскольку содержит в своем составе циклические структуры. ХС находится в организме в виде свободного стерина и в виде его эфиров. Эфир ХС представлен соединением ХС с одной из жирных кислот. Функции ХС обусловлены тем, что он, наряду с фосфолипидами, входит в состав клеточных мембран, регулируя их проницаемость и активность мембранных ферментов, а также является предшественником некоторых биологически активных веществ (стероидных гормонов, витаминов группы D и желчных кислот). ХС частично поступает с пищей в составе ХМ (20–30%), но в основном синтезируется de novo (70–80%) в организме человека. Способностью синтезировать ХС обладает большинство клеток, но основной процесс осуществляется в печени, где формируются и основные метаболиты ХС — желчные кислоты. ХС, поступивший в просвет тонкого кишечника в составе желчных кислот, подвергается обратному всасыванию и снова поступает в печень (внутрипеченочный путь обмена ХС). Как уже отмечалось, ХС бывает свободным и этерифицированным. Свободный ХС метаболически активный, в то время как эфиры ХС являются его формой, которая транспортируется и депонируется. Этерифицированный ХС преобладает в составе коры надпочечников, в плазме крови, в атеросклеротических бляшках. В составе клеточных мембран ХС находится в свободном состоянии.
В плазме крови ХС и ТГ находятся в соединении с белками, образуя липопротеины. Данные соединения обеспечивают их транспорт и представляют собой сферические частицы разного размера, состоящие из свободного и этерифицированного ХС, ТГ, фосфолипидов и белков, количество которых варьирует. Внутри находится гидрофобное ядро из плотно расположенных молекул ТГ и эфиров ХС. Снаружи ядро покрыто слоем из фосфолипидов, обеспечивающих стабилизацию липопротеиновой частицы в растворенном состоянии, а также небольшим количеством свободного ХС и белков — аполипопротеинов или апобелков. Апобелки выполняют структурную и адресную функции. Благодаря высокоспецифическому взаимодействию между апобелками липопротеинов и белками-рецепторами на клеточной мембране осуществляется рецепторопосредованное связывание липопротеинов с клетками. Полярные части молекул апобелков, фосфолипидов и свободного ХС создают внешний, гидрофильный слой липопротеиновых частиц, в то время как эфиры ХС и ТГ составляют их гидрофобное ядро. Основными липопротеинами, в зависимости от их плотности, размеров и состава липидов (табл. 2.5), а также апобелков, являются ХМ, ЛПОНП, ЛППП, ЛПНП, ЛПВП.
Экзогенные липиды — ТГ и ХС (приблизительно 100 г и 1 г в сутки соответственно) попадают внутрь эпителиальных клеток кишечника, где они всасываются, инкорпорируясь в большие липопротеиновые частицы — ХМ, наибольшие по размерам и наиболее легкие липопротеиновые частицы. Их плотность составляет 0,95 г/мл. ХМ синтезируются в эпителиальных клетках тонкого кишечника из липидов экзогенного (пищевого) происхождения; через систему лимфатических сосудов ХМ поступают в грудной лимфатический проток и оттуда в кровь, где подвергаются липолизу под действием липопротеинлипазы плазмы крови. В состав ХМ входят ТГ, в меньшем количестве эфиры ХС, фосфолипиды и апобелки. В результате липолиза ХМ теряют значительную часть ТГ и превращаются в ремнанты (остатки) ХМ. Основными белками ремнант ХМ являются апобелки: апо-В-48, апо-Е и апо-С. Именно благодаря апо-Е ремнанты связываются с рецепторами печени. Изолированную гиперхиломикронемию выявляют редко, последняя обычно свидетельствует о наследственном дефекте липопротеинлипазы. Гиперхиломикронемия не является биохимическим маркером атеросклероза, но сопутствующая ей гипертриглицеридемия может спровоцировать развитие острого панкреатита. Основной функцией ХМ является транспорт пищевых ТГ, из которых они состоят на 90%, и ХС через лимфу в плазму крови. Попадая в капилляры жировой ткани и мышц, ХМ взаимодействуют с липопротеинлипазой, которая связана с гликозаминогликанами на внешней поверхности эндотелия капилляров. В результате гидролиза ХМ освобождаются свободные жирные кислоты и моноглицериды, которые поступают в адипоциты и мышечные клетки, где метаболизируются, а ХМ превращаются в ремнанты, относительно бедные ТГ и богатые эфирами ХС. Ремнанты захватываются рецепторами печени, которые распознают апо-Е и поступают внутрь гепатоцита. Таким образом, в результате транспорта ХМ пищевые ТГ доставляются в жировую ткань, а ХС — в печень. В физиологических условиях ХМ присутствуют в крови только после приема пищи, содержащей жиры (до 12 ч), но не натощак. В печени ХС частично превращается в желчные кислоты, выделяющиеся с желчью в тонкую кишку, где, выступая в роли детергентов, облегчают всасывание алиментарных жиров.
Эндогенные липиды, представленные ТГ, синтезированными в печени из жирных кислот и глицерина, вместе с небольшим количеством этерифицированного ХС выделяются в кровь в составе ядра ЛПОНП. Основные структурно-функциональные белки ЛПОНП — апо-В-100, апо-Е и апо-С-I, C-II, C-III. ЛПОНП в основном состоят из эндогенных ТГ и в меньшей степени из эфиров ХС, поэтому их повышенное содержание в плазме крови проявляется гипертриглицеридемией и часто диагностируется у больных с инсулиннезависимым сахарным диабетом, гипотиреозом, ожирением. Гипертриглицеридемия в сочетании с низким уровнем ЛПВП служит фактором риска развития атеросклероза. В капиллярах жировой и мышечной ткани под влиянием липопротеинлипазы происходит гидролиз ТГ с отделением жирных кислот, которые поступают в ткани и используются для ресинтеза ТГ. В результате этого богатые ТГ ЛПОНП аналогично ХМ превращаются в богатые этерифицированные ХС их ремнанты — ЛППП. Основные транспортные и функциональные белки ЛППП — апо-В-100 и апо-Е. Благодаря этим белкам ЛППП связываются с соответствующими рецепторами печени. Плотность ЛППП — 1,006—1,019 г/мл. Повышенная концентрация в крови ЛППП определяется при гиперхолестеринемии и гипертриглицеридемии. Довольно редко в клинической практике отмечают изолированное повышение ЛППП, что связано с наследственным дефектом печеночной липопротеинлипазы и сопровождается прогрессирующим атеросклерозом. В норме ЛППП частично катаболизуются в печени путем рецепторопосредованного эндоцитоза с распознаванием апо-Е и апо-В, частично с помощью печеночной липазы превращаются в ЛПНП в результате изъятия из них большей части ТГ с увеличением относительного содержания эфиров ХС. При этом теряется большая часть апопротеинов.
Таблица 2.5
Характеристика основных классов липопротеинов крови
| Признак | ХМ | ЛПОНП | ЛППП | ЛПНП | ЛПВП |
| Физические свойства:
плотность, г/мл средний диаметр, нм электрофоретическая подвижность |
0,95
100–1000 Не двигаются |
1,006
43 Пре-β |
1,006–1,019
27 β |
1,019–1,063
22 β |
1,063–1,210
9,5–6,5 α |
| Состав, %
ТГ ХС Фосфолипиды Белок |
90 5 4 1 |
65
13 12 10 |
28
38 20 14 |
10
43 22 25 |
2
18 30 50 |
| Основные липиды ядра | ТГ пищи | Эндогенные ТГ | Эфиры ХС, ТГ | Эфиры ХС | Эфиры ХС |
| Основные апопротеины | AI, AII, B, CI, CII, CIII | B, CI, CII, CIII, E | В, CIII, E | В | AI, AII |
Ядро новообразованного ЛПНП состоит преимущественно из эфиров ХС, а оболочка содержит только апо-В-100 и апо-Е. Поскольку в этих липопротеинах содержится всего 70% ХС плазмы крови, их основной функцией является транспорт ХС внепеченочным клеткам организма. Повышенное содержание в плазме крови ЛПНП четко связано с развитием атеросклероза коронарных, каротидных и периферических сосудов. Однако для того чтобы ЛПНП стали атерогенными, они должны модифицироваться. Причиной модификации чаще всего служит процесс перекисного окисления ЛПНП. Окисленные ЛПНП изменяют свои свойства в двух направлениях: сначала повышается их взаимодействие с рецепторами печени, затем они становятся активными хемоаттрактантами (раздражителями) для моноцитов. Активированные моноциты крови проникают в субэндотелиальное пространство сосудов, превращаясь в макрофаги, которые фагоцитируют модифицированные ЛПНП и превращаются в «пенистые» клетки, то есть клетки, переполненные эфирами ХС. Активированные макрофаги и пенистые клетки освобождают биологически активные вещества: факторы роста, противовоспалительные цитокины, молекулы адгезии. В результате в большей степени усиливаются процессы проницаемости эндотелия и роста атеросклеротической бляшки, что в конечном итоге ведет к сужению просвета сосуда и/или разрыву покрышки бляшки с образованием внутрисосудистого тромба. Именно ХС ЛПНП, учитывая его важную роль в формировании атеросклеротической бляшки, представляют главную мишень гиполипидемической терапии.
Катаболизм ЛПНП осуществляется тремя путями: метаболизацией внепеченочными паренхиматозными клетками (основной путь), системой фагоцитирующих клеток (клетками-скэвенджерами или «мусорщиками») и печенью. В лизосомах периферических клеток из ЛПНП освобождается свободный ХС, который по механизму обратной связи регулирует синтез ХС внутри клетки путем ингибирования фермента ГМГ-КоА-редуктазы. Этот фермент катализирует преобразование ГМГ-КоА в мевалоновую кислоту — ключевой момент синтеза ХС. Клетки-скэвенджеры поглощают только модифицированные ЛПНП, которые изменили свои свойства вследствие процесса свободнорадикального окисления липидов и превращаются в вышеуказанные «пенистые» клетки.
Излишек ХС в составе ЛПНП поступает в печень, взаимодействуя со специфическими клеточными рецепторами, где он используется для образования желчных кислот. В патологических условиях атерогенные липопротеины, богатые ХС (ЛПНП, ЛППП, ЛПОНП), инициируют механизмы формирования атеросклеротической бляшки в артериальной стенке.
ЛПВП принято считать антиатерогенным фактором. Низкие концентрации ХС ЛПВП могут быть связаны не только с ранним развитием атеросклероза, но также с ухудшением прогноза для лиц, имеющих ССЗ. Отрицательные эффекты низкого содержания ХС ЛПВП зависят от множества медико-социальних причин и тесно связаны с общим риском ССЗ в урбанизованных обществах, где люди курят, ведут малоподвижный образ жизни, употребляют большое количество продуктов животного происхождения. Низкие концентрации ЛПВП метаболически связаны с высокими концентрациями ЛППП и ЛПОНП. Эксперименты на животных продемонстрировали антиатерогенную активность ЛПВП. Участие ХС ЛПВП в транспорте ХС от других органов к печени или «обратный транспорт ХС» — основной механизм, благодаря которому ХС ЛПВП может защитить стенку артерии. Существуют также многочисленные механизмы, объясняющие его прямой защитный эффект: стимуляция простациклина, блокада синтеза фактора активации тромбоцитов в эндотелиальных клетках, стимуляция антиоксидантной активности, ингибирование адгезии моноцитов к эндотелиальным клеткам на ранних стадиях атеросклеротического процесса и др. Как и для ТГ, не определены точные целевые уровни, до которых следует повышать концентрацию ХС ЛПВП. Однако ХС ЛПВП <1 ммоль/л (40 мг/дл) у мужчин и <1,2 ммоль/л (46 мг/дл) у женщин считают маркером повышенного сердечно-сосудистого риска. При выявлении этого врач должен обратить внимание пациента на необходимость изменения образа жизни, снижения высокого уровня ХС ЛПНП и нормализации АД.
Комбинацию умеренно повышенного уровня ТГ и низких концентраций ХС ЛПВП обычно отмечают у пациентов с ранним манифестированием атеросклеротического поражения. Выделяют так называемую «атерогенную дислипидемию» или «атерогенную триаду», которая включает повышение суммарной концентрации ХС ЛППП и ХС ЛПОНП, наличие маленьких плотных частиц ХС ЛПНП и низкую концентрацию ХС ЛПВП. Комбинация высокого уровня ТГ и низкого уровня ХС ЛПВП характерна не только для пациентов с сахарным диабетом II типа, но также и для пациентов с абдоминальным ожирением и ассоциируется с высоким риском сердечно-сосудистой патологии.
Излишек свободного ХС, который накопился в периферических клетках, ЛПВП удаляют путем связывания апо-А со специфическими рецепторами. «Нагруженные» ХС ЛПВП частично транспортируют его назад из тканей в печень, где он катаболизируется с образованием желчных кислот, частично передают ХС ЛПОНП, в результате чего последние превращаются в ЛППП, а потом в ЛПНП. Таким образом замыкается круг преобразований ХС. Выделяют два подкласса ЛПВП: ЛПВП-2 и ЛПВП-3. ЛПВП-3 имеют дискоидную форму и именно они начинают активный захват ХС из периферических клеток и макрофагов, превращая в ЛПВП-2 сферические частицы, богатые эфирами ХС и фосфолипидами. Апобелки апо-А1 и апо-А2 представляют собой основные белки ЛПВП, с помощью которых последние связываются с рецепторами печени и клетками сосудистой стенки. Уровень ХС ЛПВП в плазме крови находится в обратной зависимости от развития атеросклероза: чем ниже содержание ХС ЛПВП, тем выше вероятность развития атеросклероза.
Гипертриглицеридемия также связана с риском развития атеросклероза, но эта связь не настолько важна, как при гиперхолестеринемии, и продолжает обсуждаться клиницистами. Метаанализ 17 популяционных исследований, включающих более 46 000 мужчин и более чем 10 000 женщин, показал, что риск ССЗ нарастал с увеличением уровня гипертриглицеридемии, но был более тесно связан с умеренной, чем с тяжелой гипертриглицеридемией. Это объясняется тем, что первая происходит путем накопления в плазме ХС ЛППП и маленьких частиц ХС ЛПОНП, тогда как последняя обусловлена накоплением большого количества ХС ЛПОНП и ХМ.
Связь гипертриглицеридемии с атеросклерозом в данное время объясняют тремя патогенетическими механизмами:
- Подобно ХС ЛПВП, некоторые богатые ТГ липопротеины могут проникать в стенку артерии, где со временем накапливаются, вызывая атерогенное действие. Это касается маленьких частиц ХС ЛПОНП и ХС ЛППП.
- Метаболизм богатых ТГ липопротеинов тесно связан с метаболизмом атерогенных ХС ЛПНП и ХС ЛППП. Маленькие плотные ЛПНП появляются в плазме при концентрации ТГ >1,4 ммоль/л. Высокие концентрации ТГ обычно отмечают у лиц с низкими концентрациями антиатерогенных ЛПВП.
- Гипертриглицеридемия часто сочетается с другими факторами риска ССЗ, и такое сочетание может потенцировать раннее начало болезни. Перечень этих факторов включает метаболический синдром, сахарный диабет II типа, АГ, низкую физическую активность, ожирение, низкое потребление фруктов и овощей и т.д. При этом уровни ТГ >1,7 ммоль/л (150 мг/дл) считают маркером повышенного сердечно-сосудистого риска, однако концентрация ТГ <1,7 ммоль/л не рассматривается как целевой уровень терапии.
Сердечно-сосудистый риск опосредствован также, как указывалось, концентрацией белковых компонентов липопротеинов — апопротеинов. В настоящее время обсуждается роль 5 классов аполипопротеинов — А, В, С, Д и Е. Аполипопротеины или апопротеины выполняют три основные функции: 1) взаимодействуют с фосфолипидами, помогают солюбилизировать эфиры ХС и ТГ; 2) регулируют взаимодействие липидов с ферментами — липопротеинлипазой; 3) обеспечивают связывание липопротеинов со специфическими рецепторами клеточной мембраны в местах их взаимодействия. Так, апопротеин А (апо-А) — главный компонент белка ЛПВП. Низкие концентрации его субчастицы апо-А1, подобно низким концентрациям ХС ЛПВП, связаны с ухудшением прогноза ССЗ.
В противовес этому апопротеин B (апо-В) — главный компонент белка ЛПНП, ЛППП, ЛПОНП и ХМ. Однако ХМ обычно не присутствуют в плазме крови натощак, и почти весь aпo-В находится в атерогенных липопротеинах. Концентрация aпo-В может служить маркером атерогенности липопротеинов плазмы крови, особенно у пациентов с гипертриглицеридемией и у людей с нормальными концентрациями ХС ЛПНП, так как отмечено, что уровни aпo-В >150 мг/дл тесно связаны с повышенным сердечно-сосудистым риском.
Большое значение для понимания патогенеза и лечения больных с первичными гипертриглицеридемиями послужило открытие особенностей метаболизма аполипопротеина Е (апо-Е) и мутаций гена липопротеиновой липазы. Апо-Е — один из ключевых регуляторов уровня липидов плазмы. Активность апо-Е-рецепторов печени, в частности, определяет степень катаболизма богатых ТГ частиц или ремнантов ЛПОНП и ЛППП. Большое клиническое значение в липидном обмене играют разные изоформы апо-Е. Изоформа апо-Е3 считается «нормальной». Наоборот, гомозиготность по аллели апо-Е2/апо-Е2 является причиной развития редкого типа гиперлипидемии — III типа.
Описано также участие в процессах атерогенеза липопротеина (а), который по физикохимическим свойствам похож на ЛПНП, но в дополнение имеет апо-а (читать как «эй» маленькое) и в свою очередь имеет структурное сродство с молекулой плазминогена. Липопротеин (а) имеет атерогенные и тромбогенные свойства, повышение его уровня в плазме крови >30 мг/дл тесно коррелирует с развитием и прогрессированием атеросклероза коронарных и каротидных артерий. Липопротеин (а) — это атерогенная липопротеиновая частица с плотностью 1,051–1,082 г/мл, со средним диаметром 26 нм, похожа на ЛПНП; основным отличием между ними служит наличие в составе липопротеина (а) молекулы уникального апобелка апо-а, ковалентно связанного с молекулой апо-В-100. Показано, что первичная структура активных участков апо-а имеет 98% гомологии с молекулой плазминогена. Это структурное сходство обеспечивает участие липопротеина (а) в процессах атеротромбогенеза путем прикрепления тромба на участках сосудистой стенки, богатых липопротеином (а). Концентрация липопротеина (а) в крови человека прямо зависит от степени атеросклеротических поражений коронарных, каротидных и периферических артерий. В данное время липопротеин (а) рассматривают как независимый биохимический маркер атеросклероза.
Степень атерогенности липопротеинов зависит не только от их концентрации, но и от их размера. Наименьшими из липопротеинов являются ЛПВП, они легко могут проникать в стенку артерии и покидать ее, не вызывая атеросклероз. В то же время ЛПНП, ЛППП и маленькие ЛПОНП имеют также небольшие размеры, что позволяет им проникнуть в стенку артерии, но при этом, будучи модифицированными в результате окисления, могут там задерживаться и постепенно инициировать атеросклеротический процесс. Наибольшие липопротеины ХМ и большие ЛПОНП не являются собственно атерогенными, однако высокие концентрации этих больших богатых ТГ липопротеинов могут вызвать заболевание поджелудочной железы.
Установлено, что большинство ХС в плазме крови обычно находится в виде ХС ЛПНП. За последние 25 лет можно определить несколько ключевых достижений в области исследований обмена липидов, которые тем или другим способом повлияли на клиническую практику. Одно из них — это открытие Мишелем Брауном и Джозефом Гольдштейном механизма генетических нарушений при наследственной гиперхолестеринемии. Расшифровка его в виде дефекта рецепторов к ЛПНП стала основанием для присуждения этим выдающимся ученым Нобелевской премии в 1985 г. и дала ключ к пониманию механизма атерогенности липопротеинов.
Выявлена положительная связь между уровнем общего ХС, а также ХС ЛПНП и риском ССЗ. Это относится как к пациентам без кардиальной патологии, так и к пациентам с установленной коронарной болезнью; к мужчинам и женщинам, хотя общий уровень риска у женщин ниже; распространяется на все возрастные группы. В то же время общий сердечно-сосудистый риск, согласно Рекомендациям Европейского общества кардиологов, зависит не только от уровня ХС, но и от целого ряда других факторов риска: возраста, пола, курения и АГ. Гипертриглицеридемия, низкий уровень ХС ЛПВП и сахарный диабет значительно ухудшают эффекты ХС ЛПНП даже при умеренно повышенных их концентрациях. Вместе с тем коронарную болезнь сердца выявляют довольно редко в популяциях с уровнем общего ХС <3–4 ммоль/л (115–155 мг/дл ), даже в присутствии других факторов риска. Напротив, коронарная болезнь сердца неминуема у пациентов, которым не проводилась терапия, с тяжелыми формами семейной гиперхолестеринемии даже при отсутствии других факторов риска, что подтверждает ведущую роль дислипидемий в атерогенезе. ХС ЛПНП может быть значительно повышенным у пациентов с обычной формой гетерозиготной семейной гиперхолестеринемии [7–12 ммоль/л (270–465 мг/дл)] и очень высоким при редчайшей гомозиготной форме [12–20 ммоль/л (465–770 мг/дл)].
Подобно другим классам, ЛПНП неоднородные. Более всего атерогенны маленькие, плотные ЛПНП. Они появляются в плазме при концентрации ТГ >1,4 ммоль/л и связаны с ранним развитием коронарной болезни у лиц молодого возраста. Атерогенность ХС ЛПНП подтверждена результатами эпидемиологических и клинических исследований по ангиографическим или клиническим конечным точкам. Снижение ХС ЛПНП должно быть основной задачей как первичной, так и вторичной профилактики.
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ И ЛАБОРАТОРНОЕ ИССЛЕДОВАНИЕ БОЛЬНЫХ С ДИСЛИПИДЕМИЯМИ
Внешние проявления дислипидемии
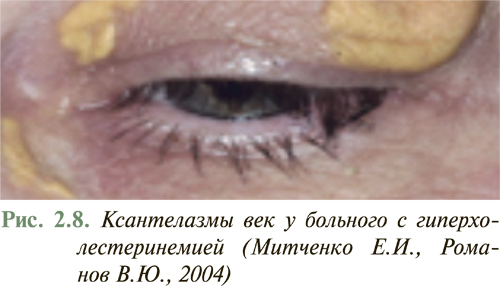
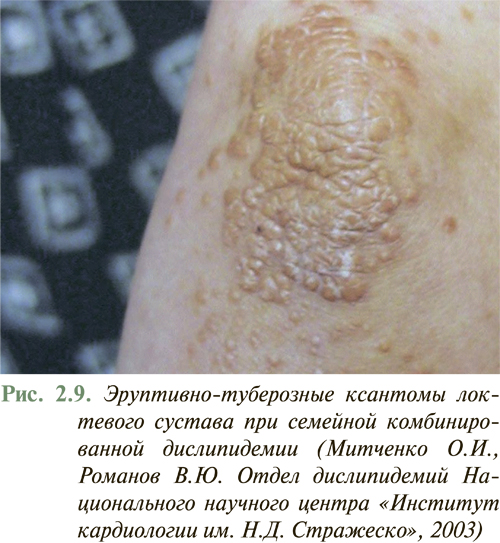
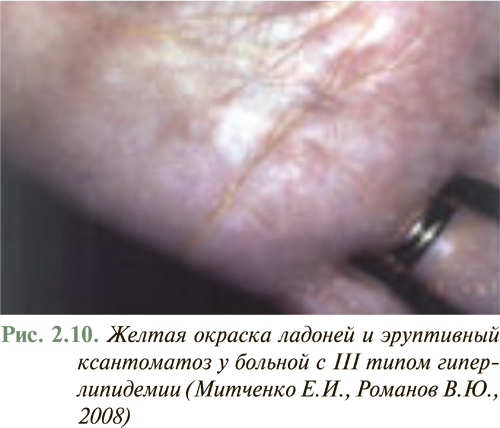
У большинства больных с умеренной дислипидемией внешние признаки нарушений липидного обмена отсутствуют. Появление внешних признаков нарушения липидного обмена в виде ксантелазм на веках (рис. 2.8), липоидной дуги роговицы, туберозных и сухожильных ксантом на участках кожи кистей рук, локтевых и коленных суставов (рис. 2.9), ахилловых сухожилий чаще отмечают у больных с семейной гиперхолестеринемией или другими наследственными нарушениями липидного обмена. Желтоватое окрашивание ладонного рисунка характерно для больных с гиперлипидемией III типа (рис. 2.10), а эруптивные ксантомы, рассеянные по всему телу, типичны для больных с комбинированной дислипидемией.
Выявление сопутствующих факторов риска ССЗ
Во время обследования пациента важно выявить сопутствующие, нелипидные факторы развития. Сочетание нескольких факторов риска существенно увеличивает опасность развития основных сердечно-сосудистых осложнений у больных с дислипидемиями. Выделяют модифицируемые и немодифицируемые факторы риска. К первым относят курение, АГ, избыточную массу тела, низкую физическую активность. Немодифицируемыми факторами риска являются возраст пациента, пол, отягощенная наследственность, то есть развитие клинических проявлений ИБС среди ближайших родственников у мужчин <55 лет, у женщин <65 лет. Сахарный диабет II типа рассматривается как эквивалент ИБС, то есть заболевание, при котором риск развития сосудистых осложнений чрезвычайно высок (табл. 2.6).
Таблица 2.6
Основные факторы риска развития и прогрессирования ИБС
| Возраст | Мужчины >45 лет
Женщины >55 лет или с ранней менопаузой |
| Раннее начало ИБС у ближайших родственников | ИМ или внезапная смерть у мужчин <55 лет, у женщин <65 лет |
| Курение | Независимо от количества |
| АГ | АД >140/90 мм рт. ст. или проведение антигипертензивной терапии |
| Гиперхолестеринемия | Общий ХС >5 ммоль/л (200 мг/дл); ХС ЛПНП >3,0 ммоль/л (115 мг/дл) |
| Гипертриглицеридемия | ТГ >1,7 ммоль/л (150 мг/дл) |
| Низкий уровень ХС ЛПВП | У мужчин <1 ммоль/л (40 мг/дл); у женщин <1,2 ммоль/л (46 мг/дл) |
| Сахарный диабет | Глюкоза крови натощак >7,0 ммоль/л (125 мг/дл) |
| Абдоминальное ожирение | Окружность талии:
у мужчин >102 см, у женщин >88 см (ATP-III, 2001); или у мужчин >94 см, у женщин >80 см (IDF, 2005) |
Лабораторное определение липидного спектра крови
Принимая во внимание необходимость мониторирования уровней липопротеинов в клинической практике, следует пользоваться лабораторной диагностикой, которая позволяет выделить группы риска. Существующие методы определения липопротеинов учитывают главным образом те или другие физико-химические характеристики, позволяющие идентифицировать отдельные их классы, имеющие определенный состав и специфические пути метаболизма. При прямом их определении в клинико-лабораторной практике применяют две методики. Одна из них основана на особенностях, выявляющихся при проведении электрофореза, согласно которым различают ХМ, которые остаются на старте; пре-β-липопротеины, β-липопротеины, занимающие промежуточное положение и α-липопротеины, как наиболее подвижные фракции. Другая методика учитывает характер разделения липопротеинов при ультрацентрифугировании. Согласно этой методике в зависимости от удельной плотности и выделяют ХМ как самые легкие частицы, а следующие — как ЛПОНП, ЛПНП и ЛПВП. Между липопротеинами, которые идентифицируются указанными методами, существует определенная аналогия, то есть пре-β-липопротеины, β-липопротеины и α-липопротеины соответствуют ЛПОНП, ЛПНП и ЛПВП.
Вместе с тем наиболее часто лабораторным путем определяются только три составляющие липидного спектра, а именно ХС, ТГ и ХС ЛПВП. Прогностически значимый ХС ЛПНП в этой ситуации вычисляют по формуле Friedewald*:
- в ммоль/л: ХС ЛПНП = общий ХС — ХС ЛПВП — (0,45 x уровень ТГ);
- в мг/дл: ХС ЛПНП = общий ХС — ХС ЛПВП — (0,2 x уровень ТГ).
*Вычисление действительно, только если концентрации ТГ <4,5 ммоль/л (400 мг/дл). Ошибка в определении ХС ЛПВП или в определении ТГ у пациентов, нарушивших диетические рекомендации перед сдачей крови, неуклонно может вызвать ошибку в вычислении наиболее прогностически значимого ХС ЛПНП!
Для предотвращения возникновения погрешностей в «Европейских рекомендациях по профилактике сердечно-сосудистых заболеваний в клинической практике» рекомендовано определять ХС не-ЛПВП натощак. Этот ХС находится в ЛПНП, ЛППП, ЛПОНП. Рассчитанный путем простого вычитания ХС ЛПВП из общего ХС ХС не-ЛПВП, в отличие от ХС ЛПНП, не требует условия, чтобы уровень ТГ был <5 ммоль/л. Этот показатель, подобно апо-B, служит для определения степени атерогенности липопротеинов в плазме и является более доступным, чем определение апо-B. Врачи, использующие ХС не-ЛПВП для оценки риска ССЗ своих пациентов, должны рассматривать его уровень <4 ммоль/л (150 мг/дл) как целевой.
Определение нескольких переменных плазменных липопротеинов, с одной стороны, уточняет, но с другой — усложняет оценку сердечно-сосудистого риска. В качестве примера можно привести вычисление соотношения общего ХС или ХС ЛПНП к ХС ЛПВП. Вместе с тем следует указать, что определение общего ХС, а не ХС ЛПНП для определения риска ССЗ в наших условиях важнее, поскольку, что следует из формулы Friedewald ошибка, допущенная в измерении ХС ЛПВП или ТГ, затронет вычисление прогностически значимого ХС ЛПНП. Для этой цели более перспективно для оценки риска использовать отношение общего ХС к ХС ЛПВП. Отношение общего ХС к ХС ЛПВП >5 указывает на повышенный риск ССЗ, что особенно ценно при оптимальных и пограничных концентрациях общего ХС — 5–6,5 ммоль/л (190–250 мг/дл). Значение определения отношения общего ХС к ХС ЛПВП как индикатора риска ССЗ основано на идее относительно близких физиологических соотношений между ЛПНП и ЛПВП и на концепции баланса между «прямым» и «обратным» транспортом ХС.
Следует также учитывать, что дислипидемия может быть вторичной по отношению к другим состояниям, и по очевидным причинам они должны быть устранены перед началом диеты и особенно медикаментозной терапии. Они включают злоупотребление алкоголем, диабет, гипотиреоз, болезни печени и почек и прием некоторых лекарственных средств. Исключение требует клинической оценки и проведения некоторых клинических тестов в виде определения тиреотропного гормона, АлАТ, ГГТ, альбумина, глюкозы, уровня гликолизированного гемоглобина и креатинина в плазме крови; определение среднего содержания эритроцитов, глюкозы и белка в моче. Пациенты, у которых предполагается генетическое заболевание типа семейной гиперхолестеринемии, должны консультироваться специалистами, включая постановку молекулярного генетического диагноза.
Определение риска общей сердечно-сосудистой смертности с использованием системы SCORE
Пациенты с установленными ССЗ являются группой высокого риска развития сердечно-сосудистых осложнений. Таким пациентам необходимы мероприятия по модификации образа жизни, при наличии показаний — назначение медикаментозной терапии. В группах с бессимптомным течением, то есть у относительно «здоровых» пациентов, профилактические мероприятия необходимо проводить согласно уровню общего риска развития ССЗ. Предложены различные модели для подсчета риска ССЗ у пациентов с бессимптомным течением. Эти модели используют мультифакториальный анализ разных комбинаций факторов риска в популяциях для определения дальнейшего прогноза.
На современном этапе предлагается использовать модель определения общего риска, основанного на системе SCORE (Systematic Coronary Risk Evaluation — Систематическая оценка коронарного риска), впервые представленную в Рекомендациях Европейского общества кардиологов в 2003 г. Существуют некоторые отличия от предыдущих вариантов подсчета. Система SCORE базируется на данных ряда последних проспективных европейских многоцентровых исследований и учитывает все варианты фатальных атеросклеротических конечных точек, то есть фатальных сердечно-сосудистых событий за 10-летний период. В системе SCORE использованы следующие факторы риска: пол, возраст, курение, САД, общий ХС или соотношение ХС и ЛПВП. Критерием высокого риска был определен риск >5%, в отличие от предыдущего >20% в диаграммах с использованием комплексной коронарной точки.
Практикующие врачи должны использовать определение общего риска ССЗ с целью интенсификации профилактических мероприятий, то есть при необходимости рекомендовать диетические мероприятия, индивидуализировать физическую активность, назначать или корригировать медикаментозную терапию, адаптировать дозирование препаратов или их комбинаций для контроля над факторами риска.
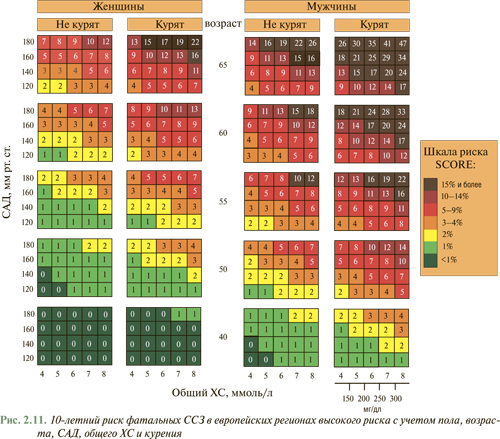
Общий сердечно-сосудистый риск может быть легко подсчитан с использованием диаграммы (рис. 2.11), где практикующим врачам и пациентам предложено использование системы SCORE для определения общего сердечно-сосудистого риска и путей его снижения (как путем модификации образа жизни, так и медикаментозной терапией) согласно доказанной эффективности и безопасности (основываясь на данных многоцентровых исследований).
Система SCORE позволяет определить общий прогнозируемый сердечно-сосудистый риск до 60-летнего возраста. Определение этого риска особенно важно для долгосрочного прогноза у пациентов молодого возраста (20–30 лет) при низком абсолютном риске, но уже с неблагоприятным профилем факторов риска. Это позволяет отнести таких пациентов к категории более высокого риска, который с возрастом будет повышаться.
К категориям высокого общего риска развития фатальных сердечно-сосудистых событий относятся:
1. Пациенты с установленным ССЗ (больные с любыми клиническими проявлениями ИБС, периферическим атеросклерозом, атеросклерозом мозговых артерий, аневризмой брюшного отдела аорты).
2. Пациенты с бессимптомным течением, имеющие:
2.1. множественные факторы риска, определяющие 10-летний риск >5% в настоящий момент и до достижения 60-летнего возраста.
2.2. значительно повышенные уровни единичного фактора риска: общего ХС >8 ммоль/л (320 мг/дл); ХС ЛПНП >6 ммоль/л (240 мг/дл); АД >180/110 мм рт. ст.
2.3. сахарный диабет II типа или диабет I типа с микроальбуминурией.
3. Ближайшие родственники больных с ранним началом ССЗ: у мужчин в возрасте до 55, у женщин — 65 лет.
Инструкция по использованию диаграммы. Для оценки персонального 10-летнего риска кардиоваскулярной смерти необходимо найти соответствующее место в таблице с учетом пола, возраста, статуса курильщика. Находят место в таблице с наиболее близким значением САД (мм рт. ст.) и общего ХС (ммоль/л или мг/дл).
Оценка факторов риска в возрастном аспекте определяется в верхней части таблицы. Это может быть полезным для дачи рекомендаций людям молодого возраста. Лиц с низким уровнем риска следует информировать о необходимости поддерживать этот низкий уровень риска в дальнейшем. Максимальное внимание необходимо уделять лицам среднего возраста, имеющим риск >5% и выше. Для определения относительного персонального риска сравнивают полученные результаты с параметрами, соответствующими пациентам, которые не курят, того же возраста и пола, с уровнем АД <140/90 мм рт. ст. и общим ХС <5 ммоль/л (200 мг/дл). Диаграмму могут использовать для сравнительной оценки перехода из одной категории риска в другую, например при отказе от курения или снижении других факторов риска.
Примечание: следует отметить, что общее количество факторов риска может быть выше, чем обозначено в диаграмме, поскольку:
- возможен переход к следующей возрастной категории;
- у пациентов с бессимптомными доклиническими проявлениями атеросклероза (например, по данным КТ, ультрасонографии);
- при семейном анамнезе предыдущих ССЗ;
- в случаях, если у пациента определяется: низкий уровень ХС ЛПВП, повышенный уровень ТГ, СРБ, фибриногена, гомоцистеина, аполипопротеина В или липопротеина (a), снижение толерантности к глюкозе;
- при ожирении и гиподинамии.
Следует принимать во внимание, что вышеуказанный 10-летний прогноз кардиоваскулярной смертности >5% (>0,5% в год) считается высоким для первичной профилактики. Его не следует непосредственно переносить на риск выявленной ИБС, то есть использовать для вторичной профилактики! В соответствии с последними Рекомендациями по диагностике и профилактике стабильной стенокардии (2006) Европейского общества кардиологов риск для установленной ИБС может быть расценен как высокий при смертности за год >2%, умеренный — 1–2%, низкий — <1%. Стратификацию риска в последнем случае следует проводить в соответствии с клиническими проявлениями, результатами стресс-тестов, состоянием вентрикулярной функции и состоянием коронарного русла.
ПЕРВИЧНАЯ И ВТОРИЧНАЯ ПРОФИЛАКТИКА ССЗ С УЧЕТОМ ВЫЯВЛЕНИЯ ДИСЛИПИДЕМИЙ
Первичная профилактика направлена на снижение ближайшего (<10 лет) и отдаленного (>10 лет) риска возникновения ИБС и предусматривает изменение образа жизни: уменьшение потребления жиров животного происхождения и ХС, повышение физической активности, контроль массы тела, снижение уровня ХС в плазме крови. Целевые уровни ХС ЛПНП при проведении первичной профилактики зависят от абсолютного риска, чем выше риск — тем ниже целевой уровень ХС ЛПНП.
Основой первичной профилактики является изменение образа жизни, однако высокие уровни общего ХС (>8 ммоль/л (320 мг/дл) или наличие множественных факторов риска являются показанием к назначению липидоснижающей терапии.
Каждому пациенту с высоким уровнем ХС ЛПНП или другой формой гиперлипидемии следует провести клинико-лабораторное обследование для исключения вторичных дислипидемий еще до начала липидоснижающей терапии.
Причинами вторичных дислипидемий могут быть:
- сахарный диабет;
- гипотиреоз;
- обструкция желчевыводящих путей;
- ХПН;
- препараты, повышающие уровень ХС ЛПНП, ТГ и уменьшающие ХС ЛПВП (прогестерон, анаболические стероиды, ГКС).
При исключении вторичной дислипидемии целевые уровни ХС для липидоснижающей терапии при первичной профилактике определяются соответственно категории риска.
Вторичная профилактика. Последние проведенные клинические исследования продемонстрировали уменьшение общей и коронарной смертности, основных коронарных событий, необходимости в проведении инвазивных процедур на коронарных артериях и инсультов у лиц с установленной ИБС под влиянием липидоснижающей терапии. Как установлено, уровень общего ХС <4,5 ммоль/л (175 мг/дл), при возможности <4,0 ммоль/л (155 мг/дл) и ХС ЛПНП <2,5 ммоль/л (100 мг/дл), при возможности <2,0 ммоль/л (80 мг/дл) является оптимальным, поэтому он определен как целевой уровень терапии при вторичной профилактике. Это подтверждается результатами клинических исследований по оценке клинических и ангиографических конечных точек и результатами проспективных эпидемиологических исследований. Те же целевые уровни следует использовать и у пациентов с эквивалентами риска ИБС. Если больные госпитализированы в случае развития острого коронарного синдрома или с целью проведения инвазивных процедур на коронарных артериях, определение липидов необходимо сделать сразу при госпитализации или на протяжении 24 ч. Целевые уровни должны ориентировать врача на начало липидоснижающей терапии до или сразу после проведения процедур. Коррекция терапии может быть проведена через 12 нед.
ДИАГНОСТИКА ДИСЛИПИДЕМИЙ И АЛГОРИТМ ОБСЛЕДОВАНИЯ БОЛЬНЫХ С УЧЕТОМ РИСКА РАЗВИТИЯ И ПРОГРЕССИРОВАНИЯ ССЗ
Каждому человеку в возрасте старше 20 лет при обращении в медицинское учреждение необходимо определить уровни ХС и ТГ (табл. 2.7); при дальнейшем обследовании врач должен:
- собрать анамнез, провести клиническое обследование;
- при повышении уровня ХС и/или ТГ провести определение развернутого липидного профиля плазмы: ХС, ХС ЛПВП, ТГ, ХС ЛПНП;
- у пациентов без клинических признаков ИБС и атеросклероза любой другой локализации оценить по шкале SCORE фатальный 10-летний риск ССЗ;
- наметить поэтапную цель гиполипидемической терапии: снижение ХС ЛПНП, затем повышение ХС ЛПВП и в итоге снижение ТГ;
- начать немедикаментозную терапию: соблюдение диеты, коррекция массы тела, повышение физической активности, прекращение курения;
- если путем модификации образа жизни на протяжении 8–12 нед не удается достичь намеченной цели, сохраняя все предыдущие условия, начать медикаментозную гиполипидемическую терапию. Если у больных с установленной ИБС или ее эквивалентами уровень ХС >4,5 ммоль/л, а ХС ЛПНП >2,5 ммоль/л, медикаментозную терапию необходимо начать одновременно с мероприятиями по немедикаментозной профилактике ИБС;
- контролировать показатели липидного обмена, уровень ферментов АлАТ, АсАТ, КФК 1 раз в 3 мес на протяжении первого года наблюдения.
Таблица 2.7
Категории лиц, подлежащие лабораторному скринингу в зависимости от степени риска ССЗ
| Возраст >20 лет | Что определять |
| У здоровых лиц, обратившихся в медицинское учреждение | ХС и ТГ |
| У больных с ИБС, сахарным диабетом, с АГ, у лиц с несколькими факторами риска (суммарный фатальный риск >5%) | Натощак
ХС, ХС ЛПВП, ТГ, ХС ЛПНП |
Примечание: у любого пациента в возрасте 20 лет и старше, обратившегося в лечебное учреждение, необходимо определить показатели ХС и ТГ. Если у обследуемого выявлена гиперхолестеринемия и/или гипертриглицеридемия (натощак), необходимо определить полный липидный профиль (ХС, ХС ЛПВП, ТГ, ХС ЛПНП) натощак. Рекомендуется рассчитать индекс атерогенности как важный показатель угрозы развития и прогрессирования атеросклероза.
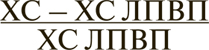
ЛЕЧЕНИЕ БОЛЬНЫХ С ДИСЛИПИДЕМИЕЙ
Модификация факторов риска у пациентов с дислипидемиями
Поведенческие факторы риска
Изменение образа жизни (ЗОЖ — здоровый образ жизни) необходим большинству пациентов с диагностированным ССЗ и лицам с высоким риском развития данной патологии. Однако в последних публикациях обращают внимание на значительные различия между рекомендациями по изменению образа жизни и фактическим соблюдением их на практике. Изменение поведенческих факторов риска аналогично как для пациентов с ССЗ, так и для лиц с высоким уровнем риска развития данной патологии, но изменения указанных факторов риска (неправильное питание, курение, сидячий образ жизни), сложившиеся на протяжении многих лет, требуют профессионального подхода.
Многим пациентам довольно тяжело изменить образ жизни только по совету врача. Это свойственно лицам социально и экономически дезадаптированным, одиноким, находящимся в хроническом стрессовом состоянии.
Кроме того, отрицательные эмоции, включая депрессию, гнев и агрессивное настроение, могут быть барьером для профилактических мероприятий у данной группы лиц. Терапевт может преодолеть эти барьеры с помощью простого набора вопросов. Однако, хотя беседа и понимание врача могут быть полезными, а в некоторых случаях и достаточными для устранения риск-факторов, для того чтобы справиться с постоянными отрицательными эмоциями и стрессовым состоянием пациенту может требоваться психологическая помощь или проведение соответствующей медикаментозной терапии. Поскольку психосоциальные факторы независимы от стандартных факторов риска, по возможности необходимо стремиться к их нормализации.
Стратегические шаги для повышения эффективности рекомендаций включают:
- развитие доверительных отношений между терапевтом и пациентом;
- понимание пациентом связи между образом жизни, здоровьем и болезнью;
- помощь пациентам в изменении поведения;
- заинтересованность пациентов в данной модификации поведения;
- привлечение пациентов к идентификации и анализу факторов риска;
- использование комбинированных стратегий для укрепления самосознания пациента;
- проектирование плана модификации образа жизни;
- контроль эффективности при последующем наблюдении;
- привлечение к решению данного вопроса других подразделений органов здравоохранения.
Прекращение курения
Все курильщики должны поощряться в стремлении прекратить курение. Стратегия содержит в себе «5А»:
1A) — «ask» (спросить): систематически идентифицировать курильщиков;
2А) — «assess» (оценить): степень готовности к прекращению курения;
3A) — «advise» (советовать): убедительно советовать отказаться от курения;
4A) — «assist» (принимать участие): рекомендовать никотинзаместительную терапию и/или фармакологическое воздействие;
5A) — «arrange» (упорядочивать): упорядочить график последующих посещений.
Повышение физической активности
Физическая активность должна повышаться у пациентов всех возрастных групп — от детского до взрослого населения. Особое внимание следует уделить группе повышенного риска, в которой физическая активность должна приводить к снижению риска возникновения ССЗ. Цель, к которой необходимо стремиться, — это как минимум полчаса физической активности каждый день, хотя более умеренная активность также приносит пользу. Здоровым людям необходимо советовать выбрать наиболее приемлемые физические нагрузки, которые вписываются в их распорядок дня, преимущественно 30–45 мин 4–5 раз в неделю, достигая 60–75% максимальной нагрузки на сердце.
Для пациентов с установленным ССЗ рекомендации по расширению физической активности должны базироваться на всестороннем клиническом обследовании с привлечением результатов нагрузочных тестов.
Для оценки допустимых физических нагрузок пациента полезно применять следующее распределение физической активности (табл. 2.8).
Таблица 2.8
Сопоставление градаций физической активности
| Активность | Ежедневная | Профессиональная | Спортивная |
| Легкая
<40 Вт |
Самообслуживание, туалет, одевание | Вождение автомобиля | Прогулки |
| Средняя
40–85 Вт |
Домашние работы | Работа стоя | Велосипед |
| Энергетическая
85–120 Вт |
Сексуальная активность | Строительные работы | Плавание |
| Напряженная
120–160 Вт |
Быстрый подъем по лестнице | Работа на огороде, в парке | Бег |
| Атлетическая
150–240 Вт |
Подъем веса >40 кг | Работа лесоруба | Регби, футбол |
Избыточная масса тела и ожирение
Нормализация массы тела или снижение имеющейся избыточной массы важны как для пациентов с ИБС, так и для лиц с высокой степенью риска. Наличие ожирения верифицируется в соответствии с критерием ВОЗ (1998) — ИМТ при его величине >30 кг/м2. Снижение веса тела крайне необходимо лицам с ожирением или избыточной массой тела (25 кг/м2<ИМТ<30 кг/м2), а также всем лицам с абдоминальным типом ожирения, которое определяется по окружности талии (при окружности талии >94 см в мужчин и >80 см у женщин (IDF, 2005)). Снижение массы тела будет более успешным, если будет поддерживаться, с одной стороны, профессионально врачами, а с другой — наличием мотивации со стороны самого пациента.
Липидоснижающая терапия у пациентов с дислипидемиями
Диета
Формирование здоровой диеты является неотъемлемой частью лечения пациентов с дислипидемиями. В каждом отдельном случае необходима профессиональная консультация относительно выбора диеты, максимально снижающей риск ССЗ. Правильно подобранная диета способствует нормализации массы, АД, липидного обмена, контролирует уровень глюкозы крови и снижает вероятность возникновения тромбоза.
Общие рекомендации необходимо адаптировать в соответствии с национальными особенностями:
- необходимо разнообразить рацион питания; потребление энергии должно быть отрегулировано соответственно энерготратам с целью поддержки идеальной массы тела;
- приоритет необходимо отдавать таким продуктам, как овощи и фрукты, неочищенные злаки и хлеб грубого помола, молочные продукты с низким содержанием жира, обезжиренные диетические продукты, постное мясо и рыба;
- желательно преимущественное потребление жирных сортов рыбы, которые содержат омега-3-полиненасыщенные жирные кислоты, обладающие специфическими защитными свойствами;
- общее потребление жира не должно превышать 30% потребляемой энергии, часть насыщенных жиров не должна превышать И общего потребления жира. Потребление ХС должно быть <300 мг/день;
- в низкокалорийной диете насыщенные жиры могут частично замещаться сложными углеводами, моно- и полиненасыщенными жирами овощей и морепродуктов.
- увеличение потребления углеводов, содержащихся в свежих фруктах, злаках и овощах. Гипертоникам и лицам с избыточной массой тела рекомендуется дополнительно снизить потребление соли до 5 г/день и менее; ограничить прием алкоголя.
Для людей с избыточной массой тела необходимо ограничение калорийности пищи. Рекомендуемые продукты питания обычно содержат мало жиров и/или много клетчатки. Эти продукты должны быть основой рациона (табл. 2.9). Некоторые пациенты с выраженной гипертриглицеридемией нуждаются в диете, строго ограничивающей содержание длинноцепочечных жирных кислот в продуктах животного и растительного происхождения. Целью этой диеты является предотвращение панкреатита. Эта рекомендация существенно отличается от общих диетических рекомендаций, большинство пациентов будет нуждаться в помощи хорошего диетолога.
Пациенты с АГ, сахарным диабетом, гиперхолестеринемией или другими дислипидемиями должны консультироваться с диетологом.
Таблица 2.9
Пищевой состав антиатерогенной диеты
| Питательные вещества | Рекомендованное потребление |
| Насыщенные жиры* | <7% общего калоража |
| Полиненасыщенные жиры | До 10% общего калоража |
| Мононенасыщенные жиры | До 20% общего калоража |
| Общие жиры | 25–35% общего калоража |
| Углеводы** | 50–60% общего калоража |
| Пищевые волокна | 20–30 г/сут |
| Белок | Приблизительно 15% общего калоража |
| ХС | <200 мг/дл/сут |
| Суточный калораж*** | Для поддержки желаемой массы тела и предотвращения ее увеличения необходимо соблюдать баланс между потреблением и затратами энергии.
Для уменьшения массы тела необходимо уменьшить потребление калорий, но не <1200 ккал/сут |
*Потребляемые жирные кислоты способствуют увеличению ХС ЛПНП, их потребление следует ограничить.
**Углеводы необходимо получать преимущественно из пищевых продуктов, богатых сложными углеводами, включая зерновые, особенно цельное зерно, а также из фруктов и овощей.
***Ежедневные энергозатраты должны включать хотя бы умеренную физическую активность (приблизительно 200 ккал/сут).
Липидоснижающие препараты
Эффективность применения липидоснижающих препаратов связана с улучшением функции эндотелия, стабилизацией атеросклеротической бляшки, торможением или регрессией атеросклероза. Медикаментозное лечение дислипидемий предусматривает использование 4 групп препаратов: ингибиторов ГМГ-КоА-редуктазы, статинов (ловастатин, симвастатин, правастатин, аторвастатин, розувастатин); секвестрантов желчных кислот (колестирамин, колестипол); никотиновой кислоты, ниацинамида, фибратов (гемфиброзил, безофибрат, фенофибрат).
Ингибиторы ГМГ-КоА-редуктазы (статины)
Статины — основной класс препаратов в лечении дислипидемий. По результатам больших рандомизированных исследований продемонстрирована их высокая эффективность в снижении общего ХС и прогностически значимого ХС ЛПНП. Согласно выводам этих исследований выявлено снижение основных осложнений ССЗ (инфаркта, инсульта, общей и сердечной смертности) более чем на 25–40%.
В данное время применяют следующие препараты: ловастатин, правастатин, флувастатин, симвастатин, аторвастатин и наиболее активный в отношении блокады ГМГ-КоА-редуктазы, новый препарат розувастатин. В основе механизма действия статинов — частичная обратимая блокада фермента ГМГ-КоА-редуктазы, ответственного за внутриклеточный синтез ХС. Снижение внутриклеточной концентрации ХС приводит к восстановлению/повышению функции клеточных рецепторов к ЛПНП, что обеспечивает увеличение сывороточного клиренса и снижение сывороточного уровня ХС ЛПНП в среднем на 25–40%. На фоне терапии статинами отмечают умеренное повышение ХС ЛПВП (на 5–15%) и снижение уровня ТГ на 10–40%. Эффекты статинов дозозависимы. Так, например, симвастатин в дозе 40 мг/сут снижает уровень ХС ЛПНП в среднем на 41%, а в дозе 80 мг — на 47%. Вместе с тем кривая зависимости эффекта симвастатина от дозы, как и других статинов, имеет вид экспоненты: каждое удвоение дозы приводит к дополнительному снижению уровня ХС ЛПНП в среднем на 6% («правило шестерки»).
Влияние статинов на организм больного — многоступенчатый процесс проявления эффектов препарата во времени, в связи с чем можно говорить о терапевтическом каскаде эффектов статинов. Наиболее раннее действие этих средств реализуется через несколько недель/месяцев после начала терапии и проявляется в улучшении функции эндотелия, уменьшении процессов сосудистого воспаления (снижение СРБ), стабилизации атероматозной бляшки, что в результате приводит к улучшению перфузии миокарда, уменьшению ишемии. Важным на этом этапе является также более раннее (после 1 года терапии — в исследовании HPS) расхождение кривых выживания по сравнению с ожидаемыми результатами, которые могли бы быть обусловлены исключительно иполипидемическим влиянием статинов. Например, в исследовании POSCH пациентам проводили частичное шунтирование тонкого кишечника, что приводило к снижению всасывания жиров и снижению уровня ХС ЛПНП на 39%, однако увеличение выживания отмечали только через 3 года после оперативного вмешательства. Одним из механизмов стабилизирующего действия статинов на атерому является их влияние на макрофаги. Статины влияют на нуклеарные а-рецепторы пероксисомных пролифераторов, в связи с чем угнетается выработка металлопротеиназ и других факторов, способствующих дестабилизации атероматозной бляшки.
Основными эффектами статинов на втором уровне терапевтического каскада является предотвращение прогрессирования старых бляшек и появления новых, а также частичное уменьшение (регресс) объема уже существующих. Так, в исследовании MAAS после 2-летнего лечения симвастатином прогрессирование атеросклероза отмечали на 30% реже, чем в контрольной группе, а регресс атером — на 30% чаще.
Третий уровень каскада действия статинов достигается через 4 года и более от начала лечения. При этом достигаются основные стратегические цели: снижение кардиальной и общей смертности (на 18–30%); предотвращение серьезных сердечно-сосудистых осложнений, уменьшение потребности в реваскуляризации. Наиболее высокую эффективность статины демонстрируют в группах высокого риска: у пациентов пожилого возраста, с сопутствующим сахарным диабетом, атеросклерозом мозговых и периферических артерий.
Четвертый уровень действия статинов — положительное влияние на некардиальную патологию. Так, в данное время имеются сведения о положительном влиянии статинов не только на количество сердечно-сосудистых осложнений у больных сахарным диабетом, но и на течение самого заболевания. Установлено, что среди лиц, принимающих статины, частота развития сахарного диабета на 30% ниже. Перспективной является информация о снижении на фоне терапии статинами риска развития болезни Альцгеймера и сосудистой деменции. Результаты недавно проведенных исследований показали, что применение статинов приводит к двукратному уменьшению остеопороза и частоты переломов костей, особенно в группе пациентов пожилого возраста. Эти эффекты статинов не связаны с липидоснижающим действием, параллельный анализ не выявил указанных эффектов ни для никотиновой кислоты, ни для фибратов.
Различные статины отличаются по фармакологическим свойствам. Первые статины (ловастатин, симвастатин и правастатин) были выделены из культуры пенициллиновых грибов и грибов Aspergillus terreus, в то же время флувастатин, аторвастатин и розувастатин — синтетические препараты. Отличаются статины и по другим свойствам: так, ловастатин и симвастатин — липофильные соединения, правастатин и флувастатин — в большей степени гидрофильные. Ловастатин и симвастатин поступают в организм в неактивной форме (pro-drugs/пролекарства) и превращаются в активные метаболиты в печени. Существенное преимущество естественных статинов заключается в том, что активные формы препарата действуют только в печени и не достигают периферических тканей, что снижает риск серьезных побочных эффектов, таких как миопатия. Период полувыведения естественных статинов из плазмы крови составляет 0,5–3 ч, что также важно для снижения риска побочных явлений. Период полувыведения синтетического препарата аторвастатина (в виде активного метаболита) составляет 14 ч. Статины метаболизируются системой цитохромов, в том числе Р450, в связи с чем лекарственные препараты, влияющие на активность печеночных цитохромов, могут значительно изменять их свойства (биодоступность, продолжительность действия и т.д.). Наиболее выраженный гиполипидемический эффект характерен для розувастатина (табл. 2.10).
В данное время для проведения первичной и вторичной профилактики ИБС наиболее обоснованным следует считать применение статинов, для которых доказано положительное влияние на долгосрочный прогноз (снижение сердечно-сосудистой смертности на 30–40%). Как показали результаты исследований (АЕСАР TexCAPS, WOSCOPS, 4S, CARE, LIPID, MIRAC, AVERT), применение статинов приводит к снижению на 25–40% коронарной смертности, на 26–30% снижает риск развития ишемических событий. Назначение больным с ИБС правастатина (CARE, 1996) и симвастатина (HPS, 2001) сопровождалось уменьшением общей и сердечно-сосудистой смертности, как у пациентов с повышенным, так и нормальным или несколько сниженным уровнем ХС.
Результаты повторных коронароангиографий в серии исследований с применением разных гиполипидемических препаратов подтвердили их способность приводить к торможению и регрессии коронарного атеросклероза. Клинический эффект снижения ХС ЛПНП по принципу «чем ниже, тем лучше» был неоднократно подтвержден в серии клинических исследований, проведенных в 80–90-х годах с применением повторных ангиографий, которые доказали регрессию атеросклероза. Был установлен гипотетический диапазон, при котором снижение ХС ЛПНП имело анатомический и клинический эффект — Δ % ХС ЛПНП = 25–45%. Клинические данные по безопасности и снижению сердечно-сосудистой смертности, полученные в регрессивных исследованиях, а также данные длительной хорошей переносимости и безопасности применения статинов послужили научным обоснованием для проведения многоцентровых клинических исследований с «твердыми» конечными точками (сердечно-сосудистая и общая смертность).
Таблица 2.10
Сопоставление эффективности статинов по способности снижения ХС ЛПНП
| Розувастатин,
мг/сут |
Аторвастатин,
мг/сут |
Симвастатин,
мг/сут |
Ловастатин,
мг/сут |
Правастатин,
мг/сут |
Флувастатин,
мг/сут |
Δ ЛПНП,
мг/сут |
| — | — | 10 | 20 | 20 | 40 | –27 |
| 5 | 10 | 20 | 40 | 40 | 80 | –34 |
| 10 | 20 | 40 | 80 | — | — | –41 |
| 20 | 40 | 80 | — | — | — | –48 |
| 40 | 80 | — | — | — | — | –52 |
Однако выраженные клинические эффекты при применении липидоснижающих средств, особенно статинов, не всегда соответствовали результатам ангиографического исследования. Как оказалось, кроме торможения прогрессирования атеросклероза путем уменьшения накопления липидов в месте атеросклеротического поражения, статины также реализуют свое действие путем нормализации функции эндотелия и стабилизации атеросклеротической бляшки, которая становится более плотной и стойкой к механическим влияниям. Соответственно снижается вероятность разрыва бляшки и развития тромбоза и тем самым обеспечивается предупреждение острого коронарного синдрома. Эти дополнительные эффекты статинов, связанные с улучшением функции эндотелия, высвобождением и биодоступностью оксида азота, уменьшением процесса воспаления в атеросклеротической бляшке, миграции и пролиферации гладкомышечных клеток сосудистой стенки, агрегации тромбоцитов, повышением фибринолитической активности крови и другие, хорошо изучены в экспериментальных и клинических исследованиях и получили название плейотропных, липидонезависимых эффектов. Именно с этими механизмами многие исследователи связывают более высокую клиническую эффективность статинов по сравнению с другими группами липидоснижающих препаратов. Недавно установлено, что статины в низких дозах вызывают неоангиогенез мелких сосудов миокарда, чем улучшают его перфузию.
В подходах к назначению гиполипидемических средств был сделан переворот, когда выяснилось, что даже нормальный уровень ХС может быть потенциально опасным в отношении развития и прогрессирования атеросклероза коронарных сосудов. Как оказалось, 35% больных с ИБС имеют нормальный уровень общего ХС и ХС ЛПНП. Однако у таких пациентов могут отмечать дислипопротеинемию с повышенным содержанием в крови наиболее атерогенной субфракции ЛПНП, так называемых маленьких плотных частиц ЛПНП, что сочетается с повышением ТГ и низким уровнем ХС ЛПВП. Особенно часто такие нарушения отмечают у больных с метаболическим синдромом и сахарным диабетом II типа. В исследовании CARE (The Cholesterol and Recurrent Events Trial) впервые показан эффект липидоснижающей терапии (правастатин) у пациентов, перенесших сердечную атаку со средним уровнем ХС 209 мг/дл. В большом исследовании HPS (Heart Protection Study), в котором принимали участие 20 536 пациентов, оценивали влияние симвастатина (40 мг/сут) и витаминов (600 мг витамина Е; 250 мг витамина С; 20 мг β-каротина ежедневно) на общую смертность и смертность от сердечно-сосудистых причин у больных с ИБС из группы высокого риска. По результатам исследования сделаны следующие выводы:
- применение витаминов было безопасным, однако не снижало риск развития сердечно-сосудистых событий на протяжении 5 лет, несмотря на повышение уровня витаминов в крови;
- применение симвастатина 40 мг/сут также безопасно, но при этом снижался риск развития неблагоприятных сосудистых событий на 24% во всех возрастных группах независимо от пола. В старшей возрастной группе (у лиц старше 75 лет) лечение оказало наиболее выраженный эффект и привело к снижению риска смерти на 32%;
- применение симвастатина не сопровождалось повышением частоты онкологических заболеваний, суммарный показатель смертности от всех причин уменьшился на 12%.
Применение симвастатина сопровождалось снижением риска развития сосудистых событий у пациентов с исходно нормальным уровнем ЛПНП и ТГ, так же эффективно, как и для пациентов с высоким уровнем указанных показателей. Таким образом, назначение статинов рекомендуется всем пациентам с доказанной ИБС и высоким риском сосудистых осложнений независимо от пола, возраста и исходного уровня ХС. Врачебной ошибкой является неназначение статинов таким больным.
Прием статинов как минимум на треть снижал риск развития ИМ, мозгового инсульта, необходимости в реваскуляризации и предотвращал сосудистые осложнения также вне зависимости от исходного уровня ХС. В исследовании защиты сердца — HPS (Heart Protection Study) продемонстрировано, что снижение уровня ХС под влиянием симвастатина уменьшает риск частоты ишемических инсультов. Установлено, что эффект липидоснижающей терапии зависит от исходного уровня риска: чем выше риск, тем больше эффект, то есть абсолютное сокращение риска было наиболее высоким у пациентов наиболее высокого риска. Главная находка HPS заключается в том, что лечение больных с цереброваскулярной патологией, заболеваниями периферических артерий и сахарным диабетом настолько же эффективно, как и терапия пациентов с коронарной болезнью сердца.
Следует отметить, что в данное время проведен ряд многоцентровых исследований по сравнению эффективности и безопасности липидоснижающих препаратов. Показательными оказались результаты анализа сравнимых доз статинов в исследовании CURVES (Comparative study of HMG-Co Reductase inhibitor, atorvastatin, Versus Equivalent dose strengths of Statins) — рандомизированном открытом изучении статинов в параллельных группах сравнения. В нем аторвастатин продемонстрировал более выраженное снижение уровня общего ХС и ХС ЛПНП в дозе 10 мг по сравнению с дозами 20 мг симвастатина и 40 мг правастатина и церивастатина. Побочные эффекты на фоне использования аторвастатина отмечали только у 2% больных.
Следующим необходимо вспомнить исследование ACCESS (The Atorvastatin Comparative Cholesterol Efficacy and Safety Study), в котором по сравнению с другим статинами (симвастатин, ловастатин, правастатин, флувастатин) лечение аторвастатином привело к максимальному снижению ХС ЛПНП как через 6 нед (–36%), так и через 54 нед терапии (–42%).
Следующая группа доказательств получена в многоцентровых исследованиях по достижению клинических точек. Так, в исследовании ASCOT-LLA (Anglo-Scandinavian Cardiac Outcomes Trial — Lipid-Lowering Arm), в котором липидоснижающая ветвь наблюдения была закончена досрочно в связи с явным преимуществом липидоснижающей терапии против плацебо. Аторвастатин снижал уровень общего ХС на 1,3 ммоль/л в 1-й год и на 1,1 ммоль/л через 3 года. В группе аторвастатина было зарегистрировано снижение относительного риска первичных конечных точек (нефатальный ИМ и фатальные случаи ИБС) по сравнению с группой плацебо на 36%. В группе аторвастатина было также отмечено снижение относительного риска для фатального и нефатального инсульта на 27%, всех сердечно-сосудистых событий на 21%, а коронарных — на 29%. По результатам исследования MIRACL (Myocardial Ischaemia Reduction with Aggressive Cholesterol Lowering) — рандомизированного двойного слепого плацебо-контролируемого сравнения применения 80 мг/ сут аторвастатина или плацебо с соблюдением диеты — отмечали редукцию миокардиальной ишемии на фоне агрессивной холестеринснижающей терапии. При этом суммарную первичную конечную точку (смерть, нефатальный ИМ, остановка сердца с реанимационными мероприятиями, рецидив симптомов ишемии миокарда с объективным подтверждением, нуждающийся в неотложной повторной госпитализации) отмечали в 14,8% случаев в группе аторвастатина и в 17,4% в группе плацебо. По сравнению с плацебо аторвастатин снизил риск ишемии с объективными признаками, требующей неотложной повторной госпитализации. Применение препарата достоверно снизило риск развития фатальных и нефатальных инсультов у больных с высоким риском на 50%. В группе пациентов, которые принимали аторвастатин, ХС ЛПНП снизился с 3,2 до 1,9 ммоль/л. Одним из основных выводов данного исследования было то, что у пациентов с острым коронарным синдромом лечение аторвастатином, которое было начато в острый период коронарных событий, помогло предотвратить повторение миокардиальной ишемии на протяжении последующих 4 мес.
Следующим решением актуальных задач терапии статинами было исследование оптимального уровня, до которого необходимо снижать ХС ЛПНП с целью получения максимального клинического эффекта. Этой цели соответствовало исследование PROV-IT, согласно которому сопоставляли лечение высокоинтенсивной липидоснижающей терапией, в качестве которой применялся аторвастатин в дозе 80 мг/сут, и стандартной липидоснижающей терапии правастатином в дозе 40 мг/сут. Преимущество интенсивной терапии выявлено уже через 30 дней и сохранялось на протяжении всего исследования. Как и предполагалось, у пациентов с ХС ЛПНП >3,23 ммоль/л наибольший эффект лечения (–34% по достижению первичной конечной точки) отмечен в группе интенсивной липидоснижающей терапии аторвастатином.
Гипотеза относительно преимущества снижения ХС ЛПНП ниже упомянутого целевого уровня в рекомендациях ATP-III (2001), а именно — 2,6 ммоль/л нашло свое подтверждение в исследовании TNT (Treating to New Targets — «Лечение к новым целям»), в котором сопоставлена эффективность двух доз одного препарата — аторвастатина 10 и 80 мг. В течение 5 лет получены убедительные результаты при интенсивной липидоснижающей терапии аторвастатином в дозе 80 мг, позволившие снизить риск сердечно-сосудистых осложнений на 22% (р<0,001). Тем не менее отмечен рост побочных реакций в виде роста гиперферментемии на фоне интенсивного режима лечения от 0,1–0,3 до 1,2%.
Дополнительный результат преимущества своевременной липидоснижающей терапии даже невысокими дозами статинов у групп с высоким риском получен в соответствии с результатами многоцентрового рандомизированного исследования CARDS, посвященного наблюдению больных с высоким риском сердечно-сосудистых осложнений (больные сахарным диабетом), у пациентов без сердечно-сосудистых заболеваний на момент включения в исследование. Согласно полученным результатам аторвастатин в дозе 10 мг/сут обеспечил на 37% снижение частоты развития тяжелых сердечно-сосудистых осложнений, на 48% — частоты развития инсультов, на 27% — смертности от всех причин. А дебаты относительно того, всем ли больным сахарным диабетом II типа следует назначать статины, отныне должны трансформироваться в вопрос: существуют ли в настоящее время больные с довольно низким риском осложнений, которым статины можно не назначать, то есть их нужно обязательно назначать больным сахарным диабетом II типа.
Проведенный недавно метаанализ длительных многоцентровых исследований (опубликован в журнале «Lancet», 2005), в котором проанализированы наблюдения 90 056 пациентов, получавших терапию статинами, продемонстрировал, что снижение ХС ЛПНП на 1,0 ммоль/л/год привело к снижению на 12% общей смертности от всех причин и на 19% — коронарной смертности. Эти закономерности появляются уже в конце 1-го года наблюдения и имеют дальнейший достоверный рост. На протяжении 5 лет снижение ХС ЛПНП на 20% приводит к уменьшению на 48 случаев из каждой 1000 пролеченных по поводу основных сердечно-сосудистых событий (инфаркт, инсульт), на 27 — коронарной реваскуляризации, при этом не отмечен достоверный рост побочных реакций, в том числе случаев онкозаболеваний. Данные результаты подтверждены убедительными доказательствами больших метаанализов, проведенных другими исследователями, в которых получены сведения о преимуществах более интенсивного снижения ХС ЛПНП — <70 мг/дл (1,8 ммоль/л), что нашло отражение в новой редакции американских рекомендаций ATP-III, откорректированных в 2004 г., где вышеуказанные уровни ХС ЛПНП обозначены как целевые для групп высокого риска, прежде всего больных с сочетанием ИБС и сахарного диабета. Тем не менее следует отметить, что данные целевые уровни для ХС ЛПНП, не принятые еще к широкому использованию у больных с ИБС Европейским кардиологическим обществом в соответствии с Рекомендациями по диагностике и лечению стабильной стенокардии (2006), указаны как «целевые» для больных сахарным диабетом в соответствии с Рекомендациями Европейского кардиологического общества по диагностике и лечению диабета, предиабета и кардиоваскулярным заболеваниям (2007).
Последними убедительными доказательствами эффективности липидоснижающей терапии являются результаты двух исследований — REVERSAL, 2004 и ASTEROID, 2006. При анализе итогов отмечается возможность регресса атеросклеротической бляшки вследствие интенсивной терапии статинами с объективизацией полученных данных путем проведения внутрисосудистого УЗИ (IVUS). Согласно полученным результатам снижение ХС ЛПНП и повышение ХС ЛПВП привело к регрессу атеросклеротических бляшек относительно проведенных параметров исследования, что позволило рекомендовать дальнейшую интенсивную терапию статинами всем больным с диагностированными атеросклеротическими поражениями коронарных сосудов.
Дальнейшее повышение эффективности гиполипидемической терапии статинами возможно 3 путями: 1 — повышение дозы статинов, но данный путь, безусловно, приводит к росту количества побочных реакций; 2 — применение новых синтетических статинов, однако следует принимать во внимание побочные эффекты церивастатина, который значительно превышал по гиполипидемической эффективности другие статины, но был снят с производства в связи с большим процентом развития побочных реакций; 3 — применение комбинации статинов с другими липидоснижающими средствами. Наибольшие перспективы на сегодня у комбинации статинов с эзитимибом, который препятствует всасыванию ХС в кишечнике. Положительный клинический опыт зарегистрирован на фоне комбинации эзетимиба с симвастатином, что привело к значительному усилению гиполипидемического эффекта липидоснижающих средств.
Секвестранты желчных кислот
Препараты этой группы (колестирамин, колестипол) используют в клинической практике более 3 десятилетий. Препараты отличаются по химической структуре, но подобны по механизму действия, которое заключается в прерывании естественной рециркуляции пула желчных кислот, обогащенных ХС. Желчные кислоты синтезируются в печени. В норме около 3% желчных кислот удаляется из организма, оставшаяся часть рециркулирует после абсорбции в дистальных отделах кишечника. Препараты связывают желчные кислоты в кишечнике, предотвращая их реабсорбцию и повышая экскрецию в 2–10 раз. Повышенное выведение желчных кислот приводит к усилению их печеночного синтеза, что в свою очередь вызывает снижение внутрипеченочного ХС. Дополнительно препараты снижают абсорбцию ХС, который поступает с пищей, и влияют на рецепторы к ЛПНП. Основным недостатком длительной терапии секвестрантами желчных кислот является снижение их эффективности, что обусловлено вторичной стимуляцией печеночного фермента ГМГ-КоА-редуктазы и в свою очередь приводит к повышению синтеза ХС. В связи с этим колестирамин и колестипол часто назначают в комбинации со статинами, блокируя этим активность ГМГ-КоА-редуктазы. Назначение секвестрантов желчных кислот приводит к снижению общего ХС и ХС ЛПНП, последнего на 15–30%, повышению ХС ЛПВП в среднем на 5%, показатели ТГ могут варьировать, незначительно может повышаться ХС ЛПОНП. Положительной стороной терапии секвестрантами желчных кислот является отсутствие у них системного действия. Однако в целом они вызывают большое количество побочных реакций со стороны ЖКТ: боль, вздутие живота, гастроэзофагеальный рефлюкс. Применение указанных препаратов приводит к нарушению всасывания жирорастворимых витаминов (А, D, E). Для секвестрантов желчных кислот характерны взаимодействия с тироксином, дигоксином, блокаторами β-адренорецепторов, диуретиками, варфарином, различными антибиотиками. В связи с чем назначение перечисленных препаратов рекомендуется за 1 ч до или через 4–6 ч после приема колестирамина/колестипола.
Никотиновая кислота
Никотиновая кислота представляет собой витамин группы В, однако дозы, которые используются для коррекции липидных нарушений, намного превышают естественную потребность организма собственно в витамине. Никотиновая кислота выявляет положительное действие практически при всех нарушениях липидного обмена, за исключением дислипидемий I типа по Фридериксону (увеличение количества ХМ). Никотиновая кислота влияет на печеночный синтез и высвобождение ЛПОНП. Формация ЛПОНП — первая ступень в эндогенном липидном каскаде, снижение синтеза и высвобождение липопротеинов-предшественников приводит к снижению концентрации всех следующих липопротеинов. Механизм влияния никотиновой кислоты на липидный обмен может также быть связан с влиянием на рецепторы ЛПНП. Никотиновая кислота оказывает положительный эффект на содержание ХС ЛПВП. Повышение ХС ЛПВП наиболее значительное у лиц с исходно повышенным уровнем ТГ. В отличие от всех других гиполипидемических средств никотиновая кислота снижает концентрацию липопротеина (a). Терапия никотиновой кислотой также снижает концентрацию наиболее атерогенных мелких плотных частиц ЛПНП. Дозы никотиновой кислоты для обеспечения суточной витаминной потребности составляют 1–5 мг/сут. Доза 1 г/сут повышает уровень ХС ЛПВП. Для влияния на ХС ЛПНП необходимо 2–6 г никотиновой кислоты в сутки. Назначение никотиновой кислоты приводит к снижению ХС ЛПНП на 20–30%, ТГ — на 20–50%. Изменения ХС ЛПВП, зависимые от исходного уровня ТГ, составляют 15–35%. Использование никотиновой кислоты ограничивают побочные реакции. Наиболее часто отмечают гиперемию и зуд кожных покровов, гипотензию, обусловленные простагландин-зависимыми механизмами. Назначение более низких доз (50 мг/сут) никотиновой кислоты в начале лечения, постепенное их увеличение и комбинация с ацетилсалициловой кислотой, оказывающей противоположное, антипростагландиновое действие, помогают устранить или существенно уменьшить выраженность указанных реакций. Более важные побочные реакции никотиновой кислоты связаны с нарушением функции печени. Патологическое повышение печеночных трансаминаз отмечают приблизительно у 5% больных, получающих никотиновую кислоту в дозе 3 г/сут. Внезапное немотивированное «падение» уровня ХС может быть предвестником угрожающей тяжелой печеночной дисфункции. Это осложнение более часто отмечали при замене кристаллической никотиновой кислоты на формы пролонгированного действия. Терапия никотиновой кислотой может способствовать развитию периферической инсулинорезистентности. У 10% пациентов на фоне терапии выявляли нарушения углеводного обмена. Миопатия не является характерным осложнением для монотерапии никотиновой кислотой, однако риск ее развития возрастает при назначении комбинации с ингибиторами ГMГ-КoА-редуктазы и фибратами. Кроме перечисленных побочных реакций, никотиновая кислота может провоцировать гиперурикемию (у 5–10% больных), приступы подагрического артрита, гастроинтестинальные нарушения, тошноту, дискомфорт приблизительно у 20% пациентов (вплоть до развития пептической язвы).
Производные фиброевой кислоты (фибраты)
Фибраты очень многочисленны, однако наибольшее распространение получили клофибрат, гемфиброзил и фенофибрат. У фибратов сложный механизм действия, характеризующийся влиянием и на синтез, и на распад липидных частиц, обогащенных ТГ. Фибраты осуществляют триггерное влияние на α-рецепторы пролифератов пероксисом. Это подгруппа нуклеарных рецепторов, контролирующих разные клеточные функции, в частности липидный метаболизм, окисление жирных кислот, обмен глюкозы, адипогенез и клеточную дифференциацию. Активированные PPARα регулируют генную экспрессию синтеза апо-А1, транспортного протеина, принимают участие в апо-А1-зависимом процессе удаления ХС. Кроме того, РРАRα влияют на атерогенез на уровне сосудистой стенки. Фибраты повышают катаболизм липидных частиц, обогащенных ТГ за счет активации энзима протеинлипазы, что в свою очередь катализирует гидролиз ХМ и ЛПОНП. Влияние фибратов на обмен ЛПНП многогранный и функционально зависит от относительной активности ЛПНП-рецепторов и исходного уровня ТГ. У пациентов с гипертриглицеридемией часто возрастает концентрация атерогенных мелких плотных частиц ЛПНП. Фибраты уменьшают долю мелких плотных ЛПНП в пользу более крупных, с меньшей плотностью и поэтому потенциально менее атерогенных, обладающих большим сродством к клеточным рецепторам ЛПНП.
Фибраты, как правило, назначают в случаях дислипидемии с повышением ТГ и снижением ЛПВП. Терапия фибратами позволяет добиться снижения ТГ на 20–50%, что сопровождается повышением ЛПВП на 5–20%. Влияние на ЛПНП менее предвиденное, отмечено снижение концентрации ЛПНП на 10–20%. Фибраты также влияют на синтез фибриногена, плазменный активатор фибриногена, адреналин-индуцированную агрегацию тромбоцитов. Из побочных эффектов чаще всего отмечают гастроинтестинальные симптомы у 5% больных. Не исключена провоцирующая роль фибратов (в частности клофибрата) в развитии желчекаменной болезни. Нарушение функции печени и миопатия не характерны для монотерапии фибратами, но риск их развития повышается в случае комбинации с другими препаратами, особенно статинами. Фибраты потенцируют действие варфарина.
Последние сведения о гиполипидемическом влиянии фибратов получены после завершения большого международного многоцентрового плацебо-контролируемого исследования FIELD (2006), согласно которому в группе больных, принимающих фенофибрат в дозе 200 мг/сут, уровень общего ХС снизился на 11%, ХС ЛПНП — на 12%, ТГ — на 29%, а ХС ЛПВП возрос на 5%. Сложность сравнительной характеристики групп фенофибрата по сравнению с плацебо обусловлена разрешением принимать дополнительную гиполипидемическую терапию наряду с исследуемой, хотя потребность в липидоснижающих средствах в группе фенофибрата была достоверно ниже — 8% против 17% (р<0,0001) в течение 5 лет наблюдения. Также в группе плацебо чаще отмечено назначение ингибиторов АПФ, блокаторов β-адренорецепторов и диуретиков, что не могло не повлиять на конечные точки наблюдения. В результате в соответствии с выводами FIELD основные коронарные события в группе фенофибрата отмечали на 11% меньше, чем в группе плацебо, тем не менее эти результаты не были достоверными, хотя количество нефатальных инфарктов снизилось на 24% в группе фенофибрата (р<0,01) и на 21% уменьшилась потребность в коронарной реваскуляризации (р<0,05). Также преимуществами терапии фенофибратом было уменьшение прогрессирования альбуминурии (р<0,05) и случаев ретинопатии, требующей применения лазеротерапии (р<0,001).
Основной вывод исследования заключался в том, что хотя фенофибрат достоверно не снизил риск развития первичной конечной точки (основных коронарных событий), однако отмечено достоверное снижение развития нефатальных ИМ и необходимости в реваскуляризации у больных сахарным диабетом. Более частое назначение статинов больным, рандомизованным в группу плацебо, могло маскировать положительное влияние фенофибрата. Таким образом, сделан вывод о положительном влиянии фенофибрата на течение сахарного диабета II типа на ранних этапах заболевания без манифестации ИБС; фенофибрат применяют в качестве монотерапии, в комбинации со статинами, а также фенофибрат является альтернативой статинам при их непереносимости больными; способствует сокращению микрососудистых осложнений диабета; отмечена хорошая переносимость при назначении в комбинации со статинами.
Краткий анализ всех классов гиполипидемических средств представлен в табл. 2.11.
Таблица 2.11
Липидоснижающие препараты
| Классы препаратов, суточные дозы | Липидоснижающие эффекты | Побочные эффекты | Противопоказания | Результаты клинических исследований |
| Ингибиторы ГМГ-КоА-редуктазы (статины)* | ЛПОНП ↓ 18–55%ЛПВП ↑ 5–15%ТГ ↓ 7–30% |
Миопатия, увеличение печеночных ферментов | Абсолютные:
• острые и хронические заболевания печени, печеночная недостаточность, Относительные: • сопутствующее использование лекарственных препаратов |
Снижение основных коронарных событий, необходимости коронарного вмешательства, уменьшение инсультов и общей смертности |
| Секвестранты желчных кислот | ЛПНП ↓ 15–30%ЛПВП ↑ 3–5%ТГ — нет изменений или роста |
Желудочно-кишечные заболевания, запор, сниженная усвояемость других препаратов, особенно витаминов | Абсолютные:
Относительные:
|
Снижение основных коронарных событий |
| Никотиновая кислота | ЛПНП ↓ 5–25%ЛПВП ↑ 15–35%ТГ ↓ 20–50% |
Приливы, гипергликемия, гиперурикемия, подагра, гастрит, гепатит | Абсолютные:
Относительные:
|
Снижение основных коронарных событий и, вероятно, общей смертности |
| Фибраты | ЛПНП ↓ 5–20% (могут увеличиваться у пациентов с высокими ТГ)ЛПВП ↑ 10–20%ТГ ↓ 20–50% |
Диспепсия, желчекаменная болезнь, миопатия, повышенная неишемическая смертность в WHO-исследовании | Абсолютные:
|
Снижение основных коронарных событий |
*Ловастатин (20–80 мг), правастатин (20–40 мг), симвастатин (20–80 мг), флувастатин (20–80 мг), аторвастатин (10–80 мг).
Циклоспорин, макролидные антибиотики, разные противогрибковые средства и ингибиторы цитохрома P450 (фибраты и никотиновую кислоту следует применять с осторожностью).
Колестерамин (4–16 г), колестипол (5–20 г).
Никотиновая кислота короткого действия (кристаллическая) (1,5–3 г), никотиновая кислота пролонгированного действия (1–2 г).
Гемфиброзил (600 мг), фенофибрат (200 мг), клофибрат (1000 мг).
Целевые уровни гиполипидемической терапии
Целевыми уровнями общего ХС и фракций липопротеинов в плазме крови принято считать те уровни, достижение которых в результате липидоснижающих мероприятий (диета, повышение физической активности, медикаментозная терапия, в ряде случаев — плазмоферез) позволяет благоприятно влиять на клиническое течение заболевания и прогноз жизни больного.
Физиологические концентрации ХС ЛПНП, согласно рекомендациям Европейского общества кардиологов, находятся в диапазоне 1–2 ммоль/л (40–80 мг/дл), но есть ли клиническая необходимость в снижении ХС ЛПНП у пациентов до таких низких уровней? Этот вопрос продолжает оставаться предметом дискуссии. Анализ результатов исследований CARE (Cholesterol And Recurrent Events) и WOSCOPS (West Of Scotland Coronary Prevention Study) позволил предположить, что снижение уровня ХС ЛПНП <3 ммоль/л (115 мг/дл) не имеет клинического значения, в то время как исследования 4S и LIPID (Long-term Intervention with Pravastatin in Ischaemic Disease) продемонстрировали, что нет того уровня ХС ЛПНП, при котором дальнейшее его снижение будет нецелесообразным. В то же время исследования HPS продемонстрировали подобные результаты вследствие снижения ХС ЛПНП как в диапазоне от 3 до 2 ммоль/л, так и при снижении его от 4 до 3 ммоль/л, однако авторы высказывают предположение, что снижение ХС ЛПНП до 2 ммоль/л имеет определенные клинические преимущества. Это утверждение также подтверждается результатами исследования ASCO-LLA, в которых продемонстрированы клинические эффекты при снижении ХС ЛПНП от 3,4 ммоль/л до 1,2 ммоль/л. В исследовании HPS все пациенты получали умеренные дозы симвастатина (40 мг/сут) и было отмечено, что снижение уровня ХС ЛПНП приблизительно на 1 ммоль/л сопровождалось сравнимым положительным влиянием на риск развития ССЗ независимо от того, был ли уровень ХС ЛПНП 3, 4 или 5 ммоль/л в начале исследования. Согласно рекомендациям Европейского общества кардиологов, целевой уровень ХС плазмы в общей популяции должен быть <5 ммоль/л (190 мг/дл), а уровень ХС ЛПНП <3 ммоль/л (115 мг/дл). Для пациентов с клиническими проявлениями ССЗ и сахарным диабетом целевые уровни липидоснижающих мероприятий должны быть ниже: общий ХС <4,5 ммоль/л (175 мг/дл), при возможности <4,0 ммоль/л (155 мг/дл) и ХС ЛПНП <2,5 ммоль/л (100 мг/дл), при возможности <2,0 ммоль/л (80 мг/дл). Для ХС ЛПВП и ТГ целевые уровни не определены, но концентрации ХС ЛПВП и ТГ могут использоваться как маркеры повышенного риска ССЗ. Уровни ХС ЛПВП <1,0 ммоль/л (<40 мг/дл) у мужчин и <1,2 ммоль/л (46 мг/дл) у женщин, уровни ТГ, определенные натощак >1,7 ммоль/л (150 мг/дл), служат маркерами повышенного сердечно-сосудистого риска и должны учитываться при выборе медикаментозной терапии. У пациентов с бессимптомным течением заболевания при высоком многофакторном риске развития сердечно-сосудистой патологии, у которых уровни общего ХС и ХС ЛПНП близки к 5 и 3 ммоль/л, необходимо проводить дальнейшее снижение общего ХС до уровня <4,5 ммоль/л (175 мг/дл) и ХС ЛПНП до уровня <2,5 ммоль/л (100 мг/дл) умеренными дозами липидоснижающих препаратов.
У данной категории пациентов (схема 2.1), согласно Рекомендациям Европейского общества кардиологов по профилактике ССЗ (2003), первым шагом должна быть оценка общего сердечно-сосудистого риска и идентификация факторов риска, которые необходимо устранить. Если у пациента 10-летний риск сердечно-сосудистой смерти <5% и не будет превышать 5% при проекции сочетания факторов риска на 60-летний возраст, пациенту необходимо дать рекомендации по соблюдению сбалансированной диеты, расширению физической активности и прекращению курения с целью сохранения сердечно-сосудистого риска на низком уровне. Оценка риска должна быть повторена через 5 лет. Следует обратить внимание, что подобная оценка общего риска не подходит пациентам с семейной гиперхолестеринемией, так как начиная с величины общего ХС >8 ммоль/л (320 мг/дл) и ХС ЛПНП >6 ммоль/л (240 мг/дл) пациентов следует отнести к категории высокого общего риска ССЗ.
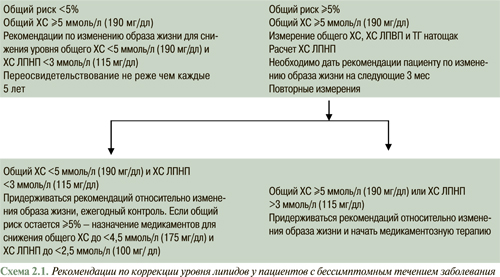
В случае, если 10-летний риск сердечно-сосудистой смерти >5% или может быть >5% при проектировании сочетания факторов риска на 60-летний возраст, необходимо провести анализ липопротеинов плазмы крови и дать рекомендации по модификации образа жизни, особенно относительно диетотерапии. Оценку риска общей сердечно-сосудистой смертности следует проводить с использованием шкалы SCORE. Для оценки риска необходимо учитывать первичный уровень общего ХС (или соотношение общего ХС к ХС ЛПВП). Если через 3 мес уровни общего ХС и ХС ЛПНП будут <5 ммоль/л (190 мг/дл) и 3 ммоль/л (115 мг/дл) соответственно, сердечно-сосудистый риск составит <5%, таким пациентам следует ежегодно проходить повторное обследование для подтверждения низкого уровня сердечно-сосудистого риска.
При сохранении сердечно-сосудистого риска >5% следует применять липидоснижающую терапию для снижения уровня общего ХС и ХС ЛПНП. Целевые уровни у таких пациентов составляют для общего ХС <4,5 ммоль/л (175 мг/дл) и ХС ЛПНП <2,5 ммоль/л (100 мг/дл). Необходимо вспомнить, что вначале клинические исследования, документировавшие клиническое улучшение в результате использования липидоснижающей терапии статинами, были ограничены, — в них участвовали пациенты в возрасте <70 лет и при уровне общего ХС >5 ммоль/л. Последние разработки продемонстрировали, что данная терапия может также быть эффективной и в более пожилом возрасте, а также у лиц с более низким уровнем ХС.
Следует также упомянуть о пациентах с семейной гиперхолестеринемией или другими серьезными, генетически обусловленными нарушениями метаболизма липидов. В этом случае снижение ХС ЛПНП даже ниже уровня 3 ммоль/л (115 мг/дл) с присоединением комбинированной липидоснижающей терапии с двойным или тройным режимом препаратов является трудновыполнимой задачей и врач должен подготовить пациента к этой ситуации. Исследования с применением статинов показали, что уменьшение общего ХС по крайней мере на 20% и ХС ЛПНП на 30% сопровождается выраженным клиническим эффектом.
Метаболический синдром как вторичная цель терапии (результат, не зависящий от липидоснижающей терапии)
Существуют доказательства того, что риск ИБС может быть снижен без липидоснижающей терапии модификацией других факторов риска. Одна из потенциальных вторичных целей терапии — устранение метаболического синдрома, представляющего собой сочетание липидных и нелипидных факторов риска метаболического происхождения. Этот синдром тесно связан с генерализованным метаболическим нарушением, названным инсулинорезистентностью. Дополнительный висцеральный жир (особенно при абдоминальном типе ожирения) и низкая физическая активность способствуют развитию инсулинорезистентности, которая у некоторых лиц может быть наследственно детерминированной.
Факторы риска формирования метаболического синдрома способны взаимно потенцироваться; в сочетании повышают риск ИБС независимо от уровня ХС ЛПНП. Диагноз метаболического синдрома устанавливают при наличии 3 и более факторов риска, приведенных в табл. 2.12, которые можно легко определить в клинической практике.
Таблица 2.12
Определение метаболического синдрома
| Фактор риска | Определяющий уровень | |
| АТР-III, 2001 | IDF, 2005 | |
| Абдоминальное ожирение*
Мужчины Женщины |
Окружность талии | |
| >102 см
>88 см |
>94 см
>80 см |
|
| ТГ | >1,7 ммоль/л (150 мг/дл) | >1,7 ммоль/л (150 мг/дл) |
| ХС ЛПВП
Мужчины Женщины |
<1,0 ммоль/л (40 мг/дл)
<1,3 ммоль/л (50 мг/дл) |
<1,0 ммоль/л (40 мг/дл)
<1,3 ммоль/л (50 мг/дл) |
| АД | >130/85 мм рт. ст. | >130/85 мм рт. ст. |
| Уровень глюкозы натощак | >6,1 ммоль/л (110 мг/дл) | >5,6 ммоль/л (100 мг/дл) |
Избыточная масса тела и ожирение тесно связаны с инсулинорезистентностью и метаболическим синдромом. Однако выявление именно абдоминального ожирения более тесно коррелировало с выраженностью других компонентов метаболического синдрома, чем повышение индекса массы тела. Поэтому простое измерение окружности талии рекомендуется для выявления абдоминального типа ожирения как компонента метаболического синдрома.
*Уровни ХС ЛПВП, которые были ниже согласно IDF (2005), в 2006 г. адаптированы в соответствии с АТР-Ш (2001).
Лечение метаболического синдрома осуществляется 2 путями: 1 — уменьшением основных причин (ожирение и низкая физическая активность) и 2 — устранением сочетающихся липидных и нелипидных факторов риска. Следует отметить, что в последнее время концепция метаболического синдрома привлекает повышенное внимание кардиологов, эндокринологов и других специалистов в связи с чрезвычайно прогрессирующим характером распространения ожирения, сахарного диабета и проявлений всего кластера сопредельных факторов риска. До 2005 г. метаболический синдром верифицировался в соответствии с критериями, изложенными в 2001 г. в документах программы АТР-III. Однако с целью унификации всех подходов диагностики метаболического синдрома в 2005 г. введены новые критерии метаболического синдрома в соответствии с консенсусом Международной противодиабетической ассоциации (IDF).
Существенным отличием последних было утверждение абдоминального ожирения в качестве основного критерия и уменьшение нормативных критериев окружности талии (<94 см для мужчин и <80 см для женщин), гипергликемии натощак (>5,6 ммоль/л). При этом еще раз было подчеркнуто, что макрососудистые осложнения (ИМ, инсульт) являются основной причиной смерти больных с метаболическим синдромом и сахарным диабетом. Диагноз метаболического синдрома в соответствии с IDF (2005) устанавливается при наличии абдоминального ожирения как основного критерия и двух любых критериев из нижеперечисленных.
Устранение основных причин метаболического синдрома
Первичные меры по устранению всех липидных и нелипидных факторов риска, связанных с метаболическим синдромом — это уменьшение массы тела и повышение физической активности.
Снижение массы тела. Избыточная масса и ожирение признаны основными факторами риска ИБС при метаболическом синдроме и являются основной точкой приложения терапевтических вмешательств. Снижение массы способствует снижению ХС ЛПНП и уменьшает выраженность других компонентов метаболического синдрома.
Физическая активность. Низкая физическая активность — также один из главных факторов риска ИБС при метаболическом синдроме. Потенцирует выраженность липидных и нелипидных факторов риска. В противовес этому рациональное повышение физической активности снижает уровни ХС ЛПОНП, повышает ХС ЛПВП, а у некоторых лиц снижает уровни ХС ЛПНП. Это сочетается со снижением АД, уменьшением инсулинорезистентности и благоприятно влияет на всю сердечно-сосудистую систему.
Устранение других факторов риска при метаболическом синдроме, то есть нормализацию повышенного АД, лечение дислипидемий и выявленных нарушений углеводного обмена, необходимо проводить в соответствии с принятыми Рекомендациями Европейского и Украинского обществ кардиологов.
СПЕЦИАЛЬНЫЕ РАЗДЕЛЫ
Лечение специфических дислипидемий
Очень высокий ХС ЛПНП (>190 мг/дл). Лица с очень высоким ХС ЛПНП обычно имеют генетически детерминированные формы гиперхолестеринемии: моногенную семейную гиперхолестеринемию, семейный дефект аполипопротеина B и полигенную гиперхолестеринемию. Раннее выявление этих нарушений у лиц молодого возраста необходимо с целью предотвращения преждевременного развития ИБС. В этом случае для идентификации состояния очень важным является обследование близких (кровных) родственников. Стандартная липидоснижающая терапия может быть недостаточной, и нередко появляется необходимость комбинированной терапии, как, например, соединение статинов и секвестрантов желчных кислот для достижения целевых уровней ХС ЛПНП.
Повышенный уровень сывороточных ТГ. Результаты метаанализа проспективных исследований продемонстировали, что повышение уровня ТГ является независимым фактором риска ИБС. Факторы, способствующие повышению уровня ТГ в организме, включают ожирение и избыточную массу тела, низкую физическую активность, курение, злоупотребление алкоголем, гиперуглеводную диету (>60% суточного калоража). Аналогичный эффект оказывает сочетание у пациента нескольких заболеваний (например, сахарного диабета II типа, ХПН, нефротического синдрома), влияние некоторых препаратов (например, ГКС и высоких доз блокаторов β-адренергических рецепторов) и генетические нарушения (семейная комбинированная гиперлипидемия, семейная гипертриглицеридемия и семейная дислипопротеинемия).
В реальной клинической практике, повышение уровня сывороточных ТГ наиболее часто отмечают у лиц с метаболическим синдромом, хотя вторичные или генетические факторы также оказывают влияние. Содержание сывороточных ТГ классифицируется:
- нормальный уровень ТГ — <150 мг/дл;
- предельно повышенный уровень ТГ — 150–199 мг/дл;
- высокий уровень ТГ — 200–499 мг/дл;
- очень высокий уровень ТГ — >500 мг/дл.
При выделении гипертриглицеридемии как независимого фактора риска ИБС принимается во внимании наличие высокой атерогенности липопротеинов, обогащенных ТГ. Последние частично представлены ремнантами (остатками) липопротеинов, образующихся вследствие распада ЛПОНП. В клинической практике ЛПОНП — наиболее доступные для измерения атерогенных ремнантов липопротеины, которые являются мишенью для липидоснижающей терапии. В настоящее время идентифицируют сумму ХС ЛПНП + ЛПОНП, так называемый ХС липопротеинов невысокой плотности — ХС не-ЛПВП (определяется как результат вычитания: общий ХС — ХС ЛПВП) как вторичную цель терапии для лиц с высоким уровнем ТГ (>200 мг/дл). Целевой уровень ХС не-ЛПВП у лиц с высоким сывороточным уровнем ТГ установлен на 30 мг/дл выше, чем ХС ЛПНП, учитывая, что уровень ХС ЛПОНП <30 мг/дл является нормальным.
Стратегия лечения для лиц с повышенным уровнем ТГ зависит от этиологических причин и степени их повышения. Для лиц с гипертриглицеридемией первичной целью терапии является достижение целевого уровня ХС ЛПНП. Если уровень ТГ погранично высокий (150–199 мг/дл), акцент терапевтических мероприятий следует сделать на уменьшении массы тела и повышении физической активности. Для лиц с высоким уровнем ТГ (200–499 мг/дл) вторичной целью терапии является ХС не-ЛПВП. Для достижения целевых уровней ХС не-ЛПВП, наряду со снижением массы и повышением физической активности, необходимо назначать липидоснижающую терапию, включающую 2 этапа. Вначале терапия должна быть направлена на достижение целевого уровня ХС не-ЛПВП за счет увеличения доз липидоснижающей терапии, а затем назначают никотиновую кислоту или фибраты для достижения целевого уровня ХС не-ЛПВП и дальнейшего снижения уровня ХС ЛПОНП. В редких случаях очень высокого уровня ТГ (>500 мг/дл) в первую очередь необходимо исключить наличие острого панкреатита. Следует назначить диету с низким содержанием жиров (<15% потребляемых калорий) и лекарственные препараты, способствующие снижению уровня ТГ (фибраты или никотиновая кислота). Только после снижения уровня ТГ <500 мг/дл необходимо приступить к снижению ХС ЛПНП с целью снижения риска ИБС.
Низкий уровень ХС ЛПВП. Согласно результатам последних исследований низкий уровень ХС ЛПВП является самостоятельным предиктором ИБС и определяется как уровень <40 мг/дл, что предъявляет более серьезные требования к терапии по сравнению с принятым ранее уровнем <35 мг/дл. Низкий уровень ХС ЛПВП меняет целевой уровень ХС ЛПНП при проведении липидоснижающей терапии и используется как фактор риска при оценке 10-летнего риска ИБС.
Снижение уровня ХС ЛПВП может быть обусловлено рядом причин, связанных с инсулинорезистентностью и метаболическим синдромом (ожирение, низкая физическая активность, высокий уровень ТГ и сахарный диабет II типа). Другие причины — курение, высокое потребление углеводов (>60% суточного калоража) и прием некоторых лекарственных препаратов (блокаторы β-адренорецепторов, анаболические стероиды, гестагены).
Несмотря на то что результаты клинических исследований дают основание ожидать от повышения уровня ХС-ЛПВП соответствующего снижения степени риска ИБС, специальный целевой уровень для ХС ЛПВП не определен. Кроме того, в данное время нет фармакологических препаратов, способных существенным образом повысить уровень ХС ЛПВП. Тем не менее низкий уровень ХС ЛПВП следует учитывать при выборе лечебной тактики.
У всех лиц с низким ХС ЛПВП первичная задача терапии — снижение уровня ХС ЛПНП. После достижения целевого уровня ХС ЛПНП необходимо принятие мер по снижению массы тела и повышению физической активности (при наличии метаболического синдрома). Если низкий ХС ЛПВП сочетается с высоким уровнем ТГ (200–499 мг/дл), необходима липидоснижающая терапия для достижения целевого уровня ХС не-ЛПВП, как указано выше. При уровне ТГ <200 мг/дл (изолированном низком уровне ХС ЛПВП) назначают фибраты или никотиновую кислоту; однако лечение при таких нарушениях сывороточных липопротеинов в основном показано пациентам с ИБС и эквивалентами риска ИБС.
Диабетическая дислипидемия. Это нарушение идентифицируют как высокоатерогенную дислипидемию (повышение уровня ТГ и содержания «маленьких плотных» ЛПНП и низкий уровень ХС ЛПВП) у лиц с сахарным диабетом II типа. Несмотря на повышение уровня ТГ и/или снижение уровня ХС и ХС ЛПВП у данного контингента больных, первичной целью липидоснижающей терапии является снижение уровня ХС ЛПНП так же, как и у лиц без диабета. Поскольку диабет определен как эквивалент риска ИБС, целевой уровень ХС ЛПНП для лиц с сахарным диабетом <100 мг/дл. Поэтому при уровне ХС ЛПНП ≥130 мг/дл пациентам с сахарным диабетом необходимо проводить липидоснижающую терапию одновременно с модификацией образа жизни. Если уровни ХС ЛПНП находятся в диапазоне 100—129 мг/дл, возможны 2 терапевтических подхода: использование комбинированной липидоснижающей терапии с добавлением фибратов или никотиновой кислоты или же модификация других факторов риска, включая гипергликемию. Если уровни ТГ ≥200 мг/дл, ХС не-ЛПВП становятся вторичной целью липидоснижающей терапии. Ряд последних многоцентровых клинических исследований (например, исследование влияния антигипертензивной и липидоснижающей терапии на частоту сердечных приступов [ALLHAT]) достоверно установил преимущества липидоснижающей терапии у лиц с сахарным диабетом старших возрастных групп. У лиц пожилого возраста с сахарным диабетом (≥65 лет) без дополнительных факторов риска ИБС необходима более тщательная оценка клинического статуса, включая наличие сопутствующих заболеваний, что поможет определить необходимую тактику лечения.
СПЕЦИАЛЬНЫЕ РЕКОМЕНДАЦИИ ДЛЯ РАЗЛИЧНЫХ ГРУПП НАСЕЛЕНИЯ
Мужчины среднего возраста (35–65 лет). В целом, у мужчин более высокий риск ИБС чем у женщин. В указанной возрастной группе мужчин более высокая распространенность основных факторов риска ИБС, склонность к абдоминальному ожирению и метаболическому синдрому. Поэтому потребность в интенсивной липидоснижающей терапии у мужчин средней возрастной группы чрезвычайно высока.
Женщины (45–75 лет). У женщин ИБС манифестирует приблизительно на 10–15 лет позже по сравнению с мужчинами и большинство случаев ИБС диагностируется после 65 лет. В женской популяции существуют все факторы риска, но раннее (в возрасте до 65 лет) развитие ИБС отмечено только у женщин с множественными факторами риска и метаболическим синдромом.
В то же время, несмотря на ожидаемый защитный эффект терапии эстрогенами, нет убедительных данных о положительном эффекте применения заместительной гормональной терапии для снижения риска ИБС у женщин в постменопаузальный период. Напротив, отмечен положительный эффект терапии статинами у женщин данной возрастной группы.
Старшие возрастные группы (мужчины ≥65 лет и женщины ≥75 лет). У людей пожилого возраста (≥65 лет) очень высок риск развития основных коронарных событий. Высокий уровень ХС ЛПНП и низкий уровень ХС ЛПВП являются факторами риска ИБС в старших возрастных группах. Результаты исследования большого контингента больных в возрастном диапазоне 65–75 лет по вторичной профилактике показали значительное сокращение риска ИБС вследствие проведения терапии статинами. Следовательно, не существует возрастных ограничений для пациентов с диагностированной ИБС при назначении липидоснижающей терапии. С целью первичной профилактики для старших возрастных групп рекомендуется модификация образа жизни.
Взрослые молодого возраста (мужчины 20–35 лет; женщины 20–45 лет). В данном возрастном контингенте ИБС отмечают довольно редко, за исключением случаев с тяжелыми факторами риска, например семейной гиперхолестеринемией, выкуриванием большого количества сигарет, декомпенсированным сахарным диабетом. Исследования, посвященные отдаленному прогнозу, продемонстрировали, что увеличение сывороточного ХС в молодом возрасте определяет более высокую степень риска ИБС по достижении среднего возраста. Таким образом, идентификация факторов риска в молодом возрасте — важная цель отдаленной профилактики. В данной возрастной группе раннее выявление ХС ЛПНП ≥130 мг/дл в сочетании со здоровым образом жизни способно предупредить развитие ИБС. Особое внимание следует уделять молодым людям, которые курят, с высоким уровнем ХС ЛПНП (160–189 мг/дл), если же определяются очень высокие уровни ХС ЛПНП (≥190 мг/дл), липидоснижающую терапию необходимо назначать так же, как и в старших возрастных группах. В случаях тяжелых генетических форм гиперхолестеринемии следует назначать комбинированную липидоснижающую терапию (например статины + секвестранты желчных кислот).
ПРИЛОЖЕНИЕ 1
Стандарты лечения больных с дислипидемией
Лечебная программа
Перечень и объем обязательных медицинских мероприятий ассортимента
Больные с дислипидемиями должны получать комплексное лечение:
1. Немедикаментозная терапия (диета, коррекция массы тела, повышение физической активности, прекращение курения) для достижения оптимальных характеристик липидного профиля.
2. Медикаментозное лечение согласно разным вариантам дислипидемий:
а) Гиперхолестеринемия — статины.
б) Комбинированная дислипидемия — статины, некоторым пациентам можно рекомендовать комбинацию статинов и фибратов.
в) Гипертриглицеридемия — фибраты и/или статины.
3. У пациентов с бессимптомным течением: если путем модификации образа жизни на протяжении 8–12 нед не удается достичь необходимого эффекта, начать медикаментозную гиполипидемическую терапию в соответствии с вариантом дислипидемии (статины и/или фибраты).
4. У больных с диагностированной ИБС или ее эквивалентами терапию статинами необходимо начать одновременно с мероприятиями по немедикаментозной профилактике.
5. Контролировать показатели липидного обмена, печеночные и мышечные ферменты: АлАТ, АсАТ, КФК 1 раз в 3 мес.
Перечень и объем дополнительных медицинских мероприятий:
1. При сопутствующей АГ — антигипертензивная терапия.
2. При сопутствующем сахарном диабете — сахароснижающая терапия.
3. При тяжелых формах семейных дислипидемий возможна коррекция липидного профиля методом плазмофереза.
Характеристика конечного ожидаемого результата лечения
1. Достижение целевых уровней ХС и
ХС ЛПНП:
- для общей популяции целевой уровень ХС плазмы должен быть <5,0 ммоль/л (190 мг/дл), а уровень ХС ЛПНП — <3 ммоль/л (115 мг/дл);
- для пациентов с ИБС, ее эквивалентами и пациентов с сахарным диабетом целевой уровень ХС должен быть <4,5 ммоль/л (175 мг/дл), при возможности <4,0 ммоль/л (155 мг/дл), а уровень ХС ЛПНП — <2,5 ммоль/л (100 мг/дл), при возможности <2,0 ммоль/л (80 мг/дл).
2. Для пациентов с семейной гиперхолестеринемией или другими генетическими нарушениями метаболизма липидов, при невозможности снижения ХС ЛПНП ниже уровня 3 ммоль/л (115 мг/дл) с привлечением комбинированной липидоснижающей терапии, с двойными или тройными режимами препаратов необходимо стараться снизить уровни общего ХС не менее чем на 20% и ХС ЛПНП на 30%, что должно сопровождаться выраженным клиническим эффектом.
Продолжительность лечения
Больные нуждаются в пожизненном немедикаментозном и медикаментозном лечении.
Критерии качества лечения
У подавляющего большинства пациентов с дислипидемиями критерием качества является достижение целевых уровней ХС и ХС ЛПВП.
У больных с семейной гиперхолестеринемией или другими генетическими нарушениями метаболизма липидов снижение уровня общего ХС на 20% и ХС ЛПНП на 30% является критерием достижения выраженного клинического эффекта.
Вероятные побочные действия и осложнения
Возможно появление побочных эффектов согласно фармакологическим свойствам липидоснижающих препаратов (статинов, фибратов): повышение уровня трансаминаз (АлАТ, АсАТ более чем в 3 раза) и КФК (более чем в 10 раз). При подозрении на развитие побочных реакций — отмена липидоснижающих препаратов.
Рекомендации относительно дальнейшего предоставления медицинской помощи
Больные должны находиться на диспансерном наблюдении по месту жительства. Контролировать параметры липидного обмена, уровень печеночных и мышечных ферментов: АлАТ, АсАТ, КФК с частотой 1 раз в 3 мес на протяжении первого года. В дальнейшем следует проводить ежегодное обязательное обследование, а по его результатам — коррекцию терапии не реже чем 1 раз в год.
Требования к диетическим назначениям и ограничениям
Больные с дислипидемиями должны придерживаться низкокалорийной диеты, общее потребление жира не должно превышать 30% потребляемой энергии, часть насыщенных жиров не должна превышать треть от общего потребления жира. Потребление ХС должно быть <300 мг/сут. Рекомендуется диета, обогащенная пищевыми волокнами. Насыщенные жиры могут частично быть заменены сложными углеводами и омега-3-полиненасыщенными жирными кислотами морепродуктов.
Для больных с АГ и лиц с избыточной массой тела рекомендуется дополнительно снизить потребление соли до 5 г/сут и меньше; ограничить прием алкоголя.
Требования к режиму работы, отдыха, реабилитации
Необходима дозированная физическая нагрузка согласно рекомендациям врача после получения результатов нагрузочных тестов.
ПРИЛОЖЕНИЕ 2
Рекомендованы следующие целевые уровни ХС:
- Пациентам с ИБС или эквивалентами риска ИБС: ХС <4,5 ммоль/л (175 мг/дл) и для ХС ЛПНП <2,5 ммоль/л (100 мг/дл).
- Для общей популяции целевой уровень ХС плазмы должен быть <5 ммоль/л (190 мг/дл), а уровень ХС ЛПНП — <3 ммоль/л (115 мг/дл).
Для разных вариантов дислипидемий рекомендуется следующая терапия:
- Гиперлипидемия IIA типа (высокий уровень ХС ЛПНП) — статины.
- Гиперлипидемия IV типа (высокий уровень ТГ) — фибраты.
- Гиперлипидемия IIB типа (высокий уровень ХС ЛПНП и ТГ) — статины, если высокий уровень ХС ЛПНП является преобладающим нарушением, и фибраты, если преобладает высокий уровень ТГ. Некоторым пациентам можно рекомендовать комбинацию статинов и фибратов.
Формулы перерасчета:
Общий ХС, ЛПНП и ЛПВП в ммоль/л x 38,7 = мг/дл
ТГ в ммоль/л x 88,6 = мг/дл
ПРИЛОЖЕНИЕ 3
Диетические рекомендации Европейского общества кардиологов и Европейского общества атеросклероза.
Общие принципы:
- доля всех жиров в общей энергетической ценности пищи должна составлять 30% и меньше;
- доля животных (насыщенных) жиров должна составлять не более ⅓ общего количества потребляемого жира;
- ограничение суточного потребления ХС — <300 мг;
- увеличение потребления моно- и полиненасыщенных жиров из овощей и морской рыбы;
- увеличение потребления углеводов, содержащихся в свежих фруктах, злаках и овощах.
Рекомендуемые продукты
| Злаки | Хлеб грубого помола, овсяная каша, хлопья разных злаков, макаронные изделия из цельных зерен и коричневый (неочищенный) рис, подсушенный хлеб |
| Молочные продукты | Обезжиренные молоко, йогурт, сыр |
| Супы | Овощные, консоме |
| Рыба | Вареная, копченая, жареная без кожи |
| Морепродукты | Устрицы, гребешки |
| Мясо и другие продукты | Индейка, куры, телятина, дичь, кролик, молодая баранина. 1—2 раза в неделю постная говядина, бекон, свинина. Яичный белок |
| Жиры | Полиненасыщенные масла: подсолнечное, кукурузное, масло сафлора и грецкого ореха. Мононенасыщенные масла: маслиновое, рапсовое. «Мягкие» (негидрогенизированные) сорта маргарина, содержащие много моно- или полиненасыщенных жиров |
| Фрукты и овощи | Все свежие и замороженные овощи, особенно бобовые: свежие и высушенные бобы, фасоль, чечевица, нут (турецкий горох), сахарная кукуруза, вареный картофель, в том числе в мундире. Все свежие или сушеные фрукты, консервированные фрукты без сахара |
| Десерты | Фруктовое мороженое, желе, пудинги на «снятом» молоке, фруктовые салаты, гоголь-моголь |
| Выпечка | |
| Кондитерские
изделия |
Лукум, нуга, карамельные конфеты |
| Орехи | Грецкие, миндаль, каштан |
| Напитки | Чай, фильтрованный или растворимый кофе, низкокалорийные безалкогольные напитки |
| Приправы | Перец, горчица, пряные травы, специи |
Продукты ограниченного употребления
| Злаки | Макаронные изделия из белой муки и белый (шлифованный) рис |
| Молочные продукты | Частично обезжиренное молоко, обезжиренные и нежирные сорта сыра (камамбер, эдам, фета, ricotta), нежирный йогурт. 2 яйца в неделю |
| Супы | Все, не вошедшие в две первые категории |
| Рыба | Жаренная на рекомендуемом масле |
| Морепродукты | Мидии, омары, креветки разных видов, кальмары |
| Мясо и другие продукты | Гуси, утки, любое мясо с видимым включением жира, сосиски, салями, мясные пироги, паштеты, кожа домашней птицы. 2 яйца в неделю |
| Жиры | Жаренный или картофель фри, приготовленные с применением рекомендованных жиров |
| Фрукты и овощи | |
| Десерты | |
| Выпечка | Песочные и бисквитные пирожные, приготовленные на ненасыщенных маргаринах и жирах |
| Кондитерские
изделия |
Марципан, халва |
| Орехи | Бразильский, кешью, арахис, фисташки |
| Напитки | Алкогольные напитки, нежирные напитки с какао |
| Приправы | Салатные соусы с низким содержанием жира |
Продукты, которые употреблять нежелательно
| Злаки | Круасан, булочки |
| Молочные
продукты |
Цельное молоко, сгущенное молоко, сливки, искусственное молоко, жирные сыры, жирный йогурт |
| Супы | Супы с большим содержанием жира, кремы-супы |
| Рыба | Икра, жаренная рыба на жире, который не рекомендуется |
| Морепродукты | |
| Мясо и другие продукты | |
| Жиры | Сливочное масло, шпик, сало, топленый жир, пальмовое масло, твердые маргарины, гидрогенизированные жиры |
| Фрукты и овощи | Жареный картофель или картофель-фри, овощи и рис, приготовленные на масле или жире, который не рекомендуется |
| Десерты | Сливочное мороженое, пудинги или пирожки, приготовленные с маслом или сливками |
| Выпечка | Коммерческие песочные пирожные, бисквиты, пироги, пудинги и т.д. |
| Кондитерские
изделия |
Шоколад, ирис, сливочная помадка, кокосовые палочки |
| Орехи | Кокосовый орех, соленые орехи |
| Напитки | Шоколадные напитки, ирландский кофе, солодовые напитки, заваренный кофе, безалкогольные напитки |
| Приправы | Добавление соли, салатных соусов, майонеза и т.п. |
ЛИТЕРАТУРА
- Дисліпідемії: діагностика, профілактика та лікування (2007) Методичні рекомендації Робочої групи з проблем атеросклерозу та хронічних форм ІХС та Робочої групи з проблем метаболічного синдрому, діабету та серцево-судинних захворювань Українського наукового товариства кардіологів. Київ, 56 с.
- Карпов Ю.А., Сорокин Э.В. (2001) Атеросклероз и факторы воспаления: нелипидные механизмы действия статинов. РМЖ, 9(10): 5-9.
- Карпов Ю.А., Сорокин Э.В. (2002) Профилактика инсульта — новая область применения статинов. РМЖ, 10(1): 12-15.
- Климов Н.А., Никульчева Н.Г. (1995) Липиды, липопротеиды и атеросклероз. Питер, Санкт-Петербург, 89-199.
- Лутай М.И. (2003) К вопросу о клинической классификации дислипопротеинемий. Укр. кардіол. журн., 4: 9-16.
- Лякишев А.А. (2003) Клиническое применение статинов. РМЖ, 11(4): 193-196.
- Митченко Э.И. (2004) Дислипидемия как фактор развития сердечно-сосудистых заболеваний. Укр. кардіол. журн., додаток 1: 28-39.
- Сусеков А.В., Поваренок В.В. (2001) Дериваты фиброевой кислоты. Кардиология, 7: 60-65.
- Шевченко О.П., Шевченко А.О. (2003) Статины. Ингибиторы ГМГ-КоА-редуктазы. Реафарм, Москва, 67 с.
- AHA Guidelines for Preventing Heart Attack and Death in Patients With Atherosclerotic Cardiovascular Disease: 2001 Update (2001) Circulation,104: 1577-1579.
- Beisiegel U. (1998) Lipoprotein metabolism. Eur. Heart J., 19 (Suppl A): A20-A23.
- Brewer H.B. (1999) Hypertriglyceridemia: changes in the plasma lipoproteins, associated with an increased risk of cardiovascular disease. Am. J. Cardiol., 83: 3-12.
- European guidelines on cardiovascular disease prevention in clinical practice (2003) Eur. Heart J., 24: 1601-1610.
- Grundy S. (1999) Hypertriglyceridemia, insulin resistance and the metabolic syndrome. Am. J. Cardiol., 83: 25F-29F.
- Guidelines on management of stable angina pectoris: Executive summary (2006)Eur. Heart J., 27: 1341-1381.
- Jeppesen J., Hein H.O., Suadicany P. et al. (1998) Triglycerides concentration and ischaemic heart disease: an eight-year follow-up in the Copenhagen Male Study. Circulation, 97: 1029-1036.
- Long-term Intervention with Pravastatin in Ischaemic Disease (LIPID) Study Group. Prevention of cardiovascular events and death with pravastatin in patients with coronary heart disease and a broad range of initial cholesterol levels (1998) N. Engl. J. Med., 339: 1349-1357.
- Mahley RW, Huang Y. (1999) Apolipoprotein E: from atherosclerosis to Alzheimer’s disease. Curr. Opin. Lipidol., 10: 207-217.
- Nissen S.E., for the REVERSAL Investigators. Comparison of Intensive Versus Moderate Lipid Lowering on the Progression of Coronary Atherosclerosis Measured by Intravascular Ultrasound: A Randomized Controlled Trial (abstract) (2003) Circulation, 108: 2723.
- Reaven G.M., Chen Y.-D.L., Jeppesen J. et al. (1993) Insulin resistance and hypertriglyceridemia in an individuals with small, dense low density lipoprotin particles. J. Clin. Invest., 92: 141.
- Scandinavian Simvaststin Survival Study Group. Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastastin Survival Study (4S) (1994) Lancet, 344: 1383-1389.
- Sever P.S., Dahlof B., Poulter N.R., et al. (2003) Prevention of coronary and stroke events with atorvastatin in hypertensive patients who have average or lower-than-average cholesterol concentrations, in the Anglo-Scandinavian Cardiac Outcomes Trial-Lipid Lowering Arm (ASCOT-LLA): a multicentre randomised controlled trial. The Lancet, 361: 1149-1158.
- The ILIB Lipid Handbook for clinician Practice: Dyslipidemia and Coronary Heart Disease. 3rd edition (2003) International Lipid Information Bureau, New York: 242.
- Third report of the National Cholesterol Education Program (NCEP) expert panel on detection, evaluation, and treatment of high blood cholesterol in adults (Adult Treatment Panel III). Final Report (2002) Circulation, 106: 3143-3421.
- Thompson G.R. (1995) Angiographic trials of lipid-lowering therapy: end of an era? Br. Heart J., 74: 343-347.
- Thompson G.R., Maher V.G.M., Matthews S. et al. (1995) Familial Hypercholesterolaemial Regression Study: a randomized trial of low-density lipoprotein apheresis. Lancet, 345: 811-816.
- Thompson G.R. (1999) The proving of the lipid hypothesis. Curr. Opin. in Lipidol. 10th Anniversary issue, 10(3): 201-205.
- Waters D., Higginson L., Gladstone P., et al. (1994) Effects of monotherapy with an HMG-CoA-reductase inhibitor on the progression of coronary atherosclerosis as assessed by serial quantitative arteriography. The Canadian Coronary Atherosclerosis Interventional Trial. Circulation, 89(3): 959-968.