Перикардит — инфекционное или неинфекционное воспаление висцерального и париетального листков перикарда, проявляющееся фиброзными изменениями и/или накоплением жидкости в полости перикарда.
Эпидемиология
В клинике перикардит диагностируют достаточно редко — в 0,1% случаев, его частота по данным аутопсии составляет 3–6%. Мужчины заболевают в 1,5 раза чаще, чем женщины.
Этиология
Перикардит чаще всего возникает как проявление или осложнение общего инфекционного заболевания, пневмонии, ИБС, некоронарогенных болезней сердца, системных заболеваний соединительной ткани, аллергической реакции, опухолевого или аутоиммунного процесса.
Этиологическими факторами острого перикардита могут являться:
- инфекции;
- вирусы (30–50%): Коксаки, ECHO, Эпштейна — Барр, эпидемического паротита, ветряной оспы, краснухи, иммунодефицита человека, цитомегаловирус, парвовирус В19;
- бактерии (5–10%): пневмококк, стафилококк, менингококк, трепонема, боррелия, хламидия, микобактерии туберкулеза;
- грибы: кандида, гистоплазма;
- паразиты: амеба, эхинококк;
- острый ИМ (эпистенокардитический перикардит) (5–20%);
- миокардит (30%);
- метаболические нарушения: уремия, почечная недостаточность, микседема (30%), холестериновый перикардит;
- новообразования;
- травмы: при прямом или непрямом повреждении перикарда;
- системные аутоиммунные заболевания: острая ревматическая лихорадка (20–50%); коллагенозы: ревматоидный артрит (30%), склеродермия (>50%), системная красная волчанка (30%);
- аутоиммунные процессы (повреждения): постинфарктный синдром Дресслера (1–5%), постперикардиотомный синдром (через 10–14 сут после операции) (<20%), перфорация катетером;
- идиопатический (вирусная этиология не установлена) (3–50%).
Классификация
В настоящее время в Украине принята классификация перикардита, утвержденная на VI Конгрессе кардиологов Украины (Киев, 2000):
I. Этиологическая характеристика:
- перикардит при бактериальных инфекциях I32.0;
- перикардит при инфекционных и паразитарных болезнях I32.1;
- перикардит при других болезнях I32.8;
- перикардит неуточненный I31.9.
II. Патогенетические и морфологические варианты:
- хронический адгезивный I31.0;
- хронический констриктивный I31.0, в том числе кальциноз перикарда;
- гемоперикард I31.2;
- перикардиальный выпот (невоспалительный) — гидроперикард (I31.3), в том числе хилоперикард.
III. Характер течения: острый (I30), хронический, прогрессирующий
IV. Оценка степени выраженности перикардиального выпота по данным ультразвуковых и других методов исследования (незначительная, умеренная, выраженная)
V. СН (0–III стадия, I–IV ФК).
Острый перикардит длится менее 6 нед, хронический — более 6 нед.
Патологическая анатомия
Возникновение перикардита сопровождается усилением экссудации жидких и мелкодисперсных компонентов крови в полость перикарда. Свободно перемещаясь в полости, экссудат интенсивно резорбируется невовлеченными в воспалительный процесс участками перикарда. При изменении проницаемости сосудистой стенки, пропотевании грубодисперсных белков плазмы крови, в частности фибриногена, и выпадении его в осадок в виде отложений фибрина образуется воспалительный инфильтрат и формируется фибринозный (сухой) перикардит, который может быть ограниченным и распространенным.
Накопление в полости обильного жидкого содержимого свидетельствует о нарушении эффективного всасывания и о широком вовлечении перикарда в воспаление. По характеру экссудата различают серозный, фибринозный, геморрагический, гнойный и гнилостный перикардит. По характеру невоспалительного выпота различают гидроперикард, гемоперикард, хилоперикард и холестериновый перикардит. Исходом острого экссудативного перикардита может быть частичная или полная организация выпота с образованием перикардиальных сращений. Локальный перикардит к накоплению в полости жидкого выпота не приводит.
При сдавливающем перикардите фиброзное рубцевание и адгезия обоих листков перикарда приводят к облитерации полости перикарда, в результате чего образуется твердая оболочка вокруг сердца; при длительном течении формируется значительное обызвествление перикарда, в отдельных случаях образовывается сплошное кольцо вокруг сердца («панцирное» сердце). На поздних этапах течения констриктивного перикардита глубоко поражается миокард желудочков, местные изменения сочетаются с миокардиофиброзом. Мышечные волокна истончаются, происходит их жировое перерождение и атрофия в связи со снижением рабочей нагрузки на желудочки. Масса сердца (без сдавливающей капсулы) у больных, умерших от констриктивного перикардита, не превышает 300 г.
Патологическая физиология
Острый фибринозный (сухой) перикардит не сопровождается нарушениями гемодинамики, поскольку медленное увеличение количества жидкости вызывает постепенное растяжение наружного листка перикарда. При быстрой экссудации реализуется «опорная» функция перикарда, которая ограничивает пределы диастолического расширения камер сердца. Ткань перикарда эластична при небольшом растяжении (диастола желудочков), но быстро теряет эластические свойства при большей степени расширения.
Нарушения кровообращения (снижение АД, венозный застой) возникают, когда давление внутри перикардиальной полости достигает 50–60 мм вод. ст. При этом венозное давление повышается, на 20–30 мм вод. ст. превышая внутриперикардиальное и обеспечивая в новых условиях диастолическое наполнение камер сердца. Если объем экссудата достигает критического уровня, вызывающего существенное сдавление сердца, возникает тампонада сердца, развитие которой зависит от скорости накопления жидкости (при быстрой аккумуляции возникает при накоплении 200 мл выпота).
При слипчивом (адгезивном, спаечном) перикардите различают два механизма сдавления сердца — первичный и вторичный. При первичном происходит истинная ретракция рубцовой капсулы, нарушения гемодинамики наступают в ранние сроки, чаще через несколько недель после начала заболевания. При вторичном сдавлении уменьшения исходного объема перикардиального мешка не наблюдается, но он утрачивает свою растяжимость и предельный размер сердца жестко ограничен, нарушения гемодинамики развиваются в течение ряда лет.
Клиническая картина и диагностика
Острый сухой перикардит
Проявляется триадой клинических симптомов — болью в грудной клетке, шумом трения перикарда и изменениями на ЭКГ.
Боль в области сердца возникает внезапно, имеет различную интенсивность, носит постоянный характер, не купируется приемом нитроглицерина, усиливается при кашле, чиханьи, глотании, дыхании, продолжается несколько часов, временно ослабевает при применении анальгетиков. Боль локализуется, как правило, в центре грудной клетки с иррадиацией в область спины, а также в область верхушки сердца, может иррадиировать в шею, спину, левое плечо. Интенсивность боли зависит от дыхания, движения, перемены положения тела, уменьшается в положении сидя с наклоном туловища кпереди, а также в коленно-локтевом положении.
Частыми жалобами являются приступы сердцебиения, сухой кашель, одышка, общее недомогание, познабливание. В результате раздражения диафрагмального нерва могут появляться икота и рвота. В некоторых случаях больные жалуются на потливость, субфебрильную температуру тела, снижение АД.
Патогномоничным симптомом является шум трения перикарда, который носит непостоянный характер, может исчезать в течение нескольких часов и появляться на следующий день, но чаще постепенно распространяется и усиливается. Шум имеет скребущий характер (напоминает хруст снега), изменчивый, прослушивается в систолу и/или в диастолу, лучше выслушивается в зоне абсолютной тупости сердца, как правило, никуда не проводится, иногда может выявляться только при сильном надавливании стетоскопом на грудную клетку. Обычно шум трения перикарда имеет три фазы: систолический и ранний диастолический компоненты сопровождаются в более поздней диастоле третьим компонентом, связанным с предсердным сокращением. Шум трехфазный у 50%, двухфазный — у 33% и монофазный — у 10% больных.
ЭКГ-изменения отмечают при большинстве форм острого перикардита, особенно инфекционной этиологии, когда сопутствующее воспаление в поверхностном слое миокарда является ведущим. Воспаление в субэпикардиальном миокарде связывают с механизмом, приводящим к изменению сегмента ST и зубца T, тогда как воспаление в предсердии приводит к изменениям сегмента PR, которые могут предшествовать изменениям сегмента ST. Выделяют 4 фазы изменений ЭКГ: 1-я стадия — элевация сегмента ST в стандартных и грудных отведениях с переходом в высокий положительный зубец Т — 90%; 2-я — сегмент ST опускается до изолинии и ЭКГ выглядит нормальной, 3-я — зубец Т постепенно уплощается и через 10–15 дней становится двухфазным или отрицательным в тех отведениях, в которых происходила динамика сегмента ST, 4-я — ЭКГ нормализуется. У большинства пациентов сохраняется синусовый ритм.
При рентгенологическом исследовании увеличения сердца не отмечают.
При эхоКГ-исследовании можно определить утолщение листков перикарда, наличие небольшого выпота.
Радионуклидное сканирование с индием-111 и галлием-67 позволяет установить диагноз перикардита, выявить вовлеченные в воспалительный процесс участки перикарда.
Лабораторные данные определяются основным заболеванием, могут отмечаться умеренное повышение СОЭ, ЛДГ и СРБ в сыворотке крови, умеренный лейкоцитоз и сдвиг лейкоцитарной формулы влево. Могут определяться маркеры повреждения миокарда: повышение уровня тропонина I и Т, МВ-фракции КФК. Уровень тропонина I в сыворотке крови повышается у больных с элевацией сегмента ST и острым перикардитом, отражая степень повреждения эпикарда и миокарда, но при этом не является негативным прогностическим маркером.
О сопутствующем перимиокардите свидетельствуют общая или локальная дисфункция миокарда, повышение в крови уровня тропонинов I и Т, МВ-фракции КФК, миоглобина и ФНО-α.
Специфические диагностические тесты должны включать кожные туберкулиновые пробы, определение ревматоидного фактора и титра антинуклеарных антител, исследование на вирусы, при необходимости — гемокультуру.
Течение острого перикардита доброкачественное. Прогноз у большинства пациентов благоприятный. Полное выздоровление отмечают даже без лечения, однако возможны рецидивы, опосредованные аутоиммунными механизмами, и прогрессирование заболевания с развитием экссудативного перикардита.
Экссудативный перикардит
Чаще всего является следствием инфекционного, а в ряде случаев аллергического воспаления, обычно осложняет течение ревматизма, туберкулеза, стафилококковой и стрептококковой инфекции. Следует учитывать, что кроме экссудата, жидкость в полости перикарда может представлять собой транссудат (гидроперикард), гной (пиоперикард), кровь (гемоперикард).
Клиническая картина острого экссудативного перикардита зависит от объема скопившегося в перикардиальной полости количества жидкости и тяжести инфекционного процесса, обычно бессимптомна, но могут отмечаться следующие клинические симптомы:
- синусовая тахикардия;
- субфебрильная лихорадка;
- выраженная постоянная одышка;
- вынужденное положение больного — сидя с наклоном туловища вперед, нередко больной становится на колени и прижимается лицом к подушке;
- при сдавливании экссудатом нижней полой вены увеличивается и становится болезненной печень, быстро нарастает асцит, появляются отеки на ногах;
- выбухание грудной клетки в области проекции сердца;
- ослабление или исчезновение верхушечного толчка;
- снижение АД.
При осмотре определяется расширение площади сердечной тупости во все стороны, а также увеличение ширины сосудистого пучка во втором межреберье, конфигурация сердца напоминает крышу с трубой. Границы абсолютной сердечной тупости расширяются и совпадают с относительной. В положении на спине область сердечной тупости округляется, в вертикальном положении напоминает неравнобедренный треугольник в связи с перемещением жидкости под действием силы тяжести книзу.
Аускультативно определяется глухость тонов сердца, иногда ритм галопа, частые нарушения ритма сердца.
При перкуссии легких в нижней доле слева возможно притупление звука, при аускультации появляются бронхофония, бронхиальный оттенок дыхания в связи со сдавлением легочной ткани перикардиальной жидкостью; притупление звука уменьшается при наклоне вперед.
По данным лабораторных исследований выявляют повышение СОЭ и увеличение количества лейкоцитов, сдвиг лейкоцитарной формулы влево, повышение уровня альфа-глобулинов, фибриногена, гаптоглобина в сыворотке крови.
При рентгенологическом исследовании выявляются следующие изменения:
1) кардиомегалия при накоплении в полости перикарда 200–300 мл жидкости;
2) переход острого печеночно-сердечного угла в тупой, исчезновение талии сердца;
3) амплитуда пульсации контуров сердца резко снижена вплоть до полного ее исчезновения при сохранении пульсации крупных сосудов;
На ЭКГ выявляют уменьшение вольтажа комплекса QRS и зубца T.
ЭхоКГ-исследование является методом выбора, который позволяет определить количество (даже небольшое — 50–100 мл) и характер выпота, включая наличие фибрина, воздуха, опухоли, отложения кальция. По объему выпот можно разделить на незначительный (<10 мм эхосвободного пространства в систолу и диастолу), умеренный (≥10 мм), значительный (≥20 мм) и очень значительный (компрессия сердца).
При эхоКГ также могут быть выявлены:
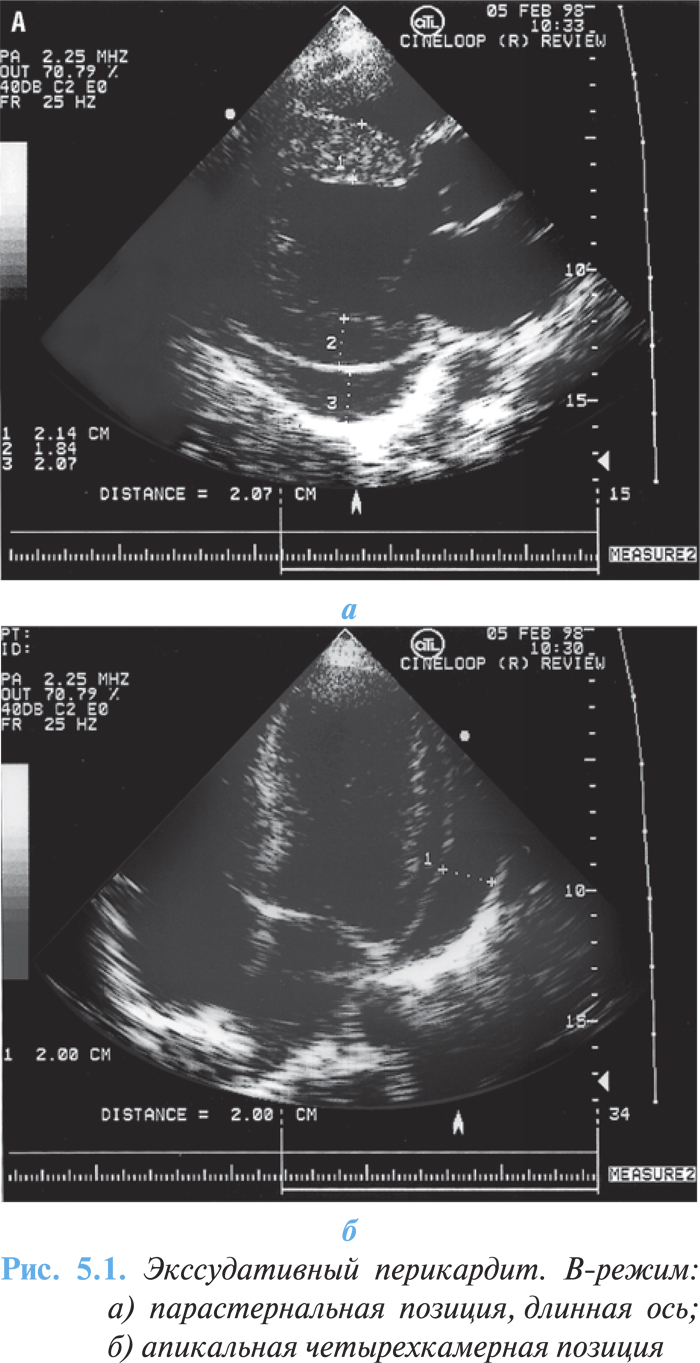
- эхонегативное пространство между стенками ЛЖ и оттесненным кзади париетальным листком перикарда; при большом количестве выпота ширина этого пространства достигает 20 мм и более (рис. 5.1а, б);
- гиперкинезия всего контура сердца и межжелудочковой перегородки;
- нарушения движения предсердно-желудочковых клапанов;
- феномен «плавающего», или «качающегося», сердца при двухмерной эхоКГ.
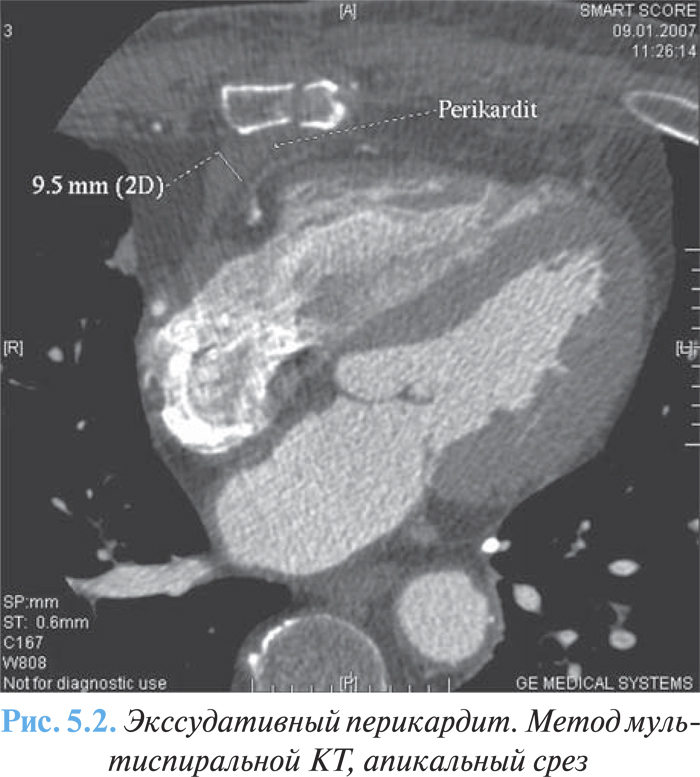
Методы КТ и МРТ могут применяться для оценки размера и распространенности выпота, который несколько больший по сравнению с таковым при эхоКГ (рис. 5.2).
Перикардиоцентез проводят при подозрении на наличие гноя в полости, туберкулезном или опухолевом поражении перикарда. Исходом экссудативного перикардита может быть либо рассасывание, либо организация выпота с образованием перикардиальных спаек, сращений, частичной или полной облитерацией сердечной сорочки. При хроническом экссудативном перикардите наиболее эффективным является субтотальная перикардэктомия, выздоровление наступает у большинства оперированных больных.
Тампонада сердца
Возникает вследствие накопления выпота в перикардиальном пространстве и повышения давления в полости перикарда, что приводит к сдавлению сердца и нарушению кровообращения вследствие уменьшения сердечного выброса и системного венозного застоя. Тампонада развивается в течение нескольких минут при разрыве, травме сердца, чаще развивается постепенно. При быстром накоплении выпота в полости перикарда тампонада может возникнуть при объеме выпота до 200–250 мл, при медленном накоплении — более 1000 мл. Объем жидкости, приводящий к развитию тампонады, находится в прямой зависимости от толщины миокарда и в обратной зависимости от толщины париетального листка перикарда.
Клинические признаки тампонады варьируют от одышки и периферических отеков до циркуляторного коллапса. Ранними проявлениями тампонады являются тахикардия, резко выраженная одышка, отеки, повышение венозного давления с набуханием яремных вен, расширение границ абсолютной и относительной тупости сердца. Возможно снижение АД вплоть до коллапса. При подостром развитии тампонады выявляются признаки правожелудочковой недостаточности с гепатомегалией, асцитом и плевральным выпотом. Аускультативно определяется глухость тонов сердца. Важнейшим признаком тампонады сердца является парадоксальный пульс — значительное (>10 мм рт. ст.) снижение САД при вдохе.
ЭхоКГ позволяет установить точный диагноз путем выявления перикардиального выпота и его локализации. Если объем перикардиального выпота при эхоКГ-исследовании составляет 15–35 мл, листки перикарда отмечаются отдельно от эпикарда.
Наиболее существенным признаком тампонады сердца при эхоКГ-исследовании является уменьшение диастолического ЛЖ на вдохе (рис. 5.3а, б), а также выраженные дыхательные изменения скорости потока через митральный и трикуспидальный клапаны или дыхательные изменения выброса ЛЖ, выявленные при импульсно-волновой допплерографии.
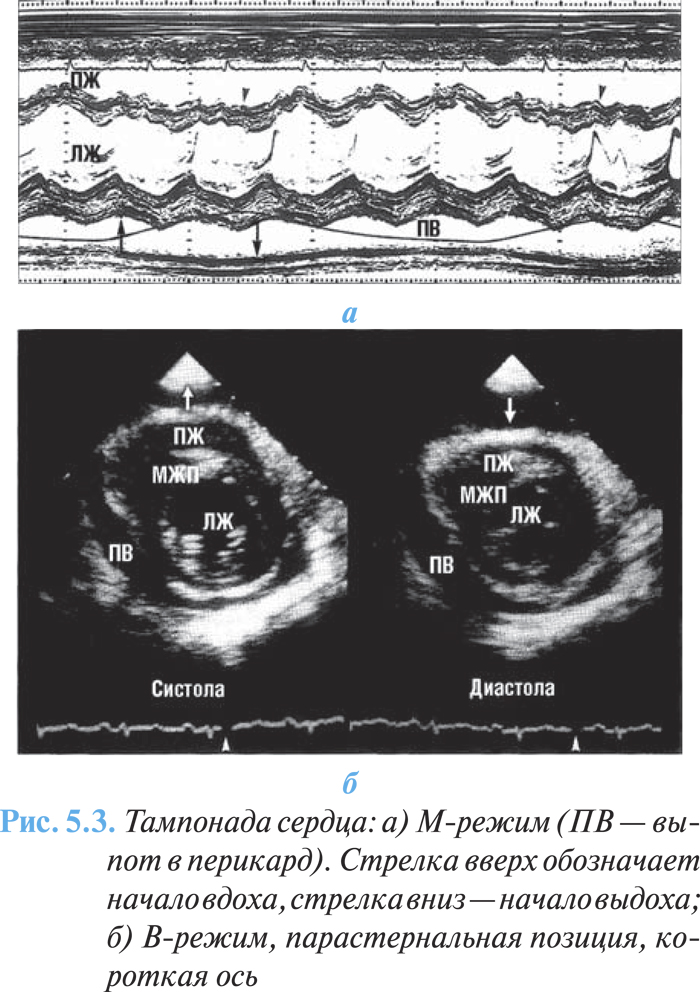
С помощью допплеровского исследования можно количественно определить кровоток через митральный и трехстворчатый клапаны, ЛА и вены. Дыхательные колебания амплитуды трансмитрального пика Е >25% и транстрикуспидального пика Е >40% дают основание заподозрить наличие тампонады сердца.
Катетеризация полостей сердца исторически была диагностическим стандартом при тампонаде сердца и остается важным диагностическим методом, особенно в случаях недостаточной информативности неинвазивных методов. Катетеризацию правых отделов сердца часто проводят одновременно с перикардиоцентезом для мониторирования удаления выпота.
Констриктивный перикардит
Это наиболее тяжелое заболевание перикарда, развивается чаще всего в результате туберкулезного, ревматического или гнойного воспаления перикарда. При этом после перенесенного острого фибринозного или серозно-фибринозного перикардита возникает облитерация полости перикарда с образованием грануляционной ткани, которая образует плотный рубец, иногда с отложением солей кальция, нарушающий наполнение желудочка.
К констриктивному (сдавливающему) перикардиту относят случаи:
- циркулярного сжатия миокарда утолщенным склерозированным и неподатливым перикардом;
- хронического значительного выпота в полость перикарда, сдавливающего миокард;
- сдавления рубцами или обызвествленными участками определенных отделов сердца, его коронарных и магистральных сосудов с нарушением гемодинамики.
Констриктивный перикардит трудно диагностировать. Клинический диагноз зависит от выявления повышенного венозного давления у пациента, у которого может не быть других клинических проявлений болезни сердца. При значительной констрикции выявляют признаки застойной СН, включая отеки, асцит, анасарку, застой в печени, спленомегалию, снижение толерантности к физическим нагрузкам, кахексию. Часто отмечают признаки выраженного хронического системного венозного застоя, обусловленного небольшим минутным объемом сердца: набухание и пульсация яремных вен, артериальная гипотензия с низким пульсовым давлением. Симптомы прогрессируют и не поддаются консервативной медикаментозной терапии.
На ЭКГ могут определяться снижение амплитуды комплекса QRS, уменьшение амплитуды или инверсия зубца Т, фибрилляция предсердий,
AV-блокада, нарушения внутрижелудочковой проводимости.
При рентгенологическом исследовании можно выявить уменьшение сердечной пульсации («тихое» сердце), кальцификацию перикарда («панцирное» сердце), плевральный выпот.
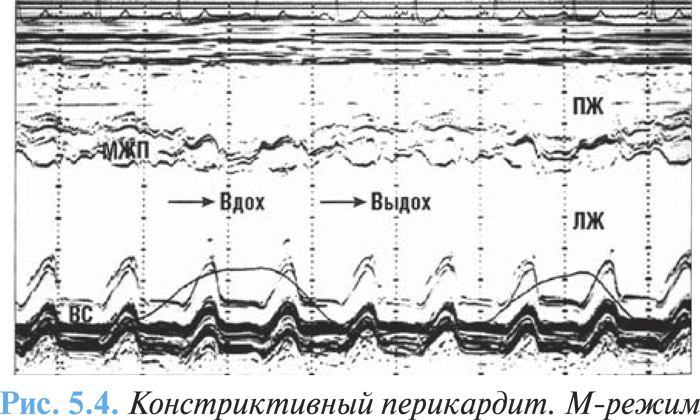
При эхоКГ-исследовании выявляется утолщение перикарда и его кальцификация, прекардиальные сращения, а также непрямые признаки констрикции: увеличение левого и правого предсердий при неизмененной конфигурации желудочков и систолической функции, раннее парадоксальное движение межжелудочковой перегородки — в сторону ЛЖ на вдохе и в сторону ПЖ на выдохе вследствие изменений размера желудочка во время дыхания, уплощение задней стенки ЛЖ вследствие ограниченного диастолического наполнения (рис. 5.4).
При допплеровской эхоКГ отмечается ограничение наполнения ЛЖ и ПЖ, при оценке трансклапанных AV потоков различия в уровне наполнения на вдохе и выдохе превышают 25%.
КТ грудной клетки и/или МРТ более достоверно помогают установить диагноз при выявлении перикардиального уплотнения: определяют утолщение и кальцификацию перикарда, сужение AV борозд, застой в полых венах, увеличение предсердий.
Для подтверждения диагноза проводят перикардиоцентез и катетеризацию сердца. При катетеризации сердца выявляют характерные изменения: повышение ЦВД, нерасширенные и нормально сокращающиеся ПЖ и ЛЖ и почти полное выравнивание в них конечно-диастолического давления.
При ангиографии определяют уменьшение размеров ПЖ и ЛЖ, увеличение размеров правого и левого предсердий.
Лечение и профилактика
В соответствии с протоколом оказания медицинской помощи больным с острым перикардитом, хроническим констриктивным перикардитом (приказ МЗ Украины № 436 от 03.07.2006 г.) в перечень медицинских услуг обязательного ассортимента входит этиопатогенетическое лечение основного заболевания: применение антибиотиков, НПВП, ГКС, проведение перикардиоцентеза при значительном количестве выпота и оперативного лечения при констриктивном перикардите.
Больных с острым перикардитом следует госпитализировать для определения этиологии, динамической оценки эффективности лечения и исключения тампонады сердца.
Снижение частоты развития перикардита при пневмонии и других инфекционных заболеваниях достигнуто благодаря широкому применению антибиотиков, имеющих решающее значение в профилактике отдельных видов перикардита. Специфический перикардит при различных инфекционных заболеваниях лечат антибиотиками после определения чувствительности выделенных возбудителей. Если этиология перикардита не выяснена, от антибактериальной терапии следует воздержаться, учитывая возрастающее количество неинфекционных форм, обусловленных сенсибилизацией организма.
При неспецифическом бактериальном перикардите применяют бензилпенициллин или его полусинтетические производные, иногда сочетанно с аминогликозидами (гентамицин, канамицин, амикацин, стрептомицин). При непереносимости пенициллина назначают цефалоспорины.
При инфекционном перикардите к неспецифическому лечению прибегают даже при эффективности антибиотикотерапии, поскольку этиотропная противомикробная терапия не оказывает непосредственного влияния на экссудативный и пролиферативный компоненты воспалительного процесса.
Основой терапии острого перикардита является применение НПВП в течение нескольких дней или недель до исчезновения перикардиального выпота. У больных пожилого возраста не следует применять индометацин, поскольку препарат снижает кровоток в коронарных артериях. Согласно Европейским рекомендациям по лечению перикардита (2004) предпочтительным препаратом является ибупрофен, который благоприятно влияет на коронарный кровоток и обладает широким диапазоном терапевтических доз. Начальная доза составляет 300–800 мг каждые 6–8 ч, такое лечение можно назначать в течение нескольких недель до резорбции перикардиального выпота. При необходимости назначают гастропротекторные средства для профилактики НПВП-ассоциированной гастропатии.
Для лечения острого перикардита и профилактики его осложнений можно назначать колхицин по 0,5 мг 2 раза в сутки (как в качестве монотерапии, так и в дополнение к лечению НПВП).
При аллергических и аутоиммунных формах перикардита неспецифическая противовоспалительная терапия играет ведущую роль.
Системное применение ГКС показано лишь при заболеваниях соединительной ткани, аутоиммунных процессах или уремии. Высокоэффективно внутриперикардиальное введение ГКС для избежания развития системных побочных эффектов.
Преднизолон в низких дозах (10–15 мг) применяют также при перикардите аутоиммунной этиологии у больных с ИМ или после оперативных вмешательств на сердце. Высокая эффективность терапии ГКС хотя и позволяет предположить аутоиммунную природу перикардита, однако не исключает его инфекционного генеза.
Тампонаду сердца умеренной степени тяжести в некоторых случаях можно лечить консервативно, назначая мочегонные средства с одновременной терапией основного заболевания. Диуретики уменьшают выраженность симптомов застоя. При фибрилляции предсердий назначают антиаритмические препараты.
Повышенное ЦВД в большинстве случаев требует удаления жидкости из перикарда. Перикардиальный выпот может быть удален с помощью пункции (перикардиоцентез) или других хирургических методик (подмечевидная перикардиостомия, торакоскопическая перикардиостомия, торакотомия). Наиболее острые формы тампонады сердца типа гемоперикарда, обусловленного расслоением аорты, проникающей травмы сердца или разрыва стенки сердца при остром ИМ требуют немедленного хирургического вмешательства.
Перикардиоцентез эффективен при большинстве подострых форм тампонады, например обусловленных идиопатическим или вирусным острым перикардитом, ревматизмом, диализом и новообразованием. Торакоскопию и торакотомию обычно применяют у пациентов с рецидивирующей тампонадой сердца, которые подверглись вначале перикардиоцентезу или подмечевидной перикардиостомии, обычно при опухолях.
Показаниями для перикардиоцентеза являются тампонада сердца, экссудат более 20 мм в диастолу по данным эхоКГ, подозрение на туберкулезный или гнойный выпот. Клиническое улучшение обычно наступает после аспирации 100–200 мл жидкости.
Перикардиоцентез противопоказан при диссекции аорты, а также в ситуациях, когда диагноз может быть установлен другим методом или выпот небольшой и разрешается после противовоспалительного лечения. Относительные противопоказания включают некорригированную коагулопатию, одновременное проведение терапии антикоагулянтами, тромбоцитопению (<50 000/мм3), наличие небольшого изолированного экссудата.
При констриктивном перикардите консервативное лечение неэффективно.
Верифицированный диагноз является абсолютным показанием к перикардэктомии — удалению обоих листков спаянного перикарда.
При выраженной кальцифицированной адгезии перикарда хирургическое вмешательство часто приводит лишь к улучшению состояния и может сопровождаться тяжелым повреждением перикарда, риском кровоизлияния от перфораций стенки сердца. Альтернативным подходом может служить применение эксимерного лазера. После проведения перикардэктомии полная нормализация внутрисердечной гемодинамики достигается лишь у 60% больных.
В ранний послеоперационный период ЦВД может остаться повышенным, однако нормализуется в течение 3 мес после операции. Неадекватная длительность периода реконвалесценции после хирургического удаления перикарда может отражать наличие сопутствующей патологии миокарда.
Перечень и объем медицинских услуг дополнительного ассортимента (указанный приказ МЗ Украины № 436) включает следующие подходы в лечении больных с перикардитом:
- Симптоматическое лечение СН.
- Амиодарон назначают больным с симптоматическими или тяжелыми желудочковыми аритмиями, а также при тахисистолической форме фибрилляции предсердий в случаях недостаточного эффекта других препаратов.
- Антикоагулянты (непрямые) применяют у пациентов с постоянной формой фибрилляции предсердий, тромбоэмболическими осложнениями в анамнезе, при наличии тромбов в полостях сердца. Обязателен контроль МНО. При невозможности его определения — определение протромбинового индекса.
ЛИТЕРАТУРА
- Оганов Р.Г., Фомина И.Г. (ред.) (2006) Болезни сердца: руководство для врачей. Литтерра, Москва, 1328 с.
- Коваленко В.Н., Несукай Е.Г. (2001) Некоронарогенные болезни сердца. Практ. руководство. Морион, Киев, 480 с.
- Коваленко В.М., Лутай М.І., Сіренко Ю.М. (ред.) (2007) Серцево-судинні захворювання. Класифікація, стандарти діагностики та лікування кардіологічних хворих. Київ, 122 с.
- Наказ № 436 Міністерства охорони здоров’я України від 03.07.2006 р. «Про затвердження протоколів надання медичної допомоги за спеціальністю «Кардіологія» (2006). Укр. кардіол.журн., 6: 89-115.
- Шиллер Н., Осипов М.А. (2005) Клиническая эхокардиография. 2-е изд. Практика, Москва, 344 с.
- Bertog S.C., Thambidorai S.K., Parakh K. et al. (2004) Constrictive pericarditis: etiology and cause-specific survival after pericardiectomy. J. Amer. Coll. Cardiol., 43: 1445-1452.
- Bonnefoy E., Godon P., Kirkorian G. et al. (2000) Serum cardiac troponin I and ST-segment elevation in patients with acute pericarditis. Eur. Heart J., 21: 832-836.
- Brucato A., Cimaz R., Balla E. (2000) Prevention of recurrences of corticosteroid-dependent idiopathic pericarditis by colchicine in an adolescent patient. Pediatr. Cardiol., 21: 395-396.
- Frank H., Globits S. (1999) Magnetic resonance imaging evaluation of myocardial and pericardial disease. J. Magn. Reson. Imaging., 10: 617-626.
- Glockner J.F. (2003) Imaging of pericardial disease. Magn. Reson. Imaging Clin. North. Amer., 11: 149-162.
- Haley J.H., Tajik A.J., Danielson G.K. et al. (2004) Transient constrictive pericarditis: causes and natural history. J. Amer. Coll. Cardiol., 43: 271-275.
- Imazio M., Demichelis B., Cecchi E. et al. (2003) Cardiac troponin I in acute pericarditis. J. Amer. Coll. Cardiol., 42: 2144-2148.
- Imazio M., Bobbio M., Cecchi E. et al. (2005) Colchicine in addition to conventional therapy for acute pericarditis: results of the COlchicine for acute PEricarditis (COPE) trial. Circulation., 112: 2012-2016.
- Ling L.H., Oh J.K., Breen J.F. et al. (2000) Calcific constrictive pericarditis: is it still with us? Ann. Intern. Med., 132: 444-450.
- Maisch B., Seferovic P.M., Ristic A.D. et al. (2004) Guidelines on the diagnosis and management of pericardial disease. Eur. Heart J., 25: 587-610.
- Maron B.J., Towbin J.A., Thiene G. et al. (2006) Contemporary definitions and classification of the cardiomyopathies: An American Heart Association Scientific Statement from the Council on Clinical Cardiology, Heart Failure and Transplantation Committee; Quality of Care and Outcomes Research and Functional Genomics and Translational Biology Interdisciplinary Working Groups; and Council on Epidemiology and Prevention. Circulation., 113: 1807-1816.
- Myers R.B., Spodick D.H. (1999) Constrictive pericarditis: clinical and pathophysiologic characteristics. Amer. Heart J., 138(1): 219-232.
- Newby L.K., Ohman E.M. (2000) Troponins in pericarditis: implications for diagnosis and management of chest pains patients. Eur. Heart J., 21: 798-800.
- Notomi Y., Setser R.M., Shiota T. et al. (2005) Assessment of left ventricular torsional deformation by Doppler tissue imaging: validation study with tagged magnetic resonance imaging. Circulation., 111: 1141-1147.
- Oh J.K., Hatle L.K., Seward J.B. et al. (1994) Diagnostic role of Doppler echocardiography in constrictive pericarditis. J. Amer. Coll. Cardiol., 23: 154-162.
- Seferovic M., Spodick D.H., Maisch B. (Eds.) (2000) Pericardiology. Contempopary answers to continuing challenges. SCIENCE, Belgrade, 475 p.
- Sagrista-Sauleda J. et al. (1999) Long-term follow-up of idiopathic chronic pericardial effusion. N. Engl. J. Med., 341: 2054-2059.
- Sagrista-Sauleda J., Angel J., Sanchez A. et al. (2004) Effusive-constrictive pericarditis. N. Engl. J. Med., 350: 469-475.
- Salem K., Mulji A., Lonn E. (1999) Echocardiographically guided pericardiocentesis — the gold standard for the management of pericardial effusion and cardiac tamponade. Can. J. Cardiol., 15: 1251-1255.
- Seferovic P.M., Ristic A.D., Maksimovic R. et al. (2003) Diagnostic value of pericardial biopsy: improvement with extensive sampling enabled by pericardioscopy. Circulation., 107: 978-983.
- Tabata T., Kabbani S.S., Murray R.D. et al. (2000) Difference in the respiratory variation between mitral inflow and pulmonary venous flow Doppler velocities in patients with constrictive pericarditis. J. Amer. Soc. Echocardiogr., 13: 435-438.
- Topol E.J. (Ed.) (2007) Textbook of cardiovascular medicine. 3th ed. Lippincott Williams&Wilkins, 1628 p.
- Troughton R.W., Asher C.R., Klein A.L. (2004) Pericarditis. Lancet, 363: 717-727.
- Van der Merwe S., Dens J., Daenen W. et al. (2000) Pericardial disease is often not recognised as a cause of chronic severe ascites. J. Hepatol., 32: 164-169.
- Von Sohsten R., Kopistansky C., Cohen M. et al. (2000) Cardiac tamponade in the «new device» era: evaluation of 6999 consecutive percutaneous coronary interventions. Amer. Heart J., 140: 279-283.