Неклассифицированные кардиомиопатии
Содержание
КАРДИОМИОПАТИЯ ТАКОТСУБО
Кардиомиопатия такотсубо — транзиторное баллоноподобное расширение средней части верхушки сердца (apical ballooning), сопровождающееся преходящей региональной систолической дисфункцией с одновременной гиперкинезией базальных сегментов ЛЖ при отсутствии стенозирующего поражения коронарных артерий.
Впервые кардиомиопатия такотсубо описана в 1990 г. японскими исследователями H. Satoh с соавторами. Название выявленного ими явления определила форма расширения сердца, которая напоминала tako-tsubo — глиняный горшок для ловли осьминогов. В мировой литературе применяют несколько синонимов кардиомиопатии такотсубо: преходящее шарообразное расширение верхушки ЛЖ, ампульная кардиомиопатия, амфороподобная кардиомиопатия.
Эпидемиология
Кардиомиопатию такотсубо диагностируют у 1% пациентов с подозрением на острый коронарный синдром.
Этиология и патогенез
По современным представлениям доминирующим причинным фактором в возникновении кардиомиопатии такотсубо является эмоциональный и физический стресс.
Заболевание возникает преимущественно у лиц женского пола пожилого и старческого возраста (91% — у женщин в возрасте 62–76 лет). Гипотеза, объясняющая развитие ампульной кардиомиопатии в пожилом и старческом возрасте у женщин, выдвинута T. Ueyama и соавторами (2007), которые установили снижение экспрессии матричной РНК кардиопротективных факторов и развитие сходной с такотсубо кардиомиопатии у самок лабораторных крыс, подверженных стрессу и не получавших эстрогены в отличие от группы животных, получавшей эстрогены, в которой развитие такотсубоподобной кардиомиопатии было достоверно ниже.
К развитию кардиомиопатии такотсубо могут приводить вредные привычки — злоупотребление алкоголем, наркомания (употребление кокаина, опиатов).
Среди других причинных факторов обсуждаются особенности строения сердца (S-образное строение межжелудочковой перегородки, малый диаметр выходного тракта ЛЖ). Описано развитие заболевания при некоторых острых состояниях: пневмотораксе, пароксизме желудочковой тахикардии и фибрилляции желудочков.
Считается, что в основе развития заболевания лежит острый выброс катехоламинов и повышение чувствительности адренорецепторов, нарушение симпатической иннервации верхушки сердца, а также нарушение вегетативной функции на уровне ядер гипоталамуса как проявление общей реакции организма на стресс.
Среди других механизмов возникновения заболевания обсуждается теория многососудистого спазма коронарных артерий в эпикардиальном отделе коронарного русла с нарушением микроциркуляции, возникающего, возможно, вследствие повышенной концентрации катехоламинов в плазме крови, что в 74,3% случаев отмечают в острую фазу ампульной кардиомиопатии. При этом не совсем ясно, почему коронароспазм возникает в одной и той же апикальной области ЛЖ. Хотя некоторые авторы предполагают наличие в базальных отделах большего количества симпатических нервных окончаний, что может способствовать развитию баллоноподобной асинергии в апикальных отделах с гиперсократимостью базальных отделов.
Патологическая анатомия
Патоморфологические изменения при кардиомиопатии такотсубо, полученные c помощью эндомиокардиальной биопсии и последующей электронной микроскопии препаратов, характеризуются структурным повреждением кардиомиоцитов, вакуолизацией, нарушением цитоскелета клеток, деградацией контрактильных белков, фокальным интерстициальным фиброзом, в некоторых случаях отмечается наличие диссеминированного фиброза с инфильтрацией мононуклеарными клетками. В острую фазу заболевания в миокарде нередко регистрируются глубокие регионарные нарушения перфузии, однако большая часть кардиомиоцитов в этих зонах сохраняет целостность мембраны и затем полностью восстанавливает свою функцию.
Применение иммуногистохимических методов в острую фазу заболевания дает возможность выявить уменьшение количества актина, нарушение структуры дистрофина и коннексина-43, значительную активацию коллагена 1-го типа и, как следствие, фибротические изменения внеклеточного пространства. Следует отметить, что правожелудочковая и левожелудочковая эндомиокардиальная биопсия являются одинаково важными для выявления морфологических изменений кардиомиоцитов при кардиомиопатии такотсубо.
Клиническая картина
Клинические проявления кардиомиопатии такотсубо характеризуются в основном приступообразной болью за грудиной (у 80–86% пациентов) и одышкой, которые появляются в покое или после физического перенапряжения. Боль длится >20–30 мин, не купируется приемом нитратов. Изредка отмечается снижение АД.
При аускультации сердца может определяться дополнительный тон и систолический шум изгнания.
Диагностика
На ЭКГ в острую фазу заболевания регистрировали инфарктоподобный подъем сегмента ST (в 90% случаев), инверсию Т (до 97%), образование патологического Q (27%). Описаны удлинение интервала Q–T и появление зубца U. Нередко выявляются синусовая брадикардия, AV-блокада, фибрилляция предсердий, желудочковая тахикардия.
Считается, что в 0,7–2,5% случаев кардиомиопатия такотсубо является причиной неправильного установления диагноза ИМ. Все отклонения нормализуются через 8–10 нед.
ЭхоКГ-исследование, выполненное в период манифестации симптомов, позволяет выявить расширение в области верхушки с базальной гиперкинезией и обструкцией выходного тракта ЛЖ, акинезию передней стенки межжелудочковой перегородки. Градиент внутрижелудочкового давления может достигать 45 мм рт. ст. и выше. Сократительная функция ЛЖ в острую фазу снижается (фракция выброса уменьшается до 15–20%), в дальнейшем ее нормализация происходит в среднем за 12–20 дней.
Вентрикулография и МРТ при кардиомиопатии такотсубо дают возможность выявить акинезию антеролатеральных, апикальных, диафрагмальных и септальных отделов ЛЖ с одновременным повышением сократимости в его базальных отделах (рис. 13.1). Дисфункция ПЖ характеризуется гипокинезией или акинезией преимущественно апико-латерального сегмента (рис. 13.2 ).

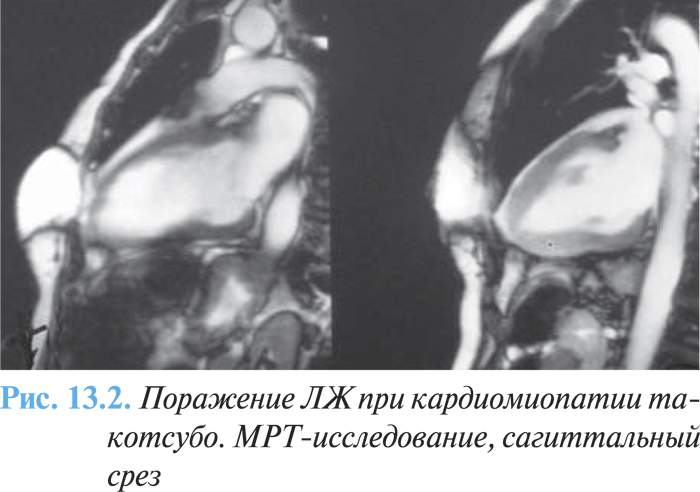
При проведении коронароангиографии отсутствует гемодинамически значимый стеноз коронарных артерий. По данным P. Наghi и соавторов (2007) у лиц с окончательно установленным диагнозом «кардиомиопатия такотсубо» максимальная обструкция коронарных артерий не превышала 50–65%.
Подтверждением теории микрососудистой дисфункции также служат результаты применения однофотонной эмиссионной КТ, свидетельствующие о снижении миокардиальной перфузии при отсутствии обструктивных изменений коронарных сосудов, и умеренное снижение сократимости в области верхушки, причем практически полное восстановление перфузии отмечают через 3–5 дней от начала заболевания.
Для больных с кардиомиопатией такотсубо характерно минимальное повышение активности кардиоспецифических ферментов — уровня тропонина I (у 85% обследуемых), МВ-фракции КФК в крови (в 73,9% случаев), не соответствующее объему пораженного миокарда.
Наиболее частым осложнением кардиомиопатии такотсубо принято считать умеренно выраженную СН, однако описано несколько случаев осложнения течения заболевания отеком легких в результате тяжелой левожелудочковой недостаточности, выраженной обструкции выносящего тракта ЛЖ с тяжелой митральной регургитацией. Крайне редко — кардиогенный шок, разрыв миокарда, описан единичный случай внезапной смерти. Возможны перикардит и пристеночное апикальное тромбообразование.
Несмотря на выраженные клинические симптомы, кажущийся высокий риск развития аритмии, СН с кардиогенным шоком, смертность в условиях стационара составляют около 1,7%, а полное клиническое выздоровление — 95,9% случаев. Как правило, рецидивы заболевания бывают достаточно редко. Так, только у 2 (2,7%) из 72 пациентов в серии, описанной K. Tsushikashi и соавторами (2001), повторный эмоциональный стресс сопровождался появлением клинической картины ампульной кардиомиопатии.
Лечение
Специальных методов лечения кардиомиопатии такотсубо в настоящее время не разработано. Схема лечения стандартна для систолической дисфункции ЛЖ и включает ингибиторы АПФ, блокаторы β-адренорецепторов, ацетилсалициловую кислоту, диуретики и блокаторы кальциевых каналов при необходимости.
НЕКОМПАКТНАЯ КАРДИОМИОПАТИЯ ЛЖ
Определение
Некомпактная кардиомиопатия ЛЖ (изолированная некомпактность ЛЖ, повышенная трабекулярность ЛЖ, губчатый миокард) — врожденное заболевание, характеризующееся выраженной трабекулярностью миокарда ЛЖ с глубокими межтрабекулярными щелями, связанными с полостью желудочка. Впервые описана R. Engberding и F. Bender в 1984 г.
Эпидемиология
Истинная распространенность заболевания неизвестна, однако его признаки при последовательных эхоКГ-исследованиях определяются в 0,014% случаев. Заболевание превалирует у женщин.
Этиология
В этиологии некомпактной кардиомиопатии ведущую роль играют генетические факторы, в основном мутации в генах, кодирующих саркомерные белки. В литературе описаны как семейные, так и спорадические формы некомпактной кардиомиопатии. До сих пор не найдено общих генетических детерминант для этого заболевания. Заболевание генетически гетерогенно, семейные формы могут передаваться по наследству как аутосомно-доминантное, аутосомно-рецессивное или связанное с Х-хромосомой заболевание. В некоторых семьях с Х-хромосомой, связанной с некомпактной кардиомиопатией, найдена связь с мутациями гена TAZ. Некоторые семейные аутосомно-доминантные кардиомиопатии могут быть объяснены мутациями генов, кодирующих протеины цитоскелета или клеточных соединений, ламина A/C, α-дистробревина. Дополнительные локусы идентифицированы в хромосомах 1q43, 5q и 11p15. В результате молекулярного скрининга генов саркомерных белков в двух семьях с аутосомно-доминантным наследованием некомпактной кардиомиопатии идентифицированы мутации в гене тяжелой цепи β-миозина сердечного саркомера. Идентифицированы мутации генов MYH7 в двух больших семьях с некомпактной кардиомиопатией ЛЖ.
Патогенез
Некомпактная кардиомиопатия ЛЖ возникает вследствие внутриутробной остановки эмбрионального развития сердца (на 5–8-й неделе эмбриогенеза) с персистированием эмбриональной морфологии миокарда и отсутствием компактности его структуры.
Клиническая картина
Заболевание может проявиться в раннем детстве, однако также может манифестировать во взрослом возрасте.
Клиническая манифестация некомпактной кардиомиопатии ЛЖ включает застойную СН с прогрессирующей одышкой и отеками, суправентрикулярные и желудочковые аритмии и системные тромбоэмболии. Патомеханизм СН неизвестен.
Желудочковую тахикардию регистрируют у 41% больных. Частота возникновения тромбоэмболических событий колеблется от 4 до 24%, наиболее часто возникают в относительно молодом возрасте. Не установлено, происходит ли это вследствие тромбообразования в межтрабекулярных щелях.
Диагностика
На ЭКГ определяются неспецифические изменения, могут быть синусовая тахикардия, признаки ГЛЖ, нарушения реполяризации, двухфазный Р, суправентрикулярные и желудочковые аритмии, а также признаки нарушения проводимости — блокада левой ножки пучка Гиса и AV-блокады.
Диагноз некомпактной кардиомиопатии ЛЖ устанавливают путем визуализации стенки желудочка и его полости с помощью двумерной трансторакальной эхоКГ и цветовой допплерографии, ангиографии ЛЖ, КТ или МРТ.
ЭхоКГ имеет центральное значение в диагностике некомпактной кардиомиопатии. При исследовании может определяться умеренная дилатация ЛЖ с нарушением систолической функции. При цветовом допплеровском исследовании подтверждаются потоки в щелях и соединение их с полостью желудочка.
Больных могут длительно наблюдать с диагнозом обструктивной гипертрофической или ДКМП.
Для диагностики некомпактной кардиомиопатии наиболее удобны диагностические критерии, предложенные R. Jenni и соавторами (2001), включающие:
1) сегментарное патологическое избыточное утолщение стенок желудочка с двухслойной структурой, состоящей из утолщенного внутреннего эндокардиального некомпактного слоя миокарда и тонкого компактного эпикардиального слоя миокарда (максимальное конечно-систолическое соотношение некомпактного/компактного миокарда ≥2 в парастернальной позиции по короткой оси) с характерной множественной избыточной трабекулярностью и глубокими межтрабекулярными щелями (рис. 13.3).
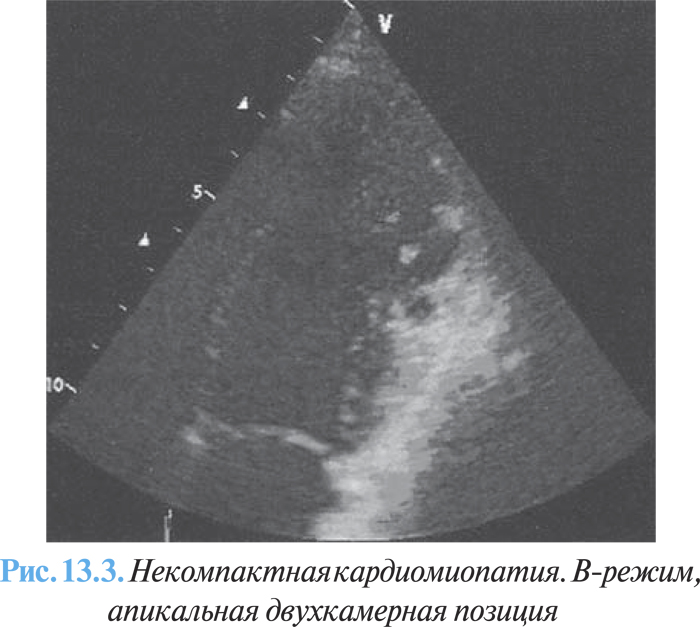
2) документированная перфузия глубоких межтрабекулярных щелей с помощью потока цветового допплера;
3) доминирующая локализация утолщения ЛЖ в апикальной, среднелатеральной и среднезадней зонах его стенки;
4) отсутствие сопутствующих аномалий сердца.
Клинический диагноз требует наличия всех четырех критериев.
МРТ и КТ имеют важное значение в диагностике некомпактной кардиомиопатии ЛЖ, для этих методов соотношение некомпактного/компактного миокарда должно превышать 2,3. Методы позволяют выявить большее количество сегментов ЛЖ, вовлеченных в патологический процесс (чувствительность 86%, специфичность 99%).
Лечение
Оптимальная концепция лечения некомпактной кардиомиопатии ЛЖ не разработана. Применяют стандартные подходы лечения СН, включая диуретики, ингибиторы АПФ, блокаторы β-адренорецепторов.
У больных с риском развития тромбоэмболии эффективно применение антикоагулянтов.
При тяжелой желудочковой аритмии решается вопрос об имплантации кардиовертеров-дефибрилляторов.
В прогрессирующей стадии заболевания и при выраженной систолической дисфункции ЛЖ важным подходом является пересадка сердца.
Прогноз
Прогноз определяют прогрессирующая СН и желудочковые аритмии.
ЛИТЕРАТУРА
- Дупляков Д.В. (2004) Шарообразное расширение верхушки левого желудочка или «takotsubo» кардиомиопатия. Кардиология, 44(1 1): 97-99.
- Хорикова Е.Н., Артемова Е.В., Остроумов Е.Н. и др. (2006) Диагностика ампульной кардиомиопатии с помощью томосцинтиграфии миокарда. РМЖ, 3: 5-8.
- Abe Y., Kondo M., Matsuoka R. (2003) Assessment of clinical features in transient apical ballooning. J. Am. Coll. Cardiol., 41: 737-742.
- Akashi Y.J., Barbaro G., Sakurai T. et al. (2007) Cardiac autonomic imbalance in patients with reversible ventricular dysfunction takotsubo cardiomyopathy. Quart. J. Med., 100(6): 335-343.
- Arora S., Alfayomi F., Srinivasan V. (2006) Transient left ventricular apical ballooning after cocaine use. Mayo Clin. Proc., 81(6): 732-735.
- Chandrasegaram M.D., Celermajer D.S., Wilson N.K. (2007) Apical ballooning syndrome complicated by acute severe mitral regurgitation with left ventricular outflow obstruction. J. Cardiothorac. Serg., 2: 14.
- Chun S.G., Kwok V., Pang D.K. et al. (2007) Transient left ventricular apical ballooning syndrome as a complication of permanent pacemaker implantation. J. Cardiol., 117(1): 27-30.
- Del Pace S., Salvadori K., Carrabba N. et al. (2007) Left ventricular apical ballooning syndrome as a novel cause of acute mitral regurgitation. J. Am. Coll. Cardiol., 50(7): 647-649.
- Elesber A.A., Prasad A., Bybee K.A. et al. (2006) Transient cardiac apical ballooning syndrome: prevalence and clinical implications of right ventricular involvement. J. Am. Coll. Cardiol., 47: 1082-1083.
- Elliott P., Andersson B., Arbustini E. et al. (2008) Classification of the cardiomyopathies: a position statement from the european society of cardiology working group on myocardial and pericardial diseases. Eur. Heat J, 29: 270-276.
- Galderisi M., Mondillo S. (2007) Echocardiography in clinical practice. One Way S.r.l., 120 p.
- Gianni M., Dentali F., Grandi A.M. et al. (2006) Apical ballooning syndrome or takotsubo cardiomyopathy: a systematic review. Eur. Heart J., 27: 1523-1529.
- Guevara R., Hazin M.I., McCord J. (2007) Takotsubo cardiomyopathy complicated with acute pericarditis and cardiogenic shock. J. Nat. Med. Assoc., 99(3): 281-283.
- Haghi D., Athanasiadis A., Papavassiliu T. et al. (2006) Right ventricular involvement in Takotsubo cardiomyopathy. Eur. Heart J., 27: 2433-2439.
- Haghi D., Papavassiliu T., Hamm K. et al. (2007) Coronary artery disease in takotsubo cardiomyopathy. Circ. J., 71(7): 1092-1094.
- Hoedemaekers Y.M., Caliskan K., Majoor-Krakauer D., et al. (2007) Cardiac β-myosin heavy chain defects in two families with non-compaction cardiomyopathy: linking non-compaction to hypertrophic, restrictive, and dilated cardiomyopathies. Eur Heart J., 28: 2732-2737.
- Jenni R., Oechslin E., Schneider J.,(2001). Echocardiographic and pathoanatomical characteristics of isolated left ventricular non-compaction: a step towards classification as a distinct cardiomyopathy. Heart, 86: 599-600.
- Maron B.J., Towbin J.A., Thiene G. et al. (2006) Contemporary definitions and classification of the cardiomyopathies: An American Heart Association Scientific Statement from the Council on Clinical Cardiology, Heart Failure and Transplantation Committee; Quality of Care and Outcomes Research and Functional Genomics and Translational Biology Interdisciplinary Working Groups; and Council on Epidemiology and Prevention. Circulation,113: 1807-1816.
- Mitchell J.H., Hadden T.B., Wilson J.M. et al. (2007) Clinical features of cardiac magnetic resonance imaging in assessing myocardial viability and prognosis in Tackotsubo cardiomyopathy. J. Cardiol., 100: 296-301.
- Mitsuma W., Kodama M., Ito M. et al. (2007) Serial electrocardiographic findings in women with Takotsubo cardiomyopathy. J. Cardiol., 100: 106-109.
- Murphy R.T., Thaman R., Blanes J.G., (2005) Natural history and familial characteristics of isolated left ventricular non-compaction. Eur. Heart J., 26: 187-192.
- Nanda S., Pamula J., Bhatt S.P. et al. (2007) Takotsubo cardiomyopathy — a new variant and widening disease spectrum. Int. J. Cardiol., 120: 34-36.
- Nef H.M., Molman H., Kostin S. et al. (2007) Takotsubo cardiomyopathy: intraindividual structural analysis in the acute phase and after structural recovery. Eur. Heart J., 28: 2456-2464.
- Sasaki O., Nishioka T., Akima T. et al. (2006) Association of takotsubo cardiomyopathy and long QT syndrome. Circ. J., 70(9): 1220-1222.
- Satoh H., Tateishi H., Uchida T. et al. (1990) Takotsubo-type cardiomyopathy due to multivessel spasm. In: Kodama K., Haze K., Hom M, eds. Clinical aspect of myocardial injury: from ischemia to heart failure [in Japanese]. Kagakuhyouronsya Co, Tokyo, 56-64.
- Tsushikashi K., Ueshima K., Uchida T. (2001) Transient left ventricular apical ballooning syndrome without coronary artery stenosis; a novel heart syndrome mimicking acute myocardial infarction. J. Am. Coll. Cardiol., 38(1): 11-18.
- Ueyama I., Ishikura F., Matsuda A. et al. (2007) Chronic estrogen supplementation improves stress induced cardiovascular responses. Circ. J., 71(4): 565-573.
- Weiford B.C., Subbarao V.D., Mulhern K.M. (2004) Non-compaction of the ventricular myocardium. Circulation, 109: 2965-2971.
- Wieneke H., Neumann T., Breuckmann F. et al. (2005) Non-compaction cardiomyopathy. Herz., 6: 571-574.
- Yoshida T., Hibino T., Kako N. et al. (2007) A pathophysyologic study of takotsubo cardiomyopathy with F-18 fluorodeoxyglucose positron emission tomography. Eur. Heart J., 21: 2598-2604.