Рестриктивная кардиомиопатия
Содержание
Рестриктивная кардиомиопатия — инфильтративное или фиброзное поражение миокарда, которое характеризуется ригидными, неподатливыми стенками желудочков, уменьшением наполнения и диастолического объема одного или обоих желудочков с нормальной или почти неизмененной систолической функцией и толщиной стенок.
В основе заболевания лежит распространенный интерстициальный фиброз.
Этиология
Множество врожденных или приобретенных заболеваний могут приводить к рестриктивной кардиомиопатии с вовлечением миокарда или эндокарда. Миокардиальные формы рестриктивной кардиомиопатии могут быть инфильтративными и неинфильтративными (табл. 11.1). Болезнь может быть идиопатической или связанной с другими инфильтративными, системными заболеваниями (амилоидоз, гемохроматоз, саркоидоз и др.). К менее распространенным причинам относят миокардит, трансплантацию сердца. Одной из идентифицированных причин рестриктивной кардиомиопатии является гиперэозинофилия. У больных с рестриктивной кардиомиопатией описаны миссенс-мутации в гене тропонина I.
Таблица 11.1
Причины рестриктивной кардиомиопатии
| Миокардиальная | Эндомиокардиальная | |
| Неинфильтративная | Инфильтративная | |
|
|
|
Патогенез
Ведущая роль в развитии рестриктивной кардиомиопатии принадлежит нарушениям иммунитета с гиперэозинофильным синдромом, на фоне которого вследствие инфильтрации дегранулированных форм эозинофильных гранулоцитов в эндомиокард формируются грубые морфологические нарушения структуры сердца. В патогенезе имеет значение дефицит Т-супрессоров, который приводит к гиперэозинофилии, дегрануляции эозинофильных гранулоцитов, что сопровождается выделением катионных белков, оказывающих токсическое действие на клеточные мембраны и ферменты, участвующие в дыхании митохондрий, а также тромбогенное действие на поврежденный миокард. Повреждающие факторы гранул эозинофильных гранулоцитов частично идентифицированы, включают нейротоксины, эозинофильный белок, имеющий основную реакцию, который, по-видимому, повреждает клетки. Нейтрофильные гранулоциты также могут оказывать повреждающее действие на миоциты. Недавно установлено, что ассоциированные с рестриктивной кардиомиопатией мутации в гене тропонина I вызывают избыточное накопление ионов Ca2+ в миофиламентах и недостаточное ингибирование Са2+-АТФазы, что приводит к ухудшению диастолической функции.
Патологическая анатомия
Размеры сердца небольшие, масса его составляет от 170 до 500 г. Характерно прогрессирующее утолщение (может достигать 1 см) пристеночного эндокарда, очень плотного на ощупь, состоящего из фиброзной ткани. Фиброз локализуется преимущественно в эндокарде верхушек обоих желудочков, задней стенки ЛЖ и задней створки митрального клапана, фиброз также может захватывать сосочковые мышцы и хорды, что приводит к нарушению функции клапанного аппарата и формированию порока сердца. В предсердиях и желудочках выявляют пристеночные тромбы. Перикард не изменен.
В развитии рестриктивной кардиомиопатии выделяют три морфологические стадии:
- некротическую — длится около 5 нед, характеризуется гиперэозинофилией, массивной дегенерацией и гибелью эозинофильных гранулоцитов, выраженной инфильтрацией эндокарда дегранулированными эозинофильными гранулоцитами, наличием миокардита в сочетании с артериитом;
- тромботическую — длится до 10 мес, характеризуется пристеночным внутриполостным тромбообразованием и нарушениями микроциркуляции в коронарном русле, обратным развитием инфильтрации миокарда и утолщением эндокарда;
- стадию фиброза — длится годами, характеризуется наряду с поражением париетального эндокарда поражением сосочковых мышц и клапанного аппарата, возникновением митральной и трикуспидальной недостаточности.
Фиброз может быть значительно выражен во внутренних слоях миокарда с последующим развитием гипертрофии и дилатации сердца, может носить очаговый или диффузный характер.
Характерна гистологическая картина: выявляются слои утолщенного эндокарда, под тромбами отмечаются слои коллагеновой ткани, под которой размещается грануляционная ткань с большим количеством кровеносных сосудов и воспалительной инфильтрацией, преимущественно эозинофильной. В эндокарде и миокарде могут быть очаги некроза, позднее — склеротическое утолщение эндокарда. Волокна миокарда ориентированы нормально, иногда гипертрофированы.
При инфильтративных заболеваниях происходит накопление амилоида (амилоидоз), гранулемы (саркоидоз), железа, преимущественно в саркоплазматическом ретикулуме (гемохроматоз) или гликогена в миокарде или интерстиции.
Патологическая физиология
Независимо от этиологических факторов при рестриктивной кардиомиопатии вследствие инфильтрации и фиброза эндокарда или миокарда увеличивается жесткость (или снижается податливость) миокарда одного или обоих желудочков, нарушается их диастолическое расслабление, что вызывает резкое повышение давления в желудочке при небольшом изменении объема, что изменяет кровенаполнение сердца. Обычно давление выше в ЛЖ по сравнению с правым, что может отражать сравнительно сниженную податливость первого по сравнению с последним.
Толщина стенок желудочков незначительно или умеренно увеличена. Заполнение ригидного ЛЖ происходит в основном в фазу быстрого наполнения, в то время как в фазу медленного наполнения и в систолу предсердия объем существенно не меняется.
Утолщение эндокарда или инфильтрация миокарда с потерей миоцитов, компенсаторной гипертрофией и фиброзом могут обусловить нарушение функции AV-клапана, приводя к митральной или трикуспидальной регургитации. Вовлечение узлов и проводящих путей вызывает дисфункцию синоатриального узла и блокады сердца различной степени. Основным гемодинамическим результатом наличия ригидных, неподатливых камер сердца является высокое давление наполнения ПЖ и ЛЖ, часто возникает легочная гипертензия. Нарушение систолической функции нехарактерно, однако может возникнуть, если компенсаторная гипертрофия становится неадекватной для поддержания сократительной функции инфильтрированных или фиброзных камер.
Классификация
В настоящее время в рамках идиопатической рестриктивной кардиомиопатии выделяют следующие заболевания:
- первичная идиопатическая рестриктивная кардиомиопатия;
- гиперэозинофильный синдром:
-
- эндомиокардиальный фиброз;
- эндокардит Леффлера;
- эндокардиальный фиброэластоз (у новорожденных и детей младшего возраста).
Обсуждается, что, возможно, эти заболевания имеют сходный патогенез или представляют собой разные стадии одного процесса.
Клиническая картина
Клинические симптомы тесно связаны с величиной давления в левом предсердии, необходимом для компенсации недостаточного наполнения желудочка. Это приводит к типичному нарушению толерантности к физической нагрузке в ранних стадиях и одышке в покое и симптомам низкого сердечного выброса (повышенная слабость) при дальнейшем развитии. Повышение ЧСС уменьшает время диастолы и уменьшает адекватное наполнение желудочков. Клинические симптомы зависят от типа поражения сердца: правожелудочкового, левожелудочкового или смешанного право- и левожелудочкового. Кардиалгический синдром и синкопальные состояния нехарактерны.
К наиболее характерным клиническим симптомам рестриктивной кардиомиопатии относят:
1. При поражении ПЖ:
- увеличение сердца с преобладанием гипертрофии и дилатации правых отделов, тяжелая правожелудочковая недостаточность;
- трехчленный ритм (ритм галопа), систолический шум недостаточности трехстворчатого клапана;
- повышение венозного давления, набухание яремных вен;
- увеличение печени;
- выраженные периферические отеки, асцит, анасарка.
2. При поражении ЛЖ:
- систолический шум;
- признаки левожелудочковой недостаточности;
- митральная недостаточность;
- увеличение размеров левого предсердия;
- застой в легких;
- гипертензия малого круга кровообращения.
3. При поражении обоих желудочков:
- тотальная СН.
4. Выпот в перикард, плевру.
5. Тяжелые нарушения ритма (фибрилляция предсердий, эктопические аритмии).
6. Тромбоэмболический синдром.
Диагностика
На ЭКГ при поражении ПЖ выявляются:
- синусовая тахикардия, аритмия, наиболее часто — фибрилляция предсердий;
- блокада правой ножки пучка Гиса;
- снижение вольтажа комплекса QRS;
- патологический зубец Q в отведениях V1–2;
- снижение сегмента ST, инверсия зубца Т;
- высокий зубец Р.
На ЭКГ при поражении ЛЖ выявляются:
- синусовая тахикардия;
- признаки гипертрофии левого предсердия и ЛЖ;
- блокада левой ножки пучка Гиса;
- наджелудочковые аритмии.
Фибрилляция предсердий часто возникает вследствие дилатации предсердия. Желудочковые аритмии или поперечная блокада часто развиваются в тяжелых случаях и часто являются причиной смерти.
При рентгенологическом исследовании больных с поражением ПЖ выявляются значительное увеличение размеров правого предсердия, малая амплитуда зубцов рентгенокимограммы ПЖ на фоне отсутствия признаков застоя в легких. При поражении ЛЖ увеличено левое предсердие, вблизи верхушки сердца и в области пути оттока определяется линейная тень кальцификации, в легких — характерная картина смешанного застоя.
ЭхоКГ-исследование является основным в диагностике заболевания, могут выявляться следующие признаки:
- систолическая функция в начальной стадии не нарушена;
- дилатация предсердий (рис. 11.1);
- парадоксальное движение межжелудочковой перегородки;
- гипертрофия миокарда чаще отсутствует;
- утолщение эндокарда;
- уменьшение полости пораженного желудочка (или обоих желудочков);
- пансистолическое пролабирование задней створки митрального клапана;
- функциональная митральная регургитация вследствие инфильтрации миокарда и сосочковых мышц или утолщения эндокарда;
- увеличение скорости потока трикуспидальной регургитации;
- укорочение времени изоволюмического расслабления;
- увеличение пика раннего наполнения;
- уменьшение пика позднего предсердного наполнения желудочков;
- расширение пути оттока из ПЖ и увеличение правого предсердия при поражении ПЖ;
- изменение кровотока в легочной вене.
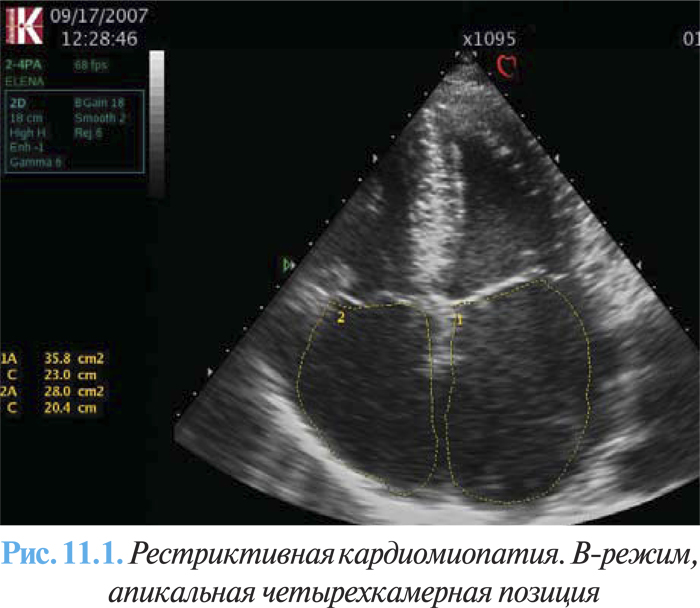
Могут визуализироваться внутриполостные тромбы. В конечной стадии заболевания может также нарушаться систолическая функция сердца.
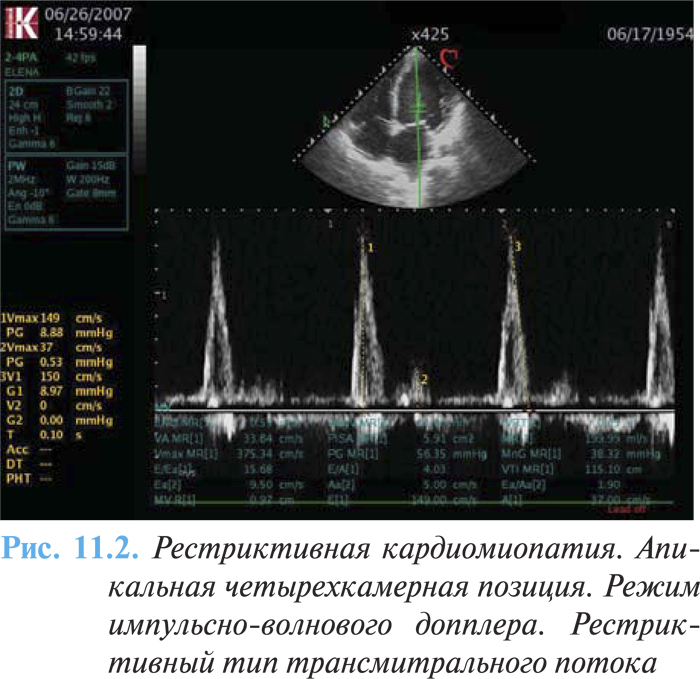
С помощью допплерографии возможно проведение детализированного эхоКГ-анализа диастолической функции. Импульсно-волновой режим допплеровского исследования трансмитрального потока показывает рестриктивный тип диастолической дисфункции, увеличение соотношения максимальной скорости потока раннего наполнения (Е) к позднему (А) >2 (рис. 11.2), укорочения времени замедления раннего диастолического потока на митральном клапане <150 мс (в норме 150–220 мс), а также уменьшение времени изоволюметрического расслабления <60 мс (в норме 60–100 мс).
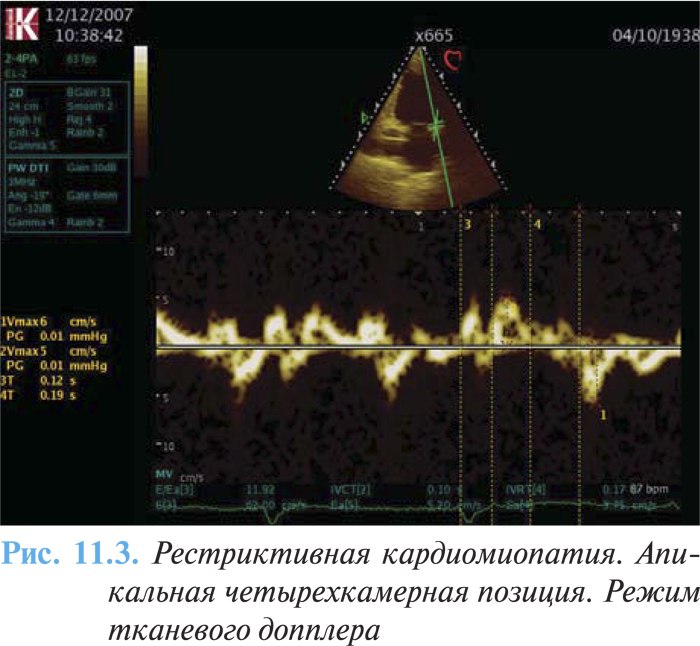
При дифференциальном диагнозе с констриктивным перикардитом центральную роль играет тканевая допплерография (рис. 11.3). Значительное снижение скорости движения медиального митрального кольца в раннюю (Еа) и позднюю (Аа) диастолу является признаком тяжелой рестрикции. При величине Еа ≥8,0 см/с можно с высокой точностью (чувствительность 95% и специфичность 96%) установить диагноз констриктивного перикардита.
Методом МРТ и КТ можно выявить нарушение наполнения в ранних и далеко зашедших стадиях рестриктивной кардиомиопатии, что совпадает с данными эхоКГ.
Для подтверждения диагноза золотым стандартом является подтверждение рестриктивного наполнения при помощи комбинированной катетеризации ЛЖ и ПЖ.
Кривая давления в желудочках характерно изменена: в начале диастолы давление в желудочке снижается, а затем быстро повышается и достигает плато, оставаясь неизменным в середине и конце диастолы, имеет вид «диастолического западения и плато» (вид квадратного корня), конечно-диастолическое давление в ЛЖ обычно на несколько миллиметров ртутного столба выше, чем в ПЖ, определяется легочная гипертензия.
Рестриктивная гемодинамика является абсолютным критерием диагноза рестриктивной кардиомиопатии.
Верифицирующим методом диагностики является эндомиокардиальная биопсия. На ранней стадии заболевания выявляют характерные эозинофильные инфильтрации, в дальнейшем — интерстициальный фиброз и утолщение эндокарда, фиброз миокарда.
При дифференциальной диагностике рестриктивной кардиомиопатии с констриктивным перикардитом определенное диагностическое значение имеет определение уровня МНУП, который в среднем повышается до 756 пг/мл при рестриктивной кардиомиопатии против 143 пг/мл при констриктивном перикардите (в норме <100 пг/мл).
Диагностика рестриктивной кардиомиопатии затрудняется ввиду разнообразия клинических вариантов застойного симптомокомплекса и отсутствия кардиомегалии.
Следует отметить, что ввиду отсутствия патогномоничных признаков, в том числе морфологических, диагноз «идиопатическая рестриктивная кардиомиопатия» устанавливают только после исключения инфильтративных и системных заболеваний миокарда.
Лечение
Терапия для большинства пациентов не разработана, в основном симптоматическая. Для некоторых форм рестриктивной кардиомиопатии (амилоидоз, гемохроматоз) существует специфическая терапия. В ранних стадиях заболевания назначают ГКС. В более поздних стадиях лечение в основном сводится к устранению симптомов застойной СН, которая является ведущим проявлением рестриктивной кардиомиопатии. Диуретики уменьшают симптомы застоя, однако их назначают с осторожностью из-за способности снижать преднагрузку, с помощью которой ригидные желудочки поддерживают сердечный выброс. Обычно лечение начинают с тиазидных диуретиков 1–2 раза в неделю, затем применяют петлевые диуретики. Ингибиторы АПФ могут улучшать функцию ЛЖ. Вазодилататоры, снижающие постнагрузку, могут вызвать артериальную гипотензию и их обычно не применяют.
Симптомы ишемии являются предвестниками внезапной смерти, необходимо применение блокаторов β-адренорецепторов.
Сердечные гликозиды помогают при наличии фибрилляции предсердий снизить ЧСС и удлинить диастолическое наполнение. Препараты наперстянки помогают несколько уменьшить нарушения гемодинамики, однако при отсутствии дилатации и сохраненной систолической функции ЛЖ при синусовом ритме применение сердечных гликозидов не оправдано.
β1-адреномиметики и ингибиторы ФДЭ увеличивают инотропную функцию сердца и улучшают его диастолическую функцию, однако препараты не рекомендуется применять длительно (повышают смертность), их назначают лишь в тяжелых случаях для краткосрочного лечения.
В некоторых случаях, если значительно выражена компенсаторная гипертрофия миокарда, могут быть применены блокаторы кальциевых каналов.
Для лечения тромбоэмболических осложнений используют непрямые антикоагулянты.
Единственным радикальным методом лечения рестриктивной кардиомиопатии является трансплантация сердца. Иногда эффективна резекция эндокарда с протезированием или пластикой митрального и трехстворчатого клапанов, однако это сопряжено с высокой летальностью (15–25%).
Прогноз
Прогноз неблагоприятный, заболевание с прогредиентным течением, смертность составляет 70% в течение первых 5 лет. Увеличение толщины стенки ЛЖ и уменьшение амплитуды комплекса QRS являются неблагоприятными прогностическими признаками.
ПЕРВИЧНАЯ ИДИОПАТИЧЕСКАЯ РЕСТРИКТИВНАЯ КАРДИОМИОПАТИЯ
Редкая форма неинфильтративного заболевания миокарда с диастолической дисфункцией по рестриктивному типу. Характерно отсутствие ГЛЖ и систолической дисфункции. Часто передается по наследству и ассоциируется со скелетной миопатией. Обычно болезнь возникает спорадически, но может наследоваться по аутосомно-доминантному типу.
Возникновение ригидного желудочка может быть следствием патологии миоцитов, включая нарушение кальциевого обмена, аккумуляцию десмина (компонента цитоскелета), нарушение структуры миофибрилл, а также патологию экстрацеллюлярного матрикса, включая пролиферацию коллагеновых волокон и эластических элементов.
Среди клинических проявлений наиболее часты симптомы застойной СН, повышение венозного давления, признаки митральной и трикуспидальной регургитации.
Для установления диагноза проводят катетеризацию полостей сердца и/или эхоКГ-исследование и эндомиокардиальную биопсию. При эхоКГ определяются увеличение предсердий и отсутствие дилатации желудочков с почти нормальной систолической функцией и рестриктивный тип диастолической дисфункции при допплеровской эхоКГ. Для установления диагноза важно наличие снижения давления наполнения при катетеризации сердца. Эндомиокардиальную биопсию проводят для оценки гипертрофии миоцитов и интерстициального фиброза.
У больных с прогрессирующей СН, плохо поддающейся медикаментозному лечению, и полной блокадой сердца необходима установка кардиостимулятора.
Предикторами плохого прогноза являются старший возраст, мужской пол, увеличение левого предсердия, высокий ФК заболевания. У больных с тяжелым течением и ФВ в пределах 40–55% необходима трансплантация сердца, при этом на прогноз оказывает влияние наличие сопутствующей скелетной миопатии.
ГИПЕРЭОЗИНОФИЛЬНЫЙ СИНДРОМ
Имеет две формы: эндомиокардиальный фиброз и эндокардит Леффлера. Общим является патологическая эозинофилия в крови и эндокарде, которая вызывает рестриктивную кардиомиопатию с фиброзным утолщением эндокарда в области верхушки и подклапанных структур, вызывая нарушение наполнения желудочка. Причина гиперэозинофилии не установлена, может быть связана с паразитарными и протозойными инфекциями, малигнизацией (лейкемия) или аллергическими, или аутоиммунными реакциями.
Ранее считалось, что это различные формы одного заболевания, которые возникают вследствие повреждения тканей из-за токсического эффекта эозинофилов и имеют сходные патологические изменения при продвинутых стадиях. Однако существуют важные различия.
Эндомиокардиальный фиброз
Это эндемичное для экваториальных стран заболевание (Уганда, Нигерия, Бразилия) и редко развивается в нетропических странах. Заболевание возникает обычно в молодом возрасте одинаково часто у мужчин и женщин и приводит к смерти в течение 1 года–4 лет с момента появления первых симптомов.
Эндомиокардиальный фиброз характеризуется значимым утолщением и рубцеванием эндокарда, приводящим к облитерации полости желудочка. Пристеночный тромбоз и системные эмболы могут вызвать еще большее уменьшение объемов полостей желудочков. Часто в процесс вовлекается и субэндокардиальный миокард. Эндомиокардиальный фиброз вовлекает оба желудочка в 50% случаев, ЛЖ — в 40%, ПЖ — в 10%, его отмечают в трех различных областях: верхушке ЛЖ или ПЖ и субклапанном пространстве. Обычно ПЖ становится более облитерированным, чем ЛЖ.
Микроскопически в эндокарде выявляют толстый коллагеновый слой поверх соединительной ткани с грануляциями, достигающими миокарда. Митральный и трехстворчатый клапаны могут фиброзироваться, вследствие чего возникает клапанная регургитация.
Клиника эндомиокардиального фиброза зависит от того, какой желудочек вовлечен в патологический процесс. При левостороннем поражении превалирует застой в легких, при правостороннем — симптомы правожелудочковой СН. Часто возникает митральная и трикуспидальная регургитация, у 25% — фибрилляция предсердий, особенно при поражении ПЖ. У больных также часто выявляют эмболии, выпот в плевральную и перикардиальную полость.
При эхоКГ-исследовании определяется облитерация верхушек желудочков и гиперкинез базальных отделов, дилатация предсердий, при левостороннем поражении — снижение подвижности задней створки митрального клапана, при допплеровской эхоКГ — признаки митральной и трикуспидальной регургитации, рестриктивный тип наполнения желудочков.
Катетеризация сердца подтверждает рестриктивный тип гемодинамики.
При эндомиокардиальной биопсии выявляют эозинофильные инфильтраты, что подтверждает диагноз.
Общий прогноз неблагоприятный, показано паллиативное лечение — хирургическая резекция фиброзного эндокарда и замена клапана, которое может улучшить симптомы, хотя интраоперационная смертность составляет 15–25%. У больных с тяжелым течением 2-летняя смертность составляет 35–50%.
Эндокардит Леффлера
Болезнь жарких стран, спорадически возникает во всем мире. Чаще болеют мужчины в возрасте до 50 лет.
Заболевание начинается как острый артериит с эозинофилией, формированием тромбов на эндокарде, хордах и прогрессированием фиброза AV-клапана. Причина эозинофилии не установлена, может быть вызвана лейкемией или вторично возникать вследствие паразитарной инвазии. Эозинофильные гранулоциты накапливаются в миокарде, вызывая его повреждение. Пристеночный тромбоз и системные эмболы могут вызвать еще большее уменьшение объемов полостей желудочков.
Клинические проявления включают уменьшение массы тела, лихорадку, кашель, кожную сыпь, цианоз, тяжелую право- и левожелудочковую СН, системную тромбоэмболию, повышение давления в правом предсердии.
В крови выявляют гиперэозинофилию.
На ЭКГ — неспецифические изменения, инверсия зубцов Т.
На рентгенограмме определяется увеличение размеров сердца.
При эхоКГ часто определяется муральный тромбоз, облитерация верхушки и неподвижность задней створки митрального клапана с признаками митральной регургитации. Систолическая функция ЛЖ часто сохранена. У больных в фиброзной фазе при допплерографии регистрируется рестриктивный тип наполнения желудочков. Трансэзофагеальную эхоКГ обычно проводят для оценки диастолической функции.
Катетеризация сердца выявляет снижение податливости ЛЖ вследствие плотного рубца, митральную и трикуспидальную регургитацию.
Эндомиокардиальная биопсия необходима для подтверждения диагноза, хотя трудно получить адекватный образец ткани.
Лечение зависит от стадии болезни. На ранней стадии применяют ГКС для лечения миокардита, ассоциированного с гиперэозинофилией. Интерферон использовали у ограниченного количества больных с многообещающими результатами.
Стандартная поддерживающая терапия СН включает дигоксин, диуретики, снижение постнагрузки, антикоагулянты.
Хирургическое вмешательство проводят в стадии фиброза, оно включает удаление фиброзных бляшек с поверхности эндокарда, замену клапана, имплантацию кардиостимулятора.
ЛИТЕРАТУРА
- Коваленко В.Н., Несукай Е.Г. (2001) Некоронарогенные болезни сердца. Практ. руководство. Морион, Киев, 480 с.
- Моисеев С.В. (1998) Инфильтративные поражения сердца. Рестриктивная кардиомиопатия. Фарма Пресс, Москва, 144 с.
- Шиллер Н., Осипов М.А. (2005) Клиническая эхокардиография. 2-е изд. Практика, Москва, 344 с.
- Ammash N.M., Seward J.B., Bailey K.R. et al. (2000) Clinical profile and outcome of idiopathic restrictive cardiomyopathy. Circulation, 101: 2490-2496.
- Angelini A., Calzolari V., Thiene G. et al. (1997) Morphologic spectrum of primary restrictive cardiomyopathy. Amer. J. Cardiol., 80: 1046-1050.
- Artz G., Wynne J. (2000) Restrictive cardiomyopathy. Curr. Treat. Options. Cardiovasc. Med., 2: 431-438.
- Bennett M.J., Hale D.E., Pollitt R.J. et al. (1996) Endocardial fibroelastosis and primary carnitine deficiency due to a defect in the plasma membrane carnitine transporter. Clin. Cardiol., 19: 243-246.
- Berensztein C.S., Pineiro D., Marcotegui M. et al. (2000) Usefulness of echocardiography and Doppler echocardiography in endomyocardial fibrosis. J. Amer. Soc. Echocardiogr., 13: 385-392.
- Braunwald E., Zipes D.P., Libby P. (Eds) (2001) Heart disease: a textbook of cardiovascular medicine. 6th ed. W.B.Saunders Company. Vol.1, 1232 p.
- Celletti F., Fattori R., Napoli G. et al. (1999) Assessment of restrictive cardiomyopathy of amyloid or idiopathic etiology by magnetic resonance imaging. Amer. J. Cardiol., 83: 798-801.
- Cooper L.T., Baughman K.L., Feldman A.M. et al.(2007) The role of endomyocardial biopsy in the management of cardiovascular disease. Eur. Heart J., 28: 3076-3093.
- Elliott P., Andersson B., Arbustini E. et al. (2008) Classification of the cardiomyopathies: a position statement from the european society of cardiology working group on myocardial and pericardial diseases. Eur. Heart J., 29: 270-276.
- Galderisi M., Mondillo S. (2007) Echocardiography in clinical practice. One Way S.r.l., 120 p.
- Garcia-Pascual J., Gonzalez-Gallarza R.D., Jimenez M.P. et al. (2000) Loffler’s syndrome: pulmonary vein and transmitral Doppler flow analysis by transesophageal echocardiography — report of a case. J Amer. Soc. Echocardiogr., 13: 690-692.
- Ha J.W., Ommen S.R., Tajik A.J. et al. (2004) Differentiation of constrictive pericarditis from restrictive cardiomyopathy using mitral annular velocity by tissue Doppler echocardiography. Amer. J. Cardiol., 94: 316-319.
- Hirota Y. (1995) Restrictive cardiomyopathy, cardiac amyloidosis and hypereosinophilic heart disease. In: Abelmann W.H., Braunwald E. (Eds). Cardiomyopathies, myocarditis, and pericardial disease. Atlas of heart diseases. Current Medicine, Philadelphia, p. 5.1-5.15.
- Katz A.M. (2006) Physiology of the heart. 4th ed., Williams&Wilkins, Lippincot, 644 p.
- Kushawa S.S., Fallon J.T., Fuster V. (1997) Restrictive cardiomyopathy. N. Engl. J. Med., 336: 267-276.
- Leung D.Y., Klein A.L. (1997) Restrictive cardiomyopathy: diagnosis and prognostic implications. In: Otto C.M. (Ed.). The practice of clinical echocardiography. WB Saunders, Philadelphia, p. 473-493.
- Leya F.S., Arab D., Joyal D. et al. (2005) The efficacy of brain natriuretic peptide levels in differentiating constrictive pericarditis from restrictive cardiomyopathy. J. Amer. Coll. Cardiol., 45: 1900-1902.
- Maron B.J., Towbin J.A., Thiene G. et al. (2006) Contemporary definitions and classification of the cardiomyopathies: An American Heart Association Scientific Statement from the Council on Clinical Cardiology, Heart Failure and Transplantation Committee; Quality of Care and Outcomes Research and Functional Genomics and Translational Biology Interdisciplinary Working Groups; and Council on Epidemiology and Prevention. Circulation, 113: 1807-1816.
- Mogensen J., Kubo T., Duque M. et al. (2003) Idiopatic restrictive cardiomyopathy is part of the clinical expression of cardiac troponin I mutations. J. Clin. Invest., 111: 209-216.
- Ommen S.R., Seward J.B., Tajik A.J. (2000) Clinical and echocardiographic features of hypereosinophilic syndromes. Amer. J. Cardiol., 86: 110-113.
- Rivenes S.M., Kearney D.L., Smith E.O. et al. (1992) Sudden death and cardiovascular collapse in children with restrictive cardiomyopathy. Circulation., 102: 876-882.
- Soler R., Rodriguez E., Remuinan C. et al. (2003) Magnetic resonance imaging of primary cardiomyopathies. J. Comput. Assist. Tomogr., 27: 724-734.
- Spyrou N., Foale R. (1994) Restrictive cardiomyopathies. Curr. Opin. Cardiol., 9: 344-348.
- Topol E.J. (Ed.) (2007) Textbook of cardiovascular medicine. 3th ed. Williams & Wilkins, Lippincott, 1628 р.
- Valiathan M.S. (1993) Endomyocardial fibrosis. Natl. Med. J. India., 6: 212-216.
- Wachter R., Pieske B. (2005) Restrictive kardiomyopathie. Herz, 6: 558-564.
- Weller P.F., Bubley G.J. (1994) The idiopathic hypereosinophilic syndrome. Blood, 83: 2759-2779.