Гипертрофическая кардиомиопатия — первичное поражение миокарда, обусловленное генетической неполноценностью сократительных белков, характеризуется ГЛЖ при отсутствии сердечной или системной причины.
Эпидемиология
Широко распространена среди многих расовых групп и в странах Европы, США, Канаде, Израиле, Южной Америке и Дальнем Востоке. В общей популяции ее распространенность составляет 0,2% и наблюдается преимущественно у мужчин.
Этиология
В настоящее время многочисленные исследования подтвердили роль генетических нарушений в развитии ГКМП. Причиной болезни являются различные мутации генов, кодирующих саркомерные протеины, что позволяет определить заболевание как нарушение контрактильного аппарата миоцита. У большинства пациентов заболевание наследуется по аутосомно-доминантному типу, приблизительно у 50–60% больных выявляют мутации в одном из восьми генов, которые кодируют различные компоненты сердечного саркомера и ассоциированных белков: тяжелой цепи β-миозина (14-я хромосома), сердечного тропонина-Т (1-я хромосома), сердечного тропонина-I (19-я хромосома), α-тропомиозина (15-я хромосома), сердечного миозинсвязывающего протеина С (11-я хромосома), эссенциальной и регуляторной легких цепей миозина (3-я и 12-я хромосомы соответственно), а также сердечного актина (15-я хромосома). В последнее время также выявлены мутации трех других генов саркомерных протеинов: титина, тропонина С и тяжелой цепи α-миозина.
В возникновении заболевания может также иметь значение нарушение взаимодействия развивающегося сердца плода с катехоламинами, тиреоидными гормонами, соматотропином, аденозином.
Распространенность и локализация гипертрофии значительно варьирует, даже среди родственников. Одинаковая мутация может привести к тяжелой гипертрофии желудочка у одного члена семьи и умеренной гипертрофии у другого. Причины этих фенотипических различий у лиц с идентичной генетической мутацией не совсем понятны, но могут быть следствием других генетических факторов, которые играют роль в экспрессии гипертрофии сердца, таких как DD-генотип АПФ, НУП и другие детерминанты роста миоцитов.
Патогенез
К основным патогенетическим факторам ГКМП относятся снижение эластичности и сократительной способности гипертрофированного миокарда ЛЖ с ухудшением его диастолического наполнения, в результате чего в пересчете на единицу массы миокарда работа сердца существенно уменьшается, коронарный кровоток не соответствует степени гипертрофии миокарда. Нарушается скорость проведения возбуждения в желудочках с асинхронным сокращением различных отделов миокарда, что снижает пропульсивную способность ЛЖ.
В результате диастолической дисфункции возникает хроническое повышение конечно-диастолического давления ЛЖ, давления заклинивания капилляров ЛА, застой в легких, прогрессирующая гипертрофия предсердий. Систолическая функция не нарушена или даже усилена вследствие гипердинамичности ЛЖ (ФВ достигает 80–90%), при этом КДО уменьшен (нередко <100 мл, иногда даже <70 мл).
Патологическая анатомия
Заболевание характеризуется гипертрофией миокарда, наиболее часто в области межжелудочковой перегородки, дезорганизацией кардиомиоцитов и миофибрилл, фиброзом миокарда и поражением мелких сосудов.
Макроскопически различают три варианта ГКМП: асимметричная (60–95%) — изолированная гипертрофия межжелудочковой перегородки (изолированный гипертрофический субаортальный стеноз); гипертрофия различных отделов ЛЖ, чаще апикальной части (рис. 10.1); симметричная — тотальная концентрическая гипертрофия (5%) (рис. 10.2).
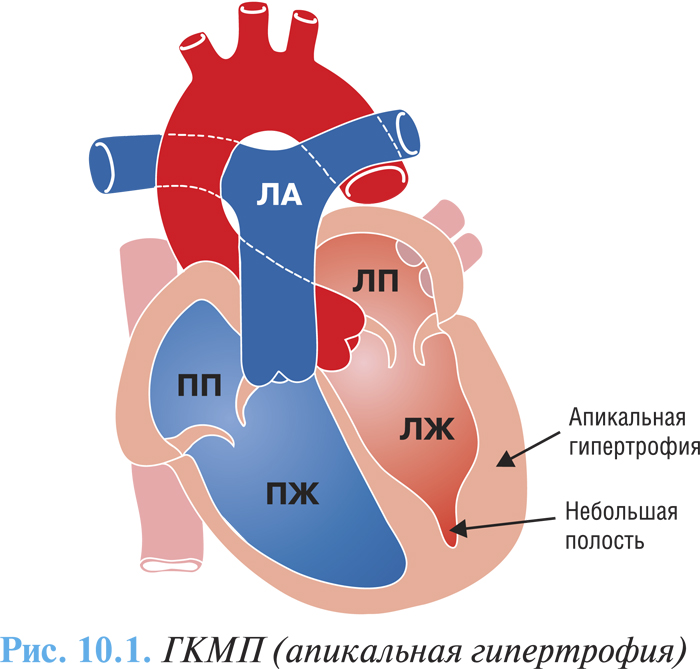
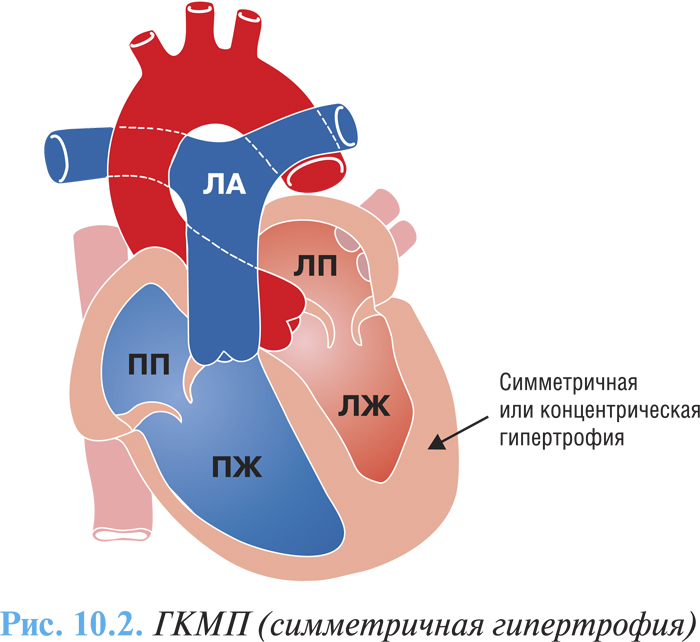
У 25% больных отмечают обструкцию выносящего тракта ЛЖ в покое. Равномерная концентрическая гипертрофия миокарда сопровождается значительным увеличением массы сердца, но обструкции желудочков не наблюдается. ПЖ вовлекается в патологический процесс примерно в 50% случаев, что значительно усугубляет течение заболевания.
В зависимости от выраженности утолщения миокарда выделяют три степени гипертрофии: умеренная (15–20 мм), средней степени (21–25 мм), выраженная гипертрофия (>25 мм).
Характерным анатомическим признаком ГКМП является структурное изменение митрального клапана, передняя створка которого расположена под углом к плоскости клапана, утолщена и «выпадает» в просвет выносящего тракта ЛЖ, образуя дополнительное препятствие кровотоку. Полость ЛЖ небольших размеров, левое предсердие часто гипертрофировано и дилатировано.
Типичные патогистологические изменения включают гипертрофию кардиомиоцитов и нарушение взаимной ориентации мышечных волокон (как наиболее частый результат мутаций саркомеров), а также очаги фиброза и рубцовые изменения вследствие некроза миокарда. Волокна размещаются короткими рядами, имеют склонность к закручиванию при отсутствии изменений интрамуральных сосудов. Ядра клеток изменены, имеют уродливую форму, часто окружены светлой зоной («перинуклеарным нимбом»), в которой отмечается накопление гликогена.
Классификация
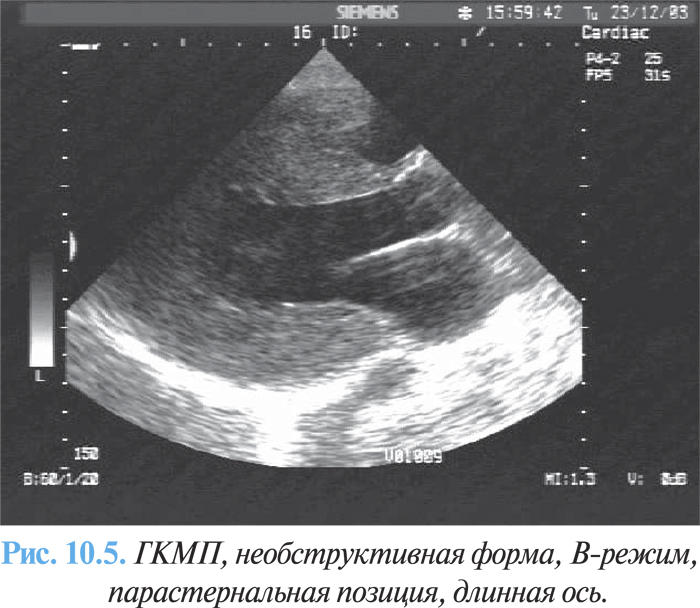
В зависимости от степени выраженности преграды оттоку крови выделяют две основные формы ГКМП: обструктивная (рубрика I42.1 по МКБ-10), характеризуется наличием градиента давления между полостью ЛЖ и аортой (рис. 10.3) и необструктивная (рубрика I42.2 по МКБ-10) — без градиента давления (рис. 10.4)
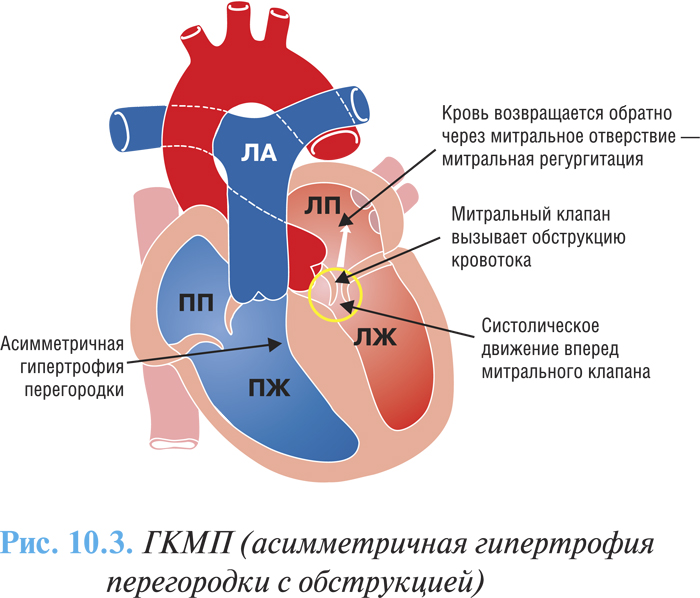
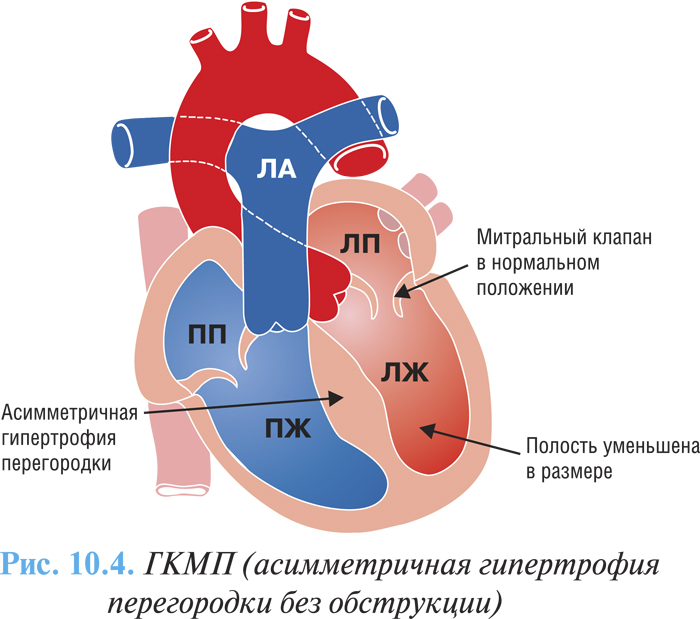
Клиническая картина
Степень обструкции и гипертрофии ЛЖ не коррелирует с наличием клинических симптомов. Заболевание может быть полностью бессимптомным или манифестировать в любом возрасте, наиболее часто симптомы проявляются у 40–50-летних пациентов.
Классическая триада симптомов включает боль в сердце, одышку при нагрузке и синкопальные состояния. Болевые ощущения в грудной клетке отмечают у 75% больных, классическую стенокардию напряжения — у 25%. У многих больных отмечается послеобеденная стенокардия. Обмороки чаще всего возникают у больных молодого возраста. В некоторых случаях внезапная смерть может быть первым проявлением заболевания, наступает с частотой приблизительно 1% в год.
При необструктивной форме отклонений от нормы при физикальном обследовании может не быть, но иногда определяются увеличение продолжительности верхушечного толчка, аускультативно IV тон сердца.
При обструктивной форме при физикальном обследовании выявляется пульсация сонных артерий, быстрый «отрывистый» пульс при пальпации сонных артерий; усиленный продолжительный верхушечный толчок, занимающий всю систолу вплоть до II тона.
Аускультативно тоны сердца глухие, выявляется IV тон, а также определяется систолический шум (crescendo-diminuendo), который не проводится или слабо проводится на сонные артерии и в область спины, усиливается при уменьшении наполнения сердца и снижении ОПСС (вставание из положения сидя на корточках, натуживание, прием нитроглицерина) и ослабевает при увеличении наполнения сердца, повышении ОПСС (в положении лежа, сидя на корточках, при сжимании кулаков).
Течение ГКМП медленно прогрессирующее, тяжесть его зависит от локализации и степени гипертрофии миокарда в зоне утолщения, а также от обструкции выносящего тракта ЛЖ.
Усугубляют течение заболевания серьезные осложнения. Внезапную смерть регистрируют у 2–4% взрослых и 4–6% детей. Другими осложнениями являются предсердные аритмии, тромбоэмболии, инфекционный эндокардит (5–9%) и застойная СН (10–15%).
Диагностика
Изменения на ЭКГ выявляют у 95% больных. Наиболее частыми из них являются увеличение левого предсердия, нарушения реполяризации ЛЖ в виде депрессии сегмента ST и инверсии зубца Т и патологические зубцы Q (25–30%), признаки гипертрофии ЛЖ. При апикальной гипертрофии возможны глубокие «гигантские» (до 4 см) симметричные отрицательные зубцы Т. Суточное мониторирование ЭКГ позволяет выявить нарушения ритма сердца: желудочковые экстрасистолы (88%), пароксизмы желудочковой тахикардии (25–30%), суправентрикулярные тахиаритмии (30–40%), а также нарушения проводимости.
Рентгенологическую картину во многом определяет степень выраженности заболевания. Возможны следующие рентгенологические изменения: в первой косой проекции появляется выбухание ЛЖ, обусловленное гипертрофией путей оттока, отсутствие талии сердца и закругления дуг, расширение левого предсердия.
ЭхоКГ является методом выбора и позволяет выявить гипертрофию ЛЖ — утолщение стенки >1,5 мм в диастолу (рис. 10.5), без увеличения его полости, увеличение левого предсердия, нарушение диастолической функции при допплеровской эхоКГ.
По данным эхоКГ-исследования в М-режиме наиболее часто можно выявить асимметричный характер гипертрофии перегородки, систолическое переднее движение митрального клапана, небольшой размер полости ЛЖ, уменьшение подвижности перегородки и преждевременное закрытие аортального клапана.
При двухмерном изображении определяются различные варианты локализации гипертрофии миокарда. Систолическая функция обычно не нарушена, ФВ увеличена (часто >80%).
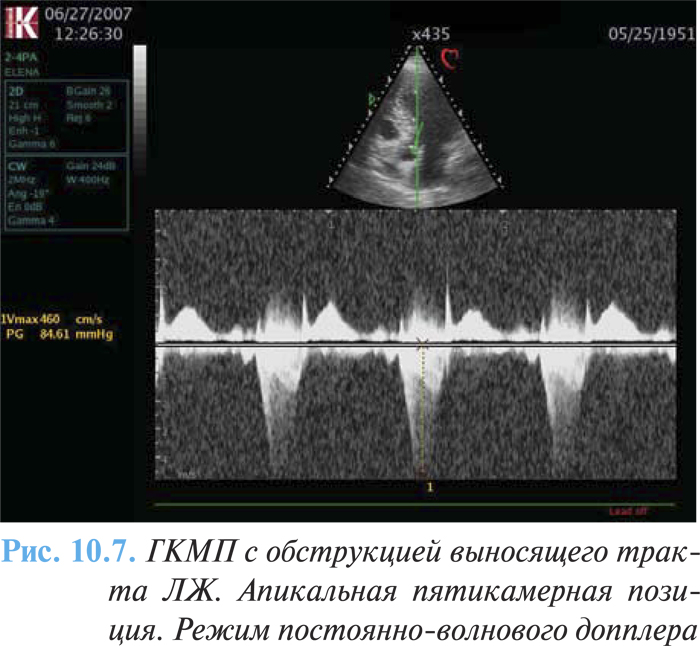
Приблизительно у 25% больных отмечают градиент давления между полостью и выносящим трактом ЛЖ в покое. Хотя клиническое значение градиента выносящего тракта у больных с ГКМП интенсивно обсуждается многие годы, этот градиент в настоящее время рассматривается как показатель истинной обструкции выброса ЛЖ. Принято соглашение, по которому обструкция выносящего тракта ЛЖ определяется при наличии градиента не менее 30 мм рт. ст. (Maron B.J. et al., 2003). Обструкция клинически важна (от средней степени до тяжелой) только в случаях, если градиент выносящего тракта составляет >50 мм рт.ст.
В зависимости от величины градиента давления согласно классификации NYHA выделяют следующие стадии заболевания:
I стадия — градиент давления до 25 мм рт. ст., как правило, жалоб больные не предъявляют;
II стадия — градиент давления до 36 мм рт. ст., самочувствие ухудшается при физической нагрузке;
III стадия — градиент давления до 44 мм рт. ст., выражены клинические симптомы — стенокардия, одышка и нарушения гемодинамики;
IV стадия — градиент давления 80 мм рт. ст. и выше, имеются значительные нарушения гемодинамики.
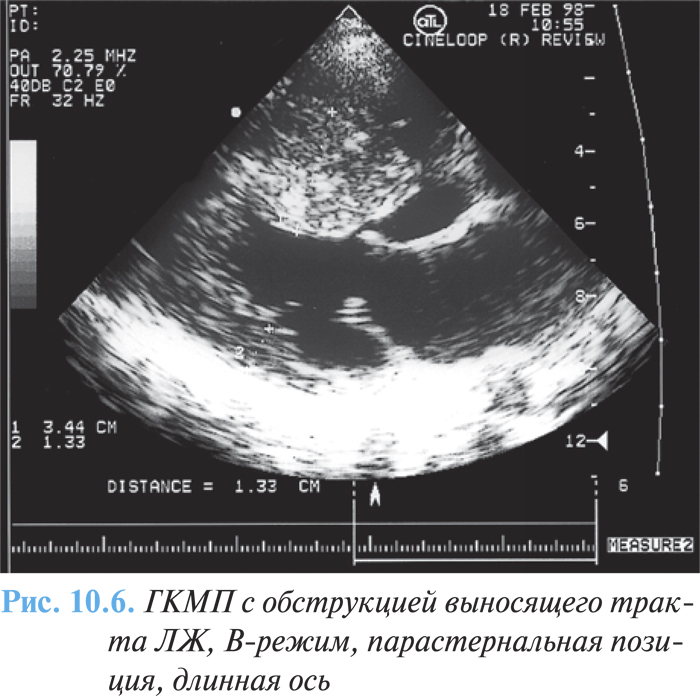
При проксимальной форме ГКМП (субаортальном стенозе) наиболее характерными эхоКГ-признаками являются утолщение межжелудочковой перегородки и снижение ее экскурсии в базальном сегменте, увеличение соотношения толщины межжелудочковой перегородки и задней стенки более 1,3 (1,5–2) (рис. 10.6), наличие градиента давления при допплеровской эхоКГ (рис. 10.7).
Для дистальной формы (апикальной ГКМП) при эхоКГ-исследовании наиболее характерно утолщение и уменьшение амплитуды движения межжелудочковой перегородки в верхушечном сегменте по длинной оси в двухмерном изображении, полость ЛЖ в левой апикальной четырехкамерной позиции пикообразной формы за счет гипертрофии дистальных отделов межжелудочковой перегородки и прилегающих отделов задней стенки ЛЖ.
Концентрическая (симметричная) форма характеризуется утолщением межжелудочковой перегородки и задней стенки ЛЖ в диастолу при значительном увеличении общей массы миокарда, уменьшением систолического и диастолического объемов ЛЖ, повышением индекса соотношения размеров левого предсердия и устья аорты.
Изолированная гипертрофия ПЖ при эхоКГ-исследовании имеет следующие признаки: увеличение диастолической толщины и уменьшение амплитуды движения межжелудочковой перегородки в верхушечном сегменте, утолщение передней стенки и уменьшение диастолического размера ПЖ.
При биопсии миокарда выявляют хаотическое расположение и укорочение волокон миокарда, дегенеративные изменения с исчезновением миофибрилл, деформацию ядер клеток, фиброзное замещение миокарда.
Катетеризацию полостей сердца обычно проводят при клинически выраженной митральной регургитации для оценки возможности хирургического лечения. Внутрижелудочковые градиенты давления выявляют в ЛЖ и реже в ПЖ. Градиент повышается после экстрасистол, во время пробы Вальсальвы и после ингаляции амилнитрита. Конечно-диастолическое давление повышено вследствие сниженной податливости желудочка.
По данным вентрикулографии выявляют характерную деформированность камеры, зависящую от формы ГКМП и также иногда подтверждают митральную регургитацию. Коронарные артерии обычно широкие с адекватным кровотоком.
С помощью МРТ можно наиболее точно оценить морфологические изменения, распространенность и выраженность гипертрофии миокарда, особенно при диагностике верхушечной формы и гипертрофии нижней части межжелудочковой перегородки и ПЖ, определить систолическую и диастолическую функцию ЛВ.
При подозрении на ГКМП диагноз устанавливают по данным генетического исследования (анализ ДНК), которое позволяет выявить характерные мутации генов, ответственных за синтез сократительных белков кардиомиоцитов.
Лечение
Должно быть направлено на уменьшение диастолической дисфункции, гипердинамической функции ЛЖ и устранение нарушений ритма сердца.
Общие мероприятия включают ограничение физических нагрузок, которые усугубляют гипертрофию миокарда, повышают внутрижелудочковый градиент давления и риск внезапной смерти.
Блокаторы β-адренорецепторов являются препаратами первой линии у больных независимо от наличия или выраженности градиента внутрижелудочкового давления, имеющих симптомы одышки или непереносимости физических нагрузок: сниженной сократимостью ЛЖ, ограниченным латентным градиентом выносящего тракта, сниженным потреблением кислорода миокардом и ишемией (схема 10.1). Блокаторы β-адренорецепторов улучшают симптомы у 70% больных, снижая ЧСС, таким образом улучшая пассивное наполнение желудочков и уменьшая потребность миокарда в кислороде.
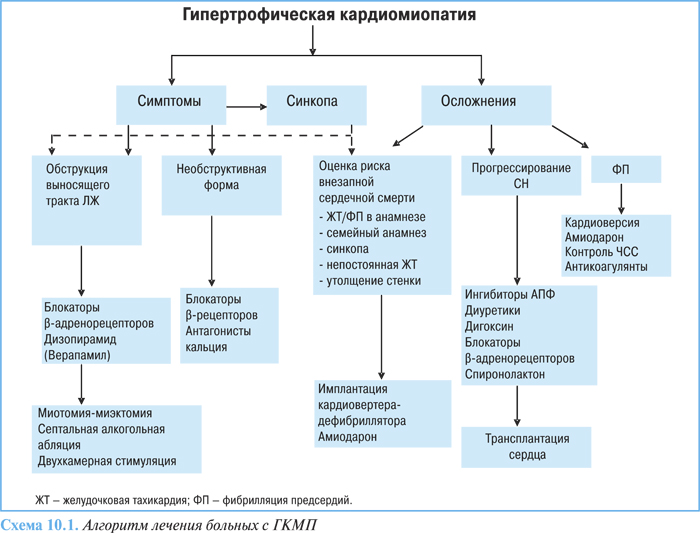
Альтернативой может быть применение верапамила, который в дозе до 480 мг/сут у больных как с необструктивной, так и обструктивной ГКМП уменьшает выраженность симптоматики, особенно боли в области сердца, улучшает расслабление и наполнение желудочков, уменьшает ишемию миокарда и сократимость ЛЖ. При применении верапамила может возникать ухудшение гемодинамики, увеличение обструкции выносящего тракта, повышение давления в ЛА.
С осторожностью следует давать нагрузки больным с обструкцией выносящего тракта ЛЖ в покое.
При наличии нарушений сердечного ритма целесообразно назначать блокаторы β-адренорецепторов и антиаритмические средства, однако следует отметить, что применение последних не снижает риск внезапной смерти. У симптоматичных пациентов с обструкцией дизопирамид действует как антиаритмическое средство (в отношении как суправентрикулярных, так и желудочковых аритмий) и как отрицательный инотропный агент вызывает уменьшение выраженности симптомов. В дозах 300–600 мг/ сут может уменьшать обструкцию выносящего тракта и объем митральной регургитации. Для уменьшения выраженности побочных эффектов можно применять в комбинации с блокаторами β-адренорецепторов в низких дозах. Не следует применять дизопирамид с соталолом/амиодароном вследствие риска проаритмогенного действия.
Наличие фибрилляции предсердий обычно хорошо переносится, однако у больных с тяжелой диастолической дисфункцией потеря предсердного «вклада» вследствие аритмии может иметь необратимые гемодинамические последствия, что требует неотложного восстановления синусового ритма посредством электрической или медикаментозной кардиоверсии с помощью амиодарона. Последний эффективен для предупреждения пароксизмов фибрилляции предсердий. Контроль ритма с помощью блокаторов β-адренорецепторов или верапамила улучшает клинический статус пациентов. Применение варфарина показано как при пароксизмальной, так и при постоянной форме фибрилляции предсердий.
Рекомендуется профилактическое применение антибиотиков для предупреждения возникновения инфекционного эндокардита.
При лечении СН у больных с ГКМП терапевтическая стратегия должна быть направлена на стимуляцию регрессии гипертрофии ЛЖ и устранение симптомов СН путем снижения давления наполнения ЛЖ без уменьшения величины сердечного выброса. В этих случаях препаратами выбора могут быть ингибиторы АПФ и антагонисты рецепторов ангиотензина II из-за их способности блокировать РААС и вызывать обратное развитие гипертрофии ЛЖ.
Клинические исследования, проведенные в последние годы, продемонстрировали благоприятное действие ингибиторов АПФ на ряд важных показателей диастолической функции, включая диастолическое наполнение, изоволюмическое расслабление и взаимосвязь давление — объем ЛЖ и возможность обратного развития процессов ремоделирования миокарда. При этом улучшение диастолической функции (улучшение диастолической растяжимости и способности к расслаблению миокарда, снижение конечно-диастолического давления наполнения ЛЖ) было более выражено у больных с исходно более тяжелой степенью дисфункции.
Лечебные мероприятия при ГКМП и СН в определенной степени носят парадоксальный характер. Диуретики следует применять с осторожностью, предпочтительно при отсутствии значимой обструкции выносящего тракта.
Инотропные агенты, направленные на стимуляцию систолического выброса (сердечные гликозиды и прессорные амины), могут оказывать неблагоприятный гемодинамический эффект — они усиливают обструкцию выносящего тракта и не снижают повышенное конечно-диастолическое давление, могут вызвать развитие асистолии. При сохраненной систолической функции может возникнуть негативный эффект из-за усиления сократимости путем повышения внутриклеточной концентрации ионов кальция. Таким образом, при ГКМП «чистый» эффект от положительных инотропных средств (как увеличение жесткости миокарда, так и повышение давления наполнения ЛЖ) приводит к ухудшению диастолической функции. Тем не менее, дигоксин можно применять у больных с диастолической дисфункцией и фибрилляцией предсердий для снижения ЧСС и/или для восстановления синусового ритма.
Показания к проведению немедикаментозной терапии:
- значительная обструкция выносящего тракта ЛЖ (максимальный градиент >50 мм рт. ст.) и тяжелые ограничивающие симптомы одышки;
- боль в сердце и пресинкопальные или синкопальные состояния;
- рефрактерность к максимальной медикаментозной терапии.
В последнее время успешно апробирован новый метод для уменьшения обструкции выносящего тракта у больных, рефрактерных к медикаментозной терапии, — перкутанная алкогольная абляция межжелудочковой перегородки. Успешная алкогольная абляция сопровождается прогрессивным уменьшением градиента в период от 6 до 12 мес у 80% больных, что сопровождается улучшением клинического статуса, уменьшением выраженности симптомов и диастолической дисфункции и увеличением переносимости физических нагрузок.
Целью хирургического вмешательства при обструкции выносящего тракта является устранение систолического переднего движения митрального клапана и септально-митрального контакта путем расширения выносящего тракта ЛЖ. Наиболее часто выполняется септальная миотомия-миэктомия, в результате которой у 95% больных отмечают значительное уменьшение градиента выносящего тракта, митральной регургитации, у 70% улучшаются клинические симптомы. Приблизительно у 5% пациентов операция осложняется аортальной регургитацией, которая обычно гемодинамически незначима.
Предупреждение внезапной смерти включает идентификацию маркеров риска (включая синкопальные состояния, внезапную смерть родственников, наличие градиента выносящего тракта). Наличие множественных клинических факторов риска повышает риск внезапной смерти, таким больным необходима имплантация кардиовертера-дефибриллятора.
Прогноз
Неблагоприятный, наиболее часто больные умирают внезапно, на фоне тяжелой физической нагрузки, в том числе при бессимптомном течении заболевания. ХСН развивается менее часто. Установленные факторы риска внезапной смерти при ГКМП: манифестация заболевания в молодом возрасте (до 16 лет), наличие в семейном анамнезе эпизодов внезапной смерти, частые синкопальные состояния, непродолжительные эпизоды желудочковой тахикардии, выявленные при 24-часовом мониторировании ЭКГ, патологическое изменение уровня АД при физической нагрузке. Степень гипертрофии ЛЖ или наличие обструкции выносящего тракта ЛЖ прогностического значения не имеют.
ЛИТЕРАТУРА
- Амосова Е.Н. (1999) Кардиомиопатии. Книга плюс, Киев, 422 с.
- Коваленко В.М., Лутай М.І., Сіренко Ю.М. (ред.) (2007) Серцево-судинні захворювання. Класифікація, стандарти діагностики та лікування кардіологічних хворих. Київ, 122 с.
- Коваленко В.Н., Несукай Е.Г. (2001) Некоронарогенные болезни сердца. Практ. руководство. Морион, Киев, 480 с.
- Целуйко В.И., Максимова Н.А., Кравченко Н.А. и др. (1998) Генетический аспект гипертрофической кардиомиопатии. Кардиология, 6: 63-65.
- Шиллер Н., Осипов М.А. (2005) Клиническая эхокардиография. 2-е изд. Практика, Москва, 344 с.
- Adabag A.S., Casey S.A., Kuskowski M.A. et al. (2005) Spectrum and prognostic significance of arrhythmias on ambulatory Holter electrocardiogram in hypertrophic cardiomyopathy. J. Amer. Coll. Cardiol., 45: 697-704.
- Arad M., Maron B.J., Gorham J.M. et al. (2005) Glycogen storage diseases presenting as hypertrophic cardiomyopathy. N. Engl. J. Med., 352: 362-372.
- Cooper L.T., Baughman K.L., Feldman A.M. et al. (2007) The role of endomyocardial biopsy in the management of cardiovascular disease. Sur. Heart J. Vol. 28, p. 3076-3093.
- Crilley J.G., Boehm E.A., Blair E. et al. (2003) Hypertrophic cardiomyopathy due to sarcomeric gene mutations is characterized by impaired energy metabolism irrespective of the degree of hypertroph. J. Amer. Coll. Cardiol., 41: 1776-1782.
- Dorn G.W., Force T. (2005) Protein kinase cascades in the regulation of cardiac hypertrophy. J. Clin. Invest., 115: 527-537.
- Elliott P., Anderson B., Arbustini E. et al. (2007) Classification of the cardiomyopathy position: statement from the European society of cardiology working group on myocardial and pericardial deseases. Sur. Heart J. Vol. 29, p. 270-276.
- Fassbach M., Schwartzkopff B. (2005) Elevated serum markers for collagen synthesis in patients with hypertrophic cardiomyopathy and diastolic dysfunction. Z. Kardiol., 94: 328-335.
- Galderisi M., Mondillo S. (2007) Echocardiography in clinical practice. One Way S.r.l., 120 p.
- Gietzen F.H., Leuner C.J., Obergassel L. et al. (2004) Transcoronary ablation of septal hypertrophy for hypertrophic obstructive cardiomyopathy: Feasibility, clinical benefit, and short-term results in elderly patients. Heart, 90: 638-644.
- Gomes A.V., Potter J.D. (2004) Cellular and molecular aspects of familial hypertrophic cardiomyopathy caused by mutations in the cardiac troponin I gene. Mol. Cell. Biochem., 263: 99-114.
- Hughes S.E. (2004) The pathology of hypertrophic cardiomyopathy. Histopathology, 44: 412-427.
- Lips D.J., deWindt L.J., Kraaij D.J.W. et al. (2003) Molecular determinants of myocardial hypertrophy and failure: alternative pathways for beneficial and maladaptive hypertrophy. Eur. Heart J., 24: 883-896.
- Maron B.J., McKenna W.J., Danielson G.K. et al. (2003) American College of Cardiology/European Society of Cardiology Clinical Expert Consensus Document on Hypertrophic Cardiomyopathy. A report of the American College of Cardiology Foundation Task Force on Clinical Expert Consensus Documents and the European Society of Cardiology Committee for Practice Guidelines. J. Amer. Coll. Cardiol., 42: 1687-1713.
- Megevand A., Ingles J., Richmond D.R. et al. (2005) Long-term follow-up of patients with obstructive hypertrophic cardiomyopathy treated with dual chamber pacing. Amer. J. Cardiol., 95: 991-993.
- Minamisawa S., Sato Y., Tatsuguchi Y. et al. (2003) Mutation of the phospholamban promoter associated with hypertrophic cardiomyopathy. Biochem. Bio-phys. Res. Commun., 304: 1-4.
- Montgomery J.V., Harris K.M., Casey S.A. et al. (2005) Relation of electrocardiographic patterns to phenotypic expression and clinical outcome in hypertrophic cardiomyopathy. Amer. J. Cardiol., 96: 270-275.
- Moon J.C., Reed E., Sheppard M.N. et al. (2004) The histologic basis of late gadolinium enhancement cardiovascular magnetic resonance in hypertrophic cardiomyopathy. J. Amer. Coll. Cardiol., 43: 2260-2264.
- Morioka N., Shigematsu Y., Hamada M. et al. (2005) Circulating levels of heart-type fatty acid-binding protein and its relation to thallium-201 perfusion defects in patients with hypertrophic cardiomyopathy. Amer. J. Cardiol., 95: 1334-1337.
- Morita H., Seidman J., Seidman C.E. (2005) Genetic causes of human heart failure. J. Clin. Invest., 115: 518-526.
- Richard P., Charron P., Carrier L. et al. (2003) Hypertrophic cardiomyopathy: Distribution of disease genes, spectrum of mutations and implications for a molecular diagnosis strategy. Circulation, 107: 2227-2232.
- Sherrid M.V., Barac I., McKenna W.J. et al. (2005) Multicenter study of the efficacy and safety of disopyramide in obstructive hypertrophic cardiomyopathy. J. Amer. Coll. Cardiol., 45: 1251-1258.
- Shirani J., Pick R., Roberts W.C. et al. (2000) Morphology and significance of the left ventricular collagen network in young patients with hypertrophic cardiomyopathy and sudden cardiac death. J. Amer. Coll. Cardiol., 35: 36-44.
- Teraoka K., Hirano M., Ookubo H. et al. (2004) Delayed contrast enhancement of MRI in hypertrophic cardiomyopathy. Magn. Reson. Imaging., 22: 155-161.
- Topol E.J. (Ed.) (2007) Textbook of cardiovascular medicine. 3th ed. Lippincott Williams & Wilkins, 1628 p.
- Zen K., Irie H., Doue T. et al. (2005) Analysis of circulating apoptosis mediators and proinflammatory cytokines in patients with idiopathic hypertrophic cardiomyopathy. Int. Heart J., 46: 231-244.