КРОВООБРАЩЕНИЕ
Кровообращение — непрерывное движение крови по замкнутой системе, образуемой сосудами различного строения и функционального назначения, обеспечиваемое работой сердца. Кровь — ткань внутренней среды организма, ее главными функциями являются транспортная, дыхательная, трофическая, экскреторная, защитная и регуляторная. Кровь участвует также в поддержании водного баланса тканей и постоянства температуры тела.
С гемодинамической точки зрения систему кровообращения в целом можно представить как два резервуара — артериальный и венозный, которые сообщаются через разветвленную сеть микрососудов. Из первого все органы и тканевые структуры получают необходимое им количество крови, а в другом, венозном, эта кровь собирается и транспортируется к сердцу.
В организме взрослого человека в покое центральные распределительные сосуды — артерии эластического типа — принимают в момент систолы около 70 мл крови. Дистальной границей этого звена сосудистой системы принято считать артериальные ветви, относящиеся к более чем одному органу. Стенки аорты и ее крупных ветвей состоят в основном из коллагена и эластина с относительно малым количеством гладких мышц, благодаря чему энергия, которая расходуется в систолу на растяжение упругих стенок магистральных артерий, используется для поддержания кровотока в диастолу.
По мере ветвления артериального русла количество параллельно и последовательно соединенных сосудов увеличивается в геометрической прогрессии. Малые ветви артериальной сети (интраорганные артерии небольшого калибра, артериолы) представляют резистивную часть сосудистого русла, в котором происходит наибольшее в кровеносной системе падение давления, а поток крови утрачивает пульсирующий характер. В стенках этих сосудов много гладкомышечных клеток, обеспечивающих активное изменение сосудистого просвета, что существенно влияет на периферическое сопротивление кровотоку. Гладкие мышцы резистивных сосудов регулируют тканевый кровоток, реагируя как на возникающие в тканях и циркулирующие в крови сигналы, так и на приходящие по нервным волокнам.
Большинство функций крови реализуется в микрогемоциркуляторном русле, которое включает артериолы, прекапилляры, капилляры, венулы и артериовенозные анастомозы. Его основным функциональным звеном являются капилляры, хотя обменные процессы в той или иной степени осуществляются и в приносящих, и в отводящих кровь микрососудах. Стенка капилляров состоит из одного слоя эндотелиальных клеток и окружающей их базальной мембраны, что обеспечивает тесный контакт протекающей по ним крови и питаемых тканевых структур. Геометрия и плотность микрососудистой сети, диаметр, длина и детали строения капилляров, образующих эту сеть, в различных органах значительно варьирует. Количество одновременно функционирующих капилляров в каждом участке ткани зависит от выполняемой ею работы и метаболической активности и может меняться в значительных пределах. При избыточном поступлении крови в артериальное колено микрогемоциркуляторного русла гладкомышечные сфинктеры артериоловенулярных шунтов-анастомозов раскрываются, часть крови сбрасывается в отводящие ее микрососуды.
Адекватность транскапиллярного обмена потребностям ткани и тем самым гомеостатическая функция микрогемоциркуляторного русла зависит не только от объема поступающей в него крови, но и от величины посткапиллярного сопротивления, определяемого условиями кровотока в венозной системе. Возврат венозной крови к сердцу обеспечивается несколькими факторами: энергией сокращения сердечной мышцы, сохранившейся в потоке крови после прохождения через микрососуды, сокращением диафрагмы, скелетных мышц, присасывающим действием отрицательного давления в грудной полости, создающимся в момент вдоха.
Венозные (емкостные) сосуды вмещают 70–80% всей крови в организме. Их стенка значительно тоньше и беднее гладкомышечными клетками, чем стенка артерий. Они обладают большой растяжимостью при относительно низкой эластичности. Местные метаболические факторы фактически не влияют на венозное русло, и регуляция тонуса емкостных сосудов осуществляется, как правило, нервной системой. Поэтому при нарушении иннервации органа объем крови в нем может увеличиваться на 20%, а при стимуляции нервов вены могут изгонять до 30% объема нормально содержащейся в них крови.
Кровеносная система координирует и объединяет функционально разные органы и системы целостного организма. Эту функцию она выполняет в комплексе с лимфатической системой, которая возвращает тканевую жидкость в кровяное русло. Любые влияния, усиливающие кровоток и гемотканевый обмен, повышающие коллоидноосмотическое и гидростатическое давление в тканях, стимулируют лимфообразование. Тканевая жидкость, содержащая электролиты и продукты метаболизма, которые должны быть эвакуированы из ткани, поступает в слепо заканчивающиеся лимфатические капилляры, межэндотелиальные стыки которых расширяются при повышении внутритканевого давления. Благодаря этому, корни лимфатической сети работают как «интерстициальные» насосы. Трансформация первичной лимфы во вторичную происходит в посткапиллярах, стенки которых сохраняют проницаемость для воды, но задерживают более крупные молекулы. Наличие клапанов в лимфатической сети, появляющееся уже на уровне посткапилляров, обеспечивает ортоградную ориентацию лимфотока. Стенки лимфатических сосудов, транспортирующих лимфу за пределы органов к региональным лимфоузлам и далее, содержат коллагеновые, эластические волокна и гладкомышечные элементы, способствующие активному продвижению лимфы.
КРУГИ КРОВООБРАЩЕНИЯ
Сосудистая система организма представляет собой сложно организованный комплекс функционально и структурно специализированных сосудов различного калибра, транспортирующих движимую сердцем кровь и лимфу во всех органах и тканях, обеспечивая их метаболизм, передачу гуморальной информации и элиминирование продуктов обмена (рис. 1.1).
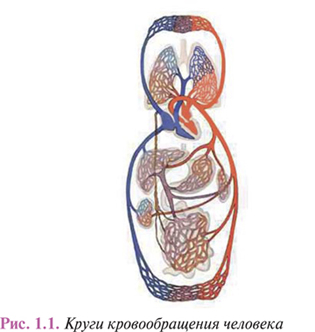
Центральным звеном системы кровообращения организма млекопитающих является сердце, интегрирующее большой и малый круг кровообращения (рис. 1.2). Венозная кровь со всего организма поступает в правое предсердие, затем через правое предсердно-желудочковое отверстие в ПЖ. Из него кровь нагнетается в легочной ствол, разделяющийся на ЛА, которые следуют в правое и левое легкое. Здесь ЛА последовательно делятся на долевые, сегментарные, лобулярные ветви и капилляры. Последние непосредственно участвуют в формировании аэрогематического барьера, который опосредует газообмен с освобождением крови от избытка СО2 и обогащением ее кислородом, необходимым для нормального течения метаболических процессов в организме.
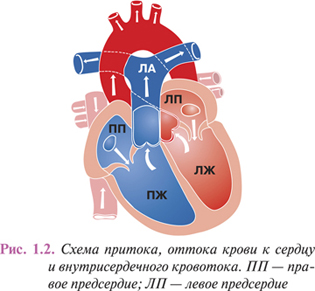
Оксигенированная артериальная кровь возвращается к сердцу по четырем легочным венам, впадающим в левое предсердие. Затем через левое предсердно-желудочковое отверстие кровь попадает в ЛЖ сердца, откуда в систолу выталкивается в аорту и разносится по ее ветвям по всему организму.
Калибр и соответственно пропускная способность магистральных артерий, отходящих от аорты, неодинаковы и определяются объемом кровоснабжаемого региона и интенсивностью метаболических процессов в соответствующих тканях и органах.
Внутриорганное, преимущественно дихотомическое деление магистральных артерий на ветви второго, третьего и т.д. порядка, определяется анатомическими особенностями кровоснабжаемого органа и завершается формированием тканеспецифичной капиллярной сети, обеспечивающей трофические процессы на микрорегиональном уровне. В их ходе артериальная кровь отдает кислород, насыщается СО2 и продуктами тканевого метаболизма, превращаясь в венозную, и направляется к сердцу.
Капилляры формируют внутриорганные пути оттока крови возрастающего калибра. Последовательно объединяясь, они впадают в крупные венозные сосуды, покидающие соответствующие органы. В итоге все экстраорганные вены собираются в два магистральных ствола: верхнюю полую вену, которая собирает кровь из областей и органов головы, шеи, верхних конечностей и тканей верхних участков грудной клетки, и нижнюю полую вену, принимающую венозную кровь из всех расположенных ниже участков тела. Впадая в правое предсердие, куда вливается и венозная кровь из самого сердца, нижняя и верхняя полые вены замыкают систему кровообращения.
Малый круг кровообращения, начинающийся в ПЖ сердца, заканчивается легочными венами, впадающими в левое предсердие. При этом общий легочный ствол и ЛА несут венозную кровь, которая трансформируется в легких в артериальную и возвращается в левое предсердие. Отсюда ЛЖ нагнетает ее в большой круг кровообращения, начинающийся аортой и заканчивающийся верхней и нижней полыми венами, впадающими в правое предсердие.
АРТЕРИАЛЬНЫЙ ОТДЕЛ КРОВЕНОСНОЙ СИСТЕМЫ
Кровь, поступающая в аорту в систолу, распределяется между всеми артериями большого круга кровообращения, которые, в зависимости от диаметра и строения стенки, условно подразделяются на крупные эластичные, средние мышечно-эластичные и более мелкие, или мышечные. К первым относится аорта, ЛА и их наиболее крупные ветви, в которые кровь вливается с большой скоростью и под максимальным давлением, развиваемым в желудочках сердца.
Артерии эластического типа
Артерии, кровоснабжающие стенки тела, относятся к париетальным (пристеночным), питающие внутренние органы — к висцеральным или внутренностным. Артериальные стволы, расположенные между магистральными сосудами эластического или мышечно-эластического типа и кровоснабжаемым органом, обозначают как внеорганные, а вступающие в тот или иной орган и разветвляющиеся в нем — как внутриорганные.
Ветвление внутриорганных артерий на более мелкие сосуды определяется строением органа и осуществляется по магистральному либо рассыпному вариантам. В первом случае диаметр основного артериального ствола уменьшается постепенно, по мере отхождения боковых ветвей, во втором артерия сразу делится на две и более ветвей меньшего диаметра. Артерии, обеспечивающие окольный кровоток, так называемые коллатеральные сосуды, могут быть межсистемными, которые осуществляют связь между сосудами, получающими кровь из различных источников, и внутрисистемными, соединяющими ветви одной артерии.
В стенке артерий различают три оболочки, отличающиеся по строению в сосудах различного калибра (рис. 1.3).

Внутренняя поверхность сосудов выстлана непрерывным слоем уплощенных клеток эндотелия с региональными морфофункциональными особенностями. Эндотелиоциты артериального типа имеют неправильную удлиненную форму, преимущественно ориентированы по току крови. Межклеточные границы в монослое эндотелия имеют зубчатую форму, межклеточные щели выполнены белково-полисахаридными субстанциями, которые вследствие наличия гликозаминогликанов обладают свойствами макромолекулярных биологических фильтров (рис. 1.4).
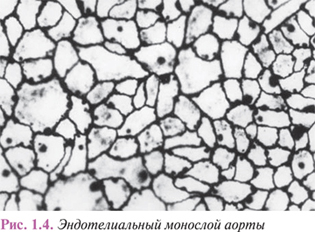
Поверхность эндотелиоцитов покрыта тонким слоем гликокаликса, также включающим гликозаминогликаны и сиаловые кислоты, анионные свойства которых имеют существенное значение для обеспечения антигемостатической функции эндотелия. Резко уплощенные эндотелиоциты довольно широко варьируют по размерам, достигая 500 мкм в длину и 150 мкм в ширину.
Естественная структурная неоднородность сосудистого эндотелия наиболее выражена в восходящем отделе, области дуги и верхней трети нисходящего грудного отдела аорты, а также в местах ответвления от нее сосудов, то есть в регионах, наименее резистентных к атеросклеротическому повреждению.
Набор органелл эндотелиоцитов стереотипен. Характерной их особенностью является хорошо развитый цитоскелет, способный изменять ширину межклеточной щели и тем самым пассивную, по градиенту давления, проницаемость эндотелиального барьера. Активный энергозависимый транспорт веществ из сосудистого просвета в субэндотелиальное пространство или обратно осуществляется посредством микропиноцитозных везикул, формируемых плазмолеммой.
Согласно современным представлениям, эндотелий — это совокупность высокоспециализированных клеток эпителиального генеза, объединенных в функциональный синцитий, который в кровеносной системе образует непрерывающийся монослой, выстилающий внутреннюю поверхность сосудистой стенки. Располагаясь между кровью и тканью, сосудистый эндотелий является мишенью, доступной для любых факторов внутренней среды, а множественность его функций обусловливает широкий диапазон морфофункциональных реакций эндотелиоцитов. Эндотелий сочетает свойства антигемостатической поверхности и структурно-функционального модулятора сосудистой стенки, ключевого компонента гистогематического барьера и массивного разветвленного звена системы поддержания гомеостаза.
Эндотелий обеспечивает трофику сосудистой стенки и ее адекватное реагирование при изменениях гемодинамики, качественного состава и реологических свойств крови, то есть адаптацию к любым сдвигам в окружающей его среде — плазме крови и в интерстиции сосудистой стенки. Помимо этого, эндотелий обеспечивает целостность образуемого монослоя и соответствует изменениями своей ауто- и паракринной функции на разнообразные нейрогуморальные сигналы.
Субэндотелиальный слой (слой Лангханса) состоит из рыхлой соединительной ткани, богатой клетками звездчатой формы, среди которых выявляют единичные гладкомышечные клетки, ориентированные по оси сосуда. Межклеточное вещество содержит гликозаминогликаны и фосфолипиды. Толщина субэндотелиального слоя обратно пропорциональна диаметру сосуда.
Следующая зона стенки аорты и других сосудов эластического типа представлена сплетением тонких эластических волокон, которые вблизи просвета расположены преимущественно циркулярно и приобретают продольное расположение в более глубоких слоях, без четких границ переходя в среднюю оболочку сосудистой стенки. Этот слой состоит из нескольких десятков окончатых эластических мембран, связанных между собой эластическими волокнами. Пространства между ними заполнены межуточным веществом, гладкомышечными клетками, лежащими косо по отношению к мембранам, и небольшим количеством фибробластов.
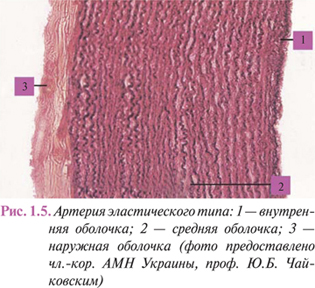
Наружная оболочка стенки этих сосудов — адвентиция, состоит из рыхлой соединительной ткани со значительным количеством коллагеновых и эластических волокон, ориентированных в основном продольно и погруженных в межклеточное вещество. Между ними часто выявляют соединительнотканные клетки, проходят элементы нервной системы, сосуды, кровоснабжающие ткань и отводящие лимфу. В целом конструкция стенки артерии эластического типа (рис. 1.5) обеспечивает ее высокую эластичность и прочность, необходимую для смягчения пульсовой волны и резервирования части передаваемой ею энергии сердечных сокращений посредством упругой деформации.
Артерии мышечно-эластического типа
С уменьшением диаметра артерии становятся тоньше и оболочки ее стенки. Тем не менее внутренний слой стенки сонной или подключичной артерий, относящихся к мышечно-эластическому типу, сравнительно мало изменяется по сравнению с сосудами большего калибра. Однако внутренняя эластическая мембрана в них лучше структурирована, более выражена, толще и прочнее, чем глубже расположенные эластичные элементы. Образуемые ими густые сети лежат между гладкомышечными клетками, собранными в переплетающиеся пучки, и ориентированы в основном по пологой спирали по отношению к оси сосуда.
В наружной оболочке таких артерий различимы слои: внутренний, еще содержащий разрозненные пучки гладкомышечных клеток, и наружный, образуемый продольно- и косорасположенными пучками коллагеновых и эластических волокон. Такая конструкция стенки позволяет сосудам мышечно-эластического типа сочетать высокую эластичность и способность сокращаться, значительно ограничивая свой просвет при колебаниях уровня АД.
Артерии мышечного типа
Сосуды среднего и мелкого калибров, такие как плечевая, бедренная, лучевая или пальцевая, как и большинство артерий внутренних органов, являются артериями мышечного типа (рис. 1.6).
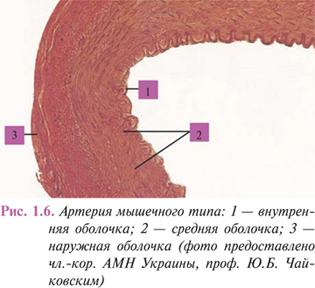
Их стенка также имеет трехслойное строение.
Внутренняя оболочка представлена эндотелиальным монослоем и субэндотелиальным слоем, который истончается с уменьшением диаметра сосуда, состоит из тонких, преимущественно продольно направленных коллагеновых и эластических волокон. В межклеточном веществе, расположенным между ними и богатом гликозаминогликанами, выявляют малодифференцированные соединительнотканные клетки неправильной звездчатой формы. Границей субэндотелиального слоя является фенестрированная извилистая эластическая мембрана, четко выраженная в артериях мышечного типа значительного диаметра.
Средняя оболочка сосудов этого типа формируется единым эластическим каркасом, структурно и функционально интегрированным с количественно преобладающим гладкомышечным компонентом. Многочисленные гладкомышечные клетки медии, как и волокнистые элементы, ориентированы в виде пологой спирали, а эластические волокна, прилежащие к поверхности клеток, как бы служат им своеобразными сухожилиями. При этом волокнистые элементы имеют радиальное расположение, образуя дуги, вершины которых находятся в середине слоя, а концы, направленные к наружной или внутренней оболочкам, сливаются с их эластическими структурами. Построенный таким образом волокнистомышечный каркас сосудистой стенки придает ей эластичность при растяжении, обеспечивая упругость при компрессии и тем самым непрерывность потока крови.
Среднюю и наружную оболочки сосудистой стенки разграничивает наружная эластическая мембрана с плотными, лишенными фенестр участками, образуемая толстыми, переплетающимися между собой эластическими волокнами. Хорошо выраженная в сравнительно крупных сосудах, она истончается с уменьшением их диаметра, все более уступая внутренней мембране по степени развития.
Наружная оболочка представлена рыхлой волокнистой неоформленной соединительной тканью, неравномерно и неплотно армированной волокнистыми элементами. В межуточном веществе между продольно ориентированными волокнами находится небольшое количество адвентициальных и жирових клеток, а также кровеносные сосуды, питающие сосудистую стенку, элементы нервной системы.
Микрогемоциркуляторное русло
Ветвление артерий завершается микрогемоциркуляторным руслом, где реализуются основные функции крови по поддержанию гомеостаза внутритканевой среды и обеспечению оптимальных условий функционирования тканевых компонентов. Согласно гистологической номенклатуре, принятой на IX Международном конгрессе анатомов (1970), среди внутриорганных сосудов, формирующих микрогемоциркуляторное русло (рис. 1.7), различают артериолы, перикапиллярные артериолы (прекапилляры), капилляры, посткапиллярные венулы (посткапилляры) и венулы.
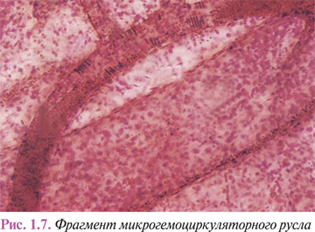
Артериолы
Первый структурно-функциональный элемент микрогемоциркуляторного русла — артериолы (рис. 1.8) — представляют собой конечное звено артериального дерева, стенка которых еще сохраняет принцип трехслойного строения.
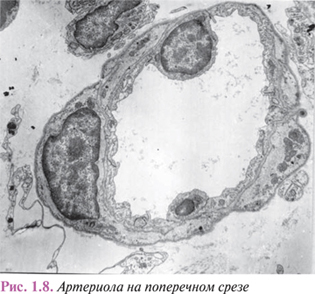
Внутренний слой артериол состоит из эндотелиального монослоя, лежащего на базальной мембране. Края удлиненных эндотелиоцитов артериол, как и сосудов большего калибра, плотно соединены между собой специализированными структурами. В субэндотелиальной зоне еще присутствуют очаговые вкрапления эластической мембраны, пронизанные тонкими фибриллами, концы которых прикреплены к базальной поверхности эндотелиоцитов и к лежащим кнаружи миоцитам.
Мышечная оболочка артериол образована одним сплошным слоем циркулярно расположенных гладкомышечных клеток. Благодаря наличию гладкомышечного слоя, артериолы способны отвечать на воздействие различных вазоактивных агентов активным изменением величины просвета. Внешний, слабо выраженный соединительнотканный слой стенки артериол, без видимой границы интегрируется в интерстиций соответствующей ткани.
Терминальные разветвления артериального дерева, в которых уже отсутствуют продольно ориентированные гладкомышечные клеточные элементы, а разрыхленная эластичная мембрана утрачивает непрерывность, являются основным участком гашения пульсовой волны и зоной наибольшего сопротивления кровотоку в сосудистом русле. Эти сосуды, а также артериолы и прекапилляры, адекватно реагируя на системные сигналы и изменения интенсивности тканевого метаболизма, осуществляют координацию региональной гемоперфузии в соответствии с потребностями питаемой ткани.
Капилляры
Следующим за артериолами звеном микрогемоциркуляторного русла являются прекапилляры, короткие и тонкостенные микрососуды, в стенке которых гладкомышечный слой утрачивает свою непрерывность, а вкрапления эластической мембраны уже отсутствуют. Прекапилляры дихотомически и трихотомически делятся на капилляры, которые иногда отходят и непосредственно от артериол. Характерной структурной особенностью прекапилляров является спиралевидная ориентация и разрозненное расположение гладкомышечных клеток стенки, а также наличие прекапиллярных сфинктеров, образуемых несколькими циркулярно лежащими гладкомышечными клетками при ответвлении от артериол и иногда — в местах деления на капилляры. Между гладкомышечными клетками прекапиллярных сфинктеров и эндотелиоцитами, выстилающими просвет прекапилляров, имеются множественные миоэндотелиальные соединения типа нексусов, синхронизирующие функции контактирующих клеток. Прекапиллярные сфинктеры осуществляют тонкую корректировку капиллярного кровотока, существенно влияя на гемотканевый обмен.
Помимо посткапилляров, артериолы также могут образовывать анастомозы с другими сосудами аналогичного калибра. Однако чаще они сообщаются через капиллярную сеть, где соединяются микрососуды, исходящие из различных прекапилляров и соответственно артериол. Следующие за посткапиллярами обменные микрососуды, или капилляры, анатомически соединяющие артериальный и венозный отделы сосудистой системы, функционируют в качестве основного звена, которое реализует транспортно-трофическое обеспечение жизнедеятельности тканей и органов. Из всех компонентов микрососудистого ложа капилляры наиболее интимно связаны с питаемой ими тканью, а общая архитектоника капиллярной сети подчинена функциональной специализации соответствующего органа.
Кровеносные капилляры
Капилляры — наиболее тонкостенные сосуды микрогемоциркуляторного русла. Основным компонентом их стенки являются эндотелиоциты, опирающиеся на базальную мембрану, и отдельные перициты (клетки Руже), тесно прилегающие к базальной поверхности эндотелиального монослоя.
Реакции капилляров на изменения тканевого гомеостаза и внешние воздействия зависят от всех конструктивных элементов стенки: эндотелиоцитов, перицитов, базальной мембраны.
Диаметр капилляров в различных тканях колеблется в широких пределах — от 4,5 до 7 мк в мышцах и нервах, 7–11 мк — в коже и слизистой оболочке, до 20–30 мк — в железах внутренней секреции. Более того, в зависимости от потребностей в кровоснабжении открытые капилляры многих тканей способны трансформироваться в так называемые плазматические, уже непроходимые для форменных элементов крови, либо в закрытые или резервные, в которых циркуляция жидкости на некоторое время практически прекращается. Количество капилляров в разных органах также неодинаково и определяется интенсивностью их метаболизма. Так, на поперечных разрезах мышечной ткани их количество может достигать 1400, в коже — не более 40 на 1 мм2. Тем не менее суммарная площадь поперечного сечения капилляров всегда многократно больше, чем исходной артерии, что снижает скорость перфузии и способствует гемотканевому обмену.
Преобладание обменно-транспортной функции над другими обусловливает соответствующие структурные особенности эндотелия капилляров, их более округлую и уплощенную форму, менее развитый цитоскелет и относительную бедность органеллами при достаточно высокой степени везикуляции. Внутренняя поверхность капиллярного эндотелия, покрытая тонким слоем гликокаликса, часто образует субмикроскопические выступы и микроворсины, а края клеток — маргинальные складки, свободно свисающие в просвет. И те и другие увеличивают обменную поверхность капиллярной стенки (рис. 1.9).
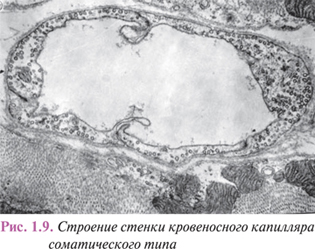
Основные пути и механизмы трансэндотелиального массопереноса различных веществ — активный транспорт в микропиноцитозных везикулах, образуемых плазмолеммой, диффузионные процессы и ультрафильтрация по межэндотелиальным щелям, проходимость которых ограничивают простые соединения и соединения по типу замка с уплотнениями в виде десмосом между плотно контактирующими листками плазмолеммы смежных клеток. По современным представлениям, микропиноцитозные везикулы — кавеолы являются носителями активности конституативных NO-синтаз, важнейшего регуляторного механизма сосудистой стенки.
Интенсивность гемотканевого обмена во многом зависит от градиента давления на входе и выходе из микрососуда, а также осмотических характеристик внутритканевой среды, окружающей капилляры. В эндотелии капилляров некоторых органов и тканей (железы внутренней секреции, почечные клубочки, ворсинки кишечника и др.) наблюдаются резкие истончения цитоплазмы вплоть до слияния внутреннего и внешнего листков плазмолеммы с образованием так называемых фенестр, а в капиллярах таких органов, как селезенка или печень, между эндотелиоцитами имеются щели, видимые под световым микроскопом.
За эндотелиальным монослоем располагается базальная мембрана, обращенная к эндотелиоцитам. Ее внутренняя поверхность повторяет рельеф эндотелиоцитов, а внешняя имеет нечеткие контуры, вплетаясь своими фибриллами в межклеточное вещество, окружающее микрососуды. Благодаря образуемой коллагеном тонкофибриллярной структуре и присутствию гликозаминогликанов в межфибриллярном аморфном компоненте базальной мембраны, она сочетает опорную функцию со свойствами макромолекулярного фильтра.
Посткапилляры
Сливаясь, капилляры образуют посткапилляры или посткапиллярные венулы, которые в различных органах варьируют по ширине просвета и длине, но по строению стенки сходны и практически не отличаются от капилляров. Благодаря большей ширине просвета, посткапилляры совмещают участие в обменно-трофических процессах с функциями микрокоммуникации и передают кровь, насыщенную продуктами тканевого метаболизма, из капиллярного ложа в собирательные венулы. Однако для посткапилляров характерны более округлая форма и большие размеры эндотелиоцитов и соответственно большая площадь истонченных периферических отделов клетки, более крупные микропиноцитозные везикулы, которые, сливаясь, чаще формируют трансэндотелиальные канальцы, упрощенную структуру межэндотелиальных стыков.
Они образованы простым наложением краевых зон контактирующих клеток, перекрывающихся на значительной площади, что сохраняет подвижность этих микрососудов и обеспечивает существенный резерв емкости.
Структура эндотелиоцитов посткапиллярных венул различных тканей имеет некоторые особенности, определяемые их принадлежностью к различным анатомо-физиологическим системам. Ими являются различная толщина эндотелиоцитов, отсутствие фенестр в микрососудах соматического типа, характерных для мышечной ткани, которые присутствуют в микрососудах секретирующих органов. К более толстой, чем у капилляров, базальной мембране посткапиллярных венул примыкает соединительнотканный футляр шириной 2–3 мкм, чаще выявляемые перициты, которые, однако, еще не образуют сплошной слой. Посткапилляры и венулы являются последним звеном микрогемоциркуляторного русла и в то же время первым компонентом венозной системы и образуют мельчайшие вены по конвергентному принципу.
ВЕНОЗНЫЙ ОТДЕЛ КРОВЕНОСНОЙ СИСТЕМЫ
Вены являются специализированным отделом кровеносного русла, который собирает кровь от органов и тканей и доставляет ее к сердцу. Последовательное слияние сосудов, отводящих кровь, в стволы возрастающего калибра завершается в большом круге кровообращения образованием верхней и нижней полых вен, а в легочном — четырьмя легочными венами. Среди вен различного калибра различают мелкие, средние и крупные со структурными и функциональными особенностями.
Общие закономерности строения стенки вен, как и артерий, связаны с условиями их функционирования. Венозная стенка, более тонкая, чем артериальная, также имеет внутреннюю, среднюю и наружную оболочки. Низкое давление и относительно малая скорость кровотока обусловливают значительно меньшее по сравнению с артериями развитие эластических элементов во всех звеньях венозного дерева.
В зависимости от наличия и степени развития мышечных элементов вены принято относить к сосудам безмышечного и мышечного типов, которые в свою очередь подразделяются на имеющие слабо, средне и сильно развитый мышечный компонент стенки (рис. 1.10). Важнейшим фактором, определяющим наличие и количество гладкомышечных клеток, помимо величины сосуда, являются органоспецифические особенности гемодинамики и влияние силы тяжести, способствующей или препятствующей продвижению крови к сердцу.
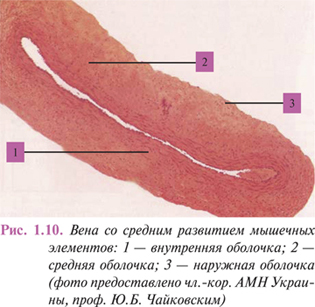
Венулы и мелкие вены
Сливаясь, посткапилляры образуют собирательные венулы, просвет которых колеблется в пределах 30–50 мкм. Выстилающий их эндотелий приобретает особенности, характерные для эндотелиоцитов венозного типа: неправильную, более округлую форму, увеличенную площадь клеток за счет обширной периферической зоны. В эндотелиоцитах венул меньше органелл, чем в эндотелиоцитах артерий, значительно слабее развит цитоскелет, упрощена конструкция межэндотелиальных стыков. В адвентиции собирательных венул, еще слабо развитой, наряду с отросчатыми перицитами уже присутствуют клетки веретенообразной формы, образующие небольшие скопления вокруг устьев при впадении посткапилляров. Ультраструктура этих клеток соответствует примитивным гладкомышечным клеткам, их цитоплазма заполнена филамен-тозными структурами и электронноплотными тельцами, которые верифицируют как элементы контрактильного аппарата.
С увеличением калибра отводящих сосудов до 50 мкм и более клеточный состав их стенки приобретает гетерогенность, обусловленную функциональной дифференциацией. Появившиеся истинные гладкомышечные клетки располагаются между базальной мембраной, подстилающей эндотелиальный монослой, и глубже расположенными фибробластами, окруженными волокнистыми элементами соединительной ткани. В сосудах, диаметр которых не превышает 100 мкм, средний слой стенки содержит лишь один ряд разрозненных беспорядочно ориентированных гладкомышечных клеток со скудно развитым контрактильным аппаратом. Характерной особенностью эндотелиоцитов этих микрососудов, в целом мало отличающихся от клеток посткапилляров и собирательных венул, является присутствие специализированных органелл — «стержневидных» гранул, или «телец Вейбеля», с компактным своеобразно структурированным содержимым.
Венулы и мелкие вены связаны между собой многочисленными анастомозами, расположенными на различных уровнях, которые объединяют венозные микрососуды в единую систему оттока крови из капиллярного бассейна. В отличие от артериальных, венулярные анастомозы, не имеющие структур, обеспечивающих активную регуляцию кровотока, организованы по принципу дублирования его путей, что повышает надежность гемотранспортирующей системы. Структура тонкой, легко дилатирующейся стенки, извилистые и дугообразные формы часто анастомозирующих венозных корней адаптированы к выполнению ими резервуарной функции и к выбору оптимальных на данный момент путей оттока крови или ее переброске по равнозначным звеньям венулярной сети.
Посткапиллярные и собирательные венулы совмещают транспортную и емкостную функции с резистивной и обусловливают около 20% общего сосудистого сопротивления. Особенности локализации пост-, как и прекапилляров, в сосудистой цепи обусловливают возможность контроля капиллярного кровотока посредством прежде всего реологического и, в какой-то мере, вазомоторного механизмов. Возрастание гидростатического давления в капиллярах при повышении сопротивления в посткапиллярных венулах обусловливает выход жидкости из крови вплоть до отека интерстиция, а его снижение переориентирует движение жидкости в противоположном направлении, в сосудистое русло.
Вены безмышечного типа
К сосудам безмышечного типа относятся вены мозговых оболочек, сетчатки глаза, костей, плаценты, селезенки. Общей особенностью вен этих органов является низкое сопротивление кровотоку вследствие податливости сосудистой стенки при изменениях кровяного давления, что облегчает эвакуацию крови под действием ее собственной силы тяжести. Частично это обусловлено пассивностью ниспадающихся сосудов, сращенных с тканями дренируемых ими органов. Упрощенная структура стенки этих сосудов слагается из широких эндотелиоцитов венозного типа с извилистыми границами, выстилающих ее внутреннюю поверхность. К эндотелиоцитам примыкает хорошо выраженная базальная мембрана, под которой расположен тонкий слой рыхлой соединительной ткани.
Вены со слаборазвитыми мышечными элементами
К этому типу сосудов относятся вены как мелкого или среднего, так и крупного калибров, включая верхнюю полую вену, в которых сила тяжести самой крови играет важную роль в качестве движущей силы кровотока. Стенки вен диаметром 1–2 мм, обычно сопровождающих артерии мышечного типа в верхней части туловища, а также более крупных, таких как вены верхних конечностей, заметно уступают по толщине соответствующим по калибру артериям, прежде всего за счет меньшего содержания гладкомышечных клеток. Небольшое их количество располагается в средней оболочке сосудистой стенки в виде циркулярных пучков под слабовыраженным субэндотелиальным слоем и разграничивается волокнистыми элементами и межклеточным веществом.
В крупных венах этого типа, несмотря на большие объемы протекающей крови, стенка остается достаточно тонкой, а образующие ее слои слаборазвиты и нечетко разграничены. Базальная мембрана, примыкающая к эндотелиальному монослою, лежит на субэндотелиальном слое, состоящем из довольно редких разрозненных волокон и соединительнотканных клеток. Медия содержит незначительное количество гладкомышечных клеток, собранных в циркулярно расположенные пучки, которые разделены рыхлой соединительной тканью. Ее неравномерные прослойки непосредственно переходят в наружную оболочку, которая по толщине в 3–4 раза превосходит обе другие. Благодаря обилию косо и циркулярно расположенных коллагеновых волокон, а также продольно-направленным эластическим структурам, адвентиция является основной опорной структурой венозной стенки.
Стенка вен со средним развитием мышечных элементов характеризуется рядом структурных особенностей. Она богаче волокнистыми элементами, выстилающие ее эндотелиоциты имеют более удлиненную форму, лучше выраженный субэндотелиальный слой. На границе с медией располагается сеть эластических волокон, связанных в единый каркас с такими же структурами средней и наружной оболочек. Во внутренней оболочке, наряду с циркулярными пучками гладкомышечных клеток, присутствуют и клетки, ориентированные продольно. Прослойки соединительной ткани, разграничивающие гладкомышечные пучки, сливаются с хорошо развитой адвентицией, среди волокнистых структур которой, ориентированных преимущественно продольно, выявляют гладкомышечные клетки, лежащие как отдельно, так и образующие пучки с такой же ориентацией.
Вены с сильноразвитыми мышечными элементами
Для стенки сосудов данного типа характерно присутствие многочисленных гладкомышечных пучков во всех оболочках. Во внутренней и наружной оболочках они имеют продольное направление, а в средней располагаются циркулярно. Хорошо развитый гладкомышечный компонент необходим для противодействия силе тяжести крови, которая продвигается по направлению к сердцу под низким давлением. Увеличение диаметра сосудов этого типа сопровождается «перераспределением» гладкомышечных клеток между слоями их стенки: количество мышечных пучков в медии уменьшается, а в наружной оболочке увеличивается.
Распределение гладкомышечных клеток в сосудистых оболочках функционально детерминировано. Ритмичные сокращения при их циркулярном расположении помогают ортоградному продвижению крови, в то время как продольная ориентация пучков способствует образованию поперечных складок сосудистой стенки, которые вместе с клапанным аппаратом мелких, средних (2–5 мм) и некоторых более крупных (>5 мм в диаметре) вен ограничивают возможность ретроградного движения крови.
Клапаноподобные образования появляются уже в дистальных отделах венозной системы, в сосудах калибром от 0,05 мм, где в зависимости от размера сосуда они представляют собой примитивные утолщения внутренней оболочки стенки либо складки интимы, образующие парные карманы. В периферических отделах микроклапаны делят на пристеночные и устьевые, которые локализуются в местах впадения притоков в более крупный сосуд и блокируют регургитацию крови.
С увеличением калибра вен строение их клапанов усложняется. В сосудах среднего калибра это тонкие складки внутренней оболочки, основу которых составляет волокнистая соединительная ткань. На стороне, обращенной к просвету сосуда, в них преобладают эластические структуры, а на противоположной — коллагеновые волокна. Эндотелиальные клетки на поверхности створки, обращенной в просвет сосуда, имеют удлиненную форму и ориентированы по току крови, тогда как на противоположной стороне они полигональные, расположены хаотично и имеют преимущественно полярную ориентацию.
Толщина стенки сосудов, завершающих этот отдел венозной системы, в большой степени определяется наружной оболочкой, достигающей максимального развития в нижней полой вене. Нечетко отграниченные внутренний и средний слои стенки этого коллектора по толщине в 5–7 раз уступают наружной оболочке, образуемой многочисленными продольно лежащими пучками гладкомышечных клеток, окруженных волокнистыми элементами. Соединительная ткань, разделяющая их, заключает пути лимфооттока и многочисленные нервные волокна, закономерно присутствующие во всех сосудах с достаточно хорошо дифференцированной адвентицией.
По топографическому признаку вены подразделяются на поверхностные, следующие, как правило, самостоятельно, и глубокие либо попарно прилежащие к одноименным артериям, часто в составе сосудисто-нервного пучка, либо являющиеся непарными, как, например внутренняя яремная, подключичная, подмышечная, бедренная, повздошные и некоторые другие вены. Нередко поверхностные и глубокие венозные стволы соединены анастомозами — прободающими венами. Многочисленные связи между соседними венами на поверхности или в стенке некоторых органов (мочевой пузырь, прямая кишка) формируют венозные сплетения.
Артериовенозные анастомозы
Между артериальным и венозным отделами сосудистой системы существуют анастомозы различных типов (рис. 1.11), которые функционируют как на уровне микрососудов, так и в проксимально расположенных участках сосудистого русла.
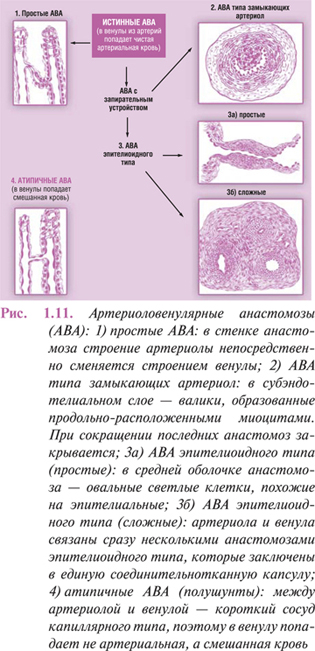
Артериовенозные анастомозы обеспечивают перераспределение потоков крови, минуя капиллярную сеть, между сосудами, которые относятся преимущественно к терминальному кровеносному руслу и существенно отличаются по перфузионному давлению. В физиологических условиях они участвуют в регуляции кровенаполнения соответствующих органов при изменениях функциональной нагрузки, при патологии, например при ангиоспазме травматического или воспалительного характера, воздействии термических, химических или механических факторов, при онкологической патологии или АГ.
В зависимости от строения, артериовенозные анастомозы подразделяют на включающие эпителиоподобные мышечные элементы и построенные по типу замыкающих артерий. В последнем случае ширина просвета контролируется продольно- ориентированными гладкомышечными клетками, образующими в субэндотелиальной зоне на границе с внутренней эластической мембраной скопления с мощным эластическим каркасом. Сокращение этих гладкомышечных клеток способно приводить к полному перекрытию сосудистого просвета. Анастомозы такого типа отмечают в коже пальцев, диафрагме, брыжейке, плевре, легких и других органах.
По строению анастомозы с эпителиоподобными элементами подразделяются на простые, которые отходят от артерии почти под прямым углом и впадают в соответствующую вену, и клубочковые, распадающиеся на несколько вторичных ветвей и иногда заканчивающиеся в различных венозных сосудах. Артериальные и венозные сегменты анастомозов неодинаковы по структуре. Эти особенности лучше прослеживаются в простых анастомозах данного типа, в артериальном сегменте которых под тонкой внутренней оболочкой, состоящей из эндотелиоцитов, тонкого субэндотелиального слоя и внутренней эластической мембраны располагаются пучки гладкомышечных клеток медии, продольные — внутренние и циркулярные — внешние. Благодаря хорошо развитому продольному мышечному слою медии, при ее сокращении на внутренней поверхности сосуда образуются складки, способные закрывать просвет. Клетки этого слоя имеют ряд особенностей: они короче обычных миоцитов, имеют просветленную цитоплазму, овоидные, а не, как обычно, палочковидные ядра.
По мере приближения к вене просвет анастомоза становится шире, стенка тоньше, а гладкомышечные клетки — более округлыми; в их светлой гомогенной цитоплазме появляется мелкая базофильная зернистость. Стенки артериовенозных анастомозов обладают способностью спонтанно сокращаться, однако ритм этих сокращений может корригироваться нейрогуморальными факторами регионального и системного происхождения.
Интермедиарный обмен
Обязательным условием поддержания гомеостаза внутритканевой среды является, наряду с доставкой кислорода и утилизируемых тканью субстратов, освобождение интерстиция от избытка жидкости и шлаковых продуктов тканевого метаболизма. Эта и ряд других жизненно важных функций реализуются в системе микроциркуляции, которая, несмотря на выраженную органоспецифичность, организована по единому принципу. Основу этой системы составляет микрогемоциркуляторное русло — комплекс структурно и функционально дифференцированных элементов, принимающих и отводящих кровь, регулирующих интенсивность гемоперфузии, обеспечивающих гемотканевый обмен, а также участвующих в гуморальной регуляции клеточных и межклеточных процессов.
Специализированные клеточные элементы, интегрируемые соединительной тканью, совместно с фрагментом микрогемоциркуляторного русла формируют микроучасток ткани, обладающий основными структурными и функциональными свойствами соответствующего органа.
Кровь, притекающая по артериолам и прекапиллярам, поступает в обменный отдел микрогемоциркуляторного русла, основу которого составляют капилляры и посткапилляры. Их трофическая функция состоит не только в доставке кислорода и различных веществ клеткам питаемой ткани, но и в реабсорбции воды и мелкодисперсных, растворимых продуктов тканевого обмена. Потеря интерстицием воды влечет рост концентрации грубодисперсных метаболитов и повышение осмотического давления, что может нарушать нормальное соотношение между фильтрацией жидкости из капилляров в ткань и ее реабсорбцией в дистальные отделы микрогемоциркуляторного русла. Данная ситуация корригируется внутриорганной лимфатической сетью, специализирующейся на отведении из ткани метаболитов и других субстанций, способных нарушать ее осмотический баланс и нормальное соотношение между коллоидной и неколлоидной фазами межклеточного вещества.
ЛИМФАТИЧЕСКАЯ СИСТЕМА
Лимфатическая система анатомически слагается из часто анастомозирующих капилляров, посткапилляров, интраорганных сосудов различного калибра и экстраорганных путей оттока лимфы, доставляющих ее к лимфоузлам и далее, в правый и левый лимфатические протоки. Строение внутриорганного лимфатического русла в каждом случае определяется структурой и функцией конкретного органа или ткани, тогда как строение лимфатических микрососудов достаточно стереотипно.
Периферические отделы лимфатического русла представлены слепыми мешковидными выростами и замкнутыми сетями. Они окружают протоки желез и кровеносные сосуды в мышцах и паренхиматозных органах, характеризуются множеством анастомозов.
Лимфатические капилляры и посткапилляры
Для лимфатических капилляров характерны извилистость, неравномерность ширины просвета, слияние в полигональные ячейки с образованием расширений — лакун — в точках слияния петель лимфатической сети. Тонкая стенка уплощенных лимфатических микрососудов состоит из «распластанных» эндотелиоцитов, которые превосходят по площади клетки кровеносных капилляров почти в 4 раза, чередуются с более округлыми клетками эндотелия, ядросодержащие зоны которых заметно выступают в просвет. Стенку лимфатических капилляров, которые по величине просвета значительно превосходят кровеносные, образует 3–4 эндотелиоцита; их тела неравномерны по толщине, а цитоплазма — по электронной плотности. Отличительной особенностью лимфатических капилляров является отсутствие базальной мембраны — макромолекулярного фильтра, укрепляющего стенку кровеносных микрососудов. Межэндотелиальные контакты образуются либо простым наложением краевых зон смежных клеток, либо усложнены интердигитациями; закрытые стыки легко трансформируются в открытые.
За капиллярами следуют посткапилляры, которые отличаются от капилляров большим диаметром, наличием прерывистой базальной мембраны, зон окклюзии, наличием, наряду с расширенными межэндотелиальными щелями, стыков, плотно закрытых и укрепленных специализированными структурами, так называемыми пятнами облитерации. Характерно также появление клапаноподобных структур, которые вначале представлены складками, образуемыми инвагинацией дистального отрезка посткапилляра в просвет проксимального, затем примитивными двустворчатыми клапанами, состоящими из двух слоев эндотелиоцитов.
Лимфатические сосуды
Переход от посткапилляров к отводящим лимфу сосудам сопровождается внедрением в межэндотелиальное пространство створок волокнистых элементов, стромальных клеток и усилением цитоскелета покрывающих их эндотелиоцитов. Стенка сформировавшихся сосудов состоит из эндотелиального монослоя и уже отчетливо дифференцированной адвентиции, образуемой волокнистыми и клеточными компонентами соединительной ткани, тогда как створки их клапанов формируются развившейся интимой без участия адвентициальной оболочки.
В месте перехода капилляров в лимфатический сосуд его калибр весьма изменчив, а слияние посткапилляров не всегда сопровождается увеличением диаметра сосуда. По отношению к органу лимфатические сосуды разделяются на интра- и экстраорганные, а в зависимости от диаметра — на мелкие, средние и крупные с соответствующими особенностями строения стенки. Внутриорганные сосуды, как и лимфатические капилляры, часто анастомозируют, образуя более или менее густую сеть. Уже на этом уровне они приобретают характерную четкообразную форму, обусловленную сужениями просвета в местах расположения многочисленных клапанов.
В экстраорганных лимфатических сосудах диаметром >0,2 мм уже различимы внутренняя, средняя и наружная оболочки. В межклапанных сегментах появляются разрозненные группы продольно-ориентированных гладкомышечных клеток, которые с увеличением калибра и переходом тонкостенных инициальных сосудов в собирательные формируют сплошной слой. Внутренняя оболочка таких сосудов выстлана эндотелиальным монослоем, опирающимся на сплошную базальную мембрану, под которой находятся продольно- и косо-ориентированные коллагеновые и эластические волокна. Однако эластическая мембрана на границе с медией сосуда выражена слабо. Створки клапанов этих сосудов, образуемые медией, имеют соединительнотканевую основу, в которой появляются гладкомышечные клетки.
При одинаковой ширине просвета стенки внеорганных сосудов имеют более сложное строение, чем интраорганные. Средняя оболочка стенки состоит из пучков продольно- и спирально-ориентированных гладкомышечных клеток, коллагеновых и эластических волокон, количество, толщина и направление которых непостоянны. Как и в венах, гладкомышечный слой в лимфатических сосудах головы, верхней части туловища и верхних конечностей развит значительно слабее, чем в нижней части тела, где транспорт лимфы сопряжен с преодолением силы тяжести.
Наружная оболочка лимфатических сосудов состоит из рыхлой волокнистой неоформленной соединительной ткани. Сосуды нижних конечностей, как и коллекторы повздошного лимфатического сплетения, включают гладкомышечные клетки, количество пучков которых пропорционально калибру сосуда. У сосудов правого и левого грудных протоков наружная оболочка в 3–4 раза толще двух других оболочек за счет присутствия мощных продольно-ориентированных гладкомышечных пучков, разделенных соединительнотканными прослойками. Стенку лимфатических сосудов значительного калибра питают vasa vasorum, которые вместе с элементами вегетативной нервной системы располагаются в рыхлой соединительной ткани их наружной оболочки.
Архитектоника и гистотопография сплетений лимфатических сосудов определяются строением органа и интенсивностью гемотканевого обмена. Начальные лимфатические сосуды включаются непосредственно в капиллярную сеть, располагаясь независимо от кровеносных сосудов. Следующие за ними сосуды уже не соединяются ни с лимфатическими капиллярами, ни с посткапиллярами и входят в состав сосудисто-нервного пучка. Они используют пульсацию крови для продвижения лимфы, эвакуация которой, как и резорбция интерстициальной жидкости, является достаточно сложным и не до конца изученным процессом.
Лимфообразование и лимфоток
Лимфообразование и лимфоток определяются существованием небольшого градиента гидростатического и коллоидно-осмотического давления между интерстициальной жидкостью и лимфой. Ортоградная направленность потока лимфы обеспечивается на уровне посткапилляров и сосудистого звена клапанным аппаратом, блокирующим ретроградное перемещение лимфы.
Региональная лимфатическая сеть структурно адаптирована к дренируемым тканям и органам, однако ее функционирование осуществляется по стереотипному принципу и включает процессы резорбирования интерстициальной жидкости, формирования лимфы и ее эвакуации из ткани.
У человека с массой тела 70 кг суточный объем жидкости, поступающий в интерстиций, приближается к 20 л, из которых до 75% возвращается обратно в кровь через венозные пути, а около 25% дренируется лимфатическим руслом. Лимфа не идентична интерстициальной жидкости, представляет собой почти прозрачную, беловатую или слегка желтоватую жидкость, рН которой колеблется в зависимости от места образования, приема пищи или функциональной активности ткани в пределах 7,4–9, а плотность — 1,012–1,023. Повышение активности ткани, проницаемости гистогематического барьера или усиление фильтрационных процессов в направлении ткань — интерстиций в условиях гиперемии являются стимулами для лимфообразования и ускорения лимфотока, неадекватность которого ведет к развитию отека.
Цикл работы начальных отделов лимфатического русла слагается из трех последовательных фаз: наполнения, промежуточной фазы и фазы изгнания резорбированной жидкости в проксимальные отделы. Избыточная гидратация интерстиция, окружающего лимфатические капилляры, сопровождается открытием стыков между эндотелиоцитами капиллярной стенки и повышением ее проницаемости. Процесс заполнения начальных отделов лимфатического русла облегчается отсутствием в них базальной мембраны.
Заполнение просветов лимфатических микрососудов жидкостью, содержащей белки, изменяет градиент давления на стенке, обусловливая захлопывание межэндотелиальных стыков в промежуточную фазу процесса и предупреждая утечку макромолекул в интерстиций. Содержание белка в лимфе микрососудов примерно в 3 раза выше, чем в интерстиции, причем в фазе изгнания этот показатель в 5 раз больше, чем при заполнении капилляров.
Фаза изгнания, завершающая цикл, определяется несколькими факторами. При компрессии элементов лимфатического русла некоторая часть жидкости и мелкодисперсных молекул отфильтровывается в ткань. Однако частицы и макромолекулярные белки, резорбированные капиллярами, остаются в оттекающей лимфе благодаря фиксированным межэндотелиальным стыкам, отводящим лимфу и повышающим плотность сосудистой стенки.
Эвакуация лимфы, образующейся в органе, осуществляется экстраорганными сосудами, которые выходят из его ворот к одной (яичник, яички, почки, легкие, сердце) или нескольким (щитовидная и поджелудочная железы, желудок, тонкий и толстый кишечник) группам лимфоузлов.
Лимфатические узлы
Более 600 лимфатических узлов, имеющихся в организме человека, являются плюрипотентными органами, которые участвуют в лимфотранспортных процессах, кроветворении, системе иммунитета. Размеры и форма лимфатических узлов весьма вариабельны, их длина колеблется в пределах 1–20 мм. На вогнутой стороне в лимфоузел через ворота (рис. 1.12) проникают артерии, нервные элементы и выходят вены. Артерии проходят в соединительной ткани трабекул, соединительнотканных ответвлениях капсулы, и разветвляются в субкапсулярно расположенном корковом и занимающем среднюю зону узла мозговом веществе паренхимы, состоящей из ретикулярной ткани и клеточных элементов.
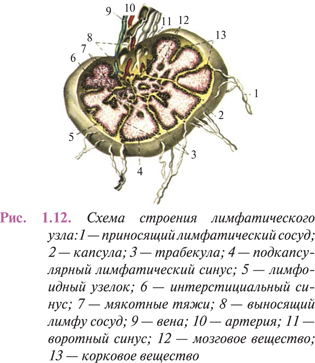
Лимфатические сосуды, приносящие лимфу, распределяются по поверхности лимфатического узла и вступают в его краевой синус. Продвигаясь вдоль трабекул, лимфа попадает в промежуточные синусы, собирается в воротном синусе и поступает в выносящие лимфатические сосуды, которые покидают лимфоузел в области его ворот. Протекающая по синусам лимфа контактирует с ретикулоэндотелиальными клетками с высокой фагоцитарной активностью; при этом обогащается лимфоцитами, которые поступают из фолликулов и мозговых тяжей паренхимы узла.
Лимфатические узлы являются механическим и биологическим фильтром, который задерживает поступление в кровь инородных частиц, микроорганизмов, клеток злокачественных опухолей, токсинов, чужеродных белков. Они могут неоднократно оказываться на пути лимфы, например 5–6 раз в верхней и 8–10 раз в нижней конечностях. По пути к лимфоузлам лимфососуды часто анастомозируют и сливаются с образованием главных и второстепенных стволов.
Множественность путей оттока лимфы повышает эффективность лимфотранспортной системы. Экстраорганные лимфососуды, следующие к региональным и отдаленным лимфоузлам, нередко извиваются вокруг кровеносных сосудов, которым они сопутствуют.
Калибр сосудов, которые отводят лимфу от различных органов, неодинаков и колеблется в пределах 0,025–1,8 мм в соответствии с массой дренируемого органа. При этом увеличение диаметра сосуда по мере приближения к лимфатическим коллекторам не является столь закономерным, как в кровеносном русле.
Колебания давления в правом и левом венозных углах, куда впадают соответствующие грудные протоки, передаются транспортируемой ими лимфе, способствуя ее поступлению в венозную кровь или затрудняя лимфоотток.
Сердце и перикард
Перикард
Перикард (сердечная сорочка) представляет собой замкнутый серозный мешок, со всех сторон окружающий сердце. Полость перикарда включает также легочный ствол вплоть до его бифуркации и восходящую часть аорты до перехода в дугу. Помимо того, в полости перикарда заключены терминальные сегменты легочных, верхней и нижней полых вен, которые прикрыты перикардом только по своей передней поверхности.
Передняя стенка перикарда прилежит к медиастенальной и внутригрудной плевре, вверху соприкасается с отложениями жировой клетчатки, вилочковой железой, ниже — с передней грудной стенкой. Задняя поверхность сердечной сорочки примыкает к правой ЛА, пищеводу, трахее и главным легочным бронхам, аорте, соприкасается с расположенными между ней и плеврой стволами блуждающих нервов. Основание перикарда прочно сращено с сухожильным центром диафрагмы. Обычное содержимое полости сердечной сорочки — около 50 мл прозрачной жидкости соломенно-желтого цвета.
В перикарде различают внешний фиброзный и внутренний серозный слои с гладкой, блестящей, бледной поверхностью, выстланной мезотелием. Серозный слой перикарда состоит из париетальной и висцеральной пластинок, которые покрывают поверхность сердца, за исключением зоны впадения легочных вен и небольшого участка задней поверхности правого предсердия между устьями верхней и нижней полых вен. Между париетальным листком перикарда и эпикардом существует несколько пазух, наибольшими из которых являются поперечная, у начальных отделов аорты и легочного ствола, косая, расположенная в нижней части заднего отдела перикарда, в области терминального сегмента нижней полой вены, и передненижняя в зоне угла между передней грудной стенкой и диафрагмой.
Кровоснабжение перикарда осуществляется многочисленными артериальными ветвями, исходящими в основном из внутренней грудной артерии, ответвлениями грудной аорты и артерий, питающих окружающие органы и ткани (тимус, пищевод, бронхиальное дерево и др.). Венозная кровь оттекает через сплетения, которые образуются венами перикарда, и по венозным сосудам соседних органов.
Иннервация перикарда осуществляется ответвлениями блуждающих и симпатических нервов из поверхностного и глубокого экстракардиального, артериального, переднего, заднего легочных и пищеводного сплетений. В иннервации перикарда участвуют также ветви левого возвратного гортанного и межреберных нервов.
Многочисленные пути лимфооттока проходят через верхние и нижние лимфатические узлы переднего средостения, околопищеводные, бифуркационные и прикорневые узлы легких.
ТОПОГРАФИЯ СЕРДЦА
Сердце является мышечным полостным четырехкамерным органом, который располагается в грудной полости в составе органов среднего средостения. По форме напоминает неправильный конус, основание которого обращено вверх и несколько назад, а верхушка — косо сверху вниз, справа налево и сзади вперед. Различают три основные формы сердца: конусовидную, с горизонтальной осью, превосходящей вертикальную, что характерно для астенического типа телосложения, шаровидную, наблюдающуюся при гиперстеническом типе, когда горизонтальная ось длиннее вертикальной, и переходную, или смешанную, при среднетипичной конституции.
В ориентации вертикальной оси сердца различают три основных варианта: поперечная, или горизонтальная, когда ее угол с продольной осью тела составляет 55–65°, диагональная, или косая (45–55°), и продольная (вертикальная), если этот угол равен 35–45°. Вариабельность формы сердца сочетается с вариабельностью его размеров. Средняя длина вертикальной оси сердца от верхушки до основания колеблется в пределах 10–16 см, ширина у основания — 8–12 см, а переднезадний размер (толщина) на этом же уровне — 6–8,5 см. Средняя масса сердца также подвержена индивидуальным колебаниям, составляет 0,5–0,57% массы тела и достигает у взрослого человека 300 г.
АНАТОМИЯ СЕРДЦА
Сердце имеет 3 поверхности: переднюю (грудинореберную), латеральную (реберную) и нижнюю (диафрагмальную). На грудинореберной поверхности расположена венечная борозда, выше которой находятся правое предсердие и его ушко, прикрывающие восходящий отдел аорты и общий легочной ствол, ушко левого предсердия, лежащее позади легочного ствола. На этой же поверхности слева от передней межжелудочковой борозды расположены участок ЛЖ и верхушка левого предсердия. Легочная или латеральная поверхность сердца, прикрытая легкими, видна только при их отведении. Она представлена задней стенкой левого предсердия и ЛЖ. Нижняя, или диафрагмальная, поверхность сердца несколько уплощена по сравнению с передней. Ее образуют стенка ЛЖ вместе с размещенными правее и несколько кзади от него участками правого предсердия и ПЖ. Левый заокругленный, более массивный, так называемый тупой край сердца сформирован его ЛЖ, а заостренный правый — преимущественно тонкостенным ПЖ.
На поверхности сердца, помимо венечной борозды, которая разграничивает предсердия и желудочки, различают переднюю и заднюю (нижнюю) межжелудочковые борозды, соответствующие границе желудочков. Венечная борозда (sukus coronarius cordis) на передней поверхности сердца шириной 5–7 мм, на задней — 5–10 мм. Спереди она проходит по основанию ПЖ, затем следует под аортой и общим легочным стволом и проходит по основанию левого ушка.
Передняя межжелудочковая борозда (sulcus interventricularis anterior), начинающаяся у легочного ствола от наружной четверти венечной борозды, является ориентиром переднего края межжелудочковой перегородки. Она делит грудинореберную поверхность сердца на две неравные части — правую, более обширную, образуемую ПЖ, и меньшую, принадлежащую ЛЖ. Продолжаясь, левая межжелудочковая борозда (sulcus interventricularis posterior) в области вырезки верхушки соединяется с задней межжелудочковой бороздой, являющейся проекцией заднего края межжелудочковой перегородки на диафрагмальной поверхности сердца. Начало задней межжелудочковой борозды соответствует месту впадения венечного синуса в правое предсердие.
Передняя и задняя межпредсердные борозды (sulcus interventricularis anterior et posterior) также хорошо различимы. Первая располагается за аортой в виде узкой полоски мышечного втяжения от корня аорты к медиальному краю устья полой вены, а задняя — между устьями верхней и нижней полых вен у корня правого легкого. Борозды заполнены слоем жировой клетчатки, выраженность которого зависит от массы тела человека.
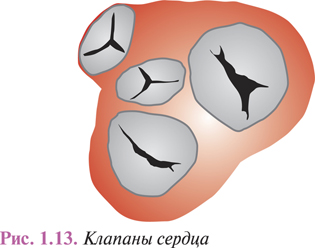
Из правого и левого предсердий кровь перемещается в ПЖ и ЛЖ, откуда выбрасывается соответственно в легочной ствол, начинающий малый круг кровообращения, и в аорту, от которой отходят многочисленные артерии большого круга к органам, стенкам тела и конечностям. Предсердия сообщаются с ПЖ и ЛЖ предсердно-желудочковыми (AV) отверстиями, которые закрываются трех- и двухстворчатым клапанами (рис. 1.13). В начале аорты и легочного ствола имеются клапаны из полулунных заслонок.
Камеры сердца
Правое предсердие (atrium dextrum) имеет форму неправильного цилиндра или куба со сглаженными углами (рис. 1.14).
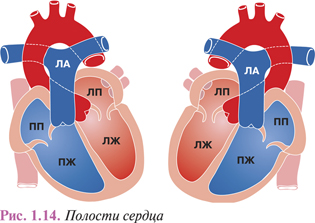
Объем правого предсердия у человека в возрасте 18–25 лет составляет 100–105 см3, оставаясь стабильным до 60 лет, после чего увеличивается еще на 5–10 см3. У взрослых женщин он на 3–6 см3 больше, чем у мужчин. При удлиненной форме сердца предсердие также вытянуто сверху вниз, при шаровидной — в переднезаднем направлении. Давление крови в правом предсердии равняется 6–15 мм рт. ст. Линейные размеры правого предсердия полностью сформировавшегося сердца составляют: переднезадний — 1,1–4,2 см, сагиттальный — 1,2–3,5 см, вертикальный — 1,3–3,7 см, определяясь в каждом конкретном случае индивидуальными особенностями формы сердца. Толщина стенки правого предсердия достигает 2–3 мм, а его средняя масса у взрослых — 17–27 г, что составляет 7,2–9,6% общей массы сердца.
В правом предсердии выделяют 3 отдела — собственно предсердие, правое ушко и синус полых вен, а также верхнюю, переднюю, заднюю, латеральную и медиальную стенки. На разделяющей предсердия предсердной перегородке (septum interatriale) имеется углубление овоидной формы, овальная ямка (fossa ovalis), дно которой истончено и состоит из листков эндокарда. Сверху и спереди края овальной ямки утолщены (перешеек Вьессена). Открытое овальное отверстие, обычно зарастающее на 5–7-м месяце внутриутробного развития плода, отмечают почти в половине врожденных пороков сердца.
Полость правого предсердия ограничивают вместе с медиальной стенкой еще четыре стенки. Верхняя, расположенная между устьями полых вен, имеет гладкую внутреннюю поверхность. Передняя, гладкая изнутри, находящаяся книзу от устьев полых вен, прилежит к задней поверхности восходящей аорты. На задней стенке правого предсердия, соприкасающейся с правым бронхом и правой ЛА, имеются многочисленные трабекулы. Наружная, на которой расположено правое ушко, также имеет характерную трабекулярную структуру.
Правое ушко объемом 10–35 мл имеет треугольную форму. Мышечные трабекулы, формирующие его стенку, разнонаправлены. В заднем сегменте ушка находится мышечный валик (пограничный гребень), отделяющий венозный синус от полости правого предсердия. Полость ушка переходит в правое предсердие, не образуя шейки, а его диаметр, как и размеры самого ушка, широко варьирует и может составлять 0,5–4,5 см.
Правое предсердие принимает кровь из верхней и нижней полых вен, а также из венечного синуса сердца и его многочисленных малых вен. В местах впадения полых вен миокард предсердия утолщен за счет кольцевидных мышечных валиков. Устье верхней полой вены находится на границе верхней и передней стенок предсердия. Его диаметр составляет 1,6–2,3 см. Место впадения нижней полой вены, расположенное между верхней, задней и внутренней стенками предсердия, ограничено полулунной складкой эпикарда — евстахиевой заслонкой шириной около 1 см. Диаметр устья нижней полой вены достигает 2,1–3,3 см, в выпуклом участке стенки между устьями полых вен, обозначаемом как синус полых вен, имеется межвенозный бугорок.
Венечный синус открывается кпереди от заслонки нижней полой вены отверстием, диаметр которого может достигать 1,3 см. Спереди и снаружи оно прикрыто заслонкой венечного синуса — перфорированной складкой эндокарда шириной до 1 см, задний конец которой иногда соединен с заслонкой нижней полой вены. Венечный синус является коллектором вен сердца и важной рефлексогенной зоной. Вокруг его устья расположены многочисленные отверстия вен сердца, самостоятельно впадающих в полость правого предсердия.
ПЖ (ventriculus dexter) по форме напоминает неправильную трехгранную пирамиду. В основании его полости, обращенном вверх к правому предсердию, расположены два отверстия. Спереди и несколько слева направо — артериальное, открывающееся в легочной ствол, справа и сзади — предсердно-желудочковое. К 18–25 годам в систолу ПЖ имеет объем около 45 см3, в диастолу — 150–240 см3 и увеличивается после 45–60 лет еще на 10–15 см3. Линейные размеры полости ПЖ составляют: длина 5,3–10,2 см, переднезадний размер — 4,5–6,9 см, ширина — 2,7–5,6 см, в возрасте старше 55 лет увеличиваясь еще на несколько миллиметров. Средние показатели массы ПЖ у мужчин составляют 73–75 г, у женщин — 63–65 г (около 27% общей массы сердца) и несколько уменьшаются с возрастом. Давление в полости ПЖ, под которым кровь выталкивается в легочной ствол, достигает 45–65 мм рт. ст.
Полость ПЖ ограничена тремя стенками: передней, задней (диафрагмальной) и внутренней, медиальной (перегородочной). Их толщина в различных зонах стенки неодинакова и составляет в области верхушки и средней трети 0,4–0,8 см, несколько уменьшаясь у основания желудочка. Толщина медиальной стенки, образуемой межжелудочковой перегородкой, значительно больше и приближается к толщине стенки ЛЖ. Она имеет нижнюю мышечную часть и меньшую верхнюю мембранозную, расположенную между септальной створкой правого AV-клапана и наджелудочковым гребнем. Последний является границей между собственно полостью желудочка и артериальным конусом.
Длина медиальной стенки, которая по форме, как и две другие, приближается к прямоугольному треугольнику, соответствует длине желудочка. Ее ширина составляет в зависимости от формы сердца 4,5–6,4 см. Поверхность нижнего мышечного и верхнего перепончатого сегментов медиальной стенки неодинакова. Почти гладкая, с мелкими трабекулами у заднего и передненижнего краев в верхней части, она переходит в сложнорельефную сеть на мышечном сегменте, а также на передней и задней стенках желудочка.
В верхнем отделе медиальной стенки находится межжелудочковый гребень, в котором выделяют ствол, переходящий на переднюю стенку желудочка и заканчивающийся двумя-тремя и более ножками, сливающимися с трабекулами. Несколько ниже гребня располагаются сосочковые мышцы, количество которых может достигать пяти. При короткой и широкой шаровидной форме сердца сосочковых мышц больше, чем при удлиненной. Они имеют, как правило, конусовидную или реже цилиндрообразную форму, а их верхушки соединены со створкой AV-клапана сухожильными нитями — хордами толщиной 0,2–1,5 мм. Длина сосочковых мышц увеличивается с возрастом и в зависимости от анатомических особенностей сердца равняется 0,8–2,3 см. Хорды, количество которых варьирует от 1 до 13, могут фиксироваться к створке клапана как по свободному краю, так и вдоль всей ее нижней поверхности, вплоть до фиброзного кольца.
Наиболее протяженная передняя стенка ПЖ также имеет форму прямоугольного треугольника, прямой угол которого образован основанием желудочка и латеральным краем стенки, а острые углы находятся у артериального конуса и верхушки. Передняя стенка составляет значительную часть передней и легочной поверхностей сердца и имеет большую площадь, чем другие стенки желудочка, занимая участок от передней межжелудочковой борозды до острого края сердца. Ее граница с задней стенкой проходит по острому краю правой легочной поверхности желудочка и составляет 3,7–8,8 см, а с медиальной обозначена хорошо выраженной бороздой.
Сложный рельеф внутренней поверхности стенки определяется мясистыми трабекулами, которые ветвятся, образуя многослойные сети, лучше выраженные у верхушки сердца. Трабекулярная сеть полностью формируется к 20 годам, сглаживаясь с возрастом. По отношению к стенке трабекулы могут быть пристеночными или мостовидными, а по степени выраженности различают мелко-, средне- и крупнопетлистую трабекулярность.
Ориентация трабекул в верхней трети стенки преимущественно перпендикулярная к правому предсердно-желудочковому отверстию, а затем косая, направленныя слева направо к правому артериальному конусу, который отграничивается от остальной полости ПЖ спереди мышечным наджелудочковым гребешком, сзади — надкраевой трабекулой. На передней стенке ПЖ расположена эластичная полупрозрачная передняя створка правого предсердно-желудочкового клапана (cuspis anterior valvula tricuspidalis), верхний внешний край которой на всем протяжении прочно фиксирован к фиброзному кольцу, а свободный внутренний край, опускающийся вниз, служит местом прикрепления 5–16 сухожильных хорд, отходящих от верхушек передних сосочковых мышц.
Задняя стенка ПЖ, наименьшая по площади из всех трех, участвует в образовании нижней, диафрагмальной поверхности сердца. Ее граница с медиальной стенкой желудочка соответствует правому краю задней межжелудочковой борозды; с передней стенкой — линии острого края сердца, проходящей между верхушкой желудочка и латеральным сегментом отверстия верхней полой вены. Длина задней стенки ПЖ у межжелудочковой перегородки составляет 3,7–9 см, ширина — 4,3–4,8 см. Трабекулы, меньшие по объему, чем на передней стенке, в целом формируют сходный рельеф. На уровне средней трети длины стенки располагаются 1–3 сосочковые мышцы неправильной конусовидной или цилиндрической формы и несколько меньшего размера, чем на передней стенке желудочка. В верхней части стенки к фиброзному кольцу прикреплена задняя створка AV-клапана (cuspis posterior valvula tricuspidalis), свободный край которой соединен с верхушками сосочковых мышц 4–16 тонкими сухожильными хордами. Иногда часть из них берет начало непосредственно от мясистых трабекул.
Полость ПЖ сердца функционально разграничена на собственно полость и расположенное выше ее воронкообразное продолжение — правый артериальный конус (conus arteriosus dexter). Нижний отдел желудочка функционирует как приемник крови, заполняющийся через расположенное в его основании правое предсердножелудочковое отверстие, а верхний обеспечивает отток крови через устье легочного ствола. Мышечное кольцо, образуемое наджелудочковым гребнем, надкраевой трабекулой и гребешком, предохраняет полость от перерастяжения избытком поступающей крови, соединяет наиболее крупные в правом желудочке переднюю и заднюю сосочковые мышцы.
Правое предсердно-желудочковое отверстие (ostium atrioventricularie dextrum) перекрывает одноименный клапан (valvula tricuspidalis), состоящий из трех створок. Они фиксированы на соединительнотканном фиброзном кольце, плотная ткань которого продолжается в эластичные полупрозрачные створки, по внешнему виду приближающиеся к треугольным пластинкам. Передняя створка клапана закреплена на передней полуокружности кольца, задняя — на его заднелатеральном сегменте, медиальная (наименьшая по площади) — на участке, соответствующем межжелудочковой перегородке.
Подвижность свободного края створок, обращенного в просвет желудочка, ограничивается фиброзными хордами, закрепленными на сосочковых мышцах, которые в систолу удерживают клапаны от выворачивания в полость предсердия. При сокращении предсердия створки клапана, прижимаемые к стенкам желудочка током крови, не препятствуют быстрому заполнению его полости. Другой клапан, определяющий направление потока крови, находится непосредственно в начале легочного ствола, образующего здесь расширение (bulbus trunci pulmonale). Он также состоит из трех полулунных заслонок — левой, правой и передней, расположенных по кругу.
Нижняя выпуклая поверхность створок клапана легочного ствола (valvulae semilunares a. pulmonalis) обращена в полость ПЖ, а вогнутая — в просвет перекрываемого сосуда. Более плотному смыканию створок в диастолу способствуют плотные фиброзные узелки полулунных заслонок, находящиеся на середине свободного края каждой из них. Небольшие карманы между заслонками и стенкой легочного ствола обеспечивают достаточно плотное прилегание к ней створок, прижимаемых током крови. Благодаря этому в систолу кровь свободно перемещается в легочной ствол, а легкая подвижность клапана обеспечивает надежное блокирование ее ретроградного возврата в полость желудочка посредством смыкания створок.
Левое предсердие (atrium sinistrum) по форме напоминает неправильный цилиндр, расположенный поперечно между устьями легочных вен; его стенки не имеют четких границ. Левое предсердие находится в углу между артериальными стволами и правым предсердием, ограничиваясь передней венечной и задней межпредсердной бороздами. Объем левого предсердия у взрослого человека в диастолу составляет 90–135 см3 с тенденцией к увеличению у лиц старших возрастных групп. При сокращении сердца он уменьшается до 45–80 см3. Давление, равное в диастолу 2–4 мм рт. ст., в систолу повышается до 9–12 мм рт. ст. Линейные размеры, как и в других камерах сердца, зависят от его формы. Переднезадний размер варьирует в пределах 1,3–3,7 см, ширина камеры составляет 1,4–2,2 см, высота — 1,3–3,9 см. При этом большие значения горизонтальных параметров коротких и широких сердец соответствуют меньшим значениям вертикальных; обратные отношения отмечают в сердцах удлиненной формы.
В левом предсердии различают верхнюю, латеральную, медиальную, переднюю и заднюю стенки и три отдела: синус легочных вен (sinus vv. pulmonales), собственно предсердие и левое ушко (auricula sinistra). Граница верхней стенки с передней проходит по линии, соединяющей края верхних легочных вен, с задней — по линии между задними краями устьев нижних легочных вен, с латеральной — по линии между медиальными и латеральными краями устьев левых легочных вен, с медиальной — по межпредсердной борозде. Верхняя стенка, расположенная между устьями легочных вен (vv. pulmonales), имеет гладкую поверхность, как и у других стенок левого предсердия. Размер этой стенки у взрослых составляет 2–3 см при ширине 1,8–3 см. Она слегка вогнута со стороны полости предсердия, что обусловлено находящимся здесь синусом легочных вен. Места их впадения не имеют резкого отграничения от миокарда предсердия, который переходит на стенки этих сосудов.
Устья легочных вен лишены клапанного аппарата и содержат кольцевидные утолщения миокарда, сокращения которых предупреждают обратный ток крови. Расстояние между их устьями не превышает 1 см, между фиброзным кольцом и устьями нижних легочных вен справа оно колеблется в пределах 2–6 см, а слева — 1,5–5 см. Кроме расположенных по углам полости отверстий легочных вен, на поверхности верхней стенки левого предсердия выявляются мелкие (до 1 мм диаметром) отверстия впадающих в него наименьших вен сердца.
Латеральная стенка левого предсердия по форме напоминает неправильный, вытянутый сверху вниз четырехугольник. Он отграничен от передней стенки условной вертикальной линией, идущей от внешнего края основания левого ушка к венечной борозде, а от задней — линией, соединяющей наружный край нижней левой легочной вены также с венечной бороздой, обозначающей нижнюю границу стенки. Размеры стенки коррелируют с его формой и колеблются по высоте в пределах 1,5–3,9, по ширине — 1,3–3,7 см. В ее передневерхней части находится щелевидное или овальное отверстие основания левого ушка диаметром от 0,5 до 4 см.
Форма, размеры и объем полости левого ушка, часто используемого как доступ в полость сердца при хирургических вмешательствах, чрезвычайно вариабельны. Его длина по наружной поверхности варьирует в пределах 1–5 см, поперечный размер в средней части тела составляет 0,8–4 см, толщина — 0,5–2 см, а внутренний объем — 1–12 см3. В соответствии с этим выделяют две крайние формы строения ушка: узкое и короткое или широкое и удлиненное. Рельеф внутренней поверхности усложнен многочисленными трабекулами с преимущественно круговой ориентацией. Полости предсердия и ушка в области его шейки отграничены утолщением, образуемым мышечными пучками.
ЛЖ (ventriculus sinister) имеет близкую к конусу форму с обращенным вверх основанием и вершиной, ориентированной вниз, влево и вперед. Объем ЛЖ в диастолу равен 140–210 см3, в систолу — 30–65 см3, длина у медиальной стенки равна 5,5–10,4 см, переднезадний размер — 3,6–6 см, ширина у основания — 2,1–4,7 см. Объем ЛЖ с возрастом увеличивается, как и ПЖ. Толщина стенки ЛЖ у верхушки составляет 0,7–1,3 см: в средней трети — 1,1–1,7 см, вблизи фиброзного кольца — 1–1,7 см. Средние показатели массы ЛЖ у взрослых мужчин колеблются в пределах 148–151 г, у женщин — 130–133 г. Давление в его полости в систолу равно 120 мм рт. ст., в диастолу — 4 мм рт. ст.
Полость ЛЖ ограничивают передняя, медиальная и задняя стенки. Передняя и задняя стенки вследствие закругленности левого края сердца плавно переходят одна в другую. По форме передняя стенка приближается к прямоугольному треугольнику, короткая сторона которого обращена к основанию желудочка, один острый угол к верхушке, второй — к месту перехода аортального конуса (conus aortae) в аорту. В зависимости от конфигурации сердца длина передней стенки может быть равна 5,5–10,4 см, ширина — 2,4–3,8 см. С возрастом морфометрические параметры передней стенки и полости ЛЖ несколько увеличиваются. Внутренний рельеф полости определяется развитой трабекулярной сетью, однако менее выраженной по сравнению с правым желудочком. У основания левого предсердно-желудочкового отверстия трабекулы и межтрабекулярные щели располагаются вертикально, ниже они ориентированы косо, справа налево.
В нижней половине передней стенки расположены 1–3 довольно массивные сосочковые мышцы, длина которых колеблется в пределах
1,3–4,7 см. В сердце удлиненной формы есть, как правило, только одна передняя сосочковая мышца. В зависимости от конституативных особенностей сердца и соответственно размеров сосочковой мышцы расстояние между ее верхушкой и фиброзным кольцом может составлять 1–5 см.
На передней стенке ЛЖ находится передняя створка левого двустворчатого предсердно-желудочкового клапана (valvula bicuspidalis seu mitralis), прочно фиксированная к переднему и частично медиальному сегменту левого фиброзного кольца, перекрывающая доступ в аортальный конус в диастолу и открывая его под напором крови в систолу. Форма створки приближается к треугольной, ширина колеблется в пределах 1,8–3,9 см, а высота — 2,1–4,5 см, свободный край несколько утолщен. Она соединена с сосочковыми мышцами сухожильными хордами, ветвящимися по пути следования от верхушки, а иногда — от верхней трети мышцы к свободному краю створки. В результате при одной передней сосочковой мышце отходящие от нее 5–15 хорд заканчиваются 18–40 фиброзными нитями у свободного края створки.
Задняя стенка по форме соответствует прямоугольнику, основание которого направлено вверх и к фиброзному кольцу, а нижний угол — к верхушке желудочка. У нее нет четкой границы с передней стенкой желудочка, верхняя проецируется на венечную борозду, а медиальная (длиной 4,2–9,8 см) соответствует задней межжелудочковой борозде. Сагиттальный размер задней стенки желудочка у его основания равен 2,1–4,7 см.
Рельеф поверхности формируют трабекулярные мышцы, ориентированные вблизи основания преимущественно вертикально, на уровне средней трети желудочка — косо. У верхушки они образуют сеть мясистых и фиброзных трабекул, окружающих основания располагающихся здесь задних сосочковых мышц, от одной — в узких удлиненных сердцах и до 6 — в коротких и широких. В соответствии с формой желудочка длина сосочковых мышц колеблется от 4,5 до 1,2 см, а толщина — в пределах 0,5–2,2 см. Их верхняя часть отстоит от фиброзного кольца соответственно на 5–1 см, а основание от верхушки желудочка — на 4,4–1,5 см.
На верхней половине стенки расположена задняя створка предсердно-желудочкового клапана шириной 2–7,5 см и высотой в пределах 0,5–2,5 см в зависимости от формы и размеров сердца. Иногда вместо одной выявляют до четырех взаимодополняющих створок, закрепленных на фиброзном кольце, со свободным краем, соединенным с задними сосочковыми мышцами сухожильными хордами толщиной 1–2 мм. Количество хорд колеблется в пределах 20–70 пропорционально числу сосочковых мышц, а их протяженность находится в обратной зависимости от длины отдающих их мышечных образований.
Медиальная стенка, образуемая межжелудочковой перегородкой, со стороны полости ЛЖ по форме чаще всего приближается к равнобедренному треугольнику. Верхняя граница стенки имеет длину 3,6–6 см. Проходит по медиальной полуокружности фиброзного кольца. Две другие границы определяются проекцией передней и задней межжелудочковых борозд, а их длина соответствует размерам других стенок ЛЖ. Сосочковые мышцы на этой стенке желудочка отсутствуют. Ее внутренняя поверхность на уровне верхних двух третей гладкая, иногда на ней контурируются ветви левой ножки предсердно-желудочкового пучка проводящей системы сердца. В нижней трети стенки и в области верхушки появляется сеть тонких мышечных трабекул, усложняющая рельеф.
Основание конусовидной полости ЛЖ ориентировано вверх, вправо и несколько назад. В нем имеются два снабженных клапанами отверстия: слева и спереди расположено левое AV-, правее, кзади от него — отверстие аорты. Расположенный на границе левого предсердия и желудочка двухстворчатый (митральный) клапан в нормальных условиях практически не оказывает сопротивления при заполнении его полости, эффективно блокируя обратный ток крови в систолу посредством смыкания своих передней и задней створок, общее количество которых может колебаться от 2 до 6. В систолу ЛЖ передняя створка выгибается в сторону венозного кольца, вместе с более широкой задней створкой закрывая левое AV-отверстие.
Подвижность створок по направлению тока крови ограничивается длиной прикрепленных к их утолщенному свободному краю сухожильных хорд и упруго-эластическими свойствами сосочковых мышц. В диастолу створки клапана прилегают к стенкам желудочка, перекрывая при этом аортальное отверстие у межжелудочковой перегородки. Открытый вниз, влево и вперед овал митрального клапана имеет площадь 11,8–13,12 см2 (по некоторым данным — 2,86–17,18 см2), продольный диаметр — 1,7–4,7 см, поперечный — 1,7–3,3 см. Периметр окружности левого предсердно-желудочкового отверстия в месте прикрепления створок к фиброзному кольцу в молодом возрасте составляет 6–9 см, с возрастом может увеличиваться до 12–15 см. Среднестатистические показатели у мужчин несколько больше, чем у женщин.
Гладкостенный левый артериальный конус, завершающийся выходом в аорту, имеет воронкообразную форму. Три его стороны ограничены мышечными стенками желудочка, а четвертая образована полулунными створками аортального клапана. Передняя, правая и левая створки клапана фиксируются фиброзным треугольником и фиброзным кольцом.
Как и общий легочной ствол, начальный отдел аорты в месте расположения клапана образует луковицу аорты (bulbus aortae). Стенка луковицы аорты, по строению соответствующая артериям эластического типа, дополнительно усилена ригидным фиброзным кольцом, обеспечивающим устойчивость к изменяющейся нагрузке АД. Ее диаметр у взрослого человека равен 1,5–3 см, длина периметра колеблется в пределах 4,7–9,4 см, а расчетная площадь поперечного сечения, перекрываемого клапаном, находится в пределах 4,56±1,12 см2.
Высота луковицы аорты достигает 1,7–2,5 см. На ее внутренней поверхности располагаются синусы аорты с выемками в сосудистой стенке глубиной 1,5–3 мм, к нижнему краю которых прикреплены 3 полулунные заслонки (valvula semilunaris sinistra, dextra at posterior aortae), формирующие аортальный клапан.
Высота аортальных синусов (1,7–2 см) несколько больше, чем у соответствующих полулунных заслонок, по ширине превышающих синусы. Пространства между стенкой аортальных синусов и обращенной к ней поверхностью полулунных заслонок клапана носят название синусов Вальсальвы. В систолу синусы заполняются прилегающими к стенке аорты створками клапана, которые в диастолу возвращаются в исходное положение обратным током крови, захлопывающей клапан и заполняющей синусы. На середине утолщенного свободного края створок расположено по одному соединительнотканному узелку Аранци, которые обеспечивают их полное смыкание. Между дугообразными основаниями треугольных створок аортального клапана имеются небольшие промежутки, называемые пространствами Генле.
Соответственно маршруту перемещения крови от предсердно-желудочкового отверстия к аорте в ЛЖ (рис. 1.15) различают области ее притока и оттока, границей между которыми служит передний парус митрального клапана. Область притока включает весь объем собственно полости ЛЖ, а область оттока продолжает собственно полость ЛЖ до аортального конуса, из которого кровь поступает в большой круг кровообращения.
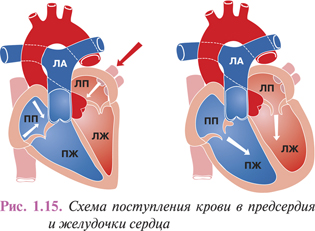
Предсердно-желудочковое соединение (junctura atrioventriculare) является основой фиброзного скелета сердца, который выполняет функцию его опорного аппарата. В этом месте ряд фиброзных образований кольцевидной формы объединен фиброзными треугольниками в единое целое. Анатомически предсердно-желудочковое соединение включает стабилизирующие его фиброзные пучки, правое и левое фиброзные кольца, правый и левый фиброзный треугольники, которые вместе с миокардом формируют предсердно-желудочковую перегородку, плотные соединительнотканные кольца, укрепляющие входные отверстия легочного ствола и аорты (рис.1.16).

Наружный край фиброзных колец, ограничивающих предсердно-желудочковые отверстия, служит местом прикрепления мышечных пучков стенок желудочков и предсердий, а внутренний является местом фиксации створок AV-клапанов. Фиброзные кольца представляют собой ответвления фиброзных треугольников, в каждом из колец можно выделить переднюю и заднюю ветви.
В результате соединения близлежащих участков фиброзных колец и фиброзных треугольников позади отверстия аорты образуется фиброзный центр сердца, сверху сращенный с межпредсердной перегородкой, сзади — с перепончатой частью перегородки, разделяющей предсердия. Фиброзный центр является основой пластинки, разграничивающей предсердия и желудочки. От фиброзных колец отходят пучки коллагеновых волокон, которые латерально вплетаются в сердечную мышцу, медиально — в ткань створок предсердно-желудочковых клапанов, повышая механическую прочность всей конструкции.
Окружность левого предсердно-желудочкового отверстия (ostium atrioventriculare sinistrum) определяется размерами фиброзного кольца, связанного с левым фиброзным треугольником, и в 20–40 лет составляет 6–11 см, увеличиваясь с возрастом на 2–3 см. Периметр правого фиброзного кольца и соответствующего отверстия на 2–3 см превосходит аналогичный параметр левого кольца.
Фиброзное кольцо, от которого начинается стенка аорты, расположено в месте перехода аортального конуса в восходящую аорту. Здесь к нему прикреплены створки аортального клапана, которые состоят из коллагеновых пучков, принадлежащих обоим фиброзным треугольникам. Правая сторона кольца укреплена сухожилием артериального конуса, соединяющегося с его нижним краем. Расположение и пространственные взаимоотношения фиброзного кольца легочного ствола с соответствующими тканевыми структурами сходны с теми, которые отмечены у фиброзного кольца аорты.
Фиброзные треугольники соединены между собой мощным тяжем коллагеновых волокон, который передним краем охватывает заднюю полуокружность аорты. Левый фиброзный треугольник лежит между левым предсердно-желудочковым отверстием и левым передним аортальным синусом, а пучки его коллагеновых волокон образуют переднюю ветвь левого фиброзного кольца. Более мощный правый фиброзный треугольник расположен между предсердно-желудочковыми отверстиями и задним горизонтальным синусом аорты. От него влево и вправо отходят пучки коллагеновых волокон, которые формируют обе ветви правого и заднюю ветвь левого фиброзного кольца.
Миокард стенки камер сердца прочно связан с фиброзными кольцами, расположенными на границе предсердий и желудочков, которые служат ему «точкой опоры». В предсердии он состоит из двух слоев: поверхностного, общего для обеих камер, и глубокого, раздельного для каждой из них. Мышечные волокна и их пучки в первом слое ориентированы поперечно. Во втором одна часть, расположенная петлеобразно, подобно сфинктерам охватывает устья вен, впадающих в предсердия, другая, берущая начало от фиброзных колец и ориентированная продольно, образует вертикальные тяжи — трабекулы, местами выступающие внутрь полостей ушек предсердий. Циркулярные волокна у основания ушек составляют дугообразные пучки, ограничивающие их сообщение с полостями предсердий.
В отличие от предсердий, миокард желудочков состоит из трех слоев: поверхностного (внешнего, stratum superficiale), среднего (stratum circulare) и внутреннего (stratum longitudinale). На передней поверхности сердца волокна внешнего мышечного слоя, прикрепленные к передним дугам фиброзных колец и к сухожилию конуса легочного ствола, следуют косо вниз к боковым краям сердца. В области его верхушки образуют завиток (vortex cordis) и продолжаются во внутренний, глубокий, расположенный продольно мышечный слой сердечной стенки, который формирует папиллярные мышцы и межжелудочковые трабекулы. На задней поверхности сердца волокна внешнего мышечного слоя, также отходящие от задних дуг фиброзных колец, следуют косо вправо, в направлении, противоположном ориентации мышечных волокон передней поверхности сердца. Не достигая его верхушки, они заканчиваются в папиллярных и трабекулярных мышцах ПЖ. В отличие от общих для обоих желудочков поверхностного и внутреннего мышечных слоев, расположенный между ними средний слой обособлен для каждого. Его циркулярно расположенные волокна проходят параллельно фиброзным кольцам, окружая каждый желудочек непрерывным мышечным кольцом.
Мышечные волокна, участвующие в формировании межжелудочковой перегородки, образуют в ней S-образный изгиб и с каждой стороны переходят в глубокий мышечный слой смежного желудочка, заканчиваясь в его папиллярных мышцах и трабекулах. Часть мышечных волокон, отходящих от передней дуги левого фиброзного кольца, дважды спиралевидно охватывает ЛЖ сердца, образуя так называемую бульбарную спираль Маккаллума.
ГИСТО- И УЛЬТРАСТРУКТУРА ЭПИКАРДА, МИОКАРДА, ЭНДОКАРДА
Стенка сердца состоит из трех оболочек: эпикарда (висцеральная пластинка перикарда), миокарда (мышечная оболочка) и эндокарда (внутренняя оболочка).
Эпикард
Снаружи миокард предсердий и желудочков покрыт тонким пленчатым образованием, которое по гистологическому строению относят к серозным оболочкам. В эпикарде различают пять слоев. Наружный, обращенный в полость перикарда, образован мезотелием — крупными полигональными клетками однослойного плоского эпителия. В области корней крупных сосудов мезотелий вместе с эндокардом переходит на перикард, покрывая его сплошным слоем и обеспечивая скольжение висцеральной и париетальной поверхностей при движениях сердца. Относительная лабильность контактов между клетками мезотелия допускает образование стомат- и стигмат-каналов для интерстициальной жидкости, облегчающих ее резорбцию из полости перикарда.
Структурную основу эпикарда образуют три слоя: поверхностный — коллагеновый, средний — эластический и глубокий — коллагеново-эластический, непосредственно переходящий в эндомизий миокарда. Нервные элементы распределены главным образом в пограничной мембране и поверхностном коллагеновом слое, являющимся также зоной распределения лимфатической сети.
Эпикард кровоснабжается мелкими сосудистыми ветвями субэпикардиальных или интрамиокардиальных артерий. В местах перехода висцерального листка перикарда в париетальный отмечают сосудистые клубочки, образуемые обильно иннервируемыми артериолами, которые активно участвуют в образовании и резорбции полостной жидкости. Микрогемоциркуляторное русло эпикарда имеет сетевидное строение и состоит из стереотипного набора элементов: артериол, пре- и посткапилляров, соединяющих анастомозирующие между собой капилляры, и собирательных везикул, открывающихся в мелкие вены.
Сеть, образуемая микрососудами, трехслойна. Слагается из поверхностного сплетения, расположенного непосредственно под базальной мембраной, и более глубокого, лежащего в поверхностном коллагеновом слое. Оба сплетения широко анастомозируют между собой. Архитектонику сосудистого русла эпикарда усложняют многочисленные анастомозы с сосудами хорошо васкуляризованной жировой ткани, субэпикардиальный слой которой может достигать 1,5 см. Плотность сосудистой сети в различных зонах эпикарда непостоянна: гуще над ЛЖ, чем над латеральной зоной ПЖ или в области предсердий.
Миокард
Насосная функция сердца обеспечивается высокоспециализированными мышечными клеткам — кардиомиоцитами, которые имеют неправильную цилиндрическую форму. Длина кардиомиоцитов из различных отделов сердца колеблется в пределах 50–120 мкм, ширина — 10–20 мкм. Посредством контактов «конец в конец» кардиомиоциты объединены в мышечные волокна с хорошо выраженной продольной и поперечной исчерченностью. Косопоперечные мостики между их боковыми поверхностями интегрируют миокард в «функциональный синтиций».
На микро-макроскопическом уровне отчетливо прослеживается тенденция к группированию мышечных волокон в пучки (фасцикулы) различной мощности. Нежные прослойки рыхлой соединительной ткани, ограничивающие их, соответствуют перемизию скелетных мышц и являются местом распределения интрамуральных сосудов, элементов лимфатической сети и нервной системы. Однако пучковая структура миокарда достаточно условна вследствие широкого обмена фасцикул мышечными волокнами и сопровождающими их микрососудами (рис. 1.17).
Структурная консолидация мышечных волокон и проходимость просветов питающих их капилляров во все фазы сердечного цикла обеспечивается коллагеновым каркасом, имеющим три уровня организации. Коллагеновая сеть охватывает целые группы мышечных волокон и интрамуральные сосуды, окружает микрососуды, нервные элементы, образует эндомизий мышечных волокон, межмиоцитарные и миоцитарно-капиллярные соединения, формируя сложную трехмерную систему.
Эндомизий представляет собой нежный несплошной футляр из пучков коллагеновых филаментов толщиной 120–150 нм, который прочно соединен с кардиомиоцитами на уровне их Z-линий. Эта связь осуществляется короткими тяжами, образующими вокруг клеток манжетки, контактирующие посредством специализированных молекул адгезии с элементами цитоскелета. Сплетения перимизия объединены поперечными коллагеновыми волокнами и более грубыми продольно ориентированными волокнистыми структурами, извитыми на протяжении. Помимо этого, ближайшие кардиомиоциты дополнительно связаны короткими «распорками» толщиной 30–70 нм, а также гранулами и микронитями из фибронектина, предупреждающими их скольжение относительно друг друга. Эластические волокна в миокарде единичны, их количество увеличивается в старших возрастных группах.
Интерстиций миокарда
Пространство между кардиомиоцитами желудочков, предсердий и клетками проводящей системы сердца выполнено сложноструктурированной средой, которая интегрирует элементы сократительного миокарда, питает его и координирует работу мышечных волокон. Компоненты интерстиция соотносятся следующим образом: 55% составляют сосудистые структуры, 5% — элементы нервной системы, на клетки соединительной ткани, ее волокна и протеогликаны приходится 7; 4 и 23% объема соответственно, а оставшиеся 6% — на оптически пустые зоны. Рыхлая соединительная ткань интерстиция, структурно интегрирующая миокард, представляет собой полифункциональную систему взаимозависимых элементов.
Межклеточное вещество обеспечивает формирование среды для нормального функционирования рабочих компонентов миокарда. С биофизической точки зрения межклеточное вещество — это армированный композит, включающий сильно гидратированный гель, транспортно-трофические свойства которого определяются протеогликанами и гликопротеинами. Их крупные молекулы состоят из белка, ковалентно связанного с гликозаминогликанами. Наиболее важные из них — гиалуроновая кислота, гепарин, сульфатированный и несульфатированный хондроитин.
Волокнистые элементы в интерстиции здорового миокарда немногочисленны. Их основу составляет коллаген I и в меньшем количестве — III типа. Молекулы коллагена способны к самосборке в слоистые упорядоченные структуры со свойствами жидких кристаллов. Волокна коллагена, армирующие межклеточное вещество, ориентированы, как правило, параллельно растягивающей силе, что обеспечивает максимальную эффективность их опорно-скелетной функции.
Связанные между собой коллагеновые фибриллы, спиралевидно обвивающие кардиомиоциты, предупреждают перерастяжение мышечных волокон и ограничивают их взаимное смещение в динамике сердечного цикла. Деформации коллагеновых структур, возникающие при этом, генерируют дополнительное усилие при возвращении сердца к исходному объему.
Субстанции, структурированные в коллагеновых волокнах, базальных мембранах и основном межклеточном веществе, продуцируются различными клетками. Синтез гликозаминогликанов и склеропротеидов осуществляется в эндоплазматическом ретикулуме и комплексе Гольджи фибробластов, в сосудистой стенке — гладкомышечными клетками, гепарин синтезируется в тучных клетках.
В миокарде клетки фибробластического ряда различаются степенью зрелости и специализацией. Все они способны к миграции в трехмерном коллагеновом геле, в основе их энергического метаболизма лежит гликолиз. Синтезированные молекулы коллагена обладают способностью к самосборке, порядок которой определяется расположением аминокислот в концевых отделах. Этот процесс и моделирование образующихся волокон осуществляются на поверхности фибробластов, что, однако, не исключает «дистанционное» фибриллообразование.
В физиологических условиях катаболизм коллагена, как и фибриллогенез, осуществляется на клеточной основе. Десмолитические факторы — катепсины, коллагеназа, гиалунидаза, ряд нелизосомных ферментов — продуцируются не только специализированными фибробластами, но и макрофагами, тучными клетками, лейкоцитами. Энзимотическую дезинтеграцию межклеточного вещества регулируют изменения рН, концентрация Са2+, гематические факторы. Клеточная резорбция фибробластами избыточного или дефектного коллагена иммунонезависима и регулируется «коллагенчувствительными» рецепторами их поверхности. Разновесие десмолитических и десмопластических процессов представляет важный фактор тканевого гомеостаза.
Фибробласты, макрофаги и иногда присутствующие в интерстиции форменные элементы крови служат источником многочисленных цитокинов, которые не только регулируют морфогенез стромы, но и воздействуют на эндотелий и кардиомиоциты. Однако наиболее мощное воздействие на морфофункциональное состояние всех тканевых компонентов, поддерживающих нормальный баланс стромы и сократительного миокарда, оказывают сами кардиомиоциты. В спектр биологически активных веществ, синтезируемых кардиомиоцитами желудочков, входят металлопротеазы, коллагеназы (стромелин, желатиназы А и В) и ряд других гуморальных факторов.
Структура рабочих кардиомиоцитов
В основе функции высокоспециализированных кардиомиоцитов лежит процесс электромеханического сопряжения. В соответствии с этим в каждом кардиомиоците имеются следующие структурно-функциональные комплексы: контрактильный аппарат, система рецепции регуляторных сигналов и поддержания внутриклеточного гомеостаза, включая обмен электролитов, система воспроизводства и транспорта макроэргических фосфатов, система обеспечения пластической и секреторной функций клетки, а также система внутриклеточного катаболизма, основным элементом которой являются лизосомы.
Расположение структурных компонентов отражает функциональную специализацию различных отделов клетки, в которой выделяют три зоны: перинуклеарную, миофибриллярную и подсарколеммную (рис. 1.18). Перинуклеарная зона занимает 2–5 мкм вокруг ядра, в ее гиалоплазме содержатся митохондрии, лизосомы, отложения липофусцина, микротельца, цитогранулы, элементы гладкого и шероховатого ретикулума, иногда — вакуоли, липидные капли, сосредоточивающиеся преимущественно у полюсов ядра. Строение этой зоны может изменяться в зависимости от функционального состояния клетки. Миофибриллярная зона занимает большую часть внутриклеточного пространства. Включает миофибриллы, митохондрии, элементы саркотубулярной системы, цитогранулы, иногда — другие органеллы. Под сарколеммой в прозрачном матриксе расположены цитогранулы, начальные отделы Т-системы, а также микропиноцитозные везикулы, митохондрии, элементы саркоплазматического ретикулума и цитоскелета, связывающего миофибриллы и сарколемму.
Контрактильный аппарат вентрикулярных кардиомиоцитов занимает 40–60% внутриклеточного объема. Образующие его миофибриллы пронизывают клетку от одной апикальной поверхности до другой, прочно закрепляясь в плазмолемме, часто анастомозируя. В одном кардиомиоците содержится до 1000 миофибрилл, состоящих из компактных, хорошо упакованных пучков сократительных нитей — миофиламентов Количество миофиламентов в миофибриллах неодинаково — от 200 до 1000, однако, несмотря на различный объем, их структура стереотипна. В световом микроскопе сердечная мышца выглядит поперечно-полосатой. Вдоль мышечного волокна чередуются регулярно расположенные темные, анизотропные, имеющие постоянную длину А-диски, и изотропные, светлые I-диски, укорачивающиеся в систолу.
Элементарной структурой миофибриллы является саркомер (рис. 1.19), ограниченный двумя Z-линиями, каждая из которых делит соответствующий изотропный I-диск на две равные части. Саркомеры клеток миокарда расположены таким образом, что их Z-линии параллельны друг другу не только в одном, но и в соседних кардиомиоцитах. Z-линия, или телофрагма, имеет аморфно-фибриллярную структуру, образуемую белками десмином, виментином, филамином, а-актинином, которые являются основными компонентами цитоскелета. Z-линии смежных миофибрилл соединены между собой, а по периферии клетки — с сарколеммой и элементами коллагенового каркаса миокарда посредством специализированных молекул адгезии.
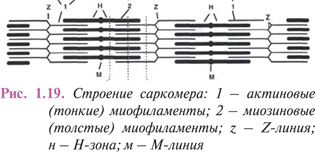
Сокращение саркомера определяется взаимным перемещением двух разновидностей миофиламентов — толстых длиной 1,65 мкм и толщиной 15 нм, образуемых миозином, и тонких, основу которых составляет актин. Длина тонких филаментов даже в пределах одного сарко-мера колеблется в широких пределах — от 0,65 до 1,4 мкм, тогда как их толщина постоянна и равна 8 нм. Наружные концы актиновых нитей прочно вплетены в телофрагму, а внутренние располагаются между толстыми филаментами, на периферии образуемого ими А-диска. Участок совместного расположения толстых и тонких филаментов релаксированного саркомера заметно светлее А-диска. Он обозначается Н-зоной, имеющей нечеткие границы из-за различной длины актиновых филаментов.
В центре саркомера расположен еще один поперечно ориентированный опорный диск — М-линия, или мезофрагма, шириной 50–80 нм, который образован перемычками, удерживающими вместе толстые филаменты. Если взятый для исследования материал зафиксирован в конце диастолы, по обеим сторонам мезофрагмы можно видеть относительно светлые L-полоски вследствие отсутствия на миозиновых филаментах поперечных мостиков, обеспечивающих их функциональной контакт с актиновыми протофибриллами. Длина максимально расслабленного саркомера — 3–3,5 мкм. В систолу она уменьшается до 1,5 мкм вследствие скольжения толстых и тонких филаментов друг относительно друга. В полностью сокращенном саркомере I-диски и L-зоны исчезают. Таким образом, в зоне Н, границей которой служат продвигающиеся вперед кончики тонких филаментов, содержатся только толстые, а в зоне I — только тонкие филаменты. На поперечных срезах саркомеров через А-диски выявляется гексогональное расположение протофибрилл, причем каждая толстая нить окружена 6 тонкими.
Состав и структура протофибрилл достаточно сложны. Толстая нить слагается из 180–360 продольно-ориентированных, сплетенных между собой молекул миозина. Она имеет утолщение — двойную головку, подвижно соединенную с удлиненной хвостовой частью, состоящей из двух фрагментов. Начальный фрагмент длиной 60 нм вместе с головкой образует компонент протофибриллы, называемый тяжелым меромиозином, который также подвижно соединен с легким меромиозином — вторым ее фрагментом длиной около 90 нм. Головки миозина с правильными интервалами располагаются вдоль толстого филамента, за исключением зоны М-линии саркомера. На электронных микрофотографиях головки молекул миозина имеют вид поперечных мостиков между тонкими и толстыми филаментами.
Тонкие нити изотропного диска состоят из глобулярных молекул актина. Обвивая друг друга, они образуют остов филамента — двойную спираль, по бокам которой проходят два продольных желобка. В этих желобках, повторяя форму актиновой спирали, уложены тонкие молекулы тропомиозина, к которым на правильных расстояниях присоединены молекулы тропонина, каждая из которых состоит из трех субъединиц. Тропонин и тропомиозин играют ключевую роль в регуляции взаимодействия актина и миозина.
Комплекс тропонина и тропомиозина действует как молекулярное запирающее устройство, не позволяющее актину тонких фибрилл взаимодействовать с головками миозина. Присоединение Са2+ к тропонину изменяет конформацию тропонин-тропомиозинового комплеса и открывает актиновые участки, способные взаимодействовать с миозином, что инициирует сокращение. Сокращение саркомера происходит вследствие образования и разъединения поперечных мостиков между тонкими и толстыми филаментами, что заставляет последние скользить вдоль миозиновых протофибрилл к центру А-диска. Сила сокращения пропорциональна числу актомиозиновых мостиков, она возрастает с увеличением площади перекрытия филаментов до входа концов тонких актиновых нитей в Н-зону. Длина саркомера в конце диастолы, равная 2,2 мкм, соответствует наиболее полному взаимному перекрытию филаментов с максимальным числом поперечных актомиозиновых мостиков между ними. И сокращение, и расслабление саркомера осуществляется при обязательном участии АТФ.
Сокращение миофибрилл — сложный процесс, который осуществляется в результате целого комплекса условий: наличия соответствующего энергетического потенциала и концентрации ионов кальция, адекватной функции ряда ферментов, электрохимического импульса, запускающего этот многокомпонентный механизм. Координация всех фаз сокращения и расслабления кардиомиоцита обеспечивается его ионтранспортной системой, функционирование которой возможно благодаря компартментализации внутриклеточного пространства и специфическим свойствам осуществляющих это мембран. Основными элементами данной системы являются сарколемма, саркоплазматический ретикулум и митохондрии.
Строение сарколеммы подчинено ее основным функциям, в ней начинается процесс электромеханического сопряжения с последующей мобилизацией всех непосредственно участвующих в нем органелл. В сарколемме различают внутренний слой, плазматическую мембрану (плазмолемма) и гликокаликс (базальная мембрана, перимембрана, гликолемма).
Гликокаликс, покрывающий поверхность кардиомиоцита, входит в непосредственный контакт с межклеточным пространством, стенками капилляров, коллагеновыми волокнами. Представляет собой опорно-фибриллярный комплекс сложных липидов, протеогликанов и коллагена IV типа. В гликокаликсе различают поверхностную и более плотную внутреннюю пластинки толщиной 20 и 30 нм. Наличие в гликокаликсе сиаловых кислот и гликозаминогликанов сообщает ему полианионные свойства. Гликокаликс стабилизирует плазмолемму, является основным внеклеточным депо Са2+, участвующего в регуляции сокращения кардиомиоцита. Между ним и плазмолеммой имеется довольно постоянная щель шириной 10 нм.
Плазмолемма представляет собой элементарную трехслойную мембрану толщиной 8 нм. С биофизической точки зрения это микрогетерогенно-динамическая система с жидкокристаллическими свойствами. В плазмолемме выявляются белковые частицы диаметром 7–10 нм, как погруженные в липидный бислой мембраны, так и пересекающие всю ее толщу. Структура мембраны поддерживается нековалентными, гидрофобными и гидрофильными взаимодействиями белков, липидов и олигосахаридов. Один из основных компонентов мембраны — белки часто совмещают структурную функцию с рецепторной или ферментной, примерами чего являются Na+, К+-АТФаза, комплекс β-адренорецептор — аденилатциклаза и др. Важнейшая особенность плазмолеммы, обусловленная присутствием белков, — наличие каналов, обеспечивающих медленный, электрогенный и быстрый, электронейтральный транспорт Са2+. Фиксация сарколеммы свободной поверхности рабочих кардиомиоцитов к миофибриллам на уровне Z-линий обусловливает ее фестончатые выбухания при сокращении клетки.
Сарколемма кардиомиоцита имеет пять различных специализированных зон: большие и малые инвагинации, формирующие Т-систему и кавеолы, участки контактов с саркоплазматическим ретикулумом и вставочные диски. Диаметр кавеол — 50–80 нм, они являются динамичными структурами, напоминающими везикулы. Их содержимое — гранулярный или мелкодисперсный матрикс. Количество кавеол увеличивается при нагрузке или при СН.
Т-систему образуют глубокие разветвленные впячивания боковой сарколеммы, выстланные гликокаликсом. Устья Т-тубул находятся на уровне Z-линий. Их начальные отделы, ориентированные перпендикулярно миофибриллам, диаметром 150–200 нм. Т-система образует продольные и поперечные ответвления, постепенно истончается и проникает до границы околоядерного пространства, примерно на треть увеличивая суммарную площадь сарколеммы. Ее тесный контакт с саркоплазматическим ретикулумом обеспечивает проведение электрохимического импульса в аксиальные отделы клетки.
Вставочный диск при световой микроскопии виден как темная линия неодинаковой ширины, проходящая через мышечное волокно. Он образуется сарколеммой двух кардиомиоцитов на уровне Z-линий одного или нескольких саркомеров (см. рис. 1.19). В пределах вставочного диска имеются три вида специализированных структур: нексусы, десмосомы и промежуточные соединения (рис. 1.20).

Десмосомы и промежуточные соединения служат для более прочного механического скрепления клеток. Десмосомы — электронно-плотные округлые образования диаметром от 30 до 200 нм. Со стороны цитоплазмы в состав десмосом входят плотные пластинки прикрепления и связанные с ними пучки переплетающихся коротких, плотно расположенных кератиновых тонофиламентов толщиной около 10 нм. Межклеточная щель в области десмосом равна 20–30 нм. Посредине содержит полоску богатого белком материала, так называемый центральный диск, тонкими перемычками связанный с мембранами соседних клеток.
Промежуточные соединения занимают большую часть горизонтального сегмента вставочного диска, который в этой зоне имеет зигзагообразный профиль, а щель между клеточными мембранами шириной до 30 нм заполнена тонкофибриллярным материалом, способствующим их скреплению. На внутренней поверхности плазмолеммы в данных участках присутствуют компактные отложения электронноплотного материала, образуемого фосфолипидами и цитоскелетными белками, характерными для телофрагмы. Актиновые протофибриллы внедряются во внутреннюю поверхность этих участков плазмолеммы, переплетаясь с плотной сетью отходящих от них тонофибрилл. Таким образом, благодаря промежуточным соединениям мембрана вставочных дисков клетки как бы соответствует первой или последней Z-линиям.
Нексусы, или щелевые контакты, располагающиеся преимущественно вдоль миофибрилл на вертикальных сегментах вставочного диска, занимают 7–10% его поверхности. В электронном микроскопе высокого разрешения нексус на поперечном срезе имеет вид семислойной конструкции, по три слоя которой принадлежат каждой из контактирующих мембран смежных клеток, разделенных светлой щелью шириной 2 нм. В составе нексусов выявлены глобулярные структуры диаметром около 7 нм, которые располагаются на расстоянии 10 нм друг от друга, формируют гексагональные фигуры, образующие ориентированные поперек мембраны каналы глубиной около 9 нм. Возможность прямого межклеточного обмена ионами через эти структуры обеспечивает быструю межклеточную передачу импульсов, вызывающих сокращение. В пределах вставочного диска располагаются и свободные от специализированных структур участки такого же строения, что и плазмолемма боковых поверхностей клетки, но без гликокаликса и кавеол. В этих местах мембраны соседних клеток мышечного волокна тесно прилежат друг к другу, никогда, однако, не сближаясь между собой в такой степени, как в нексусах.
Функция сарколеммы по поддержанию ионного гомеостаза клетки тесно связана с саркоплазматическим ретикулумом. Эти органеллы представляют собой сложную систему трубочек, оплетающих миофибриллы, их стенка образована агранулярной цитомембраной. Саркоплазматический ретикулум включает свободную сеть и терминальные цистерны, структурно и функционально дифференцированные.
Свободная сеть состоит из анастомозирующих канальцев диаметром 20–60 нм, ориентированных поперечно и продольно. Они образуют два сплетения на уровне М-линий и в зоне телофрагмы, так называемый пористый воротник. Расположение тубулярных элементов сети относительно стабильно благодаря их фиксации тончайшими плотными нитями цитоскелета. Поперечные трубочки более многочисленны, чем продольные, которые через промежуточные цистерны постепенно переходят в промежуточные, а затем в терминальные цистерны в виде слепых мешковидных образований. Цистерны саркоплазматического ретикулума контактируют либо с сарколеммой, либо с Т-тубулами. В зависимости от плоскости среза эти контакты могут образовывать триады, муфты, более сложные фигуры из 4 трубочек.
Т-система и саркоплазматический ретикулум между собой не сообщаются. В области контактов между их мембранами всегда сохраняется зазор шириной около 10 нм при длине контакта от 0,1 до 1 мкм. В таких зонах определяют специализированные структуры, состоящие из расположенных по оси цистерны плотной полоски, образованной рядом тесно прилегающих гранул, и периодических уплотнений диаметром около 15 нм, разделенных промежутками в 20 нм.
В диастолу Са2+ из саркоплазмы элиминируется канальцами свободной сети, перемещается по ним к цистернам, из которых вновь выбрасывается при инициации сокращения. Часть протеинов мембраны саркоплазматического ретикулума совмещает функции пластического материала и энзимов. В первую очередь это относится к Са2+-Мg2+-зависимой АТФазе — основному компоненту кальциевого насоса, обеспечивающего расслабление миокарда. Помимо того, в саркоплазматическом ретикулуме присутствуют кислые гидролазы и фосфолипазы, активирование которых может иметь критическое значение в патологии.
Митохондрии. Высокая интенсивность механической работы миокарда находит отражение в строении его энергообеспечивающего аппарата. Местом, где протекают процессы тканевого дыхания и окислительного фосфорилирования, являются митохондрии — органеллы овоидной формы размером 0,5–2,5 мкм, основной источник макроэргических фосфатов. Они располагаются между миофибриллами, чаще всего по 1–2 митохондрии на каждый саркомер, под сарколеммой, вокруг ядра, занимая около 35% объема клетки. Иногда смежные митохондрии образуют тесные контакты, в зоне которых содержится мелкозернистый электронноплотный материал. Количество межмитохондриальных контактов варьирует в зависимости от функциональной нагрузки на клетку.
Митохондрии состоят из наружной мембраны, образующей оболочку органелл, и внутренней, формирующей многочисленные, расположенные параллельно, плотно упакованные складки-кристы, обычно ориентированные в поперечном направлении. Межкристное пространство заполнено мелкозернистым матриксом, содержащим электронно плотные гранулы, более темным, чем узкая щель между наружной и внутренней мембранами органеллы. Наружная и внутренняя мембраны митохондрий имеют толщину до 6 нм, но существенно отличаются по своему составу, физико-химическим свойствам и функциям. Первая более насыщена холестерином, легко проницаема для мелких молекул, например креатинфосфата. Энзимы мембран принадлежат к различным метаболическим звеньям. Для внутренней мембраны характерно более высокое содержание белка, до 25% которого составляют дыхательные ферменты. Митохондрии кардиомиоцитов содержат собственную ДНК, синтезирующую РНК и до 15% митохондриальных белков.
Функции митохондрий не ограничиваются воспроизводством макроэргических фосфатов и обновлением собственной структуры, но включают еще и участие в обмене ионов кальция. Поглощение ими ионизированного кальция, благодаря наибольшей емкости этого внутриклеточного депо, эффективно поддерживает электролитный баланс саркоплазмы. Однако при определенных обстоятельствах возможно быстрое освобождение этих ионов из митохондрий с неблагоприятными последствиями для клетки. Помимо окислительного фосфорилирования, зависящего от кислородзависимого тканевого дыхания, воспроизводство некоторой доли АТФ обеспечивается анаэробным гликолизом, в процессе которого утилизируется глюкоза, доставляемая кровью либо образуемая из депонированного в клетке гликогена.
В общий энергетический баланс здорового миокарда гликолиз вносит заметно меньший вклад, чем аэробное окисление. Вместе с тем для многих процессов, регулирующих уровень ионов кальция в цитозоле клетки, преимущественным источником АТФ является именно гликолиз.
Гранулы метаболически лабильного β-гликогена в виде округлых частиц умеренной электронной плотности диаметром 20–40 нм рассеяны в саркоплазме под сарколеммой, между митохондриями, в околоядерной зоне. Некоторую его часть выявляют в составе относительно инертных белковополисахаридных комплексов — гликосом.
Регенераторный аппарат кардиомиоцитов представлен нуклеарным и саркоплазматическим компонентами. Большинство кардиомиоцитов имеет одно и лишь 10–13% — два ядра, занимающих осевое положение. На долю ядра приходится 2,8–5,4% объема клетки. Длина миокардиальных ядер колеблется от 7 до 12 мкм. Оболочка ядра, карио- или нуклеолемма, состоит из двух элементарных мембран толщиной около 7–8 нм, формирующих отдельные мешотчатые образования с узким (10–30 нм) перинуклеарным пространством между ними, которое сообщается с просветом саркоплазматического ретикулума. На гладкой цитоплазматической поверхности нуклеолеммы иногда выявляют рибосомы.
Сообщение нуклео- и саркоплазмы осуществляется посредством пор круглой или октагональной формы, периметр которых образован стенками наружного и внутреннего листков нуклеолеммы. Ядерные поры закрыты тонкой белковой диафрагмой, ограничивающей их проницаемость. Ядро заполнено электроннопрозрачной нуклеоплазмой, основное содержимое которой дезоксинуклеопротеиды — хроматин в неактивной, конденсированной форме (гетерохроматин) либо в активном деконденсированном состоянии (эухроматин). Гетерохроматин имеет вид компактных электронноплотных глыбок, расположенных в основном под нуклеолеммой и вокруг ядрышек. Эухроматин, обычно преобладающий в ядрах кардиомиоцитов, в виде слабоконтрастной сети заполняет все остальное внутриядерное пространство.
Количество ядрышек варьирует от 1 до 5–6. Их структурной основной является ДНК, тонкие нити которой сплетены в нуклеолонемму. Благодаря ей ядрышки являются местом сосредоточения ядрышковых организаторов — мест синтеза рибосомальной РНК (рРНК), который осуществляется деконденсированным хроматином — участками хромосом, объединенных в петлистый шнур — нуклеолемму. На поперечном срезе нуклеолеммы выявляют ее светлую слабоструктурированную сердцевину — фибриллярный центр, образованный ДНК ядрышкового организатора. Фибриллярный центр окружен плотным кольцом фибриллярного материала, структурирующегося в рРНК, и гранулярным компонентом — многочисленными гранулами созревающих рибосом. Это придает ядрышку вид петлистого клубочка из темного гранулярного и филаментозного материалов, перемежающегося узкими более светлыми включениями — фибриллярными центрами.
Пул саркоплазматических рибосом весьма многочисленен. Их гранулы имеют округлую форму и диаметр около 15 нм. Рибосомы располагаются в околоядерном пространстве либо под сарколеммой плотнее, чем между миофибриллами. Иногда они объединены в короткие цепочки-полирибосомы, которые выстраиваются между актиновыми нитями саркомера в зоне телофрагмы, где синтез белков контрактильного аппарата наиболее активен. В саркоплазме, чаще всего перинуклеарно, выявляют тубулы или спиралевидные элементы шероховатого эндоплазматического ретикулума, также имеющего прямое отношение к пластической функции кардиомиоцита.
У полюсов ядра определяют элементы относительно слабо развитого пластинчатого комплекса Гольджи. Мембрана органеллы образует 3–4 уплощенных цистерны, окруженных несколькими десятками мелких пузырьков с содержимым различной электронной плотности. Основная функция пластинчатого комплекса состоит в воспроизводстве гликопротеинов и липопротеинов цитомембран.
Ошибки при биосинтезе белков в здоровой клетке достигают 15% их общей продукции. Помимо того, химические воздействия и конформационные изменения функционирующих макромолекул неизбежно влекут их постепенную денатурацию. Необходимость освобождения от таких продуктов обусловливает потребность клетки в специализированном аппарате их разрушения и элиминирования. Наиболее изученным его звеном являются лизосомы, которые, как и в других клетках, воспроизводятся пластинчатым комплексом и саркоплазматической сетью. Их преимущественное расположение — перинуклеарная зона.
Первичные лизосомы представляют собой округлые тельца диаметром 0,5 мкм с электронноплотным матриксом. Они содержат сложный набор гидролитических ферментов и окружены одноконтурной мембраной. Эти органеллы обладают способностью ассоциироваться с внутриклеточными структурами, подлежащими расщеплению, с последующей частичной утилизацией либо удалением из клетки. Сливаясь с ними, они образуют крупные вторичные лизосомы размером до 2 мкм, с полиморфным содержимым, трансформирующиеся в резидуальные тельца. К последним относятся и гранулы липофусцина — тельца неправильной формы размером до 7 мкм, состоящие из аморфного вещества и скоплений осмиофильных зерен диаметром 7–50 нм. Их количество увеличивается с возрастом и в условиях патологии.
Функция лизосом осуществляется в комплексе с различными протеазами. Система внутриклеточного катаболизма кардиомиоцитов включает также рибонуклеазы, структурированные непосредственно в рибосомах, фосфолипазы, которые также локализуются на мембранах митохондрий, саркоплазматического ретикулума, плазмолемме в непосредственной близости от расщепляемых субстратов.
К числу редко выявляемых в кардиомиоцитах органелл относят пероксисомы (микротельца), имеющие отношение к липидному и углеводному обмену. Это мелкие (0,15 на 0,25 мкм) тельца овоидной формы с плотным гранулярным матриксом, окруженным мембраной. Наиболее частая локализация пероксисом — на границе А–I дисков миофибрилл, а также вблизи митохондрий, терминальных цистерн саркоплазматического ретикулума, жировых включений, «липидных капель», иногда выявляемых рядом с митохондриями.
В саркоплазме во всех участках кардиомиоцита присутствуют микрофиламенты диаметром 7–10 нм, которые совместно с микротрубочками образуют цитоскелет клетки и, возможно, определяют внутриклеточные перемещения жидкости.
Структурные особенности различных типов кардиомиоцитов
В строении кардиомиоцитов различных отделов сердца имеются некоторые отличия, которые минимальны для клеток ЛЖ и ПЖ. Хотя структура контрактильного аппарата и митохондрий клеток обоих желудочков практически идентична, в ПЖ ядра кардиомиоцитов чаще имеют складчатую поверхность, цепевидное расположение митохондрий между миофибриллами чередуется с гнездным, в виде скоплений. Т-тубулы, проникающие в околоядерную зону кардиомиоцитов ПЖ, образуют заметные расширения, чаще выявляют фрагменты шероховатой эндоплазматической сети, липидные включения, а элементы более развитого пластинчатого комплекса, помимо перинуклеарного пространства, чаще отмечают и в периферических отделах клетки. Саркоплазма содержит больше цитогранул, причем гликоген образует розетки вокруг митохондрий и под сарколеммой. Эти особенности отражают более высокую способность ПЖ сердца к адаптации при повреждениях либо перегрузках по сравнению с ЛЖ.
Различия миокарда желудочков и предсердий более существенны. Ход мышечных волокон в предсердиях более извилистый, а промежутки между ними шире, чем в желудочках. В связи с этим они довольно рыхло объединены в отдельные анастомозирующие пучки, как и в желудочках. По размерам предсердные кардиомиоциты значительно уступают клеткам желудочков: их средняя длина — 18–22, диаметр — 6–9 мкм, внешне очертания также заметно усложнены. Кардиомиоциты предсердий, в отличие от желудочков, весьма неоднородны по своей структуре. При меньшей степени дифференцированности в плане контрактильной функции в их структуре присутствуют отчетливые признаки секреторной активности. Ультраструктура миофибрилл предсердных и желудочковых кардиомиоцитов однотипна, однако объем, занимаемый контрактильным аппаратом в клетках предсердий, примерно на 40% меньше, а иммунохимические тесты свидетельствуют о его качественном отличии от подобных структур рабочих клеток желудочков. Вследствие меньшего количества миофибрилл зона их прикрепления в промежуточных соединениях вставочного диска заметно короче и содержит меньше электронноплотного материала.
Вставочные диски имеют вид ровной линии, перпендикулярной длиннику клетки, без ступенчатости, характерной для мышечных волокон желудочков. Десмосомы присутствуют не только во вставочном диске, но и на боковых поверхностях апикальных отделов контактирующих клеток, сливаясь с плотным материалом Z-линий. Нексусы, напротив, располагаются между десмосомами и промежуточными соединениями вставочного диска.
Меньшему объему миофибрилл соответствует и меньшее количество митохондрий, структурно не отличающихся от описанных выше, а также значительно менее развитый саркоплазматический ретикулум, в котором преобладают продольные элементы, а диаметр канальцев меньше, чем в клетках желудочков. Т-система в предсердных кардиомиоцитах также выражена слабее и присутствует не во всех клетках. Ее строение значительно упрощено, а менее многочисленные канальцы ориентированы вдоль миофибрилл. Сарколемма предсердных кардиомиоцитов, не имеющих Т-системы, образует многочисленные кавеолы, что, возможно, компенсирует отсутствие Т-тубул. В то же время для кардиомиоцитов предсердий характерно большее развитие элементов пластинчатого комплекса Гольджи, шероховатого эндоплазматического ретикулума, более высокая плотность рибосом в саркоплазме.
Специфической особенностью предсердных кардиомиоцитов является наличие в них секреторных гранул, или «плотных телец», которые почти не отмечаются в желудочках (рис. 1. 21).
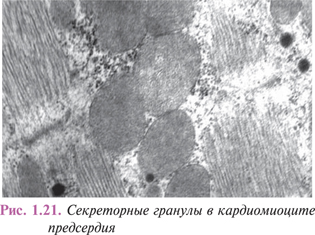
Количество плотных телец коррелирует со степенью развития пластинчатого комплекса и гранулярной эндоплазматической сети. Секреторные гранулы неоднородны по строению и составу содержимого. Различают несколько разновидностей этих округлых, покрытых мембраной телец: расположенные около ядра, темные, аргентофинные диаметром 100–450 нм; светлые, преобладающие в левом предсердии, размером 200–450 нм, а также аргентофинные гранулы, локализующиеся рядом с миофибриллами, и наиболее крупные из всех лизосомы и аутофагические вакуоли.
Количество специфических гранул, как и клеток без Т-системы, в правом предсердии значительно больше, чем в левом. Обилие и разнообразие секреторных гранул соответствуют функции сердца как эндокринного органа, в котором содержатся катехоламины, ренин, ангиотензин, предсердный натрийуретический полипептид и целый ряд других веществ, оказывающих как внутри-, так и экстраорганное воздействие. Помимо специфических «атриальных» гранул, в околоядерной зоне присутствуют лизосомы, имеющие более крупные размеры.
По мощности контрактильного аппарата, органелл, обеспечивающих его работу, их распределению, присутствию в клетке морфологических эквивалентов секреторной активности предсердные кардиомиоциты могут быть разграничены по крайней мере на две разновидности: рабочие и мышечно-секреторные. Первые по своей структуре напоминают кардиомиоциты желудочков, тогда как у второй разновидности секреторная функция, по-видимому, доминирует над контрактильной. Об этом свидетельствуют слабее развитые миофибриллярные структуры, меньшее количество и размеры митохондрий и в то же время хорошо представленный комплекс органелл, осуществляющих пластические процессы и обеспечивающих секреторную функцию: комплекс Гольджи, гранулярная эндоплазматическая сеть. Их отличает также большое число специфических гранул в обильной светлой саркоплазме и отсутствие Т-системы. Количество светлых мышечно-секреторных клеток в правом предсердии значительно больше, чем в левом. Концентрируются ближе к эпикарду и в клетках проводящей системы сердца (пучках Бахмана). Морфологические и иммунохимические данные дают основание полагать сходный онтогенез этих предсердных кардиомиоцитов и структурно- гомологичной популяции клеток проводящей системы желудочков.
Эндокард
Полости сердца и все выступающие в них структуры — трабекулы, сосочковые мышцы, сухожильные нити и клапаны — выстилает эндокард (его внутренняя оболочка). Толщина эндокарда обратно пропорциональна мощности миокарда — в предсердиях, особенно в левом, она больше, чем в желудочках, особенно на трабекулах или сосочковых мышцах, однако везде сохраняет трехслойное строение. Со стороны полостей сердца эндокард покрыт эндотелиальным монослоем, непосредственно продолжающимся из сосудистых стволов.
Эндотелиальное покрытие эндокарда испытывает большую функциональную нагрузку вследствие колеблющихся по силе гемодинамических воздействий и активного обмена метаболитами между плазмой крови и субэндотелиальной тканью. Неодинаковые условия функционирования отражаются на морфологических характеристиках эндотелиоцитов, обусловливая их заметные отличия в различных отделах сердца. В ЛЖ это уплощенные полигональные клетки с относительно ровными контурами, тогда как в ПЖ и предсердии они крупнее, местами резко разнятся размерами и формой. Эндотелиоциты ложных сухожилий — это многогранники, неориентированные либо вытянутые поперек сухожилия. Межклеточные щели эндотелия фиброзных нитей и клапанов сердца тоньше и сложнее по конфигурации, чем трабекулярного эндокарда, и не имеют определенной ориентации.
Поверхность эндотелия, контактирующая с кровью, покрыта гликокаликсом с атромбогенными свойствами. Он повторяет микрорельеф эндотелиального монослоя и контурирует утолщенные ядросодержащие зоны клеток, короткие маргинальные складки в зоне межклеточных стыков, микровыступы, лучше выраженные там, где кровоток имеет турбулентный характер, например на папиллярных мышцах или на сердечных клапанах. Предсердия имеют более ровную эндотелиальную поверхность.
Эндотелий эндокарда лежит на тонком субэнтелиальном слое, отграничиваясь базальной мембраной. Субэндотелиальный слой образован густым тонкофибриллярным сетчатым коллагеновым компонентом, погруженным в основное межклеточное вещество с небольшим количеством клеток камбиального типа. Эндотелий и субэндотелиальный слой полостей сердца переходят в выстилку стенок открывающихся в них сосудов Вьессена — Тебезия.
Глубже следует наиболее толстый эластически-мышечный средний слой эндокарда, образуемый плотной соединительной тканью с большим количеством эластических волокон, которые в наиболее толстых участках переслаиваются пластами коллагеновых элементов. В глубине этого слоя среди эластических волокон расположены немногочисленные гладкомышечные клетки.
Наиболее глубокий слой эндокарда образован рыхлой соединительной тканью, непосредственно связанной с эндомизием миокарда. В этом слое расположены немногочисленные кровеносные сосуды, образующие широкие петли, лимфатическая сеть и элементы нервной системы, жировые клетки и разветвления проводящей системы сердца, состоящие из клеток Пуркинье.
Створки сердечных клапанов образованы складками эндокарда. Створки обоих AV-клапанов имеют сходное строение. Их основу образует средний опорный слой плотной соединительной ткани, исходящей из фиброзных колец. По своей структуре напоминает апоневроз и образован пучками коллагена, наиболее мощными у основания створки. Ткань клапанов эластична, что во многом обусловлено наличием многочисленных переплетающихся эластических волокон. Постепенно истончаясь, опорный слой достигает края створки, продолжаясь в сухожильные нити.
У свободного края количество волокнистых структур значительно уменьшается, а соединительнотканных клеток и основного межуточного вещества увеличивается.
Эндокард, покрывающий опорный слой створки клапана, имеет сходное строение с эндокардом камеры сердца, из которой он исходит, резко истончаясь в фиброзных нитях. В соответствии с этим эндокард, выстилающий клапаны, со стороны предсердий заметно толще и имеет лучше выраженную послойную структуру, чем на поверхности, обращенной к желудочкам, где эластический слой, подстилающий эндотелий, в 4–6 раз тоньше и практически не содержит гладкомышечных клеток.
В основании клапанов количество гладкомышечных элементов увеличивается. Здесь присутствуют мелкие сосуды и капилляры, распространяющиеся на створки, отмечаются жировые клетки. Трофика основной функциональной части клапанов осуществляется посредством диффузии из омывающей их крови. Иногда в зоне прикрепления створки отмечают волокна кардиомиоцитов, как бы спускающиеся в субэндотелиальный слой клапана со стороны стенки предсердия.
Створки «выпускных» клапанов сердца — аорты и легочного ствола — тоньше, чем антриовентрикулярных и, несмотря на отсутствие фиброзных нитей, сохраняют в принципе сходную структуру. Их основа, как и у предсердно-желудочковых клапанов, образована тонким, но прочным и эластичным средним слоем с большим количеством коллагеновых волокон, несколько утолщенным по свободному краю. Со стороны желудочков полулунные створки также покрыты эндокардом, более толстым у основания клапана, но истончающимся вплоть до неразличимости слоев на самих створках. Богат эластическими волокнами и не содержит мышечных клеток.
Слой на поверхности створок, обращенный к аорте или к легочному стволу, состоит из поперечно ориентированных коллагеновых волокон с незначительной примесью эластических элементов, продолжающихся из интимы и медии этих сосудов. Расширенное основание клапанов имеет сечение треугольника, примыкающего к соответствующим кольцам фиброзного скелета сердца. Здесь присутствует рыхлая соединительная ткань, в которой расположены сосудистые и нервные элементы, не проникающие в створки клапанов.
СОСУДИСТАЯ СИСТЕМА СЕРДЦА
Транспортно-трофическое обеспечение функции сердца осуществляется сложно устроенной сосудистой системой, включающей артерии, микроциркуляторное русло, систему оттока венозной крови и лимфы.
Анатомия артерий сердца
Главным источником кровоснабжения сердца являются венечные артерии (рис. 1.22).

Левая и правая венечные артерии ответвляются от начальной части восходящей аорты в левом и правом синусах. Расположение каждой венечной артерии варьирует как по высоте, так и по окружности аорты. Устье левой венечной артерии может находиться на уровне свободного края полулунной заслонки (42,6% наблюдений), выше или ниже ее края (в 28 и 29,4% соответственно). Для устья правой венечной артерии наиболее частым является расположение выше свободного края полулунной заслонки (51,3% наблюдений), на уровне свободного края (30%) или ниже его (18,7%). Смещение устьев венечных артерий вверх от свободного края полулунной створки составляет до 10 мм для левой и 13 мм — для правой венечной артерии, вниз — до 10 мм для левой и 7 мм — для правой венечной артерии. В единичных наблюдениях отмечают и более значительные вертикальные смещения устьев венечных артерий, вплоть до начала дуги аорты.
По отношению к средней линии синуса устье левой венечной артерии в 36% наблюдений оказывается смещенным к переднему или заднему краю. Значительное смещение начала венечных
артерий по окружности аорты приводит к отхождению одной или обеих венечных артерий от несвойственных им синусов аорты, а в редких случаях обе венечные артерии исходят из одного синуса. Изменение расположения устьев венечных артерий по высоте и окружности аорты не влияет на кровоснабжение сердца.
Левая венечная артерия расположена между началом легочного ствола и левым ушком сердца и делится на огибающую и переднюю межжелудочковую ветви. Последняя следует к верхушке сердца, располагаясь в передней межжелудочковой борозде. Огибающая ветвь направляется под левым ушком в венечной борозде на диафрагмальную (заднюю) поверхность сердца. Правая венечная артерия после выхода из аорты ложится под правое ушко между началом легочного ствола и правым предсердием. Далее поворачивает по венечной борозде вправо, затем — назад, достигает задней продольной борозды, по которой опускается до верхушки сердца, называясь уже задней межжелудочковой ветвью. Венечные артерии и их крупные ветви лежат на поверхности миокарда, располагаясь на различной глубине в подэпикардиальной клетчатке.
Разветвления основных стволов венечных артерий делят на три типа — магистральный, рассыпной и переходный. Магистральный тип ветвления левой венечной артерии наблюдается в 50% случаев, рассыпной — в 36% и переходный — в 14%. Последний характеризуется делением ее основного ствола на 2 постоянные ветви — огибающую и переднюю межжелудочковую. К рассыпному типу относятся случаи, когда основной ствол артерии отдает межжелудочковую, диагональную, добавочную диагональную и огибающую ветви на одном или почти на одном уровне. От передней межжелудочковой ветви, как и от огибающей, отходят 4–15 ветвей. Углы отхождения как первичных, так и последующих сосудов различны и колеблются в пределах 35–140°.
Согласно Международной анатомической номенклатуре, принятой на Конгрессе анатомов в Риме в 2000 году, различают следующие сосуды, кровоснабжающие сердце:
Левая венечная артерия (arteria coronaria sinistra)
- Передняя межжелудочковая ветвь (r. interventricularis anterior)
- Диагональная ветвь (r. diagonalis)
- Ветвь артериального конуса (r. coni arteriosi)
- Латеральная ветвь (r. lateralis)
- Перегородочные межжелудочковые ветви (rr. interventricularis septales)
- Огибающая ветвь (r. circumflexus)
- Анастомотическая предсердная ветвь (r. atrialis anastomicus)
- Предсердно-желудочковые ветви (rr. atrioventricularis)
- Левая краевая ветвь (r. marginalis sinister)
- Промежуточная предсердная ветвь (r. atrialis intermedius).
- Задняя ветвь ЛЖ (r. posterior ventriculi sinistri)
- Ветвь синусно-предсердного узла (r. nodisinoatrialis)
- Ветвь предсердно-желудочкового узла (r. nodi atrioventricularis)
Правая венечная артерия (arteria coronaria dextra)
- Ветвь артериального конуса (ramus coni arteriosi)
- Ветвь синусно-предсердного узла (r. nodi sinoatrialis)
- Предсердные ветви (rr. atriales)
- Правая краевая ветвь (r. marginalis dexter)
- Промежуточная предсердечная ветвь (r. atrialis intermedius)
- Задняя межжелудочковая ветвь (r. interventricularis posterior)
- Перегородочные межжелудочковые ветви (rr. interventriculares septales)
- Ветвь предсердно-желудочкового узла (r. nodi atrioventricularis).
К 15–18 годам диаметр венечных артерий (табл. 1.1) приближается к показателям взрослых. В возрасте старше 75 лет наблюдается некоторое увеличение диаметра этих артерий, что связано с утратой эластических свойств артериальной стенки. У большинства людей диаметр левой венечной артерии больше правой. Количество артерий, отходящих от аорты к сердцу, может уменьшаться до 1 или увеличиваться до 4 за счет дополнительных венечных артерий, которых нет в норме.
Таблица 1.1
Диаметр магистральных субэпикардиальных артерий (мм)
| Название артерии | Крайние значения посмертных изменений | Прижизненные значения по данным коронарографии (крайние/средние значения) | ||
| детей | взрослых | Mc. Alpin (1975) | А.А. Лиллосон (1978) | |
| Правая венечная артерия | 0,8–2,5 | 2,2–6,8 | 2,3–4,5
3,2±0,6 |
2,7–6
3,3±0,07 |
| Левая венечная артерия | 1,1–3,6 | 4,2–6 | 2,6–5,5
4–0,7 |
2,9–7
4,6±0,08 |
| Огибающая ветвь | 0,7–1,3 | 0,5–3 | 1,7–4,4
9±0,7 |
2–5,5
4,6±0,08 |
| Передняя межжелудочковая ветвь | 1,0–3,5 | 2,8–4,8 | 2,4–3,5
3,4±0,5 |
1–5,5
3±0,08 |
| Задняя межжелудочковая ветвь | 0,7–1,3 | 1–3 | — | 1–3
1,9±0,04 |
| Правая краевая ветвь | — | — | 0,8–2,7
1,7±0,6 |
1–03
1,8±0,05 |
| Левая краевая ветвь | — | — | 1,6–3,3
2,4±0,5 |
1–3
1,7±0,04 |
| Диагональная ветвь | 0,7–1,3 | 0,5–3 | 1,3–2,4
2±0,3 |
0,8–3,5
1,6±0,04 |
Левая коронарная артерия (ЛКА) берет начало в задневнутреннем синусе луковицы аорты, проходит между левым предсердием и ЛА и примерно через 10–20 мм делится на переднюю межжелудочковую и огибающую ветви.
Передняя межжелудочковая ветвь является прямым продолжением ЛКА и проходит в соответствующей борозде сердца. От передней межжелудочковой ветви ЛКА отходят диагональные ветви (от 1 до 4), которые участвуют в кровоснабжении боковой стенки ЛЖ и могут анастомозировать с огибающей ветвью ЛЖ. ЛКА отдает от 6 до 10 перегородочных ветвей, которые кровоснабжают передние две трети межжелудочковой перегородки. Сама передняя межжелудочковая ветвь ЛКА достигает верхушки сердца, снабжая его кровью. Иногда передняя межжелудочковая ветвь переходит на диафрагмальную поверхность сердца, анастомозируя с задней межжелудочковой артерией сердца, осуществляя коллатеральный кровоток между левой и правой коронарными артериями (при правом или сбалансированном типах кровоснабжения сердца).
Правая краевая ветвь раньше называлась артерией острого края сердца — ramus margo acutus cordis. Левая краевая ветвь — ветвь тупого края сердца — ramus margo obtusus cordis, поскольку хорошо развитый миокард ЛЖ сердца делает его край закругленным, тупым).
Таким образом, передняя межжелудочковая ветвь ЛКА кровоснабжает переднебоковую стенку ЛЖ, его верхушку, большую часть межжелудочковой перегородки, а также переднюю сосочковую мышцу (за счет диагональной артерии).
Огибающая ветвь, отходя от ЛКА, располагаясь в AV (венечной)-борозде, огибает сердце слева, достигает перекрестка и задней межжелудочковой борозды. Огибающая ветвь может как закончиться у тупого края сердца, так и продолжиться в задней межжелудочковой борозде. Проходя в венечной борозде, огибающая ветвь посылает крупные ветви к боковой и задней стенкам ЛЖ. Кроме того, от огибающей ветви отходят важные предсердные артерии (в их числе — r. nodi sinoatrialis). Эти артерии, особенно артерия синусного узла, обильно анастомозируют с ветвями правой коронарной артерии (ПКА).
Поэтому ветвь синусного узла имеет «стратегическое» значение при развитии атеросклероза в одной из магистральных артерий.
ПКА начинается в передневнутреннем синусе луковицы аорты. Отходя от передней поверхности аорты, ПКА располагается в правой части венечной борозды, подходит к острому краю сердца, огибает его и направляется к crux и далее — к задней межжелудочковой борозде. В области пересечения задней межжелудочковой и венечной борозд (crux), ПКА отдает заднюю межжелудочковую ветвь, которая идет по направлению к дистальной части передней межжелудочковой ветви, анастомозируя с ней. Редко ПКА заканчивается у острого края сердца.
ПКА своими ветвями кровоснабжает правое предсердие, часть передней и всю заднюю поверхность ЛЖ, межпредсердную перегородку и заднюю треть межжелудочковой перегородки. Из важных ветвей ПКА следует отметить ветвь конуса легочного ствола, ветвь синусного узла, ветвь правого края сердца, заднюю межжелудочковую ветвь.
Ветвь конуса легочного ствола часто анастомозирует с конусной ветвью, которая отходит от передней межжелудочковой ветви, образуя кольцо Вьессена. Однако, приблизительно в половине случаев (Schlesinger M. et al., 1949), артерия конуса легочного ствола отходит от аорты самостоятельно.
Ветвь синусного узла в 60–86% случаев (Арьев М.Я. , 1949) отходит от ПКА, однако есть данные, что в 45% случаев (James T., 1961) она может отходить от огибающей ветви ЛКА и даже от самой ЛКА. Ветвь синусного узла располагается по стенке ПЖ и достигает места впадения верхней полой вены в правое предсердие.
У острого края сердца ПКА отдает довольно постоянную ветвь — ветвь правого края, которая идет вдоль острого края к верхушке сердца. Примерно на этом уровне отходит ветвь к правому предсердию, которая снабжает кровью переднюю и боковую поверхности правого предсердия.
В месте перехода ПКА в заднюю межжелудочковую артерию от нее отходит ветвь AV- узла, которая кровоснабжает этот узел. От задней межжелудочковой ветви перпендикулярно отходят ветви к ПЖ, а также короткие ветви к задней трети межжелудочковой перегородки, которые анастомозируют с подобными ветвями, отходящими от передней межжелудочковой артерии ЛКА.
Таким образом, ПКА снабжает кровью переднюю и заднюю стенки ПЖ, частично — заднюю стенку ЛЖ, правое предсердие, верхнюю половину межпредсердной перегородки, синусный и AV-узлы, а также заднюю часть межжелудочковой перегородки и заднюю сосочковую мышцу.
Типы кровоснабжения сердца
Из сказанного выше понятно, что ЛКА снабжает кровью значительно больший как по объему, так и по значению массив сердца. Однако принято рассматривать, какой тип кровоснабжения (левовенечный, правовенечный или равномерный) присутствует у больного. Речь идет о том, из какой артерии в конкретном случае сформирована задняя межжелудочковая артерия, зоной кровоснабжения которой является задняя треть межжелудочковой перегородки; то есть при наличии правовенечного типа задняя межжелудочковая ветвь сформирована из ПКА, которая развита более выражено, чем огибающая ветвь ЛКА. Однако это не значит, что ПКА кровоснабжает больший, по сравнению с ЛКА, массив сердца. Правовенечный тип васкуляризации характеризуется тем, что правая венечная артерия заходит за заднюю продольную борозду и снабжает своими ветвями правую и большую часть левого сердца, а огибающая ветвь левой венечной артерии оканчивается на тупом краю сердца. При левовенечном типе огибающая ветвь левой венечной артерии заходит за заднюю продольную борозду, отдавая заднюю межжелудочковую ветвь, которая обычно отходит от правой венечной артерии и снабжает своими ветвями не только заднюю поверхность левого сердца, но и большую часть правого, а правая венечная артерия заканчивается на остром краю сердца. При равномерном типе кровоснабжения сердца обе венечные артерии развиты одинаково. Некоторые авторы, кроме этих трех типов кровоснабжения сердца, выделяют еще два промежуточных, обозначая их «среднеправыми» и «среднелевыми».
Преобладание правой венечной артерии сердца отмечается только в 12% случаев, в 54% случаев преобладает левая венечная артерия и в 34% обе артерии развиты равномерно. При доминировании правой венечной артерии никогда не бывает такого резкого различия в развитии обеих венечных артерий, какое наблюдается при левовенечном типе. Это связано с тем, что передняя межжелудочковая ветвь, всегда образуемая левой венечной артерией, снабжает кровью значительные области ЛЖ и ПЖ.
Венечные артерии и их ветви, располагающиеся подэпикардиально, окружены рыхлой соединительной тканью, количество которой увеличивается с возрастом. Одной из особенностей топографии венечных артерий является наличие над ними в 85% случаев мышечных перемычек в виде мостиков или петель. Мышечные мостики являются частью миокарда желудочков и чаще выявляются в передней межжелудочковой борозде над участками одноименной ветви левой венечной артерии. Толщина мышечных перемычек находится в пределах 2–5 мм, их ширина по ходу артерий варьирует в пределах 3–69 мм. При наличии мостиков артерия имеет значительный интрамуральный сегмент и приобретает «ныряющий» ход. При прижизненной коронарографии их присутствие выявляется в систолу коническим сужением артерии или резким ее изгибом перед перемычкой, а также недостаточным наполнением сосуда под перемычкой. В диастолу указанные изменения исчезают.
К дополнительным источникам кровоснабжения сердца относятся внутренние грудные, верхние диафрагмальные, межреберные артерии, бронхиальные, пищеводные и медиастинальные ветви грудной части аорты. Из ветвей внутренних грудных артерий имеют значение перикардиально-диафрагмальные артерии. Вторым ведущим источником дополнительной васкуляризации сердца являются бронхиальные артерии. Средняя суммарная площадь поперечного сечения всех экстракардиальных анастомозов в возрасте 36–55 лет и старше 56 лет составляет 1,176 мм2.
Строение стенки коронарных артерий и их ветвей
Структура стенки этих сосудов соответствует распределительным сосудам мышечного типа и включает 3 хорошо выраженных слоя-оболочки: внутренний (интима), средний (медия) и наружный (адвентиция). Внутренний слой со стороны просвета сосуда выстлан клетками эндотелия. Его клетки имеют уплощенную вытянутую форму с продольной осью, ориентированной по длиннику сосуда. Межклеточные границы имеют вид тонких, слегка извитых линий. Чем дистальнее расположен артериальный сегмент и чем меньше его диаметр, тем более вытянуты выстилающие его эндотелиоциты и тем меньше угол их отклонения от оси сосуда. В местах отхождения ветвей эта закономерность нарушается: расположение эндотелиоцитов становится хаотичным, а их форма — полигональной. Размеры артериальных эндотелиоцитов достаточно вариабельны. Длина клеток составляет 25–50 мкм, ширина — 7–15 мкм, толщина выбухающей в просвет ядросодержащей части — до 3 мкм, а по периферии <1 мкм. В эндотелиоцитах выделяют контактную, периферическую, занимаемую органеллами, и ядерную зоны, весьма условно разграниченные между собой.
Ядро, занимающее центральную область, уплощенной овоидной формы, выполнено филаментозным эу- и гранулярно-глыбчатым гетерохроматином. Ядрышки невелики и их редко бывает больше одного. В зоне перикариона, окружающей ядро, сосредоточена основная масса органелл, обеспечивающих энергетические и пластические потребности клеток. Комплекс Гольджи обычно расположен ближе к люминальной поверхности. Его профили имеют вид плоских полостей, образуемых элементарной мембраной, которые окружены немногочисленными крупными вакуолями и группами мелких везикул, иногда с уплотненным содержимым.
Гладкая и гранулярная эндоплазматическая сеть представлены разнонаправленно-ориентированными канальцами. Мембрана гранулярного ретикулума усеяна РНП-гранулами (рибонуклеопротеидные частицы). Немногочисленные митохондрии имеют округлую или овоидную формы диаметром 0,1–1 мкм, внутренняя мембрана образует 3–6 коротких крист. Количество лизосом и их размеры также невелики, они имеют типичное строение. Митохондрии и лизосомы содержат весь набор ферментов, характерных для этих органелл. Цитоспецифическим элементом ультраструктуры эндотелиоцитов являются тельца Вейбеля — Паладе длиной 2–3 и диаметром 0,15 мкм. Электронная плотность их содержимого изменяется от значительной до высокой в соответствии с функциональным состоянием.
Форма эндотелиальной клетки поддерживается элементами цитоскелета, объединенными в сеть. В этой сети различают цитокортекс, лишенный органелл, расположенный непосредственно под плазмолеммой и лучше выраженный в контактной зоне клетки, микротрабекулярную решетку эндоплазмы и волокна напряжения, пересекающие цитоплазму в различных направлениях. Филаменты этой сети образованы актином, способным переходить из глобулярной Г-формы в фибриллярную Ф-форму либо вновь деполимеризоваться. Элементами цитоскелета являются также ориентированные вдоль клетки микротрубочки, довольно редко выявляемые в срезах, и так называемые промежуточные фибриллы, служащие для соединения элементов фибриллярного каркаса.
Структурирование фибрилл актина требует расхода АТФ. При взаимодействии с молекулами миозина и Са2+ Ф-актин генерирует силу, влияя на расположение органелл и рельеф клеточной поверхности. Связь миофибрилл с плазмолеммой в зонах межэндотелиальных стыков дает основания думать о зависимости их проницаемости от состояния цитоскелета, а его контакты со встроенными в плазматическую мембрану рецепторами — о возможности регуляторного влияния эндотелиоцитов на процессы ультрафильтрации.
Плазматическая мембрана эндотелиоцита — типичная трехслойная биологическая мембрана с белковыми комплексами, погруженными в липидный биослой. Их выступающие полярные части со стороны цитоплазмы входят в состав субмембранного, а снаружи — параплазмолемм-ного слоев клеточной оболочки. Люминальная поверхность эндотелия покрыта гликокаликсом, в котором присутствуют сиаловые кислоты, гликолипиды, гепарин, моно- и полисахариды, белки. Весь этот материал организован в виде рыхлого внеклеточного слоя, пропитанного водой с ионами, мелкодисперсными белками, белками плазмы крови.
Важным структурно-функциональным элементом эндотелиального монослоя являются межклеточные контакты. Периферические и контактные зоны смежных клеток могут просто накладываться друг на друга либо формировать интердигитации, значительно усложняющие контуры межклеточной щели. При этом край одной из клеток свободно свисает в просвет сосуда, образуя так называемую маргинальную складку. Пространство между клетками шириной в среднем 2–3 нм на всем протяжении заполнено межклеточным «цементом», близким по своим физико-химическим свойствам к гликокаликсу. Зоны резкого сближения примыкающих поверхностей клеток могут перемежаться локальными расширениями контактной щели.
Специализированными структурами, поддерживающими целостность эндотелиальной выстилки сосуда, являются плотные и щелевые контакты в области латерального примыкания эндотелиоцитов. Плотный или замыкающий контакт, образованный слиянием внешних листков плазмолеммы смежных клеток, представляет собой пенталамилярный комплекс, укрепленный сетью контактных фибрилл. Щелевидные межэндотелиальные контакты отмечают значительно реже. Они имеют определенное структурное сходство с подобными образованиями вставочных дисков кардиомиоцитов. Несмотря на наличие этих специализированных структур, межклеточная щель обеспечивает ультрафильтрацию жидкости и небольших гидрофильных молекул по гемотканевому градиенту давления.
Отличительной особенностью поверхности эндотелиоцитов является лабильность, которая проявляется формированием многочисленных выступов и втяжений, отшнуровывающихся в виде микропиноцитозных везикул. Они способны вновь встраиваться в плазмолемму либо сливаться друг с другом, образуя полиморфные гроздьевидные или цепочечные комплексы из нескольких элементов. Микропиноцитозные везикулы представляют собой округлые образования диаметром 50–70 мм, выстланные изнутри слабоосмиофильным аморфным или гранулярным материалом. Основная их функция — трансэндотелиальный «контейнерный» перенос грубодисперсных веществ. Процесс отделения нагруженного ими пузырька от плазмолеммы, как и последующее слияние с ней и опорожнение на противоположной поверхности клетки, осуществляется значительно быстрее, чем его перемещение через цитоплазму. В связи с этим микровезикула большую часть времени существует в виде более или менее глубокого инвагината плазмолеммы либо не связанного с ней мембранного образования.
Ассоциируясь, микровезикулы могут формировать динамичные трансэндотелиальные канальцы, диафрагмированные, если между ними сохраняются везикулярные перегородки, либо свободные при их отсутствии. В первом случае они становятся дополнительным маршрутом миграции низкомолекулярных липотропных веществ, во втором — канальцами для ультрафильтрации по градиенту давления.
Популяция микровезикул эндотелиоцита неоднородна. Некоторая часть из них имеет отношение к секреторному процессу, другие являются, по-видимому, мембранным резервом клетки и активно не участвуют в транспортном процессе. Часть везикул в фазу формирования загружается свободно, а фактором, лимитирующим размер диффундирующих в везикулу веществ, является ширина устья. У других оно перекрыто диафрагмой толщиной 3–5 мм, которая является фильтром, осуществляющим селекцию загружающего везикулу материала с учетом размеров и заряда его частиц.
Так называемые окаймленные везикулы, окруженные со стороны цитоплазмы специализированным белком — клатрином, связанным с цитоскелетом, участвуют не только в рецептор-опосредованном эндоцитозе липопротеинов, грубодисперсных белков и положительно заряженных частиц, но и в переносе материала из эндоплазматического ретикулума в пластинчатый комплекс.
Сосудистый эндотелий является полифункциональной системой, оказывающей регуляторное воздействие как на сосуды, так и на систему крови. Образует тромборезистентную поверхность, участвует в гемотканевом обмене, обеспечивая его селективность, синтезирует и катаболизирует целый ряд биологически активных веществ, участвует в липидном обмене и регуляции тонуса сосудистой стенки. Благодаря наличию рецепторного аппарата, эндотелий чувствителен к ацетилхолину, катехоламинам, гормонам гипофиза, вазопрессину и окситоцину, гистамину, факторам, выделенным тромбоцитами, — серотонину, тромбоксану А2, брадикинину. Эндотелиальные клетки артерий участвуют в метаболизме таких веществ, как норадреналин, серотонин, аденозин, в них присутствует АПФ, образуются метаболиты арахидоновой кислоты, лейкотриены, в частности простациклин (ПГI2), обладающий вазодилататорными и антиагрегантными свойства .
Клетки эндотелия выделяют эндотелиальный релаксирующий фактор, идентифицированный как NO, а также ангиотензин, эндотелин — полипептид вазоконстрикторной природы, повышающий уровень АД. Секреция эндотелиального фактора роста детерминирует новообразование сосудов.
Являясь естественной границей между тканями и кровью, эндотелий образует и связывает на своей поверхности широкий спектр антитромботических, антикоагулянтных и прокоагулянтных факторов, регулирует агрегатное состояние пристеночного слоя плазмы крови. Гликокаликс эндотелия, как и поверхность форменных элементов крови, имеет отрицательный заряд, что также во многом определяет тромборезистентность сосудистой стенки. Неравномерное, «доменное» распределение этого заряда в гликокаликсе оказывает существенное влияние на его неспецифическую адгезивность и транспортную функцию, основанную на электростатическом взаимодействии.
В эндотелиоцитах присутствует набор ферментов, необходимых для разрушения фибрина, синтеза биологически активных веществ, компонентов базальной мембраны и межклеточного вещества. Энзимы интегрированы с мембранами митохондрий и других органелл, с плазмолеммой, содержатся в лизосомах, адсорбированы гликокаликсом, связаны с рецепторами — гликопротеин-ферментными комплексами, встроенными в плазмолемму. Гликопротеиновый компонент рецептора, взаимодействующий со специфическим раздражителем, структурирован в гликокаликсе. Полученный сигнал передается на протеидный компонент рецептора и далее на встроенный в толщу мембраны G-белок, последовательно вызывая в них конформационные изменения. При этом G-белок приобретает способность взаимодействовать с гуанозинтрифосфатом, дополнительно изменяя свою пространственную конфигурацию. Это служит сигналом для активирования аденилциклазы, гуанилциклазы либо фосфолипазы — любого из ферментов, локализованных на внутренней поверхности плазмолеммы и функционально сопряженных с соответствующим рецептором. В результате в клетке повышается концентрация вторичных мессенджеров: цАМФ, NO, цГМФ, диацилгли-церола и инозитолтрифосфата, которые изменяют концентрацию Са2+, стимулируют разнообразные ферментные системы и тем самым различные виды клеточной активности.
Эндотелиальный монослой лежит на базальной мембране, связываясь с ней полудесмосомами и адгезивными белками, в частности фибронектином. Во всех отделах сосудистого русла сердца базальная мембрана имеет трехслойное строение и тонкофибриллярную сетчатую основу, ячейки которой выполнены гликопротеинами и гепаринсульфатсодержащими протеогликанами. Наряду с пограничной и опорной функциями, она выполняет роль барьера с электростатическими свойствами, проницаемость которого для фильтрирующихся субстратов зависит от их размера и заряда.
Эндотелиальный слой механически непрочен и легко травмируется, например воздействием высокого напряжения сдвига, однако возникшие микродефекты быстро восстанавливаются благодаря высокой регенераторной способности эндотелиоцитов.
К базальной мембране прилежит субэндотелиальный слой, который составляет примерно 1/6 толщины всей стенки и в магистральных субэпикардиальных артериях развит лучше, чем в разнокалиберных сосудах других регионов. Образован различно ориентированными коллагеновыми волокнами, погруженными в основное межклеточное вещество, богатое гликозаминогликанами. В нем выявляют также немногочисленные фибробласты, низкодифференцированные секреторно активные гладкомышечные клетки, изредка — макрофаги. В местах ветвления сосудов и других участках, испытывающих сильное воздействие потока крови, отмечают мышечно-эластические утолщения, в которых различают поверхностный и более богатый волокнистыми элементами глубокий слой.
Средний слой
Границей интимы — внутреннего слоя сосудистой стенки является внутренняя эластическая мембрана. Представляет собой гладкую пластинку, образованную из ветвящихся эластических волокон, с отверстиями диаметром 2–5 мкм, через которые в субэндотелиальное пространство из медии проникают отростки гладкомышечных клеток. Эластическая мембрана и эластичный коллагеновый каркас определяют механические свойства сосудистой стенки. Зрелые эластические волокна состоят из двух компонентов: аморфного, образуемого растяжимым эластином, и фибриллярного, состоящего из структурных гликопротеинов и ограничивающего растяжимость эластинового матрикса.
Медия коронарных артерий состоит в основном из гладкомышечных клеток, образующих >15 слоев. Их ориентация во внешнем сегменте медии коронарных артерий приближается к продольной, в остальных эти слои располагаются спиралевидно. Гладкомышечные клетки имеют уплощенную веретенообразную форму с поверхностью, усложненной частыми и глубокими инвагинатами сарколеммы, наиболее выраженными в апикальных отделах клеток.
Органеллы кардиомиоцитов и гладкомышечных клеток стереотипны при качественно отличной внутриклеточной организации. Большую периферическую часть гладкомышечных клеток занимает контрактильный аппарат, который состоит преимущественно из актиновых филаментов, группирующихся в пучки толщиной 5–8 нм. В то же время толстые (15–19 нм) миозиновые нити распределены нерегулярно и не всегда выявляются. Актиновые филаменты фиксированы в клетке «плотными телами» — удлиненными электронно-плотными аналогами телофрагм кардиомиоцитов, а на сарколемме — нерегулярно расположенными поверхностными уплотнениями, соответствующими промежуточным зонам вставочных дисков рабочих клеток миокарда.
В центральной зоне клеток расположено крупное палочковидное ядро длиной около 20 мкм, содержащее 1–2 ядрышка. Околоядерная зона свободна от контрактильных элементов и занята различными органеллами, сосредоточенными в основном у полюсов ядра. Это пластинчатый комплекс Гольджи, имеющий небольшой объем и типичное строение, редко выявляемые центриоли, фрагменты гранулярной эндоплазматической сети, свободно рассеянные гранулы рибонуклеопротеидов и гликогена.
Митохондрии гладкомышечных клеток значительно меньше по объему, чем в вентрикулярных кардиомиоцитах, с немногочисленными кристами. Имеют округлую или удлиненную форму и также сосредоточены в перинуклеарной зоне вдоль длинной оси клетки. Здесь же систематически определяются первичные лизосомы с гомогенным электронноплотным содержимым и одноконтурной мембраной, а также их вторичные формы. Они содержат светлые и темные компоненты, которые активно участвуют в удалении продуктов внутриклеточного катаболизма посредством экзоцитоза.
Саркоплазматический ретикулум гладкомышечных клеток артерий развит достаточно хорошо и представлен периферическим и центральным компартментами. На ультратонких срезах он имеет вид многочисленных везикул и разнонаправленно ориентированных тубул, образуемых гладкой цитомембраной. В их распределении отмечается определенная связь с плотными телами, которая лучше прослеживается в кортикальной зоне клетки. Элементы периферического отдела саркоплазматического ретикулума довольно часто образуют функциональные контакты с сарколеммой и ее инвагинатами, окружая их ответвлениями своих канальцев.
Характерной особенностью гладкомышечных клеток является хорошо развитый опорный цитоскелет, элементы которого распределены в саркоплазме неравномерно. Сарколемма гладкомышечных клеток образована типичной трехслойной цитомембраной, покрытой слоем гликокаликса. Его толщина в местах сближения клеток составляет 30–50 нм и значительно возрастает на свободной поверхности клеток. Общую площадь сарколеммы существенно увеличивают простые кавеолы и более сложные, как бы состоящие из нескольких таких элементов инвагинаты, так называемые бусовидные тубулы, соответствующие Т-системе кардиомиоцитов.
Гладкомышечные клетки артериальной стенки интегрированы между собой посредством межклеточных контактов и мембранного каркаса медии. Контакты между ними многообразны: это может быть как небольшая по протяженности щель между уплотненными участками плазматических мембран смежных клеток шириной 17–20 нм без электронноплотного содержимого, так и структуры, напоминающие десмосомы или нексусы. Наличие окон во внутренней эластической мембране делает возможным также миоэндотелиальные контакты в виде простого прилегания небольшого выступа, образуемого одной из клеток, к поверхности другой с узким свободным промежутком между ними.
Слои медии и гладкомышечных клеток разделены небольшим количеством коллагеновых и эластических волокон. Пучки коллагеновых фибрилл окружают эластические волокна и гладкомышечные клетки, объединяя их в единую систему с обеими эластическими мембранами сосудистой стенки. Такая стереоархитектоника мышечно-волокнистых элементов обеспечивает ее однонаправленное растяжение, лимитируемое коллагеновыми волокнами и регулируемое тонусом гладкомышечных клеток.
Наружная оболочка
Адвентиция коронарных артерий отделена от медии наружной эластической мембраной, которая тоньше и более перфорирована, чем внутренняя. Адвентиция состоит из рыхлой соединительной ткани со значительным количеством продольно-ориентированных эластических волокон. По толщине не уступает медии. Внешняя граница адвентициального слоя постепенно сливается с окружающей тканью, образующей вокруг коронарных артерий и их крупных ветвей соединительнотканные футляры — фиброзные артериальные влагалища, которые истончаются и разрыхляются в дистальных отделах сосудов.
В адвентиции расположены элементы нервной системы и лимфатического русла, а также мелкие кровеносные сосуды, «сосуды сосудов» (vasa vasorum), разветвления которых, как и нервные окончания, располагаются в медии. Сосуды, питающие артериальную стенку, образуют сплетение в адвентиции крупных субэпикардиальных и интрамуральных артерий сердца, которое по архитектонике отличается от периферических разветвлений, питающих миокард. Оно построено по «классическому типу», в виде сети микрососудов, которые, часто анастомозируя, последовательно сливаются в короткие посткапилляры и венулы. Питание различных слоев стенки коронарных артерий осуществляется дифференцированно: в интиме и примерно трети прилежащей медии обеспечивается за счет диффузионных процессов из просвета сосуда, тогда как лежащие глубже гладкомышечные клетки и адвентиция кровоснабжаются vasa vasorum.
Внутриорганное артериальное русло сердца
В толщу стенки желудочков сердца артерии проникают, как правило, перпендикулярно или косо к его поверхности, а затем ветвятся в миокарде (рис. 1.23).

В наружных слоях миокарда они разделяются на артерии меньшего калибра (0,1–0,2 мм), проходящие в основном горизонтально, соответственно ориентации мышечных пучков. Во внутреннем продольном слое миокарда артериальное русло становится более густым. Оно образовано резистивными сосудами диаметром 20–100 мкм, ориентированными преимущественно вертикально, параллельно пучкам мышечных волокон и трабекул. В мышечных трабекулах проходят артериолы диаметром 50–60 мкм. Миокард предсердий содержит артериальные сосуды двух направлений соответственно ориентации пучков мышечных волокон. В наружных пучках артерии проходят и ветвятся в горизонтальном направлении, во внутреннем — в вертикальном.
С уменьшением калибра артерий строение их стенки становится менее сложным. Крупные транспортные интрамуральные артерии миокарда являются ветвями коронарных артерий III–IV порядка. Их диаметр редко превышает 1,5–2 мм, а медия состоит из 4–5 слоев гладкомышечных клеток. Транспортные артерии диаметром >0,6 мм, ориентированные от эпикарда к эндокарду, делятся и образуют распределительные и терминальные артерии. Их диаметр — 100–150 мкм, медия состоит из 2–3 слоев гладкомышечных клеток, ориентация которых часто не совпадает. Мышечные волокна наружного и внутреннего слоев могут располагаться в продольном, а среднего — в косопоперечном направлениях, причем только центральный слой гладкомышечных клеток образует замкнутую оболочку на всем протяжении сосуда. В среднем слое сосудов 7–8-го порядка диаметром 40–60 мкм, достигающих эндокарда, присутствует уже не более 2 слоев гладкомышечных клеток, которые имеют преимущественно спиралевидное расположение.
Ультраструктура гладкомышечных клеток медии артерий такого калибра упрощается. Поверхность клеток, окутанных базальной мембраной толщиной около 80 нм, становится более гладкой, они плотнее прилежат друг к другу, чаще образуя функциональные контакты. Зона органелл расширяется, аппарат пластического обеспечения представлен лучше, а количество контрактильных структур несколько уменьшается.
Коллагеновые и эластические волокна, как и гладкомышечные клетки, идут винтообразно, перекрещиваясь по ходу. По мере уменьшения гладкомышечного слоя средней оболочки артерий ее коллагеново-эластическая основа становится нежнее, постепенно трансформируясь в тонковолокнистую сеть. Внутренняя эластическая мембрана интрамуральных артерий лучше развита, чем наружная, которая с уменьшением калибра сосудов распадается на отдельные фрагменты и в конечном счете сливается с другими волокнистыми структурами сосудистой стенки. Внутренняя эластическая мембрана при этом также истончается, ее окна становятся шире, и в терминальных артериях она превращается в нежную сеть эластических волокон.
Интима транспортных интрамуральных артерий миокарда образована основным аморфным веществом и тонкими фибриллярными структурами, количество которых заметно убывает при разветвлениях сосуда. В сочетании с рарификацией внутренней эластической мембраны это облегчает формирование миоэндотелиальных контактов. Эндотелий, сплошным слоем выстилающий внутреннюю поверхность интрамуральных артерий сердца, в целом сохраняет те же тканеспецифические признаки, что и в коронарных артериях. Его клетки имеют несколько уплощенную
и более округлую форму, расположены в один слой, частично перекрывая друг друга своими краями. Цитоскелет эндотелиоцитов даже в мелких сосудах хорошо развит, в них отмечается высокая интенсивность везикулярного транспорта, межэндотелиальные контакты часто укреплены плотными соединениями или образуют сложные взаимовыпячивания типа «ключ-замок».
Адвентиция наиболее дифференцирована у транспортных артерий, сохраняющих в миокарде свою органную обособленность, тогда как распределительные артерии и их ветви постепенно становятся интегральным компонентом его стромы. На всем протяжении адвентиция состоит из рыхло расположенных тонких коллагеновых волокон, местами собирающихся в эксцентрично расположенные пучки. Среди них иногда выявляют разрозненные гладкомышечные клетки или группы волокон, ориентированных спирально или косопродольно. Гладкомышечные включения наиболее характерны для артерий сосочковых мышц и трабекул миокарда. Соединительнотканное окружение интрамуральных артерий прослеживается вплоть до их терминальных разветвлений, сливаясь с их внешней оболочкой.
Помимо наличия гладкомышечных клеток в адвентиции, артерии миокарда отличает от сосудов других органов целый комплекс адаптационных структур. К ним относятся неодинаковая толщина и асимметрия медии по ходу сосуда; очаговые утолщения интимы у мест отхождения ветвей разного порядка, мышечные жомы, расположенные в местах ответвления артериол от мелких артерий миокарда, а на уровне микрогемоциркуляторного русла — прекапиллярные сфинктеры. В ПЖ медия мелких артерий толще, чем в ЛЖ, а в левом предсердии выявляют артерии, гладкомышечные клетки медии которых составляют два слоя, расположенные в косопоперечном направлении по отношению друг к другу и продольной оси сосуда. Эти образования обеспечивают резистентность сосудистой стенки к неравномерному воздействию пульсовой волны и участвуют в регуляции кровотока.
Терминальные артерии и ответвляющиеся от них артериолы — главный участок сосудистой системы, где происходит снижение АД, гашение пульсовой волны и коррекция потока крови в соответствии с региональными потребностями.
Микрогемоциркуляторное русло
Микрогемоциркуляторное русло в миокарде, как и в других тканях, представлено пятичленным комплексом, образуемым артериолами, прекапиллярами, капиллярами, посткапиллярами и венулами (рис. 1.24).
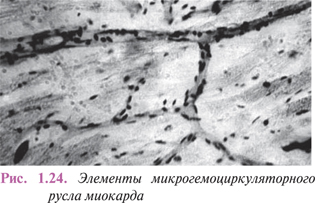
Ангиоархитектоника микрогемоциркуляторного русла
Интрамуральные артерии, ветвясь преимущественно дихотомически, распадаются на ветви, которые васкуляризируют отдельные мышечные пучки — фасцикулы. Каждый мышечный пучок кровоснабжается несколькими «интрафасцикулярными сосудами». Внутрипучковые артерии делятся на артериолы диаметром 20–25 мкм, расположенные под углом 10–30° к длинной оси фасцикулы, которые являются началом микрогемоциркуляторного русла. От артериол под острым углом отходят короткие прекапилляры шириной 12–15 мкм, которые непосредственно разветвляются на капилляры, ориентированные вдоль мышечных волокон. Каждое из них кровоснабжается тремя-пятью капиллярами; каждый капилляр в то же время прилежит к нескольким мышечным волокнам.
Кровь из капилляров попадает в посткапилляры и далее — в венулы. От мышечного пучка ее отводят несколько мелких веточек, впадающих в разные интрамуральные вены. С анатомической точки зрения микрогемоциркуляторное русло миокарда представляет систему кровоснабжения отдельного мышечного пучка, в которой ясно обозначены артериальный, венозный и капиллярный отделы (рис. 1.25).
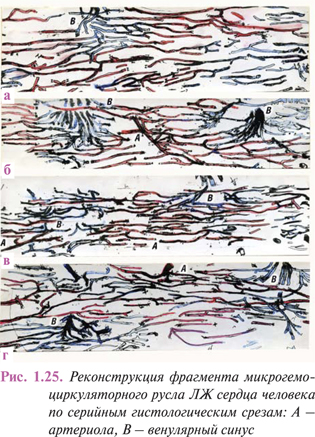
Равномерная трофика кардиомиоцитов на территории всего мышечного пучка достигается расположением отдельных звеньев микрогемоциркуляторного русла, прежде всего — капилляров. Артериолы чаще ориентированы вдоль фасцикулы; прекапилляры, ответвляясь от артериол неравномерно, располагаются чаще под острым углом к мышечным волокнам. В каждом пункте фасцикулы капилляры несут кровь в противоположных направлениях, что обеспечивается характером распределения прекапилляров в мышечном пучке, а также способностью артериол отдавать капилляры в обе стороны.
Соседние капилляры, одинаково ориентированные, взаимно смещены на треть-половину своей длины. Благодаря этим особенностям, к каждому мышечному волокну прилежат как проксимальные, так и дистальные отделы капилляров. Иногда капилляры дополнительно делятся в артериальном сегменте; от них под углом, близким к прямому, отходит короткая перемычка. Она дает начало двум новым микрососудам, которые расходятся в противоположных направлениях. Это имитирует «мостик» между параллельными капиллярами, создавая иллюзию частого их анастомозирования в миокарде, что справедливо для посткапилляров.
Венозные отделы микрогемоциркуляторного русла построены по двум типам. В первом посткапилляры, ориентируясь вдоль мышечного пучка, достигают удлиненных конусовидных венул у его полюсов. Во втором венулы начинаются ампулами, к которым из толщи фасцикулы сходятся посткапилляры подобно кисточке.
Артерии и вены соседствуют вдоль мышечного пучка. Не анастомозируя и лишь переплетаясь, они транспортируют кровь как от полюсов мышечного пучка к его срединной части, так и от центра к периферии. В результате каждое мышечное волокно получает питание из нескольких относительно независимых источников, а у каждого мышечного волокна функционально сопряжены артериальные и венозные отделы нескольких смежных капилляров.
Описанные особенности кровоснабжения миокарда являются важнейшим приспособлением для обеспечения относительно постоянного состава внутритканевой среды, а следовательно, и оптимальных условий функционирования кардиомиоцитов.
Венулярные синусы (рис. 1.26), сливаясь, образуют собирательные венулы второго порядка удлиненной мешковидной формы с диаметром в наиболее широких сегментах 100-200 мкм и конусовидно сужающимся устьем.

У принимающих от них кровь более крупных, диаметром до 300 мкм, интрамуральных вен часто наблюдаются округлые или веретеноподобные расширения, образующиеся не только в области впадения притоков, но и по ходу сосуда. Таким образом, для интрамуральных истоков венозной системы миокарда характерны множественность слияния микрососудов, возможность впадения посткапилляров второго, и даже первого порядка, сразу в значительно более объемный венулярный синус, а также структура начальных отделов венозного русла в виде последовательно соединяющихся лакуноподобных элементов. Подобное строение этого отдела кровеносной системы сердца наиболее характерно для ЛЖ, в значительно меньшей степени — для ПЖ. Не отмечается в предсердиях, где общая архитектоника микрогемоциркуляторного русла ближе к плоскостным структурам, в которых микрососуды формируют многослойные сети.
Строение стенки элементов микрогемоциркуляторного русла миокарда
Структурные особенности различных звеньев микрогемоциркуляторного русла зависят от их калибра и соответственно функции. Наружная оболочка артериол, как и терминальных артерий, образована рыхло расположенными волокнистыми структурами и единичными клетками и без видимой границы переходит в соединительную ткань периваскулярной зоны. Эндотелиоциты артериолярной стенки удлинены и утолщены, имеют зубчатые края, в межэндотелиальных стыках присутствуют зоны окклюзии. Зональная дифференцировка цитоплазмы эндотелиальных клеток несколько сглажена, тем не менее основная масса органелл концентрируется рядом с клеточным ядром.
Конфигурация эндотелиального пласта зависит от функционального состояния сосуда. Расширение его просвета сопровождается резким уплощением периферических зон эндотелиоцитов, при сокращении сосудистой стенки они приобретают ромбовидную форму с выбуханием ядросодержащих отделов в просвет. Базальный слой, подстилающий эндотелиоциты, хорошо развит и следует за неровностями их плазмолеммы. Эластическая мембрана, образуемая аморфным и фибриллярным компонентом, тонкая, с широкими окнами, на поперечных срезах часто имеет вид мелких разрозненных фрагментов. Узкая субэндотелиальная зона представлена гомогенным слабоосмиофильным веществом.
Гладкомышечные клетки составляют один не всегда сплошной слой и расположены циркуляр-но, под углом к оси сосуда. Они несколько беднее органеллами, чем в магистральных артериях. Характерной особенностью резистивных сосудов миокарда, являются мио-миоцитарные и мио-эндотелиальные контакты. По ходу сосудистого русла миокарда, от артериального уровня до капилляров, выявляют зоны, где постоянно располагаются скопления гладкомышечных клеток. В прекапиллярах место гладкомышечных клеток могут занимать массивные перициты, охватывающие большую часть периметра сосуда.
Кровеносные капилляры миокарда ЛЖ классифицируются как «типично соматические». Их диаметр колеблется в пределах 5–7 мкм, увеличиваясь с возрастом до 7–9 мкм. Стенка образована сплошным пластом тесно контактирующих эндотелиоцитов и базальным слоем, состоящим из неклеточного компонента (базальной мембраны) и перицитов. Хорошо развитая базальная мембрана выполняет опорную функцию и является важным элементом гистогематического барьера.
Проксимальные участки капилляров имеют сравнительно небольшую величину просвета и дифференцируются на открытые, плазматические и резервные, а по функции — на преимущественно фильтрующие, резорбирующие либо в равной мере участвующие в обоих процессах. Способность к изменению объема наиболее выражена у клеток с лучше развитым цитоскелетом, расположенных в устьях капилляров.
Эндотелиоциты окружены тонким параплазмалеммальным слоем, заполняющим межклеточные щели. Полианионная природа гликозаминогликанов, входящих в состав параплазмалеммального слоя и базальной мембраны, определяет характер их участия в функции гистогематического барьера посредством изменения условий диффузии и ультрафильтрации через межэндотельные стыки.
В исследовании ультраструктуры артериальных и венозных сегментов капилляров существует ряд различий. Наиболее характерные заключаются в ортоградном расширении просвета с увеличением количества эндотелиоцитов, формирующих стенку капилляра, более частом присутствии в его дистальном отделе микроворсин и свободно свисающих маргинальных складок, менее сложной структуре контактов между эндотелиоцитами.
Особенность дистальных отделов микрогемоциркуляторного русла состоит в уменьшении диаметра просветов в местах впадения капилляров в посткапилляры и далее — в венулы. Проходимость устьев капилляров зависит от располагающихся здесь специализированных эндотелиоцитов, обладающих способностью реагировать на изменения окружающей среды колебаниями объема и структуализацией цитоскелета, а также от клапаноподобных цитоплазматических выступов и дупликатур микрососудистой стенки.
Стенка посткапилляров не приобретает новые черты строения, и лишь больший диаметр и большее количество эндотелиоцитов отличают их от венозных отделов капилляров. Для венулярных синусов, завершающих функциональную единицу микрогемоциркуляторного русла миокарда, как и для конусовидных венул, характерны уплощенные и более округлые эндотелиоциты листовидной конфигурации с обширной периферической зоной. Межклеточные границы изрезаны, стыки, как правило, формируются простым наложением либо соприкосновением контактных зон эндотелиоцитов, проходимость межклеточной щели ограничена единичными пятнами облитерации. Базальная мембрана сплошная, хорошо контурируется, перициты отмечаются чаще, чем в капиллярах и посткапиллярах, не образуя, однако, сплошного слоя. Периваскулярная зона организована по-разному. Стенка широких сегментов венулярного синуса близко подходит к мышечным волокнам, а более узких сегментов окружена разрозненными, рыхло лежащими волокнистыми элементами. Здесь же определяют фиброциты, изредка — макрофаги и другие клетки соединительной ткани.
В строении венулярного звена микрогемоциркуляторного русла миокарда совмещены признаки, характерные для трофической и емкостной функций. Небольшая толщина стенки микрососудов, упрощенная конструкция межклеточных стыков эндотелия способствует их активному участию в гемотканевом обмене. В то же время отсутствие структур, сообщающих ригидность стенке, предопределяет зависимость тонуса венул от соотношения внутри- и внесосудистого давления, градиент которого, как и конфигурация просвета микрососуда, изменяется при сокращении и расслаблении миокарда. Это полностью соответствует представлениям об исключительно важной роли дистальных отделов микрогемоциркуляторного русла, венулярных синусов для сглаживания неравномерностей нутритивного кровотока.
Анатомия вен сердца
В венозной системе сердца выделяются три основных функционально связанных отдела, имеющих морфологические и топографические особенности: систему венечного синуса сердца, вены обоих предсердий и вены Вьессена — Тебезия.
Кровь, пройдя капиллярную сеть, вливается в венулы, слияние которых образует густое сплетение в субэндокарде. Венозная система миокарда желудочков начинается синусоидами или венулярными синусами, присутствие которых объясняет феномен «мраморности миокарда». В глубоких и средних слоях миокарда желудочков вены образуют разветвления сетчатого характера, а в глубоких впадают в трабекулярные вены и вены сосочковых мышц. В области верхушки некоторые сосочковые вены идут от створок клапанов через сухожильные нити. Внутримышечные венозные сети находятся в разных слоях миокарда, направление широко анастомозирующих вен миокарда соответствует направлению мышечных волокон. Различают под- и внутриэндокардиальную, внутрикардиальную, внутримышечную, внутриэпикардиальную и наиболее мощную подэпикардиальную венозную сеть, формирующуюся из вен всех указанных сплетений.
Вены сердца, как правило, единичны, их расположение не связано с расположением артерий, а суммарный объем венозного русла сердца намного превышает артериальный. В перегородке желудочков расположены два мощных венозных пучка, которые формируются в передневерхнем и задневерхнем отделах межжелудочковой перегородки на границе с предсердиями. Они считаются основными венозными коллекторами, по которым оттекает кровь от перегородки желудочков сердца и ножек пучка Гиса.
Завершающим звеном венозной системы сердца является венечный синус (sinus coronarius cordis). Представляет собой коллектор, собирающий кровь от стенок желудочков и частично — предсердий, является остатком эмбрионального левого протока (протока Кювье) и расположен на задней поверхности сердца в левой венечной борозде. Длина венечного синуса колеблется от 1,4 до 5,8 см, ширина — от 0,5 до 1,4 см. В венечный синус сердца впадают, как правило, четыре сосуда: большая вена сердца, задняя вена ЛЖ, косая вена правого предсердия и средняя вена сердца.
Большая вена сердца поднимается в передней межжелудочковой борозде, а затем располагается в венечной борозде под левым ушком сердца. Переходя далее на заднюю поверхность сердца, продолжается непосредственно в венечную пазуху. Большая вена сердца собирает кровь от передних отделов ЛЖ, частично — ПЖ и межжелудочковой перегородки, а также принимает в себя вену левого края сердца. Задняя вена ЛЖ образуется из вен задней стенки ЛЖ в верхушке сердца и впадает в венечный синус. Косая вена левого предсердия берет начало на задней поверхности левого предсердия и, проходя косо вниз и вправо, впадает в начальный отдел венечного синуса или в большую вену сердца. Средняя вена сердца располагается в задней межжелудочковой борозде и собирает кровь от задней поверхности обоих желудочков.
В правой части венечной борозды располагается малая вена сердца, формирующаяся из вен передней и частично задней поверхности ПЖ и правого предсердия. Чаще впадает в среднюю вену сердца, иногда — непосредственно в венечный синус. В некоторых случаях в малую вену сердца впадает правая краевая вена, которая является связующим звеном между отдаленными системами средней и большой вен сердца.
Установлено два типа венозного оттока. При первом типе развита преимущественно система большой вены сердца (44,2%), по которой осуществляется отток крови от ЛЖ и почти всего ПЖ. При другом типе преимущественно развита система передних вен сердца (42,5%), по которым кровь отводится не только от всего ПЖ, но и части ЛЖ сердца. В этих случаях обычно значительно развита и малая вена сердца.
Анастомозы между венами сердца множественны и хорошо выражены как в толще сердечной стенки, так и между основными магистральными стволами.
Сосуды Вьессена — Тебезия
Эти сосуды присутствуют во всех отделах сердца, впадая непосредственно в его полости. В правом предсердии таких вен больше, чем в левом, где их устья располагаются главным образом на медиальной стенке вокруг края овальной ямки. В ЛЖ сосуды Вьессена — Тебезия наиболее многочисленны в области верхушки и основании сосочковых мышц. В правом наибольшее их количество располагается в зоне артериального конуса.
В предсердиях сосуды Вьессена — Тебезия представлены типичными венозными стволами. Желудочковые сосуды Вьессена — Тебезия построены по типу синусоидов, которые переходят в капиллярную сеть или смыкаются как с артериями, так и венами и артериовенозными анастомозами в неглубоких субэндокардиальных слоях. Через сосуды Вьессена — Тебезия осуществляется чрезвычайно сложный кровоток в мышце сердца, поскольку эти сосуды проходимы в обоих направлениях: как в сторону полостей сердца, так из полостей в толщу миокарда. Около 40% всей венозной крови, которая оттекает от сердечной стенки, поступает в полость сердца по тебезиевым венам, а отток крови в венечный синус сердца составляет 56–60% общего количества крови, притекающей по венечным артериям.
В системе вен Вьессена — Тебезия различают две группы сосудов: видимые под эпикардом невооруженным глазом интрамуральные вены первого порядка, широко анастомозирующие с субэндокардиальной и другими венозными сетями сердца, и микроскопические интрамуральные вены второго порядка (тебезиевы вены), никогда не анастомозирующие с периферической венозной сетью сердца.
Предполагается возможность обратного тока крови из полостей сердца через сосудистые связи в миокард и участие последних в кровоснабжении сердца, особенно при внезапно наступающих нарушениях венечного кровообращения. Описано два типа таких сосудов: небольшие артерии и артериолы, расположенные под эпикардом, которые открываются непосредственно в полости сердца (артериолюминарные сосуды), и небольшие ветви артерий и артериол, впадаюшие в «синусоиды», находящиеся между мышечными пучками (артериосинусоидальные сосуды).
Строение стенки венозных сосудов сердца
Начиная с венулярных синусов второго порядка, в сосудистой стенке появляется тонкая прослойка рыхлой соединительной ткани. Перициты приобретают отростчатую форму, они богаче фибриллярными элементами цитоскелета и другими органеллами, чем типичные перикапиллярные клетки. Плотно прилегая к базальной мембране эндотелия, перициты вместе с волокнистыми структурами полностью изолируют эндотелиальную выстилку от периваскулярного пространства. Эндотелиоциты приобретают еще более округлую или неправильную полигональную форму и располагаются без четкой ориентации относительно потока крови. Площадь, занимаемая клеткой, увеличивается, главным образом за счет уплощенных периферических отделов.
По мере увеличения диаметра вен, наряду с более плотной упаковкой волокнистых структур соединительной ткани, в сосудистой стенке выявляют фибробласты и разрозненные уплощенные клетки веретенообразной формы Эти клетки часто группируются в устьях синусоид, они окружены базальной мембраной, прерывающейся лишь в зонах межклеточных контактов. В цитоплазме этих клеток присутствуют пучки актиновых микрофибрилл, ориентированные параллельно их поверхности, и электронноплотные структуры, напоминающие плотные тельца гладкомышечных клеток Совокупность этого с большим, чем в перицитах, содержанием РНП-гранул и лучше развитым гранулярным ретикулумом позволяет идентифицировать данные клетки как примитивные миоциты. В стенке крупных интрамуральных вен появляются отдельные гладкомышечные волокна. Строение стенок тебезиевых сосудов идентично структуре соответствующих им по калибру интрамуральных вен, несущих кровь в систему венечного синуса.
В субэпикардиальной венозной сети синусовидные эктазии отсутствуют, а сосудистая стенка имеет относительно ровные контуры. Четкая послойная дифференцировка, характерная для артериальной стенки, отсутствует, и в целом стенка значительно тоньше, чем у артерий такого же калибра, вследствие слабой выраженности ее среднего и наружного слоев.
Эндотелий интрамуральных и субэпикардиальных вен сходен, однако в контактной зоне чаще отмечают специализированные структуры, связывающие эндотелиоциты. Субэндотелиальная зона слабо выражена, заполнена в основном межклеточным веществом с редкими тонкими волокнами коллагена, между которыми иногда выявляют низкодифференцированные отростчатые и веретенообразные фибробласты. Эластическая мембрана не сформирована и представлена единичными эластическими волокнами и пластинами.
Гладкомышечные клетки медии вен сходны с артериальными, отличаются от них лишь более уплощенной формой и меньшим числом межклеточных контактов. В небольших ветвях образуют спиралевидно расположенные скопления, разделенные волокнистыми элементами. Клетки окружены базальной мембраной и тонкофибриллярными футлярами, связанными между собой. С увеличением калибра сосуда скопления гладкомышечных клеток становятся мощнее, достигая в крупных венах 4–5 слоев, которые тем не менее не становятся сплошными. Ориентация клеток весьма вариабельна, особенно во внутренних слоях медии.
Наружная оболочка представлена разрозненными различно ориентированными коллагеновыми волокнами и их пучками, часто с наличием фибробластов. Внешняя оболочка стенки сосудов утолщается при увеличении калибра и формирует довольно плотные соединительнотканные футляры вокруг терминальных отделов крупных вен сердца. В адвентиции крупных венозных стволов сердца, как и артерий, имеется собственная сосудистая сеть. Последняя оплетается коллагеновыми фибриллами и окружает сосуд в виде чехла. В стенке капилляров часто выявляют перициты, а в окружающей соединительной ткани — фибробласты и тучные клетки.
Этот отдел венозного русла сердца отличает также присутствие неравномерно расположенных клапанов, облегчающих их освобождение от избытка крови. В мелких сосудах это одностворчатые карманоподобные заслонки, представляющие собой дубликатуру эндотелия с тонкой прослойкой соединительной ткани в основе. В более крупных венах клапаны образованы складками сосудистой стенки, имеют 2–3 створки с утолщенным свободным краем. Их основа образована соединительной тканью с включением гладкомышечных волокон, что предполагает активное участие в регуляции кровотока.
Лимфатическое русло сердца
В лимфатическом русле сердца различают эндокардиальный, миокардиальный, субэпикардиальный, эпикардиальный отделы. Лимфа, собираемая ими, транспортируется из более глубоких слоев сердечной стенки в поверхностные и далее — в общий лимфоток по экстраорганным коллекторам.
Топография лимфатического русла сердца
Эндокардиальный отдел представляет собой однослойную мелкопетлистую сеть в наружном соединительнотканном слое эндокарда, которая образована многочисленными слепыми капиллярами диаметром 15–25 мкм, проникающими ближе к его выстланной эндотелием поверхности. В эндокарде сосочковых мышц эта сеть наиболее густая, диаметр капилляров, сливающихся с лакуноподобными расширениями, составляет 30–60 мкм. Эндотелиоциты капилляров неправильной удлиненной формы и по размерам заметно превосходят клетки других отделов лимфатического русла.
Миокардиальный отдел лимфатического русла сердца является как бы продолжением субэндокардиального. Состоит из капилляров диаметром 15–40 мкм и более широких посткапилляров, локализованных в межфасцикулярных прослойках строительной ткани. Они объединены в трехмерную сеть, крупные полигональные ячейки которой вытянуты вдоль окружаемых ими мышечных пучков. В этой сети капилляры чередуются с клапансодержащими резервуароподобными посткапиллярами диаметром до 150 мкм, которые накапливают лимфу в диастолу и освобождаются от нее при последующем сокращении сердечной мышцы. Из миокарда лимфа по посткапиллярам и редким отводящим сосудам первого порядка направляется к эпикарду. В области проводящей системы сердца и особенно в зоне предсердно-желудочкового узла элементы лимфатического русла расположены гуще, чем в других регионах.
Субэпикардиальная лимфатическая сеть состоит из широких капилляров диаметром 40–80 мкм, посткапилляров и сосудов первого порядка, заложенных в подэпикардиальной соединительной ткани и часто анастомозирующих. Собственно эпикардиальная лимфатическая сеть состоит из поверхностного и глубокого слоев, последний залегает на уровне глубокого коллагеново-эластического слоя эпикарда. Его широкие ячейки, образуемые посткапиллярами и мелкими сосудами, чаще всего имеют ромбовидную форму и диаметр 25–150 мкм.
Поверхностная лимфатическая сеть, наиболее густая из всех, расположена в коллагеновом слое эпикарда ближе к его поверхности. Состоит из широких сосудистых петель, заполняемых мелкоячеистой сетью из впадающих в них капилляров и посткапилляров. Капилляры диаметром 15–45 мкм, сливаясь, часто образуют звездчатые лакуны шириной 75–150 мкм. Лимфатическая сеть эпикарда, помимо отведения лимфы из более глубоких слоев сердечной стенки, активно участвует в резорбции перикардиальной жидкости. Как и элементы кровеносной системы, лимфатическое русло сердца образует в адвентиции магистральных артерий и вен крупнопетлистую периваскулярную сеть, направляющую лимфу в его субэпикардиальный отдел.
Лимфатическую сеть эпикарда и сердца в целом завершают сосуды возрастающего калибра, собирающиеся в два лимфатических коллектора. Диаметр сосудов первого порядка находится в пределах 350 мкм, второго — 650 мкм, третьего — 750 мкм, а четвертого порядка — 1,5 мм. Правый лимфатический коллектор, соответствующий четвертому порядку, покидает сердце в периартериальной клетчатке, левый, более крупный — по переднебоковой поверхности общего легочного ствола, прерываясь в региональных медиастинальных лимфоузлах, которые принимают также лимфу от легких.
Строение элементов лимфатического русла сердца
Структуру лимфатического русла сердца отличает ряд особенностей. Эта «разомкнутость» с началом в виде слепых трубок или петель, сетевая конструкция, многочисленные клапаны уже в посткапиллярах, резкая объемная диспропорция между ее корнями и сосудами, отводящими лимфу. Лимфатические капилляры по сравнению с кровеносными имеют значительно больший просвет при относительно меньшей толщине стенки, которая обычно образована несколькими эндотелиоцитами, по величине превосходящими эндотелиальные клетки кровеносных капилляров примерно в 4 раза.
Несмотря на часто отмечаемую складчатость эндотелиального пласта, внутренняя плазматическая мембрана эндотелиоцитов не образует микроворсин. Межэндотелиальные контакты лимфатических капилляров отличает повышенная подвижность и способность к снижению плотности, которой способствуют стропные филаменты. Вплетаясь в плазмолемму, они фиксируют край эндотелиоцита к коллагеновым протофибриллам, всегда присутствующим в перикапиллярном пространстве. Сообщение капиллярного просвета с интерстицием облегчается отсутствием базальной мембраны и перицитов.
Размер периферической зоны эндотелиоцита значительно больше размера зоны, содержащей ядро и органеллы. В связи с этим эндотелитоциты лимфатических капилляров оказываются относительно беднее органеллами, чем эндотелиоциты кровеносных капилляров. В эндотелиоцитах лимфатических капилляров достаточно хорошо развит лизосомный аппарат, тогда как микро-пиноцитозные везикулы немногочислены и не играют существенной транспортной роли, несмотря на способность захватывать электронно-плотные маркеры.
С переходом капилляров в посткапилляры и отводящие лимфу сосуды в их стенке, наряду с клапанами, выявляется нежнофибриллярный, местами фрагментированний базальный слой, изменяется строение межклеточных стыков. Наложение контактирующих краев дополняют интердигитации, иногда укрепленные пятнами облитерации. На внутренней плазматической мембране появляются выступы и немногочисленные микроворсины, а вокруг эндотелиальной трубки начинается формирование адвентиции, а медия отсутствует. В стенках лимфатических сосудов сердца любого калибра полноценные гладкомышечные клетки не идентифицированы, функцию ортоградного продвижения лимфы выполняет сокращающийся миокард. Ригидность стенок лимфатических сосудов обеспечивается пучками переплетающихся коллагеновых волокон, образующих сплошные футляры в более крупных сосудах.
В формировании характерных для лимфатической системы двухстворчатых клапанов принимают участие все структуры сосудистой стенки. В посткапиллярах это эндотелиоциты, а по мере возрастания калибра сосудов в их стенке появляется основа, состоящая из волокон соединительной ткани. Многочисленные клапаны обусловливают наличие выраженных перетяжек по ходу лимфатических сосудов, придавая им четкообразную форму. Сетевидное устройство лимфатического русла делает клапаны функционально необходимой структурой, координирующей ток лимфы.
Иннервация сердца и его сосудов
Сердце иннервируется тремя видами нервов: симпатическими, парасимпатическими (эфферентными или моторными) и сенсорными (афферентными). Их источниками являются сердечные нервы и ветви, следующие к сердцу, поверхностное и глубокое нервные сплетения, расположенные возле дуги аорты и легочного ствола, а также внутриорганное сплетение, элементы которого распределены во всех слоях сердечной стенки (рис. 1.27).
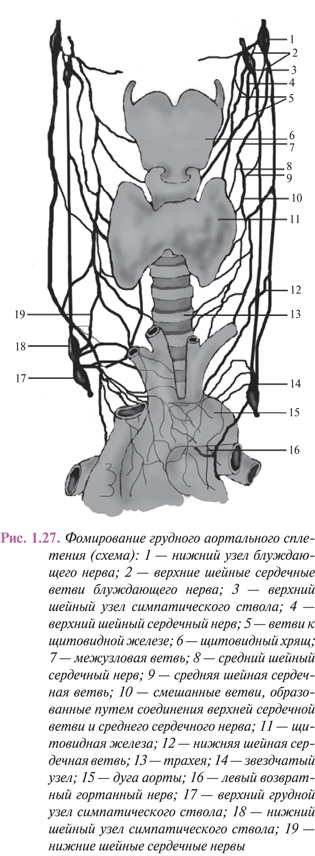
Топография экстракардиального отдела
Экстракардиальные нервные сплетения принято разделять на поверхностные и глубокие, которые формируются в основном ветвями шейного отдела пограничного симпатического ствола, а также ветвями отходящих от шейной и грудной части блуждающих нервов.
Симпатическая (адренергическая) иннервация обеспечивается нервными сплетениями, которые образуются отростками нервных клеток, сосредоточенных в шейно-грудном (звездчатом) и верхне-шейном симпатических узлах. Исходящие из них постганглионарные пучки адренергических нервных волокон вступают под эпикард предсердий и формируют густую субэпикардиальную сеть, распространяющуюся по ходу коронарных сосудов (рис. 1.28).
От пограничного симпатичного ствола берут начало три сердечных нерва — верхний, средний и нижний. Верхний сердечный нерв отходит чаще всего от верхнего шейного узла пограничного симпатического ствола, направляется книзу вдоль безымянной (справа) и сонной артерии (слева), принимая участие в образовании общего экстракардиального сплетения. Как правило, получает дополнительные ветви от верхнего гортанного или блуждающего нервов и от различных участков шейного пограничного ствола. В результате этот нерв может быть представлен или одиночным стволом или несколькими ветвями, которые соединяются каудально в один нервный ствол.
Средний сердечный нерв присутствует не во всех случаях. Обычно он отходит от среднего шейного узла, а если этот шейный узел не выражен, то непосредственно от симпатического ствола на уровне VI–VII шейных позвонков. От среднего узла отходят два стволика, один из которых составляет продолжение пограничного ствола, другой охватывает дугу подключичной артерии, образуя петлю (петля Вьессана), отдающую нервные стволики к сердцу. Петля Вьессана образуется между средним шейным и звездчатыми узлами, но может также возникать между краниальным шейным и звездчатыми узлами. Иногда слева вместо нее отмечают сильно развитое нервное сплетение. Нижний сердечный нерв, постоянный, но варьирующий по величине, отходит от нижнего узла пограничного симпатического ствола.
В строении и расположении пограничных симпатических стволов и блуждающих нервов правой и левой сторон наблюдается асимметрия. Для сердечных нервов эта особенность выражается в неодинаковом количестве ветвей, которые отходят справа и слева от пограничных симпатических стволов. В образовании экстракардиального сплетения в 15% случаев принимает также участие безымянный сердечный нерв, который начинается двумя корешками. Правый является ветвью правого коллатерального ствола или правого верхнего шейного узла, а левый отходит от левого блуждающего нерва.
Парасимпатическая (холинэргическая) часть сердечных сплетений представлена верхними и нижними сердечными ветвями, которые исходят от блуждающего нерва и его ветвей как в области шеи, так и в пределах средостения. Верхние сердечные ветви отходят от шейного отдела блуждающего нерва ниже пучкообразного узла, а также от верхнего гортанного нерва.
По ходу блуждающего нерва и его ветвей расположены внутристволовые скопления вегетативных нервных клеток. Нижние сердечные ветви в количестве от 4 до 10 формируются от ствола блуждающего нерва в участке шеи и средостения, а также от поворотных нервов. Помимо того, выявлены правый и левый дополнительные поворотные нервы, от которых отходят сердечные ветви, принимающие участие в образовании экстракардиального нервного сплетения. Рядом авторов описаны сердечные ветви, возникающие от диафрагмальных нервов и принимающие участие в образовании экстракардиального нервного сплетения, а также отходящие к сердцу от петли подъязычного нерва.
Сердечные ветви из многочисленных источников широко соединяются между собой еще в участке шеи и, продолжаясь до основания сердца, формируют единое мощное экстракардиальное сплетение, в котором выделяют глубокую и поверхностную части. Глубокая часть, локализованная у поверхности бифуркации трахеи, формируется из большого количества сердечных нервов и значительно мощнее, чем поверхностная, расположенная перед дугой аорты В состав этого сплетения входят нервные стволы, которые широко варьируют по форме, количеству и расположению.
По ходу сердечных нервов расположены экстракардиальные ганглиозные узлы. Большие сердечные нервные узлы связаны нервными стволами в цепи, которые в виде двух замкнутых колец окружают сердце (рис. 1.29).
Одно из этих колец залегает под прямым углом к основанию сердца и соответствует внешней окружности перегородки предсердий, другое располагается под прямым углом к первому, находясь в AV-борозде. От ганглиозных колец в мышцы предсердий и желудочков отходят тонкие веточки в виде петель, содержащие мелкие узлы и отдельно расположенные нервные клетки.
Большинство узлов лежит около места впадения в сердце больших вен, где сердечные нервы вступают в сердце на границе предсердий и желудочков. Узлы никогда не проникают в глубокие слои сердечной мышцы, располагаясь обычно на поверхности сердца. Вдоль ветвей субэпикардиального нервного сплетения предсердий лежат группы узловых нервных клеток. Рядом с ними в предсердиях и основании желудочков постоянно отмечают отдельные клетки, прилежащие к нервным стволам или располагающиеся в их средине.
Гистоархитектоника интракардиального отдела
Интракардиальную нервную систему сердца формируют переходящие на сердце ветви экстракардиального нервного сплетения, которые, наряду с эпикардиальным сплетением, включают подэпикардиальное, межмышечное, подэндокардиальное, эндокардиальное и сплетение венечных сосудов. Под эпикардом располагаются:
- Правое переднее сплетение, которое образуется как из глубокого, так и поверхностного сердечных сплетений и снабжает преимущественно ПЖ и правое предсердие.
- Левое переднее сплетение, состоящее преимущественно из ветвей глубокого сплетения, посылает ветви главным образом к верхушке, левой передней и боковой поверхностям ЛЖ.
- Левое заднее сплетение обеспечивает иннервацию левого края ЛЖ, задней поверхности левого предсердия и ЛЖ.
- Правое заднее сплетение, располагается между правыми легочными венами, верхней и нижней полыми венами, проходит до верхушки сердца. От него исходят ветви к задней поверхности медиальной части ЛЖ и ПЖ.
- Сплетение на передней поверхности стенок обоих предсердий, от которого отходят ветви к мышцам предсердий, передней части межпредсердных и межжелудочковых перегородок.
- Сплетение синуса Галлера расположено на задней стенке левого предсердия и иннервирует участок между четырьмя легочными венами.
Иннервация отделов сердца и слоев его стенки характеризуется неравномерностью. В предсердиях и под эндокардом, вокруг сосудов, в узлах и по ходу проводящих путей она более выражена, чем в миокарде, и практически отсутствует в эндокарде. Внутрисердечная нервная система построена по «кабельному» типу из шванновских протоплазматических тяжей, включает мякотные и безмякотные нервные волокна, исходящие из смешанных нервов, вступающих в сердце.
Симпатические (адренергические) сплетения сосудов и миокарда анатомически тесно связаны. Располагаясь в адвентиции сосудов в виде густой сети, они дают частые ответвления в медию, образуя в ней сплошные сетеобразные структуры. Ажурные чехлы из адренергических нервных волокон окутывают все разветвления сосудистого русла. Встречаясь с интрамуральными нервными ганглиями, большая часть которых сосредоточена по ходу сосудов или нервных стволов, они образуют как концевые, так и транзиторные синапсы. В нервных ганглиях сердца, наряду с парасимпатическими нейронами, присутствует и некоторая часть адренергических, аксоны которых вплетаются в общую симпатическую сеть.
Строение различных элементов
Нервные пучки, проникая из сосудистой стенки в миокард, разделяются на отдельные аксоны и формируют сетевидный концевой синаптический нервно-мышечный аппарат. По ходу таких аксонов наблюдаются небольшие варикозные утолщения, в которых сосредоточены запасы нейромедиатора норадреналина. Нервные пучки и их моноаксоанальная терминальная сеть являются единственными структурами в сердце, осуществляющими его синтез и хранение. В соответствии с локализацией в миокарде различают паракапиллярные окончания, лежащие около кардиомиоцитов, и «свободные» окончания, расположенные в интерстиции.
Парасимпатическая иннервация сердца осуществляется через сердечные ганглии, локализованные преимущественно под эпикардом в области основания сердца, задней стенки предсердий, выносящего тракта. На их холинэргических нейроцитах оканчиваются эффекторные волокна блуждающих нервов. Нейриты этих клеток составляют пучки нервных волокон, которые, часто ветвясь, истончаясь и анастомозируя, образуют полиаксональное сплетение. Аксоны внутрисердечных нейроцитов участвуют в иннервации кровеносных сосудов рабочего миокарда, проводящей системы сердца, достигая в последней наивысшей плотности. Нервные волокна преганглионарных нервных стволов, идущих из продолговатого мозга к сердцу, значительно менее протяженные, постганглионарные отделены от окружающей их ткани телами шванновских клеток.
Поли- и моноаксональные структуры предсердного сплетения, сопровождаемые шванновскими клетками, наиболее густо распределены в межпредсердечной перегородке и достигают наибольшей плотности в области AV-узла, в котором они непосредственно контактируют с кардиомиоцитами. Концентрация холинэргических волокон на всем протяжении проводящих путей выше, чем в окружающем миокарде, где они располагаются вдоль мышечных пучков.
Парасимпатическая иннервация миокарда и сосудов осуществляется дифференцированно. Нервные волокна, окружающие сосуды и проникающие в их медию, выходят из пучков, образованных аксонами нейронов интрамуральных ганглиев. На участке пути до обособления они следуют в шванновском плазмодии вместе с симпатическими волокнами. Плотность образуемой ими пара- и интравазальной сети пропорциональна калибру сосуда. После выхода из полиаксональных анастомозирующих тяжей парасимпатические аксоны образуют вторичную сеть из свободных моноаксональных структур с неравномерно распределенной по длине активностью ацетилхолинэстеразы, что придает им четкообразный, «варикозный» вид.
Парасимпатический компонент эфферентной иннервации сердца, как и симпатический, является в периферическом, преимущественно моноаксональном отделе сетевидным и частично незамкнутым образованием. Он не имеет специальных окончаний, подобных синаптическим бляшкам преганглионарных волокон, на интрамуральных нейронах сердца. Локусы повышенной активности ацетилхолинэстеразы в концевой холинэнергической нервно-мышечной синаптической структуре соответствуют зонам концентрирования и выделения нейромедиатора — ацетилхолина.
Афферентная (сенсорная) иннервация сердца обеспечивается волокнами вагусного и спинномозгового происхождения. Чувствительные нейрорецепторы выявлены во всех оболочках сердечной стенки. Преимущественная зона их распределения — эпикард и субэпикардиальный слой, где количество чувствительных нервных окончаний достигает нескольких сотен на 1 см2.
Нервные терминалы на большем своем протяжении заключены в тонкую оболочку из глиальных клеток-сателлитов. Она отсутствует лишь в области варикозных расширений аксонов, содержащих скопления синаптических пузырьков. Единственным барьером между плазмолеммой аксона и интерстицием в таких местах становится базальная мембрана клеток-сателлитов, не препятствующая диффузии содержимого синаптических везикул к миоцитам миокарда или сосудистой стенки, расположенных на расстоянии 50–150 нм. Взаимодействие соответствующих звеньев симпатической и парасимпатической иннервации сердца осуществляется в местах сближения холинэргических и адренергических терминалей, не разграниченных отростками глиальных клеток.
Толстые миелиновые эфферентные нервные волокна, вступающие в сердце в составе экстракардиальных нервов, вначале образуют внутрисердечные сплетения, которые состоят из крупных неветвящихся нервных пучков, не анастомозирующих с идущими рядом безмякотными волокнами. В следующих далее более мелких пучках сплетения они многократно ветвятся и, покидая их, заканчиваются рецепторами. Проводящие волокна сопровождаются шванновскими клетками, которые в проксимальных отделах плотно прилегают к волокну, располагаясь в один и нередко два ряда. В претерминальных и терминальных ответвлениях количество клеток существенно уменьшается, и они распределяются со значительными промежутками.
Афферентные сплетения предсердий, стенки желудочков, клапанов и сосудов сердца морфологически принципиально сходны. Их терминальные отделы представляют собой без-мякотные ответвления мякотных афферентных волокон, единичные либо в виде скоплений — рецепторных полей. В миокарде афферентные нервные терминали распределены главным образом в соединительнотканных прослойках, окружающих мышечные пучки и крупные сосуды, на кардиомиоцитах и среди элементов проводящей системы сердца.
Отличительной особенностью чувствительных терминалей является обилие митохондрий, присутствие осмиофильных ламеллярных телец и полиморфных везикул, хотя в целом на ультраструктурном уровне элементы чувствительной иннервации сердца исследованы еще недостаточно.
Кардиальные вегетативные ганглии являются специализированными структурами, обеспечивающими передачу импульса к кардиомицитам. Количество составляющих их нейроцитов колеблется от единичных до нескольких сотен клеток. Ганглии чаще всего имеют неправильную округлую форму и органоидное строение. Каждый из них окружен тонкой соединительнотканной капсулой, имеет строму, образуемую отростками и телами глиальных, шванновских клеток и некоторым количеством соединительнотканных элементов, а также свою региональную «систему» кровоснабжения и лимфооттока.
Нейроны кардиальных ганглиев отличает крупное отростчатое тело. Дендриты значительно увеличивают воспринимающую поверхность клетки и расширяют ее коммуникационные возможности, а аксон обеспечивает передачу импульса на другие нейроны или эфферентные клетки. В одних случаях отростки более или менее равномерно распределены по всей поверхности нейроцита, в других группируются у одного из полюсов, придавая клеткам звездчатую, овоидную или грушевидную форму. Преобладают мультиполярные клетки, однако в мелких ганглиях отмечают би- и униполярные нейроны.
Основные функции этих клеток — восприятие, трансформация и передача нервных импульсов — осуществляются при участии концевых и транзиторных синаптических контактов на их телах и отростках. При этом холинэргические терминали значительно преобладают над симпатическими, которые выявляются лишь в крупных ганглиях. В пресинаптической части аксона, имеющей вид варикозного расширения, содержатся мелкие митохондрии, синаптические везикулы, гранулы гликогена, большие гранулярные пузырьки. Нередко подобное окончание одновременно контактирует с несколькими дендритами нейроцитов. Высокоспециализированные синаптические контакты устанавливаются не только между нейроцитами, но между ними и малыми гранулярными клетками. Помимо того, в сердечных ганглиях существуют также дендродендрические и дендросоматические контакты несимпатического происхождения.
Нервные клетки имеют большие округлые ядра с двухслойной кариолеммой, диффузно распределенным малогранулированным хроматином и одним-двумя довольно крупными ядрышками. Цитоспецифическая структура нервных клеток представляет собой компактно расположенные участки гранулярного эндоплазматического ретикулума в виде телец Ниссля, что в сочетании с присутствием хорошо развитого пластинчатого комплекса, многочисленных гранул рибонуклеопротеинов, лежащих свободно или объединенных в полисомы, свидетельствует об интенсивности внутриклеточных пластических процессов.
Косвенным признаком секреторной активности нервных клеток является наличие в них значительного количества гладких и окаймленных микровезикул, расположенных рядом с цистернами аппарата Гольджи. Здесь же, в зоне перикариона, часто выявляют большие гранулярные пузырьки, мультивезикулярные тельца, лизосомы. Митохондрии многочисленны, разнообразны по размерам и форме, с редкими короткими кристами, погруженными в слабоосмиофильный матрикс. Органеллы отмечаются как в теле, так и в отростках нейронов, где они приобретают удлиненную форму и продольную ориентацию крист. Плазмолемма нервных клеток образована типичной трехслойной цитомембраной с субплазмолеммальными осмиофильными зонами в промежутках между окружающими их клетками-сателлитами.
Глиальные клетки-сателлиты значительно мельче нейронов, вокруг которых они расположены. Их богатые хроматином ядра имеют неправильную форму, в цитоплазме, помимо стереотипного набора органелл, содержится большое количество филаментозных структур. Межклеточные контакты нередко укреплены десмосомами. Промежутки в слое клеток-сателлитов повышают доступность нейронов для медиаторов, которые выделяются вариксами холинэргических или адренергических нервных волокон и циркулируют в межклеточных пространствах ганглиев.
В пространствах между компактно расположенными нервными клетками находятся их дендриты и аксоны, отростки нейронов из других участков нервной системы, тела и отростки шванновских клеток и клеток-сателлитов, образуя в совокупности так называемую нейропиль ганглиев. Интраганглионарные нервные пучки, иногда насчитывающие десятки аксонов, чаще всего не имеют миелиновой оболочки, разграничиваются глиальными клетками и тонкими прослойками соединительной ткани.
Важной популяцией регуляторных клеток миокарда являются малые гранулярные клетки (МГ-, МИФ- или SiF-), значительно уступающие по размерам нейроцитам ганглиев. Кластеры МГ-клеток, интенсивно флюорисцирующие при гистохимическом тесте на катехоламины, сопровождают ганглии всех размеров, располагаются, как правило, в непосредственной близости от обменных микрососудов, но иногда вне последних. В их цитоплазме выявляют многочисленные везикулы диаметром 100–200 нм с осмиофильной сердцевиной, электронная плотность которой варьирует в зависимости от концентрации катехоламинов, которые синтезируются, депонируются и выделяются МГ-клеткой.
Поверхности смежных МГ-клеток довольно часто соприкасаются, образуя десмосомоподобные контакты. Они находятся в афферентных симпатических связях с холинэргическими нервными терминалями, а также формируют эфферентные синапсы и воздействуют на постсинаптическую плазмолемму нервной терминали катехоламинами, которые высвобождаются из их больших гранулярных пузырьков. Как и нейроны, МГ-клетки и отростки их плазмолеммы довольно плотно окружены глиальными элементами. В основном это тела клеток-сателлитов; в промежутках между ними находится лишь базальная мембрана глии, что облегчает секреторную функцию МГ-клеток, диффузию выделяемого ими медиатора, который поступает во внутриклеточную среду и в близко расположенные капилляры с фенестрированным эндотелием.
Сердечные ганглии обильно васкуляризованы. Густые терминальные разветвления артериол или посткапилляров образуют вокруг узлов периганглионарный футляр с отходящими вглубь узла многочисленными разнонаправленно ориентированными ответвлениями, которые проходят мимо нервных клеток либо образуют окружающие их петли. Характерным компонентом гистогематического барьера в кардиальных ганглиях являются клетки-сателлиты, которые окружают цитоспецифические клетки ганглия, но иногда отсутствуют на небольших участках питающего их микрососуда.
Проводящая система сердца
Миокард предсердий и желудочков, разделенный фиброзными кольцами, синхронизируется в своей работе проводящей системой сердца, единой для всех его отделов (рис. 1.30).
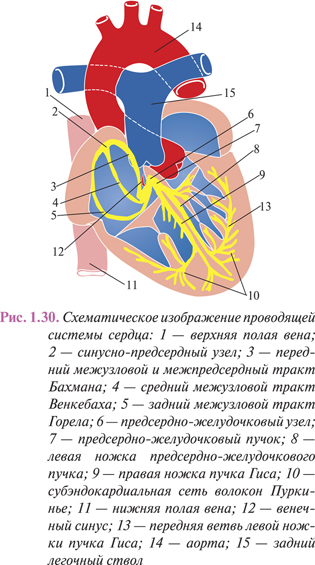
Структуры, генерирующие и передающие импульсы к предсердным и вентрикулярным кардиомиоцитам, регулирующие и координирующие сократительную функцию сердца, специализированы и сложны. Проводящая система сердца по своей гистоструктуре и цитологическим характеристикам существенно отличается от других отделов сердца. Анатомически проводящая система включает синусно-предсердный и предсердно-желудочковый узлы, межузловые и межпредсердные проводящие пути, предсердно-желудочковый пучок (пучок Гиса) специализированных мышечных клеток, отдающий левую и правую ножки, субэндокардиальную сеть волокон Пуркинье.
Синусно-предсердный узел
Синусно-предсердный узел расположен с латерильной стороны над основанием правого ушка у места впадения верхней полой вены в правое предсердие, от эндокарда которого его отделяет тонкая прослойка соединительной и мышечной ткани. Имеет форму уплощенного эллипса или полумесяца, горизонтально расположенного под эпикардом правого предсердия. Длина узла 10–15 мм, высота — до 5 мм, толщина — около 1,5 мм. Визуально узел слабо отличим от окружающего его миокарда, несмотря на капсулоподобное скопление соединительной ткани по периферии.
Ткань синусно-предсердного узла почти на 30% состоит из переплетающихся в различных направлениях пучков коллагеновых фибрилл различной толщины с небольшим количеством эластических волокон и клеток соединительной ткани. Тонкие мышечные волокна из специализированных клеток диаметром 3–4,5 мк расположены беспорядочно с неравномерными промежутками, выполненными интерстицием, микрососудами, нервными элементами, ориентированы по окружности сосуда, лишь вблизи центральной артерии, питающей узел. По периферии узел окружен значительным количеством фиброэластической ткани с обширной сетью капилляров, здесь же расположены нервные ганглии, единичные ганглиозные клетки и нервные волокна, в большом количестве проникающие в ткань узла.
Синусно-предсердный узел дает начало множественным путям, которые проводят импульсы, генерируемые специализироваными клетками. От него отходят латеральные пучки к правому ушку, нередко — горизонтальный пучок к левому ушку, задний горизонтальный пучок к левому предсердию и устьям легочных вен, пучки к верхней и нижней полым венам, медиальные 66 пучки к межвенозному мышечному пучку миокарда. Данные мышечные пучки проводящей системы являются факультативными анатомическими образованиями, отсутствие того или иного из них может не оказывать заметного влияния на работу сердечной мышцы.
Межузловые пути проведения импульсов
Наиболее функционально значимыми являются нисходящие пути. Передний межузловой тракт, пучок Бахмана, берет начало от переднего края синусно-предсердного узла, проходит спереди и влево от верхней полой вены по направлению к левому предсердию, продолжаясь до уровня левого ушка. От пучка Бахмана ответвляется передний межузловой пучок, далее самостоятельно следующий в межпредсердной перегородке до предсердно-желудочкового узла. Средний межузловой тракт, пучок Венкебаха, отходит от верхнего и заднего краев синуснопредсердного узла. Проходит единым пучком позади верхней полой вены, разделяясь затем на две неравные части, меньшая из которых следует до левого предсердия, а основная продолжается по межпредсердной перегородке до предсердножелудочкового узла.
Задний межузловой тракт, пучок Тореля, выходит из заднего края синусно-предсердного узла. Он рассматривается как основной путь межузлового проведения импульсов, его волокна следуют по пограничному гребешку, образуют основную долю волокон евстахиева гребня, следуя далее до предсердно-желудочкового узла по межпредсердной перегородке. Часть волокон перегородочной части всех трех трактов переплетается в непосредственной близости от предсердно-желудочкового узла, проникая в него на разных уровнях. Отдельные волокна межпредсердных и межузловых трактов по структуре сходны с волокнами Пуркинье желудочков, другие состоят из обычных предсердных кардиомиоцитов.
Предсердно-желудочковый узел
Предсердно-желудочковый узел обычно локализован под эндокардом правого предсердия на правом фиброзном треугольнике в нижней части межпредсердечной перегородки, над прикреплением септальной створки правого AV-клапана и несколько спереди от устья венечного синуса. Чаще всего овоидной, веретенообразной, дисковидной или треугольной формы, его размеры колеблятся в пределах от 6х4х0,5 до 11х6х1 мм.
В структуре предсердно-желудочкового узла, как и в рабочем миокарде, мышечный компонент преобладает над соединительной тканью. В отличие от синусно-предсердного узла, он является мышечным образованием с менее развитым соединительнотканным остовом. Ткань узла как бы разграничена на две части кровоснабжающей его артерией и пластинкой соединительной ткани, соединяющей стенку этого сосуда и фиброзное кольцо. От остальной ткани правого предсердия узел отделяет прослойка жировой клетчатки. Между предсердно-желудочковым узлом и устьем венечного синуса компактно размещены многочисленные парасимпатические ганглии. У мышечных волокон толщиной до 5 мкм продольное, косое и поперечное направление. Тесно переплетаясь, они образуют лабиринты, влияющие на электрофизиологические свойства ткани.
Пучок Гиса
От предсердно-желудочкового узла отходят верхний, задний и предсердно-желудочковый пучки Гиса, причем только последний выявляют в 100% наблюдений. Границей между пучком Гиса, отходящим от передней части предсердно-желудочкового узла, является его суженный участок, перфорирующий правый фиброзный треугольник в месте соединения с верхней перепончатой частью межжелудочковой перегородки. Длина пучка колеблется в пределах 8–20 мм при ширине 2–3 мм, толщине 1,5–2 мм и коррелирует с формой сердца.
По длиннику пучок Гиса слагается из двух частей: короткой интрафиброзной, проходящей сквозь ткань правого фиброзного треугольника, и более протяженной перегородочной, залегающей в межжелудочковой перегородке в виде серовато-бледного тяжа, который с возрастом приобретает желтоватый оттенок из-за накопления жировой ткани. На поперечных разрезах составляющие его мышечные волокна разделены соединительнотканными прослойками на группы, консолидированы в виде неправильного треугольника или фигуры овоидной формы. Предсердно-желудочковый пучок Гиса по всему периметру окружен плотной фиброзной тканью, размер его клеток возрастает по мере удаления от узла.
Под перепончатой частью, на уровне правого синуса аорты, пучок Гиса раздваивается на две ножки, как бы «седлая» гребень мышечного участка межжелудочковой перегородки. Более мощная правая ножка, сохраняющая вид пучка, проходит по правожелудочковой стороне межжелудочковой перегородки, отдавая ветви всем стенкам ПЖ. В большинстве случаев ее удается проследить до основания передней сосочковой мышцы, и лишь в отдельных наблюдениях она теряется уже на уровне середины межжелудочковой перегородки.
Топографически правая ножка пучка Гиса подразделяется на верхнюю, составляющую треть длины до основания перегородочных сосочковых мышц, среднюю — до перегородочнокраевой трабекулы, и нижнюю, расположенную в ней и в основании передней сосочковой мышцы. Верхняя часть этой ножки проходит субэндокардиально, следующая — интрамурально, а нижняя вновь возвращается под эндокард. Нижний участок ножки дает начало дистальным ветвям: передним, идущим к передней стенке желудочка, задним — к трабекулам задней стенки желудочка, и латеральным, следующим к правому краю сердца.
Левая ножка предсердно-желудочкового пучка появляется под эндокардом левой стороны межжелудочковой перегородки из-под задненижнего края перепончатой части перегородки между желудочками на уровне синусов аорты. В левой ножке различают стволовую и разветвленную части. Стволовая разделяется на переднюю ветвь, идущую к передней стенке ЛЖ и расположенной на ней сосочковой мышце, задняя — к его задней стенке и сосочковой мышце. При делении ножки на большее количество ветвей дополнительные ответвления следуют к верхушке сердца.
На периферии вторичные ветви левой ножки рассыпаются на более мелкие пучки, которые входят в трабекулы и образуют сетевидные связи между собой. Пучковые строения менее компактной левой ножки и обеих ее ветвей, направляющихся к передней и задней сосочковым мышцам, как и их граница с тканью рабочего миокарда, выражены значительно слабее, чем правой. Соединительнотканный и сосудистый компонент в них представлены хуже, чем в других участках проводящей системы. Клетки проводящей системы образуют под эндокардом сильно ветвящуюся сеть, элементы которой разграничиваются соединительнотканными прослойками, включающими сосудистые и нервные структуры.
Структура клеточных элементов
Строение клеток проводящей системы сердца определяется их функциональной специализацией. В ее неоднородном клеточном составе по морфофункциональным признакам выделяют три типа специализированных кардиомиоцитов. Клетки I типа — П-клетки, типичные нодальные или ведущие пейсмейкерные — неправильной удлиненной формы. Эти небольшие миоциты диаметром 5–10 нм, со светлой саркоплазмой и довольно крупным центрально расположенным ядром отдают многочисленные цитоплазматические отростки, сужающиеся к концам и плотно переплетающиеся между собой. П-клетки образуют небольшие группы — кластеры, разграниченные элементами рыхлой соединительной ткани. Кластеры П-клеток окружены общей базальной мембраной толщиной 100 нм, глубоко проникающей в межклеточные щели. Их сарколемма образует многочисленные кавеолы, а вместо Т-системы — нерегулярно определяющиеся глубокие туннельные инвагинации диаметром 1–2 мкм, в которые проникает интерстиций и иногда — нервные элементы.
Контрактильный аппарат П-клеток представлен редкими, хаотично перекрещивающимися миофибриллами либо произвольно ориентированными свободно лежащими тонкими и толстыми протофибриллами и их пучками, нередко в комплексе с полирибосомами. Тонкие миофибриллы состоят из рыхло упакованных филаментов с небольшим количеством саркомеров, диски которых выражены нечетко, Z-линии неодинаковой толщины, иногда прерывисты, а электронно-оптически плотное вещество часто выходит за пределы миофибрилл. Объем, занимаемый миофибриллами в П-клетках, составляет не более 25% такового в вентрикулярных кардиомиоцитах. Редкие митохондрии неодинакового размера и формы с внутренней структурой, значительно упрощенной в сравнении с клетками рабочего миокарда, беспорядочно разбросаны в обильной светлой саркоплазме, окружающей относительно крупное ядро, которое расположено в центральной зоне. Гранулы гликогена немногочисленны.
Слабо развитый саркоплазматический ретикулум распределен преимущественно по периферии клетки, причем его терминальные цистерны иногда формируют типичные функциональные контакты с плазмолеммой. В цитоплазме содержатся свободные гранулы рибонуклеопротеидов, элементы гранулярного ретикулума, комплекса Гольджи, лизосомы. Стабильность формы этих довольно бедных органеллами клеток поддерживают многочисленные хаотично расположенные элементы цитоскелета — так называемые промежуточные филаменты диаметром около 10 нм, часто оканчивающиеся в плотном веществе десмосом.
Клетки II типа — переходные или латентные пейсмейкеры — неправильной удлиненной отростчатой формы. Они короче, но толще рабочих кардиомиоцитов предсердий, нередко содержат два ядра. Сарколемма переходных клеток часто образует глубокие инвагинации диаметром 0,12–0,16 мкм, выстланные гликокаликсом, как и в Т-тубулах. Эти клетки богаты органеллами и имеют меньше недифференцированной саркоплазмы, чем П- клетки, их миофибриллы ориентированы вдоль длинной оси, толще и состоят из большего количества саркомеров, в которых слабо выражены Н- и М-полоски. Митохондрии, расположенные между миофибриллами, по своей внутренней организации приближаются к таковым клеток рабочего миокарда, количество гликогена непостоянно.
Клетки III типа подобны клеткам Пуркинье — проводящие миоциты, на поперечных срезах выглядят объемнее других кардиомиоцитов. Их длина составляет 20–40 мкм, диаметр — 2050 мкм, образуемые ими волокна имеют большее поперечное сечение, чем в рабочем миокарде, но неодинаковую толщину.
Клетки Пуркинье отличают также обширная свободная от миофибрилл перинуклеарная зона, выполненная светлой вакуолизированной саркоплазмой, крупное округлое либо напоминающее прямоугольник ядро с умеренной концентрацией хроматина. Их контрактильный аппарат развит слабее, а система пластического обеспечения — лучше, чем в вентрикулярных кардиомиоцитах. Сарколемма образует многочисленные кавеолы, единичные, нерегулярно расположенные Т-тубулы и глубокие, достигающие аксиальной зоны клетки-туннели диаметром до 1 мкм, выстланные базальной мембраной.
Миофибриллы, расположенные в субсарколеммной зоне, иногда ветвятся и анастомозируют. Несмотря на нечеткую ориентировку по длиннику клетки, они, как правило, закреплены в обоих вставочных дисках. Упаковка миофиламентов в миофибриллах довольно рыхлая, гексагональное расположение толстых и тонких протофибрилл не всегда выдерживается, в саркомерах слабо выражены Н-полоска и мезофрагма, отмечается полиморфизм в структуре Z-линий.
В саркоплазме видны свободно взвешенные разрозненные и собранные в комплексы толстые и тонкие филаменты цитоскелета, связанные с полисомами, микротрубочки, лептофибриллы с периодом 140–170 нм, рибосомы и гранулы гликогена, нередко заполняющие всю свободную саркоплазму. Немногочисленные элементы саркоплазматического ретикулума располагаются вокруг миофибрилл и под сарколеммой, иногда образуют субсарколеммные цистерны. Митохондрии заметно меньше, чем в рабочих кардиомиоцитах, расположены как вдоль миофибрилл, так и перинуклеарно в виде небольших скоплений. Здесь же отмечаются профили гранулярного ретикулума, пластинчатого комплекса, лизосомы, окаймленные везикулы.
В целом, П-клетки проводящей системы, генерирующие импульсы, отличаются наиболее низким уровнем морфологической дифференцировки, который постепенно повышается по мере приближения к рабочим кардиомиоцитам желудочков, достигая здесь максимального значения. Объединение различных типов клеток в единую систему генерации и проведения импульса определяется необходимостью синхронизации этого процесса во всех отделах сердца.
Миоциты проводящей системы сердца имеют не только цитоморфологические, но иммуно- и гистохимические отличия от клеток рабочего миокарда. Все миоциты проводящей системы, за исключением П-клеток предсердно-синусного узла, богаче гликогеном, который присутствует в них не только в легко метаболизируемой β-форме, но и в виде более устойчивого комплекса с белками — десмогликогена, выполняющего пластические функции. Активность гликолитических ферментов и гликогенсинтетазы в проводящих кардиомиоцитах относительно выше, чем энзимов цикла Кребса и дыхательной цепи, тогда как в рабочих кардиомиоцитах это соотношение имеет обратный характер соответственно содержанию митохондрий. В результате миоциты предсердно-желудочкового узла, пучка Гиса и других отделов проводящей системы устойчивее к гипоксии, чем остальной миокард, несмотря на более высокую активность АТФазы. В ткани проводящей системы отмечается интенсивная реакция на холинэстеразу, отсутствующая в миокарде желудочков, и значительно большая активность лизосомальных гидролаз.
Распределение миоцитов различных типов, характер и строение контактов клеток в различных отделах проводящей системы определяется их функциональной специализацией. В срединной зоне синусно-предсердного узла расположены наиболее рано активирующиеся П-клетки — пейсмейкеры, генерирующие импульс. Его периферию занимают переходные клетки II типа, П-клетки контактируют только с ними. Переходные клетки опосредуют прохождение импульса к миоцитам предсердий, замедляют его распространение. Контакты П-клеток немногочисленны, имеют упрощенное строение и весьма произвольную локализацию. В большинстве случаев представлены простым сближением плазмолеммы смежных клеток, фиксируемым единичными десмосомами. Цитологический состав предсердно-желудочкового узла более разнообразен. В нем присутствуют клетки, по структуре очень близкие к пейсмейкерным, краниодорсальную часть занимают миоциты II типа, а дистальные отделы состоят из быстрее проводящих импульс Пуркинье-подобных проводящих миоцитов III типа.
Некоторые исследователи выделяют в составе узла три зоны, отличающиеся по морфологическим и электрофизиологическим характеристикам: AN, переходную от предсердного миокарда к узловой ткани, состоящую в основном из переходных клеток, и NH-зону, пограничную с пучком Гиса, преимущественно формируемую полиморфными переходными Пуркинье-подобными клетками.
Контакты переходных миоцитов с типичными нодальными П-клетками имеют более простое строение, чем их соединения между собой, с предсердными рабочими миоцитами или клетками III типа. Межклеточные стыки образуют лишь непротяженные и бедные осмиофильным материалом промежуточные зоны, а десмосомы и миниатюрные нексусы отмечают довольно редко.
Межклеточные контакты миоцитов III типа между собой и с окружающими сократительными кардиомиоцитами организованы сложнее и по своей структуре ближе к характерным для рабочего миокарда. Вследствие более упорядоченного расположения миофибрилл они ориентированы поперек длинной оси клеток и заметно реже образуются боковыми поверхностями их апикальных зон. Поперечно расположенные вставочные диски отличает большая протяженность хорошо выраженных промежуточных зон. Наличие протяженных нексусов при боковых контактах значительно повышает проводимость этих мышечных волокон и облегчает передачу импульсов на рабочий миокард. Вставочные диски между клетками Пуркинье иногда имеют косое расположение или V-образную форму. Подобная ориентация и слабая извитость промежуточных зон соответствуют более примитивному строению их вставочных дисков по сравнению с рабочими клетками.
Кровоснабжение
Транспортно-трофическое обеспечение предсердных отделов проводящей системы сердца осуществляется в значительной степени дифференцированно от окружающего миокарда. Синусно-предсердный узел питают один или два сосуда, стенки которых имеют строение типичных интрамуральных транспортных артерий III–IV порядка. Характерной особенностью узла является непропорционально крупная питающая артерия, проходящая по длинной оси через его середину. Она является одной из первых ветвей правой венечной артерии либо, несколько реже, отходит от проксимального сегмента огибающей ветви ЛКА. Ее последующие разветвления на короткие промежуточные звенья включают терминальные артерии, артериолы, прекапилляры дают начало густой сети капилляров того же типа, что и в миокарде, доля которых в ткани узла более чем в 2 раза больше, чем в окружающей его ткани правого предсердия. Их стенка образована 1–3 эндотелиоцитами, лежащими на базальной мембране, в которой довольно часто отмечают перициты. Посткапилляры анастомозируют перед слиянием в конусовидные венулы, образующие довольно густую венозную сеть. Кровеносное русло синусно-предсердного узла завершается двумя группами мелких интрамиокардиальных вен.
Кровоснабжение предсердно-желудочкового узла чаще всего осуществляется ветвью ПКА, отходящей непосредственно от нее или от проксимального сегмента задней межжелудочковой артерии. Иногда узел получает кровь из огибающей ветви левой венечной артерии. Собственная мелкая интрамуральная артерия мышечного типа, питающая предсердно-желудочковый узел, последовательно распадается на артериолы диаметром 20–25 мкм. Отдаваемые артериолами прекапилляры располагаются под различными углами по отношению к мышечным волокнам, их диаметр не превышает 18 мкм. Капилляры диаметром около 6 мкм формируют густую трехмерную сеть с удлиненными полиморфными ячейками, петли которой охватывают по 1–2 мышечных волокна.
В некоторых капиллярах AV-узла выявляют фенестры — небольшие локальные диафрагмоподобные истончения периферической зоны эндотелиоцита вплоть до слияния плазмолеммы люминальной и базальной поверхности клетки. Капиллярная сеть завершается короткими широкими посткапиллярами диаметром 20–22 мкм, сливающимися в единичные венулы шириной 45 мкм, которые располагаются в соединительнотканных прослойках между группами мышечных волокон, принимая многочисленные притоки. Другие отделы проводящей системы получают питание вместе с окружающей их тканью.
Иннервация
Проводящая система сердца иннервируется интенсивнее в сравнении с другими регионами миокарда. Наиболее мощная иннервация характерна для ее начальных отделов. Синуснопредсердный и предсердно-желудочковый узлы кровоснабжаются и иннервируются обильнее, чем остальной миокард. В мощном нервном сплетении AV-пучка выделяют внешнее и глубокое нервные сплетения. Безмякотные нервные волокна глубокого сплетения образуют окончания на мышечных волокнах AV-пучка. Терминали, имеющие вид маленьких колечек, считаются моторными окончаниями.
Проводящая система сердца имеет собственный ганглиозный аппарат, в области AV-узла расположено значительное количество крупных и мелких нервных узлов. Нервные клетки этих узлов по морфологическим характеристикам могут быть отнесены к системе блуждающего нерва. Аксоны этих клеток заканчиваются на мышечных волокнах пучка. В интерцеллюлярных сплетениях узлов проводящей системы разветвления одного мякотного нервного нейрона контактируют с несколькими нервными клетками. Мякотное волокно в узлах распадается на тонкие нити интерцеллюлярного сплетения, которые оканчиваются на теле нескольких нервных клеток.
ЛИТЕРАТУРА
- Анатомія людини (2006) Підруч. для студ. вищ. мед. навч. закл. IV рівня акредитації: У 3 т. Т. 1. За ред. А.С. Головацького, В.Г. Черкасова. Нова книга, Вінниця, 365 с.
- Атлас микроскопического и ультрамикроскопического строения клеток, тканей и органов (2004) Учеб. пособие для студентов мед. вузов. В.Г. Елисеев, Ю.И. Афанасьев, Е.Ф. Котовский, А.Н. Яцковский. Медицина, Москва, 447 с.
- Атлас сканирующей электронной микроскопии клеток, тканей, органов (1987) Под ред. О.В. Волковой, В. А. Шахламова, А.А. Миронова. Медицина, Москва, 464 с.
- Большакова Г.Б. (1991) Межтканевые взаимоотношения в развитии сердца. Наука, Москва, 88 с.
- Гайворонский И.В. (2004) Нормальная анатомия человека. Учеб. для мед. вузов. 4-е изд. СпецЛит, Санкт-Петербург, Т. 1. 560 с.
- Гайворонский И.В. (2004) Нормальная анатомия человека: Учеб. для мед. вузов. 4-е изд. СпецЛит, Санкт-Петербург, Т. 2. 424 с.
- Гартнер Л.П. (2008) Цветной атлас гистологии. Л. П. Гартнер, Дж. Л. Хайатт; Под ред. В.П. Сапрыкина. Логосфера, Москва, 463 с.
- Караганов Я.Л., Кердиваренко Н.В., Левин В.Н. (1982) Микроагиология. Под ред. В.В. Куприянова. Штиинца, Кишинев, 248 с.
- Кузнецов С.Л. (2002) Атлас по гистологии, цитологии и эмбриологии. Учеб. пособие для студентов мед. вузов, мед. фак. ун-тов. С.Л. Кузнецов, Н.Н. Мушкамбаров, В.Л. Горячкина. Медицинское информационное агентство, Москва, 373 с.
- Кузнецов, С.Л. (2005) Гистология, цитология и эмбриология. Учеб. для мед. вузов. С.Л. Кузнецов, Н.Н. Мушкамбаров. МИА, Москва, 600 с.
- Кульчицкий К.И., Роменский О.Ю. (1985) Сравнительная анатомия и эволюция кровеносных сосудов. Здоров’я, Киев, 176 с.
- Куприянов В.В., Бородин Ю.И., Караганов Я.Л., Выренков Ю.Е. (1983) 20. Микролимфология. Медицина, Москва, 288 с.
- Луцик О.Д., Іванова А.Й., Кабак К.С., Чайковський Ю.Б. (2003) Гістологія людини. Підруч. для студ. вищ. мед. навч. закл. III-IV рiвнiв акредитації. Книга плюс, Киев, 592 с.
- Микроморфология человека (2007) Учеб. пособие для студентов мед. ву- 23. зов. Под ред. С.Ю. Масловского, Е.В. Мирошниченко. 3-е изд., испр. и доп. Ткани, Харьков, 126 с.
- Михайлов С.С. (1987) Клиническая анатомия сердца. Медицина, Москва, 228 с.
- Привес М.Г. (2005) Анатомия человека. Учеб. для рос. и иностр. студентов мед. вузов и факультетов. М.Г. Привес, Н.К. Лысенков, В.И. Бушкович. 26. 12-е изд., перераб. и доп. Изд. дом СПбМАПО, Санкт-Петербург, 720 с.
- Румянцев П.П. (1982) Кардиомиоциты в процессах репродукции, дифференцировок и регенерации. Ленинград, 288 с.
- Самойлова С.Д. (1970) Анатомия кровеносных сосудов сердца. Под ред. 28. А.П. Надеина. Медицина, Ленинград, 217 с.
- Синев А.Ф., Крымский Л.Д. (1985) Хирургическая анатомия проводящей системы сердца. Медицина, Москва, 272 с.
- Синельников Р.Д. (1958) Атлас анатомии человека. Т 2. Медгиз, Москва, 627 с.
- Сосудистый эндотелий (1986) Под ред. В.В. Куприянова, И.И. Бобрика, Я.Л. Караганова. Здоров’я, Киев, 248 с.
- Хэм А., Кормак Д. Гистология (1982) Пер с англ. Т. 2. Мир, Москва, 254 с.
- Чайковский Ю.Б. (2006) Гістологія, цитологія та ембріологія. Атлас для самостійної роботи студентів. Луцьк.
- Чернух А.М., Александров П.Н., Алексеев О.В. (1984) Микроциркуляция. Медицина, Москва, 432 с.
- Шаров В.Г., Иргашев Ш.Б. (1988) Ультраструктура сердца. Медицина, Ташкент, 242 с.
- Шахламов В.А., Цамерян А.П. (1982) Очерки по ультрастуктурной организации сосудов лимфатической системы. Наука, Новосибирск, 120 с.
- Воробъев В.П. (2003) Большой атлас анатомии человека. Харвест, Минск, 1312 с.
- Grant J.C.B. (1956) An atlas of anatomy. J.C.B. Grant. 4-th ed. Williams and Wilkins, Baltimore, I-X, 800 p.