Форма выпуска
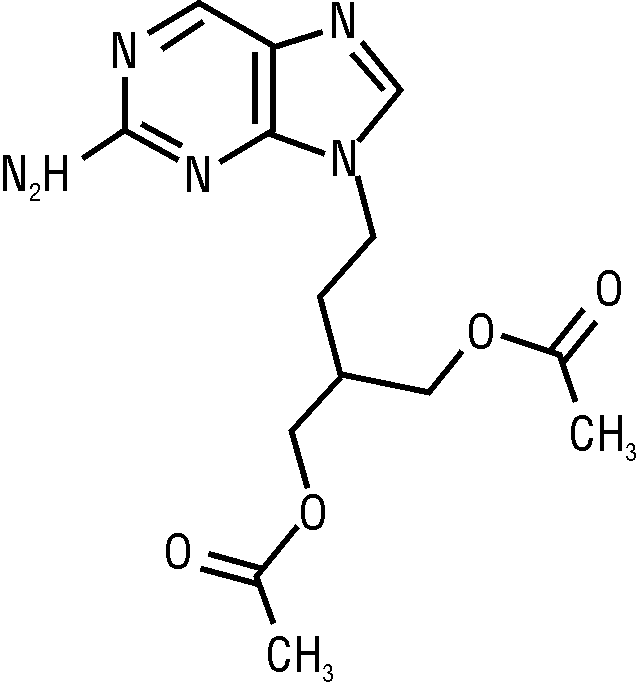
Состав и формула
Фармакологические свойства
противовирусное средство. После приема внутрь фамцикловир быстро превращается в пенцикловир, обладающий in vitro и in vivo активностью в отношении вирусов герпеса человека, включая вирус Varicella zoster и Herpes simplex I и II типа, а также вирусов Эпштейна — Барр и цитомегаловируса. Пенцикловир попадает в инфицированные вирусом клетки, где под действием вирусной тимидинкиназы быстро превращается в монофосфат, который в свою очередь при участии клеточных ферментов переходит в трифосфат. Пенцикловира трифосфат находится в инфицированных вирусами клетках более 12 ч, подавляя в них синтез вирусной ДНК, нарушая репликацию вирусов. T½ пенцикловира трифосфата в клетках, пораженных Varicella zoster, Herpes simplex I и II, составляет 9, 10 и 20 ч соответственно. Концентрация пенцикловира трифосфата в неинфицированных клетках не превышает минимальную определяемую, поэтому в терапевтических концентрациях пенцикловир не оказывает влияния на неинфицированные клетки. Пенцикловир активен в отношении недавно обнаруженных устойчивых к ацикловиру штаммов вируса Herpes simplex с измененной ДНК-полимеразой. Установлено, что частота возникновения резистентности к фамцикловиру (пенцикловиру) не превышает 0,3%, и 0,19% — у пациентов со сниженным иммунным статусом. Применение фамцикловира существенно снижает выраженность и длительность постгерпетической невралгии у пациентов с опоясывающим герпесом.
Показания
инфекции, вызванные Varicella zoster (опоясывающий герпес), включая опоясывающий герпес с осложнениями со стороны органа зрения; инфекции, вызванные Herpes simplex (тип I и II): первичная инфекция, рецидивирующая хроническая инфекция.
Применение
при инфекциях, вызванных Varicella zoster, у пациентов с нормальным иммунным статусом рекомендуемая доза составляет 250 мг 3 раза в сутки или 500 мг 2 раза в сутки, или 750 мг 1 раз в сутки в течение 7 дней (острая фаза заболевания). При осложнениях со стороны органа зрения рекомендуемая доза составляет 500 мг 3 раза в сутки в течение 7 дней. При инфекциях, вызванных вирусом Varicella zoster, у пациентов со сниженным иммунным статусом назначают в дозе 500 мг 3 раза в сутки в течение 10 дней. При первичной герпетической инфекции, вызванной вирусами Herpes simplex I и II типов, у пациентов с нормальным иммунным статусом назначают в дозе 250 мг 3 раза в сутки в течение 5 дней. Лечение следует начинать как можно раньше, сразу после появления первых симптомов заболевания. При рецидивах хронической инфекции взрослым назначают по 125 мг 2 раза в сутки в течение 5 дней. Лечение следует начинать уже в продромальный период или сразу после появления симптомов заболевания. При герпетической инфекции, вызванной Herpes simplex I и II типов у пациентов со сниженным иммунным статусом назначают в дозе 500 мг 2 раза в сутки в течение 7 дней. Лечение следует начинать как можно раньше, сразу после появления первых симптомов заболевания. При рецидивирующей герпетической инфекции назначают по 250 мг 2 раза в сутки. Рекомендуется периодическое прекращение приема 1 раз в 12 мес для оценки возможных изменений течения заболевания. У ВИЧ-инфицированных пациентов эффективная доза составляет 500 мг 2 раза в сутки. Коррекции дозы у пациентов пожилого возраста при условии неизмененной функции почек не требуется. У пациентов с нарушением функции почек отмечается снижение клиренса пенцикловира. Рекомендуется адекватная коррекция режима дозирования в зависимости от клиренса креатинина. При назначении больным с нарушением функции почек, находящимся на гемодиализе, следует учитывать, что после 4 ч гемодиализа концентрация пенцикловира в плазме крови снижается приблизительно на 75%, поэтому дозу фамцикловира следует принимать сразу после процедуры гемодиализа. Рекомендуемая доза составляет 250 мг (для больных с опоясывающим герпесом) и 125 мг (для больных с генитальным герпесом).
У больных с заболеваниями печени в фазе компенсации корректировки дозы не требуется. Данные о применении фамцикловира при тяжелых декомпенсированных хронических заболеваниях печени отсутствуют, поэтому точных рекомендаций по дозированию фамцикловира у этой категории больных не существует. Эффективность и безопасность фамцикловира у детей не изучали.
Противопоказания
повышенная чувствительность к фамцикловиру, пенцикловиру.
Побочные эффекты
переносимость фамцикловира в исследованиях у человека была хорошей. С такой же частотой, как и у пациентов, получавших плацебо, отмечали слабую и умеренную головную боль и тошноту. В постмаркетинговых исследованиях редко отмечались рвота, головокружение, кожная сыпь (преимущественно у пожилых пациентов), спутанность сознания и галлюцинации. У пациентов со сниженным иммунитетом отмечались также боль в животе, лихорадка и редко — гранулоцитопения и тромбоцитопения.
Особые указания
поскольку безопасность фамцикловира в период беременности и кормления грудью не изучалась, его применение в этот период не рекомендуется, если только возможные преимущества лечения не превышают потенциальный риск. Неизвестно, выделяется ли пенцикловир с грудным молоком. Фамцикловир не оказывает выраженного эффекта на спермограмму, морфологию или подвижность сперматозоидов человека. В экспериментальных исследованиях не выявлено эмбриотоксического и тератогенного действия фамцикловира и пенцикловира. Следует соблюдать осторожность при лечении больных с нарушением функции почек, для которых может потребоваться коррекция режима дозирования. Специальных предосторожностей при лечении пациентов пожилого возраста не требуется.
Взаимодействия
клинически значимого фармакокинетического взаимодействия фамцикловира с другими препаратами не отмечалось. Доклинические исследования не выявили воздействия фамцикловира на систему цитохрома Р450. Пробенецид и другие препараты, оказывающие влияние на функцию почек, могут изменять уровень пенцикловира в плазме крови.
Передозировка
описанные случаи передозировки (10,5 г) фамцикловира не сопровождались клиническими проявлениями. По показаниям назначается поддерживающая терапия. При несоблюдении рекомендаций по снижению дозы фамцикловира с учетом функции почек у больных с заболеваниями почек отмечены случаи ОПН. Пенцикловир выводится при гемодиализе (через 4 ч гемодиализа концентрация в плазме крови снижается приблизительно на 75%).