Что известно о происхождении мочевой кислоты?
У большинства млекопитающих фермент уратная оксидаза (уриказа) превращает мочевую кислоту в алантоин, благодаря чему поддерживается очень низкая концентрация мочевой кислоты в сыворотке крови (менее 60 мкмоль/л). В процессе филогенеза, в эпоху Миоцена, около 15 млн лет назад, большие обезьяны и люди утратили активность фермента уриказы в результате 3 различных мутаций. Следовательно, у людей отмечают более высокие уровни мочевой кислоты, чем у других млекопитающих. Эта потеря функции, предположительно, предоставила некоторые эволюционные преимущества.
Во-первых, мочевая кислота как антиоксидант представляет 60% антиоксидантной емкости плазмы крови. Может удалять свободный кислород, пероксильные и гидроксильные радикалы, вступает в реакцию с пероксинитритом и стабилизирует активность eNOS. Конечно, ее антиокислительные эффекты требуют наличия аскорбата. Важно отметить, и что очень низкий уровень мочевой кислоты связан с эндотелиальной дисфункцией, и существует J-образное соотношение между сердечно-сосудистыми событиями и уровнем мочевой кислоты при эссенциальной артериальной гипертензии.
Во-вторых, мочевая кислота повышает чувствительность к соли. И, возможно, таким образом поддерживала артериальное давление при недостатке соли во времена раннего развития человечества.
В-третьих, мочевая кислота увеличивает хранение жира и липогенез. Плоды содержат больше фруктозы в конце лета, что приводит к усилению отложения липидов, чтобы лучше справляться с проблемами выживания предстоящей зимой.
Источником образования мочевой кислоты в организме человека являются пуриновые соединения, поступающие с пищей, кроме этого, она образуется в процессе обмена нуклеотидов (рис. 1).
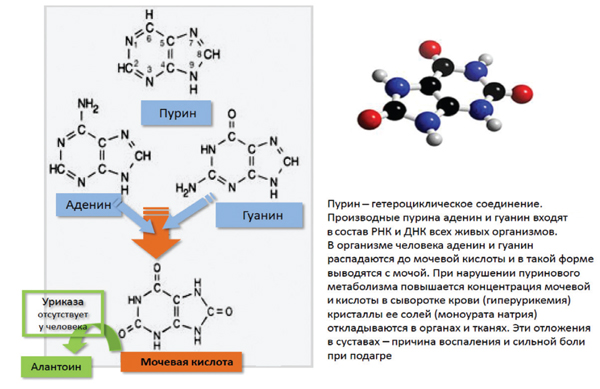
Рис. 1. Источники образования и метаболизм мочевой кислоты
Каков патогенез нарушений обмена мочевой кислоты?
Мочевая кислота (2,6,8-триоксипурин) является конечным продуктом пуринового обмена у человека и представлена натриевой солью: мононатриевым уратом.
Нормальный уровень мочевой кислоты <420 мкмоль/л у мужчин (7 мг/дл) и <360 мкмоль/л у женщин (6 мг/дл). Уровень мочевой кислоты повышается с возрастом. Вследствие урикозурического эффекта эстрогенов у женщин в фертильном возрасте содержание мочевой кислоты ниже, чем у мужчин того же возраста. Нормальный уровень мочевой кислоты — важный фактор гомеостаза. Мочевая кислота характеризуется слабой степенью диссоциации и при супернасыщении сыворотки крови уратами (уровень мочевой кислоты выше 420 мкмоль/л) происходит формирование и отложение кристаллов моноурата натрия в тканях.
Синтез пуринов начинается в организме человека с того, что из молекул фосфорибозилпирофосфата и глутамина под влиянием фермента аминотрансферазы образуется фосфорибозиламин. Из него после нескольких биохимических реакций образуется первый пуриновый нуклеотид — инозиновая кислота, значительное количество которой превращается в пуриновые нуклеотиды нуклеиновых кислот — адениловую и гуаниловую, которые становятся строительным материалом для нуклеиновых кислот (рис. 2). Однако часть адениловых и гуаниловых кислот катаболизируется, превращаясь в простые пурины: гуанин, ксантин и другие, которые под воздействием фермента ксантиноксидазы превращаются в мочевую кислоту, но большая их часть при участии фермента гипоксантин-гуанинфосфорибозилтрансферазы снова образует гуаниловую кислоту. Таким образом, непосредственными предшественниками мочевой кислоты являются пурины — гуанин и ксантин — составные части нуклеиновых кислот, как эндогенных, так и в значительно меньшей степени поступающих с пищей, а также пуриновые нуклеозиды, из которых образованы аденозинтрифосфат и подобные соединения. Мочевая кислота образуется главным образом в печени при участии фермента ксантиноксидазы. Она находится в сыворотке крови в двух формах: свободной — более 3/4 и меньшая часть — связанной с белками.
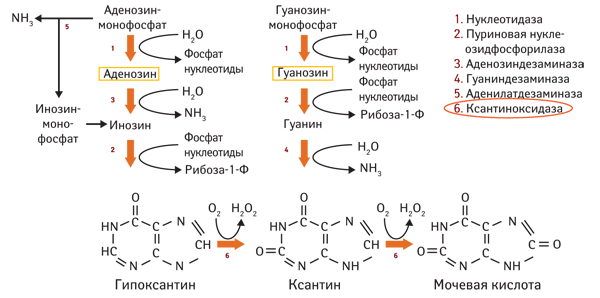
Рис. 2. Метаболизм пуриновых нуклеотидов
Две трети мочевой кислоты выделяется почками. Ее метаболизм в почках обеспечивают такие механизмы: клубочковая фильтрация, реабсорбция, канальцевая секреция и послеканальцевая реабсорбция. Через клубочек медленно фильтруется 95% уратов плазмы крови, небольшая часть мочевой кислоты, связанная с белками плазмы, не влияет на ее клиренс; в дальнейшем происходит почти полная реабсорбция в проксимальном канальце, канальцевая секреция и послеканальцевая реабсорбция в проксимальном канальце и петле Генле.
Одна треть метаболизма уратов происходит в кишечнике, кишечный уриколиз — это процесс превращения мочевой кислоты под воздействием кишечных бактерий. В отличие от почек, реабсорбция уратов в желудочно-кишечном тракте пассивна и зависит от концентрации уратов в просвете кишечника.
Обычно процессы синтеза и выделения мочевой кислоты сбалансированы. В основе развития подагры лежит нарушение ее метаболизма. У многих пациентов с подагрой выявляют именно нарушение канальцевой секреции при нормальной продукции мочевой кислоты.
Какие известны формы и типы нарушения обмена мочевой кислоты?
Выделяют 3 формы нарушения обмена пуринов:
1. Метаболическая форма, связана с увеличением синтеза мочевой кислоты. Например, при чрезмерном поступлении субстратов образования пуринов с пищей (сардины, жирное мясо, печень, почки, мясные экстракты, сухое вино, пиво и др.).
- Первичная — гиперпродукция связана с дефектами ферментативной системы обмена мочевой кислоты.
- Вторичная — гиперпродукция обусловлена повышением распада клеток при алкоголизме, гемобластозах, парапротеинемиях, хроническом гемолизе, проведении противоопухолевой терапии.
2. Почечная форма, при которой нарушена экскреция мочевой кислоты. Дефекты экскреции могут быть обусловлены нарушением функции почек, уменьшением объема внеклеточной жидкости, влиянием алкоголя или лекарственных средств, голоданием, накоплением кетоновых соединений, артериальной гипертензией, микседемой и др.
3. Смешанная форма, при которой одновременно нарушены синтез и экскреция мочевой кислоты.
По типу нарушения обмена мочевой кислоты и пуринов выделяют:
1. Первичное нарушение обмена мочевой кислоты и пуринов:
- идиопатическая подагра — 99% случаев, при этом с нормальной экскрецией мочевой кислоты (снижение почечного клиренса ± гиперпродукция уратов) — 80–90% случаев, или с повышенной экскрецией (гиперпродукция ± повышение почечного клиренса) — 10–20% случаев;
- результат наследственного метаболического дефекта — 1% случаев, повышение активности фосфорибозилпирофосфатсинтетазы или синдромы Леша — Нихена и Келли — Сигмиллера.
2. Вторичное нарушение обмена мочевой кислоты и пуринов:
- хронический гемолиз, эритромиело- и лимфопролиферативные заболевания (повышение обмена клеток и нуклеиновых кислот);
- наследственный дефект глюкозо-6-фосфатазы — болезнь Гирке.
3. Почечный механизм нарушения:
- хроническая почечная недостаточность;
- длительный прием лекарств — диуретики, циклоспорин и др., которые угнетают секрецию или повышают реабсорбцию уратов;
- эндогенные метаболиты — лактат, кетоны, бетаоксибутират (угнетают секрецию уратов).
Таким образом, в реальной врачебной практике в подавляющем большинстве случаев гиперурикемия обусловлена снижением урикозурической функции почек, что наблюдается при:
1) артериальной гипертензии;
2) заболеваниях почек и хронической почечной недостаточности;
3) приеме алкоголя, тиазидных и петлевых диуретиков, низких доз ацетилсалициловой кислоты, циклоспорина, этамбутола, пиразинамида, леводопы и никотиновой кислоты;
4) ожирении, гипотиреозе, гиперпаратиреозе;
5) ацидозе (в том числе кето- и лактоацидозе), дегидратации и свинцовой интоксикации.
Среди больных подагрой этот механизм развития гиперурикемии отмечают почти в 90% случаев, при этом исследование суточной мочи на содержание мочевой кислоты не включено в рекомендации.
Гиперпродуцентами мочевой кислоты являются:
1) лица с врожденными энзимопатиями (повышение активности фосфорибозилпирофосфатсинтазы, дефицит гипоксантин-гуанинфосфорибозилтрансферазы — синдром Келли — Сигмиллера) и болезнями накопления (гликогеноз Гирке);
2) пациенты с различными новообразованиями;
3) больные, принимающие цитостатики.
Вторичная, продукционная гиперурикемия отмечается также у лиц с врожденными пороками сердца и эритроцитозом, тяжелым псориазом, саркоидозом, акромегалией, а также при гемолитической и пернициозной анемии, лучевой болезни, гемоглобинопатиях, злоупотреблении пищей, богатой пуринами, и некоторых заболеваниях печени.
Смешанный тип гиперурикемии отмечают при застойной сердечной недостаточности (преобладает продукционный механизм), ожирении, гипотиреозе и гиперпаратиреозе, гестозах, алкоголизме, обезвоживании.
Что такое гиперурикемия? Каковы нормативы уровней мочевой кислоты в сыворотке крови и их гендерные особенности?
Гиперурикемия определяется как уровень мочевой кислоты в плазме крови >6,8 мг/дл при физиологичной температуре (37,0 °С) и нейтральном уровне рН. Однако у лиц с хронической гиперурикемией и у больных подагрой нормальными считают уровни мочевой кислоты в сыворотке крови <6,0 мг/дл (360 мкмоль/л), поскольку именно при этих уровнях эффективно предотвращаются депозиции кристаллов мочевой кислоты.
Таким образом, в соответствии с Рекомендациями Европейской антиревматической лиги (European League Against Rheumatism — EULAR) по диагностике и лечению подагры (2006, 2016) гиперурикемией считают уровень мочевой кислоты в сыворотке крови ≥360 мкмоль/л (6 мг/дл). Именно такой уровень, по данным международных исследований, повышает риск развития подагры у мужчин в 4 раза и в 17 — у женщин. Известно, что содержание мочевой кислоты в крови >420 мкмоль/л (7 мг/дл) является уровнем чрезмерного насыщения сыворотки крови уратами, при котором образуются кристаллы моноурата натрия. Стабильная сывороточная концентрация мочевой кислоты ≤360 мкмоль/л (6 мг/дл) является условием для растворения кристаллов и предупреждения их образования.
Содержание мочевой кислоты в сыворотке крови зависит от возраста и пола человека. У детей он всегда ниже (до 14 лет — 120–320 мкмоль/л). Затем он повышается во время пубертатного периода, достигая значений у взрослых. У мужчин уровень мочевой кислоты повышается в возрасте половой зрелости, у женщин — в период менопаузы. Именно поэтому возраст риска возникновения гиперурикемии для мужчин — 30 лет, а для женщин — 50. У мужчин уровень мочевой кислоты довольно стабильный на протяжении всей жизни. А вот у женщин репродуктивного возраста более низкий уровень мочевой кислоты обусловлен защитной функцией эстрогенов, влиянием на процессы канальцевой экскреции уратов, увеличением их почечного клиренса. По результатам многочисленных исследований изучена частота возникновения гиперурикемии среди мужчин и женщин в различных странах мира: США — 21,6 и 5,8%, страны западной Европы — 12,1 и 2,3%, Россия — 19,6 и 3,8%, Япония — 34,5 и 11,6%. Турция — 19 и 5,8%, Китай — 21,6 и 8,6% соответственно. В Украине известны лишь цифры общей распространенности гиперурикемии, которая составляет 15–20%.
Подтверждением значимости гиперурикемии является ее распространенность в популяции в сравнении с клинически очерченной подагрой: так называемую бессимптомную гиперурикемию регистрируют от 10 до 38,7% в различных странах мира.
«Подагра является гиперурикемией, но гиперурикемия не означает подагра!». Этот тезис означает, что гиперурикемия охватывает более широкий спектр патофизиологических изменений, чем собственно подагра, и служит важным маркером метаболических сдвигов в организме человека, в частности, абдоминального ожирения, сахарного диабета 2-го типа, дислипидемий, сердечно-сосудистых событий.
Сегодня гиперурикемия с уратными депозитами приобрела новый клинический смысл — это суставная, почечная и кардиометаболическая болезнь.
Какие патогенетические механизмы лежат в основе гиперурикемии?
Во-первых — гиперпродукция.
Повышение образования мочевой кислоты за счет повышения образования эндогенных пуринов или по причине чрезмерного поступления экзогенных пуриновых соединений с пищей.
Во-вторых — гипоэкскреция. 90% всех случаев гиперурикемии.
Недостаточное выделение мочевой кислоты (нарушение выделения мочевой кислоты почками).
В-третьих — объединение двух механизмов (смешанный тип гиперурикемии).
Как определить ведущий механизм гиперурикемии у больного?
Необходимо определить содержание мочевой кислоты и креатинина в суточной моче (за 24 ч). По суточной экскреции мочевой кислоты можно судить о причине гиперурикемии. У мужчин в отсутствие пуринов в рационе и при нормальной функции почек она составляет <3,6 ммоль (600 мг). При обычной диете, которая содержит пуриновые основания, выделение >800 мг уратов свидетельствует об увеличении образования мочевой кислоты, если же их выделяется меньше данного уровня, то это означает нарушение выделения мочевой кислоты почками. Снижение скорости клубочковой фильтрации приводит к уменьшению экскреции мочевой кислоты. Поэтому низкая величина суточной экскреции мочевой кислоты у таких больных не исключает ее повышенного образования, но увеличенная экскреция однозначно свидетельствует о ее избыточном образовании. Глюкокортикоиды, аскорбиновая кислота, салицилаты в дозе выше 2 г/сут и некоторые другие препараты усиливают экскрецию мочевой кислоты, что необходимо учитывать при оценке результатов лабораторного анализа.
Соотношение концентраций мочевой кислоты и креатинина в моче или отношение клиренса мочевой кислоты к скорости клубочковой фильтрации, определенное однократно, не позволяет судить об интенсивности синтеза мочевой кислоты. Однако это важный показатель для оценки состояния больного при острой почечной недостаточности и подозрении на острую мочекислую нефропатию.
В зависимости от суточного выделения мочевой кислоты выделяют 3 группы больных: гиперпродукторы и гипоэкскреторы, смешанные дефекты.
Гиперпродукторы
1. Составляют 10% больных подагрой.
2. Они выделяют более 750–1000 мг мочевой кислоты в сутки при обычной диете.
3. У них повышенное образование мочевой кислоты происходит при катаболизме нуклеиновых кислот.
Первичная причина повышенного образования мочевой кислоты связана с дефектами ферментной системы синтеза мочевой кислоты.
Причиной заболевания является первичная гиперурикемия. У больных отмечают конституциональный диспуринизм: семейно-генетическую аномалию пуринового обмена, детерминированную несколькими генами (какими именно генами, пока не установлено). Существуют семьи, в которых подагру отмечают чаще. У 20% членов семей больных выявляют гиперурикемию.
Конституциональный диспуринизм связан с определенными дефектами ферментов, которые участвуют в пуриновом обмене:
1) полный дефицит гипоксантин-гуанинфосфорибозилтрансферазы наряду с картиной подагрического артрита приводит к выраженным психоневрологическим нарушениям — умственной отсталости, аутоагрессивности, хореоатетозу. Такой симптомокомплекс получил название синдрома Леша — Нихена;
2) развитие семейной подагры, обусловленное генетическим дефектом Х-хромосомы, наблюдается при частичном дефиците гипоксантин-гуанинфосфорибозилтрансферазы (синдром Келли — Сигмиллера). При наследственно обусловленной подагре редко отмечают уролитиазную форму нефропатии, чаще выявляют очаговый гломерулонефрит с изменениями в канальцах, строме и сосудах. Особенностью течения данной формы подагры является то, что она обычно не связана с полом и проявляется в молодом возрасте;
3) проявление скрытых, генетически обусловленных ферментативных дефектов обусловливают экзогенные факторы: переедание, чрезмерное употребление продуктов, содержащих пуриновые основания, злоупотребление алкоголем, переохлаждение и др. Имеет значение высокая калорийность пищи в сочетании с низкой физической активностью.
Вторичная причина связана с повышенным распадом клеток при алкоголизме, болезнях крови, хроническом гемолизе или проведении противоопухолевой химиотерапии:
1) причиной гиперурикемии может быть повышение катаболизма пуриновых нуклеотидов при усиленной пролиферации, массовой гибели и распаде клеток, например, при бластном кризе, химиотерапии злокачественных новообразований (синдром распада опухоли), гемолизе и рабдомиолизе. Нуклеиновые кислоты, высвобождаемые из погибающих клеток, распадаются под действием нуклеаз и фосфодиэстераз до нуклеозидмонофосфатов, которые последовательно превращаются в нуклеозиды, азотистые основания и мочевую кислоту. Усиленный распад мышечного аденозинтрифосфата при тяжелой физической нагрузке, эпилептическом статусе и гликогенозах типов III, V и VII тоже может привести к гиперурикемии;
2) возможно, что гиперурикемия при инфаркте миокарда, отравлении продуктами горения и острой дыхательной недостаточности также связана с распадом аденозинтрифосфата.
Гипоэкскреторы
1. Составляют 90% больных подагрой.
2. Они выделяют менее 700 мг мочевой кислоты в сутки.
3. Причиной гиперурикемии в подобных случаях считают снижение выделения мочевой кислоты почками вследствие эффекта диуретиков алкоголя, низких доз ацетилсалициловой кислоты, а также заболеваний почек (хроническая почечная недостаточность, свинцовая нефропатия):
- почечная недостаточность всегда сопровождается гиперурикемией, но подагрический артрит отмечают только у 1% больных с хронической почечной недостаточностью.
Первый приступ подагры обычно возникает после многих лет стойкой гиперурикемии, поэтому у большинства пациентов с хронической почечной недостаточностью просто не успевает накопиться достаточное количество мочевой кислоты для развития подагры. Кроме того, при хронической почечной недостаточности снижается интенсивность воспалительной реакции при подкожном введении уратных кристаллов. По неясным причинам исключение составляет поликистоз почек, он сопровождается подагрой в 24–36% случаев.
Иногда рецидивирующий артрит или периартрит развивается после многократного проведения гемодиализа вследствие кристаллизации уратов, фосфата кальция или оксалата кальция;
- экскреция мочевой кислоты может уменьшаться в результате снижения скорости клубочковой фильтрации, уменьшения секреции или повышения реабсорбции. Снижение скорости клубочковой фильтрации вряд ли может вызвать первичную гиперурикемию, но обусловливает развитие вторичной гиперурикемии при почечной недостаточности.
Хронические заболевания почек всегда сопровождаются гиперурикемией, но при этом нет прямой зависимости между концентрацией мочевой кислоты в сыворотке крови, с одной стороны, аммониевой кислоты и концентрацией креатинина — с другой. При хронической почечной недостаточности отношение клиренса мочевой кислоты к скорости клубочковой фильтрации постепенно повышается, канальцевая секреция не меняется, реабсорбция снижается, и по мере усугубления почечной недостаточности все больше мочевой кислоты выводится с калом;
- подагра — частое осложнение после трансплантации почки.
Подагрический артрит наблюдается у 7–12% больных, получающих иммуносупрессивную терапию циклоспорином и глюкокортикоидами, и еще чаще — при одновременном назначении диуретиков; между операцией и первым приступом подагры проходит в среднем 17 мес. При лечении азатиоприном и глюкокортикоидами подагру отмечают намного реже. У больных, получающих циклоспорин, синтез мочевой кислоты не усиливается, но ее экскреция ниже, чем у тех, кто получает азатиоприн;
- снижение секреции мочевой кислоты в проксимальных канальцах может привести к гиперурикемии и при нормальной скорости образования мочевой кислоты. Этим объясняется вторичная гиперурикемия при ацидозе. Диабетический кетоацидоз, голодание, лактоацидоз, отравление этанолом или салицилатами приводят к накоплению органических кислот (β-оксимасляной, ацетоуксусной, молочной, салициловой), которые конкурируют с мочевой кислотой за транспортные системы, обеспечивающие ее секрецию. Усиление реабсорбции в дистальных отделах проксимальных канальцев почек также может привести к гиперурикемии и подагре. Это наблюдается при снижении объема внеклеточной жидкости, например, при несахарном диабете или приеме диуретиков.
Следует помнить, что «гиперпродукторы» могут одновременно быть и «гипоэкскреторами» мочевой кислоты.
Какие генетические дефекты ферментов в обмене уратов обусловливают гиперурикемию?
Дефекты ферментных систем, которые обусловливают увеличение образования мочевой кислоты, наследуются как сцепленные с Х-хромосомой рецессивные признаки:
- повышение активности фосфорибозилпирофосфатсинтетазы;
- частичный дефицит гипоксантин-гуанинфосфорибозилтрансферазы — синдром Келли — Сигмиллера;
- недостаточность глюкозо-6-фосфатазы — болезнь Гирке (болезнь накопления гликогена 1-го типа).
У таких больных подагра развивается, как правило, в возрасте до 30 лет и чаще протекает с развитием уратного нефролитиаза.
При полном отсутствии гипоксантин-гуанинфосфорибозилтрансферазы развивается синдром Леша — Нихена: задержка умственного развития, стремление к самоповреждению, хореоатетоз, снижение порога судорожной готовности.
Увеличение продукции уратов при болезни Гирке происходит за счет повышенного расщепления аденозинтрифосфата в процессе распада гликогена, обусловленного гипогликемией. Болезнь характеризует молочнокислый ацидоз, который приводит к повышению порога секреции уратов в канальцах почек как следствию повышения концентрации конкурирующих анионов.
В каких случаях развивается вторичная, приобретенная гиперурикемия?
- Увеличение образования уратов происходит при чрезмерном употреблении пищи, содержащей большое количество пуриновых оснований, повышенном распаде аденозинтрифосфата при злоупотреблении алкоголем, употреблении продуктов, содержащих глюкозу, в случаях врожденной ее непереносимости, а также при чрезмерном обмене нуклеотидов при миелопролиферативных и лимфопролиферативных заболеваниях (метаболическая гиперурикемия). Около 10% всех случаев чрезмерного образования мочевой кислоты связано с врожденными нарушениями ее метаболизма.
- Недостаточное выведение уратов выявляется при заболеваниях почек, нефропатии вследствие отравления свинцом — «свинцовая» подагра, торможении канальцевой секреции уратов — кето- и лактоацидоз (почечная гиперурикемия). Уменьшение выделения уратов отмечают и при некоторых других заболеваниях, а именно при гиперпаратиреоидизме, гипотиреоидизме и респираторном ацидозе.
- Сочетание причин.
Какие наиболее значимые факторы влияют на уровень мочевой кислоты и обусловливают развитие подагры?
Итак, сегодня доказано, что и у мужчин, и у женщин риск развития подагры ассоциируется прежде всего с наследственными факторами, возрастом, а также факторами внешней среды: особенностями питания, злоупотреблением алкоголя, приемом некоторых лекарственных препаратов (табл. 1). Имеет значение и наличие определенных заболеваний и обменных нарушений, в том числе метаболического синдрома и его компонентов (ожирение, артериальная гипертензия, дислипидемия, инсулинорезистентность, сахарный диабет), хроническая болезнь почек, ранней менопаузы и др.
Таблица 1
Факторы, обусловливающие развитие подагры (по М.С. Елисееву, 2016)
|
Фактор риска |
Примечание |
Относительный риск (95% доверительный интервал) |
|
Прием диуретиков |
— |
3,37 (2,75–4,12) |
|
Потребление алкоголя:
|
≥50 г день vs нет ≥2 порций в день vs нет ≥2 порций в день vs нет ≥2 порций в день vs нет |
2,53 (1,73–3,70) 2,51 (1,77–3,55) 1,60 (1,19–2,16) 1,05 (0,64–1,72) |
|
Артериальная гипертензия |
— |
2,31 (1,96–2,72) |
|
Индекс массы тела |
≥30 кг/м2 (возраст — старше 21 года) |
2,14 (1,37–3,32) |
|
Потребление подслащенных напитков |
≥2 порций в день vs нет |
1,85 (1,08–3,16) |
|
Потребление фруктозы |
Верхний vs нижний квартиль |
1,81 (1,31–2,50) |
|
Потребление морепродуктов |
Верхний vs нижний квартиль |
1,51 (1,71–1,95) |
|
Потребление мяса |
Верхний vs нижний квартиль |
1,41 (1,07–1,86) |
|
Потребление молочных продуктов |
Верхний vs нижний квартиль |
0,56 (0,42–0,74) |
|
Потребление витамина С |
≥1,5 мг vs <250 мг в сутки |
0,55 (0,38–0,80) |
|
Потребление кофе |
≥6 чашек в сутки vs нет |
0,41 (0,19–0,88) |
Действительно, статистика неумолимо подтверждает значение возраста как фактора риска развития подагры: у мужчин младше 35 лет распространенность подагры менее 0,5% и более 7% — в возрасте старше 75 лет. У женщин в период пременопаузы подагра развивается редко, но в возрасте 75 лет и старше распространенность заболевания достигает 2,5–3%.
Риск развития подагры повышается при ожирении в 4 раза по сравнению с лицами с индексом массы тела 21–25 кг/м2. Чрезмерное ежедневное употребление мяса повышает риск развития подагры на 20%. У лиц, ежедневно употребляющих >50 г алкоголя, частота развития подагры в 2,5 раза выше, чем у тех, кто не пьет спиртные напитки.
Применение некоторых лекарственных препаратов ассоциируется с повышением сывороточного уровня мочевой кислоты. Однако, например, такая ассоциация с диуретиками, занимающими ведущие позиции в этом отношении, некоторыми экспертами в настоящее время ставится под сомнение, поскольку у пациентов с артериальной гипертензией и сердечной недостаточностью, получающих диуретики, это, возможно, связано с нарушениями пуринового обмена при данной патологии. Особенности механизмов почечной экскреции уратов при применении различных диуретиков также неоднозначны. Риск развития гиперурикемии и подагры выше при приеме петлевых диуретиков, чем тиазидовых. Циклоспорин, ацетилсалициловая кислота и салицилаты снижают экскрецию уратов и тем самым также могут обусловливать развитие гиперурикемии.
Как питание влияет на уровень мочевой кислоты?
Алиментарные факторы и пищевые пристрастия человека определяют высокий риск гиперурикемии и подагры (табл. 2).
Таблица 2
Влияние алиментарных факторов на развитие подагры и гиперурикемии (по N. Dalbeth et al., 2010)
|
Фактор |
Риск развития подагры |
Ассоциация с гиперурикемией |
|
Все алкогольные напитки |
Повышают |
Есть |
|
Пиво |
Повышает |
Есть |
|
Виски |
Повышает |
Есть |
|
Вино |
Не влияет |
Нет |
|
Мясо |
Повышает |
Есть |
|
Морепродукты |
Повышают |
Есть |
|
Овощи, богатые пуринами |
Не влияют |
Нет данных |
|
Нежирные молочные продукты |
Снижают |
Нет |
|
Жирные молочные продукты |
Не влияют |
Нет данных |
|
Кофе |
Снижает |
Нет |
|
Кофе без кофеина |
Снижает |
Нет |
|
Чай |
Не влияет |
Нет данных |
|
Витамин С |
Снижает |
Нет |
|
Сладкие напитки |
Повышают |
Есть |
|
Напитки без сахара |
Не влияют |
Нет |
|
Фрукты, богатые фруктозой |
Повышают |
Нет данных |
|
Фруктовые соки |
Повышают |
Есть |
|
Фруктоза |
Повышает |
Нет данных |
Высокопуриновые продукты питания обусловливают избыток субстрата для синтеза мочевой кислота, что приводит к значительному повышению уровня мочевой кислоты в крови. Прежде всего это зависит от состава пуринов и их количества. Так, пристрастие к мясу и морепродуктам именно у мужчин сопровождается повышением риска развития подагры соответственно на 41 и 51%, а предпочтение сладких газированных напитков (на основе фруктозы), по данным канадских и американских ученых, на 85% повышает этот риск. В то же время регулярное употребление молочных продуктов, продуктов переработки овса, овощей, содержащих пурины (горох, бобы, чечевица, грибы, цветная капуста), не приводит к повышению риска развития подагры.
Кроме того, следует помнить, что жирная пища нарушает экскрецию уратов почками, а алкоголь, метаболизируясь до молочной кислоты, препятствует экскреции уратов. Наиболее высокую опасность представляют крепкие алкогольные напитки и пиво.
Какова связь между гиперурикемией и подагрой?
Гиперурикемия является основным патогенетическим звеном и фактором риска развития подагры (табл. 3).
Таблица 3
Гиперурикемия как фактор риска развития подагры (по H. Gullu еt al., 2007)
|
Содержание мочевой кислоты в сыворотке крови, ммоль/л |
5-летняя кумулятивная частота развития подагры, ‰ |
|
<0,42 |
5 |
|
0,42–0,47 |
20 |
|
0,48–0,53 |
41 |
|
0,54–0,59 |
198 |
|
>0,6 |
305 |
Каков современный взгляд на патогенез подагры?
Острое подагрическое воспаление развивается как результат взаимодействия микрокристаллов моноурата натрия с нейтрофильными гранулоцитами, моноцитами/макрофагами и базофильными гранулоцитами, что приводит к высвобождению медиаторов воспаления (рис. 3). Таким образом, кристаллы моноурата натрия являются триггерами воспалительных медиаторов:
- цитокины: интерлейкин-1α и интерлейкин-6, фактор некроза опухоли;
- хемокины: интерлейкин-8;
- мини-молекулы: простагландины, гистамин;
- жирные кислоты выступают как вторичный сигнал и необходимы для развития подагрического артрита;
- кроме того, кристаллы мочевой кислоты активируют циклооксигеназу-2, киназы (Syk, p38 MAPK).
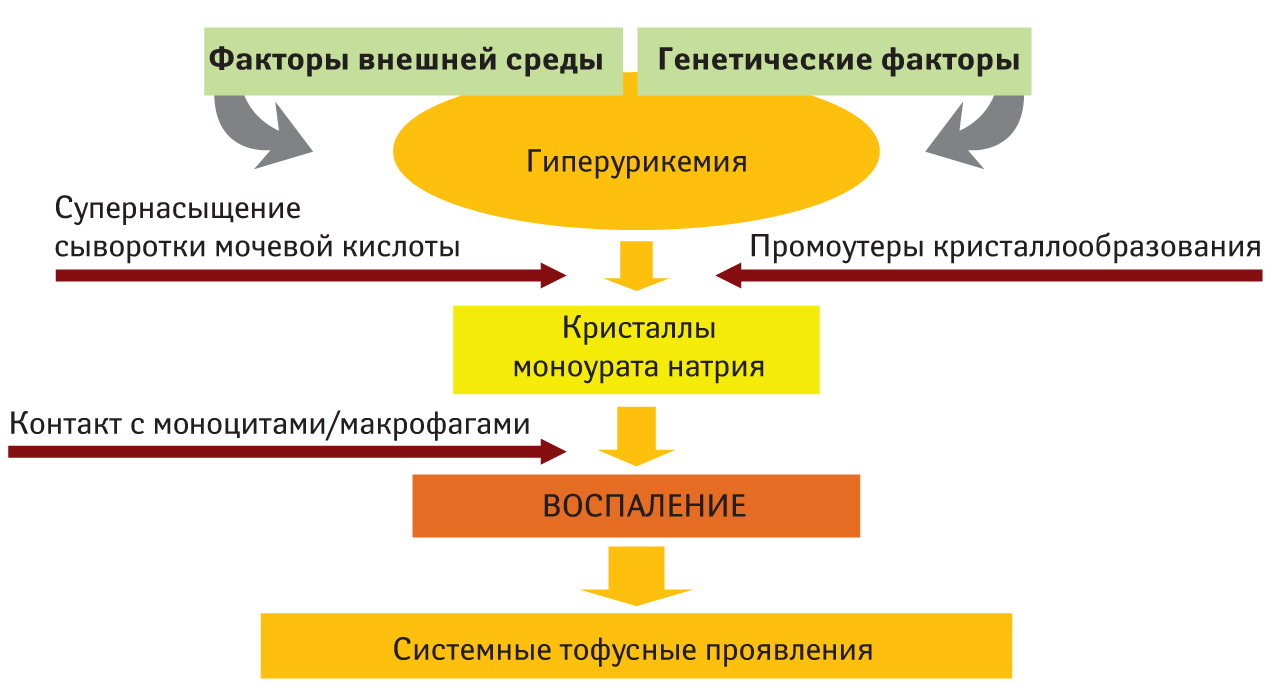
Рис. 3. Современная схема патогенеза подагры (по В.Г. Барсковой, В.А. Насоновой, 2005)
В последнее время в патогенезе подагрического воспаления особое внимание уделяется роли инфламмасомы.
Что такое инфламмасомы?
Это особый внутриклеточный комплекс протеинов, который инициирует развитие воспалительной реакции при контакте клетки с микроорганизмами, кристаллами мочевой кислоты, что приводит к трансформации провоспалительных цитокинов в их активное состояние. На сегодня идентифицированы 4 типа инфламмасом: NLRP1, NLRP2, AIM2, IPAF.
Очень важная роль в развитии подагры принадлежит интерлейкину-1β. Инфламмасомы способствуют превращению неактивной формы медиатора проинтерлейкина-1β в активную форму интерлейкина-1β. Основной компонент инфламмасом — Nod—подобный рецептор (их известно более 23) выступает в качестве датчика при взаимодействии с экзогенными и эндогенными сигналами опасности, что инициирует активацию капсаз и последующее образование зрелой активной формы интерлейкина-1β. Nod—подобный рецептор, содержащий пуриновый домен — криопирин, NLRP3, имеет наибольшее значение в патогенезе подагры. Криопириновый тип инфламмасом отвечает за воспаление, возникающее при контакте клеток с кристаллами мочевой кислоты, что и характерно для подагры (рис. 4).
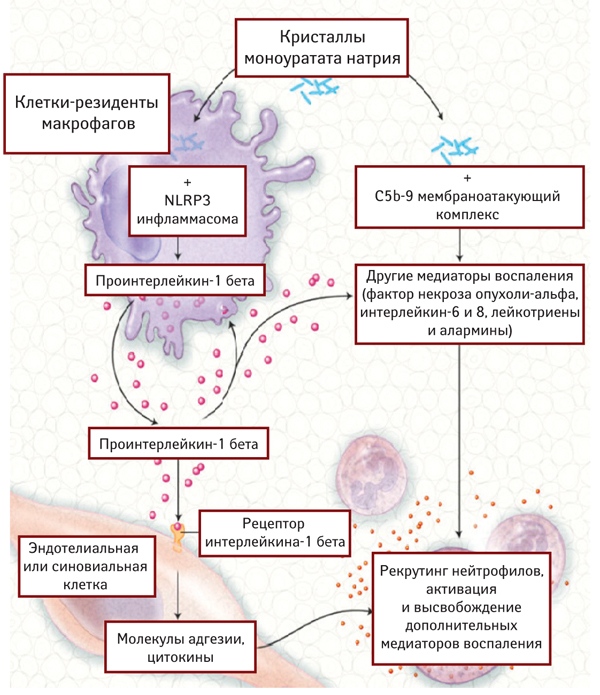
Рис. 4. Механизмы воспаления при подагре. При острой подагре кристаллы моноуратов натрия после фагоцитоза активируют NLRP3 инфламмасому, ведущую к секреции интерлейкина-1β. В свою очередь, эта секреция может индуцировать дальнейшую продукцию интерлейкина-1β и других воспалительных медиаторов, а также дальнейшую активацию синовиальных клеток и фагоцитов. Кристаллы моноурата натрия также индуцируют и многие другие воспалительные цитокины (например фактор некроза опухоли-альфа, интерлейкин-6 и 8, лейкотриены и алармины) через механизмы, зависящие и не зависящие от интерлейкина-1. Экспериментальная модель подагры показала, что активация терминальной части комплементарного пути (С5b-9 мембраноатакующий комплекс) индуцируется кристаллами моноурата натрия. Связь между интерлейкином-1β и рецептором интерлейкина-1β ведет к усиленной экспрессии молекул адгезии и хемокинов, которые вместе с другими воспалительными событиями вызывают рекрутинг нейтрофилов — главный механизм интенсивного воспаления при подагре.
Адаптировано по Tuhina Neogi, 2011 (www.nejm.org/doi/full/10.1056/NEJMcp1001124)
Возникновение и течение подагрического артрита четко коррелирует с уровнем провоспалительных цитокинов в ранние утренние часы.
Каковы структурные изменения в тканях и органах при подагре?
Отложение кристаллов моноурата натрия происходит в хрящах, сухожилиях, синовиальной жидкости и подкожной ткани. Наиболее ранние артикулярные изменения являются результатом депозиции кристаллов моноурата натрия. Ведущим в этом процессе предрасполагающим фактором является аваскулярность соединительной ткани, особенно хрящей.
Подагрические узелки — тофусы могут быть интер-, пери- и экстраартикулярными. Они представляют собой гранулемы, состоящие из моно- и мультинуклеарных макрофагов, окружающих депозиты кристаллов моноурата натрия. В тофусах представлено несколько зон, включающих центральную, состоящую из кристаллов моноурата натрия, окруженных клеточной венечной зоной, в которой выявляется большое количество макрофагов и плазматических клеток. Эта венечная зона разделяет центральный отдел депозитов кристаллов моноурата натрия и окружающую фиброваскулярную зону.
Гранулематозный процесс в костях и суставах ведет к развитию эрозий, костной редукции и подагрического артрита. Депозиция кристаллов моноурата натрия часто ассоциируется с сопутствующим остеоартрозом.
В каких случаях уровень мочевой кислоты может повышаться быстро?
Повышенный распад аденозинтрифосфата как следствие значительной физической нагрузки или эпилептического припадка может приводить к повышению содержания мочевой кислоты. В случае накопления аденозинтрифосфата, при деградации аденозинтрифосфата и последующем его превращении в аденозинмонофосфат также возможно быстрое образование мочевой кислоты. Подобное происходит под влиянием напитков, содержащих этиловый спирт. Более того, при ослабленном выделении мочевой кислоты почками и метаболическом ацидозе возникает значительная гиперурикемия.
Что означает бессимптомная гиперурикемия?
Гиперурикемия может быть случайно выявлена у практически здоровых людей, то есть протекать бессимптомно. Термином «бессимптомная», или «асимптоматическая гиперурикемия», обозначают повышенный уровень мочевой кислоты в крови (≥7 мг/дл), который, однако, не сопровождается симптомами организации кристаллов мочевой кислоты в том или ином органе, то есть не проявляется каких-либо клинических признаков подагры. В дальнейшем возможно формирование различных клинических синдромов, связанных с нарушением метаболизма мочевой кислоты и тогда используют термин «синдром гиперурикемии». Считается, что это признак начальной стадии классической первичной подагры, который выявляют раньше приступа острого артрита или тофусов, но прямой зависимости между гиперурикемией и риском развития подагры не существует.
Синдром гиперурикемии может рассматриваться и как признак уже существующего поражения почек, а именно хронического уратного тубулоинтерстициального нефрита.
Актуальность интереса к метаболизму мочевой кислоты в организме человека связана и с пониманием роли бессимптомной гиперурикемии как мощного, независимого и модифицируемого фактора риска возникновения сердечно-сосудистых заболеваний и смертности, основанное на данных многочисленных эпидемиологических и проспективных исследований (NHANES, Framingham Heart Study, MONICA/KORA Cohort Study, The Worksite Treatment Program, PIUMA, SHEP, LIFE и др.).
Бессимптомную гиперурикемию выявляют почти у 30% больных сахарным диабетом 2-го типа. Однако только у 5–20% этих пациентов (на протяжении 5 лет) развивается подагра. Гиперурикемия является независимым фактором риска, предиктором:
- субклинического коронарного, каротидного атеросклероза;
- сердечно-сосудистой смертности (при артериальной гипертензии, ишемической болезни сердца, хронической сердечной недостаточности);
- сахарного диабета;
- артериальной гипертензии (риск повышен в 2–3 раза через 5–7 лет);
- нефролитиаза;
- повреждения почек (риск повышен в 5 раз через 2 года);
- прогрессирования нефропатии.
При каких патологических состояниях чаще всего развиваются гиперурикемия и подагра?
Чаще всего гиперурикемия и подагра развиваются при (табл. 4):
- ожирении;
- АГ;
- гиперлипидемии;
- атеросклерозе;
- злоупотреблении алкоголем, особенно пивом.
Таблица 4
Патологические состояния, при которых уровень мочевой кислоты в сыворотке крови повышен, и механизмы развития гиперурикемии (по В.И. Панькову, 2007)
|
Патология |
Механизмы развития гиперурикемии |
|
Артериальная гипертензия |
Реабсорбция мочевой кислоты в канальцах почек увеличивается за счет повышения тонуса почечных сосудов; ишемия тканей вследствие спазма сосудов микроциркуляторного русла приводит к увеличению образования мочевой кислоты в результате повышенного распада аденозина; снижение секреции мочевой кислоты в проксимальних канальцах почек в связи с конкурентным повышением экскреции лактата; причинами гиперурикемии и вторичной артериальной гипертензии могут быть алкоголизм и хроническая интоксикация свинцом |
|
Ожирение/инсулинорезистентность |
Инсулин стимулирует реабсорбцию натрия в канальцах почек, которая тесно связана с реабсорбцией мочевой кислоты, поэтому гиперинсулинемия при инсулинорезистентности вызывает гиперурикемию |
|
Хроническая почечная недостаточность |
Снижение скорости клубочковой фильтрации |
|
Сердечная недостаточность |
Повышение активности ксантиноксидазы, снижение почечного кровотока |
|
Прием петлевых диуретиков |
Гемоконцентрация; уменьшение объема циркулирующей крови приводит к повышению реабсорбции уратов в почечных канальцах |
|
Прием тиазидовых диуретиков |
Уменьшение почечного клиренса мочевой кислоты |
|
Постменопауза |
Снижение уровня эстрогенов, которые в норме обладают урикозурическим действием |
|
Алкоголизм |
Увеличение деградации пуринов вследствие повышения активности ксантиноксидазы из-за высокого содержания молибдена, который является ее кофактором; снижение экскреции мочевой кислоты вследствие повышения уровня лактата |
|
Гипертриглицеридемия |
Селективная инсулинорезистентность, снижение инсулинопосредованного усвоения глюкозы и свободных жирных кислот в клетках почечных канальцев в случае сохранения инсулинопосредованной реабсорбции мочевой кислоты |
|
Преэклампсия |
Повышенный распад аденозинтрифосфата при ишемии тканей |
Как поражается сердце при подагре?
Поражение сердца при подагре является, к сожалению, проблемой, недостаточно изученной. Основными изменениями сердца при подагре считаются:
- формирование клапанных пороков;
- прогрессирование миокардиосклероза с развитием хронической сердечной недостаточности;
- прогрессирующее течение ишемической болезни сердца и атеросклеротического поражения коронарных артерий;
- формирование гипертрофии левого желудочка, изменения диастолических характеристик миокарда.
- Каковы патофизиологические механизмы формирования пороков сердца при подагре?
Кристаллизация мочевой кислоты и ее фиксация в миокарде и на клапанных структурах может приводить к формированию подагрических пороков сердца. Считают, что эти процессы обусловлены взаимодействием фосфолипидов клеточных мембран с уратами, следствием чего является некроз клеток и кристалл-индуцированное асептическое воспаление (вальвулит) с формированием заместительного склероза пораженных структур (створчатых пороков, развития дисфункции хордального аппарата, очагового или диффузного миокардиосклероза, надрывов папиллярных мышц). Чаще всего поражаются митральный и аортальный клапаны, при этом чаще формируется створчатая недостаточность, реже — комбинированные пороки сердца. Считают, что в развитии подагрических пороков сердца могут принимать участие несколько механизмов:
- кристаллы моноурата натрия могут вызывать цитолиз при взаимодействии мочевой кислоты с фосфолипидами клеточных мембран;
- соли мочевой кислоты активируют синтез цитокинов с дальнейшей активацией протеаз и комплемента, супероксидных анионов, увеличением продукции интерлейкина-1, которые принимают участие в реакциях воспаления;
- активация и высвобождение клеточных энзимов могут иметь самостоятельное повреждающее действие на структуры клапанов.
- Чем характеризуются структурные изменения сердца при подагре?
При патоморфологическом исследовании сердца наряду со структурными изменениями клапанов выявляются мелкокапельные белесоватые утолщения размерами от 2 до 15 мм, которые содержат кристаллы моноурата натрия (вальвулит), которые можно увидеть при светооптической микроскопии. Отложения уратов у лиц с гиперурикемией выявляют чаще в зоне эндокарда, перикарда, коронарных артерий, реже — в створках митрального клапана.
Является ли гиперурикемия фактором сердечно-сосудистого риска?
По данным доказательной медицины, гиперурикемия является модифицированным фактором сердечно-сосудистого риска:
- доказана связь гиперурикемии с общей и сердечно-сосудистой смертностью как у мужчин, так и женщин (исследования MONICA, NHANES, HPF Study, ARIC), в том числе она является независимой детерминантой этих событий у больных с тяжелым атеросклеротическим поражением коронарных артерий (J-CAD Study);
- у лиц с ишемической болезнью сердца содержание мочевой кислоты 303 мкмоль/л соответствует уровню смертности 3,4%, а 433 мкмоль/л — 17,1% (American Journal of Cardiology, 2002);
- у пациентов с инфарктом миокарда гиперурикемия ассоциируется с более высоким уровнем смертности (Japanese Acute Coronary Syndrome Study);
- систематизированный обзор с метаанализом 16 исследований, охватывающий 238 449 больных, продемонстрировал, что гиперурикемия сопряжена с повышением риска возникновения мозгового инсульта в 1,47 раза и смерти от него — в 1,26 раза;
- у больных артериальной гипертензией с исходным уровнем мочевой кислоты более 396 мкмоль/л риск сердечно-сосудистых событий, фатальных сердечно-сосудистых событий и общей смертности был достоверно выше, чем у пациентов с исходным уровнем мочевой кислоты от 268–309 мкмоль/л. У пациентов с артериальной гипертензией и низким исходным уровнем мочевой кислоты (менее 268 мкмоль/л) также было достоверно большее количество сердечно-сосудистых событий и выше общая смертность (PIUMA Study);
- доказана роль мочевой кислоты как независимого предиктора сердечно-сосудистых событий и смертности у больных артериальной гипертензией и в SHEP Study. Показано, в частности, что применение тиазидных диуретиков в обычных терапевтических дозах приводит у половины больных в течение года к бессимптомному повышению уровня мочевой кислоты, с которым ассоциируется значительное увеличение количества сердечно-сосудистых событий. Следовательно, у таких больных возникает необходимость мониторировать уровень мочевой кислоты и предотвращать его повышение;
- по данным исследования MRFIT, риск развития артериальной гипертензии при устойчивой гиперурикемии (>7 мг/дл) повышается на 80%;
- снижение уровня мочевой кислоты при терапии лозартаном оказывает влияние на риск сердечно-сосудистой заболеваемости и смертности у больных артериальной гипертензией (LIFE Study).
Итоговый анализ многочисленных научных данных свидетельствует о более сильной независимой взаимосвязи уровня мочевой кислоты в сыворотке крови с сердечно-сосудистыми заболеваниями у женщин по сравнению с мужчинами, у представителей негроидной расы по сравнению с европеоидной, а также у больных артериальной гипертензией, застойной сердечной недостаточностью по сравнению с общей популяцией.
Сегодня мы имеем научное подтверждение взаимосвязи гиперурикемии с эндотелиальной дисфункцией, оксидативным стрессом, нарушениями реологии крови, повышением адгезии и агрегации тромбоцитов. Обоснованно и мнение о мочевой кислоте как маркере поражения почек. Получены данные о том, что повышение уровня мочевой кислоты, которое сопровождает развитие инсульта, является независимым предиктором риска смерти, необходимости посторонней помощи и последующих сосудистых осложнений. Доказано, что мочевая кислота — один из сильнейших предикторов не только выживаемости больных, но и частоты их госпитализации.
Таким образом, гиперурикемия — сильный, независимый и, главное, модифицируемый предиктор сердечно-сосудистой и общей смертности у больных с высоким и очень высоким сердечно-сосудистым риском (артериальная гипертензия, ишемическая болезнь сердца, цереброваскулярные заболевания, хроническая сердечная недостаточность, метаболический синдром/сахарный диабет). Роль бессимптомной гиперурикемии как независимого предиктора сердечно-сосудистых заболеваний и смертности у больных с высоким общим риском сердечно-сосудистых событий не вызывает сомнений, а также необходима разработка методов коррекции и доказывание их эффективности в рандомизированных проспективных исследованиях.
Патофизиологические механизмы воздействия мочевой кислоты при сердечно-сосудистых заболеваниях пока достаточно точно не установлены.
Каким образом взаимосвязаны гиперурикемия и сердечно-сосудистый континуум?
Обзор современных источников литературы позволяет считать гиперурикемию важным фактором патогенеза основных этапов сердечно-сосудистого континуума — оксидативного стресса, эндотелиальной дисфункции, воспаления, клубочковой и артериальной гипертензии, сердечной недостаточности, образования атеросклеротических бляшек. В последних рекомендациях Европейского общества кардиологов по артериальной гипертензии (ESC, 2018) гиперурикемия уже учтена для стратификации сердечно-сосудистого риска.
Сосудистый эндотелий — мишень мочевой кислоты?!
Свидетельства о преждевременном и быстром развитии атеросклероза у больных подагрой побуждает изучать влияние гиперурикемии на ранние его этапы — оксидативный стресс и эндотелиальную дисфункцию. Оксидативный стресс, как известно, — одно из важнейших начальных звеньев сердечно-сосудистого континуума, и его предотвращение или преодоление снижает риск развития атеросклероза. Антиоксидантные свойства мочевой кислоты и ее солей состоят в способности инактивировать супероксиданион, гидроксидные радикалы и синглетный кислород, предотвращать деградацию внеклеточной супероксиддисмутазы. Эти данные позволяют рассматривать гиперурикемию, с одной стороны, как один из компенсаторных механизмов атерогенеза. Однако, с другой стороны, было показано, что при снижении содержания в крови других антиоксидантов мочевая кислота и ураты обладают прооксидантными/провоспалительными свойствами: накопление их активирует специфический фермент — митогенактивированную протеинкиназу. За этим следует индукция ядерного фактора NF-kB и циклооксигеназы-2, что сопровождается локальной гиперпродукцией тромбоксана А2, тромбоцитарного фактора роста, а также моноцитарного хемоаттрактантного протеина-1.
Усиленная продукция моноцитами, макрофагами, нейтрофилами, синовиоцитами и остеобластами фактора некроза опухоли-альфа и интерлейкинов-1β, -6 и -8 отмечается не только при тканевом (суставном) подагрическом воспалении, но и при бессимптомной гиперурикемии. Такой цитокиновый дисбаланс, как известно, обусловливает и нарушение эндотелиальной функции, и нестабильности уже имеющихся атеросклеротических бляшек. Было также показано, что при отсутствии коморбидных состояний гиперурикемия ослабляет активность NO-синтетазы и, соответственно, способность сосудов к вазодилатации.
Кроме того, повышение сывороточной концентрации мочевой кислоты стимулирует пролиферацию гладкомышечных клеток сосудов. Была показана опосредованность этого эффекта гиперурикемии действием на PGF, а также стимулирующее влияние мочевой кислоты на продукцию моноцитарного хемоаттрактантного протеина-1 гладкомышечными клетками сосудистой стенки, опосредованное влиянием на митогенактивированную протеинкиназу и циклооксигеназу-2.
Принципиальной является роль ключевого фермента пуринового обмена — ксантиноксидазы. Было показано ее участие в синтезе некоторых оксидантов, индуцирующих эндотелиальную дисфункцию, получены данные о преодолении окислительного стресса и улучшении эндотелиальной функции на фоне применения блокатора ксантиоксидазы аллопуринола — как у пациентов с хронической сердечной недостаточностью, так и у больных сахарным диабетом 2-го типа и артериальной гипертензией легкой степени. В ряде работ было даже показано, что применение аллопуринола способствует снижению риска сердечно-сосудистых осложнений — при идиопатической дилатационной кардиомиопатии и при аортокоронарном шунтировании. Однако доказательная база на сегодня не является достаточной для того, чтобы в международных клинических рекомендациях оговаривалось применение аллопуринола для первичной или вторичной профилактики сердечно-сосудистых заболеваний.
Каковы внешнесредовые факторы риска гиперурикемии?
Алиментарные факторы риска развития гиперурикемии связаны с увеличением в рационе доли продуктов с большим содержанием пуринов, консервантов и алкоголя. Однако не только: по данным National Collaborating Centre for Primary Care (2006), ожирение (индекс массы тела ≥30) у взрослых повышает риск развития гиперурикемии в 2–3 раза.
Традиционный спутник абдоминального ожирения — инсулинорезистентность тканей — сопровождается гиперинсулинемией, под влиянием которой снижается реабсорбция мочевой кислоты в проксимальных канальцах почек и возможно развитие гиперурикемии. Инсулинорезистентность в настоящее время рассматривается как патогенетическое ядро метаболического синдрома — эпидемии XXI века, а мочевая кислота — ее признанный высокоинформативный маркер.
Что такое метаболический синдром?
В 1981 г. M. Hanefeld и W. Leoonardt предложили обозначить случаи сочетания различных метаболических нарушений термином «метаболический синдром». В 1988 г. профессор G. Reaven в своей Бантинговской лекции на основании собственных наблюдений и обобщения исследований других авторов выдвинул гипотезу, в соответствии с которой резистентность к инсулину, абдоминальное ожирение, артериальная гипертензия, атерогенная дислипидемия и ишемическая болезнь сердца служат проявлением патологического состояния, которое он предложил назвать «синдромом Х». В 1989 г. D. Kaplan ввел термин «смертельный квартет»: сочетание сахарного диабета, ожирения, артериальной гипертензии и ишемической болезни сердца.
Почти полстолетия дискуссии относительно комплекса взаимосвязанных метаболических нарушений стали поводом для последовательного появления таких синдромов-предшественников: метаболический трисиндром, полиметаболический синдром, синдром Х, «смертельный квартет» и др. По данным литературы, термин «метаболический синдром» имеет 7 синонимов и 24 ученых считаются пионерами этой теории.
Однако в сущности понятию «метаболический синдром» исполнилось 30 лет, а его появление и развитие концепции большей частью обязаны работам американского ученого G. Reaven. С позиции современных представлений метаболический синдром — это комплекс взаимосвязанных нарушений пуринового, углеводного и липидного обмена, в основе развития которых лежит снижение чувствительности тканей к инсулину, инсулинорезистентность (рис. 5).
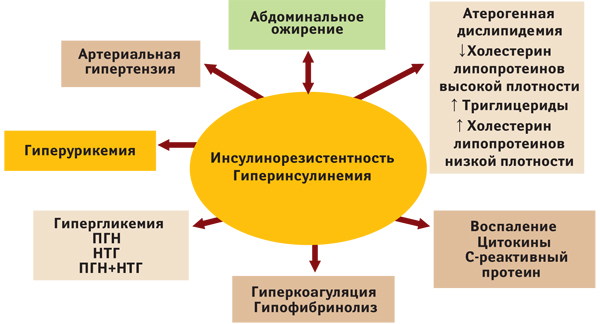
Рис. 5. Современные представления о метаболическом синдроме (Международная федерация диабета, 2005)
НТГ — нарушенная толерантность к глюкозе; ПГН — простагландины Н (повышенные показатели глюкозы натощак).
Эпидемиологические данные свидетельствуют о достаточно высокой распространенности метаболического синдрома, которая в среднем составляет около 24% и превышает 40% в возрастной группе старше 60 лет. Главными составляющими проявлений метаболического синдрома считают: абдоминальный тип ожирения, артериальную гипертензию, гипер- и дислипидемию, нарушение толерантности к глюкозе или сахарный диабет, гиперурикемию.
Сегодня доказано повышение частоты развития метаболического синдрома во всем мире. Исследование с участием 8814 мужчин и женщин при проведении третьего Обзора национального здоровья и питания (National Health and Nutrition Examination Survey) показало необычайно высокую частоту возникновения метаболического синдрома, повышающуюся с возрастом: от 6,7% — среди 20–29-летних до 43,5% — среди 60–69-летних.
По определению Национальной образовательной программы по холестерину Соединенных Штатов Америки (US National Cholesterol Education Program, Adult Treatment Panel) метаболический синдром устанавливают на основании соответствия пациента по меньшей мере 3 из 5 критериев (табл. 5): абдоминальное ожирение (окружность талии >102 см у мужчин и >88 см у женщин); повышенный уровень триглицеридов в крови (≥150 мг/дл); сниженный уровень холестерина липопротеинов высокой плотности в крови (<40 мг/дл у мужчин и <50 мг/дл у женщин); повышенный уровень АД (систолическое — ≥130 мм рт. ст., диастолическое — ≥85 мм рт. ст.); повышенный уровень глюкозы в крови натощак (>110 мг/дл).
Так, при ожирении в результате повышенного липолиза из висцеральной клетчатки в кровоток, а затем и в печень поступает огромное количество свободных жирных кислот, в результате чего нарушается процесс их окисления, происходит активация глюконеогенеза и образование избыточного количества глюкозы. На этом фоне в гепатоцитах повышается синтез триглицеридов и их секреция в виде липопротеидов очень низкой плотности. Это приводит к избыточному отложению липидов в тканях и снижению активности ферментов, участвующих в метаболизме глюкозы.
Таблица 5
Диагностика метаболического синдрома по критериям National Cholesterol Education Program и ВОЗ
|
Критерии Adult Treatment Panel III National Cholesterol Education Program |
|
|
Уровень глюкозы в плазме крови (натощак) |
>6,1 ммоль/л или 110мг/дл |
|
Гипертриглицеридемия:
|
>1,7 ммоль/л или 150 мг/дл |
|
Артериальное давление |
>130/85 мм рт. ст. или антигипертензивная терапия |
|
Центральное (абдоминальное, висцеральное) ожирение
|
>102 см |
|
ВОЗ |
|
|
Уровень глюкозы в плазме крови |
>6,1 ммоль/л или 110 мг/дл |
|
+ два следующих критерия |
|
|
Индекс массы тела |
>30 кг/м2 |
|
Соотношение талия/бедро |
>0,9 (абдоминальное ожирение) |
|
Гиперлипидемия:
|
>1,69 ммоль/л |
|
Артериальное давление |
>140/90 мм рт. ст. или антигипертензивная терапия |
|
Экскреция альбумина с мочой или соотношение альбумин/креатинин |
≥20 мкг/мин 30 мкг/кг |
При гипергликемии в эндотелии сосудов активируется фермент протеинкиназа С, повышающий проницаемость сосудов и процессы перекисного окисления, угнетается синтез эндотелием оксида азота, обладающего антиагрегантным и сосудорасширяющим действием, что приводит в конечном итоге к развитию артериальной гипертензии. Кроме того, в результате увеличения поглощения глюкозы в инсулинчувствительных клетках вентромедиальных ядер гипоталамуса повышается центральная активность симпатического отдела вегетативной нервной системы. Это способствует поддержанию как вазоконстрикции, так и гипергликемии за счет снижения капиллярной сети и количества медленно сокращающихся волокон в скелетной мускулатуре, которая является основным потребителем глюкозы. Кроме того, гиперсимпатикотония стимулирует процессы липолиза в жировой ткани, тем самым обусловливая прогрессирование инсулинорезистентности.
Общепризнанным является мнение о том, что критерии National Cholesterol Education Program более удобны для использования в повседневной врачебной практике, в то время как критерии ВОЗ могут быть актуальными при проведении научных исследований.
Кто эти пациенты с метаболическим синдромом?
Ранее считалось, что метаболический синдром — это проблема лиц среднего возраста и преимущественно женщин. Однако проведенные под эгидой Американской диабетической ассоциации исследования свидетельствуют о том, что метаболический синдром демонстрирует устойчивый рост среди подростков и молодежи. По данным ученых из Вашингтонского университета (University of Washington) в период 1994–2000 гг. частота выявляемости метаболического синдрома среди подростков США возросла с 4,2 до 6,4%. Развитие данного синдрома у 32% наблюдаемых из этой возрастной подгруппы было ассоциировано с ожирением.
По данным эпидемиологических исследований, проведенных в России, у около 12% подростков в возрасте 12–17 лет выявляют избыточный вес, из них 2,3% — ожирение, при этом у каждого третьего подростка с ожирением отмечают признаки метаболического синдрома. По данным других источников метаболический синдром диагностируют у половины детей с ожирением подросткового возраста.
Впервые ожирение сравнивали с эпидемией в сообщении ВОЗ 2000 г. Подагра отмечена среди других заболеваний (наряду с коронарными болезнями, инсультом, сахарным диабетом и т.д.), сопровождающихся ожирением.
Почему подагра сегодня ассоциируется с метаболическим синдромом?
В 2002 г. Американской ассоциацией клинических эндокринологов (American Association of Clinical Endocrinologists) было предложено рассматривать гиперурикемию как один из основных критериев метаболического синдрома. Сегодня и эксперты ВОЗ признали ее компонентом метаболического синдрома.
Гипотезу о связи сердечно-сосудистых заболеваний с уровнем мочевой кислоты обсуждали еще в 1886 г. на страницах Британского медицинского журнала (British Medical Journal). В 1923 г. шведский врач E. Kylin впервые описал синдром «гипертензия–гипергликемия–гиперурикемия». В то же время выдающийся советский ученый Г.Ф. Ланг указал на тесную связь артериальной гипертензии с ожирением, нарушением углеводного обмена и подагрой. В дальнейшем известный клиницист Е.М. Тареев в своей монографии «Гипертоническая болезнь» (1948 г.) также обращал внимание на частоту сочетания артериальной гипертензии и метаболических нарушений, к числу которых относил не только ожирение, но и нарушения углеводного, липидного обменов и гиперурикемию. В связи со значительной частотой гиперурикемии при сердечно-сосудистой патологии и сахарном диабете в 1970–1980-е годы ее начали включать в число факторов риска развития этих заболеваний. В 2008 г. было окончательно доказано, что метаболические нарушения влияют на обмен уратов. По мнению экспертов комитета Европейской антиревматической лиги (European League Against Rheumatism), повышение заболеваемости подагрой в последние годы почти вдвое обусловлено ожирением, артериальной гипертензией, сахарным диабетом 2-го типа, гиперлипидемией и не зависит от улучшения диагностики.
Почему уровень мочевой кислоты повышается у пациентов с метаболическим синдромом?
Ранее рассматривали 2 возможных патогенетических варианта, по которым реализуются дефекты обмена мочевой кислоты, в частности, и при метаболическом синдроме. Первый — нарушение биосинтеза пуринов на различных его этапах, приводящее к гиперурикемии, а в дальнейшем — к развитию подагрического артрита и висцеральных изменений. Закономерным было предположение, что в основе развития гиперурикемии при метаболическом синдроме лежит повышение синтеза мочевой кислоты. Как вариант обоснования повышенного синтеза мочевой кислоты при метаболическом синдроме предполагается наличие повышения потребления фруктозы. Фосфорилирование фруктозы в печени приводит к снижению уровня аденозинтрифосфата, что в конечном счете находит отражение в виде повышения синтеза мочевой кислоты. Предполагается, что широко распространенная продажа кукурузного сиропа, содержащего большое количество фруктозы (который является более устойчивым и более дешевым, чем сахар), заметно повысила частоту возникновения признаков метаболического синдрома, отмечаемых в последние годы среди населения США.
Второй патогенетический вариант предполагал первичное повреждающее действие гиперурикемии на почки с развитием уратной нефропатии и, как следствие, нарушение экскреции мочевой кислоты, развитие подагрического артрита и усугубление висцеральных поражений.
Ассоциация гиперурикемии с другими компонентами метаболического синдрома, часто отмечаемая во врачебной практике и подтвержденная многочисленными исследованиями, позволила предположить еще один механизм — инсулинорезистентности как первичной (генетически детерминированной), так и вторичной (возникающей на фоне ожирения). Инсулинорезистентности сейчас отводится все более значительная роль в развитии метаболического синдрома, так как она напрямую вызывает появление других метаболических факторов риска. Полагают, что повышение уровня мочевой кислоты у пациентов с инсулинорезистентностью и гиперинсулинемией обусловлено способностью инсулина замедлять клиренс мочевой кислоты в проксимальных канальцах почек. Этот механизм рассматривается как одно из возможных объяснений развития гиперурикемии и подагры в условиях наличия компонентов метаболического синдрома. Под инсулинорезистентностью следует понимать нарушение биологического действия инсулина, сопровождающееся снижением потребления глюкозы тканями и приводящее к хронической компенсаторной гиперинсулинемии.
Какова взаимосвязь подагры и абдоминального ожирения?
Ожирение ассоциировалось с подагрой за много столетий до открытия мочевой кислоты. Уже тогда была отмечена явная связь заболевания с невоздержанностью в еде и приемом алкоголя (Гален, 131–200 гг. н.э.). Это связано с тем, что мочевая кислота является конечным продуктом метаболиза пуринов.
В 1947 г. J. Vague описал два типа отложения жира (андроидный и гиноидный) и обратил внимание на то, что андроидное ожирение чаще сочетается с сахарным диабетом, ишемической болезнью сердца и подагрой. В клинической практике подагра довольно часто ассоциируется с ожирением (у 78% больных отмечают 10% избыточной массы тела, у 57% — более 30%), а именно с андроидным типом или абдоминальным (висцеральным) ожирением, которое фактически является клиническим проявлением инсулинорезистентности.
Как известно, висцеральная жировая ткань обладает эндокринной и паракринной активностью. Висцеральные адипоциты имеют повышенную чувствительность к липолитическому влиянию катехоламинов и сниженную чувствительность к антилиполитическому действию инсулина. В абдоминальных жировых депо скорость липолиза значительно выше, чем в подкожно-жировой клетчатке. Адипоциты наряду со свободными жирными кислотами продуцируют адипоцитокины — фактор некроза опухоли, тканевый фактор роста бета-1, интерлейкин-6, лептин, резистин, адипонектин, индуцибельную NO-синтазу и пр., которые также влияют на чувствительность тканей к инсулину.
Накопление хронического избытка инсулина в крови рассматривается как основной фактор развития метаболического синдрома. Связь уровня мочевой кислоты с избыточной массой тела, показателями липидного обмена, особенно триглицеридов, отмечается не только у пациентов с подагрой, но и при артериальной гипертензии, сахарном диабете, ишемической болезни сердца. Именно это дает основания рассматривать концепцию относительно гиперурикемии и подагры как компонентов метаболического синдрома.
По данным National Collaborating Center for Primary Care (2006), ожирение у взрослых с индексом массы тела ≥30 повышает риск развития гиперурикемии в 2–3 раза.
В чем проблема инсулинорезистентности?
Учение об инсулинорезистентности является достоянием XX в. Под инсулинорезистентностью следует понимать нарушение биологического действия инсулина, сопровождающееся снижением потребления глюкозы тканями и приводящее к хронической компенсаторной гиперинсулинемии. Необходимо отметить, что, по сути, инсулинорезистентность «…первично развивается не только при наличии ожирения или диабета, обладает тканевой специфичностью (главным образом касается скелетных мышц), селективной (по преимуществу определяет стимулированное инсулином потребление глюкозы), специфичной по механизму (касается неокислительного пути трансформации гликогена), не полной, а частичной потерей функции, наблюдается при нормальном или повышенном уровне глюкозы не только у больных с сахарным диабетом» (Зимин Ю.В., 1996).
Сама по себе инсулинорезистентность связана прежде всего с генетически детерминированными особенностями рецепторов клеток. В настоящее время есть данные о том, что основные дефекты, приводящие к развитию инсулинорезистентности, локализованы на пострецепторном уровне (табл. 6). В первую очередь страдают ткани, испытывающие потребность в инсулине: мышечная (в том числе миокард), нервная, печеночная и сама жировая ткань.
Таблица 6
Типы инсулинорезистентности
|
Тип |
Характер нарушений |
|
Пререцепторный |
Синтез инсулина с измененным аминокислотным составом, нарушение превращения проинсулина в инсулин, нарушение процессинга инсулина, подавление распада инсулина, нарушение фазности секреции инсулина бета-клетками поджелудочной железы |
|
Рецепторный |
Синтез рецепторов инсулина с измененной структурой, что может снижать прочность связи гормон–рецептор; снижение тирозинкиназной активности бета-субъединиц рецепторов, что в конечном итоге замедляет поступление глюкозы в клетку; уменьшение количества рецепторов на клеточных мембранах адипоцитов |
|
Пострецепторный |
Нарушение сигнального каскада инсулинового рецептора, повреждение на уровне транспортеров глюкозы, блокада синтеза гликогена, блокада гликолиза, активация печеночного глюконеогенеза, стимуляция гликогенолиза |
Говоря о решающей роли наследственного фактора в возникновении инсулинорезистентности, следует подчеркнуть, что, как и в других случаях, этот генетический фактор реализуется при определенных внешнесредовых воздействиях. Чаще всего это связано с избыточным питанием на фоне низкой физической активности. Ситуация, которая резко стимулирует синтез инсулина β-клетками островков Лангерганса поджелудочной железы. Наряду с инсулинорезистентностью это приводит к компенсаторной гиперурикемии.
Гиперинсулинемия сначала снижает чувствительность инсулиновых рецепторов, а затем блокирует их, вследствие чего поступающие с пищей глюкоза и жиры депонируются в жировой ткани, что еще больше усиливает инсулинорезистентность. Гиперинсулинемия подавляет распад жиров, усиливая тем самым ожирение. Формируется порочный круг.
Что первично: ожирение или инсулинорезистентность?
Хотя и существует тесная взаимосвязь между ожирением и инсулинорезистентностью, до настоящего времени так и нет ответа на вопрос: что из них первично? Одна гипотеза рассматривает как первопричину наследственную предрасположенность к инсулинорезистентности, которая реализуется в условиях низкой физической активности и избыточного питания. В результате формирования компенсаторной гиперинсулинемии блокируются инсулиновые рецепторы, экзогенные углеводы и жиры депонируются жировой тканью, липолитические процессы замедляются и прогрессирует ожирение.
Другая гипотеза выдвигает на передний план абдоминальное ожирение. Адипоциты висцеральной жировой ткани секретируют свободные жирные кислоты, которые препятствуют связыванию инсулина с рецептором и нарушают передачу сигнала от рецептора в клетки, что приводит к развитию инсулинорезистентности и компенсаторной гиперинсулинемии.
Какова взаимосвязь подагры и инсулинорезистентности?
В современных исследованиях было показано существование при подагре различных признаков инсулинорезистентности: нарушение толерантности к глюкозе, гиперлипидемия и ожирение. Обсуждается взаимосвязь инсулинорезистентности с гиперурикемией и подагрой. В исследовании S. Takahashi было показано, что у пациентов с подагрой отмечаются признаки инсулинорезистентности, которые становятся более выраженными при сочетании с висцеральным ожирением, внося свою лепту в развитие атеросклероза у таких больных.
Анализ уровня мочевой кислоты в ряде исследований показал наличие прямой корреляции уровня гиперурикемии с инсулинорезистентностью. Более того, больные с выявленной инсулинорезистентностью демонстрировали тенденцию к затяжному течению артрита. Таким образом, развитие инсулинорезистентности имеет большое значение для больных подагрой, заключающееся не только в простом увеличении факторов риска, приводящих к сердечно-сосудистым заболеваниям. Можно с большой вероятностью говорить о влиянии гиперинсулинемии и инсулинорезистентности на течение болезни, характеризующееся заведомо высокой гиперурикемией, тенденцией к хроническому течению суставного синдрома. Можно предположить, что прогноз у больных подагрой с инсулинорезистентностью является менее благоприятным как в отношении развития сердечно-сосудистых событий и сахарного диабета 2-го типа, так и в отношении течения собственно подагры.
Как опосредуется влияние гиперинсулинемии на мочевую кислоту?
Выявлено снижение экскреции уратов при эугликемической гиперинсулинемии за счет усиления реабсорбции не только натрия, хлоридов и гидрокарбонатов, но и органических анионов, к которым относятся и ураты. Этот механизм, по-видимому, и является главным патогенетическим моментом в формировании как хронической неконтролируемой подагры, так и артериальной гипертензии. Возникает вопрос: а так ли важен этот механизм для больных подагрой?
Справедливо можно заметить, что значимость это приобретает лишь при значимой частоте выявления гиперинсулинемии у больных подагрой. Несмотря на то что таких исследований немного, тем не менее частота установления гиперинсулинемии и инсулинорезистентности при подагре достигает 95 и 76% соответственно.
Каким образом гиперурикемия и артериальная гипертензия взаимосвязаны?
Роль избытка мочевой кислоты в развитии артериальной гипертензии и поражении почек была признана еще в конце ХIХ в. Впервые связь между артериальной гипертензией и мочевой кислотой предположили у пациентов с подагрой еще в 1870-х годах. В 1897 г. N.S. Davis в своем приветственном слове президента к членам Американской медицинской ассоциации (American Medical Association) писал: «Высокое артериальное давление при подагре, по крайней мере, частично обусловлено токсическим действием мочевой кислоты, возможно, и других веществ, приводящих к повышению тонуса почечных артериол…».
В 1922 г. выдающийся клиницист, представитель российской терапевтической школы Г.Ф. Ланг указывал на связь артериальной гипертензии с нарушениями углеводного обмена, ожирения и подагры. Он описал портрет современника, больного артериальной гипертензией, актуальный и сегодня: «Считается, что гипертония чаще наблюдается у людей крепких, полнокровных, склонных к ожирению и подагре, отличающихся повышенной психической и нервной возбудимостью, обильно питающихся богатой белками (мясными) пищей и злоупотребляющих алкоголем».
Уже в 1966 г. были опубликованы данные о том, что у 47% пациентов с артериальной гипертензией отмечали гиперурикемию. В последующем многие эпидемиологические исследования показали сильную ассоциацию между уровнем мочевой кислоты и артериальной гипертензией и, в частности, подтвердили риск развития артериальной гипертензией при гиперурикемии.
Недавний систематический обзор и метаанализ 18 исследований показал, что повышение уровня мочевой кислоты на 1 мг/дл ассоциируется с повышенным риском развития артериальной гипертензии на 13%. Эти эффекты были значительно более выражены у женщин и у молодых пациентов. Поэтому уровень мочевой кислоты часто рассматривается как независимый фактор риска развития артериальной гипертензии, с большей вероятностью у молодых людей по сравнению с лицами пожилого возраста. Асимптоматическая гиперурикемия была, кроме того, сильным предиктором резистентности артериальной гипертензии у пожилых людей.
Подагра и артериальная гипертензия как сопутствующая патология связаны теснейшим образом (25–50% случаев), при этом гиперурикемию выявляют у 22–38% больных с артериальной гипертензией, которые не применяют лекарства.
Важным является предположение, что гиперурикемия ассоциируется с почечной сосудистой резистентностью, имеет обратную связь с почечным кровотоком, существенно ухудшает его, угнетает выделение уратов с мочой, приводит к развитию хронического тубулоинтерстициального нефрита и тем самым обусловливает прогрессирование артериальной гипертензии.
Считается, что кристаллы мочевой кислоты, поражая интерстиций и другие структуры почки, вызывают макрофагальную реакцию. Активированные макрофаги экспрессируют молекулы адгезии провоспалительных цитокинов (интерлейкины-1, -2, -4, -6, -8, фактора некроза опухолей-альфа, трансформирующего фактора роста бета-1 и др.), которые, в свою очередь, обусловливают фибробластное перерождение клеток интерстиция почек с потерей их синтетической функции. Это проявляется увеличением реабсорбции Na+ в восходящем отделе петли Генле и ростом чувствительности рецепторов к антидиуретическому гормону. Таким образом происходит задержка натрия и воды, увеличение объема циркулирующей крови, общего периферического сопротивления, активация симпатической нервной системы и, как следствие, развитие артериальной гипертензии.
При гиперурикемии и подагре экскреция альбуминов с мочой, которая характерна для артериальной гипертензии, является предвестником нефросклероза. Таким образом, гиперурикемия обусловливает прогрессирование артериальной гипертензии, которая, в свою очередь, углубляет нарушения почечной гемодинамики.
Большое значение в патогенезе артериальной гипертензии при подагре имеет активация ренин-ангиотензиновой системы. При подагре гиперренинемия отмечается чаще при развитии неконтролируемой артериальной гипертензии, в других случаях ренин либо нормальный, либо сниженный, что гипотетически объясняется уратным повреждением юкстагломерулярного аппарата почки.
В специальном информационном бюллетене Европейского общества по артериальной гипертензии (European Society of Hypertension) в 2018 г. приведены обновленные данные по контролю артериальной гипертензии и особой роли уровня мочевой кислоты в развитии и прогнозе артериальной гипертензии, хронической болезни почек, сердечно-сосудистых событий, указана необходимость, с учетом этого, дальнейших исследований для модификации лечения.
Сегодня доказано, что существует ассоциация между уровнем мочевой кислоты и сердечно-сосудистыми заболеваниями, смертностью, метаболическим синдромом, субклиническим атеросклерозом, инсультом, заболеваниями почек и эндотелиальной дисфункцией.
Все эти данные свидетельствуют о том, что высокие уровни мочевой кислоты могут влиять на патогенез сердечно-сосудистых, почечных и метаболических заболеваний. Тем не менее у взрослых до сих пор нет убедительных доказательств того, что снижение уровней мочевой кислоты улучшает контроль артериального давления или предотвращает артериальную гипертензию. Таким образом, потенциальное положительное влияние стратегий снижения уровня мочевой кислоты на течение артериальной гипертензии еще предстоит изучать и анализировать.
Нужно ли определять уровень мочевой кислоты при артериальной гипертензии?
Известный клиницист Е.М. Тареев еще в 1948 г. писал: «Представление о гипертонике наиболее часто ассоциируется с ожирелым гиперстеником, с возможным нарушением белкового обмена, с засорением крови продуктами неполного метаморфоза — холестерином, мочевой кислотой…».
Такой портрет пациента с артериальной гипертензией не только сохраняет свою актуальность в ХХI в., но и позволяет с точки зрения современных диагностических позиций и возможностей расширить представления о проблеме и обеспечить контроль течения болезни.
В 2003 г. экспертами Европейского общества по артериальной гипертензии определение содержания мочевой кислоты в сыворотке крови было включено в перечень обязательных исследований у больных артериальной гипертензией.Это положение было подтверждено в версиях 2007, 2013, 2018 г. Показатель уровня мочевой кислоты повышается при стратификации пациентов по риску сердечно-сосудистых заболеваний, его повышение >300 мкмоль/л рассматривается как признак поражения почек.
Как связаны гипреурикемия, артериальная гипертензия и нарушения углеводного обмена?
Глюкоза и инсулин являются важнейшими факторами в гомеостазе мочевой кислоты. Дисбаланс этих показателей углеводного обмена приводит к гиперурикемии и гиперурикозурии. Нарушения углеводного обмена, а именно снижение толерантности к глюкозе, определяются при подагре с различной частотой — от 7 до 74% случаев. Связь инсулинорезистентности и гиперурикемии состоит в снижении клиренса мочевой кислоты в проксимальных канальцах почек под воздействием гиперинсулинемии.
Гиперинсулинемия способна также повышать активность симпатической нервной системы, что служит причиной повышения уровня мочевой кислоты в сыворотке крови. Хроническая гиперинсулинемия или инсулинорезистентность отмечают у пациентов с подагрой в почти 95% случаев и более 75%, соответственно, обусловливают развитие артериальной гипертензии.
Вследствие прямого воздействия инсулина на почки происходит также задержка натрия и воды. Кроме того, стимулируется пролиферация гладких мышечных клеток сосудистой стенки, что приводит к ремоделированию артериол, повышению сосудистого сопротивления и дополнительной активации симпатической нервной системы. Недавно подтвердилась и мысль о том, что гиперурикемия может быть показателем инсулинорезистентности именно у пациентов с артериальной гипертензией, подтверждая тесную взаимосвязь этих компонентов метаболического синдрома с повышением сердечно-сосудистой заболеваемости.
Как связаны гиперурикемия, метаболический синдром и сахарный диабет?
Большое эпидемиологическое исследование, проведенное при участии взрослых мужчин в Японии, продемонстрировало, что повышение концентрации мочевой кислоты в сыворотке крови является фактором риска развития сахарного диабета 2-го типа, однако существуют противоречивые представления об ассоциациях между этими двумя патологическими состояниями.
В связи с этим представляют интерес результаты исследования ученых из Эфиопии, опубликованные в журнале «BMC Endocrine Disorders» в 2017 г. Было проведено одноцентровое перекрестное исследование, основная цель которого заключалась в определении распространенности гиперурикемии и метаболического синдрома у пациентов с сахарным диабетом 2-го типа и изучении ассоциаций между этими состояниями. В исследовании приняли участие 319 пациентов с сахарным диабетом 2-го типа (n=211, 67% — мужчины, средний возраст — 49,8±9,8 года). Исследователи проанализировали распространенность гиперурикемии и метаболического синдрома у лиц с сахарным диабетом 2-го типа и выявили, что у 33,8% участников отмечены повышенные уровни мочевой кислоты в сыворотке крови, а распространенность метаболического синдрома у субъектов исследования составила 70,1%.
Повышенная концентрация мочевой кислоты в сыворотке крови оказалась более распространенной среди испытуемых мужской когорты по сравнению с женщинами (22,3% против 11,5% соответственно), эта патология также была чаще распространена среди лиц в возрасте старше 45 лет, чем у более молодых участников исследования (24,2% против 9,6% соответственно). Распространенность гиперурикемии оказалась выше среди лиц, не имеющих родственников с сахарным диабетом, по сравнению с участниками с положительным семейным анамнезом в отношении данного заболевания (25,2% против 8,6% соответственно).
Анализ результатов показал положительную корреляцию между повышенными уровнями мочевой кислоты в сыворотке крови испытуемых и всеми компонентами метаболического синдрома за исключением холестерина липопротеинов высокой плотности. Согласно этому статистическому анализу, пациенты с сахарным диабетом 2-го типа в возрасте 45 и более лет примерно в 1,9 раза более подвержены риску развития гиперурикемии по сравнению с лицами в возрасте моложе 45 лет. У пациентов с сахарным диабетом 2-го типа и метаболическим синдромом в 2,6 раза более высокий риск развития гиперурикемии по сравнению с лицами без метаболического синдрома.
Выяснено, что лица, употреблявшие алкоголь в течение периода наблюдения, оказались в 1,6 раза более подверженными риску развития гиперурикемии по сравнению с непьющими участниками, аналогично курильщики — в 1,1 раза, а лица, не занимающиеся регулярно физическими упражнениями — в 1,5 раза соответственно.
В заключение исследователи пришли к выводу, что среди пациентов с сахарным диабетом 2-го типа широко распространены гиперурикемия и метаболический синдром. Как метаболический синдром, так и возраст старше 45 лет идентифицированы как независимые предикторные переменные высокой распространенности гиперурикемии у пациентов с сахарным диабетом 2-го типа. При этом гипертриглицеридемия, гипергликемия и сниженный уровень холестерина липопротеинов высокой плотности продемонстрировали положительную корреляцию с высокой распространенностью гиперурикемии у пациентов с сахарным диабетом 2-го типа.
Исходя из этого, акцентировано, что регулярное медицинское информирование о важности ранней модификации образа жизни, своевременная диагностика и лечение пациентов с гиперурикемией и метаболическим синдромом необходимы для снижения распространенности этих нарушений у пациентов с сахарным диабетом 2-го типа.
Влияет ли гиперурикемия на развитие атеросклероза?
Сегодня известно, что нарушения липидного обмена (гиперхолестеринемия, гипертриглицеридемия) выявляют почти у 75% больных подагрой. При первичном нарушении липидного обмена гиперурикемию устанавливают в 40–70% случаев и, наоборот, гипертриглицеридемию выявляют у 84% пациентов с гиперурикемией. Причем было показано, что высокий уровень триглицеридов отмечается при подагре у пациентов с ожирением и интенсивно употребляющих алкоголь, но не у больных с нормальными показателями массы тела.
При подагре без поражения почек гиперлипидемию IIб и IV, реже IIа типов по Фредриксону отмечают у 40–100% больных.
В настоящее время считается, что по крайней мере 2 фактора привносят значительный вклад в ассоциацию гипер-, дислипидемии и гиперурикемии: факторы окружающей среды (питание, ожирение) и генетический фактор. Среди генетических факторов 2 гена аполипопротеина наиболее часто отмечают у больных первичной подагрой и гипертриглицеридемией (апопротеин СIII ген S2 аллель и аполипопротеин Е фенотип aпo e4 аллель).
Во-первых, гиперурикемия усиливает окисление липопротеидов низкой плотности и обусловливает перекисное окисление липидов. Повышение содержания мочевой кислоты сопровождается повышением содержания свободных радикалов. Оксидантный стресс и окисление липидов в стенке артерий играют определенную роль в формировании атеросклеротических бляшек. В условиях гиперурикемии усиливается продукция цитокинов, прежде всего фактора некроза опухоли-альфа, интерлейкинов-1β, -6, -8, и не только при тканевом подагрическом воспалении, но и при бессимптомном процессе (рис. 6). Фактор некроза опухоли-альфа является маркером неспецифического воспаления и физиологическим активатором апоптоза. Оксид азота и другие активные формы кислорода, которые накапливаются при гиперурикемии, также являются продуктами апоптоза гладких мышечных клеток и других составляющих атеросклеротической бляшки.
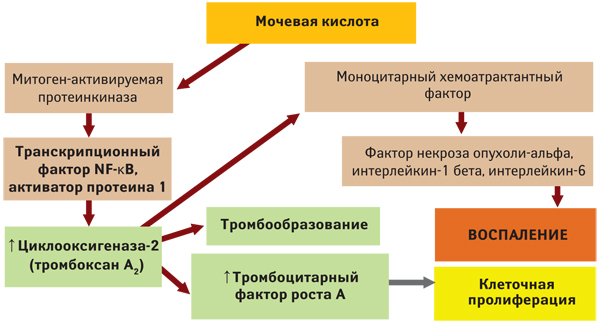
Рис. 6. Гиперурикемия в патогенезе атеросклероза (по В.З. Нетяженко, 2008)
Во-вторых, мочевая кислота принимает участие в процессах адгезии и агрегации тромбоцитов, тем самым повышая риск коронарного тромбоза при ишемической болезни сердца.
В-третьих, показано, что в клетках эндотелия содержится ксантиноксид, который является генератором свободных радикалов. Содержание мочевой кислоты и ксантиноксида в сосудах с атеросклеротическими поражениями значительно выше, чем непораженных. То есть, возможно, гиперурикемия является одним из факторов прогрессирования атеросклероза с использованием механизмов влияния ксантиноксида.
Гипотетически прогрессирующее течение атеросклероза при подагре объясняют эндотелиальной дисфункцией, вызванной или опосредованной гиперурикемией при участии гомоцистеина. К гипергомоцистеинемии при подагре может приводить как гиперренинемия, так и повышение уровня креатинина, что может обусловливать высокий уровень сердечно-сосудистой патологии и смертности от этих причин, особенно в случаях с хронической почечной недостаточностью.
Влияет ли подагра на «сценарий» жизни пациентов?
Среди причин смерти больных подагрой более половины составляют сердечно-сосудистые заболевания, в то время как почечные причины — лишь 1/4. Мочевая кислота — ключевой компонент кардиоренометаболического континуума. В основу концепции этого континуума положено представление о единстве патогенеза, наличии общих факторов риска развития и прогрессирования, а также существенного значения функции почек (от субклинических проявлений до терминальной почечной недостаточности) для течения сердечно-сосудистых заболеваний и причин смертности.
Считается, что поражение сердечно-сосудистой системы развивается приблизительно у 50% больных с хроническим течением подагры в первые 6–10 лет от дебюта заболевания. Распространенность артериальной гипертензии, ишемической болезни сердца, сахарного диабета при подагре, а также риск сердечно-сосудистых событий при соединении этих состояний выше того, что отмечается в популяции. Повышение уровня мочевой кислоты в крови на 1 мг/дл повышает риск сердечно-сосудистых событий на 10%. Именно на фоне этих данных гиперурикемия рассматривается сегодня как маркер сердечно-сосудистого риска, а в сценарии сердечно-сосудистого континуума на этапе развития сердечной недостаточности — и как фактор неблагоприятного прогноза.
Какая связь между гиперурикемией и хронической сердечной недостаточностью?
Оказалось, что у больных, госпитализируемых по поводу декомпенсации хронической сердечной недостаточности, частота развития гиперурикемии возрастает и выявляется в 60% случаев. Гиперурикемия при хронической сердечной недостаточности служит маркером нарушенного оксидативного метаболизма, характеризующегося повышением уровня свободных радикалов, которые повреждают кардиомиоциты и эндотелий сосудов с развитием нарушения сократительной способности миокарда и вазоконстрикции. Нейрогуморальный профиль хронической сердечной недостаточности вносит существенный вклад в метаболизм мочевой кислоты: ангиотензин II повышает реабсорбцию мочевой кислоты в канальцах нефрона и уменьшает ее экскрецию почками; норадреналин уменьшает урикозурию, возможно, за счет гемодинамических изменений в почках при хронической сердечной недостаточности (рис. 7).
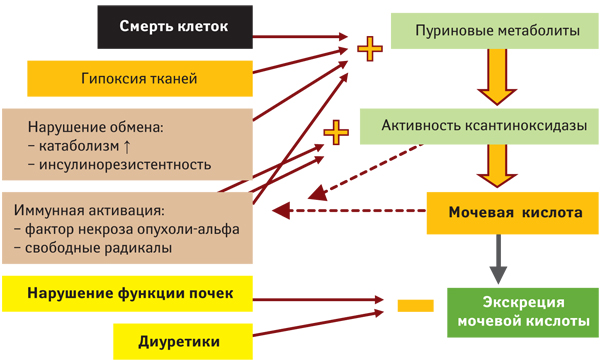
Рис. 7. Вклад гиперпродукции и гипосекреции мочевой кислоты в развитие гиперурикемии при хронической сердечной недостаточности (адаптировано по M.G. Netea et al.,1997)
В возникновении гиперурикемии при хронической сердечной недостаточности большое значение отводится и собственно нарушенной функции почек. Гипонатриевая диета, лечение диуретиками (особенно тиазидными) могут увеличивать реабсорбцию мочевой кислоты в проксимальных канальцах нефрона почки и у больных с хронической сердечной недостаточностью без сопутствующей дисфункции почек. Снижение скорости клубочковой фильтрации как результат систолической дисфункции миокарда также приводит к уменьшению экскреции мочевой кислоты и, несомненно, играет ведущую роль в развитии гиперурикемии при прогрессировании хронической сердечной недостаточности.
Имеются данные о том, что больных с повышенным уровнем мочевой кислоты чаще госпитализируют по поводу декомпенсации хронической сердечной недостаточности (>435 мкмоль/л — на ранних стадиях заболевания и >500 мкмоль/л при среднетяжелом и тяжелом течении). Это характеризует гиперурикемию как маркер неблагоприятного прогноза у этой когорты больных.
Существует, однако, мнение, что мочевая кислота выступает в роли не активного участника, а «свидетеля» патофизиологических процессов, происходящих при хронической сердечной недостаточности. Но факт гиперурикемии при хронической сердечной недостаточности установлен, поэтому необходим и ее контроль в динамике течения патологического процесса.
Существует ли связь подагры и ментального здоровья пациентов?
До настоящего времени у ученых не было единого мнения относительно роли подагры в развитии деменции у лиц пожилого возраста: некоторые исследования указывали на существование связи между подагрой и деменцией, в то время как авторы других исследований утверждали, что наличие подагры приводит к снижению вероятности развития тяжелого нейродегенеративного заболевания. Теперь практически все точки над «i» расставлены благодаря исследованию, которое провели ученые из университета американского штата Алабама в г. Бирмингем (University of Alabama at Birmingham). Результаты этого исследования были представлены участникам Европейского конгресса ревматологов в Амстердаме Европейской лиги против ревматизма 2018 г.
Ученые провели анализ данных о состоянии здоровья 1,23 млн клиентов одной из американских страховых компаний. Результаты этого масштабного исследования убедительно свидетельствуют о заметном повышении вероятности развития деменции у пациентов в возрасте 65 лет и старше с подагрой. Оказалось, что подагра была независимо связана с повышением риска развития деменции на 17% (ОР=1,17; 95% ДИ 1,13–1,21).
Какие заболевания почек развиваются вследствие гиперурикемии?
- Уратная нефропатия. Отложение кристаллов урата натрия в интерстициальной ткани почек приводит к нестойкой, умеренной альбуминурии, но редко является причиной значительного снижения функции почек. Иногда на фоне уратной нефропатии может развиваться артериальная гипертензия.
- Мочекислая нефропатия. Значительная преципитация кристаллов мочевой кислоты в собирательных трубочках почек и мочеточниках приводит к развитию острой почечной недостаточности. Это происходит при резком значительном увеличении содержания мочевой кислоты, например, при синдроме распада опухоли.
- Мочекаменная болезнь с образованием уратных камней (рис. 8). Частота образования камней уратов зависит от уровня гиперурикемии, гиперурикозурии и кислотности мочи. Камни уратов (иногда кораллоподобные) — рентгеннегативные, лучше визуализируются при эхографии. У больных подагрой обычно выявляют камни, содержащие кальций, особенно при значительной урикозурии. Кристаллы мочевой кислоты служат основой для формирования кальциевых камней.
- Семейная уратная нефропатия.
- Отравление свинцом.
- Поликистозное поражение почек (более чем у 30% больных выявляют подагру).
Рис. 8. Подагрический уролитиаз: уратные камни (в том числе коралловидные)
Когда выявляют гиперурикозурию и что это означает?
Гиперурикозурия — специфичный признак при подагре в ряде случаев: у больных молодого возраста, при неконтролируемом сахарном диабете 2-го типа (высокая гипергликемия), синдроме Леша — Нихена, а также при лечении урикозуриками (бензбромароном). Среди других причин гиперурикозурии чаще всего отмечаются миелопролиферативные болезни и химиотерапия, приводящая в ряде случаев к острому уратному кризу при отсутствии надлежащей профилактики.
Почками экскретируется до 70% мочевой кислоты, кишечником — 15–20%, кожа, волосы и ногти берут на себя остаточное количество. При этом мочевая кислота полностью фильтруется клубочками, но 99% реабсорбируется в проксимальных канальцах. Очень большой объем реабсорбции мочевой кислоты генетически детерминирован.
Гиперурикозурия является отражением повышенной продукции мочевой кислоты в организме и отмечается даже чаще, чем гиперурикемия. Повышение экскреции мочевой кислоты с мочой носит компенсаторный характер, но может обусловливать патологические изменения в почках. Именно повышение клиренса мочевой кислоты и высокая гиперурикозурия могут быть причиной образования уратных камней в почках почти у 50% пациентов.
Однако классический фактор уратного нефролитиаза — гиперурикозурия не подходит для объяснения нефролитиаза при подагре. При гипоурикемической гиперурикозурии (дефект транспортера URAT1) подагра не возникает, поскольку для развития подагры нужна гиперурикемия, то есть супернасыщение крови, а не мочи.
Среди других факторов риска также обсуждаются генетические детерминанты нефролитиаза: ZNF365 на хромосоме 10q21-q22 и ген SLC2A9, кодирующий URAT1.
Кроме того, ряд ассоциированных с подагрой состояний связывают с развитием нефролитиаза: ожирение (рН мочи обратно коррелирует с массой тела; независимый фактор нефролитиаза), инсулинорезистентность (снижение аммониогенеза и экскреции аммония, что приводит к снижению рН); сахарный диабет 2-го типа (независимый фактор нефролитиаза); высокопуриновый стереотип питания (транзиторное повышение экскреции мочевой кислоты). Отметим, что при подагре частота указанных сопутствующих болезней стабильно высокая во всех популяциях.
Какие еще органы и системы поражаются при подагре?
- Подагрическая почка — наиболее частый и значимый вариант подагрической висцеропатии. Однако, кроме этого, в период острых приступов подагрического артрита иногда отмечают ряд других состояний.
- Подагрическая гастропатия.
- Гепатопатия и поражение желчевыводящих путей обусловлены образованием подагрических узлов в печени, выявляются чаще, чем случаи в популяции в целом. По данным ультразвукового исследования и компьютерной томографии, у 1/3 больных выявляют очаговые поражения печени в виде кист и округлых образований, как правило, при наличии видимых тофусов. Аналогичным может быть поражение селезенки.
- Поражение глаз. Протекает по типу ирита, иридоциклита, конъюнктивита.
- Приступы мигрени.
- Аллергические проявления. В форме экземы или бронхоспастического синдрома.
- Подагрические флебиты.
- Поражение сердца и сосудов. Описаны случаи тяжелого поражения клапанного аппарата сердца вследствие отложения уратов на створках клапанов. Еще в 1954 г. M. Prinzmetal приводил сведения о нормализации сердечного ритма и купировании явлений перикардита на фоне лечения больных подагрой препаратами, нормализующими уровень мочевой кислоты. Доказана склонность к артериальной гипертензии, коронарной недостаточности, тромбозам, атеросклерозу. Метаболическая форма подагры может быть причиной нарушения микроциркуляции с расширением венул, поражением артериол и капилляров.
- Поражение легких характеризуются плевродиафрагмальными спайками, утолщением междолевой плевры, петрификатами.
- Поражение позвоночника сопровождается образованием тофусов преимущественно в грудном отделе или проявлениями воспалительно-дегенеративных изменений в суставах, дисцитом, воспалением межпозвоночных связок с клинической симптоматикой корешкового синдрома.
- Поражение спинного мозга. На аутопсии нередко выявляют отложение масс кристаллов мочевой кислоты в области спинного мозга.
- Поражение нервной системы. На фоне классической подагрической атаки с помощью рентгенологических и сцинтиграфических методов диагностики установлен случай дистрофии симпатической нервной системы, описывается атипичное внекостное расположение тофусов, выявленное у больных в начале заболевания. Могут развиваться острые формы люмбаго и радикулиты за счет отложения уратов в зоне межпозвонковых суставов, что ведет к локальному воспалению и раздражению нервных корешков.
- Нередко возникают миозиты, тендиниты, тендовагиниты.
- Возможны специфические ангины, бронхиты, хронические колиты, ириты, иридоциклиты.
Часто те или иные висцеральные проявления подагры выявляют еще до развития типичного подагрического артрита.
При каких патологических состояниях еще может проявляться гиперурикемия?
Гиперурикемия может быть следствием таких заболеваний и состояний, как:
- употребление лекарств (терапевтически-индуцированная подагра);
- почечная недостаточность;
- гипотиреоз;
- миело- и лимфопролиферативные заболевания, гемолитическая анемия, истинная полицитемия;
- гиперпаратиреоз, диабетический кетоацидоз, несахарный диабет, синдром Шварца — Бартера или почечный литиаз;
- поликистоз почек, отравление свинцом;
- саркоидоз, псориаз;
- обезвоживание.
Какие лекарства влияют на выделение мочевой кислоты почками и могут приводить к развитию вторичной гиперурикемии или обострению подагры?
Сегодня список лекарственных препаратов, влияющих на обмен мочевой кислоты, расширился (табл. 7).
Лекарственные средства, которые вызывают гиперурикемию, объединены в мнемоническое выражение — CAN’T LEAP (англ. «не могу преодолеть»):
С — циклоспорин А;
А — алкоголь;
N — никотиновая кислота;
Т — тиазиды;
L — лазикс (фуросемид и другие петлевые диуретики);
Е — этамбутол;
А — ацетилсалициловая кислота (низкие дозы);
Р — пиразинамид.
Таблица 7
Лекарственные средства, повышающие содержание мочевой кислоты в сыворотке крови (по Moriwaki Y., 2014)
|
Диуретики (петлевые и тиазидные) |
Филграстим |
|
Блокаторы β-адренорецепторов |
Рибавирин, интерферон |
|
Ацетилсалициловая кислота в низких дозах |
Ритонавир |
|
Пиразинамид, этамбутол |
Дарунавир |
|
Никотиновая кислота, ниацин |
Диданозин |
|
Молочная кислота |
Ритуксимаб |
|
Циклоспорин |
Базиликсимаб |
|
Такролимус |
Терипаратид |
|
Фруктоза, ксилитол, теофиллин |
Силденафил |
|
Леводопа |
Диазоксид |
|
Цитотоксические агенты |
Иммуносупрессор циклоспорин А может обусловливать гиперурикемию, снижая экскрецию уратов почками и таким образом вызывая их дисфункцию. Через несколько лет иммуносупрессивной терапии тяжелая подагра развивается у 10% пациентов. Кроме того, салицилаты (ацетилсалициловая кислота в низких дозах) вызывают нарушение выделения уратов почками.
Противотуберкулезные лекарственные средства (пиразинамид и этамбутол) способны вызывать гиперурикемию и обострение подагры, боль в суставах (как на фоне гиперурикемии, так и без нее). Аналогичным эффектом обладает и диданозин, применяемый при вирусе иммунодефицита человека. Для этих препаратов гиперурикемия является ожидаемым побочным эффектом, вызванным конкуренцией с уратами за пути элиминации.
Гиперурикемия по невыясненным причинам может возникать при применении леводопы, теофиллина. Никотиновая кислота и рибоксин метаболизируются до нуклеотидов и далее — до мочевой кислоты. Поэтому с осторожностью при гиперурикемии и подагре назначают комплексный церебропротекторный препарат, содержащий инозин, мононуклеотид рибофлавина, никотинамид, янтарную кислоту. Сходным метаболизмом обладает противовирусное средство инозин пранобекс.
Рутин при длительном применении может обусловливать образование уратов в почках. Поэтому применение таких препаратов, как у пациентов с нарушениями пуринового обмена, требует осторожности. Нарушение пуринового обмена вызывают также силденафил, статины (кроме аторвастатина) и даже ингибиторы ангиотензинпревращающего фермента.
Какой алкогольный напиток самый опасный?
Что касается подагры, то с давних времен считается, что «ее отец — вино, а мать — пища…». Но наиболее опасным в отношении гиперурикемии считают пиво. В пиве содержится достаточно большое количество гуанозина (пуринового основания), который полностью всасывается в желудочно-кишечном тракте и способен в большей мере, чем сухие вина и ликеры, повышать уровень мочевой кислоты в крови. Считают, что протекторные факторы в винах способны ослаблять влияние этилового спирта на риск развития подагры.
Есть ли объяснения развитию гиперурикемии и даже подагры при чрезмерном употреблении алкоголя?
Чрезмерное употребление алкоголя приводит к повышению содержания молочной кислоты, которая уменьшает выделение уратов почками (рис. 9). Алкоголь увеличивает и образование уратов, повышая распад аденозинтрифосфата.

Рис. 9. Механизмы развития гиперурикемии при алкоголизме (по В.Г. Барсковой и В.А. Насоновой, 2005)
Установлено, что ежедневное употребление 10,0–14,9 г этилового спирта (абсолютная масса) сопровождается повышением риска развития подагры на 32%; при его употреблении в количестве 15,0–29,9 г; 30,0–49,9 г; 50,0 и больше — на 40, 96 и 153% соответственно. Более того, в пиве содержится достаточно большое количество гуанозина — пуринового основания.
Каковы клинические осложнения гиперурикемии?
Основным осложнением гиперурикемии является острая почечная недостаточность как результат острого мочекислого кризиса на фоне утилизации большого количества аденозинтрифосфата и образования гипоксантина, а потом и мочевой кислоты. Первые признаки обычно появляются через 6–12 ч после физической нагрузки: сильная боль в пояснице или животе, тошнота.
Почему подагра часто развивается у больных после трансплантации органов?
Основным фактором риска у таких больных является прием циклоспорина, который уменьшает выделение уратов с мочой.
Что означает гипоурикемия?
Гипоурикемия — это снижение концентрации мочевой кислоты в сыворотке крови до 2 мг% за счет как снижения продукции, так и повышения экскреции мочевой кислоты.
Причины снижения продукции мочевой кислоты:
1. Наследственная ксантинурия — дефицит фермента ксантиноксидазы, аутосомно-рецессивное нарушение с триадой гипоурикемия — мочекаменная болезнь — отложение кристаллов мочевой кислоты в мышцах скелета с развитием миопатии.
2. Дефицит фосфорилазы с задержкой развития, нарушением клеточного иммунитета и лимфопенией, уменьшением содержания Т-лимфоцитов и развитием рецидивных инфекций.
3. Тяжелая печеночно-клеточная недостаточность — потеря функции печеночной ксантиноксидазы.
4. Бесконтрольная терапия аллопуринолом со снижением мочевой кислоты ниже 2,5 мг%.
Причины повышения экскреции мочевой кислоты с мочой:
1. Семейная почечная гипоурикемия — аутосомно-наследственный синдром, который характеризуется нефролитиазом на фоне нарушения канальцевого транспорта урата.
2. Синдром Фанкони — гиперурикозурия, глюкозурия, аминоацидурия, фосфатурия, бикарбонатурия.
3. Новообразования, включая болезнь Ходжкина.
4. Синдром приобретенного иммунодефицита (гипоурикемия — плохой прогностический фактор).
5. Увеличение объема внеклеточной жидкости.
6. Лекарства. Особое значение имеет прием триметоприма/сульфаметоксазола, например, при лечении пневмоцистной пневмонии у больных синдромом приобретенного иммунодефицита, а также высоких доз ацетилсалициловой кислоты, антагонистов рецепторов ангиотензина II.