Ультибро Бризхайлер (Ultibro® Breezhaler®)
Ультибро Бризхайлер инструкция по применению
Состав
Индакатерол - 110 мкг
Гликопирроний - 50 мкг
Фармакологические свойства
фармакодинамика. Механизм действия. Когда индакатерол и гликопирроний применяются вместе, они проявляют аддитивную эффективность, поскольку действуют на разные рецепторы и пути для достижения расслабления малых мышц. Из-за разницы в плотности β2-адренорецепторов и М3-рецепторов в центральных дыхательных путях по сравнению с меньшими дыхательными путями β2-агонисты могут быть более эффективными в расслаблении малых дыхательных путей, тогда как антихолинергическое соединение может быть более эффективно в больших дыхательных путях. Таким образом, для оптимальной бронходилатации во всех участках легких человека комбинация β2-адреноагониста и антагониста мускариновых рецепторов может быть эффективной.
Индакатерол. Индакатерол является агонистом β2-адренорецепторов длительного действия для применения 1 раз в сутки. Фармакологические эффекты β2-адренорецепторов, в том числе индакатерола, по крайней мере частично объясняются стимуляцией внутриклеточной аденилатциклазы — фермента, который катализирует превращение АТФ в циклический 3',5'-аденозинмонофосфат (циклический монофосфат). Повышение уровня цАМФ вызывает расслабление гладких мышц бронхов. Исследования in vitro показали, что индакатерол более чем в 24 раза активнее агониста β2-рецепторов по сравнению с β1-рецепторами и в 20 раз активнее относительно β3-рецепторов. Этот профиль селективности схож с таковым формотерола. При ингаляции индакатерол действует локально в легких как бронхолитик. Индакатерол представляет собой частичный агонист β2-адренорецепторов человека с наномолярной потенцией. В изолированных бронхах человека индакатерол оказывает быстрое начало и большую продолжительность действия. Хотя β2-рецепторы являются преобладающими адренорецепторами в бронхиальных гладких мышцах, а β1-рецепторы являются преобладающими рецепторами в сердце человека, β2-адренорецепторы есть также в сердце человека, которое содержит 10–50% общего количества адренорецепторов. Точные функции β2-адренорецепторов в сердце неизвестны, но их присутствие повышает вероятность того, что даже высокоселективные β2-адренергические агонисты могут проявлять сердечные эффекты.
Гликопирроний. Гликопирроний является ингаляционным антагонистом мускариновых рецепторов (антихолинергическим средством) длительного действия для применения 1 раз в сутки с целью поддерживающей бронхолитической терапии хронического обструктивного заболевания легких (ХОЗЛ). Парасимпатические нервы являются основными бронхоконстриктивными нейронными путями в дыхательных путях, и холинергический тонус является ключевым компонентом обратимой обструкции дыхательных путей при ХОЗЛ. Гликопирроний действует, блокируя бронхоконстриктивное действие ацетилхолина на клетки гладких мышц дыхательных путей, тем самым расширяя дыхательные пути.
Гликопиррония бромид — это антагонист мускариновых рецепторов с высоким сродством. Более чем 4-кратная селективность в отношении М3-рецепторов человека по сравнению с М2-рецепторами человека была продемонстрирована в исследованиях связывания радиолиганда. Он имеет быстрое начало действия, о чем свидетельствуют наблюдаемые кинетические параметры ассоциации/диссоциации рецепторов и начало действия после ингаляции в клинических исследованиях.
Продолжительность действия может быть частично связана с устойчивой концентрацией активного вещества препарата в легких, проявляется в длительном Т½ гликопиррония после ингаляции гликопиррония, в отличие от такового после в/в введения.
Фармакодинамические эффекты
Первичные фармакодинамические эффекты. Комбинация индакатерола и гликопиррония в препарате Ультибро Бризхайлер продемонстрировала быстрое начало действия — в течение 5 мин после приема. Эффект остается устойчивым в течение 24-часового интервала дозирования.
Средний бронхолитический эффект, полученный из последовательных измерений объема форсированного выдоха за одну секунду (ОФВ1) в течение 24 ч, составляет 0,32 л после 26 нед лечения. Эффект был значительно выше у Ультибро Бризхайлера по сравнению с индакатеролом, гликопирронием или тиотропием отдельно (разница 0,11 л для каждого сравнения). Не получено доказательств эффекта тахифилаксии Ультибро Бризхайлера с течением времени по сравнению с плацебо или его компонентами в монотерапии.
Вторичные фармакодинамические эффекты. Системные побочные эффекты ингаляционных β2-адреноагонистов и ингаляционных антагонистов мускариновых рецепторов является результатом активации системных β2-адренорецепторов и блокады мускариновых рецепторов после системной абсорбции активных веществ. Профиль побочных эффектов Ультибро Бризхайлера был исследован у здоровых лиц и у пациентов с ХОЗЛ.
Влияние на ЧСС. Частоту эффектов на сердечные сокращения у здоровых добровольцев исследовали после применения одной дозы Ультибро Бризхайлера 440 мкг/200 мкг, которую вводили в четыре шага с промежутками в 1 ч и сравнивали с эффектами плацебо, индакатерола 600 мкг, гликопиррония 200 мкг и салметерола 200 мкг. Наибольшее повышение ЧСС при применении препарата Ультибро Бризхайлер по сравнению с плацебо составляло +5,69 уд./мин, наибольшее снижение — 2,51 уд./мин. В целом изучение влияния на ЧСС в течение длительного времени не выявило последовательного фармакодинамического эффекта Ультибро Бризхайлера. Хотя не выявлено существенных эффектов, когда Ультибро Бризхайлер сравнивали с индакатеролом и гликопирронием отдельно, ЧСС была несколько выше (наибольшая разница — около 11 уд./мин) после ингаляции 200 мкг салметерола. ЧСС у пациентов с ХОЗЛ в сверхтерапевтических дозах исследована при применении Ультибро Бризхайлера в дозах 150; 300 и 600 мкг/100 мкг. Не выявлено существенных эффектов Ультибро Бризхайлера на среднюю ЧСС в течение 24 ч и ЧСС, которая оценивалась через 30 мин, 4 и 24 ч.
Интервал Q–T. Компоненты препарата Ультибро Бризхайлер, как известно, не оказывают влияния на удлинение интервала Q–T при применении в клинических дозах. Исследование TQT с участием здоровых добровольцев, получавших дозы ингаляционного индакатерола до 600 мкг, не показало клинически значимого влияния на интервал Q–T. Аналогично в исследовании TQT не выявлено удлинения Q–T после ингаляции доз 400 мкг гликопиррония. Эффекты Ультибро Бризхайлера относительно интервала Q–Tc исследованы у здоровых добровольцев после ингаляции Ультибро Бризхайлера 440 мкг/200 мкг в четыре шага, разделенных 1 ч. Самая соответствующая по времени разница в сравнении с плацебо составляла 4,64 мс (90% ДИ 0,40; 8,85 мс), всего подходящее по времени снижение составило –2,71 мс (90% ДИ –6,97; 1,54 мс), что свидетельствует о том, что Ультибро Бризхайлер не оказывал существенного влияния на интервал Q–T, как и ожидалось из свойств его компонентов. У пациентов с ХОЗЛ дозы до 600 мкг/100 мкг Ультибро Бризхайлера также не оказывали очевидного влияния на интервал Q–Tc при повторных оценках ЭКГ, которые проводили через 15 мин–24 ч после приема препарата. Несколько больше доля пациентов в группе Ультибро Бризхайлера 600 мкг/100 мкг, у которых отмечено удлинение Q–Tc >450 мс. Ряд заметных изменений Q–TcF по сравнению с исходным состоянием (>30 мс) был одинаковым во всех группах активного лечения (Ультибро Бризхайлер 600 мкг/100 мкг, 300 мкг/100 мкг, 150 мкг/100 мкг и 300 мкг индакатерола), но их было меньше в группе плацебо.
Уровень калия в плазме крови и глюкозы в крови. У здоровых добровольцев после введения Ультибро Бризхайлера 440 мкг/200 мкг снижение концентрации калия было очень малым (максимальная разница — 0,14 ммоль/л по сравнению с плацебо). Максимальный эффект на уровень глюкозы в крови составлял 0,67 ммоль/л. Когда Ультибро Бризхайлер 440 мкг/200 мкг сравнивали с 200 мкг салметерола, влияние на концентрацию калия (максимальная разница — 0,21 ммоль/л) и глюкозы в крови было ниже (максимальная разница — 0,21 и 1,19 ммоль/л соответственно) .
Клиническая безопасность и эффективность. Клиническая программа разработки Ультибро Бризхайлера III фазы [IGNITE] включала четыре исследования:
1) [SHINE], 26-недельное плацебо- и активно-контролируемое исследование (индакатерол 150 мкг 1 раз в сутки, гликопирроний 50 мкг 1 раз в сутки, открытый прием тиотропия 18 мкг 1 раз в сутки);
2) [ILLUMINATE], 26-недельное активно-контролируемое исследование (флутиказон/салметерол 50 мкг/500 мкг 2 раза в сутки);
3) [SPARK], 64-недельное активно-контролируемое исследование (гликопирроний 50 мкг 1 раз в сутки, открытый прием тиотропия 18 мкг 1 раз в сутки);
4) [ENLIGHTEN], 52-недельное плацебо-контролируемое исследование, в которое были включены более 5000 пациентов.
В эти исследования были включены пациенты с ХОЗЛ от легкой до очень тяжелой степени в возрасте старше 40 лет и с курением не менее 10 лет в анамнезе. Из этих четырех исследований в двух ([SHINE] и [ENLIGHTEN]) отмечен постбронходилатационный ОФВ1 <80 и ≥30% прогнозируемого нормального значения, постбронходилатационное соотношение ОФВ1/форсированной жизненной емкости легких составило <70%. В 26-недельное активно-контролируемое исследование [ILLUMINATE] были включены пациенты с постбронходилатационным ОФВ1 <80 и ≥40% прогнозируемого нормального значения. Для сравнения, в 64-недельное исследование [SPARK] были включены пациенты с тяжелым и очень тяжелым ХОЗЛ с постбронходилатационным ОФВ1 <50% прогнозируемого нормального значения.
Влияние на функцию легких. Ультибро Бризхайлер, который вводили в дозе 110 мкг/50 мкг 1 раз в сутки, показал клинически значимое улучшение функции легких (при измерении ОФВ1) в ряде клинических исследований. В исследованиях III фазы бронхолитические эффекты отмечались в течение 5 мин после первой дозы и сохранялись в течение 24-часового интервала дозирования. В течение 26-недельного ([SHINE]) и 52-недельного ([ENLIGHTEN]) исследований не выявлено ослабления бронхолитического эффекта с течением времени.
Минимальный ОФВ1. В исследовании [SHINE] Ультибро Бризхайлер увеличивал минимальный ОФВ1 на 200 мл по сравнению с плацебо на момент 26-недельной первичной конечной точки (р<0,001) и продемонстрировал значительное увеличение по сравнению с группами монотерапии отдельными компонентами (индакатерол и гликопирроний), а также с группой лечения тиотропием, как показано в таблице ниже.
Минимальный ОФВ1 (предел среднего) после введения дозы в 1-й день и на 26-й неделе (первичная конечная точка)
| Сравнение лечения | 1-й день | 26-я неделя |
|---|---|---|
| Ультибро Бризхайлер – плацебо | 190 мл (р<0,001) | 200 мл (р<0,001) |
| Ультибро Бризхайлер – индакатерол | 80 мл (р<0,001) | 70 мл (р<0,001) |
| Ультибро Бризхайлер – гликопирроний | 80 мл (р<0,001) | 90 мл (р<0,001) |
| Ультибро Бризхайлер – тиотропий | 80 мл (р<0,001) | 80 мл (р<0,001) |
Средний преддозовый ОФВ1 (среднее значение, установленное за 45 и 15 мин до утренней дозы исследуемого препарата) был клинически и статистически значимым в пользу Ультибро Бризхайлера на 26-й неделе по сравнению с флутиказоном/салметеролом (100 мл, р<0,001; [ILLUMINATE]), на 52-й неделе по сравнению с плацебо (189 мл, р<0,001; [ENLIGHTEN]), а также во время всех визитов на 64-й неделе по сравнению с гликопирронием (70–80 мл, р<0,001) и тиотропием (60–80 мл, р<0,001; [SPARK]).
Пиковый ОФВ1. Ультибро Бризхайлер вызывал статистически значимое улучшение пикового ОФВ1 по сравнению с плацебо в течение первых 4 ч после введения дозы в 1-й день (210 мл, р<0,001) и на 26-й неделе (330 мл, р<0,001), по сравнению с индакатеролом (120 мл), гликопирронием (130 мл), тиотропием (130 мл) на 26-й неделе (р<0,001 для всех сравнений; [SHINE]) и по сравнению с флутиказоном/салметеролом в 1-й день (70 мл, р<0,001) и на 26-й неделе (150 мл, р<0,001; [ILLUMINATE]).
Площадь под кривой ОФВ1. Ультибро Бризхайлер увеличивал AUC0–12 ОФВ1 после введения дозы (первичная конечная точка) на 140 мл через 26 нед (р<0,001) в активно контролируемом исследовании [ILLUMINATE] по сравнению с флутиказоном/салметеролом.
Начало действия. В исследованиях [SHINE] и [ILLUMINATE] Ультибро Бризхайлер продемонстрировал статистически значимое быстрое наступление эффекта бронходилататоров в 1-й день и на 26-й неделе.
Начало действия по сравнению с плацебо, тиотропием и флутиказоном/салметеролом на 5-й и 30-й минуте в 1-й день и на 26-й неделе
| Начало действия, мин | 1-й день, мл | 26-я неделя, мл |
|---|---|---|
| По сравнению с плацебо | ||
| 5 | 130* | 290* |
| 30 | 200* | 320* |
| По сравнению с тиотропием | ||
| 5 | 70* | 120 |
| 30 | 90* | 140 |
| По сравнению с флутиказоном/салметеролом | ||
| 5 | 80* | 150* |
| 30 | 80* | 160* |
*р<0,001 для всех сравнений лечения.
Субпопуляция серийной спирометрии. В 26-недельном плацебо-контролируемом исследовании [SHINE] в 1-й день проводилась 12-часовая серийная спирометрия (рис. 1) и 24-часовая серийная спирометрия на 26-й неделе (рис. 2) в подгруппе из 294 пациентов. Серийные значение ОФВ1 в течение 12 ч в 1-й день и значение ОФВ1 во 2-й день показаны на рис. 1, а на 26-й неделе — на рис. 2. Улучшение функции легких сохранялось в течение 24 ч после первой дозы и устойчиво сохранялось в течение 26-недельного периода лечения без признаков толерантности.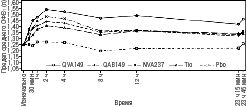
Рис. 1. 24-часовой профиль предела среднего ОФВ1 (л) в 1-й день (субпопуляция серийной спирометрии)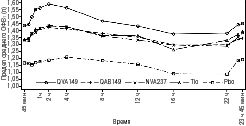
Рис. 2. 23 ч 45 мин профиля предела среднего ОФВ1 (л) после 26 нед лечения (субпопуляция серийной спирометрии)
В субпопуляции серийной спирометрии исследования [SHINE] Ультибро Бризхайлер продемонстрировал статистически значимое улучшение ОФВ1 по сравнению с плацебо (400 мл, р<0,001) и тиотропием (160 мл, р<0,001) через 2 ч после введения дозы на 26-й неделе.
Ультибро Бризхайлер также вызвал клинически и статистически значимое улучшение ОФВ1 по сравнению с флутиказоном/салметеролом во всех временных точках, начиная с 5 мин после введения дозы до 12 ч после введения дозы как на 12-й неделе (р<0,001), так и 26-й неделе (р<0,001; [ILLUMINATE]) (рис. 3).
Неделя 12-я
Неделя 26-я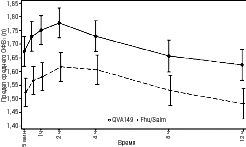
Рис. 3. Профиль предела среднего ОФВ1 (л) с 5 мин до 12 ч после введения дозы на 12-й и 26-й неделе (полный комплект для анализа)
В исследовании [ILLUMINATE] Ультибро Бризхайлер продемонстрировал значительное общее улучшение функции легких по сравнению с флутиказоном/салметеролом во всех ключевых подгруппах, включая возраст, пол, анамнез курения, тяжесть заболевания и обратимость.
Влияние на симптоматику
Одышка. Ультибро Бризхайлер значительно снижал одышку согласно динамическому индексу одышки (Transitional Dyspnoea Index — TDI), он продемонстрировал клинически и статистически значимое улучшение итогового балла TDI на 26-й неделе по сравнению с плацебо (1,09; р<0,001), тиотропием (0,51; р=0,007; [SHINE]) и флутиказоном/салметеролом (0,76; р=0,003; [ILLUMINATE]).
Значительно более высокий процент пациентов, которые получали Ультибро Бризхайлер, ответили 1-балльным или более выраженным улучшением итогового балла TDI на 26-й неделе по сравнению с плацебо (68,1 и 57,5% соответственно, р=0,004). Высокий процент пациентов продемонстрировал клинически значимый ответ на 26-й неделе применения Ультибро Бризхайлера по сравнению с тиотропием (68,1% против 59,2%, р=0,016; [SHINE]) и флутиказоном/салметеролом (65,1% против 55,5% флутиказона/салметерола, р=0,88; [ILLUMINATE]).
Качество жизни, связанное со здоровьем. Ультибро Бризхайлер при применении 1 раз в сутки также показал статистически значимое влияние на связанное со здоровьем качество жизни, которое определяется с помощью анкеты Госпиталя Святого Георгия для оценки дыхательной функции (St. George’s Respiratory Questionnaire, SGRQ), через 26 нед, которое определяли по снижению общей оценки SGRQ по сравнению с плацебо (–3,01; р=0,02) и тиотропием (–2,13; р=0,009; [SHINE]), и через 64 нед по сравнению с тиотропием (разница предела среднего –2,83; р<0,001; [SPARK]). Кроме того, улучшение по доменам SGRQ «симптомы», «активность» и «влияние на повседневную жизнь» были статистически значимыми по сравнению с тиотропием на 64-й неделе («симптомы»: 3,06, р=0,003; «активность»: 3,14, р<0,001; «влияние на повседневную жизнь»: 2,24, р=0,008; [SPARK]).
Большая доля пациентов, получавших Ультибро Бризхайлер, ответили клинически значимым улучшением оценки SGRQ (определено как снижение минимум на 4 единицы по сравнению с исходным уровнем) на 26-й неделе по сравнению с плацебо (63,7 и 56,6% соответственно, р=0,088) и тиотропием (63,7% против 56,4% тиотропий, р=0,047; [SHINE]), а на 64-й неделе — по сравнению с гликопирронием и тиотропием (57,3% — Ультибро Бризхайлер по сравнению с 51,8% — гликопирронием, р=0,055; 50,8% — тиотропием, р=0,051; [SPARK]).
Повседневная деятельность. Ультибро Бризхайлер продемонстрировал статистически преобладающее улучшение по сравнению с тиотропием по проценту дней, когда пациенты были в состоянии выполнять обычную повседневную работу в течение 26 нед (8,45%; р<0,001; [SHINE]), и показал численное улучшение по сравнению с гликопирронием (1,87; р=0,195) и статистическое улучшение по сравнению с тиотропием (4,95; р=0,001; [SPARK]).
Обострение ХОЗЛ. На 64-й неделе в исследовании [SPARK] Ультибро Бризхайлер при применении 1 раз в сутки снижал частоту средней тяжести или тяжелого обострения ХОЗЛ на 12% по сравнению с гликопирронием (р=0,038) и на 10% — по сравнению с открытым приемом тиотропия (р=0,096).
Кроме того, было показано, что Ультибро Бризхайлер клинически и статистически превосходил гликопирроний и тиотропий в снижении частоты всех обострений ХОЗЛ (легких, средней тяжести и тяжелых), со снижением частоты на 15% при применении Ультибро Бризхайлера по сравнению с гликопирронием (р=0,001) и на 14% — по сравнению с тиотропием (р=0,002).
Для времени до первого обострения ХОЗЛ средней тяжести или тяжелого Ультибро Бризхайлер продемонстрировал снижение риска на 7% по сравнению с гликопирронием (р=0,319).
Гликопирроний и тиотропий не показали никакой разницы в снижении риска.
Использование препаратов для неотложной терапии. Прием в течение 26 нед Ультибро Бризхайлера 1 раз в сутки значительно уменьшил применение неотложной помощи (сальбутамол) на 0,96 впрыскивания в сутки (р<0,001) по сравнению с плацебо и 0,54 впрыскивания в сутки (р<0,001) — по сравнению с тиотропием в исследовании [SHINE], а также на 0,39 впрыскивания в сутки (р=0,019) — по сравнению с флутиказоном/салметеролом в исследовании [ILLUMINATE].
В течение 64 нед Ультибро Бризхайлер уменьшил применение неотложной помощи (сальбутамол) на 0,76 впрыскивания в сутки (р<0,001) по сравнению с тиотропием в исследовании [SPARK].
Толерантность к физической нагрузке. В 3-недельном исследовании [BRIGHT], где толерантность к физической нагрузке была протестирована с помощью велоэргометрии при субмаксимальной (75%) нагрузке (тест на толерантность к субмаксимальной нагрузке), Ультибро Бризхайлер, который применяли утром, снижал динамическую гиперинфляцию и увеличивал продолжительность нагрузки, сохранявшиеся начиная с первой дозы. В 1-й день лечения объем вдоха при нагрузке значительно увеличивался (250 мл, р<0,001) по сравнению с плацебо. После 3 нед лечения улучшение объема вдоха с Ультибро Бризхайлер было больше (320 мл, р<0,001), а при физической нагрузке увеличилось (59,5 с, р=0,006) по сравнению с плацебо. Аналогичные результаты отмечали в группе тиотропия.
Измерение с помощью общей плетизмографии остаточного объема (ОО) и функционального остаточного объема (ФОО) позволяет получить представление о закрытии дыхательных путей и отражает наличие «ловушек воздуха», что считается отличительной чертой ХОЗЛ. В 1-й день лечения через 60 мин после введения дозы Ультибро Бризхайлер отмечено уменьшение ОО на 380 мл (р<0,001) по сравнению с плацебо и ФОО — на 350 мл (р<0,001) по сравнению с плацебо. На 21-й день через 60 мин после введения дозы отмечали дальнейшее сокращение ОО на 520 мл (р<0,001) и ФОО — на 520 мл (р<0,001).
Детская популяция. Европейское агентство по лекарственным средствам отказалось от требования предоставить результаты исследований Ультибро Бризхайлера во всех подгруппах педиатрических пациентов с ХОЗЛ.
Фармакокинетика
Всасывание
Ультибро Бризхайлер. После ингаляции препарата Ультибро Бризхайлер медиана времени до достижения Cmax в плазме крови индакатерола и гликопиррония составляла около 15 и 5 мин соответственно.
На основании данных исследований in vitro ожидается, что доза индакатерола, доставленная в легкие, будет одинаковой для Ультибро Бризхайлера и индакатерола 150 мкг в монотерапии. Стационарная экспозиция индакатерола после ингаляции Ультибро Бризхайлера была или такой же или чуть ниже, чем системная экспозиция после ингаляции индакатерола 150 мкг в монотерапии.
Биодоступность индакатерола после ингаляции Ультибро Бризхайлера была в пределах 47–66%, тогда как в гликопиррония — около 40%.
Стационарная экспозиция гликопиррония после ингаляции Ультибро Бризхайлера была подобна системной экспозиции гликопиррония после ингаляции 50 мкг препарата в монотерапии.
Индакатерол. Медиана времени до достижения Cmax в плазме крови индакатерола составляла около 15 мин после однократной или многократной ингаляции дозы. Системная экспозиция индакатерола увеличивалась с повышением дозы (со 150 до 600 мкг) дозопропорционально. Системная экспозиция состояла из легочной и кишечной абсорбции.
Концентрация индакатерола в плазме крови повышалась с повторным применением 1 раз в сутки. Стационарное состояние достигается в течение 12–15 дней. Среднее соотношение накопления индакатерола, то есть AUC в течение 24-часового интервала дозирования на 14-й или 15-й день по сравнению с 1-м днем, находилось в диапазоне 2,9–3,8 при ингаляции 1 раз в сутки в дозах 75–600 мкг.
Гликопирроний. После оральной ингаляции гликопирроний быстро всасывается и достигает пиковых уровней в плазме крови на 5-й минуте после введения препарата.
Биодоступность гликопиррония, по оценкам, составляет около 45% доставленной дозы. Около 90% системной экспозиции после ингаляции достигается путем всасывания в легких, 10% связано с желудочно-кишечной абсорбцией.
У пациентов с ХОЗЛ фармакокинетическое стационарное состояние гликопиррония достигалось в течение 1 нед после начала лечения. Стационарная средняя максимальная и минимальная плазменная концентрация гликопиррония при применении в рекомендуемой дозе 1 раз в сутки составляла 166 и 8 нг/мл соответственно. Стационарная экспозиция гликопиррония (AUC в течение 24-часового интервала дозирования) была примерно в 1,4–1,7 раза выше, чем после первой дозы.
Распределение
Индакатерол. После в/в введения объем распределения индакатерола на этапе конечной элиминации составлял 2557 л, что указывает на экстенсивное распределение. Связывание с белками плазмы и сыворотки крови человека in vitro составляло около 95%.
Гликопирроний. После в/в введения стационарный объем распределения гликопиррония составлял 83 л, а объем распределения в терминальной фазе — 376 л. Мнимый объем распределения в терминальной фазе после ингаляции был почти в 20 раз больше, что отражает значительно более медленную элиминацию после ингаляции. Связывание с белками плазмы и сыворотки крови человека in vitro составляло 38–41% при концентрации 1–10 нг/мл.
Биотрансформация
Индакатерол. После приема радиоактивно меченного индакатерола в исследовании ADME (всасывание, распределение, метаболизм, экскреция) у людей неизмененный индакатерол был основным компонентом в плазме крови и составлял примерно 1/3 общей связанной с препаратом AUC в течение 24 ч. Гидроксилированное производное было основным метаболитом в плазме крови. Фенольные О-глюкурониды индакатерола и гидроксилированного индакатерола были следующими значимыми метаболитами. Диастереомер гидроксилированного производного — N-глюкуронид индакатерола, а также С- и N-деалкилированные продукты идентифицированы среди других метаболитов.
Исследования in vitro показали, что UGT1A1 является единственной изоформой UGT, которая метаболизирует индакатерол до фенольного О-глюкуронида. Окислительные метаболиты выявлены при инкубации с рекомбинантными CYP 1A1, CYP 2D6 и CYP 3A4. Установлено, что CYP 3A4 является предпочтительным изоферментом, ответственным за гидроксилирование индакатерола. Исследования in vitro в дальнейшем показали, что индакатерол имеет низкое сродство к субстрату для эфлюксной помпы P-gp.
Гликопирроний. Исследования метаболизма in vitro показали подобные метаболические пути для гликопиррония бромида у животных и людей. Гидроксилирование обусловливает образование различных моно- и бис-гидроксилированных метаболитов, а прямой гидролиз приводит к образованию производного карбоновой кислоты (М9). In vivo М9 образуется из проглоченной фракции ингалированного гликопиррония бромида. Глюкуронид и/или сульфатные конъюгаты гликопиррония выявлены в моче людей после повторных ингаляций, что составляет около 3% дозы.
Ряд изоферментов CYP способствовал окислительной биотрансформации гликопиррония. Ингибирование или индукция метаболизма гликопиррония вряд ли будут приводить к существенным изменениям системной экспозиции активного вещества.
Исследования ингибирования in vitro показали, что гликопиррония бромид не имеет значимой способности подавлять CYP 1A2, CYP 2A6, CYP 2C8, CYP 2C9, CYP 2C19, CYP 2D6, CYP 2E1 или CYP 3A4/5, эфлюкс-транспортеры MDR1, MRP2 или MXR и транспортеры захвата OCT1 или OCT2. Исследования индукции ферментов in vitro не выявили клинически значимой индукции гликопиррония бромида любого из тестируемых изоферментов цитохрома Р450 или UGT1A1 и транспортеров MDR1 и MRP2.
Элиминация
Индакатерол. В клинических исследованиях, которые включали сбор мочи, количество индакатерола, которое выводится в неизмененном виде с мочой, было в целом <2% дозы. Почечный клиренс индакатерола составлял в среднем 0,46–1,2 л/ч. По сравнению с плазменным клиренсом индакатерола 23,3 л/ч очевидно, что почечный клиренс играет незначительную роль (2–5% системного клиренса) в элиминации системно доступного индакатерола.
В исследовании ADME индакатерола, применявшегося перорально, путь экскреции с калом доминировал над элиминацией с мочой. Индакатерол выводился с калом в основном в виде неизмененного исходного вещества (54% дозы) и в меньшей степени — в виде гидроксилированных метаболитов индакатерола (23% дозы). Баланс массы был полным, ≥90% дозы выявлено в кале.
Концентрация индакатерола в плазме крови снижалась многофазным образом со средним Т½ в пределах 45,5–126 ч. Эффективный Т½, рассчитанный по накоплению индакатерола после многократного применения, колебался в пределах 40–52 ч, что согласуется с наблюдаемым временем до достижения стационарного состояния — около 12–15 дней.
Гликопирроний. После в/в введения 3H-меченного гликопиррония бромида у человека средняя экскреция радиоактивности в течение 48 ч составила 85% дозы. Еще 5% дозы выявлено в желчи.
Почечная экскреция исходного препарата составляла около 60–70% общего клиренса системно доступного гликопиррония, в то время как внепочечный клиренс составлял около 30–40%. Желчный клиренс является составляющей внепочечного клиренса, но в основном внепочечный клиренс, как полагают, связан с метаболизмом.
Средний почечный клиренс гликопиррония после ингаляции находился в диапазоне 17,4–24,4 л/ч. Активная канальцевая секреция способствует почечной экскреции гликопиррония. До 23% доставленной дозы выявлено в моче как исходный препарат.
Концентрация гликопиррония в плазме крови снизилась многофазным образом. Средний терминальный Т½ был гораздо дольше после ингаляции (33–57 ч), чем после в/в (6,2 ч) и перорального (2,8 ч) введения. Модель элиминации предусматривает длительную легочную абсорбцию и/или поступление гликопиррония в системный кровоток в течение 24 ч после ингаляции и больше.
Линейность/нелинейность. У больных ХОЗЛ как системная экспозиция, так и общая экскреция с мочой гликопиррония в фармакокинетически стационарном состоянии увеличились примерно дозопропорционально в диапазоне доз 50–200 мкг.
Особые популяции
Ультибро Бризхайлер. Популяционный фармакокинетический анализ данных у пациентов с ХОЗЛ после ингаляции Ультибро Бризхайлера не выявил существенного влияния возраста, пола и (безжировой) массы тела на системное воздействие индакатерола и гликопиррония. Безжировая масса тела (которая является функцией массы и роста) была определена как ковариата. Выявлена отрицательная корреляция между системным воздействием и безжировой массой тела (или массой тела), однако коррекция дозы не рекомендуется в связи с величиной изменения или прогнозируемой погрешностью безжировой массы тела.
Курение и базовый ОФВ1 не оказывали очевидного влияния на системную экспозицию индакатерола и гликопиррония после ингаляции Ультибро Бризхайлера.
Индакатерол. Популяционный фармакокинетический анализ показал, что нет клинически значимого влияния возраста (взрослые до 88 лет), пола, массы тела (32–168 кг) или расы на фармакокинетику индакатерола. Не предполагалось никакой разницы между этническими подгруппами в этой популяции.
В связи с очень незначительной долей мочевого пути в полной экскреции исследований у пациентов с нарушением функции почек не проводили.
Гликопирроний. В популяционном фармакокинетическом анализе данных в отношении пациентов с ХОЗЛ масса тела и возраст определены как факторы индивидуальной изменчивости системной экспозиции. Гликопирроний в рекомендованной дозе можно безопасно применять у пациентов всех возрастных групп и групп по массе тела.
Пол, курение и базовый ОФВ1 не оказывали явного влияния на системную экспозицию.
Пациенты с нарушением функции печени
Ультибро Бризхайлер. Исходя из клинических фармакокинетических характеристик компонентов Ультибро Бризхайлера в монотерапии, его можно применять в рекомендованной дозе у пациентов с нарушением функции печени легкой и средней тяжести. Нет данных о пациентах с тяжелым нарушением функции печени.
Индакатерол. У пациентов с нарушением функции печени легкой и средней тяжести не выявлено ни значимых изменений Cmax или AUC индакатерола, ни разницы в связывании белка по сравнению со здоровыми лицами группы контроля. Исследования с участием пациентов с тяжелым нарушением функции печени не проводились.
Гликопирроний. Клинические исследования не проводили у пациентов с печеночной недостаточностью. Гликопирроний выводится преимущественно из большого круга кровообращения путем почечной экскреции. Считается, что нарушение печеночного метаболизма гликопиррония не приводит к клинически значимому увеличению системной экспозиции.
Пациенты с нарушением функции почек
Ультибро Бризхайлер. Исходя из клинических фармакокинетических характеристик компонентов Ультибро Бризхайлера в монотерапии, его можно применять в рекомендованной дозе у пациентов с нарушением функции почек легкой и средней тяжести.
Больным с тяжелым нарушением функции почек или терминальной стадией болезни почек, требующей диализа, Ультибро Бризхайлер следует применять, только если ожидаемая польза превышает потенциальный риск.
Индакатерол. В связи с очень низкой долей мочевого пути в полной элиминации индакатерола малеата из организма исследований с участием пациентов с нарушением функции почек не проводили.
Гликопирроний. Нарушение функции почек влияет на системную экспозицию гликопиррония бромида. Умеренное среднее увеличение общей системной экспозиции (AUC) до 1,4 раза отмечено у пациентов с нарушением функции почек легкой и средней тяжести и до 2,2 раза — у пациентов с тяжелым нарушением функции почек или терминальной стадией болезни почек. У лиц с ХОЗЛ с нарушением функции почек легкой и средней тяжести (скорость клубочковой фильтрации (СКФ) ≥30 мл/мин/1,73 м2) гликопиррония бромид можно применять в рекомендуемой дозе.
Этническая принадлежность
Ультибро Бризхайлер. После коррекции на безжировую массу тела не установлено статистически значимого влияния этнической принадлежности (японцы по сравнению с неяпонцами) на экспозицию для обоих соединений.
Индакатерол. Разницы между этническими подгруппами не выявлено. Опыт лечения пациентов негроидной популяции ограничен.
Гликопирроний. Не выявлено существенных различий в общей системной экспозиции (AUC) между японскими пациентами и пациентами европеоидной расы. Фармакокинетические данные по другим национальностям или расам недостаточны.
Доклинические данные по безопасности
Ультибро Бризхайлер. Влияние Ультибро Бризхайлер на ЧСС увеличивалось по величине и продолжительности по сравнению с влиянием, которое характерно для каждого компонента отдельно. Сокращение ЭКГ-интервалов, которые отражают увеличение ЧСС и снижение систолического и диастолического АД, также проявлялось после лечения Ультибро Бризхайлером. Индакатерол, который вводили собакам отдельно или в комбинации как Ультибро Бризхайлер, вызывал аналогичную частоту и тяжесть поражения миокарда. Системная экспозиция (AUC) в концентрации, в которой не отмечается неблагоприятного воздействия (NOAEL), была в 64 и 59 раз выше, чем у человека при приеме дозы 110 мкг/50 мкг, для каждого компонента соответственно.
В исследованиях на крысах не выявлено влияния на эмбрион или плод на любом дозовом уровне Ультибро Бризхайлера.
Индакатерол. Влияние на сердечно-сосудистую систему было связано с β2-агонистическими свойствами индакатерола, в частности с тахикардией, аритмией и поражением миокарда у собак. Легкое раздражение полости носа и гортани отмечали у грызунов. Все эти нарушения были при экспозиции выше, чем та, которую ожидают у людей.
Хотя индакатерол не влиял на общие репродуктивные характеристики в исследовании фертильности крыс, отмечали уменьшение количества беременных в поколении F1 при экспозиции в 14 раз выше, чем у людей, которых лечили индакатеролом. Индакатерол не оказывал эмбриотоксического или тератогенного действия на крыс или кроликов.
Исследования генотоксичности не выявили мутагенного или кластогенного потенциала.
Гликопирроний. Доклинические данные не продемонстрировали особой опасности для людей на основе традиционных исследований фармакологии безопасности, токсичности повторных доз, генотоксичности, канцерогенного потенциала, токсичности для репродукции и развития.
Гликопирроний не проявлял тератогенных свойств у крыс и кроликов после ингаляции. Фертильность, а также пре- и постнатальное развитие не нарушались у крыс. Гликопиррония бромид и его метаболиты существенно не проникают через плацентарный барьер беременных мышей, кроликов и собак. Гликопиррония бромид (в том числе его метаболиты) проникает в молоко крыс и достигает концентрации, в 10 раз выше, чем в крови самок.
Исследования генотоксичности не выявили мутагенного или кластогенного потенциала гликопиррония бромида. Исследования канцерогенности у трансгенных мышей с использованием перорального введения и использования ингаляции у крыс не выявили доказательств канцерогенности при системной экспозиции препарата (AUC) у мышей примерно в 53 раз выше и у крыс — в 75 раз выше, чем при максимальной рекомендованной дозе 1 раз в сутки у человека.
Показания Ультибро Бризхайлер
поддерживающая бронхолитическая терапия для уменьшения выраженности симптомов и снижения частоты обострений у взрослых пациентов с ХОЗЛ.
Применение Ультибро Бризхайлер
дозирование. Рекомендуемая доза — ингаляция содержимого одной капсулы с помощью ингалятора Ультибро Бризхайлер 1 раз в сутки.
Ультибро Бризхайлер рекомендуется применять 1 раз в сутки в одно и то же время каждый день. Если прием дозы пропущен, следующую дозу следует принять как можно быстрее. Пациенты должны знать, что нельзя принимать больше одной дозы в сутки.
Пациенты пожилого возраста. Пациенты пожилого возраста (старше 75 лет) могут применять Ультибро Бризхайлер в рекомендованной дозе.
Нарушение функции почек. Пациенты с нарушением функции почек легкой и средней степеней тяжести могут применять Ультибро Бризхайлер в рекомендованной дозе. Пациентам с тяжелым нарушением функции почек или с заболеванием почек в терминальной стадии, которым требуется проведение диализа, Ультибро Бризхайлер следует применять, только если ожидаемая польза превышает потенциальный риск.
Нарушение функции печени. Пациенты с нарушением функции печени легкой и средней степени тяжести могут применять Ультибро Бризхайлер в рекомендованной дозе. Данные по применению Ультибро Бризхайлер у пациентов с тяжелым нарушением функции печени отсутствуют.
Способ применения. Только для ингаляционного применения.
Капсулы Ультибро Бризхайлер следует применять только с помощью ингалятора Ультибро Бризхайлер.
Пациенты должны быть проинструктированы относительно правильного применения препарата.
Применение ингалятора
1. Снять колпачок.
2. Открыть ингалятор: прочно удерживать основу ингалятора и наклонить мундштук. Ингалятор открыт.
3. Подготовить капсулу: отделить один блистер от блистерной упаковки, оторвав его по линии перфорации. Взять один блистер и снять защитную подложку для того, чтобы открыть капсулу. Не выжимать капсулу через фольгу.
4. Вынуть капсулу: капсулы следует всегда хранить в блистере и вынимать только перед применением. Сухими руками вынуть капсулу из блистера. Капсулу не глотать.
5. Вставить капсулу: поместить капсулу в камеру для капсулы. Никогда не размещать капсулу непосредственно в мундштуке.
6. Закрыть ингалятор: закрыть ингалятор до щелчка.
7. Проколоть капсулу: держать ингалятор в вертикальном положении так, чтобы мундштук был направлен вверх. Проколоть капсулу путем одновременного сильного нажатия на обе боковые кнопки. Сделать это только один раз. В тот момент, как капсула проколется, должен быть слышен щелчок.
8. Полностью отпустить боковые кнопки.
9. Выдохнуть: прежде чем поместить мундштук в рот, сделать полный выдох. Не дуть в мундштук.
10. Вдохнуть лекарственное средство: для того чтобы лекарственное средство попало глубоко в дыхательные пути, необходимо правильно держать ингалятор. Боковые кнопки должны быть расположены слева и справа. Не следует сжимать боковые кнопки. Поместить мундштук в рот и плотно сжать губы вокруг него. Сделать быстрый, но равномерный вдох так глубоко, как только возможно. Не нажимать на боковые кнопки.
11. Примечание: при вдыхании через ингалятор капсула вращается в камере, должно быть слышно жужжание. Ощущается сладкий аромат, как только лекарственное средство попадает в легкие. Если не слышно жужжания, капсулу может заклинить в камере. Если это случится, следует открыть ингалятор и осторожно освободить капсулу, постукивая по основанию ингалятора. Не нажимать на боковые кнопки. Опять вдохнуть лекарственное средство, повторив пункты 9 и 10.
12. Задержать дыхание: после того, как вдохнули лекарственное средство, задержать дыхание по крайней мере на 5–10 с или на сколько возможно, не испытывая неудобства, одновременно вынимая ингалятор изо рта. Затем сделать выдох. Открыть ингалятор и проверить капсулу на остатки порошка. Если в капсуле остался порошок: закрыть ингалятор. Повторить пункты от 9 до 12.
Большинство людей может опорожнить капсулу одним или двумя вдохами.
Дополнительная информация. Некоторые люди могут иногда непродолжительное время кашлять сразу после вдыхания лекарственного средства. Если такое случилось, не следует волноваться. Если капсула пуста, получено достаточное количество лекарственного средства.
13. После завершения приема суточной дозы Ультибро Бризхайлер: снова открыть мундштук и удалить пустую капсулу, наклоняя камеру, чтобы капсула выпала. Пустую капсулу выбросить в бытовые отходы. Закрыть ингалятор и вставить на место колпачок. Не хранить капсулы в ингаляторе Ультибро Бризхайлер.
Противопоказания
повышенная чувствительность к действующему веществу, лактозе или любому из вспомогательных веществ.
Побочные эффекты
резюме профиля безопасности. Опыт изучения безопасности Ультибро Бризхайлера состоял из экспозиции до 15 мес в рекомендуемой терапевтической дозе.
Клиническая программа разработки III фазы Ультибро Бризхайлера состояла из 6 ключевых исследований. Были привлечены более 6000 пациентов с клиническим диагнозом ХОЗЛ средней или очень тяжелой степени. Данные по безопасности 5 исследований с длительностью более 12 нед, объединявшие 1805 пациентов, основываются на применении Ультибро Бризхайлера 1 раз в сутки в рекомендуемой терапевтической дозе.
Профиль безопасности характеризуется типичными антихолинергическими и β-адренергическими симптомами, связанными с отдельными компонентами комбинации. Другими наиболее распространенными побочными реакциями, связанными с препаратом (сообщили ≥3% пациентов, применявших Ультибро Бризхайлер), были кашель и боль в ротоглотке (в том числе раздражение в горле).
В рекомендуемой дозе профиль побочных реакций у пациентов с ХОЗЛ отражает клинически незначимые системные эффекты β2-адренергической стимуляции. Средние изменения ЧСС составляли <1 уд./мин, тахикардия отмечалась нечасто и реже, чем в группе плацебо. Значимое удлинение Q–TcF не определялось по сравнению с плацебо.
Частота выраженного интервала Q–TcF (то есть >450 мс) и сообщений о гипокалиемии была сходной с плацебо.
Резюме нежелательных реакций. Нежелательные реакции связывали с фиксированной комбинацией, когда они ранее не наблюдались ни с одним из отдельных компонентов, или если они также отмечались с более высокой частотой при применении Ультибро Бризхайлер, чем зарегистрировано для отдельных компонентов (индакатерол 150 мкг и гликопирроний 50 мкг).
Нежелательные реакции на препараты, о которых сообщили в течение первых 6 мес двух объединенных базовых исследований III фазы продолжительностью 6 и 12 мес, перечислены по классам систем органов по MedDRA. В каждом классе систем органов побочные реакции на препараты представлены по частоте — сначала наиболее частые реакции. В каждой группе по частоте неблагоприятные реакции на лекарства представлены в порядке убывания серьезности. Частота классифицирована следующим образом: очень часто (≥1/10); часто (≥1/100 до <1/10); нечасто (≥1/1000 до <1/100); редко (≥1/10 000, <1/1000); очень редко (<1/10 000); неизвестно (не может быть оценена на основе имеющихся данных).
Поскольку Ультибро Бризхайлер содержит индакатерол и гликопирроний, побочные реакции, связанные с каждым из этих компонентов, можно ожидать и для комбинации.
Побочные реакции, отмеченные в плацебо-контролируемых клинических исследованиях
Инфекции и инвазии: часто — инфекции верхних дыхательных путей**, инфекции мочевыводящих путей.
Со стороны нервной системы: часто — головокружение.
Со стороны органа зрения: нечасто — глаукома*.
Со стороны сердца: нечасто — сердцебиение**.
Со стороны органов дыхания, грудной клетки и средостения: часто — кашель, орофарингеальная боль, включая раздражение горла; нечасто — носовые кровотечения.
Со стороны пищеварительного тракта: часто — диспепсия, кариес.
Со стороны опорно-двигательного аппарата и соединительной ткани: часто — костно-мышечная боль.
Со стороны почек и мочевыделительной системы: нечасто — обструкция мочевого пузыря и задержка мочи.
Общие нарушения и состояние места введения: часто — гипертермия*, боль в груди.
*Нежелательные реакции, выявленные при применении Ультибро Бризхайлер, но не отдельных компонентов.
**Эти нежелательные реакции отмечались с более высокой частотой при применении плацебо, но включены, поскольку были представлены с более высокой абсолютной частотой, чем при применении отдельных компонентов (индакатерол 150 мкг и гликопирроний 50 мкг).
Дополнительные побочные реакции, которые могут возникать при применении отдельных компонентов
Побочные реакции, о которых сообщалось ранее в отношении отдельных компонентов, могут возникать при применении Ультибро Бризхайлера, даже если они не зафиксированы в основных клинических исследованиях.
Индакатерол. Нижеприведенные нежелательные реакции содержатся в объединенной базе данных по безопасности лекарств для лечения ХОЗЛ по индакатеролу (доза 150 или 300 мкг). Реакции приведены в порядке убывания частоты: назофарингит, головная боль, синусит, мышечный спазм, ринорея, периферические отеки, миалгия, ИБС, зуд/сыпь, сахарный диабет и гипергликемия, фибрилляция предсердий, гиперчувствительность, парестезии, тахикардия и парадоксальный бронхоспазм.
Гликопирроний. Нижеприведенные побочные реакции содержатся в объединенной базе данных по безопасности лекарств для лечения ХОЗЛ по гликопирронию. Реакции приведены в порядке убывания частоты: сухость во рту, гастроэнтерит, бессонница, боль в конечностях, сыпь, утомляемость, астения, отек слизистой оболочки придаточных пазух носа, ринит, гипергликемия, гипестезия и фибрилляция предсердий.
Описание отдельных нежелательных реакций на препарат. Наиболее распространенным побочным эффектом антихолинергических средств была сухость во рту (0,6% против 0,3% в группе плацебо), однако это неблагоприятное явление отмечали с низкой частотой при применении Ультибро Бризхайлера, чем гликопиррония, который применялся в качестве монотерапии. Большинство случаев сухости во рту были легкой степени, ни один не был тяжелым.
Кашель был частым, но обычно легкой интенсивности.
Некоторые серьезные побочные эффекты, в том числе повышенная чувствительность и ИБС, были представлены как побочные реакции на применение индакатерола качестве монотерапии. При применении Ультибро Бризхайлера частота гиперчувствительности и ИБС составляла 0,1% против 0,0% в группе плацебо и 0,1% против 0,3% в группе плацебо соответственно.
Отдельные популяции. У пациентов в возрасте старше 75 лет частота инфекций мочевыводящих путей была выше при применении Ультибро Бризхайлера, чем в группе плацебо (3,5% против 2,8% соответственно).
Особые указания
не предназначен для применения при острых состояниях.
Ультибро Бризхайлер назначают 1 раз в сутки для долгосрочной поддерживающей терапии. Препарат не предназначен для первоначального лечения острых эпизодов бронхоспазма, то есть как неотложная терапия.
Парадоксальный бронхоспазм. Как и при применении другой ингаляционной терапии, применение препарата Ультибро Бризхайлер может привести к развитию парадоксального бронхоспазма, который может быть опасным для жизни. Если возникает парадоксальный бронхоспазм, применение препарата Ультибро Бризхайлер необходимо немедленно прекратить и начать альтернативную терапию.
Антихолинергический эффект. Как и другие антихолинергические лекарственные средства, Ультибро Бризхайлер следует применять с осторожностью у пациентов с закрытоугольной глаукомой или задержкой мочи.
Пациенты должны быть проинформированы о симптомах острой закрытоугольной глаукомы и необходимости отмены препарата Ультибро Бризхайлер, а также о необходимости немедленно обратиться к врачу в случае появления каких-либо из этих симптомов.
Пациенты с нарушением функции почек тяжелой степени. У пациентов с нарушением функции почек тяжелой степени (СКФ <30 мл/мин/1,73 м2), включая пациентов с заболеванием почек в терминальной стадии, которым требуется проведение диализа, Ультибро Бризхайлер следует применять, только если ожидаемая польза превышает потенциальный риск. Этих пациентов необходимо внимательно наблюдать относительно появления возможных нежелательных реакций на препарат.
Применение в период беременности и кормления грудью. Беременность. Данные по применению препарата Ультибро Бризхайлер у беременных отсутствуют. Препарат Ультибро Бризхайлер следует применять в период беременности только в случаях, если ожидаемая польза для матери превышает потенциальный риск для плода.
Кормление грудью. Неизвестно, экскретируются ли индакатерол, гликопирроний и их метаболиты в грудное молоко. Вопрос о применении препарата Ультибро Бризхайлер в период кормления грудью следует рассматривать только в том случае, если ожидаемая польза для женщины больше, чем риск для ребенка.
Фертильность. Данные исследований репродуктивной функции и другие данные, полученные в результате опытов на животных, не вызывают беспокойства относительно фертильности как мужчин, так и женщин.
Дети. Препарат не предназначен для применения у детей.
Способность влиять на скорость реакции при управлении транспортными средствами или работе с другими механизмами. Ультибро Бризхайлер может влиять на способность управлять транспортными средствами или работать с механизмами, поэтому при применении препарата рекомендуется воздержаться от управления транспортными средствами и других работ, требующих концентрации внимания.
Взаимодействия
одновременное применение индакатерола и гликопиррония в препарате Ультибро Бризхайлер, когда оба действующих вещества находятся в стационарном состоянии, не влияет на фармакокинетику других лекарственных средств.
Специальные исследования взаимодействия с Ультибро Бризхайлер не проводились. Информация о возможных взаимодействия основывается на свойствах каждого из компонентов.
Взаимодействия, связанные с индакатеролом
Не выявлено, что индакатерол является причиной взаимодействия с другими лекарственными средствами. Исследования in vitro показали, что потенциал индакатерола вызывать метаболические взаимодействия с лекарственными средствами в системных экспозициях, достигаемых в клинической практике, является незначительным.
Не рекомендуется одновременное применение с:
- блокаторами β-адренорецепторов: блокаторы β-адренорецепторов могут ослаблять или противодействовать эффекту β2-агонистов. Поэтому Ультибро Бризхайлер не следует назначать вместе с блокаторами β-адренорецепторов (включая глазные капли), если нет веских причин для их применения. При необходимости следует предпочесть кардиоселективные блокаторы β-адренорецепторов, хотя их следует применять с осторожностью;
- симпатомиметиками: одновременное применение других симпатомиметиков (отдельно или в составе комбинированной терапии) может усиливать нежелательные эффекты индакатерола;
- гипокалиемическими средствами: одновременное применение с гипокалиемическими средствами из группы производных метилксантина, стероидами или некалийсберегающими диуретиками может усиливать гипокалиемические эффекты β2-агонистов, поэтому их следует применять с осторожностью.
Следует учитывать при одновременном применении
Метаболические и транспортные взаимодействия: ингибирование ключевых участников клиренса индакатерола — CYP 3A4 и Р-гликопротеина — повышает системную экспозицию индакатерола до 2 раз. Увеличение экспозиции за счет взаимодействия не вызывает проблем с безопасностью, учитывая опыт безопасности лечения индакатеролом в клинических исследованиях до 1 года в дозе, в 2 раза превышающей максимальную рекомендованную дозу индакатерола.
Вещества, которые удлиняют интервал Q–Tc. Клинически значимого влияния на удлинение интервала Q–Tc не выявлено в клинических исследованиях применения индакатерола в рекомендованных терапевтических дозах.
Взаимодействия, связанные с гликопирронием. Исследования in vitro показали, что гликопирроний не подавляет и не стимулирует метаболизм других активных веществ или процессов с участием транспортеров лекарственных средств. Метаболизм, в котором принимают участие несколько ферментов, играет второстепенную роль в элиминации гликопиррония. Ингибирование или индукция метаболизма гликопиррония вряд ли приведут к релевантным изменениям системной экспозиции активного вещества.
Не рекомендуется одновременное применение с:
- антихолинергическими средствами: сочетанное применение Ультибро Бризхайлера с другими антихолинергическими лекарственными средствами не изучено и поэтому не рекомендуется.
Следует учитывать при одновременном применении с циметидином и другими ингибиторами транспорта органических катионов: в клинических исследованиях у здоровых добровольцев циметидин — ингибитор транспорта органических катионов, который, как считается, способствует почечной экскреции гликопиррония, — увеличивал общую экспозицию (AUC) гликопиррония на 22% и снижал почечный клиренс на 23%. Таким образом, клинически значимых лекарственных взаимодействий не ожидается, если гликопирроний применяют одновременно с циметидином или другими ингибиторами транспорта органических катионов.
Передозировка
в исследованиях разовой дозы с участием здоровых добровольцев 4-кратная терапевтическая доза Ультибро Бризхайлера (4 дозы по 50 мкг/110 мкг/ч) хорошо переносилась, существенно не влияя на сердечный ритм, интервал Q–Tc, уровень калия в плазме крови и уровень глюкозы в крови. У пациентов с ХОЗЛ, получавших дозы до 600 мкг/100 мкг препарата в течение 2 нед, не отмечено значимых эффектов на сердечный ритм, интервал Q–Tc, уровень глюкозы и калия в крови. Выявлено повышение частоты желудочковых эктопий после 14 дней применения 300 мкг/100 мкг и 600 мкг/100 мкг препарата Ультибро Бризхайлер, но низкая частота и небольшое количество пациентов (n=49 и n=51 при применении 600 мкг/100 мкг и 300 мкг/100 мкг препарата Ультибро Бризхайлер соответственно) исключает точный анализ. У 4 пациентов отмечена неустойчивая желудочковая тахикардия, зафиксирован самый длинный эпизод — 9 сокращений (4 с).
Дополнительная информация, связанная с индакатеролом. У пациентов с ХОЗЛ, получавших разовую дозу, в 10 раз превышавшую максимальную рекомендованную терапевтическую дозу индакатерола, выявлено умеренное повышение частоты пульса, систолического АД и увеличение интервала Q–Tc.
Дополнительная информация, связанная с гликопирронием. Высокие дозы гликопиррония способны вызвать антихолинергические симптомы, которые могут потребовать лечения. Острая интоксикация вследствие непреднамеренного проглатывания капсул гликопиррония маловероятна из-за его низкой биодоступности (около 5%). Пиковые плазменные уровни и общая системная экспозиция после введения 150 мкг гликопиррония бромида (эквивалент 120 мкг гликопиррония) у здоровых добровольцев были соответственно примерно в 50 и 6 раз выше, чем пиковая и общая системная экспозиция в стационарном состоянии, которые достигаются при применении рекомендованных доз гликопиррония, и хорошо переносились.
Условия хранения
в оригинальной упаковке для защиты от влаги при температуре не выше 25 °С.