3.1. Характеристика остеопении, остеопороза, остеомаляции, рахита. Классификации остеопороза
В литературе имеются различные определения понятия «остеопороз», но изложение сущности этого патологического состояния в них фактически не отличается: для него характерно уменьшение костной массы в единице объема кости по сравнению с нормальными показателями у лиц аналогичного пола и возраста, нарушение микроархитектоники костной ткани. В результате этих изменений отмечается увеличение хрупкости костей (снижается их прочность), повышается риск возникновения переломов. На конференциях по проблемам остеопороза в Копенгагене (1990), в Гонконге (1993) дано определение остеопороза как системного заболевания скелета. В дальнейшем был выделен остеопороз с высоким и низким уровнями метаболических процессов в костной ткани, активная и неактивная формы (в зависимости от характера течения по морфологическим данным). Ряд исследователей рассматривают остеопороз как синдром. Так, А.А. Корж и соавторы (1995) считают остеопороз «синдромом гетерогенной группы заболеваний, характеризующихся нарушением равновесия процессов перестройки костной ткани, сопровождающихся ее разрежением, то есть уменьшением массы на единицу объема (плотности), что приводит к повышенной хрупкости кости». Как синдром рассматривают остеопороз S. Khosla et al. (2000б). А.С. Аврунин и соавторы (1998) считают, что «остеопоротические сдвиги в структуре костной ткани по сути своей носят адаптивный характер и не являются отдельными заболеваниями (нозологическими единицами), как это трактует Международная классификация болезней (МКБ), а лишь отражают приспособительные изменения метаболизма, происходящие в организме в целом». Остеопороз, по мнению этих авторов, является синдромом, развивающимся в результате адаптивной перестройки формирования клеток костной ткани в ответ на происходящие в организме метаболические изменения любой этиологии. Ш. Шуцяну и соавторы (1983) также считают остеопороз анатомо-клинико-рентгенологическим синдромом, сопровождающимся уменьшением объема костной ткани, сокращением костной массы. По мнению Н.А. Коржа (2002б), определение остеопороза как синдрома в большей мере отражает патогенетическую сущность этой патологии, а так называемые первичные остеопорозы вряд ли являются таковыми.
Остеопорозу предшествует развитие остеопении, для которой характерно снижение МПКТ. При анализе плотности ткани определяют такие показатели, как абсолютную плотность костной ткани, Т- и Z-критерий. Т-критерий — стандартное отклонение значения абсолютной плотности от среднего значения МПКТ у лиц молодого возраста. Значение Т-критерия в пределах 1 и 2,5 свидетельствует об остеопении. В зависимости от выраженности остеопению подразделяют на три (I, II, III) степени. В соответствии со стандартами ВОЗ различают следующие показатели МПКТ:
Нормальная кость: изменения МПК по Т-критерию в пределах 1 стандартного отклонения (SD)
Остеопения I степени: снижение МПК в пределах 1,0…1,5 SD
Остеопения II степени: снижение МПК в пределах 1,5…2,0 SD
Остеопения III степени: снижение МПК в пределах 2,0…2,5 SD
При показателе свыше 2,5 SD в костной ткани имеются остеопоротические изменения, что свидетельствует о повышении риска развития переломов. Z-критерий — это стандартное отклонение значения абсолютной МПКТ пациента от среднего значения абсолютной МПКТ людей такого же возраста. Z-критерий ниже 1 предполагает наличие какого-то дополнительного фактора снижения МПКТ, помимо старения организма.
Остеопенический синдром или остеопороз по данным денситометрии обнаруживают при остеомаляции, характеризующейся нарушением минерализации в зрелой костной ткани, соотношения органических и неорганических веществ в костях (в норме составляет 1:1). Сочетание остеопороза и остеомаляции называют остеопоромаляцией (Делягин В.М., Румянцев А., 2001). При остеодистрофии наблюдается усиление процессов резорбции кости (развитие остеопороза) при одновременной пролиферации фиброзной ткани. Гиперостоз представляет собой увеличение объема костной ткани, сопровождающееся утолщением костей или их деформацией. Он может сочетаться с очагами разрежения костей. Остеомаляция возникает вследствие сниженной концентрации фосфатов и кальция во внеклеточной жидкости или циркуляции в крови ингибиторов минерализации. Иногда для подтверждения диагноза остеомаляции необходимо проведение биопсии кости. К основным причинам развития остеомаляции относят дефицит витамина D (его метаболитов) и неорганического фосфата.
Недостаток витамина D и его метаболитов может быть обусловлен:
- недостаточным ультрафиолетовым облучением;
- его дефицитом в пищевом рационе;
- нарушением всасывания в тонком кишечнике;
- нарушением образования активных метаболитов витамина D в печени, почках;
- повышенным разрушением.
Всасывание витамина D нарушается при недостаточности внешнесекреторной функции поджелудочной железы, энтеритах, целиакии, болезни Крона, неспецифическом язвенном колите, после операций на желудке (гастрэктомия, резекция желудка по Бильрот II), тонком кишечнике (резекция, наложение анастомозов), биллиарных циррозах печени (недостаток солей желчных кислот), стеаторее при поражении печени, желчных фистулах. Метаболизм витамина D нарушается при болезнях печени (нарушается продукция 25-ОН-D3), почек (снижается активность 1α-гидроксилазы), генетически обусловленном дефиците 1α-гидроксилазы, нарушении функции и дефиците рецепторов к 1,25-(ОН)2D3. Развитие остеомаляции наблюдается при синдроме Мак-Кьюна — Олбрайта, опухолях (опухолевая генерализованная остеомаляция).
Недостаток неорганического фосфата может быть обусловлен:
1) пониженной канальцевой реабсорбцией (аутосомная, Х-хромосомная гипофосфатемия, синдром Фанкони, миеломная болезнь, опухоли, амилоидоз, синдром и болезнь Шегрена, метаболический ацидоз);
2) недостаточным поступлением фосфатов с пищей;
3) нарушением всасывания (мальабсорбция, прием антацидов);
4) повышенным выведением (гемодиализ).
Остеомаляция в результате ацидоза развивается при почечном тубулярном ацидозе, синдроме Фанкони, мочеточниково-сигмальной стоме (развивается гиперхлоремический ацидоз). Остеомаляция отмечается при несовершенном остеогенезе, гипофосфатазии (снижении активности ЩФ в циркулирующей крови), несовершенном фиброгенезе костей, «осевой остеомаляции». Несовершенный фиброгенез костей обусловлен дефицитом коллагеновых фибрилл в костях, нарушением их минерализации. Наблюдается у лиц среднего возраста и протекает с рецидивирующими переломами. У пациентов с этой патологией выявлено повышение активности ЩФ в сыворотке крови, нормальный уровень кальция и фосфора (Делягин В.М., Румянцев А., 2001). «Осевая остеомаляция» характеризуется остеомаляцией позвонков, ребер, костей таза (кости черепа и длинные трубчатые кости не изменены). Остеомаляция может быть обусловлена ингибиторами минерализации костной ткани — фторидами, алюминием, бисфосфонатами, приемом некоторых лекарственных препаратов (противосудорожных, противотуберкулезных, кетоконазола). Дифенилгидантоин, фенобарбитал индуцируют ферменты печени, вызывающие усиленное разрушение витамина D и его метаболитов. Подразделение остеомаляции на кальципеническую и фосфатпеническую, по мнению Н.В. Бунчука (1997д), условно, поскольку часто отмечается дефицит обоих минералов. Остеомаляция сопровождается не только нарушением минерализации костей: дефицит метаболитов витамина D и фосфатов обусловливает нарушение процессов синтеза, изменение функции остеобластов и остеоцитов. При морфологических исследованиях у пациентов с остеомаляцией обнаруживают:
1) увеличение остеоида (поверхности, толщины, объема);
2) уменьшение количества зрелой костной ткани;
3) замедление минерализации остеоида (происходит в течение нескольких лет вместо 23 мес);
4) уменьшение количества активных остеобластов.
Для клинических проявлений остеомаляции характерны:
- проявления гипофосфатемической миопатии (мышечная боль, слабость, особенно проксимальных групп мышц, болезненность мышц при пальпации);
- арталгия, периартикулярная болезненность, оссалгия, болезненность при пальпации костей (ребер, таза, дистальных отделов нижних конечностей), боль в поясничном отделе позвоночника;
- деформация костей (кифоз, сколиоз, «куриная» грудь, укорочение туловища, искривление голеней, протрузия вертлюжных впадин, сужение внутреннего диаметра таза, изменение его формы);
- развитие реактивного синовита голеностопных суставов, энтезопатии;
- патологические переломы костей (шейки бедра, плюсны);
- изменение походки («утиная», переваливающаяся);
- сенсорная полинейропатия (результат дефицита кальция и фосфора), проявляющаяся парестезией дистальных отделов конечностей.
При остеомаляции отмечают следующие изменения (Бунчук Н.В., 1997д):
- снижается плотность костей (повышается «прозрачность»);
- изменяется костная структура (становится нерезкой, размытой);
- уменьшается общее число трабекул, они утолщаются, образуют «грубый» костный рисунок;
- появляются очаговые зоны перестройки костной ткани — зоны просветления Лоозера, псевдопереломы (болезнь Милкмена), возникающие в местах пересечения крупных артерий и кости, и полосы просветления, перпендикулярные к краю кости (не распространяются на всю толщину кости);
- обнаруживаются деформации костей (изменение формы таза, протрузия вертлюжных впадин, деформация шеек бедренных костей, искривление диафизов бедренных костей, костей голеней и предплечий, утолщение ребер (в форме четок и плюсневых костей);
- меняется форма тел позвонков (клиновидная деформация в грудном отделе, равномерная двояковогнутость («рыбьи» позвонки) в поясничном отделе).
При Х-ассоциированной гипофосфатемии обнаруживают нетипичные рентгенологические изменения:
- разрастание костной ткани в местах прикрепления связок, сухожилий, капсул, в области позвоночника (имитация синдрома Форестье);
- локальное расширение или сужение щели в области илеосакральных сочленений (имитация сакроилеита).
При аксиальной остеомаляции выявляют повышение МПКТ, «грубый» костный рисунок преимущественно в позвонках шейного отдела.
Диагностика остеомаляции основана на характерных клинических проявлениях (боль в костях; деформации, особенно длинных трубчатых костей и костей таза), выявлении диффузного снижения плотности костей (остеопении), повышенного уровня ЩФ, пониженного уровня кальция и/или фосфора в крови, снижения содержания 25-гидроксивитамина D в сыворотке крови, снижения канальцевой реабсорбции фосфата (повышенного выведения с мочой), выявлении при болезни Милкмена зон просветления Лоозера на рентгенограме, результатах биопсии гребня подвздошной кости (количественного определения минерализации остеоида). Для установления причины остеомаляции требуется глубокое изучение анамнеза, обследование тонкого кишечника (эндоскопия, биопсия, копрограмма, тест с D-ксилозой), изучение функции почечных канальцев, выявление наличия опухолей костей (неоссифицирующая фиброма, гигантоклеточная опухоль, остеобластома) и мягких тканей (гемангиоперицитома, гемангиома, нейрофиброма, гигантоклеточные и мезенхимальные образования). Причиной остеомаляции может быть доброкачественная и злокачественная опухоль, при этом клинические и рентгенологические данные аналогичны остеомаляции другой этиологии. Остеомаляция может возникнуть у лиц пожилого возраста на фоне остеопороза с длительным течением. Следует учитывать, что изменения, похожие на зоны просветления Лоозера, при рентгенографии обнаруживаются у больных с несовершенным остеогенезом, фиброзной дисплазией, при синдроме Кушинга, болезни Педжета. Эти изменения несимметричны и сочетаются с другими костными изменениями (Бунчук Н.В., 1997д).
Нарушение минерализации остеоида характерно и для рахита. Рахит развивается в детском возрасте, а остеомаляция является сходным заболеванием у взрослых (McDermott M.T., 1999а; Маршалл В.Дж., 2002). Для обоих состояний характерно нарушение минерализации остеоида. Из-за недостаточности витамина D или нарушения его всасывания организм недостаточно снабжается кальцием, в результате чего нарушается минерализация кости. «Кальципенический» рахит и остеомаляция могут быть обусловлены нарушением продукции или невосприимчивостью к кальцитриолу. При наследственном витамин D-зависимом рахите I типа отмечают врожденный дефицит почечной 1α-гидроксилазы, причиной которого является мутация гена, кодирующего этот фермент. Дефицит фермента приводит к нарушению образования 1,25-дигидроксивитамина D и, как следствие, недостаточному всасыванию кальция и фосфатов в кишечнике. При рахите II типа (витамин D-независимом рахите) характерна врожденная резистентность к действию кальцитриола. Причиной его является мутация гена, кодирующего рецептор к витамину D. При отсутствии рецептора или его дефекте нарушается всасывание кальция и фосфатов в кишечнике, опосредованное витамином D. Наследование обоих типов заболевания совершается по аутосомно-рецессивному типу. Нарушение минерализации костей может быть обусловлено недостаточным поступлением фосфатов, «утечкой» фосфата в почечных канальцах при синдроме Фанкони, почечном канальцевом ацидозе I типа, изолированном феномене семейного Х-сцепленного гипофосфатемического рахита. При гипофосфатемическом рахите очень низкая концентрация фосфатов в сыворотке крови вследствие избыточной экскреции в канальцах почек, что нарушает процессы минерализации костной ткани. При рахите, как и при остеомаляции, отмечается боль в костях, болезненность при пальпации, деформация скелета (особенно при рахите), патологические переломы, отставание в росте, слабость проксимальных мышц, гипокальциемия (содержание кальция в крови может быть нормальным у 50% больных с недостаточностью витамина D в результате развития вторичного гиперпаратиреоза) (табл. 3.1).
Изменения лабораторных показателей аналогичны таковым при остеомаляции. На рентгенограммах определяются:
- задержка окостенения эпифизов;
- увеличение расстояния между зонами роста;
- неравномерное расширение метафизов;
- истончение кортикального слоя костей;
- редкие, с грубой структурой трабекулы в диафизах длинных костей.
При изучении биоптатов кости обнаруживается избыточное накопление остеоида с нарушением минерализации. С лечебной целью при рахите и остеомаляции применяют витамин D, его активные метаболиты (кальцитриол), а также препараты кальция и фосфаты.
К факторам риска развития остеопороза относят:
- Генетические:
- Генетическая предрасположенность.
- Европеоидная и монголоидная раса.
- Женский пол.
- Дефицит массы тела (низкий пик костной массы).
- Пожилой и старческий возраст.
- Гормональные:
- Позднее менархе (появление первой менструации).
- Нерегулярные менструации, бесплодие.
- Ранняя (преждевременная) менопауза, удаление яичников до наступления менопаузы.
- Менопауза.
- Две и более беременностей.
- Продолжительное (более 68 мес) грудное вскармливание.
- Факторы риска, связанные с питанием:
- Недостаток кальция в рационе.
- Дефицит микроэлементов в пище.
- Высокое потребление белка с пищей.
- Дефицит витамина D в рационе.
- Повышенное употребление с пищей клетчатки и жиров.
- Повышенное потребление кофе.
- Факторы риска, связанные с образом жизни:
- Гипокинезия.
- Чрезмерная физическая нагрузка.
- Курение.
- Злоупотребление алкоголем.
- Сопутствующие заболевания.
- Влияние токсических веществ, радионуклидов, длительный прием медикаментов.
Более склонны к развитию остеопороза представители европеоидной и монголоидной расы. У лиц мужского пола негроидной расы костная масса на 5%, у лиц женского пола — на 6% больше, чем у представителей европеоидной расы (Окороков А.Н., 2000). К факторам риска развития остеопороза относят проживание в условиях повышенной инсоляции, в регионах с большим количеством солнечных дней (Felsenberg D. et al., 1998), влияние радиации, позднее менархе, раннюю менопаузу, длительный постменопаузальный период (Cosman F. et al., 1988), наличие в анамнезе гистерэктомии (Silverman S.L. et al., 1998), генетическую предрасположенность (Suzuki T. et. al., 1998), наличие переломов в семейном анамнезе. Развитие остеопороза обусловливает гипогонадизм, позднее менархе, нерегулярность менструации, бесплодие, удаление яичников до наступления менопаузы. Кормящие матери за период вскармливания ребенка теряют 2–6% костной массы. Из-за возникающей гипокальциемии развивается вторичный гиперпаратиреоз. Повторные беременности ускоряют развитие остеопороза. Максимальная костная масса обусловлена генетически и 70% случаев отклонений возрастных пиков костной массы объясняют генетическими факторами. При малой костной массе риск развития остеопороза повышен и остеопороз может развиваться у нескольких поколений. Малая костная масса может быть обусловлена передающейся по наследству мутацией генов, влиянием различных факторов, в том числе радиации, химических веществ. Малая масса тела (менее 58 кг) обусловливает развитие остеопороза, особенно в постменопаузальный период. На развитие остеопороза оказывают негативное влияние факторы окружающей среды в пренатальный и ранний постнатальный период. Масса тела новорожденного определяет величину костной массы в зрелом возрасте. Потеря костной ткани наблюдается с возрастом человека начиная с 35–40 лет. Курение повышает риск возникновения переломов шейки бедренной кости в 3 раза. Злоупотребление алкоголем и курение являются факторами снижения МПКТ.
В.Дж. Маршалл (2002) отмечает следующие причины остеопороза:
- возрастные (особенно в постменопаузальный период);
- эндокринные (ранняя недостаточность яичников), тиреотоксикоз, синдром Кушинга, сахарный диабет, гипогонадизм);
- прием некоторых лекарственных и других препаратов (длительное применение гепарина натрия, ГК, алкоголизм);
- прочие (иммобилизация, нарушение всасывания кальция, состояние невесомости).
В МКБ-10 в классе XIII «Болезни костно-мышечной системы и соединительной ткани» (М00–М99) имеется блок (М80–М94) «Остеопатии и хондропатии» с подразделом (М80–М85) «Нарушения плотности и структуры кости»:
М80 — остеопороз с патологическим переломом (включены остеопоротическое разрушение и заклинивание позвонка);
М80.0 — постменопаузальный остеопороз с патологическим переломом;
М80.1 — остеопороз с патологическим переломом после удаления яичников;
М80.2 — остеопороз с патологическим переломом, вызванный обездвиженностью;
М80.3 — постхирургический остеопороз с патологическим переломом, вызванный нарушением всасывания в кишечнике;
М80.4 — лекарственный остеопороз с патологическим переломом (при необходимости идентифицировать лекарственное средство используют дополнительный код внешних причин, класс XX);
М80.5 — идиопатический остеопороз с патологическим переломом;
М80.8 — другой остеопороз с патологическим переломом;
М80.9 — остеопороз с патологическим переломом неуточненный;
М81 — остеопороз без патологического перелома;
М81.0 — постменопаузальный остеопороз;
М81.1 — остеопороз после удаления яичников;
М81.2 — остеопороз, вызванный обездвиженностью;
М81.3 — постхирургический остеопороз, вызванный нарушением всасывания;
М81.4 — лекарственный остеопороз (при необходимости идентифицировать лекарственное средство используют дополнительный код внешних причин, класс XX);
М81.5 — идиопатический остеопороз;
М81.6 — локализованный остеопороз (Лекена);
М81.8 — другие остеопорозы (старческий остеопороз);
М81.9 — остеопороз неуточненный;
М82 — остеопороз при болезнях, классифицированных в других рубриках;
М82.0 — остеопороз при множественном миеломатозе (С90.0);
М82.1 — остеопороз при эндокринных болезнях (Е00Е34);
М82.8 — остеопороз при других болезнях, классифицированных в других рубриках; М83 — остеомаляция у взрослых (исключены: остеомаляция детская и юношеская (Е55.0); витамин-D-резистентная остеомаляция (Е83.3); почечная остеодистрофия (N25.0); рахит (активный) (Е55.0); последствия рахита (Е64.3); витамин-D-резистентный рахит (Е83.3)).
М83.0 — послеродовая остеомаляция;
М83.1 — старческая остеомаляция;
М83.2 — остеомаляция вследствие нарушения всасывания (постхирургическая остеомаляция у взрослых вследствие нарушения всасывания);
М83.3 — остеомаляция у взрослых вследствие недостаточности питания;
М83.4 — костная болезнь, связанная с алюминием;
М83.5 — другие лекарственные остеомаляции у взрослых (при необходимости идентифицировать лекарственное средство используют дополнительный код внешних причин, класс XX);
М83.8 — другая остеомаляция у взрослых;
М83.9 — остеомаляция у взрослых неуточненная.
Остеопороз подразделяют на первичный и вторичный. К первичному остеопорозу относят идиопатический юношеский остеопороз, идиопатический остеопороз у лиц молодого возраста, инволюционный остеопороз (I тип — постменопаузальный, II тип — сенильный). Термин «первичный остеопороз» применяется по отношению к тем случаям остеопороза, когда неизвестны причины его развития. Вторичный остеопороз развивается на фоне большого числа заболеваний и действия различных факторов. Остеопороз подразделяют на локальный и системный. Имеются экспериментальные модели локального и системного остеопороза — сенильного, алиментарного, гормонального, иммобилизационного, при различных заболеваниях.
Существующие классификации, прежде всего, выделяют доминирующие причины остеопороза, на которых следует концентрировать внимание и усилия ученых и медиков. Большое внимание, уделяемое постменопаузальному остеопорозу, обусловлено его значительной долей (вместе с сенильным он составляет 80% случаев остеопороза), диагностированием его у миллионов женщин в нашей стране, медико-социальными последствиями, которые по масштабам не сравнимы с таковыми, обусловленными остеопорозом и другими причинами. Как отмечено выше, к первичному остеопорозу большинство специалистов относят возрастзависимый (инволюционный). Термин «инволюционный» не совсем корректный, поскольку слово «инволюция» означает обратное развитие и не отражает сущности метаболических процессов, происходящих в кости с возрастом. Как постменопаузальный, так и сенильный остеопороз относятся к возрастзависимому остеопорозу. Возрастзависимый (инволюционный) остеопороз генетически обусловлен (развивается в соответствии с генетической программой, у 100% людей в возрасте старше 75 лет выявляют его проявления). Инволюционные (возрастные) процессы в костной ткани начинаются у женщин в возрасте старше 35 лет, у мужчин — старше 40. Женское население Украины достигает пика костной массы в 23–24 года, мужское — в 25–26 лет (Поворознюк В.В., Григорьева Н.В., 2002). По мнению Е.Е. Михайлова и Л.И Беневоленской (1997), пик массы костной ткани достигается к 30–40 годам. До этого происходит увеличние костной массы, затем отмечается период стабилизации, вслед за которым постепенно развивается «физиологическая» остеопения — уменьшение массы костной ткани, обусловленное возрастом. Что же касается идиопатического ювенильного остеопороза (диагностируется в единичных случаях), идиопатического остеопороза взрослых, причины их развития остаются неустановленными. В большинстве случаев, действительно, остеопороз является клиническим синдромом, обусловленным многочисленными причинами. В некоторых случаях (например, идиопатический ювенильный остеопороз, остеопороз в период беременности и кормления грудью, др.) он может носить транзиторный характер. Классификации вторичного остеопороза включают перечисление заболеваний, состояний, лекарственных средств, различных других факторов, приводящих к уменьшению костной массы. Назрела необходимость в создании классификации вторичного остеопороза, основанной на выделении патогенетических механизмов потери костной ткани.
К факторам риска, приводящим к развитию генерализованного остеопороза у детей, J.A. Kanis (1994) относит трисомию по 13–15, 18-й хромосоме, дисгенез гонад, врожденные заболевания сердца, болезнь Стилла, мукополисахаридоз, нейромышечные заболевания и дистрофии, семейную вегетативную дисфункцию (синдром Райли — Дея), интолерантность к лизину, псевдоглиому, алкаптонурию (охроноз), туберкулез. К группам риска по развитию остеопении и остеопороза А.П. Крись-Пугач и соавторы (2002) относят детей, проживающих в районах с повышенным уровнем радиационной активности, концентрацией предприятий металлургической и химической промышленности, а также с врожденной патологией пищеварительного тракта, нарушениями функции печени, кишечника, почек.
3.2. Первичный остеопороз
3.2.1. Ювенильный остеопороз
Наиболее интенсивное увеличение костной массы у детей отмечается в возрасте 10–14 лет и составляет 78% в год (Поворознюк В.В. и соавт., 2001). Возраст 10–15 лет авторы считают критическим для формирования костной ткани (наряду с периодом раннего пре- и постнатального онтогенеза). В возрасте до 1 года и в 9–11 лет выявляют самый высокий уровень положительного кальциевого баланса. МПКМ у девушек в возрасте 17 лет составляет 93% максимальной для женщин, у юношей — 86% максимальной у мужчин. А.П. Крись-Пугач и соавторы (2002) считают, что нарушения минерального обмена у детей легко возникают в периоды интенсивного роста и формирования скелета: в первые годы жизни, во время первого (5–7 лет) и второго (11–15 лет) периодов интенсивного роста, в период полового созревания.
Ювенильный идиопатический остеопороз отмечают в препубертатном возрасте и, прежде всего, у быстрорастущих детей. Случаи ювенильного остеопороза редки, их выявляют у лиц в возрасте от 1,5 лет до 21 года (Norman M.E., 1993) чаще в возрасте 10–11 лет. Как отмечает автор, с 1939 по 1991 год было описано всего 60 случаев заболевания ювенильным остеопорозом (к настоящему времени описано около 100 случаев). Заболевание продолжается 24 года и сопровождается задержкой роста. У пациентов обнаруживают отрицательный кальциевый баланс (он становится положительным при применении витамина D), снижение секреции кальцитонина, дефицит 1,25-(ОН)2D3. Уровень сывороточного ПТГ не повышается, что дает основание считать выявленные биохимические изменения вторичными по отношению к уменьшению костной массы. У пациентов обнаруживают как ускоренную резорбцию костной ткани, так и снижение костеобразования. Содержание кальция и фосфора в сыворотке крови нормальное, а гидроксипролина и ЩФ в моче — повышается. При внешнем осмотре у больных не всегда обнаруживают отклонения от нормы. Поражаются аксиальные и периферические отделы скелета. При умеренном остеопорозе имеется компрессия 12 позвонков, при выраженном — деформация всех позвонков грудного и поясничного отделов. Характерными являются кифоз, кифосколиоз, «куриная» грудь. Возможны инвалидизирующие деформации конечностей и грудной клетки, смерть от легочной недостаточности. Остеопороз имеет диффузный характер, развиваются переломы тел позвонков, костей конечностей в метафизарных областях (чаще дистального отдела большеберцовой кости), характерны боль в спине, бедрах, голенях, стопах. Ювенильный остеопороз необходимо дифференцировать с несовершенным остеогенезом (табл. 3.2). Причиной развития несовершенного остеогенеза (osteogenesis imperfecta — врожденная ломкость костей) является мутация одного или двух генов, кодирующих проколлаген I типа. В результате этого остеобласты вырабатывают аномальный остеоид, что обусловливает развитие остеопороза, повышенную ломкость костей. Имеется четыре типа заболевания, которые отличаются различной степенью тяжести. По мнению J.K. Jenkins (1999а, б), это группа заболеваний со сходными клиническими проявлениями различной степени тяжести, с предположительно одинаковой этиологией, но разными типами наследования). При несовершенном остеогенезе у новорожденных быстро наступает смерть. У взрослых заболевание может протекать в легкой форме. У больных отмечается тугоухость, голубые склеры (склера при снижении содержания в ней коллагена приобретает голубоватый оттенок), несовершенный дентиногенез. В соответствии с классификацией Силленса клинические виды несовершенного остеогенеза подразделяют на четыре типа по степени тяжести (Jenkins J.K., 1999а, б). Для I типа (легкого течения) характерна хрупкость костей с умеренным количеством переломов, голубые склеры. Переломы иногда приводят к искривлению длинных трубчатых костей. При II типе (обычно летальном) отмечается множество переломов во внутриутробный период и высокая смертность в период новорожденности. При III типе (тяжелом, деформирующем) имеются многочисленные деформации скелета, ломкость костей, сколиоз, разболтанность суставов с большим количеством переломов. Склеры серые или голубые, МПКТ снижена. При IV типе (средней степени тяжести) также отмечается снижение МПКТ, большое количество переломов, деформация костей, в том числе червеобразное искривление длинных трубчатых костей, нормальные белые или серые склеры. I, II, IV типы наследуются аутосомно-доминантно, III — аутосомно-рецессивно. Глухота отмечается при I и IV типах, аномалии тканей зубов — при I, III, IV. Лечение включает симптоматическую терапию, ортопедические и реабилитационные мероприятия.
Для ювенильного остеопороза характерна спонтанно наступающая ремиссия с дальнейшим постепенным восстановлением нормального роста костей. С лечебной целью для предотвращения деформации позвоночника до наступления ремиссии используют бисфосфонаты, кальцитриол, фторид натрия. У взрослых, перенесших ювенильный остеопороз, на рентгенограммах в нормальной кости обнаруживают порозные тени. Может оставаться кифоз, укорочение туловища, деформации костей в результате перенесенных переломов.
При синдроме Шоу — Рида (osteogenesis exhausta) имеются генерализованные прогрессирующие нарушения развития костей у подростков: сморщивание тел позвонков, фрагментация костей таза, множественные переломы. Нередко наступает спонтанная ремиссия с заживлением переломов, в крови биохимические изменения не обнаруживаются.
Для синдрома Дента — Фридмана — идиопатического ювенильного остеопороза, наследуемого по аутосомно-рецессивному типу, характерен развивающийся в детстве выраженный системный остеопороз, голубоватые склеры. Имеются другие признаки, характерные для несовершенного остеогенеза, нередко отмечают аминоацидурию, гипоурицемию (Лазовских И.Р., 1981).
Ювенильный остеопороз необходимо дифференцировать с различными заболеваниями, в том числе с цистинозом, гликогенозом, галактоземией, эозинофильной гранулемой (Крись-Пугач А.П. и соавт., 2002).
3.2.2. Идиопатический остеопороз людей молодого возраста
Развивается у лиц молодого возраста чаще, чем идиопатический ювенильный остеопороз. Этиология заболевания окончательно не установлена (предполагается гетерогенная этиология этой формы остеопороза). Выявляют в одинаковой мере у женщин и мужчин в возрасте от 20 до 44 лет с частотой 0,4 на 100 тыс. населения (Khosla S. et al., 2000а). Частыми проявлениями заболевания являются множественные переломы позвонков. Они возникают через 5–10 лет течения болезни и сопровождаются значительным снижением роста. Отмечаются переломы ребер, плюсневых костей, проксимальных отделов бедер. Возможны смертельные исходы из-за развития дыхательной недостаточности. При обследовании часто выявляют гиперкальциурию, показатели сывороточного кальция, фосфора и ЩФ остаются в норме. У большинства пациентов снижаются показатели формирования костной ткани. В ряде случаев отмечено повышение костной резорбции с угнетением или усилением костного формирования. В результате нарушения функции остеобластов (в них снижается синтез ДНК) уменьшается объем трабекулярной костной ткани, толщина кортикального слоя и средняя толщина костной стенки. У больных отмечается низкий уровень ИПФР-1 в плазме крови, возрастает выделение моноцитами крови ИЛ-1. Предполагается наличие первичного дефекта в локальной регуляции функции костных клеток. Некоторые пациенты, возможно, в период роста не набрали необходимой костной массы или имеют генетическую предрасположенность для низкого пика костной массы.
Диагноз «идиопатический остеопороз» устанавливают после исключения врожденных заболеваний скелета, вторичного остеопороза.
3.2.3. Возрастзависимый (инволюционный) остеопороз
Развивается в средине жизни у мужчин и женщин в результате естественного уменьшения костной массы по мере старения человека (Маршалл В. Дж., 2002). При этом теряется около 1% костной массы ежегодно. Основу развития составляет относительное снижение активности остеобластов по сравнению с активностью остеокластов в процессе ремоделирования кости. Результатом является уменьшение количества трабекул, истончение коркового слоя. После достижения пика костной массы компактная кость сохраняется на достигнутом уровне до 40 лет (Окороков А.Н., 2000). В последующем происходит ежегодное уменьшение компактной костной массы у мужчин на 0,4%, у женщин — на 0,9–1,1%. К возрасту 90 лет потеря компактной костной массы составляет 18,9% у мужчин, 32,4% — у женщин. Потеря губчатого вещества, по мнению автора, начинается с возраста 20–30 лет и ежегодно составляет 1% у лиц обоего пола. К 70 годам общая потеря губчатого вещества составляет 35–40%. По данным E.S. Orwoll и соавторов (1989), у мужчин (начиная с возраста 30 лет) ежегодно теряется около 1% минерального компонента в лучевой кости и более 2% в позвоночнике. Более выраженную возрастную потерю компактного вещества отмечают у женщин. Она особенно значительна после достижения менопаузы. 50 лет рассматривают как возрастной пик, после которого наблюдается ускоренное развитие остеопороза. При преждевременной менопаузе ускоренная потеря костной массы начинается раньше. S. Khosla et al. (2000б) также выделяют две фазы в процессе уменьшения костной массы: медленную, которая развивается у представителей обоих полов и связана с возрастом, и быструю, которая наблюдается у женщин в постменопаузальный период (реже у мужчин с гипогонадизмом). Медленная фаза, по мнению авторов, начинается в 35 лет и продолжается до пожилого возраста. Она протекает с одинаковой скоростью у мужчин и женщин, сопровождается уменьшением сходного количества массы кортикальной и трабекулярной кости. У женщин, кроме этого медленного, связанного с возрастом, снижения, в период менопаузы ускоряется потеря костной массы.
Развитие остеопороза с возрастом является общебиологическим процессом, который отмечают у животных различных видов (Фролькис В.В. и соавт., 2004). Выраженные инволюционные трофические нарушения в костях наблюдают у долгоживущих животных. Остеопороз у человека является возрастзависимой патологией наряду с атеросклерозом, сахарным диабетом, раком, болезнью Альцгеймера — заболеваниями, которые чаще возникают в пожилом возрасте. Возрастзависимый остеопороз В.В. Фролькис (1997) относит к хронобиологическим изменениям. В.В. Фролькис и В.В. Поворознюк (1999) выдвинули регуляторную гипотезу развития возрастного остеопороза: экстраоссальные и интраоссальные механизмы нарушения регуляции кости являются основой развития остеопороза. Важными факторами развития возрастного остеопороза являются:
- ослабление нервного, нейротрофического контроля;
- возрастные изменения в гормональной регуляции;
- изменения с возрастом соотношения в синтезе кальцитонина и ПТГ;
- хронический стресс.
Изменения, наступающие при старении, по мнению В.В. Фролькиса (1995), напоминают изменения при стрессе: повышается уровень АКТГ, кортизола, снижается продукция половых гормонов. Остеопороз является одним из проявлений стресс-возраст-синдрома. Костная ткань реагирует на изменения регуляторных механизмов, при этом важнейшим механизмом развития возрастного остеопороза являются генорегуляторные изменения: первичные механизмы старения связаны с изменениями в регуляторных генах. Эти изменения обусловливают изменение транскрипции и синтеза белков, развитие патологических процессов (возрастные и патологические процессы, по мнению автора, разделить чрезвычайно сложно). Генорегуляторные механизмы лежат в основе изменений при возрастном остеопорозе, в том числе функции остеобластов, синтеза коллагена (изменяется синтез полипептидных цепей, их расположение, появляются коллагены других типов, нарушается минерализация костной ткани). С возрастом нарушается регуляция кальциевого гомеостаза клеток, повышается содержание внутриклеточного кальция, что приводит к старению клеток. Опосредованно через гены при старении изменяется структура плазматических мембран (из них формируются матриксные пузырьки). Генорегуляторные изменения определяют изменения в соотношении клеточного и межклеточного вещества, процессах минерализации.
Е.П. Подрушняк (1987; 2002) также считает возрастзависимый остеопороз следствием биологического старения человека. По его мнению, если остеопороз развился без видимой причины исподволь на протяжении длительного времени в результате старения костной ткани, то его появление следует трактовать как возрастной физиологический процесс (не зависимо от степени выраженности и клинических проявлений). Возникновение остеопоротических изменений в кости в результате экзогенного или эндогенного воздействия известного фактора является патологией. Остеопороз во второй половине жизни определяется как возрастными, так и патологическими факторами. Костная масса человека в возрасте старше 30–35 лет постепенно снижается. Как отмечает автор, рарефикация костей выявляется у 50% населения в возрасте до 50 лет, у лиц пожилого возраста — у 80%, у долгожителей — у 100%. С возрастом снижается минеральная насыщенность трабекулярной ткани. Протеинсинтезирующая способность остеобластов снижается пропорционально возрасту, причем остеоклазия остается активной, нормальной или незначительно сниженной. С возрастом снижается скорость минерализации остеоидной ткани, генерируются остеоидные зоны, не покрытые активными остеобластами (Шуцяну Ш. и соавт., 1983). Снижение остеобластического костеобразования, ассоциированное с сокращением минерализации остеоидной ткани, со временем обусловливает развитие остеопороза даже при нормальной или слегка сниженной остеокластической резорбции. При старении выявляют изменения капиллярной сети и кровообращения в области периоста, коркового вещества кости. В каналах остеона капилляры запустевают, исчезают (Подрушняк Е.П., 1987). Одним из факторов возникновения остеопороза может быть стаз кровообращения в костном мозге и надкостнице. Костная система и другие органы и системы организма функционально взаимосвязаны. Ухудшение их функционирования с возрастом, по мнению автора, сказывается на структурном и функциональном состоянии костной ткани. Костная ткань может быть маркером степени старения организма, имеющейся скрытой декомпенсации минерального гомеостаза, степени понижения жизнеспособности организма. В возрасте старше 40 лет костная масса ежегодно снижается на 1,3% (у мужчин после 60 лет ее остается около 70% нормы, у женщин — 60%). В то же время снижаются прочностные характеристики. Для клинических проявлений характерно наличие боли ноющего характера, прежде всего, в области грудного отдела позвоночника (вдоль позвоночника). Возможно развитие компрессионных переломов, появление острой боли. При рентгенологическом исследовании отмечается разрежение трабекул, их истончение, прерывание, исчезновение, появление просветлений. Разволокняется, истончается кортикальный слой, развивается деминерализация костных структур, появляются просветления и кисты. Изменение структуры костей носит системный характер. Кроме особенностей клинических проявлений, структурно-функциональных изменений, к признакам возрастного остеопороза Е.П. Подрушняк (1987) относит симптомы «пупка» (двойное кольцо просветления) остистых отростков шейных позвонков, «воронки» тел позвонков (участки треугольной формы, лишенные костных трабекул), симптом «веко» вертлужной впадины и синдром «пяточная шпора». «Рыбьи» позвонки, по мнению автора, не характерны для возрастного остеопороза. Для этой формы остеопороза характерно возникновение переломов (при незначительных травмах, физических перегрузках ThVIThVII, шейки бедренной кости, дистальной части лучевой кости, реже — шейного и поясничного отделов позвоночника). Автор отмечает, что возрастной и каузальный факторы тесно переплетаются и их довольно трудно различать. Такая дифференциация необходима, поскольку от ее результатов зависят лечебная и профилактическая тактика.
3.2.3.1. Постменопаузальный остеопороз (I тип)
Как отмечалось выше, B.L. Riggs и L.I.III Melton (1986) выделяют два типа инволюционного остеопороза: I тип — постменопаузальный, II тип — сенильный. Инволюционные (возрастные) изменения в костях у женщин начинаются после достижения 35 лет, у мужчин — 40, но они резко усиливаются после выпадения остеотропной функции половых гормонов, то есть в постменопаузальный период и в старческом возрасте. Распространение инволюционного остеопороза приняло характер «тихой эпидемии». Учитывая старение населения, снижение физической активности по мере индустриального прогресса, актуальность проблемы будет возрастать. В европейских странах болеет остеопорозом 11–12% населения. В анамнезе почти каждой третьей женщины в возрасте старше 65 лет, у 40% женщин, достигших 70 лет, и 50% населения в возрасте старше 75 лет — минимум один перелом. Риск остеопоротических переломов в возрасте 50 лет в среднем составляет 39,7% для женщин и 13,1% — для мужчин (Kanis J.A., Pitt F.A., 1992; Melton L.J., 1993; 1995), риск перелома бедра для женщин — 17,5%, тел позвонков —15,6%, дистального отдела предплечья — 16%; для мужчин соответственно — 6; 5; 2,5% (Kanis J.A., 1993). Остеопоротические переломы влияют на уровень заболеваемости и смертности. В результате переломов бедра предполагаемая средняя продолжительность жизни снижается на 12–15 лет (Kanis J.A., 1993). Более 30% больных с этими переломами нуждаются в уходе, 50% самостоятельно не передвигаются. Смертность в результате осложнений, возникающих при остеопоротических переломах шейки бедра у белых женщин в возрасте 50 лет и старше, достигает 2,8%.
В 1995 г. в Украине женщины составили 53% населения (Поворознюк В.В., 1997). На 1 января 1995 г. люди в возрасте старше 55 лет составили 25,6% населения, старше 60 — 18,4% (из них 12,4% женщины). В 1996 г. средняя продолжительность жизни женщин составила 72,7 года, мужчин — 61,2 года. В возрасте 26 лет соотношение численности женщин и мужчин составляет 1:1, в 65–70 лет — 2:1. На 1 января 1995 г. женщины в возрасте старше 50 лет составили 35,3% женского населения, 18,9% всего населения. У большинства женщин Украины 1/3 продолжительности жизни приходится на постменопаузальный период (Поворознюк В.В. и соавт., 1997). В.В. Поворознюк (1998) называет следующие факторы риска развития инволюционного остеопороза:
- женский пол;
- возраст;
- первичная аменорея;
- вторичная аменорея;
- ановуляторные менструальные циклы;
- ранняя менопауза: идиопатическая, после овариоэктомии;
- продолжительная иммобилизация и неподвижность;
- принадлежность к европеоидной и монголоидной расе;
- курение;
- злоупотребление алкоголем;
- гиподинамия;
- анорексия или булемия;
- алиментарные факторы (недостаточное употребление кальция, злоупотребление кофеином, употребление в большом количестве белков, «грубой» пищи);
- применение некоторых лекарственных препаратов (КС, антиконвульсантов, длительный прием препаратов гепарина, тироксина, антацидных средств, содержащих алюминий);
- некоторые заболевания (эндокринные нарушения, заболевания почек и пищеварительного тракта и др.);
- низкий индекс массы тела (ИМТ ниже 19);
- наличие остеопороза и остеопоротических переломов у родителей;
- рано выявленная хрупкость костей;
- невысокий рост и тонкие кости.
Постменопаузальный остеопороз развивается в первые 1020 лет после менопаузы. Клинические проявления при этом отмечаются у 510% женщин. Уменьшение массы костной ткани (по данным количественной компьютерной томографии) выявляется уже через 612 мес после наступления менопаузы, в течение первых 46 лет ежегодно теряется 3% костной ткани, затем — около 1% в год (Михайлов Е.Е., Беневоленская Л.И., 1997). Авторы отмечают два основных типа изменения метаболизма костной ткани:
1) ускоренный (усиление резорбции не компенсируется нормальным костеобразованием);
2) сниженный (процесс резорбции нормальный, а процесс костеобразования снижен).
Эти два типа изменения метаболизма M.T. McDermott (1999а) называет высокооборотным и низкооборотным остеопорозом. Высокооборотный остеопороз проявляется быстрым исчезновением костной ткани вследствие значительной скорости костной резорбции в сочетании с нормальным или умеренно повышенным костеобразованием. Эта форма, по мнению автора, отмечается менее чем в 30% всех случаев остеопороза, обычно в первые годы после менопаузы. При этом экскреция с мочой поперечных цепей пиридинолина и концентрация в сыворотке крови остеокальцина повышены или в норме. Лечение следует проводить антирезорбтивными средствами. Более чем через 10 лет после менопаузы возникает низкооборотный остеопороз, для которого характерна низкая скорость костной резорбции и еще более низкая скорость образования новой костной ткани. Отмечается тенденция к снижению экскреции поперечных цепей пиридинолина и остеокальцина. Лечение следует проводить средствами, стимулирующими костеобразование.
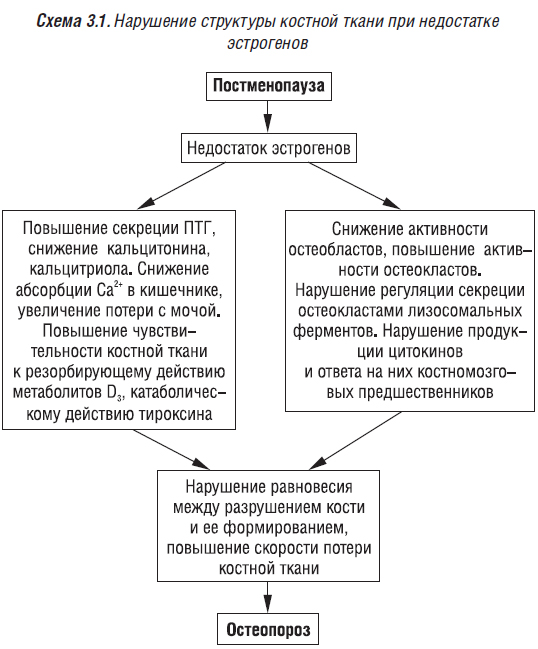
У женщин в репродуктивном возрасте эстрогены синтезируются в основном в яичниках (вне яичников из тестостерона синтезируется около 10% эстрадиола). Около 50% эстрона синтезируется в яичниках, остальная часть — вне яичников из эстрадиола. (Эстрион — низкоактивный метаболит эстрадиола и эстрона). В постменопаузальный период эстрогены синтезируются в яичниках, надпочечниках, экстрагландулярно в результате превращения предшественников эстрогенов. Нарушается циркадный ритм секреции эстрадиола, его уровень снижается в среднем на 30%. Уровень эстрона превышает показатель эстрадиола в 2–3 раза, оставаясь в целом ниже уровня его секреции в репродуктивный период. Эстрадиол образуется в результате превращения эстрона (в большей степени), тестостерона, андростендиона. Тестостерон и андростендион имеют смешанное яичниково-надпочечниковое происхождение. В постменопаузальный период в яичниках секретируются преимущественно андрогены — тестостерон, андростендион, дегидроэпиандростерон (в меньшей мере). Но уровень их метаболизма значительно (на 10–20%) снижен по сравнению с пременопаузой. Основным эстрогеном в постменопаузальный период является эстрон (в жировой ткани в него конвертируются андрогены). После развития менопаузы эстрогены образуются исключительно в процессе метаболизма надпочечниковых андрогенов, поэтому их содержание в плазме крови снижается до очень низких значений. 60% эстрогенов в плазме крови связаны с альбумином, 40% — с глобулином, связывающим половые гормоны (ГСПГ). У лиц обоего пола результатом повышения концентрации ГСПГ является усиление эффектов эстрогенов, а снижение концентрации ГСПГ обусловливает усиление андрогенных эффектов. Эстрогены стимулируют синтез ГСПГ, тироксинсвязывающего глобулина и транскортина, повышая концентрацию общего тироксина и общего кортизола в плазме крови. Эстрадиол в невысоких концентрациях присутствует в плазме крови у мужчин. 1/3 его секретируется яичками, 2/3 образуется в результате метаболизма тестостерона в печени и жировой ткани. Прогрессирующая недостаточность функции яичников в течение климактерического периода приводит к прекращению менструаций. Менопауза — последний менструальный период. Дефицит эстрогенов является основным фактором развития постменопаузального остеопороза.
Клетки-мишени к эстрогенным гормонам имеются в костной ткани, тканях суставов, межпозвонковых дисков (дефицит эстрогенов обусловливает развитие остеопороза, остеохондроза, остеоартроза). В опорно-двигательном аппарате к клеткам-мишеням относятся остеобласты, остеобластоподобные клетки, остеоциты, остеокласты, костные эндотелиальные клетки, синовиоциты, хондроциты, фибробласты, синовиальный эпителий, стенки сосудов суставов, волокна коллагена I типа. Наличие рецепторов эстрогенов на остеобластах свидетельствует о прямом их действии на костную ткань (Eriksen E.F. et al., 1988; Komm B.S. et al., 1988). Специфические рецепторы имеются не только в структурах репродуктивной системы, но и в других органах и системах: сердечно-сосудистой, пищеварительной, центральной нервной системе, в коже и ее придатках, слизистых оболочках, мочеполовой системе и т.д.). Это объясняет многообразие клинических проявлений в результате удаления гонад, в постменопаузальный период.
После связывания молекулы гормона с цитозольным рецептором и образования комплекса «стероид — рецептор» последний транслоцируется в ядро клетки, где образуется комплекс с ядерным белковым рецептором. Хроматин, с которым связывается комплекс, регулирует транскрипцию матричной РНК, принимающей участие в синтезе белка. Имеется два типа эстрогенных рецепторов — α (локализуются в ядре клетки) и β. В тканях центральной нервной и сердечно-сосудистой системы, молочных желез представлены оба типа рецепторов; в костной системе, кишечнике, легких — β-, в печени — α-рецепторы.
Дефицит эстрогенов в постменопаузальный период сопровождается нарушением секреции ПТГ, кальцитонина, кальцитриола, снижением абсорбции кальция в кишечнике, увеличением его потери в результате выведения с мочой. Эстрогены повышают содержание кальцитонина в случаях его снижения (Deftos L.I. et al., 1980). Прогрессирующим снижением МПКТ сопровождается ранняя овариоэктомия. После развития менопаузы повышается скорость потери костной ткани, обусловленная дефицитом эстрогенов (эстрогены снижают остеокластическую резорбцию кости, хотя молекулярные механизмы этого действия не установлены). Эстрогены действуют на костную ткань непосредственно (через специфические рецепторы), а также через локальные медиаторы, другие системные гормоны (ПТГ, кальцитонин и т.д.). Так, на остеокласты они действуют прямо и опосредованно и снижают продукцию лизосомальных ферментов, интенсивность резорбции. Эстрогены влияют на предшественников остеокластов, которые, в свою очередь, через продукцию цитокинов определяют активность остеокластов. Предшественники остеокластов стимулируют остеокласты с помощью продукции ИЛ, ФНО, колониестимулирующего фактора и угнетают, вырабатывая ТФР-β, ИФН, ИЛ. Эстрогены стимулируют продукцию ТФР-β и снижают синтез ИЛ-6. Повышение скорости потери костной ткани при наступлении менопаузы и кастрации обусловлено нарушением продукции цитокинов и ответа на них костномозговых предшественников. Увеличивается уровень ИЛ-6, который стимулирует остеокластогенез через остеобласты, а также оказывает прямое действие на остеокласты. Нарушению равновесия между разрушением кости и ее формированием способствует усиление апоптоза остеоцитов. В период менопаузы продукция цитокинов в костной ткани повышается. Считают, что при этом предшественники остеокластов в большей мере ответственны за усиление резорбции, чем дефицит эстрогенов. Локальные факторы действуют на разные звенья пролиферации и дифференциации остеокластов. Так, пролиферации и дифференциации клеток — предшественников остеокластов способствуют ИЛ-6, М-КСФ, нуклеарный фактор каппа В. Активации остеокластов способствуют ИЛ-1, ФНО-α, апоптозу и гибели остеокластов — ТФР-β, ингибируют этот процесс ИЛ-1, -6, М-КСФ.
В результате прямого действия эстрогены снижают резорбцию костной ткани, повышают активность остеобластов и формирование костной ткани (этот аспект действия изучен недостаточно). Они способствуют отложению кальция в костной ткани, снижают его выделение с мочой через кишечник. При этом экзогенные эстрогены действуют более активно, чем эндогенные. Дефицит эстрогенов сопровождается снижением экскреции кальцитонина и, наоборот, назначение эстрогенов приводит к повышению концентрации кальцитонина в результате прямого действия на щитовидную железу. Косвенно (через кальцитонин) эстрогены снижают уровень ПТГ, таким образом уменьшая абсорбцию кальция в кишечнике и реабсорбцию в почках. Эстрогены, активируя 1α-гидроксилазу, усиливают синтез кальцитриола (1,25-(ОН)2D3) в почках. Их дефицит приводит к снижению синтеза активного метаболита витамина D и абсорбции кальция в кишечнике (Castillo L. et al., 1977). Эстрогены замедляют резорбцию кости, стимулированную ПТГ, снижают коллагеназную активность макрофагов (Raiz L.G., 1988). Андрогены угнетают активность 24-гидроксилазы 25-гидроксихолекальциферола. Они оказывают прямое анаболическое действие на костную ткань. Эстрогены также снижают чувствительность костной ткани к резорбирующему действию активных метаболитов витамина D3, снижают катаболическое действие тироксина за счет усиления синтеза тиреоглобулина.
Потерю костной ткани предотвращает прогестерон, конкурирующий с КС за их рецепторы. Предполагают, что он оказывает прямое стимулирующее действие на остеобласты, влияет на процессы костного ремоделирования. Дефицит гестагенов после овариоэктомии способствует развитию остеопороза, негативно влияет на формирование костной ткани. Очевидно, большое значение имеет факт снижения андрогенов в инволютивный период: они оказывают стимулирующее влияние на костную ткань (стимулируют синтез белка остеобластами), увеличивают минеральную массу кости. Ослабление формирования кости после кастрации обусловливает дефицит тестостерона: он активирует анаболические процессы в костях.
В развитии остеопороза в период менопаузы важную роль играет снижение способности периферических тканей продуцировать эстрогены из андростендиона (синтезируется в яичниках и надпочечниках). В жировой ткани содержатся ферменты, трансформирующие (ароматизирующие) андрогены в эстрогены. Этим обусловлена высокая частота развития остеопороза у женщин с дефицитом массы тела.
Таким образом, после наступления менопаузы (естественной, после хирургического вмешательства) вследствие снижения уровня эстрогенов отмечается:
- увеличение продукции ИЛ-1, -6;
- нарушение равновесия в процессе перестройки костной ткани;
- увеличение количества активных КРЕ;
- повышение активности остеокластов;
- резорбция кости превалирует над ее образованием;
- наблюдается быстрая потеря костной ткани, негативный костный баланс;
- снижается уровень кальцитонина;
- уменьшается образование кальцитриола в почках;
- ухудшается абсорбция кальция в кишечнике;
- повышается темп резорбции костной ткани;
- нарушается баланс между уровнем кальция в сыворотке крови, ПТГ, кальцитриолом, кальцитонином.
Нарушение структуры костной ткани при недостатке эстрогенов представлено на схеме 3.1.
Для постменопаузального остеопороза характерно почти полное отсутствие клинических проявлений до возникновения переломов (чаще всего они являются первыми клиническими проявлениями). В патогенезе остеопоротических переломов существенную роль играют риск падения, сила внешнего воздействия, прочность кости. Высокий риск падения у лиц пожилого возраста обусловлен сопутствующей хронической патологией. Главными факторами возникновения остеопоротических переломов являются низкие показатели костной массы и МПКТ (снижение на 10% МПКТ позвоночника, бедра, запястья повышает риск возникновения перелома в 1,53 раза). Для постменопаузального остеопороза характерно развитие компрессионных переломов тел позвонков, перелом дистального отдела предплечья (перелом Коллиса), наружной лодыжки (Поворознюк В.В. и соавт., 1997). Дефицит эстрогенов, низкие показатели костной массы, недостаточная физическая активность являются факторами риска деформаций позвоночника. У женщин с деформацией позвонков вероятность развития переломов костей значительно повышается. Повторные остеопорозные переломы позвонков, как правило, локализуются рядом с ранее переломленными позвонками. При остеопоротических переломах позвоночника признаки компрессии спинного мозга или его корешков наблюдаются редко (компрессия более характерна для травматических переломов). Переломы развиваются в участках с выраженной трабекулярной костной тканью.
Для начальной стадии постменопаузального остеопороза известны (Поворознюк В.В., 1998) две формы течения заболевания: острое и медленное. Острое начало обусловлено компрессионным переломом позвонка, проявляется интенсивной болью в поврежденном отделе позвоночника. Распространение боли на другие органы, участки тела приводит к установлению таких диагнозов, как стенокардия, инфаркт миокарда, плеврит, «острый живот», остеохондроз позвоночника с корешковым синдромом. Движение, кашель, изменения положения тела усиливают выраженность боли в позвоночнике. Отмечается ограничение объема движений позвоночника (особенно сгибания), спазмирование паравертебральных мышц. Медленное начало постменопаузального остеопороза проявляется периодически возникающей болью в области спины, связанной с движением и покоем. Боль становится более интенсивной и постоянной, исчезает в горизонтальном положении, выраженность ее усиливается в положении стоя и сидя. Такая симптоматика обусловлена нарастающей деформацией позвонков, микропереломами трабекул. В подобных случаях периодически возникает острая боль в позвоночнике. Увеличивается мышечная слабость, уменьшается рост, изменяется осанка, возникает «вдовий горб», усиливается грудной кифоз, компенсаторный гиперлордоз. В результате усиленной резорбции альвеолярной кости развивается генерализованный парадонтит.
Имеется прямая корреляционная связь между МПКТ и стойкостью к переломам. Показатели МП шейки бедренной кости и участков скелета связаны с риском переломов у женщин различного возраста до и после периода менопаузы, а также с длительностью постменопаузального периода. Отмечена корреляционная связь между количеством переломов, обусловленных остеопорозом, и показателями МПКТ дистальных отделов лучевой кости. Кроме снижения МПКТ имеется связь между возникновением переломов и предыдущими переломами, тремя и более хроническими заболеваниями. У 30% женщин в постменопаузальный период имеются вторичные причины, приводящие к переломам (Caplan G.A. et al., 1994). На состоянии костной ткани сказываются перенесенные ранее заболевания (органов пищеварения, почек, туберкулез и др.), низкое потребление кальция.
Чаще всего причиной вторичного остеопороза является применение ГК. Заболевания и состояния, предшествующие вторичным формам остеопороза, ухудшают течение первичного постменопаузального остеопороза. Потеря костной массы при вторичном остеопорозе обусловлена изменениями ремоделирования, негативным дисбалансом между формированием и резорбцией костной ткани. В этих случаях количество образующейся костной ткани меньше количества резорбированной кости, что становится причиной остеопороза. При заболеваниях пищеварительного тракта, после гастрэктомии, заболеваниях печени, ХПН вследствие нарушения метаболизма витамина D нарушается минерализация кости. Таким образом, в постменопаузальный период суммируются факторы, влияющие на процессы ремоделирования. S. Khosla и соавторы (2000б) отмечают, что у всех женщин в менопаузальный период имеется эстрогенный дефицит, но остеопороз развивается только у 10–20%. Остеопороз I типа, по мнению исследователей, является результатом не только менопаузы, но и влияния дополнительных факторов, имеющихся у некоторых женщин в постменопаузальный период и усиливающих уменьшение костной массы, вызванное дефицитом эстрогенов. К таким возможным факторам относят малую костную массу в менопаузальный период, нарушение костного формирования, повышение чувствительности к ПТГ, повышенную продукцию цитокинов, способствующих костной резорбции.
Среди пациенток с постменопаузальным остеопорозом преобладают женщины со сниженным индексом массы тела. Показатели МПКТ у женщин пожилого возраста зависят от мышечной силы, массы тела, функциональных возможностей (Geusens P., 1998). МП бедренной кости у женщин в пременопаузальный и постменопаузальный период, кроме массы тела, коррелирует с их ростом. Данные о влиянии жировой массы тела на МПКТ противоречивы. Ожирение является фактором защиты от развития остеопороза. Избыточная масса тела положительно влияет на МП тел позвонков, бедренной кости: повышается МПКТ. Влияние избыточной массы тела на структурно-функциональное состояние костной ткани более выражено в постменопаузальный период, чем в пременопаузальный (Поворознюк В.В., Григорьева Н.В., 2002). Общая масса тела, ИМТ достоверно влияют на структурно-функциональное состояние костной ткани только в постменопаузальный период. Скорость распространения звука, широкополосное ослабление ультразвука и прочности костной ткани у женщин с доклиническим и клиническим ожирением выше в сравнении с женщинами с нормальной массой тела только в первые 9 лет постменопаузального периода.
Результаты исследования, проведенного сотрудниками отдела клинической физиологии и патологии опорно-двигательного аппарата Института геронтологии АМН Украины, свидетельствуют, что на развитие постменопаузального остеопороза оказывают влияние неблагоприятные факторы окружающей среды. Так, ускоренная потеря костной ткани выявлена в экологически «напряженных» регионах — Львовской области (эндемический район по фтору и йоду) и Киевской (загрязнение радионуклидами). В этих областях отмечается повышение частоты остеопороза и остеопений у женщин в постменопаузальный период. Снижение МПКТ повышает риск переломов, увеличивает их количество: в 55 лет высокий риск переломов у 6,1% женщин, в 55–59 лет — 29,2%, в 60–64 — 41%, в 65–69 — 55,7%, в возрасте старше 70 — 76,9%.
Для предотвращения остеопороза большое значение имеет диета, включающая молочные продукты, витамины D, К. Люди пожилого возраста нуждаются в дополнительном приеме препаратов кальция, витамина D. Умеренное потребление алкоголя на фоне заместительной гормональной терапии (ЗГТ) не снижает эффективность эстрогенов, а курение оказывает негативное влияние даже на этом фоне. С целью профилактики остеопороза женщины должны вести активный образ жизни со значительной физической нагрузкой в любом возрасте. Снижение МПКТ наиболее выражено в постменопаузальный период у женщин с «сидячей» работой. Имеется связь между потерей костной массы и содержанием липопротеидов в сыворотке крови. Липопротеиды высокой плотности (ЛПВП) предотвращают развитие остеопороза. С остеопорозом в постменопаузальный период и ишемической болезнью сердца коррелирует индекс атерогенности. Данные о сезонном влиянии на состояние костной ткани противоречивы.
Установлена тесная взаимосвязь структурно-функционального состояния костной ткани скелета в целом и альвеолярного отростка. Распространенность заболеваний пародонта у населения Украины составляет 80%, в возрасте старше 40 лет — 100% (Поворознюк В.В., Мазур И.П., 2003). Формирование альвеолярного гребня, его моделирование продолжается до 18–20 лет. Оно сопровождается минерализацией костной ткани, увеличением ее массы, плотности. Окостенение продолжается до 30 лет с участием солей кальция, фосфора, микроэлементов (фтора, магния, алюминия, железа), витаминов (прежде всего С, Е, А). Развитие и окостенение альвеолярной кости (как и костей скелета в целом) контролируется гормонами (гипофиза, надпочечников, половых желез). Диэнцефальные нарушения, нарушения функционального состояния системы гипоталамус — гипофиз — половые железы сопровождается ухудшением процессов минерализации костной ткани скелета, альвеолярной кости, формированием низкого пика костной массы (Вишняк Г.Н., 1999). В период полового созревания развивается как ювенильный остеопороз, так и ювенильный пародонтит. Гормональные дисфункции у девочек (аменорея, ювенильные кровотечения) сопровождаются повышением частоты пародонтита, нарушением формирования костной ткани. У детей патология зубов и челюстей сочетается с нарушением формирования скелета, пиком костной массы, снижением показателей МПКТ, развитием сколиоза. Закон Вольфа применим по отношению к альвеолярной кости в такой же мере, как и к другим костям: нагружаемые трабекулы и структуры альвеолярной кости усиливаются, менее нагружаемые — истончаются, рассасываются. Альвеолярная кость у молодых людей формируется за счет преобладания процессов костеобразования, в среднем возрасте костеобразование и резорбция уравновешены, в пожилом возрасте высота альвеолярного гребня уменьшается в результате атрофии (сенильной). Инволютивное снижение высоты альвеолярной кости связано не только с дефицитом эстрогенов, но и со снижением жевательной нагрузки, уменьшением костной массы (в возрасте старше 40 лет костная масса ежегодно уменьшается на 1% у женщин и на 0,5% — у мужчин). Частота развития заболеваний пародонта повышается у женщин в пре- и постменопаузальный период (более чем в 2 раза в возрасте 45 лет), что свидетельствует о важной роли эстрогенов для состояния альвеолярной кости. Выявляется корреляционная взаимосвязь между МПКТ различных отделов скелета и высотой альвеолярного гребня. Все эти данные, по мнению В.В. Поворознюка и И.П. Мазура (2003), свидетельствуют о том, что постменопаузальный остеопороз является фактором риска развития заболеваний пародонта. Нарушению равновесия между процессом костеобразования и резорбции в альвеолярной кости (в сторону преобладания резорбции) способствуют локальный патологический процесс (в том числе воспалительный), заболевания органов пищеварения, почек, эндокринной системы (сахарный диабет, гипогонадизм, гипер- и гипофункция щитовидной железы), климатические и географические факторы, ионизирующее излучение, особенности питания, наследственные факторы (Поворознюк В.В., Мазур И.П., 2003). На процессы ремоделирования альвеолярной кости влияют малые дозы поступающего излучения: остеотропные радионуклиды (90Sr, 137Cs) угнетают клетки остеобластной линии, нарушают соотношение остеобласты/остеокласты, что приводит к преобладанию резорбции над процессами костеобразования. Среди населения, проживающего на загрязненных радиацией территориях, отмечается высокий уровень заболеваемости пародонта. На состоянии альвеолярной кости, пародонта сказывается хроническая интоксикация фтором. Развивается флюороз зубов, нарушается минерализация твердых тканей зубов, на эмали появляются пятна, развивается деструкция.
3.2.3.2. Инволюционный остеопороз II типа (сенильный)
Развивается у мужчин и женщин в возрасте старше 70 лет (у женщин — в 2 раза чаще) (табл. 3.3). В этот период появляются клинические проявления остеопороза. У мужчин старше 70 лет наступает выраженное снижение уровня тестостерона. В этом возрасте уровень эстрогенов у женщин снижается на 80%, тестостерона у мужчин — на 50%. Снижение уровня эстрогенов у женщин сопровождается повышением уровня КС в 20 раз, снижение тестостерона у мужчин — в 10 раз (Франке Ю., Рунге Г., 1995). У мужчин отмечается более высокий пик костной массы, у них замедлена потеря кости с возрастом (Корж Н.А. и соавт., 2002б). С возрастом снижается активность остеобластов, ослабевает синтез белков, что, возможно, обусловлено снижением содержания ДНК. К старости самообновление белков замедляется, ухудшение синтеза белков приводит к снижению скорости деления клеток, нарушению их физиологической регенерации. Многие клетки подвергаются атрофии и погибают. Снижение синтеза белков распространяется на синтез окислительных ферментов, что приводит к снижению продукции энергии, необходимой для процессов синтеза. Гибель и замедление размножения костных клеток приводит к разрежению костей, снижению их прочности. У лиц пожилого возраста снижается уровень гормона роста, ФР, дефицит витамина D и его активных метаболитов в крови и костях, уменьшение количества рецепторов к 1,25-(ОН)2D3 в пищеварительном тракте и костной ткани, снижение потребления кальция, его абсорбции в кишечнике. Снижается потребление витамина D3 и нарушается его синтез в коже. Также снижено содержание кальция в рационе. Почти во всех экономически развитых странах мира люди пожилого возраста употребляют кальция меньше физиологической нормы (Kanis J.A., 1990). Возникающая вследствие этого гипокальциемия приводит к вторичному усилению продукции ПТГ (сенильный гиперпаратиреоидизм), отмечается выраженная пролиферация паратиреоидных клеток. При этом достаточно длительное применение препаратов кальция и витамина D сопровождается снижением частоты переломов. Прием преднизолона лицами пожилого возраста приводит к развитию переломов. Определенное значение в старческом возрасте играет также иммобилизационный фактор (резкое снижение физической активности). Он ведет к развитию гиперкальциемии, а затем к снижению секреции ПТГ, синтеза витамина D, снижению кишечной абсорбции кальция. Дефицит витамина D в организме R. Eastell и соавторы (1991) объясняют снижением активности почечной 1α-гидроксилазы, что приводит к повышению секреции паратиреотропного гормона.
Таким образом, у лиц с сенильным остеопорозом наблюдается:
- дефицит эстрогенов, снижение секреции других системных гормонов;
- снижение активности остеобластов;
- развитие атрофических процессов в кишечнике, печени, почках, костной ткани;
- снижение содержания кальция в рационе;
- снижение абсорбции кальция в кишечнике;
- снижение потребления витамина D, образования его в коже;
- снижение активности 1α-гидроксилазы вследствие инволюционных изменений в почках;
- дефицит активных метаболитов витамина D в крови, костях;
- нарушение взаимоотношений между кальцитриолом и ПТГ; снижение уровня кальцитриола, повышение ПТГ;
- дефицит рецепторов 1,25-(ОН)2D3 в пищеварительном тракте;
- пролиферация паратиреоидных клеток;
- развитие сенильного гиперпаратиреоидизма.
В результате указанных изменений увеличивается порозность компактной кости, снижается регенерация микропереломов, повышается склонность к развитию переломов. Снижается МПКТ, появляется мышечная слабость, нарушается нейромышечная координация, повышается частота падений, травм, переломов.
Для сенильного остеопороза характерна пропорциональная потеря трабекулярной и кортикальной кости. Потеря кортикальной и трабекулярной костной массы начинается с момента снижения (утраты) функции гонад. Переломы развиваются в частях скелета, содержащих компактную и губчатую ткань. Наиболее характерны переломы проксимального отдела бедренной кости, тел позвонков. Однако отмечают и переломы дистального отдела плечевой кости, таза, проксимального отдела большеберцовой кости. Частым падениям способствуют нарушения нервно-мышечной координации, мышечная слабость, сопутствующая патология. Усиливается грудной кифоз в результате множественных переломов позвонков. При инволюционном остеопорозе почти полностью отсутствуют клинические проявления до тех пор, пока не возникает коллапс позвонков, их деформация, переломы. По данным В.П. Поворознюка (1996; 1997), женское население Украины достигает пика костной массы в 23–24 года, мужское — в 25–26 лет. С 20 до 89 лет индекс МПКТ снижается у мужчин на 26%, у женщин — на 37%. В пременопаузальный период (до 50 лет) наблюдается незначительная потеря костной ткани, в постменопаузальный (до 69 лет) — ускоренная потеря, для сенильного периода (после 70 лет) характерна медленная потеря костной ткани. По данным автора, уровень костной массы в постменопаузальный период определяется двумя основными детерминантами:
1) максимальным количеством костной массы, достигаемой в период формирования скелета (пик костной массы);
2) скоростью последующей утраты костной массы.
У жительниц Украины основной прирост костной массы, ее плотности и прочности наблюдается в возрасте 10–16 лет и мероприятия, направленные на профилактику постменопаузального остеопороза, следует проводить именно в этот период.
Таким образом, инволюционный остеопороз I и II типа патофизиологически гетерогенен. Остеопороз I типа (постменопаузальный) обусловлен дефицитом эстрогенов, приводящим к ускорению костного метаболизма, увеличению потери костной массы. Он развивается у 10–20% женщин в течение 15–20 лет после менопаузы и проявляется в основном переломами позвоночника и переломами Коллиса. Остеопороз II типа (сенильный) обусловлен процессами, зависящими от старения (снижение функции остеобластов, вторичный гиперпаратиреоз, снижение всасывания кальция в кишечнике). Наблюдается у мужчин и женщин старше 70 лет, проявляется переломами бедра, клиновидными переломами позвоночника.
3.3. Вторичный остеопороз
Традиционно термин «вторичный остеопороз» используется в случаях, когда известны состояния, приводящие к потере костной массы. По мнению S. Khosla и L.J. Melton III (2000), более правильно эти состояния считать факторами риска. Следует помнить, что воздействие этих состояний дополняется различными другими эффектами: применяемыми лекарствами, недостаточной пиковой костной массой, ее возрастной потерей, гипогонадизмом, курением, злоупотреблением алкоголя, малой физической активностью и т. д. К настоящему времени выявлено большое число заболеваний, обусловливающих потерю костной массы. Но роль различных патологических состояний в механизме развития остеопороза изучена недостаточно. Влияние некоторых заболеваний на распространенность остеопороза незначительно в силу того, что они редко выявляются (генетически обусловленные аномалии развития и созревания кости, нарушения обмена веществ, болезнь Кушинга, акромегалия, др.). Однако ряд заболеваний диагностируются часто.
3.3.1. Факторы риска развития вторичного остеопороза
- Ревматические заболевания: РА, болезнь Стилла, СКВ, анкилозирующий спондилоартрит (ББ), системная склеродермия, ревматическая полимиалгия, реактивная артропатия, синдром Рейтера.
- Эндокринная патология: гипопитуитаризм, гиперпаратиреоз, тиреотоксикоз, гипотиреоз, гипогонадизм, синдром Шерешевского — Тернера, эндогенный гиперкортицизм (синдром или болезнь Иценко — Кушинга), хроническая недостаточность коры надпочечников (болезнь Аддисона), феохромоцитома, акромегалия, сахарный диабет I типа.
- Заболевания внутренних органов: сердечно-сосудистой системы (врожденные заболевания сердца, хроническая сердечная недостаточность различного генеза); легких (хронический обструктивный бронхит, бронхиальная астма, гнойные заболевания легких, туберкулез и др.); органов пищеварения (резекция желудка, гастрэктомия, мальабсорбция, в том числе в результате аутоиммунного гастрита, хронического панкреатита с внешнесекреторной недостаточностью, хронического энтерита, резекции тонкого кишечника, наложения анастомозов, ферментопатий, колита), хронические заболевания печени (активный гепатит, вирусный и алкогольный цирроз печени, первичный и вторичный билиарный цирроз печени)).
- Болезни почек: ХПН (в результате заболевания хроническим гломерулонефритом, пиелонефритом, диабетическим гломерулосклерозом, поликистозом почек), почечный канальцевый ацидоз, синдром Фанкони.
- Болезни крови: апластическая, пернициозная, гемолитические анемии, миеломная болезнь, талассемия, лейкозы, лимфомы, системный мастоцитоз, пересадка костного мозга.
- Генетические дефекты: несовершенный остеогенез, синдромы Марфана, Элерса — Данлоса, гомоцистеинурия, лизинурия (интолерантность к лизину), цистиноз, гликогеноз, галактоземия, мукополисахаридоз, трисомия по 13–15, 18-й хромосоме, дисгенез гонад, семейная вегетативная дисфункция (синдром Райли — Дея), алкаптонурия (охроноз).
- Другие заболевания, состояния: прогрессирующий оссифицирующий миозит, травматическое повреждение костей, ортопедическая патология у детей (спондило-эпифизарная дисплазия, остеохондропатия позвоночника (синдром Шейермана), сколиоз, дисхондроплазия, доброкачественные опухоли костей, нейрофиброматоз, фиброзная дисплазия), инфекционно-воспалительные заболевания костей (остеомиелит, туберкулез), врожденные пороки развития нижних конечностей, злокачественные новообразования, амилоидоз, гемохроматоз, болезнь Вильсона, удаление яичников, пересадка внутренних органов (сердца, почек, печени), нейромышечные заболевания и дистрофии (нейродистрофический синдром), нейроартропатии, длительная иммобилизация, геми- и тетрапарезы, параличи, нервная анорексия, нарушения питания, длительное парентеральное питание, алкоголизм.
- Длительное применение медикаментов: КС, тиреоидные гормоны, иммунодепрессанты, противоопухолевые препараты, седативные, фенотиазины, барбитураты, противосудорожные, антикоагулянты, препараты лития, тетрациклина, диуретики, антациды, содержащие алюминий, злоупотребление слабительными, передозировка препаратов железа.
- Действие радионуклидов (стронция, цезия), токсических веществ, пестицидов.
Вторичный локальный остеопороз развивается при злокачественных новообразованиях, метастазах в кости, локальной лучевой терапии костей, иммобилизации (лечение переломов, наложение гипсовых повязок), рефлекторной симпатической дистрофии (альгодистрофии), инфекционно-воспалительных процессах в костной ткани (артрит, артропатия, остеомиелит, туберкулез), нарушении артериального кровотока (облитерирующий эндартериит) и др.
3.3.2. Остеопороз при ревматических заболеваниях
3.3.2.1. Ревматоидный артрит
Причиной развития остеопороза при аутоиммунных заболеваниях являются:
- повышенная продукция провоспалительных цитокинов;
- прием ГК, цитостатиков;
- поражение органов пищеварения;
- снижение физической (двигательной) активности.
Снижение МПКТ выявляют у 53% пациентов с ревматологическими заболеваниями (Зборовская И.А. и соавт., 2002). По данным авторов, у таких больных повышен костный обмен, высокий уровень остеокальцина в крови. У больных РА отмечается гиперпродукция С-терминального телопептида (СТх) — лабораторного индикатора системного катаболического процесса (Раскина Т.А., 2002). Высокую частоту развития остеопороза у пациентов с ревматическими заболеваниями объясняют применением ГК, гормональными изменениями у пациентов (большинство из которых — женщины), сопутствующими заболеваниями, воспалительным процессом, иммобилизацией (функциональной недостаточностью суставов). Так, остеопороз обнаруживается у больных детей с диффузными заболеваниями соединительной ткани с высокой степенью активности воспалительного процесса, подострым течением, наличием висцеритов — нефрита, пульмонита, гепатита, аутоиммунного тиреоидита (Шевченко Н.С., Леонтьева Ф.С., 1997). Частота остеопороза возрастает при полиорганном поражении с вовлечением в патологический процесс трех и более органов. На фоне терапии ГКС снижаются показатели МПКТ, содержания кальция в сыворотке крови, повышается содержание общих гликозаминогликанов.
Остеопения и остеопороз отмечаются у 77% больных ревматоидным артритом, их частота повышается до 86% в период менопаузы и при применении ГКС (Муравьев Ю.В., 2001). Ранним проявлением ревматоидного артрита является периартикулярный остеопороз, развитие которого связывают с усиленной продукцией провоспалительных цитокинов (схема 3.2). ИЛ-1, -3, -6, -11, ФНО, ГМ-КСМ участвуют в регуляции локальных и системных воспалительных реакций, а также в развитии остеокластов. Протекторное действие на костную ткань нестероидных противовоспалительных препаратов (НПВП) объясняют их противовоспалительным действием, снижением активности системного аутоиммунного процесса. НПВП снижают активность циклооксигеназ, блокируют синтез провоспалительных ПГ из арахидоновой кислоты. Они оказывают антиоксидантное действие: тормозят синтез АФК, продуктов переокисления липидов, что снижает выраженность остеокластной резорбции кости. Селективные ингибиторы циклооксигеназы-2 восстанавливают активность ГКС-рецепторов синовиальных фибробластов человека, предотвращают деградацию хряща, оказывают анаболическое действие. Они являются препаратами выбора (среди НПВП) у ревматологических пациентов с остеопорозом, а также у принимающих ГК.
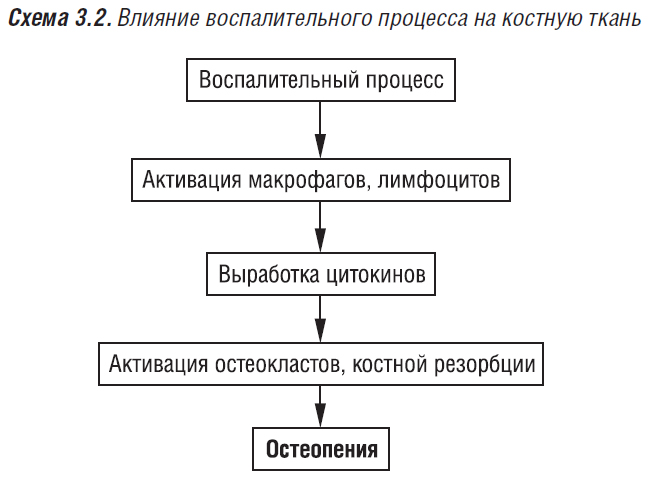
Околосуставной остеопороз развивается достаточно быстро — уже через 2 мес от начала заболевания (более быстрый и тяжелый процесс отмечается у женщин, особенно в постменопаузальный период). Имеется прямая связь показателей МП в губчатом и компактном веществе кости с активностью воспалительного процесса. Так, концентрация С-реактивного протеина (СРП) у больных с РА коррелирует со снижением МПКТ в поясничном отделе позвоночника, деструктивным процессом в периферических суставах. Деструктивный процесс в значительной мере обусловлен активацией остеокластов цитокинами, баланс которых (провоспалительных и антивоспалительных) при РА нарушается. Диффузный остеопороз присоединяется на более поздних этапах болезни на фоне хронического воспаления, снижения физической активности пациентов. У этих пациентов снижена МПКТ, особенно в участках ткани с преобладанием губчатого вещества (Борткевич О.П., 1997). Наряду с регионарными нарушениями, в костной системе отмечают разрежение костной ткани. По данным В.Н. Коваленко и соавторов (1997), у больных РА наблюдается общее ухудшение состояния костной ткани, а также выраженная мозаичность ее поражения. Поэтому у них следует проводить денситометрию в различных участках костной ткани. В начальный период РА снижение МПК наблюдается без явных рентгенологических проявлений (0 стадия заболевания) (Котлубей О.В., 1997). С повышением стадии (I, II стадия) МПКТ по данным рентгенографии снижается, но при III, IV стадии МПКТ мало отличается от соответствующего показателя при II стадии. Отмечается связь потери костной массы с длительностью болезни, активностью процесса, проводимой терапией, возрастом и полом пациента (Насонов Е.Л. и соавт., 1997). Прогрессированию остеопороза способствует гипокинезия, которая сопровождается замедлением ремоделирования вследствие механической стимуляции (снижения «деформационного потенциала»), торможением остеобластического гистогенеза, уменьшением объема кости, деминерализацией. В.Н. Коваленко и соавторы (2001) установили, что у больных РА ухудшается динамическое состояние костной ткани по мере увеличения выраженности утренней скованности, ухудшения результатов Стэнфордской анкеты состояния здоровья. Степень разрежения костной ткани коррелирует с выраженностью функциональной недостаточности суставов. Ухудшение функционального состояния играет важную роль на поздних этапах заболевания. Иммобилизация при РА сопровождается повышением риска переломов. Риск их развития при РА, по данным N.F. Laan et al. (1995), составляет 1,2–2,5%. Кроме воспаления, менопаузального периода, ограничения двигательной активности, на развитие и прогрессирование остеопороза влияет и лечение ГКС, наличие ревматоидного фактора. Причиной потери костной массы является длительный прием ГК в дозах выше 7,5 мг/сут. Применение ГК в низких дозах может иметь противоостеопоротический эффект: улучшение двигательной активности больных, уменьшение выраженности воспаления. Для остеопороза при РА характерно бессимптомное течение, возникновение нетравматических переломов, не адекватных тяжести травмы. Частота переломов выше у пациентов с высокой активностью воспалительного процесса, принимавших ГКС. При снижении МПК на 1 SD риск переломов возрастает в 1,5 раза (шейки бедра — в 2,6 раза). Болевой синдром отмечается при свежих компрессионных переломах позвонков (острой компрессии). Между частотой патологических переломов и данными денситометрии прямая корреляция отсутствует. Это объясняют тем, что влияние ГКС и базисных препаратов на костную ткань определяется не только снижением показателей МПКТ, но и изменением скорости костного ремоделирования, нарушением микроархитектоники кости. Возможна диффузная боль в костях (в результате микропереломов, раздражения периоста) острого и тупого характера. Довольно трудно дифференцировать боль, возникающую в результате остеопороза и суставного синдрома. Изменения в позвонках приводят к деформации позвоночника, которая проявляется сколиозом, сутулостью, гиперлордозом шейного отдела позвоночника, увеличением кифоза грудного отдела, сглаженностью кривизны поясничного отдела, ограничением подвижности суставов, уменьшением роста (порой на 1015 см). МПКТ у больных РА всех возрастных групп снижена (табл. 3.4).
Результаты исследования В.Н. Коваленко и соавторов (2001) свидетельствуют, что потеря костной ткани (системная деминерализация) ускоряется в ранний постменопаузальный период. Авторы установили наличие прямой связи между выраженностью остеопении, остеопороза и длительностью болезни: снижение МПКТ, которое отмечали через 1 год–5 лет, достигает максимума при продолжительности заболевания более 10 лет. Потеря костной ткани относительно замедляется через 5–10 лет, хотя деминерализация продолжается. У женщин в первые годы болезни преобладает деминерализация губчатого вещества кости. Через 48 лет губчатое и компактное вещество деминерализуются в одинаковой мере. При длительности болезни более 10 лет преобладающим становится снижение минеральной насыщенности (МНК) и МП компактной кости. Данные, полученные В.Н. Коваленко и соавторами (2001), свидетельствуют, что разрежение компактного вещества (II типа) характерно, прежде всего, для женщин в постменопаузальный период, особенно в первые 5 лет менопаузального периода, что важно для прогноза возможных переломов. У мужчин преобладающей является деминерализация губчатого вещества при любой длительности болезни.
Рарефикация костной ткани более выражена у больных с серопозитивным (по ревматоидным факторам) и с более высоким уровнем СРП (Клубова А.Ф. и соавт., 2002). По мнению авторов, генерализованное поражение костной ткани, количественно выраженное в виде показателей фотонной абсорбциометрии, может служить надежным маркером прогрессирования ревматоидного процесса. Генерализованное нарушение МПКТ коррелирует также с наличием висцеральных и системных поражений. У больных с персистирующей высокой активностью заболевания авторы обнаружили низкие показатели МПКТ как в губчатом, так и компактном веществе.
Изменения кальциевого обмена при РА более значительные, чем фосфорного. У больных РА выявлено (Дець В.В. и соавт., 1997) повышенную экскрецию кальция с мочой, которая зависит от активности процесса, приема КС и их дозы. Содержание неорганического фосфора в плазме крови повышено, а суточная экскреция с мочой не отличается от уровня в контроле. Результаты компьютерной томографии подтверждают снижение МПКТ, особенно у больных, которые получали КС в дозах выше 20 мг/сут и с давностью заболевания более 10 лет. Изменения коррелируют с возрастом больных. По данным С.И. Билоцецкой-Смиян и соавторов (1997), остеопороз диагностируют у всех пациентов с РА с продолжительностью заболевания более 3 лет и длительно принимающих ГКС. У 15,3% пациентов авторы диагностировали остеопению без развития остеопороза (длительность заболевания составляла 212 мес). Значительное снижение плотности костей при РА, снижение уровня кальция, повышение ПТГ и кальцитонина в крови установлено и О.В. Синяченко и соавторами (1996). По их данным, степень выраженности остеопороза не зависит от уровня фосфора, гонадотропных гормонов и ПТГ. Имеется слабая корреляционная связь с уровнем в крови эстрадиола, общего и ионизированного кальция, выявлена тесная связь между МПКТ и концентрацией кальцитонина в крови пациентов.
Факторами риска компрессионных переломов у больных РА в постменопаузальный период, принимающих ГКС, являются возраст, продолжительность менопаузы и МПКТ (Зоткин Е., 2002). Чем старше больные, которые принимают ГКС, тем выше вероятность возникновения вертебральных переломов. Риск этих переломов у пациентов, принимающих ГКС более 12 мес, выше в 5,1 раза, чем у тех, кто их не принимал.
Уже через 1 мес от начала лечения больных РА иприфлавоном в сочетании с препаратами кальция, диетой, богатой кальцием, фосфором, витаминами группы D, улучшалось состояние костной ткани (по данным денситометрии) и состояние больных (Коваленко В.Н., Мальцев В.И., 1997).
Остеопороз в зоне имплантации эндопротеза тазобедренного сустава при РА является одной из причин нестабильности компонентов эндопротеза (Жаденов И.И. и соавт., 2002) и требует назначения препаратов кальция, кальцитонина до оперативного вмешательства и в ближайший послеоперационный период.
3.3.2.2. Системная красная волчанка
Развитие остеопороза у больных с СКВ Е.Л. Насонов и соавторы (1997) связывают со многими факторами: воспалительным процессом, поражением почек (нарушается 1α-гидроксилирование витамина D), снижением функции половых желез (патологией яичников у женщин, гипогонадизмом у мужчин), развитием вторичного гиперпаратиреоза, низкой физической активностью, недостаточной инсоляцией, медикаментозным лечением (ГК, антикоагулянты, гепарин и др.). Распространенность остеопороза у пациентов с СКВ не установлена. Нарушения структуры костной ткани у больных СКВ и РА отличаются (Борткевич О.П., 1997а, б). У больных СКВ нарушение структуры костной ткани в дистальной и проксимальной части предплечья не отмечается. У больных РА хуже показатели в дистальной части, что автор объясняет тем, что у больных СКВ нарушения имеют вторичный равномерно-генерализованный характер под воздействием гормональной терапии. У больных РА нарушения мозаичные, а при СКВ — равномерно-генерализованные (Головков Ю.Ж., 1997).
3.3.2.3. Системная склеродермия
У больных ССД развивается эпифизарный остеопороз, максимальным выражением которого на поздних стадиях болезни является остеолиз, и генерализованный (Глушко Л.В. и соавт., 1997). Нарушение кальциевого обмена проявляется кальцинозом мягких тканей. Выраженность остеопороза у больных дерматомиозитом менее значительна по сравнению с пациентами с ССД, часто отмечается кальциноз тканей. На МПКТ у больных всех возрастных групп с ССД оказывает отрицательное влияние длительный прием ГКС. У молодых женщин снижение МПКТ обусловлено назначением КС в высоких дозах, однако Е.Ю. Пудовкина и соавторы (2002) не отмечали у них остеопороза.
3.3.2.4. Дерматомиозит
Остеопороз костей, кальцификация мышц рентгенологически определяются у больных с синдромом Петжа — Клежа — вариантом идиопатического дерматомиозита с пойкилодермией. Он клинически проявляется хроническим течением дерматомиозита с лихорадкой, кожным зудом, атрофией мышц, мышечной слабостью, склеродермоподобной очаговой атрофией эпидермиса, дермы, вторичными телеангиоэктазиями и участками гиперпигментации.
3.3.2.5. Болезнь Шегрена
Заболевание сопровождается нарушением кальцификации зубов и костей, хроническим полиартритом. У пациентов с болезнью Шегрена длительный прием преднизолона даже в низких дозах (2,5–5 мг/сут) приводит к учащению периферических переломов (Шорникова Н.С. и соавт., 2002) и поэтому лечение должно сопровождаться приемом противоостеопоротических препаратов.
3.3.2.6. Анкилозирующий спондилоартрит
Остеопороз при анкилозирующем спондилоартрите (ББ) является достаточно частым явлением. МПКТ в позвоночнике, проксимальных отделах бедренных костей снижается уже на ранних этапах болезни. В дальнейшем этот процесс прогрессирует и становится причиной переломов тел позвонков. Как свидетельствуют данные исследования В.Н. Коваленко и соавторов (2002), к развитию остеопении и остеопороза более склонны больные с активным и тяжелым течением ББ, особенно при наличии поражения периферических суставов. Выраженность потери МПКТ компонента наиболее значительна в губчатом веществе. Показатели МПКТ компактной костной ткани изменяются в меньшей степени и повышаются при длительности заболевания, превышающей 10 лет, что авторы связывают с развитием вторичного окостенения. По данным В.Н. Коваленко и соавторов (2002), предикторами прогрессирования остеопенического синдрома у обследованных больных были персистирующее повышение скорости оседания эритроцитов (СОЭ), длительность заболевания до начала активной терапии. Механизм развития остеопороза при ББ не изучен. Некоторые исследователи (Calin A., 1991; Rubinstein H.M., 1991) связывают его с уменьшением подвижности позвоночника в результате окостенения. По данным количественной компьютерной томографии, остеопению в области шейки бедра и лучевой кости выявляют у большинства пациентов, не зависимо от рентгенологической стадии заболевания (Przepiera-Bedzak H. et al., 2000). В литературе имеются многочисленные сведения о переломе тел позвонков, их уплощении при данном заболевании. Как правило, подобные пациенты болеют более 20 лет и относятся к больным старшего возраста. Развитие остеопенического синдрома при ББ более характерно для мужчин. При ББ не обнаруживают изменения содержания кальция, фосфора, ПТГ и 25-ОН-D3 в крови, соотношения кальций/креатинин в моче (Wendling D., Dumoulin G., 1991). Уровень остеокальцина в крови может оставаться нормальным или снижаться (Franck H., Keck E., 1993). Его снижение свидетельствует об уменьшении образования костной ткани. На потерю костной ткани при ББ влияют медиаторы воспаления, в частности ИЛ-6, содержание которого в сыворотке крови у больных повышается (Gratacos J. et al., 1994). Повышение у больных с анкилозирующим спондилоартритом содержания пиридинолина в моче свидетельствует о стимуляции резорбции костной ткани (Marhoffer W. еt al., 1995). Повышение резорбтивной активности остеокластов выявлено N. Yilmaz и J. Оzaslan (2000).
3.3.2.7. Остеоартроз
Результаты обследования, проведенного в Украинском ревматологическом центре (Коваленко В.Н., Борткевич О.П., 2003) при участии 2500 человек без патологии опорно-двигательного аппарата и с остеоартрозом свидетельствуют, что у тех и других снижается МПК (табл. 3.5). У пациентов с остеоартрозом потеря минерального компонента ускоряется в ранний постменопаузальный период. При остеоартрозе и остеопорозе имеются одни и те же факторы риска: пожилой и старческий возраст, женский пол, дефицит эстрогенов, недостаток витамина D и его метаболитов, семейная предрасположенность. В частности, адекватное потребление витамина D необходимо для предотвращения как остеопороза, так и остеоартроза.
Даже при отсутствии клинической симптоматики нарушения метаболизма костной ткани выявляют у 28% больных остеоартрозом и у 8% — здоровых (Железняк В.С., 1996). У больных остеоартрозом в возрасте 40–49 и 50–59 лет МПКТ снижена по сравнению со здоровыми лицами. У пациентов в возрасте старше 60 лет различия несущественны, что обусловлено инволютивным процессом (отмечена корреляция с возрастом). По данным автора, разрежение костной ткани при остеоартрозе генерализованно и захватывает как губчатое, так и компактное вещество кости. На состояние костной системы больных остеоартрозом негативно влияет продолжительность патологического процесса (изменения максимальны при длительности патологического процесса более 10 лет). В возрасте 57–69 лет (в среднем 63,7 года) постменопаузальный остеопороз сочетается с остеоартрозом коленных суставов (Ходырев В.Н., 2002). Снижение МПКТ у больных остеоартрозом старшего возраста по сравнению со здоровыми лицами аналогичного возраста обнаружили и В.И. Алякна с соавторами (1988). Ими выявлено снижение синтеза остеоида, нарушение минерализации. У больных развивается также периартикулярный остеопороз костной ткани, прилегающей к суставу (Karvonen R.L. et al., 1998).
По данным одних авторов (Boonen S. et al., 1996), у больных с остеоартрозом снижается риск переломов костей, в том числе шейки бедренной кости. N.K. Arden и соавторы (1999) не находят такого снижения, наоборот, обнаруживают повышение риска переломов бедренной кости, несмотря на повышение МПК. По мнению В.Н. Коваленко, О.П. Борткевича (2003), эти данные свидетельствуют о том, что у больных остеоартрозом, несмотря на нормальную или повышенную МПК, необходимо проводить профилактику остеопоротических переломов. Тем более, что при денситометрии костей при наличии дегенеративных изменений возможно получение ложноположительного результата — «высокой» МПК. Переломы костей у больных остеоартрозом авторы связывают с:
- нарушением качества костной ткани;
- снижением (атрофией) мышечной массы;
- нарушением нейромышечной координации;
- развитием асептических некрозов костей (Коваленко В.Н., Борткевич О.П., 2003).
По данным Украинского ревматологического центра, асептические некрозы развиваются у 1,34% больных остеоартрозом и сопровождаются разрежением кости — потерей минерального и органического компонента. Самые низкие денситометрические показатели исследователи обнаруживали у лиц с течением остеоартроза на протяжении 6–10 лет. При длительности болезни до 5 и более 10 лет костная масса несколько большая, хотя в целом она не достигает таковой у пациентов без остеоартроза или с течением такового менее 1 года. Повышение МПК у больных остеоартрозом длительностью более 10 лет В.Н. Коваленко и О.П. Борткевич (2003) объясняют компенсаторными процессами (снижением метаболизма, замедлением темпов потери минерального компонента). По данным авторов, снижение МПК отмечается при поражении многих суставов (полиостеоартрозе). У 76,7% пациентов с моно- и олигоартрозом МПК превышает возрастную норму. Аналогичные изменения наблюдали и другие исследователи. Так, по данным L. Malavolta и соавторов (2000), МПК позвоночника и шейки бедренной кости у пациентов с коксартрозом выше, чем у больных с преимущественным поражением мелких суставов кистей и у лиц без патологии суставов. Такой характер изменений авторы объясняют протекторным действием дегенеративно-дистрофического процесса.
3.3.2.8. Реактивные артропатии
Изменения МПКТ являются составной частью метаболических нарушений в патогенезе различных форм синдрома Рейтера. Нарушение МПКТ выявлено (Хвисюк А.Н., 2002) у 82,6% больных с верифицированными, хронически протекающими реактивными артропатиями. Остеопения I степени выявлена автором у 11%, II степени — у 24%, III степени — у 27%; остеопороз — у 38% больных; остеопения по губчатому типу — у 34%, по компактному — у 22%, по смешанному — у 34% больных. Остеопороз усугубляет деформации и деструкции отделов опорно-двигательного аппарата, выполняющих наибольшую статическую и динамическую нагрузку. Включение терапии остеопороза в базисную терапию реактивных артропатий улучшает функциональные результаты лечения. Необходимо применение препаратов, направленных на улучшение минерального обмена, диеты, обогащенной солями кальция, фосфора. В результате этого уменьшаются проявления артропатического и вертебрального синдромов, предотвращается развитие остеопоротических переломов.
3.3.2.9. Ревматическая полимиалгия
Ревматическая полимиалгия сопровождается локальным и системным остеопорозом. Локальную потерю костной ткани при ревматических заболеваниях связывают с воспалительным процессом — синовитом, продукцией провоспалительных цитокинов, лечением ГК, иммобилизацией, дефицитом микроэлементов.
3.3.2.10. Болезнь Шейермана
Остеопорозом характеризуется болезнь Шейермана (ювенильный деформирующий остеохондрит позвоночника). При этом заболевании позвонки клиновидно истончаются, становятся уже. Может возникнуть кифоз, неподвижность участка позвоночника. Характерной является боль в позвоночнике, изменяются замыкательные пластинки позвонков, снижается высота промежутков между позвонками, развиваются грыжи Шморля (Корж Н.А., Колесниченко В.А., 2002в). Основой болезни авторы считают нарушение синтеза коллагена и метаболический дисбаланс в экстрацеллюлярном матриксе гиалиновых замыкательных пластинок и эпифизарной зоны роста тел позвонков. В губчатой костной ткани позвонка развивается локальный остеопороз, а в дальнейшем — диффузный. Механизм развития остеопороза при данном заболевании не установлен. После достижения пациентом 16-летнего возраста болезнь не прогрессирует, имеются лишь ее остаточные явления.
3.3.2.11. Синдром Марфана
Представляет собой заболевание с аутосомно-доминантным типом наследования, характерным проявлением которого является поражение скелета, сердечно-сосудистой системы, глаз (Шайков А.В., 1997а; Jenkins J.K., 1999а, б; Гречанина Е.Я., Гречанина Ю.Б., 2003). Возможны заболевания кожи и дыхательной системы. У всех больных выявляется дефект в гене фибриллина. Фибриллин, обнаруженный в рыхлой соединительной ткани, является компонентом внеклеточных микрофибрилл, которые формируют субструктуру эластина. Поражаются органы, в которых эластические волокна выполняют важную функцию. Заболевание наследуется от родителей (75%) или возникает впервые (25%) в результате новой мутации. Популяционная частота 4:100 000–6:100 000. В одинаковой мере болеют мужчины и женщины. Отмечают вовлечение в патологический процесс эндокринной системы: показатели соматотропина и инсулина у больных в 5–10 раз превышают норму. Обнаруживаются патологические типы кривых содержания глюкозы в крови. Для больных характерны узкий лицевой скелет, «птичье лицо», готическое небо, высокий рост, узкая грудная клетка, деформация грудной клетки (воронкообразная или килевидная), сколиоз, удлинение конечностей, арахнодактилия («пальцы паука»), врожденные контрактуры кистей, гипермобильность суставов (чаще локтевых, коленных, тазобедренных), вальгусная деформация предплечий и голеней, плосковальгусная деформация стоп. Сколиоз может быстро прогрессировать в подростковом возрасте и требует хирургической коррекции. Со стороны легких отмечаются недоразвитие долей, поликистоз, бронхоэктазы, буллезная эмфизема с возможным развитием спонтанного пневмоторакса, инфаркты легкого. У 30% развивается аневризма аорты, аортальная недостаточность, требующие хирургической коррекции, у 80% — пролапс митрального клапана, наблюдаются блокады правой ножки пучка Гиса, артериальная гипертензия. Развиваются подвывихи хрусталика или его эктопия, вторичная глаукома, миопия, гиперметропия, дегенерация и отслойка сетчатки, катаракта и др. У половины больных с синдромом Марфана повышено выделение с мочой гидроксипролина и растворимого коллагена. Нарушение развития коллагена и его последующей минерализации обусловливает развитие остеопороза.
Арахнодактилия не является патогномоничным признаком синдрома Марфана: она наблюдается и при других заболеваниях. Неастеническая конституция при синдроме Марфана может быть проявлением forme fruste (приостановленной болезни): у больного имеется арахнодактилия и нормальный фенотип при наличии той же генной мутации, что и у других членов семьи с более тяжелыми проявлениями болезни (Jenkins J.K., 1999а, б). Врожденная контрактурная арахнодактилия представляет собой другое аутосомно-доминантное заболевание, для которого характерны высокий рост, арахнодактилия, контрактуры суставов. Высокий рост, арахнодактилия, аномалии позвоночника наблюдаются у больных, страдающих гомоцистинурией.
3.3.2.12. Синдром Элерса — Данлоса
Для этого синдрома характерно многообразие клинических проявлений (Шайков А.В., 1997б; Гречанина Е.Я., Гречанина Ю.Б., 2003). Синдром представляет собой группу наследственных нарушений, в основе которых лежит дефект синтеза коллагена, который обусловливает нарушение минерализации кости и остеопороз. Частота составляет 4:100 000 новорожденных (стертые формы выявляют чаще). Известно 11 типов заболевания, что отражает его генетическую гетерогенность (генетический дефект известен только при нескольких типах синдрома). В большинстве случаев наследование происходит по аутосомно-доминантному типу и сопровождается уменьшением количества или изменением структуры коллагена. Исключением является синдром Элерса — Данлоса VI типа (окулосколиотический), при котором дефект лизилгидроксилазы наследуется рецессивно (Jenkins J.K., 1999а, б). Клинически дифференцировать различные типы синдрома весьма затруднительно. Для всех типов характерны: гиперрастяжимость кожи, гипермобильность суставов, геморрагический диатез, поражение глаз, сердечно-сосудистой системы, органов дыхания и пищеварения. Наблюдается гиперэластичность слизистых оболочек (симптом Горлина). К кожным проявлениям относятся келоидные рубцы, трофические язвы голеней, гематомы, экхимозы, кровоподтеки, кровотечения из носа, матки, пищеварительного тракта, мочевых путей. Со стороны сердечно-сосудистой системы возможны врожденные пороки сердца, пролапс митрального клапана, аневризма аорты, сосудов головного мозга, артериовенозные фистулы, варикозное расширение вен. К глазным симптомам относятся косоглазие, птоз верхнего века, эктопия хрусталиков, миопатия, патологические изменения глазного дна. Отмечаются явления периодонтита, неправильное формирование, аномальное расположение зубов, частичное отсутствие зубов. У пациентов с синдромом Элерса — Данлоса I и II типа выявляют патологию коллагена I типа. Развивается косолапость, выпот в суставах, гемартроз, сколиоз, спондилолистез, гипермобильность суставов, гиперрастяжимость кожи. Часто диагностируют врожденные подвывихи тазобедренных суставов. В любом возрасте возникают подвывихи других суставов. Синдром Элерса — Данлоса IV (сосудистого) типа характеризуется нарушением продукции коллагена III типа, который находится в стенках кровеносных сосудов. При V типе (практически не отличается от II типа) основным биохимическим нарушением является дефицит лизилоксидазы. При VI типе в структуре коллагена содержится недостаточное количество гидроксилизина. Для IX типа (формы с черепными шпорами) характерно наличие шпор в затылочной области черепа, дивертикулы мочевого пузыря, генерализованная дисплазия скелета с остеопорозом. Основу болезни составляют снижение активности лизилоксидазы и низкое содержание меди в сыворотке крови. Наиболее частым является XI тип, основным признаком которого является генерализованная несостоятельность периферических суставов.
3.3.2.13. Гомоцистинурия
Заболевание обусловлено врожденным дефектом метаболизма соединительной ткани. Различают три формы (клинические и биохимические) нарушения метаболизма аминокислот, которые характеризуются повышением концентрации гомоцистеина в плазме крови и моче. Наиболее часто выявляют форму гомоцистинурии, связанную с аутосомно-рецессивным дефектом обмена метионина — отсутствием или низкой активностью фермента цистатионин-β-синтазы, которая участвует в переносе сульфатного остатка от метионина цистеину. Две другие формы наблюдаются реже и характеризуются нарушением реметилирования гомоцистеина до метионина (Jenkins J.K., 1999а, б).
Частота заболевания составляет 1:50 000–1:250 000 (Гречанина Е.Я., Гречанина Ю.Б., 2003). В США дефицит цистатионин-β-синтазы обнаруживают у примерно 1 на 200 000 родившихся. Недостаток фермента обусловливает повышение концентрации гомоцистеина и метионина. При нарушении обмена до стадии образования метионина (дефиците метилвитамина В12 и метилтетрагидрофолата) концентрация гомоцистеина повышается, метионина — снижается. Эти изменения сопровождаются нарушением развития соединительной ткани. Гомоцистеин связывается с альдегидами (производными лизина) и препятствует образованию поперечных связей коллагена, то есть его нормальному синтезу. Для правильного поперечного соединения структурных белков (коллагена, фибриллина) соединительной ткани, костей, супрасенсорных связок глазного яблока, экстрацеллюлярного матрикса эндотелиальных клеток необходим цистеин, содержание которого снижается. Измененный коллаген является причиной развития остеопороза, смещения хрусталика. Аномальные белки эластомера или фибриллина обусловливают фенотипическое сходство с синдромом Марфана, а измененное межуточное вещество эндотелиальных клеток является причиной тромбозов и задержки интеллектуального развития. Наблюдается повышенная экскреция оксипролина и гликозамингликанов, развивается генерализованный остеопороз, сопровождающийся повторными переломами костей, тугоподвижность суставов. Остеопороз обусловливает избыточная продукция дерматансульфатов. У 36–64% (Jenkins J.K., 1999а, б) больных в возрасте старше 15 лет отмечают остеопороз позвонков в сочетании с патологическими переломами, дегенеративными изменениями дисков и межпозвонковых сочленений. При этом состав внутрисуставной жидкости в норме. Гомоцистеин оказывает повреждающее действие на интиму артерий среднего калибра с дальнейшей агрегацией тромбоцитов, активирует фактор Хагемана. Накопление гомоцистеина в тканях сопровождается умственной отсталостью, возникают тромбозы сосудов мозга, спастические параличи, парезы. Наблюдается жировое перерождение и белковая дистрофия печени, купферовских клеток, дегенеративное поражение хрусталиков, цилиарных тел. Клинические проявления напоминают внешне синдром Марфана: высокий рост, астеническое телосложение, арахнодактилия кистей и стоп, воронкообразная или килевидная деформация грудной клетки, кифосколиоз. Избыток гормона роста при гомоцистеинурии обусловливает рост костей. Со стороны сердечно-сосудистой системы выявляют тромбэмболию артериальных сосудов разного калибра. Отмечаются эктопия хрусталика — смещение его вниз (при синдроме Марфана смещение направлено вверх и возникает во внутриутробный период), глаукома.
При лечении используются витамины В6, В12 и фолаты, являющиеся кофакторами ферментов, участвующих в обмене метионина. 50% пациентов хорошо реагируют на терапию витамином В6, высокие дозы которого снижают концентрацию метионина, повышают — цистеина, улучшают состояние больных с дефицитом цистатионин-β-синтазы.
3.3.2.14. Алкаптонурия (охроноз)
Заболевание возникает в результате нарушения метаболизма тирозина из-за дефицита оксидазы гомогентизиновой кислоты (фермент регулирует реакцию превращения этой кислоты в форму, участвующую в цикле трикарбоновых кислот) и сопровождается остеодистрофией. Оно является результатом аутосомно-рецессивного наследования. У гетерозигот симптомы болезни не возникают (Jenkins J.K., 1999а, б). Кислота связывает коллаген и накапливается в соединительной ткани. Накопление гомогентизиновой кислоты обусловливает появление гиперпигментации тканей серого или темно-синего цвета. Моча при отстаивании становится темно-синего цвета. На третьем десятилетии жизни развивается дегенеративный артрит, тугоподвижность суставов (чаще поражаются коленные, тазобедренные и плечевые суставы), позвоночника. Отмечается аномальная кальцификация и окостенение костей, которые становятся ломкими.
3.3.2.15. Амилоидоз
Поражение костей и опорно-двигательного аппарата наблюдается при первичном (идиопатическом) амилоидозе, амилоидозе у пациентов с миеломной болезнью и находящихся на программном гемодиализе (Бунчук Н.В., 1997б). Амилоид откладывается в тканях суставов, костях, околосуставных тканях. На рентгенограммах выявляется утолщение периартикулярных тканей, околосуставной или системный остеопороз с возможными остеолитическими изменениями. Обнаруживаются очаги повышенной рентгенологической прозрачности в костномозговых пространствах, кортикальном слое костей (особенно проксимальной части бедренной и плечевой костей). Вследствие отложения амилоида в костном мозге кости развивается остеолиз, возникают патологические переломы. Этот процесс, подобный возникающему при ишемическом остеонекрозе, может отмечаться в головке бедренной кости, костях запястья, плечевого, локтевого, коленного суставов. В результате отложения амилоида повышается прозрачность позвонков, возникает их деформация. Возникновение остеопороза обусловлено развитием полинейропатии, нейроартропатии. Амилоид выявляют в синовиальной оболочке и жидкости, в других тканях.
3.3.2.16. Наследственные системные заболевания скелета
3.3.2.16.1. Диастрофическая дисплазия (эпифизарный дизостоз, диастрофическая карликовость)
Проявляется с рождения характерной косолапостью, косорукостью, контрактурами суставов, а также воспалительным процессом в ушных раковинах (остается деформация и утолщение), который возникает в первые месяцы жизни (Нечволодова О.Л., 1997). При рентгенологическом исследовании обнаруживают резкое уплощение эпифизов, подвывихи в тазобедренных и коленных суставах, укорочение и деформацию пястных костей и фаланг пальцев, сколиоз, деформацию тел позвонков (без снижения их высоты). При множественной эпифизарной дисплазии в возрасте 3–5 лет пациенты жалуются на боль в коленных и тазобедренных суставах, связанную с нагрузкой. В последующие годы появляется боль в покое, ограничение подвижности в суставах.
3.3.2.16.2. Спондилоэпифизарная дисплазия
В основе спондилоэпифизарной, как и диастрофической дисплазии, лежит генетический дефект суставного хряща. Проявления спондилоэпифизарной дисплазии появляются в возрасте 6–8 лет: боль в суставах нижних конечностей при нагрузке, ограничение движений. Рентгенологически выявляют уплощение эпифизов трубчатых костей, уменьшение высоты тел позвонков, которые обретают двояковыпуклую форму.
При обоих заболеваниях у 20—30% пациентов в возрасте 8–14 лет возникают атаки острого артрита (поражаются тазобедренные суставы), причина которых не установлена. Они сопровождаются повышением температуры тела до 37,5–38 °С. Увеличивается выраженность остеопороза костей суставов, возникают контрактуры, анкилозирование. Развивается остеоартроз всех остальных суставов. Рентгенологические проявления остеоартроза маскируют деформацию суставных концов костей, характерную для дисплазий.
3.3.2.17. Синдром несовершенного остеогенеза (синдром Ван-дер-Хуве)
Наследуется по аутосомно-доминантному типу. Из нескольких форм заболевания чаще выявляют две. При первой из них нарушается синтез коллагена, снижается отношение коллагена I типа ко II типу. Нарушается состав матрикса кости, периостальное окостенение (рост кости в ширину), развивается «стеклянный» остеопороз. Рентгенологически обнаруживается истончение кортикального слоя костей, увеличение костномозгового канала в поперечнике, генерализованный остеопороз. В период внутриутробного развития или у новорожденного (сразу после рождения) возникают множественные переломы, срастание костей происходит в обычные сроки. Одними из признаков болезни являются голубой цвет склер, наличие «перепончатого черепа» (свод черепа имеет консистенцию кожи), снижение слуха (развивается отосклероз), гипермобильность суставов, кальциноз периферических артерий. При второй форме заболевания переломы костей возникают в первые годы жизни.
3.3.2.18. Синдром Тиманна — Флейшнера (бессосудистый некроз фаланг пальцев)
Представляет собой наследственное заболевание, начинающееся в период полового развития. Сопровождается поражением эпифизов II и III пальцев, концевых фаланг кистей, тарзометатарзальных суставов стоп, основных фаланг I пальца. Рентгенологически обнаруживается остеопороз эпифизов, резорбция кости, ее разрушение, приостановление роста фаланг.
3.3.2.19. Синдром Бэкуина — Эйгера
Редкая форма семейной генерализованной остеопатии с кортикальным гиперостозом, которая наследуется по аутосомно-рецессивному типу. Проявляется в детском возрасте задержкой роста, искривлением ног, выраженной ломкостью костей. На рентгенограмме отмечается утолщение почти всех костей с одновременным остеопорозом (Лазовскис И.Р., 1981). Начиная с 3-го года жизни развивается гиперостоз черепа. В крови обнаруживается повышение уровня кислой и ЩФ, лейцинаминопептидазы, гипохромная анемия, лейкоцитоз. В костном мозге — гиперплазия остеобластов.
3.3.2.20. Синдром Блегвада — Хакстхаузена
Это комплекс врожденных аномалий, для которого характерна хрупкость костей, вывихи и подвывихи суставов, вялость мышц. На рентгенограммах трубчатые кости тонкие, истончен компактный слой костей. После наступления половой зрелости часто хрупкость костей снижается. Для больных также характерна синюшность склер, катаракта, появление на коже серо-синеватых пятен с втянутой поверхностью, часто с гиперемированной каймой.
3.3.2.21. Синдром Капдепона
Одонтодисплазия, наследуемая по аутосомно-доминантному типу и проявляющаяся нарушением развития зубов и костей. Отмечается хрупкость скелета, нередко полидактилия. Зубы коричневой и бурой окраски, эмаль трескается, коронка быстро изнашивается. Рентгенологически обнаруживается декальцинация костей и зубов.
3.3.2.22. Синдром Чейна
Является комплексом наследственных семейных аномалий, наследуемых по аутосомно-доминантному типу. Для больных характерна низкорослость, запоздалое окостенение швов черепа, раннее выпадение зубов. Имеется выраженный системный остеопороз, деформации костей, возникновение переломов челюстей, позвоночника, пальцев рук. В позднем детском возрасте на стопах появляются язвы, возникает секвестрация костей, деформация стоп (Лазовскис И.Р., 1981).
3.3.2.23. Синдром Дюшенна — Гризингера
Наследственная мышечная дистрофия у детей (наследование рецессивное, сцепленное с Х-хромосомой), которая отмечается только у мальчиков в возрасте от 2 до 6 лет. Поражаются мышцы грудной клетки, поясницы, конечностей. Сначала наблюдается их гипертрофия, затем развивается атрофия, обусловливающая обездвиживание. Развивается деминерализация костей, часто отмечаются кифосколиоз, конская стопа, исчезают сухожильные рефлексы. В крови повышается активность креатинфосфокиназы, альдолазы.
3.3.2.24. Синдром Олбрайта — Батлера — Блумберга
Представляет собой комплекс врожденных аномалий (наследование по доминантному типу, сцепленное с Х-хромосомой). Признаки заболевания появляются в течение 1-го года жизни. У больных отмечаются низкий рост, наличие рахита, резистентного к лечению витамином D, гипофосфатемия, гиперфосфатурия (Лазовскис И.Р., 1981).
3.3.2.25. Синдром Герена — Штерна
Комбинация врожденных аномалий и дисплазии суставов. Характерно анкилозирование крупных суставов, вывихи или подвывихи бедренного сустава, гипоплазия и аплазия мышц, надколенника, системный остеопороз. Отмечаются гипогонадизм, врожденные пороки сердца, аномалия позвоночника, дисплазия нижней челюсти, волчья пасть, заячья губа, телеангиэктазии.
3.3.2.26. Наследственная гипофосфатемическая дистрофия костей (синдром Сальвиоли)
Остеодистрофия развивается в детстве (предполагается аутосомно-доминантное наследование), характеризуется болью в костях при движении, их деформацией, спонтанными переломами, атрофией мускулатуры конечностей. Нарушается деятельность центральной нервной системы, поражаются экстрапирамидные пути, возникают расстройства движения, отмечаются гинекомастия, гипергинетализм. В крови — гипофосфатемия, нормокальциемия. Рентгенологически определяется генерализованная атрофия костей, истончение компактного слоя, декальциноз.
3.3.2.27. Синдром Винчестера
Представляет собой комплекс наследственных аномалий (аутосомно-рецессивное наследование). Отмечаются низкий или карликовый рост, контрактуры конечностей, системный остеопороз, резорбция костей запястья и предплюсны, деструкция суставных и периартикулярных структур, подобная таковой при ревматоидном артрите, помутнение роговицы. В биоптатах кожи пролиферация фибробластов, набухание и дегенерация митохондрий (Лазовскис И.Р., 1981).
3.3.2.28. Полиостотическая фиброзная дисплазия (синдром Яффе — Лихтенштейна)
Наследственная болезнь начинается в возрасте между 5 и 15 годами и сопровождается истончением компактной кости, спонтанными переломами (чаще бедренной кости), болями в костях. Кости удлинены и изогнуты, изменения в них нарастают в проксимальном направлении. Содержание кальция и фосфора в крови нормальное, уровень ЩФ иногда повышается.
3.3.2.29. Изолированный дизостоз суставных эпифизов (синдром Риббинга)
В результате остеомаляции возникает деформация, «сморщивание» эпифизов различных костей, боль и скованность в суставах. Одновременно изредка отмечаются симптомы гипотиреоза.
3.3.2.30. Наследственный метафизарный энхондральный дизостоз (синдром Шмида)
Болезнь проявляется на 2-м году жизни задержкой роста, патологическими изменениями в метафизах костей. Рентгенологически обнаруживаются очаги уплотнения и остеопороза с неясными контурами, неровная эпифизарная линия.
3.3.2.31. Синдром Стиклера
Представляет собой комплекс наследственных аномалий суставов и глаз. На 34-м десятилетии жизни развивается артропатия, отмечаются сплющивание позвонков, кифоз, кифосколиоз.
3.3.3.32. Синдром Флинна — Эйрда (аутосомно-доминантное наследование)
Симптоматика появляется в возрасте 1220 лет. Развиваются системный остеопороз, кифосколиоз, кисты костей, невриты, парестезии, глухота, билатеральная катаракта, миопия, атипичный пигментный ретинит, судороги эпилептического характера. Атрофия мозга может сочетаться с эозинофильной гиперплазией передней доли гипофиза и гиперплазией коры надпочечников (Делягин В.М., Румянцев А., 2001).
3.3.2.33. Гиперкортицизм, ГК-остеопороз
ГК-остеопороз является результатом негативного влияния на костную ткань ГКС эндогенного и экзогенного происхождения. Эндогенный гиперкортицизм отмечается у пациентов с синдромом или болезнью Кушинга. Резкое повышение концентрации кортизола и АКТГ в плазме крови отмечается и при эктопической секреции АКТГ. Оно более значительно, чем при болезни Кушинга (за исключением карциноидной опухоли и опухоли вилочковой железы). Влиянием ГК обусловлены такие костно-мышечные проявления, как мышечная слабость, быстрая утомляемость, диффузный остеопороз, аваскулярный некроз. При болезни Кушинга поражаются позвонки, ребра, череп, тазовые кости, реже — трубчатые кости, развиваются патологические переломы позвонков, ребер (Арапова С.Д. и соавт., 1999; Lindsay R., 1990). Остеопороз обнаруживают у 91% обследованных с болезнью Кушинга, переломы тел позвонков или ребер — у 58% (Рожинская Л.Я., 1991). При действии ГКС на костную ткань обнаруживают (Reid I.R., 1989; Lukert B.P. et al., 1990; Рожинская Л.Я., 1991; Насонов Е.Л., 2004) следующие изменения:
- Увеличение количества остеокластов, усиление ими резорбции костной ткани.
- Снижение пролиферации (созревания предшественников) остеобластов, их функциональной активности; нарушение прикрепления к матриксу, синтеза коллагена I типа, неколлагеновых белков, формирования костной ткани.
- Подавление синтеза КМГБ-2 и специфического для остеобластов фактора транскрипции (связывающий фактор ядра альфа-1-2-1 (Cbfal-2) (основных факторов остеобластогенеза), стимуляцию транскрипционной активности PPARg2 (фактор транскрипции адипогенеза).
- Снижение уровня циркулирующего остеокальцина, продукции ПГЕ, ИПФР, ТФР.
- Угнетение активного транспорта кальция и фосфора в тонком кишечнике, их абсорбции в кишечнике (снижается синтез кальцийсвязывающего белка, возникает дефицит витамина D, разрушаются рецепторные зоны к кальцитриолу в слизистой оболочке), повышение почечной экскреции кальция. Развитие в результате этих изменений вторичного гиперпаратиреоза, усиление резорбции костной ткани.
- Снижение уровня гормонов гипофиза (соматотропной функции гипофиза), гонадотропина, лютеинизирующего гормона, продукции андрогенов надпочечниками. Снижение коцентрации эстрадиола, эстрона, дегидроэпиандростендиона сульфата, андростендиона, прогестерона (развитие гипогонадизма), в том числе в результате прямого влияния на яички и яичники.
- Угнетение формирования костной ткани как непосредственно, так и опосредованно через локальные регулирующие факторы: уменьшение образования ИПФР (стимулирует связывание белка), влияние на связывание ТФР-β.
- Развитие миопатии, слабости мышц (обусловливают прогрессирование остеопороза).
- Снижение уровня кальцитонина в крови (как базального, так и стимулированного), повышение экскреции оксипролина с мочой.
Таким образом, нарушение кальциево-фосфорного обмена при терапии ГК обусловлено их прямым действием на органы и ткани и опосредованным через влияние на кальцийрегулирующие гормоны. Аналогично ГК оказывают непосредственное отрицательное влияние на продукцию эстрогенов и тестостерона и опосредованно — через подавление секреции гонадотропина. ГК оказывают катаболическое действие на метаболические процессы в костной ткани, угнетают синтез коллагена, протеогликанов. Они оказывают прямое стимулирующее действие на секрецию ПТГ, повышают чувствительность к нему остеобластов (Reid J.P., 1989; Manning P.S. et al., 1992). ГК-индуцированный остеопороз сопровождается повышенной частотой возникновения апоптоза остеоцитов (Jilka R.L. et al., 1997; Weinstein R.S. et al., 1998) и остеобластов (Manolagas S.C., 1998). В исследованиях in vitro ГК подавляют образование остеопротегерина (который тормозит резорбцию кости), конкурентно стимулируют костную резорбцию. Предполагается, что в результате этого увеличивается продолжительность жизни зрелых остеокластов.
ГКС-терапия, угнетая формирование кости и усиливая резорбцию, разобщает процессы ремоделирования кости. При ГК-остеопорозе в большей степени поражается трабекулярная костная ткань (позвоночник, большие вертелы), чем кортикальная (длинные кости) (Насонов Е.Л., 2004). Потере костной ткани способствуют не только ГК, но и другие факторы риска — детский возраст, постменопаузальный период, низкий ИМТ, иммобилизация и т.д. «Порог переломов» у лиц, принимающих ГК, ниже, чем у лиц, не получающих их. Риск переломов костей скелета зависит от дозы ГК (риск переломов позвоночника составляет 30–40%). Остеопоротические переломы и/или остеонекроз развиваются у 50% пациентов, длительно леченных ГК. Переломы костей могут развиваться при более высокой МПКТ, чем при первичном остеопорозе. При ГКС-индуцированном остеопорозе отмечается повышение содержания кальция в крови и его экскреции с мочой, снижение содержания пиридинолина, дезоксипиридинолина в моче, ЩФ, остеокальцина, N- и T-терминальных телопептидов в крови. Пульс-терапия метилпреднизолоном смягчает негативное влияние ГКС на метаболизм костной ткани. Внутрисуставное введение ГК не влияет на резорбцию кости и временно ингибирует образование костной ткани. По мнению Е.Л. Насонова (2004), режим применения ГК через день не имеет никаких преимуществ перед «стандартным» (ежедневным) в отношении снижения риска развития остеопороза.
При гистоморфометрических исследованиях в кости обнаруживают уменьшение количества и снижение функции остеобластов, усиление остеокластической резорбции. При отмене ГКС, излечении эндогенного гиперкортицизма возможно устранение явлений остеопороза (Meunier P.J. et al., 1984; Pocokc N.A. et al., 1987; Manning P.J. et al., 1992; Рожинская Л.Я., 1999).
ГК-индуцированный остеопороз в 4–25% случаев сопровождается развитием асептического некроза чаще головки бедренной и плечевой кости (Socie G. et al., 1998). При длительном приеме ГК во всех частях скелета отмечается потеря костной ткани. При длительном применении ГК разницы между МПКТ поясничного отдела позвоночника и проксимального отдела бедренной кости не отмечается. Для ГК-индуцированного остеопороза характерна быстрая и ранняя потеря костной ткани. Наиболее быстрая потеря костной ткани (3–27%) развивается в течение первых 6–12 мес ГК-терапии (Насонов Е.Л., 2004). При прерывании терапии ГК наблюдается частичное восстановление костной массы. Степень потери костной ткани зависит от дозы КС — доза преднизолона, превышающая 7,5 мг/сут, обусловливает потерю костной ткани. При дозе ниже 7,5 мг/сут потеря костной ткани наблюдается у пациентов с дополнительными факторами риска. Применение преднизолона по 5 мг/сут у женщин пожилого возраста вызывает потерю костной ткани в проксимальном и дистальном отделе лучевой кости, пяточной кости. Данные метаанализа результатов контролируемых исследований свидетельствуют, что даже минимальные (2,5 мг) дозы ГК могут оказывать нежелательное действие на метаболизм костной ткани и способствовать уменьшению костной массы (Насонов Е.Л., 2004). Исследования В.В. Поворознюка (1999) выявили широкополосное ослабление ультразвука, индекса МПКТ у пациенток с ревматоидным артритом разного возраста (в диапазоне 20 лет–74 года), которые принимали КС. Риск развития остеопороза снижает пульс-терапия, локальное введение ГК. Следует назначать возможно низкие дозы ГК, снижать частоту их приема. Центральное место в профилактике и лечении ГК-остеопороза занимают препараты кальция и витамина D (или альфакальцидола). Лечение кальцием и витамином D показано всем больным, которым планируется длительная ГК-терапия. Для предотвращения развития ГК-индуцированного остеопороза В.В. Поворознюк и Н.В. Григорьева рекомендуют (2002) дополнительное введение 1500 мг кальция, 400 МЕ/сут витамина D. При развитии кальциурии следует использовать тиазидные диуретики. Ограничение поступления в организм натрия способствует гиперкальциурии. Прием только препаратов кальция не оказывает существенного влияния на развитие остеопороза (Насонов Е.Л., 2004). Эффективность ЗГТ для предотвращения потери костной ткани в начале ГК-терапии и у пациентов, применяющих ГК в средних и высоких дозах, не доказана. Отсутствуют данные об эффективности модуляторов эстрогеновых рецепторов у таких пациентов. В соответствии с международными рекомендациями определение МПКТ (позвоночника, проксимального отдела бедренной кости) методами костной денситометрии необходимо проводить у всех больных, которым планируется лечение ГК в дозе выше 7,5 мг/сут в течение более 6 мес. Наиболее информативно определение МПКТ проксимального отдела бедренной кости. Денситометрию следует проводить каждые 6 мес у пациентов, не применяющих антирезорбтивную терапию, и не реже 1 раза в год, применяющим ее (Насонов Е.Л., 2004). Целесообразно определять у женщин в пременопаузальный период уровень фолликулостимулирующего гормона и эстрадиола, у мужчин — свободного тестостерона. Для снижения риска развития остеопороза имеют значение: прием пищи с высоким содержанием кальция и витамина D, физические упражнения, регулярное пребывание на солнце, отказ от курения, приема алкоголя. Несмотря на то что главным фактором влияния ГК является снижение формирования костной ткани, целесообразно применение антирезорбентов (особенно у пациентов с малой массой костной ткани и переломами, а также при применении ГК в средних и высоких дозах). Препаратами выбора являются бисфосфонаты — алендроновая кислота, ризедроновая кислота (они показаны женщинам в постменопаузальный период). Следует учитывать, что сочетанное применение ГК, бисфосфонатов и НПВП повышает риск эрозивно-язвенных поражений пищевода и желудка. В таких случаях альтернативным препаратом является кальцитонин, который ингибирует желудочную секрецию. Достоинством бисфосфонатов являются их противовоспалительные свойства. Не доказана эффективность анаболических препаратов, фторидов. Протекторное действие НПВП на костную ткань, которое особенно эффективно на фоне применения ГК, связывают с их противовоспалительным действием.
Мероприятия по профилактике ГК-индуцированного остеопороза у женщин в постменопаузальный период (Поворознюк В.В., Григорьева Н.В., 2002):
- Использование у женщин в постменопаузальный период ГК в низких дозах и сокращение сроков их применения
- Применение препаратов с наименее выраженным остеопоротическим эффектом (дефлазакорт, метилпреднизолон)
- Выбор оптимального способа введения препаратов (при бронхиальной астме самым безопасным является ингаляционное введение, при ревматических заболеваниях — чередование перорального приема с внутримышечным, периартикулярным, лимфотропным введением)
- Выбор оптимальных схем (применение пульс-терапии меньше влияет на процессы ремоделирования, чем постоянный пероральный прием ГК)
- Устранение или уменьшение влияния других факторов риска уменьшения костной массы — курения, чрезмерного употребления алкоголя, недостаточной физической активности, голодания, гипертиреоза, гиперпаратиреоза
- Сохранение и поддержание положительного кальциевого баланса пероральным приемом препаратов кальция и/или дополнительным применением витамина D или его активных метаболитов
- ЗГТ (при отсутствии противопоказаний)
- Определение исходного уровня МПКТ и ее контроль каждые 12 мес при длительном применении ГК
3.3.2.34. Болезнь Педжета (деформирующая остеодистрофия, деформирующий остеит)
Заболевание неизвестной этиологии, для которого характерна прогрессирующая перестройка кости, замещение ее грубоволокнистой бесструктурной тканью с хаотичным расположением трабекул, гиперваскуляризацией участков костного мозга. Отмечается также пятнисто-очаговый вид структуры, напоминающий хлопья ваты (Насонова В.А. (ред.), 1983). Нормальная архитектоника кости исчезает как в корковом, так и губчатом веществе. При болезни Педжета наблюдается усиление активности остеокластов, что, в свою очередь, обусловливает активизацию остеобластов и образование новой костной ткани (то есть нарушается равновесие между остеобластическим костеобразованием и резорбцией кости остеокластами). Причина этих изменений не установлена. Для ранней остеолитической фазы характерно преобладание резорбции кости остеокластами. В следующую фазу наблюдается повышение активности остеокластов и остеобластов. В смешанную фазу обнаруживают резорбцию кости остеокластами, новообразование кости остеобластами. Структура вновь формируемой ткани дезорганизуется, кости истончаются, искривляются, становятся болезненными. Замещение дефектов происходит хаотично, участки с трабекулярным и мелкоячеистым строением чередуются и формируется мозаичная структура костной ткани, характерная для болезни Педжета. Разрушение костной ткани сопровождается разрастанием сосудов и фиброзом костного мозга. Изменения могут развиваться в одной (монооссальная) или нескольких (полиоссальная формы) костях скелета соответственно в 20 и 80% случаев (Finger D.R., 1999). При монооссальной форме чаще поражаются большеберцовые и подвздошные кости. Характерны гиперостоз (цилиндрическое утолщение кости), дугообразное искривление костей. Преимущественно поражаются (в убывающем порядке) кости таза, поясничный отдел позвоночника, бедренная кость, грудной отдел позвоночника, крестец, кости черепа, большеберцовая и плечевая кости. Суставы не поражаются (развиваются вторичные артрозные изменения, деформации). В длинных трубчатых костях процесс начинается с одного конца и распространяется по диафизу. Заболевание развивается преимущественно у лиц пожилого возраста и проявляется деформацией костей, патологическими переломами. Патологические переломы характеризуются строгой параллельностью поверхностей костных отломков («банановый перелом»). Чаще всего происходят переломы бедренной, большеберцовой, плечевой костей и предплечья. При поражении черепа наблюдается шероховатая наружная поверхность костей свода (он выглядит «курчавым»). Костные новообразования могут воздействовать на соседние ткани, в том числе на нервные стволы. Возможно развитие инсульта из-за сдавления кровеносных сосудов, сдавление нервов (черепно-мозговых, корешков спинно-мозговых нервов), спинного мозга. Остроту заболевания отражает активность ЩФ в плазме крови. Содержание в плазме крови кальция и фосфата в большинстве случаев соответствует норме (гиперкальциемия может развиться у иммобилизованных больных). О резорбции костной ткани свидетельствует повышенное выведение гидроксипролина и пиридинолина с мочой. Заболевание прогрессирует медленно. Редким осложнением болезни Педжета является остеосаркома, фибросаркома, доброкачественные гигантоклеточные опухоли. Из-за поражения слуховых костей, сдавления слухового нерва возможно развитие глухоты. При гиперкальциемии, гиперкальциурии развивается нефрокальциноз. На рентгенограммах костей скелета обнаруживают признаки остеолиза, новообразования костной ткани, сочетанные повреждения. Края диафизов длинных трубчатых костей остеолитически изменены и шероховаты (симптом «листа травы»). Отмечается выраженное утолщение трабекул в области соединений подвздошной и лонной, подвздошной и седалищной костей со стороны внутренней поверхности таза (рентгенологические симптомы «полей шляпы», «тазового кольца») (Finger D.R., 1999). Участки избыточного разрушения костного вещества в костях черепа обусловливают рентгенологическую картину «очагового» или «хлопьевидного» остеопороза. Лечение влючает НПВС, кальцитонин, бисфосфонаты (этидроновая, памидроновая кислота), пликамицин, хирургические вмешательства. После курса эффективного лечения возможна продолжительная ремиссия и даже полное выздоровление.
3.3.2.35. Рефлекторная симпатическая дистрофия (альгодистрофия)
Это синдром неизвестной этиологии, для которого характерна гиперфункция регионарной симпатической нервной системы. Он сопровождается локальной деминерализацией костной ткани, поражением сегментов опорно-двигательного аппарата, болью, нарушением функции, остеопорозом (Бунчук Н.В., 1997а). Также наблюдается отек, дистрофические изменения мягких тканей, подкожной клетчатки. Развитию синдрома могут предшествовать травмы, острые и хронические заболевания, применение медикаментов, беременность. Основным звеном патогенеза является гиперстимуляция регионарной симпатической нервной системы. В костной ткани, суставах, околосуставных тканях, подкожной клетчатке обнаруживают неспецифические морфологические изменения. Патологический процесс претерпевает три стадии:
1) отек и сосудистые нарушения;
2) развитие «трофических» изменений тканей;
3) стихание.
D.H. Collier (1999) также выделяет 4-ю стадию — психологическую. Первым (а затем постоянным) симптомом является боль. 1-я стадия заболевания длится несколько месяцев. На 2-й стадии в костях развивается остеопороз, в суставах — капсулит, выпот, явления фиброза и контрактур в околосуставных сумках, сухожилиях, апоневрозах, атрофия мышц, кожи, выпадение волос, истончение ногтей. Характерно поражение кисти, стопы, плечевого, тазобедренного, коленного суставов. При альгодистрофии кисти уже на 1-й стадии рентгенологически обнаруживают диффузный остеопороз. На 2-й стадии (длится 36 мес) выраженность диффузного остеопороза увеличивается, развивается «стеклянный» остеопороз (костная структура почти не различается). Аналогично развивается остеопороз костей стопы, головки плечевой кости, части или всей головки бедренной кости. При альгодистрофии области тазобедренного сустава (длится от 2 до 11 мес) остеопороз распространяется на кости таза и у 30% больных выявляется уже в первые 2 нед заболевания. При поражении коленного сустава остеопороз может захватить суставные части костей, надколенник. При синдроме рефлекторной симпатической дистрофии рентгенологически выявляют 5 видов резорбции кости (Collier D.H., 1999):
1. Истончение трабекулярной зоны кости в области метафиза (выглядит как лентовидный, пятнистый или периартикулярный остеопороз).
2. Субпериостальная резорбция кортикального слоя кости (наблюдаются неровность, гофрированные края с наружной стороны диафиза).
3. Внутрикортикальная резорбция (отмечается чрезмерная исчерченность, наличие туннелей в кортикальном слое кости параллельно ее продольной оси).
4. Эндостальная резорбция кости (изменяется толщина кортикального слоя кости, края эндооста неровные).
5. Субхондральные и околосуставные эрозии (выявляются как малые околосуставные участки снижения МПКТ и внутрисуставные щели в субхондральной кости).
По данным трехфазного сканирования с использованием технеция (99mТс) пертехнетата у пациентов с альгодистрофией обнаружено нарушение кровообращения и депонирования крови в костях. Наиболее типичным является альгодистрофия области плечевого сустава и кисти (синдром «плечо — кисть», синдром Штейнброкера). Возможен двусторонний синдром «плечо — кисть». У одного и того же больного может последовательно развиваться альгодистрофия различных локализаций.
3.3.2.36. Нейрогенные артропатии
Развиваются при нарушениях глубокой чувствительности иннервации суставов (Бунчук Н.В., 1997г) в результате разных заболеваний: сахарного диабета, сирингомиелии, спинной сухотки, повреждения центральной части спинного мозга (травма, опухоль, менингомиелоцеле, пернициозная анемия), поражения периферической нервной системы (алкоголизм, травма, семейная интерстициальная гипертрофическая полинейропатия Дежерина — Сотта, амилоидоз), врожденной нечувствительности к боли. Утрата глубокой болевой чувствительности и проприорецепции сочетается с гипотонией мышечно-связочного аппарата суставов, их нестабильностью, разрушением тканей, возникновением переломов, не сопровождающихся болью. В результате поражения симпатических нервных волокон нарушается регуляция тонуса сосудов, возникает их дилатация, усиливается остеокластическая резорбция костной ткани. Локализация нейроартропатии определяется уровнем неврологического поражения, который различен при указанных заболеваниях.
Для наследственных нейротрофических нарушений тканей нижних конечностей (синдром Тевенара) характерны изъязвления на подошве, остеопороз плюсневых костей и фаланг стоп. Синдром Райли — Дея (наследственная комплексная дисфункция вегетативной нервной системы) обусловливает развитие сколиоза, других ортопедических изменений.
3.3.2.37. Прогрессирующий оссифицирующий миозит
А.П. Крись-Пугач и соавторы (2002) впервые выявили остеопороз у детей с прогрессирующим оссифицирующим миозитом, характеризующимся прогрессирующим окостенением различных мышечных групп туловища и конечностей. Этиология заболевания не установлена. Отмечается аномальное костеобразование в соединительной ткани, нарушение структуры костной ткани, снижение ее МП.
3.3.2.38. Ортопедическая и травматологическая патология
Остеопороз различной степени выявляют у детей с различной ортопедической патологией. К этой патологии А.П. Крись-Пугач и соавторы (2002) относят спондило-эпифизарную дисплазию (некоторые формы), остеохондропатию позвоночника, сколиоз, дисхондроплазию, доброкачественные опухоли костей, фиброзную дисплазию, нейрофиброматоз. В 62,8% детей, больных сколиозом, определяют остеопению преимущественно в губчатой кости (Шевченко С.Д., Ермак Т.А., 2002). Снижается прочность и меняется форма позвонков. Частота выявления остеопении повышается с увеличением степени деформации и возраста больных. Дети со сколиозом к окончанию периода роста не достигают пика костной массы по возрастно-половой норме. На фоне остеопении сколиотическая деформация прогрессирует чаще, чем у больных без остеопении. Локальные формы остеопороза отмечают при воспалительных заболеваниях костей (остеомиелите, туберкулезе), опухолевых процессах в кости, врожденных пороках развития нижних конечностей. Изменения в костной ткани связывают с отсутствием механической нагрузки, нарушением кровообращения и иннервации. Нарушение кровообращения нижних конечностей сопровождается повышением скорости потери костной ткани в бедренной и пяточных костях (Vogt M.T. et al., 1997).
Травматическое повреждение костей является фактором риска развития остеопенического синдрома и остеопороза, поскольку на перелом реагирует костная система в целом (Виноградова Т.П., Лаврищева Г.И., 1974; Зупанец И.А. и соавт., 2002). Переломы сопровождаются потерей кальция и других минералов из костей скелета. Снижение МПКТ отмечается после перелома большеберцовой кости.
3.3.3. Эндокринная патология и остеопороз
3.3.3.1. Гипопитуитаризм
Причиной его развития чаще всего является опухоль гипофиза. Развитие остеопении обусловливают:
- недостаточная выработка СТГ;
- гипогонадотропный гипогонадизм;
- снижение продукции тиреоидных гормонов;
- развитие гиперкортицизма.
Считают (Bravenboer N. et al., 1997; Degerblad M. et al., 1992), что доминирующее значение в развитии остеопении и степени ее выраженности играет недостаточность СТГ, гипогонадизм (его длительность и выраженность), начало заболевания в раннем возрасте. ЗГТ сопровождается повышением МПКТ (Kaufman J.V. et al. 1992).
3.3.3.2. Дефицит соматотропного гормона (гормона роста)
СТГ является важным гормональным регулятором не только у детей, но и у взрослых. Причиной недостаточности СТГ у взрослых является развитие опухолей в области гипофиза. Механизм влияния СТГ на костную ткань окончательно не установлен. При его дефиците отмечается снижение метаболической плотности костной ткани, развивается остеопения в позвоночнике, трубчатых костях. К возможным механизмам действия СТГ R. Barnard и соавторы (1991) и M.B. Bengtsson (1994) относят:
- увеличение доступности минералов (СТГ активизирует 1б-гидроксилазу почек, которая превращает 25-ОН-D3 в 1,25-(ОН)2D3, в результате чего повышается абсорбция кальция и фосфатов в кишечнике);
- усиление пролиферации остеобластов (у них имеются рецепторы к СТГ).
Заместительная терапия СТГ у детей и взрослых сопровождается повышением МПКТ в трабекулярной и кортикальной части костей предплечья (Bengtsson M.B., 1994).
3.3.3.3. Акромегалия
Заболевание сопровождается повышением секреции гормона роста, однако гипогонадизм и усиление продукции ИПФР-1 способствуют повышению скорости ремоделирования костной ткани. МПКТ снижается по мере развития гипогонадизма. У больных с акромегалией по гистоморфологическим данным повышается скорость обмена кости и ее трабекулярного объема (Halse J. et al., 1981). Это обусловлено усиленным синтезом остеобластами протеинов матрикса. Введение гормона роста (0,1 МЕ 2 раза в сутки в течение 7 дней) сопровождается активизацией остеокластов и остеобластов (Brixen K. et al., 1990). Для заболевания характерны выраженная пролиферация костно-суставной ткани, артропатия, которая развивается в среднем через 10 лет от начала заболевания (Прокаева Т.Б., 1997). Клинически артропатия напоминает остеоартроз. Боли в суставах и позвоночнике могут появиться в самом начале болезни. Первыми, как правило, поражаются тазобедренные, коленные и плечевые суставы. Развивается утолщение мягких тканей и болезненная припухлость пястно-фаланговых, проксимальных межфаланговых суставов, суставов запястий. Может отмечаться утренняя скованность суставов. Рентгенологически обнаруживают расширение суставных щелей (утолщение хрящей), остеофитоз, экзостозы (синдром «барабанных палочек»), генерализованный остеопороз, нередко — хондрокальциноз суставов. Постепенно суставные щели суживаются. На рентгенограмме позвоночника обнаруживают кифоз, увеличение размера тел позвонков, кальцификацию связок, утолщение межпозвонковых дисков. Характерно увеличение размеров пяточной кости, изменение формы челюстей из-за экзостозов, утолщение свода черепа, увеличение придаточных пазух, затылочного бугра, размеров турецкого седла.
3.3.3.4. Гиперпролактинемия
Отмечаемое уменьшение костной массы обусловлено развитием гипогонадизма (Greenspan S.L. et al., 1986; 1989; Jackson J.A. et al., 1986).
3.3.3.5. Гипертиреоз
Избыток тиреоидных гормонов в организме (эндогенного и экзогенного происхождения) сопровождается развитием остеопороза. В основе их влияния — следующие эффекты (Greenspan S. et al., 1991): увеличение количества остеокластов, резорбционных поверхностей, нарушение соотношения резорбционных и костеобразующих пространств (преобладание активности резорбции над формированием кости). Ускорение метаболизма костной ткани, повышение резорбции кости сопровождается гиперкальциемией при одновременном снижении продукции ПТГ и 1,25-(ОН)2D3, всасывания кальция в кишечнике (Lalau J. et al., 1986). Кроме гиперкальциемии, можно обнаружить гиперкальциурию, гиперфосфатурию. Гормоны щитовидной железы не играют специфической роли в гомеостазе кальция: гиперкальциемия вызвана повышенной активностью остеокластов. Сопутствующий тиреотоксикоз может провоцировать симптоматическую гиперкальциемию у пациентов с субклинической формой гиперпаратиреоза. При гипертиреозе отмечают торможение синтеза гликозамингликанов в органическом матриксе (Baran D.T., Braverman F.E., 1991), ускорение процесса ремоделирования (повышение скорости резорбции и костеобразования одновременно), повышается распад гликогена, содержание в крови остеокальцина, активность ЩФ, что отражает усиление остеобластической функции. Уменьшается костная масса, МПКТ в проксимальных отделах бедренной кости, позвоночника (Greenspan S. et al., 1991), хотя переломы у больных с гипертиреозом случаются редко. По данным Л.Я. Рожинской (2000), остеопения, прежде всего, выявляется в костях с преимущественно кортикальным типом строения (при длительном течении заболевания наблюдается потеря как компактной, так и трабекулярной костной ткани). Резорбцию костей при этом отражают гиперкальциурия натощак, повышение экскреции оксипролина с мочой. При кратковременном течении болезни выраженная потеря костной ткани не развивается, так как Т3 и Т4 стимулируют резорбцию и формирование костной ткани. Адекватная терапия гипертиреоза, применение противоостеопоротических средств позволяет нормализовать метаболическую плотность костной ткани. При нормализации функции щитовидной железы восстанавливается абсорбция кальция в кишечнике.
Т3 и Т4 стимулируют костную резорбцию как in vivo, так и in vitro. Прием левотироксина натрия в течение 5 и более лет обусловливает снижение на 9–12,8% МПКТ предплечья, шейки бедра, позвонков поясничного отдела позвоночника. Подобные изменения обнаруживают при использовании левотироксина в высоких дозах у больных раком щитовидной железы (даже при приеме эстрогенов). Для предотвращения потери костной ткани необходимо применять левотироксин в минимальных дозах. Потерю костной ткани предотвращает ЗГТ эстрогенами в постменопаузальный период.
Тиреоидэктомия повышает риск переломов бедра. После тотальной резекции щитовидной железы снижается уровень кальцитонина в крови, изменяется ответ на инфузию кальция, снижается МПК.
Скелетно-мышечные проявления при гипертиреозе, кроме системного остеопороза, включают акропатию, периартрит, миопатию (Прокаева Т.Б., 1997). Акропатия проявляется утолщением дистальных фаланг пальцев по типу «барабанных палочек», отечностью мягких тканей кистей и стоп, скованностью суставов. Рентгенологически выявляют периостальные изменения диафизов костей. Наиболее часто развивается периартрит плечевых суставов, реже поражаются периартикулярные ткани коленных, тазобедренных, пястно-фаланговых, межфаланговых суставов. У большинства больных отмечают клиническое течение хронической тиреотоксической миопатии. В отдельных случаях развивается острая тиреотоксическая миопатия с возможными параличами и парезами.
При синдроме Олбрайта — комплексе врожденных аномалий (аутосомно-доминантное наследование) нередко выявляют гипертиреоз с экзофтальмом, раннее половое созревание у девочек, фиброзную дисплазию с болью в костях, со спонтанными переломами. Функция паращитовидных желез и содержание в крови кальция и фосфора соответствуют норме.
3.3.3.6. Гипотиреоз (врожденный, послеоперационный гипотиреоз, аутоиммунный тиреоидит)
При первичном (тиреогенном) гипотиреозе патологический процесс локализуется в щитовидной железе, при вторичном — в гипофизе, при третичном — в гипоталамусе. Причиной первичного гипотиреоза являются наследственные дефекты в биосинтезе тиреоидных гормонов, гипоплазия и аплазия щитовидной железы, воспалительный и аутоиммунный процессы, тиреоидэктомия, недостаточное поступление в организм йода. При вторичном гипотиреозе снижена секреция тиреотропного гормона, третичном — тиреотропин-рилизинг-гормона (тиролиберина). Метаболизм костной ткани поражается не только при избытке тиреоидных гормонов, но и их недостатке в организме. При врожденном гипотиреозе у детей формируется низкий пик костной массы, замедленно формируются трабекулярные и кортикальные костные структуры (Марова Е.И. и соавт., 1999). У больных с гипотиреозом обнаруживают: снижение содержания кальция в крови и его выведения с мочой; повышение секреции ПТГ, 1,25-(ОН)2D3; снижение скорости костной резорбции и формирования (образования) костной ткани, то есть замедление процесса ремоделирования. Развитие остеопороза при первичном гипотиреозе, по мнению R. Smith (1990), обусловлено нарушением синтеза белка, формирования органического матрикса. Потеря кости наблюдается в центральном и периферическом скелете. ЗГТ может ускорять уменьшение массы костной ткани. Прием тиреоидных гормонов сопровождается быстрой потерей костной массы. У женщин с нелеченым гипотиреозом установлено (Рожинская Л.Я., 2000) снижение костеобразования и костной резорбции при отсутствии остеопении в позвоночнике и проксимальных отделах бедренных костей. У пациенток, принимающих ЗГТ, автор обнаружила наиболее выраженную остеопению в случаях врожденного гипотиреоза. Остеопению проксимальных отделов бедра Л.Я. Рожинская (2000) выявила у женщин с послеоперационным гипотиреозом. По данным Е.И. Маровой и соавторов (1999), на развитие остеопении при гипотиреозе оказывают влияние длительность терапии препаратами тиреоидных гормонов, раннее (в молодом возрасте) начало заболевания, тиреотоксикоз в анамнезе. Длительная ЗГТ левотироксином может обусловить отрицательный кальциевый баланс, вторичный гиперпаратиреоз.
Гипотиреоз сопровождается развитием артропатии и миопатии, вследствие которых возникает обездвиживание больных, усугубление явлений остеопороза. Для артропатии характерна боль, припухлость, скованность суставов, наличие выпота невоспалительного характера (Прокаева Т.Б., 1997). Наблюдается симметричное поражение суставов: коленных, лучезапястных, пястнофаланговых, проксимальных межфаланговых, плюснефаланговых. Возможно развитие деструкции костей. Иногда формируются кисты Бейкера, развивается ишемический некроз костей (полулунной кости, бугристости большеберцовой кости, бедренных костей). Отмечаются слабость и скованность мышц, двигательные расстройства. Возможно развитие миопатии с мышечной гипертрофией (синдром Гоффмана), для которой характерно увеличение объема мышц и их плотности.
3.3.3.7. Гиперпаратиреоз
В Украине проблема гиперпаратиреоза недостаточно изучена. Заболеваемость гиперпаратиреозом составляет 25–28 случаев на 100 000 человек в год (Бондар П.М. (ред.), 2002). По частоте выявления среди заболеваний эндокринной системы гиперпаратиреоз находится на 3-м месте после сахарного диабета и гипертиреоза. Частота первичного гиперпаратиреоза среди населения колеблется от 0,1 до 2%, а в популяции женщин в возрасте старше 60 лет составляет 1,5% (Головач I.Ю., Попович В.I., 2003). Заболеваемость среди женщин и мужчин составляет 3:1, в постменопаузальный период — 5:1. Причиной повышенной функции паращитовидной железы может являться аденома (аденомы могут быть множественными и носить семейный характер), гиперплазия, карцинома паращитовидной железы. К характерным проявлениям первичного гиперпаратиреоза относятся боль в костях, субпериостальная резорбция, рентгенологические признаки — ограниченные зоны костной резорбции (череп, напоминающий «смесь перца и соли»), костные кисты (Маршалл В.Дж., 2002). Причиной этих изменений является повышение активности остеокластов. В результате повышения активности остеобластов повышается активность ЩФ. На ранней стадии (до поражения костей) отмечается гиперкальциемия на фоне еще нормальной активности ЩФ в плазме крови. По мнению У. Клаттера (1995), первичный гиперпаратиреоз является основной причиной гиперкальциемии у амбулаторных больных. Особенно эта патология распространена у женщин пожилого возраста (2:1000 женщин в год). 85% случаев обусловлены аденомой одной из паращитовидных желез, 15% — гиперплазией всех четырех желез, 1% — карциномой паращитовидной железы. Чаще гиперкальциемия протекает бессимптомно, обнаруживается случайно по результатам биохимического скрининга. Также возможны клинические проявления гиперкальциемии, почечно-каменной болезни, остеопения кортикальных слоев (преимущественно) костей, иногда — фиброзная остеодисплазия. Гиперсекреция паратиреоидного гормона сопровождается:
- преобладанием костной резорбции над костеобразованием;
- возникновением отрицательного костного баланса;
- гиперкальциемией;
- развитием системного (генерализованного) остеопороза;
- снижением реабсорбции фосфора в проксимальных канальцах, фосфатурией;
- гипофосфатемией;
- гиперкальциурией;
- повышением активности ЩФ в плазме крови (у 20–30%).
Концентрация ПТГ (интактного гормона) в плазме крови обычно повышена, иногда соответствует верхней границе нормы. Результаты определения ПТГ следует сопоставлять с концентрацией кальция в плазме крови. Концентрация кальция повышена почти всегда, за исключением случаев с сопутствующей почечной недостаточностью, дефицитом витамина D или гипотиреозом. В таких случаях содержание кальция повышается скачкообразно (Маршалл В.Дж., 2002). Не всегда наблюдается гипофосфатемия: концентрация фосфата может быть нормальной или повышенной при нарушении функции почек. Гиперкальциурия не является диагностическим признаком: она отражает гиперкальциемию.
Больные жалуются на боль в трубчатых костях, стопах (в том числе при пальпации), которая усиливается при движении. Наблюдаются переломы различных костей при травмах, а также спонтанные. Компрессионные переломы позвонков отмечают у 5–10% больных с фиброзным остеитом. Хирургическое лечение с последующей противоостеопоротической терапией позволяет достичь эффекта. Больные с умеренной (ниже 3 ммоль/л) бессимптомной гиперкальциемией многие годы могут оставаться здоровыми. Они представляют группу повышенного риска развития остеопороза и почечной недостаточности. У лиц, которые раннее перенесли оперативное вмешательство, проводится сканирование с технецием (99mTc) сестамиби. Риск смерти при первичном гиперпаратиреозе ассоциируется с гиперкальциемией, остеопорозом, возрастом больных, низким ИМТ.
Развитие первичного гиперпаратиреоза в постменопаузальный период усугубляет течение первичного остеопороза. У 50% пациенток отмечается ускорение метаболизма костной ткани, увеличение количества остеокластов, остеобластов, выраженная потеря компактной костной ткани. Хирургическое лечение первичного гиперпаратиреоза сопровождается медленным повышением плотности костной ткани. Такая положительная динамика наблюдается не у всех пациентов. Первичный гиперпаратиреоз сопровождается резорбцией костной ткани, гиперкальциемией, повышением канальцевой реабсорбции кальция и абсорбции Са2+ в тонком кишечнике. Удаление аденомы паращитовидной железы приводит к увеличению костной массы.
Вторичный гиперпаратиреоз в постменопаузальный период у лиц пожилого возраста ухудшает течение болезней кишечника, почек, обусловливающих вторичный остеопороз в результате нарушения метаболизма витамина D.
Осложнением первичной или вторичной гиперфункции паращитовидных желез является болезнь Реклингхаузена (фиброзно-кистозный остеит). Обычно болеют женщины. Болезнь сопровождается обеднением костей кальцием (в первую очередь поражаются кости конечностей, таза, черепа, ребра). В костях возникают множественные кисты, истончается кортикальный слой, в губчатом веществе откладывается фиброзная ткань. У больных развивается гиперкальциемия, гиперкальциурия, снижается количество фосфора в сыворотке крови, повышается активность ЩФ. Однако описаны случаи нормокальциемии у лиц с развившимся фиброзным остеитом. Клинически фиброзно-кистозный остеит сопровождается болью в костях. Кисты и гигантоклеточные опухоли могут пальпироваться. Возникают искривления костей, несущих высокую нагрузку, — голеней, бедер, костей таза, усиливаются изгибы позвоночника, меняется форма грудной клетки. У 35% больных гиперпаратиреозом обнаруживается хондрокальциноз. Кальцифицируются мениски, хрящи коленных и лучезапястных суставов. Развивается миопатический синдром с преимущественным поражением проксимальных отделов рук и ног. Следует учитывать, что любая форма гиперпаратиреоза сопровождается болью в костях (особенно выраженной в позвоночнике), вялостью, отсутствием аппетита, болью в эпигастральной области, тошнотой, рвотой, тахикардией, часто — почечной коликой.
Возможно сочетание гиперпаратиреоза с болезнью Педжета (деформирующим остеитом). Кости становятся более широкими, разрыхленными, деформируются большеберцовые кости, кости черепа, тазовые, ключицы, позвоночника (изменения всегда выявляются на вскрытии). Усиливается дорсолюмбальный лордоз, появляется горб, уменьшается рост в результате укорочения позвоночника. Повышается активность ЩФ в сыворотке крови, увеличивается выведение кальция с мочой. Характерны боль в костях, головная боль, радикулярный синдром (паралич глазной мышцы, нарушения чувствительности в области конечностей, ишиас), возможны эпилепсия, несахарный диабет.
Гиперпаратиреоз возможен при трех наследственных синдромах: множественном эндокринном аденоматозе I (синдроме Вермера) и II типа (синдроме Сиппла), семейной гипокальциурической гиперкальциемии. При синдроме Вермера имеется аденоматоз гипофиза, поджелудочной и околощитовидных желез. Аденома паращитовидных желез обусловливает гиперпаратиреоз. Аденома гипофиза протекает с клиникой акромегалии или болезни Кушинга, которые также приводят к развитию остеопороза. Известны два варианта синдрома Сиппла: при варианте IIA отмечается гиперпаратиреоз, медуллярный рак щитовидной железы и феохромоцитома, при IIБ — медуллярный рак щитовидной железы, феохромоцитома, множественный нейроматоз слизистых оболочек рта, пищеварительного тракта, деформации скелета (Чиркин А.А. и соавт., 1993). Семейная гипокальциурическая гиперкальциемия развивается в молодом возрасте и характеризуется доброкачественным течением. Гиперпаратиреоз проявляется гиперкальциемией, гипермагниемией в сочетании со сниженной экскрецией кальция и магния с мочой. Характерное для гиперпаратиреоза возникновение камней в почках, язвы желудка в данном случае не наблюдается.
Псевдогиперпаратиреоз (эктопированный гиперпаратиреоз) отмечается при злокачественных опухолях различной локализации — бронхогенном раке, раке молочной железы и др. В этих случаях злокачественные опухоли секретируют ПТГ или ПТГ-подобное вещество.
3.3.3.7.1. Вторичный и третичный гиперпаратиреоз
Вторичный гиперпаратиреоз является компенсаторной реакцией на длительную гипокальциемию, развивающуюся чаще при нарушении процессов всасывания в кишечнике (мальабсорбции), гастрэктомии, рахите, синдроме Фанкони, ХПН, применении противосудорожных препаратов. Содержание кальция в сыворотке крови снижено или в пределах нормы. Концентрация неорганического фосфата в крови повышена при почечной форме, снижена при кишечной. При постоянной и длительной гипокальциемии возникает гиперплазия паращитовидных желез с возможной трансформацией в аденому. Концентрация ПТГ может повышаться при хронических заболеваниях почек, недостаточности витамина D. В этих случаях снижается синтез кальцитриола, развивается гипокальциемия, которая обусловливает повышение секреции ПТГ (развитие вторичного гиперпаратиреоза). Повышение секреции ПТГ не сопровождается нормализацией концентрации кальция в плазме крови, так как из-за низкого содержания кальцитриола не происходит мобилизация кальция из костной ткани под действием ПТГ. Гиперкальциемия может возникать на стадии почечной недостаточности, а также после трансплантации почки (восстанавливается выработка кальцитриола). Последнее состояние называют третичным гиперпаратиреозом (Маршалл В.Дж., 2002). В обычных условиях нормальная или повышенная концентрация кальция по закону обратной связи ингибирует выделение ПТГ и содержание кальция в крови поддерживается на нормальном уровне. Третичный гиперпаратиреоз является следствием нарушения обратной связи на фоне длительно текущего вторичного гиперпаратиреоза. Пересадка почки выявляет третичный гиперпаратиреоз: секреция ПТГ остается повышенной, несмотря на нормализацию концентрации кальция в крови (в связи с улучшением функции почки) и способствует дальнейшему разрушению кости.
ПТГ частично метаболизируется и экскретируется почками. При почечной недостаточности содержание ПТГ в плазме крови повышается из-за нарушения этих процессов, а также по причине усиления секреции. При этом ПТГ состоит из С-терминальных фрагментов, которые неактивны в процессе поддержания гомеостаза кальция. Уровень ПТГ зависит от уровня клубочковой фильтрации, канальцевой реабсорбции, интерканальцевого протеолиза. Повышение уровня ПТГ при ХПН обусловлено снижением его метаболизма в почках, уменьшением количества рецепторов к ПТГ, развитием резистентности к нему периферических тканей. Допустимым уровнем ПТГ у пациентов с ХПН считают 9–18 пмоль/л (у здоровых лиц его уровень составляет 16,8 пмоль/л). Гиперсекреция ПТГ сопровождается активацией остеокластов, нарушением функции остеобластов, их способности к синтезу компонентов матрикса. Резорбцию костей обусловливает отмечающийся при ХПН хронический ацидоз. Эти изменения сопровождаются болью в костях, мышцах, компрессионными переломами тел позвонков. Происходящее накопление кальция в организме, гиперфосфатемия сопровождаются развитием кальцинатов, зудом кожи.
3.3.3.8. Гипопаратиреоз, псевдогипопаратиреоз, псевдо-псевдогипопаратиреоз
Гипопаратиреоз может быть врожденным (в результате иммунологической недостаточности, аплазии вилочковой железы, синдрома Ди Джордже) и приобретенным. К причинам приобретенной формы относят аутоиммунный процесс, оперативное вмешательство (тиреоидэктомия), гемохроматоз. Возможен идиопатический вариант заболевания. При гипопаратиреозе нарушается α-гидроксилирование 25-ОН-D3, не образуется кальцитриол. Для гипопаратиреоза типичным является сочетание гипокальциемии, гиперфосфатемии, нормальной активности ЩФ. Хроническая гипокальциемия может не проявляться. Можно обнаружить положительные симптомы Хвостека и Труссо, катаракту. Предполагают, что причиной развития катаракты является отложение в хрусталике кальция фосфата, содержание которого повышено. В ряде случаев при первичном гипопаратиреозе развивается поражение позвоночника, напоминающее идиопатический анкилозирующий гиперостоз скелета, сопровождающееся жалобами на скованность, ограничение движений. Характерна кальцификация мягких тканей. Поскольку клиническая симптоматика гипопаратиреоза в основном обусловлена дефицитом кальция, следует учитывать, что к развитию гипокальциемии приводят следующие заболевания и состояния (Балаболкин М.И., 1989):
- Недостаточность секреции ПТГ:
а) гипопаратиреоз аутоиммунного генеза (полиэндокринный синдром с недостаточностью многих эндокринных желез и кандидозом); синдром Ди Джордже — агенезия околощитовидных желез, аплазия вилочковой железы, пороки развития, иммунологическая недостаточность;
б) гипопаратиреоз послеоперационный и после лечения радиоактивным йодом;
в) травма, туберкулез, саркоидоз паращитовидных желез;
г) гипопаратиреоз вследствие первичной или вторичной опухоли шеи с разрушением околощитовидных желез.
- Функциональный гипопаратиреоз (недостаточная секреция ПТГ в ответ на гипокальциемию):
а) гипопаратиреоз новорожденных, родившихся от матерей с гиперпаратиреозом;
б) идиопатическая неонатальная гипокальциемия;
в) гипомагниемия (мальабсорбция, рвота, диарея, стеаторея, сахарный диабет, алкоголизм);
г) недостаток витамина D.
- Периферическая резистентность к ПТГ:
а) псевдогипопаратиреоз (синдром Олбрайта);
б) гипомагниемия;
в) ХПН;
г) недостаток витамина D.
- Гипокальциемия ятрогенной природы:
а) введение фосфатов;
б) введение этилендиаминтетраацетата (ЭДТА);
в) введение пликамицина, актиномицинов, неомицина;
г) применение тиазидных диуретиков;
д) длительный прием фенобарбитала;
е) длительный прием слабительных;
ж) массивная инфузия цитратной крови;
з) передозировка кальцитонина.
Псевдогипопаратиреоз является врожденным заболеванием. По клинике он напоминает гипопаратиреоз, но концентрация ПТГ в плазме крови повышена. Известно два типа заболевания. При первом типе заболевания нарушен процесс активации аденилатциклазы и в ответ на связывание ПТГ с рецептором не происходит образование цАМФ. При втором типе цАМФ образуется, однако реакция на него заблокирована. Оба типа заболевания можно дифференцировать: после введения ПТГ при псевдогипопаратиреозе второго типа (и у здоровых лиц) содержание цАМФ в моче повышается, при первом — нет. Для псевдогипопаратиреоза первого типа характерны изменения скелета: низкий рост, укорочение IV и V пястной и плюсневой костей, тенденция к экзостозам, округлое лицо. Возможна задержка умственного развития. При псевдо-псевдогипопаратиреозе характерны подобные нарушения строения скелета, однако коцентрация кальция в плазме крови остается на уровне нормы. При наследственном семейном псевдогипопаратиреозе с гипокальциемической, устойчивой по отношению к ПТГ тетанией (синдроме Мартина — Олбрайта), наблюдается гипоплазия зубной эмали с ранним выпадением зубов, укорочение пальцев локтевой стороны, хроническая гипокальциемия, гиперфосфатемия. Уровень ЩФ нормальный.
При синдроме Костелло — Дента отмечают диспаратиреоидизм в сочетании с признаками гипо- и гиперпаратиреоидизма. Отмечается фиброзная генерализованная остеопатия (декальцинация и множественные кисты костей, псевдоартрозы), повышение уровня ЩФ в крови, гиперфосфатемия, гипокальциемия, гипокальциурия, припадки тетанических судорог.
Псевдогипопаратиреоз и псевдо-псевдогипопаратиреоз выявляются редко.
Следует учитывать, что для секреции ПТГ и его действия на ткани-мишени необходим магний и его дефицит может сопровождаться гипокальциемией, развитием невосприимчивости организма к лечению гипокальциемии витамином D и препаратами кальция.
3.3.3.9. Гипогонадизм
У большинства девочек пубертатный период начинается в возрасте 13 лет. Задержка начала пубертатного периода проявляется отсутствием развития молочных желез, аменореей. Если отсутствие развития молочных желез наблюдается в возрасте 13 лет, а первичная аменорея — старше 15 лет, девочки нуждаются в обследовании. Причиной таких проявлений является гипогонадизм (гипогонадотрофический — первичная недостаточность яичников, гипергонадотрофический — вторичный вследствие поражения гипофиза, гипоталамуса) или хронические заболевания, например кишечника, ХПН (Маршалл В.Дж., 2002). Продукция гипофизом гонадотропных гормонов снижается при краниофарингоме, синдроме Шиена, аденоме гипофиза, синдроме персистирующей лактореи-аменореи, др. Первичный гипогонадизм может быть врожденным (синдром Тернера, различные варианты синдрома Нунана), приобретенным вследствие аутоиммунного оофорита, влияния ионизирующей радиации, химио- или лучевой терапии, хирургического удаления яичников, повреждения яичников инфекционным процессом (эпидемический паротит, туберкулез, сифилис). Первичная аменорея (менструаций никогда не было) является компонентом синдрома женского гипогонадизма, однако отмечается иногда у женщин с нормальной фертильностью. Причиной аменореи может быть дисфункция гипоталамо-гипофизарной системы, связанная с уменьшением массы тела. Эта дисфункция (на фоне аутоиммунного процесса) может вызывать гиперпролактинемию, нарушение функции яичников. Аменорею может обусловливать повышенная продукция андрогенов при поликистозе яичников, позднем проявлении врожденной гиперплазии надпочечников (отмечаются гирсутизм, вирилизация). Аменорея развивается при уменьшении массы тела меньше 75% от нормы. После восстановления массы тела менструации возобновляются. Уменьшение массы тела сопровождается снижением частоты пульсовой секреции гонадотропин-рилизинг-гормона, уменьшением выработки лютеинизирующего гормона и фолликулостимулирующего гормона гипофиза. В результате сложных нейроэндокринных изменений, а также уменьшения массы тела к аменорее могут привести тяжелый стресс, интенсивные физические упражнения (бег на длинные дистанции, гимнастика, балет). Аменорея у женщин-атлетов вызывается гипоталамическим гипогонадизмом и сопровождается интенсивной потерей костной массы. Снижение тренировочных режимов способствует восстановлению костной массы. Причиной развития аменореи может быть нарушение функции матки. Плотность костей центрального скелета коррелирует с числом менструальных циклов, их продолжительностью (Georgiou E. еt al., 1989; Fox K.M. et al., 1993). У женщин с ановуляторными менструальными циклами и дефектами лютеинизирующей фазы потеря костной массы позвонков отмечается и при отсутствии аменореи (Prior J.C. et al., 1990). Секреция тестостерона стимулируется лютеинизирующим гормоном гипофиза, сперматогенез зависит от тестостерона и от фолликулостимулирующего гормона. Андрогены вырабатываются и надпочечниками. Секреция тестостерона у мужчин сохраняется на протяжении всей жизни, секреция эстрогенов у женщин снижается после менопаузы. Потеря костной ткани у мужчин происходит в связи со снижением функции яичек. Гипогонадизм обусловливает нарушение метаболизма кальция, уменьшение костной массы, переломы позвонков. МПК снижена у мужчин, в анамнезе которых позднее половое созревание. Гипогонадизм у мужчин также может быть первичным и вторичным (в результате нарушения функции гипофиза или гипоталамуса). К врожденным причинам первичного гонадизма у мужчин относятся агенезия яичек, нелеченый крипторхизм, синдром Кляйнфелтера, дефекты 5б-редуктазы. Приобретенные причины первичного гипогонадизма включают двусторонний орхит, варикоцеле, прием цитостатиков, травму или хирургическое удаление гонад, инфекционный процесс (эпидемический паротит, сифилис, гонорея), действие ионизирующей радиации. Вторичный гипогонадизм у мужчин развивается в результате пангипопитуитаризма, опухоли гипофиза (особенно обусловливающей гиперпролактинемию), заболеваний гипоталамуса (синдром Каллмена). У взрослых мужчин с поздним половым созреванием в анамнезе МПКТ снижена по сравнению с теми, у которых созревание наступило своевременно. Дефицит половых гормонов (эстрогенов, андрогенов) сопровождается снижением костного метаболизма, нарушением метаболизма кальция, уменьшением костной массы. Эти гормоны, судя по наличию эстрогенных и андрогенных рецепторов на остеобластоподобных клетках (Reid I.R. et al., 1993), непосредственно влияют на синтез костной ткани. Остеопороз при гипогонадизме у женщин по механизмам развития и степени выраженности не отличается от постменопаузального. У больных с гиперпролактинемическим гипогонадизмом отсутствуют биохимические признаки повышенной костной резорбции, у них снижается содержание остеокальцина в крови, отрицательно коррелирующего с уровнем пролактина в крови (Рожинская Л.Я., 1999). При дефиците тестостерона снижается секреция кальцитонина, нарушается синтез 1,25-(ОН)2D3. Пациенты нуждаются в патогенетической терапии — назначении половых гормонов. При лечении андрогенами увеличивается масса кости. Влияние тестостерона проявляется в отношении как губчатой, так и компактной кости. Состояние костной ткани улучшается после устранения гиперпролактинемии.
Резкое нарушение развития гонад (дисгенезия) в ранний эмбриональный период происходит при синдроме Шерешевского — Тернера — заболевании, обусловленном аномалией половых хромосом и выявляемым относительно редко (1:3000 родившихся девочек). Эта аномалия приводит и к различным соматическим аномалиям (Потемкин В.В., 1978). От генной патологии зависят сопутствующие характерные симптомы: задержка роста (обычно не выше 150 см), аномалии скелета (вдавление в области грудины, укорочение IV и V пястных костей, отставание «костного» возраста от «паспортного» на 3–3,5 года, высокое твердое небо, умеренный остеопороз и др.), пороки развития внутренних органов (дефект межжелудочковой перегородки, незаращение артериального протока, стеноз легочной артерии, перешейка аорты, удвоенные лоханки, гипоплазия почек, подковообразная почка и др.), дефекты органа зрения (косоглазие, птоз верхнего века, дальтонизм и др.). Отмечается выраженная атрофия матки и яичников, вторичные половые признаки слабо выражены или отсутствуют. При рентгенологическом исследовании костей выявляется гипертрофический остеопороз с наличием кистоподобных дефектов костного вещества с четкими границами. Также отмечаются патологическое синостозирование в метаэпифизарных зонах скелета, аномалии развития костей — чаще в лучезапястных суставах (деформация Маделунга), костях кистей (укорочение фаланг пальцев), коленных суставах и позвоночнике.
Причиной гипогонадизма (и развития системного остеопороза) может быть гиперпролактинемический синдром — клинический симптомокомплекс, развивающийся в результате длительного повышения секреции пролактина (табл. 3.6). Пролактин секретируется гипофизом, эндометрием, клетками иммунной системы (преимущественно Т-лимфоцитами). Его секреция регулируется гипоталамусом с помощью дофамина (регуляция осуществляется по принципу обратной связи). Предполагается наличие в гипоталамусе пролактолиберина, стимулирующего секрецию пролактина, и пролактостатина, ингибирующего продукцию пролактина аденогипофизом (Окороков А.Н., 2000). Продукцию пролактина стимулирует также тиролиберин и вазоактивный интестинальный полипептид. Хроническая гиперпролактинемия (первичная и вторичная) нарушает циклическое выделение гонадотропинов, снижает частоту и амплитуду пиков секреции лютеотропного гормона, ингибирует действие гонадотропинов на половые железы, вследствие чего развивается синдром гипогонадизма. У женщин отмечаются нарушение менструального цикла (отсутствие первой менструации, недостаточность функции желтого тела, ановуляторные циклы, опсоменорея, олигоменорея, аменорея, др.), нарушение половой функции, гипоплазия матки, бесплодие и др. Наиболее частой причиной развития гиперпролактинемии у мужчин является макропролактинома.
3.3.3.10. Сахарный диабет
Остеопороз преимущественно характерен для больных сахарным диабетом I типа: он развивается при недостаточной выработке инсулина. Инсулин активизирует белковый синтез, стимулирует синтез костного матрикса, обеспечивает поступление аминокислот в костную ткань (Cokolic M., 1998). При дефиците инсулина нарушается синтез и состав протеогликанов в хрящах и костях. К патогенетическим механизмам развития остеопороза относят:
- усиление костной резорбции в результате прямого влияния высокой концентрации глюкозы посредством продуктов гликозилирования;
- снижение выработки остеобластами коллагена, ЩФ;
- уменьшение стимуляции остеобластов посредством ФР (ИПФР и др.);
- недостаток активных метаболитов витамина D, сопровождающийся снижением всасывания кальция в кишечнике, усилением секреции и активности ПТГ;
- отрицательный баланс кальция в организме, усиление резорбции костной ткани;
- нарушение кровообращения в костях (в результате ангиопатии) с развитием остеопении;
- гипогонадизм у пациентов молодого возраста (с сахарным диабетом I типа) и дефицит СТГ;
- наличие таких факторов риска развития остеопороза, как дефицит массы тела, воспалительный процесс.
Наблюдается снижение МПКТ в области шейки бедра, большого вертела. В исследованиях, проведенных В.В. Поворознюком и соавторами (2001), установлены выраженные изменения структурно-функционального состояния костной ткани у девочек 11–17 лет с сахарным диабетом I типа. Сведения о состоянии костной ткани у пациентов с сахарным диабетом II типа противоречивы. Данные исследований у пациенток с сахарным диабетом II типа свидетельствуют, что масса тела является более важным фактором, определяющим МПКТ, чем гиперинсулинемия или резистентность к инсулину. Избыточная масса тела, ожирение предохраняют от развития остеопороза (в периферической жировой ткани усиливается превращение тестостерона в эстрадиол, андростендиона в эстрон). Нейропатия, гипогликемия, поражение сосудов (в том числе ретинопатия) обусловливают падения, переломы костей. У пациенток с сахарным диабетом II типа снижается содержание уровня остеокальцина, активность остеобластов, формирование костной ткани. При сахарном диабете отмечается нарушение всасывания Са2+, связанное с нарушением метаболизма витамина D (снижается концентрация кальцитриола).
Декомпенсация сахарного диабета сопровождается повышением секреции контринсулярных гормонов (глюкагона, ГК, соматотропина), снижением — половых гормонов. Эти изменения обусловливают активизацию остеокластов, усиление катаболических процессов в костном матриксе (Thomas D.M. et al., 1997). Катаболические процессы в костной ткани усиливаются при кетоацидозе. При развитии диабетической нефропатии, ХПН нарушается синтез 1,25-(ОН)2D3, снижается всасывание кальция в кишечнике. Результатом этих изменений является развитие вторичного гиперпаратиреоза, усиление остеокластического остеолиза.
У больных сахарным диабетом часто отмечают ограничение подвижности различных суставов (без признаков воспаления), развитие контрактур, «руки диабетика» (диабетической хейропатии). Усиленное образование фиброзных тканей объясняют не повышением синтеза коллагена, а его ускоренным созреванием (Прокаева Т.Б., 1997). Нарушается синтез компонентов межклеточного матрикса, протеогликанов. В результате дегенеративных изменений эпифизов костей, суставных хрящей, действия нейрогенных факторов развивается диабетическая остеоартропатия, диабетическая стопа. Часто поражаются суставы нижних конечностей, что связывают с повышенной физической нагрузкой, предплюсне-плюсневые, плюснефаланговые, голеностопные, реже — коленные, тазобедренные, суставы рук, поясничный отдел позвоночника. При рентгенологическом исследовании обнаруживают умеренный эпифизарный остеопороз, субхондральный остеосклероз, краевые остеофиты. Возникают переломы, деформация суставов, обусловленные диффузным остеопорозом. Все же у большинства больных наблюдается только арталгия, связанная с поражением периферической нервной системы. У пациентов с сахарным диабетом повышена частота заболеваний околосуставных тканей.
Вторичный гликогеноз у детей с сахарным диабетом (синдром Мориака) сопровождается задержкой роста, запоздалым окостенением, системным остеопорозом, повышенным содержанием липидов в крови, гиперхолестеринемией.
3.3.3.11. Хроническая недостаточность коры надпочечников (болезнь Аддисона)
При болезни Аддисона повышается продукция АКТГ, меланоцитостимулирующего гормона. Недостаток ГК и минералкортикоидов является причиной избыточного выделения натрия с мочой (в крови концентрация натрия снижается). Развивается деминерализация костей, атрофия половых органов. Содержание кальция в сыворотке крови иногда повышается до 4,24 ммоль/л (17 мг/100 мл) (Балаболкин М.И., 1989). Гиперкальциемия сочетается с гиперкальциурией, жаждой, полиурией, гипостенурией. Повышается абсорбция кальция в кишечнике и его выход из костей. Часто отмечается диарея, масса тела уменьшается на 2030%. При адекватной ЗГТ происходит нормализация кальциевого обмена.
3.3.3.12. Феохромоцитома (хромаффинома)
Это гормонально-активная опухоль, исходящая из мозгового слоя надпочечников и вненадпочечниковой хромаффинной ткани, секретирующая катехоламины. Избыточная секреция адреналина сопровождается ускорением обменных процессов (гиперметаболизмом), усилением гликогенолиза, липолиза, исхуданием (теряется до 15% массы тела). Развитие остеопении обусловливает симптоматический сахарный диабет, снижение половой функции и массы тела.
3.3.3.13. Недостаточность витамина D
Дефицит витамина D в организме может быть вызван нарушением эндогенного синтеза, недостаточным поступлением с пищей, мальабсорбцией и сопровождается развитием остеомаляции у взрослых, рахита — у детей. В результате дефицита витамина D снижается количество 25-гидроксихолекальциферола, из которого синтезируется кальцитриол, снижается абсорбция в кишечнике кальция и фосфата. Гипокальциемия стимулирует 1α-гидроксилирование 25-гидроксихолекальциферола, но при выраженном дефиците витамина D не хватает субстрата для достаточного образования кальцитриола.
Дефицит витамина D приводит к развитию вторичного гиперпаратиреоза, в результате которого снижается коцентрация фосфата в плазме крови. У больных с недостаточностью витамина D обнаруживают гипокальциемию, гипофосфатемию, повышенную ЩФ, низкую концентрацию 25-гидроксихолекальциферола.
3.3.3.14. Нарушение метаболизма витамина D
Образование активных форм витамина нарушается у больных с патологией печени и почек. В частности, нарушение всасывания витамина D, снижение 25-гидроксилирования и синтеза Са-связывающего белка плазмы крови наблюдается при билиарных циррозах печени. К нарушению метаболизма витамина D (образования кальцитриола) приводит прием фенобарбитала, фенитоина. Эти препараты стимулируют микросомальные гидроксилазы в гепатоцитах, изменяют метаболизм витамина D в печени. Они также угнетают всасывание кальция в кишечнике. В результате развивается гипокальциемия, поражение костей.
3.3.4. Остеопороз при заболеваниях сердечно-сосудистой и дыхательной системы, органов пищеварения
3.3.4.1. Заболевания сердечно-сосудистой системы
Развитие остеопороза обусловливает возникновение хронической сердечной недостаточности, к которой чаще всего приводят ишемическая болезнь сердца, гипертоническая болезнь, врожденные и приобретенные пороки сердца (нескорригированные), кардиомипатии, миокардиты. У больных с сердечной недостаточностью развивается тканевая гипоксия, хронический нереспираторный (метаболический) ацидоз, нарушается межуточный обмен, повышается содержание органических кислот в крови. Кроме усиления образования органических кислот, причиной нереспираторного ацидоза у этих больных может быть недостаточное выделение и нейтрализация органических кислот вследствие поражения почек, кишечника. При нереспираторном ацидозе снижены концентрация бикарбонатов крови и содержание СО2 в альвеолярном воздухе, легочная вентиляция ускорена, кислотность и концентрация аммиака в моче повышены (Комаров Ф.И. и соавт., 1981). Хронический ацидоз является причиной вымывания кальция из костей (схема 3.3). Частота остеопороза у женщин с гипертонической болезнью в возрасте 45 лет–64 года выше, чем в популяции (Чижов П.А., Беляев Д.В., 2002). У пациентов с гипертонической болезнью и сопутствующей ишемической болезнью сердца остеопоротические изменения выявляют чаще, чем у пациентов с гипертонической болезнью без ишемической болезни сердца (Беляев Д.В., Чижов П.А., 2002). Наблюдается положительная корреляция между степенью остеопороза и функциональным классом хронической сердечной недостаточности и отрицательная корреляция между выраженностью остеопороза и фракцией выброса. В результате применения гипотензивных препаратов снижается риск развития переломов бедренной и лучевой кости. Как отмечено выше, с остеопорозом в постменопаузальный период и с ишемической болезнью коррелирует индекс атерогенности. ЛПВП коррелируют с высокой МПКТ.
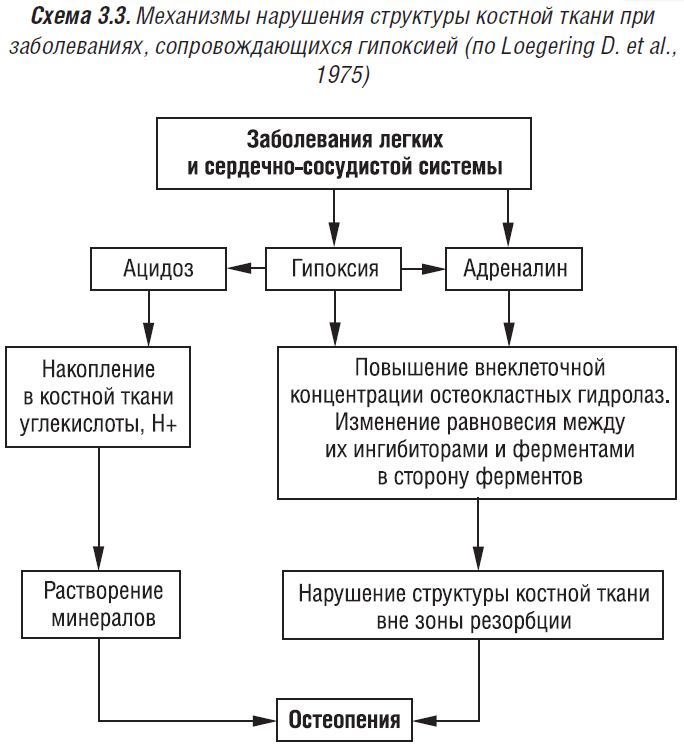
3.3.4.2. Заболевания легких
Причиной развития остеопороза у пациентов с заболеваниями легких является хронический респираторный ацидоз, воспалительный процесс, применение ГК. Резорбцию кости обусловливают продукты жизнедеятельности бактерий (эндотоксины, мукополисахариды и др.), которые накапливаются в очагах воспаления и активируют выработку провоспалительных цитокинов. У людей молодого возраста с воспалительными заболеваниями пиковая костная масса низкая.
Респираторный ацидоз вызывается уменьшением минутного объема дыхания (к примеру, при бронхите, бронхиальной астме, эмфиземе легких), бронхиальной обструкцией, недостаточностью кровообращения. Хронический респираторный ацидоз отмечают у пациентов с хронической обструктивной болезнью, бронхиальной астмой, эмфиземой, фиброзом легких, тяжелым кифосколиозом. Респираторный ацидоз возникает при заболеваниях, сопровождающихся нарушением диффузии газов через альвеолярную мембрану. К этим заболеваниям относят хронический диффузный интерстициальный фиброз, альвеолярный протеиноз, легочный саркоидоз, узелковый полиартериит, ССД, ревматоидный артрит, синдром Вегенера, гистиоцитоз, первичный легочный гемосидероз, бронхиолярный клеточный рак, пострадиационный фиброз, бериллиоз, асбестоз и др. Все эти патологические состояния обусловливают гиповентиляцию легких, накопление углекислого газа в организме. Уменьшается сродство гемоглобина к кислороду, поступление кислорода в ткани, развивается гипоксия. При гипоксии происходит нарушение обмена углеводов, анаэробный гликолиз преобладает, вследствие этого накапливается избыточное количество молочной кислоты в крови, что и определяет развитие ацидоза. Возникновению ацидоза противостоят буферные системы крови, в частности бикарбонатный буфер. Повышается выведение с мочой свободных и связанных в форме аммонийных солей кислот, учащаются дыхательные движения. Однако в большинстве случаев компенсаторные акты оказываются недейственными, поскольку при перечисленных заболеваниях редко удается устранить причину развития гипоксии и, следовательно, хронического ацидоза. У пациентов с хроническим обструктивным бронхитом остеопороз диагностируют чаще, чем в популяции (Беляева А., Чижов П.А., 2002). Имеется положительная корреляция между степенью остеопоротических изменений, выраженностью дыхательной недостаточности, продолжительностью болезни, отрицательная корреляция с объемом форсированного выдоха за 1 с и пробой Тиффно. У многих пациентов с хроническими обструктивными заболеваниями легких отмечается суммирование факторов риска потери костной массы: терапии ГК, курения, злоупотребления алкоголем, низкой физической активности. Факторами риска развития остеопороза у детей с бронхиальной астмой являются задержка роста, дефицит массы тела независимо от применения ГК.
Остеопения развивается у пациентов с гнойными заболеваниями легких, туберкулезом.
3.3.4.2.1. Саркоидоз
Системное заболевание неизвестной этиологии, для которого характерно образование эпителиоидно-клеточных гранулем, развитие гиалиновой соединительной ткани. Чаще всего (в 80–90%) при саркоидозе поражаются легкие. Гранулемы локализуются во всех органах и системах, в том числе в костной ткани (Бунчук Н.В., 1997ж). Развивается острый и хронический артрит, поражение костей. Острый артрит возникает в начале заболевания у 10–35% больных (в 2–3 раза чаще у женщин) и проходит через 4–6 нед. Хронический артрит развивается у больных с длительно протекающим саркоидозом в виде моно- или олигоартрита. Рентгенологически у этих пациентов обнаруживают околосуставной остеопороз, а также поражение костей (которое протекает чаще бессимптомно). Наиболее типичными являются кистовидные просветления костной ткани и остеосклероз. Кистовидные просветления локализуются в разных отделах костей. Отмечаются изменения трабекулярной кости, иногда в виде вздутия участка диафиза кости. Редко возникают краевые дефекты костей (секвестрация). Характерными считаются множественные просветления костной ткани, которые придают структуре кости ячеистый и решетчатый вид. Кистовидные просветления в фаланговых костях могут сопровождаться расширением контура кости, возникновением патологических переломов. При поражении костной ткани фаланг костей развивается «саркоидный дактилит», в том числе всех пальцев («универсальный дактилит»). Заболевание сопровождается диффузным или многоочаговым остеосклерозом. Может возникать деструкция костей носа, околоносовых пазух, глазницы.
3.3.4.3. Болезни желудка
Функциональное состояние пищеварительной системы отражается на плотности костной ткани. Из патогенетических факторов наибольшее значение имеет нарушение всасывания минералов и, в первую очередь, кальция. При гипокальциемии нарушается всасывание витамина В12, развивается мегалобластная анемия. Устранение гипокальциемии эффективно при этой анемии. По данным В.В. Поворознюка и соавторов (1997), у мужчин среднего (45–59 лет) и пожилого (60 лет–74 года) возраста с патологией желудка и двенадцатиперстной кишки скорость распространения ультразвуковой волны по губчатому и компактному компоненту костной ткани снижена по сравнению с аналогичными показателями у мужчин без этой патологии. Через 5 лет после резекции желудка развивается остеопения. Остеопения и остеопороз наиболее выражены после гастрэктомии (Rao O.S., 1993). Дефицит соляной кислоты, пепсина, болезнь оперированного желудка, ускоренный пассаж пищи приводят к мальабсорбции, нарушению всасывания витамина D. Остеопения развивается постепенно, сопровождается мышечной слабостью, нарушением походки, диффузной болью в костях. Пациенты нуждаются в постоянном (до конца жизни) приеме витамина D. При остеопорозе с низким костным метаболизмом лечение проводится в соответствии с принципами лечения первичного остеопороза. Гастрэктомия и резекция желудка по Бильрот II сопровождаются повышением (в 2,6–3 раза) риска перелома бедра. Развитие остеопороза у этих больных также обусловливает пернициозная анемия, вторичная гиперфункция паращитовидной железы, прием алкоголя.
Одной из причин развития остеодистрофии у больных с патологией желудка является избыточная секреция гастрина. Она отмечается при аутоиммунном гастрите, синдроме Золлингера — Эллисона, пернициозной анемии, ХПН, после ваготомии. Продукцию гастрина (схема 3.4) усиливают Са2+, адреналин, тормозят кальцитонин, глюкагон, секретин, соматостатин, вазоактивный интестинальный полипептид, гастроингибирующий интестинальный полипептид.
Базальная секреция гастрина повышается с возрастом (по мере развития атрофических процессов в желудке). Гиперпродукция гастрина не всегда сопровождается гиперсекрецией соляной кислоты желудком. Это отмечается при таких заболеваниях, как пернициозная анемия, атрофические гастриты, витилиго (Комаров В.И. и соавт., 1981). Во всех этих случаях имеется атрофия слизистой оболочки желудка, реакция на гастрин отсутствует. Постоянная гиперпродукция гастрина способствует деминерализации костной ткани. С другой стороны, гастрин усиливает секрецию кальцитонина. В желудке под действием соляной кислоты из нерастворимых солей кальция образуется растворимый хлорид кальция. Приведенные данные свидетельствуют о зависимости метаболизма костной ткани от функционального состояния желудка.
3.3.4.4. Патология печени, желчевыводящих путей
Хронические заболевания печени сопровождаются развитием печеночной остеодистрофии — остеопении и остеомаляции. Достоверные отличия между эхоостеометрическими показателями выявлены (Поворознюк В.В. и соавт., 1997) у женщин среднего и пожилого возраста с заболеваниями гепатобилиарной системы по сравнению с лицами без этой патологии. Чаще всего остеопения развивается при хроническом активном гепатите, холестазе, первичном и вторичном билиарном циррозе (Tsuneoka K. et al., 1996; Floreani A. et al., 1997). Остеопороз обусловливает алкогольный цирроз печени. Нарушение костного метаболизма отмечают у 9,1% больных хроническим активным гепатитом, у 50% — циррозом печени (Suzuki T. еt al., 1998). У пациентов с указанной патологией отмечают боль в костях, развиваются переломы. К факторам — предпосылкам остеопороза относят нарушение всасывания витамина D и усиленное выведение его с калом и мочой; связывание витамина D, его метаболитов желчными кислотами; нарушение гидроксилирования витамина D в печени (Compston J.E., Thompson R.P., 1977). Гипербилирубинемия подавляет пролиферацию остеобластов, что ведет к пониженному формированию кости (Janes C.H. et al., 1992). У больных с печеночной остеодистрофией обнаруживают повышение в сыворотке крови уровня остеокальцина, ПТГ. Развитие остеопороза обусловливает анорексия, дефицит белков и кальция. Дополнительными факторами риска являются гипогонадизм, низкая физическая активность. При злоупотреблении алкоголем отмечается его негативное действие не только на печень, но и костную ткань.
Установлено (Митник З.Н., 2003), что скорость потери костной массы, структурно-функциональное состояние костной ткани у больных циррозом печени зависят от этиологического фактора, степени гепатоцеллюлярной недостаточности, при хроническом алкогольном гепатите — активности патологического процесса. Дополнительными факторами являются период менопаузы, низкий ИМТ. С помощью метода двухфотонной рентгеновской абсорбциометрии поясничного отдела позвоночника и шейки бедренной кости у больных хроническим алкогольным гепатитом автор диагностировал остеопороз у 12,6 и 7,8% соответственно, остеопенический синдром — у 72,8 и 71,8%. При алкогольном циррозе печени остеопороз установлен соответственно у 37,5 и 28,1%, остеопенический синдром — у 60,9% и 69,5%. При циррозе печени, обусловленном инфицированием вирусом гепатита С, остеопороз выявлено у 30,4 и 20,3%, остеопенический синдром — у 69,5 и 75,4%. По данным З.Н. Митника (2003), остеопоротические переломы костей выявляют у 2,8–8% больных хроническим алкогольным гепатитом и у 6,59% — циррозом печени. При указанных заболеваниях выраженность изменений кальций-фосфорного обмена определяется степенью гепатоцеллюлярной недостаточности, влиянием этиологических факторов и активностью процесса. Они проявляются кальципеническим синдромом, повышенными потерями кальция с мочой, снижением тубулярной реабсорбции фосфора и повышенной экскрецией фосфора с мочой. При алкогольных поражениях печени отмечается умеренное повышение резорбции на фоне угнетения костеобразования, низкий темп костного метаболизма, а потери костной массы определяются недостаточностью остеосинтетических процессов. При циррозах, обусловленных инфицированием вирусом гепатита С или В, характерен высокий темп костного обмена, что проявляется выраженной активацией костной резорбции на фоне незначительного снижения активности процессов формирования костной ткани, что обусловливает потерю костной массы. При этих формах циррозов развивается вторичный гиперпаратиреоз, повышается концентрация ПТГ. У пациентов с хроническими заболеваниями печени, особенно алкогольной этиологии и в стадии декомпенсации, автором выявлен дефицит активных метаболитов витамина D. Обнаруженное у мужчин с циррозом печени снижение в крови тестостерона не зависит от этиологического фактора, уровень его снижения определяется степенью гепатоцеллюлярной недостаточности. У больных хроническим алкогольным гепатитом и циррозом печени обнаружен дисбаланс продукции цитокинов: повышается концентрация провоспалительных цитокинов (ИЛ-1β, -6; ФНО-α), снижается — противовоспалительных (ИЛ-4, -10). Выраженность этих изменений зависит от активности патологического процесса и степени гепатоцеллюлярной недостаточности. Выявлена тесная корреляцонная связь между концентрацией различных цитокинов в крови, МПКТ и активностью остеомаркеров.
Экспериментальный холестаз оказывает остеотоксическое влияние (Романюк Б.П., 1994). Достоверно снижается содержание органических веществ в большеберцовой и тазовой костях животных.
3.3.4.5. Заболевания поджелудочной железы
Остеопороз отмечается в случаях развития внешнесекреторной недостаточности железы, развития синдромов мальдигестии и мальабсорбции, нарушения всасывания кальция и витамина D. Мальабсорцией сопровождается рак поджелудочной железы. Причиной развития остеомаляции, остеопороза может быть муковисцидоз, обструктивный процесс в железе, воспаление. Поджелудочная железа имеет большой функциональный резерв: для развития стеатореи необходимо, чтобы секреция панкреатической липазы снизилась до 10% нормального объема. У больных со стеатореей отмечается рентгенологический симптомокомплекс (синдром Голдена — Кантора), включающий остеопороз, деформацию костей.
3.3.4.6. Заболевания кишечника
Они сопровождаются недостаточным перевариванием (мальдигестией), недостаточным всасыванием переваренных продуктов (мальабсорбцией). Развивается понос, снижается всасывание питательных веществ (витамина D, К, В12, фолата, белков, кальция). Развивается остеомаляция и рахит, отставание детей в росте, уменьшается масса тела. Мальабсорбция развивается при радиационном энтерите, целиакии, спру, болезни Крона, резекции кишечника, дивертикулезе тощей кишки, дисбактериозе, амилоидозе, синдроме короткой кишки. Синдром короткой кишки (результат резекции тонкой кишки) сопровождается персистирующей диареей, недостаточностью питательных веществ. Возникает дефицит витамина В12, недостаточное всасывание витамина D, кальция, магния, цинка, резистентность к витамину D, которые обусловливают метаболические заболевания костей. При хронической недостаточности лактазы нарушается всасывание кальция, содержащегося в молоке (непереносимость лактозы выявляется у 1/3 больных остеопорозом). На состояние костной ткани негативное влияние (усиливается резорбция кости) оказывает ацидоз, возникающий при дисбактериозе за счет продукции молочной кислоты. Обеднение организма магнием и калием отмечается при кишечных свищах, опухолях, секретирующих вазоактивный интестинальный полипептид, который обусловливает профузный водянистый понос.
У детей с синдромом Хейбнера — Хертера — тяжелой хронической пищеварительной недостаточностью в результате целиакии возникает задержка роста, атрофия мускулатуры, остеопороз, запоздалое прорезывание зубов, склонность к кариесу, признаки гиповитаминоза (в том числе витамина А).
Потеря костной ткани характерна при болезни Крона, неспецифическом язвенном колите. У 30–60% больных с этой патологией выявляют ускоренную потерю костной массы. Ежегодная потеря МПКТ в поясничном отделе позвоночника у этих больных в среднем составляет 6,4%, шейке бедренной кости — 3,1%. Аналогичные цифры у пациентов с болезнью Крона составляют соответственно 6,9 и 5,6% (Roux C. еt al., 1995). Патогенез развития остеопении при воспалительных заболеваниях кишечника недостаточно изучен. К патогенетическим факторам остеопороза у этих больных относят:
- дефицит витамина D (при болезни Крона потеря витамина D незначительна);
- нарушение абсорбции кальция;
- недостаточное питание;
- высокий уровень провоспалительных цитокинов (ИЛ-1, -6; ФНО);
- лечение ГК.
Дополнительными факторами риска могут быть низкая физическая активность, гипогонадизм, дефицит белков. Абсорбция кальция и витамина D нарушается при энтеритах, в случае резекции кишечника, наложении обходных анастомозов. Часто (у 50–70% больных) остеопороз развивается при целиакии.
Таким образом, остеопороз у пациентов с хроническими заболеваниями органов пищеварения развивается достаточно часто и не всегда диагностируется. У них возможны остеопороз и остеомаляция (которые трудно дифференцировать), их сочетание. Проявлением остеомаляции является умеренное снижение содержание кальция, значительное — фосфора в сыворотке крови, повышение активности общей ЩФ или костноспецифической. У больных с патологией органов пищеварения вероятность развития остеомаляции ниже, чем остеопороза.
3.3.4.7. Алиментарный остеопороз
Как свидетельствуют данные экспериментальных исследований (Дедух Н.В. и соавт., 2002), одним из решающих факторов развития остеопороза является дефицит кальция в рационе, он приводит к нарушению механических свойств костей (прочности, жесткости, упругости). Дефицит кальция в рационе в первую очередь сопровождается нарушениями в губчатой костной ткани (Дедух Н.В. и соавт., 2002). Отмечается выраженное разрежение плотности, истончение и вертикализация костных трабекул, отсутствие поперечных костных перемычек. Затем происходят изменения в структуре компактной кости: истончается кортикальный слой, появляются резорбционные полости. Угнетаются процессы костеобразования, активизируется костная резорбция и, таким образом, происходит расбалансирование костного ремоделирования. Преобладающая резорбция костной ткани обусловлена в основном активизацией остеоцитарного остеолиза. При дефиците кальция в диете животных отмечается уменьшение массы скелета, содержания минералов в костях, нарушается их структурная организация и механические свойства. Н.В. Дедух и соавторы (2002) считают неполноценное питание (наряду с гипокинезией, дегравитацией, гипергравитацией) мощным стрессорным фактором для организма. Активизация синтеза ГК сопровождается нарушением всасывания кальция в кишечнике. Развивающаяся гипокальциемия обусловливает развитие вторичного гиперпаратиреоза, усиление костной резорбции в результате активации остеоцитарного остеолиза и остеокластической резорбции (в меньшей степени). На протяжении 2 нед после действия стрессорного фактора развивается стероидная остеопения, резко теряется костная масса. В дальнейшем наступает стадия адаптации: костная ткань переходит на медленный тип обмена («ленивая» кость). Резко угнетается процесс костеобразования, активность костной резорбции становится невысокой.
Вторичный остеопороз развивается при длительном парентеральном питании больных.
У пациенток, соблюдающих вегетерианскую диету и употребляющих молоко, содержание минералов в кости на 40% выше, чем при разнообразной системе питания (Дедух Н.В., Зупанец И.А., 2002).
3.3.4.7.1. Гиповитаминоз С
Для нормального развития скелета существенное значение имеет аскорбиновая кислота. При ее недостатке остеобласты не вырабатывают нормальный коллаген, что сопровождается нарушением окостенения. Аскорбиновая кислота необходима для гидроксилирования пролиновых остатков в коллагене, поддержания нормальной структуры и функции этого белка. Как считают А. Уайт и соавторы (1981а), рост скелета задерживается в условиях недостаточной калорийности пищи, но только при недостатке кальция, фосфора, витаминов А, D и С отмечаются характерные поражения костей, отличные от таковых при истощении. Как при недостатке аскорбиновой кислоты, так и недостаточном питании нарушается образование коллагена остеобластами. Аскорбиновая кислота является антиоксидантом: она удерживает железо гидроксилирующего фермента в восстановленном (Fe2+) состоянии (Маршалл В.Дж., 2002). Также она усиливает всасывание негеминового железа пищи, переводя его в Fe2+-состояние. Субклиническую недостаточность витамина С выявляют весьма часто. Его концентрация в плазме крови зависит от недавнего поступления с пищей и, по мнению В.Дж. Маршалла (2002), не является достоверным показателем состояния тканевых запасов витамина. Достоверным показателем является уровень содержания витамина в лейкоцитах. При нормальных тканевых запасах излишек витамина быстро выводится с мочой. При дефиците витамина в тканях поступающий витамин пополняет запасы. Иногда (при тяжелой недостаточности витамина С) для этого требуется больше недели. При авитаминозе С у грудных детей и детей раннего возраста (синдроме Меллера — Барлоу) отмечают очаги просветления в метафизах, трещины, переломы костей. Рентгенологические изменения в костях долго сохраняются после излечения.
3.3.5. Нарушения метаболизма костной ткани при заболеваниях почек
Хроническая почечная патология осопровождается развитием остеодистрофии, поскольку почки играют важную роль в регуляции минерального обмена. В них расщепляются кальцийрегулирующие гормоны (кальцитонин, ПТГ), в эпителии проксимальных канальцев образуются активные метаболиты витамина D: 1,25-(ОН)2D3 (кальцитриол) и 24,25-(ОН)2D3. Прогрессирующее и необратимое нарушение функции почек обусловлено многими патологическими процессами. Наиболее часто ХПН развивается у больных с хроническим гломерулонефритом, сахарным диабетом, артериальной гипертензией, хроническим пиелонефритом, поликистозом почек. Уже в начальной стадии гломерулонефрита создаются условия для нарушения метаболизма кальция, обусловливающие гипокальциемию. Гипокальциемию усугубляет применение при лечении пациентов с гломерулонефритом ГК, иммуносупрессантов, гепарина. Механизм развития остеопороза при этом заболевании включает нарушение метаболизма витамина D, гомеостаза кальция и фосфора. Изменения наиболее значительны в случае развития почечной недостаточности. У большинства больных с ХПН развивается гипокальциемия, со временем возникает остеодистрофия. В терминальной стадии почечной недостаточности из-за снижения синтеза почками кальцитриола (1,25-(ОН)2D3) развивается комплексное поражение костей. Патогенез поражения костей сложен и представлен на схеме 3.5.
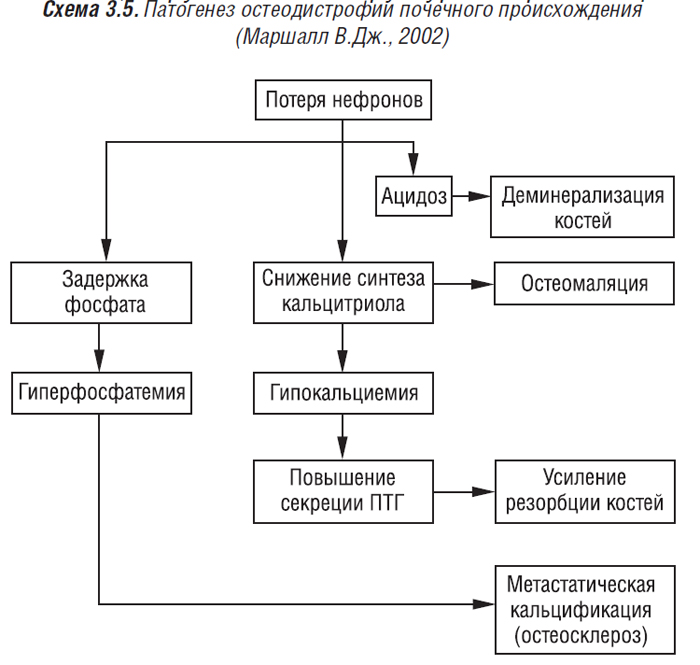
У пациентов с почечной патологией наблюдаются:
- нарушение образования активных метаболитов витамина D;
- вторичный гиперпаратиреоз;
- задержка в организме фосфора;
- интоксикация алюминием (при проведении гемодиализа);
- снижение функции остеобластов;
- развитие адинамичной («ленивой») костной ткани.
Вследствие задержки фосфата развивается гиперфосфатемия, которая тормозит синтез кальцитриола и ведет к гипокальциемии. При ХПН отмечается прямая корреляция между снижением клубочковой фильтрации и уровнем всасывания кальция в кишечнике. Внеклеточный кальций является одним из основных факторов регуляции продукции ПТГ. Влияя на участок «негативной регуляции» сайта начала транскрипции гена ПТГ, кальций угнетает транскрипцию. У пациентов с уремией уменьшается количество кальциевых рецепторов в паращитовидной железе, снижается чувствительность к кальцию. Усиливается секреторная активность паращитовидной железы, гипокальциемия обусловливает гиперсекрецию ПТГ (развитие вторичного гиперпаратиреоза), снижающую реабсорбцию фосфата в нефронах. Скорость клубочковой фильтрации ограничивает экскрецию фосфатов и развивается стойкая гиперфосфатемия. Вторичный гиперпаратиреоидизм при ХПН развивается относительно рано — когда клубочковая фильтрация составляет 60–90 мл/мин (Jarek M., 1999). Он подтверждается высокой концентрацией ПТГ в крови и гистологическими изменениями в костях. К факторам, усиливающим секрецию ПТГ, M. Jarek (1999) относит:
- гиперфосфатемию из-за снижения почечной экскреции;
- нарушение гидроксилирования 25-гидроксивитамина D до 1,25-дигидроксивитамина D;
- сниженное потребление и абсорбцию кальция;
- нечувствительность паращитовидной железы к ингибирующему действию кальция на секрецию ПТГ.
Повышение секреции ПТГ сопровождается стимуляцией остеокластов, быстрой резорбцией костей. Гиперпаратиреоидизм в большинстве случаев протекает бессимптомно, но может сопровождаться болью в костях (полиарталгией). Развитие вторичного гиперпаратиреоза у больных с ХПН предотвращают: ограничение потребления фосфатов, включение в диету дополнительных количеств кальция (карбоната кальция), прием 1,25-дигидроксивитамина D (иногда в высоких дозах). Изредка для коррекции гиперпаратиреоза применяют субтотальную паратиреоидэктомию. Концентрация фосфатов может быть настолько высокой, что начинается метастатическая кальцификация (склеротические изменения в костной ткани и кровеносных сосудах). Кальцификаты часто выявляются при почечной остеодистрофии и могут достигать значительных размеров. Они локализуются в разных тканях, в том числе во внутренних органах, в роговице, конъюнктиве, под кожей. Околосуставные и подкожные кальцификаты ограничивают подвижность суставов, вызывают боль, снижают кровоток (образуются язвы кожи, инфаркты тканей). Во внутренних органах откладывается магнийсодержащий казеозный материал, в околосуставных тканях, сосудах, коже — гидроксиапатит (Jarek M., 1999). Деминерализацию вызывает возникающий ацидоз. Остеомаляцию может вызывать алюминий, содержащийся в диализной жидкости, солях, применяющихся для связывания фосфата. На фоне почечной недостаточности и гемодиализа алюминий, поступающий с пищей, не удаляется в достаточном количестве и накапливается в остеоиде формирующейся кости, тормозит ее минерализацию (Jarek M., 1999). Возникающая остеомаляция проявляется диффузной болью, способствует патологическим переломам. При рентгенологическом исследовании обнаруживается снижение плотности кости, появление зон просветления Лоозера. Для предотвращения остеомаляции, обусловленной алюминием, не применяют препараты, содержащие алюминий, назначают витамин D в достаточных дозах, поддерживают нормальную концентрацию 1,25-дигидроксивитамина D в плазме крови. При ХПН также снижается синтез тестостерона, эстрогенов, нарушается функция щитовидной железы, возникает резистентность к инсулину.
У больных с ХПН существует четкая зависимость между длительностью пребывания на лечении гемодиализом и степенью развития вторичного гиперпаратиреоза (Кулизький М., 2004). По данным автора, частота и структура клинических проявлений вторичного гиперпаратиреоза зависит от длительности лечения гемодиализом. Из 32 больных хронические подвывихи и патологические переломы отмечали у 4, боль в конечностях — у 21, зуд кожи — у 17. Повышенный уровень ПТГ в крови обнаружен у большинства больных.
Развитие вторичного остеопороза при аллотрансплантации почки связывают с эндокринными изменениями (дефицитом кальцитриола или ПТГ), приемом ГК, циклоспорина А.
3.3.5.1. Генетически обусловленные расстройства функции проксимальных канальцев
Заболевания, при которых затрагиваются только почечные канальцы, диагностируют редко. Они сопровождаются чрезмерной потерей веществ, которые в норме реабсорбируются канальцами (фосфат, глюкоза, аминокислоты), недостаточной экскрецией веществ, секретируемых канальцами (ионы водорода).
3.3.5.1.1. Синдром Фанкони
При синдроме Фанкони (генетически обусловленном заболевании) развивается устойчивый к витамину D рахит, остеомаляция, нарушение реабсорбции фосфатов и аминокислот. Появляется аминоацидурия, моча содержит до 10 различных аминокислот, среди которых преобладают лизин, цистин, аргинин и орнитин (Хорст А., 1967). Причиной их наличия в моче является нарушение процесса реабсорбции в проксимальных почечных канальцах. Потеря фосфатов обусловливает развитие хронических костных изменений. Возникает хронический метаболический ацидоз (вследствие потери бикарбонатов) при щелочной реакции мочи, часто отмечают гипокалиемию, отложение кристаллов цистеина в тканях, полиурию, обезвоживание. Заболевание может проявиться в любом возрасте. У детей прекращается рост и, несмотря на назначение витамина D в адекватном количестве, развивается тяжелый рахит. В старшем возрасте обнаруживают остеомаляцию с повторными переломами (характерно при заболевании костей), гипофосфатемию, гипофосфатурию, повышение уровня аминокислот в крови, глюкозурию, альбуминурию, иногда — гипокалиемию. Причиной смерти больных является почечная недостаточность, ацидоз. Синдром Фанкони может возникать вторично при различных патологических состояниях, в том числе при цистинозе (болезни Линьяка — Фанкони). Это заболевание сопровождается нарушением транспорта цистина из лизосом, отложением его в тканях (включая почки) в виде кристаллов. Развивается рахит, полиурия с обезвоживанием, почечная недостаточность. Причиной развития синдрома Фанкони могут быть другие наследственные метаболические заболевания (галактоземия, непереносимость фруктозы, болезни накопления гликогена, тирозинемия, болезнь Вильсона), а также нефротоксины (тяжелые металлы, лекарственные средства), парапротеинемия, амилоидоз (Маршалл В.Дж., 2002). Первичный синдром Фанкони может развиться у людей молодого возраста.
3.3.5.1.2. Семейная гипофосфатемия
Также обусловлена генетическими нарушениями. Для нее характерны гипофосфатемия в результате снижения реабсорбции неорганических фосфатов в почечных канальцах, развитие устойчивого к витамину D рахита, остеомаляции. При легкой форме заболевания выявляются биохимические нарушения. Рахит и костные изменения (более выражены у лиц женского пола) наблюдаются при тяжелых формах болезни в детстве. На них не влияет витамин D в высоких дозах (но повышенный уровень ЩФ нормализуется). Уровень кальция в крови остается в норме.
3.3.5.1.3. Почечный канальцевый ацидоз
Проксимальный (II) тип является компонентом синдрома Фанкони, но может быть изолированным. У младенцев отмечают преходящую форму. Нарушается реабсорбция бикарбонатов (при низком содержании в плазме крови они могут реабсорбироваться), развивается системный ацидоз (почки не выделяют кислую мочу) из-за задержки водородных ионов в организме. Чаще выявляют дистальный (I тип, классический) тип. Он может быть врожденным и приобретенным вторичным по отношению к гиперкальциемии, аутоиммунным болезням. Из-за усиленного выведения кальция с мочой развиваются камни в почках. Имеется недостаток калия в организме. В грудном возрасте заболевание проявляется гиперкальциемией, повышенной температурой тела, отсутствием аппетита, тошнотой, рвотой, полиурией, обезвоживанием. Дети старшего возраста отстают в росте, жалуются на усталость, повышенную утомляемость, отсутствие аппетита, сонливость. Причиной этой симптоматики является постоянная задержка ионов водорода в организме. Гипокалиемия сопровождается вялыми параличами, мышечной слабостью. Постоянная потеря кальция обусловливает развитие костных изменений. Данное генетическое заболевание может быть самостоятельной формой или сопутствует другим врожденным почечным нарушениям, в том числе синдрому Фанкони. Чаще диагностируют почечный канальцевый ацидоз IV типа, связанный с гипоальдостеронизмом, вторичным по отношению к заболеваниям надпочечников или почек, сопровождающимся снижением секреции ренина или резистентностью к альдостерону. Этот тип, в отличие от других, сопряжен с гиперкалиемией.
3.3.5.1.4. Синдром Де Тони — Фанкони
Наследственный почечный ацидоз с нефрокальцинозом, поздним рахитом, адипозогенитальной дистрофией (наследование, вероятно, по аутосомно-рецессивному типу). Характерен низкий или карликовый рост, ожирение, гипогенитализм, системный остеопороз, поздний рахит, прогрессирующий genu valgum (вальгусное колено), гипокалиемические псевдопарезы, полидипсия, полифагия, полиурия, кальциурия, нефрокальциноз. В крови гипофосфатемия, гипонатриемия, гиперхлоремический ацидоз (Лазовскис И.Р., 1981).
3.3.5.1.5. Синдром Бойда — Стернса
Эта почечная канальцевая недостаточность с гипохлоремическим ренальным ацидозом и поздним рахитом (аутосомно-рецессивное, реже аутосомно-доминантное наследование) начинается в младенческом возрасте. Отмечается полиурия, альбуминурия, интермиттирующая гликозурия, в крови — снижение щелочного резерва, гипохлоремия, иногда — гиперфосфатемия.
3.3.5.1.6. Синдром Лоу
Имеет сходство с синдромом Фанкони и проявляется аминоацидурией, усиленным выделением с мочой органических кислот, снижением синтеза аммиака в почках, системным ацидозом, альбуминурией, глаукомой, запоздалым развитием, гипорефлексией, уменьшением мышечной массы, интермиттирующей лихорадкой и рахитом (Хорст А., 1967). Причиной перечисленных расстройств является генетический дефект реабсорбции аминокислот, фосфатов, глюкозы, транспорта ионов водорода и калия.
3.3.5.1.7. Синдром Ладера — Шелдона (наследственное нарушение канальцевой реабсорбции)
Предполагают аутосомно-доминантное наследование, проявляется гипераминоацидурией, гиперфосфатурией, гликозурией, рахитом, аномалиями костей. Клинические симптомы могут отсутствовать.
3.3.5.1.8. Гликогеновая болезнь
Определено 12 типов заболевания. Болезнь Гирке (болезнь накопления гликогена в печени и почках — I тип, болезнь Кори) сопровождается генетически обусловленным накоплением гликогена в клетках почечных канальцев. Клинические симптомы такие же, как при синдроме Фанкони: аминоацидурия, рахит (резистентный к витамину D), метаболический ацидоз, лихорадка, рвота. Причиной развития псевдогипопаратиреоидизма является неспособность канальцевых клеток реагировать на ПТГ. Клинические симптомы аналогичны тем, которые отмечаются при недостаточности паратиреоидных желез. Отличие заключается в том, что уровень кальция и фосфатов в крови не изменяется под влиянием ПТГ. Отсутствие реакции на ПТГ обусловливает развитие костных и легочных изменений.
Гликогеновая болезнь IV типа — синдром Андерсена передается по аутосомно-рецессивному типу, отмечается дефицит 1,4-глюкан-6-альфа-глюкозилтрансферазы. В результате дефекта вместо гликогена в органах и тканях синтезируется амилопектин. Его отложение в печени обусловливает развитие фиброза. Сразу после рождения могут появиться гипогликемия, мышечная слабость, желтуха. Отмечается отставание в росте, контрактуры, отсутствие сухожильных рефлексов, остеопороз трубчатых костей, гепато- и спленомегалия, асцит. В.М. Делягин и А. Румянцев (2001) полагают, что истинная частота синдрома Андерсена выше зарегистрированной.
3.3.5.1.9. Юношеское поражение нефронов
При юношеском поражении нефронов имеется генетический дефект дистального канальца или петель Генле, в основном при реабсорбции воды. Отмечаются полиурия, гипостенурия, периодическая умеренная глюкозурия, азотемия, анемия, дистрофия костей.
3.3.5.2. Гипофосфатазия
Редкое врожденное заболевание, при котором отмечается мутация гена, кодирующего изоформу ЩФ, присутствующую в хрящевой и костной тканях. У больных обнаруживается очень низкая активность ЩФ в сыворотке крови, симптомы рахита или остеомаляции. Главным проявлением наследственного заболевания являются костные изменения, вызванные недостатком ЩФ. Нарушение минерализации костной ткани связано с неспособностью к расщеплению неорганических пирофосфатов, которые замедляют процессы минерализации (McDermott M.T., 1999б). Костные изменения напоминают симптомы рахита. В плазме крови и моче больных появляется фосфоэтаноламин. Нарушается образование костной ткани, наступает преждевременное зарастание костных швов черепа. Чем раньше появляются симптомы болезни, тем тяжелее она протекает. В результате этой болезни плод погибает. Преждевременное зарастание швов черепа сопровождается симптомами сдавления мозга, судорогами. При позднем развитии болезнь может протекать бессимптомно. При гипофосфатазии кальций находится в крови в форме неионизированного комплекса, не обеспечивающего правильное обызвествление кости. Под влиянием витамина D у больных гипофосфатазией быстро повышается уровень кальция в крови. Гиперкальциемия и гиперкальциурия не всегда отмечаются при гипофосфатазии. При их наличии развивается нефрокальциноз, почечная недостаточность. У родителей детей, больных этим заболеванием, обнаруживают снижение уровня ЩФ в крови. Эффективного лечения данного заболевания нет.
3.3.5.3. Гипофосфатемический рахит (витамин D-резистентный рахит)
Заболевание наследуется по доминантному, сцепленному с Х-хромосомой, типу. Эту форму рахита обусловливает нарушение реабсорбции фосфатов в почечных канальцах. Применение монотерапии витамином D не эффективно. Клинический эффект отмечается при приеме внутрь препаратов фосфата и витамина D в виде активного метаболита.
3.3.5.4. Витамин D-зависимый рахит
Болезнь наследуется по аутосомно-рецессивному типу. Нарушено 1α-гидроксилирование 25-гидроксихолекальциферола. Больных можно лечить 1α-гидроксилированными производными витамина D.
3.3.6. Состояние костей при злокачественных новообразованиях и заболеваниях крови
3.3.6.1. Злокачественные новообразования
У. Клаттер (1995) считает их причиной большинства случаев гиперкальциемии у госпитализированных больных и отмечает два механизма ее развития. При локальной остеолитической гиперкальциемии продукты жизнедеятельности опухолевых клеток (например, цитокины) стимулируют локальную резорбцию кости остеокластами. Это бывает при обширном поражении костей опухолью, метастазах рака молочной железы, миеломной болезни, лимфоме. При гуморальной паранеопластической гиперкальциемии продукты метаболизма опухоли оказывают общее действие, стимулируя резорбцию костей и снижая экскрецию кальция. Центральная роль в этом процессе отводится пептиду, родственному паратиреотропному гормону, который действует через рецепторы гормона. Возможно, имеют значение опухолевые факторы роста. Гуморальную паранеопластическую гиперкальциемию чаще обусловливают плоскоклеточный рак легких; опухоли головы, шеи, пищевода; карцинома почек, мочевого пузыря, яичников. При обоих типах паранеопластической гиперкальциемии, как правило, отмечаются поздние стадии заболевания.
Отмечается слабая корреляция между метастатическим поражением костей и степенью гиперкальциемии. Гиперкальциемию выявляют и при отсутствии видимого метастазирования. Вследствие гиперкальциемии снижается секреция ПТГ. В результате нарушается канальцевая реабсорбция кальция и усиливается его вымывание из костей. Это подтверждает участие гуморальных факторов в развитии гиперкальциемии при опухолевых процессах. По-мнению В.Дж. Маршалла (2002), в этих процессах задействован ПТГ-подобный пептид (ПТГпП). Это вещество (с N-концевой последовательностью аминокислот, гомологичной таковой ПТГ) связывается с рецепторами ПТГ и оказывает аналогичное ему действие. Гиперкальциемия сопутствует злокачественным заболеваниям крови и, прежде всего, миеломе. Она связана с выбросом опухолями цитокинов, активирующих остеокласты (ИЛ-1, -6; М-КСФ; ФНО-β). Остеокласты также активируют ПГ, которые вырабатываются метастазами опухолей в костях (например, метастазами карциномы молочной железы).
Опухоль тела позвонка никогда не возникает в межпозвоночном диске, она исходит из тела позвонка. В части случаев тело позвонка становится остеопорозным. Чаще всего опухоли позвонков — это метастазы опухолей молочной и предстательной желез, легких, почек (гипернефрома), поджелудочной железы. Изменения отмечаются в нескольких позвонках, ребрах. Метастазы опухоли сопровождаются сильной болью, первичная опухоль (щитовидной или предстательной железы, гипернефрома) может быть длительно не распознана.
Паранеопластическую гиперкальциемию устраняет цисплатин. Лечение гиперкальциемии облегчает симптомы анорексии, тошноты, недомогания. Метастатическое поражение костной ткани может сопровождаться компрессионными переломами, компрессией тел позвонков. Антирезорбтивная терапия сопровождается уменьшением выраженности болевого синдрома, скелетных осложнений, увеличением длительности жизни.
При некоторых опухолях отмечают аберрантную секрецию гормонов, в том числе вырабатывается АКТГ (развивается синдром Кушинга), ПТГпП, кальцитонин, ИПФР (табл. 3.7).
Эктопическая секреция АКТГ наблюдается достаточно часто. Признаки эктопической секреции АКТГ выявляют у 50% больных с мелкоклеточной карциномой бронхов.
Гастринома (синдром Золлингера — Эллисона) сопровождается гиперпаратиреозом.
Генерализованное снижение костной массы отмечают при противоопухолевой терапии, удалении яичников, гипофиза, надпочечников. Функцию яичников подавляет химиотерапия, проводимая в пременопаузальный период (большинство женщин болеют раком в постменопаузальный период, поэтому синтез эстрогенов не имеет значения). Лучевая терапия обусловливает остеопению в местах облучения, повышает риск переломов костей (ключицы, ребер, проксимального отдела плеча и бедра).
3.3.6.1.1. Лимфогрануломатоз, лимфомы
При лимфогрануломатозе обнаруживают остеолитические костные поражения с локализацией в позвоночнике, ребрах, плечевых костях, периостальные изменения (в грудине, ребрах, ключицах). Изменения сопровождаются болью, развитием диффузного остеопороза. Клинические остеоартикулярные проявления предшествуют рентгенологическим изменениям. Остеолитическое поражение позвонков сопровождается их коллапсом. На ранних стадиях поражения костной системы отмечается кальциурия.
Поражение костей объясняют (Окороков А.Н., 2001) лимфогенным метастазированием из пораженных органов и лимфатических узлов. Реже наблюдается первичное поражение костной ткани. Чаще всего поражается позвоночник, реже — ребра, еще реже — грудина и тазовые кости. Патологические изменения редко выявляются в костях черепа и трубчатых костях. Для заболевания характерны постоянная боль в грудном и поясничном отделе позвоночника, усиливающиеся при поворотах, наклонах туловища. Боль усиливается при надавливании на остистые отростки позвонков, иррадиируют в ноги. Поражение костей осложняется компрессионными и патологическими переломами. Возможна компрессия спинного мозга, развитие пареза нижних конечностей, нарушение функции тазовых органов. При поражении костей таза надавливание на подвздошные кости, поколачивание по ним сопровождается болью. Боль в области таза усиливается при ходьбе. На рентгенограмме костей таза, позвоночника, ребер выявляют очаги деструкции различной (округлой, овальной, неправильной) формы, обширные участки разрушения или рассасывания костной ткани.
При синдроме Брилла — Симмерса — разновидности лимфомы — также нередко отмечаются спонтанные переломы костей.
3.3.6.1.2. Лимфосаркома
Ранним и частым признаком поражения суставов при этом заболевании является боль в суставах. В дальнейшем периферические суставы на рентгенограммах выглядят как гиперпрозрачные зоны (Шуцяну Ш. и соавт., 1983), наблюдается деструкция эпифизарных частей костей.
3.3.6.1.3. Диффузный опухолевый гемангиоматоз костей с генерализованным остеолизом (синдром Хаферкампа)
Допускается наследственный характер синдрома с аутосомно-доминантным наследованием. Отмечается боль, деформации многих костей, возможны множественные переломы. При рентгенологическом исследовании обнаруживается генерализованный неравномерный остеопороз, в анализах крови — увеличение количества α-2-глобулинов, повышение СОЭ, в костном мозге — лейкоэритробластная анемия, миелофтиз (Лазовскис И.Р., 1981). Болезнь быстро прогрессирует.
3.3.6.2. Заболевания крови
3.3.6.2.1. Острые лейкозы
Поражение костей часто выявляют при остром лейкозе. Оно проявляется болью в области длинных трубчатых костей (у детей), ребер, позвонков (у взрослых), патологическими переломами вследствие выраженного остеопороза. Боль в костях обусловлена периостальными наслоениями, кортикальной деструкцией, боль в спине — поражением позвонков. При остром лейкозе у детей рентгенологически обнаруживают характерные так называемые поперечные полосы разрежения в метафизах шириной 2–6 см. Они выявляются в дистальных отделах бедренных костей, проксимальных отделах большеберцовой и плечевой костей, костях голени, предплечья. Также в костях отмечаются очаговые деструктивные изменения — множественные мелкие и крупные округлые очаги просветления, которые преимущественно расположены в диафизах длинных костей. Кроме того, развивается диффузный остеопороз костей и периостальные наслоения (в местах лейкемической инфильтрации). У взрослых преобладают периоститы, подобные полосы разрежения костей у них не выявляются. Характерны повышенная прозрачность и уменьшение тел позвонков. Выраженность изменений зависит от морфологической формы острого лейкоза: изменения костной системы чаще определяются при остром лимфобластном лейкозе.
3.3.6.2.2. Хронические лейкозы
3.3.6.2.2.1. Тучноклеточный лейкоз
Выделяют острую (очень редкую) и хроническую форму заболевания. Тучные клетки (мастоциты, гепариноциты) гематогенного происхождения (имеют общую с базофилами клетку-предшественницу) и находятся во всех органах и системах организма. Продуцируемый мастоцитами гепарин оказывает непосредственное костнорезорбирующее действие. В норме тучные клетки в периферической крови не определяются, в костном мозге определяются только единичные клетки. В крови при тучноклеточном лейкозе имеется высокая концентрация гистамина. Хроническую форму лейкоза выявляют у новорожденных, у детей и взрослых. Заболевание медленно прогрессирует (изредка отмечают обратное развитие процесса), поражается костный мозг, печень, селезенка. При костном поражении имеет место диффузный остеолиз. При пигментной крапивнице (мастоцитозе) — кроме поражения кожи (папулезные, уртикарные, буллезные, диффузные розоватые высыпания), процесс захватывает костный мозг, кости, печень, селезенку, лимфатические узлы. Следует учитывать, что количество тучных клеток в костном мозге значительно увеличивается при остеопорозе, хроническом лимфолейкозе, лимфомах, синдроме Вальденстрема, идиопатической сидеробластной анемии, хронических заболеваниях печени, почек.
3.3.6.2.2.2. Хронический миелолейкоз, лимфолейкоз
При обострениях хронического миелолейкоза появляются припухлость, боль в костях, суставах (в терминальный период). При рентгенологическом исследовании, кроме очагов деструкции, обнаруживают системный остеопороз. В терминальной стадии выявляют опухолевые узлы в костях, обусловливающие их деструкцию. При хроническом лимфолейкозе на рентгенограмме также выявляют остеопороз, компрессионные переломы позвонков. У 56% больных обнаруживают генерализованные деструктивно-очаговые изменения костей (Бунчук Н.В., 1997в).
3.3.6.2.2.3. Миеломная болезнь
Заболевание сопровождается продукцией миеломными клетками факторов, стимулирующих остеокласты, угнетающих остеобласты. Факторами поражения костей являются:
1) миеломатозные разрастания в костях;
2) продукция миеломными клетками остеокластактивирующего фактора (ИЛ-1β), активность которого усиливают лимфотоксин, ФНО-β, ИЛ-6.
Эти факторы вызывают лизис костной ткани и, прежде всего, плоских костей (череп, кости таза, грудина, ребра) и позвонков. Отражением этих процессов является повышение уровня маркеров костной резорбции и снижение маркеров костеобразования. Поражение костной ткани (остеопороз) носит как локальный, так и диффузный характер, сопровождается выраженной гиперкальциемией. В большинстве случаев диффузная остеопения сочетается с множественными очагами деструкции (от нескольких миллиметров до 5 см и более в диаметре). Очаги деструкции обнаруживают в телах позвонков нижнегрудного и поясничного отдела позвоночника, ребрах, черепе («штампованные» очаги деструкции), лопатках, костях таза, грудине, проксимальных отделах бедренных и плечевых костей. Часто определяется множество мелких остеолитических очагов в виде «пчелиных сот». Иногда обнаруживают только диффузный остеопороз. Характерны частые патологические переломы костей. Переломы возникают при надавливании на кости, легком физическом усилии, энергичном движении. В отдельных случаях в результате переломов развивается компрессия спинного мозга, его корешков, параплегия. Поражение костей при миеломной болезни является основным клиническим синдромом, который проявляется у всех больных. Боль в костях отмечают 8090% больных. В поздний период заболевания возможны опухолевидные деформации костей — ребер, грудины, черепа, позвонков, эпифизов длинных трубчатых костей. Иногда опухолевые разрастания можно увидеть при осмотре, обнаружить при пальпации.
У 20–40% больных отмечается (чаще в терминальный период) повышение содержания кальция в крови в результате вымывания кальция из костей. Эти изменения обусловливают появление тошноты, рвоты, сонливости, дезориентации. Отложение кальция в интерстициальной ткани почек (нефрокальциноз) является одной из причин развития почечной недостаточности.
3.3.6.2.2.4. Синдром Вальденстрема
Может сопровождаться арталгиями, артритами (с припуханием, ригидностью), развитием локального остеопороза. Поражаются суставы кистей, голеностопные, пястно-фаланговые, проксимальные межфаланговые, плюсневые. Остеолитические изменения при синдроме Вальденстрема отмечаются реже, чем при миеломной болезни.
3.3.6.2.3. Гемоглобинопатии, анемии
Изменения со стороны костей при таласемии объясняют тем, что неэффективный эритропоэз сопровождается гиперплазией костного мозга, обусловливает изменения структуры костной ткани. Наиболее выраженные изменения скелета отмечаются при гомозиготной форме β-таласемии — «большой таласемии». Рентгенологические изменения свода черепа в виде «симптома ежика» обнаруживают уже на 1-м году жизни. Меняются черты лица: возникает уплощение переносицы, выступают скулы, суживаются глазные щели. С возрастом нарастают явления диффузного остеопороза, приводящего к изменению тел позвонков. Наступает перестройка костной структуры, возникают микропереломы, расширяются костно-мозговые каналы, истончается кортикальный слой кости, возникают спонтанные переломы костей. У 1015% больных возникает деформация эпифизов, укорочение костей (Бунчук В.Н., 1997в). Возможно развитие характерной артропатии с наличием боли и припухлости стоп, голеностопных суставов. Чаще изменения происходят в периартикулярных тканях, возможно также развитие артрита. Развитие артропатии объясняют повышением резорбционных полостей в костях, остеобластических поверхностей, отложением гемосидерина, нарушением микроциркуляции в синовиальной оболочке. У отдельных больных развиваются вторичный гемохроматоз с поражением суставов, вторичная подагра, пирофосфатная артропатия.
Поражение костей при серповидно-клеточной анемии также связано с гиперплазией костного мозга, нарушением микроциркуляции, развитием инфарктов. Приступообразную боль в костях, преходящий артрит, дактилит, синдром «кисть — рука», лихорадку, лейкоцитоз объясняют развитием инфарктов костной ткани, ткани суставов. Повторные множественные инфаркты обусловливают повышенную прозрачность костей, грубопетлистый рисунок (рентгенологические изменения подобны тем, которые отмечаются при почечной остеодистрофии, миелофиброзе, остеомаляции). У некоторых больных артриты принимают хроническое течение и сопровождаются деструкцией хряща. Вследствие гиперплазии костного мозга появляется «симптом ежика», увеличивается размер верхних челюстей. Развивается диффузный остеопороз, который у 1/3 пациентов приводит к деформации тел позвонков (преимущественно грудного отдела). У больных возможны гиперурикемия, гемартроз, септический артрит, остеомиелит.
Развитием системного остеопороза сопровождается эссенциальная железодефицитная анемия с ахлоргидрией (синдром Фабера). Преимущественно болеют женщины в климактерический период. Отмечается низкий рост, остеопороз, часто клинодактилия, приросшие ушные мочки, нередко увеличенная селезенка, ахлоргидрия. В анализах крови — сниженное содержание железа, гипохромная анемия, в костном мозге — усиленный эритропоэз, торможение созревания эритроцитов.
Остеосклеротическая анемия у взрослых (остеомиелопоэтическая дисплазия, идиопатическая миелоидная метаплазия, синдром Хейка — Асмана и др.) проявляется болью в костях, их деформацией, спонтанными переломами, гепато- и спленомегалией, экстрамедуллярным кроветворением, эритробластозом, нормо- или гипохромной анемией, лейкопенией со сдвигом влево. В костном мозге выявляют эритробластоцитоз, при рентгенологическом исследовании — интенсивные бесструктурные затемнения в костях, сужение костномозгового канала.
3.3.6.2.4. Гемофилия
Повторение гемартрозов при этом заболевании сопровождается выраженными суставными явлениями (гемофилической остеоартропатией). Появляются субхондральные кистовидные полости, генерализованный остеопороз, обусловливающий разрушение костей (эти изменения объясняют внутрикостными геморрагиями). Костные эпифизы подвергаются остеолизу, надколенная чашечка приобретает квадратную форму (уплощается нижняя или дистальная часть), появляется субпериостальное костное новообразование, остеофитоз, сужение суставного пространства, анкилоз, амиотрофия. Гемофилическая артропатия возникает при тяжелых формах болезни (концентрация антигемофилического глобулина ниже 2%) (Шуцяну Ш. и соавт., 1983). Гемартроз поражает чаще всего крупные суставы (коленные, голеностопные, локтевые), реже тазобедренные и совсем редко — плечевые, суставы кисти. Со временем суставы деформируются. Синовиальные, субхондральные, внутрикостные геморрагии детерминируют картину хронической артропатии.
3.3.6.2.5. Трансплантация костного мозга
Риск развития остеопороза повышается при трансплантации костного мозга. Развитие остеопороза обусловливается основным заболеванием и химиотерапией.
3.3.7. Другие заболевания
3.3.7.1. Гемохроматоз
Это одно из самых частых наследственных метаболических заболеваний. Заболевание наследуется по аутосомно-доминантному типу. Ген гемохроматоза выявляют у 5% лиц европеоидной расы, частота носительства гена (гетерозиготы) достигает приблизительно 10%, заболеваемость (гомозиготы) — 1:1000–3:1000 (Jarek M., 1999). Признаки болезни начинают проявляться в возрасте 40–60 лет: появляется гепатомегалия, развивается цирроз печени, коричневая пигментация кожи (накопление меланина), сахарный диабет, гипогонадизм. У 30% больных отмечают поражение сердца, проявляющееся застойной сердечной недостаточностью. Часто отмечают мышечную слабость, заторможенность, вялость. Поражаются многие суставы, при этом гемохроматозные артропатии чаще диагностируют у женщин. Не установлено взаимосвязи между наличием артикулярных и висцеральных явлений. У 30–60% больных выявляют хондрокальциноз без дегенеративной артропатии. Железистые отложения обнаруживаются в костных трабекулах, где определяется и остеопороз. Накопление железа сопровождается повреждением мукополисахаридных комплексов, нарушением ферментативных процессов, повреждением основного вещества хряща, кости. Поражение суставов возникает через 3–4 года течения заболевания. Остеопороз развивается у 25–60% больных, он может затрагивать любой костный сегмент, сопровождается повышением прозрачности костей, позвонками в виде рамок, коллапсом позвонков, появлением переломов. К причинам развития остеопении M. Jarek (1999) относит:
1) торможение формирования кости в результате повышенного содержания железа в синовиальной жидкости;
2) инфильтрацию железом гипофиза и снижение секреции гонадотропина;
3) атрофию яичек и гипогонадизм вследствие цирроза печени.
Отмечающаяся гиперкальциурия, по мнению Ш. Шуцяну и соавторов (1983), свидетельствует о том, что при гемохроматозном остеопорозе недостаточно фиксируется кальций. Для артропатии характерны боль в суставах, утренняя скованность, припухание суставов (проксимальных межфаланговых, пястно-фаланговых, запястных, коленных, тазобедренных, плечевых). Часто наблюдается симметричное поражение проксимальных межфаланговых суставов II и III пальцев. Боль может быть постоянной, поражение суставов может проявляться в виде атак с периодом ремиссии. Даже при длительном течении гемохроматозной артропатии тяжелого нарушения функции суставов не отмечается: ограничение движений, деформация суставов умеренные. При рентгенологическом исследовании обнаруживают утолщение субхондральной пластинки, микрокисты субхондральной кости, незначительный остеофитоз, параартикулярные отложения кальция, кальцификация менисков, треугольной связки запястья, лонного симфиза, остеонекроз головки бедренной и плечевой кости. При гистологическом исследовании определяется сидерозная инфильтрация (накопление гемосидерина) суставной синовиальной мембраны. Воспалительные явления отсутствуют, применение ГК не эффективно.
3.3.7.2. Болезнь Вильсона (гепатолентикулярная дегенерация)
Болезнь Вильсона развивается вследствие избыточного накопления меди, сочетающегося с дефицитом церулоплазмина. Как и гемохроматоз, она наследуется по аутосомно-рецессивному типу и выявляется в соотношении 1:30 000. Заболевание обычно проявляется в возрасте 20–40 лет. Первым клиническим проявлением у 50% больных является такое поражение печени, как преходящий гепатит, злокачественный гепатит, хронический активный гепатит, цирроз печени (Jarek M., 1999). Для болезни Вильсона характерно снижение концентрации сывороточного церулоплазмина (ниже 20 мг/дл), меди (ниже 80 мкг/дл), повышение почечной экскреции меди (выше 100 мкг/сут). Надежным ранним критерием диагностики является повышение содержания меди в печени (выше 250 мкг/г ткани). Обнаруживают неврологические расстройства, артропатию, гемолитическую анемию, аменорею, бесплодие. Вследствие дегенерации ядер двигательных нервов возникают двигательные нарушения. Наблюдаются психиатрические синдромы. Кольцо Кайзера — Флейшнера (депозиты меди) не специфично для болезни Вильсона, но оно сочетается с неврологическими и психиатрическими расстройствами. Признаки поражения опорно-двигательного аппарата (в том числе рентгенологические) напоминают поражения при гемохроматозе. Поражения тазобедренных и пястно-фаланговых суставов, в отличие от гемохроматоза, выявляются редко. Еще реже обнаруживают хондрокальциноз, расслаивающий остеохондрит, хондромаляцию надколенника, клиновидную деформацию позвонков. У 25–50% пациентов с болезнью Вильсона диагностируют остеопению и/или остеомаляцию, которые, возможно, являются результатом почечного канальцевого ацидоза или синдрома Фанкони — частых поражений почек при этом заболевании.
3.3.7.3. Болезнь Гоше
К наследственным болезням обмена веществ относятся лизосомные болезни накопления, обусловленные генетическими изменениями лизосомальных ферментов, нарушением внутриклеточного расщепления гликозамингликанов, гликолипидов, гликопротеинов. Следствием генетического дефекта является накопление нерасщепленных макромолекул, увеличение количества лизосом в клетках различных тканей (морфологически выявляются «пенистые» клетки), нарушение функции и гибель клеток. Нерасщепленные метаболиты накапливаются в умеренной или выраженной степени. Выделяют 4 группы лизосомных болезней накопления: мукополисахаридозы, мукополилипидозы, гликопротеинозы, сфинголипидозы. Для лизосомных болезней накопления характерны полисистемность, прогредиентное течение. Накопление метаболитов в костной ткани обусловливает нарушения, которые обозначают как «множественный дизостоз». Он отмечается при болезни Гоше, мукополисахаридозе, муколипидозе. Возникают изменения в суставах, ограничивается объем движений в них. В случае болезни Гоше наблюдается низкая активность глюкоцереброзидазы и в лизосомах макрофагов накапливается глюкоцереброзид (образуются клетки Гоше). Клетки Гоше накапливаются во многих тканях, в том числе костном мозге, синусоидах печени, красной пульпе селезенки, лимфатических узлах. Поражение скелета обусловливает стойкую инвалидизацию. Изменения костной ткани наблюдаются у 75% пациентов и являются результатом замещения нормальных элементов костного мозга инфильтратами клеток Гоше, их накапливания в костном веществе. Прежде всего поражаются трубчатые кости (особенно бедренные), позвоночник, появляются остеолитические очаги, повышается внутрикостное давление, появляется острая боль («костные кризы»). Характерны также гепато- и спленомегалия с проявлениями гиперспленизма (панцитопения, геморрагический синдром). Для подтверждения диагноза необходимо проведение гистологического исследования, определение активности глюкоцереброзидазы. Лечение — внутривенные инъекции модифицированной человеческой глюкоцереброзидазы.
3.3.7.4. Первичная гипогаммаглобулинемия у взрослых (болезнь Брутона)
Эта редко выявляемая болезнь относится к синдромам первичного иммунодефицита и сцеплена с Х-хромосомой. Синдром связан с аутоиммунными заболеваниями, характеризуется отсутствием или очень низкой концентрацией сывороточных иммуноглобулинов (IgG, IgM, IgA) и патологическими В-клеточными функциональными тестами in vivo. В периферической крови отсутствуют В-клетки: нарушено созревание В-клеточной линии (Malyak M., 1999). Поражение костно-суставной системы возникает в возрасте 19–59 лет у 20% больных. Артрит обусловливают гноеродные бактерии, энтеровирусы, микоплазменная инфекция. Артикулярный синдром развивается в виде моноартрита (поражаются крупные суставы), олигоартрита, полиартрита, клиническое течение подобно таковому при ревматоидном артрите. У больных обнаруживают снижение общего белка, γ-глобулинов, иммуноглобулинов (IgG, IgM, IgA). При рентгенологическом исследовании обнаруживают умеренный остеопороз, маловыраженные костно-суставные изменения, чаще асимметричного характера (при затяжном течении артритов). При проведении дифференциальной диагностики следует учитывать развитие вторичной гипогаммаглобулинемии у больных с лимфогранулематозом, множественной миеломой, хроническим лимфолейкозом. Лечение — внутривенное введение иммуноглобулина (200–600 мг/кг/мес) и антибиотикотерапия бактериальной инфекции.
3.3.7.5. Мукополисахаридоз
Синдром Санфилиппо (мукополисахаридоз III) — разновидность наследственных мукополисахаридозов, наследуется по аутосомно-рецессивному типу. Отмечается задержка роста, умственная отсталость, гипертрихоз, сросшиеся брови, широкая спинка носа, застывшая мимика, макроглоссия, гепатомегалия, утолщение костей черепа, патологическая форма поясничных позвонков. Отмечается два типа биохимических нарушений:
1) дефицит бета-галактозидазы и гепарансульфатазы;
2) дефицит N-ацетил-α-D-глюкозаминидазы.
В моче отмечается значительное увеличение количества кислых мукополисахаридов (Лазовскис И.Р., 1981). При синдроме Шейе (мукополисахаридоз V) симптомы болезни проявляются в зрелом возрасте. Генетический дефект заключается в дефиците α-L-идуронидазы, в результате которого в соединительной ткани (хрящах, костях) накапливаются мукополисахариды. Отмечается низкий рост, Х-образные ноги, гиперэкстензия пястно-фаланговых и гиперфлексия межфаланговых суставов, атрофия межкостных мышц, помутнение роговицы, возможны пигментный ретинит, аортальный порок или коарктация аорты. С мочой в повышенном количестве выводится дерматансульфат. Синдром Брейлсфорда — Моркио — разновидность наследственных мукополисахаридозов (аутосомно-рецессивное наследование) проявляется низким или карликовым ростом, короткой шеей, короткой талией, куриной грудью, кифозом, кифосколиозом, Х-образными ногами, остеопорозом, поражением зубной эмали. В соединительной ткани, хрящах, костях в больших количествах накапливаются мукополисахариды. Эпифизарные хрящи распадаются, метафизы укорачиваются и расширяются, тела позвонков сплющиваются. С мочой выводятся кератансульфат, дерматансульфат. При синдроме Марото — Лами (III) — разновидности мукополисахаридоза — характерны вальгусные колени, поясничный кифоз, выпуклая грудь, тугоподвижность суставов. Рентгенологически обнаруживают сплющенные, клиновидные позвонки, метафизарные и эпифизарные дефекты костей, задержку роста запястных и предплюсневых костей. С мочой выводится большое количество дерматансульфата.
3.3.7.6. Тирозинемия (синдром Гьессинга)
Наследственное нарушение обмена тирозина (аутосомно-рецессивное наследование дефицита n-гидроксифенилпируватоксидазы). Характерны некрозы в печени (I стадия) с дальнейшим развитием цирроза, печеночной недостаточности (II стадия). Позже (III стадия) присоединяются проявления почечного тубулярного поражения и гипофосфатемический рахит, устойчивый к витамину D. Прогрессирование болезни приостанавливается в случае соблюдения диеты, бедной тирозином.
3.3.7.7. Синдром Скривера — Голдблума — Роя
Отмечается наследственное нарушение обмена аминокислот с проявлениями рахита. Характерна гипофосфатемия, гиперглицинурия, глицилпролинурия, глюкозурия.
3.3.7.8. Синдром Бейбера
Выявляется только у детей (реже — у подростков), прогноз неблагоприятный. Представляет собой заключительную (III) стадию аномалий метаболизма аминокислот (аутосомно-рецессивное наследование) и проявляется задержкой роста, частыми поносами со зловонным стулом, рахитом. При I стадии характерны очаговый некроз печени, гиперметионинемия, при II — нодулярный цирроз печени с печеночной недостаточностью. Отмечается аминоацидурия: с мочой в большом количестве выводятся тирозин, серин, треонин, триптофан, гистидин и лизин (Лазовскис И.Р., 1981).
3.3.7.9. Метилмалонацидемия (дефект мутазы)
Проявляется системным остеопорозом, повышением концентрации глицина в плазме крови, гипераммониемией, гипервентиляцией, почечной недостаточностью.
Остеопороз отмечается также при аминоацидурии II типа, пропионацидемии, гиперглицеринемии, остеодиспластической геродермии, синдроме Гольца — Горлина, синдроме псевдоглиомы, синдроме Вольмана (Делягин В.М., Румянцев А., 2001).
3.3.7.10. Врожденные нарушения холестеринового обмена
Синдром Богарта — Шерера — Эпштейна (аутосомно-рецессивное наследование) проявляется имбецильностью, гипогенитализмом, преждевременным выпадением зубов, системным остеопорозом, кифосколиозом, сухой желтоватой кожей с трещинами, ксантелазмами глазных век, ксантомами на коже и в сухожилиях нижних конечностей, двусторонней ювенильной катарактой, медленно прогрессирующим бульбарным параличом. Рано развивается ишемическая болезнь сердца, инфаркт миокарда. Содержание холестерина в крови нормальное или сниженное (Лазовскис И.Р., 1981). Синдром Тейчлендера — разновидность наследственного липоидтезаурисмоза (аутосомно-рецессивное наследование) — встречается только в возрасте младше 20 лет. В мышцах и сумках суставов образуются очаги кальциноза, в фасциях и в серозных оболочках откладываются липоиды, развивается гранулемная ткань. Часто отмечается остеопороз, мышечная дистрофия, склеродермия. В крови обнаруживают гиперхолестеринемию. При синдроме Хенда — Шюллера — Крисчена (наследственном гранулематозном тезаурисмозе холестерина, болезни накопления), который преимущественно возникает у детей и юношей, отмечается повышение содержания холестерина в крови, задержка роста, изменения в скелете (очаги просветления в костях черепа, бедренных костях, позвонках), выпадение зубов.
3.3.7.11. Синдром Олбрайта — Хадорна
Обусловлен первичными нарушениями калиевого обмена. Характерны периодические параличи с парестезиями, гипо- и арефлексия (обусловлены гипокалиемией), рвота, поносы, слабость, адинамия. Развивается системный остеопороз, резистентный к лечению витамином D, и сопровождается множественными трещинами костей. Кроме гипокалиемии отмечается нормокальциемия, гипофосфатемия, гиперхлоремия, снижение щелочного резерва крови, гиперкалиурия, гиперкальциурия (Лазовскис И.Р., 1981).
3.3.7.12. Сенильный нанизм (синдром Хатчинсона — Гилфорда)
Редкая наследственная аномалия, характеризующаяся гипоплазией гениталий, системным остеопорозом, слабым развитием мускулатуры. У детей старческая внешность, жидкие седые волосы, тонкая кожа, напоминающая кожу при склеродермии, карликовый рост, костные и соединительнотканные контрактуры, атероматоз сосудов, склонность к апоплексии.
3.3.7.13. Нервно-психическая анорексия
Сопровождается остеопорозом, снижением МПКТ в поясничном отделе позвоночника, шейке бедренной кости, риском развития переломов. Этому способствуют:
- сниженный пик костной массы;
- ограничения в питании;
- дефицит массы тела;
- гипогонадизм, аменорея.
Для заболевания характерен отказ от еды, значительное похудание (до 30–50% исходной массы тела), развитие алиментарной дистрофии, аменорея. Нарушение обмена веществ усугубляет витаминная недостаточность.
Основные факторы и механизмы, влияющие на развитие остеопении (остеопороза) при различных заболеваниях, состояниях представлены в табл. 3.8 и 3.9.
3.3.8. Влияние на метаболизм костной ткани лекарств, пестицидов, токсических веществ. Корригирующая роль антиоксидантов
Введение животным тетрациклина в дозе 50 мг/кг массы тела в течение 8 нед обусловливает резкое истончение эпифизарного хряща, нарушение его зональной структуры, увеличение количества межклеточного вещества, резкое снижение числа размножающихся хондроцитов (Сикора В.З., 1981). В диафизах замедляются процессы перестройки первичных генераций остеонов во вторичные, преобладают элементы грубоволокнистой ткани. Изменения сохраняются и через 24 нед. При длительном приеме тетрациклин связывается с кальцием, накапливается в костях и зубах, разрушает их, способствует потере кальция с мочой. На зубах образуются желтые пятна. Длительное использование антибиотиков широкого спектра действия ведет к нарушению формирования кости (гибнет кишечная флора, вырабатывающая витамин К). Выведение минералов, в том числе кальция, с мочой повышают мочегонные препараты.
Синтетическая активность остеобластов нарушается при действии ГК, метотрексата. Метотрексат не только подавляет пролиферацию остеобластов, но и усиливает резорбцию костной ткани остеокластами, его прием сопровождается уменьшением объема губчатой и компактной кости. Потеря минерального компонента матрикса ускоряется при сочетанном приеме метотрексата и ГК. Циклоспорин ингибирует костную резорбцию in vitro. Он активирует процессы ремоделирования костной ткани in vivo и ускоряет уменьшение костной массы (Movsowitz C. et al., 1988). У больных ревматоидным артритом, резистентных к метотрексату, установлено повышение МП позвонков поясничного отдела позвоночника при применении циклоспорина в дозе 3 мг/кг/сут. Процессы ремоделирования нарушают также антагонисты и агонисты гонадотропного гормона, тироксин, гепарин в высоких дозах, препараты лития, антиконвульсанты, диуретики (фуросемид), антациды (содержащие алюминий), производные фенотиазина, индометацин. Фенобарбитал и фенитоин обусловливают повышенный распад и нарушение метаболизма витамина D (образования кальцитриола), что сопровождается угнетением всасывания Са2+ в кишечнике, гипокальциемией. Ингибиторы монооксигеназ, например, циметидин, нарушают метаболизм витамина D и при длительном приеме вызывают его дефицит. Гиповитаминоз D развивается при длительном приеме ГКС и противосудорожных препаратов.
При накожном, ингаляционном, пероральном поступлении в организм динитроортокрезола отмечается выраженное отрицательное действие на морфогенез костной системы у плодов самок крыс, находившихся в условиях пониженной температуры, повышенной влажности и медленного движения воздуха (Ковешников В. и соавт., 1981). Обнаруживается уменьшение ядер окостенения во всех пястных и плюсневых костях. У 40% плодов точки окостенения в концевых фалангах пальцев тазовой конечности отсутствуют. Меньше контрольных показателей точки окостенения в подвздошной, седалищной и лонной костях, в длинных трубчатых костях конечностей. Показатели морфогенеза костной системы плодов приближаются к контрольной группе при имитации рассеянной солнечной радиации.
Остеотоксическое действие оказывает пестицид диптерекс: снижаются темпы роста, возникает дисбаланс МНК и химического состава, снижаются прочностные показатели (Пикалюк В.С., 1991). Эти изменения нивелируются терапевтическими дозами антиоксидантов (токоферол, селенит натрия, дибунол (ионол)), начиная с 3 мес проведения опыта. Такое же действие оказывает и пестицид дипал. При интоксикации пестицидами в минеральном компоненте скелета снижается содержание калия, натрия, магния, повышается — фосфора и кальция (Ковешников В., Пикалюк В.С., 1990б). 20-дневный курс приема антиоксидантов нивелирует влияние пестицида. Однократное введение диптерекса, пестицида кельтана влияет на параметры роста скелета, МНК, макроэлементный состав и прочностные характеристики костной ткани, холинэстеразную и антиокислительную активность сыворотки крови животных. Применение антиоксидантов оказывает выраженный терапевтический эффект уже с первых дней опыта, нивелируя токсичность пестицидов в высоких дозах. Эффект стабилен на протяжении 30 дней опыта и несколько нивелируется к 90-му дню. Авторы отмечают, что кроме нормализации параметров роста скелета происходит его коррекция до уровня контрольных показателей макросостава, влагосодержания, МНК. Селенит натрия выявляет корригирующие свойства в краткий (10–30 дней) период действия, токоферол и дибунол эффективны в разной степени на протяжении всего периода эксперимента.
Интенсификацию перекисного окисления липидов при воздействии пестицидов (линдан, плондрел, афос), дисбаланс процессов перекисного окисления и антирадикальной активности, угнетение защитных систем организма отмечали другие авторы. О.Б. Леоненко (1990) связывает ее с индукцией микросомального окисления. Воздействие линдана в течение 2–6 мес обусловливает снижение поглотительной и микробицидной активности фагоцитов, уменьшение количества киллерных клеток, В-лимфоцитов, увеличение соотношения Т-супрессоры/Т-хелперы, угнетение реакции бластообразования на фитогемагглютинин (Кузьминский С.Н. и соавт., 1990).
Нарушение функционирования костной ткани возникает в результате влияния вредных факторов металлургического производства и промышленно развитых городов (Побел А.Н., 2002). К этим факторам относятся углекислый газ, окись углерода, диоксид азота, оксида серы ((SO3), соединения ртути, свинца, кремния, оксид марганца, хрома, аммиак, фенол, бензол, толуол, формальдегид, сероводород, оксид серы (SO2), кремнефторводород. Химические загрязнители вызывают развитие остеопороза, аномалий скелета, повышение частоты переломов. В экспериментальных исследованиях под влиянием паров формальдегида отмечается снижение содержания воды в костях, повышение содержания минеральных компонентов (Мякоткина Г.В., 2000).
Хрящевая и костная ткань интенсивно накапливают свинец, особенно активно это происходит в молодом возрасте: депонирование металла наблюдается в зоне роста кости. Нарушается пролиферация хондроцитов в период активного роста хрящевых закладок скелета в пренатальном онтогенезе. В ткани хряща свинец накапливается как внутриклеточно, так и в матриксе. Внутри клеток свинец связывается с активными центрами ферментов и, в первую очередь, окислительно-восстановительных. Нарушаются метаболизм хондроцитов (синтез ими гликогена), синтез сульфатированных гликозамингликанов, формообразовательные процессы в костной ткани. Высокую концентрацию свинца обнаруживают в ребрах, позвонках, черепе, костях таза, длинных трубчатых костях. Он замещает кальций в кристаллической решетке гидроксиапатита. Под влиянием свинца нарушается включение в костную ткань не только кальция, но и фосфора, изменяется их соотношение в кости. Под влиянием свинца нарушается внутрикостное кровообращение (возникают дистрофические изменения в клетках эндотелия капилляров, в периваскулярных клетках), дифференциация и функциональная активность остеобластов, снижается скорость образования остеоцитов.
Алюминий, как аргументировано выше, является жизненно необходимым металлом, потребность человека в нем составляет около 35–40 мг/сут (в суточном рационе содержится от 2 до 100 мг). При избыточном содержании алюминий вытесняет из металлопротеидов магний, кальций, железо, азот и тем самым нарушает метаболические процессы: углеводный обмен, синтез гемоглобина. Интоксикация алюминием обусловливает развитие остеопенического синдрома, остеомаляции (в МКБ-10 в рубрике М83 — остеомаляция у взрослых выделена костная болезнь, связанная с алюминием (М83.4)). Остеопенический синдром развивается при длительном приеме антацидов, содержащих гидроксид алюминия. Накопление в кости алюминия сопровождается снижением минерализации кости, МПКТ, развитием переломов. Под действием алюминия снижаются темпы дифференцировки клеток остеобластической и остеокластической линии, нарушается синтез коллагена остеобластами, минерализация матрикса (кристаллы гидроксиапатита не образуются, кальций в них замещается на алюминий).
Как отмечено выше, жизненно необходимым элементом является фтор. Ежедневно взрослый человек нуждается в 1,3–1,8 мг фтора. 96% фтора, поступающего в организм, накапливается в костной ткани. Хроническая интоксикация фтором может проявиться остеосклерозом, остеомаляцией, вторичным гиперпаратиреозом и остеопорозом (Франке Ю., Рунге Г., 1995). Характер изменений зависит от поступающей в организм дозы. Фтор стимулирует метаболическую активность остеобластов, способствует формированию остеоида. В низких дозах он активизирует процесс ремоделирования, в высоких — ингибирует остеокласты. При хроническом воздействии фтора повышается минерализация кости, при высоких дозах появляются очаги деминерализации. Выделяют три стадии флюороза: I — плотность костей (таза, позвоночника) повышается; II — нарушаются контуры костей (ребер, длинных костей); III — развивается «мраморность» кости, суживается костномозговой канал, утолщается кортикальный слой. Флюороз сопровождается болью в костях, позвоночнике, крупных суставах.
Вследствие потребления крысами воды, содержащей повышенное количество стронция, снижается МПКТ во всех отделах скелета.
3.3.9. Влияние на метаболизм костной ткани других факторов
На состоянии костной ткани негативно сказывается гипокинезия, постельный режим. К факторам, лежащим в основе их влияния (Burr D.B., Martin B., 1992; Оганов В.С., 1997), относят:
- снижение нагрузки тела на опорно-двигательный аппарат,
- повышение экскреции кальция из организма (возникает отрицательный баланс);
- выпадение механизма адаптации костной ткани к деформации костного материала, механической нагрузке (напряжению);
- снижение уровня эффективного «деформационного» потенциала;
- снижение (отсутствие) механической стимуляции;
- замедление адаптивного ремоделирования костной ткани;
- торможение остеобластического гистогенеза.
Нарушения функционирования костной ткани при иммобилизации могут быть связаны с недостаточной пьезоэлектрической стимуляцией скелета, нарушением кровообращения кости и мышц. В развитии остеопороза при гипокинезии Н.В. Дедух и соавторы (2002) выделяют две фазы (схема 3.6). Резкая потеря костной ткани в I фазу обусловлена факторами стресса («стероидная остеопения»). Для II фазы (адаптации) характерно устойчивое состояние и переход костной системы на низкий функциональный уровень (иммобилизационный остеопороз). Выраженность остеопороза на фоне гиподинамии варьирует в костных структурах: остеодистрофические явления наиболее быстро развиваются в костях, несущих нагрузку тела. Костные изменения в губчатых структурах более выражены, чем в компактных. Наиболее реактивной является губчатая костная ткань метафизов длинных трубчатых костей.
У здоровых лиц снижение содержания кальция появляется на 56-й неделе постельного режима. При постельном режиме в течение 30–36 нед повышается уровень кальция, фосфора, гидроксипролина, снижается около 1/3 костной массы (Donaldson C.L. et al., 1970). При пребывании на постельном режиме в течение 120 дней МПК поясничных позвонков снижается на 1,7% ежемесячно по данным компьютерной количественной томографии (Оганов В.С. и соавт., 1997). В восстановительный период после гипокинезии также продолжается снижение МПК (в костях таза), которое В.С. Оганов и соавторы (1997) объясняют активацией резорбции и формирования (с ригидностью процесса) костной ткани.
Степень выраженности процессов деминерализации снижается после 25 нед постельного режима (Woodard D. et al., 1988). При гипокинезии у здоровых лиц и при постельном режиме у больных отмечается прогностически неблагоприятный фактор гиперминерализации губчатой кости тел поясничных позвонков, который связывают с замедлением ремоделирования костной ткани и накоплением высокоминерализованной фракции минерального компонента.
Отмечающееся в невесомости и при гипокинезии снижение нагрузки на скелет обусловливает развитие остеопороза. Нарушается рост костей, структурная организация губчатой костной ткани и компактного вещества, изменяется минеральный состав, снижаются прочностные характеристики (Дедух Н.В. и соавт., 2002). Губчатая костная ткань становится широкопетлистой, трабекулы истончаются, уменьшается численность слоев, снижается плотность остеоцитов, число и функциональная активность остеобластов.
Компактная костная ткань реагирует на гипокинезию позже губчатой — через 2–6 мес. В первую очередь поражаются длинные кости. Интенсивную потерю костной массы в первые 2 нед гипокинезии, угнетение роста костей в длину указанные авторы связывают со стрессорной реакцией животных (КС тормозят рост костей, повышают уровень ПТГ, усиливающего резорбцию кости, ингибируют метаболизм и гистогенез остеобластов). Таким образом, развитие остеопороза происходит в две фазы: сначала развивается стероидная остеопения, затем — иммобилизационный остеопороз. Наиболее быстро происходят изменения в костях, несущих нагрузку тела, интенсивность изменений выше в губчатом веществе. В процессе гипокинезии отмечается выход из кости кальция, фосфора, магния, железа и включение стронция, который конкурирует с кальцием за место в кристаллической решетке. Также наблюдается временная мобилизация из кости цинка, хрома, рутения, натрия, сурьмы. Одной из причин развития остеопороза при иммобилизации считают снижение кровотока в костях, мышцах.
Уменьшение костной массы обусловлено уменьшением массы тела. Уменьшение костной массы отмечается через 59–84 дня пребывания в космосе, баланс кальция становится негативным. После возвращения на Землю костная масса восстанавливается не полностью (Tilton F.E. et al., 1980). Механизм развития остеопении, деминерализации кости глубоко не изучен.
Быстрое уменьшение массы губчатой кости отмечается при повреждении спинного мозга (Minaire P. et al., 1974). При тетраплегии сначала увеличивается костный обмен во всем скелете, а затем уменьшается костная масса, особенно в нижних конечностях (Whedon G.D., 1984). После уменьшения объема трабекулярной кости на 30% и более костный объем стабилизируется. При параплегии в ранних стадиях диспропорционально повышается скорость костного формирования и костной резорбции. Наступает дисбаланс ремоделирования, кости больше резорбируются, чем образуются. Костная резорбция усиливается во всех трех костных отделах: эндостальном, гаверсовом, периостальном. Костная резорбция сопровождается гиперкальциемией, повышением содержания кальция, фосфора, гидроксипролина в моче, негативным балансом кальция и фосфора. Мышечная атрофия обусловливает повышение уровня азота в моче. Также снижается уровень ПТГ в сыворотке крови, 1,25-(ОН)2D3 — в плазме крови, снижается кишечная абсорбция кальция (Steward A.F. et al., 1982). Весьма быстро развивается остеопороз у больных неврологического профиля после инсульта, при этом потеря костной массы коррелирует с продолжительностью гемиплегии, гемипареза и наибольшая потеря массы кости наблюдается на стороне поражения. На стороне гемиплегии чаще развиваются переломы. Фактором развития остеопороза в этих условиях также является отсутствие мышечной активности. Достоверная потеря костной ткани отмечается у женщин, перенесших инсульт, в постменопаузальный период (Поворознюк В.В. и соавт., 2001) и связана, по мнению авторов, с гормональным дефицитом, иммобилизацией, нарушением абсорбции кальция и витамина D. Иммобилизационный остеопороз описан у больных с деменцией (Melton L.J. et al., 1994), болезнью Паркинсона. Повышенный риск переломов характерен при детском параличе, параплегии. Развитие остеопороза у больных неврологического профиля обусловливают психотропные средства.
Остеопения и остеопороз развиваются в условиях длительного плавания на судах (Лобенко А.А. и соавт., 2002). Их причиной является снижение двигательной активности, ослабление нагрузок на кости, стрессорный фактор (гипокинезия, вибрация, ударное ускорение), развитие общего адаптационного синдрома. Отмечается интенсивное снижение минералов (прежде всего в губчатом веществе кости), снижаются прочностные характеристики. На 5–20% разрежается костная структура, на 20–40% снижается прочность кости. По данным авторов, остеопенический синдром начинает развиваться уже через 30 сут. Кальциевый и фосфорный баланс становится отрицательным. Причем потеря губчатой костной ткани значительна при невысоких показателях отрицательного кальциевого баланса. Наиболее ранние и выраженные изменения возникают в позвоночнике, богатом губчатым веществом. При динамическом воздействии в условиях шторма возникает опасность травматизма, которая усугубляется при остеохондрозе, остеоартрозе, плоскостопии. При изгибе позвоночника возникают микро- и макропереломы с неврологическими проявлениями. В целях коррекции развивающихся изменений А.А. Лобенко и соавторы (2002) рекомендуют использовать комплекс лечебно-профилактических мероприятий, включающий рациональное питание (продукты с повышенным содержанием кальция), повышение двигательной активности, ЛФК, массаж, адаптогены и др.
Физические упражнения стимулируют образование гормона роста (в результате применения гормона роста пациентами пожилого возраста повышается МПКТ). Длительная физическая нагрузка сопровождается дестабилизацией лизосомальных мембран, повышением секреции лизосомальных гидролаз в остеокластах (Панина Л.Е., Маянская Н.Н., 1987). Это обусловливает нарушение структуры костной ткани вне зоны резорбции. Физические упражнения высокой интенсивности приводят к снижению выработки эстрогенов, метаболическому ацидозу, который сопровождается усилением костной резорбции. У женщин молодого возраста меняется эстрогенный статус, нарушается менструальный цикл. При усиленных физических упражнениях в период беременности организм матери использует Са2+ для своих повышенных потребностей, обделяя плод и нарушая его рост.
Под влиянием никотина нарушается образование половых гормонов, ускоряется метаболизм экзогенных эстрогенов, эстрадиола в печени (образуется неактивный 2-гидроксиэстрон). Метаболизм эстрогенов активируется в результате повышения активности цитохрома Р450 в печени под влиянием никотина, компонентов дыма. Курение сопровождается снижением всасывания кальция, его усвоения. Оно обусловливает преждевременное наступление менопаузы. В организме курильщиков обнаруживают кадмий, который разрежает костную ткань. В целом в результате курения в 3 раза повышается риск возникновения переломов бедренной кости. Курение в период беременности приводит к уменьшению костной массы ребенка на 11%. Интоксикация табачным дымом сопровождается угнетением роста костей у экспериментальных животных. Нарушение функций клеток в зонах роста костей может быть связано с интенсификацией перекисного окисления никотином (Kalra J. et al., 1991). Результатом курения является стимуляция резорбции, уменьшение массы кортикальной кости, костной массы в целом, нарушение абсорбции кальция, раннее наступление менопаузы, понижение уровня эстрогенов у женщин, повышение риска развития переломов. Уровень витаминов С, А, Е, D, В2, фолиевой кислоты в организме снижается по мере увеличения количества выкуриваемых сигарет. У курильщиков повышается потребность в антиоксидантно действующих витаминах С, Е, А, которые инактивируют образующиеся свободные радикалы. Дефицит в организме витаминов С, Е, А (в-каротина), D повышает риск развития опухолевых процессов. В связи с тем, что обеспечение витаминами ухудшается в пожилом возрасте, особенно выраженный дефицит аскорбиновой кислоты развивается у курильщиков пожилого возраста.
Потерю костной массы обусловливает избыточное потребление алкоголя и кофе. Под их действием снижается биодоступность кальция. Кофеин, теофиллин снижают концентрацию цАМФ в клетках почечных канальцев, тормозят образование кальцитриола. При повышенном потреблении алкоголя, алкоголизме снижается поступление в организм витаминов С, β-каротина и особенно В1. Развитие остеопении при алкоголизме связывают с нарушением питания, мальабсорбцией, снижением всасывания кальция, витамина D3, подавлением функции остеобластов, повышением уровня ПТГ, нарушением метаболизма кортизола (Дедух Н.В., Зупанец И.А., 2002). Алкоголь также снижает концентрацию ПТГ, повышает выделение кальция с мочой, активирует цитохром Р450, разрушение 25-ОН-D3. У лиц, злоупотребляющих алкоголем, уменьшается костная масса, повышается риск переломов. Морфологические исследования обнаруживают изменения трабекулярной кости.
Плотность костной ткани, геометрическая форма костей программируются уже в период внутриутробного развития. Неправильное питание, неадекватная физическая нагрузка, курение в период беременности в дальнейшем обусловливают развитие остеопороза. Малая масса тела при рождении приводит к уменьшению костной массы в последующие периоды жизни, изменениям формы бедренной кости. У родившихся с недостаточной массой тела отмечают дефицит толщины проксимального отдела бедра и сниженную МПКТ. При ограничении в приеме пищи, недостаточных резервах жиров в период вынашивания плода костная масса детей уменьшается на 8% по сравнению с возрастной нормой. Эти изменения обусловлены недостаточным поступлением кальция в организм плода через плаценту. Отмеченные изменения, наступившие в период внутриутробного развития, сказываются на состоянии костной ткани через многие десятилетия жизни.
Нарушением роста, формообразования костей, снижением прочности, гибкости костей, пластичности костной ткани сопровождается хроническое перегревание организма (Чистолинова Л.И., Опалинская Л.И., 1990). Возникает дисбаланс микроэлементного состава кости (Чистолинова Л.И., 1990). Выраженность изменений варьирует в зависимости от длительности воздействия.
Негативное влияние на состояние костной ткани оказывает как острый, так и хронический стресс (схема 3.7).
Стресс, или общий неспецифический адаптационный синдром, проявляется рядом стереотипных реакций, направленных на обеспечение устойчивости организма в ответ на изменение условий (травма, перелом костей, операция, инфекция, воспаление, кровопотеря, голод, жажда, эмоциональное напряжение, обездвиживание, резкое снижение или повышение температуры оружающей среды и др.). Определенную роль во влиянии стресса играет снижение активности андроген- и эстрогенпродуцирующих систем (Вартапетов В.А. и соавт., 1982): ежедневное (на протяжении 1 нед) одновременное воздействие на животных ноцицептивного и иммобилизационного стрессоров снижает активность этих систем. Гипокинезия, дегравитация, гипергравитация, неполноценное питание, по мнению Н.В. Дедух и соавторов (2002), являются мощными стрессорными факторами. Усиленный выброс катехоламинов активизирует синтез ГК. Возникающая гипокальциемия сопровождается развитием вторичного гиперпаратиреоидизма, усилением костной резорбции (остеоцитарного остеолиза и остеокластической резорбции). Результатом этих изменений является развитие на протяжении первых 2 нед после действия стрессорного фактора стероидной остеопении, потеря костной ткани. В последующую стадию (адаптации) костная ткань переходит на медленный тип обмена («ленивая кость»), характеризующийся угнетением костеобразования, невысокой активностью костной резорбции (как при неактивном остеопорозе). Очевидно, наиболее выраженные изменения в кости происходят при повторных, хронических стрессовых ситуациях. Отмечаемое при стрессе усиление продукции кальцитонина в какой-то мере нивелирует негативное влияние катехоламинов, ГК, ацидоза. Однако отсутствует активирующее по отношению к кальцитонину действие эстрогенов и андрогенов.
Похудение, резкое уменьшение массы тела является одним из вариантов стресса, сопровождается снижением продукции половых гормонов, нарушением овариально-менструального цикла (вплоть до аменореи), развитием ацидоза, потерей костной ткани.
Снижение МПКТ наблюдается у 43% лиц, подвергшихся радиационному воздействию (Зборовская И.И. и соавт., 2002). Уровень остеокальцина в их крови снижен. В эксперименте под действием ионизирующего излучения нарушается метаболизм и структура костной ткани, меняются механические свойства. При этом величина дозы облучения не имеет решающего значения. После действия ионизирующего излучения развивается лучевой остеопороз. Под влиянием ионизирующего излучения в больших дозах в костных тканях снижается содержание кальция, магния, натрия, калия, угнетается функция остеобластов, нарушается регенерация (Дедух Н.В. и соавт., 2002). Прежде всего поражаются клетки кости (как предшественники, так и зрелые), нарушаются процессы ремоделирования, угнетаются процессы резорбции и костеобразования. Снижение МНК отмечается и при действии облучения в малых дозах (до 50 Гр). Появляются изменения структуры костной ткани (качественные и количественные) в губчатой и кортикальной кости, снижается упругость и прочность костей. Химио- и лучевая терапия (особенно головы) негативно влияют на продукцию гормонов гипофиза, является причиной нарушения гомеостаза костной ткани. Основными механизмами патологического влияния радиационного фактора на систему регуляции кальций-фосфорного гомеостаза и процессы формирования костной ткани у детей, по данным В.В. Поворознюка и соавторов (1997) и В.В. Поворознюка и Н.В. Григорьевой (2002), являются поражение щитовидной железы, нарушение секреции СТГ и половых гормонов, патологическое влияние на костную ткань инкорпорированного 90Sr, нарушение развития плода, формирование костной ткани в антенатальный период, снижение клоногенной способности клеток, увеличение количества функционально неактивных генов, отвечающих за метаболизм костной ткани, недостаточное потребление кальция, витамина D, вторичный дисбаланс в гормональном статусе, дисгармоничное физическое развитие. Эти изменения в детском организме в дальнейшем проявятся ростом распространенности остеопороза у взрослых. Дети, проживающие на радиационно загрязненных территориях, потребляют недостаточное количество кальция, витамина D. Повышение у них частоты развития патологии органов пищеварения сопровождается снижением абсорбции кальция.
Вибрация оказывает как локальное (на кости кистей, предплечья, голеней), так и системное влияние на скелет. Процессы резорбции усиливаются уже при I стадии вибрационной болезни.
Гипоксия сопровождается дестабилизацией лизосомальных мембран, возрастанием секреции лизосомальных гидролаз (Loegering D. et al., 1975). В результате повышается концентрация гидролаз в остеокластах, что обусловливает нарушение структуры костной ткани вне зоны резорбции.
Как отмечено выше, острый и хронический респираторный и нереспираторный (метаболический) ацидоз сопровождаются снижением активности ЩФ, усилением мобилизации кальция и фосфора из костей (Комаров Ф.И. и соавт., 1981). При ацидозе из костей в межклеточную жидкость поступает натрий (при алкалозе и избыточном приеме с пищей он аккумулируется в кости). В костных клетках протекают процессы дыхания, гликолиз, постоянно образуется молочная кислота. При введении ПТГ повышается образование лактата (это один из механизмов его действия), что приводит к локальной деминерализации кости вследствие снижения рН. По мере растворения кристаллов кости освобождается цитрат, который поступает в кровь. Эстрогены ингибируют образование лактата и повышают МПК при длительном введении.
В процессах деминерализации при ацидозе участвует карбоангидраза, играющая важную роль при переносе или накоплении Н+ в различных органах. Введение ингибиторов карбоангидразы нефрэктомированным крысам обусловливает гипокальциемию, ингибирует гиперкальциемию, индуцируемую ПТГ (Уайт А. и соавт., 1981б). Добавление ингибиторов карбоангидразы к культуре костной ткани блокирует секрецию Са2+, индуцируемую ПТГ. Авторы предполагают, что наряду с цитратом и лактатом карбоангидраза, участвуя в секреции Н+, влияет на приток Са2+ в костные клетки и выход его из них. При сахарном диабете ацидоз является результатом накопления кетоновых кислот вследствие их усиленного образования при распаде высших жирных кислот. Голодание вызывает развитие ацидоза вследствие недостаточности углеводов, мобилизации жиров из депо. Повышается окисление жирных кислот в печени, но поскольку углеводов не хватает, происходит неполное окисление жирных кислот, накапливаются кетоновые тела. При поносах ацидоз является результатом потери натрия, калия, хлоридов, бикарбонатов. Функция почек в регуляции концентрации ионов Н+ в организме нарушается и из-за обезвоживания. При нефритах нарушается выведение органических кислот с мочой в свободном виде и в составе аммонийных солей. При поражении почек отмечается несколько вариантов развития ацидоза. Так, при поражении клубочков, вызванном хроническим гломерулонефритом, наблюдается задержка сульфатов, фосфатов, снижается концентрация бикарбонатов. В результате развивается ацидоз, гиперфосфатемия. Другим вариантом почечного ацидоза является канальцевый ацидоз, сопровождающийся недостаточностью переноса ионов водорода. Причиной расстройств является нарушение активности карбоангидразы. Моча имеет щелочную реакцию, развивается гипохлоремический ацидоз без азотемии. Аналогичные изменения возникают при применении диуретиков в избыточных дозах, ингибирующих активность карбоангидразы (например, ацетазоламида). Ацидоз возникает при недостаточном поступлении фосфатов в организм из-за нарушения всасывания. Развитие ацидоза обусловлено понижением функциональной активности щитовидной железы, недостаточным образованием в почках аммиака, применением хлорида аммония в качестве диуретического средства. В последнем случае в крови накапливаются хлориды, развивается метаболический гиперхлоремический ацидоз. Склонность к развитию нереспираторного ацидоза отмечают у пациентов с Аддисоновой болезнью: из-за недостаточной продукции стероидов нарушается активность ферментов, регулирующих синтез аммиака, оксидаз аминокислот, глутаминазы.
Большое количество кальция выводится из организма с потом. У спортсменов некоторых категорий потеря костной массы может достигать 3% в год, что требует соответствующего контроля и компенсации.
3.3.10. Экспериментальные модели остеопороза
Многофакторность остеопороза подтверждается созданием многих экспериментальных моделей остеопороза. Экспериментально смодулированы локальный и системный остеопороз: сенильный, алиментарный, гормональный, иммобилизационный, вторичный при многих заболеваниях (Фролькис В.В. и соавт., 1999; 2002; 2004). Развития гормонально обусловленного остеопороза в эксперименте можно достичь введением КС, экстракта гипофиза, СТГ, глюкагона, овариоэктомией, моделированием гипертиреоза, гипотиреоза, гиперпаратиреоза, сахарного диабета. Остеопороз можно вызвать денервацией, иммобилизацией, созданием экспериментальной модели остеопороза в условиях невесомости, химической, лучевой, полиэтиологической и других моделей (холодового стресса, экспериментальной почечной недостаточности, экспериментального цирроза печени). Локальный остеопороз в эксперименте также может быть обусловлен следующими факторами (Фролькис В.В., Поворознюк В.В., Евтушенко О.А., 2004):
- нарушением кровообращения (венозного оттока при длительной иммобилизации конечностей);
- в результате экспериментальных переломов, невритов, пересечения магистральных нервных стволов;
- искусственными ожогами, отморожениями.
3.4. Клиника остеопороза
Больные жалуются на быструю утомляемость, снижение работоспособности, диффузную боль в костях, затылочную боль (из-за гиперлордоза шейного отдела позвоночника). Отмечаются психологические реакции: раздражительность, плаксивость, эмоциональная лабильность или депрессивное состояние, апатия, чувство безнадежности, страха, нарушение сна. Во многих случаях остеопороз протекает бессимптомно, появление боли в различных частях скелета относится к предвестникам остеопороза (к классической клинической триаде остеопороза, кроме боли в костях, относятся деформация скелета, переломы костей). При сборе анамнеза следует учитывать наличие и частоту переломов в прошлом, особенности питания, физическую активность пациента.
При осмотре обращают внимание на:
- возраст пациента (календарный, биологический);
- особенности конституции;
- наличие грудного кифоза;
- возможное укорочение туловища;
- наличие дополнительных кожных складок на туловище;
- расположение ребер на гребнях подвздошных костей;
- дряблость мышц, наличие в них болезненных узелков;
- боль при сдавливании грудной клетки;
- болезненность при пальпации грудного и поясничного отдела позвоночника;
- уменьшение соотношения расстояния голова — симфиз/симфиз лонной кости — стопа более чем на 5 см (в норме эти размеры одинаковы).
При остеопорозе резкое опускание на цыпочках, давление сверху на вытянутые руки сопровождается болью в позвоночнике.
В процессе диагностики следует учитывать тесную связь между ИМТ и риском развития остеопороза. Повышение ИМТ (после наступления менопаузы, при умеренном ожирении) является фактором снижения риска развития остеопороза. Наоборот, хрупкое (астеническое) телосложение, невысокий рост, малая масса тела, истощение являются факторами риска остеопороза.
Из-за избыточного поступления кальция в кровь из костей скелета отмечается реакция симпатического отдела вегетативной нервной системы: повышение артериального давления, тахикардия, кардиалгия, чувство онемения и парестезий дистальных отделов конечностей, ангиоспастические проявления — судорожное сокращение мышц голеней (преимущественно ночью), болезнь Рейно (Евтушенко С.К. и соавт., 2001). У некоторых пациентов развиваются симпатоадреналовые кризы с характерными проявлениями.
Болевой синдром у пациентов с остеопорозом может быть практически постоянным. При этом боль чаще локализуется в поясничном и крестцовом отделах позвоночника, костях таза, в области тазобедренных, голеностопных суставов, в ребрах. Она усиливается при физической нагрузке, ее выраженность меняется (увеличивается) при перемене погоды, атмосферного давления. В горизонтальном положении пациента выраженность боли уменьшается. По мере прогрессирования остеопороза, увеличения кифоза боль в позвоночнике нарастает. Постоянный характер боли связывают с напряжением мышц и связочного аппарата позвоночника (повышается мышечный тонус, возникает спазм). Появление острой боли, как правило, обусловлено возникшим переломом позвонка, ребер. При переломе позвонка в соответствующем месте появляется острая боль, усиливающаяся при движении, а также при перкуссии позвоночника. В случае клиновидного перелома при сенильном остеопорозе болевые ощущения могут отсутствовать. Боль возникает при микропереломах, напряжении сосудистой стенки, сдавлении нервных окончаний. Хроническая боль возникает и в результате кифотических и сколиотических изменений, растяжений связок. Причиной боли в нижней части спины может явиться синдром Бострупа: соприкосновение люмбальных отростков в результате уплощения позвонков и возникновения боли в раздраженной надкостнице (Мадьяр И., 1983). Остеопороз сопровождается уменьшением роста пациента, мышечной слабостью, появлением чувства тяжести в межлопаточной области. Поколачивание по позвоночнику обусловливает боль, при пальпации обнаруживают напряжение длинных мышц спины. Укорочение позвоночника может быть причиной боли в нижней части ребер, отдающих в спину. Постепенно меняется осанка больного: появляется (усиливается) кифоз грудного отдела позвоночника, развивается сутулость. Кифотическая осанка может возникать без остеопороза в результате ослабления мышц спины, снижения эластичности дисков. Может усиливаться поясничный лордоз. Изменяется вся фигура больного: нижняя часть тела становится длиннее верхней, уплощается верхний треугольник ромба Михаэлиса, грудная клетка и живот выпячиваются, кожа над позвоночником истончается, подвижность его минимальна, круговые и наклонные движения ограничены. Обнаруживается положительный симптом осевой нагрузки, симптомы «посадки», «треноги». Походка больных становится неуверенной, они передвигаются мелкими шагами, ноги при этом широко расставлены.
Характерным проявлением остеопороза являются переломы костей. Возникают деформации тел позвонков в результате центральных компрессионных переломов, передней клиновидной деформации, нарушения формы тела позвонка в области хрящевых замыкательных пластинок (Грунтовский Г.Х., 2002). При постменопаузальном остеопорозе в связи с преимущественной потерей губчатой кости развиваются компрессионные переломы тел позвонков, которые появляются в первые 10 лет после менопаузы и их частота достигает максимума в возрасте 60–65 лет. Наиболее часто возникают переломы TVILII позвонков, возможны в среднегрудном и нижних поясничных позвонках. На рентгенограммах переломы позвонков могут не выявляться в течение 4 нед после повреждения. Также характерными для этой категории больных являются переломы лучевой кости в дистальном отделе (перелом Коллиса), частота которых повышается в возрасте старше 45 лет. Этот перелом является индикатором остеопении и остеопороза у женщин в постменопаузальный период (Поворознюк В.В., Григорьева Н.В., 2002). На поздних стадиях постменопаузального остеопороза возникают переломы проксимального отдела бедренной кости, шейки бедра, что характерно и для сенильного остеопороза. При этом переломы шейки бедра обусловлены кортикальным остеопорозом, межвертельные — потерей губчатого вещества. Стероидный остеопороз может сопровождаться множественными переломами ребер.
При недиагностированных компрессионных переломах позвонков допускаются диагностические ошибки: предполагается кардиологическая, гастроэнтерологическая и другая патология. Н.А. Корж и соавторы (2002а) выделяют острое и медленное клиническое течение остеопороза. Острое течение характеризуется выраженным болевым синдромом в пораженном отделе позвоночника, обусловленном компрессионным переломом позвонка после неадекватной травмы. Для медленного течения характерна средняя интенсивность постоянной или периодически усиливающейся боли в положении стоя или сидя, исчезающей в горизонтальном положении пациента. Возможны переходные состояния.
Остеомаляция может сопровождаться болью в паховой области, лонной кости, почечная остеодистрофия — болью в суставах, костях. В том и другом случае отмечается мышечная слабость.
Из других симптомов остеопороза следует отметить развитие парадонтоза, преждевременное поседение, нарушение дыхания из-за сжатия грудной клетки, нервозность.
Очень часто при наличии остеопороза возникают различные симптомы со стороны нервной системы (Евтушенко С.К. и соавт., 2001).
Классификация патологии нервной системы у взрослых, обусловленной остеопорозом (Евтушенко С.К., Луцкий И.С., 1998)
- Патология надсегментарного отдела вегетативной нервной системы (синдром вегетососудистой дистонии).
1.1. Цефалгия с мигренеподобными кризами.
1.2. Вестибулопатия.
1.3. Головные боли напряжения («болезненный скальп»).
1.4. Симпатоадреналовые кризы (панические атаки).
1.5. Синкопальные состояния.
1.6. Краниоцервикальная дистония.
- Патология сегментарного уровня вегетативной нервной системы.
2.1. Прогрессирующая периферическая ангиовегетодистония (с синдромом Рейно и без).
2.2. Висцеральные (абдоминальные) вегето-сосудистые кризы.
2.3. Периодический ангиотрофический синдром с атрофией мышц кистей и стоп.
2.4. Ганглионевралгия.
2.5. Трункалгия.
3. Патология периферической нервной системы (преимущественно ишемического характера на шейном, грудном и поясничном уровнях).
3.1. Преимущественно с болевым синдромом.
3.1.1. Радикулоневралгии.
3.1.2. Радикулоневропатии.
3.1.3 Плексоневропатии.
3.1.4. Ганглиорадикулопатии.
3.1.5. Вегеторадикулопатии.
3.1.6. Ночные плечевые парестезии.
3.2. Радикулоишемические синдромы с парезами рук и ног.
4. Патология спинного мозга.
4.1. Миелорадикулоишемия.
4.2. Нарушение кровообращения спинного мозга:
4.2.1. Инфаркт спинного мозга в бассейне артерии Адамкевича.
4.2.2. Инфаркт спинного мозга в бассейне артерии Депрож — Готтерона.
4.2.3. Инфаркт спинного мозга в бассейне позвоночных артерий.
5. Патология мышц.
5.1. Фибромиалгия.
5.2. Миофасцикулярный болевой синдром.
5.3. Синдром мышечных крампи.
5.4. Синдром беспокойных ног.
6. Сочетанные (многоуровневые) поражения нервной системы.
В результате компрессии позвонков, уменьшения межреберных промежутков формируются корешковые синдромы. Как отмечают С.К. Евтушенко и соавторы (2001), наиболее часто поражаются (в отличие от остеохондроза позвоночника) корешки нижнегрудного и верхнепоясничного отделов позвоночника. Реже сдавливаются корешковые артерии: передние корешково-спинальные артерии, корешково-спинальная артерия поясничного утолщения, среднегрудного бассейна кровоснабжения спинного мозга, дополнительная корешково-спинальная артерия. При умеренной компрессии отмечается корешковый синдром (радикулоишемия), поражение спинного мозга в виде оживления (повышения) сухожильных рефлексов на ногах, появление патологических стопных знаков, нарушение функции тазовых органов (часто в виде императивных позывов к мочеиспусканию). Значительное сдавление корешково-спинальных артерий обусловливает острое и хроническое нарушение спинального кровообращения.
С.К. Евтушенко и соавторы (2001) выделили ряд неврологических синдромов — первых проявлений остеопороза у детей на фоне хронических, длительно протекающих заболеваний нервной системы (церебральный паралич, синдром Элерса — Данлоса, гомоцистинурия). К ним авторы отнесли: продолжительную боль в мышцах, костях, крупных суставах, позвоночнике, крампи, прогрессирующий вегетососудистый синдром с дистоническими и синкопальными приступами, полинейропатию, акропарестезии, головную боль.
3.5. Диагностика остеопороза
Диагностика остеопороза (Рожинская Л.Я., 2000) включает:
I. Клинико-анамнестические данные.
II. Рентгенографическую диагностику остеопении.
III. Радиоизотопные методы исследования.
IV. Количественные методы определения плотности костной ткани.
- Фотонная абсорбциометрия.
- Моноэнергетическая и двухэнергетическая рентгеновская абсорбциометрия.
- Количественная компьютерная томография.
- Ультразвуковая костная денситометрия.
V. Лабораторную диагностику метаболических заболеваний скелета.
- Оценка состояния минерального обмена и кальцийрегулирующих гормонов:
а) кальций сыворотки крови;
б) фосфор сыворотки крови;
в) магний;
г) ПТГ;
д) кальцитонин;
е) кальцитриол.
- Маркеры костного метаболизма.
2.1. Маркеры костного формирования:
а) ЩФ;
б) пропептид проколлагена I типа.
2.2. Маркеры костной резорбции:
а) оксипролин;
б) коллагеновые поперечные (перекрестные) соединения;
в) тартрат-резистентная кислая фосфатаза;
г) галактозилоксилизин в моче.
VII. Биопсию костной ткани.
VIII. Дифференциальную диагностику остеопенического синдрома.
3.5.1. Инструментальная диагностика остеопороза
3.5.1.1.Рентгенологическое исследование
Это исследование остается общепринятым и наиболее распространенным методом диагностики остеопороза. Считается, что с помощью рентенографии оценить выраженность остеопороза достаточно трудно из-за неспецифичности рентгенологических симптомов. Выявление рентгенологических признаков остеопороза во многом субъективно, а также зависит от качества аппаратуры, пленок и др. Основной задачей рентгенологического исследования является дифференциальная диагностика остеопороза, его осложнений. Для получения информации о состоянии костной ткани Ю. Франке и Г. Рунге (1995) рекомендуют выполнить рентгенографию:
- грудного и поясничного отдела позвоночника (в 2 проекциях);
- черепа (в боковой проекции);
- костей таза с тазобедренными суставами;
- кистей рук (в прямой проекции).
При анализе снимков особое внимание следует обратить на наличие таких характерных признаков:
- атрофия костного рисунка (истончение кортикального слоя, подчеркнутость (контрастирование) контуров кортикального слоя, то есть феномен «рамки», редукция трабекулярных структур);
- рассасывание костных элементов в кортикальном слое трубчатых костей (спонгиозирование);
- появление гипертрофического остеопороза (Спузяк М.И., 1988);
- появление костной структуры крупнопетлистого характера как результата рассасывания и гипертрофии оставшихся трабекул);
- увеличение костномозговых пространств, расширение костномозгового канала.
Классификация остеопороза по рентгенологическим данным (Smith R.W., Rizek J., 1966) представлена в табл. 3.9. По рентгенологическим данным различают диффузный (равномерный) или неравномерный (пятнистый, мелкоочаговый) остеопороз. Выделяют 4 вида костной резорбции в трубчатых костях: субпериостальную, интракортикальную, трабекулярную, эндостальную. Трабекулярная и интракортикальная резобция характерны для постменопаузального остеопороза, гиперпаратиреоза, гипертиреоза, акромегалии, почечной остеопатии. Эндостальная наблюдается при физиологической возрастной атрофии, инволютивном, иммобилизационном остеопорозе, гиперпаратиреозе, локальной декальцинации, опухолях костей, ревматоидном артрите. Субпериостальная резорбция характерна для гиперпаратиреоза, гипертиреоза.
К рентгенологическим критериям остеопороза позвоночника относят такие признаки:
- прозрачность тел позвонков повышена, по интенсивности сравнима с мягкими тканями («пустой позвонок»);
- уменьшена толщина кортикального слоя позвонков и толщина суставных площадей позвонков;
- уменьшено количество горизонтальных трабекул, вертикальные трабекулы контрастированы;
- форма позвонков двояковогнутая, имеются «рыбьи» позвонки, плоские (равномерная компрессия);
- клиновидная деформация позвонков.
При визуальной оценке по параметрам позвонков определяют индексы клиновидности и вогнутости. К основным остеопоротическим деформациям позвонков относят двояковогнутость, клиновидную и компрессионную. При полной компрессии высота тела позвонка уменьшается на всем протяжении, при клиновидной — передней или задней (реже) части тела позвонка. У «рыбьего» позвонка верхняя, нижняя или обе поверхности имеют вогнутую форму.
Так называемый юкстаартикулярный остеопороз характеризуется просветлением в эпифизарно-метафизарных участках кости и выявляется при воспалительном поражении суставов, а также при постменопаузальном остеопорозе. Для него характерны:
- атрофия субхондральной пограничной пластинки пораженного сустава;
- истончение кортикального слоя, его спонгиозирование;
- подчеркнутость контуров кортикального слоя (феномен «рамки»);
- усиление костной структуры (визуально) эпифизов, появление в костной структуре петлевидных образований.
Рентгенологические проявления в сопоставлении с клиническими данными при нерезко выраженном, выраженном и резко выраженном остеопорозе отражены в классификации Е.П. Подрушняка (1997). Так, при нерезко выраженном остеопорозе клинические проявления отсутствуют или умеренные. Рентгенологически выявляют диффузное истончение костных балок, нарушение непрерывности трабекулярных структур в отдельных костях, в одном отделе скелета. При выраженном остеопорозе характерна ноющая, тупая боль в позвоночнике, в нижних конечностях. В трабекулярной сети появляются участки просветления, истончение и подчеркнутость кортикального слоя, расширяются костномозговые каналы, меняется форма костей, позвонков. Эти изменения обнаруживаются в одном или нескольких отделах скелета. При резко выраженном остеопорозе, кроме постоянной или периодической боли, отмечается нарушение функции отдела скелета, органа, сегмента.
При сенильном остеопорозе обнаруживают деформацию (в том числе клиновидную), снижение высоты позвонков, кисты студенистого ядра, двояковогнутую форму позвонков, увеличение грудного кифоза, изменение осанки («вдовий горб»), уменьшение роста.
Недостатком рентгенологической диагностики остеопороза является субъективизм, низкая чувствительность метода, сложность количественной оценки. Рентгенологические признаки появляются, когда уже потеряно около 2530% минерального компонента кости (Корж А.А. и соавт., 1995).
3.5.1.2. Рентгеноденситометрия
Метод не пригоден для ранней диагностики остеопении и массовых исследований.
3.5.1.3. Рентгенограмметрия
В целях объективизации изменений, установленных при рентгенологическом исследовании, определяют специальные индексы: периферический индекс Барнетта — Нордина или метакарпальный; индекс Экстона; индекс Рохлина; остеопоротический индекс (Подрушняк Е.П.); центральный индекс Барнетта — Нордина; дисковый коэффициент (Нейко Е.М. и соавт., 2001). Для полуколичественной оценки выраженности деформаций позвонков чаще всего используют систему Н.К. Genant и соавторов (1993). Поражение грудных и поясничных позвонков оценивают в соответствии с 4 степенями, также определяют индекс деформаций (от 0 до 3).
3.5.1.4. Ультразвуковая денситометрия
Механические свойства кости оцениваются с помощью ультразвукових волн. Определяют скорость распространения ультразвука в костной ткани: она зависит от плотности кости. Вычисление ослабления волны позволяет судить о плотности ткани, количестве костных трабекул, их пространственной ориентации, наличии микроповреждений (исследуют пяточную, большеберцовые кости, фаланги пальцев). Измеряется скорость прохождения ультразвуковой волны в определенных участках скелета (лучевая кость, большеберцовая кость, грудина и др.). Метод позволяет обнаружить ранние признаки разрежения костной ткани (точность метода около 5%). Результаты денситометрии выражаются показателями МНК (или ВМС — bone mineral content), МПК (или BMD — bone mineral density) — проекционной МПК. Данные костной денситометрии сопоставляют с современной классификацией остеопений и остеопороза (табл. 3.10).
При снижении костной массы на величину 1ГSD риск развития перелома повышается на 50–100%. При ультразвуковой денситометрии оцениваются такие параметры, как скорость распространения ультразвука; широкополюсное ослабление ультразвука (показатель характеризует количество, размеры, пространственную ориентацию микроархитектоники костной ткани); индекс прочности костной ткани (характеризует прочность костной ткани); Z-критерий; T-критерий.
3.5.1.5. Фотонная абсорбциометрия (однофотонная, двухфотонная)
Радиоизотопный источник (125I, 241Am) испускает узконаправленный пучок фотонов, который, проходя через кость, фиксируется детектором. При этом костная масса, МПК прямо пропорциональны числу абсорбированных костной тканью фотонов (или обратно пропорциональны числу фотонов, зафиксированных детектором). К недостаткам метода относят:
- невозможность исследования участков скелета с различной плотностью мягких тканей и разным составом;
- по мере снижения активности источника изотопов увеличивается время исследования;
- необходима периодическая замена источника радиоактивного излучения.
В Украине (в Институте кардиологии им. Н.Д. Стражеско АМН Украины, Киев, в Институте ортопедии и травматологии, Харьков) используются костные денситометры NK-364A (производства GAMMA Muvek Corp.). Источником моноэнергетического излучения в них является 125I. Результаты исследований, проведенных В.Н. Коваленко и соавторами (2001), свидетельствуют о преимуществе этого метода при скрининговых исследованиях, мониторинге состояния костной ткани у больных. Исследования проводятся в режиме сканирования участков дистальной и проксимальной частей локтевой кости (1/20 и 1/3 длины предплечья). В дистальном отделе содержится преимущественно губчатое вещество кости, в проксимальном — компактное. Исследование длится 10–30 мин.
Двухфотонная абсорбциометрия отличается наличием в радиационном пучке двух потоков фотонных излучений и имеет преимущества перед однофотонным: можно проводить отдельно исследование мягких тканей и костной ткани, измерение любого участка скелета. Возможно определение общего содержания кальция в организме.
3.5.1.6. Биоэнергетическая рентгенологическая абсорбциометрия. Количественная компьютерная томография
Трехмерный характер исследования позволяет определять объемную МП трабекулярного и кортикального вещества отдельно. Возможно проведение исследования любой части скелета (чаще исследуют позвоночник). Используется компьютерная томография с одним и двумя уровнями энергии. Метод позволяет измерить плотность кости, общее содержание минералов, получить информацию об анатомии позвоночника, оценить (дифференцированно) состояние компактного слоя, губчатого вещества. Различие в объеме мягких тканей не влияет на точность измерения МПКТ.
3.5.1.7. Антропометрический метод
На основании данных об уменьшении роста, отрицательной динамике роста можно предположить наличие остеопороза. При остеопорозе общая длина позвоночника ежегодно уменьшается на 10 мм (в норме с возрастом — на 3 мм).
3.5.1.8. Трепанобиопсия
Проводится биопсия гребня подвздошной кости с последующей оценкой морфологии биоптата. При остеопорозе характерно снижение объемной плотности губчатого вещества, разрежение трабекул, истончение трабекул и кортикального слоя, спонгизация последнего. Метод используется для проведения дифференциальной диагностики.
3.5.2. Лабораторная диагностика
Лабораторная диагностика имеет следующие цели:
- выявление причины вторичного остеопороза;
- определение активности процесса;
- проведение дифференциальной диагностики;
- оценка эффективности лечения;
- выявление групп риска по остеопорозу;
- прогнозирование риска развития остеопоротических переломов.
Лабораторная диагностика дает возможность дифференцировать патологию, сопровождающуюся остеопенией, установить причины вторичного остеопороза, дать метаболическую характеристику остеопороза (определить уровень обмена), контролировать эффективность проводимой терапии. Рутинные методы лабораторной диагностики включают определение кальция, фосфора, ЩФ в крови, суточной экскреции кальция и фосфора с мочой по отношению к креатинину, а также определение гидроксипролина в моче. Биохимические маркеры делят (Нейко Є.М. та співавт., 2001) на две группы:
1) позволяющие определить тип остеопороза, механизмы его развития;
2) отражающие процессы ремоделирования костной ткани, метаболические изменения в ней.
Определить тип остеопороза и механизмы его возникновения позволяет изучение уровня различных гормонов (эстрогенов, андрогенов, тиреоидных и ПТГ, кальцитонина) витамина D3, его метаболитов, концентрации кальция, фосфора, магния в сыворотке крови и в моче, суточной экскреции кальция и фосфора с мочой. Эти исследования дают возможность выявить характер эндокринной патологии, оценить состояние минерального обмена.
Процессы формирования костной ткани отражают такие маркеры, как остеокальцин, общая и костная фракция ЩФ, карбокси- и аминотерминальные пропептиды проколлагена I типа (PICP, PINP). Для получения информации о состоянии костной резорбции в плазме крови определяют пиридинолин, пиридинолинсодержащие пептиды, тартратрезистентную кислую фосфатазу, СТх (карбокситерминальный телопептид коллагена I типа — IСТР). С этой же целью в моче определяют пиридинолин, дезоксипиридинолин, пиридинолинсодержащие пептиды, галактозилоксилизин, оксипролин, N-терминальный телопептид (NTx), продукты распада СТх (Cross laps). Определение маркеров костного ремоделирования не позволяет установить диагноз остеопороза: кроме клинико-лабораторного обследования необходимы денситометрические, рентгенологические и морфологические данные.
3.5.2.1.Оценка состояния минерального обмена и кальцийрегулирующих гормонов
3.5.2.1.1. Кальций сыворотки крови
При первичном остеопорозе содержание кальция в сыворотке крови не меняется (табл. 3.11), при постменопаузальном — иногда отмечается тенденция к гиперкальциемии (табл. 3.12). Выраженная гиперкальциемия характерна при гиперпаратиреозе, возможна при метастазах в кости, приеме витамина D, тиазидных диуретиков, препаратов лития. Причиной гипокальциемии может быть мальабсорбция, ревматоидный артрит с высокой степенью активности, длительный прием ГК. Повышенное содержание кальция в сыворотке крови и в моче обнаруживают при постменопаузальном остеопорозе, остеопорозе, ассоциированном с ревматоидным артритом и приемом ГКС, гиперпаратиреозе, эндогенном гиперкортицизме, злокачественных новообразованиях, саркоидозе.
3.5.2.1.2. Фосфор в сыворотке крови
Уровень неорганического фосфора при первичном остеопорозе не отличается от нормы (снижение возможно при наличии остеомаляции). Его содержание (табл. 3.13) снижается при гиперпаратиреозе, остеопорозе, индуцированном ГКС, тенденция к снижению характерна у пациентов с ревматоидным артритом. Гиперфосфатемия может быть выявлена при вторичном гиперпаратиреозе, гипертиреозе, акромегалии.
3.5.2.1.3. Магний
Содержание магния в крови снижено или в норме при первичном гиперпаратиреозе. Оно повышается при ХПН, снижается при дефиците магния в пище, синдроме мальабсорбции, алкоголизме, сахарном диабете (кетоацидозе), гиперкальциемии.
Повышенное содержание магния в моче наблюдается при гиперпаратиреозе, почечной недостаточности (на стадии полиурии), почечном канальцевом ацидозе, избытке углеводов в питании, введении тиазидных диуретиков (табл. 3.14). Гипомагнийурия является результатом болезни Иценко — Кушинга, диабетического кетоацидоза, почечной недостаточности.
3.5.2.1.4. Паратиреоидный гормон
Уровень ПТГ в крови повышается при первичном и вторичном гиперпаратиреозе, остеомаляции. Часто повышение обнаруживают при сенильном и ГК-индуцированном остеопорозе (вследствие развития вторичного гиперпаратиреоза, обусловленного гипокальциемией). Постменопаузальный остеопороз сопровождается нормальным или сниженным уровнем ПГ в крови.
3.5.2.1.5. Кальцитонин
При активном костном метаболизме кальцитонин обусловливает транзиторную гипокальциемию и гипофосфатемию. Уровень в крови повышается при раке щитовидной железы.
3.5.2.1.6. Кальцитриол (1,25-(ОН)2D3)
Снижение концентрации в крови отмечается при первичном и вторичном остеопорозе.
3.5.2.2. Маркеры костного метаболизма
3.5.2.2.1. Маркеры костеобразования
3.5.2.2.1.1. Щелочная фосфатаза
Костный изофермент ЩФ является маркером активных остеобластов (они продуцируют ЩФ) и участвует в процессах минерализации. Показатель зависит от состояния дифференцировки и метаболической активности остеобластов. Окончательно биологическая роль ЩФ не установлена. Из пяти известных фракций ЩФ костная фракция является самой большой — составляет около 50%. Синтез ЩФ повышается при ускоренном костеобразовании. Костный изофермент считают наиболее адекватным показателем формирования костной ткани. Определение активности общей ЩФ у пациентов с остеопорозом не является достаточно чувствительным и специфичным тестом. Более важным является определение костного изофермента как более чувствительного и тонкого маркера костного метаболизма. При первичном остеопорозе активность ЩФ, как правило, не меняется (она повышается при сочетании остеопороза с остеомаляцией и появлении переломов костей). Повышается активность фермента в плазме крови при гиперпаратиреозе (первичном и вторичном), рахите, остеомаляции, остеосаркоме, костных метастазах, миеломной болезни, болезни Педжета, механической желтухе, билиарном циррозе печени, раке печени, метастазах в печень, гепатитах с синдромом холестаза, хроническом алкоголизме, инфекционном мононуклеозе, гранулематозе печени (саркоидоз, туберкулез), применении барбитуратов, противозачаточных средств. ЩФ отражает уровень костного метаболизма в менопаузальный период. Активность ЩФ повышается с возрастом. Она слабо коррелирует с показателями костной гистоморфометрии.
Причины повышения активности ЩФ плазмы крови (Маршалл В.Дж., 2002):
Физиологические причины:
- Беременность (последний триместр)
- Детский возраст
Патологические причины:
Часто превышение более чем в 5 раз верхней границы нормы:
- Болезнь Педжета
- Остеомаляция и рахит
- Холестаз (внутри- и внепеченочный)
- Цирроз печени
Обычно превышение менее чем в 5 раз верхней границы нормы:
- Опухоли кости (первичные и вторичные)
- Почечная остеодистрофия
- Первичный гиперпаратиреоз с вовлечением кости
- Заживающие переломы
- Остеомиелит
- Объемные поражения печени (опухоль, абсцесс)
- Инфильтративное заболевание печени
- Гепатит
- Воспалительное заболевание желудка
Наиболее точным методом определения костной фракции ЩФ является радиоиммунный и иммунноферментный методы с использованием моноклональных антител.
3.5.2.2.1.2. Остеокальцин
Этот костный Gla-белок синтезируют остеобласты (одонтобласты) и выделяют в матрикс кости. Для его синтеза необходим витамин К. В кровь поступает только часть синтезированного остеокальцина. Функции его глубоко не изучены. Остеокальцин является адекватным маркером скорости ремоделирования костей (при балансе резорбции и формирования кости), а также специфическим маркером костного формирования в случае разобщения резорбции и синтеза. Отмечается корреляция показателя с ростом скелета. Рекомендуется учитывать, что уровень сывороточного остеокальцина, определяемого методами радиоиммунного и иммуноферментного анализа с использованием антител, зависит от многих факторов (времени года, возраста, содержания в организме витаминов К и D, менструального цикла, приема алкоголя и др.). Сывороточный остеокальцин подвержен циркадному ритму, меняется в течение жизни человека, повышается в период полового созревания. Он выделяется из организма почками и может повышаться в крови при почечной недостаточности. Уровень остеокальцина в крови повышается при первичном и вторичном гиперпаратиреозе, акромегалии, болезни Педжета, миеломной болезни, то есть состояниях, для которых характерен повышенный костный метаболизм. Он снижен при ГКС-индуцированном остеопорозе, остеомаляции, почечной остеодистрофии (вследствие дефицита витамина D). Показатель остеокальцина при ревматоидном артрите повышается с возрастом, он выше у женщин, отмечается корреляция с активностью процесса и активностью ЩФ.
Определение этого показателя может быть использовано для контроля за эффективностью лечения противоостеопоротическими препаратами.
3.5.2.2.1.3. Пропептиды проколлагена I типа (PICP, PINP)
Для изучения процесса костного формирования определяют содержание циркулирующих в крови карбокси- и аминотерминальных пропептидов проколлагена I типа (применяют методы иммунноферментного и радиоиммунного анализа с использованием антител). Карбокси- (PICP) и аминотерминальные (PINP) пропептиды проколлагена I типа освобождаются при биосинтезе коллагена I типа (отщепляются от молекулы проколлагена). Гистоморфометрические исследования при остеопорозе подтверждают наличие корреляции между костеобразованием и уровнем сывороточного PICP. PICP почками не фильтруется, метаболизируется в печени. Уровень PINP в сыворотке крови коррелирует с активностью ЩФ, концентрацией остеокальцина. При первичном остеопорозе существенные изменения не отмечаются. При ускоренном костном обмене их содержание повышается, но определение остеокальцина является более надежным (Нейко Є.М. та співавт., 2001). В.В. Поворознюк и Н.В. Григорьева (2002) отмечают, что в период менопаузы содержание пропептидов проколлагена I типа в сыворотке крови повышается. Корреляции с уровнем потери костной ткани, определяемой денситометрически, не наблюдается.
3.5.2.3. Маркеры костной резорбции
3.5.2.3.1. Оксипролин, гидроксипролин
Оксипролин образуется из пролина (при участии аскорбиновой кислоты) и составляет около 13% коллагена. Освобождается в кровь при распаде коллагена (как костного, так и некостного) в виде свободных олиго- и полипептидов. Считают, что уровень выведения с мочой отражает процесс резорбции костей (распад коллагена) на 10% (Нейко Є.М. та співавт., 2001). Повышенная экскреция оксипролина характерна при повышенном костном обмене, гиперпаратиреозе, ГКС-индуцированном остеопорозе, остеомаляции, акромегалии. Для определения концентрации в моче используют колориметрический метод или жидкостную хроматографию высокого давления. Определение содержания оксипролина в моче необходимо проводить натощак после 12-часового голодания, поскольку на показатель влияет прием пищи. По мнению В.Н. Коваленко и соавторов (2001), определение экскреции оксипролина не является надежным маркером резорбции кости: при системных заболеваниях, ревматоидном артрите активизация обмена в различных тканях сопровождается повышением его уровня.
Гидроксипролин входит в состав коллагенов различного типа и освобождается при их разрушении. Так как половина коллагена в организме содержится в костной ткани, его экскреция с мочой считается маркером костной резорбции (60% гидроксипролина в моче костного происхождения). 40% экскреции гидроксипролина с мочой может составлять гидроксипролин С1q-фракции комплемента (Krane S.M. et al., 1977). Показатель имеет низкую специфичность и плохо коррелирует с костной резорбцией, оцененной по кальциевой кинетике, гистоморфометрии кости (общий гидроксипролин мочи составляет только 10% общего метаболизма коллагена). Гидроксипролин входит в состав коллагена II и III типов и может повышаться в моче при туберкулезе легких, хроническом пиелонефрите, лимфогрануломатозе, саркоидозе, а в крови — при гепатитах. Чувствительность показателя повышается при использовании для его определения жидкостной хроматографии высокого давления.
3.5.2.3.2. Гидроксилизин
Аминокислота входит в состав коллагена, протеинов. Как и гидроксипролин, не реутилизируется для биосинтеза коллагена. Существует (частично) в виде галактозил-гидроксилизина (GHYL) и глюкозил-галактозил-гидроксилизина (GGHYL), экскреция которых с мочой является более чувствительным маркером резорбции, чем гидроксипролин. Экскреция GHYL повышается с возрастом при патологии, сопровождающейся усилением костного метаболизма.
3.5.2.3.3. Галактозилоксилизин
Появляется в крови при резорбции костного матрикса в результате деградации коллагена I типа. Образуется в процессе гидроксилирования лизина с последующим его гликолизированием. Считается, что его определение является более чувствительным тестом на резорбцию, чем уровень экскреции оксипролина. Для определения используют жидкостную хроматографию с флюоресцентным анализом.
3.5.2.3.4. Общий кальций в сыворотке крови
Определение его не является специфичным, поскольку наблюдается широкое варьирование показателя, зависящее от сопутствующей патологии, диеты. Учитывая, что кальций составляет основную минеральную массу кости, его показатель используют для оценки минерализации костной ткани.
У больных РА отмечается гипокальциемия, которая усиливается по мере роста активности процесса.
3.5.2.3.5. Экскреция кальция с мочой
Определение экскреции кальция является низкочувствительным маркером костной резорбции, поскольку выявляет выраженную резорбцию кости. Содержание в утренней пробе мочи зависит от его высвобождения при резорбции и состояния реабсорбции, содержания кальция и белка в пище, выделения фосфатов (они изменяют экскрецию кальция с мочой). Для исключения влияния диеты на показатель рекомендуется определять кальций в 2-часовой моче после 12-часового голодания.
3.5.2.3.6. Кислая фосфатаза (тартратрезистентная)
Этот лизосомальный фермент присутствует в различных клетках и тканях, в том числе имеется костный изофермент, который резистентен к L(+)-тартрату. Тартратрезистентную кислую фосфатазу вырабатывают остеокласты. В кислой среде лизосомальные кислые фосфатазы гидролизируют фосфорные моноэфиры. Костная фракция кислой фосфатазы дефосфорилирует остеопонтин и костный сиалопротеин. Активность фермента (определяют спектрофотометрическим и иммунологическими методами с использованием моноклональных антител) повышается при остеопорозе, заболеваниях, сопровождающихся высоким костным метаболизмом, после удаления яичников. Маркер недостаточно специфичен (его специфичность и информативность при остеопорозе уточняется).
3.5.2.3.7. Пиридинолин и дезоксипиридинолин
Пиридиновые соединения входят в состав коллагена сухожилий, суставного хряща, костей, аорты. Они образуют перекрестные сшивки (cross-links), стабилизирующие фибриллы коллагена. Костная ткань является основным источником соединений: они освобождаются при резорбции костной ткани (в результате распада коллагена) остеокластами и выводятся почками (в печени не метаболизируются) как в свободной форме (40%), так и связанной с белками (60%). Их определение специфично и высокочувствительно и имеет преимущество перед оксипролином (не нужно придерживаться диеты перед исследованием, поскольку пиридиновые соединения, содержащиеся в желатине, не абсорбируются в кишечнике, не подвергаются метаболическим превращениям в организме, имеют в основном костное происхождение). Дезоксипиридинолин содержится только в костной ткани и дентине (незначительное количество). Определение уровня экскреции пиридиновых соединений с мочой используется для оценки ремоделирования в постменопаузальный период (применяется иммунноферментный метод с использованием моноклональных антител или жидкостная хроматография высокого давления с последующим флюоресцентным анализом). Показатели коррелируют с величиной костной резорбции, определяемой радиоизотопным методом, костной гистоморфометрией. Являются также маркерами суставной деструкции (при ревматоидном артрите отмечается корреляция с активностью воспалительного процесса). Наиболее показательно отношение концентрации пиридинолина и дезоксипиридинолина к содержанию креатинина в моче.
3.5.2.3.8. С-терминальный (СТх) и N-терминальный (NTх) фрагменты коллагена I типа
Экскреция с мочой СТх и NТх, отражая резорбцию кости, повышается в постменопаузальный период, у лиц с первичным гиперпаратиреозом, тиреотоксикозом, болезнью Педжета. Существует выраженный циркадный ритм экскреции этих фрагментов коллагена с мочой. Для исследования используют утреннюю мочу (до 9 ч), поскольку пик экскреции приходится на 25 ч. Результаты исследования мочи необходимо корректировать по уровню креатинина. Используется иммунологический метод определения СТх и NТх в сыворотке и стандартная жидкостная хроматография — в моче. Информативность данных показателей нуждается в уточнении. Предполагается, что пептидсвязанные терминальные фрагменты в почках трансформируются в свободные, а также что этот процесс обратим.
3.5.2.3.9. С-терминальный телопептид коллагена I типа (ICTP)
Представляет собой продукт распада коллагена, является компонентом С-терминального участка цепи коллагена и образуется при действии на коллаген коллагеназ, трипсина. Содержание его в крови повышается при остеопорозе (при высоком костном обороте), гиперпаратиреозе, костных метастазах. Не является маркером костного ремоделирования (отражает метаболизм коллагена). Для определения его уровня в крови применяют радиоиммунный метод. Показатель отражает костную деструкцию, коррелирует с СРП, СОЭ.
3.5.2.3.10. Сross laps
Компонент СТх коллагена I типа, который образуется из коллагена при ферментативной деградации и состоит из 8 аминокислот. Его экскреция с мочой повышается при остеопорозе, первичном гиперпаратиреозе, гипертиреозе, болезни Педжета. Компоненты распада СТх являются специфическим маркером костной резорбции. Определяют в моче твердофазным иммунноферментным методом.
3.5.2.3.11. N-терминальный телопептид (NTx)
Представляет собой N-терминальный перекрестно-связанный пептидный фрагмент коллагена I типа, который образуется при резорбции кости остеокластом. Он более специфичен и чувствительнее при диагностике остеопороза по сравнению с пиридолином. Его определение используется для оценки эффективности противоостеопорозной терапии.
Лабораторные маркеры дополняют инструментальные исследования, повышают их эффективность и качество мониторинга у больных остеопорозом. Определение биохимических маркеров дает возможность контролировать эффективность противоостеопоротической терапии, сравнивать эффективность препаратов (их комбинаций), подбирать дозы. Информативным является применение в клинической практике определение экскреции с мочой пиридинолина и содержания в крови остеокальцина (Нейко Є.М. та співавт., 2001). Первый показатель позволяет судить об остеокластической активности, второй — о состоянии костного формирования. В.Н. Коваленко и соавторы (2001) установили, что при остеопорозе на фоне ревматоидного артрита наиболее чувствительными маркерами костеобразования являются сывороточный остеокальцин и костный изофермент ЩФ. Наиболее чувствительными маркерами костной резорбции является экскреция с мочой пиридинолиновых соединений и терминальных фрагментов коллагена I типа, определяемая методом иммунноанализа, жидкостной хроматографии под высоким давлением. Повышенный костный метаболизм ассоциируется с высокой скоростью потери костной массы, а повышенные уровни маркеров костной резорбции — с повышенным риском переломов.