1.1. Строение и морфология костной ткани, структурно-функциональная организация кости
Кости представляют собой чрезвычайно плотную специализированную форму соединительной ткани. Клетки соединительной ткани, включающие фибробласты, клетки хрящевой и костной ткани, специализируются на секреции фибриллярных белков (прежде всего коллагенов), которые используются для строительства межклеточного вещества. Межклеточный матрикс — это сложное вещество, которое находится в интерстициальном внутритканевом пространстве (между клетками). В соединительной, хрящевой и костной ткани межклеточный матрикс занимает значительный объем и выполняет основные функции.
1.1.1. Формирование кости
Клетки мезенхимального происхождения — фибробласты, остеобласты — синтезируют и выделяют фибриллы коллагена, которые находятся в матриксе, содержащем также протеогликаны и гликозаминогликаны (Уайт А. и соавт., 1981а). Минеральные компоненты поступают из окружающей жидкой фазы, образование кристаллической решетки индуцируется нуклеацией (активирует образование кристаллов трехцепочечный коллаген). Формирование кости начинается между фибриллами коллагена, где выстраиваются апатитовые структуры (происходит биоминерализация). Кристаллы становятся центрами нуклеации для отложения гидроксиапатита и коллаген индуцирует отложение кальция. Протеогликаны повышают растяжимость коллагеновой сети, увеличивают набухание. Формирование кости происходит вблизи остеобластов. В зоне кальцификации отмечают деградацию комплексов белок — полисахарид. Растущие кристаллы вытесняют протеогликаны и воду (сформировавшаяся кость обезвожена). 20% массы кости и 40% объема составляет коллаген. В структуре вещества кости имеются выстланные клетками гаверсовы каналы, проводящие кровеносные сосуды. Кость является динамичным депо кальция, при этом постоянство структуры кости обеспечивает активность остеобластов и остеокластов. Большая поверхность контакта кристаллов минеральных компонентов костной ткани с межклеточной жидкостью обеспечивает быстрое поступление в состав кости различных катионов. Кристаллы представляют собой гидроксиапатиты или карбонатапатиты, которые являются наиболее важной минеральной составляющей костной ткани и состав которых отражают формулы Са10(РО4)6(ОН)2 и Са10(РО4)6СО3. В костях имеются карбонаты других щелочноземельных химических элементов. Апатит представляет собой крупный комплексный катион Са[Са3(РО4)2]32+, который окружен противоионами ОН-, СО32-, НРО42-, F-. Кристаллы имеют форму пластинок или палочек толщиной около 815 °А, шириной — 20–40, длиной — 200–400. В кристаллической решетке гидроксиапатита кальций может замещаться другими двухвалентными катионами. Анионы адсорбируются на поверхности, которую образуют малые кристаллы, или растворяются в гидратной оболочке кристаллической решетки. С кристаллами гидроксиапатита прочно связан белок (49 аминокислотных остатков), содержащий три остатка γ-карбоксиглутаминовой кислоты. Этот белок участвует в регуляции связывания кальция в костях и зубах.
1.1.2. Анатомия и структура костей
Анатомически кости делят на плоские и длинные. К плоским относятся кости черепа, нижняя челюсть, лопатки, кости таза, к длинным — плечевые, кости предплечья, бедренные, кости голени. В длинных костях различают эпифизы (два широких конца), диафизы (цилиндрическую среднюю часть) и метафизы (места перехода диафиза в эпифизы). Между метафизами и эпифизами имеются так называемые ростовые площадки, представленные слоем эпифизарного хряща. Наружный (корковый) слой кости весьма тонкий, плотный и представляет собой кальцифицированную ткань, которая еще больше истончается в направлении метафизов и диафизов. Корковый слой выстилает также внутреннюю медуллярную полость в диафизах, содержащую костный мозг (таким образом, в трубчатой кости имеется периост и эндост). Внутренняя часть (губчатая, трабекулярная) кости заполнена кальцифицированными трабекулами. Костный мозг находится не только в медуллярной полости, но и в перитрабекулярных пространствах. Кортикальная и трабекулярные части различаются функционально и структурно, хотя состоят из одних и тех же клеток и матрикса. Кортикальная кость выполняет защитную и механическую функции, трабекулярная — метаболическую. Кортикальная часть кальцифицирована на 80–90%, трабекулярная — на 15–20%. 80% объема скелета составляет кортикальная кость (в основном плоские кости и диафизы трубчатых костей). Тела позвонков, кости таза, дистальные отделы бедренных костей в основном состоят из трабекулярной ткани. Костный мозг, сосуды, соединительная ткань составляют остальную часть кости.
Кость состоит из клеточных элементов, межклеточного матрикса, минеральных компонентов, тесно связанных друг с другом. Известны два вида костной ткани — грубоволокнистая (незрелая) и пластинчатая (зрелая). Грубоволокнистая (ретикулофиброзная костная ткань) у взрослых находится в зонах роста, в местах прикрепления сухожилий к костям, в зубных альвеолах, костном лабиринте внутреннего уха, в участках зарастания черепных швов (Дедух Н.В., 2002а). Она также образуется при воспалительных, неопластических процессах, метаболических нарушениях, в процессе лечения, стимулирующего костеобразование. Для ее структуры характерно наличие неупорядоченных коллагеновых пучков, большого количества протеогликанов, гликопротеидов и, наоборот, низкое содержание минеральных солей. Пластинчатая костная ткань является результатом дальнейшего развития грубоволокнистой — насыщения минералами, упорядочения структуры, повышения прочности. Основной структурно-функциональной единицей пластинчатой костной ткани является остеон, состоящий из слоя остеобластов, остеоцитов, системы связанных между собою костных пластинок, окружающих центральный канал, в котором располагаются кровеносные и лимфатические сосуды, нервы. Время образования остеона у взрослого человека составляет около 79 дней. Остеон является динамической структурой: при повышении нагрузки возрастает количество пластинок, уменьшается просвет канала, при снижении нагрузки наблюдается обратный процесс. Эти данные свидетельствуют, в какой мере важна физическая нагрузка для состояния костной ткани. Различают три группы остеонов: растущих, зрелых, резорбционных. Их превращения (перестройка) продолжаются на протяжении всей жизни человека. Количество и размеры остеонов с возрастом уменьшаются. Между остеонами располагается ткань, которая носит название «вставочной костной пластинки».
Клеточные элементы кости представлены остеобластами, остеоцитами, остеокластами. Они составляют 2% костной ткани (табл. 1.1). Происхождение костных клеток окончательно не установлено: предполагают, что из мезенхимальных стволовых клеток сначала дифференцируются преостеобласты, затем остеобласты, остеоциты. Из моноцитов (представляющих гемопоэтическую стволовую линию) дифференцируются преостеокласты, остеокласты.
Остеобласты располагаются на поверхности кости и формируют ее. Они представляют собой полигональные клетки среднего размера (15–40 мкм) с развитым комплексом Гольджи, эндоплазматической сетью, значительным количеством рибосом, полисом, высоким содержанием актина. Гистохимическим маркером остеобластов является щелочная фосфатаза (ЩФ), биохимическим — остеокальцин. Различают незрелые и зрелые, активные и неактивные (покоящиеся) остеобласты. Активные остеобласты (крупные кубические или цилиндрические клетки с тонкими отростками) выделяют ЩФ, синтезируют белки, формируют остеоид. С учетом особенностей их функционирования различают три типа остеобластов. Остеобласты выделяют матриксные пузырьки (содержат кальций, фосфатазы), кальцифицирующие остеоид, замуровывающие клетку. Остеобласты могут переходить в состояние покоя или в остеоциты. Основной функцией остеобластов является белковый синтез, формирование коллагеновой сети, продукция компонентов органического матрикса, матриксных пузырьков, цитокинов, факторов роста (ФР). Эти клетки синтезируют также коллагеназы, гликопротеины, остеонектин, остеокальцин, костный сиалопротеин, остеопонтин, активатор плазминогена и др. Новообразованная ткань, состоящая из синтезированных остеобластами коллагеновых волокон и протеогликанов, в дальнейшем подвергается минерализации (отложение кристаллов гидроксиапатита). Минерализация кости осуществляется в результате синтеза продуктов матрикса и выработки матриксных везикул. Под влиянием паратиреоидного гормона (ПТГ), цитокинов остеобласты высвобождают факторы, которые активируют остеокласты. Остеобласты (остеоциты) могут осуществлять резорбцию межклеточного вещества с формированием лакун, пазух резорбции. Они влияют на дифференцировку остеокластов из клеток-предшественников. Неактивные остеобласты принимают участие в обмене веществ в костной ткани (Aaron J.E., 1976). 28% поверхности кости занимают активные остеобласты, 80–92% — неактивные (они расположены в основном около синуса костномозгового канала). Остеобластные клетки несут на себе рецепторы и продуцируют факторы, которые регулируют костное ремоделирование. В остеобластных клетках имеются рецепторы к ПТГ, ПТГ-связанным белкам, 1,25-дигидроксихолекальциферолу (кальцитриолу) — 1,25-(ОН)2D3, ГК, эстрогенам, андрогенам, прогестинам, тиреоидным гормонам, ретиноидам (витамину А), простагландинам (ПГ)Е, ПГF2б , инсулиноподобному фактору роста (ИПФР)-1 и -2, инсулину, фактору роста фибробластов (ФРФ), трансформирующему фактору роста (ТФР)-β, костному морфогенетическому белку (КМГБ), эпидермальному фактору роста (ЭФР), тромбоцитарному фактору роста (ТрФР)-А и -В, интерлейкинам (ИЛ)-1, -3, -4, -6, -8, -11, фактору некроза опухоли (ФНО)-α, фактору, ингибирующему лейкоз (ФИЛ), эндотелину. На функцию остеобластов влияют ИПФР, ТФР и ТрФР, а также ФРФ, ПГ. На нагрузку остеобласты отвечают усиленной работой. Отсутствие физической нагрузки, уменьшение массы тела обусловливают снижение костного формирования. Механический сигнал возникает в матриксе, передается клеткам, трансформируется в биохимические сигналы. В приеме и преобразовании механических стимулов участвуют погруженные внутрь кости остеоциты. Кроме механических стимулов костное формирование регулируют системные и локальные факторы (половые гормоны, ГК, анаболические стероиды, 1,25-(ОН)2D3, ПТГ, ИЛ-1, ПГЕ и др.).
Остеоциты происходят из остеобластов: наработанные ими ткани (коллаген, протеогликаны) минерализуются в направлении остеобласта и он замуровывается, кальцифицируется. Они располагаются в остеоцитарных лакунах, заполненных коллагеновыми фибриллами. В зависимости от функциональной активности остеоцитов выделяют 5 типов лакун. Клеточные лакуны соединяются с канальцами и образуют так называемую лакунарно-канальцевую систему. Жидкость, содержащаяся в лакунарно-канальцевой системе, по составу отличается от плазмы крови. В периостеоцитарных пространствах (между цитоплазматическими мембранами и матриксом) содержатся интерстициальная жидкость, ионы кальция (более низкая по сравнению с плазмой крови концентрация ионов кальция обеспечивает его приток). У лиц зрелого возраста остеоциты составляют 90% остеогенных клеток скелета. Метаболически остеоциты не активны. С помощью длинных отростков они контактируют друг с другом, образуя сеть канальцев в костном матриксе, позволяющую осуществлять внутри- и внеклеточный транспорт минералов, питательных субстратов (Aaron J.E., 1976). Различают каналы (центральные, прободеющие, соединительные), содержащие сосуды.
Основной функцией остеокластов, контактирующих с кальцифицированными поверхностями, является рассасывание (резорбция) костной ткани. Эти большие (гигантские) многоядерные куполообразной формы клетки продолжительностью жизни от 2 до 20 дней выделяют лизосомальные ферменты (в том числе кислую фосфатазу), которые позволяют им выполнять основную функцию. Они берут начало от гемопоэтических гранулоцитарно-макрофагальных колониеобразующих единиц — предшественников моноцитов/макрофагов. Участие в резорбции кости принимают и преостеокласты (одноядерные клетки). Из факторов, влияющих на формирование остеокластов, отмечают (Дедух В.Н., 2002б) ИЛ, 1,25-(ОН)2D3, ФНО (остеопротегерин подавляет остеокластогенез). Резорбция модулируется за счет усиления пролиферации клеток остеокластической линии и повышения активности зрелых остеокластов. В разрушении кости принимают участие лактат, Н+-ионы, которые образуются из Н2СО3 вследствие действия карбоангидразы при участии аденозинтрифосфатазы (АТФазы) (остеокластного Н+-насоса), протеолитические ферменты. Снижение активности карбоангидразы и Н+-АТФазы сопровождается ингибированием костной резорбции. К резорбируемой поверхности принадлежит так называемая резорбируемая каемка. В этом месте образуется остеокластическая лакуна резорбции. На цитоплазматической мембране имеются рецепторы к кальцитонину, эффекты действия которого опосредуются через циклический аденозинмонофосфат (цАМФ). Функциональную активность остеокластов регулируют остеобласты, системные (ПТГ, кальцитонин, 1,25-(ОН)2D3) и локальные факторы.
Кальцитонин ингибирует пролиферацию и дифференцировку предшественников остеокластов. Одним из механизмов действия эстрогенов и тестостерона, подавляющих резорбцию, является снижение продукции ИЛ-6. ПТГ, 1,25-(ОН)2D3 стимулируют дифференцировку предшественников, а также усиливают резорбционную активность остеокластов. Из локальных факторов резорбцию костной ткани усиливают:
- ИЛ-1, -3, -6, -11;
- ФНО-α, -β;
- макрофагальный колониестимулирующий фактор (М-КСФ);
- гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ);
- фактор стволовых клеток;
- ПГ.
Угнетают резорбцию костной ткани интерферон (ИФН)-γ; TФР-β; ИЛ-4, -13. Цитокины могут продуцироваться клетками остеобластической линии, что свидетельствует о функциональной связи между этими двумя типами клеток.
Вследствие генетического нарушения функции остеокластов возникает «остеосклероз», или «мраморная болезнь костей». Остеосклероз развивается у пациентов с дефектом гена, кодирующего карбоангидразу II, что обусловливает дефицит этого фермента. У пациентов с данной патологией остеокласты не могут полностью резорбировать костную ткань, кости обызвествляются. Рентгенография обнаруживает генерализованный остеосклероз, сужение костномозговых пространств, панцитопению. В раннем детском возрасте развивается злокачественная форма заболевания, за короткое время приводящая к смерти больных. В случае доброкачественного течения больные доживают до зрелого возраста. При злокачественной форме у детей применяется пересадка костного мозга, который содержит нормальные остеокласты.
1.1.3. Матрикс костной ткани
Как отмечено выше, значительную часть костной ткани составляет межклеточный матрикс (межклеточное вещество — 98%), который выполняет основные функции (см. табл. 1.1). Его условно делят на органический и минеральный. Неорганические минеральные компоненты кости составляют 70%, остальная часть представлена органическим матриксом (20%) и водой (10%). В состав органического матрикса кости входят белки и липиды. Основу органического матрикса (95%) составляют коллагены.
В организме человека коллаген является преобладающим в количественном отношении белком: он составляет 25% общего белка (Кольман А., Рем К. ., 2000). Имеет необычный аминокислотный состав: 1/3 составляет глицин, около 10% — пролин, а также гидроксипролин, гидроксилизин. Длина всей молекулы коллагена — около 300 нм. Коллаген I типа составляет 90%, III, IV, V, XI, XII типов — 5%. Таким образом, прочность костей к нагрузкам и растяжению обеспечивает коллаген I типа, вокруг волокон которого происходит минерализация. Молекула коллагена состоит из трех полипептидных цепей разных типов (α-спиралей), скрученных в виде правой тройной спирали (Кольман Я., Рем К., 2000). Полипептидные цепи построены из часто повторяющихся фрагментов, имеющих характерную последовательность -Gly-X-Y-. Каждым третьим аминокислотным остатком является глицин. В положениях Х часто выявляется пролин, положение Y может быть занято как пролином, так и 4-гидроксипролином. Молекула коллагена также содержит остатки 3-гидроксипролина и 5-гидроксилизина. Характерной особенностью коллагена является наличие в полипептидной цепи остатков гидроксиаминокислот. Остатки пролина и лизина гидроксилируются после включения в полипептидную цепь (посттрансляционно). Гидроксилирование остатков пролина и лизина в молекуле проколлагена катализируется проколлаген-гидроксилазами, содержащими в активном центре атомы железа. В качестве кофермента служит аскорбиновая кислота. Один из концов молекулы коллагена сшит поперечными связями (сшивками), образованными боковыми цепями остатков лизина. По мере старения организма количество поперечных связей увеличивается. В зависимости от характера сочетания полипептидных α-цепей выделяют 12 типов коллагена. Коллаген I типа имеет длинную нитевидную молекулу с молекулярной массой 285 кДа. Молекулы коллагенов способны к спонтанной агрегации с образованием более сложных структур — микрофибрилл, фибрилл, сеток, связок. Фибриллы имеют цилиндрическую форму и диаметр от 20 до 500 нм. Составные компоненты межклеточного матрикса связывают адгезивные белки: ламинин, фибронектин, эластин. Адгезивные белки, взаимодействуя с клеточными рецепторами (интегринами), фиксируют клетки в межклеточном пространстве. Особенности строения фибронектинов обеспечивают им свойства «молекулярного клея», поскольку субъединицы фибронектина, подразделяющиеся на различные домены, способны связываться с клеточными рецепторами, коллагенами, фибрином и протеогликанами.
В межклеточном веществе содержатся органические кислоты, которые образуют комплексы с кальцием. 5% межклеточного вещества составляют неколлагеновые белки (остеокальцин, остеонектин, костные сиалопротеины, фосфопротеины, морфогенетический белок (МГБ), протеолипиды, гликопротеины, протеогликаны). Протеогликаны выполняют функцию наполнителя и составляют основное вещество межклеточного матрикса. Это крупные молекулы (более 2·106 Да) с белковой (5%) и углеводной (95%) составляющими (Кольман Я., Рем К. ., 2000). Белковые мономеры, несущие большое количество полисахаридных цепей, ассоциированы с осевой молекулой гиалуроновой кислоты. Полисахариды, обнаруженные в протеогликанах, относятся к гликозаминогликанам. Основной структурной единицей различных гликозаминогликанов является дисахаридное звено, состоящее из уроновой кислоты (глюкуроновой, идуроновой, галактуроновой) и N-ацетилгексозамина. От неколлагеновых белков зависит минерализация, формирование кости, синтез коллагена. От них зависят такие процессы, как межклеточные взаимодействия (фибронектин, сиалопротеин, остеопонтин, тромбоспондин), ремоделирование костной ткани (остеокальцин), минерализация (фосфопротеины, протеолипиды, остеонектин). 10% неколлагеновых белков составляют протеогликаны, которые влияют на формирование фибрилл коллагена, их связь с кристаллической фазой и выполняют роль медиаторов к ФР. Комплекс «коллаген — протеогликаны — кристаллы» обеспечивает механические качества костной ткани. К гликопротеинам кости относят ЩФ, остеонектин, тромбоспондин, фибронектин, витронектин, остеопонтин, костный сиалопротеин. Они создают условия для осуществления процессов минерализации, пролиферации клеток, их адгезии, др. В составе органического матрикса обнаруживают S и Gla-белки, цитокины (ИПФР-1 и -2, ТрФР, колониестимулирующий фактор роста). Неколлагеновые матриксные белки неравномерно располагаются в матриксе (их расположение изучено недостаточно). Остеопонтин находится во вновь синтезированной минерализованной костной ткани вблизи остеобластов, в зоне остеоцитарных лакун, в зоне клеточно-остеоидных контактов (Hultenby К. et al., 1991). ИПФР-1 и -2, ТФР 1-β, основной ФРФ размещаются совместно (Slater М. et al., 1994). Сиалопротеин находится внутри межфибриллярных отверстий и регулирует начало кальцификации (Fujisawa R. et al., 1995). Коллагеновые волокна костного матрикса ориентированы в одном направлении. Нити коллагена окружены кристаллами (пластинчатыми, веретенообразными), ориентированными в идентичном с волокнами направлении. Все вместе они создают пластинчатое строение кости. Пластинки располагаются параллельно или концентрически в зависимости от характера поверхности кости, наличия каналов. В кальцификации, фиксации кристаллов гидроксиапатита важную роль играет основное вещество, состоящее из гликопротеинов и протеогликанов. Протеогликаны выполняют функцию наполнителя — основного вещества. Они связывают катионы и основную часть воды благодаря полярной природе и сильному отрицательному заряду. В матриксе имеются остеокальцин (γ-карбоксилированные белки), протеины, содержащие остеопонтин, фибронектин (Gideon A., 1992; Martin T.J., Demрster D.W., 1998). Остеокальцин представлен 50 аминокислотными остатками (3 из них связывают кальций) и составляет 15% неколлагеновых белков. Он секретируется остеобластами и участвует в минерализации костной ткани. Секреция его регулируется активным метаболитом витамина D — кальцитриолом (1,25-(OH)2D3). Концентрация остеокальцина в крови является биохимическим маркером костного обмена.
Остеоциты и остеобласты взаимодействуют (через интегриновые и другие рецепторы) с коллагенами I и II типа, коллагеновыми волокнами, остеопонтином, остеонектином, фибронектином, фибриногеном, тромбоспондином, ламином (Aarden Е. et al., 1996).
Выделяют (Аврунин А.С. и соавт., 1998) быстрые и медленные изменения ультраструктуры органического матрикса. Первые обусловлены внешними факторами — физическими и нейрогуморальными нагрузками, заболеваниями, экстремальными факторами. К медленным изменениям относят метаболические изменения, происходящие в процессе естественного старения (рассматриваются как результат суммарного влияния внешних условий в течение жизни).
Среди минеральных соединений в неорганическом матриксе преобладают фосфаты кальция (95% из них составляет гидроксиапатит, перестройка которого происходит постоянно). В состав неорганического матрикса входят апатиты, магний, фториды, натрий, калий, хлориды, микроэлементы (около 30, в том числе медь, свинец, радий, стронций, барий), аморфный фосфат кальция, СаСО3, Mg3(РО4)2 и др. Минеральный матрикс содержит около 98% всех неорганических веществ организма (99% кальция, 87% фосфора, 58% магния, 46% натрия, 20% микроэлементов) (Проханчуков А.А. и соавт., 1984). Основными компонентами минерального матрикса являются кристаллический гидроксиапатит Са10(РО4)(ОН)2 и аморфный фосфат кальция Са3(РО4)2. Считают, что кристаллические структуры являются апатитом, так как не содержат свободные ОН-группы. Ядра кристаллизации, представляющие собой слой фосфата кальция, располагаются между фибриллами коллагена и постепенно увеличиваются, заполняя межфибриллярные промежутки (Fratzl P. et al., 1991). Структура кристаллов зависит от условий кристаллизации. Предполагают, что предшественниками при формировании апатита в патологических условиях (при кислом рН) являются дикальций гидрофосфат и октакальций фосфат. Наименее растворимый гидроксиапатит формируется в нейтральной и основной среде (Johnsson M., Nancollas G., 1992). Аморфный фосфат кальция преобразуется в апатит, соотношение в нем кальция/фосфора относительно постоянно — 1,5. Продольная ось кристаллов параллельна оси фибрилл. Стереохимическое соотношение кальция/фосфора в апатите составляет от 1,37 до 1,67. До 50% минеральных солей находится в аморфной фазе. В кристаллической решетке гидроксиапатита Са2+ может замещаться другими двухвалентными катионами, тогда как анионы, отличные от фосфата и гидроксила, либо адсорбируются на поверхности кристаллов, либо растворяются в гидратной оболочке кристаллической решетки. Особенностью костного матрикса является высокая концентрация цитрата: около 90% его общего количества в организме содержится в костной ткани. Он необходим для минерализации костной ткани, образует комплексные соединения с солями кальция и фосфора. Между обменом кальция и лимонной кислоты существует тесная зависимость. Наряду с довольно прочно связанным кальцием в форме гидроксиапатита, кости содержат поддающийся быстрому использованию запас кальция (около 100 г) в форме цитратов и карбонатов. В клетках костной ткани процесс расщепления глюкозы может переключаться на образование цитрата. Витамин D, очевидно, тормозит окисление лимонной кислоты. Кроме цитрата, в костной ткани обнаруживают сукцинат, фумарат, малат, лактат и другие остатки или соли органических кислот. Костный матрикс содержит липиды (Березов Т.Т., Коровкин Б.Ф., 1990), которые представляют собой непосредственный компонент костной ткани, участвуют в процессе минерализации, а не являются примесью в результате недостаточно полного удаления богатого липидами костного мозга (табл. 1.2). При остеопорозе размеры и свойства кристаллов гидроксиапатита меняются (Подрушняк Е.П., 1997).
При резорбции кости (как в физиологических, так и патологических условиях) отмечают одновременное «рассасывание» как минеральных, так и органических структур костной ткани (Березов Т.Т., Коровкин Б.Ф., 1990). В выведении минеральных солей из кости определенную роль играют органические кислоты и их остатки, в том числе лактат. Изменение рН в кислую сторону обусловливает растворение и удаление минералов. В резорбции органического матрикса участвуют лизосомные кислые гидролазы. Резорбция коллагеновых волокон происходит после предварительного воздействия коллагенолитических ферментов.
За 1 год в среднем обновляется около 8% костной ткани, в том числе 11% кортикального слоя трубчатых костей, до 44% — ребер. Как отмечают А.С. Аврунин и соавторы (1998), величина показателей костного метаболизма изменяется с недельной периодичностью. Средние значения показателей амплитуды колебаний содержания фосфатов минерального матрикса в кортикальном слое диафиза длинных костей составляют 2%, скорости их обмена между кровью и минеральным матриксом — 1%, толщины кортикального слоя на рентгенограмме — 5%, его оптической плотности — 19%. Авторы пришли к выводу, что только значительные физические и нейрогуморальные воздействия обусловливают клинически выявляемые изменения в стабильной макроструктуре костного матрикса.
1.1.4. Структурно-функциональные особенности кости
Структурно-функциональной единицей губчатой костной ткани является подверженная нейрогуморальной регуляции костная трабекула, основным формообразующим фактором которой является вектор нагрузки. Являясь динамической системой, костная ткань постоянно подвергается ремоделированию, основу которого составляют резорбция и костеобразование: в нормальных условиях протекают взаимосвязанные процессы — остеокластическая резорбция и остеоцитарный остеолиз с формированием новой костной ткани на участках резорбции. В процессе ремоделирования у взрослого человека ежегодно обновляется от 2 до 10% костной массы (Canalis E., 1993) при сохранении исходных внешних параметров кости (они изменяются у растущих костей). Костная ткань человека практически полностью перестраивается каждые 10 лет. Более низким является темп формирования кости (по сравнению с резорбцией). Интенсивность обменных процессов более значительна в трабекулярной кости. Нарушение процессов ремоделирования наблюдается при остеопении, остеопорозе. Различают единицы ремоделирования:
- базисную многоклеточную единицу (БМЕ);
- костную ремоделирующую единицу (КРЕ);
- костную структурную единицу (КСЕ).
К БМЕ относится комплекс клеток, участвующих в резорбции (локальной) и формировании кости. С возрастом число новых БМЕ уменьшается, а время, необходимое для их формирования, увеличивается. В результате снижается интенсивность ремоделирования, нарушается костно-минеральный баланс. Под КРЕ понимают участок костной ткани, в котором протекает резорбция и образование кости. КСЕ отражает суммарную активность ремоделирования. В компактной кости КСЕ является формированием вторичных остеонов гаверсовой системы, в губчатой — поверхность в 40–60 мкм с площадью 0,51 мм2. Время, необходимое для резорбции и восстановления комплекса КСЕ, составляет 35 мес (Ревел П.А., 1993; Kanis J.A., 1994): резорбция происходит в течение 30 дней, замещение новой тканью — 90 дней. Более длительный (40–50 дней) период резорбции в губчатой кости. В среднем возрасте скорость обновления скелета составляет 8% костной массы в год, при этом она более значительна (20%) в губчатом веществе (в компактной ткани — 4%). В.Дж. Маршалл (2002) отмечает, что процесс ремоделирования в любой момент охватывает около 5% скелета. Ремоделирование координируется гормонами, ФР и цитокинами. Всего в костной системе имеется около 35 млн КСЕ. Ремоделирование губчатой ткани протекает в несколько последовательных стадий:
- активирование остеокластов;
- формирование локуса резорбции;
- образование остеоида;
- минерализация остеоида.
Ремоделирование компактной кости — это синхронный процесс резорбции внутренней поверхности костного канала (ремоделирование происходит в сосудистых каналах) и формирования остеобластами остеоида, подвергающегося в дальнейшем минерализации. Ремоделирование определяется количеством активных клеток, балансом ремоделирования в единице ремоделирования (баланс ремоделирования — это отношение количества резорбированной и сформированной ткани кости). У практически здоровых людей в молодом возрасте соотношение резорбированной ткани равно количеству вновь сформированной. При преобладании резорбции уменьшается масса костной ткани, нарушается структура, уменьшается количество и толщина пластинок, увеличиваются полости. Нарушение ремоделирования с преобладанием резорбции — причина остеопороза. Резорбцию костной ткани осуществляют не только остеокласты, но и остеоциты (остеоцитарное моделирование осуществляется в прелакунарной области и недостаточно изучено). Механизмы минерализации пластинчатой кости и грубоволокнистой ткани различаются. В процессах минерализации хрящевой и грубоволокнистой ткани важную роль играют матриксные пузырьки (везикулы), выделяемые остеобластами и поставляющие в матрикс кристаллы гидроксиапатита. В первом случае минеральные вещества откладываются внутри и между фибриллами коллагена.
Гомеостаз кости зависит от механического напряжения: при его действии соблюдается сбалансированность процессов резорбции и формирования костной ткани (трабекулы, которые не подвержены механическому напряжению, рассасываются). В костях скелета, которые несут наибольшую нагрузку, наблюдаются явления гипертрофии, утолщение кости, происходящее за счет повышения содержания костного белка, минеральных элементов. Предполагают, что формообразование костей является результатом интеграции всей совокупности внешних механических воздействий с помощью ремоделирования костной ткани (Оганов В.С., 1997). Решающими для возникновения адаптивных процессов в кости являются деформации костного материала. Механические воздействия обусловливают изменения на тканевом и клеточном уровне. Недостаток механической стимуляции сопровождается торможением активации, дифференциации, пролиферации остеобластов, потерей костной массы в эндосте и трабекулярной кости, увеличением интракортикальной порозности. Остеопороз, возникающий в результате недостатка механической стимуляции, может быть локальным, региональным, генерализованным. Для прочности кости имеет значение потеря костной массы, архитектоника и структура кости, состав органического матрикса, порозность, ориентация коллагеновых волокон, характер связи коллаген — кристалл и другие факторы.
1.1.5. Структурно-функциональные особенности зубов
Заполненная пульпой полость зуба окружена кальцифицированной плотной тканью — дентином (содержит 75% минералов). В пульпе находятся кровеносные сосуды, нервные окончания. Дентин покрыт эмалью, корни зуба — цементом. 98% эмали составляют минералы (табл. 1.3).
Органический матрикс дентина и цемента идентичны матриксу кости. При формировании эмаль содержит много белка (пролин, оксилизин), в дальнейшем его количество становится минимальным в результате обызвествления. Кристаллы гидроксиапатита более крупные, чем в дентине, цементе, костях. По сравнению с дентином эмаль содержит меньше неорганических ионов. Процесс обновления фосфора в дентине значительно (в 6 раз) медленнее, чем в длинных костях, и быстрее (в 15–20 раз), чем в эмали (Уайт А. и соавт., 1981б). Медленный обмен минералов в зубах, по мнению авторов, обеспечивает их стабильность в условиях возможной декальцификации у беременных, а также при дефиците витамина D. Состояние зубов зависит от поступления в них фтора. При избытке фтора в питьевой воде (1,5 мг/мл и более) в период формирования зубов на них появляются тусклые, меловые пятна, углубления желтого и коричневого цвета. Развивается обызвествление зубов, теряется цементирующее вещество. При содержании в питьевой воде 0,9–1,0 мг/л фтора редко развивается кариес, что послужило основой его профилактического применения. По мнению А. Уайта и соавторов (1981б), после окончания формирования зубов фтор не влияет на возникновение кариеса.
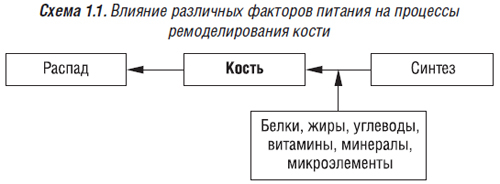
1.2. Метаболизм костной ткани и его зависимость от характера питания
Для состояния костного метаболизма у человека в любом возрасте чрезвычайное значение имеет питание, являющееся лечебно-профилактическим фактором.
Существует тесная взаимосвязь между питанием и состоянием костной ткани (Поворознюк В.В., Григорьева Н.В., 2002а; Поворознюк В.В. и соавт., 2002б).
1.2.1. Роль белков, жиров, углеводов
Важное значение имеет адекватное (суточной потребности) содержание в рационе белков — структурного элемента кости. Белки интенсивно используются в качестве строительного материала при формировании органического матрикса. При поступлении необходимого количества белков в организм повышается уровень продукции ИПФР-1. Недостаточное поступление в организм белков (особенно животного происхождения), равно как и их избыток, негативно сказывается на состоянии костной ткани: при их дефиците ухудшается образование кости, происходит консолидация переломов, снижается минеральная плотность костной ткани (МПКТ), возникают переломы шейки бедра (у лиц пожилого возраста), а при избытке белков развивается остеопороз. Из белков растительного происхождения специалисты отдают предпочтение сое. Адекватное потребление белков уменьшает потерю костной массы, снижает частоту возникновения переломов. Белки оказывают регулирующее влияние на обмен кальция, который осуществляется на уровне почек. Имеется прямая зависимость между потреблением белков животного происхождения и экскрецией кальция, между экскрецией кальция, с одной стороны, мочевины и сульфатов — с другой. Избыточное потребление белков сопровождается (особенно у лиц пожилого возраста) увеличением экскреции кальция, клубочковой фильтрации. При недостаточном потреблении белков снижается уровень абсорбции кальция в почках и кишечнике и, наоборот, при избыточном — повышается, что связывают со вторичным гиперпаратиреозом, индуцированным протеинами. Потеря костной массы при избыточном белковом питании (особенно богатом витамином С, сульфатными группами) обусловлена кислотной стимуляцией остеокластами костной резорбции (Burckhardt R., 1998), повышенной экскрецией кальция в результате увеличенного выделения мочевины, взаимосвязью между экскрецией кальция и фосфатов. Кислотная нагрузка усиливает кальциурию, повышает скорость клубочковой фильтрации. При поступлении в организм 50 г избыточного белка с мочой выводится 60 мг кальция, его баланс в организме становится отрицательным. Оптимальное количество потребления белка составляет приблизительно 1,5 г/кг массы тела в сутки, а при тяжелой работе — 22,5 г при условии, что за счет углеводов и жиров обеспечивается 85–90% необходимой энергии. В смешанную диету, содержащую 110–120 г белков, 40–60 г жиров и 600–700 г углеводов, должно входить не менее 50% животных белков. В настоящее время некоторые авторы считают достаточным для взрослого человека потребление белка 0,60 г/кг массы тела в сутки. Не все исследователи считают, что употребление большого количества белка негативно влияет на скелет. Так, в эксперименте на животных (крысах) установлено, что потребление пищи с высоким содержанием белка на протяжении 9 мес не оказывает влияния на содержание кальция в бедренной, большеберцовой костях, нижней челюсти (Whiting S.J. et al., 1981). В исследовании с участием японских мужчин K. Yano и соавторы (1985) не выявили корреляции между потреблением белка и костной массой. Недостаточное питание у пациентов пожилого возраста с переломами в анамнезе замедляет процессы консолидации. И, наоборот, дополнительное потребление 20 г белка уменьшает период госпитализации, количество осложнений, снижает уровень смертности (Delmi M. et al., 1990).
Для оптимального питания необходим не сам белок per se, а сбалансированная смесь аминокислот (табл. 1.4). На величины потребностей в аминокислотах влияет состав общей смеси аминокислот. К примеру, потребность в фенилаланине и метионине снижается при достаточном обеспечении организма тирозином и цистином. Если экспериментальные животные получают лишь минимальное количество незаменимых аминокислот, то стимулом для роста является введение в рацион заменимых аминокислот — глутаминовой кислоты, аргинина (Уайт А. и соавт., 1981а). Белки растительного происхождения менее питательны, чем животного. Они беднее лизином, метионином, триптофаном, труднее перевариваются. Отсутствуют данные о том, что недостаток одной из аминокислот вызывает определенное заболевание, но известно, что неизменно возникает задержка роста и ряд других нарушений. Недостача одной аминокислоты является причиной того, что не может завершиться построение большой молекулы белка, не используются также все другие аминокислоты. Некоторые из них задействованы в синтезе других продуктов или окисляются с выделением энергии, а часть выводится с мочой. Экспериментальные животные (крысы) не растут, если незаменимые аминокислоты давать им поочередно с интервалом 3 ч. Белки могут синтезироваться только при условии одновременного наличия в организме всех аминокислот.
На абсорбцию кальция влияют жиры. Их адекватное поступление в организм необходимо не только потому, что они влияют на абсорбцию кальция (путем образования кальциевых солей жирных кислот), но и на всасывание жирорастворимых витаминов — D, Е, А, К. Липиды являются структурным элементом кости, энергетическим субстратом, участвуют в процессе минерализации. При избытке жиров возникает недостаток желчных кислот для их эмульгации, и не все соли кальция переводятся в растворимые соединения, в результате этого увеличиваются потери кальция, выводимого с калом. Оптимальное всасывание кальция отмечается, когда 1 г жира в пище соответствует 10 мг кальция. В постменопаузальный период, независимо от уровня потребления жиров, рекомендуется увеличение потребления кальция.
Недостаток жиров в рационе сказывается на уровне потребления кальция в организме, структурно-функциональном состоянии костной ткани. При низком уровне потребления жиров образуется мало кальциевых солей жирных кислот, которые после эмульгации желчными кислотами всасываются в кишечнике. Это приводит к значительной потере кальция, выделяемого через кишечник. Важное значение для метаболизма костей имеет достаточное поступление в организм незаменимых полиненасыщенных жирных кислот (линолевой, линоленовой, арахидоновой), которые участвуют в образовании клеточных мембран и являются субстратом свободнорадикальных процессов, синтеза эйкозаноидов в том числе ПГ. При отсутствии в пище незаменимых жирных кислот у животных затормаживается рост, нарушаются функция почек и функция размножения, поражается кожа. При отсутствии жировых резервов у беременных рождаются дети с дефицитом массы тела.
Углеводы влияют на состояние минерального обмена, костного метаболизма. Они являются основным источником энергии (в виде аденозинтрифосфата — АТФ), обеспечивающим синтетические процессы в костной ткани. Известно, что обмен кальция в организме связан с витамином D, функцией паращитовидных желез и обменом углеводов. Экспериментальные данные показывают, что витамин D и ПТГ создают условия для усвоения, а также перехода кальция из костей в кровь в виде растворимых солей лимонной кислоты — цитратов. Особенности взаимосвязи между обменом углеводов, витамина D и кальция, очевидно, состоят в том, что под влиянием витамина D усиливается окисление глюкозы и повышается синтез лимонной кислоты, которая образует растворимые кальциевые соли. В виде цитрата кальций поступает из костной ткани в кровь, а также усваивается ею. Углеводы необходимы для построения органического матрикса кости, синтеза протеогликанов. В структуру костной ткани входят галактозамин, глюкозамин, гиалуроновая и хондроитинсерная кислоты. В качестве склеивающих веществ в соединительную ткань входят мукоиды. Известно, что целлюлоза, пектины, являющиеся энтеросорбентами, уменьшают всасывание кальция, цинка, железа. Потребление клетчатки также сопровождается снижением абсорбции магния, меди. Под влиянием пищи, богатой клетчаткой, у здорового человека возникает отрицательный баланс кальция (Смоляр В.И., 1991). Пищевые волокна выводят радионуклиды (стронций), канцерогены. Лактоза (при содержании ее в пище в повышенных количествах) стимулирует биосинтез солей кальция. Создавая кислую среду в кишечнике, лактоза активирует транспорт кальция через мембраны, повышает его всасывание.
1.2.2. Роль макро- и микроэлементов
Функции солей и отдельных элементов, поступающих в организм с пищей, чрезвычайно разнообразны. Как пластические материалы они являются составляющими тканей организма (например, костей), органических соединений (белков, некоторых липидов), а также находятся в свободном состоянии. Организм содержит почти все известные химические элементы. Количество элементов, их солей, их качество зависят от окружающей среды, откуда они с водой и продуктами поступают в организм человека. Содержание макроэлементов составляет от нескольких до десятков граммов, микроэлементов — миллиграммы, доли миллиграммов. В незначительных количествах содержатся такие ультрамикроэлементы, как висмут, кадмий, радий, ртуть, селен, серебро, свинец, торий, уран и др.
«Элементы жизни» включают Na, K, Mg, Ca, Zn, Cu, Co, Mn, Fe, Mo, H, O, N, C, P, S. Они составляют основу биологически важных молекул и макромолекул. В незначительном количестве в организме содержатся B, Cr, F, Cl, Br, J. Организм реагирует на изменения концентрации микроэлементов Cu, Zn, Mn, Mo, Ko, Fe, Ni и др. — элементов, количество которых в организме составляет менее 1 г на 70 кг массы тела. В стрессовых ситуациях, когда интенсивность метаболических процессов повышается, скрытый дефицит микроэлементов становится явным. Все биохимические реакции в организме осуществляются с участием неорганических и органических соединений. Причем большинство органических соединений участвуют в физиологических и патологических процессах в виде соединений с металлами. Металлы входят в состав многих важнейших ферментов. Ионы d-элементов (Zn, Mn, Fe, Co, Cu, Mo, Ni) имеют незаполненные d-электронные слои, что обусловливает их способность участвовать в различных окислительно-восстановительных процессах. В составе костной ткани содержится 20% имеющихся в организме микроэлементов. Одним из условий существования организма, а значит, нормального функционирования костной ткани является относительное динамическое постоянство внутренней среды и устойчивость физиологических функций — гомеостаз. При недостаточном поступлении минералов с пищей гомеостаз нарушается. Отмечается потеря костной ткани при дефиците бора (Nielsen F.H. et al., 1987), меди (Strain J.J., 1988; Conlan D. et al., 1990;), цинка (Frendenheim J.L. et al., 1986; Foldes J. еt al., 1987; Angus R.M. et al., 1988; Herzberg M. еt al., 1990), магния (Cohen L. еt al., 1983; Reginster J.I. et al., 1989). Минеральные вещества участвуют в обмене организма с внешней средой. С помощью радиоактивных меток установлено, что подобно другим веществам (белкам, липидам и т.п.), минеральные вещества непрерывно обмениваются, заменяясь новыми частицами, поступающими извне. Это наблюдается и в костной ткани, зубной эмали. Так, введение радиоактивного фосфора (32Р) свидетельствует об активном обновлении фосфатов. Недостаточное поступление минеральных веществ с пищей ведет к нарушению метаболизма, структурным изменениям в костной ткани. Недостаточность минеральных веществ, необходимых организму в больших количествах (кальций, магний, натрий, калий), устанавливают на основании клинических данных и определения их коцентрации в плазме крови. Дефицит микроэлементов (цинка, меди, марганца) диагностировать труднее, поскольку их коцентрации в плазме крови точно не отражают содержание этих элементов в крови (Маршалл В.Дж., 2002).
1.2.2.1. Макроэлементы
Кальций, фосфор, магний (а также микроэлемент фтор) образуют нерастворимые соли, которые входят в состав костей, зубов и хрящей. Они являются составными частями опорных тканей.
Кальций. Известны следующие функции кальция в организме:
- структурная (кости, зубы);
- сигнальная (является внутриклеточным вторичным мессенджером);
- ферментативная (кофермент факторов свертывания крови);
- нейромышечная (контроль возбудимости, выделение нейротрансмиттеров, инициация мышечного сокращения).
Главная роль в метаболизме кальция в организме человека принадлежит костной ткани. В костях кальций представлен фосфатами — Са3(РО4)2 (85%), карбонатами — СаСО3 (10%), солями органических кислот — лимонной и молочной (около 5%). Вне скелета кальций содержится во внеклеточной жидкости и практически отсутствует в клетках. В состав плотного матрикса кости наряду с коллагеном входит фосфат кальция — кристаллическое минеральное соединение, близкое к гидроксиапатиту Са10(РО4)6(ОН)2. Часть ионов Са2+ замещена ионами Mg2+, незначительная часть ионов ОН- замещена ионами фтора, которые повышают прочность кости. Минеральные компоненты костной ткани находятся в состоянии химического равновесия с ионами кальция и фосфата сыворотки крови. Клетки костной ткани могут ускорять отложение или, наоборот, растворение минеральных компонентов при локальных изменениях рН, концентрации ионов Са2+, НРО42-, хелатообразующих соединений (Мецлер Д., 1980). В организме взрослого человека содержится 12 кг кальция, 98% которого — в скелете (Уайт А. и соавт., 1981б), составляющем около 2% массы тела. В крови уровень кальция составляет 9–11 мг/100 мл (2,2–2,8 ммоль/л), во внеклеточной жидкости — около 20 мг/100 мл. Регуляция обмена кальция между вне- и внутриклеточной жидкостью осуществляется ПТГ, кальцитонином, 1,25-дигидроксихолекальциферолом. При снижении концентрации ионов кальция возрастает секреция паратиреотропного гормона и остеокласты увеличивают растворение минеральных соединений, содержащихся в костях. Одновременно ПТГ увеличивает реабсорбцию ионов Са2+ в почечных канальцах. В итоге повышается уровень кальция в сыворотке крови. При повышении содержания ионов Са2+ секретируется кальцитонин, который снижает концентрацию ионов Са2+ за счет отложения кальция в результате деятельности остеобластов. В процессе регуляции участвует витамин D: он требуется для синтеза Са2+-связывающих белков, необходимых для всасывания ионов Са2+ в кишечнике, реабсорбции его в почках. Постоянное поступление витамина D необходимо для нормального течения процессов кальцификации. Изменение уровня кальция в крови могут вызывать тироксин, андрогены, которые повышают содержание ионов Са2+, и ГК, снижающие его. Ионы Са2+ связывают многие белки, в том числе некоторые белки системы свертывания крови. В белках системы свертывания крови содержатся Са2+-связывающие участки, образование которых зависит от витамина К.
В пищевых продуктах кальций содержится в основном в виде фосфата кальция, который и поступает в организм. В природе кальций встречается в виде карбоната, оксалата, тартрата, фитиновой кислоты (содержится в злаках). Дефицит кальция в организме, по мнению А. Уайта и соавторов (1981б), часто связан с низкой растворимостью большинства солей. С низкой растворимостью солей кальция исследователи связывают кальцификацию стенок артерий, образование камней в желчном пузыре, почечной лоханке, канальцах. Формы фосфата кальция по степени возрастания растворимости располагают следующим образом:
Са3(РО4)2>СаНРО4>Са(Н2РО4)2
Фосфаты кальция легко растворяются в желудочном содержимом. Максимальное всасывание кальция происходит в проксимальных отделах тонкого кишечника. Оно уменьшается в дистальных отделах. Доля усвоения кальция более значительна у детей (по сравнению с взрослыми), у беременных и кормящих грудью. Усвоение кальция снижается с возрастом человека, при дефиците витамина D. В плазме крови содержатся фракции белково-связанного (недиффундирующего) кальция (0,9 ммоль/л), диффундирующего: ионизированного (1,1–1,4 ммоль/л) и неионизированного (0,35 ммоль/л). Биологически активным является ионизированный кальций. Ионизированный кальций проникает в клетки через мембраны, неионизированная форма связана с белками (альбумином), углеводами и другими соединениями. Внутри клеток концентрация свободного кальция низкая. Так, общая концентрация ионов Са2+ в цитоплазме эритроцитов составляет около 3 мкм, из них на свободные ионы приходится менее 1 мкм. Градиент концентрации ионов кальция по разные стороны от мембраны (от 102 до 105) поддерживается при помощи кальциевого насоса. Очень медленная обратная диффузия ионов внутрь клетки противостоит работе этого насоса. Са2+ относится к вторичным мессенджерам — внутриклеточным веществам, концентрация которых контролируется гормонами, нейромедиаторами, внеклеточными сигналами. Низкий уровень кальция в клетках поддерживается кальциевым насосом (кальциевыми АТФазами) и натрий-кальциевыми обменниками. Высокая активация Mg2+, Са2+-АТФазы связана с конформационными изменениями кальциевого насоса, приводящими к переносу Са2+. Резкое повышение содержания кальция в клетке происходит при открытии кальциевых каналов или внутриклеточных кальциевых депо (концентрация повышается до 500–1000 нМ при 10–100 нМ в нестимулированной клетке). Открытие каналов может быть обусловлено деполяризацией мембран, действием сигнальных веществ, нейромедиаторов (глутамат, АТФ), вторичных мессенджеров (инозит-1,4,5-трифосфат, цАМФ) (Кольман Я., Рем К. ., 2000). Уровень кальция в клетках повышается в 5–10 раз в виде кратковременных флюктуаций (высокое содержание кальция оказывает цитотоксическое действие). В клеточных органеллах и цитоплазме клеток имеется большое количество белков, способных связывать кальций и выполнять роль буфера. Действие кальция опосредовано «кальциевыми сенсорами» — специальными Са2+-связывающими белками — аннексином, кальмодулином, тропонином. Кальмодулин имеется во всех клетках животных и при связывании четырех ионов кальция переходит в активную форму, которая может взаимодействовать с белками. Са2+ оказывает влияние на активность ферментов, ионных насосов, компонентов цитоскелета за счет активации кальмодулина.
Гипоальбуминемия не влияет на уровень ионизированного кальция, который варьирует в узком диапазоне и тем самым обеспечивает нормальное функционирование нервно-мышечного аппарата. С повышением рН доля связанного кальция возрастает. При алкалозе ионы водорода диссоциируют из молекулы альбумина, что обусловливает снижение концентрации ионов кальция. Это может вызвать клинические симптомы гипокальциемии, несмотря на то, что концентрация общего кальция в плазме крови не изменена. Обратная картина (повышение концентрации ионов кальция в плазме крови) отмечается при остром ацидозе. Глобулины также связывают кальций, хотя и в меньшей степени, чем альбумин.
Составные компоненты регуляции содержания кальция в плазме крови включают:
- скелет (является резервуаром кальция);
- почки;
- экскрецию кальция через кишечник с желчью;
- ПТГ, кальцитонин (их секреция определяется уровнем кальция в плазме крови);
- 1,25-дигидроксихолекальциферол.
Внеклеточный пул кальция в течение суток обновляется приблизительно 33 раза (Маршалл В.Дж., 2002), проходя через почки, кишечник и кости. И даже незначительное изменение любого из этих потоков оказывает существенное влияние на концентрацию кальция во внеклеточной жидкости, включая плазму крови. Кальций, входящий в состав секретов пищеварительного тракта, частично реабсорбируется вместе с пищевым кальцием.
Нарушения обмена кальция сопровождаются нарушениями обмена фосфатов и клинически проявляются в изменениях костного скелета и нервно-мышечной возбудимости. Наблюдается обратная зависимость между содержанием кальция и фосфора в сыворотке крови (одновременное повышение наблюдается при гиперпаратиреоидизме, снижение — при рахите у детей). При повышенном содержании в пище фосфора в пищеварительном тракте образуется невсасывающийся трехосновный фосфат кальция. Суточная потребность взрослого человека в кальции составляет 20–37,5 ммоль (0,8–1,5 г), у беременных и кормящих — в 2 раза выше (Базарнова М.А., Морозова В.Т. (ред.), 1986). В пищеварительный тракт ежедневно поступает 35 ммоль кальция, но всасывается только половина. Он всасывается в 50 раз медленнее, чем натрий, но интенсивнее, чем железо, цинк, марганец. Всасывание происходит в тонком кишечнике (максимально в двенадцатиперстной кишке). Лучше всего всасывается глюконат и лактат кальция. Оптимальное всасывание происходит при рН 3,0. Кальций соединяется с жирными и желчными кислотами и через воротную вену поступает в печень. Транспорту через мембрану энтероцита в кровь способствует витамин D. Всасывание снижается при недостатке фосфатов (важное значение имеет соотношение кальций/фосфор). На всасывание влияет концентрация Nа+, активность ЩФ, Mg2+,Са2+-АТФазы, содержание кальцийсвязывающего белка. Из организма в норме кальций выделяется через кишечник. Ежедневно в пищеварительный канал секретируется слюнными, желудочными и поджелудочной железами и выводится около 25 ммоль Са2+ (Базарнова М.А., Морозова В.Т. (ред.), 1986). Выведение кальция с калом (в составе желчи) сохраняется даже при бескальциевой диете. В почках за сутки фильтруется около 270 ммоль Са2+. 90% кальция, фильтруемого в почках, реабсорбируется, поэтому в целом с мочой его выводится мало (выведение возрастает при повышении концентрации кальция в крови и ведет к образованию камней в почках). Суточная экскреция колеблется от 1,5 до 15 ммоль и зависит от суточного ритма (максимум — в утренние часы), уровня гормонов, кислотно-основного состояния, рациона (углеводы усиливают выведение кальция). При рассасывании минерального остова костей реабсорбция кальция снижается. Кости являются резервуаром кальция: при гипокальциемии кальций поступает из костей и, наоборот, при гиперкальциемии — откладывается в скелете.
Ионы кальция важны для течения многих процессов:
- нервно-мышечного возбуждения;
- мышечного сокращения;
- свертывания крови;
- проницаемости клеточных мембран;
- активности многих ферментов;
- активности перекисного окисления липидов.
Основным источником кальция являются молоко, молочные продукты (творог, твердые сыры), рыба, яйца. Также он содержится в зеленых овощах, орехах. Одним из источников кальция является питьевая вода (1 л содержит 350–500 мг). С питьевой водой поступает 10–30% кальция (Смоляр В.И., 1991). Биодоступность кальция повышают кисломолочные продукты, белки животного происхождения, снижают — пищевые волокна, алкоголь, кофеин, избыток жиров (образуются нерастворимые соединения), фосфаты, оксалаты. Повышенное содержание в пище магния и калия тормозит всасывание кальция: они конкурируют с кальцием за желчные кислоты. Препараты витамина D способствуют всасыванию кальция. При лечении остеопороза одновременно с применением препаратов кальция необходимо восполнить дефицит белков, кальциферола и других витаминов.
Гиперкальциемия — результат повышенного поступления кальция во внеклеточную жидкость из резорбируемой костной ткани или из пищи в условиях снижения почечной реабсорбции. Наиболее частой (90% случаев) причиной гиперкальциемии является первичный гиперпаратиреоз, злокачественные новообразования. Часто гиперкальциемия клинически не проявляется. Редко причинами гиперкальциемии являются (Клаттер У., 1995): гранулематозные заболевания (в том числе саркоидоз), гипервитаминоз D, тиреотоксикоз, применение тиазидных диуретиков, препаратов лития, молочно-щелочной синдром, длительная обездвиженность, наследственная гипокальциурическая гиперкальциемия, почечная недостаточность.
М.И. Балаболкин (1989) называет следующие причины гиперкальциемии:
- Гиперкальциемия вследствие избыточной секреции ПТГ:
а) первичный, вторичный, третичный гиперпаратиреоз;
б) множественный эндокринный аденоматоз I и II типа;
в) гиперпаратиреоз при эктопированном образовании ПТГ (псевдогиперпаратиреоз).
- Эндокринопатическая гиперкальциемия:
а) тиреотоксикоз;
б) хроническая надпочечниковая недостаточность;
в) феохромоцитома;
г) акромегалия.
- Злокачественные новообразования:
а) остеолитические метастазы злокачественных опухолей в кости;
б) заболевания системы крови (лейкоз, лимфома, миеломная болезнь, лимфогрануломатоз).
- Медикаментозные гиперкальциемии:
а) молочно-щелочной синдром;
б) лечение тиазидовыми диуретиками;
в) передозировка витаминов А и D;
г) лечение препаратами лития.
- Гиперкальциемия при иммобилизации:
а) переломы костей;
б) соматические заболевания, приковывающие больного к постели на длительный период.
К клиническим симптомам гиперкальциемии относятся:
- отсутствие аппетита, тошнота, рвота, боль в животе (развивается язва желудка и двенадцатиперстной кишки, панкреатит), запоры;
- слабость, утомляемость, уменьшение массы тела, мышечная слабость;
- изменения личности, снижение концентрации внимания, сонливость, кома;
- аритмия, укорочение интервала QT, выявляемое при электрокардиографическом (ЭКГ)-исследовании;
- нефрокальциноз, почечные конкременты, кальциноз сосудов и роговицы;
- полиурия, дегидратация, почечная недостаточность.
Наиболее частой причиной снижения общей концентрации кальция в сыворотке крови является гипоальбуминемия. Обмен кальция в организме не нарушается, если содержание свободного кальция находится в пределах нормы. Концентрация свободного кальция в сыворотке крови снижается при гипопаратиреозе, резистентности к ПТГ (псевдогипопаратиреозе), авитаминозе D, почечной недостаточности, выраженной гипомагниемии, гипермагниемии, остром панкреатите, некрозе скелетных мышц (рабдомиолизе), распаде опухолей, многократном переливании цитратной крови. К клиническим проявлениям гипокальциемии относятся: парестезия, чувство онемения, судороги мышц, спазмы гортани, отклонения в поведении, ступор, положительные симптомы Хвостека и Труссо, удлинение интервала QT на ЭКГ, развитие катаракты. Умеренная гипокальциемия может быть бессимптомной.
Гиперкальциурия развивается при повышенном потреблении кальция с пищей, передозировке витамина D (усиливается резорбция в кишечнике), канальцевых расстройствах (идиопатическая гиперкальциурия, почечные тубулярные ацидозы), при повышенном распаде костной ткани (миеломная болезнь, опухоли костной ткани, фосфатный диабет, остеопороз, гиперпаратиреоз). Гипокальциурия отмечается при гипопаратиреозе, гиповитаминозе D, гипокальциемии, снижении клубочковой фильтрации.
Фосфор. В организме взрослого человека содержится около 670 г фосфора (1% массы тела), который необходим для образования костей и клеточного энергетического обмена. 90% фосфора, как и кальция, находится в скелете — костях и зубах (Базарнова М.А., Морозова В.Т. (ред.), 1986). Вместе с кальцием они составляют основу твердого вещества кости. В костях фосфор представлен труднорастворимым фосфатом кальция (2/3) и растворимыми соединениями (1/3). Большая часть остального количества фосфора находится внутри клеток, 1% — во внеклеточной жидкости. Поэтому уровень фосфора в сыворотке крови не позволяет судить о его общем содержании в организме.
Фосфаты являются структурными элементами костной ткани, участвуют в переносе энергии в виде макроэргических связей (АТФ, аденозиндифосфорная кислота — АДФ, креатинфосфат, гуанинфосфаты, др.). Фосфор и сера являются двумя элементами в организме человека, которые входят в состав различных макроэргических соединений. С участием фосфорной кислоты осуществляется гликолиз, гликогенез, обмен жиров. Фосфор входит в структуру ДНК, РНК, обеспечивающих синтез белка. Он участвует в окислительном фосфорилировании, в результате которого образуется АТФ, фосфорилировании некоторых витаминов (тиамина, пиридоксина и др.). Фосфор также важен для функционирования мышечной ткани (скелетной и сердечной мышц). Неорганические фосфаты входят в состав буферных систем плазмы и тканевой жидкости. Фосфор активирует всасывание ионов кальция в кишечнике. Суточная потребность в фосфоре составляет 30 ммоль (900 мг), у беременных она возрастает на 30–40%, в период лактации — в 2 раза (Базарнова М.А., Морозова В.Т. (ред.), 1986). По данным В.И. Смоляра (1991), потребность в фосфоре у взрослых составляет 1600 мг/сут, у детей — 1500–1800 мг/сут.
В организм человека фосфор поступает с пищей растительного и животного происхождения в виде фосфолипидов, фосфопротеинов и фосфатов. В растительных (в частности, бобовых) продуктах содержится много фосфора, однако усвояемость его низкая. Важным его источником является мясо и рыба. В желудке и кишечнике фосфорная кислота отщепляется от органических соединений. Всасывание 70–90% фосфора происходит в тонком кишечнике. Оно зависит от концентрации фосфора в просвете кишки, активности ЩФ (ее угнетение снижает всасывание фосфата). Активность ЩФ повышает витамин D, а всасывание фосфатов — ПТГ. Всосавшийся фосфор поступает в печень, участвует в процессах фосфорилирования, частично откладывается в виде минеральных солей, которые затем переходят в кровь и используются костной и мышечной тканью (синтезируется креатинфосфат). От обмена фосфатов между кровью и костной тканью зависит нормальное течение процессов окостенения, поддержания нормальной костной структуры.
В крови фосфор содержится в виде четырех групп соединений: неорганического фосфата, органических фосфорных эфиров, фосфолипидов и свободных нуклеотидов. В плазме крови неорганический фосфор присутствует в виде ортофосфатов, но его концентрацию в сыворотке крови оценивают непосредственно (1 мг фосфора=0,32 ммоль/л фосфата). Он проникает через полунепроницаемые мембраны, фильтруется в почечных клубочках. Концентрация неорганического пирофосфата в плазме крови составляет: 110 мкмоль. Содержание неорганического фосфора в плазме крови у взрослых людей составляет 3,54 мг фосфора/100 мл, несколько выше оно у детей (45 мг фосфора/100 мл) и у женщин после менопаузы. В плазме также содержатся гексозофосфаты, триозофосфаты и др. Скелет является резервуаром неорганического фосфора: при снижении его содержания в плазме он поступает из скелета и, наоборот, откладывается в скелете при повышении его концентрации в плазме крови. Концентрацию фосфора в сыворотке крови рекомендуется определять натощак: богатая фосфором пища повышает ее, а углеводы, инфузия глюкозы — снижают. Фосфор выделяется из организма через кишечник и почки в виде фосфата кальция. С мочой выводится 2/3 растворимых одно- и двузамещенных фосфатов натрия и калия и 1/3 — фосфатов кальция и магния. В почках за сутки фильтруется около 208 ммоль фосфата, экскретируется — 16–26 ммоль. Соотношение одно- и двузамещенных солей фосфора зависит от кислотно-основного состояния. При ацидозе однозамещенных фосфатов выводится в 50 раз больше, чем двузамещенных. При алкалозе усиленно образуются и выделяются двузамещенные фосфаты.
ПТГ снижает уровень фосфора в сыворотке крови, угнетая реабсорбцию его в проксимальных и дистальных канальцах, усиливая выведение с мочой. Кальцитонин оказывает гипофосфатемическое действие, снижая реабсорцию и усиливая экскрецию. Усиливая всасывание фосфата в кишечнике, 1,25-(ОН)2D3, повышает его уровень в крови, способствует фиксации фосфорно-кальциевых солей костной тканью. Инсулин стимулирует поступление фосфата в клетки и тем самым снижает его содержание в сыворотке крови. Гормон роста повышает реабсорбцию фосфатов, вазопрессин — экскрецию.
Обмен фосфора и кальция тесно взаимосвязаны. Считается (Смоляр В.И., 1991), что оптимальным для их сочетанного усвоения из пищи является соотношение между кальцием и фосфором 1:11,5. Гиперкальциемия, снижая секрецию ПТГ, стимулирует реабсорбцию фосфатов. Фосфаты кальция могут обусловливать отложение кальция в тканях и гипокальциемию.
При нарушении обмена фосфора отмечается повышение или снижение его содержания в крови. Гиперфосфатемию часто выявляют при почечной недостаточности, гипопаратиреозе, псевдогипопаратиреозе, рабдомиолизе, распаде опухолей, метаболическом и респираторном ацидозе. Гиперфосфатемия подавляет 1-гидроксилирование 25-гидроксикальциферола в почках. Умеренная гипофосфатемия не сопровождается существенными последствиями. Тяжелая гипофосфатемия (менее 0,3 ммоль/л (1 мг%)) сопровождается нарушением функции эритроцитов, лейкоцитов, мышечной слабостью (нарушается образование АТФ, 2,3-дифосфоглицерата). Ее отмечают при злоупотреблении алкоголем и абстиненции, респираторном алкалозе, нарушении всасывания в кишечнике, применении лекарственных средств, связывающих фосфат, возобновлении приема пищи после голодания, переедании, тяжелых ожогах, лечении диабетического кетоацидоза (Клаттер У., 1995). При диабетическом кетоацидозе гипофосфатемия не является признаком истощения запасов фосфата. Умеренная гипофосфатемия (1,0–2,5 мг%) возможна при инфузии глюкозы, дефиците витамина D в пище или снижении его всасывания в кишечнике, при гиперпаратиреозе (потеря фосфора, выделяемого через почки), остром тубулярном некрозе, после пересадки почек, при наследственной гипофосфатемии, синдроме Фанкони, паранеопластической остеомаляции, увеличении объема внеклеточной жидкости. Респираторный алкалоз может обусловить гипофосфатемию, стимулируя активность фосфофруктокиназы и образование фосфорилированных промежуточных продуктов гликолиза. Хроническая гипофосфатемия приводит к рахиту и остеомаляции. Гипофосфатемия проявляется потерей аппетита, недомоганием, слабостью, парестезиями в конечностях, болью в костях.
Гипофосфатурия отмечается при остеопорозе, гипофосфатемическом почечном рахите, инфекционных заболеваниях, острой желтой атрофии печени, снижении клубочковой фильтрации, повышенной реабсорбции фосфора (при гипосекреции ПТГ). Гиперфосфатурия возникает при повышенной фильтрации и сниженной реабсорбции фосфора (рахит, гиперпаратиреоз, тубулярный ацидоз, фосфатный диабет), при гипертиреозе, лейкозах, отравлениях солями тяжелых металлов, бензолом, фенолом.
Гомеостаз кальция и фосфата. Гипокальциемия стимулирует секрецию ПТГ и тем самым повышает продукцию кальцитриола. В результате увеличивается мобилизация кальция и фосфатов из костей, их поступление из кишечника. Избыток фосфатов экскретируется с мочой (ПТГ оказывает фосфатурическое действие), а реабсорбция кальция в почечных канальцах возрастает и его концентрация в крови нормализуется. Гипофосфатемия сопровождается усилением секреции только кальцитриола. Повышение под действием кальцитриола концентрации в плазме крови приводит к снижению секреции ПТГ. Гипофосфатемия обусловливает стимуляцию абсорбции фосфата и кальция в кишечнике. Избыток кальция выводится с мочой, поскольку кальцитриол в незначительной мере (по сравнению с ПТГ) усиливает реабсорбцию кальция. В результате описанных процессов нормальная концентрация фосфата в плазме крови восстанавливается, независимо от концентрации кальция.
Магний. Естественным антагонистом кальция является магний, который играет важную роль в метаболизме костной ткани. Около 60% магния, содержащегося в организме (20–30 г), находится в костной ткани, остальная часть — в клетках. 1% всего магния содержится во внеклеточной жидкости. Проявления дефицита магния предотвращает доза 200–300 мг/сут (всасывается 30%). Средняя суточная потребность в магнии для взрослого человека составляет 10 мг/кг массы тела. Ежедневное потребление магния превышает количество, необходимое для поддержания баланса, а избыток выделяется через почки. В период беременности, лактации, усиленного роста потребность достигает 15 мг/кг массы тела. Содержание магния в плазме крови составляет около 0,9 (0,75–1,1) ммоль/л. Уровень содержания в сыворотке крови не всегда отражает его общее содержание в организме. 80% магния содержится в ионизированной форме, 20% — связаны с белком (альбумином, α1- и α2-глобулинами). Содержание Mg2+ в клетках выше, чем в межклеточной жидкости. В межклеточной жидкости содержится 15–29 ммоль магния. При повышенном катаболизме углеводов, уменьшении рН снижается степень связывания Mg2+ с АТФ и повышается концентрация свободного магния. Выводится магний (введенный per os или парентерально) из организма с мочой и калом. За сутки фильтруется около 135 ммоль магния, суточная экскреция составляет 3–9 ммоль (70–200 мг) (Базарнова М.А., Морозова В.Т. (ред.), 1986). При дефиците магния его экскреция снижается. При преобладании углеводов в пище выведение магния усиливается, хотя в целом дефицит магния, связанный с питанием, наблюдается редко. Реабсорбция ионов магния и кальция осуществляется сходными механизмами. Повышенная экскреция одного из них сопровождается увеличением выведения другого. Повышение содержания Mg2+ в крови сопровождается изменением реабсорбции и выведением его из организма. Минералокортикоиды не влияют на канальцевую реабсорбцию и экскрецию магния (влияние альдостерона на обмен магния, вероятно, опосредовано изменениями объема внеклеточной жидкости), вазопрессин — повышает. ПТГ непосредственно усиливает реабсорбцию магния в почечных канальцах. Инсулин вызывает переход магния из плазмы крови в клетки.
Значительная потеря Mg2+ наблюдается при диарее, мальабсорбции и сопровождается развитием сопорозного состояния, мышечной дрожи, спазма мышц, повышенной нервно-мышечной возбудимости. Как недостаток, так и избыток магния в организме сопровождается понижением всасывания кальция в кишечнике. Соотношение кальция и магния 2:1 считается оптимальным в рационе. При увеличении количества магния в организме усиливается вытеснение кальция из органических и минеральных соединений. Взаимодействуя с кальцием, магний влияет на проницаемость возбудимых мембран и их электрические свойства. Снижение содержания магния во внеклеточной среде вызывает состояние гипервозбудимости. Магний способствует задержке фосфора в организме и улучшению его ассимиляции. Ионы Mg2+ вместе с ионами Na+, К+, Са2+ играют большую роль в поддержании структуры рибосом и митохондрий, что необходимо для поддержания их функций. Они поддерживают структуру нуклеопротеинов. Ионы Mg2+ являются соединительным звеном в образовании комплекса между структурной РНК рибосом, с одной стороны, транспортной и информационной РНК, с другой. Это создает необходимые условия для биосинтеза белков. Магний является кофактором и активатором 300 ферментов, среди которых самую большую группу представляют фосфотрансферазы, для которых комплекс Mg — АТФ рассматривается как субстрат. Этот комплекс служит субстратом для многих АТФ-зависимых ферментов. К этим ферментам относятся ферменты белкового синтеза, гликолиза, трансмембранного транспорта ионов. К Mg-зависимым ферментам относятся фосфатазы, пептидазы, декарбоксилазы кетокислот, карбоксилазы, фосфорилазы, енолаза, пируваткиназа, фосфоглюкомутаза, ферменты цикла лимонной кислоты, холинэстеразы, холинацетилазы и др. Mg2+ необходим для синтеза холестерина, нуклеотидов. Недостаток магния в пище сопровождается:
- уменьшением всасывания кальция в кишечнике;
- снижением биодоступности кальция;
- гипокальциемией;
- снижением уровня паратиреотропного гормона, 1,25-(ОН)2D3;
- потерей костной массы (трабекулярного компонента);
- увеличением количества остеокластов и участков костной резорбции;
- развитием рахита, остеопороза (Rude R.K. et al., 1998).
Поскольку магний необходим для секреции ПТГ и его действия на ткани-мишени, его дефицит может быть причиной гипокальциемии, а также невосприимчивости организма к лечению гипокальциемии витамином D и препаратами кальция.
У человека недостаток магния вызывает психические расстройства, возбуждение, делирий, атаксию, тремор, хорееподобные движения, мышечные подергивания, судороги, артериальную гипотензию, тахикардию, сердечные аритмии, а также смерть вследствие паралича дыхательной мускулатуры.
При избытке магния в пище отмечается:
- снижение экскреции кальция с мочой;
- стимуляция остеокластов;
- нарушение структурно-функционального состояния кости (Hunt C.D. et al., 1997).
Гипермагниемия (свыше 1,25 ммоль/л) возникает при почечной недостаточности, лечении содержащими магний антацидами и слабительными, внутривенном введении сульфата магния с лечебной целью. Повышение до 2,5 ммоль/л сопровождается снижением артериального давления, тошнотой, рвотой, жаждой, чувством жара. При концентрации свыше 5 ммоль/л развивается угнетение центральной нервной системы, кома, при 7–10 ммоль/л — блокада сердца, остановка сердечной деятельности, паралич дыхания (такая гипермагниемия может быть вызвана только почечной недостаточностью). Внутривенное введение кальция обусловливает кратковременный защитный эффект при подобных явлениях гипермагниемии. Симптомы гипомагниемии наблюдаются при снижении концентрации в сыворотке крови ниже 0,5–0,6 ммоль/л. Гипомагниемия почти всегда свидетельствует о недостаточном содержании магния в организме и наблюдается чаще, чем гипермагниемия (выявляется у 10% госпитальных больных). Гипомагниемия возникает у пациентов с алкоголизмом, абстиненцией; при неполноценном питании, нарушении всасывания, диарее, усиленном выделении почками при гиперкальциемии, осмотическом диурезе, при применении петлевых диуретиков, аминогликозидов, амфотерицина В, циклоспорина, цисплатина (Клаттер У., 1995).
При недостатке Mg2+ может повышаться содержание Са2+ в стенках артерий, миокарде, почках (отмечают обратную связь в костях и мягких тканях содержания Mg2+ и Са2+). Гипомагниемия может сочетаться с гипокальциемией в случае потери минералов через пищеварительный тракт и гиперкальциемией при метастазах злокачественных опухолей, гипопаратиреозе. Между уровнем магния в сыворотке крови и общим содержанием Mg2+ в организме не всегда отмечается зависимость. Определение концентрации магния в плазме крови обязательно при установленной или предполагаемой гипокальциемии, гипокалиемии.
Натрий. Состояние костной ткани зависит от уровня содержания в организме натрия. Кости являются его основным депо. Из общего содержания натрия в организме (около 105 г) 44% находятся в костях. При злоупотреблении солью на фоне дефицита эстрогенов снижается минеральная плотность кости (МПК), усиливается экскреция с мочой кальция и гидроксипролина. Кость является лабильным резервуаром натрия: при ацидозе он поступает в межклеточную жидкость, при алкалозе и избытке в рационе — накапливается в кости (Уайт А. и соавт., 1981б). Ионы натрия адсорбируются на поверхности костных кристаллов. Избыточное содержание натрия (в виде соли — NaCl) в пище приводит к повышению экскреции кальция, фосфора, оксипролина, деминерализации кости. Натрий необходим высшим животным: при отсутствии натрия в рационе экспериментальные животные погибают. Внутриклеточное содержание натрия в 5–10 раз ниже содержания калия, в крови — обратное соотношение (концентрация Na+ в плазме крови — 0,15 М, а К+ — 0,005 М). Потребность взрослого человека в натрии составляет от 4 до 5 г/сут. Он поступает с пищей в виде NaCl, всасывается в тонком кишечнике и ободочной кишке (более интенсивно). Всасывание усиливается в присутствии аминокислот, глюкозы, его стимулирует альдостерон, гидрокортизон, а угнетается гастрином, секретином, холецистокинином, ПГ. Оптимальное всасывание происходит при рН 6,84,4. В организме натрий содержится в виде солей NaCl, NaHCO3, Na2HPO4. Ионная форма составляет 85%, связанная с белками — 15%. Натрий является основным катионом внеклеточной жидкости, поддерживает осмотическое давление, определяет движение воды, участвует в регуляции кислотно-основного состояния, нервно-мышечной возбудимости, в передаче возбуждения по нервно-мышечному волокну. Натрий сохраняет и поддерживает постоянство биоэлектрического потенциала мембран клеток, потенцирует действие адреналина, влияет на величину сосудистого тонуса. Содержание натрия в плазме крови колеблется в пределах 137–150 ммоль/л, в цельной крови — 70–90, в эритроцитах — 9–28 ммоль/л. За сутки взрослый человек теряет 36 г натрия: с мочой — 90–95%, калом, потом — 5–10% (Базарнова М.А., Морозова В.Т. (ред.), 1986). Баланс натрия в организме регулируется нервной, эндокринной системами, почками, посредством хеморецепторов. Основная роль в сохранении баланса натрия принадлежит альдостерону, ренин-ангиотензиновой системе.
Калий. Имеется прямая связь между потреблением калия лицами преклонного возраста и МПКТ: при высоком потреблении калия с пищей наблюдается более высокая МПК (Tucker K.L. et al., 1999). Одним из последствий экспериментального недостатка калия у животных является нарушение роста. Следует отметить, что в норме пищевые продукты содержат достаточное количество калия (поступает в основном с растительной пищей). Потребность человека в калии достаточно высокая — достигает примерно 2 г/сут. Ионы калия и натрия имеют первостепенное значение для обеспечения возбудимости мембран. Различие в концентрации данных ионов по разные стороны от мембраны позволяет обеспечивать существование источника энергии для функционирования мембранных процессов. Ионы К+ необходимы для функционирования многих внутриклеточных ферментов, в том числе катализирующих фосфорилирование карбоксильных групп или енольных анионов, реакции элиминирования. Калий поддерживает осмотический и кислотно-основный гомеостаз, участвует в обеспечении трансмембранной разности потенциалов, принимает участие в синтезе белка, гликогена, АТФ, креатинфосфата, ацетилхолина, в фосфорилировании глюкозы и передаче возбуждения по нервно-мышечному волокну. От соотношения ионов калия с другими ионами зависит состояние нервно-мышечной возбудимости, сократительная способность миокарда, секреция желез пищеварительного тракта.
Наиболее активно всасывание калия происходит в тонком кишечнике. С пищей поступает 23 г калия, с мочой выводится также 23 г, в пищеварительном тракте секретируется и реабсорбируется 25 г, с калом выводится менее 10 ммоль. Секреция и выведение калия зависят от его поступления с пищей. В регуляции калиевого гомеостаза участвуют минералокортикоиды (альдостерон), инсулин. Общее содержание калия в организме составляет около 160 (80–250) г. Основное (89–90%) его количество находится в клетках, в костях, хрящах, соединительной ткани содержится 8% общего количества (Базарнова М.А., Морозова В.Т. (ред.), 1986). В сыворотке крови у взрослого человека содержится 3,6–5,3 ммоль/л (14–21 мг/100 мл), в эритроцитах — 79,8–99,3 ммоль/л (312–388 мг/100 мл). Нарушения обмена калия проявляются гипо- и гиперкалиплазмией.
Хлор. Представляет собой анион внеклеточной жидкости Cl, содержание которого в организме составляет около 2300 ммоль/л. 70% его находится во внеклеточной жидкости, 30% неравномерно распределяется между тканями. Клетки соединительной ткани богаты ионами хлора, который играет важную роль в метаболизме кальция. В продуктах питания кальций находится в виде карбоната, фосфата, оксалата и других труднорастворимых соединений. В желудке происходит частичное превращение этих солей в хлорид кальция, который всасывается. Таким образом, для всасывания кальция имеет значение и уровень продукции HCl в желудке. Cl имеет и опосредованное значение для метаболизма костной ткани: от концентрации NaCl зависит гидратация, дисперсность, растворимость многих белков. Концентрация хлора в плазме крови составляет 95–110 ммоль/л, в эритроцитах — 45–54 ммоль/л.
Сера. Для нормального функционирования костной ткани необходима сера. Она содержится в организме в виде органических и неорганических соединений. Как и фосфор, сера входит в состав макроэргических соединений, обеспечивающих энергией синтетические процессы. Является составным элементом серосодержащих аминокислот, абсолютного большинства белков, входит в состав гормонов (инсулина, некоторых гормонов гипофиза), ферментов (особенно тканевого дыхания), глутатиона, желчных кислот (таурин). Сера входит в состав метионина, который играет важную роль в обмене белков и липидов. В виде серной кислоты участвует в обезвреживании в печени токсических продуктов.
Железо. Содержание в пище различных макро- и микроэлементов имеет важное значение для метаболизма кальция и фосфора. Длительный дефицит или избыток микроэлементов в рационе сопровождается изменением показателей фосфорно-кальциевого обмена. Дефицит железа (макроэлемент) в пище, по данным В.И. Смоляра (1972), вначале вызывает уменьшение выведения кальция и фосфора из организма и повышение активности ЩФ в сыворотке крови. В дальнейшем в результате истощения адаптационных механизмов дефицит железа приводит к отрицательному балансу кальция и снижению его содержания в костях. Обогащение пищи железом (5-кратное увеличение суточной потребности) способствует повышению минерализации костей скелета. Железо принимает активное участие в биохимических процессах, происходящих в регенерате кости (Христич А.Д., Вашкевич З.Ф., 1972). 70% из 35 г железа, содержащихся в организме человека, сосредоточено в эритроцитах. В остальных тканях общее содержание железа составляет лишь около 0,3 мМ (Мецлер Д., 1980). Суммарное содержание всех железосодержащих ферментов составляет около 0,01 мМ. Железо сконцентрировано в окислительных ферментах в мембранах, поэтому его локальные концентрации могут быть более высокими. В тканях человека значительная часть железа находится в форме ферритина. Содержание железа в ферритине составляет 17–23%. Полностью заполненная (до 23% Fe) молекула ферритина содержит свыше 2000 атомов железа. Другая резервная форма железа, гемосидерин, состоит из молекул ферритина вместе с добавочным количеством железа. При введении в организм избыточного количества железа отложение гемосидерина в печени достигает токсического уровня. В норме суточный рацион человека содержит около 15 мг железа, из них в организме всасывается около 1 мг. Этого достаточно для того, чтобы компенсировать небольшие потери (с желчью). Д. Мецлер (1980) считает, что в организме человека нет механизма, обеспечивающего выведение из него избыточного количества железа. Его содержание регулируется только уровнем поступления. Молекулярные механизмы всасывания железа не изучены. В крови Fe3+ связывается белком трансферрином (молекулярный вес — 80 000), имеющим два центра связывания железа. В жидких средах организма находятся сидерофилины — железосвязывающие белки. Трансферрин осуществляет транспорт железа, служит буфером, регулирующим поступление железа. Для переноса железа из трансферрина в гем Fe3+ должен восстановиться в Fe2+. В роли восстановителя могут быть аскорбиновая кислота или глутатион. Ежесуточно разрушается 9 млрд эритроцитов и освобождается 20–25 мг железа, которое используется или резервируется.
1.2.2.2. Микроэлементы
Важным компонентом организма является марганец, содержащийся в двух- и трехвалентной форме. Основная роль марганца заключается в участии в ферментативных процессах. Он входит в состав металлозависимых ферментов и регулирует их активность. В марганце нуждается большое количество ферментов, в том числе галактозил- и N-ацетилгалактозаминил-трансферазы, участвующие в синтезе мукополисахаридов (гликозамингликанов), лактозосинтетаза, L-лейцинаминопептидаза, пируваткарбоксилаза, глутаминсинтетаза, ДНК-полимераза, многие нуклеазы. Он является составным компонентом важнейшего антиоксидантного фермента — супероксиддисмутазы. Активирует фосфатазы, карбоксилазу, аргиназу, дипептидазы, транскетолазу и др. Марганец усиливает действие гормонов гипофиза, половых гормонов, инсулина и таким образом опосредованно влияет на костный метаболизм. Стимулирует рост, предотвращает развитие атеросклероза. Многие из белков, нуждающихся в Mg2+, могут вместо него использовать Mn2+. Марганец может замещать магний и цинк в металлозависимых ферментах. Имеется взаимосвязь между обменом марганца и витаминами А, В, С, D, Е.
В организм марганец поступает из растительных продуктов и всасывается в тонком кишечнике. Всасывание усиливается при совместном введении с кобальтом, цинком, медью. Суточная потребность организма взрослого человека в марганце составляет 6–10 мг, у детей — 3,63–7,54 мкмоль/кг массы тела (то есть значительно выше). Общее количество в организме составляет около 20 мг (Базарнова М.А., Морозова В.Т. (ред.), 1986), он содержится во всех органах и тканях. Концентрация в крови составляет 1,45–1,80 мкмоль/л (8–10 мкг/100 мл). 40–60% содержащегося в крови марганца находится в эритроцитах. Концентрация марганца в тканях составляет в среднем 0,01 мМ. Выводится с калом (в моче содержится в следовых количествах).
Состояние костной ткани меняется при недостатке или избытке в пище марганца (Мецлер Д., 1980; Смоляр В.И., 1989; Циприян В.И. (ред.), 1999). Он является необходимым компонентом пищи. Дефицит марганца обусловливает:
- нарушение биосинтеза кислых мукополисахаридов, активизацию биосинтеза гиалуроновой кислоты, хондроитинсульфата; снижение содержания в костной ткани гексуроновых кислот, глюкозамина, галактозамина;
- замедление роста костей;
- укорочение длинных костей скелета, искривление костей и позвоночника у экспериментальных животных, нарушение роста, задержку окостенения;
- накопление в организме перекисных соединений;
- остеопороз, замедленное сращение костей;
- анемию.
Кроме перечисленного, недостаток Mn2+ приводит к дегенерации ткани яичников и семенников, нарушению продукции половых гормонов, опосредованно влияя на метаболизм костной ткани. Сниженное содержание концентрации марганца в крови наблюдается у пациентов с пептической язвой, анемией, экземой.
Избыток марганца проявляется повышением его содержания в кости, развитием «марганцевого рахита», пневмонии, цирроза печени, поражением центральной нервной системы. Прием кальция усиливает дефицит марганца, поскольку ухудшает его усвоение. Абсорбцию марганца снижают железо, фосфаты (Смоляр В.И., 1989). Высокие дозы марганца могут вызвать анемию, устраняемую повышением содержания железа в рационе. Экспериментально вызванный недостаток марганца в организме животных, кроме укорочения и искривления костей, сопровождается увеличением суставов, заболеванием «соскользнувших сухожилий», нарушением репродуктивной функции. Повышение содержания марганца в крови отмечают у пациентов с туберкулезом легких, атеросклерозом, ревматизмом, лейкозом, инфекционным гепатитом, рахитом.
В костном метаболизме участвует фтор. Кальциевая соль фтора входит в состав костей (0,3% всех солей костной ткани). Он накапливается в кристаллах апатита (формируется фтор-апатит), в зонах костеобразования, повышает активность остеобластов (Hillier S. et al., 1996; Okano T., 1996). Фтор принимает участие в формировании дентина, зубной эмали. Он связывает кальций и способствует выведению его из организма с мочой, снижению концентрации в тканях. При этом выведение кальция из организма преобладает над поступлением и задержкой в тканях. Основным источником фтора является вода. Дополнительное потребление фтора с водой сопровождается усилением костного ремоделирования. Содержание фтора и других микроэлементов в продуктах питания представлено в табл. 1.5, суточных рационах взрослых — в табл. 1.6, детей и подростков — табл. 1.7.
Низкий уровень фтора в питьевой воде коррелирует с более высокой частотой переломов шейки бедра у лиц, потребляющих ее, то есть фтор защищает от переломов. Нормальное содержание фтора в питьевой воде составляет около 1,2 мг/л. Избыток фтора (флюороз) сопровождается нарушением синтеза коллагена, нарушением процесса роста у детей, развитием рахита, повреждением молочных зубов. Существует прямая зависимость между флюорозом и содержанием фтора в питьевой воде. Дозы фтора ниже 1,5 мг/сут предотвращают кариес, 12–25 мг/сут применяют для лечения постменопаузального остеопороза, переломов. Интоксикация фтором является фактором риска замедленной консолидации переломов при травматических повреждениях. В табл. 1.8 представлены суточная потребность детского населения Украины в основных пищевых веществах и безопасные уровни потребления микроэлементов.
В табл. 1.9 представлена суточная потребность взрослых в микроэлементах.
Наличие солей фтора (фторидов) в костях значительно снижает растворимость оксиапатитов. Под влиянием карбонатов и цитратов растворимость оксиапатитов повышается, что имеет негативные последствия. Поэтому соли фтора используются для профилактики кариеса. При недостатке фтора в пище экспериментальных животных повышается экскреция кальция и фосфора с мочой и калом, что приводит к отрицательному балансу кальция и снижению ретенции фосфора в организме, снижению содержания кальция в костях (Смоляр В.И., 1972). При избытке фтора в пище (10-кратное превышение суточной потребности) сначала возникает отрицательный баланс кальция и уменьшение задержки фосфора в организме. В дальнейшем снижается содержание кальция в костях ниже нормальных значений, а также активность ЩФ.
Влияние йода на состояние костной ткани реализуется опосредованно — через продукцию тироксина и трийодтиронина, которые регулируют процессы роста, полового и физического созревания. Эти гормоны ускоряют костное ремоделирование. У лиц с гипертиреозом отмечают снижение минеральной плотности осевого скелета. При дефиците йода в пище выявляют (Смоляр В.И., 1989):
- повреждение остеоцитов (пикноз, лизис ядра);
- увеличение зоны некроза;
- нарушение строения зон роста;
- изменения тинкториальных свойств кости.
Влияние йода на костную ткань недостаточно изучено. Йод влияет на синтез белков, жиров. Недостаточное поступление йода сопровождается развитием эндемического зоба, снижением гормональной функции щитовидной железы, разрастанием в ней соединительной ткани. Содержание йода в крови снижается при нефротическом синдроме, гипопротеинемиях, повышается — при лейкозах, гиперфункции щитовидной железы.
Йод поступает с продуктами питания, водой. Содержание йода в воде зависит от высоты нахождения колодца над уровнем моря: чем выше уровень, тем содержание йода ниже. При высоте 300–400 м содержание йода в воде составляет 3,79 мкг/л, 500–600 м — 1,76 мкг/л, 800 м — 0,51 мкг/л, 800–1000 м — 0,98 мкг/л (Савицкий И.В., 1973). Суточная потребность организма человека в йоде составляет 0,8–1,5 мкмоль (100–200 мкг) (Базарнова М.А., Морозова В.Т. (ред.), 1986). Всасывается йод в тонком кишечнике и поступает в печень. Всего в организме содержится 50 мг йода, из которых 30% — в щитовидной железе в виде органических соединений. В крови содержится 550–1200 нмоль/л (7–15 мкг/100 мл) йода в форме йодида и в связанном с белками виде. Содержание белково-связанного йода в плазме крови составляет 315,2–630,4 нмоль/л (4–8 мкг/100 мл). С мочой экскретируется 0,4 мкмоль йода.
В процессах синтеза эластина и коллагена — составных элементов матрицы хрящевой и костной ткани — участвует медь. Поэтому дефицит меди в организме сопровождается нарушением метаболизма этих тканей, с ним связывают развитие остеопороза, в том числе постменопаузального остеопороза у животных. Недостаточность потребления меди сопровождается снижением функции остеобластов, остеокластов, активности костного ремоделирования. При длительном и явно выраженном дефиците меди в рационе животных развивается рахитоподобный синдром, возникают неврологические нарушения, анемия, обесцвечиваются волосы, нарушается синтез гемоглобина. Медь необходима для функционирования соединительной ткани, сосудов. Аномалии артериальных сосудов, разрыв эластического слоя связывают с недостатком лизилоксидазы, необходимой для окисления лизина, в результате чего образуется десмозин — вещество, способствующее формированию поперечных связей в молекулах эластина. Превращение эпсилон-аминогруппы боковых цепей лизина в альдегидные группы в коллагене и эластине происходит под действием аминооксидазы, содержащей Cu2+. Нарушается функция воспроизведения и образования эластина, артерии становятся ломкими (у белка эластина недостаточно поперечных связей, поэтому артерии оказываются непрочными). Дефицит меди возникает у детей, получающих только молоко, у них развивается микроцитарная нормохромная анемия. При питании детей молоком с добавкой железа и витамина В12 возникает макроцитарная анемия, проходящая после введения меди. При недостатке меди у детей первого года жизни возникают костные нарушения (кроме анемии, нейтропении, диареи). Добавление к пище детей, больных рахитом, в течение 1 мес 1 мг меди способствует повышению задержки кальция (на 29,7%) и фосфора (на 11,5%) в организме (Смоляр В.И., 1972). При экспериментальном рахите у белых крыс медь также обусловила увеличение задержки кальция и фосфора и повышение содержания кальция в костях. Для взрослого человека верхним пределом является содержание меди 12 мг/кг рациона (Смоляр В.И., 1991) (потребность человека — 23 мг/сут). Общее содержание меди в организме человека составляет около 100 мг, поглощение и выделение меди строго регулируется. Регуляция очень важна, поскольку избыток меди оказывает токсическое действие. Медь активно реагирует с аминокислотами и белками, образует с биологически активными веществами устойчивые хелатные комплексы. Неорганической меди (в форме солей) в организме мало. В живых клетках она целиком находится в комплексе с белками. Служит эффективным катализатором, легко переходит из одного валентного состояния в другое. Может служить как донором, так и акцептором электронов. Ионы меди входят в активные центры большого числа катализаторов (ион меди является участком, в котором происходит взаимодействие с О2). Медьсодержащие белки осуществляют функцию одноэлектронного переносчика. Медьсодержащим ферментом является уратоксидаза, дофамин-β-гидроксилаза, тирозиназа (полифенолоксидаза). Главным медьсодержащим белком крови является церулоплазмин, на долю которого приходится 3% содержащейся в организме и 98% входящей в состав сыворотки крови меди. Церулоплазмин — голубой белок с молекулярной массой около 150 000, содержащий 8 ионов Cu+ и 8 ионов Cu2+. Церулоплазмин связан с регуляцией содержания меди в организме (депо и регулятор) и его содержание снижено при болезни накопления меди (болезни Вильсона). Этот белок обладает ферментативными свойствами: может катализировать окисление Fe2+ в Fe3+. Его еще называют ферроксидазой, поскольку после превращения Fe2+ в Fe3+ последний может присоединяться к трансферрину, который транспортирует железо. Церулоплазмин участвует в синтезе гемоглобина. Медь играет важную роль в антиоксидантных процессах благодаря наличию ее в составе супероксиддисмутазы. Медь, входящая в этот фермент, подвергается последовательному окислению и восстановлению в реакции с перекисными радикалами. Она необходима для биосинтеза фермента каталазы, которая разлагает перекись водорода. Медь усиливает действие инсулина, гормонов гипофиза, которые стимулируют развитие и функцию половых желез. Медь в незначительном количестве тормозит распад гликогена и тем самым способствует его сохранению в организме.
На состояние костной ткани активно влияет цинк. Считают, что его влияние на костное ремоделирование может быть опосредованным через регуляцию секреции щитовидной железой кальцитонина, активность эстрогенов (цинк влияет на половую функцию). У животных при недостатке цинка в рационе наблюдается задержка роста. Хронический дефицит цинка в организме сопровождается нарушением роста и развития скелета у детей (Смоляр В.И., 1989), а также полового развития. Задержку роста объясняют уменьшением биосинтеза белков, количества остеобластов, активности цинксодержащих ферментов в костной ткани. Дефицит цинка развивается при потреблении пищи со значительной долей злаков: содержащаяся в них фитиновая кислота препятствует всасыванию солей цинка из кишечника. У пациенток с постменопаузальным остеопорозом наблюдаются высокие показатели экскреции цинка с мочой. Данные литературы свидетельствуют о наличии взаимосвязи между обменом кальция и цинка (Wood R.J., Zheng J.J., 1997). Высокое потребление кальция лицами репродуктивного, старшего и преклонного возраста обусловливает снижение абсорбции цинка, его уровня в крови.
Цинк активирует ряд гормонов (половые, гонадотропный, тиреотропный, вазопрессин), продлевает гипогликемический эффект инсулина и, таким образом, косвенно влияет на состояние метаболизма костной ткани. Он входит в состав инсулина, тканевых белков, ДНК, большого количества ферментов, в том числе карбоангидразы, карбоксипептидазы, аргиназы, енолазы, лецитиназы, альдолазы. Ионы цинка необходимы для функционирования ЩФ, РНК- и ДНК-полимераз, дипептидаз, дегидрогеназ (лактат-, глутамат-, алкогольдегидрогеназы и др.). Цинк, являясь компонентом инсулина, подобно марганцу усиливает его действие. Он входит в состав гипофиза и половых желез. Ионы цинка, содержащиеся в ферментах, могут быть заменены ионами марганца или кобальта без снижения активности фермента. С цинком конкурируют медь, кадмий. Соли цинка вместе с ионами меди и кобальта повышают иммунитет, в частности фагоцитарную реакцию.
Содержится цинк в луке, шпинате, печени, грибах и зерновых, бобовых, других продуктах. Всасывается в тонком кишечнике, при этом выраженность всасывания зависит от содержания микроэлемента в крови и стенке кишок. Всасывание цинка угнетают кальций и медь. Суточная потребность организма человека в цинке составляет 10–15 мг (Базарнова М.А., Морозова В.Т. (ред.), 1986) и резко (в 2–3 раза) возрастает в период роста и полового созревания. Общее содержание цинка в организме — 1,4–2,3 г. В плазме крови содержится 46–61 мкмоль/л (0,3–0,4 мг/100 мл) цинка. Снижение содержания цинка в плазме крови отмечается при мальабсорбции, катаболических состояниях (после травмы, тяжелых операций), циррозе печени (в том числе алкогольном), сахарном диабете, анемиях, острых и хронических инфекционных заболеваниях, нефрите, лейкозах, злокачественных новообразованиях. Повышение концентрации цинка в крови характерно при гипертиреозе, полицитемии, гемолизе эритроцитов различного генеза (в них содержится 153–214 мкмоль/л или 11,4 мг/100 мл, то есть значительно выше, чем в плазме крови), эозинофилии, при проведении лучевой терапии.
При определении концентрации цинка в плазме крови следует брать кровь натощак, поскольку после еды его концентрация может снижаться на 20% (Маршалл В.Дж., 2002). В связи с тем, что цинк связывается с альбумином, его концентрация в плазме крови должна оцениваться в сопоставлении с концентрацией альбумина.
Важное значение для профилактики остеопороза имеет достаточное поступление в организм титана: при формировании костей, их росте, заживлении переломов потребление титана значительно повышается (необходим для роста и дифференциации скелета).
В процессах костеобразования участвуют бор, ванадий. Их достаточное поступление в организм имеет профилактическое значение. Бор регулирует активность ПТГ и через него — обмен кальция, магния, фосфора и холекальциферола. Он влияет на обмен кальция, фосфора и магния независимо от витамина D3. Ванадий препятствует развитию кариеса, способствует минерализации зубов. Потребление ванадия в норме составляет 2 мг/сут, в организме его содержится около 30 мг. Он может выполнять в организме окислительно-восстановительные функции. Ванадий в высоких дозах ингибирует синтез холестерина, снижает содержание в крови фосфолипидов и холестерина. Следовые количества олова и ванадия необходимы для роста молодых животных, хотя их роль в метаболизме не установлена. Обогащение рациона ванадием способствует повышению выведения кальция с мочой и калом, его отрицательному балансу, снижению содержания кальция в костной ткани (Смоляр В.И., 1972). У животных с недостатком железа в пище добавление ванадия вызывает снижение экскреции кальция с мочой и калом и повышение содержание кальция в костях скелета.
Молибден — один из немногих тяжелых металлов, необходимых для организма, а также для функционирования костной ткани. Молибден участвует в азотистом, пуриновом обменах, активирует деятельность ряда окислительно-восстановительных ферментов. Входит в состав ксантиноксидазы, которая катализирует окисление гипоксантина и ксантина до мочевой кислоты, а также в состав альдегидоксидазы, ксантиндегидрогеназы, сульфитоксидазы. От наличия молибдена зависит активность этих ферментов (молибдензависимых), а также ЩФ. С молибденом в организме может конкурировать вольфрам: он препятствует включению молибдена в молекулы ферментов.
Суточная потребность организма человека в молибдене составляет 1,59–3,2 мкмоль (0,15–0,3 мг). Общее содержание его в организме — около 20 мг. Содержится в костях, надпочечниках, других тканях (Базарнова М.А., Морозова В.Т. (ред.), 1986). Средняя концентрация металла в крови составляет 0,16 мкмоль/л (1,5 мг/100 мл). Избыток молибдена сопровождается задержкой роста костей вследствие нарушения обмена меди и фосфора. При этом резко повышается синтез ксантиноксидазы и в 3 раза повышается содержание мочевой кислоты, возникает молибденовая подагра. При уменьшении количества молибдена в организме человека может возникнуть «эндемическая» молибденовая подагра вследствие нарушения пуринового обмена.
Молибден содержится в зерновых и бобовых продуктах, печени, почках. Всасывание его происходит в тонком кишечнике, выводится с мочой и калом.
В кристаллическую решетку гидроксиапатита попадают (встраиваются) ионы тяжелых металлов — свинец, радий, уран, стронций. Стронций обладает тропными свойствами по отношению к костной ткани, его источником является растительная пища, молоко. После всасывания стронция в тонком кишечнике он накапливается в костях (99%). Являясь антагонистом кальция, включается в кристаллы решетки оксиапатита (фиксируется гликозамингликанами), участвует в процессах оссификации (стронций обменивается с кальцием на поверхности кости). При наличии дефицита кальция в рационе всасывание в кишечнике стронция увеличивается в 2 раза (Поворознюк В.В., 1997). Увеличение всасывания радионуклидов, тяжелых металлов обусловливает также дефицит белка. Стронций является постоянной составляющей тканей животных. Общее его содержание в организме человека — около 0,01–0,1 мг/кг массы тела, но наибольшее его количество имеется в костях. Содержание стронция в костях зависит от возраста. В невысоких дозах он необходим для формирования костной ткани, в больших — тормозит этот процесс. Радиоактивный стронций 89Sr в значительных концентрациях накапливается в костях (особенно молодых животных) и этим задерживает образование фосфорно-кальциевых солей, которые входят в состав скелета. 90Sr, образующийся при ядерных взрывах, очень медленно распадается (период полураспада составляет 27,7 года) и поэтому долго находится в воде, почве. Попадая в организм с пищевыми продуктами, 90Sr длительное время влияет на него негативно.
Для нормального развития костей необходим кремний. При его дефиците нарушается структура хрящей и костной ткани, их функции, снижается их плотность, возникают структурные деформации. Кремний имеет особое значение для стабилизации кислых гексозаминогликанов соединительной ткани.
Существенным компонентом пищи является селен. Отсутствие его в пище животных обусловливает развитие некротических процессов в печени, поджелудочной железе, мышечную дистрофию, кардиомиопатию. Вместе с α-токоферолом является частью антиоксидантной системы, которая защищает клеточные мембраны, другие структуры от оксидантного влияния свободных радикалов. Селен входит в состав важного антиоксидантного фермента — глутатионпероксидазы, — катализирующего реакцию окисления глутатиона. Фермент является главным средством защиты от накопления в клетках Н2О2 и органических перекисей. Глутатионпероксидаза также разрушает перекиси жирных кислот. Некоторые из селенопротеинов могут служить посредником при передаче электронов от восстановленного глутатиона на систему цитохромов.
Концентрацию селена можно определять в плазме крови, однако более точно содержание селена в тканях отражает определение активности глутатионпероксидазы.
В тканях организма, в том числе в костях, выявляют алюминий. Он необходим для регенерации костной ткани, формирования соединительной ткани и эпителия. Относительно большое количество алюминия содержится в поджелудочной железе, железах желудка, что свидетельствует о его роли в их функции. Наибольшее количество (0,25 мг%) выявлено в головном мозге. Костная ткань является депо для поступающего в организм алюминия. Загрязнение среды отходами алюминия в результате металлургического производства способствует развитию остеопении и остеомаляции. При избыточном поступлении возникает «алюминиевая болезнь» с накоплением микроэлемента в печени и мозге, снижается абсорбция кальция в кишечнике. Избыток алюминия оказывает токсическое действие на остеобласты, нарушает структуру и функцию кости, задерживает костеобразование. Подобное негативное действие на костную ткань оказывает галлий. Его влияние сопровождается гиперкальциемией, снижением плотности костной ткани.
Для функционирования костной ткани важное значение имеет кобальт, одним из механизмов действия которого является влияние на белковый обмен (усиливает обмен нуклеиновых кислот). Дефицит кобальта обусловливает нарушения кроветворения, синтеза гемоглобина, регенерации эритроцитов, общее истощение.
Никель влияет на состояние костной ткани опосредованно — через функцию поджелудочной железы: усиливает образование инсулина.
В костной ткани накапливается значительная (20–95%) часть поступающего в организм свинца. Потребность в микроэлементе составляет 0,35–0,50 мг в сутки (Смоляр В.И., 1991). При загрязнении свинцом больших городов отмечается его встраивание в костную ткань, снижение прочности кости. Он преимущественно локализуется в компактной части трубчатых костей (Смоляр В.И., 1989; Авцын А.П. и соавт., 1991), влияет на их формирование и рост. Свинец замещает кальций в костной ткани, накапливается в дентине, при этом уровень его накопления в зубах выше, чем в костной ткани. Свинец может освобождаться при деминерализации костей и вызывать интоксикацию. При высоком потреблении кальция с пищей всасывание свинца снижается и наоборот (конкуренция между ними происходит на уровне всасывания). При отравлениях свинцом необходим усиленный прием кальция, белков (молока). Всасыванию свинца в кишечнике способствует витамин D. Кроме кальция, антагонистом свинца является цинк: он снижает содержание свинца в костях, ослабляет токсическое действие.
1.2.3. Витамины
Витамин D имеет чрезвычайно важное значение для костной ткани. Его основная функция состоит в регуляции обмена кальция (собственно регуляторами обмена являются полярные гидроксилированные метаболиты витамина D). Эти метаболиты рассматриваются как стероидные гормоны. Витамин D существует в виде нескольких соединений. Наибольшей биологической активностью обладают D2 (эргокальциферол) и D3 (холекальциферол), содержащиеся в природных продуктах. Витамины D2 и D3 подвергаются в организме аналогичным метаболическим превращениям и оказывают одинаковое физиологическое действие (Маршалл В.Дж., 2002). Поэтому термины «холекальциферол» и «витамин D» часто используются для обозначения обеих форм витамина. У большинства людей основным источником, по мнению автора, является эндогенный синтез. Пищевая недостаточность витамина D наблюдается у лиц, имеющих одновременно снижение эндогенного синтеза. Витамин D2 (эргокальциферол) образуется из эргостерина под действием ультрафиолетового облучения. Предшественником витамина D3 является холестерин. При солнечном облучении или лампой ультрафиолетового излучения поверхности тела 7-дегидрохолестерин превращается в активный витамин D3 в поверхностных слоях кожи. Дефицит витамина D в рационе детей сопровождается нарушением фосфорно-кальциевого обмена, отложения в костной ткани фосфата кальция и возникновением рахита. Нарушается остеогенез, возникает остеомаляция — размягчение костей. Мягкие кости деформируются, задерживается появление зубов и развитие дентина. У взрослых при дефиците витамина D развивается остеопороз, из-за хрупкости костей возникают переломы.
Из витамина D образуются активные метаболиты: 1,25-дигидроксихолекальциферол (1,25-(ОН)2D3) и 24,25-дигидроксихолекальциферол (24,25-(ОН)2D3). Предшественником этих метаболитов является основная циркулирующая форма всех кальциферолов — 25-гидроксихолекальциферол. Процесс гидроксилирования структуры витамина D происходит в печени у 25-го атома углеророда, в почках — у 1-го. У больных с поражением почек часто развивается деминерализация костей (почечная остеодистрофия). Кроме почек специфическая 1α-гидроксилаза содержится в костной ткани и плаценте. 1,25-(ОН)2D3 участвует в регуляции всасывания кальция и фосфора в кишечнике (транспорта этих ионов через клеточные мембраны), резорбции костной ткани, реабсорбции кальция и фосфора в почечных канальцах. В результате действия витамина повышается содержание ионов кальция и фосфора в крови. При рахите в силу недостатка витамина D все эти процессы нарушаются, возникает деформация костей скелета (грудной клетки, конечностей, черепа). По своей активности 1,25-(ОН)2D3 в 10 раз превышает активность исходных кальциферолов. 24,25-(ОН)2D3 регулирует процессы остеогенеза и ремоделирования костной ткани, повышает чувствительность клеток к 1,25-(ОН)2D3. Важным фактором регуляции физиологических процессов в организме является наличие определенных соотношений между метаболитами витамина D3. Витамин D3 содержится в продуктах животного происхождения: сливочном масле, желтке яиц, печени, рыбьем жире; D2 — в растительных маслах: подсолнечном, оливковом и др. Кроме полноценного питания, включающего указанные продукты, для профилактики рахита необходимо ультрафиолетовое облучение кожи. Суточная потребность в витамине D для детей составляет от 100 до 400 МЕ, для взрослых — 400–500 МЕ. По данным M.E. Holick (1998), у лиц в возрасте от 51 года до 70 и более лет рекомендованный уровень потребления витамина D составляет 400 МЕ для мужчин, 600 МЕ — для женщин. Некоторые исследователи считают, что даже при полноценной диете потребность организма в витамине не может быть полностью обеспечена и поэтому необходимо дополнительно принимать его препараты в течение всей жизни. Прием 1000–1500 МЕ в сутки может вызвать интоксикацию (Смоляр В.И., 1991). При экспериментальном гипервитаминозе D у животных наблюдается усиленное отложение гидроксиапатита в костях, внутренних органах (кальцификация сосудов, почек). Эти отклонения исчезают после прекращения приема витамина. Интоксикация витамином D у животных и человека сопровождается рассасыванием костей (наступает их деминерализация, переломы), повышением содержания кальция в сыворотке крови (Уайт А. и соавт., 1981). Этот эффект обусловлен 1,25-дигидроксихолекальциферолом: при нефрэктомии не отмечается мобилизации кальция костной ткани. Гипервитаминоз D сопровождается нарушением функции почек. Повышенное содержание кальция и фосфатов в крови обусловливает образование камней в мочевыводящих путях.
При гипервитаминозе выявлено изменение деятельности сердечно-сосудистой системы (Слободян Л.М., 1981):
- увеличивается длительность интервала PQ;
- уменьшается длительность электрической систолы и комплекса QRS;
- изменяется форма зубцов Р и Т;
- нарушается ритм сердца в виде экстрасистолии, АV-блокад;
- повышается кровенаполнение сосудов, появляются периваскулярные геморрагии;
- развивается паренхиматозная дистрофия;
- в мышце сердца периваскулярно откладываются соли кальция.
Механизмы воздействия витамина D на состояние костной ткани включают:
- влияние на трансмембранный транспорт (всасывание) кальция и неорганического фосфата в кишечнике;
- реабсорбцию в почечных канальцах;
- кальцификацию костей;
- влияние на функциональное состояние щитовидной, паращитовидных, половых желез.
Витамин D участвует в биосинтезе Са2+-связывающих белков, необходимых для всасывания ионов кальция в кишечнике, реабсорбции Са2+ в почках и мобилизации кальция из костей.
Витамин D3 оказывает многогранное воздействие на метаболические процессы в организме:
- принимает участие в регуляции пролиферации и дифференциации клеток всех органов и тканей;
- является одним из регуляторов обменных процессов (минерального, белкового, липидного);
- участвует в синтезе ферментов, гормонов (ПТГ, тиреотропина, ГК, пролактина, гастрина, инсулина и др.), рецепторных белков;
- влияет на иммунную резистентность организма;
- от него зависит функциональная активность органов дыхания, сердечно-сосудистой системы, органов пищеварения и др. Витамин D влияет на метаболизм соединительной ткани, хряща, кости. Снижение содержания активных метаболитов витамина D в крови коррелирует с потерей хрящевой ткани, прогрессированием рентгенологических изменений в коленных, тазобедренных суставах, позвоночнике. Дефицит кальция и витамина D сопровождается усилением синтеза ПТГ, отложением кальция в суставном хряще (Fujita T., 1997).
Витамин D3 непосредственно влияет на структуру и функцию клеточных мембран, на активность ферментов, транспорт кальция. В ответ на введение витамина D повышается содержание кальцийсвязывающих белков, участвующих в процессе всасывания кальция в кишечнике. Продукты метаболизма витамина D влияют на мышцы и другие ткани.
Дефицит витамина D, обусловливающий развитие рахита и остеомаляции, выявляют относительно часто, особенно у недоношенных детей, людей пожилого возраста, при мальабсорбции. Витамин необходим для профилактики вторичного гиперпаратиреоза, остеопороза, лечения остеоартроза. При недостаточном солнечном освещении необходимо применение витамина D для предотвращения развития остеомаляции. Дефицит кальциферола наблюдается у детей раннего возраста, беременных, у лиц пожилого возраста, не потребляющих продуктов животного происхождения, проживающих на Крайнем Севере. Недостаточность витамина D развивается у больных с патологией печени и почек: нарушается образование активных форм витамина D. В клинической практике используются природный витамин D (в составе рыбьего жира) и синтетический (эргокальциферол, холекальциферол), активные метаболиты (25-гидроксикальциферол). Следует отметить, что прием избыточных количеств витамина D в течение длительного времени обусловливает деминерализацию костей. Важным показателем обеспеченности организма кальциферолом В.И. Смоляр (1991) считает содержание в сыворотке крови кальция (в норме — 0,1 г/л), фосфора (0,05 г/л), кальциферола (в норме — 60–200 МЕ/100 мл). Содержание кальциферола и других витаминов в пищевых продуктах представлено в табл. 1.10.
Содержание витамина D в организме оценивают лабораторным методом путем определения концентрации в плазме крови 25-гидроксихолекальциферола (кальцидиола) — основного циркулирующего метаболита. Отмечены сезонные колебания его содержания в крови: летом оно выше, чем зимой. Развитие рахита у детей, остеомаляции у взрослых обусловливает снижение синтеза, поступление витамина с пищей, нарушение метаболизма холекальциферола, мальабсорбцию.
Витамин А (ретинол) является предшественником группы «ретиноидов», к которой относятся ретиналь и ретиноевая кислота. Ретинол образуется при окислительном расщеплении провитамина β-каротина. Ретиноиды содержатся в продуктах животного происхождения, β-каротин — в свежих фруктах и овощах. Ретиноевая кислота выполняет функции ФР. Она нужна для роста костей и поддержания нормальной секреторной функции слизистых оболочек. Витамин А необходим для синтеза мукополисахаридов. Он влияет на минеральный обмен: при авитаминозе повышается содержание в тканях кальция, фосфора, магния. Лишение животных витамина А в эксперименте обусловливает нарушение роста скелета (раньше, чем мягких тканей). Так, рост спинного мозга при остановке роста костей позвоночника сопровождается сдавлением нервных корешков, нарушением иннервации органов и тканей. Прекращение роста связывают с нарушением синтеза хондроитинсульфата. Недостаточность витамина А у человека проявляется задержкой роста, сухостью кожи и волос, гемералопией (куриной слепотой), конъюнктивитом, поражением слизистых оболочек дыхательных путей и пищеварительного тракта, их кератинизацией, низкой сопротивляемостью к инфекциям, снижением образования гликопептидов. Витамин А обеспечивает синтез дисульфидных связей в молекулах коллагена, фибронектина. Он принимает участие в метаболизме стероидов, тироксина, участвует в синтезе белков, регуляции структуры костей. Следствием избыточных (нелетальных) доз витамина А у животных являются множественные переломы длинных костей в результате резорбции кости. Потребление детьми витамина А в избыточных дозах обусловливает деформацию костей, что связывают (Уайт А. и соавт., 1981б) с деполимеризацией и гидролизом хондроитинсульфата. В плазме крови витамин А транспортируется в комплексе с особым ретинолсвязывающим белком (молекулярная масса — 21 000). Белок насыщен ретинолом и связан с другим белком сыворотки крови — преальбумином. В тканях присутствуют ретинолсвязывающие белки и белки, связывающие ретиноевую кислоту. Для поддержания нормального содержания витамина А в плазме крови необходим цинк. Потребность взрослого человека в витамине А составляет около 0,7 мг/сут (1 мг ретинола соответствует 3300 МЕ).
Коцентрацию витамина А определяют в плазме крови, в которой он транспортируется в форме, связанной с преальбумином и специфическим ретинолсвязывающим глобулином. Следует учитывать, что низкая концентрация связывающего белка может стать причиной снижения концентрации витамина А в плазме крови и нарушения его доставки при достаточных запасах витамина в печени.
Витамин Е. Имеет важное значение для метаболизма костной ткани (витамин Е включает токоферол и группу родственных соединений с хромановым циклом). Так, повышенное содержание витамина Е в пище животных сопровождается увеличением на 40% синтеза активных метаболитов витамина D в почках и всасывания кальция. Он является основным пищевым антиоксидантом. Физиологическая потребность в витамине Е составляет для взрослых 10 мг, детей — 3–15 мг (Смоляр В.И., 1991). Она зависит от уровня потребления жиров.
Дефицит витамина Е в организме может развиться в случаях:
- избыточного потребления полиненасыщенных жирных кислот;
- больших физических нагрузок (у спортсменов);
- искусственного вскармливания;
- заболеваний органов пищеварения, сопровождающихся нарушением всасывания жиров.
Для ненасыщенных жирных кислот токоферолы являются эффективными антиоксидантами. Их дефицит сопровождается усилением свободнорадикального окисления (СРО), деструктивным процессом в стенках сосудов, тканях, гемолизом эритроцитов. Нарушается структура эластических волокон, деструкция стенки сосуда сопровождается кальцинозом. Их главная функция состоит в том, что они служат антиоксидантами по отношению к ненасыщенным липидам, защищают липидные мембраны (остатки ненасыщенных жирных кислот) от действия свободных радикалов. Радикалы, образующиеся под действием ферментов или в неферментативных реакциях, катализируемых следовыми количествами металлов с переменной валентностью, могут инициировать цепную реакцию. В этой реакции происходит регенерирование радикала R. и одновременное образование органической перекиси, которая может распадаться на два радикала, вступающие в последующие реакции. Таким образом, развивается аутокаталитический процесс, обусловливающий быстрое прогоркание жиров. Процесс сопровождается различными разрывами цепи и реакциями димеризации. Токоферолы в небольших количествах ингибируют перекисное окисление жиров: токоферолы захватывают радикалы и образуются более устойчивые радикалы токоферола, способные димеризоваться или вступать в реакцию с другими радикалами, прерывая цепь реакции. Такая функция витамина Е подтверждена в исследованиях на животных с использованием синтетического антиоксиданта N,N-дифенил-n-фенилендиамина (Мецлер Д., 1980). (Следует отметить, что, по мнению А. Ленинджера (1985), in vivo подобные цепные реакции эффективно контролируются витамином Е, аскорбиновой кислотой, антиоксидантными ферментами). Неблагоприятным последствием перекисного окисления липидов считается образование малонового альдегида в результате обусловленного радикалами разрыва полиненасыщенных кислот. Этот бифункциональный альдегид образует шиффовы основания с аминогруппами белка, выступая в качестве сшивающего агента. В результате сшивки образуются липофусцины (пигменты изнашивания) — нерастворимые липидбелковые комплексы.
Замена в экспериментальных исследованиях токоферолов синтетическим антиоксидантом N,N-дифенил-n-фенилендиамином (Мецлер Д., 1980) не устраняла все болезненные симптомы авитаминоза Е. Это свидетельствует о том, что токоферолы играют специфическую роль на уровне мембран. Предполагают, что она может представлять собой защиту каких-то компонентов системы переноса электронов или непосредственное участие в окислительно-восстановительных процессах.
Клинический дефицит витамина Е может развиться при тяжелых нарушениях всасывания, особенно у детей. Дефицит витамина Е, кроме негативного влияния на состояние костной ткани, является этиологическим фактором развития атеросклероза, ишемической болезни сердца, заболеваний печени, желчевыводящих путей. Недостаточность витамина Е у животных вызывает алиментарную мышечную дистрофию, истощение, гемолитическую анемию, неврологические нарушения. Содержание витамина Е в сыворотке крови составляет 0,006–0,008 г/л. По мнению Д. Мецлера (1980), вероятная потребность в токоферолах составляет около 5 мг/сут и еще 0,6 мг на каждый грамм потребляемых полиненасыщенных жирных кислот. Поступление токоферолов в организм человека составляет около 14 мг/сут.
Витамин К. У пациентов с остеопоротическими переломами обнаруживают сниженное содержание витамина К в сыворотке крови. И, наоборот, его высокое содержание в рационе коррелирует со сниженной частотой переломов бедра. С возрастом содержание витамина К в сыворотке крови снижается. Имеющийся в костях белок, содержащий три остатка γ-карбоксиглутаминовой кислоты, участвует в регуляции связывания кальция в костях и зубах. Так как витамин К необходим для образования остатка γ-карбоксиглутаминовой кислоты в ферментах свертывания крови, то А. Уайт и соавторы (1981б) предполагают, что этот витамин участвует в регуляции метаболизма кальция в костях и зубах. При дефиците витамина К в почечных канальцах снижается содержание витамин К-зависимого кальцийсвязывающего белка и реабсорбция кальция. Эти изменения создают предпосылки для развития остеопороза. Витамин К принимает участие в карбоксилировании остеокальцина. Декарбоксилирование остеокальцина у пациентов, получающих кумариновые антикоагулянты, сопровождается снижением МПК (Fiore C.E. et al., 1990). Нарушение транспорта, функционирования, недостаточное потребление витамина К с пищей опосредованно через биосинтез остеокальцина оказывает влияние на функцию остеобластов. Результаты исследований in vitro (Akedo Y. еt al., 1992; Koshihara Y. еt al., 1992) свидетельствуют, что витамин К является модулятором пролиферации остеобластов и минерализации.
Выраженный дефицит витамина К развивается у пациентов с холестазом, механической желтухой. Недостаточность витамина К обусловливает понижение содержания протромбина, некоторых других факторов свертывания крови (V, IX, Х). В отсутствие витамина К в печени образуется дефектный протромбин, не способный связывать ионы кальция, необходимые для последующего связывания протромбина с фосфолипидами и активации его в тромбин. Функция витамина К заключается в том, что он содействует включению дополнительных карбоксильных групп в остатки глутамата в предобразованном протромбине. Такая модификация вызывает повышение способности к связыванию ионов кальция. Для участия в карбоксилировании остатков глутамата необходима гидрохинонная форма витамина и О2. Сильными антагонистами витамина К являются дикумарол и родственный с ним варфарин (ингибирует карбоксилирование глутамата). Нафтохиноновое кольцо витамина может служить окислителем в системе переноса электронов. Эта особенность придает витамину К и антиоксидантные свойства. В целом роль витамина в метаболизме костной ткани, развитии остеопороза нуждается в дальнейшем изучении.
Определения концентрации витамина К в крови для установления диагноза «гиповитаминоз» не требуется: о его содержании в организме можно судить по продолжительности протромбинового времени.
Витамин С (L-аскорбиновая кислота) представляет собой γ-лактон-2,3-дегидрогулоновой кислоты. Обе гидроксильные группы имеют кислотный характер, в связи с чем при потере протона соединение может существовать в форме аскорбат-аниона (Кольман Я., Рем К., 2000). У человека, приматов, морской свинки отсутствует фермент гулонолактон-оксидаза, катализирующий последнюю стадию превращения глюкозы в аскорбат. Поэтому они нуждаются в ежедневном поступлении витамина с пищей. Витамин С обладает восстановительными свойствами и легко окисляется в дегидроаскорбиновую кислоту. Представляет собой слабую кислоту, способную образовывать комплексы с металлами. Хотя аскорбиновая кислота обладает антиоксидантными свойствами, в присутствии трехвалентного железа она может способствовать образованию свободных радикалов. Витамин С принимает участие в качестве восстановителя во многих реакциях (главным образом в реакциях гидроксилирования). Участвует в гидроксилировании пролина, тирозина, диоксифенилаланина, стероидных гормонов, окислении гомогентизиновой кислоты. Он служит для поддержания металлсодержащих катализаторов в восстановленном состоянии. Фермент дофамин-β-гидроксилаза использует аскорбиновую кислоту в роли истинного субстрата при синтезе норадреналина. Эта реакция протекает в нейронах мозга, в надпочечниках (содержание аскорбиновой кислоты в них высокое). С участием аскорбиновой кислоты осуществляется синтез коллагена, стероидных гормонов, катехоламинов, гликогена, альбумина, протромбина, деградация тирозина, желчных кислот. При недостатке витамина С в организме отмечается поражение сосудистых стенок, хрящевой и костной ткани. Фибробласты, остеобласты, одонтобласты перестают синтезировать коллаген в костях, дентине зубов. Нарушаются образование гликопротеингликанов, структурно-функциональные свойства хрящевой и костной ткани. Изменения в синтезе гликозамингликанов сопровождаются повышением содержания гиалуроновой кислоты в костной ткани в несколько раз, в то же время биосинтез хондроитинсульфатов замедляется. Цинга в тяжелой стадии проявляется геморрагическим синдромом, остеопорозом, патологическими переломами костей, выпадением зубов. Аскорбиновая кислота принимает участие в гидроксилировании пролина и лизина при синтезе коллагена, в гидроксилировании проколлагена. Предотвращение простуды, возможно, обусловлено повышенным гидроксилированием коллагена. В формировании и стабилизации трехспиральной молекулы коллагена важную роль играет гидроксилирование пролина и лизина в оксипролин и оксилизин. Оно осуществляется ферментами пролил- и лизилгидроксилазами в присутствии кофакторов (витамин С, О2, Fe++, α-кетоглютарат) с последующим глюкозированием, то есть присоединением моно- и дисахаридов к оксилизиновым остаткам с помощью ферментов гликозил- и галактозил-трансфераз. В условиях дефицита витамина С, а также О2, Fe2+ и др. выделяется негидроксилированная форма коллагена — протоколлаген. Предполагают, что коллагенолиз регулируется сочетанием трех механизмов:
1) стимуляцией синтеза коллагеназы в клетках гормонами, ПГ, факторами, секретируемыми тучными клетками, лимфоцитами, эпителием и др.;
2) активированием проколлагеназы;
3) ингибированием активной коллагеназы. Нарушение выработки нормального коллагена сопровождается нарушением процесса обызвествления. Аскорбиновая кислота является ингибитором гиалуронидазы, повышает синтез и активность ИФ. Она усиливает желудочную секрецию, всасывание железа в кишечнике. При высоком содержании аскорбиновой кислоты происходит более быстрое заживление ран. Почками выделяется 20–30 мг/сут аскорбиновой кислоты. Содержание ее в плазме крови составляет 7–12 мг/л, в лейкоцитах — 200–300 мг/л. Суточная потребность составляет 60 мг (в разных рекомендациях необходимая доза витамина С составляет от 30 до 70 мг). Для предотвращения цинги требуется 10 мг витамина С в сутки, однако и при этом уровне наблюдаются клинические симптомы (хрупкость мелких капилляров кожи).
Биофлавоноиды (витамин Р). Взаимодействуя с аскорбиновой кислотой, биофлавоноиды регулируют образование коллагена, препятствуют деполимеризации гиалуроной кислоты гиалуронидазой. Их источником являются свежие фрукты, ягоды (черноплодная рябина, черная смородина, яблоки, виноград), а также шиповник, чай. Потребность составляет 25–50 мг в сутки. Как природные антиоксиданты флавоноиды способны к восстановлению свободных радикалов (О2-·, ОН·, NО·, RO·, ROO·). Они подавляют образование активных форм кислорода, ингибируя окислительно-восстановительные ферменты (монооксигеназы, циклооксигеназы, липооксигеназы, ксантиноксидазу, никотинамидадениндинуклеотидфосфат-оксидазу). Флавоноиды обладают противовоспалительным, антивирусным, антиаллергическим, антиканцерогенным действием.
1.2.4. Другие факторы питания
Потере костной массы способствует избыточное потребление алкоголя и кофе. Кофеин и теофиллин снижают концентрацию цАМФ в почечных канальцах, тормозят на 40–50% превращение 25-гидроксивитамина D в 1,25-(ОН)2D3, что приводит к снижению всасывания кальция. Острая алкогольная интоксикация обусловливает снижение концентрации ПТГ в сыворотке крови, увеличение выделения кальция с мочой. Хроническое употребление алкоголя сопровождается снижением содержания в организме кальция, магния, калия, нарушением водно-солевого баланса. Нарушению водно-солевого обмена при злоупотреблении алкоголем способствует нарушение расщепления и всасывания пищевых продуктов в результате снижения активности пищеварительных ферментов. Обнаруживается низкое содержание в организме витамина D и его активных метаболитов (в результате активации алкоголем цитохрома Р450 в печени разрушается 25-гидроксивитамин D). Ежедневный прием более 55 мл водки мужчинами и 35 мл — женщинами оказывает токсическое воздействие на костную ткань. Результатом сочетания курения и злоупотребления алкоголем является уменьшение костной массы до 25%. Механизмы влияния различных факторов питания на состояние костной ткани представлены в табл. 1.11.
Данные мировой литературы свидетельствуют о недостаточном потреблении женщинами в постменопаузальный период кальция (около 600 мг/сут), магния, цинка, железа. С возрастом также снижается всасывание кальция в тонком кишечнике, особенно у лиц с остеопорозом. Результатом является усиление выхода кальция из костной ткани, отрицательный кальциевый баланс. Усвоение кальция снижено при наличии таких заболеваний органов пищеварения, как атрофический гастрит, язва желудка и двенадцатиперстной кишки, хронический гепатит, цирроз печени, желчнокаменная болезнь, хронический панкреатит с внутри- и внешнесекреторной недостаточностью, энтериты. Снижение всасывания кальция может быть обусловлено низкой обеспеченностью витамином D, нарушением соотношения кальция и других минералов в рационе. Результаты исследований, проведенных в Институте геронтологии АМН Украины (Поворознюк В.В. и соавт., 2002), свидетельствуют, что рацион украинской популяции является дефицитным по многим пищевым веществам. В частности, содержание в суточном рационе женщин старшего возраста белков растительного происхождения значительно ниже рекомендованного. Выявлен дисбаланс за счет уменьшения количества животных белков, который отрицательно сказывается на состоянии костной ткани. Установлено, что содержание в рационе жиров растительного происхождения также ниже рекомендованного. Люди пожилого и старческого возраста недостаточное потребление белков и жиров растительного происхождения компенсируют избыточным потреблением углеводов (крахмал, моно-, дисахариды), что отрицательно сказывается на структурно-функциональном состоянии костной ткани. Ниже рекомендованного уровень потребления основных макроэлементов — кальция, фосфора и магния, — необходимых для процессов костного ремоделирования. Лица старшего возраста в ограниченном количестве потребляют продукты, содержащие витамин D, хотя исследователи отмечают, что на фоне хронической кальциевой недостаточности возможно развитие парадоксального эффекта действия витамина D — ухудшение структурно-функционального состояния костной ткани, усиление резорбции кости. Данные, полученные в исследованиях В.В. Поворознюка и соавторов (2002б), свидетельствуют, что для питания женщин старшего возраста в Украине характерно снижение индекса полиненасыщенные жирные кислоты/насыщенные жирные кислоты. Дефицитный по многим пищевым веществам рацион обусловливает развитие остеопороза и требует соответствующей коррекции. Следует отметить, что в оптимальном по калорийности питании может быть скрытый недостаток витаминов, макро- и микроэлементов, дисбаланс этих ингредиентов. Суточный рацион взрослого человека должен содержать более 600 веществ, в том числе 17 витаминов, 20 аминокислот (Институт питания АМН СССР). При назначении добавок витаминов, других пищевых веществ в большинстве случаев следует учитывать суточную потребность в них.
Итак, приведенные данные свидетельствуют, что в генезе метаболических остеопатий большое значение имеет дефицит витаминов и минералов, дисбаланс микроэлементов. Растительные продукты богаты минералами и микроэлементами, но они содержатся в них в труднорастворимой форме. Поэтому необходимо включить в рацион продукты животного происхождения, из которых минеральные вещества легко усваиваются (хотя содержатся в меньшем количестве). Для нормального течения метаболических процессов в костной ткани необходимо достаточное (и в оптимальном соотношении) поступление с пищей белков, жиров, углеводов, сбалансированное содержание в рационе макро- и микроэлементов. Это условие следует соблюдать на протяжении всей жизни: в период роста, в репродуктивный период, в пожилом и старческом возрасте.
1.2.5. Взаимосвязь между обменом минералов, микроэлементов, витаминов, гормонов
Между этими и другими нутриентами существуют тесные функциональные взаимосвязи, о которых свидетельствуют следующие многочисленные факты:
- На всасывание Са2+ влияет концентрация Na+, активность ЩФ. Калий способствует всасыванию Са2+ и глюкозы в кишечнике. Углеводы усиливают выведение Са2+. Общее количество ионов калия, их соотношение с другими ионами имеет важное значение для обеспечения многих биоэнергетических процессов. От соотношения этих элементов зависит состояние нервно-мышечной возбудимости. Витамин D способствует транспорту Са2+ через мембрану энтероцита в кровь, при этом имеет значение соотношение кальций/фосфор. Гиповитаминоз D обусловливает снижение синтеза Са2+-связывающего белка, участвующего в процессе всасывания Са2+ в кишечнике. Витамин D стимулирует всасывание фосфора в кишечнике, способствует фиксации фосфорно-кальциевых солей в костной ткани. Нарушение обмена кальция сопровождается нарушениями обмена фосфатов и клинически проявляется изменениями костного скелета. При недостатке фосфатов всасывание Са2+ снижается. Гиперфосфатемия, гипермагниемия обусловливают отложение солей кальция в сосудах, органах и тканях, образование камней. При очень высоком содержании Са2+ в рационе появляются признаки недостаточности марганца в организме. От биосинтеза аденозинполифосфатов и поступления в организм сульфатов зависит образование гепарина.
- Повышение концентрации некоторых ионов может влиять на способность определенных органов реагировать на воздействие физиологически активных веществ: например, кальций в высоких дозах может препятствовать развитию приступа бронхоспазма, вызванного ингаляцией аэрозоля гистамина. Такой же эффект оказывает избыток кальция в питании. Недостаток кальция повышает чувствительность к гистамину.
- Углеводы усиливают выведение кальция и магния.
- Реабсорбция ионов Mg2+ и Са2+ осуществляется по сходным схемам. Повышенная экскреция одного из этих ионов сопровождается повышением выведения другого. Дефицит магния сопровождается снижением всасывания кальция в кишечнике, гипокальциемией, снижением уровня ПТГ, кальциферолов. Инсулин вызывает переход Mg2+ из плазмы крови в клетки. Содержание Mg2+ в костях и мягких тканях находится в обратном отношении с Са2+. При недостатке магния может повыситься содержание кальция в стенках артерий, миокарде, почках. Гипомагниемия может сочетаться с гипокальциемией.
- Имеется взаимосвязь между обменом марганца и витаминами А, В, С, D, Е. Всасывание марганца усиливается при сочетанном введении его с кобальтом, цинком, медью. Марганец может замещать магний и цинк в металлозависимых ферментах. Прием марганца в высоких дозах затрудняет всасывание железа и обусловливает анемию. Повышение содержания железа в рационе предотвращает ее развитие.
- Отмечен антагонизм между К+ и Na+ в отношении водного обмена.
- Всасывание Na+ в кишечнике зависит от присутствия аминокислот, глюкозы. Его угнетают ПГ, гастрин, секретин, холецистокинин.
- Резорбцию железа снижают оксалаты, фосфаты, повышают — аскорбиновая и янтарная кислота, фруктоза, сорбит, алкоголь.
- Медь способствует включению железа в протопорфирин, стимулирует всасывание железа в пищеварительном тракте, мобилизацию его из тканей. Она способствует депонированию глюкозы, снижает содержание фосфатов в крови. Медь усиливает действие инсулина, гипофизарных гормонов, необходима для синтеза йодтиронинов.
- Ионы меди, селена предотвращают негативные эффекты кадмия, ртути.
- Часто наблюдается повышение активности одного иона металла в присутствии другого. Явления синергизма отмечаются при совместном присутствии ионов меди и цинка, кобальта и железа.
- В ряде ферментов ионы цинка могут быть заменены ионами марганца или кобальта без явного снижения активности фермента. С цинком конкурируют медь и токсичный кадмий. Цинк активирует половые гормоны, тиреотропный и гонадотропный гормоны, вазопрессин. Имеется тесная связь между цинком и инсулином, цинк продлевает его гипогликемический эффект. Резорбцию цинка угнетают кальций и медь.
- Цинк необходим для поддержания нормальной концентрации витамина А в плазме крови.
- Кобальт стимулирует накопление в организме витамина А, В, С, К, никотиновой кислоты. Всасывание кобальта усиливается в смеси с другими микроэлементами и при дефиците железа в организме. Сочетания солей кобальта с медью эффективны при анемиях. Комплекс трехвалентного кобальта Co3+ с цианогруппой составляет основу витамина В12.
- Избыток молибдена обусловливает задержку роста костей вследствие нарушения обмена меди, кобальта (снижения их концентрации) и фосфора. Излишек молибдена активирует ксантиноксидазу, усиливает образование мочевой кислоты, может вызвать развитие подагры, анемии.
- Ионы хрома и никеля могут связываться с клеточными белками и вызывать аллергические реакции.
- Ионы ртути (Hg2+), кадмия (Cd2+) и стронция (Sr2+) вытесняют ионы биометаллов (Са2+, Mg2+, Zn2+) из соединений. Свинец и стронций вместо кальция откладываются в костях.
- При недостатке йода в пище избыток ионов кальция обусловливает прекращение включения йода в органические соединения, что приводит к недостаточному образованию тиреоидных гормонов и развитию зоба.
- Ионы фтора (при ежедневном введении 5 мг) вызывают ухудшение деятельности щитовидной железы у человека. Сочетанно с кальцием фтор может оказывать зобогенный эффект.
- На биосинтез, секрецию и действие ряда гормонов могут оказывать влияние поступающие с пищей соединения, содержащие серу, фенолоподобные растительные эстрогены, пептиды.
- Чрезмерное употребление этилового спирта вызывает нарушение обмена ферментов в печени, а затем возможно повышение содержания эстрогенов в организме, нарушение равновесия половых гормонов. Поступление с пищей недостающих предшественников ферментов — витаминов, микроэлементов способствует нормализации состояния.
- Имеется синергизм между половыми гормонами и витамином Е. Биосинтез эстрогенов и гестагенов в значительной степени зависит от поступления в организм витамина В1, В6, аминокислот, калия. Эстрогены, образующиеся в мужском организме, в нормальных условиях быстро разрушаются ферментами, содержащими активные группы из витаминов группы В. Нарушение образования и всасывания этих витаминов в кишечнике обусловливает гинекомастию.
- При длительной недостаточности витамина Е развивается недостаточность витамина А вследствие его разрушения в результате окисления из-за отсутствия в рационе витамина Е, обладающего антиоксидантными свойствами.
- Отмечены признаки недостатка витамина Е при α- и β-липопротеидемиях. При β-липопротеидемии выявлены значительные изменения в плазматических мембранах клеток слизистой оболочки кишечника. После введения витамина Е ультраструктура клетки нормализуется, что свидетельствует о важном значении витамина Е для метаболизма клеточных мембран. При нарушении всасывания липидов у пациентов с холестазом развивается дефицит витамина Е.
- Для нормального биосинтеза стероидных гормонов необходимо достаточное обеспечение коры надпочечников аскорбиновой кислотой. При увеличении поступления аскорбиновой кислоты в организм может замедляться разрушение гормонов коры надпочечников в процессе обмена веществ. Для биосинтеза кортикостероидов (КС) существенное значение имеют пантотеновая кислота, витамин В6.
- При недостатке строительного материала (белков, жиров, углеводов, минералов, микроэлементов), витаминов, ферментов, гормонов анаболического действия (эстрогенов, андрогенов, соматотропина) в недостаточном количестве образуется основное вещество костей, нарушается способность к захвату кальция.
Приведенные данные свидетельствуют о тесных и сложных (в полной мере не изученных) функциональных взаимосвязях между метаболизмом минералов, микроэлементов, витаминов, гормонов, ферментов, белков, углеводов (как в каждой группе, так и между представителями групп). Для поддержания нормального метаболизма, регенерации компонентов минерального и органического матрикса костной ткани необходимо адекватное постоянное комплексное (сбалансированное) снабжение аминокислотами, витаминами, минералами, микроэлементами. В связи с неполноценностью рациона жителей Украины по многим пищевым веществам следует также шире применять препараты витаминов, минералов, микроэлементов, биоантиоксидантов в качестве добавок к рациону. Дозы ингредиентов в таких комплексных препаратах должны соответствовать суточной потребности в них.