Для диагностики ОА в целях большей точности, оценки динамики заболевания и эффективности лечения в настоящее время применяют различные инструментальные методы исследования: рентгенографию, артроскопию, ультрасонографию, компьютерную томографию, магнитно-резонансную томографию (МРТ), сцинтиграфию, тепловидение.
С помощью указанных методик можно оценить толщину хряща и синовиальной оболочки, выявить наличие эрозий в хряще, определить характер и количество жидкости в различных отделах суставов. Особо следует подчеркнуть самые ранние изменения при ОА: от легкой шероховатости хряща до глубоких эрозий.
Артроскопия — прямое визуальное исследование полости сустава. Оно позволяет устанавливать воспалительные, травматические или дегенеративные поражения менисков, связочного аппарата, хряща, синовиальной оболочки. При этом есть возможность проведения прицельной биопсии пораженных участков суставов.
Гистоморфологические методы — биопсия синовиальной оболочки
Биопсию синовиальной оболочки проводят двумя способами — с помощью пункции сустава или во время артроскопии. В дальнейшем будут охарактеризованы различные патоморфологические изменения синовии, характерные для тех или иных нозологических форм поражения суставов. При диффузных заболеваниях соединительной ткани выполняют также биопсию кожи, внутренних органов.
Радиоизотопная сцинтиграфия
Радиоизотопную сцинтиграфию суставов проводят с помощью остеотропных радиофармацевтических препаратов (пирофосфат и др.), меченных 99mTc. Указанные препараты преимущественно накапливаются в местах активного костного и коллагенового метаболизма. Особенно интенсивно они накапливаются в воспаленных тканях суставов, что видно на сцинтиграммах суставов.
Метод радиоизотопной сцинтиграфии используют для ранней диагностики артритов, выявления субклинических фаз поражения суставов, дифференциальной диагностики воспалительных и дистрофических поражений суставов.
Термография
Термография (тепловидение) — метод исследования интенсивности инфракрасного излучения тканями. С помощью данного метода дистанционно измеряется температура кожи в области суставов, которая записывается на фотобумаге в виде контурной тени сустава.
Метод может считаться визуализирующим и в то же время индикаторным, поскольку позволяет судить об активности воспалительного поражения суставов.
Прямая визуализация суставного хряща (артроскопия)
На сегодняшний день лечение ОА направлено в основном на улучшение симптоматики, в первую очередь на устранение болевого синдрома. В процессе проводящихся в настоящее время исследований разрабатывают препараты, которые могут изменять течение ОА: предотвращать, задерживать развитие изменений в суставах или даже вызывать их обратное развитие. Проведение подобных исследований требует стандартизованных и воспроизводимых оценок изменений в суставах для четкой оценки результатов лечения. Это касается в первую очередь оценки количества, целости и/или качества суставного хряща (Brandt K. et al., 1994).
В последние годы артроскопию рассматривают как метод ранней диагностики остеоартроза, поскольку она позволяет выявлять вышеуказанные изменения хряща даже в случае отсутствия рентгенологических признаков болезни. Применительно, например, к коленному суставу, этот метод обеспечивает прямую, включающую увеличение, визуализацию шести поверхностей сустава, причем методика является более чувствительной, чем рентгенография или МРТ, в отношении повреждений хряща (Blackburn P.M. et al., 1994). Преимущества артроскопии послужили основанием считать этот метод «золотым стандартом» оценки состояния суставного хряща (Fife R.S. et al., 1991). Некоторые авторы с учетом этих преимуществ называют методику «хондроскопией» (Ayral X. et al., 1993). Прямая визуализация позволяет оценивать синовиальную оболочку, выраженность синовита, а также направленно проводить биопсию, что приобретает особое значение для передних отделов коленного сустава, изменения в которых при ОА часто фрагментарны (Lindblad S., Hedfors E., 1987; Kurosaka M. et al., 1991; Ayral X. et al., 1996).
К основным проблемам артроскопии на сегодняшний день относятся следующие: ее инвазивный характер, недостаточно разработанные стандартизованные оценочные системы хондропатий при ОА, а также рекомендации по унификации визуализации поверхностей суставного хряща.
Методика проведения артроскопии
Артроскопию, выполняемую с лечебной целью, часто проводят под общей или спинномозговой анестезией, тогда как диагностическую артроскопию можно выполнять под местной (подкожной или внутрисуставной) анестезией, что делает процедуру более безопасной, доступной и недорогой. Е. Eriksson и соавторы (1986) при сравнении результатов различных методик проведения артроскопии обнаружили, что проведением этой процедуры под местной или спинномозговой анестезией были удовлетворены около 77% пациентов, в то время как под общей — 97%. P.M. Blackburn и соавторы (1994) обнаружили хорошую переносимость артроскопии, проводимой под местной анестезией, сравнимую с МРТ коленных суставов, у всех обследованных 16 пациентов, причем 8 из них отдали предпочтение артроскопии, 2 — МРТ, а 6 говорили об одинаково хорошей переносимости обеих процедур.
В проспективном исследовании, проведенном X. Ayral и соавторами (1993), 84 больных подверглись хондроскопии под местной анестезией, причем переносимость оценили как «хорошую» 62% пациентов, «очень хорошую» — 28%. 25% этих больных вообще не ощущали боли, а 75% отмечали незначительную боль в ходе процедуры или непосредственно после нее. Ежедневная двигательная активность после артроскопии была затруднена у 79% пациентов (до 1 дня — у 44%, до 2 дней — у 55%, до 1 нед — у 79%). К концу 1-го месяца после хондроскопии 82% пациентов отмечали улучшение состояния.
J.B. McGinty и R.A. Matza (1978) оценили диагностическую точность артроскопии, проводимой под общей или местной анестезией, путем постартроскопической визуализации с помощью артротомии. Обнаружено, что артроскопия была несколько точнее, если проводилась под местной анестезией (95%), чем под общей (91%). Однако следует подчеркнуть, что проведение артроскопии под местной анестезией требует большей подготовки, даже для опытных артроскопистов.
Артроскоп с малой стеклянной линзой
Артроскопию коленного сустава часто проводят с помощью артроскопа с 4-миллиметровой стеклянной линзой и 5,5-миллиметровым троакаром. У некоторых больных с контрактурами связок или остаточным мышечным напряжением (из-за местной анестезии) задняя часть тибиофеморального отдела сустава может оказаться недоступной для стандартного артроскопа (4 мм). Артроскоп с 2,7-миллиметровой линзой имеет поле обзора, сравнимое со стандартным артроскопом, и в большинстве случаев позволяет исследовать все отделы сустава. Постоянная ирригация коленного сустава, обеспечиваемая 2,7-миллиметровым артроскопом, достаточна для очистки сустава от крови и различных частиц и обеспечения четкого поля для визуализации (Ayral X. et al., 1993). Технически, 25–30° угол обзора обеспечивает широкое и лучшее обозрение. Волоконно-оптические артроскопы меньшего диаметра (1,8 мм) можно вводить в сустав через пункционное отверстие, а не через разрез, однако они имеют ряд недостатков: меньшее поле обзора, более тусклое и зернистое изображение, что связано с переносом изображения по волокнам и худшей ирригацией, а также тенденцией к перегибам и поломке оптических волокон, что часто ведет к получению только прямого изображения (Ike R.W., Rourke K.S., 1993). По данным этих авторов, чувствительность подобных артроскопов по сравнению со стандартными в обнаружении дефектов хряща составляет 89%, а синовиальной оболочки — 71%.
Результаты проспективного открытого неконтролируемого исследования, проведенного Х. Ayral и соавторами (1993), свидетельствуют об улучшении самочувствия у 82% пациентов через 1 мес после хондроскопии. Считается, что лаваж полости сустава, проводимый в ходе процедуры (обычно около 1 л изотонического раствора натрия хлорида) обеспечивает клиническое улучшение со стороны проявлений суставного синдрома, что подтверждают данные контролируемых исследований (Livesley P.J. et al., 1991; Ike R.W. et al., 1992; Chang R.W. et al., 1993), и нивелирует потенциальный вред этой инвазивной процедуры.
Артроскопическая оценка выраженности поражения хряща при ОА
1. Традиционные классификационные системы.
Для оценки динамики поражения суставного хряща при ОА, особенно под влиянием проводимого лечения, необходимы количественные оценочные системы, предусматривающие три основных параметра этих поражений: глубину, размер и локализацию. К настоящему времени известно много различных артроскопических классификационных систем (Outerbridge R.E., 1961; Cassels S.W., 1978; Ficat R.P. et al., 1979; Beguin J., Locker B., 1983; Bently G., Dowd J., 1984; Insall J.N., 1984, и др.).
Некоторые из классификационных систем (Beguin J., Locker B., 1983; Insall J.N., 1984) учитывают только глубину поражений суставного хряща и дают качественную информацию о поверхности хряща, не обеспечивая количественный подход к учету хрящевых поражений. В других системах (Outerbridge R.E., 1961; Cassels S.W., 1978; Ficat R.P. et al., 1979; Bently G., Dowd J., 1984) учитывается комбинация глубины и размера наиболее тяжелой хондропатии суставной поверхности по одной описательной категории, однако имеется и много расхождений. Краткая характеристика классификационных систем приведена ниже (табл. 18).
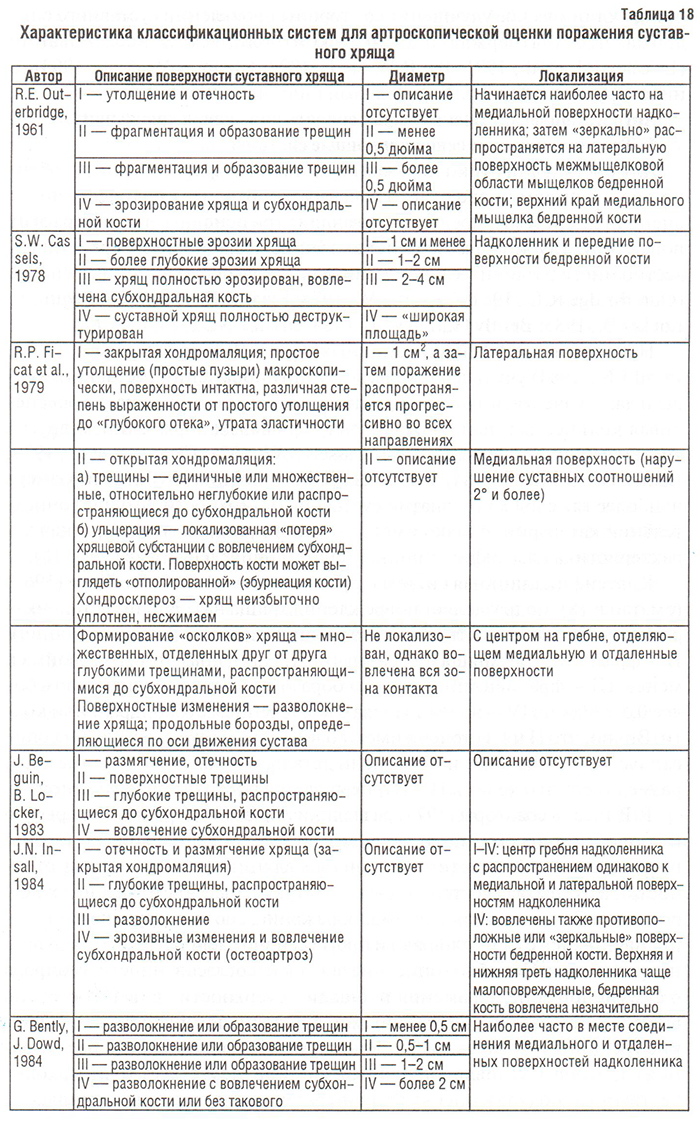
Классификационная система, предложенная R.E. Outerbridge (1961) (см. табл. 18), подразделяет повреждения хряща на степени:
I степень — размягчение и отечность хряща без трещин (истинная хондромаляция);
II — фрагментация хряща и образование трещин диаметром 0,5 дюйма и менее;
III — фрагментация хряща и образование трещин диаметром более 0,5 дюймов;
IV — эрозии хряща с вовлечением субхондральной кости.
Видно, что II и III степени имеют одинаковую глубину и для них описан размер, тогда как I и IV степени детально не оценены. Кроме того, размер трещин (степени II и III) не является постоянной величиной.
R.P. Ficat и соавторы (1979) разделили поражения хряща на закрытую и открытую хондромаляцию, причем закрытая хондромаляция (І степень) представляет собой истинную хондромаляцию (размягчение и отечность), а открытая (ІІ степень) — открытую (с наличием трещин) хондропатию. Согласно этой системе, поражение, соответствующее І степени, начинается с 1 см2 площади и прогрессивно распространяется во всех направлениях. Подобное описание ведет к несогласованности в вопросе о суммарной зоне поражения площади поверхности хряща. ІІ степень включает три различные глубины хондропатии: поверхностные и глубокие трещины и вовлечение в процесс субхондральной кости без указания размеров. Следовательно, в этой системе отсутствует точный количественный подход к оценке степени разрушения суставного хряща.
В классификации, предложенной G. Bently, J. Dowd (1984), степени І, ІІ и ІІІ имеют одинаковые признаки (разволокнение или образование трещин), а различия между степенями основаны на диаметре поражений (см. табл. 18). Отсутствует упоминание об истинной хондромаляции. Степени IV соответствуют две различные глубины хондромаляции: разволокнение с или без вовлечения субхондральной кости, с фиксированным размером более 2 см. Возникает резонный вопрос, какой степени поражений соответствует вовлечение субхондральной кости с диаметром менее 2 см?
S.W. Cassels (1978) оценивал диаметр поражений в сантиметрах и относительную глубину поражений, изначально полагая, что меньшей глубине поражений соответствует меньший ее диаметр (см. табл. 18). В этом случае, какая же степень соответствует поверхностным поражениям, вовлекающим всю суставную поверхность?
Таким образом, вышеописанные системы не обеспечивают достаточную информацию о глубине, размере и локализации повреждений хряща. Кроме того, система оценки должна быть применима как к коленному суставу в целом, так и к каждому из его трех отделов: пателлофеморальному, медиальному и латеральному тибиофеморальному. Тем не менее, без количественного картирования сустава описание локализации хондропатии вне данной суставной поверхности остается качественным.
2. Современные классификационные системы.
В 1989 г. F.R. Noyes, C.L. Stabler предложили свою систему градации повреждений суставного хряща (табл. 19). Они разделили описание суставной поверхности (хряща/субхондральной кости), глубины поражения, диаметр и локализацию поражений. Авторы различают три степени нарушения суставной поверхности: 1-я степень — суставная поверхность интактна; 2-я степень — суставная поверхность нарушена, открытое поражение; 3-я степень — вовлечение кости. Каждая из этих степеней разделена на типы А или В в зависимости от глубины поражения. Степень 1 подразумевает хондромаляцию. Тип 1А соответствует умеренной степени размягчения суставного хряща; тип 1В — значительному размягчению с отечностью суставной поверхности. Степень 2 характеризуется любыми разрушениями суставной поверхности без визуализируемого вовлечения кости. Тип 2А поражений включает поверхностные трещины (менее половины толщины хряща); тип 2В — более половины толщины (глубокие трещины вплоть до кости). Степень 3 указывает на вовлечение кости. Тип 3А предполагает, что нормальный контур кости сохранен; тип 3В — свидетельствует о кавитации или эрозировании поверхности кости. На диаграмме коленного сустава отмечаются все обнаруженные повреждения, а диаметр каждого из них оценивается исследователем в миллиметрах с использованием специального градуированного «крючка». В зависимости от диаметра и глубины поражения используется точечная шкала для количественной оценки выраженности хондропатии для каждого отдела сустава и в итоге — для проведения общего суставного счета.
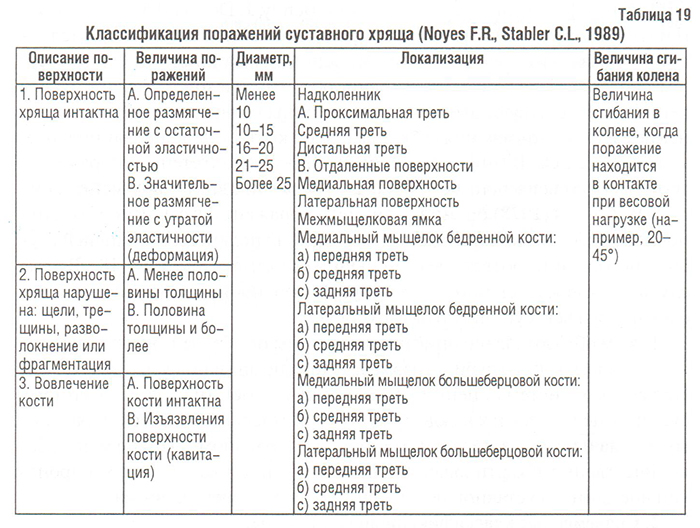
Система F.R. Noyes, C.L. Stabler явилась первой попыткой исследователей произвести количественную оценку хондропатии, поэтому она не лишена недостатков:
- Все повреждения хряща представлены на диаграммах коленного сустава в виде полного круга с диаметром, определяемым с помощью градуированного «крючка». Это является недостаточно объективным методом оценки размера, так как большинство поражений хряща не имеют строго круглой формы, часто они овальные или не имеют определенной формы. Кроме того, дегенеративные изменения хряща часто могут иметь форму с наиболее глубоким поражением по центру, окруженную зоной более поверхностного поражения хряща; причем к этой зоне «окружающего поражения», имеющей кронообразную форму, диаметр не может быть применен.
- Любое поражение менее 10 мм в диаметре не учитывается как клинически значимое, что приводит к потере чувствительности методики. При мониторировании действия базисного препарата любые, даже самые малые, поражения должны быть описаны.
- Точечная шкала оценки одновременно глубины и диаметра повреждений хряща является произвольной; она не базируется ни на статистической методологии, ни на клинической оценке и учете тяжести этих повреждений.
Наиболее новые из предложенных методик артроскопической оценки хондропатии предложены X. Ayral и соавторами (1993, 1994), M. Dougados и соавторами (1994).
Первая из этих методик основана на субъективной общей оценке хондропатии исследователем; она базируется на 100-миллиметровой визуальной аналоговой шкале (VAS), причем «0» соответствует отсутствию хондропатии, а «100» — наиболее тяжелой хондропатии (Ayral X. et al., 1993). Одна VAS используется для каждой суставной поверхности коленного сустава: надколенника, блока (trochlea), медиального и латерального мыщелков, медиального и латерального плато большеберцовой кости. Счет VAS проводится для каждого из трех отделов коленного сустава и получается путем усреднения счетов VAS для двух соответствующих суставных поверхностей отдела сустава.
Вторая методика (Ayral X. et al., 1994; Dougados M. et al., 1994) более объективна и основана на аналитическом подходе, который включает суставную диаграмму коленного сустава с градированием локализации, глубины и размеров всех имеющихся повреждений хряща (табл. 20).
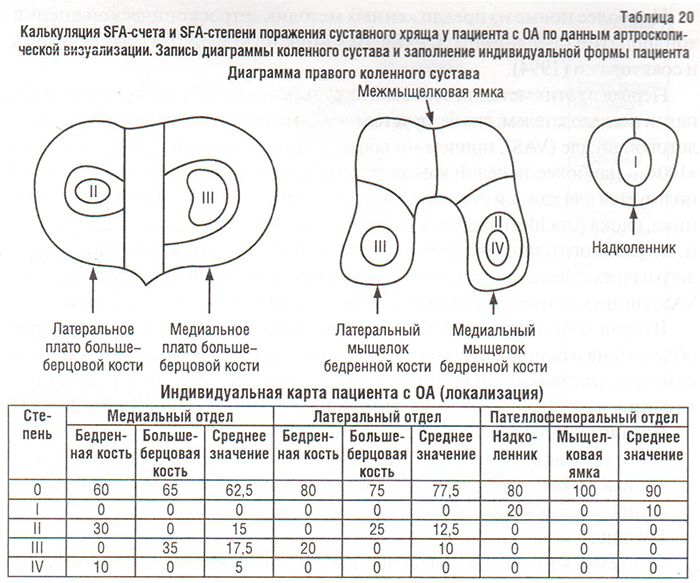
Локализация
Методика включает 6 зон определения: надколенник, блок (межмыщелковая ямка), медиальный и латеральный мыщелки (отдельно), медиальное и латеральное плато большеберцовой кости (отдельно).
Глубина
Система основана на классификации хондропатии, предложенной французскими артроскопистами J. Beguin, B. Locker (1983), в ней выделяется 4 степени поражений хряща (рис. 23, 24):
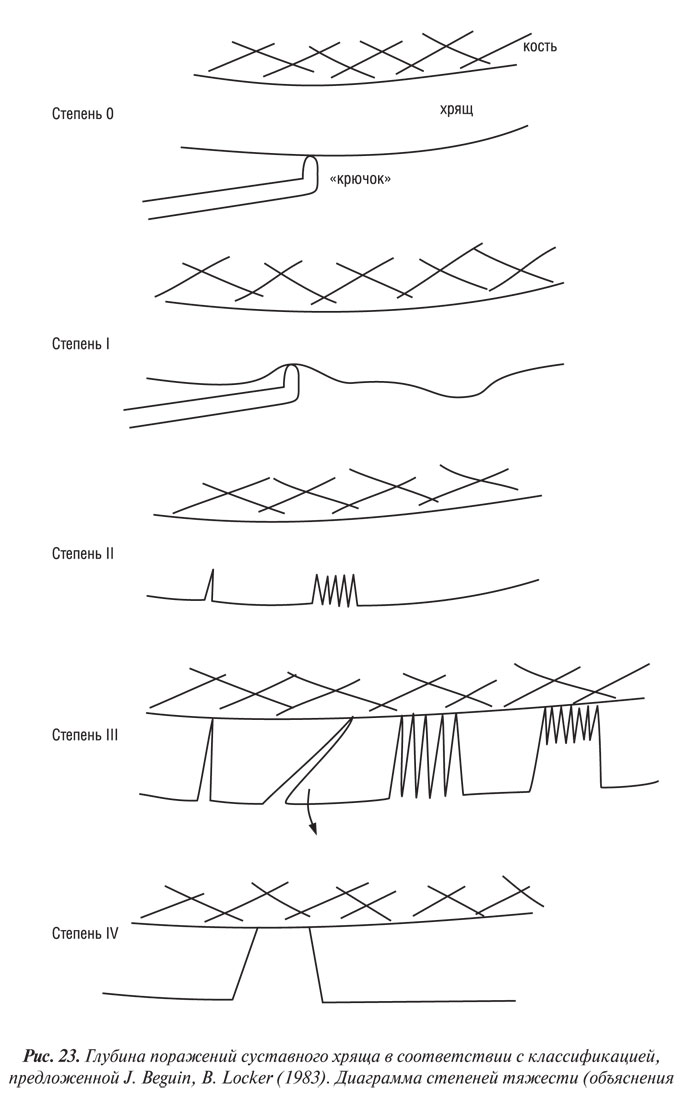
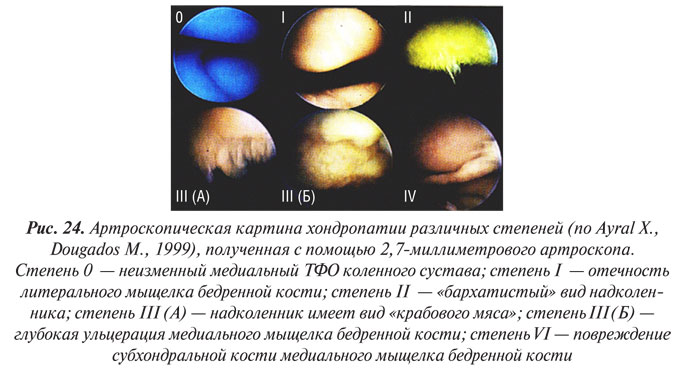
Степень 0 — нормальный хрящ;
Степень І — хондромаляция, включающая размягчение с отечностью или без нее; может соответствовать степени 1, типам А и В по F.R. Noyes, C.L. Stabler (1989);
Степень ІІ — в хряще имеются поверхностные трещины, единичные или множественные, придающие поверхности «бархатистый» вид; эта степень также включает поверхностные эрозии. Трещины и эрозии не достигают поверхности субхондральной кости. Может соответствовать степени 2А по F.R. Noyes, C.L. Stabler, 1989 (т.е. поражения, занимающие менее половины толщины хряща);
Степень III — имеются глубокие трещины хрящевой поверхности вплоть до субхондральной кости, которые прямо не визуализируются, однако могут быть выявлены с помощью артроскопического зонда; степень ІІІ может быть в виде «рта акулы» или отдельной части хряща, образовавшегося из-за единичной глубокой трещины, «крабового мяса» из-за множественных глубоких разрывов. Степень ІІІ также включает глубокую ульцерацию хряща, образующую кратер, который остается покрытым тонкой прослойкой хряща. Может соответствовать степени 2В по F.R. Noyes, C.L. Stabler, 1989 (т.е. поражения, занимающие более половины толщины хряща);
Степень IV — субхондральная кость обнажена, причем ее поверхность может быть интактной или с наличием полостей. Может соответствовать степени 3 (типам А и В) по F.R. Noyes, C.L. Stabler (1989).
При ОА коленного сустава разрушение суставного хряща часто проявляется в виде комбинации различных степеней тяжести, когда наиболее тяжелые зоны поражения окружены зонами менее выраженных поражений (см. табл. 20).
Размер
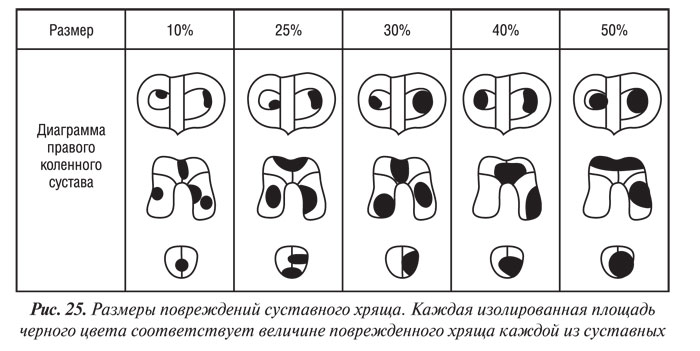
Размер и форма для каждой степени хондропатии записывается артроскопистом на диаграмме коленного сустава (см. табл. 20). Затем размер оценивается в процентах к суставной поверхности (последняя принимается за 100%) с помощью компьютерной техники или вручную (при достаточном навыке эксперта). К примеру, если отслеженная хондропатия 4 раза на диаграмме мыщелка бедренной кости заполняет ее, то размер этой хондропатии составляет 25% мыщелка бедренной кости (результат получается путем деления 100% суставной поверхности мыщелка бедренной кости на 4). Образцы различных размеров хондропатии представлены на рис. 25.
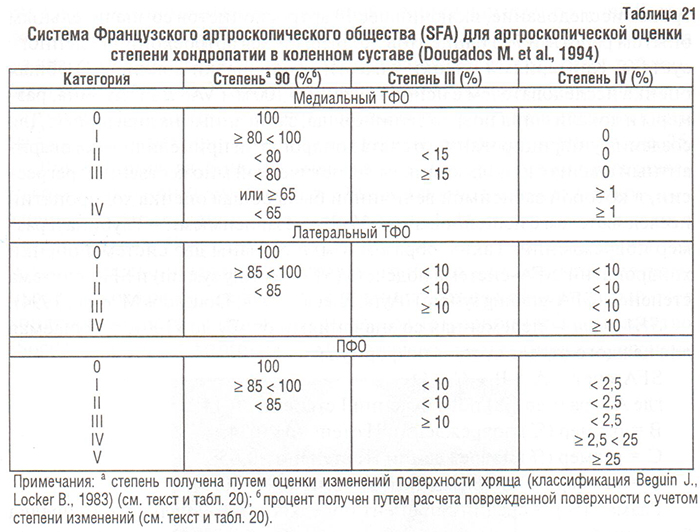
Локализация, глубина и размер различных хондропатий представлены в специальной форме (см. табл. 20). Эта форма включает 8 различных количественных величин, т.е. хондропатии I–IV степеней для каждого отдела сустава. Сравнение тяжести хондропатии у разных пациентов и/или артроскопических данных одного и того же пациента, полученных в разное время, требуют объединения этих величин в единый счет хондропатий. С этой целью Французское артроскопическое общество (Societe Francaise d’Arthroscopie, SFA) провело проспективное многоцентровое исследование, включившее 14 артроскопистов со значительным опытом работы и 755 пациентов, подвергшихся артроскопии коленного сустава. Критериями оценки тяжести хондропатии явились: 1) общая оценка исследователем с использованием 100 мм VAS и 2) глубина, размеры и локализация повреждений хряща, записанные на диаграмму. Для создания унифицированного счета хондропатий применяли многовариантный анализ с использованием логистической множественной регрессии, в которой зависимой величиной была общая оценка хондропатии исследователем с использованием VAS, а независимыми — глубина и размер повреждений. Таким образом, были созданы две системы оценки хондропатий: SFA-система подсчета (SFA-scoring system) и SFA-система степеней (SFA-grading system) (Ayral X. et al., 1994; Dougados M. et al., 1994).
SFA-счет — переменная со значениями от «0» до «100», получаемая для каждого отдела сустава по формуле:
SFA-счет = А + В + С + D,
где А = размер (%) повреждений I степени × 0,14;
В = размер (%) повреждений IІ степени × 0,34;
С = размер (%) повреждений ІІI степени × 0,65;
D = размер (%) повреждений IV степени × 1,00.
Размер (%) = средний процент поверхности медиального мыщелка бедренной кости и медиального плато большеберцовой кости (медиальный тибиофеморальный отдел — ТФО), латерального мыщелка бедренной кости и латерального плато большеберцовой кости (латеральный ТФО) или trochlea и надколенника (пателлофеморальный отдел — ПФО).
Коэффициенты тяжести хондропатии (0,14; 0,34; 0,65; 1,00) получены путем параметрического многовариантного анализа.
SFA-степень — полуколичественная величина. Вышеназванные величины (размер (%) повреждений I–IV степеней) подставляются в формулу для получения суммарной степени (или категории тяжести хондропатии отдела) для каждого из отделов коленного сустава (табл. 21). Формула для каждого отдела получена непараметрическим многовариантным анализом с использованием регрессионного анализа; всего — 6 категорий для ПФО (0–V) и 5 категорий для медиального и латерального ТФО (0–IV). Пример подсчета SFA-счета и SFA-степени представлен в табл. 20.
Система ACR
В 1995 г. комитет ACR предложил систему подсчета поражений хряща (Scoring system for cartilage) (Klashman D. et al., 1995). Эта система учитывает глубину, размер и локализацию повреждений хряща с последующим внесением данных в диаграмму коленного сустава. Глубина каждого повреждения оценивается по степени (классификация Noyes F.R., Stabler C.L., 1989); размер каждого повреждения — в процентах. Точечная шкала используется для подсчета общего счета, так называемого подсчета повреждений (damage score). Достоверность последнего была оценена D. Klashman и соавторами (1995) в слепом исследовании: видеопленки 10 артроскопий просмотрены дважды тремя ревматологами-артроскопистами, причем была показана высокая достоверность как данных одного эксперта в двух исследованиях (r = 0,90; 0,90; 0,80; p<0,01 для каждого), так и между экспертами (r = 0,82; 0,80; 0,70; p<0,05 для каждого).
Сравнительный анализ достоверности, значимости и чувствительности к изменениям артроскопических систем SFA, VAS
X. Ayral и соавторы (1996) обнаружили тесную корреляционную связь между артроскопической количественной оценкой хондропатии и рентгенологической оценкой сужения суставной щели в условиях весовой нагрузки, а именно следующими показателями: 1) общей оценкой хондропатии (VAS) и сужением рентгенологической суставной щели (РСЩ) медиального отдела сустава, выраженными в % (r = 0,646; p<0,0001); 2) SFA-счетом и сужением РСЩ в медиальном и латеральном ТФО, выраженными в мм (r = –0,59; p<0,01 и r = –0,39; p<0,01 соответственно); 3) SFA-степенью и сужением РСЩ в медиальном и латеральном ТФО, выраженными в мм (r = –0,48; p<0,01 и r = –0,31; p<0,01 соответственно). Несмотря на эти результаты, артроскопия была более чувствительным методом, чем рентгенография: даже глубокие и распространенные эрозии хряща могут оставаться недиагностированными на рентгенограммах, даже при проведении рентгенографии с весовой нагрузкой (Fife R.S. et al., 1991; Ayral X. et al., 1993; 1996). Из 33 пациентов с ОА, достоверным по критериям ACR, сужение РСЩ медиального отдела сустава у которых было менее 25% при проведении нагрузочной рентгенографии, у 30 при артроскопии была обнаружена хондропатия со средним VAS-счетом 21 мм (2–82 мм), причем более 10 мм — у 24 пациентов (Ayral X. et al., 1993).
X. Ayral и соавторы (1996) обнаружили статистически достоверную корреляцию (p<0,05) между повреждением суставного хряща: 1) трех отделов коленного сустава (медиального, латерального, ПФО) и возрастом пациентов; и 2) медиального отдела сустава и индексом массы тела. При проведении же повторной артроскопии через 1 год (41 пациент) теми же авторами было показано, что изменения тяжести повреждения хряща коррелировали с изменениями функциональной недостаточности опорно-двигательного аппарата (индекс Lequesne: r = 0,34; p = 0,03) и качества жизни (AIMS2: r = 0,35; p = 0,04). В этом же исследовании VAS-счет медиального отдела сустава изменялся с 45±28 в начале исследования до 55±31 спустя 1 год (р = 0,0002), а SFA-счет — с 31±21 до 37±24 (р = 0,0003). Подобные результаты, свидетельствующие о высокой чувствительности артроскопии к динамическим изменениям в хряще, получены также Y. Fujisawa и соавторами (1979), T. Raatikainen и соавторами (1990), а также V. Listrat и соавторами (1997) при динамической артроскопической оценке изменений в суставном хряще больных с ОА под действием хондропротекторной терапии (гиалуронан).
Применение микроскопической техники позволяет артроскопически визуализировать изменения, недоступные другим методам исследования (рис. 26 а, б).
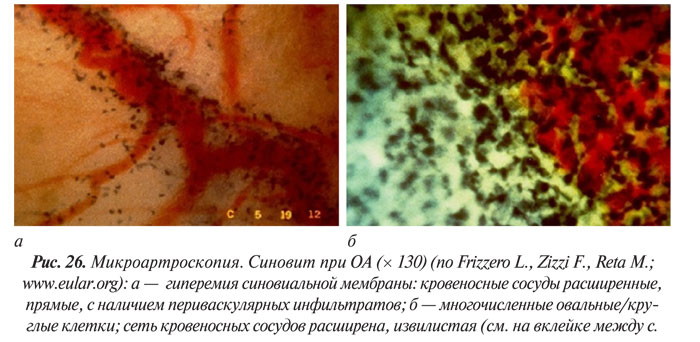
Таким образом, артроскопия, проводимая под местной анестезией, является адекватным методом инструментальной диагностики ОА, а также может использоваться для контроля эффективности лечения, в первую очередь препаратами, модифицирующими течение заболевания (DМОАD).
Рентгенологическая диагностика ОА
Несмотря на бурное развитие в последние годы таких современных методов медицинской визуализации, как МРТ, рентгеновская компьютерная томография, расширение возможностей ультразвуковой диагностики, рентгенография остается наиболее распространенным объективным методом диагностики и контроля эффективности лечения ОА. Это обусловлено доступностью данного метода, простотой исследования, экономичностью и достаточной информативностью.
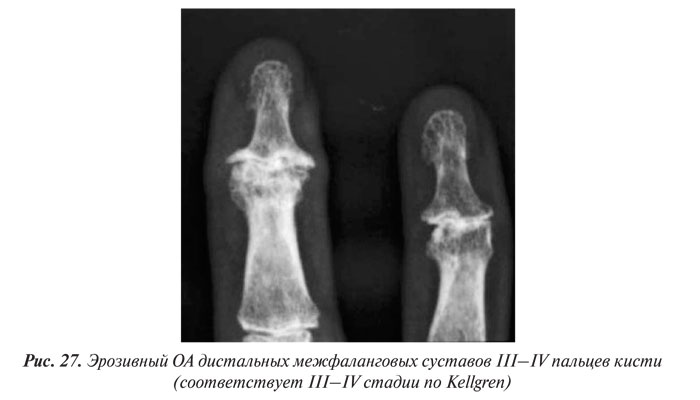
В целом рентгенологическая диагностика ОА основана на выявлении сужения суставной щели, субхондрального остеосклероза и остеофитов (ОФ), причем основное диагностическое значение имеет степень сужения РСЩ. На рентгенограммах суставов могут определяться участки оссификации суставной капсулы (поздний ОА). При узелковой форме ОА наибольшее диагностическое значение имеет обнаружение ОФ, иногда сопровождающееся выраженной деструкцией суставных поверхностей (так называемый эрозивный артроз) (рис. 27, 28).

РСЩ, будучи заполненной хрящом и прослойкой синовиальной жидкости, не дающими изображения на рентгенограммах, имеет вид более прозрачной полосы между суставными поверхностями.
Суммарная толщина суставного хряща на рентгенограммах определяется измерением ширины РСЩ между суставными поверхностями эпифизов костей. Укажем, что ширина РСЩ до настоящего времени используется как основной показатель в диагностике ОА, а стандартная рентгенография коленных суставов в прямой и боковой проекциях рекомендуется WHO и ILAR как метод выбора для оценки динамики изменений в суставном хряще при проведении клинических испытаний лекарственных препаратов. Сужение РСЩ соответствует уменьшению объема суставного хряща, а субхондральный остеосклероз и остеофиты на краях суставных поверхностей большинство исследователей рассматривают как ответную реакцию костной ткани на увеличение механической нагрузки на сустав, что в свою очередь является результатом дегенеративных изменений и уменьшения в объеме суставного хряща. Перечисленное важно не только для диагностики ОА, но и для оценки прогрессирования заболевания и проводимого лечения.
Указанные рентгенологические симптомы считаются специфическими для ОА и включены в перечень рентгенологических критериев диагностики этого заболевания наряду с клиническими.
Рентгенологические симптомы, обязательные для установления диагноза первичного ОА
Сужение РСЩ — один из самых важных рентгенологических симптомов, имеющий прямую коррелятивную связь с патологическими изменениями, происходящими в суставном хряще. РСЩ в разных отделах сустава имеет различную ширину, что связано с неравномерным уменьшением объема суставного хряща на разных участках суставной поверхности. Согласно рекомендациям WHO/ILAR, ширину РСЩ необходимо измерять в наиболее суженном участке. Считается, что в патологически измененном суставе именно этот участок испытывает максимальную механическую нагрузку (для коленного сустава — это чаще медиальные отделы, для тазобедренного сустава — верхнемедиальные, реже — верхнелатеральные отделы). К числу анатомических ориентиров, используемых для измерения суставной щели на рентгенограммах крупных суставов, относятся:
а) для выпуклых поверхностей (головка и мыщелки бедренной кости) — кортикальный слой замыкательной пластинки суставной поверхности кости;
б) для вогнутых поверхностей (край вертлужной впадины, проксимальные мыщелки большеберцовых костей) — край суставной поверхности в основании суставной впадины.
Субхондральный остеосклероз — уплотнение костной ткани, непосредственно расположенной под суставным хрящом. Обычно этот рентгенологический симптом — следствие трения обнаженных сочленяющихся неровных суставных костных поверхностей друг о друга — выявляют на поздних стадиях ОА, когда суставная щель резко сужена. Этот симптом свидетельствует о глубоком дегенеративно-деструктивном процессе в суставном хряще или даже об исчезновении последнего. Нарушение целости суставного хряща, предшествующее его количественному уменьшению, может быть результатом уплотнения кортикальной и трабекулярной костной ткани, непосредственно расположенных под хрящом. Уплотнение субхондральной костной ткани в области суставных поверхностей костей измеряется в трех равноотстоящих точках вдоль суставного края; результаты измерения при этом могут быть усреднены.
Остеофиты — ограниченные патологические костные выросты различной формы и размеров, возникающие при продуктивном воспалении надкостницы на краях суставных поверхностей костей — характерный рентгенологический симптом ОА. В начальных стадиях развития ОА они имеют вид заострений или небольших (до 1–2 мм) костных образований на краях суставных поверхностей и в местах прикрепления собственных связок суставов (в коленных суставах — по краям межмыщелковых бугорков большеберцовых костей, в местах прикрепления крестообразных связок; в тазобедренных суставах — по краям ямки головки бедренной кости, на медиальной ее поверхности, в месте прикрепления собственной связки головки бедренной кости).
По мере нарастания тяжести ОА и прогрессирования сужения суставной щели ОФ увеличиваются в размерах, приобретают различные формы в виде «губ» или «гребней», прямолинейных или «пышных» костных разрастаний на широком или узком основании (Смирнов А.В., 2001). При этом суставные головка и впадина могут значительно увеличиваться в поперечнике, становиться более массивными и «расплющенными». Количество ОФ можно подсчитать отдельно или суммарно в обоих суставах, а их размеры определить по ширине в основании и длине. Изменение количества ОФ и их размеров является чувствительным индикатором прогрессирования ОА и контроля эффективности его лечения.
Рентгенологические симптомы, необязательные для установления диагноза первичного ОА
Околосуставной краевой дефект костной ткани. Хотя этот рентгенологический симптом, который может наблюдаться при ОА, определен R.D. Altman и соавторами (1990) как «эрозия суставной поверхности», термин «околосуставной краевой дефект костной ткани» более предпочтителен, так как точной гистологической характеристики этих рентгенологически выявляемых изменений пока не дано. Краевые дефекты костной ткани могут быть обнаружены и на ранних стадиях ОА, причем их появление может быть вызвано воспалительными изменениями в синовиальной оболочке. Подобные изменения описаны в крупных суставах и в суставах кистей. Обычно при ОА эти дефекты небольших размеров, с участком остеосклероза в основании. В отличие от истинных эрозий, выявляемых при ревматоидном артрите, не имеющих склеротических изменений в основании и часто определяющихся на фоне околосуставного остеопороза, костная ткань, окружающая околосуставной краевой дефект, при ОА не разрежена.
Субхондральные кисты формируются в результате резорбции костной ткани в области с высоким внутрисуставным давлением (в месте наибольшей нагрузки на суставную поверхность). На рентгенограммах они имеют вид кольцевидных дефектов трабекулярной костной ткани в субхондральной кости с четко определяемым склеротическим ободком. Чаще всего субхондральные кисты располагаются в наиболее узкой части суставной щели и возникают при обострении заболевания. Они характерны для ОА тазобедренных суставов, причем могут обнаруживаться как в головке бедренной кости, так и в крыше вертлужной впадины. О динамике изменений субхондральных кист судят по их количеству и размерам.
Внутрисуставные обызвествленные хондромы образуются из участков некротизированного суставного хряща, а также могут являться фрагментом костной ткани (ОФ) или продуцироваться синовиальной оболочкой. Обычно они достигают небольших размеров, расположены между суставными поверхностями костей или сбоку от эпифизов костей, имеют различную форму (округлую, овальную, удлиненную) и неравномерную крапчатую структуру, что обусловлено отложением кальцийсодержащих веществ в хрящевой ткани. В суставе обычно обнаруживают не более 1–2 хондром.
В коленном суставе за обызвествленную хондрому можно принять сесамовидную кость (fabella) в подколенной ямке, которая при ОА коленного сустава также меняет свою форму, положение и размеры. Деформация fabella является одним из симптомов ОА коленного сустава.
Ниже описаны особенности диагностики ОА отдельных суставов, методики оценки выявленных изменений.
Рентгенологическая диагностика ОА тазобедренных суставов (коксартроза)
Точность оценки ширины РСЩ в тазобедренных суставах определяется правильными позиционированием больного, поворотом конечности и центрацией рентгеновских лучей при проведении рентгенографии. В положении больного стоя ширина РСЩ достоверно меньше, чем в положении лежа. РСЩ сужена в большей степени при повороте стопы внутрь. Рекомендуется, чтобы центральный рентгеновский луч проходил через центр головки бедренной кости, поскольку смещение рентгеновской трубки в сторону от центра сустава может достоверно изменить ширину суставной щели. Однако раздельная рентгенография тазобедренных суставов приводит к повышению лучевой нагрузки на пациента.
В начальных стадиях коксартроза (I–II стадии по Kellgren) при рентгенологическом исследовании определяются:
- незначительное сужение РСЩ,
- слабовыраженный субхондральный остеосклероз,
- точечные кальцификаты в области наружного края крыши вертлужной впадины (начальные явления остеофитоза),
- заострение краев ямки головки бедренной кости в области прикрепления круглой связки головки бедренной кости.В поздних стадиях заболевания (III–IV стадии по Kellgren) отмечаются:
- прогрессирующее сужение РСЩ,
- формирование различной формы и размеров ОФ на краях суставных поверхностей вертлужной впадины, головки бедренной кости, отчего она может приобретать грибовидную форму. В средней части вертлужной впадины возможно формирование клиновидного ОФ, который может обусловить латеральное смещение головки бедренной кости (рис. 29),
- углубление вертлужной впадины, которое может быть вызвано ростом ОФ (ее протрузия возможна на фоне остеопороза или истончения костей, составляющих дно вертлужной впадины),
- выраженный субхондральный остеосклероз, который проявляется вначале в области крыши вертлужной впадины, затем в верхнем отделе головки бедренной кости,
- в далеко зашедших случаях — уменьшение в объеме и уплощение суставной поверхности головки бедренной кости на фоне выраженной кистовидной перестройки костной ткани, чередующейся с участками субхондрального остеосклероза,
- костные кисты — единичные или множественные — возникают в верхней части вертлужной впадины или в зоне наибольшей нагрузки на суставную поверхность головки бедренной кости,
- асептический некроз головки бедренной кости,
- подвывихи бедренной кости: чаще вверх/латерально, реже вверх/медиально,
- уплотнение костной ткани и укорочение шейки бедренной кости,
- свободные внутрисуставные тельца (при коксартрозе выявляются редко).
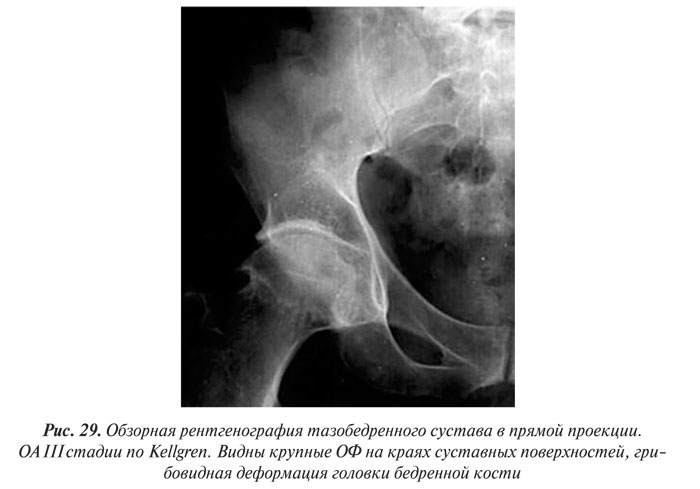
При вторичном диспластичном коксартрозе все рентгенологические симптомы развиваются рано (в молодом или среднем возрасте) и могут закончиться асептическим некрозом головки бедренной кости и подвывихом или полным вывихом бедра.
Описан также ишемический коксартроз с быстрым сужением суставной щели, перестройкой костной структуры в головке и шейке бедренной кости, ранними остеосклеротическими изменениями, но без значительного остеофитоза, с достаточно быстрым развитием деструкции головки бедренной кости.
Рентгенологическая диагностика ОА коленных суставов (гонартроза)
Коленные суставы — одни из самых трудных сочленений для правильного рентгенологического исследования из-за их структурной сложности и широкого диапазона движений. Гонартроз может локализовываться только в определенном отделе сустава, что также затрудняет диагностику суставных изменений.
Анатомические и биомеханические особенности коленного сустава изначально предполагают значительную частоту поражения не только костных структур, но и связочно-менискового комплекса (СМК). Поэтому высокий процент первичных диагностических ошибок при анализе рентгенограмм можно объяснить тем, что основное внимание уделяется только изменениям в костных структурах. Анализировать и на основании определенных признаков предполагать с большой долей вероятности наличие повреждений СМК при проведении рентгенографии позволяют многочисленные функциональные пробы и укладки. С учетом выявленных изменений рентгенологическое исследование может быть дополнено другими методами визуализации — ультразвуковым исследованием, МРТ и др.
Основным правилом при рентгенологическом исследовании коленного сустава является полипозиционность.
К стандартным проекциям, применяемым при рентгенографии коленного сустава, относятся прямая (переднезадняя) и боковая (рис. 30, 31). По мере необходимости их дополняют правой или левой косой, а также аксиальной и другими проекциями.
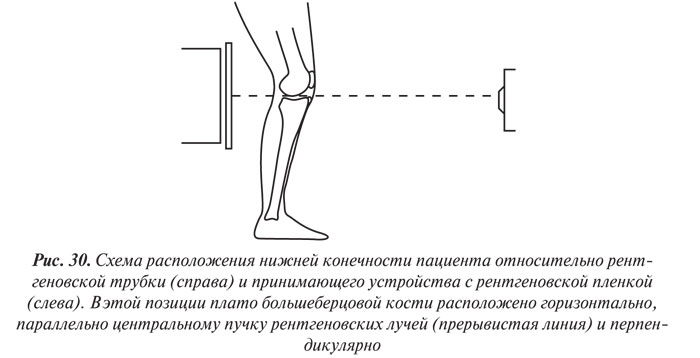
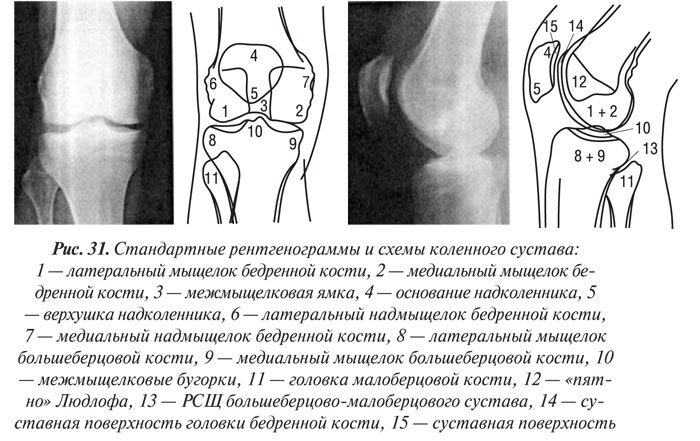
Эффективность рентгенодиагностики поражений коленного сустава во многом зависит от качества рентгенограмм.
В прямой проекции внутренний и наружный контуры РСЩ имеют различную кривизну и ориентацию, вследствие чего они не могут быть получены как идеальная единая линия на одном и том же снимке. Внутренняя ее часть лучше видна, когда центральный рентгеновский луч перпендикулярен поверхности стола, а наружная — при каудокраниальном смещении луча на 5–7°. Компромисс достигается в зависимости от зоны интереса. Ось ротации колена проходит через медиальную область сустава, которая поэтому чаще подвергается изменениям по сравнению с наружной. Следовательно, при выполнении снимка колена в прямой проекции предпочтительной считается укладка, когда сустав находится в состоянии максимального разгибания с перпендикулярным направлением центрального луча к объекту исследования и центрацией его на срединную точку колена, несколько смещенную кнутри.
Снимок, выполненный в положении максимального разгибания колена, является стандартным для переднезадней проекции. Он позволяет исследовать переднюю часть РСЩ.
Прямые снимки, выполненные при сгибании колена на 30° (укладка Шусса) или на 45° (укладка Фика), производятся для оценки состояния задних отделов РСЩ, на уровне которой чаще всего и обнаруживаются повреждения субхондральных отделов костей (остеонекрозы) и хрящевых структур (остеохондриты).
Эти укладки удобны для изучения межмыщелкового пространства, которое в этом положении оказывается максимально доступным обзору, а также позволяют выявлять свободные инородные тела в полости сустава, образующиеся как следствие повреждения суставных хрящей.
Снимок коленного сустава в прямой проекции можно выполнять в положении больного лежа и стоя. Когда патология имеет механическую природу и предполагается повреждение связочного аппарата, предпочтительно выполнять рентгенографию стоя как при нагрузке, так и в расслабленном состоянии для исследования РСЩ и оси сустава.
Рентгенологическое исследование коленного сустава в прямой проекции обязательно дополняется снимком в боковой проекции.
При боковой рентгенографии центральный луч проходит по суставной щели с уклоном на 10° в каудокраниальном направлении. При этом края мыщелков бедренной кости накладываются друг на друга, а их суставные поверхности смещаются в своей задней нижней части. Это позволяет хорошо различать их контуры и оценить состояние ПФО сочленения.
Снимок коленного сустава в боковой проекции производится либо в положении пациента лежа на боку, при полном расслаблении сустава, либо стоя, без нагрузки на исследуемый сустав. Легкое сгибание колена (30° или 15°) позволяет определить состояние ПФО сочленения. Сгибание предназначено для визуализации надколенника в момент его внедрения в межмыщелковую область.
Проведение рентгенографии в боковой проекции позволяет выявить транзиторную нестабильность (задержку вхождения надколенника в межмыщелковую ямку), которая может исчезнуть при 30° сгибании или не выявляться на аксиальном снимке, когда минимальное сгибание равно 30°, а также оценить высоту надколенника и состояние его суставной поверхности.
Различные зоны суставной поверхности колена на боковом снимке имеют характерные отличительные особенности. Эти различия связаны с функциональными особенностями каждого участка. Форма мыщелков бедренной кости представляет зеркальную картину передней части соответствующего тибиального плато, с которой устанавливается контакт при крайнем разгибании колена.
При наличии транзиторной нестабильности надколенника или при подозрении на повреждение крестообразных связок необходимо дополнительное проведение нагрузочных тестов.
Для выявления нестабильности надколенника снимок коленного сустава выполняют в момент сокращения четырехглавой мышцы бедра, что позволяет косвенно оценить состояние связочного аппарата и высоту стояния надколенника.
При подозрении на повреждение крестовидных связок дополнительно выполняют боковую рентгенографию в условиях физической нагрузки. Для этого больного просят переместить массу тела на поврежденную конечность. При повреждениях крестообразных связок происходит смещение концов костей коленного сустава относительно друг друга в зависимости от поврежденной структуры. Так, смещение суставного конца бедренной кости относительно большеберцовой кости кпереди более чем на 5 мм свидетельствует о разрыве задней крестообразной связки, тогда как при смещении кзади следует предполагать разрыв передней крестообразной связки.
Особенно велико значение бокового снимка для изучения ПФО сочленения.
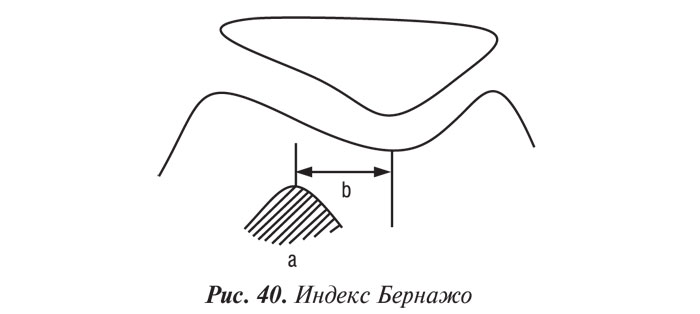
В оценке топографии надколенника применяются различные коэффициенты измерения, из которых наиболее используемый — индекс Катона (рис. 32). Для измерения этого индекса требуется снимок, произведенный при сгибании коленного сустава на 30°.
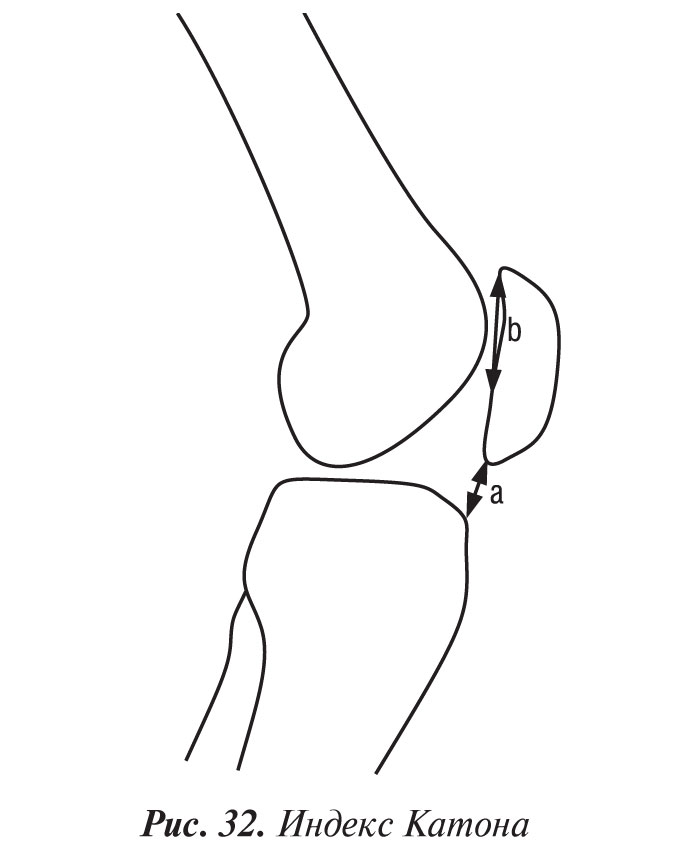
Индекс Катона является соотношением расстояния от нижнего края надколенника до передневерхнего угла большеберцовой кости (а) к длине суставной поверхности надколенника (b). В норме это соотношение обычно равно 1,0±0,3.
Слишком высокое расположение надколенника (patella alta) приводит к запоздалому его внедрению в трохлеарное устье, что может являться причиной надколенниково-бедренной нестабильности. Для диагностики такой нестабильности используется надколенниковый индекс (рис. 33).
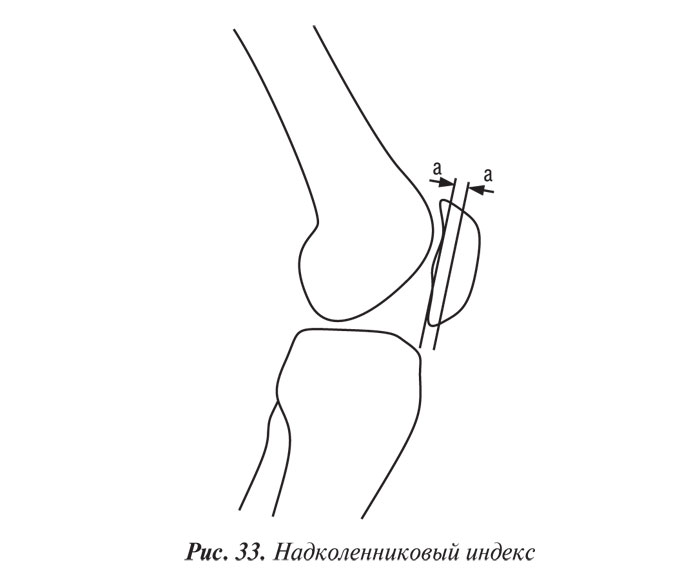
На боковом снимке профиль надколенника имеет две задние линии, одна из которых соответствует гребню надколенника, а другая, более плотная, — его наружному краю. Расстояние между этими двумя линиями (а–а) и является надколенниковым индексом (в норме — 5 мм). Значения <2 мм свидетельствуют о нестабильности, которая, однако, может быть транзиторной, исчезающей при сгибании под углом более 15–30°.
Боковой снимок по сравнению с аксиальными проекциями дает возможность анализа движения надколенника в самом начале сгибания (0–30°), когда он начинает входить в межмыщелковую ямку. В этот момент можно оценить глубину межмыщелковой ямки и установить ее дисплазию, которая может оказаться причиной нестабильности.
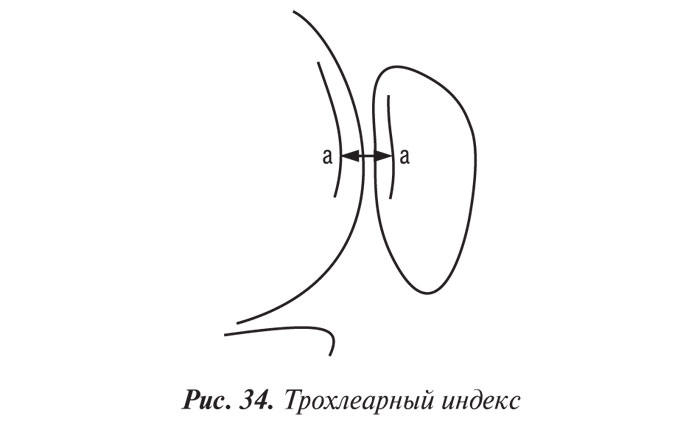
Трохлеарный индекс (рис. 34) измеряется от дна межмыщелковой ямки (а) до суставной поверхности надколенника, а именно до его гребня (а), и определяется на расстоянии 1 см от верхнего края межмыщелковой поверхности, что соответствует зоне внедрения надколенника в самом начале сгибания. В норме он должен равняться 1 см. Значения <1 см свидетельствуют о дисплазии надколенника, которая часто сочетается с недоразвитием суставной поверхности надколенника. При больших значениях индекса следует думать об излишней глубине межмыщелковой ямки, что повышает риск развития хондропатии надколенника.
Определенная роль в диагностике поражений коленного сустава отводится пателлофеморальным аксиальным проекциям.
На этих проекциях соприкосновение ПФО варьирует в зависимости от угла сгибания колена — 30°, 60° или 90° (рис. 35).
Рентгенография при 30° сгибании наиболее информативна для изучения РСЩ ПФО. При меньшем сгибании толщина мягких тканей, через которые проходит луч, велика, что отрицательно сказывается на качестве изображения. Данная аксиальная проекция отличается от других, с бо′льшим углом сгибания, визуализацией краев трохлеарной вырезки. Внутренний край межмыщелковой ямки очень короткий, внутренний и наружный края имеют угловатый вид, значительно более острые, чем в нижнем и среднем сегментах трохлеи. Наружная часть ПФО сустава подвергается более значительным нагрузкам, чем внутренняя. Поэтому субхондральная кость плотнее на уровне наружного участка, а костные трабекулы ориентированы кнаружи.
Аксиальный снимок при 30° наиболее удобен для выявления нестабильности надколенника (наружные транзиторные подвывихи надколенника происходят только в самом начале сгибания) и начального ОА латерального ПФО сустава (см. ниже).
Традиционно для определения рентгенологической стадии ОА коленных суставов используется классификация I. Kellgren и I. Lawrence (1957), усовершенствованная M. Lequesne в 1982 г., основанная на оценке степени выраженности сужения РСЩ, субхондрального остеосклероза и величины краевых костных разрастаний, в ней выделяются 4 стадии.
Стадии ОА (по Kellgren I. и Lawrence I., 1957)
0 — Отсутствие рентгенологических признаков
I — Сомнительная
II — Минимальная
III — Средняя
IV — Выраженная
Несмотря на определенную условность подобного деления ОА на рентгенологические стадии, данная методика успешно применяется в современной рентгенологии при соблюдении ряда условий. В частности, для своевременного выявления гонартроза необходимо исследовать сустав в трех проекциях: передней, боковой и аксиальной, что позволяет оценить медиальный, латеральный, ПФО и ТФО сустава.
Для более точной оценки рентгенологических изменений при ОА A. Larsen (1987) предложил более сложную методику, позволяющую количественно оценить степень тяжести ОА.
Критерии остеоартроза (Larsen A., 1987)
0 — Отсутствие рентгенологических признаков
I — Сужение РСЩ менее чем на 50%
II — Сужение РСЩ более чем на 50%
III — Слабая ремодуляция
IV — Средняя ремодуляция
V — Выраженная ремодуляция
Ранние рентгенологические признаки (соответствуют I–II стадиям артроза по Kellgren):
- вытягивание и заострение краев межмыщелкового возвышения большеберцовой кости (в месте прикрепления крестообразной связки);
- небольшое сужение суставной щели (чаще в медиальном отделе сустава);
- заострение краев суставных поверхностей мыщелков бедренной и большеберцовой кости, чаще в медиальном отделе сустава (связано с большей нагрузкой на этот отдел сустава), особенно при наличии варусной деформации; реже — в латеральной части или одновременно в обеих половинах суставной поверхности (рис. 36).
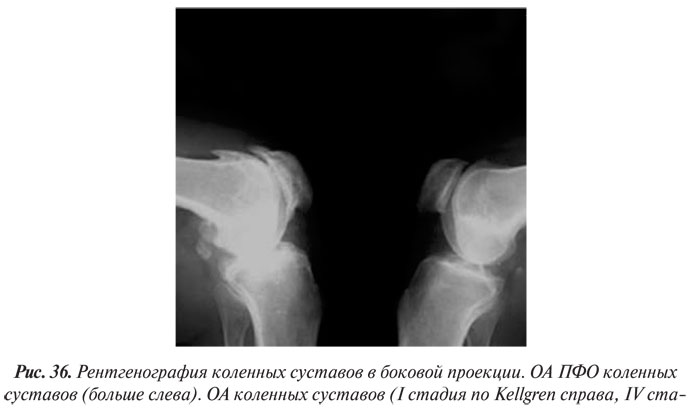
Рентгенологические признаки прогрессирования артроза коленных суставов (соответствуют III–IV стадии артроза по Kellgren):
- увеличение сужения РСЩ;
- развитие субхондрального остеосклероза в самой нагруженной части сустава;
- появление множественных крупных ОФ на боковых, передних и задних краях суставных поверхностей;
- субхондральные кисты (обнаруживаются редко);
- вторичный синовит с развитием субпателлярной или подколенной кисты Бейкера;
- уплощение и неровность суставных поверхностей бедренной и большеберцовой кости, потеря их анатомо-функциональной дифференциации;
- многогранная неправильная форма сесамовидной кости (fabella);
- возможно обнаружение обызвествленных хондром;
- возможно развитие асептических некрозов мыщелков костей (редко).
Достаточно часто ОА коленных суставов проявляется в виде артроза ПФО (почти всегда наружного, иногда наружного и внутреннего, редко только внутреннего).
Наружный артроз ПФО сустава обычно проявляется в начале своего развития на уровне верхнего хрящевого сектора межмыщелковой борозды и нижнего хрящевого сектора надколенника, соответствующего той части ПФО сустава, которая визуализируется в этой проекции. Наибольшая нагрузка на субхондральные отделы костей отмечается в самом начале сгибания коленного сустава, в тот момент, когда надколенник начинает входить в межмыщелковую ямку. Поэтому изменения в ПФО сустава встречаются довольно часто, но, как правило, редко диагностируются вовремя. Основной причиной несвоевременной диагностики является то, что на практике рентгенографические аксиальные проекции не используются в достаточной мере. Следовательно, прямую рентгенографию коленных суставов необходимо обязательно дополнять прицельным снимком надколенника в боковой или аксиальной проекции.
К рентгенологическим признакам ОА ПФО коленного сустава в боковой и аксиальной проекциях относятся:
- сужение РСЩ между надколенником и бедренной костью;
- ОФ на задних углах надколенника и мыщелков бедренной кости;
- субхондральный остеосклероз надколенника;
- единичные субхондральные кисты со склеротическим ободком.
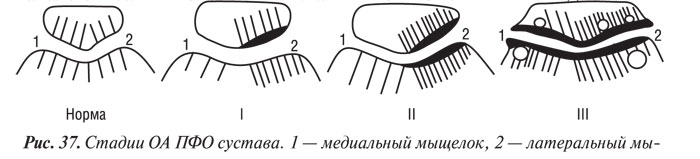
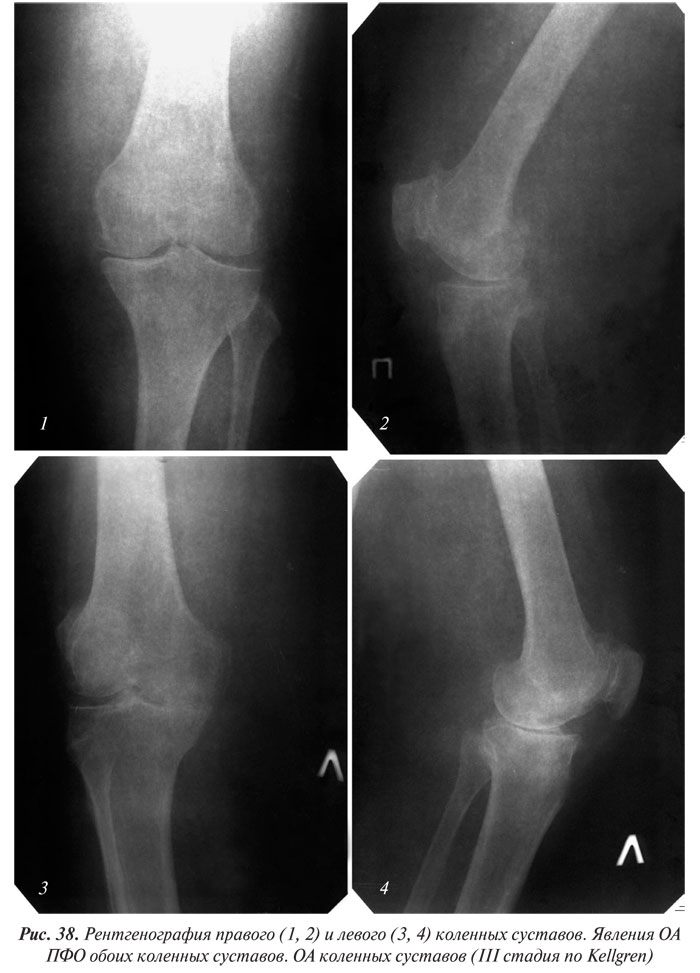
Следует отметить, что рентгенологически различают три стадии ОА ПФО (рис. 37). Субхондральная остеоконденсация и усиление трабекулярного рисунка наружного края надколенника, испытывающего наибольшие внешние нагрузки («синдром гипердавления»), соответствуют I стадии артроза. При II стадии наблюдается ущемление (локальное сужение) суставной щели, даже при отсутствии признаков подвывиха надколенника. III стадия артроза ПФО характеризуется практически полным исчезновением РСЩ, уплотнением субхондрального кортикального слоя, в толще которого образуются участки разрежения — кортикальные кисты, и появлением перихондральных остеофитных клювовидных образований. Выявление краевых ОФ надколенника позволяет с большой долей достоверности предполагать повреждение суставного хряща. Наличие их по контурам наружного и внутреннего мыщелков бедренной и большеберцовой костей указывает на повреждение мениска соответствующей стороны. Выраженный артроз чаще всего возникает при смещении оси надколенника вследствие наружного его подвывиха, возникающего в результате дисплазии или нарушения суставных взаимоотношений ПФО сочленения. На рис. 38, 39 представлена рентгенологическая картина ОА ПФО коленного сустава.
Использование аксиального снимка при 30° позволяет также рассчитать индекс Бернажо — расстояние между передней бугристостью большеберцовой кости (а) и межмыщелковой ямкой (b), в норме составляющее от 10 до 15 мм (рис. 40). Уменьшение или увеличение этого расстояния обычно свидетельствует о дисплазии мыщелков бедренной кости или надколенника, что выражается в нестабильности ПФО сочленения.
Изучение РСЩ ПФО при сгибании колена на 60 и 90° позволяет детально изучить среднюю и нижнюю части межмыщелкового пространства и верхнюю часть надколенника. Обычно патологические изменения в этих зонах наблюдаются позже, чем в верхних отделах межмыщелковой ямки.
Стандартная оценка рентгенограмм суставов по Kellgren и Lawrence подходит главным образом для использования в повседневной клинической практике. При проведении клинических и эпидемиологических исследований часто требуется более подробная классификация тяжести ОА. С этой целью высоту суставной щели ТФО коленного сустава измеряют тонкой пластиковой линейкой, градуированной по 0,5 мм, или кронциркулем. Такая количественная оценка будет более точной, если использовать специальные компьютерные программы обработки рентгенограмм.
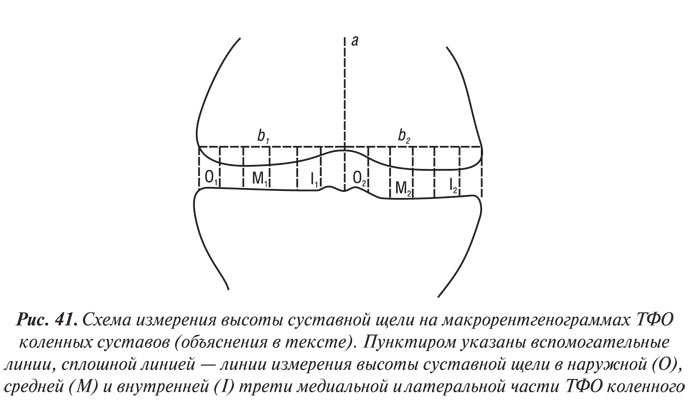
J.C. Buckland-Wright и соавторы (1995) предложили измерять высоту РСЩ (в мм) на макрорентгенограммах коленных суставов в наружной, средней и внутренней третях ТФО медиально и латерально.
Для облегчения измерения высоты РСЩ по этой методике нами предложен следующий алгоритм (рис. 41). Через центр межмыщелковой борозды опускается перпендикуляр (а), затем строго перпендикулярно ему проводится линия (b), проходящая через две наиболее отдаленные точки латерального и медиального мыщелков бедренной кости. Таким образом, линия а делит b на две части — b1 и b2. На медиальную и латеральную пластинки большеберцовой кости от b1 и b2 опускаются по два перпендикуляра, делящие b1 и b2 на три равные части. Через середину каждой трети (наружной, средней, внутренней) медиальной и латеральной части ТФО коленного сустава опускаются перпендикуляры — O1, M1, I1 и O2, M2, I2. Осуществляют измерение последних шести (по три с каждой стороны) линий.
Очевидно, что в оценке рентгенограмм суставов больных с ОА нельзя ограничиваться лишь исследованием высоты суставной щели, поэтому более предпочтительным являются методики полуколичественной оценки, которые широко используются при проведении масштабных клинических и эпидемиологических исследований. Все эти методики имеют общий принцип — наиболее важные рентгенологические симптомы ОА (высота суставной щели, остеофитоз, субхондральный склероз, субхондральные кисты) оцениваются в баллах либо в степенях (обычно от 0 до 3).
Одним из первых полуколичественную оценку рентгенограмм коленных суставов предложил S. Ahlback (1968). Согласно этой методике, четыре вышеназванных рентгенологических критерия ОА оценивают в баллах от 0 до 3 в ПФО и ТФО. Основными недостатками этой шкалы являются: отсутствие оценки ПФО коленного сустава и высокая вероятность двусмысленной трактовки рентгенологических симптомов разными специалистами. Аналогичную систему разработали R.D. Altman и соавторы (1987). Учитывая основной недостаток этих двух систем (оценка только ТФО коленного сустава), T.D. Spector и соавторы (1992) предложили метод полуколичественной оценки рентгенограмм коленных суставов в проекции «sunrise», которая позволяет оптимально исследовать ПФО. В «Рентгенографическом атласе остеоартроза» S. Barnett и соавторов (1994) к оценке ПФО сустава в проекции «sunrise» добавлена оценка в стандартной боковой проекции.
Мы предлагаем свой метод полуколичественной оценки прогрессирования гонартроза:
1. Снижение высоты суставной щели:
0 — отсутствует,
1 — незначительное,
2 — умеренное,
3 — полная облитерация межкостного пространства;
2. Остеофиты:
0 — отсутствуют,
1 — 1–2 мелких ОФ,
2 — один крупный или 3 мелких ОФ и более,
3 — 2 крупных ОФ и более;
3. Субхондральные кисты:
0 — отсутствуют,
1 — 1–2 мелкие кисты,
2 — 1 крупная или 3 мелкие кисты и более,
3 — 2 крупные кисты и более;
4. Субхондральный склероз:
0 — отсутствует,
1 — незначительный, локальный (в медиальной или латеральной части ТФО или ПФО сустава),
2 — умеренный,
3 — значительно выраженный, распространенный.
R.D. Altman и соавторы (1995) объединили в единую систему полуколичественную оценку обоих отделов коленного сустава и издали «Атлас индивидуальных рентгенологических симптомов остеоартроза», который получил второе название «Атлас ORS». К преимуществам этой системы можно также отнести то, что в ней приведены реальные рентгенограммы коленных суставов с ОА. Наряду с этим «Атлас ORS» имеет ряд недостатков.
Среди них можно выделить следующие:
- градации сужения суставной щели и увеличения размеров ОФ имеют неравные интервалы;
- на некоторых рентгенограммах коленных суставов представлены редкие типы ОФ;
- качество рентгеновских снимков варьирует, что затрудняет их сравнение;
- наличие нескольких рентгенологических симптомов (сужение суставной щели, остеофитоз и др.) на одном рентгеновском снимке, что затрудняет работу с «Атласом» и может привести к предвзятой оценке реальных ренгенограмм;
- большой объем «Атласа», что осложняет его использование.
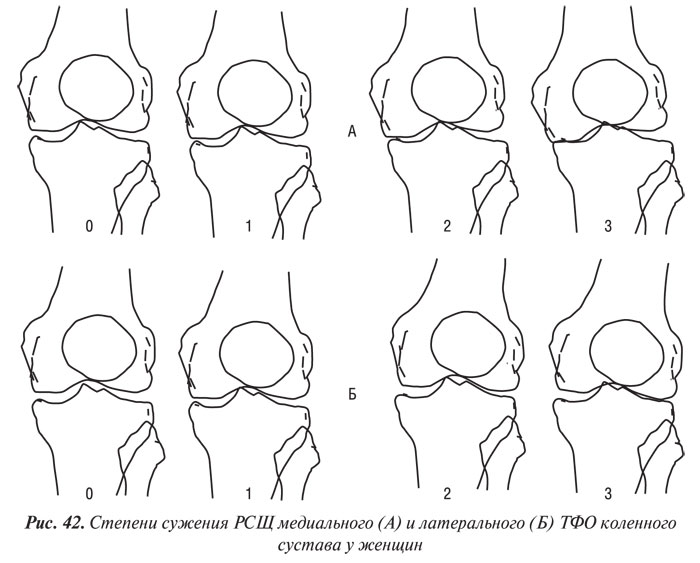
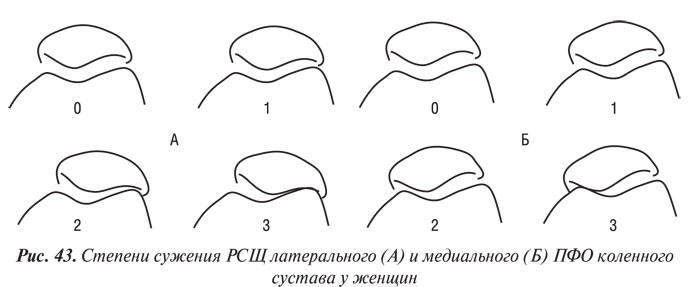
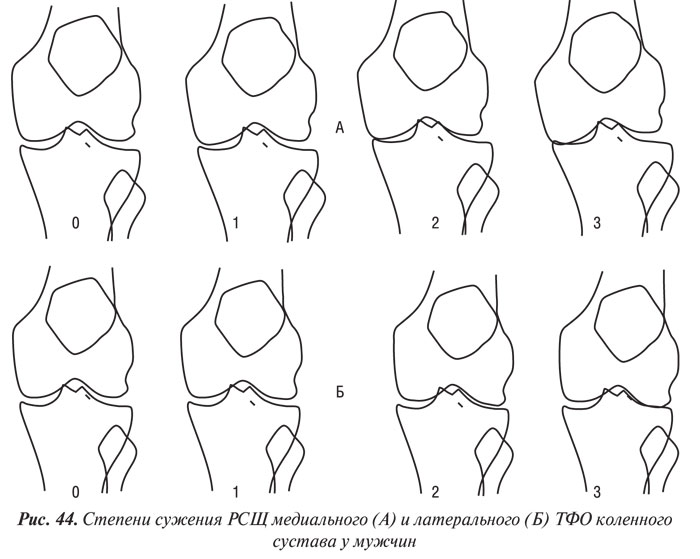
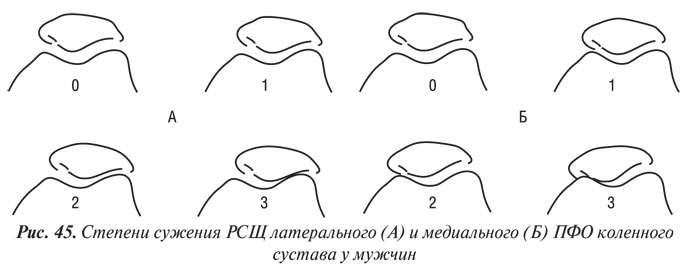
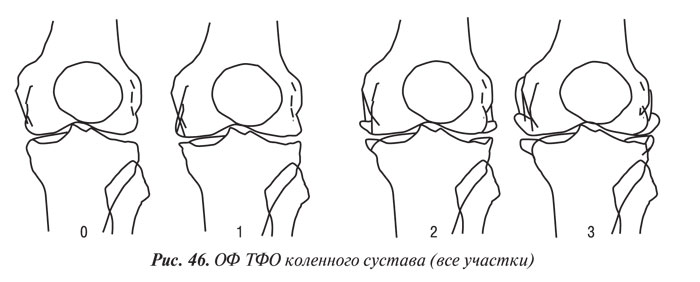
Y. Nagaosa и соавторы (2000) учли недостатки предыдущих систем полуколичественной оценки рентгенограмм коленных суставов и разработали свой атлас, иллюстративный материал в котором представляет собой графическое изображение контуров составляющих коленного сустава в прямой проекции (ТФО сустава) и в проекции «sunrise» (ПФО сустава) (рис. 42–48). Важным преимуществом системы Y. Nagaosa и соавторов является не только то, что они отдельно рассматривают медиальную и латеральную части ТФО и ПФО коленного сустава, но и то, что рентгенологические симптомы ОА представлены отдельно для мужчин и для женщин.
При обследовании 104 больных с достоверным ОА коленных суставов (согласно критериям ACR, 1990) нами изучены размеры и направление роста ОФ и оценены возможные связи между их размерами и другими рентгенологическими данными, имеющими связь с ростом ОФ.
Анализировали стандартные рентгенограммы обоих коленных суставов (за исключением больных, перенесших пателлэктомию или артропластику). Рентгенологически гонартроз определяли как наличие равномерного или неравномерного сужения РСЩ и краевых ОФ (критерии ACR, 1990). Рентгенографию коленных суставов выполняли в стандартных проекциях: переднезадней с полным разгибанием нижних конечностей и аксиальной.
При оценке рентгенограмм коленный сустав условно разделяли на отделы в соответствии с современными рекомендациями (Nagaosa Y. et al., 2000): латеральный и медиальный ТФО, латеральный и медиальный ПФО. Сужение РСЩ в каждом из этих отделов, а также размеры ОФ на каждом из 6 участков: латеральная и медиальная суставные поверхности бедренной кости (соответственно ЛБ и МБ), большеберцовой кости (ЛББ и МББ), надколенника (ЛН и МН), а также ОФ латерального и медиального мыщелков бедренной кости (ЛМ и ММ) оценивали по шкале от 0 до 3 по аттестационной системе Logically derived line drawing atlas for grading of knee osteoarthritis (Nagaosa Y. et al., 2000). Направление роста ОФ разделяли визуально на 5 категорий — вверх (восходящий рост), вверх латерально, латерально, вниз латерально или вниз (нисходящий рост).
Нарушение коркового слоя кости (локальная деформация или «изнашивание» кости) и хондрокальциноз в ТФО и ПФО оценивали по 2-балльной системе (0 — отсутствует, 1 — имеется). Тибиофеморальный угол, индикатор варусной деформации, оценивался в переднезадней проекции. Подвывих надколенника на снимках колена в аксиальной проекции медиально оценивался 0–1, латерально 0–3. Сужение РСЩ в каждом изучаемом отделе и латеральный подвывих надколенника были также соответственно разделены на степени 0–3 (Nagaosa Y. et al., 2000).
У 92 пациентов обнаружена тесная корреляция между данными рентгенографии правого и левого коленных суставов (табл. 22).

ОФ обнаруживались во всех исследуемых областях (табл. 23), причем были отмечены различные формы и направления их роста.
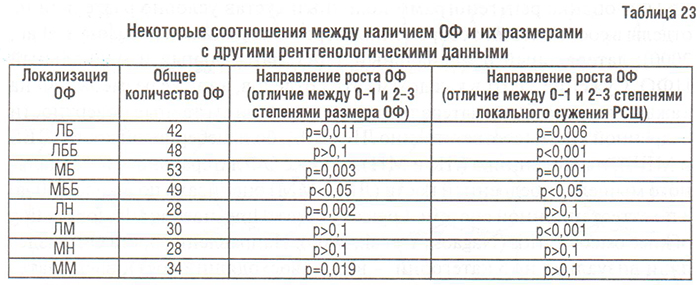
Как видно на рис. 49 (переднезадняя проекция), малые ОФ (0–1 ст.) на участках МБ, МББ и ЛБ имели главным образом горизонтальное направление, тогда как большие ОФ на этих участках были направлены в основном вертикально по отношению к линии суставной щели. ОФ в ЛББ, независимо от их размера, главным образом были направлены вверх по отношению к линии суставной щели. На рис. 49 (аксиальная проекция) малые ОФ МББ с одинаковой частотой направлены вверх медиально или вниз латерально от линии суставной щели, а большие — в основном вниз; ОФ в ЛББ — главным образом вниз латерально от этой линии, однако большие ОФ расположены более латерально, чем малые. Самые малые ОФ в области МН расположены параллельно суставной щели, а большие — под углом, тогда как в ЛН малые ОФ главным образом растут в основном под углом, а большие — перпендикулярно линии суставной щели. Таким образом, на некоторых участках направление роста малых и больших ОФ значительно отличается.
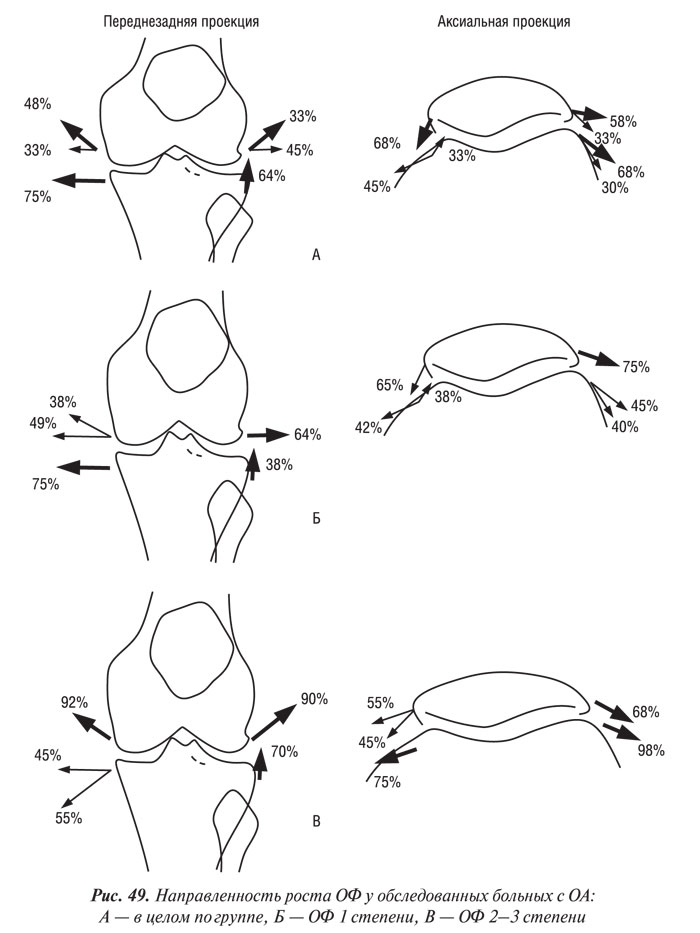
Похожие закономерности наблюдались и при анализе направления роста ОФ в зависимости от степени локального сужения суставной щели (см. табл. 23, рис. 50). В ЛБ, МБ, МББ, ЛМ выраженность локального сужения щели была связана с направлением роста больших ОФ. Направление роста ОФ в ЛББ было связано не с размером ОФ, а с локальным сужением суставной щели латерального и медиального ТФО, а в МН оно не коррелировало ни с размером ОФ, ни со степенью локального сужения.
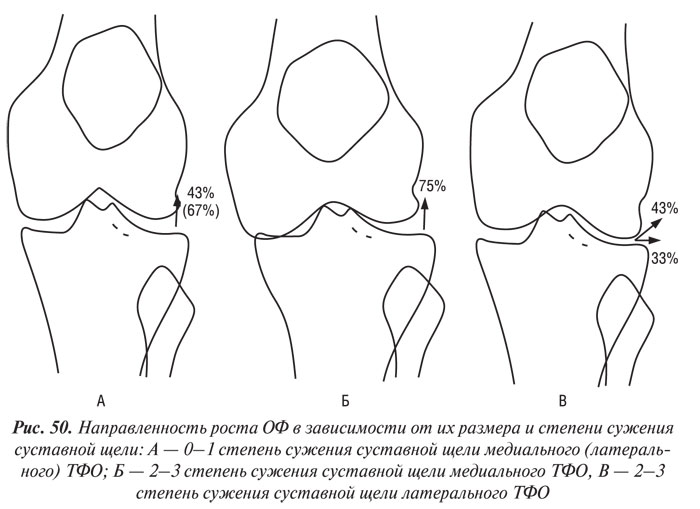
Позитивная корреляция между размером ОФ и степенью локального сужения суставной щели была обнаружена во всех отделах, кроме медиального ПФО. В последнем размеры ОФ надколенника и ММ позитивно коррелировали с сужением щели медиального ТФО. Размер ОФ в ЛБ и ЛББ латерального ТФО позитивно коррелировали со степенью сужения латерального ПФО.
Для уточнения связей между некоторыми рентгенологическими и общеклиническими данными с размером ОФ последние были проанализированы с помощью многофакторного анализа. В табл. 24 показаны те факторы, которые оказались статистически значимыми после проведения последнего (для каждой исследуемой области ассоциированные факторы расположены в порядке их значимости).

Локальное сужение щели было связано с наличием ОФ в большинстве анализируемых участков. ОФ в ЛББ были связаны с сужением щелей медиального ТФО и латерального ПФО. ОФ в ЛН и ЛМ коррелировали больше с латеральным подвывихом надколенника, чем с локальным сужением. Степени 2–3 ОФ медиального ПФО не связаны с локальным сужением, но связаны с варусной деформацией и сужением щели медиального ТФО. Степень локальной деформации ТФО ассоциировалась с наличием ОФ 2–3 степени как в латеральных, так и медиальных ТФО, тогда как локальная деформация ПФО — с наличием ОФ (1 ст. и выше) как в латеральном ТФО, так и (ОФ 2–3 ст.) в латеральном ПФО. Хондрокальциноз был вызван ростом ОФ на многих участках. Наличие латерального подвывиха надколенника тесно коррелировало с ростом ОФ в латеральном ПФО, а варусная деформация — с наличием ОФ 2–3 степени в медиальном ТФО. Общее количество ОФ коррелировало с числом ОФ в МБ и ММ.
Размеры растущих навстречу друг другу ОФ в одном и том же отделе коррелировали во всех анализируемых отделах: коэффициент корреляции r составил 0,64 для латерального ТФО, 0,72 — для медиального ТФО, 0,49 — для латерального ПФО, 0,42 — для медиального ПФО.
Следовательно, во всех отделах коленного сустава, кроме ЛББ и МН, направление роста ОФ изменяется с увеличением размеров последних и степени сужения суставной щели. Обнаруженные корреляции поддерживают гипотезу о влиянии как общих, так и местных биомеханических факторов на формирование ОФ. О влиянии последних свидетельствует обнаруженная нами корреляция между такими параметрами, как:
- размер ОФ в медиальном ПФО и сужение щели медиального ТФО;
- размер ОФ ЛББ и сужение щели как медиального ТФО, так и латерального ПФО;
- размер ОФ в латеральном ПФО и латеральный подвывих надколенника;
- размер ОФ медиальных ТФО и ПФО и наличие варусной деформации. Напротив, при анализе связей хондрокальциноза с общим количеством ОФ обнаружены разнонаправленные изменения.
Можно предположить, что локальная нестабильность — важный пусковой биомеханический механизм формирования ОФ. В экспериментальных моделях OA продемонстрировано, что формирование ОФ при нестабильности сустава ускоряется при движениях в этом суставе и замедляется при иммобилизации (Palmoski M.J., 1982). Как отмечено L.A. Pottenger и соавторами (1990), хирургическое удаление ОФ при проведении артропластики коленного сустава у больных с OA приводит к усугублению нестабильности в суставе, что позволяет говорить о стабилизирующей роли ОФ при этой патологии. Наше наблюдение о том, что латеральный рост ОФ способствует увеличению площади нагружаемой суставной поверхности, подтверждается данными, полученными J.M. Williams и K.D. Brandt (1984). Для ОФ малого размера преобладающее направление роста — латеральное (за исключением ЛББ, где ОФ растут преимущественно вверх, при условии, что щель медиального ТФО сужена, а латеральный ТФО минимально вовлечен в процесс). L.A. Pottenger и соавторы (1990) показали, что даже вертикальные ОФ могут стабилизировать сустав, видимо, путем создания новообразованной поверхности большеберцовой кости и ограничения избыточного вальгусного движения. В отличие от малого крупный ОФ растет преимущественно вверх или вниз. Это явление может отражать анатомическое ограничение «латерального» роста смежными периартикулярными структурами или компенсаторные процессы расширения и механического усиления основания ОФ для предотвращения вывихов.
В числе подобных компенсаторных изменений следует упомянуть и о так называемых линиях прилива, представляющих собой зоны обызвествления, соединяющие гиалиновый хрящ с субхондральной костью. В норме они волнистые и поэтому эффективно противодействуют значительным нагрузкам. При ОА в связи с тем, что хрящ разрушается, а новый хрящ формируется в виде ОФ, эта зона перестраивается. Следовательно, одним из проявлений ОА является наличие множественных линий прилива. Поскольку обнажена суставная поверхность кости, то компенсаторным механизмом становится формирование плотного склероза (эбурнеация), часто сочетающееся с образованием глубоких борозд (углублений). Последние особенно часто обнаруживаются в коленном суставе (ПФО), где могут считаться средством, стабилизирующим сустав, обеспечивая его «рельсами» (Watt I., 2000). Эти борозды хорошо визуализировались на аксиальных изображениях ПФО у обследованных нами пациентов.
В нашем исследовании тесная корреляция наблюдалась между размером ОФ и локальным истончением хряща, особенно в медиальном ТФО и латеральном ПФО. Однако размер ОФ в латеральном ТФО больше коррелировал с сужением суставных щелей медиального ТФО и латерального ПФО, а не его собственной суставной щели, а размер ОФ в медиальном ПФО коррелировал не с локальным сужением щели, а с сужением в медиальном ТФО. Видимо (van Beuningen H.M. et al., 1994, 1999), на размер ОФ могут влиять как изменения в смежных участках сустава, так и локальные, что может опосредоваться биохимическими или механическими факторами роста ОФ. Последними с наибольшей вероятностью может быть объяснена связь размеров ОФ медиальных ТФО и ПФО с варусной деформацией. G.I.van Osch и соавторы (1996) предположили, что процессы повреждения хряща и формирования ОФ прямо не связаны, но вызваны одним и тем же фактором и развиваются независимо друг от друга. Подобное независимое развитие наблюдается в латеральном ПФО и медиальном ТФО, причем размер ОФ связан больше с латеральным подвывихом надколенника и варусной деформацией, чем с локальным сужением суставной щели.
Связь между общим количеством ОФ и их расположением на нескольких участках поддерживает концепцию конституциональной обусловленности формирования ОФ и «гипертрофического» ответа кости (Solomon L., 1983). Возможно, имеются индивидуальные различия в выраженности ответа на действие некоторых ФР, например ТФР-β (van Beuningen H.M., 1994; van den Berg W.B., 1995), или принимающего участие в росте ОФ костного протеина-2 (bone morphogenic proteine-2) (van Beuningen H.M., 1999). Интересным наблюдением является связь хондрокальциноза и количества ОФ: клинические исследования предполагают наличие специфических отношений между кристаллами пирофосфата кальция (обычной причиной хондрокальциноза) и «гипертрофическим» исходом OA (Doherty M., Dieppe P.A., 1988; Felson D.T. et al., 1989). ТФР-β1, кроме стимуляции роста ОФ, увеличивает выработку хондроцитами внеклеточного пирофосфата (Rosen F. et al., 1997), а механическая стимуляция хондроцитов увеличивает выработку ATФ, мощного источника внеклеточного пирофосфата (Graff R.D. et al., 2000), тем самым предрасполагая к образованию кристаллов последнего.
Полученные нами данные предполагают участие в патогенезе ОА ряда факторов, включая местные биомеханические, конституциональные и другие, определяющих размер и направленность роста ОФ, формирующихся в процессе прогрессирования заболевания.
ОА проксимальных и дистальных межфаланговых суставов
Стандартная рентгенография кистей проводится в прямой проекции. Пальцы расположены вместе, кисти лежат ровно на кассете на одной линии с осью, проходящей через предплечья и запястья (рис. 51).

Начальные проявления (соответствуют I–II стадиям артроза по Kellgren):
- небольшие заострения краев или ОФ с нерезким субхондральным остеосклерозом;
- мелкие, субхондрально расположенные кисты;
- нормальная или слегка суженная РСЩ;
- наличие мелких кальцификатов в мягких тканях в области боковых краев суставных поверхностей костей.
Выраженные изменения (соответствуют III–IV стадиям артроза по Kellgren):
- умеренно выраженные или крупные ОФ;
- деформация краев суставных поверхностей костей;
- значительное сужение РСЩ;
- остеосклероз (узелки Гебердена в дистальных межфаланговых суставах и узелки Бушара в проксимальных);
- кисты со склеротическим ободком;
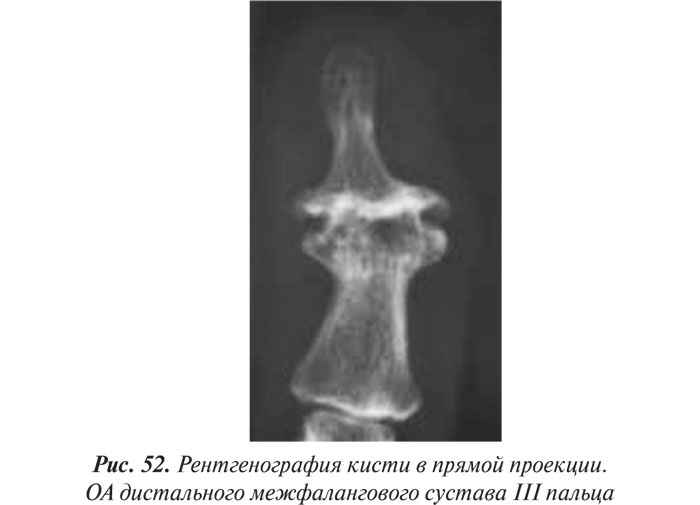
- краевые дефекты суставных поверхностей (при этом костные выступы с одной стороны могут вклиниваться в другую), обычно окруженные зоной остеосклероза (рис. 52; см. также рис. 27, 28).
Дорсопальмарное изображение кисти
Полуколичественная оценка
D.A. Kallman и соавторы (1989), R.D. Altman и соавторы (1995) в своих методиках оценки индивидуальных рентгенологических изменений при ОА учитывают ОФ, сужение РСЩ и периартикулярные субхондральные эрозии для оценки дистальных и проксимальных межфаланговых суставов и запястно-пястного сустава I пальца. Дополнительные данные оценки включают периартикулярный субхондральный склероз и смещения в суставе без подвывихов.
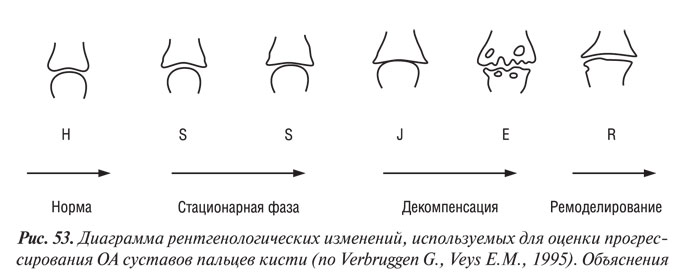
Четырехбалльная шкала оценки вышеуказанных изменений (Altman R.D. et al., 1995) не вмещает весь комплекс анатомических изменений, наблюдавшихся и описанных G. Verbruggen, E.M. Veys (1995). Эти авторы выделяют 5 фаз прогрессирования заболевания (рис. 53). Непораженный сустав (N), стационарная фаза ОА (S) основаны на наличии ОФ и/или сужения РСЩ и/или субхондрального склероза. Большинство суставов на этой стадии остаются в фазе S от 2 до 3 лет. Затем происходит облитерация суставной щели (J-фаза), которая также длится 2–3 года. Эта фаза предшествует или сосуществует с появлением субхондральных кист, нарушающих целость субхондральной пластинки (эрозивная или Е-фаза). Эрозивные эпизоды стихают спонтанно, сменяясь восстановлением повреждений и ремоделированием (R-фаза). Эта последняя фаза ведет к регенерации субхондральной пластинки, покрывающейся хрящевой тканью, с формированием больших остеофитов, придающих пораженным суставам узловатый вид (рис. 54, 55). G. Verbruggen, E.M. Veys (1995) считают, что предложенный ими метод обеспечивает быструю оценку прогрессирования ОА.
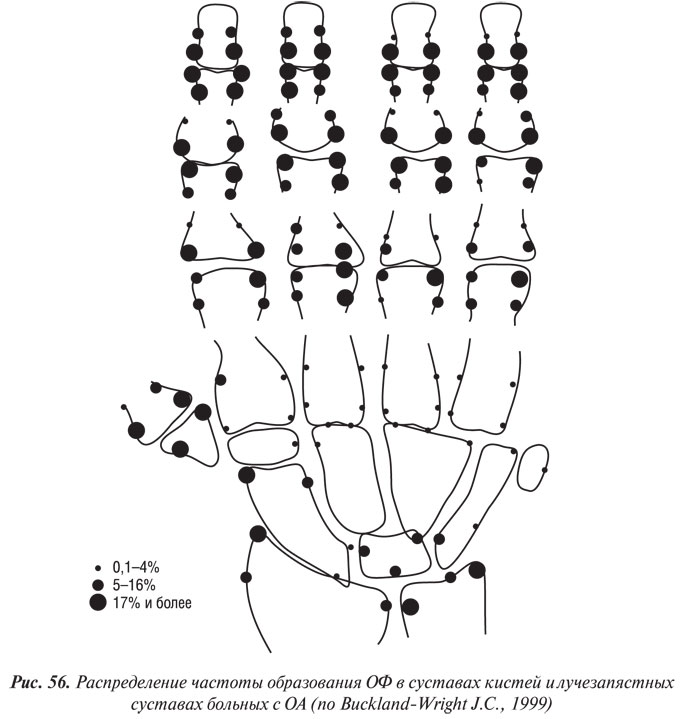
Данные о количественном распределении частоты образования остеофитов (%) в суставах кистей и лучезапястных суставах больных с ОА (по Buckland-Wright C., 1999) представлены на рис. 56.
Методы оптимизации рентгенологической диагностики ОА
Как уже упоминалось, методы оценки прогрессирования ОА основаны на выявлении рентгенологической динамики в суставах. Следует учитывать, что динамика рентгенологических изменений при ОА отличается медленным темпом: скорость сужения РСЩ у больных с гонартрозом составляет приблизительно 0,3 мм в год. Результаты длительных исследований рентгенологических изменений у больных с ОА в коленных суставах, получавших негормональное противовоспалительное лечение, показали отсутствие рентгенологического прогрессирования заболевания после 2 лет наблюдений и минимальные различия между группами больных, получавших лечение, и контролем. Отсутствие достоверных изменений при длительных исследованиях дают основание предполагать, что рентгенологические симптомы ОА при стандартной рентгенографии суставов остаются относительно стабильными в течение длительного времени. Следовательно, для оценки динамики изменений предпочтительнее использовать более чувствительные рентгеновские технологии, к одной из которых относится микрофокусная рентгенография суставов.
В микрофокусных рентгеновских аппаратах применяются специальные рентгеновские трубки с точечным источником излучения. Количественная микрофокусная рентгенография с прямым увеличением изображения показывает достаточную чувствительность по выявлению мелких изменений в структуре костей. С помощью этого метода прогрессирование ОА и эффект от проводимого лечения может быть зарегистрирован и точно измерен за достаточно короткое время между исследованиями. Это достигается благодаря стандартизации исследования и использованию рентгенографической измерительной процедуры, улучшению качества получаемых рентгенограмм суставов с прямым увеличением изображения, что позволяет регистрировать невидимые на стандартных рентгенограммах структурные детали кости. WHO/ILAR рекомендуют измерять ширину РСЩ вручную методом Lequesne с использованием увеличительной линзы и расчетом ширины РСЩ в различных точках. Такие измерения показывают, что при повторных измерениях коэффициент вариации составляет 3,8%. Развитие микрокомпьютерной и анализирующей изображения техники обеспечивает более точную оценку изменений анатомии суставов, чем ручные методы. Цифровая обработка рентгеновского изображения сустава позволяет автоматически измерить ширину суставной щели с помощью компьютера. Ошибка исследователя практически исключается, потому что точность при повторных измерениях устанавливается самой системой.
С точки зрения оперативности диагностики, простоты и удобства использования особый интерес представляют передвижные рентгенодиагностические аппараты с полипозиционным штативом типа С-дуга, широко применяемые в мировой практике. Аппараты данного класса позволяют проводить обследование пациента в любых проекциях без изменения его положения.
Заслуживает внимания метод функциональной рентгенографии коленных суставов (Алешкевич А.И., 1999, 2000), заключающийся в выполнении 2 последовательных рентгеновских снимков коленного сустава в положении больного стоя в прямой передней проекции с преимущественной опорой на исследуемую конечность (1-й снимок — при полностью выпрямленном коленном суставе, 2-й — при сгибании под углом 30°). Контуры костных элементов, образующих РСЩ, с 1-й и 2-й рентгенограмм переводили на бумагу и сканером последовательно вводили в компьютер, после чего по разнице соотношения латеральной и медиальной площади между 1-й и 2-й рентгенограммами определяли степень поражения гиалинового хряща коленного сустава (стадию ОА оценивали по Hellgen). В норме она составила 0,05±0,007; для I стадии — 0,13±0,006; для II стадии — 0,18±0,011; для III стадии — 0,3±0,03. Между показателями в норме и при I стадии имеется существенное различие (р<0,001): между I и II стадией разница достоверна (р<0,05), между II и III стадией ОА — существенное различие (р<0,001).
Полученные показатели свидетельствуют, что рентгенопланиметрия коленного сустава при функциональной рентгенографии объективно отображает стадийность ОА коленного сустава.
Метод функциональной рентгенографии с нагрузкой позволил установить, что у 8 пациентов, у которых при традиционной рентгенографии не было обнаружено патологических изменений, имеется исходное снижение высоты РСЩ. У 7 пациентов была установлена более тяжелая степень поражения. Таким образом, диагноз был изменен у 15 (12,9±3,1%) больных.
Наряду с традиционной методикой рентгенографии коленного сустава — исследованием коленного сустава в стандартных проекциях при горизонтальном положении больного — существует методика исследования этого сустава при вертикальном положении. По мнению В.А. Попова (1986), снимок коленного сустава, выполненный в горизонтальном положении, не отражает реальных механических условий сустава в состоянии нагрузки массой тела. Он предложил проводить исследование коленного сустава в ортостатическом положении с преимущественной опорой на исследуемую конечность. S.S. Messich и соавторы (1990) высказали мнение, что наилучшим положением для диагностики ОА является сгибание коленного сустава на 28° при вертикальном положении больного также с преимущественной опорой на исследуемую конечность, поскольку проведенные биомеханические исследования показали, что начальное поражение гиалинового хряща коленного сустава отмечается в задних отделах мыщелков бедра, находящихся под углом 28° в сагиттальной плоскости, так как именно в этом положении действует основная по времени механическая нагрузка на хрящ (физиологическое положение коленного сустава). H. Petterson и соавторы (1995) предложили методику рентгенографии коленного сустава с нагрузкой, при котором нижняя часть голени находится под углом 5–10° к плоскости пленки и дополнительно сустав сгибается под углом 10–15°. По мнению авторов, в этом положении центральный луч направляется по касательной к плоскости большеберцового мыщелка и суставное пространство будет правильно представлено на снимке.
Таким образом, целенаправленное использование возможностей классической рентгенографии с учетом клинических проявлений позволяет во многих случаях подтвердить или как минимум заподозрить наличие повреждения той или иной структуры связочно-менискового комплекса коленного сустава и решить вопрос о необходимости дообследования больного с помощью других средств медицинской визуализации.
Магнитно-резонансная томография
Магнитно-резонансная томография (МРТ) за последние годы стала одним из ведущих методов неинвазивной диагностики. С 70-х годов, когда принципы магнитного резонанса (МР) впервые стали использовать для исследования человеческого организма, до сегодняшних дней этот метод медицинской визуализации коренным образом изменился и продолжает быстро развиваться. Совершенствуются техническое оснащение, программное обеспечение, развиваются методики получения изображений, разрабатываются МР-контрастные препараты. Это позволяет постоянно находить новые сферы применения МРТ. Если сначала ее применение ограничивалось лишь исследованиями центральной нервной системы, то сейчас МРТ с успехом применяют практически во всех областях медицины.
В 1946 г. группы исследователей из Стэндфордского и Гарвардского университетов независимо друг от друга открыли явление, которое было названо ядерно-магнитным резонансом (ЯМР). Суть его состояла в том, что ядра некоторых атомов, находясь в магнитном поле, под действием внешнего электромагнитного поля способны поглощать энергию, а затем испускать ее в виде радиосигнала. За это открытие Ф. Блоч и Е. Пармель в 1952 г. были удостоены Нобелевской премии. Новый феномен вскоре научились использовать для спектрального анализа биологических структур (ЯМР-спектроскопия). В 1973 г. Пауль Раутенбург впервые продемонстрировал возможность с помощью ЯМР-сигналов получить изображение. Так появилась ЯМР-томография. Первые ЯМР-томограммы внутренних органов живого человека были продемонстрированы в 1982 г. на Международном конгрессе радиологов в Париже.
Следует дать два пояснения. Несмотря на то, что метод основан на явлении ЯМР, его называют магнитно-резонансным (МР), опуская слово «ядерный». Это сделано для того, чтобы у пациентов не возникало мысли о радиоактивности, связанной с распадом ядер атомов. И второе обстоятельство: МР-томографы не случайно «настроены» именно на протоны, т.е. на ядра водорода. Этого элемента в тканях очень много, а ядра его обладают наибольшим магнитным моментом среди всех атомных ядер, что обусловливает достаточно высокий уровень МР-сигнала.
Если в 1983 г. во всем мире насчитывалось лишь несколько приборов, пригодных для клинических исследований, то к началу 1996 г. в мире работало около 10 000 томографов. Ежегодно в практику вводится 1000 новых приборов. Более 90% парка МР-томографов составляют модели со сверхпроводящими магнитами (0,5–1,5 Тл). Интересно отметить, что если в середине 80-х годов фирмы — производители МР-томографов руководствовались принципом «чем выше поле, тем лучше», делая упор на модели с полем 1,5 Тл и выше, то уже к концу 80-х годов стало ясно, что в большинстве областей применения они не имеют существенных преимуществ перед моделями со средней силой поля. Поэтому основные производители МР-томографов («Дженерал Электрик», «Сименс», «Филипс», «Тошиба», «Пикер», «Брукер» и др.) в настоящее время большое внимание уделяют выпуску моделей со средним и даже низким полем, которые отличаются от высокопольных систем компактностью и экономичностью при удовлетворительном качестве изображений и значительно меньшей стоимости. Высокопольные системы используются преимущественно в научно-исследовательских центрах для проведения МР-спектроскопии.
Принцип метода
Основными компонентами МР-томографа (рис. 57) являются: сверхсильный магнит, радиопередатчик, приемная радиочастотная катушка, компьютер и пульт управления. Большинство аппаратов имеют магнитное поле с магнитным моментом, параллельным длинной оси тела человека. Сила магнитного поля измеряется в теслах (Тл). Для клинической МРТ используют поля с силой 0,2–1,5 Тл.
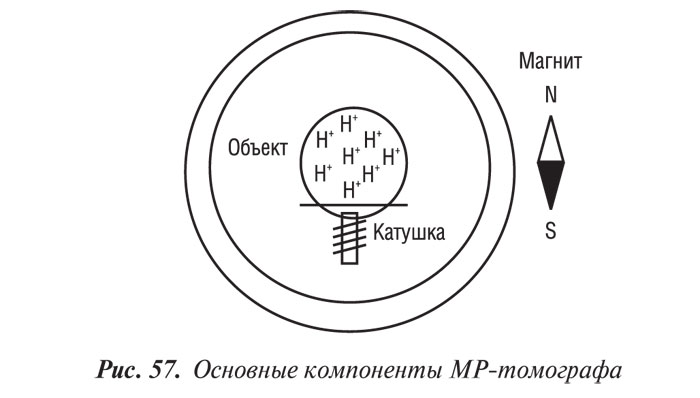
Когда пациента помещают в сильное магнитное поле, все протоны, являющиеся магнитными диполями, разворачиваются в направлении внешнего поля (подобно компасной стрелке, ориентирующейся на магнитное поле Земли). Помимо этого, магнитные оси каждого протона начинают вращаться вокруг направления внешнего магнитного поля. Это специфическое вращательное движение называют процессией, а его частоту — резонансной частотой. При пропускании через тело пациента коротких электромагнитных радиочастотных импульсов магнитное поле радиоволн заставляет магнитные моменты всех протонов вращаться вокруг магнитного момента внешнего поля. Для того чтобы это произошло, необходимо, чтобы частота радиоволн была равна резонансной частоте протонов. Это явление называют магнитным резонансом. Для изменения ориентации магнитных протонов магнитные поля протонов и радиоволн должны резонировать, т.е. иметь одинаковую частоту.
В тканях пациента создается суммарный магнитный момент: ткани намагничиваются и их магнетизм ориентируется строго параллельно внешнему магнитному полю. Магнетизм пропорционален числу протонов в единице объема ткани. Огромное число протонов (ядер водорода), содержащихся в большинстве тканей, обусловливает тот факт, что чистый магнитный момент достаточно велик для того, чтобы индуцировать электрический ток в расположенной вне пациента принимающей катушке. Эти индуцированные МР-сигналы используются для реконструкции МР-изображения.
Процесс перехода электронов ядра из возбужденного состояния в равновесное называется спин-решеточным релаксационным процессом или продольной релаксацией. Он характеризуется Т1 — спин-решеточным временем релаксации — временем, необходимым для перевода 63% ядер в состояние равновесия после их возбуждения 90° импульсом. Выделяют также Т2 — спин-спиновое время релаксации.
Существует ряд способов получения МР-томограмм. Их различие заключается в порядке и характере генерации радиочастотных импульсов, методах анализа МР-сигналов. Наибольшее распространение имеют два способа: спин-решеточный и спин-эховый. При спин-решеточном анализируют главным образом время релаксации T1. Различные ткани (серое и белое вещество головного мозга, спинномозговая жидкость, опухолевая ткань, хрящ, мышцы и т.д.) имеют в своем составе протоны с разным временем релаксации T1. С продолжительностью T1 связана интенсивность МР-сигнала: чем короче T1, тем интенсивнее МР-сигнал и тем светлее выглядит данное место изображения на телемониторе. Жировая ткань на МР-томограммах — белая, вслед за ней по интенсивности МР-сигнала в порядке убывания идут головной и спинной мозг, плотные внутренние органы, сосудистые стенки и мышцы. Воздух, кости и кальцификаты практически не дают МР-сигнала и поэтому отображаются черным цветом. Указанные взаимоотношения времени релаксации T1 создают предпосылки для визуализации нормальных и измененных тканей на МР-томограммах.
При другом способе МР-томографии, названном спин-эховым, на пациента направляют серию радиочастотных импульсов, поворачивающих прецессирующие протоны на 90°. Вслед за прекращением подачи импульсов регистрируют ответные МР-сигналы. Однако интенсивность ответного сигнала по-иному связана с продолжительностью Т2: чем короче Т2, тем слабее сигнал и, следовательно, ниже яркость свечения экрана телемонитора. Таким образом, итоговая картина МРТ по способу Т2 противоположна таковой по способу T1 (как негатив позитиву).
На МР-томограммах лучше, чем на компьютерных томограммах, отображаются мягкие ткани: мышцы, жировые прослойки, хрящи, сосуды. На некоторых аппаратах можно получить изображение сосудов, не вводя в них контрастное средство (МР-ангиография). Вследствие невысокого содержания воды в костной ткани последняя не создает экранирующего эффекта, как при рентгеновской компьютерной томографии, т.е. не мешает изображению, например, спинного мозга, межпозвоночных дисков и т.д. Конечно, ядра водорода содержатся не только в воде, но в костной ткани они фиксированы в очень больших молекулах и плотных структурах и не являются помехой при МРТ.
Преимущества и недостатки метода
К основным достоинствам МРТ относятся неинвазивность, безвредность (отсутствие лучевой нагрузки), трехмерный характер получения изображений, естественный контраст от движущейся крови, отсутствие артефактов от костных тканей, высокая дифференциация мягких тканей, возможность выполнения МР-спектроскопии для прижизненного изучения метаболизма тканей in vivo. МРТ позволяет получать изображение тонких слоев тела человека в любом сечении — во фронтальной, сагиттальной, аксиальной и косых плоскостях. Можно реконструировать объемные изображения органов, синхронизировать получение томограмм с зубцами электрокардиограммы.
К основным недостаткам обычно относят достаточно большое время, необходимое для получения изображений (обычно минуты), что приводит к появлению артефактов от дыхательных движений (это особенно снижает эффективность исследования легких), аритмий (при исследовании сердца), невозможность надежного выявления камней, кальцификатов, некоторых видов патологии костных структур, высокая стоимость оборудования и его эксплуатации, специальные требования к помещениям, в которых находятся приборы (экранирование от помех), невозможность обследования больных с клаустрофобией, искусственными водителями ритма, крупными металлическими имплантатами из немедицинских металлов.
Противопоказания к проведению МРТ
К абсолютным противопоказаниям относят состояния, при которых проведение исследования является угрожающим жизни пациентов. Например, наличие имплантатов, которые активируются электронным, магнитным или механическими путями, — это в первую очередь искусственные водители ритма. Воздействие радиочастотного излучения МР-томографа может нарушить функционирование стимулятора, работающего в системе запроса, так как изменения магнитных полей могут имитировать сердечную деятельность. Магнитное притяжение может вызвать также смещение стимулятора в гнезде и сдвинуть электроды. Кроме того, магнитное поле создает препятствия для работы ферромагнитных или электронных имплантатов среднего уха. Наличие искусственных клапанов сердца представляет опасность и является абсолютным противопоказанием только при исследовании на МР-томографах с высокими полями, а также если клинически предполагается повреждение клапана. К абсолютным противопоказаниям к исследованию относится также наличие небольших металлических хирургических имплантатов (гемостатические клипсы) в центральной нервной системе, так как смещение их вследствие магнитного притяжения угрожает кровотечением. Их наличие в других частях тела имеет меньшую угрозу, так как после лечения фиброз и инкапсулирование зажимов помогают удержать их в стабильном состоянии. Однако помимо потенциальной опасности, наличие металлических имплантатов с магнитными свойствами в любом случае вызывает артефакты, создающие сложности для интерпретации результатов исследования.
К относительным противопоказаниям, помимо перечисленных выше, относятся также декомпенсированная сердечная недостаточность, необходимость физиологического мониторинга (механическая вентиляция легких, электрические инфузионные насосы). Клаустрофобия является препятствием для проведения исследования в 1–4% случаев. Преодолеть его можно, с одной стороны, использованием приборов с открытыми магнитами, с другой — подробным объяснением устройства аппаратуры и хода обследования. Свидетельств повреждающего действия МРТ на эмбрион или плод не получено, однако рекомендовано избегать МРТ в I триместре беременности. Применение МРТ в период беременности показано в случаях, когда другие неионизирующие методы диагностической визуализации не дают удовлетворительной информации. МРТ-исследование требует большего участия в нем пациента, чем компьютерная томография, так как движения больного во время исследования значительно сильнее влияют на качество изображений, поэтому исследование больных с острой патологией, нарушенным сознанием, спастическими состояниями, деменцией, а также детей нередко бывает затруднительным.
Контрастные вещества для МРТ
В начале использования МРТ считалось, что естественная контрастность между различными тканями исключает необходимость применения контрастных веществ. Вскоре было обнаружено, что разница в сигналах между различными тканями, т.е. контрастность MP-изображения может быть существенно улучшена контрастными средствами. Когда первое МР-контрастное средство (содержащее парамагнитные ионы гадолиния) стало коммерчески доступным, диагностическая информативность МРТ значительно возросла. Суть применения МР-контрастного средства состоит в том, чтобы изменить магнитные параметры протонов тканей и органов, т.е. изменить время релаксации (TR) Т1 и Т2 протонов. На сегодняшний день существует несколько классификаций МР-контрастных средств (или вернее контрастных агентов — КА).
По преимущественному влиянию на время релаксации МР-КА делят на:
Т1-КА, которые укорачивают Т1 и тем самым повышают интенсивность МР-сигнала тканей. Их еще называют позитивными КА.
Т2-КА, которые укорачивают Т2, снижая интенсивность МР-сигнала. Это негативные КА.
В зависимости от магнитных свойств МР-КА подразделяются на парамагнитные и суперпарамагнитные:
Парамагнитные контрастные средства. Парамагнитными свойствами обладают атомы с одним или несколькими неспаренными электронами. Это магнитные ионы гадолиния (Gd), хрома, никеля, железа, а также марганца. Наиболее широкое клиническое применение получили соединения гадолиния. Контрастирующий эффект гадолиния обусловлен укорочением времени релаксации Т1 и Т2. В низких дозах преобладает воздействие на Т1, повышающее интенсивность сигнала. В высоких дозах преобладает воздействие на Т2 со снижением интенсивности сигнала. Парамагнетики сейчас наиболее широко используются в клинико-диагностической практике.
Суперпарамагнитные контрастные средства. Доминирующим воздействием суперпарамагнитного оксида железа является укорочение релаксации Т2. С повышением дозы происходит снижение интенсивности сигнала. К этой группе КА можно отнести и ферромагнитные КА, в состав которых входят ферромагнитные оксиды железа, структурно сходные с ферритом магнетита (Fe2+OFe23+O3).
Следующая классификация основана на фармакокинетике КА (Сергеев П.В. и соавт., 1995):
- внеклеточные (тканенеспецифические);
- желудочно-кишечные;
- органотропные (тканеспецифические);
- макромолекулярные, которые используют для определения сосудистого пространства.
В Украине известны четыре МР-КА, которые являются внеклеточными водорастворимыми парамагнитными КА (табл. 25), из них широко используют гадодиамид и гадопентетовую кислоту. Остальные группы КА (2–4) проходят стадию клинических испытаний за рубежом.

Внеклеточные КА вводят внутривенно, на 98% они выделяются почками, не проникают через гематоэнцефалический барьер, обладают низкой токсичностью, относятся к группе парамагнетиков.
МРТ суставного хряща
МРТ-картина суставного хряща (рис. 58, 59) отражает совокупность его гистологического строения и биохимического состава (Jeffery A.K. et al., 1991; Mow V.C. et al., 1992). Суставной хрящ является гиалиновым, который не имеет собственного кровоснабжения, лимфатического дренажа и иннервации. Он состоит из воды и ионов, волокон коллагена II типа, хондроцитов, агрегированных протеогликанов и других гликопротеинов (Mow V.C. et al., 1992; Watt I., 2000). Коллагеновые волокна укрепляются в субхондральном слое кости, как якорь, и идут перпендикулярно поверхности сустава, где они расходятся горизонтально (Jeffery A.K. et al., 1991). Между волокнами коллагена находятся крупные молекулы протеогликана, имеющие значительный отрицательный заряд, который интенсивно притягивает молекулы воды. Хондроциты хряща расположены ровными колоннами. Они синтезируют коллаген и протеогликаны, а также расщепляющие ферменты в неактивной форме и ингибиторы ферментов.
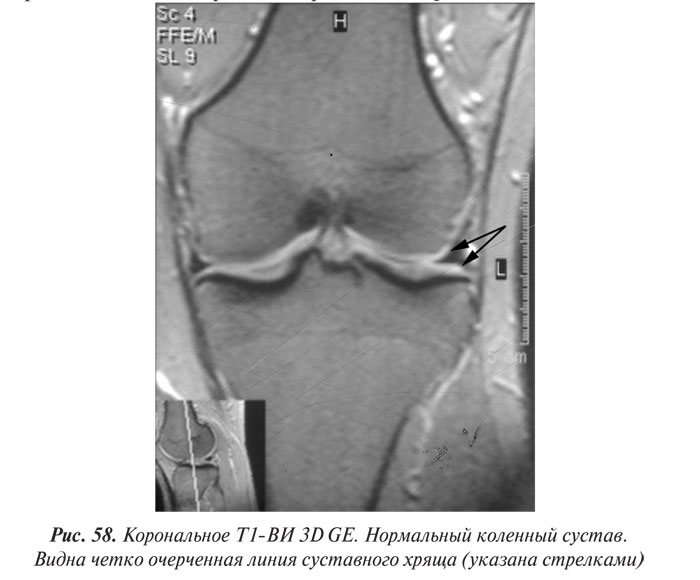
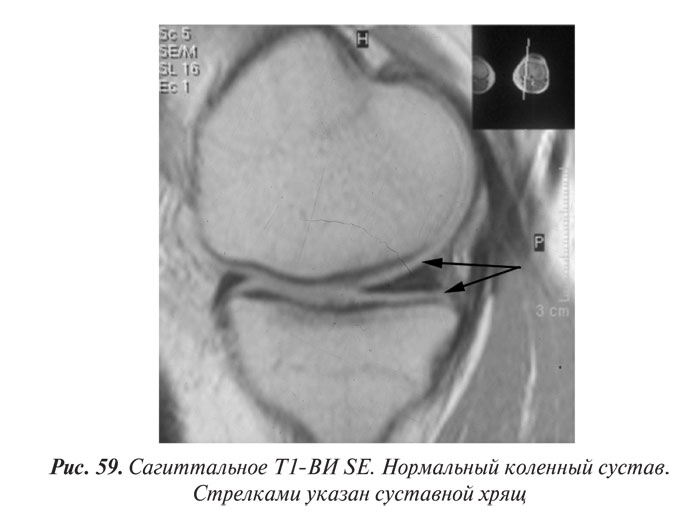
Гистологически было определено 3 слоя хряща в крупных суставах, таких, как коленный и бедренный (Cova M. et al., 1998; Uhl M. et al., 1998). Самый глубокий слой представляет собой соединение хряща и субхондральной кости и служит как прикрепляющий слой обширной сети коллагеновых волокон, распространяющихся от него к поверхности плотными пучками, соединенными многочисленными перекрестными связывающими фибриллами. Он назван радиальным слоем. По направлению к суставной поверхности отдельные коллагеновые волокна становятся тоньше и связываются вместе в более регулярные и компактные параллельные массивы с меньшим числом перекрестных связей (Rubеnstein J.D. et al., 1993). Средний слой — переходный, или промежуточный, содержит больше беспорядочно организованных коллагеновых волокон, большинство которых косо ориентированы с целью противостоять вертикальным нагрузкам, давлению и толчкам (Mow V.C. et al., 1992). Наиболее поверхностный слой суставного хряща, известный как тангенциальный, — тонкий слой плотно устроенных, тангенциально ориентированных коллагеновых волокон, противостоящий растягивающим силам, действующим при нагрузке сжатием, и формирующий водонепроницаемый барьер для интерстициальной жидкости, что предотвращает ее потери в процессе сжатия (Mow V.C. et al., 1992). Самые поверхностные коллагеновые волокна этого слоя расположены горизонтально, образуют плотные горизонтальные пластины на суставной поверхности, хотя фибриллы поверхностной тангенциальной зоны необязательно соединены с таковыми более глубоких слоев (Hwang W.S. et al., 1992).
Как было отмечено, внутри этой сложной ячеистой сети волокон расположены агрегированные гидрофильные молекулы протеогликанов (Mow V.C. et al., 1992). Эти крупные молекулы имеют на концах своих многочисленных ответвлений отрицательно заряженные фрагменты SO–3 и COO–, которые интенсивно притягивают противоположно заряженные ионы (обычно Nа+), что, в свою очередь, способствует осмотическому проникновению воды в хрящ. Давление внутри коллагеновой сети огромно, а хрящ функционирует как чрезвычайно эффективная гидродинамическая подушка. Компрессия суставной поверхности вызывает горизонтальное смещение воды, содержащейся в хряще, так как сеть коллагеновых волокон сжимается. Вода перераспределяется внутри хряща так, что его общий объем не может измениться. Когда компрессия после нагрузки сустава уменьшается или исчезает, вода движется обратно, привлекаемая отрицательным зарядом протеогликанов (Watt I., 2000). Таков механизм, поддерживающий высокое содержание воды и тем самым высокую протонную плотность хряща. Наиболее высокое содержание воды отмечается ближе к суставной поверхности и снижается по направлению к субхондральной кости (Mow V.C. et al., 1992; Paul P.K. et al., 1993). Концентрация же протеогликанов повышена в глубоких слоях хряща (Paul P.K. et al., 1993).
В настоящее время МРТ — это основной способ получения изображения гиалинового хряща, осуществляемый в основном при использовании градиент-эхо (GE) последовательностей (Watt I., 2000) (рис. 58, 60). МРТ отражает содержание воды в хряще. Однако важно, какое количество протонов воды содержит хрящ. Содержание и распределение гидрофильных молекул протеогликанов и анизотропная организация коллагеновых фибрилл оказывает влияние не только на суммарное количество воды, т.е. протонную плотность, в хряще, но также на состояние релаксационных свойств, а именно Т2 этой воды, давая хрящу характерные «зональные» или расслаивающие изображения на МРТ, которые, как считают некоторые исследователи, соответствуют гистологическим слоям хряща (Fry M.E. et al., 1991; Modl J.M. et al., 1991; Paul P.K. et al., 1993; Cova M. et al., 1998; Uhl M. et al., 1998) (рис. 61, 62).
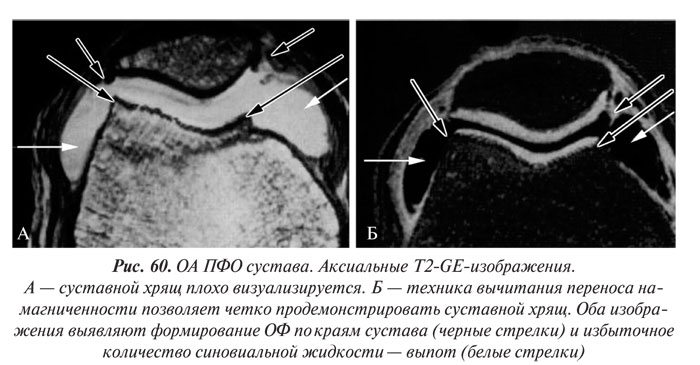
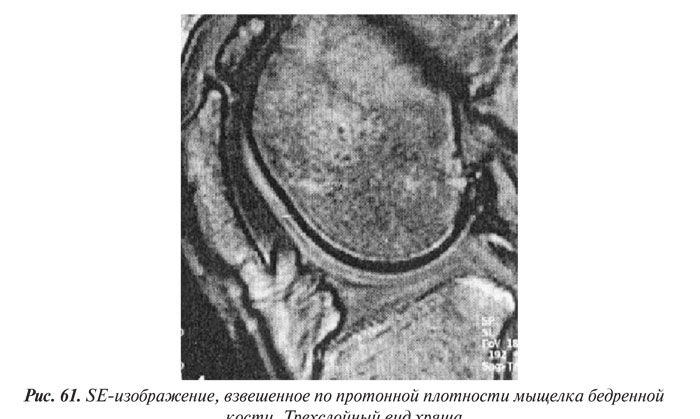
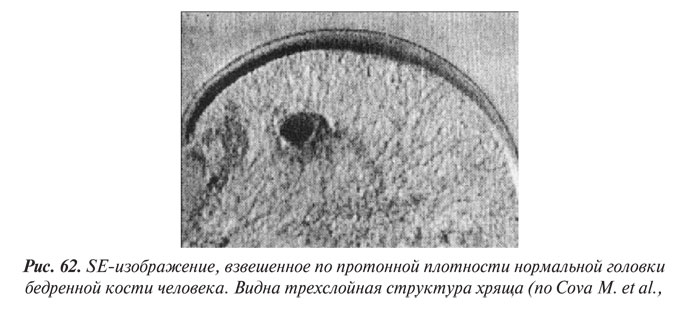
На очень коротких изображениях времени эхо (ТЕ) (менее 5 мс) более высокое разрешение изображений хряща в типичном случае показывает двухслойное изображение: глубокий слой расположен ближе к кости в зоне предварительного обызвествления и имеет низкий сигнал, так как присутствие кальция сильно сокращает ТR и не дает изображения; поверхностный слой дает среднеинтенсивный или высокоинтенсивный МР-сигнал (Lehner K.B. et al., 1989; Watt I., 2000).
На промежуточных ТЕ-изображениях (5–40 мс) хрящ имеет трехслойный вид: поверхностный слой с низким сигналом; переходный слой с сигналом промежуточной интенсивности; глубокий слой, имеющий низкий МР-сигнал (Peterfy C.G., Genant H.K., 1996; Dardizinski B. et al., 1997). При Т2-взвешивании сигнал не включает промежуточный слой, и изображение хряща становится гомогенно низкой интенсивности. Когда используется низкое пространственное разрешение, на коротких ТЕ-изображениях иногда появляется дополнительный слой, что происходит из-за артефактов косых срезов и высокого контраста на поверхности хрящ/жидкость (Rubenstein J.D. et al., 1993), этого можно избежать путем увеличения размера матрицы.
Кроме того, некоторые из этих зон (слоев) могут быть не видны при определенных условиях. Например, при изменении угла между осью хряща и основным магнитным полем вид хрящевых слоев может меняться, а хрящ может иметь гомогенное изображение. Этот феномен авторы объясняют анизотропным свойством коллагеновых волокон и различной ориентацией их внутри каждого слоя (Fullerton G. et al., 1985; Rubenstein J.D. et al., 1993; Peterfy C.G., Genant H.K., 1996).
Другие авторы считают, что получение послойного изображения хряща не достоверно и является артефактом. Мнения исследователей расходятся и в отношении интенсивности сигналов от полученных трехслойных изображений хряща. Данные исследования очень интересны и требуют, конечно же, дальнейшего изучения.
Структурные изменения хряща при ОА
На ранних стадиях ОА происходит деградация коллагеновой сети в поверхностных слоях хряща, приводящая к разволокнению поверхности и повышенной проницаемости для воды (Dodge G.R., Poole A.R., 1989). По мере разрушения части протеогликанов появляется больше отрицательно заряженных гликозаминогликанов, которые привлекают катионы и молекулы воды, в то же время оставшиеся протеогликаны теряют способность притягивать и удерживать воду (Lehner K.B. et al., 1989; Buckwalter J. et al., 1990; Mow V.C. et al., 1990; 1992). Кроме того, потеря протеогликанов снижает их тормозящее воздействие на интерстициальный ток воды. В результате хрящ отекает, «не срабатывает» механизм сжатия (удержания) жидкости и снижается компрессионная устойчивость хряща. Происходит эффект переноса большей части нагрузки на уже поврежденный твердый матрикс (Mow V.C. et al., 1992), а это приводит к тому, что отекший хрящ становится более восприимчивым к механическим повреждениям. В итоге хрящ либо восстанавливается, либо продолжает разрушаться.
Кроме повреждения протеогликанов частично разрушается и коллагеновая сеть, которая уже не восстанавливается, и в хряще появляются вертикальные щели и изъязвления. Эти повреждения могут распространяться вниз по хрящу до субхондральной кости. Продукты распада и суставная жидкость распространяются до базального слоя, что приводит к появлению мелких участков остеонекроза и субхондральных кист (Watt I., 2000).
Параллельно с этими процессами хрящ претерпевает ряд репаративных изменений с попыткой восстановления поврежденной суставной поверхности, которые включают в себя формирование хондрофитов. Последние со временем претерпевают энхондральную оссификацию и становятся ОФ.
Острая механическая травма и компрессионная нагрузка могут привести к развитию горизонтальных трещин в глубоком кальцифицированном слое хряща (Vener M.J. et al., 1992) и отслойке хряща от субхондральной кости (Armstrong C.G., Mow V.C., 1982). Базальное расщепление или деламинация хряща подобным образом может служить механизмом дегенерации не только нормального хряща в условиях механической перегрузки, но и при ОА, когда имеется нестабильность сустава. Если гиалиновый хрящ полностью разрушен и обнажена суставная поверхность, то возможны два процесса: первый — образование плотного склероза на поверхности кости, который называется эбурнеацией; второй — повреждение и компрессия трабекул, что на рентгеновских снимках выглядит как субхондральный склероз. Соответственно, первый процесс можно рассматривать как компенсаторный, второй же явно является фазой разрушения сустава (Watt I., 2000).
Повышение содержания воды в хряще повышает протонную плотность хряща и устраняет Т2-укорачивающие эффекты протеогликан-коллагенового матрикса (Konig H. et al., 1987), который имеет высокую интенсивность сигнала в участках повреждения матрикса на обычных МРТ-последовательностях. Эта ранняя хондромаляция, являющаяся самым ранним признаком повреждения хряща, может быть заметна до того, как произойдет даже незначительное его истончение. В этой стадии может также присутствовать слабое утолщение или «разбухание» хряща. Структурные и биомеханические изменения суставного хряща постоянно нарастают, происходит потеря основного вещества. Эти процессы могут быть локальными или диффузными, ограниченными поверхностным истончением и разволокнением или же полным исчезновением хряща. В некоторых случаях локальное утолщение или «разбухание» хряща может наблюдаться без разрыва суставной поверхности (Hwang W.S. et al., 1992). При ОА часто можно наблюдать локальное повышение интенсивности сигнала хряща на Т2-взвешенных изображениях, что подтверждается артроскопически наличием поверхностных, трансмуральных и глубоких линейных изменений (Rose P.M. et al., 1994). Последние могут отражать глубокие дегенеративные изменения, начинающиеся главным образом в виде отслойки хряща от кальцифицированого слоя или линии прилива (Armstrong C.G., Mow V.C., 1982; Vener M.J. et al., 1992). Ранние изменения могут ограничиваться только глубокими слоями хряща, в этом случае они не обнаруживаются при артроскопическом осмотре суставной поверхности, хотя локальное разволокнение глубоких слоев хряща может вести к поражению смежных слоев, часто с разрастанием субхондральной кости в форме центрального ОФ.
В зарубежной литературе имеются данные о возможности получения количественной информации о составе суставного хряща, например о содержании фракции воды и диффузионном коэффициенте воды в хряще (Burstein D. et al., 1993; Xia Y. et al., 1994). Это достигается с применением специальных программ МР-томографа или при МР-спектроскопии. Оба эти параметра увеличиваются при повреждении протеогликан-коллагенового матрикса при поражении хряща. Концентрация подвижных протонов (содержание воды) в хряще снижается по направлению от суставной поверхности к субхондральной кости.
Количественная оценка изменений возможна и на Т2-взвешенных изображениях (Dardizinski B. et al., 1997). Обобщив данные изображений одного и того же хряща, полученные с различными ТЕ, авторы оценивали Т2-взвешенные изображения (ВИ) хряща с помощью подходящей экспоненциальной кривой от полученных величин интенсивности сигнала на каждый пиксель. Т2 оценивается в определенной зоне хряща или отображается на карте всего хряща, в которой интенсивность сигнала каждого пикселя соответствует Т2 в этом месте (рис. 63) (Dardizinski B. et al., 1997). Однако несмотря на достаточно большие возможности и относительную легкость вышеописанного метода, роль Т2 недооценивается, частично из-за повышения диффузионно-связанных эффектов с увеличением ТЕ (Xia Y. et al., 1997). В основном недооценивают Т2 в хряще при хондромаляции, когда диффузия воды повышена. Если не применять специальные технологии, потенциальное увеличение Т2, измеренное при этих технологиях в хряще при хондромаляции, будет незначительно подавлять диффузионно-связанные эффекты.

Таким образом, МРТ является весьма перспективным методом для выявления и мониторинга ранних структурных изменений, характерных для дегенерации суставного хряща.
Морфологические изменения хряща при ОА
Оценка морфологических изменений хряща зависит от высокого пространственного разрешения и высокой контрастности от поверхности сустава до субхондральной кости. Это лучше всего достигается применением жирподавляемой Т1-взвешенной 3D GE-последовательности (Peterfy C.G., Genant H.K., 1996), которая точно отражает выявленные локальные дефекты и верифицированные как при артроскопии, так и на аутопсийном материале. Изображение хряща также может быть получено с переносом намагниченности путем вычитания изображений, тогда суставной хрящ имеет вид отдельной полосы c высокой интенсивностью сигнала, отчетливо контрастирующую с рядом лежащими низкоинтенсивными суставной жидкостью, интраартикулярной жировой тканью и субхондральным костным мозгом. Однако при использовании этого метода получение изображения происходит в 2 раза медленнее, чем жирподавляемое Т1-ВИ, поэтому менее широко применяется (Peterfy C.G. et al., 1994a,b).
Кроме того, возможно получение изображений локальных дефектов, неровности поверхности и генерализованного истончения суставного хряща, используя обычные МР-последовательности (рис. 64). По данным некоторых авторов, морфологические параметры — толщина, объем, геометрия и топография поверхности хряща — могут быть количественно вычислены с помощью 3D МРТ-изображений (Peterfy C.G. et al., 1998). Путем суммирования вокселей, составляющих 3D реконструируемое изображение хряща, может быть определено точное значение этих комплексно связанных структур. Более того, измерение общего объема хряща, полученного из отдельных срезов, является более простым методом из-за меньших изменений в плоскости одного среза и более достоверным в пространственном разрешении. При изучении целых ампутированных коленных суставов и образцов надколенников, полученных при артропластике этих суставов, определяли общий объем суставного хряща бедренной, большеберцовой костей и надколенника и нашли корреляцию объемов, полученных при МРТ, и соответствующих объемов, полученных при отделении хряща от кости и измерении его гистологически (Peterfy C.G. et al., 1994b). Следовательно, эта технология может быть полезна для динамической оценки изменений объема хряща у пациентов с OA. Получение необходимых и точных срезов суставного хряща, особенно у пациентов с ОА, требует достаточных навыков и опыта врача, проводящего исследование, а также наличия соответствующего программного обеспечения МР-томографа.
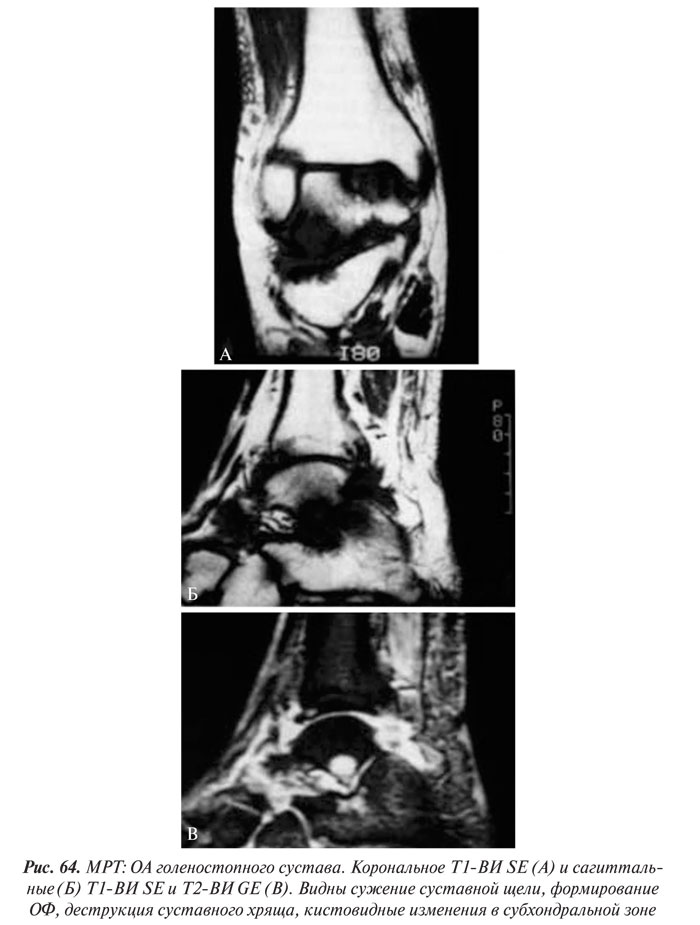
Измерения общего объема содержат немного информации о распространенных изменениях и чувствительны, соответственно, для локальной потери хряща. Теоретически потерю хряща или его истончение на одном участке может уравновесить эквивалентное увеличение объема хряща в другом месте сустава, и измерение общего объема хряща не показало бы какого-либо отклонения от нормы, поэтому такие изменения не поддавались бы определению этим методом. Деление суставного хряща с помощью 3D реконструкции на отдельные мелкие регионы дало возможность оценить объем хряща в определенных участках, в частности, на поверхностях, испытывающих силовую нагрузку (Pilch L. et al., 1994). Однако точность измерений при этом уменьшается, так как выполняется очень малое разделение. В конце концов, чрезвычайно высокое пространственное разрешение является необходимым для подтверждения точности измерений. Если может быть достигнуто достаточное пространственное разрешение, перспектива составления карты толщины хряща in vivo становится возможной (Ateshian G.A. et al., 1994; Eckstein F. еt al., 1995). Карты толщины хряща могут воспроизводить локальные повреждения при прогрессировании OA.
МРТ кости и костного мозга при ОА
Корковый слой и трабекулы кости содержат мало протонов водорода и много кальция, который сильно сокращает TR, и поэтому не дают какого-либо определенного МР-сигнала. На МР-томограммах они имеют изображение кривых линий с отсутствием сигнала, т.е. темных полос. Они создают силуэт среднеинтенсивным и высокоинтенсивным тканям, очерчивая их, например костный мозг и жировую ткань. Патология кости, обусловленная ОА, включает образование ОФ, субхондральный костный склероз, образование субхондральных кист и отек костного мозга (рис. 64–68). МРТ из-за ее многоплоскостных томографических возможностей является более чувствительной, чем рентгенографическая или компьютерная томография, для визуализации большинства из этих видов изменений. ОФ к тому же лучше изображаются при МРТ, чем при обычной рентгенографии — особенно центральные ОФ, которые особенно сложно выявить рентгенографически. Причины образования центральных остеофитов несколько иные, чем краевых, и поэтому имеют другое значение. Костный склероз также хорошо выявляется при МРТ и имеет низкую интенсивность сигнала во всех импульсных последовательностях, обусловленную кальцификацией и фиброзом. При МРТ также можно обнаружить воспаление энтезиса и периостит. МРТ с высоким разрешением является также основной МР-технологией для изучения трабекулярной микроархитектуры. Это может быть полезным для мониторинга трабекулярных изменений в субхондральной кости для того, чтобы определить их значение в развитии и прогрессировании ОА.
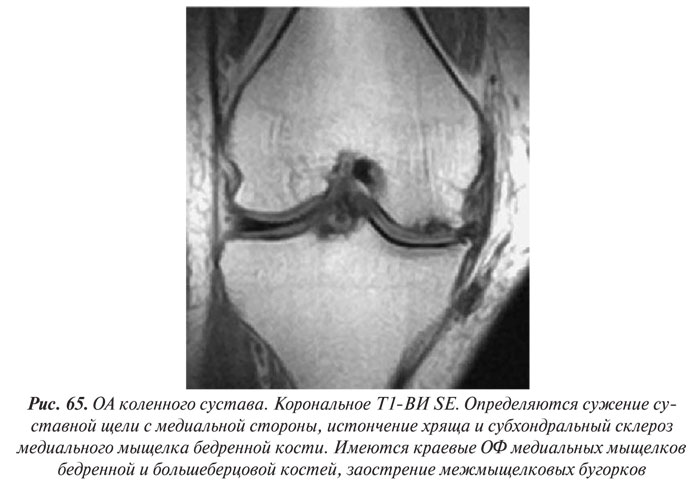
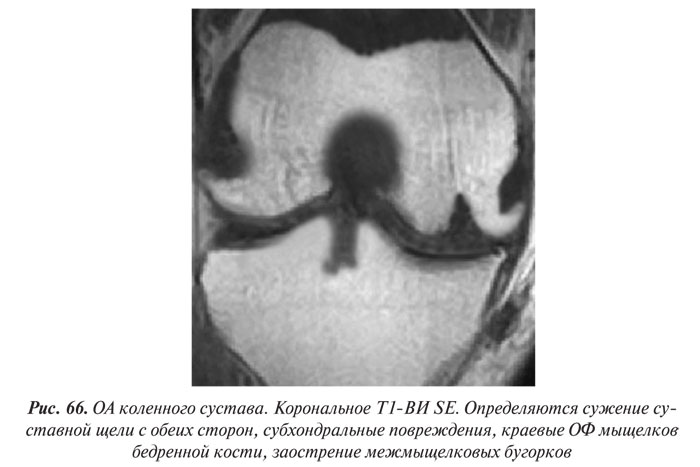
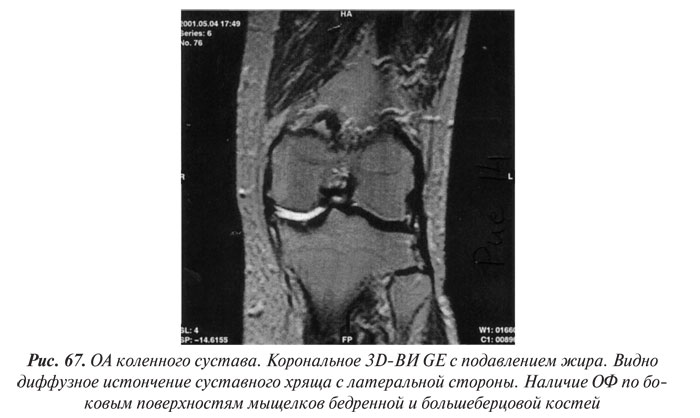

МРТ является уникальной возможностью для получения изображения костного мозга и обычно очень чувствительная, хотя не очень специфичная технология для выявления остеонекроза, остеомиелита, первичной инфильтрации и травм, особенно костной контузии и переломов без смещения. Признаки этих заболеваний на рентгенограммах не выявляются до тех пор, пока кортикальный и/или трабекулярный отделы кости не будут поражены. В каждом из перечисленных случаев повышается содержание свободной воды, которая имеет вид сигнала низкой интенсивности на Т1-ВИ и сигнала высокой интенсивности на Т2-ВИ, показывающих высокий контраст с нормальным костным жиром, имеющим сигнал высокой интенсивности на Т1-ВИ и низкий сигнал на Т2-ВИ (см. рис. 64,В). Исключением является Т2-ВИ FSE (быстрое спин-эхо), на котором изображения жира и воды имеют сигнал высокой интенсивности и требуют подавление жира для получения контраста между этими составляющими. Последовательности GE, по крайней мере, с большой силой поля, являются в основном не чувствительными к патологии костного мозга, потому что магнитные эффекты погашаются костью. Участки отека субхондрального костного мозга часто видны в суставах с прогрессирующим ОА. Обычно эти участки локального отека костного мозга при ОА развиваются в местах потери суставного хряща или хондромаляции. Гистологически эти участки являются типичной фиброваскулярной инфильтрацией. Они могут быть обусловлены механическим повреждением субхондральной кости, вызванным изменением точек соприкосновения сустава в местах биомеханически слабого хряща и/или утратой стабильности сустава, или, возможно, из-за затекании синовиальной жидкости через дефект в обнаженной субхондральной кости. Иногда эпифизарный отек костного мозга виден на некотором расстоянии от суставной поверхности или энтезиса. Остается неясным, какая величина и распространенность этих костномозговых изменений способствует возникновению локальной болезненности и слабости сустава и когда они являются предвестниками прогрессирования заболевания.
МРТ синовиальной оболочки и синовиальной жидкости
Нормальная синовиальная оболочка в основном слишком тонка для визуализации при обычных последовательностях МРТ и ее сложно отличить от рядом расположенной суставной жидкости или хряща. В большинстве случаев при ОА может наблюдаться небольшое утолщение синовиальной оболочки в вовлеченных в процесс суставах (Fernandez-Madrid F., 1995). Остается невыясненным, действительно ли синовит способствует потере суставного хряща или он возникает вторично в результате реакции на разрушение хряща (Brandt K.D., 1995).
В норме в суставах содержится небольшое количество синовиальной жидкости, которое в разных суставах вариабельно. В голеностопном суставе, например, может содержаться относительно большое количество синовиальной жидкости в норме (Schweitzer M.E. et al., 1994). Все еще не известно, какое же количество жидкости следует расценивать как патологическое. С помощью 3-D-реконструкции возможен подсчет количества свободной жидкости в суставе при МРТ (Heuck A.F. et al., 1989). Для мониторинга ответа на лечение у пациентов с ОА или для изучения нормального физиологического функционирования синовиальной жидкости в суставе in vivo эта методика весьма полезна.
МР-сигнал негеморрагической синовиальной жидкости имеет низкую интенсивность на Т1-взвешенных изображениях и высокую на Т2-взвешенных изображениях благодаря наличию свободной воды (рис. 69–72). Геморрагическая синовиальная жидкость может содержать метгемоглобин, который имеет короткое Т1 и дает высокоинтенсивный сигнал на Т1-ВИ, и/или дезоксигемоглобин, который имеет вид низкоинтенсивного сигнала на Т2-ВИ. При хроническом рецидивирующем гемартрозе в синовиальной оболочке откладывается гемосидерин, который дает низкоинтенсивный сигнал на Т1- и Т2-ВИ. Геморрагии часто развиваются в подколенных кистах, они располагаются между икроножной и камбаловидной мышцами по задней поверхности голени. Истечение синовиальной жидкости из поврежденной кисты Бейкера может напоминать форму пера при усилении гадолинийсодержащими контрастными агентами. При внутривенном введении КА он располагается вдоль поверхности фасции между мышцами кзади от суставной капсулы коленного сустава (Eich G.F. et al., 1994).
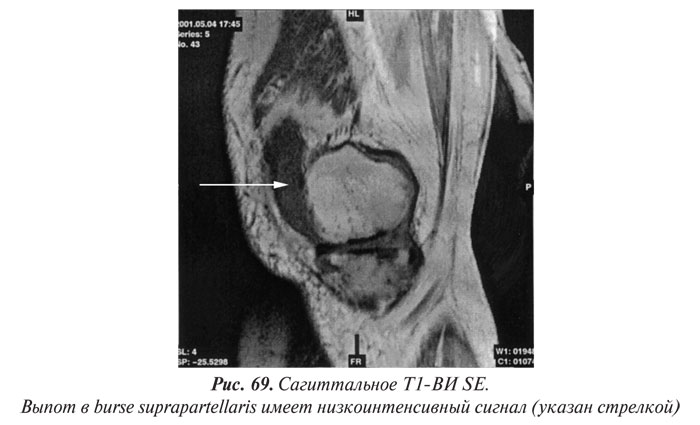
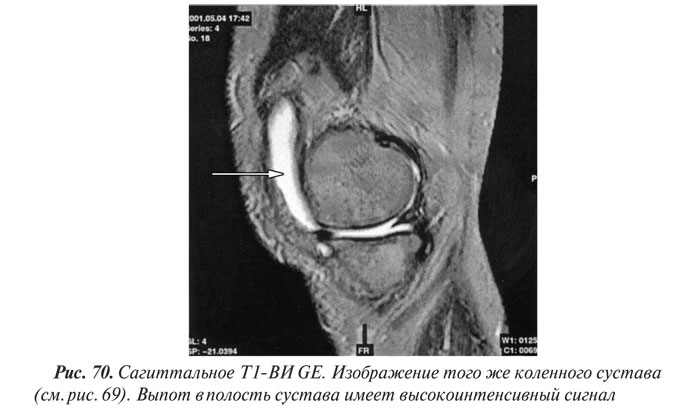
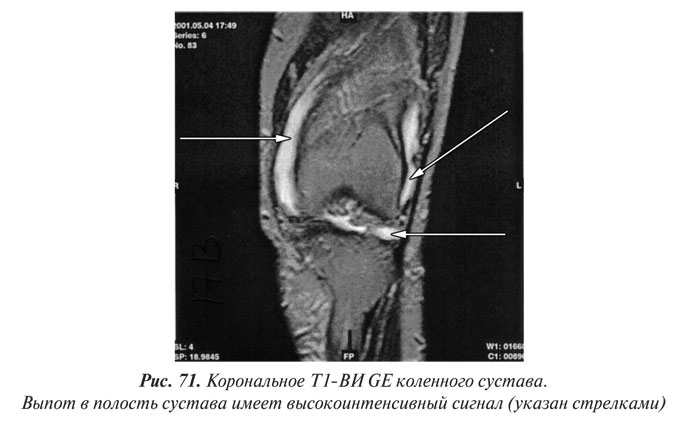
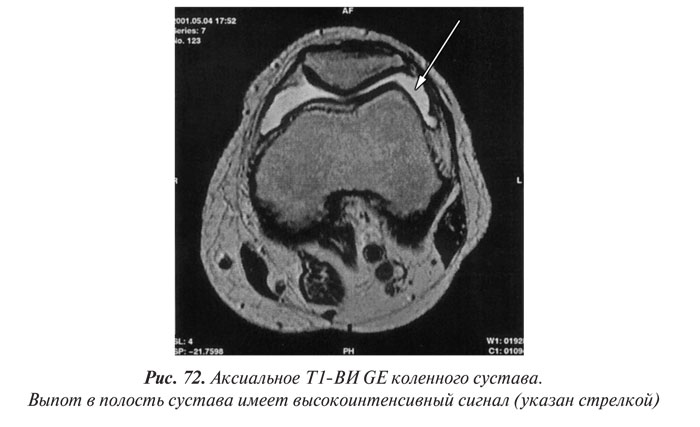
Воспаленная, отечная синовиальная оболочка обычно имеет медленное Т2, отражая высокое содержание интерстициальной жидкости (имеет МР-сигнал высокой интенсивности на Т2-ВИ). На Т1-ВИ утолщение синовиальной ткани имеет низко- или среднеинтенсивный МР-сигнал. Однако утолщенную синовиальную ткань сложно отличить от находящейся рядом синовиальной жидкости или хряща. Отложение гемосидерина или хронический фиброз может понижать интенсивность сигнала гиперплазированной синовиальной ткани на изображениях с длинным ТЕ (Т2-ВИ) и иногда даже на изображениях с коротким ТЕ (Т1-ВИ; изображениях, взвешенных по плотности протонов; во всех GE-последовательностях).
Как отмечалось ранее, КА оказывает парамагнитный эффект на рядом расположенные протоны воды, вызывая их более быструю релаксацию Т1. Водосодержащие ткани, накопившие КА (содержащие хелат Gd), показывают повышение интенсивности сигнала на Т1-ВИ пропорционально концентрации в ткани накопившегося КА. При внутривенном введении КА быстро распределяется по гипервaскуляризированным тканям, таким, как воспаленная синовиальная оболочка. Хелатный комплекс гадолиния имеет относительно малые молекулы, быстро диффундирующие внутрь даже через нормальные капилляры и, как недостаток, с течением времени в находящуюся рядом синовиальную жидкость (Drape J.-L. еt al., 1993; Winalski C.S. et al., 1993; Peterfy C.G. et al., 1994a). Непосредственно после болюсного в/в введения КА синовиальная оболочка сустава может быть видна отдельно от других структур, так как интенсивно усилена. Контрастное отображение высокоинтенсивных синовиальной оболочки и рядом лежащей жировой ткани может быть увеличено методикой подавления жира. Скорость, с которой происходит контрастное усиление синовиальной оболочки, зависит от числа факторов, включающих: скорость тока крови в синовии, объем гиперплазированной синовиальной ткани и свидетельствует об активности процесса.
Кроме того, определение количества и распределения воспаленной синовиальной оболочки и жидкости в суставах при артритах (и ОА) предоставляет возможность установления степени выраженности синовита путем мониторинга скорости синовиального усиления с Gd-содержащим КА в течение периода наблюдения за больным (Konig H. еt al., 1990; Drape J.-L. еt al., 1993; Yamato M. et al., 1993; Tamai K. et al., 1994). Высокая скорость синовиального усиления и быстрое достижение пика усиления, следующие за болюсным введением КА, относятся к активному воспалению или гиперплазии, в то время как медленное усиление соответствует хроническому фиброзу синовиальной оболочки. Хотя сложно контролировать тонкие отличия в фармакокинетике Gd-содержащего КА при МРТ-исследованиях в разных периодах заболевания одного и того же больного, скорость и пик синовиального усиления могут служить критериями для назначения или отмены соответствующей противовоспалительной терапии (Tamai K. et al., 1994; Stiskal M.A. et al., 1995). Высокие показатели этих параметров характерны для гистологически активного синовита.
МРТ других компонентов сустава
Вспомогательный аппарат сустава, т.е. связки, мениски, сухожилия, суставная губа являются важными в поддержании статической и динамической стабильности, распределении механической нагрузки и функциональной целости суставов. Потеря этих функций повышает биомеханический износ и является причиной повреждения сустава, очевидно, из-за большого снижения риска возникновения ОА после менискэктомии (Lynch M.A. et al., 1983; Jiang Y. et al., 1997; White D. et al., 1998), при разрывах крестовидных связок и ротаторной манжеты плеча (Jiang Y. et al., 1996). Эти структуры состоят преимущественно из коллагена, который обеспечивает силу натяжения, а также удерживает протоны воды. Т2 коллагена обычно такое быстрое (<1 мс) (Fullerton G. еt al., 1985), что в большинстве случаев имеет вид сигнала низкой интенсивности во всех импульсных последовательностях, очерченного высокоинтенсивными структурами, такими, как жировая ткань или синовиальная жидкость.
Неповрежденные связки имеют вид темных полос (рис. 73, 74). Прерывание их является прямым признаком разрыва связок. Однако необходимо учитывать, что имитация разрыва связки может встречаться при получении косой плоскости среза через интактную связку. Для изображения некоторых связок может понадобиться специальный выбор плоскости. Передняя крестообразная связка коленного сустава лучше всего видна на косых сагиттальных изображениях колена в нейтральной позиции или на прямых сагиттальных с небольшим отведением голени, в то время как нижняя lig. glenohumerale плечевого сустава в принципе статически стабильна при отведении плеча и сложна для визуализации, если бы не положение плеча в состоянии отведения и наружной ротации (Tirman P.F.J. et al., 1994). Многоплоскостная 3-D-реконструкция достаточно полно анализирует целость связок, но не является первоначально полученным изображением.
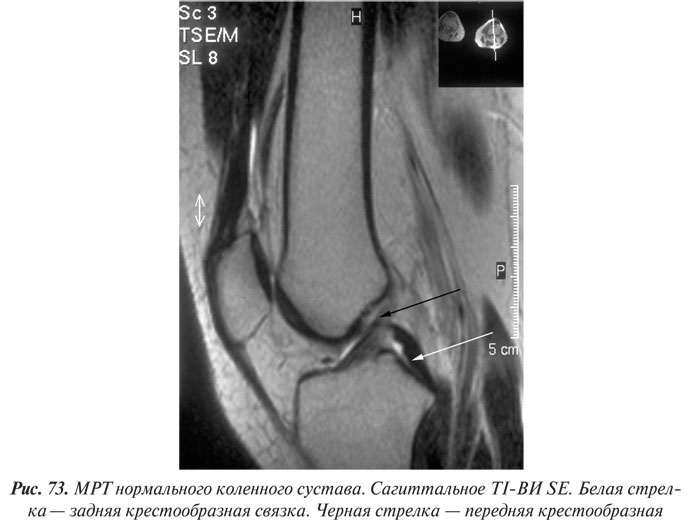
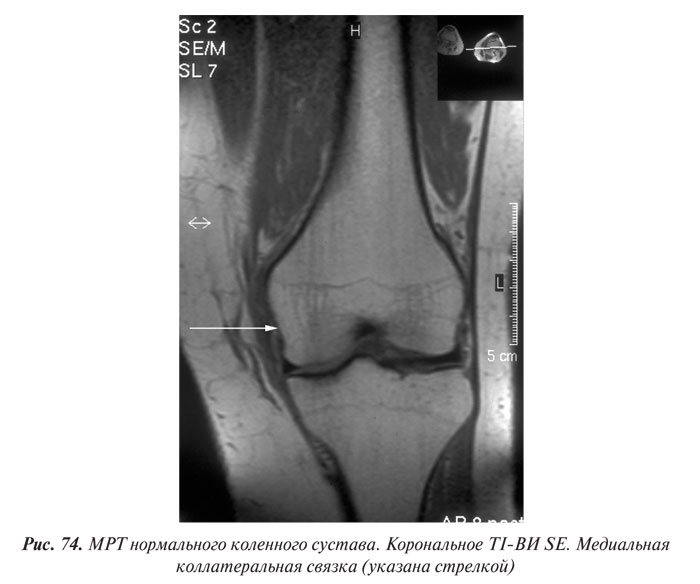
Мениски состоят из фиброзного хряща и содержат большое количество коллагеновых волокон, пространственно расположенных так, чтобы противостоять силе натяжения при воздействии весовых нагрузок. Волокна ориентированы преимущественно циркулярно, особенно в периферической части мениска, что объясняет склонность к разрывам, которые идут продольно, поэтому линейные трещины между волокнами коллагена образуются чаще, чем поперек волокон. Когда происходит локальная потеря коллагена, например, при миксоидной или эозинофильной дегенерации, которая обычно тоже сопровождается локальным повышением содержания воды, уменьшается эффект укорочения Т2, а сигнал от воды не маскируется и проявляется в виде округлого или линейного участка со среднеинтенсивным сигналом внутри мениска на коротких ТЕ-изображениях (Т1-взвешенных по протонной плотности SE или GE), имеет склонность постепенно исчезать при длинном ТЕ. Эти патологические сигналы не являются разрывами в отличие от нарушения целости мениска. Разрыв мениска может быть обусловлен грубой деформацией его поверхности. Иногда большое количество синовиальной жидкости очерчивает контур разрыва мениска и он визуализируется на Т2-ВИ, но в большинстве случаев невыявленные разрывы менисков не видны на длинных ТЕ-изображениях. Короткие ТЕ-изображения являются, таким образом, высокочувствительными (>90%), но отчасти неспецифическими для разрывов мениска, тогда как длинные ТЕ-изображения являются нечувствительными, хотя высокоспецифическими, когда они видны.
МРТ является чувствительной ко всему спектру патологии сухожилий и выявляет тендиниты и разрывы в большинстве случаев с большей точностью, чем клиническое обследование (Rubens D.J. et al., 1993). Нормальные сухожилия имеют ровные края и гомогенный сигнал низкой интенсивности при длинном ТЕ (Т2-ВИ) (см. рис. 73). Разрыв сухожилия может быть частичным или полным и изображается различными степенями прерывания сухожилия высокоинтенсивным сигналом внутри сухожилия на Т2-ВИ при МРТ. При теносиновите жидкость может быть видна под сухожильной оболочкой, но само сухожилие имеет нормальный вид. Тендинит обычно является результатом расширения и неровности сухожилия, но более надежный симптом — это повышение интенсивности сигнала внутри сухожилия на Т2-ВИ. Разрыв сухожилия может быть результатом механического износа, возникающего из-за трения об зазубренные ОФ и острые края эрозий, или первичного воспаления в самом сухожилии (Williamson S.C., Feldon P., 1995). Отрыв сухожилия от места прикрепления может быть острым. Чаще разрываются сухожилия экстензоров запястья или кисти, ротаторной манжеты плеча и сухожилие задней большеберцовой мышцы в голеностопном суставе. Тендинит и разрыв ротаторной манжеты плеча и сухожилия длинной головки бицепса в большинстве случаев проявляются болью и нестабильностью плечевого сустава. Полный разрыв ротаторной манжеты плеча — результат переднего подвывиха головки плечевой кости и часто является ведущим при ОА.
Мышцы содержат меньше коллагена и поэтому имеют сигнал средней интенсивности на Т1- и Т2-ВИ. Воспаление мышц иногда сопровождает артрит и имеет сигнал высокой интенсивности на Т2-ВИ, потому что в обоих случаях с развитием интерстициального отека повышается содержание воды и удлинение Т2 связано с потерей коллагена. И наоборот, поствоспалительный фиброз имеет тенденцию к снижению интенсивности сигнала на Т2-ВИ, в то время как мраморная жировая атрофия мышц имеет высокоинтенсивный сигнал жира на Т1-ВИ. Для мышц типична локализация процесса.
Можно сделать вывод, что МРТ — высокоэффективный диагностический, неинвазивный метод, дающий информацию обо всех составных частях сустава одновременно и способствующий изучению структурных и функциональных параметров при заболеваниях суставов. МРТ может выявлять очень ранние изменения, связанные с дегенерацией хряща, когда клинические симптомы минимальны или отсутствуют. Раннее выявление пациентов, у которых имеется риск прогрессирования заболевания, обнаруженный при МРТ-исследовании, позволяет назначить соответствующее лечение намного раньше, чем при использовании клинических, лабораторных и радиологических методов. Применение МР-контрастных агентов значительно повышает информативность метода при ревматических заболеваниях суставов. Более того, МРТ обеспечивает объективные и количественные измерения тонких, едва уловимых морфологических и структурных изменений различных тканей сустава с течением времени и поэтому является более надежным и легко воспроизводимым методом, который помогает осуществлять мониторинг течения ОА. МРТ также облегчает оценку эффективности новых препаратов для лечения больных с ОА и позволяет быстро проводить исследования. Необходима дальнейшая оптимизация этих измерений, так как они могут быть применены как мощные объективные методы для исследования патофизиологии ОА.
Ультразвуковое исследование суставов при ОА
Применение ультразвукового исследования (сонографии) в ревматологии — относительно новое и перспективное направление. В последнее десятилетие методика ультразвукового исследования (УЗИ) получила широкое распространение как техника визуализации при обследовании пациентов с ревматическими заболеваниями суставов, а также контроля за лечением (Manger B., Kalden J.R., 1995; Manger B., Backhaus M., 1997; Grassi W., Cervini C., 1998; Gibbon W.W., Wakefield R.J., 1999). Это стало возможным благодаря усовершенствованию компьютерной техники и разработке датчиков с более высокой частотой. Обычно сонография используется для оценки патологии мягких тканей и выявления жидкости, но позволяет также визуализировать хрящ и поверхности костных структур (Grassi W. et al., 1993; 1999; Backhaus M. et al., 1999).
Ряд несомненных достоинств — неинвазивность (в отличие от артроскопии), доступность, простота, экономичность (в сравнении с КТ и МРТ) — обеспечили методу УЗИ опорно-двигательного аппарата приоритет среди других инструментальных методов исследования суставов и мягких тканей. УЗИ высокоинформативно в отражении мелких деталей поверхности костей, связочно-сухожильного аппарата, а также позволяет выявлять и контролировать воспалительные изменения в тканях. Преимуществом УЗИ перед рентгенологическим методом является также то, что положение датчика определяется исключительно целями, поставленными исследователем, поэтому в отличие от рентгенографии нет необходимости строгого позиционирования пациента для получения стандартных проекций, т.е. датчик может быть полипозиционным. При проведении рентгенологического исследования для визуализации определенных структур в стандартных проекциях часто приходится делать снимки несколько раз, что приводит к увеличению времени исследования, дополнительному расходованию материалов (пленки) и облучению пациента и персонала лаборатории. К числу основных недостатков УЗИ относятся невозможность визуализации структуры костной ткани, субъективность оценки полученных данных.
В связи с вышесказанным очень важно правильно использовать возможности УЗИ для выявления патологических изменений в различных суставах и мягких тканях, для чего необходимо знать не только возможности современной диагностической аппаратуры, но и ультразвуковую анатомию исследуемой области и наиболее типичные проявления заболевания.
Оборудование и методики проведения УЗИ
УЗИ мягких тканей и суставов следует выполнять с помощью высокочастотного линейного датчика, работающего в диапазоне 7–12 МГц. Применение датчика с меньшей рабочей частотой (3,5–5 МГц) ограничивается только исследованием тазобедренного сустава и исследованием суставов у тучных пациентов. Важно также выбрать правильные программы исследования для различных суставов. Многие ультразвуковые приборы уже сегодня содержат набор стандартных программ для исследования различных отделов опорно-двигательного аппарата. Современные ультразвуковые аппараты оснащены также большим количеством дополнительных режимов сканирования, которые позволяют значительно расширять диагностические возможности обычного серо-шкального сканирования, таких, как режим нативной или тканевой гармоники, режим панорамного сканирования и режим трехмерной реконструкции. Так, сканирование в режиме нативной гармоники позволяет получить более контрастное, чем при обычном серо-шкальном сканировании, изображение нежных гипоэхогенных структур, отражающих зоны разрывов связки или мениска. Режим панорамного сканирования позволяет получить расширенное изображение сразу нескольких структур, например структур, образующих сустав, и отобразить их пространственное расположение и соответствие. Трехмерная реконструкция обеспечивает получение не только волюметрической информации, но и дает возможность получать многоплоскостные срезы исследуемых структур, в том числе и фронтальные. Принципиально новым является применение высокочастотных ультразвуковых датчиков, которые обеспечивают возможность визуализации различных по эхогенности и глубине залегания структур. Эти датчики значительно повысили разрешающую способность в ближних к датчику зонах с одновременным повышением проникающей способности ультразвукового луча. В них используется узкий ультразвуковой луч, работающий в высокочастотном диапазоне, способствующий значительному повышению латеральной разрешающей способности в зоне ультразвукового фокуса. Возможности ультразвукового сканирования также существенно расширились в связи с внедрением в практику новых ультразвуковых технологий, основанных на эффекте Допплера. Новые методики ультразвуковой ангиографии позволяют визуализировать патологический кровоток в зоне воспалительных изменений органов и тканей (например, при синовите).
Артефакты
Все артефакты, возникающие при проведения УЗИ опорно-двигательного аппарата, разделяются условно на стандартные, возникающие при всех УЗИ, и специфические, характерные для УЗИ связок и сухожилий.
Артефакты, возникающие за счет рефракции УЗ-луча. По краям округлых структур на границе двух различных акустических сред может возникать дистальная тень. В норме этот эффект можно наблюдать при поперечном сканировании ахиллова сухожилия. Внутримышечные перегородки также могут давать позади себя тень. Позади жидкостных структур возникает эффект усиления ультразвукового сигнала. Поэтому структуры, располагающиеся позади содержащих жидкость объектов, могут выглядеть более эхогенными, чем в норме. Например, наличие небольшого выпота в синовиальной оболочке сухожилия повышает его эхогенность (рис. 75). Для сравнения на рис. 76 показана УЗ-картина разгибателей кисти контралатеральной стороны у той же больной.
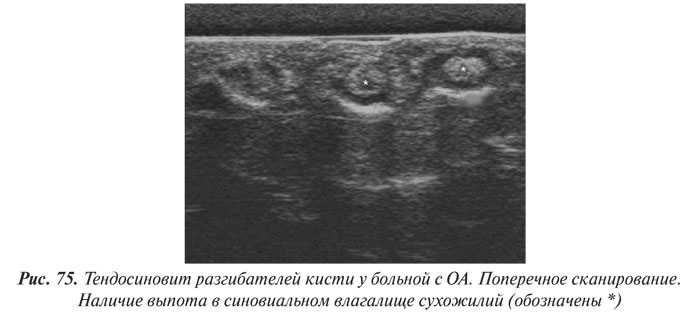
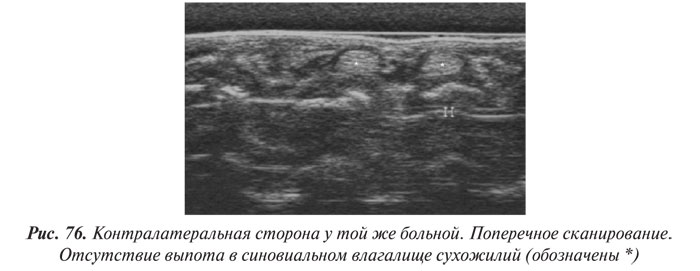
Реверберация. Этот эффект может возникать позади высокоотражающих объектов, таких, как кость, диафрагма, приводя к появлению зеркальных или фантомных изображений. При исследовании опорно-двигательного аппарата такой эффект можно наблюдать позади малоберцовой кости. Металлические и стеклянные объекты вызывают эффект реверберации, получивший название «хвост кометы». Как правило, при исследовании органов опорно-двигательного аппарата он может наблюдаться при наличии металлических протезов или металлических (стеклянных) инородных тел.
Рефракция. Возникает на границе отражающих сред с разным звукопроведением (например, жировая ткань и мышцы) в результате преломления ультразвукового луча, что приводит к дислокации изображаемых структур. Для уменьшения рефракции следует держать датчик перпендикулярно к исследуемым структурам.
Анизотропия – специфический для УЗИ опорно-двигательного аппарата артефакт, возникающий при УЗ-сканировании линейным датчиком сухожилий, когда сканирующий ультразвуковой луч не падает на них строго перпендикулярно. На том участке сухожилия, где нет точного перпендикулярного отражения ультразвукового луча, будут появляться зоны пониженной эхогенности, которые могут симулировать наличие патологических изменений. Мышцы, связки и нервы также обладают слабым эффектом анизотропии. Снижение эхогенности сухожилия приводит к ухудшению качества визуализации его фибриллярной структуры. Однако в ряде случаев, когда необходимо визуализировать сухожилие на фоне эхогенной клетчатки, изменяя угол сканирования, сухожилие будет выглядеть контрастным (гипоэхогенным) на фоне эхогенной жировой клетчатки.
Для того чтобы избежать анатомической неясности результатов УЗИ опорно-двигательного аппарата (например, относительно стандартных рентгенологических стереотипов, хорошо знакомых специалистам), мы сочли необходимым далее рядом с УЗ-изображениями разместить схемы рентгенограмм исследуемых суставов с указанием основных анатомических ориентиров.
Коленный сустав
Как известно, рентгенография в большинстве случаев позволяет определить поражение коленного сустава при вовлечении в патологический процесс элементов кости. Часто эти изменения уже необратимы, лечение таких больных затруднено.
Преимуществами УЗИ коленного сустава являются доступность, экономичность, отсутствие лучевой нагрузки на пациента, возможность визуализации мягкотканных компонентов сустава, позволяющая выявить ранние признаки поражений, которые практически не определяются при рентгенографии.
Разработанная L. Rubaltelly (1993) методика УЗИ позволяет определять основные признаки патологии коленного сустава — травматических повреждений, дегенеративно-дистрофических и воспалительных процессов и др.
УЗИ обычно начинают с супрапателлярной области. Здесь хорошо визуализируется при продольном и поперечном сканировании (позиционирование датчика представлено на рис. 77, а и на рис. 78 соответственно) сухожилие четырехглавой мышцы бедра, контуры верхнего полюса надколенника, супрапателлярная сумка (верхний заворот), исследование которой при ОА особенно информативно для диагностики выраженности дегенеративно-дистрофических и воспалительных поражений. В норме синовиальная оболочка не визуализируется (рис. 77, б). При деформирующем ОА с синовитом отмечаются увеличение сумки, выпрямление складок, наличие избытка жидкости (рис. 77, в–е).
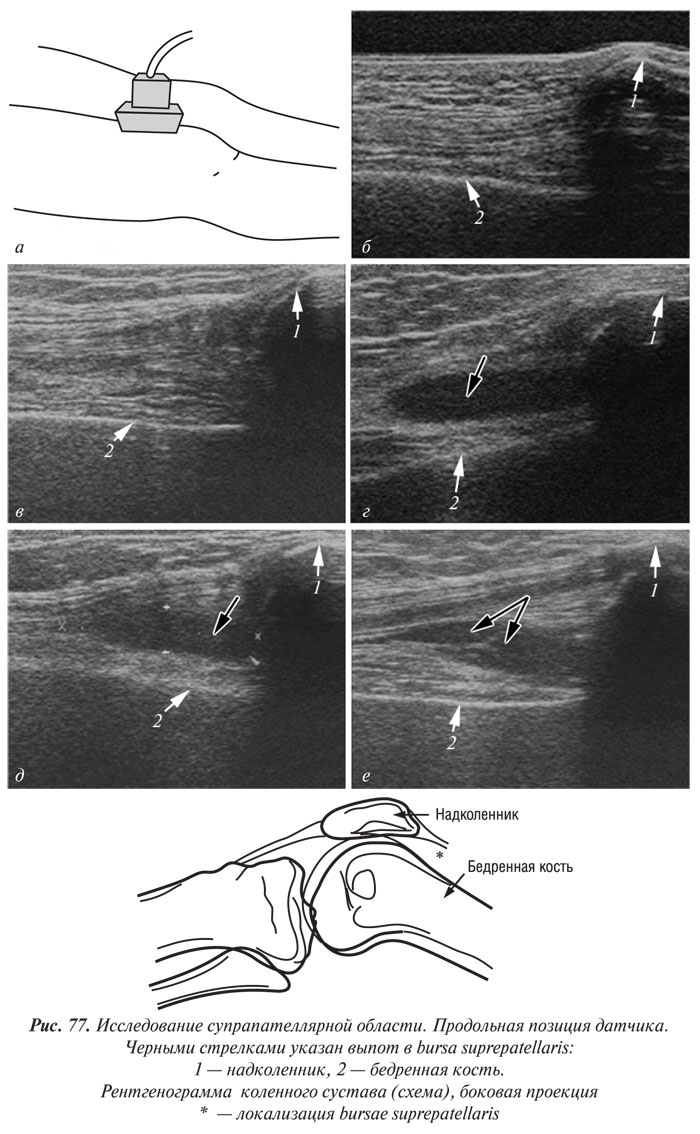
Дальнейшее исследование при сгибании коленного сустава и перемещении датчика в поперечное положение позволяют визуализировать ПФО сустава, в частности гиалиновый хрящ и наличие или отсутствие над ним избытка жидкости (рис. 78). Перевод датчика на область ниже надколенника дает возможность определить поверхностно расположенную собственную связку надколенника, ее структуру, поднадколенниковое жировое тело, поднадколенниковую синовиальную складку, глубже которой расположена передняя крестовидная связка. Поперечное положение датчика (рис. 79, а) позволяет визуализировать суставной хрящ латерального и медиального мыщелков, изменения формы суставных поверхностей бедренной кости (уплощение и т.д.) (рис. 79, б–е). Установление датчика на внутреннюю и наружную боковую поверхности коленного сустава позволяет визуализировать соответственно внутреннюю и наружную коллатеральные связки, краевые костные разрастания бедренной и большеберцовой костей, наличие или отсутствие выпота (рис. 80, 81).
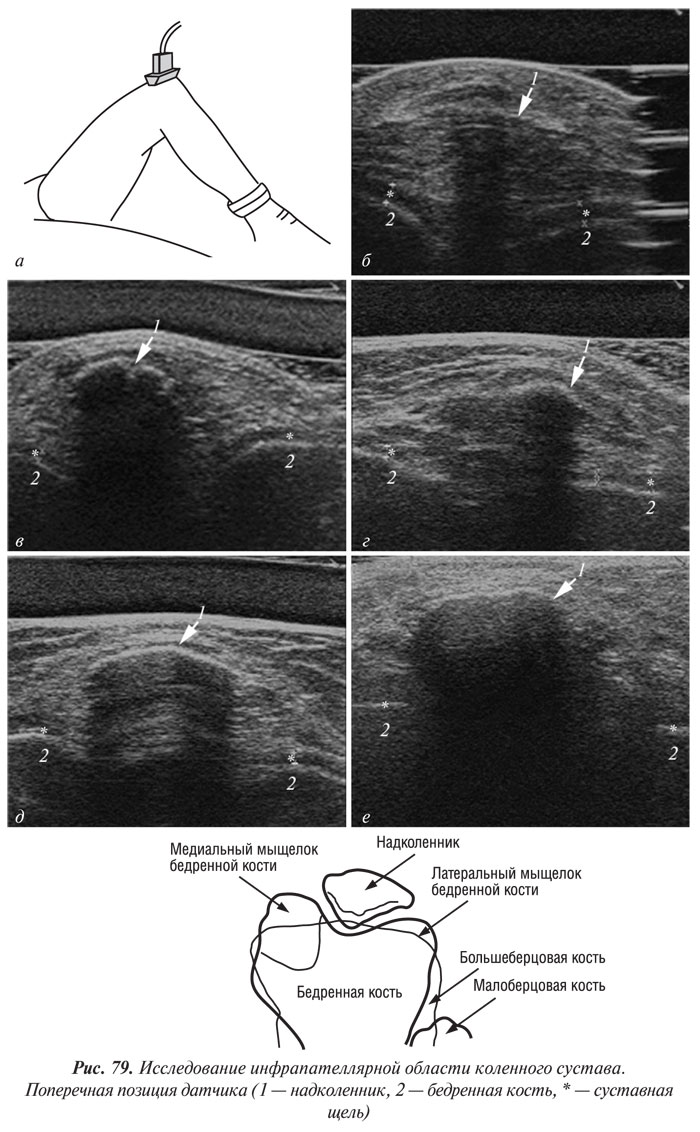

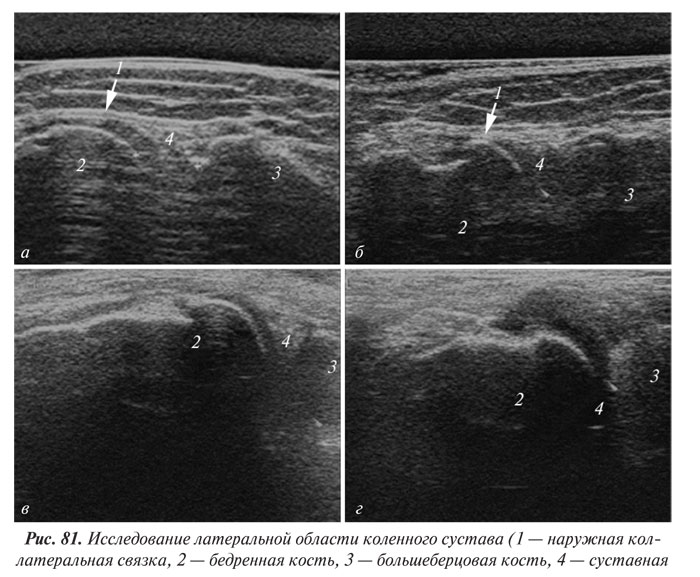
При УЗИ подколенной ямки можно визуализировать патологические образования данной области (киста Бейкера), суставные хрящи латерального и медиального мыщелков, задние части медиального и латерального мыщелков, задние рога латерального и медиального менисков, заднюю крестовидную связку.
Мы обследовали 62 больных гонартрозом, причем провели сравнительную оценку данных УЗИ и термографии (см. выше). УЗИ опорно-двигательного аппарата проводили на аппарате SONOLINE Omnia (Siemens) с линейным датчиком 7,5L70 (частота 7,5 МГц) в режиме «ortho» в стандартных позициях. Оценивали состояние суставных поверхностей кости (включая состояние кортикального слоя, в том числе и субхондральной кости), суставных щелей, околосуставных мягких тканей, наличие выпота и его особенности, изменения связочно-сухожильного аппарата и некоторые другие параметры.
По данным УЗИ, у пациентов с гонартрозом наблюдались: сужение суставной щели за счет снижения высоты суставного хряща (поперечная позиция датчика), костные разрастания (ОФ) и/или дефекты суставных поверхностей костей, изменения синовиальной мембраны и наличие выпота в суставах, изменения параартикулярных мягких тканей (все позиции). Изменения поверхности кортикального слоя суставных поверхностей (неровность, формирование дефектов поверхности) регистрировались уже на начальных стадиях заболевания (I рентгенологическая стадия по Kellgren) (см. рис. 80, а) и достигали максимальной выраженности при ІІІ и IV стадии. Так, на рис. 80, а–в представлено формирование ОФ на костных суставных поверхностях медиальной области коленного сустава, на рис. 81, а–в — латеральной области. Связочный аппарат — внутренняя (большеберцовая) коллатеральная связка и наружная (малоберцовая) коллатеральная связка обозначены соответственно на рис. 80 и 81.
Выпот в суставе отмечали у 28 (45,16%) пациентов с гонартрозом, преимущественно при ІІ и ІІІ стадиях заболевания, он в основном локализовался в верхнем завороте (у 32,3% больных) (см. рис. 77, г–е), в латеральной части суставной щели (у 17,7%) (см. рис. 81, г), реже — в медиальной части суставной щели (у 9,7%) и в заднем завороте (у 3,2%) (рис. 82, а, в). На рис. 82, б для сравнения показана поперечная задняя проекция при исследовании нормального коленного сустава, а под ней — та же проекция больной с ОА и кистой Бейкера. Выпот имел гомогенную анэхогенную эхоструктуру при условии длительности клинической симптоматики ОА до 1 мес (см. рис. 77, г), а у больных с клиническими признаками персистирующего воспаления в суставе — негомогенную, с наличием включений различного размера и эхоплотности (см. рис. 77, д, е). Толщина синовиальной оболочки была увеличена у 24 (38,7%) обследованных, а неравномерное ее утолщение регистрировалось у 14 из них (см. рис. 77, е). Хотелось бы отметить, что средняя длительность заболевания у этих пациентов была большей, чем в группе больных с гонартрозом в целом (6,7±2,4 года), причем у пациентов с неравномерным утолщением синовиальной оболочки она была еще большей (7,1±1,9 года). Таким образом, особенности синовита отображали длительность гонартроза и остроту процесса на момент обследования.
Оценку гиалинового хряща сустава (поднадколенниковый доступ, поперечная позиция датчика) (см. рис. 79, а) проводили по следующим критериям: толщина, равномерность толщины, структура, поверхность, изменения поверхности субхондральной кости (наличие кист, эрозий, других дефектов). Отметим, что высота хряща больше уменьшалась на медиальном мыщелке в соответствии с большей механической нагрузкой на данную область (см. рис. 79, в–д; рис. 80, а, б). Стадийность изменений в хряще и субхондральной кости представлена на рис. 79, б–е.
На рис. 79, б представлен нормальный гиалиновый хрящ медиального (слева) и латерального (справа) мыщелков бедренной кости, на рис. 79, в–д видно уменьшение высоты гиалинового хряща у пациентов с гонартрозом (хрящ указан *), причем видна его негомогенная структура, а также наличие включений и неровность контуров субхондральной кости (обозначены стрелками). На рис. 79, е показана УЗ-картина коленного сустава в инфрапателлярной поперечной проекции у больного с гонартрозом III стадии по Kellgren. Видны резкое уменьшение высоты суставного хряща (указан стрелками), деформация надколенника.
Заслуживают внимания результаты, полученные при сопоставлении данных дистанционной термографии и УЗИ (табл. 26).

Как видно из табл. 26, сильная или очень сильная прямая связь по данным корреляционного анализа обнаружена между градиентом температур в медиальной и латеральной областях коленных суставов, с одной стороны, и выпотом в суставе и утолщением синовиальной оболочки по данным УЗИ — с другой. Более слабая связь обнаружена между наличием костных разрастаний в медиальной области коленных суставов (данные УЗИ) и градиентом температур во всех исследованных участках суставов.
Следовательно, УЗИ и термография являются взаимодополняющими методами в диагностике ОА коленных суставов, что особенно касается активности процесса и выраженности дегенеративных изменений суставов.
Тазобедренный сустав
Хотя ведущим методом выявления коксартроза является МРТ, УЗИ имеет преимущества в выявлении небольшого выпота в тазобедренном суставе (даже менее 1 мл), а также нарушений состояния околосуставных мягких тканей на ранних стадиях развития заболевания. Исследование осуществляется с помощью линейного или конвексного датчика в диапазоне 3,5–7 МГц в зависимости от конституциональных особенностей пациента.
Исследование проводится обычно из переднего доступа (продольная и поперечная позиции датчика, рис. 83), в положении пациента на спине с выпрямленными ногами. Костными ориентирами являются верхний край вертлужной впадины и полуокружность головки бедренной кости (рис. 84, а). Из переднего доступа хорошо визуализируются гипоэхогенный гиалиновый хрящи, синовиальная суставная капсула тазобедренного сустава (представлена волокнами седалищно-бедренной, лобково-бедренной и подвздошно-бедренной связок) (рис. 84, б). Для визуализации большого вертела и вертельной сумки, располагающейся над ним поверхностно подкожно, используется латеральный доступ. Седалищный бугор исследуется из заднего доступа в положении пациента лежа на боку с согнутой и приведенной к животу исследуемой конечностью.
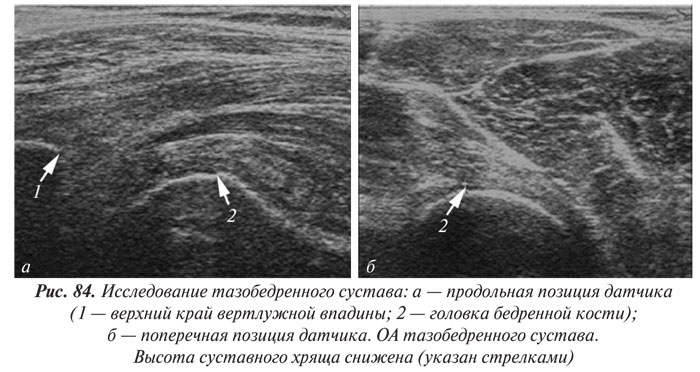
Нами было проведено УЗИ 54 больных коксартрозом (диагностические критерии ACR, 1990) в возрасте 41 года — 74 лет (средний возраст — 56,44±7,12 года); из них мужчин — 22, женщин — 32, длительность заболевания составила 0,6 года — 37 лет (в среднем — 8,3±3,48 года). Данные УЗИ у пациентов с коксартрозом в зависимости от клинико-рентгенологической стадии заболевания представлены в табл. 27.
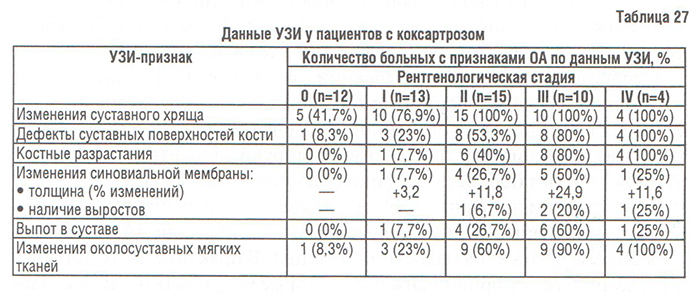
Наличие выпота в тазобедренном суставе диагностировали при условии, что расстояние между поверхностью шейки бедренной кости и суставной капсулой превышало 9–10 мм (Зубарев А.В., 2002).
Плечевой сустав является одним из самых удобных для УЗИ, особенно потому, что многие патологические изменения происходят в его мягких тканях. Из-за низкой информативности рентгенологического метода в отражении именно мягкотканных изменений позволили УЗИ наряду с МРТ стать ведущими в исследовании плечевого сустава.
Особое внимание при исследовании следует уделять так называемой ротаторной манжетке, формируемой сухожилиями четырех мышц: надостной, подостной, подлопаточной и малой круглой. При этом обязательными проекциями являются отведение руки пациента в позицию наружной ротации (для исследования подлопаточной мышцы) с пассивным внутренним и внешним вращением конечности пациента, заведение исследуемой руки за спину с поперечным позиционированием датчика (для оценки сухожилия надостной мышцы). В практике часто встречаются разрывы ротаторной манжетки, которые могут быть полными, частичными, продольными и поперечными.
Необходимо учитывать, что речь идет не только о травматических повреждениях этого образования, но и о том, что у лиц с ОА, особенно пожилого возраста, разрывы часто наступают вследствие дегенеративных изменений в суставе и составляющих его элементах, в результате которых возникает протрузионный тендинит вплоть до полного дегенеративного разрыва ротаторной манжеты плеча. Это может сопровождаться бурситом не только в подакромиальной, но и в поддельтовидной сумке. Чаще всего эти изменения локализуются у основания сухожилия надостной, подостной мышцы и большого бугорка плечевой кости.
Все эти изменения могут привести к развитию так называемого импинджемент-синдрома, характеризующегося стойкими дегенеративными изменениями перикапсулярных тканей плечевого сустава и часто сопровождающегося выраженным болевым синдромом, различной степенью ограничения объема движения в суставе. Причинами развития импинджемент-синдрома, наряду с ОА, являются микротравматические повреждения капсулы, травма плечевого сустава, осложненная разрывом ротаторной манжеты, а также такие заболевания, как ревматоидный артрит и диабетическая артропатия. Различают три стадии заболевания.
Первая стадия — отек и кровоизлияние. Боль проявляется после физической нагрузки, характерна боль, возникающая ночью. На этом этапе определяется симптом «дуги» или «арки болезненного отведения», когда при отведении больной руки появляется боль в пределах 60–120° активной абдукции. Это указывает на то, что происходит соударение большого бугорка плечевой кости, передненаружного края акромиона и клювовидно-ключичной связки. Между этими структурами в месте прикрепления вращательной манжеты происходит ее ущемление. При УЗИ в суставной сумке отмечается неравномерное утолщение сухожилия надостной мышцы, с наличием гиперэхогенных участков фиброза. В проекции верхушки акромиального отростка лопатки, в месте прикрепления сухожилия надостной мышцы к большому бугру плечевой кости, отмечаются его утолщение и субакромиальный бурсит.
Вторая стадия — фиброз и тендинит. Наблюдаются болезненные явления в плечевом суставе при полном отсутствии активных движений. В сухожильно-мышечном и связочном комплексе плечевого сустава происходят дегенеративные изменения. В результате снижается стабилизирующая функция сухожильного аппарата. При УЗИ отмечается неоднородность структуры сухожилия надостной мышцы, появление множественных мелких гиперэхогенных включений. В межбугорковой ямке визуализируются утолщенные, неровные контуры длинной головки двуглавой мышцы плеча с единичными точечными обызвествлениями и выпотом.
Третья стадия — разрывы ротаторной манжеты — характеризуется устойчивой болевой контрактурой при пассивных движениях и почти полной утратой движений в плечевом суставе. Полость плечевого сустава значительно уменьшается в объеме, суставная капсула становится ригидной и болезненной. В периартикулярных тканях развивается адгезивный капсулит.
Дегенеративно-дистрофические изменения при ОА других суставов эхографически также проявляются сужением суставных щелей, уменьшением высоты хряща, изменениями периартикулярных мягких тканей и костных суставных поверхностей с формированием при длительном течении ОФ, как это имеет место при гонартрозе или коксартрозе, поэтому на них мы подробно не останавливаемся. На рис. 85 представлено продольное позиционирование датчика для исследования мелких суставов кистей. Эхографическая картина пястно-фаланговых и проксимальных межфаланговых суставов при ОА представлена на рис. 86. На рис. 86, а представлена нормальная УЗ-картина пястно-фалангового и проксимального межфалангового суставов ІІ пальца кисти. На рис. 86, б–з отмечаются УЗ-признаки ОА пястно-фаланговых и проксимальных межфаланговых суставов пальцев кистей, с наличием синовита этих суставов (рис. 86, в–е), сужением суставных щелей (рис. 86, б, в, д, ж), наличием разрастаний костных суставных поверхностей — ОФ (рис. 86, б, е, ж). На рис. 86, з представлена картина эрозивного ОА ІІ пальца кисти (видна эрозия (+) головки пястной кости ІІ пальца, ее размеры приведены справа).
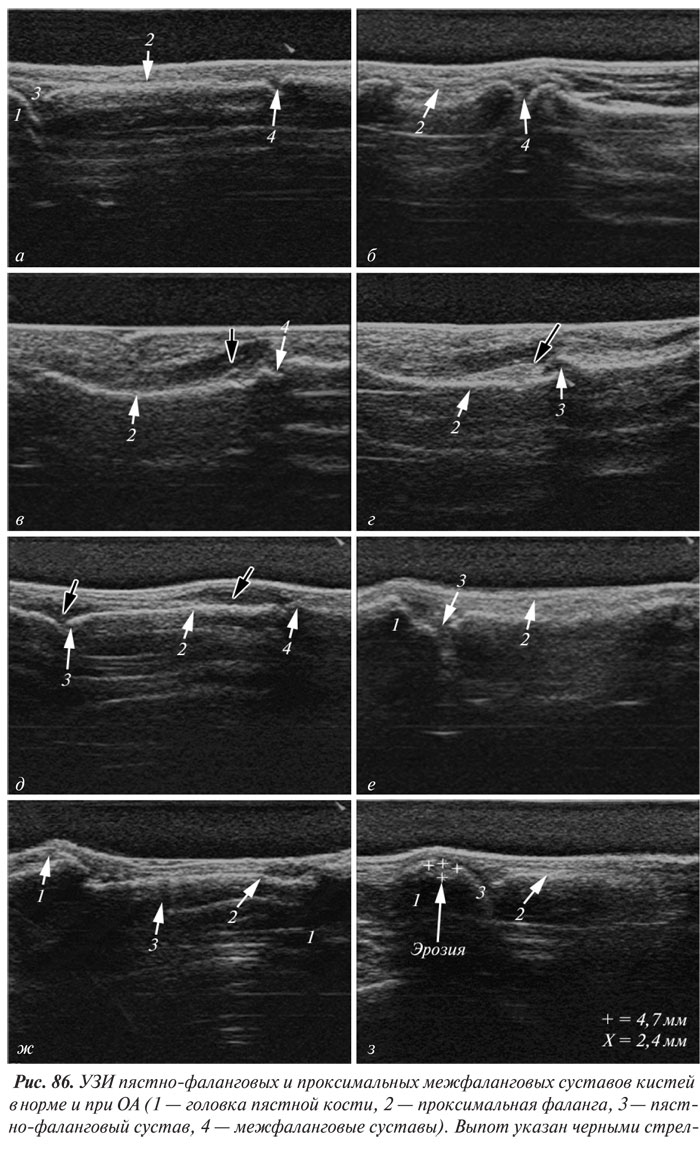
На рис. 75 представлена УЗ-картина тендосиновита разгибателей кисти у больной с ОА (поперечное сканирование). Видно наличие выпота в синовиальном влагалище сухожилий (последние обозначены *). Для сравнения на рис. 76. представлена контралатеральная сторона у той же больной при той же позиции датчика. Видно отсутствие выпота в синовиальном влагалище сухожилий (обозначены *).
На рис. 87, б представлена УЗ-картина суставов предплюсны при ОА при продольном позиционировании датчика (для сравнения на рис. 87, а приведена норма в той же проекции). Видны резко суженные суставные щели (указаны стрелками), неровность контуров костей, наличие костных разрастаний.
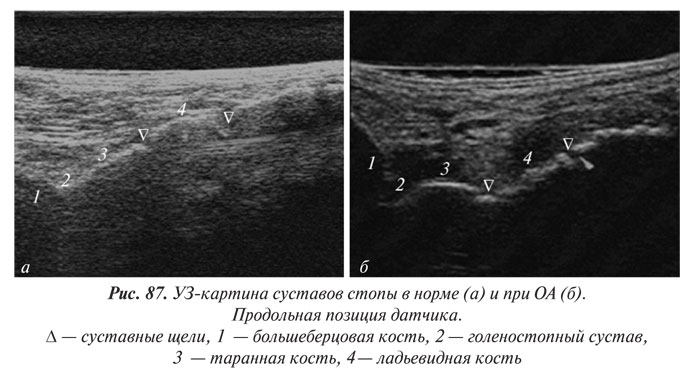
Таким образом, УЗИ имеет преимущества перед традиционной рентгенографией в раннем выявлении локальных изменений в суставах и околосуставных мягких тканях больных ОА.
В заключение приводим примерный протокол обследования опорно-двигательного аппарата (программа «Ортопедия») и образец УЗИ при гонартрозе.
Пример протокола УЗИ больного с гонартрозом:
Суставные соотношения сохранены (нарушены, утрачены), без деформации (уплощены, деформированы). Краевые костные разрастания бедренной и большеберцовой костей не определяются (имеются до …мм, локализация). Верхний заворот не изменен (расширен, с наличием избытка однородной или неоднородной жидкости, синовиальная оболочка не визуализируется или утолщена). Толщина гиалинового хряща в области пателло-феморального сустава, латерального и медиального мыщелка в пределах нормы до 3 мм (уменьшена, увеличена), равномерная (неравномерная), структура однородная (с наличием включений, описание). Контуры субхондральной кости не изменены (неровные, с наличием кист, поверхностных дефектов, эрозий). Целость четырехглавой мышцы бедра и собственной связки надколенника не нарушена, lig. collaterales не изменены, целость волокон сохранена (УЗ-признаки частичного повреждения или полного разрыва). Передняя крестовидная связка не изменена (имеются признаки кальцификации). Мениски (наружный, внутренний) — структура однородная, контуры четкие, ровные (УЗ-признаки повреждения — фрагментация, кальцификация и др.).
Радиоизотопная сцинтиграфия
Радиоизотопная сцинтиграфия суставов проводится с помощью остеотропных радиофармацевтических препаратов (пирофосфат, фосфон, меченных 99mTc). Указанные препараты активно накапливаются в местах активного костного и коллагенового метаболизма. Особенно интенсивно они накапливаются в воспаленных тканях суставов, что отражается на сцинтиграммах суставов.
Метод радиоизотопной сцинтиграфии используют для ранней диагностики артритов, выявления субклинических фаз поражения суставов, дифференциальной диагностики воспалительных и дистрофических поражений.
Для ранней диагностики патологических изменений в суставах, выявления реактивного воспаления может быть использована сцинтиграфия скелета с пирофосфатом, меченным 99mTc (рис. 88). Гиперфиксация с диффузным распределением радиоизотопа отмечается при наличии реактивного синовита. В гиповаскулярных участках эпифизов костей на сцинтиграммах в зонах ишемии определяется снижение накопления радиофармпрепарата, тогда как в местах усиленного кровоснабжения, что соответствует участкам перестройки кости, накопление его равномерно повышено. При сравнении данных сцинтиграфии с результатами внутрикостной флебографии и измерения внутрикостного давления отмечено, что венозный стаз и повышенное давление в костномозговом канале сочетаются с аномально высоким поглощением радиофармпрепарата. При этом степень поглощения его прямо пропорциональна стадии дегенеративно-дистрофического процесса. Анализ распределения радионуклида при коксартрозе выявил повышенное накопление меченого соединения в зонах усиленной нагрузки, в основном в стенках кист и остеофитах, а также в зонах образования новой кости.
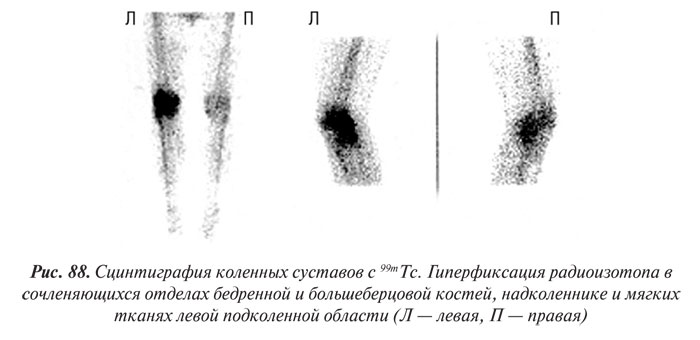
Термография
В широком смысле слова термография представляет собой производимую различными способами графическую регистрацию теплового поля объектов, т.е. поля их инфракрасного излучения (Карпужанский А.Л., 1979). Термограммой называют фиксированное двухмерное изображение температурного поля части или всего тела обследуемого (Розенфельд Л.Г. и соавт., 1988).
Термография является вспомогательным диагностическим тестом, который должен быть расшифрован в единой связи с клиническими, лабораторными, анамнестическими данными, полученными в соответствии с диагностическим алгоритмом. По мнению Л.Г. Розенфельда и соавторов (1988), основными преимуществами термографии являются:
- Абсолютная безопасность. Организм человека не подвергается ни облучению, ни повреждению. Возможно многократное исследование одного и того же субъекта.
- Быстрота исследования. В зависимости от типа термографа требуется от 1/16 мин до 4 мин. Время, необходимое для уравновешивания температуры кожи больного и окружающего воздуха (15 мин), можно существенно сократить при соответствующем оснащении кабинета термографии.
- Высокая точность. Минимальный регистрируемый градиент температуры между двумя точками на расстоянии одного миллиметра составляет 0,1 °С. Такая точность позволяет осуществить предварительную топическую диагностику очага поражения.
- Возможность выбора последовательности безопасных исследовательских процедур для беременных и детей.
- Возможность одновременной оценки функционального состояния нескольких систем организма (при обзорной термографии).
Важным моментом точного выполнения термографии является правильное оснащение кабинета, а также подготовка пациента к исследованию. В кабинете должны быть созданы условия для стабилизации воздействия факторов внешней среды на термодиагностическую аппаратуру и пациента. Для этого двери и окна занавешивают плотными светозащитными шторами. Возможные источники ИК-излучения (батареи центрального отопления) экранируют. В смотровом помещении рекомендуется поддерживать температуру 22±1 °С, так как при более высокой наблюдается снижение контрастности термограмм, а при более низкой температуре у пациентов развивается вазоконстрикция, что резко снижает информативность метода (Howell K.J., 1998). Относительная влажность воздуха в помещениях кабинета должна быть в пределах 40–70%. Скорость движения воздушных потоков в помещении не должна превышать 0,15–0,2 м/с. Этим требованиям отвечает закрытое помещение, оборудованное кондиционером (Мельникова В.П., Суханова В.Ф., 1982).
При заболеваниях суставов различной локализации следует придерживаться следующих правил подготовки пациента к термографическому обследованию:
А. Верхние конечности:
- Руки должны быть чистыми, лак с ногтей снять.
- В течение суток перед обследованием не применяют кремы, не принимают физиопроцедуры, сосудорасширяющие или сосудосуживающие средства.
- При обследовании руки освобождают от одежды и укладывают на столик-подставку.
Б. Нижние конечности:
- Ноги освобождают от любых повязок, компрессов и обнажают для адаптации кожи к температуре помещения.
- В течение суток перед обследованием не принимают лекарственные средства и не проводят физиотерапевтические процедуры.
- Накануне вечером необходимо сделать ножную ванну для снятия кожного сала и отслоившегося эпидермиса; лак с ногтей снять.
- Обследование пациента производят в положении лежа на спине, реже — в положении стоя.
Исследованию должен предшествовать период температурной адаптации, который у взрослого составляет 10–15 мин. В связи с тем что температурные показатели организма человека изменяются в течение суток каждые 3–4 ч с колебаниями 0,2–0,4 °С, сравнительные (динамические) исследования рекомендуется осуществлять в одни и те же часы. Также необходимо учитывать, что максимальная температура тела у здоровых людей отмечается в 15–16 ч.
Правильная интерпретация термограмм требует знания общей физиологии, анатомии и специальных областей медицины. В норме у здорового человека существуют зоны гипер- и гипотермии, обусловленные рядом причин. Появление зон гипертермии может быть вызвано:
- повышенным обменом веществ в данном органе или ткани в определенный промежуток времени (например, молочные железы в период лактации),
- «полостным эффектом» (области орбит, пупка, межъягодичной складки, подмышечные, паховые области, межпальцевые промежутки, медиальные поверхности сведенных вместе нижних конечностей или верхних конечностей, плотно прижатых к телу).
Некоторые топографические особенности нормальных термограмм
Спина и позвоночник на термограммах представлены гомогенной термотопографией при наличии незначительной гипертермии в срединной части поясничной области. Иногда наблюдается умеренная гипертермия межлопаточного пространства.
На термограмме спины можно выделить 4 постоянные зоны гипертермии (Лихтерман Л.Б., 1983):
1) в проекции остистых отростков, начиная с уровня среднегрудного отдела позвоночного столба; ширина первой зоны несколько больше в нижнегрудном и верхнепоясничном отделах по сравнению с нижнепоясничным,
2) в проекции межъягодичной складки,
3) две симметричные зоны в проеции крестцово-подвздошных сочленений (латеральнее и несколько выше межъягодичной складки),
4) в проекции почек (симметрично расположенные участки гипертермии неравномерной интенсивности).
Пояснично-крестцовый корешковый синдром приводит к снижению температуры кожи ноги в зоне иннервации данного корешка на 0,7–0,9 °С с одновременной легкой гипертермией сегмента на уровне соответствующих соединительных ветвей симпатического ствола. Новокаиновая блокада пораженного корешка нормализует температуру поверхности адекватного дерматома конечности и снижает температуру сегмента в пояснично-крестцовой области на 0,2–0,3 °С. Через 10–12 мин после завершения новокаиновой или тримекаиновой блокады поясничных симпатических узлов повышается температура кожи стопы и голени соответствующей стороны на 0,7—0,9 °С, что сохраняется в течение 2—3 мин (Розенфельд Л.Г. и соавт., 1988).
Средняя температура кожи в области спины и позвоночника — 33,5–34,2 °С (Розенфельд Л.Г. и соавт., 1988).
Верхние конечности. Термографическое изображение обеих верхних конечностей характеризуется симметричностью, хотя по данным Г.М. Фролова и соавторов (1979), отмечается незначительная термоасимметрия верхних конечностей, вызванная преобладающим развитием правой или левой конечности или разницей артериального давления.
Зоны гипертермии на термограммах верхних конечностей в норме определяются в области прохождения сосудистых пучков — внутренняя поверхность плеча, локтевого сустава, предплечья, подмышечная область. Относительная гипотермия характерна для наружной поверхности плеча и предплечья, пальцев (по сравнению с ладонями). В области І пальца кисти, межпальцевых промежутков, по ходу крупных вен на тыльной стороне кисти отмечается умеренная гипертермия (Лихтерман Л.Б., 1983). Средняя температура кожи в области верхних конечностей (кроме пальцев) — 31,2–32,6 °С, пальцев кистей — 27,2–28,6 °С (Розенфельд Л.Г., 1988).
Нижние конечности. Термографическое изображение обеих нижних конечностей также симметрично. В верхней и средней третях голеней определяются зоны выраженной гипертермии, тогда как в области коленного сустава, нижней трети голени и стопы отмечаются участки гипотермии.
На термограммах тыльной поверхности стоп регистрируется гетерогенная картина с тенденцией к уменьшению гипертермии сверху вниз — в области пальцев определяется зона гипотермии. На подошвенной поверхности стоп интенсивность гипертермии более выражена вдоль медиального края, особенно в проекции свода стопы. По латеральному краю и в области пальцев регистрируются зоны гипотермии.
На задней поверхности бедер определяются зона выраженной гипотермии в проекции ягодиц и зона гипертермии в верхней трети бедер, подколенной ямке, верхней трети голеней. Для голеней характерна тенденция к уменьшению интенсивности гипертермии в дистальном направлении. Над ахилловым сухожилием определяется зона гипотермии. Среднее значение температуры кожного покрова в области нижних конечностей (кроме пальцев стоп) — 32,1–32,4 °С, пальцев стоп — 23,3–23,9 °С (Розенфельд Л.Г., 1988).
Анализ и обработка термограмм проводится по следующим термографическим признакам (Розенфельд Л.Г., 1988):
- выявление термоасимметрии,
- изучение площади асимметричного участка (зоны гипо- или гипертермии): размеры, степень однородности, характеристика границ и т.д.,
- определение температурного градиента и вычисление его коэффициента, выражающего отношение разницы температуры между точками и расстоянию между ними,
- определение максимальной, минимальной и средней абсолютной температуры симметричных участков,
- определение термографического индекса (ТИ), представляющего собой отношение суммы температур, соответствующих каждому изотермическому полю, к общей площади зоны патологической термоасимметрии:
ТИ = ε (∆Т °С·а),
А
где ε — сумма температур, соответствующих каждому изотермическому полю; ∆Т — разница между температурой каждого температурного градиента и стандартом, соответствующим средней температуре данного участка поверхности тела человека; а — выявленная температура каждого градиента; А — общая площадь зоны патологической термоасимметрии.
В норме термографический индекс лежит в пределах от 4,62 до 4,94, составляя в среднем 4,87 (Collins A. et al., 1974).
По данным Н.К. Тернового и соавторов (1988), при ОА І рентгенологической стадии по Н.С. Косинской наблюдаются термоасимметрия суставов, зона гипотермии над областью сустава, постепенно переходящая в зону гипертермии выше и ниже лежащих сегментов конечности. Градиент температур в зоне гипотермии составляет 0,6±0,2 °С.
На термограммах больных с ОА ІІ–ІІІ стадий наблюдаются термоасимметрия, зона гипертермии над пораженным суставом различного рельефа и степени выраженности, что указывает на гиперваскуляризацию сустава и асептическое воспаление в синовиальной оболочке сустава и параартикулярной клетчатке. Градиент температур патологически измененного сустава составляет 1±0,2 °С.
В случае эффективного лечения термограмма характеризуется уменьшением температурной асимметрии, снижением интенсивности гипертермии, градиент температур падает до 0,4–0,8 °С.
В Украинском ревматологическом центре мы проводили исследование связи между данными дистанционной компьютерной термографиии (ДКТ), рентгенографии и УЗИ коленных суставов, пораженных ОА.
В исследовании участвовали 62 больных с ОА коленных суставов, удовлетворяющим классификационным критериям ACR (1986), из них 43 (69,4%) женщины, 19 (30,6%) мужчин в возрасте от 47 до 69 лет (в среднем 57,4±6,2 года), которые болели на протяжении 1,5 года — 12 лет (в среднем 5,6±2,6 года). Моноартикулярное поражение коленных суставов обнаружено у 44 (71%) пациентов, двустороннее — у 18 (29%), таким образом в целом было обследовано 80 коленных суставов у пациентов основной группы. I рентгенологическую стадию по Kellgren и Lawrence диагностировали у 23 (28,8%), II — у 32 (40%), III — у 19 (23,8%) и IV — у 6 (7,4%) больных. Для сравнения использовали 54 рентгенограммы коленных суставов 27 лиц, составивших контрольную группу, у которых в анамнезе отсутствуют данные о травматическом или каком-либо другом поражении коленных суставов, а также сосудов, мягких тканей, костей и других суставов нижних конечностей. Среди 27 лиц контрольной группы было 18 (66,7%) женщин и 9 (33,3%) мужчин в возрасте от 31 года до 53 лет (в среднем 41,5±4,9 года).
Рентгенографию коленных суставов выполняли в переднезадней проекции по стандартной методике. Градацию рентгенологических критериев ОА от 0 до 3 степени (снижение высоты суставной щели и остеофитоз) осуществляли з использованием Атласа градаций ОА коленных суставов Y. Nagaosa и соавторов (2000).
При проведении ДКТ с помощью тепловизора «Радуга-1» использовали рекомендации Л.Г. Розенфельда (1988). На термограмме коленного сустава выбирали два симметричных участка размером 35×35 мм, которые соответствовали медиальной и латеральной частям тибиофеморального отдела коленного сустава (ТФКС), где определяли среднюю температуру. Для математической обработки результатов ДКТ определяли показатель градиента температур по формуле:
∆Тм = Тм – Трм и ∆Тл = Тл – Трл,
где ∆Т — градиент температур, Тм и Тл — температуры участков в проекции медиальной и латеральной областей ТФКС, Трм и Трл — референтные значения температур участков в проекции медиальной и латеральной областей ТФКС, полученные при обследовании здоровых лиц контрольной группы.
Всем обследованным лицам проведено УЗИ коленных суставов на аппарате SONOLINE Omnia (Siemens) с линейным датчиком 7,5L70 (частота 7,5 МГц) в режиме «ortho» в стандартных позициях (Backhaus M. et al., 2001). Оценивали состояние костных суставных поверхностей (включая наличие «разрыхления» кортикального слоя и его дефектов), суставных щелей, околосуставных мягких тканей, наличие выпота, изменений связочного аппарата и некоторые другие параметры.
У больных основной группы изучали также клинические признаки суставного синдрома. С этой целью использовали альгофункциональный индекс Лекена (АФИ) тяжести гонартроза (Lequesne M., 1997), который определяли по характеру болевого синдрома (время возникновения, максимальная дистанция ходьбы без боли), длительности утренней скованности и др. Степень тяжести гонатроза кодировали в баллах (1–4 — слабая, 5–7 — средняя, 8–10 — выраженная, 11–13 — значительно выраженная, более 14 — резко выраженная). Интенсивность болевого синдрома оценивали с использованием визуальной аналоговой шкалы боли (ВАШ) (Huskisson E.C., 1982), где отсутствие боли соответствует 0 мм, а максимальная боль — 100 мм.
Статистический анализ полученных результатов проводили с помощью компьютерной программы STATGRAPHICS plus v.3. При проведении корреляционного анализа коэффициент корреляции r < 0,37 свидетельствовал о наличии слабой, 0,37 ≤ r < 0,05 — умеренной, 0,5 ≤ r < 0,7 — значительной, 0,7 ≤ r < 0,9 — сильной и r ≥ 0,9 — очень сильной связи. Значение р<0,05 считали достоверным.
Клиническое обследование пациентов обнаружило слабую степень тяжести гонартроза у 8 (12,9%), среднюю — у 13 (20,9%), выраженную — у 21 (33,9%), значительно выраженную — у 15 (24,2%), резко выраженную — у 5 (8,1%) больных. Девять (14,5%) пациентов не жаловались на боль в пораженных суставах, другие 53 (85,5%) — оценили интенсивность боли по ВАШ от 5 до 85 мм. Ограничение объема движения от 75 до 125° обнаружено у 38 (61,2%), увеличение объема разгибания от 5 до 20° — у 19 (30,6%) больных (табл. 28).

Изучение термограмм коленных суставов у обследованных больных с ОА показало, что в среднем ДТм равнялся 0,69±0,26 °С, а ДТл — 0,63±0,26 °С (р=0,061). Корреляционный анализ обнаружил статистически значимую связь между ДТм и всеми изучаемыми клиническими показателями, а также между ДТл и АФИ Лекена, ВАШ боли и объемом сгибания (табл. 29).
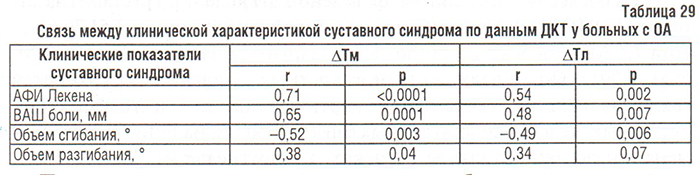
При проведении корреляционного анализа обнаружено наличие статистически существенной прямой связи между градиентом температур в медиальном ТФКС и сужением РСЩ в медиальной области, а также остеофитозом в медиальной и латеральной областях, в то время как градиент температур латерального ТФКС коррелировал со сужением РСЩ и остеофитозом лишь в латеральном ТФКС (табл. 30).

По данным УЗИ у больных с ОА обнаружили сужение РСЩ за счет уменьшения высоты суставного хряща (поперечная позиция датчика), костные разрастания (остеофиты) и/или дефекты суставной поверхности костей, изменение синовиальной мембраны и наличие выпота в суставе, изменение параартикулярных мягких тканей (все позиции). Изменения поверхностей кортикального слоя суставной поверхности костей (неровность, формирование дефектов поверхности) регистрировались уже в начальных стадиях болезни (I стадия) и достигали максимальной выраженности при III–IV стадии.
Выпот в суставе регистрировался у 28 (45,16%) больных, преимущественно при II и III стадиях ОА, который в основном локализовался в верхнем завороте (32,3% больных в латеральной части РСЩ (17,7%), реже — в медиальной (9,7%) и в заднем завороте (3,2%). Выпот имел гомогенную анэхогенную эхоструктуру при условии клинической симптоматики продолжительностью до 1 мес, а у больных с клиническими признаками персистирующего воспаления — негомогенную с включениями различного размера и эхоплотности. Толщина синовиальной оболочки была увеличена у 24 (38,7%) больных, а неравномерное ее утолщение регистрировалось у 14 из них. Средняя длительность заболевания в этой группе была большей, чем в целом (6,7±2,4 года), причем у больных с неравномерным утолщением синовиальной оболочки она была еще большей (7,1±1,9 года). Таким образом, особенности синовита отражали длительность болезни и остроту течения на момент обследования. Заслуживают внимания данные сопоставления результатов ДКТ и УЗИ (табл. 31).
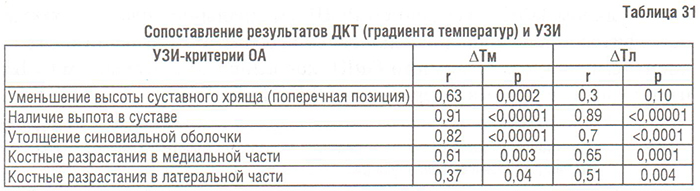
Как видно из табл. 29, сильная или очень сильная прямая связь по данным корреляционного анализа отмечается между градиентом температур в медиальном и латеральном ТФКС, с одной стороны, и выпотом в сустав и утолщением синовиальной оболочки по данным УЗИ — с другой. Более слабая связь обнаружена между наличием костных разрастаний в медиальной области ТФКС (данные УЗИ) и градиентом температур во всех исследуемых участках сустава.
Таким образом, была выявлена корреляционная связь между данными ДКТ, с одной стороны, и клинической характеристикой суставного синдрома у обследованных больных с ОА, рентгенологической стадией болезни и результатами УЗИ — с другой. Полученные данные свидетельствуют о целесообразности использования комплекса инструментальных диагностических методов, включающего рентгенографию, ДКТ и УЗИ, что обеспечивает больший объем информации о состоянии не только внутрисуставных, но и внесуставных тканей.