В большинстве случаев больной не может точно указать время и причину появления симптомов ОА. Достаточно длительное время заболевание даже при наличии патогистологических изменений и рентгенографических признаков протекает бессимптомно (Cobb S. et al., 1957; Bagge E. et al., 1991).
Наиболее частым ранним признаком болезни является диффузная, непостоянная боль в суставе, обычно возникающая во время или сразу после нагрузки на сустав. Для ОА также характерна утренняя скованность продолжительностью не более 30 мин. Иногда определяется незначительная болезненность околосуставных тканей (главным образом мышц). Постепенно и, как правило, незаметно уменьшается объем движений в суставе. Например, пациент может пожаловаться на то, что в последнее время (год/несколько лет) ему все труднее наклоняться, чтобы надеть носки, из-за ощущения скованности в тазобедренном суставе.
В редких случаях первые симптомы ОА развиваются быстро (в течение нескольких дней или недель) после травмы. Вероятно, травма в данном случае играет роль «триггера» для клинической манифестации изменений в суставе, длительно протекавших бессимптомно.
Боль. Самым важным симптомом ОА, несомненно, является боль. В сравнительных исследованиях продемонстрировано отличие количественных и качественных характеристик боли при ОА и ревматоидном артрите (Bellamy N., Buchanan W.W., 1984; Charter R.A. et al., 1985). Для ОА характерна «механическая» боль, т.е. возникающая/усиливающаяся во время нагрузки на сустав и затихающая в покое. Боль обычно возникает спустя некоторое время (минуты/часы) после начала воздействия нагрузки на сустав (реже — сразу после нагрузки) и может продолжаться в течение нескольких часов после ее прекращения. Характер болевого синдрома является одним из главных дифференциально-диагностических признаков ОА: для воспалительных процессов в суставах (артрит, в том числе и ревматоидный) в отличие от дегенеративных характерен «воспалительный» характер боли (возникает/нарастает в покое и ночью, утихает при движениях в суставе). Редко больные с ОА предъявляют жалобы на боль в покое и ночью, однако одновременно их обычно беспокоит и боль в суставе при физической нагрузке, т.е. «механическая боль».
Боль при манифестном ОА не столь выражена, как при артритах, более локальная, хотя с прогрессированием болезни приобретает стойкий характер. В известной мере по характеру боли, ее стойкости при ОА можно определить степень тяжести заболевания в целом. Например, вначале боль в конкретном суставе связана с движением и при его прекращении исчезает. Позже боль в суставе (суставах) беспокоит и в покое, усиливаясь при нагрузке. Наконец, боль беспокоит больного уже и по ночам. И хотя клинически боль в суставе воспринимается однозначно, но в действительности механизмы боли при ОА связаны не только с синовитом, как при артрите. При синовите боль возникает при вставании с постели с ощущением скованности («геля») в пораженном суставе, впоследствии боль усиливается при нагрузке. Боль при определенных движениях в суставе может быть обусловлена вовлечением периартикулярных тканей, а боль, вызванная отслойкой периоста из-за развития остеофитов, носит локальный характер, усиливаясь при пальпации сустава. Кроме того, при ОА боль может быть обусловлена мышечной патологией, усиливается с нарастанием тревоги и депрессии, а также в связи с нарушением двигательной активности и др. (Насонова В.А., 2001).
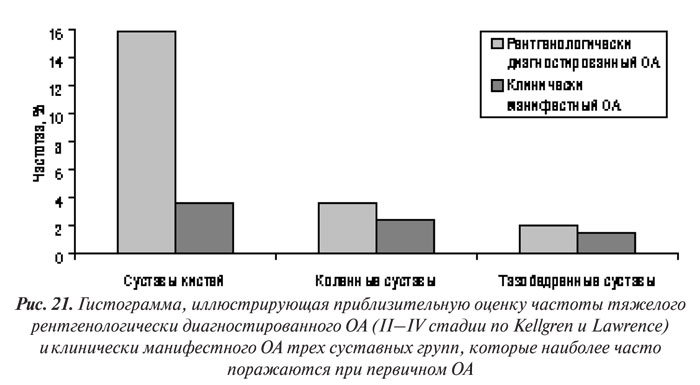
При эпидемиологических и клинических исследованиях обнаружили значительные расхождения интенсивности боли в различных группах больных с ОА. Так, по данным J.S. Lawrence и соавторов (1966), представленным на рис. 21, рентгенологически диагностированный коксартроз практически всегда манифестирует клинически, в то время как лишь у небольшой части больных с ОА суставов кистей имеются специфические жалобы. Тяжесть изменений, обнаруживаемых на рентгенограммах пораженных суставов, ассоциируется с повышением вероятности клинической манифестации ОА (Hochberg M.C. et al., 1989). В то же время авторы этого исследования отмечают, что даже значительно выраженные изменения на рентгенограммах могут быть бессимптомными. J. Cashnaghan (1991) указывает на то, что у женщин, больных ОА, болевой синдром интенсивнее, чем у мужчин. Результаты исследования M.N. Summers и соавторов (1988) свидетельствуют о наличии прямой корреляционной связи между болью и беспокойством/депрессией у пациентов с ОА.
Изучение особенностей боли у пациентов с ОА было предметом нескольких исследований. F.A. Hart (1974) описал шесть типов болевых ощущений при ОА. Результаты детального исследования боли у 500 пациентов с ОА периферических суставов (Cashnaghan J., 1991) подтвердили эти данные. Так, наиболее частым вариантом была боль при движениях в суставе или опоре на конечность (use-related pain). Такая боль, по данным авторов, обычно возникала в течение нескольких секунд/минут после начала статической или динамической нагрузки и могла сохраняться на протяжении нескольких часов после ее прекращения. Некоторые пациенты жаловались на непостоянную острую боль, точно совпадающую с определенными движениями в суставах или ношением тажестей; другие — на постоянный характер боли, при этом они затруднялись точно указать ее локализацию. В то время как почти все больные с манифестным ОА жаловались на боль, связанную с движениями в суставе или опорой на конечность, только половина из них указывала на наличие боли в покое и около 30% — на боль, возникающую ночью (Cashnaghan J., 1991). Лишь у небольшого числа обследованных интенсивность боли в пораженных суставах затрудняла повседневную активность или вызывала бессонницу. Как правило, в этих случаях на рентгенограммах суставов обнаруживали значительные и быстропрогрессирующие изменения, часто с вовлечением субхондральной кости.
Боль в суставе при ОА нередко сопровождается ощущением болезненности при пальпации области сустава. Пациент может указать на наличие нескольких болевых точек, расположенных по ходу суставной щели и в области прилежащих скелетных мышц.
Механизм, лежащий в основе болевого синдрома при ОА, до сих пор остается предметом дискуссий (табл. 15). Факторы, влияющие на возникновение боли при ОА, можно разделить на локальные, системные и факторы со стороны ЦНС.

Изменение очертаний суставных поверхностей, остеофитоз и другие локальные механические факторы могут быть причиной возникновения аномальной нагрузки на связки, суставную капсулу и другие иннервируемые структуры. Подобный механизм, возможно, играет важную роль в появлении болезненности периартикулярных структур и острой боли, возникающей в суставе при движении.
Известно, что при ОА повышается внутрикостное давление в субхондральной кости вследствие затруднения венозного оттока (Arnoldi C.C. et al., 1971; 1980). Снижение внутрикостного давления уменьшает боль при ОА (Revell P.A. et al., 1988). Предполагают, что этот механизм ответственен за выраженный болевой синдром — длительный, возникающий в покое ночью. Возможно, одним из источников боли при ОА является периост, который утолщается в результате появления остеофитов и хондрофитов (Kellgren J.H., 1983).
Умеренный синовит часто сопровождает ОА, особенно на поздних стадиях (Dieppe P.A., 1978; Revell P.A. et al., 1988), и может способствовать усилению боли. В пользу этого механизма свидетельствует уменьшение боли при ОА в ответ на лечение НПВП (Dieppe P.A. et al., 1993).
Боль, обусловленная воспалением, давно является предметом серьезного внимания, а в настоящее время механизмы боли, ассоциированной с воспалением, активно изучаются. Показано, что любая периферическая боль связана с повышением чувствительности специализированных нейронов — ноцицепторов, создающих сигнал, распознаваемый как боль. Повышение чувствительности первичного ноцицептора в пораженной периферической ткани приводит к повышению активности нейронов, посылающих сигнал в спинной мозг и ЦНС, однако необходимо подчеркнуть, что в очаге воспаления может генерироваться спонтанная электрическая активность, обусловливающая стойкий болевой синдром. Таким мощным индуктором болевой чувствительности являются провоспалительные компоненты: брадикинины, гистамин, нейрокинины, комплемент, оксид азота, которые обычно обнаруживаются в очаге воспаления. В последние годы все большее внимание уделяют простагландинам, накопление которых коррелирует с интенсивностью воспаления и гипералгезией. Однако простагландины сами по себе не являются медиаторами боли, они лишь повышают чувствительность ноцицепторов к различным стимулам. Они как бы «включают» нормальные («молчаливые») ноцицепторы в такое состояние, когда они легко возбуждаются при различном воздействии.
Нарушение биомеханики в пораженном суставе способствует развитию вторичных периартикулярных синдромов — бурситов, теносиновитов и др. При сборе анамнеза и осмотре больного с ОА необходимо определить, чем обусловлена боль — непосредственно поражением сустава или воспалением, локализующимся в суставных сумках и синовиальных влагалищах.
Больные с ОА нередко предъявляют жалобы на боль в околосуставных мышцах при пальпации. Предполагают, что слабость мышц, осуществляющих движения в суставе, может быть одной из причин боли. В пользу этого свидетельствует уменьшение боли у больных с гонартрозом, выполняющих упражнения на укрепление четырехглавой мышцы бедра (Chamberiain M.A. et al., 1982).
J.H. Kellgren (1939) указывал на «направленность» боли и болезненности при пальпации от пораженных суставов к мышцам, осуществляющим движения в суставах. Это явление может объяснить нередкое возникновение боли «рядом» с пораженным суставом.
Больные с ОА могут иметь признаки фибромиалгии (Mologofsky H., 1989). Кроме того, M.N. Summers и соавторы (1988) указывают на важность центральных нейрогенных механизмов в генезе боли при ОА.
Скованность. Ощущение скованности в суставах — частая жалоба больных. Скованность обычно характеризуется затруднением первых движений, феноменом «замороженного» сустава после периода покоя, ограничением объема движений в пораженном суставе. Скованность при ОА, как правило, длится несколько минут (редко до 30 мин) и возникает только в пораженном суставе.
Причина возникновения скованности при ОА остается неизвестной. Жалобы на «замороженность» сустава после периода покоя можно объяснить простыми механическими причинами (утолщение суставной капсулы и др.). Длительная (до 30 мин) утренняя скованность, наблюдающаяся у некоторых больных ОА, возможно, возникает вследствие развития синовита (по аналогии с утренней скованностью при ревматоидном артрите).
Ограничение объема движений — нередкая жалоба больных с ОА. Оно обычно сопровождается жалобами на боль при движениях в суставе, причем максимальная боль отмечается на высоте ограниченного движения. Хондрофитоз и остеофитоз, ремоделирование сустава, утолщение суставной капсулы способствуют ограничению объема движений в суставе, пораженном ОА. Последнее может также объяснить затруднение выполнения доступного объема движения в пораженном суставе.
Плотные утолщения суставных краев часто хорошо пальпируются и могут быть болезненными. Наряду с грубыми крепитациями, которые ощущаются при движениях в пораженных суставах, плотные утолщения суставных краев являются важным дифференциально-диагностическим признаком ОА (Altman R.D. et al., 1986). Крепитации обнаруживают при пальпаторном исследовании пораженного сустава, в поздних стадиях ОА их можно услышать на расстоянии. Вероятной причиной возникновения крепитации при ОА наряду с образованием газовых пузырьков в синовиальной жидкости, которые «лопаются» при движениях в суставе, является шероховатость суставных поверхностей пораженного сустава (Watson P. et al., 1989). Необходимо дифференцировать крепитации и ощущение грубого хруста при движениях в нормальных суставах. Последний, как правило, всегда слышен на расстоянии и представляет собой один или несколько непостоянных отдельных звуковых феноменов во время движения в суставе. Крепитации ощущаются (реже их можно услышать) в суставах всегда и на протяжении всего движения в суставе.
Образование плотных («костных») утолщений по краю суставной щели в большей степени характерно для ОА кистей: узловатость проксимальных межфаланговых суставов носит название узлов Бушара, а дистальных межфаланговых суставов — узлов Гебердена. Реже плотные утолщения обнаруживают по краю суставных щелей других суставов, в частности коленных.
Крепитации являются одним из основных дифференциально-диагностических признаков ОА. Крепитации при ОА необходимо дифференцировать с хрустом в суставе у здорового человека, причиной которого могут быть газовые пузырьки в синовиальной жидкости, которые лопаются при движениях.
Синовит. Чаще всего синовит при ОА возникает в коленных суставах. У больных с синовитом изменяется характер боли: она возникает в ряде случаев сразу же после опоры на ногу и при обычной (не длительной) ходьбе. Такая «стартовая» боль не исчезает полностью в состоянии покоя, а у части больных приобретает неопределенный ритм (больной не может четко определить время их наибольшей интенсивности). Синовит при гонартрозе может быть субклиническим, слабым, умеренным, значительным (табл. 16); по распространенности — ограниченным и диффузным; в зависимости от течения — первичным, рецидивирующим и часто рецидивирующим.
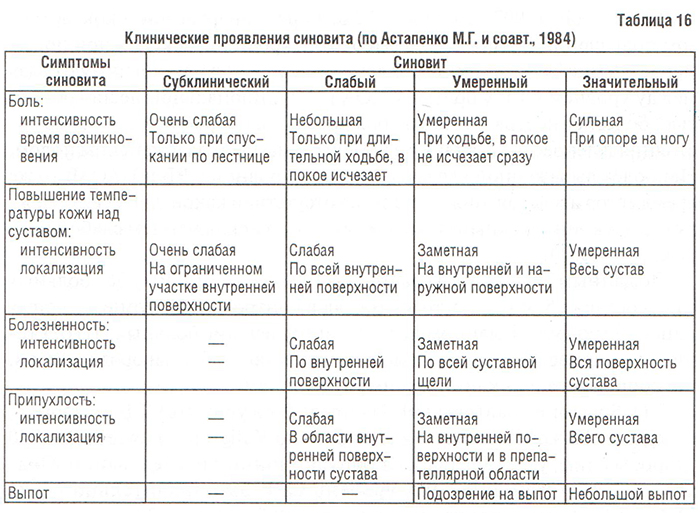
Cиновит при ОА имеет не только диагностическое, но и патогенетическое значение. Обнаружение провоспалительных медиаторов в синовиальной жидкости больных с ОА, в том числе и на ранней стадии, привело к пересмотру существовавшей ранее концепции патогенеза заболевания как «неизбежного результата процесса старения суставов». В середине 90-х годов ХХ в. формула патогенеза ОА «дегенерация — первична, воспаление — вторично» изменилась с точностью до наоборот. В настоящее время, несмотря на активный поиск в этом направлении, доказать первичность воспаления так и не удалось, поэтому идеи «первичности» воспаления в патогенезе ОА высказываются менее активно. С другой стороны, почти все без исключения исследователи однозначно сходятся в одном: воспаление играет важную роль в прогрессировании заболевания. Так, еще в 1984 г. М.Г. Астапенко и соавторы продемонстрировали выраженную корреляционную связь синовита (оцененного клинически по собственному методу авторов и сцинтиграфически с Tc 99m). M. Takahashi и соавторы (2004) выявили статистически значимую отрицательную корреляционную связь между высотой рентгенологической суставной щели и маркером воспаления пиридинолином в моче больных с ОА (р = 0,034), а также между степенью рентгенологических изменений по Kellgren и Lawrence и пиридинолином в моче (р = 0,039) и ТИМП-1 (р = 0,017) в крови больных с ОА. Кроме того, авторы обнаружили, что у пациенток с генерализованной формой ОА СРБ (количественно), пиридинолин, гликопротеин хряща-39 (YKL-40) и ТИМП-1 были значительно выше, чем у больных с негенерализованной.
Окончательно невыясненным остается вопрос о существовании системного воспаления при ОА. Результаты многочисленных исследований свидетельствуют о наличии маркеров системного воспаления у больных с ОА. Сторонники концепции объясняют этот феномен системной стимуляцией локально продуцируемыми провоспалительными цитокинами, в том числе индуцирование ими синтеза реактантов острой фазы в печени.
Так, F. Wolfe (1997) выявил у 572 больных гонартрозом и коксартрозом повышение уровня СРБ в сыворотке крови (5,9 мкг/мл при норме менее 0,8 мкг/мл). Он также обнаружил небольшую, но значимую связь между уровнем СРБ у больных с ОА и функциональной неспособностью, болезненностью суставов, болью, слабостью, общей тяжестью состояния и депрессией, а также с индексом массы тела и женским полом. Наиболее выраженной связь была между уровнем СРБ и HAQ. В то же время автор исследования сообщил об отсутствии какой-либо связи между СОЭ и клиническими симптомами ОА, за исключением слабой корреляции с HAQ.
По данным L.D. Loose и соавторов (1993) уровень СРБ у 365 больных с ОА составил 5 мкг/мл, в то время как в контрольной группе здоровых лиц—1,9 мкг/мл). В данном исследовании лечение больных НПВП тенидапом привело к значительному снижению СРБ в сыворотке крови, что сопровождалось клиническим улучшением.
T.D. Spector и соавторы (1997) определяли уровень СРБ в сыворотке крови 105 женщин с ОА (≥ ІІ стадии по Kellgren и Lawrence) и 740 здоровых лиц, участвовавших в популяционном исследовании. Оказалось, что у женщин с ОА уровень СРБ был значительно выше (2,4 мкг/мл), чем в контрольной группе (0,7 мкг/мл). 70 женщинам с ОА из 105 повторная рентгенография коленных суставов выполнена спустя 4 года после исходного обследования. Было выявлено, что у 32 женщин с признаками прогрессирования болезни за 4 года исходный уровень СРБ был значительно выше, чем у таковых без признаков прогрессирования на рентгенограммах (2,6 vs 1,3 мкг/мл соответственно). В то же время боль в коленном суставе не влияла на уровень СРБ в сыворотке крови. Авторы исследования предположили, что уровень СРБ в сыворотке крови можно считать прогностическим фактором прогрессирования болезни. Аналогичные результаты получили T. Conrozier и соавторы (1998), обнаружившие значительно более высокий уровень СРБ у больных с быстро прогрессирующим ОА (5,61 мкг/мл vs 1,94 мкг/мл).
Противники концепции системного воспаления при ОА основывают свои контраргументы на неспецифичности используемых маркеров системного воспаления и неадекватной трактовке результатов исследований (более подробно см. главу 9).
В последнее время в литературе появились сообщения о выявлении участков панусоподобной фиброзной ткани на поверхности пораженных суставов (Shibakawa A., et al., 2003; Yuan G.-H., et al., 2004). О похожих находках сообщали и более 30 лет назад, однако эти изменения трактовали как феномен ремоделирования (Meaсhim G., et al., 1970; Meaсhim G., 1972; Nakata K., et al., 1982). В настоящее время известно, что паннус — инвазивная грануляционная ткань, покрывающая суставные поверхности суставов, пораженных РА, и вызывающая их деструкцию (Bresnihan B., 1999). Недавно A. Shibakawa и соавторы (2003) сообщили, что 80% образцов суставных тканей, полученных у больных с ОА, содержали паннусоподобную ткань с катаболическими свойствами.
По данным G.-H. Yuan и соавторов (2004), в 15 суставах из 21 (71,4%), пораженного ОА, была макроскопически найдена паннусоподобная ткань. Но лишь в 5 из них ткани было достаточно для того, чтобы выделить ее для гистологического исследования. В отличие от паннуса при РА, диффузно покрывающего всю суставную поверхность с участками локальных кровоизлияний и инвазии в подлежащие твердые ткани, паннусоподобная ткань располагается лишь маленькими участками на периферии или в центре суставной поверхности. Кроме того, в отличие от паннуса при РА, характеризующегося гиперваскуляризацией и инфильтрацией воспалительными клетками, а также содержащего лимфатические фолликулы, паннусоподобная ткань при ОА в меньшей степени васкуляризирована.
A. Shibakawa и соавторы (2003) выделили два типа паннусоподобной ткани: фиброзный и сосудистый. Кроме того, паннусоподобная ткань не содержит CD68 лимфоцитов, которыми богато инфильтрирован паннус у пациентов с РА, а ее толщина может достигать 5 мм (Yuan G.-H. et al., 2004).
В результате гистохимического исследования паннусоподобной ткани было выявлено экспрессию генов маркера фибробластов коллагена I типа, а также аггрекана и коллагена II типа, что свидетельствует об общих свойствах паннусоподобной ткани с хондроцитами. На основании данных гистохимических исследований G.-H. Yuan и соавторы (2004) предположили, что возможными предшественниками паннусоподобной ткани могут являться: синовиальная ткань, хрящевая ткань (претерпевшая фиброзную метаплазию), субартикулярные мезенхимальные клетки (только клетки паннусоподобной ткани при ОА экспрессируют виментин — маркер мезенхиальных клеток). У больных с ОА клетки паннусоподобной ткани вырабатывают ММП-1, ММП-3 и ММП-13 в значительно большем количестве, чем хондроциты. С действием этих ферментов связывают инвазивные свойства паннусоподобной ткани и деградацию тканей суставов.
По мнению G.-H. Yuan и соавторов (2004) дефекты суставного хряща могут замещаться фиброзной тканью с целью последующей репарации, но неблагоприятные условия (например, продолжающаяся неадекватная нагрузка на сустав, микротравмы, действие цитокинов, др.) могут задержать процесс репарации и переключить на катаболические процессы. Экспрессия протеогликанов и коллагена ІІ типа клетками паннусоподобной ткани свидетельствует о возможном ее репаративном действии в определенных условиях.
Реже синовит возникает в проксимальных и дистальных межфаланговых суставах кистей с наличием узлов Гебердена и/или Бушара (проявляется болезненностью, припухлостью, гиперемией суставов), что требует дифференциальной диагностики с РА (Huskisson E.C. et al., 1979).
Признаки деструкции суставов. На поздних стадиях ОА обнаруживают признаки деструкции хряща, кости и окружающих мягких тканей: варусная деформация коленных суставов (в связи с поражением медиальной тибиофеморальной части сустава), слабость связочного аппарата, нестабильность суставов (часто развивается в дистальных межфаланговых суставах). Деструкция костной ткани при ОА тазобедренного сустава может привести к укорочению конечности.
Течение ОА различных локализаций отличается друг от друга. В общем, заболевание прогрессирует медленно. У большинства пациентов с ОА протекает в виде периодов обострения (могут длиться дни/месяцы), когда боль особенно интенсивна, значительно нарушена функция пораженных суставов и может появляться суставной выпот, и периодов относительной ремиссии, когда боль отсутствует или слабо выражена, пораженные суставы функционируют в полном объеме или их функция незначительно снижена и выпот отсутствует (Dieppe P.A., 1995). Некоторые больные с диагностированным ОА в течение месяцев и даже лет могут не предъявлять никаких жалоб (Massardo L. et al., 1989).
Наиболее быстрое прогрессирование ОА наблюдается в суставах кистей, наиболее медленное — в коленных суставах, поражение тазобедренных суставов занимает промежуточное положение. «Быстрое» прогрессирование, означающее изменение клинических симптомов и рентгенологических признаков в течение короткого времени, измеряемого месяцами, выявляют лишь у небольшого числа пациентов (Siefert M.H. et al., 1969). Деструкция костной ткани характерна для женщин пожилого возраста (Dieppe P.A. et al., 1984). Для ОА суставов кистей и тазобедренных суставов описано явление обратного развития не только клинических симптомов, но и рентгенологических признаков (Perry G.H. et al., 1979; Bland J.H., Cooper S.M., 1984). Рентгенологические признаки изменений анатомии суставов не всегда коррелируют с изменениями клинических симптомов ОА и нетрудоспособностью больных (Danielsson L.G., 1964; Dieppe P.A., Cushnaghan J., 1991).
ОА — заболевание, не имеющее системных проявлений, поэтому осложнения всегда связаны с пораженным суставом/суставами. Локальные осложнения включают развитие вторичных периартикулярных синдромов (бурсит, тендовагинит и др.), туннельных синдромов, обусловленных образованием крупных остеофитов или деформацией суставов. Тяжелые деформации пораженных суставов могут быть причиной вторичных переломов и асептического некроза костей (Bauer G.C.H., 1978).
Особенности ОА различных локализаций
Наиболее часто первичным ОА поражаются суставные группы, которые несут наибольшую статическую (коленные, тазобедренные суставы, апофизарные суставы позвоночника) и динамическую (проксимальные и дистальные межфаланговые суставы кистей) нагрузку. Клинические проявления ОА значительно отличаются в зависимости от локализации поражения (см. рис. 21).
ОА коленного сустава (гонартроз). Коленный сустав состоит из трех анатомических частей (компартментов): большеберцово-бедренного (тибиофеморального) отдела, имеющего медиальную и латеральную области, и надколенниково-бедренного (пателлофеморального) отдела. Каждая из этих областей может быть отдельно поражена ОА либо возможна любая комбинация поражений (Ahlback S., 1969). Наиболее часто встречается изолированный ОА в медиальном тибиофеморальном отделе и комбинированное поражение медиального тибиофеморального и пателлофеморального отделов.
В среднем медиальный тибиофеморальный отдел поражается в 75%, латеральный тибиофеморальный — в 26%, а пателлофеморальный — в 48% случаев (McAlindon T.E. et al., 1993).
Потеря суставного хряща обычно наиболее выражена в латеральном пателлофеморальном отделе и на суставной поверхности большеберцовой кости в тибиофеморальном отделе, на участке, наименее всего покрытом менисками. По данным артроскопии и МРТ, наряду с поражением суставного хряща при гонартрозе поражаются мениски (McAlindon T.E. et al., 1991). Остеофитоз наиболее выражен в латеральном тибиофеморальном компартменте, тогда как максимальную деструкцию хряща обычно обнаруживают в медиальном.
Биомеханика коленного сустава хорошо изучена (Maquet P.G.J., 1976). В нормальном суставе ось нагрузки проходит через центр тибиофеморального отдела. Однако при движениях, когда нагрузка на тибиофеморальный отдел в 2–3 раза превышает массу тела, максимум нагрузки приходится на медиальную часть сочленения; при сгибании коленного сустава нагрузка на пателлофеморальную его часть в 7–8 раз превышает массу тела. Возможно, этим объясняется высокая частота поражения именно медиального тибиофеморального и пателлофеморального отделов коленного сустава (Cooke T.D.V., 1985). Развитию гонартроза способствуют некоторые физиологические аномалии коленного сустава — физиологический genu varum, гипермобильность сустава и др. Менискэктомия и повреждения связочного аппарата нарушают нормальное распределение нагрузки на коленный сустав, что является предрасполагающим фактором к развитию вторичного гонартроза.
Больных ОА коленного сустава можно разделить на две группы (Cobb S. et al., 1957). К первой группе относятся пациенты молодого возраста, чаще мужчины, с изолированным поражением одного, реже обоих коленных суставов, имеющие в анамнезе данные о травме или операции (например, менискэктомии) на коленном суставе (Bagge E. et al., 1991). Ко второй группе относятся лица среднего и пожилого возраста, преимущественно женщины, у которых отмечают ОА одновременно других локализаций, включая кисти рук (Cushnaghan J., Dieppe P.A., 1991); многие пациенты этой группы страдают ожирением (Felson D.T., 1988).
Наиболее важными симптомами гонартроза являются боль в суставе при ходьбе, длительном стоянии и спуске по лестнице; хруст в суставах при движениях; локальная болезненность при пальпации, главным образом в медиальной части сустава по ходу суставной щели; болезненное ограничение сгибания, а позже и разгибания сустава, краевые костные разрастания, атрофия четырехглавой мышцы бедра. Поражение медиального отдела коленного сустава приводит к развитию варусной деформации. Редко встречающееся поражение латеральной части тибиофеморального сустава может вызвать формирование вальгусной деформации. При любом типе поражения ОА коленного сустава часто обнаруживают признаки воспаления. При этом изменяется характер боли: боль усиливается, появляются «стартовая» боль, боль в покое, утренняя скованность в суставе продолжительностью до 30 мин. В области сустава появляются небольшая припухлость, местное повышение температуры кожи. Вследствие наличия в полости сустава костного или хрящевого отломка («суставной мыши») у больного с гонартрозом могут возникать симптомы «блокады» сустава (острая боль в суставе, лишающая больного возможности сделать любое движение).
Течение ОА коленного сустава длительное, хроническое, прогрессирующее, с медленным нарастанием симптомов, чаще без резко выраженных обострений. У части больных гонартроз может протекать стабильно как клинически, так и рентгенологически в течение многих лет (Miller R. et al., 1973; Massardo L. et al., 1989). Периодически может возникать спонтанное уменьшение выраженности симптомов. В отличие от коксартроза и ОА суставов кистей спонтанное улучшение (обратное развитие) рентгенологических признаков ОА возникает крайне редко (Dieppe P.A., 1995). ОА чаще всего протекает с периодами «обострения», которые обычно сопровождаются появлением выпота в полость сустава и длятся дни/месяцы, и улучшения, или «ремиссии». В некоторых случаях ухудшение течения заболевания происходит в течение нескольких недель или месяцев. Это может быть связано с развитием нестабильности сустава или деструкцией субхондральной кости. Внезапная, почти мгновенная боль в коленном суставе может означать развитие асептического некроза медиального эпифиза бедренной кости — редкого, но тяжелого осложнения ОА.
Остеоартроз тазобедренного сустава (коксартроз). Чаще всего ОА поражает верхний полюс тазобедренного сустава с верхнелатеральным смещением головки бедренной кости (около 60% больных коксартрозом, мужчины болеют чаще, чем женщины). Реже встречается поражение медиального полюса сустава с медиальным смещением головки бедренной кости и протрузией вертлужной впадины (около 25% больных коксартрозом, женщины болеют чаще, чем мужчины) (Solomon L., 1976). Концентрическое поражение, при котором поражается весь сустав, — наиболее редко встречающийся вариант коксартроза (около 15% пациентов с коксартрозом, женщины болеют чаще, чем мужчины) (Marks J.S. et al., 1979). Крайне редко встречается поражение задненижней части сустава, которое можно обнаружить только на рентгеновском снимке в боковой проекции.
Рентгенологически можно выделить два типа остеоартроза тазобедренного сустава: гипертрофический, при котором преобладают признаки повышенного репаративного ответа (остеофиты, субхондральный склероз), и атрофический, при котором признаки повышенного репаративного ответа не выражены (Solomon L. et al., 1982). Некоторые авторы описывают особую форму быстро прогрессирующего ОА, при котором сужение суставной щели происходит в течение нескольких месяцев (Edelman J., Owth E.J., 1981).
Исследование биомеханики сустава продемонстрировало, что нагрузка, которая приходится на тазобедренный сустав, состоит из нагрузки массы тела и приводящих бедро сил (Radin E.L., 1980). Верхний полюс сустава — зона, через которую проходит ось нагрузки массы тела, поэтому верхний полюс — наиболее уязвимый участок.
По нашим данным (обследованы 54 больных коксартрозом и 40 лиц без патологии со стороны опорно-двигательного аппарата, группы были сопоставимы по возрасту и полу), снижение объема движений в тазобедренном суставе ассоциировалось с тяжестью клинико-рентгенологической стадии заболевания (табл. 17). Однако не все виды движений были связаны с прогрессированием коксартроза: так, наибольшая корреляция была отмечена для сгибания (r= –0,84), отведения и внутренней ротации бедра (r= –0,69 и r= –0,67 соответственно), более слабая корреляция — для наружной ротации (r= –0,40); не выявлено коррелятивной связи для приведения.
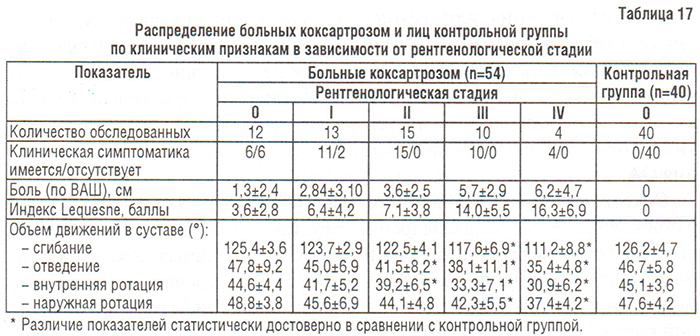
Следовательно, снижение объема движений в тазобедренном суставе (сгибание, отведение и внутренняя ротация бедра) выраженно коррелирует с тяжестью рентгенологической стадии коксартроза.
На поздних стадиях коксартроза обнаруживают значительные изменения синовиальной оболочки и утолщение суставной капсулы (Byers P.D. et al., 1970). Исследование материала, полученного во время артропластики тазобедренного сустава, свидетельствует о том, что при коксартрозе часто имеются небольшие зоны асептического некроза головки бедренной кости (Dieppe P.A., 1995).
Коксартроз обычно поражает лиц в возрасте 40–60 лет. Основными предрасполагающими факторами к развитию ОА тазобедренного сустава являются его врожденная дисплазия, болезнь Пертеса, аномалии длины нижней конечности, дисплазия вертлужной впадины (Harris W., 1986). Одностороннее поражение сустава встречается гораздо чаще, чем двустороннее.
Основной симптом ОА тазобедренного сустава — боль при ходьбе и опоре на ногу в бедре, ягодице, паху, иногда только в коленном суставе, что значительно затрудняет диагностику. Больных беспокоят скованность в пораженном суставе после периода покоя; болезненное уменьшение объема движений, причем первым уменьшается объем внутренней, а затем наружной ротации и угол отведения ноги. Уменьшается функциональная способность больного: трудно, нагнувшись, надеть носки, обувь, поднять что-либо с пола. В наиболее тяжелых случаях можно услышать (но не пальпировать) крепитации при движениях в суставе. Болезненность над латеральной поверхностью сустава может быть обусловлена вторичным вертельным бурситом. На поздних стадиях коксартроза появляется хромота в связи с укорочением ноги вследствие миграции головки бедренной кости, а при двустороннем поражении — «утиная походка». Развивается атрофия мышц бедра и ягодицы, появляются характерные «анталгическая» (коксалгическая) походка и так называемый признак Тренделенбурга: при попытке больного опереться на пораженную конечность опускается таз.
Коксартроз — наиболее тяжелая форма ОА. Течение коксартроза — хроническое прогрессирующее. Скорость прогрессирования заболевания варьирует. В большинстве случаев пациенты, которые нуждаются в хирургическом лечении, имеют относительно короткий анамнез — от 3 до 36 мес (Dieppe P.A., 1995). При быстро прогрессирующем течении коксартроза в течение нескольких лет наступает полная инвалидизация больного, особенно при двустороннем поражении. По данным L.G. Danielsson (1964), у части обследованных больных состояние оставалось стабильным на протяжении 10 лет и более. Для концентрического поражения тазобедренного сустава и гипертрофического варианта коксартроза характерен более благоприятный прогноз (Rueble M., Dubois J.L., 1981). Для коксартроза описаны случаи спонтанного обратного развития болезни в случае, если хирургическое лечение было отложено (Dieppe P.A., 1995).
Наиболее частое осложнение коксартроза — деструкция костной ткани. К другим осложнениям остеоартроза тазобедренного сустава относятся асептический некроз головки бедренной кости, протрузия вертлужной впадины, разрушение кист области вертлужной впадины. В некоторых случаях быстро прогрессирующий коксартроз может привести к необычной картине — выраженная деструкция костной ткани и широкая суставная щель. Такой вариант коксартроза называют «анальгетическим тазобедренным суставом», поскольку связывают с приемом обезболивающих препаратов. Однако он может развиваться и у пациентов, которые не принимают вообще или принимают мало анальгетиков и НПВП (Rashad S. et al., 1989).
Коксартроз может возникать вторично на фоне контралатерального или ипсилатерального гонартроза (Dixon A.S.J., Campbell-Smith S., 1969). Среди осложнений со стороны периартикулярных структур чаще всего развивается трохантерический бурсит.
Остеоартроз суставов кистей. К сожалению, ОА суставов кистей не так детально изучен, как гонартроз и коксартроз. Вероятно, это связано с относительной доброкачественностью ОА этой локализации.
ОА преимущественно поражает дистальные (~70% больных с ОА кистей), реже — проксимальные (~35% больных с ОА суставов кистей) межфаланговые суставы и запястно-пястный сустав большого пальца (~60% женщин и ~40% мужчин с ОА кистей). Пястно-фаланговые суставы и лучезапястный сустав поражаются редко (у женщин ~10 и 5%, у мужчин ~20 и 20% соответственно). ОА кистей поражает женщин в 4 раза (по другим данным, в 10 раз) чаще, чем мужчин (Swanson A.B., Swanson G.G., 1985). По мнению E.L. Radin и соавторов (1971), вышеописанное распределение частоты поражения суставов кистей можно объяснить распределением нагрузки на них — максимальная нагрузка приходится на дистальные межфаланговые суставы. Частота поражения суставов кистей у больных с ОА является зеркальным отражением таковой при ревматоидном артрите (Swanson A.B., Swanson G.G., 1985).
ОА кистей обычно начинается в среднем возрасте, чаще у женщин в климактерический период (Acheson R.M. et al., 1970; Spector T.D., Campion G.D., 1989). Нередко ОА кистей ассоциирован с гонартрозом и ожирением (особенно изолированный ОА запястно-пястного сустава большого пальца и межфаланговых суставов). Изолированные артрозы отдельных мелких суставов кистей (за исключением запястно-пястного сустава I пальца), а также изолированный артроз лучезапястного сустава обычно вторичны (например, ОА лучезапястного сустава после перенесенной болезни Кинбека (асептический некроз луновидной кости) или посттравматический ОА).
Отличительным признаком ОА межфаланговых суставов кистей являются узелки Гебердена (дистальные межфаланговые суставы) и Бушара (проксимальные межфаланговые суставы). Они представляют собой плотные узловатые утолщения преимущественно на верхнелатеральной поверхности суставов. Узлы болезненны, часто осложняются вторичным синовитом, при котором могут появляться небольшая припухлость мягких тканей, локальное повышение температуры кожи, иногда гиперемия кожи над суставом. Больные с ОА межфаланговых суставов чаще, чем больные с другой локализацией, жалуются на скованность продолжительностью до 30 мин в пораженных суставах утром и после периода покоя. На ранних стадиях ОА межфаланговых суставов кистей над суставами могут образовываться кисты, которые иногда спонтанно вскрываются с высвобождением вязкого бесцветного желеобразного содержимого, богатого гиалуроновой кислотой. На поздних стадиях ОА межфаланговых суставов могут возникнуть их нестабильность, уменьшение объема сгибания, а также снижение функциональной способности суставов, которая проявляется затруднениями при выполнении мелкой работы, тонких движений (Pattrick M. et al., 1989).
Пациентов с изолированным ОА запястно-пястного сустава І пальца беспокоит боль в области основания І пястной кости. Редко больной может жаловаться на неопределенную боль «где-то в лучезапястном суставе». Частой жалобой больных при ОА запястно-пястного сустава І пальца является затруднение при складывании пальцев в щепоть. Пальпация сустава болезненна, иногда можно слышать и пальпаторно ощущать крепитации при движениях в суставе. В тяжелых случаях дегенеративные изменения запястно-пястного сустава І пальца сопровождаются приведением пястной кости и атрофией близлежащих мышц, что ведет к формированию «квадратной кисти». ОА запястно-пястного сустава І пальца кисти также может осложняться вторичным синовитом, сопровождающимся усилением боли, припухлостью мягких тканей, гиперемией и повышением локальной температуры кожи над суставом.
В тяжелых случаях ОА суставов кистей рентгенологически обнаруживают не только характерные для ОА признаки (сужение суставной щели, склероз субхондральной кости, остеофитоз, субхондральные кисты), но и прерывистый характер белой кортикальной линии. Такой ОА называют эрозивным (Utsinger P.D. et al., 1978). Для эрозивной (безузелковой) формы ОА кистей характерно рецидивирование синовитов. Особенностью клинической картины эрозивного ОА суставов кистей является поражение не только проксимальных и дистальных межфаланговых суставов и запястно-пястного сустава I пальца кисти, но и вовлечение первого (чаще), второго и третьего (реже) пястно-фаланговых суставов (Ehrlich G.E., 1972a). Эрозивные изменения очень редко выявляют при ОА коленных, тазобедренных суставов и плюснефаланговых суставов стоп и почти никогда — при ОА плечевых, локтевых суставов и суставов позвоночника (Crain D.C., 1961; Ehrlich G.E., 2001). По данным G.E. Ehrlich (1972b) приблизительно у 15% больных с эрозивным ОА со временем развивается РА, проявляющийся стойким повышением СОЭ и выявлением РФ в крови.
Клинически эрозивный ОА суставов кистей определяют по признакам локального воспаления над пораженными суставами (нередко уже визуально измененными в виде узлов Гебердена и/или Бушара), их латеральной нестабильности (результат эрозивных изменений) и шишковидной деформации пальцев (Balboza B. et al., 1968; Ehrlich G.E., 1972).
Гистологически в синовиальной оболочке обнаруживают явления воспаления без паннуса, в анализах крови — признаки острофазового ответа (гипергаммаглобулинемия, повышение СОЕ и содержания СРБ и др.).
Природа эрозивного ОА неустановлена. Его иногда трактуют как перекрестное состояние между ОА и РА, хотя чаще — как тяжелую форму ОА суставов кистей (Dieppe P.A., 1995). В основе наблюдаемых при эрозивном ОА изменений, возможно, лежит явление неоангиогенеза (Ehrlich G.E., 1975; 2001; Walsh D.A., 2001). Результаты раннего исследования свидетельствовали о повышенной неоваскуляризации в области узелковых деформаций пальцев, последнее исследование подтвердило это наблюдение. Известно, что неоваскуляризация — ответ на повреждение тканей воспалением. Кроме того, этот процесс может способствовать хронизации воспаления при ряде болезней, в том числе и при ОА (Ehrlich G.E., 2001).
Эволюция ОА суставов кистей обычно завершается в течение нескольких лет (Kellgren J.H., Moore R., 1952; Ehrlich G.E., 1972; Hutton C.W. et al., 1986). Заболевание начинается с ощущений дискомфорта, болезненности, иногда зуда в области межфаланговых суставов и основания І пястной кости. В течение нескольких лет (иногда месяцев) симптоматика периодически обостряется и стихает, часто возникают признаки локального воспаления. Над суставами могут формироваться кисты. Спустя некоторое время процесс стабилизируется, боль и воспаление затихают, припухлость над суставами становится твердой и фиксированной, приобретает узловатый характер; объем движений в суставах уменьшается, иногда развивается нестабильность суставов.
Для ОА суставов кистей характерно неодновременное поражение суставов. Поэтому в каждый определенный момент времени в одних суставах изменения стабильны, в других — есть признаки активного воспаления и прогрессирования морфологических изменений. Появляющиеся «эрозии» впоследствии претерпевают обратное развитие, оставляя типичный симптом «крыла чайки». По мнению P.A. Dieppe (1995), ОА суставов кистей представляет собой стадийный процесс, в котором каждый сустав проходит период «активных» изменений, за которым следует стабилизация состояния.
ОА суставов кистей редко сопровождается осложнениями. Поражение лучезапястного сустава может осложняться туннельным синдромом. В каждом суставе может развиваться нестабильность. Следствием эрозивной (безузелковой) формы ОА межфаланговых суставов кистей может быть сращение суставных поверхностей (Crain D.C., 1961); этот процесс ускоряется внутрисуставным введением кортикостероидных препаратов пролонгированного действия (Gray R.G. et al., 1981).
ОА позвоночника. ОА апофизарных суставов позвоночника (спондилоартроз) и дегенерация межпозвоночных дисков (остеохондроз) — разные заболевания (Dieppe P.A., 1995). Напомним, что по определению ОА — заболевание синовиальных суставов или диартрозов (см. «Введение»), а остеохондроз — дегенеративное поражение хрящевых суставов или амфиартрозов. По классификации МКБ-10, остеохондроз и остеоартроз относят к разным классам болезней — соответственно М42 и М47. Однако существует взаимосвязь между остеоартрозом суставов позвоночника и остеохондрозом: они могут способствовать возникновению друг друга и обычно сосуществуют в одной и той же зоне позвоночника (Gotfried Y. et al., 1986).
Наиболее часто ОА поражаются шейный (особенно СV) и поясничный (особенно LIII–V) отделы позвоночника.
Морфологические и рентгенологические изменения в апофизарных суставах позвоночника аналогичны таковым при ОА других локализаций (Farfan H.S., 1973). Дегенерация межпозвоночных дисков часто сопровождается краевым остеофитозом. Вероятно, клиническая связь между ОА апофизарных суставов и дегенерацией межпозвоночных дисков отражает их биомеханическую взаимосвязь: любые изменения в одном из этих сочленений неизбежно влекут за собой аномальную нагрузку на другой. Расположение остеофитов на позвонках, возможно, демонстрирует приложение максимальной нагрузки.
Рентгенологические признаки ОА позвоночника настолько часто выявляются в возрасте около 40 лет, что дискутируется вопрос: не является ли ОА позвоночника естественным процессом при старении (Lawrense J.S. et al., 1966; Frymoyer J.W. et al., 1984)? В пользу этой гипотезы свидетельствует и то, что не обнаружена связь между степенью рентгенологических изменений в суставах позвоночника и выраженностью симптоматики — даже значительное прогрессирование морфологических изменений в апофизарных суставах позвоночника с образованием крупных остеофитов нередко клинически не манифестирует (Dieppe P., 1995). Это также является отличительной чертой ОА позвоночника от остеохондроза, для которого характерна четкая взаимосвязь между степенью выраженности дегенеративных изменений в дисках и клинической манифестацией.
Для ОА позвоночника характерен «механический» характер боли в поясничном отделе: боль появляется/усиливается при движениях, длительном сидении, стоянии. Она может иррадиировать в область ягодиц и бедер. Усиление боли при разгибании позвоночника в большей степени характерно для ОА, усиление боли при сгибании позвоночника — для дегенерации межпозвоночных дисков (Dieppe P., 1995).
Основным осложнением ОА позвоночника является сдавление нервных корешков остеофитами или при подвывихе апофизарных суставов, что может сопровождаться чувствительными и двигательными нарушениями. Подобные осложнения могут возникать при поражении любого отдела позвоночника; они особенно выражены при ОА шейного отдела. Тяжелые неврологические нарушения наблюдаются при сдавлении спинного мозга крупными остеофитами. При сдавлении позвоночных артерий возможно нарушение кровоснабжения головного мозга. Однако необходимо заметить, что такие осложнения при ОА встречаются значительно реже, чем при остеохондрозе позвоночника.
ОА других локализаций. ОА — одна из причин боли и дисфункции височно-нижнечелюстного сустава. Чаще всего встречается вторичный ОА этого сустава на фоне воспалительных артропатий (Zart G.A., Carlsson G.E., 1979; Guralnick W., Keith D.A., 1991).
Как случайную находку часто обнаруживают характерные для ОА изменения в грудино-ключичном сочленении. Эти изменения крайне редко проявляются клинически (Cierboom M.A.C., 1992). ОА — частая причина боли в акромиально-ключичном суставе. Больной, как правило, не может точно определить источник боли и характеризует ее как «боль в плечевом суставе». При осмотре области сустава обнаруживают болезненность над его проекцией, иногда над верхним полюсом можно пропальпировать остеофит.
ОА плечевого сустава выявляют редко и преимущественно у женщин пожилого возраста (Maquet P.G.J., 1976; Cushnaghan J., Dieppe P.A., 1991). Основные симптомы ОА плечевого сустава — болезненность при движениях и пальпации, болезненное ограничение движений, особенно затруднены поднимание руки и наружная ротация. На рентгенограммах обнаруживают «классические» рентгенологические симптомы ОА, часто с большими остеофитами в области нижнего полюса гленоидальной ямки.
Локтевой сустав редко поражается ОА. Мужчины болеют чаще, чем женщины, причем обычно в процесс вовлекается плечелоктевой отдел этого сложного сустава (Doherty M., Preston B., 1989). Болевой синдром при ОА локтевого сустава обычно не выражен (иногда отсутствует), основными признаками заболевания являются фиксированная флексия сустава, крепитации и ограничение объема движений.
Несмотря на то, что голеностопный сустав часто травмируется и несет большую нагрузку, он редко поражается ОА (Mann R.A., 1991).
У женщин любого возраста (особенно среднего и пожилого) часто можно обнаружить вальгусную деформацию плюснефалангового сустава I пальца стопы (hallux valgus) — результат ношения узкой обуви на высоком каблуке (Mann R.A. et al., 1979). Эта деформация, как правило, сопровождается ОА плюснефалангового сустава I пальца стопы. Сам ОА данной локализации редко проявляется клинически, боль в области сустава обычно вызвана вторичным воспалением суставной сумки.
Клинические формы и варианты ОА
Анализ результатов крупных популяционных исследований позволил выделить четыре наиболее часто встречающиеся клинические формы ОА (Dieppe P.A., 1995) (рис. 22):
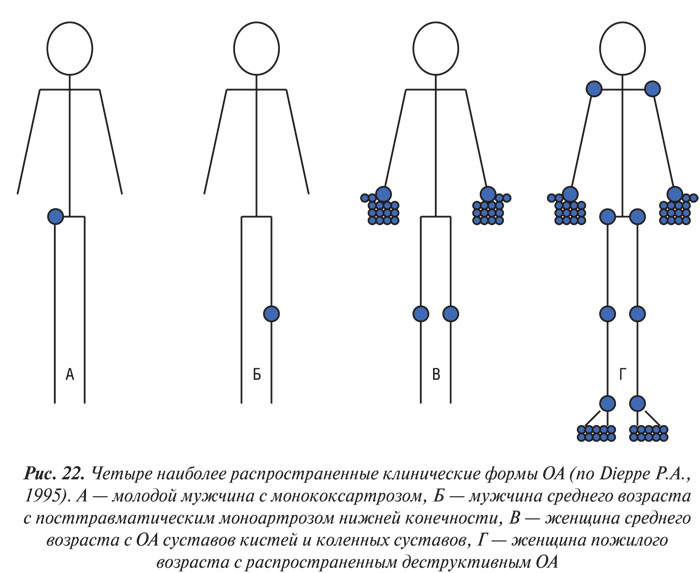
- Ранний моноартроз суставов нижних конечностей. Очевидно, что моноартроз коленного, голеностопного или других суставов нижних конечностей у молодых людей вторичен — после травмы или операции (например, менискэктомии). Такая форма ОА встречается редко.
- Ранний моноартроз тазобедренного сустава также вторичен — посттравматический (преимущественно у молодых мужчин) либо на фоне врожденных дисплазий (преимущественно у женщин молодого возраста).
- Сочетание ОА коленных суставов и суставов кистей. Эта форма часто встречается у женщин среднего возраста с ожирением и гипертонической болезнью. Поражаются межфаланговые суставы с образованием узелков и преимущественно медиальный тибиофеморальный и пателлофеморальный компартменты коленного сустава.
- Сочетание гонартроза, ОА кистей, позвоночника и ОА других локализаций принято называть генерализованным ОА. I.H. Kellgren и R. Moore (1952) рекомендовали называть генерализованным ОА «…наличие рентгенологических признаков ОА в шести и более группах суставов, включая первые запястно-пястные суставы кистей, проксимальные межфаланговые суставы кистей, апофизарные суставы позвоночника, коленные суставы и первые плюснефаланговые суставы стоп». Согласно классификации остеоартроза ACR, генерализованным называют ОА с поражением трех и более суставных групп с обязательным вовлечением следующих: коленные, тазобедренные суставы, апофизеальные суставы позвоночника и суставы кистей и стоп.