Современные представления о строении и функции синовиальных суставов
ОА — заболевание синовиальных суставов (диартрозов). Основные функции диартрозов — двигательная (перемещение составляющих сустав элементов по определенным осям) и опорная (нагрузка при стоянии, ходьбе, прыжке). Синовиальный сустав состоит из сочленяющихся костных поверхностей, покрытых хрящом, суставной полости, содержащей синовиальную жидкость, и суставной капсулы. Непостоянными анатомическими элементами диартроза являются связки, расположенные снаружи или, реже, внутри сочленения, и хрящевые мениски.
По форме сочленяющихся костных поверхностей диартрозы разделяют на следующие виды (Насонова В.А., Бунчук Н.В., 1997):
- плоские суставы (например, некоторые запястные и предплюсневые суставы);
- шаровидные суставы, в которых один суставной конец имеет форму шара или часть шара, а другой представляет собой вогнутую поверхность, конгруэнтную шаровидному сочленяющемуся концу; примером шаровидного сустава является плечевой сустав, в котором возможна большая свобода движений всех видов — сгибание, разгибание, отведение и приведение, круговые движения;
- эллипсоидные суставы, в которых один из сочленяющихся концов имеет вид эллипса, а другой — вид конгруэнтной впадины, в результате такого анатомического строения объем движений в этих сочленениях ограничен по сравнению с шаровидными и в них невозможны, например, круговые движения; различают простые эллипсоидные суставы и сложные с несколькими парами суставных сочленений (например, лучезапястные);
- блоковидные суставы, в которых один суставной конец представляет собой по форме блок, напоминающий катушку, шпульку, а другой вогнутый суставной конец охватывает часть блока и соответствует ему по форме; типичным блоковидным суставом является межфаланговый сустав кисти и стопы; движения в таких сочленениях могут совершаться только в одной плоскости — сгибание и разгибание; к блоковидным суставам относится и локтевой сустав — он состоит из трех сочленений — плечелоктевого, плечелучевого и проксимального лучелоктевого, в результате чего в этом сложном сочленении возможны помимо сгибания и разгибания, супинация и пронация, т.е. ротационные движения;
- вращательные (колесовидные) суставы, примером которых является срединный атлантоосевой сустав, состоящий из кольца, образованного передней дугой атланта и поперечной связкой, и зубовидного отростка II шейного позвонка, входящего в кольцо и служащего своеобразной осью, вокруг которой вращается кольцо атланта; в локтевом суставе лучелоктевое сочленение также следует отнести к вращательному типу суставов, так как головка лучевой кости вращается в кольцевой связке, охватывающей головку луча и прикрепляющейся к локтевой вырезке;
- седловидные суставы, примером таких суставов является запястно-пястный сустав большого пальца кисти; сочленованную поверхность в форме седла имеет трапециевидная кость, а форму вогнутого седла — I пястная кость; такое анатомическое строение позволяет производить круговые движения в сагиттальной и фронтальной плоскостях, круговые движения по оси в этом суставе невозможны;
- мыщелковые суставы, анатомической особенностью которых являются парные мыщелки — выпуклые и вогнутые, в которых возможны содружественные движения; примером мыщелкового сустава может служить коленный, состоящий из трех компонентов, образующих единую биомеханическую систему — пателлофеморального и внутреннего и наружного тибиофеморального сочленений; не вполне совершенная конгруэнтность мыщелков большой берцовой кости восполняется наружным и внутренним менисками; мощные боковые связки препятствуют боковым и качательным движениям голени вокруг бедра, а также предохраняют голень от подвывиха вперед и назад во время движений сустава; в этом мыщелковом суставе возможны сгибание и разгибание, наружная и внутренняя ротация в полусогнутом положении сустава; при сгибательно-разгибательных движениях происходит вращение мыщелков бедра по отношению к мыщелкам большой берцовой кости и одновременное их скольжение за счет перемещения осей вращения; таким образом, коленный сустав является многоосевым или полицентрическим, во время полного разгибания боковые связки и сухожилия, вплетенные в суставную капсулу, максимально напряжены, что создает условия для наибольшей устойчивости и опороспособности сустава в данном положении.
Сустав окружен фиброзной капсулой, прикрепляющейся к кости вблизи периферии суставного хряща и переходящей в надкостницу. Капсула синовиального сустава состоит из двух слоев — наружного фиброзного и внутреннего — синовиального. Фиброзный слой состоит из плотной волокнистой ткани, в некоторых местах фиброзный слой капсулы истончается с образованием заворотов или бурс, в других местах он утолщен, выполняя функцию связки сустава. Толщина фиброзного слоя капсулы определяется функциональной нагрузкой на сустав.
Утолщения капсулы образуют связки, состоящие из плотных параллельных пучков коллагеновых волокон, которые служат для стабилизации и укрепления сустава и ограничивают определенные движения. Среди особенностей капсулы, помимо выполнения ею функции опоры для синовиальной оболочки и соединения со связками, следует отметить большое количество находящихся в ней нервных окончаний в отличие от синовии, имеющей незначительное количество таких окончаний, и суставного хряща, не содержащего их вовсе. Считается, что вместе с нервами мышц нервы капсулы участвуют в контроле положения, а также реагируют на болевые воздействия (Вернон-Робертс В., 1990).
Синовиальная оболочка — наименьшая по массе и объему, но наиболее важная составная часть синовиального сустава, поскольку большая часть ревматических болезней протекает с воспалением синовиальной оболочки, которое носит общее название «синовит». Синовиальная оболочка выстилает все внутрисуставные структуры кроме суставного хряща, ее толщина составляет 25–35 мкм. Гистологически она представляет собой пласт соединительной ткани, состоящий из покровного, коллагенового и эластического слоев (Павлова В.Н., 1980). Синовиальная оболочка в норме имеет известное количество складок и пальцевидных ворсин и формирует тонкий синовиальный слой (называемый иногда покровным слоем); в его состав входят слой покровных клеток, образующий выстилку несочленяющихся поверхностей сустава, и субсиновиальный поддерживающий слой, состоящий из фиброзно-жировой соединительной ткани различной толщины, которая соединяется с капсулой. Синовиальный слой часто сливается с субсиновиальной тканью путем плавного перехода от аваскулярного внутреннего покрытия, содержащего множество клеток, к васкуляризированной субсиновиальной соединительной ткани с меньшим количеством клеток, которая по мере приближения к соединению ее с фиброзной капсулой становится все более насыщенной коллагеновыми волокнами. Из кровеносных сосудов субсиновиальной соединительной ткани в синовиальную жидкость выходят клетки и питательные вещества благодаря отсутствию морфологического разъединения синовиального и субсиновиального слоев (отсутствию базальной мембраны, наличию промежутков между покровными клетками).
Синовиальная оболочка в норме выстлана 1–3 слоями синовицитов — синовиальных клеток, расположенных в матриксе (основном веществе), богатом микрофибриллами и аггрегатами протеогликанов. Синовициты делят на две группы — типа А (макрофагоподобные) и типа В (фибробластоподобные). Синовициты типа А имеют неровную клеточную поверхность с большим количеством выростов, у них хорошо развит комплекс Гольджи, много вакуолей и везикул, однако рибосомальная эндоплазматическая сеть выражена слабо. Макрофагальные синовициты также могут содержать большое количество фагоцитированного материала. У синовицитов типа В поверхность относительно гладкая, хорошо развита рибосомальная эндоплазматическая сеть, они содержат лишь незначительное количество вакуолей. Классическое деление синовицитов на А-клетки, выполняющие фагоцитирующую функцию, и В-клетки, основной функцией которых является выработка компонентов синовиальной жидкости, прежде всего гиалуроновой кислоты, не отражает всех функций синовицитов. Так, были описаны синовициты типа С, которые по своим ультраструктурным признакам занимают промежуточное положение между клетками типа А и В. Кроме того, установлено, что макрофагоподобные клетки способны синтезировать гиалуроновую кислоту, а фибробластоподобные обладают способностью к активному фагоцитозу (Вернон-Робертс Б., 1990).
Современные представления о строении и функции суставного хряща
Структура суставного хряща человека
Нормальный суставной хрящ выполняет две основные функции: поглощение давления путем деформации во время механической нагрузки и обеспечение гладкости суставных поверхностей, что позволяет максимально уменьшить трение при движениях в суставе. Это обеспечивается уникальной структурой суставного хряща, который состоит из хондроцитов, погруженных во внеклеточный матрикс (ВКМ).
Нормальный суставной хрящ взрослого можно разделить на несколько слоев, или зон (рис. 6): поверхностная, или тангенциальная, зона, переходная зона, глубокая, или радиальная, зона и кальцифицированная зона. Слой между поверхностной и переходной зонами и особенно между переходной и глубокой зонами не имеет четких границ. Соединение между некальцифицированным и кальцифицированным суставным хрящом называется «волнистой границей» — это линия, определяемая при окрашивании декальцифицированной ткани. Кальцифицированная зона хряща составляет относительно постоянную пропорцию (6–8%) в общей высоте среза хряща (Oegema T.R., Thompson R.C., 1992). Общая толщина суставного хряща, включая зону кальцифицированного хряща, варьирует в зависимости от нагрузки на определенный участок суставной поверхности и от вида сустава. Перемежающееся гидростатическое давление в субхондральной кости играет важную роль в поддержании нормальной структуры хряща, замедляя оссификацию.
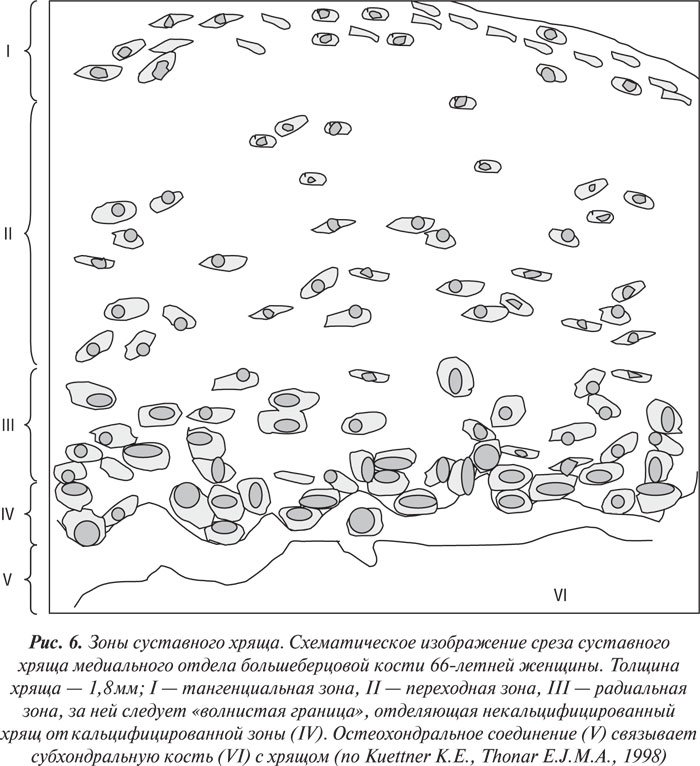
Хондроциты составляют приблизительно 2–3% от общей массы ткани; в поверхностной (тангенциальной) зоне они рсположены вдоль, а в глубокой (радиальной) зоне — перпендикулярно к поверхности хряща; в переходной зоне хондроциты формируют группы по 2–4 клетки, рассеянные по всему матриксу. В зависимости от зоны суставного хряща варьирует плотность расположения хондроцитов — наивысшая плотность клеток в поверхностной зоне, наиболее низкая — в кальцифицированной (рис. 6). Кроме того, плотность распределения клеток варьирует от сустава к суставу, она обратно пропорциональна толщине хряща и нагрузке, которую испытывает соответствующий его участок.
Наиболее поверхностно расположенные хондроциты имеют дисковидную форму и образуют в тангенциальной зоне несколько слоев клеток, расположенных ниже узкой полоски матрикса; глубже расположенные клетки этой зоны имеют тенденцию к более неровным контурам. В переходной зоне хондроциты имеют сферическую форму, иногда они объединяются в небольшие группы, рассеянные в матриксе. Хондроциты глубокой зоны имеют преимущественно эллипсоидную форму, группируются в радиально расположеные цепочки из 2–6 клеток. В кальцифицированной зоне они распределены еще более разреженно; некоторые из них некротизированы, хотя большинство жизнеспособны. Клетки окружены некальцифицированным матриксом, межклеточное пространство — кальцифицировано.
Таким образом, суставной хрящ человека состоит из гидратированного ВКМ и погруженных в него клеток, которые составляют 2–3% от общего объема ткани. Так как хрящевая ткань не имеет кровеносных и лимфатических сосудов, взаимодействие между клетками, доставка к ним питательных веществ, удаление продуктов обмена осуществляется путем диффузии через ВКМ. Несмотря на то, что метаболически хондроциты очень активны, в норме у взрослых людей они не делятся. Хондроциты существуют в бескислородной среде, считают, что их метаболизм осуществляется преимущественно анаэробным путем (Shapiro I.M. et al., 1991).
Каждый хондроцит рассматривают как отдельную метаболическую единицу хряща, изолированную от соседних клеток, но ответственную за продукцию элементов ВКМ в непосредственной близости от данной клетки и поддержание его состава (Aydelotte M.B., Kuettner K.E., 1988).
В ВКМ выделяют три отдела (рис. 7), каждый из которых имеет уникальную морфологическую структуру (Hunziker E.B., 1992) и определенный биохимический состав (Mok S.S. et al., 1994; Hauselmann H.J. et al., 1996). ВКМ, непосредственно прилегающий к базальной мембране хондроцита, называется перицеллюлярным, или лакунарным, матриксом. Он характеризуется высоким содержанием агрегатов протеогликанов, связанных с клеткой взаимодействием гиалуроновой кислоты с СD44-подобными рецепторами (Knudson C.B., Knudson W., 1993), и относительным отсутствием организованных фибрилл коллагенов. Непосредственно с перицеллюлярным матриксом соприкасается территориальный, или капсулярный, матрикс, который состоит из сети перекрещивающихся фибриллярных коллагенов, которая инкапсулирует отдельные клетки или (иногда) группы клеток, формируя хондрон, и, вероятно, обеспечивает специальную механическую поддержку клеток (Kuettner K.E., Thonar E.J.M.A., 1998). Контакт хондроцитов с капсулярным матриксом осуществляется посредством многочисленных цитоплазматических отростков, богатых микрофиламентами, а также посредством специфических матриксных молекул, таких, как анкорин и СD44-подобные рецепторы. Наиболее крупный и наиболее удаленный от базальной мембраны хондроцита отдел ВКМ — межтерриториальный матрикс, содержащий наибольшее количество коллагеновых фибрилл и протеогликанов (Hunziker E.B., 1992).
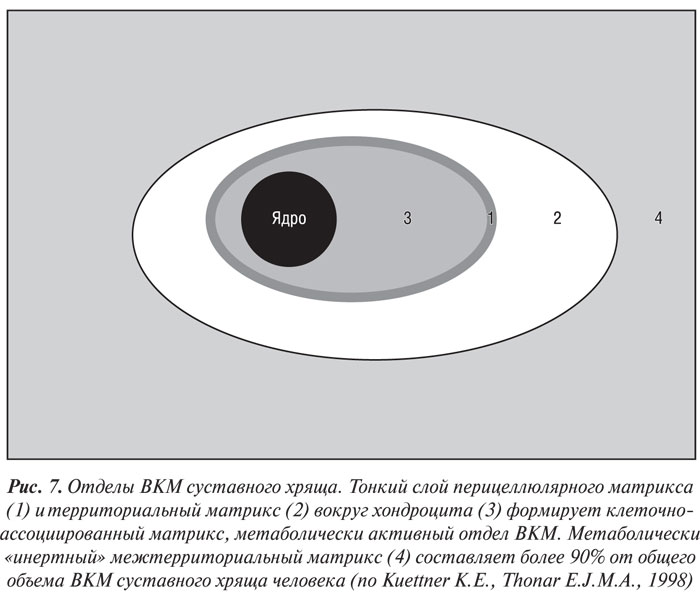
Разделение ВКМ на отделы более четко очерчено в суставном хряще взрослого человека, чем в незрелом суставном хряще (Kuettner K.E., Thonar E.J.M.A., 1998). Относительный размер каждого отдела варьирует не только в разных суставах, но даже в пределах одного и того же хряща. Каждый хондроцит вырабатывает матрикс, окружающий его. По данным исследований (Hunziker E.B., 1992; Mok S.S. et al., 1994), хондроциты зрелой хрящевой ткани осуществляют активный метаболический контроль над своими перицеллюлярным и территориальным матриксами, менее активно они контролируют межтерриториальный матрикс, который может быть метаболически «инертным».
Как указывалось раньше, суставной хрящ главным образом состоит из обширного ВКМ, синтезируемого и регулируемого хондроцитами. Тканевые макромолекулы и их концентрация меняются в течение жизни в соответствии с изменяющимися функциональными потребностями. Однако остается неясным: клетки синтезируют весь матрикс одновременно или в определенные фазы в соответствии с физиологическими потребностями (Kuettner K.E., Thonar E.J.M.A., 1998). Концентрация макромолекул, метаболическое равновесие между ними, взаимоотношение и взаимодействие определяют биохимические свойства, а значит, и функцию суставного хряща в пределах одного сустава. Основным компонентом ВКМ суставного хряща взрослого человека является вода (65–70% от общей массы), которая прочно связана внутри него благодаря особым физическим свойствам макромолекул хрящевой ткани, входящих в состав коллагенов, протеогликанов и неколлагеновых гликопротеинов (Thonar E.J.M.A. et al., 1999).
Биохимический состав хряща
Коллагеновые волокна состоят из молекул фибриллярного белка коллагена. У млекопитающих на долю коллагена приходится четвертая часть всех белков организма. Коллаген формирует фибриллярные элементы (коллагеновые фибриллы), состоящие из структурных субъединиц, называемых тропоколлагеном. Молекула тропоколлагена имеет три цепи, которые образуют тройную спираль. Такое строение молекулы тропоколлагена, а также структура коллагенового волокна, когда эти молекулы располагаются параллельно в продольном направлении с постоянным сдвигом примерно на 1/4 длины и обеспечивают высокую упругость и прочность тканям, в которых они находятся. В настоящее время известны 10 генетически различных типов коллагена, различающихся химической структурой α-цепей и/или их набором в молекуле. Наиболее изученные первые четыре типа коллагена способны формировать до 10 молекулярных изоформ.
Коллагеновые фибриллы входят в состав внеклеточного пространства большинства видов соединительной ткани, в том числе и хрящевой. Внутри нерастворимой трехмерной сети из перекрещивающихся коллагеновых фибрилл «запутаны» другие более растворимые компоненты, такие, как протеогликаны, гликопротеины и тканеспецифические протеины; иногда они ковалентно связаны с коллагеновыми элементами.
Организованные в фибриллы коллагеновые молекулы составляют около 50% органического сухого остатка хряща (10–20% нативного хряща) (Thonar E.J.M.A. et al., 1999). В зрелом хряще около 90% коллагенов составляют коллагены II типа, которые обнаруживают лишь в некоторых тканях (например, стекловидное тело, эмбриональная спинная струна). Коллаген II типа относится к I классу (формирующих фибриллы) коллагеновых молекул. Кроме него в зрелом суставном хряще человека также находят коллагены IX, XI типа и в небольшом количестве VI типа. Относительное количество коллагеновых волокон IX типа в коллагеновых фибриллах снижается от 15% в хряще плода до около 1% в зрелом хряще быка (Mayne R., 1989; Eyre D.R., 1991; 1992).
Молекулы коллагена II типа состоят из трех идентичных полипептидных α1(II)-цепей, синтезируемых и секретируемых в виде проколлагена-предшественника. Как только готовые молекулы коллагена высвобождаются во внеклеточное пространство, они формируют фибриллы (Kuettner K.E., Thonar E.J.M.A., 1992). В зрелом суставном хряще коллаген II типа образуют фибриллярные аркады, в которых более «толстые» молекулы расположены в глубоких слоях ткани, а более «тонкие» — горизонтально в поверхностных слоях (Schenk R.K. et al., 1986; Aydelotte M.B., Kuettner K.E., 1988).
В гене проколлагена II типа обнаружен экзон, кодирующий богатый цистеином N-терминальный пропептид. Этот экзон экспрессируется не в зрелом хряще, а на ранних стадиях развития (прехондрогенез). Благодаря наличию этого экзона молекула проколлагена II типа (тип II А) длиннее коллагена II типа (Ryan M.C., Sandell L.J., 1990). Вероятно, экспрессия этого типа проколлагена угнетает накопление элементов в ВКМ суставного хряща. Возможно, он играет определенную роль в развитии патологии хряща (например, неадекватный репаративный ответ, образование остеофитов и др.) (Sundell L.J. et al., 1992).
Сеть из коллагеновых фибрилл II типа обеспечивает функцию сопротивления растяжению и необходима для поддержания объема и формы ткани (Eyre D.R. et al., 1992; Hunziker E.B., 1992). Эта функция усиливается ковалентными и поперечными связями между молекулами коллагена (Eyre D.R. et al., 1990). В ВКМ фермент лизилоксидаза образует альдегид из гидроксилизина, который затем превращается в мультивалентную аминокислоту гидроксилизил-пиридинолин, формирующую поперечные связи между цепями. С одной стороны, концентрация этой аминокислоты повышается с возрастом, однако в зрелом хряще она практически не изменяется (Eyre D.R. et al., 1988). С другой стороны, в суставном хряще обнаруживают повышение с возрастом концентрации поперечных связей различных типов, образующихся без участия ферментов (Monnier V.M., Cerami A., 1981).
Около 10% от общего количества коллагенов хрящевой ткани составляют так называемые минорные коллагены, которые во многом обусловливают уникальную функцию этой ткани (Thonar E.J.M.A. et al., 1999). Коллаген IX типа принадлежит к III классу короткоспиральных молекул и к уникальной группе FACIT-коллагенов (Fibril-Associated Collagen with Interrupted Triple-helices — фибрилл-ассоциированный коллаген с прерванной тройной спиралью) (Olsen B.R., 1992). Он состоит из трех генетически различных цепей. Одна из них — α2-цепь — гликозилируется одновременно с хондроитин сульфатом, что делает эту молекулу одновременно протеогликаном. Между сегментами спирали коллагена IХ типа и коллагеном II типа обнаруживают как зрелые, так и незрелые гидроксипиридиновые поперечные связи (Eyre D.R. et al., 1987; van der Rest M., Mayne R., 1988). Коллаген IХ также может функционировать как межмолекулярный-интерфибриллярный «коннектор» (или мостик) между прилежащими коллагеновыми фибриллами (Muller-Glauser W. et al., 1986; Wu J.J., Eyre D.R., 1989). Молекулы коллагена IХ образуют поперечные связи между собой, что увеличивает механическую стабильность фибриллярной трехмерной сети и защищает ее от воздействия ферментов. Они также обеспечивают сопротивление деформации, ограничивая набухание находящихся внутри сети протеогликанов. Кроме анионной CS-цепи молекула коллагена IХ содержит катионный домен, сообщающий фибрилле большой заряд и склонность к взаимодействию с другими матриксными макромолекулами (Vasios G. et al., 1988).
Коллаген ХI типа составляет только 2–3% от общей массы коллагенов. Он принадлежит к I классу (образующих фибриллы) коллагенов и состоит из трех различных α-цепей. Вместе с коллагенами II и IХ типов коллаген ХI типа образует гетеротипные фибриллы суставного хряща (Eyre D.R., 1991). Молекулы коллагена ХI типа выявлены внутри коллагеновых фибрилл II типа с помощью иммуноэлектромикроскопии. Возможно, они организуют молекулы коллагена II типа, контролируя латеральный рост фибрилл и детерминируя диаметр гетеротипной коллагеновой фибриллы (Eikenberry E.F. et al., 1992). Кроме того, коллаген ХI принимает участие в формировании поперечных связей, однако даже в зрелом хряще поперечные связи остаются в виде незрелых дивалентных кетоаминов (Eyre D.R. et al., 1992).
Малое количество коллагена VI типа, другого представителя III класса короткоспиральных молекул, обнаружено в суставном хряще (Eyre D.R., 1991; Thomas J.T. et al., 1994). Коллаген VI типа образует различные микрофибриллы и, возможно, концентрируется в капсулярном матриксе хондрона (Poole C.A. et al., 1988).
Протеогликаны — это белки, к которым ковалентно присоединена по крайней мере одна гликозаминогликановая цепь. Протеогликаны относятся к одним из наиболее сложных биологических макромолекул. Наиболее обширно протеогликаны представлены в ВКМ хряща. «Запутанные» внутри сети из коллагеновых фибрилл, гидрофильные протеогликаны выполняют свою основную функцию — сообщают хрящу способность обратимо деформироваться (Kuettner K.E., Thonar E.J.M.A., 1998). Предполагают, что протеогликаны осуществляют и ряд других функций, суть которых до конца не ясна (Wight T., Mecham R., 1987; Hardingham T.E. et al., 1992; Sandy J.D., 1992).
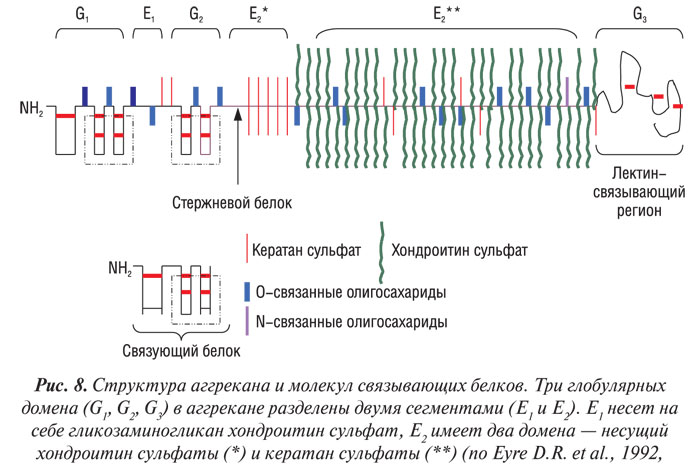
Аггрекан — основной протеогликан суставного хряща: он составляет около 90% общей массы протеогликанов в ткани (Thonar E.J.M.A. et al., 1999). Его стрежневой белок массой 230 кД гликозилирован множеством ковалентно связанных гликозаминогликановых цепей, а также N-концевыми и С-концевыми олигосахаридами (рис. 8).
Гликозаминогликановые цепи суставного хряща, которые составляют около 90% от общей массы макромолекул, — кератансульфат (представляет собой последовательность из сульфатированного дисахарида N-ацетилглюкозамингалактоза с множественными сульфатированными участками и других моносахаридных остатков, таких, как сиаловая кислота) и хондроитин сульфат (представляет собой последовательность из дисахарида N-ацетилгалактозамин-глюкуроновой кислоты с сульфатным эфиром, присоединенным к каждому четвертому или шестому атому углерода N-ацетилгалактозамина).
Стержневой белок аггрекана содержит три глобулярных (G1, G2, G3) и два межглобулярных (Е1 и Е2) домена (см. рис. 8). N-концевой участок содержит G1- и G2- домены, разделенные Е1-сегментом, протяженностью 21 нм. G3-домен, расположенный на С-концевом участке, отделен от G2 более длинным (около 260 нм) Е2-сегментом, который несет на себе более 100 цепей хондроитин сульфатов около 15–25 цепей кератан сульфатов, а также О-связанные олигосахариды. N-связанные олигосахариды обнаруживают главным образом в пределах G1- и G2-доменов и Е1-сегмента, а также вблизи G3-региона. Гликозаминогликаны группируются в двух регионах: наиболее протяженный (так называемый регион, богатый хондроитин сульфатами) содержит цепи хондроитин сульфатов и около 50% кератан сульфатных цепей (Thonar E.J.M.A., Kuettner K.E., 1987). Регион, богатый кератан сульфатами, локализуется на Е2-сегменте вблизи G2-домена и предшествует региону, богатому хондроитин сульфатами (Hardingham T.E. et al., 1992). Молекулы аггрекана также содержат фосфатные эфиры, локализованные прежде всего на ксилозных остатках, которые присоединяют цепи хондроитин сульфатов к стержневому белку; их также обнаруживают на сериновых остатках стержневого белка (Thonar E.J.M.A. et al., 1999).
С-терминальный сегмент G3-домена высокогомологичен лектину, благодаря чему молекулы протеогликана могут фиксироваться в ВКМ путем связывания с некоторыми углеводородными структурами (Hardingham T.E. et al., 1992).
В недавно проведенных исследованиях был обнаружен экзон, кодирующий ЭФР-подобный (эпидермальный фактор роста) субдомен в пределах G3. Используя анти-ЭФР поликлональные антитела, ЭФР-подобный эпитоп был локализован внутри пептида массой 68 кД в аггрекане суставного хряща человека. Однако его функции требуют уточнения (Kuettner K.E., Thonar E.J.M.A., 1998). Этот субдомен также обнаружен в структуре молекул адгезии, контролирующих миграцию лимфоцитов (Hardingham T.E. et al., 1992). Лишь около трети молекул аггрекана, изолированных из зрелого суставного хряща человека, содержат интактный G3-домен; вероятно, это связано с тем, что в ВКМ молекулы аггрекана могут быть уменьшены в размерах ферментным путем. Дальнейшая судьба и функция отщепленных фрагментов неизвестны (Kuettner K.E., Thonar E.J.M.A., 1998).
Главным функциональным сегментом молекулы аггрекана является гликозаминогликан-несущий Е2-сегмент. Участок, богатый кератан сульфатами, содержит аминокислоты пролин, серин и треонин. Большинство остатков серина и треонина О-гликозилированы N-ацетилгалактозаминовыми остатками, они запускают синтез некоторых олигосахаридов, которые встраиваются в цепи кератан сульфатов, тем самым удлиняя их. Остальная часть Е2-сегмента содержит более 100 последовательностей серин–глицин, в которых серин обеспечивает прикрепление к ксилозильным остаткам в начале цепей хондроитин сульфатов. Обычно и хондроитин-6-сульфат, и хондроитин-4-сульфат существуют одновременно в пределах одной и той же молекулы протеогликана, из соотношение варьирует в зависимости от локализации хрящевой ткани и возраста человека (Thonar E.J.M.A. et al., 1999).
Структура молекул аггрекана в матриксе суставного хряща человека претерпевает ряд изменений в процессе созревания и старения (Roughley P.J., Mort J.S., 1986; Thonar E.J.M.A. et al., 1986; Thonar E.J.M.A., Kuettner K.E., 1987; Bayliss M.T., 1990). Связанные со старением изменения включают снижение гидродинамического размера в результате изменения средней длины цепей хондроитин сульфатов, увеличение числа и длины цепей кератан сульфатов (Thonar E.J.M.A., Kuettner K.E., 1987). Ряд изменений молекулы аггрекана также претерпевают под действием протеолитических ферментов (например, аггреканазы и стромелезина) на стержневой белок (Plass A.H.K., Sandy J.D., 1995). Это приводит к прогрессирующему уменьшению средней длины стержневого белка молекул аггрекана.
Молекулы аггрекана синтезируются хондроцитами и секретируются в ВКМ, где они формируют агрегаты, стабилизированные молекулами связующих белков. Эта агрегация включает в себя высокоспецифичные нековалентные и кооперативные взаимодействия между нитью глюкуроновой кислоты и почти 200 молекулами аггреканов и связующих белков. Глюкуроновая кислота — внеклеточный несульфатированный линейный гликозаминогликан с большой молекулярной массой, состоящий из множества последовательно связанных молекул N-ацетилглюкозамина и глюкуроновой кислоты (Knudson C.B., Knudson W., 1993). Спаренные петли G1-домена аггрекана (см. рис. 8) обратимо взаимодействуют с пятью последовательно расположенными дисахаридами гиалуроновой кислоты. Связующий белок, который содержит аналогичные (высокогомологичные) спаренные петли (Neame P.J. et al., 1987), взаимодействует с G1-доменом и молекулой гиалуроновой кислоты и стабилизирует структуру агрегата. Комплекс G1-домен — гиалуроновая кислота — связующий белок формирует высокостабильное взаимодействие, которое защищает G1-домен и связующий белок от действия протеолитических ферментов. Идентифицированы две молекулы связующего белка с молекулярной массой 40–50 кД; они отличаются друг от друга степенью гликозилирования. Только одна молекула связующего белка имеется в месте связи гиалуроновая кислота — аггрекан. Третья, более мелкая, молекула связующего белка образуется из более крупных путем протеолитического отщепления (Roughley P.J. et al., 1992).
Около 200 молекул аггрекана могут связываться с одной молекулой гиалуроновой кислоты с образованием агрегата длиной 8 мкм. В клеточно-ассоциированном матриксе, состоящем из перицеллюлярного и территориального отделов, агрегаты сохраняют свою связь с клетками путем связывания (через нить гиалуроновой кислоты) с CD44-подобными рецепторами на клеточной мембране (Knudson C.B., Knudson W., 1993).
Образование агрегатов в ВКМ — процесс сложный. Вновь синтезированные молекулы аггрекана не сразу проявляют способность связываться с гиалуроновой кислотой (Sandy J.D., Plass A.H.K., 1989). Это может служить регуляторным механизмом, позволяющим вновь синтезированным молекулам достичь межтерриториальной зоны матрикса перед тем, как быть иммобилизированными в крупные агрегаты (Mok S.S. et al., 1994). Количество вновь синтезированных молекул аггрекана и связующих белков, способных образовывать агрегаты путем взаимодействия с гиалуроновой кислотой, значительно уменьшается с возрастом (Bayliss M.T., 1992). Кроме того, с возрастом значительно уменьшаются размеры агрегатов, выделенные из суставного хряща человека. Это отчасти связано с уменьшением средней длины молекул гиалуроновой кислоты и молекул аггрекана.
Установлено два вида агрегатов в суставном хряще (Manicourt D.H. et al., 1988). Средний размер агрегатов первого вида — 60 S, агрегатов второго вида (быстро осаждающихся «суперагрегатов») — 120 S. Последний отличается обилием молекул связующего белка (Manicourt D.H. et al., 1988; Pita J.C. et al., 1992). Наличие этих суперагрегатов, возможно, играет большую роль в функционировании ткани; во время восстановления ткани после иммобилизации конечности в средних слоях суставного хряща обнаруживают более высокие их концентрации, в суставе, пораженном ОА, на ранних стадиях заболевания их размеры значительно уменьшаются (Pita J.C. et al., 1992).
Кроме аггрекана, суставной хрящ содержит ряд более мелких протеогликанов. Бигликан и декорин, молекулы, несущие дерматан сульфаты, имеют молекулярную массу около 100 и 70 кД соответственно; масса их стержневого белка — около 30 кД (Fisher L.W. et al., 1989).
В суставном хряще человека молекула бигликана содержит две цепи дерматан сульфата, тогда как более часто встречающийся декорин — только одну. Эти молекулы составляют лишь небольшую часть протеогликанов в суставном хряще, хотя их может быть также много, как и крупных агрегированных протеогликанов. Мелкие протеогликаны взаимодействуют с другими макромолекулами в ВКМ, включая коллагеновые фибриллы, фибронектин, факторы роста и др. (Kuettner K.E., Thonar E.J.M.A., 1998). Декорин первоначально локализуется на поверхности коллагеновых фибрилл и угнетает коллагеновый фибриллогенез (Vogel K.G. et al., 1984; Scott J.E., 1990). Стержневой протеин прочно сохраняется с клеточно-связывающим доменом фибронектина, тем самым, вероятно, препятствуя связыванию последнего с рецепторами клеточной поверхности (интегринами). В связи с тем что и декорин, и бигликан связываются с фибронектином и сдерживают адгезию и миграцию клеток, а также образование тромбов, они способны угнетать процессы тканевой репарации (Rosenberg L., 1992).
Фибромодулин суставного хряща — это протеогликан с молекулярной массой 50–65 кД, ассоциированный с коллагеновыми фибриллами (Olberg A. et al., 1989). Его стержневой протеин, гомологичный стержневым протеинам декорина и бигликана, содержит большое количество остатков сульфата тирозина. Эта гликозилированная форма фибромодулина (ранее ее называли матриксный протеин 59 кД) может участвовать в регуляции образования и поддержании структуры коллагеновых фибрилл (Plass A.H.K. et al., 1992). Фибромодулин и декорин располагаются на поверхности коллагеновых фибрилл. Таким образом, как указывалось раньше, увеличению фибриллы в диаметре должно предшествовать селективное удаление этих протеогликанов (а также молекул коллагена IХ типа) (Kuettner K.E., Thonar E.J.M.A., 1998).
Суставной хрящ содержит в ВКМ ряд белков, которые не относятся ни к протеогликанам, ни к коллагенам (рис. 9). Они взаимодействуют с другими макромолекулами с образованием сети, в которую включено большинство молекул ВКМ (Heingard D., Oldberg A., 1989; Heingard D. et al., 1995).
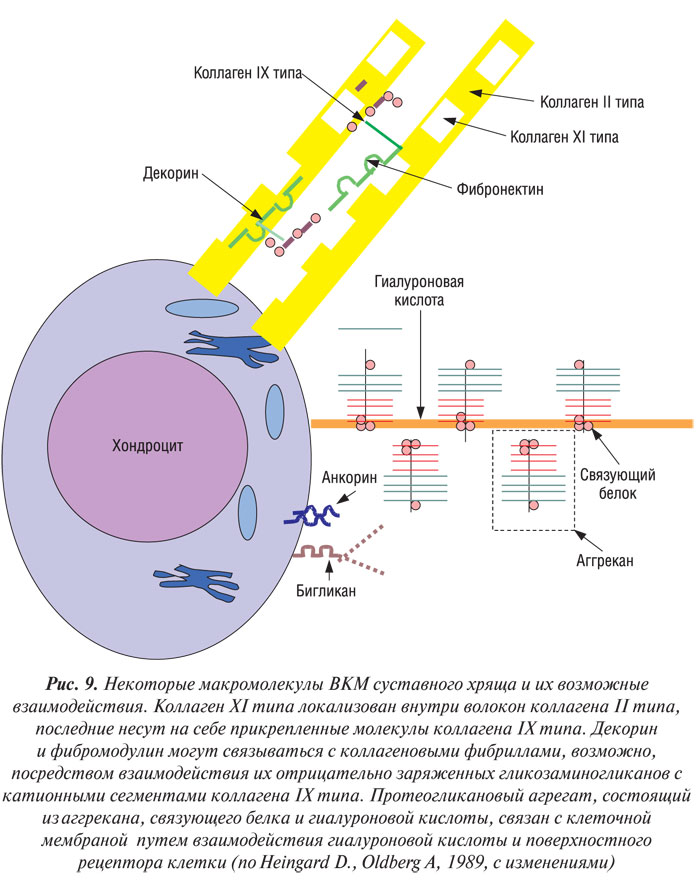
Анкорин, белок с массой 34 кД, локализуется на поверхности хондроцитов и в клеточной мембране, опосредует взаимодействие между клеткой и матриксом. В связи с его высокой аффинностью к коллагену II типа он может выступать в качестве механорецептора, передающего сигнал об измененном давлении на фибриллу хондроциту (von der Mark K. et al., 1986).
Фибронектин — компонент большинства хрящевых тканей, незначительно отличается от фибронектина плазмы крови (Kuettner K.E., Thonar E.J.M.A., 1998). Предполагают, что фибронектин способствует интеграции матрикса путем взаимодействия с клеточными мембранами и другими составными матрикса, такими, как коллаген II типа и тромбоспондин (Heingard D. et al., 1995). Фрагменты фибронектина негативно влияют на метаболизм хондроцитов — угнетают синтез аггрекана, стимулируют катаболические процессы. В суставной жидкости больных с ОА обнаружена высокая концентрация фрагментов фибронектина, таким образом, они могут участвовать в патогенезе заболевания на поздних стадиях (Homandberg G.A. et al., 1992). Вероятно, такими же эффектами обладают и фрагменты других матриксных молекул, которые связываются с рецепторами хондроцитов (Poole A.R., 1995).
Олигомерный матриксный протеин хряща (ОМПХ) — член суперсемейства тромбоспондинов, представляет собой пентамер с пятью идентичными субъединицами с молекулярной массой около 83 кД. Их обнаруживают в большом количестве в суставном хряще, особенно в слое пролиферирующих клеток в растущей ткани. Поэтому, возможно, ОМПХ принимает участие в регуляции роста клеток (Heingard D. et al., 1995). В значительно более низкой концентрации их обнаруживают в ВКМ зрелого суставного хряща (Heingard D. et al., 1995).
К матриксным протеинам также относят:
- основной матриксный протеин (36 кД), обладающий высокой аффинностью к хондроцитам, может опосредовать взаимодействие клеток в ВКМ, например во время ремоделирования ткани;
- GP-39 (39 кД) экспрессируется в поверхностном слое суставного хряща и в синовиальной мембране (его функции неизвестны) (Heingard D. et al., 1995);
- 21 кД-протеин синтезируется гипертрофированными хондроцитами, взаимодействует с коллагеном Х типа, может фунционировать в зоне «волнистой линии» (Heingard D. et al., 1995).
Кроме того, очевидно, что хондроциты экспрессируют негликозилированные формы малых неагрегированных протеогликанов на определенных стадиях развития хряща и в патологических условиях, однако их специфическая функция в настоящее время изучается.
Функциональные свойства суставного хряща
Молекулы аггрекана сообщают суставному хрящу способность претерпевать обратимую деформацию (Maroudas A. et al., 1992). Они демонстрируют специфические взаимодействия внутри внеклеточного пространства и, несомненно, играют важную роль в организации, структуре и функции ВКМ. В хрящевой ткани молекулы аггрекана достигают концентрации 100 мг/мл (Thonar E.J.M.A. et al., 1999). В хряще молекулы аггрекана сжаты до 20% объема, который они занимают в растворе. Трехмерная сеть, образованная фибриллами коллагена, сообщает ткани свойственную ей форму и предотвращает увеличение объема протеогликанов. Внутри коллагеновой сети неподвижные протеогликаны несут большой отрицательный электрический заряд (содержат большое количество анионных групп), который позволяет взаимодействовать с подвижными катионными группами интерстициальной жидкости (Kuettner K.E., Thonar E.J.M.A., 1998). Взаимодействуя с водой, протеогликаны обеспечивают так называемое давление набухания, которому противодействует коллагеновая сеть (Maroudas A., 1975).
Наличие воды в ВКМ является очень важным моментом. Вода определяет объем ткани; связанная с протеогликанами, она обеспечивает сопротивление сжатию. Кроме того, вода обеспечивает транспорт молекул и диффузию в ВКМ. Высокая плотность отрицательного заряда на крупных протеогликанах, фиксированных в ткани, создает «эффект исключенного объема» (Kuettner K.E., Thonar E.J.M.A., 1998). Размер пор внутри концентрированного раствора протеогликанов настолько мал, что диффузия крупных глобулярных белков в ткань резко ограничена (Urban J.P.G., 1990). ВКМ отталкивает мелкие отрицательно заряженные (например, ионы хлора) и крупные (такие, как альбумин и иммуноглобулины) белки. Размер ячеек внутри плотной сети из коллагеновых фибрилл и протеогликанов соизмерим лишь с размерами некоторых неорганических молекул (например, натрия и калия, но не кальция).
В ВКМ некоторое количество воды присутствует в коллагеновых фибриллах. Физико-химические и биомеханические свойства хряща определяет экстрафибриллярное пространство (Maroudas A. et al., 1992). Содержание воды во внутрифибриллярном пространстве зависит от концентрации протеогликанов в экстрафибриллярном пространстве и повышается при снижении концентрации последних.
Фиксированный отрицательный заряд на протеогликанах определяет ионный состав внеклеточной среды, содержащей свободные катионы в высокой концентрации и свободные анионы в низкой концентрации (Urban J.P.G., 1990). Так как концентрация молекул аггрекана повышается от поверхностной к глубокой зоне хряща, меняется ионная среда ткани. Концентрация неорганических ионов в ВКМ создает высокое осмотическое давление.
Свойства хряща как материала зависят от взаимодействия коллагеновых фибрилл, протеогликанов и жидкой фазы ткани. Структурные и композиционные изменения, связанные с несоответствием между процессами синтеза и катаболизма, деградацией макромолекул и физической травмой, значительно влияют на материальные свойства хряща и изменяют его функцию. Так как концентрация, распределение и макромолекулярная организация коллагенов и протеогликанов изменяются в зависимости от глубины зоны хряща, варьируют биомеханические свойства каждой зоны. Например, поверхностная зона с ее высокой концентрацией коллагена, тангенциально расположенными фибриллами, относительно низкой концентрацией протеогликанов обладает наиболее выраженными свойствами противодействовать растяжению, распределяя нагрузку равномерно по всей поверхности ткани (Kuettner K.E., Thonar E.J.M.A., 1998). В переходной и глубокой зонах высокая концентрация протеогликанов сообщает ткани свойство переносить компрессионную нагрузку. На уровне «волнистой линии» материальные свойства хряща резко изменяются от податливой некальцифицированной зоны к более жесткому минерализованному хрящу (Donohue J.M. et al., 1983). В области «волнистой линии» прочность ткани обеспечивается коллагеновой сетью. Подлежащие отделы хряща коллагеновые фибриллы не пересекают; в области костно-хрящевого соединения прочность ткани обеспечивается особыми контурами границы между зонами некальцифицированного и кальцифицированного хряща в виде нерегулярных пальцеобразных выростов, которая «замыкает» два слоя и препятствует их разделению. Кальцифицированный хрящ менее плотный, чем субхондральная кость, таким образом, он выполняет функцию промежуточного слоя, который смягчает компрессионную нагрузку на хрящ и передает ее субхондральной кости (Radin E.L. et al., 1984).
Во время нагрузки происходит сложное распределение трех сил — растяжения, сдвига и сжатия. Суставной матрикс деформируется за счет изгнания воды (а также продуктов метаболизма клеток) из зоны нагрузки, повышается концентрация ионов в интерстициальной жидкости (рис. 10) (Urban J.P.G., 1994). Движение воды прямо зависит от длительности и силы прилагаемой нагрузки и задерживается негативным зарядом протеогликанов (Torzilli P.A., 1988; Maroudas A., Grushko G., 1990). Во время деформации ткани протеогликаны более плотно прижимаются друг к другу, тем самым эффективно повышая плотность отрицательного заряда, а межмолекулярные отталкивающие отрицательный заряд силы в свою очередь повышают сопротивление ткани дальнейшей деформации. В конечном счете деформация достигает равновесия, в котором внешние силы нагрузки уравновешены внутренними силами сопротивления — давлением набухания (взаимодействие протеогликанов с ионами) и механическим стрессом (взаимодействие протеогликанов и коллагенов). Когда нагрузка устранена, хрящевая ткань приобретает свою исходную форму путем всасывания воды вместе с питательными веществами. Исходная (донагрузочная) форма ткани достигается тогда, когда давление набухания протеогликанов уравновешивается сопротивлением коллагеновой сети их распространению.
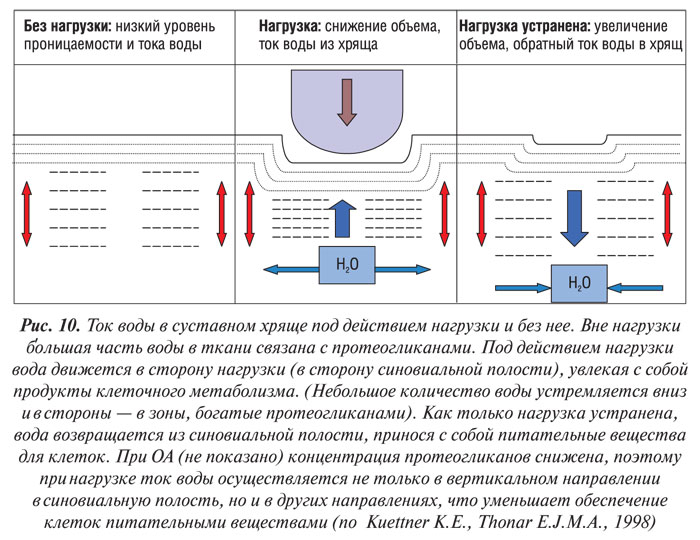
Биомеханические свойства суставного хряща основаны на структурной целости ткани — коллагеново-протеогликановой композиции как твердой фазы и воды и растворенных в ней ионах как жидкой фазы (Myers E.R. et al., 1984). Вне нагрузки гидростатическое давление суставного хряща составляет около 1–2 атм. Это гидростатическое давление может повышаться in vivo до 100–200 атм. в миллисекунду во время стояния и до 40–50 атм во время ходьбы. Исследования in vitro показали, что гидростатическое давление 50–150 атм (физиологическое) в течение короткого промежутка времени ведет к умеренному росту хрящевого анаболизма, в течение 2 ч — приводит к потере хрящом жидкости, но не вызывает каких-либо других изменений (Sah R.L. et al., 1992). Остается нерешенным вопрос, насколько быстро хондроциты реагируют in vivo на такого рода нагрузку.
Индуцированное уменьшение гидратации с последующим повышением концентрации протеогликанов приводит к притяжению положительно заряженных ионов, таких, как Н+ и Na+ (Urban J., Hall A., 1992). Это ведет к изменению общего ионного состава и рН ВКМ, и хондроцитов. Длительная нагрузка индуцирует снижение рН и одновременно снижение синтеза протеогликанов хондроцитами. Возможно, влияние внеклеточной ионной среды на синтетические процессы также частично связано с ее влиянием на состав ВКМ. Вновь синтезированные молекулы аггрекана в слабокислой среде позже, чем в нормальных условиях, созревают в агрегированные формы (Plaas A.H.K., Sandy J.D., 1986). Вероятно, снижение рН вокруг хондроцитов (например, во время нагрузки) позволяет большему количеству вновь синтезированных молекул аггрекана достичь межтерриториального матрикса (Mok S.S. et al., 1994).
Когда нагрузка устранена, вода возвращается из синовиальной полости, неся с собой питательные вещества для клеток. В хряще, пораженном ОА (на рис. 10 не показано), концентрация протеогликанов снижена, следовательно, во время нагрузки вода движется не только вертикально в синовиальную полость, но и в других направлениях, уменьшая тем самым питание хондроцитов (по Kuettner K.E., Thonar E.J.M.A., 1998).
Иммобилизация или небольшая нагрузка ведет к заметному снижению синтетических процессов в хрящевой ткани и содержанию протеогликанов, тогда как увеличение динамической нагрузки ведет к умеренному повышению синтеза и содержания протеогликанов (Palmoski M.J., Brandt K.D., 1981). Напряженные тренировки (20 км в день в течение 15 нед) у собак вызвали изменения содержания протеогликанов, в частности, резкое снижение их концентрации в поверхностной зоне (Helminen H.J. et al., 1992). Произошло некоторое обратимое размягчение хряща и ремоделирование субхондральной кости. Большая статическая нагрузка, однако, вызвала повреждение хряща и последующую дегенерацию. Кроме того, потеря аггрекана ВКМ инициирует аномальные изменения, характерные для ОА (Helminen H.J. et al., 1992). Потеря аггрекана приводит к притягиванию воды и набуханию оставшегося небольшого количества протеогликанов. Это растворение аггрекана способствует снижению плотности локального фиксированного заряда и в итоге приводит к изменению осмолярности.