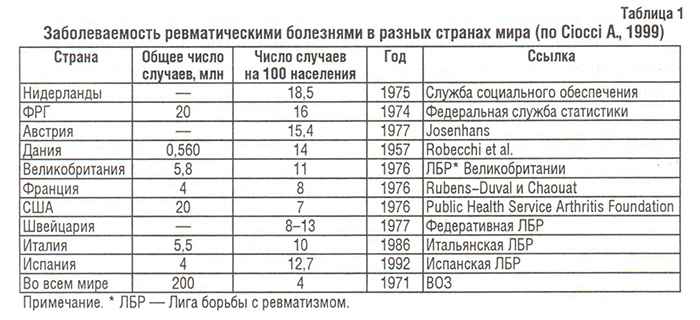
Распространенность и заболеваемость
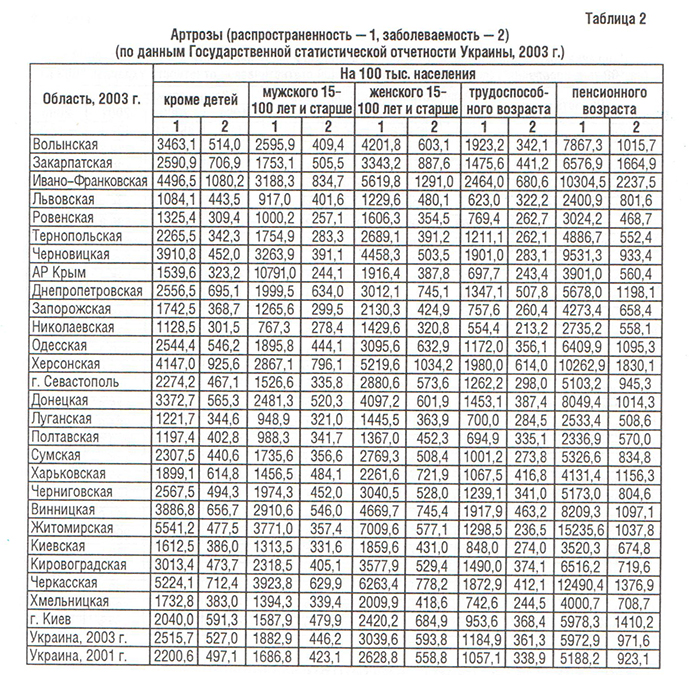
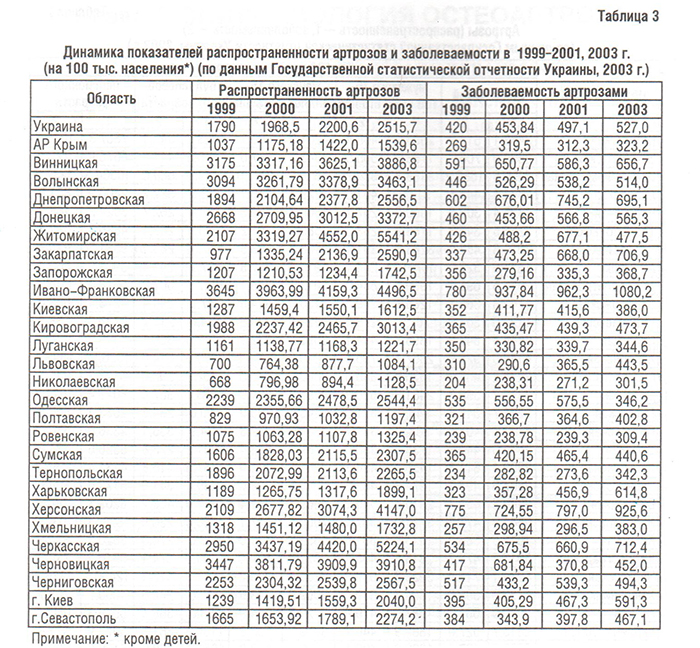
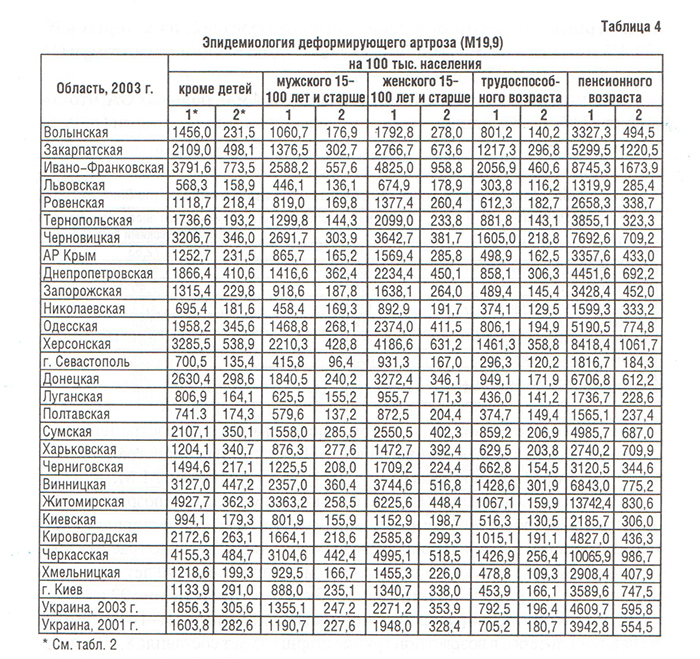
Болезни костно-мышечной системы, объединенные в XIII классе МКБ, рассматриваются во всем мире как одна из наиболее распространенных патологий современного общества (Насонова В.А. и соавт., 2000; табл. 1). Среди них ОА — наиболее распространенная патология синовиальных суставов. Распространенность ОА в популяции (6,43%) коррелирует с возрастом и достигает максимальных показателей (13,9%) у лиц старше 45 лет (Цветкова Е.С., 1997). Заболеваемость ОА в Украине составляет 497,1, распространенность — 2200,6 на 100 000 населения (табл. 2–4), что значительно ниже мировых показателей (в США — соответственно 700 и 6500) (Коваленко В.М. і співавт., 2002).
Перед изложением данных о распространенности ОА в мире необходимо заметить, что в различных эпидемиологических исследованиях, как правило, использовали два вида критериев диагностики болезни — рентгенологические по Kellgren и Lawrence (1957) и критерии АСR (Altman R. et al., 1986; 1990; 1991). В соответствии с последними диагноз ОА устанавливается только в тех случаях, когда присутствует главный признак — боль в суставах в течение большинства дней предыдущего месяца. Естественно, что распространенность ОА, оцениваемая с применением разных критериев, будет различной и, вероятно, этот показатель занижается при использовании критериев АCR по сравнению с традиционной рентгенологической оценкой (рис. 1) (Hart D.-J. et al., 1991; Spector Т.О., Hochberg M.C., 1994; Loesser R.F., 2000).
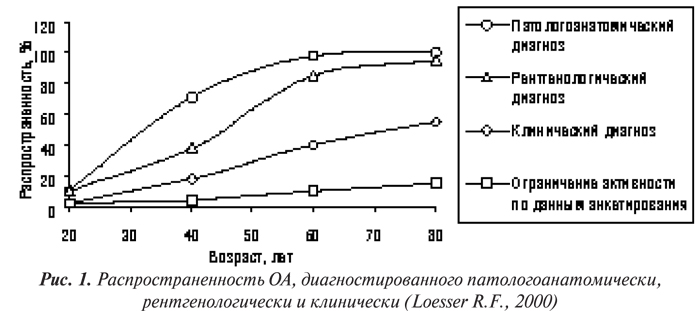
В США наиболее глубоко эпидемиология ОА была изучена в рамках двух национальных программ — National Health Examination Survey (NHES) и First National Health and Nutrition Examination Survey (NHANES-I), которые проводились с 1960 по 1962 г. и с 1971 по 1975 г. соответственно (National Center for Health Statistics, 1966; Maurer K., 1979). Позже данные этих двух исследований были суммированы National Arthritis Data Work Group в 1989 и 1998 гг. (Lawrence R.C. et al., 1989; 1998). Диагностика ОА базировалась на рентгенологических признаках ОА в суставах кистей и нижних конечностей (NHES) и в коленных и тазобедренных суставах (NHANES-I). В последнем исследовании при диагностике ОА также учитывали клиническую картину болезни.
По данным NHES и NHANES-I около трети лиц в возрасте от 25 до 74 лет имеют рентгенологические признаки ОА по меньшей мере одной локализации. В частности, у 33% обнаружен достоверный ОА суставов кистей, у 22% — ОА суставов стоп, у 4% — коленных суставов (Lawrence R.C. et al., 1989). Среди лиц в возрасте от 55 до 74 лет ОА суставов кистей диагностирован у 70%, суставов стоп — у 40%, гонартроз — у 10%, коксартроз — у 3% (Lawrence R.C. et al., 1998). Среди 6913 обследованных в рамках NHANES-I ОА диагностирован у 12% лиц в возрасте от 25 до 74 лет (Maurer K., 1979). Используя данные за 1990 г., National Arthritis Data Work Group сделала заключение, что более 20 млн взрослого населения США имеют клинические признаки ОА (Lawrence R.C. et al., 1998).
По данным Framinghem Osteoarthritis Study (исследование распространенности ОА среди американцев — представителей европеоидной расы в возрасте от 63 до 93 лет), одна треть лиц имеют достоверные рентгенологические признаки ОА коленного сустава (Felson D.T. et al., 1987). Аналогичные данные были получены при проведении Baltimore Longitudinal Study on Aging (Lethbridhe-Cejku M. et al., 1994).
Распространенность манифестного ОА коленных суставов изучалась в NHANES-I и Framinghem Osteoarthritis Study. ОА считали манифестным, если пациент жаловался на боль в коленных суставах в течение большинства дней по меньшей мере одного месяца. По данным NHANES-I распространенность манифестного гонартроза составила 1,6% среди лиц в возрасте 25–74 лет (Maurer K., 1979), по данным Framinghem Osteoarthritis Study — 9,5% среди лиц в возрасте 63–93 лет (Felson D.T. et al., 1987).
Проведенное в 1990 г. в Испании исследование-анкетирование распространенности ревматических болезней показало, что в сообщениях 12,7% респондентов (25,7% в возрасте старше 60 лет) имеются жалобы, характерные для некоторых ревматических болезней, из которых 43% (29,4% мужчин и 52,3% женщин) жаловались на наличие симптомов ОА (Martin P. et al., 1992).
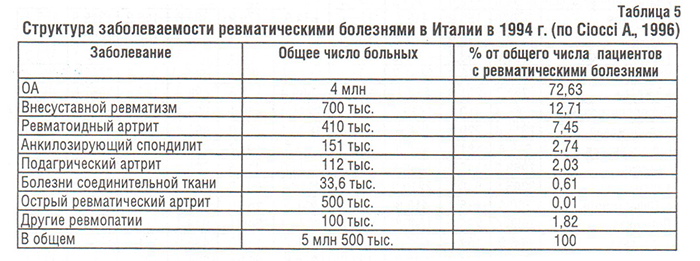
По данным 1994 г. в Италии насчитывалось 4 млн больных ОА, что составило 72% от всех пациентов с ревматическими заболеваниями (табл. 5) (Ciocci A., 1996).
По данным эпидемиологического исследования распространенности хронических болезней в горных районах Шотландии распространенность манифестного ОА составила 65 на 1000 населения (Steven M.M., 1992).
I. Petersson (1996) выявил ОА суставов кистей у 10% лиц в возрасте от 40–49 лет и у 92% (более 90% женщин, 80% мужчин) в возрасте старше 70 лет, проживающих в Европе. В популяциях Швеции и Нидерландов распространенность ОА суставов кистей в возрастной группе старше 70 лет составила соответственно 92 и 75%, у лиц старше 15 лет — соответственно 22 и 29%.
В Великобритании распространенность коксартроза III–IV стадии по Kellgren и Lawrence в возрастной группе старше 55 лет составила 8,4% у женщин и 3,1% у мужчин (Kellgren J.A., Lawrence J.S., 1958). В Нидерландах распространенность ОА у лиц старше 60 лет оценивается в 5,6% у женщин и 3,7% у мужчин (Jo/rring K., 1980). В проспективном исследовании 12 051 рентгенограммы в Швеции обнаружено, что распространенность коксартроза повышается от менее 1% в возрастной группе младше 55 лет до 10% у лиц старше 85 лет; средняя распространенность ОА среди лиц старше 55 лет составила 3,1% без различий по полу (Lindberg H., 1985). В Нидерландах распространенность коксартроза II–IV стадии по Kellgren и Lawrence составляет около 3% в возрастной группе 45–49 лет (Van Saase J.L.C.M., 1966).
Распространенность ОА коленных суставов широко варьирует, по данным различных исследователей. Так, по данным J.A. Kellgren и J.S. Lawrence (1958), в возрастной группе 55 лет — 64 года у женщин этот показатель составил 40,7%, у мужчин — 29,8%. T.D. Spector и соавторы (1991) обнаружили ОА коленных суставов у 2,9% женщин в возрасте 45–65 лет. В рамках голландского исследования гонартроз диагностирован у 7,7–14,3% лиц в возрасте 45–49 лет (Van Saase J.L.C.M., 1966).
В 12-летнем проспективном наблюдении 258 лиц из общей популяции в возрасте старше 45 лет установлено, что у около 25% женщин и 10% мужчин в течение этого периода появились рентгенологические признаки ОА коленных суставов (Badia Llach X., 1999). По данным E. Bagge и соавторов (1992), в возрастной группе 75–79 лет заболеваемость ОА мелких суставов кистей составила 13,6%, коленных суставов — 4,5% за пятилетний период. J.P. Masse и соавторы (1992) обнаружили, что средний возраст появления хронической боли у женщин с латеральным пателлофеморальным (надколенниково-бедренным), медиальным и латеральным тибиофеморальным (большеберцово-бедренным) ОА был 56,6±12, 62,7±12 и 69,2±10 лет соответственно. У мужчин боль в коленных суставах появилась несколько позже: в возрасте 60,5±10 лет при латеральном пателлофеморальном ОА и 64±10 лет при медиальном тибиофеморальном ОА.
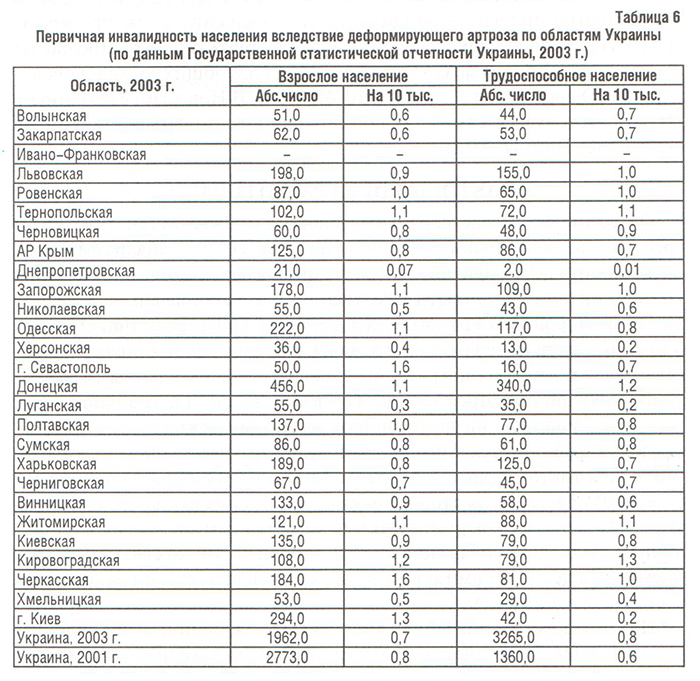
В США ОА занимает второе место после заболеваний сердечно-сосудистой системы как причина преждевременного выхода на пенсию (более 5% в год) (Hochberg M.C. et al., 1995). Структура первичной инвалидности населения Украины вследствие ОА представлена в табл. 6.
Экономические аспекты ОА
Патология костно-мышечной системы, в которой ОА занимает лидирующее место, ведет к значительным потерям в экономической, социальной и психологической сферах. Убытки, связанные с заболеваниями этой группы, возросли за последние годы и составляют 1–2,5% валового национального дохода таких развитых стран мира, как США, Канада, Великобритания, Франция, Австралия (March L.M., Bachmeier C.J., 1997). В 1980 г. в Соединенных Штатах Америки затраты, связанные с болезнями опорно-двигательного аппарата, составили 21 млрд долларов (1% валового национального продукта) (Gabriel S.E.,1995), в 1988 г. — 54,6 млрд долларов (Praemer A. et al., 1992), а в 1992 г. — 64,8 млрд долларов (Yelin E., Callahan L.F., 1995). В 1986 г. в Канаде эти потери оценивались в 8,3 млрд канадских долларов (Tugwell P., 1992); во Франции — 4 млрд французских франков прямых затрат (лекарства, посещение врачей, лабораторные анализы, рентгенологические исследования, реабилитационная терапия и др.) и около 600 млн франков непрямых затрат, связанных с убытками на производстве, где заняты больные ОА (Levy E. et al., 1993). В Великобритании на нестероидные противовоспалительные препараты (НПВП) расходуется около 219 млн фунтов стерлингов в год (бо′льшую их часть тратят больные ОА), что составляет 5% общих расходов на лекарства (Dieppe P.A. et al., 1993; Bird W., 1994). В Норвегии ежегодно на НПВП расходуется сумма, эквивалентная 8 млн фунтов стерлингов (Kvien T.K., Brors O., 1992).
Факторы риска развития ОА
ОА возникает вследствие взаимодействия множества генетических и средовых (включая травматические) факторов. Именно анализ факторов риска развития ОА различных локализаций способствовал возникновению концепции о гетерогенности заболевания. Так, установлены четкие различия факторов риска развития коксартроза и гонартроза: при ОА тазобедренных суставов нет различий по полу, его редко диагностируют у представителей монголоидной расы, часто сочетается с врожденными дефектами развития; гонартроз чаще встречается у женщин негроидной расы, чем у представительниц европеоидной расы, для них характерно предшествующее травматическое повреждение суставов. Появились данные о том, что группа факторов риска ОА пателлофеморального отдела коленных суставов отличается от факторов риска поражения медиального тибиофеморального отдела — первый тип связан с семейным анамнезом ОА и наличием узелкового поражения кистей, второй частично связан с ожирением и предшествующими хирургическими вмешательствами на коленном суставе (Алексеева Л.И., 2000).
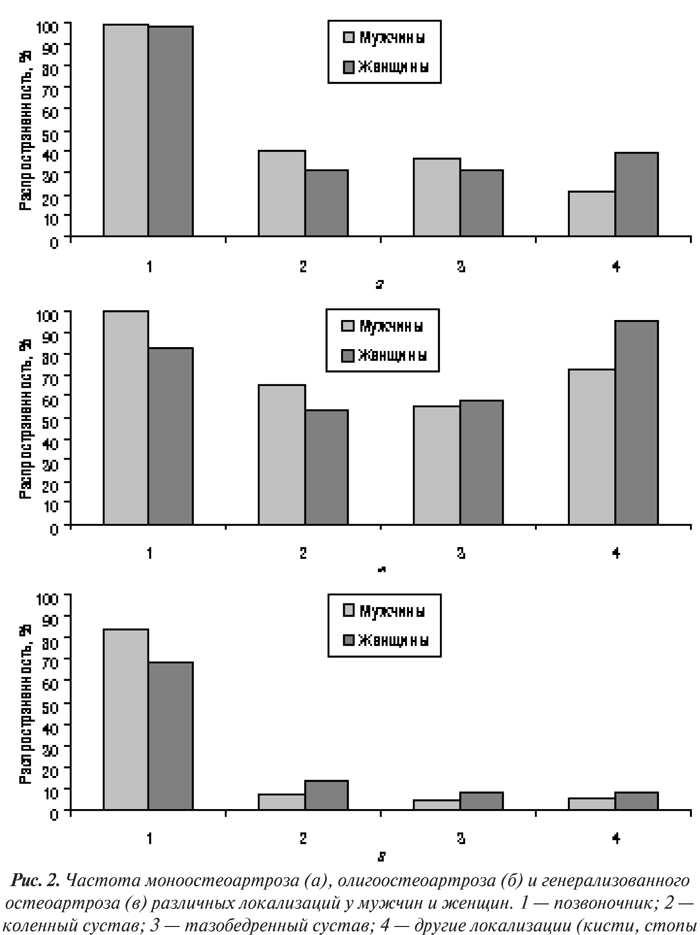
Пол имеет важное значение в развитии ОА — женщины чаще склонны к развитию ОА большинства локализаций. Результаты финского исследования с участием 6647 фермеров показало, что женский пол — независимый предрасполагающий фактор к развитию гонартроза (Manninen P. et al., 1996). Данные обзора 29 эпидемиологических исследований ОА коленного и тазобедренного суставов в 14 странах мира свидетельствуют о том, что ОА тазобедренных суставов чаще встречается у мужчин, чем у женщин; коленные суставы чаще поражены у женщин, особенно в возрасте старше 45 лет (Sun Y., 1997). Однако в большинстве других исследований отмечается высокая заболеваемость женщин коксартрозом (Bjelle A., 1982; Lindberg H., 1985; Spector T.D. et al., 1996). При ОА суставов кистей наблюдается быстрый подъем заболеваемости у женщин до 60 лет, далее частота ОА этой локализации существенно не меняется; у мужчин отмечается более медленное повышение заболеваемости, оно продолжается и в течение 7–8-го десятилетия жизни (Van Saase J.L.C.M. et al., 1989). Обнаружены различия в распространенности моноостеоартроза, олигоостеоартроза и генерализованного (поли-) ОА между мужчинами и женщинами (рис. 2).
Указанные особенности позволили предположить, что определенную роль при ОА играют эндокринные факторы. Действительно, результаты многих работ, особенно исследований на моделях ОА у животных, свидетельствуют о том, что половые гормоны способны модифицировать метаболизм в хрящевой ткани. Рецепторы эстрогенов найдены в суставном хряще многих видов животных (Young P.C.M., Stack M.T., 1982; Sheridan P.J. et al., 1985; Hart D-.J. et al., 1991). В исследовании J.A.P. Da Silva и соавторов (1994) отмечено, что овариэктомия увеличивает скорость деструктивных процессов в хряще животных. На моделях ОА у животных было продемонстрировано, что эстрадиол может угнетать синтез протеогликанов (Rosner L.A. et al., 1979). Сверхфизиологические дозы эстрадиола увеличивают «поломку» хряща, которую блокировали антиэстрогеном тамоксифеном (Rosner L.A. et al., 1982; Rosner L.A. et al., 1986). У кроликов после овариэктомии, получавших высокие дозы эстрогенов, развивались истончение и разволокнение суставного хряща, т.е. изменения, типичные для ОА у человека (Tsai C.L., Liu Т.К., 1993).
Существует также ряд эпидемиологических доказательств участия половых гормонов, в первую очередь эстрогенов, в развитии ОА. К ним относят более высокую частоту ОА у женщин, которая повышается к периоду менопаузы, связь распространенного ОА с такими факторами, как гинекологические операции, масса кости и ожирение, которые могут отражать воздействие эндогенных половых гормонов. По данным T.D. Spector и G.C. Champion (1989), женщины с гиперпродукцией эстрогенов предрасположены к генерализованному ОА.
Кроме того, возможная роль эстрогенов в патогенезе ОА предполагается на основании «антагонистических» взаимоотношений остеопороза с ОА и повышенного риска развития ОА при ожирении (Spector T.D., Champion G.C., 1989). Эстрогены регулируют костный метаболизм, их дефицит вызывает потерю костной тканью минерального компонента у женщин в пред- и постменопаузальный период; высокая минеральная плотность костной ткани (МПК) в постменопаузальный период может свидетельствовать о длительном сохранении избытка эстрогенов (Kritz-Silverstein D.K., Barret-Connor E., 1993). У женщин в постменопаузе с гонартрозом, коксартрозом, ОА суставов кистей и с полиостеоартрозом отмечается повышение МПК, что не вызвано ожирением (Hannan M.T. et al., 1993) или более медленной потерей костной ткани у женщин с ОА во время менопаузы (Burger H. et al., 1996). При высокой МПК суставной хрящ может выдерживать повышенную механическую нагрузку.
Ожирение также связывают с более высоким уровнем эндогенных эстрогенов в постменопаузальный период. Ожирение повышает риск развития ОА коленных, тазобедренных суставов и суставов кистей у женщин, но вопрос о том, чем это обусловлено (механическим воздействием избыточной массы тела на хрящ, более высоким уровнем эстрогенов или другими системными влияниями), пока не изучен (Felson D.T., 1996).
Некоторые доказательства связи женских половых гормонов с ОА были получены в работах, посвященных изучению факторов риска ОА у женщин, получающих заместительную гормональную терапию эстрогенами (ЗГТЭ). Было показано, что ЗГТЭ снижает риск развития гонартроза и коксартроза (Nevitt M.C. et al., 1994). У женщин, получавших ЗГТЭ в течение 8 лет, наблюдали замедление прогрессирования ОА (Zhang Y.O. et al., 1995). Поскольку ЗГТЭ снижает костный метаболизм, можно предположить, что эстрогены способствуют стабилизации ОА посредством замедления ремоделирования субхондральной кости.
Роль эстрогенов в развитии ОА, вероятнее всего, реализуется посредством влияния на провоспалительные и анаболические цитокины, которые, в свою очередь, оказывают действие на метаболизм хряща. Действие эстрогенов на кость, по-видимому, частично связано с интерлейкином-1 (ИЛ-1), ИЛ-6, фактором некроза опухолей α (ФНО-α) (Manologas S.C., Jilka R.L., 1995). Рецепторы эстрогенов обнаруживаются в суставном хряще и, вероятно, ИЛ-1 и ИЛ-6 способны опосредовать действие эстрогенов на его метаболизм. Инсулиноподобный фактор роста 1 (ИФР-1) и трансформирующий фактор роста β (ТФР-β) участвуют в синтезе и восстановлении матрикса хряща, а эстрогены, вероятно, оказывают комплексное действие на факторы роста (Romagnoli E. et al., 1994).
В общем, доказательства ассоциации ОА с факторами, связанными с воздействием половых гормонов у женщин, противоречивы. Возможно, эстрогены оказывают различное действие, которое зависит от времени наступления менопаузы и стадии ОА (Spector Т., Campion G.C., 1989; Oldenhave A. et al., 1996).
Важным среди генетических факторов риска ОА является унаследованная или приобретенная мутация гена проколлагена II типа (основного коллагена гиалинового хряща) COL2A1, расположенного на 12-й хромосоме. Наиболее ранние описания генетической связи между фенотипом раннего ОА и COL2A1 относятся к концу 80-х—началу 90-х годов прошлого столетия (Palotie A. et al., 1989; Knowlton R.G. et al., 1990). В одном из них сообщалось о мутации COL2A1 у родственников с ранним ОА, что проявлялось заменой аминокислоты аргинина на цистеин в положении 519 в молекуле коллагена II типа (Ala-Kokko L. et al., 1990). К настоящему времени еще у 4 семей описана подобная мутация (Bleasel J.F. et al., 1998). C.J. Williams и соавторы (1995) обнаружили другую мутацию COL2A1 в семье, у членов которой отмечалось раннее развитие ОА, — замену аргинина на цистеин в положении 75. Авторы отмечают, что фенотип ОА в этой семье отличен от такового в семьях, у членов которых обнаружена замена аргинина на цистеин в положении 519. J.F. Bleasel и соавторы (1995) выявили такую же мутацию COL2A1 в другой семье. Кроме вышеописанных в семьях, у членов которых диагностирован ранний ОА, встречаются и другие мутации COL2A1: замена глицина на серин в положении 976 (Williams C.J. et al., 1995), в положении 493 (Katzenstein P.L. et al., 1992).
Наследственная предрасположенность чаще выявляется при генерализованной форме ОА (ГОА). J.H. Kellgren и соавторы (1963) обнаружили узелки Бушара и Гебердена у 36% родственников мужчин и 49% родственников женщин с ГОА; в общей популяции эти показатели соответственно составили 17 и 26%. У больных с ГОА чаще находят HLA A1 В8 гаплотип (Lawrence J.S. et al., 1983; Pattrick M. et al., 1989) и MZ-форму α1-антитрипсина (Pattrick M. et al., 1989). T.D. Spector и соавторы (1996) при исследовании влияния наследственности на возникновение узелковой формы заболевания у близнецов также отмечают определенную роль генетических факторов в развитии этой формы ОА.
В больших семьях с ГОА путем анализа сцепления показано совместное наследование ОА и аллеля гена проколлагена II типа (COL2A1) (Knowlton R.G. et al., 1990). Этот аллель был клонирован и в нем обнаружена единственная мутация в позиции 519 в 1-й цепи коллагена, которая присутствовала у всех заболевших членов семей, но не выявлялась ни у одного здорового (Ala-Kokko L. et al., 1990). Первичный ГОА, по-видимому, является гетерогенным заболеванием и может быть ассоциирован с мутациями других генов. Недавно проведенные исследования полиморфных маркеров генов, кодирующих коллаген II типа, протеин матрикса хряща и связующий протеин, у 38 пар сибсов не подтвердили предположение об их отношении к локусам подверженности развитию ОА (Loughlin J. et al., 1994). Вероятно, лишь небольшую часть случаев заболевания можно объяснить этим генетическим отклонением.
Популяционные исследования свидетельствуют о роли расовой/этнической принадлежности в развитии ОА (табл. 7), однако нередко авторы приводят противоположные данные. Так, по данным J.J. Anderson и D.T. Felson (1988), у афроамериканок чаще, чем у женщин с белым цветом кожи, отмечается ОА коленных суставов; для коксартроза авторы не выявили расовых различий. В вышеназванном обзоре 29 эпидемиологических исследований, проведенных в 14 странах мира, указывается, что у представителей европеоидной расы чаще, чем у неевропеоидов, обнаруживают рентгенологические признаки коксартроза; однако распространенность гонартроза в обеих популяциях оказалась одинаковой (Sun Y. et al., 1997).
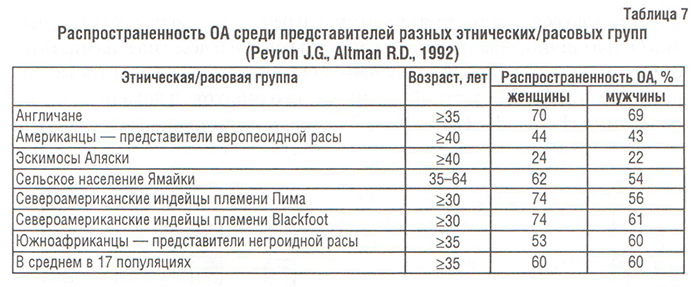 Несмотря на тот факт, что ОА заболевают преимущественно лица пожилого возраста и распространенность его в возрастной группе младше 45–50 лет чрезвычайно низка (рис. 3, 4; табл. 8), его нельзя назвать неизбежным следствием старения. Распространенность ОА суставов кистей, тазобедренных и коленных суставов резко увеличивается у мужчин и женщин в возрасте от 50 до 80 лет (Lethbridge-Cejku M. et al., 1994; Oliveria S.A. et al., 1995). Однако причины, по которым возраст является одним из значимых факторов риска возникновения ОА, не ясны. Возможно, что, с одной стороны, хондроциты человека в процессе старения теряют способность к пополнению или восстановлению матрикса суставного хряща, «утрачиваемого» в результате повреждения или нормального (для этого возраста) обмена, и в итоге развивается дефицит компонентов матрикса (как при остеопорозе). С другой стороны, матрикс хряща в пожилом возрасте может стать более чувствительным к нормальным кумулятивным микротравмам, и восстановительные механизмы клеток не в состоянии компенсировать эту возросшую чувствительность. В обоих случаях существует расхождение между влиянием внешней среды на суставной хрящ и способностями хондроцитов или матрикса реагировать на эти влияния. И хотя время от появления первоначальных изменений в суставах до возникновения симптомов и рентгенографических признаков ОА различно, обычно оно измеряется годами и десятилетиями. Вместе с тем, скорость прогрессирования ОА у отдельных больных варьирует даже в одной возрастной группе и при одинаковой локализации заболевания (Lomander L.S., 1991). Это предполагает участие в развитии ОА таких факторов, как генетическая предрасположенность, уровень физической активности, различия между суставами и т.п.
Несмотря на тот факт, что ОА заболевают преимущественно лица пожилого возраста и распространенность его в возрастной группе младше 45–50 лет чрезвычайно низка (рис. 3, 4; табл. 8), его нельзя назвать неизбежным следствием старения. Распространенность ОА суставов кистей, тазобедренных и коленных суставов резко увеличивается у мужчин и женщин в возрасте от 50 до 80 лет (Lethbridge-Cejku M. et al., 1994; Oliveria S.A. et al., 1995). Однако причины, по которым возраст является одним из значимых факторов риска возникновения ОА, не ясны. Возможно, что, с одной стороны, хондроциты человека в процессе старения теряют способность к пополнению или восстановлению матрикса суставного хряща, «утрачиваемого» в результате повреждения или нормального (для этого возраста) обмена, и в итоге развивается дефицит компонентов матрикса (как при остеопорозе). С другой стороны, матрикс хряща в пожилом возрасте может стать более чувствительным к нормальным кумулятивным микротравмам, и восстановительные механизмы клеток не в состоянии компенсировать эту возросшую чувствительность. В обоих случаях существует расхождение между влиянием внешней среды на суставной хрящ и способностями хондроцитов или матрикса реагировать на эти влияния. И хотя время от появления первоначальных изменений в суставах до возникновения симптомов и рентгенографических признаков ОА различно, обычно оно измеряется годами и десятилетиями. Вместе с тем, скорость прогрессирования ОА у отдельных больных варьирует даже в одной возрастной группе и при одинаковой локализации заболевания (Lomander L.S., 1991). Это предполагает участие в развитии ОА таких факторов, как генетическая предрасположенность, уровень физической активности, различия между суставами и т.п.

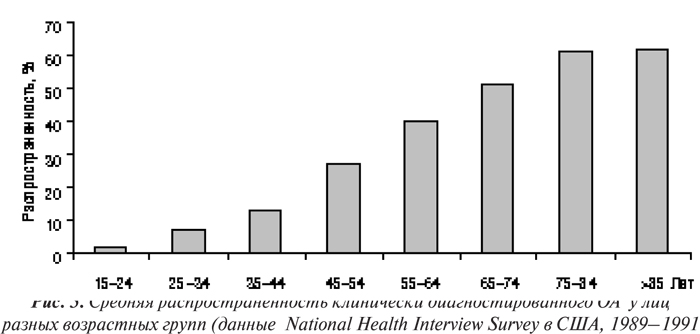
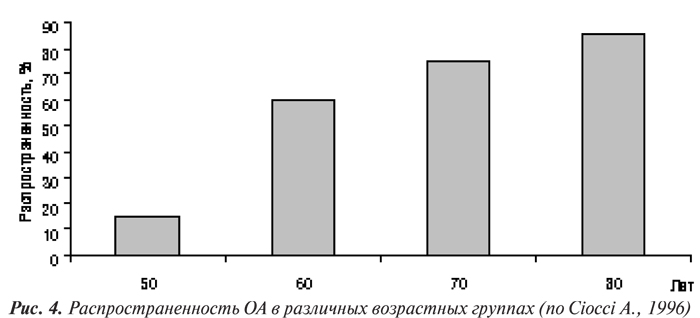
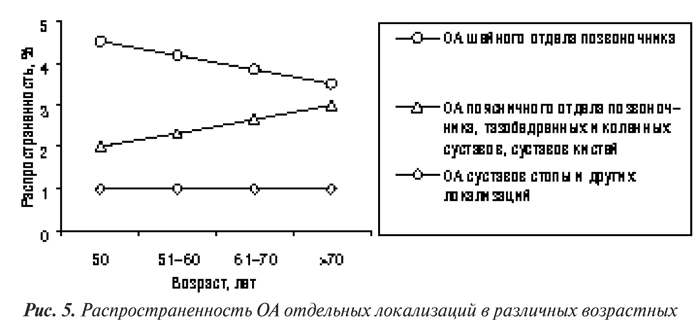
По данным L. Buratti и соавторов (1995), с возрастом повышается заболеваемость ОА тазобедренных, коленных суставов, суставов кистей, однако снижается заболеваемость ОА шейного отдела позвоночника (рис. 5). Кроме того, у лиц более старших возрастных групп наблюдается увеличение количества пораженных ОА суставов, что отражено в табл. 9 (Ciocci A., 1996).

Проведено относительно немного исследований, в которых изучали влияние старения на прогрессирование ОА, хотя значение пожилого возраста в развитии ОА является общепризнанным. В одном из них у большинства больных с ОА (60% обследованных коленных суставов) в течение 11 лет наблюдения не выявлено никаких рентгенологических изменений по Kellgren и Lawrence, у 33% — лишь незначительные изменения (Spector T.D. et al., 1992). Таким образом, прогрессирование ОА не всегда является неизбежным процессом и, вероятно, зависит от различной способности к восстановлению и деградации тканей сустава после их повреждения.
В популяционных исследованиях однозначно установлено, что у лиц с избыточной массой тела регистрируют более высокий риск развития гонартроза (Hartz A.J. et al., 1986; Anderson J.J., Felson D.T., 1988; Davis M.A. et al., 1988; 1989; 1990; 1998). Наибольший риск возникновения ОА у лиц с индексом массы тела (ИМТ) ≥ 25 (Centers for Disease Control,1996). В исследовании NHANES-1 показано, что у тучных женщин с ИМТ выше 30, но ниже 35 риск развития ОА был в 4 раза выше по сравнению с женщинами, у которых ИМТ достигал 25. У мужчин с такой же избыточной массой риск повышался в 4,8 раза по сравнению с мужчинами с нормальной массой тела. Обнаружена значительная прямая ассоциация между ИМТ и гонартрозом у лиц обоего пола: на каждые 5 единиц ИМТ относительное соотношение (95% доверительные интервалы) связи с ОА коленных суставов составило 2,1 (1,7; 2,58) для мужчин и 2,2 (1,95; 2,5) для женщин (Аnderson J.J., Felson D.T., 1988). Эти данные сходны с результатами других исследований. По данным Т. MacAlinden и соавторов (1996), избыточная масса тела ассоциировалась с ОА и тибиофеморального, и пателлофеморального отделов коленного сустава. Авторы предположили, что масса тела увеличивалась уже после развития ОА из-за ограничения двигательной активности. Однако имеются сведения, что при наличии избыточной массы тела у лиц в возрасте 37 лет, когда ОА наблюдается крайне редко, риск развития ОА коленных суставов к 70 годам возрастает (Felson D.T. et al., 1988). Результаты проспективного популяционного исследования и повторные рентгенологические наблюдения дали основание утверждать, что избыточная масса тела у лиц без ОА является потенциальным фактором риска ОА коленных суставов в дальнейшем (Felson D.T. et al., 1995).
При избыточной массе тела не только высок риск развития ОА коленных суставов, но и, как показали длительные наблюдения, также высок риск прогрессирования заболевания (Dougados M. et al., 1992), а у женщин — развития билатерального ОА (Spector T.D. et al., 1994).
M.A. Davis и соавторы (1989) исследовали связь между избыточной массой тела и уни/билатеральным ОА коленных суставов, диагностированным рентгенологически. В NHAINS-I принимали участие 3885 лиц в возрасте от 45 до 74 лет, из которых у 226 (4,9%) был билатеральный и у 75 (1,8%) унилатеральный гонартроз; ИМТ выше 30 отмечен у 65% больных с билатеральным гонартрозом, у 37,4% — с ОА правого коленного сустава, у 43,3% — с ОА левого коленного сустава и у 17,7% здоровых лиц. Относительное соотношение (95% доверительные интервалы) связи избыточной массы тела с билатеральным гонартрозом составило 6,58 (4,71; 9,18), тогда как с правосторонним и левосторонним ОА — соответственно 3,26 (1,55; 7,29) и 2,35 (0,96; 5,75).
Связь между избыточной массой тела и гонартрозом в отношении характера распределения подкожной жировой клетчатки (ПЖК) у лиц в возрасте 45—74 лет, которые принимали участие в NHAINS-I, изучали M.A. Davis и соавторы (1990). Центральный характер распределения ПЖК определяли путем измерения толщины кожной складки ниже угла лопатки, периферический — складки в области трехглавой мышцы плеча. Авторы не обнаружили связи между толщиной соответствующих кожных складок с наличием уни/билатерального ОА коленных суставов независимо от пола, возраста, расовой принадлежности, ИМТ. Однако связь величины ИМТ с билатеральным гонартрозом оказалась прочной у мужчин и женщин, с унилатеральным — только у мужчин.
M.C. Hochberg и соавторы (1995) исследовали связь между распределением ПЖК, процентным содержанием ПЖК у 465 мужчин и 275 женщин — представителей европеоидной расы, принимавших участие в Baltimore Longitudinal Study of Aging, а также у 169 мужчин и 99 женщин с рентгенологически диагностированным ОА. Распределение ПЖК определяли с помощью соотношения окружности запястья и бедра, тогда как для расчета процентного содержания ПЖК использовали стандартное уравнение, которое включало такие показатели, как толщина складок ниже угла лопатки, живота, а также в области трехглавой мышцы плеча. Как и предполагалось, ИМТ имел прочную связь с наличием гонартроза у лиц обоего пола. Однако авторы исследования не обнаружили ассоциации между рентгенологически диагностированным ОА коленных суставов и характером распределения ПЖК (центральный/периферический), а также процентным содержанием ПЖК.
В исследованиях K. Martin и соавторов (1997), Davis M.A. и соавторов (1988) показано, что при ожирении на возникновение ОА коленных суставов влияют механические, а не метаболические факторы.
При избыточной массе тела повышен риск развития ОА тазобедренных суставов (Hartz A.J. et al., 1986), хотя эта ассоциация не такая сильная, как при гонартрозе. Результаты подобных исследований противоречивы. Отмечено, что такие лица предрасположены к двустороннему, а не к одностороннему ОА тазобедренных суставов (Van Saase J.L.C.M. et al., 1988; Heliovaara M. et al., 1993).
По данным проспективного (в течение 23 лет) наблюдения при избыточной массе тела отмечается и более высокий риск развития ОА суставов кистей (Carman W.J. et al., 1994). В исследованиях, проведенных в Лондоне с участием близнецов, также выявлена ассоциация избыточной массы тела с ОА запястно-пястного сустава I пальца кисти (Cicuttini P.M. et al., 1996).
Взаимосвязь избыточной массы тела и ОА можно объяснить увеличением нагрузки на суставы, которое вызывает механическую «поломку» хряща, приводящую затем к развитию ОА. Однако такое объяснение применимо лишь для ОА коленных и тазобедренных суставов, но не для ОА суставов кистей. Возможно также, что у лиц с ожирением существует пока неизвестный фактор, ускоряющий «поломку» хряща и способствующий развитию заболевания. Кроме того, у тучных людей обнаруживается более высокая МПК, которая также считается фактором риска ОА (Hannan M.T. et al., 1993).
Во Фремингемском исследовании осмотр пациентов осуществляли один раз в 2 года в течение 40 лет, при этом установлено, что увеличение массы тела является фактором риска манифестного ОА коленных суставов у женщин, а снижение массы на 5 кг у женщин с ИМТ, равным 25 (т.е. выше среднего), снижало риск развития ОА на 50% (Felson D.T. et al., 1992). Для женщин с ИМТ ниже средней величины ни увеличение, ни уменьшение массы значимо на риск развития заболевания не влияли. Следовательно, ожирение — важный фактор риска ОА коленных, тазобедренных суставов и суставов кистей, у таких пациентов существует также высокий риск прогрессирующего течения заболевания. Уменьшение массы тела может предотвратить заболевание, особенно ОА коленных суставов.
По мнению K.D. Brandt и соавторов (1986), около 80% всех случаев идиопатического ОА тазобедренных суставов связаны с нераспознанными дефектами развития, такими, как дисплазии и подвывихи. В то же время частота этих аномалий развития не дает четкого объяснения высокой распространенности ОА тазобедренных суставов в Европе и США.
Имеются убедительные доказательства связи профессиональных факторов с развитием ОА, избыточная нагрузка на определенные суставы ассоциируется с повышенным риском развития ОА этих суставов. Риску подвержены шахтеры (ОА коленных суставов и поясничного отдела позвоночника), докеры и рабочие верфи (ОА коленных суставов и суставов кистей), сборщики хлопка и работники мельничного производства (ОА отдельных суставов кистей), операторы пневматических инструментов (ОА локтевого и лучезапястного суставов), маляры и бетонщики (ОА коленных суставов), фермеры (ОА тазобедренных суставов (Scott J.C. et al., 1999).
Профессиональный спорт (футбол, легкая атлетика и др.) связан с высоким риском развития ОА (Lane N.E., Buckwalter J.A., 1993; Panush R.S., Lane N.E., 1994). У лиц, занимающихся физической культурой непрофессионально, риск возникновения ОА коленных и тазобедренных суставов не отличается от общего в популяции (Lane N.E. et al., 1986; 1990; 1993).
Очень важным фактором риска возникновения ОА является травма/повреждение сустава. Травмирование коленного сустава (особенно передней крестовидной связки) связано с высоким риском развития ОА коленного сустава у профессиональных футболистов (Scott J.C. et al., 1999).
M.A. Davis и соавторы (1989) в описанном выше NHAINS-I исследовали связь между травмой коленного сустава и уни/билатеральным рентгенологически подтвержденным гонартрозом. У 5,8% обследованных лиц с билатеральным гонартрозом, у 15,8% из 37 лиц с правосторонним гонартрозом и у 1,5% лиц контрольной группы в анамнезе имелись указания на травму правого коленного сустава, в то время как сведения о травме левого коленного сустава в анамнезе были у 4,6% лиц с билатеральным поражением, у 27% — с левосторонним гонартрозом и у 1,8% — в контрольной группе. Статистический анализ полученных данных показал, что относительное соотношение (95% доверительные интервалы) ассоциации травмы коленного сустава и билатерального гонартроза составило 3,51 (1,8; 6,83), правостороннего гонартроза — 16,3 (6,5; 40,9) и левостороннего гонартроза — 10,9 (3,72–31,93).
S. Tepper и M.C. Hochberg (1993) изучали связь между травмой тазобедренного сустава и рентгенографически подтвержденным коксартрозом у 2359 лиц в возрасте от 55 до 74 лет, которые принимали участие в NHAINS-I; из них только у 73 (3,1%) диагностирован ОА одного или обоих тазобедренных суставов. Статистический анализ выявил значительную ассоциацию между травмой тазобедренного сустава в анамнезе и коксартрозом (относительное соотношение (95% доверительные интервалы) — 7,84 (2,11; 29,1). Анализируя связь между травмой тазобедренного сустава и уни/билатеральным повреждением, авторы определили более выраженную ассоциацию с унилатеральным (относительное соотношение (95% доверительные интервалы) — 24,2 (3,84; 153)), чем с билатеральным коксартрозом (относительное соотношение (95% доверительные интервалы) — 4,17 (0,5; 34,7). Таким образом, травма тазобедренного и коленного суставов — важный фактор риска развития коксартроза и гонартроза, особенно унилатерального.
Кроме приведенных выше, K.D. Brandt (2000) выделяет слабость периартикулярных мышц как фактор риска развития гонартроза.
У больных ОА коленных суставов часто обнаруживают слабость четырехглавой мышцы бедра, что обычно связывают с атрофией вследствие ограничения движения в пораженной конечности. Однако слабость этой мышцы также обнаруживают у пациентов с неманифестным гонартрозом, у которых отсутствовала боль в суставе и в момент осмотра, и в анамнезе, мышечная масса не только не уменьшалась, а даже иногда была увеличена (Slemenda C. et al., 1997). Проспективные исследования свидетельствуют о том, что слабость четырехглавой мышцы бедра является не только следствием манифестного гонартроза, но также может быть фактором риска ОА (Slemenda C. et al., 1998; Brandt K.D. et al., 1999). Среди женщин без рентгенологических признаков гонартроза в начале наблюдения и с рентгенологически диагностированным ОА через 30 мес исходная сила разгибателя колена была значительно меньше (р<0,04), чем у тех женщин, у которых не развился ОА (Slemenda C. et al., 1997; Slemenda C. et al., 1998).
C. Slemenda и соавторы (1997) определили, что повышение силы разгибателя колена на каждые 10 фунтов/фут2 ассоциировано со снижением вероятности развития ОА коленного сустава на 20%, манифестного ОА — на 29%. Относительно небольшое увеличение силы разгибателя колена (приблизительно на 20% от среднего для мужчин и на 25% от среднего для женщин) ассоциировано со снижением риска развития гонартроза на 20 и 30% соответственно.
Роль четырехглавой мышцы бедра в защите коленного сустава от повреждения связана со стабилизирующей сустав функцией, а также с тем, что она обеспечивает сопротивление гравитации всей нижней конечности.