Внутрипротоковый рак (протоковый рак in situ)
По сути это внутрипротоковая карцинома, которая рассматривается как предвестник инвазивной карциномы. Это не значит, что каждый инвазивный РМЖ проходит стадию рака in situ, однако риск развития инвазивных форм на фоне рака in situ высокий. Проведение оперативной и/или лучевой терапии позволяет вылечить пациентов. Это та форма рака, которую желательно активно выявлять при маммографических исследованиях. Улучшение качества скрининга во многих европейских странах привело к тому, что ежегодный прирост рака in situ с 1973 по 1983 г. составлял 3,9% , а с 1983 по 1992 г. — 17,5%. Показатель этого заболевания в 1973 г. составил 2,4 на 100 тыс. женского населения, а в 1992 г. — 15,8 [1]. Рак in situ часто представлен в виде отдельных очагов поражения, разделенных прослойками ткани молочной железы. В зависимости от ядерной атипии, полиморфизма клеток, количества атипических митозов, наличия очагов некроза в протоках, кальцинатов и их количества рак in situ разделяют на три степени дифференцировки. Поэтому в патологоанатомическом заключении должна быть характеристика опухоли по нижеприведенным параметрам.
Патологоанатомическое описание внутрипротоковой карциномы:
- тканевая архитектоника (количество и размеры микроочагов карциномы и фон, на котором она развилась);
- выраженность атипии ядер;
- наличие некрозов;
- узловое или диффузное поражение (размеры и количество узлов);
- расстояние очагов карциномы от края резекции;
- наличие микрокальцинатов (их расположение непосредственно в очаге карциномы или за пределами).
Внутрипротоковый рак высокой степени дифференцировки или низкой степени злокачественности (low grade ductal carcinoma in situ G-1)
Рак in situ G-1 состоит из мелких мономорфных клеток, растущих в виде папиллярных, криброзных, солидных структур внутри протоков молочной железы. Ядра полиморфны, некоторые гиперхромные с четкими нуклеолами, фигуры митоза редки. Пролифераты могут отмечать в одном или нескольких протоках. Между ними прослойки ткани молочной железы или чаще протоковой неоплазии разной степени дифференцировки. Очаги поражения, как правило, небольшие, максимум до 2 мм в диаметре. Микрокальцинаты, наличие десквамированных клеток внутри протоков, некрозы и структуры типа «комедо» для этой стадии дифференцировки нехарактерны. Наиболее часто отмечают микропапиллярные и криброзные структуры (фото 25).
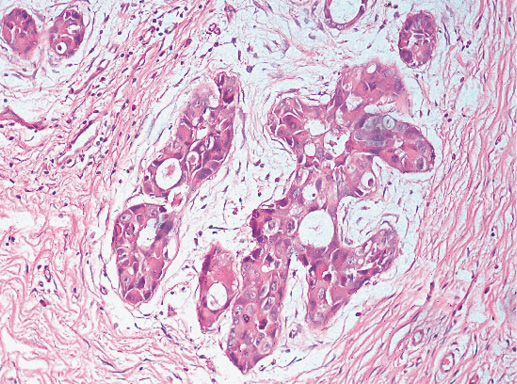
Фото 25. Рак in situ G-1. Опухолевые клетки формируют криброзные внутрипротоковые структуры. Гематоксилин-эозин, х 200
Внутрипротоковый рак умеренной степени дифференцировки (intermediate grade ductal carcinoma in situ G-2)
Рак in situ G-2 состоит из мелких полиморфных клеток, растущих внутри протоков молочной железы в виде папиллярных, криброзных, солидных структур. В отличие от предыдущего варианта, для рака in situ G-2 более характерны солидные структуры, структуры типа «комедо», как при угревидном раке (фото 26). Ядра полиморфны, гиперхромные с грубодисперсным хроматином, чаще отмечают фигуры митоза. Возможны очаги некроза, микрокальцинаты, однако эти признаки не обязательны. Очаги карциномы небольшие, как и при раке in situ G-1.
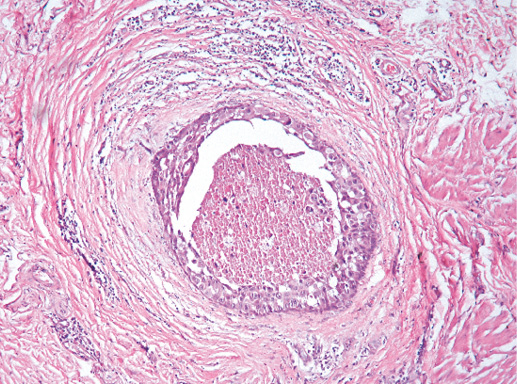
Фото 26. Рак in situ G-2. В участке рака отмечают десквамацию эпителия, формирование структуры типа «комедо». В ткани, окружающей внутрипротоковый рак, изменения, характерные для дольково-протоковой гиперплазии молочной железы. Гематоксилин-эозин, х 200
Внутрипротоковый рак низкой степени дифференцировки (high grade ductal carcinoma in situ G-3)
Рак in situ G-3, в отличие от предыдущих вариантов дифференцировки, имеет более крупные очаги поражения, часто до 5 мм, но помимо крупных очагов возможны единичные мелкие, иногда менее 1 мм. Структура компоновки клеток в протоке такая же, то есть наличие папиллярных, криброзных и солидных форм роста с преобладанием солидных структур.
В раке in situ G-3 клетки более полиморфны, отмечают много полигональных клеток разного размера. Преобладают клетки большого размера, особенно в очагах пролиферации. Ядра гиперхромные, атипичные, много фигур митоза. Часто отмечают некрозы и микрокальцинаты, которые могут быть расположены фокально или диффузно в просвете протоков. Цитологическая характеристика опухолевых клеток рака in situ G-3 близка к характеристике клеток инвазивной карциномы (фото 27–28а).
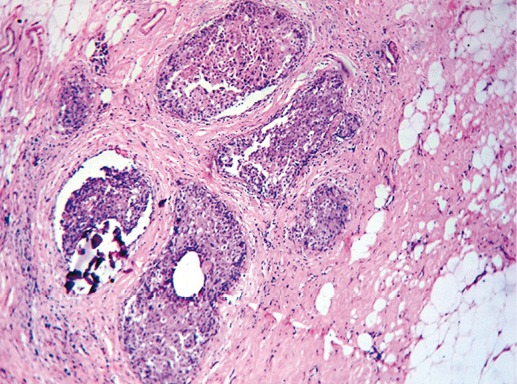
Фото 27. Рак in situ G-3. В поле зрения несколько протоков с раком in situ, в одном из них — микрокальцинаты, в верхнем протоке на фото — очаг некроза. Гематоксилин-эозин, х 100
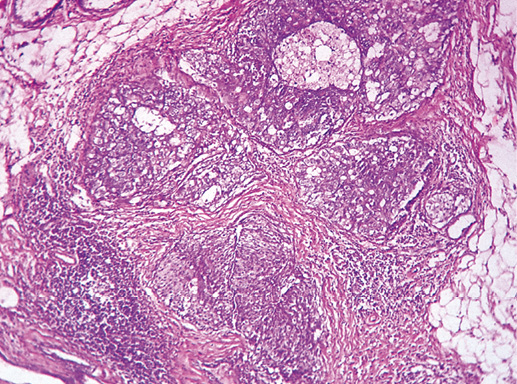
Фото 28. Рак in situ G-3. Опухолевые клетки крупные, заполняют просвет протоков полностью, формируя солидные структуры. Гематоксилин-эозин, х 200
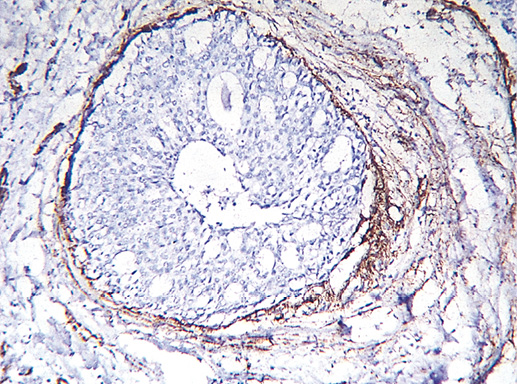
Фото 28а. Протоковый рак in situ. Миоэпителиальный слой сохранен в виде непрерывного слоя (коричневая линия на фото). Экспрессия гладкомышечного актина (клон HHF35, производство DAKO). Иммуногистохимическое окрашивание, система визуализации EnVision, хромоген DAB. Миоэпителиальные клетки в виде непрерывной линии вдоль базальной мембраны, часть этих клеток вошли в сосочковую структуру внутри протока, х 200
Основным для верификации рака in situ любой степени дифференцировки является достоверное определение отсутствия микроинвазии опухоли в строму. Для этого необходимо исследовать большое количество срезов и использовать иммуногистохимический метод для окраски базальной мембраны и миоэпителиальных клеток.
Необходимо обратить внимание на изменение структуры стромы, которая реагирует на инвазию опухоли и лимфоплазмоцитарную инфильтрацию вокруг очагов инвазии опухоли.
Следует отметить, что морфологический код в Международном классификаторе онкологических заболеваний для рака in situ всех степеней дифференцировки одинаков — 8500/2.
Особыми вариантами рака in situ являются веретеноклеточный, апокриновый, перстневидный, нейроэндокринный, плоскоклеточный и светлоклеточный. Эти варианты отражены в классификации ВОЗ (2003), однако выявляются очень редко.
Пролиферативную активность в настоящее время часто исследуют с помощью антитела Ki 67. В раке in situ G-3 со структурами «комедо» индекс пролиферации составляет 13%, в раке in situ G-1 в среднем 4,5%, а в микропапиллярном раке высокой степени дифференцировки часто может быть нулевым.
Для дифференциальной диагностики протоковой и дольковой неоплазии применяют иммуногистохимическое исследование. E—cadherin всегда экспрессируется в протоковых неоплазиях, а cytokeratin1/5/10/14 (clon CK34BetaE12) в большинстве случаев дает негативную реакцию (92%). В лобулярной неоплазии все наоборот. Нет экспрессии E—cadherin, а cytokeratin1/5/10/14 (clon CK34BetaE12) выявляют почти всегда.
Внутрикистозный папиллярный рак
Выявляют чаще у женщин пожилого возраста (в среднем 65 лет), составляет 2% всех случаев РМЖ. Размеры опухоли могут быть большие — от 0,4 до 10 см, в среднем — 2 см. Прежде всего опухоль представлена кистой и папиллярным раком в виде небольшого участка в кисте или замещающим почти всю полость кисты. Морфологическое строение характерно для внутрипапиллярного рака, то есть представлено фиброваскулярными лучиками, лишенными миоэпителиальной выстилки и покрытыми неоплазированным эпителием, соответствующим дифференцировке G-1. Атипичный эпителий формирует солидные, криброзные, папиллярные структуры. Миоэпителиальная выстилка сохранена только в стенке кисты неопухолевого строения. Возможна продукция муцина (фото 29). Бывают участки метаплазии, участки клеток нейроэндокринной дифференцировки [1].
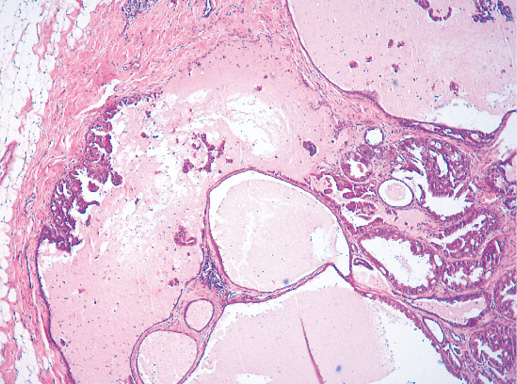
Фото 29. Участок внутрикистозного папиллярного рака с выраженными признаками секреции. Гематоксилин-эозин, х 100
Характерной особенностью является отсутствие инвазии опухоли в окружающую строму (фото 30).
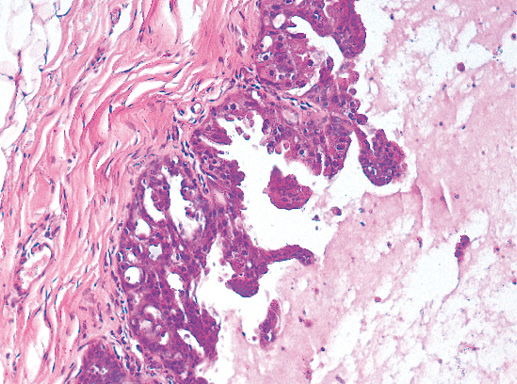
Фото 30. Участок стенки кисты внутрикистозного папиллярного рака. Эпителиальная выстилка кисты малигнизирована и представлена микрососочковыми структурами. Нет признаков опухолевой инвазии
в фиброзную капсулу кисты. Гематоксилин-эозин, х 100
Морфологический код в Международном классификаторе онкологических заболеваний папиллярного рака внутри кисты — 8504/2.