S. Brem и соавторы были первыми, предположившими, что количество микрососудов в опухоли может коррелировать с гистологическим вариантом рака и его агрессивностью [59]. А. Srivastova и соавторы получили подтверждение этому, изучая количество кровеносных сосудов в 20 случаях меланомы кожи [74, 75]. Тканевые срезы опухоли окрашивали специальными красителями, выявляющими сосуды, и визуально изучали их с помощью микроскопа. Затем считали плотность сосудов в опухоли. В 10 случаях меланомы с развитием метастазов в дальнейшем плотность сосудов в два раза выше по сравнению с клинически благоприятно протекающими случаями.
В 90-х годах прошлого столетия проведен ряд исследований по изучению микрососудов РМЖ [60]. Доказано, что их высокий удельный вес отмечают в опухолях с агрессивным течением. Удельный вес (индекс) микрососудов в РМЖ — это количество микрососудов в поле зрения площадью 0,75 мм2.
Для выявления сосудов не существует идеального маркера. Чаще изучают эндотелиальные клетки сосудов, используя антитела к VIII фактору свертываемости крови (фактор Виллебранда), CD31 и CD34 (фото 94).
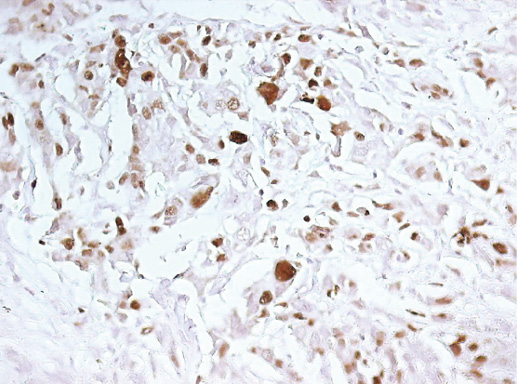
Фото 94. Экспрессия Ki67 Protein (клон IVAK-2, производство DAKO). Иммуногистохимическое окрашивание, система визуализации EnVision, хромоген DAB, х 400
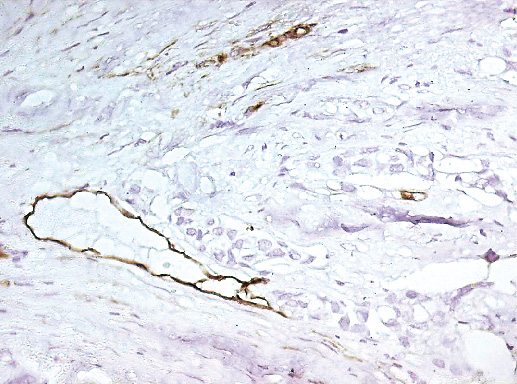
Фото 95. Экспрессия CD 34. В опухоли небольшое количество сосудов, нет инвазии стенки крупного сосуда, хотя клетки рака в непосредственной близости от него. Иммуногистохимическое окрашивание, CD 34 (клон QBEnd10, производство DAKO). система визуализации EnVision, хромоген DAB, х 400
Антитела к VIII фактору свертываемости крови (фактор Виллебранда) не выявляют все сосуды. Более чувствителен CD31, но это антитело окрашивает плазматические клетки, поэтому в опухолях с воспалительной инфильтрацией его нецелесообразно использовать. CD34 — более информативный для выявления кровяных и лимфатических сосудов, так как окрашивает эндотелиальные клетки всех сосудов. Этот маркер основной во многих патологоанатомических лабораториях. Его недостаток — выявление перевезикулярных стромальных элементов.
Учитывая гетерогенность опухоли, в начале исследования необходимо отобрать участки с наиболее выраженным ангиогенезом. Для этого нужно просмотреть большое количество тонких срезов множественных участков опухоли, окрашенных гематоксилин-эозином.
N. Weidner и соавторы изучали плотность сосудов с помощью иммуногистохимического метода окрашивания эндотелия, используя антитела к VIII фактору свертываемости крови (фактор Виллебранда) [60]. При этом участки склероза, некроза, ткани нормального строения в исследовании не учитывали, а для анализа отбирали участки опухоли, содержащие наибольшее количество сосудов. Эти участки могут быть в глубине, но чаще их определяли по краю опухоли. Любую группу или цепочку позитивно окрашенных клеток, не относящихся к опухоли и строме, рассматривали в качестве микрососуда. Результатом считали самый высокий показатель плотности микрососудов после просмотра 200 полей зрения при увеличении 20х10 окуляр, площадь поля зрения микроскопа — 0,74 мм2. Среднее арифметическое не вычисляли. В агрессивных типах РМЖ определялии индекс микрососудов 101 и выше, в опухолях с благоприятным клиническим течением — в среднем 45 (р=0,003). Таким образом в агрессивных типах РМЖ плотность микрососудов выше на 33%. У всех пациенток с РМЖ с индексом микрососудов 100 и более выявляли метастазы в течение 33 мес, в то время как в группе больных РМЖ с индексом микрососудов менее 33 только у 5%.
Риск метастазирования возрастает на 100% для пациентов с РМЖ с индексом микрососудов более 100.
Показатель плотности микрососудов является важным прогностическим фактором общей и безрецидивной выживаемости пациентов [60].
Некоторые исследователи считают, что в случаях рака с высокой внутриопухолевой плотностью сосудов более эффективна внутриартериальная полихимиотерапия [76] и лучевая терапия [77].
Во многих патологоанатомических лабораториях применяют подсчет плотности микрососудов в опухолях, однако данная методика, как и подсчет митозов, требует навыков и поэтому результаты различных лабораторий не всегда сопоставимы. М.К. Braweret и соавторы попытались автоматизировать процесс подсчета сосудов [78]. По его мнению автоматизированный подсчет дает более объективные данные, тесно коррелирующие с общей выживаемостью пациентов (р<0,001).
Однако некоторые исследователи не установили взаимосвязь между плотностью сосудов внутри опухоли и выживаемостью пациентов. Возможно, причина не в корректном подсчете, а в анатомических особенностях некоторых органов. Так, D.A. Leedy и соавторы отметили, что такой орган, как язык, изначально содержит большое количество сосудов, поэтому при исследовании рака языка многие ученые не получили прогностического значения индекса микрососудов [79]. С. Kainz и соавторы считают, что в раке цервикального канала, печени, почек, кожи, желудка плотность микрососудов не имеет прогностического значения [80].
Важный прогностический признак — также инвазия опухолевыми клетками стенки лимфатических и кровеносных сосудов. Однако выявить и объективно доказать наличие инвазии сосудистой стенки часто бывает очень сложно. Во-первых, в силу того, что не всегда можно выявитьь участок инвазии, даже используя современные методы визуализации базальной мембраны и эндотелиальных клеток. Необходимо изучать большое количество серийных срезов. Во-вторых, высокая вероятность возникновения артефактов, особенно в случаях рака с большим количеством некрозов и кровоизлияний. Поэтому более доступно изучение наличия инвазии стенки сосудов вокруг опухоли. Особенно это важно при опухолевом узле менее 1 см в диаметре, без метастазов, так как наличие инвазии указывает на более высокую вероятность прогрессирования заболевания и необходимость проведения адъювантной химиотерапии [81–83].