Известно, что частота артериальной гипертензии значительно повышается с возрастом. Каковы же современные критерии нормального и повышенного АД у взрослых? До недавнего времени согласно международным критериям от 1999 г., разработанным экспертами ВОЗ совместно с международным обществом по гипертензии, а также рекомендациям шестого доклада экспертов Объединенного национального комитета США по предупреждению, распознаванию, оценке и лечению при повышенном АД от 1997 г. (JNC VI), нормальным АД для лиц в возрасте 18 лет и старше, не получавших антигипертензивную терапию, считали уровень до 140/90 мм рт. ст., а АГ определяли как состояние, при котором уровень АД составляет >140/90 мм рт. ст.
Однако в 2003 г. был опубликован седьмой доклад Объединенного национального комитета США по предупреждению, распознаванию, оценке и лечению повышенного АД (JNCVII), который от предыдущего, шестого, отличается изменениями в классификации уровней АД. Давление, ранее расценивавшееся как «высокое нормальное», — 120–139 мм рт. ст. (систолическое АД — САД) или 80–89 мм рт. ст. (диастолическое АД — ДАД) — признано предгипертензией. II и III стадии АГ объединены в одну — вторую, к которой относится АД >160 мм рт. ст. для САД или 100 мм рт. ст. для ДАД. Первое изменение подчеркивает значимость и необходимость коррекции даже минимального отклонения АД от нормального уровня (>120/80 мм рт. ст.), второе указывает на то, что уровень САД>160 или ДАД>100 мм рт. ст. являются крайней, последней стадией его повышения (табл. 8.1).
Таблица 8.1
Градации уровней АД по рекомендациям JNC VII (2003)
| Клиническая трактовка | Уровень АД, мм рт. ст. | |
| САД | ДАД | |
| Нормотензия | <120 | <80 |
| Предгипертензия | 120–139 | 80–89 |
| АГ I стадии | 140–159 | 90–99 |
| АГ II стадии | >160 | >100 |
Практически одновременно с докладом JNC VII появились новые рекомендации Европейского общества кардиологов (2003), характерным отличием которых является сохранение понятия «высокого нормального» АД и трехстепенной градации тяжести АГ (табл. 8.2).
Таблица 8.2
Критерии тяжести АГ согласно Европейским рекомендациям (2003)
| Клиническая трактовка | Уровень АД, мм рт. ст. | |
| САД | ДАД | |
| Оптимальное | <120 | <80 |
| Нормальное | 120–129 | 80–84 |
| Высокое нормальное | 130–139 | 85–89 |
| АГ I степени (мягкая — легкая) | 140–159 | 90–99 |
| АГ II степени (умеренная — средней тяжести) | 160–179 | 100–109 |
| АГ III степени (тяжелая) | >180 | >110 |
| Изолированная систолическая АГ | >140 | <90 |
Артериальная гипертензия является наиболее распространенным заболеванием сердечно-сосудистой системы, которое выявляют по данным ВОЗ у 20–30% взрослого населения. Распространенность артериальной гипертензии в возрастной группе старше 18 лет составляет примерно 39,2% у мужчин и 41,1% у женщин, при этом доля эссенциальной гипертензии составляет 90–95% всех случаев АГ, а остальная часть — вторичная АГ, обусловленная заболеваниями почек, надпочечников, эндокринных желез, нервной или сердечно-сосудистой систем и другими факторами. Нельзя исключить, что соотношение эссенциальной и вторичной гипертензии со временем будет изменяться.
По разным данным, эссенциальную (первичную) артериальную гипертензию выявляют также у 1–3% всех детей. Установить наличие АГ у детей можно с помощью критериев, предложенных Второй рабочей группой по контролю АД у детей (Second Task Force in Blood Pressure Control in Children, 1987), табл. 8.3.
Таблица 8.3
Критерии АГ у детей в зависимости от возраста
| Возраст | САД | мм рт. ст. |
| Умеренная АГ | Выраженная АГ | |
| 7 дней | >96 | >106 |
| 8–30 дней | >104 | >110 |
| До 2 лет | >112 | >118 |
| 3 года–5 лет | >116 | >124 |
| 6–9 лет | >122 | >130 |
| 10–12 лет | >126 | >134 |
| 13–15 лет | >136 | >144 |
| 16–18 лет | >142 | >150 |
Среднее значение артериальной гипертензии у новорожденных мужского пола составляет 72/55 мм рт. ст. АГ принято считать показатели свыше 90/60 мм рт. ст. у доношенных и свыше 80/50 мм рт. ст. у недоношенных детей. Повышенное АД отмечают не более чем у 2,5% новорожденных, в том числе недоношенных. В возрасте 2 мес показатель АД повышается до 90/50 мм рт. ст. У девочек показатели чуть ниже. Причина повышения АД в первые 2 мес жизни неизвестна. За весь последующий грудничковый период повышения АД не отмечают.
По истечении грудничкового периода САД и ДАД повышается с возрастом и увеличением роста. Максимальные показатели АД в популяции отмечены в Северной Америке, несколько ниже — в Европе, еще ниже — в России. Однако один только возраст не позволяет определить, высок ли показатель АД у конкретного ребенка. Определяющими являются физическое развитие, рост и масса тела, характер питания, а не хронологический возраст.
При впервые выявленном повышении АД необходимо особенно тщательно соблюдать корректность измерений. Измерение АД по Рива — Роччи и Короткову обычно проводят с помощью ртутного или мембранного манометра. У новорожденных и детей грудного возраста АД надежнее и проще измерять приборами, работающими по осциллометрическому методу.
Показания ртутного манометра легче считывать и проверить, чем показания мембранного. Во время измерения ртутный столб должен быть в вертикальном положении, а мениск находиться на уровне глаз врача. Ртутные манометры позволяют точнее зафиксировать показатели АД, поскольку их шкала значительно длиннее мембранных. Мембранные манометры прочнее и более удобны в обращении, однако со временем они утрачивают точность измерения, в связи с чем их приходится периодически поверять и регулировать. В противном случае при измерении возможны серьезные ошибки.
Декомпрессия манжеты осуществляется, как правило, произвольно регулируемым клапаном (винтом). Скорость сброса давления определяется исследователем и должна составлять 2–5 мм рт. ст./с. При более быстрой декомпрессии страдает точность измерения.
Приборы, работающие на основе осциллометрического принципа, предназначены для прерывистого автоматического измерения АД. В процессе работы прибора вся манжета служит сенсором для пульсаций артерии. Потребность в каком-либо дополнительном микрофоне отсутствует, что существенно упрощает процедуру закрепления манжеты. Во время постепенного снижения давления в манжете осцилляционные импульсы на одном и том же уровне давления сопоставляются до тех пор, пока не будут измерены два соответствующих друг другу значения. За счет этого система не подвержена никаким случайным импульсам, служащим помехами. По сравнению с аускультационным измерением по тонам Короткова показатель ДАД оказывается на 9 мм рт. ст. выше. Показатели САД совпадают.
Источник значительных ошибок при определении уровня АД — неправильно подобранная манжета. Если манжета слишком узкая, при измерении получают завышенные показатели АД. Для детей грудного возраста используют манжету 5–6 см шириной, для детей более старшего возраста — 8–9 см. Правильно подобранная манжета должна перекрывать – 1/3 длины плеча.
О диагнозе артериальной гипертензии можно говорить, когда полученный показатель превышает 95 процентилей при 3 измерениях АД, проведенных в разные дни. Но это правило можно рассматривать всего лишь как рабочую гипотезу.
Измерение АД необходимо выполнить на обеих руках и на ноге, что позволит одной этой простой манипуляцией исключить коарктацию аорты.
Важно определить степень гипертензии и сделать первое заключение о возможных системных изменениях. Следует помнить, что чем младше пациент, тем менее вероятна эссенциальная и функциональная (психогенная) гипертензия, чем выше при этом цифры АД, тем вероятнее нефрогенная (прежде всего реноваскулярная) АГ. Необходимо проведение исследования сердца, сосудов, глазного дна, почек, выявление наиболее измененных органов-мишеней. Одновременно врач должен оценить наличие факторов риска, из которых особенно значимы ожирение, сахарный диабет, гиперлипидемия, курение. На основании данных анамнеза, клинического исследования, лабораторных (клинический анализ крови и мочи, определение уровня калия, остаточного азота, гормонов в сыворотке крови, выделения адреналина и ванилилминдальной кислоты с мочой) и инструментальных (ЭКГ, рентгенография органов грудной клетки, эхоГ почек) исследований провести разграничение между первичной и вторичной АГ у пациента.
Систолическая гипертензия (состояние с нормальным ДАД) возникает при увеличенном сердечном выбросе (лабильная фаза первичной АГ, тиреотоксикоз, артерио-венозные фистулы, недостаточность клапанов аорты). У лиц пожилого возраста с нормальным или уменьшенным сердечным выбросом систолическая гипертензия отражает ригидность аорты и ее основных ветвей (атеросклеротическая АГ).
Клиническая картина артериальной гипертензии разнообразна, определяется степенью и давностью заболевания, изменениями внутренних органов. Длительное время АГ может протекать бессимптомно, так что часто только в результате случайного измерения АД выявляют заболевание. Больной может предъявлять жалобы на вегетативные расстройства, боль в области сердца, головную боль преимущественно в затылочной области. Чаще эта боль возникает в утренние часы, постепенно ее выраженность уменьшается к вечеру. Могут выявляться снижение остроты зрения, левожелудочковая недостаточность и расширение границ сердца, стенокардия, парестезия, носовые и желудочно-кишечные кровотечения, уменьшение массы тела.
Экстренной ДД и неотложного терапевтического вмешательства требует гипертонический криз — внезапное повышение САД и ДАД выше индивидуальных цифр, сопровождающееся дисфункцией вегетативной нервной системы и усилением расстройств мозгового, коронарного и почечного кровообращения. Внезапное повышение АД может провоцироваться психическими стрессами, употреблением алкоголя, отменой гипотензивной терапии и др. Развитие гипертонического криза может быть обусловлено двумя основными механизмами:
- сосудистым — повышением общего периферического сосудистого сопротивления в результате повышения базального (задержка натрия) или нейрогуморального тонуса (нейрогуморальное влияние) сосудистой стенки;
- кардиальным — повышением сократимости миокарда и сердечного выброса, объема циркулирующей крови, объема кровотока при повышении частоты сердечного сокращения, наполнения камер сердца при клапанной патологии с регургитацией.
Клинически гипертонический криз проявляется головной болью, головокружением, тошнотой, рвотой, нарушениями зрения, кардиалгией, ощущением перебоев в ритме сердца, одышкой. В качестве объективных симптомов отмечают возбуждение или заторможенность, озноб, тремор, повышенную потливость, субфебриллитет, нарушения мозгового кровообращения, аритмию.
Выделяют гипер- и гипокинетический вариант гипертонического криза. Гиперкинетический вариант развивается остро, на ранней стадии АГ. Основной патогенетический механизм — кардиальный. Криз длится не более 3–4 ч. Характерны тахикардия и преимущественное повышение САД и пульсового давления. Гипокинетический вариант ГК развивается на поздних стадиях АГ, основной патогенетический механизм — сосудистый. Криз развивается постепенно, длится от нескольких часов до нескольких дней. Тахикардии обычно нет. Для этого варианта криза типично преимущественное повышение ДАД, снижение пульсового давления.
Осложнениями ГК могут быть острое нарушение мозгового кровообращения, стенокардия, инфаркт миокарда, острая сердечная недостаточность, расслаивание аневризмы аорты. Одним из самых тяжелых осложнений является гипертензивная энцефалопатия. Гипертензивная энцефалопатия — результат нарушения ауторегуляции мозгового кровообращения, вследствие чего начинается транссудация из капилляров в ткань мозга с развитием ее отека. При гипертензивной энцефалопатии может отмечаться кортикальная слепота, гемипарезы, гемисенсорные нарушения, но в отличие от подобных изменений при геморрагическом инсульте они обратимы.
Указанные симптомы весьма тревожны и заставляют думать о злокачественной АГ. Клинические критерии степени тяжести АГ приведены в табл. 8.4.
Таблица 8.4
Степени тяжести АГ
| Степень тяжести | ДАД, мм рт. ст. | Глазное дно** | Гипертрофия ЛЖ | Признаки почечных нарушений |
| Легкая* | <100 | 0–I | Нет | Нет |
| Средней тяжести | 100–120 | 0–II | Изменения на ЭКГ, признаки гипертрофии на эхокардиограмме | Нет |
| Тяжелая | >120 | III–IV | Есть | Есть |
*При наличии изменений органов тяжесть АГ увеличивается на следующую ступень; **подробнее — табл. 8.5.
В процессе обследования врач должен выявить объективные признаки поражения внутренних органов. В результате перегрузки миокарда определяется приподнимающий разлитой верхушечный толчок, акцент II тона над аортой, систолический шум над верхушкой как результат относительной митральной недостаточности при расширении ЛЖ.
На ЭКГ выявляются признаки гипертрофии миокарда, кардиосклероза, возможны нарушении ритма. На рентгенограмме — расширение тени сердца, уплотнение и расширение аорты. При проведении эхоКГ определяются признаки гипертрофии миокарда.
Одним из важнейших органов-мишеней, поражающихся при АГ, являются почки. Злокачественная гипертензия приводит к нефросклерозу и ответственна за 15–20% всех новых пациентов, нуждающихся в гемодиализе. Необходимо обращать внимание на следующие признаки поражения ЦНС: головная боль, рвота, нарушения зрения, речи, движения и чувствительности, изменения личности, судорожные припадки, то есть признаки гипертензивной энцефалопатии. Иногда они подвергаются обратному развитию после нескольких дней успешной терапии.
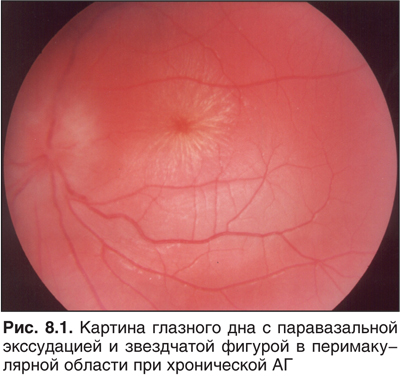
При АГ обязательно исследование глазного дна. На ранних стадиях выявляется извитость и удлинение сосудов, их разветвленность. В дальнейшем появляются признаки атеросклероза, спазм сосудов. Злокачественная АГ осложняется геморрагиями, выход плазмы крови виден как «ватные» (хлопковидные) комки, диагностируются отек сосочка, сетчатки, звездчатые фигуры в перимакулярной области, отложения липидов (рис. 8.1).
В рекомендациях ВОЗ и Международного общества по АГ (World Health Organization-International Society of Hypertension Guidelines for the Management of Hypertension, 1999) для оценки гипертензивной ангиоретинопатии прелагается использовать классификацию Keith — Wagener — Barker (1939), согласно которой выделяют четыре стадии ангиоретинопатии (табл. 8.5).
Таблица 8.5
Стадии ангиоретинопатии при АГ
| Стадия | Артериолы | Кровоизлияния | Экссудаты | Отек соска зрительного нерва | |
| Сужение (соотношение диаметров артериол и вен) | Фокальный спазм (соотношение диаметров артериол и вен) | ||||
| Норма | 3:4 | 1:1 | 0 | 0 | 0 |
| I | 1:2 | 1:1 | 0 | 0 | 0 |
| II | 1:3 | 2:3 | 0 | 0 | 0 |
| III | 1:4 | 1:3 | + | + | 0 |
| IV | Тонкие фиброзные нити | Облитерация дистальных отделов | + | + | + |
В интерпретации Л.А. Кацнельсона и соавторов (1999) классификация Keith — Wagener — Barker представлена в следующем виде:
- степень — минимальное сегментарное или диффузное сужение артерий и артериол. Общее состояние удовлетворительное;
- степень — более отчетливое сужение артерий, умеренное утолщение их стенок, феномен артериовенозного перекреста, извитость и расширение вен. Ретинопатии нет. Умеренно выраженная АГ. Общее состояние удовлетворительное, функции сердца и почек не нарушены;
- степень — ангиосклеротическая ретинопатия (выраженный склероз и сужение артериол, их неравномерность, мелкие и крупные кровоизлияния, экссудаты по типу «ваты»), высокая АГ, нарушение функций сердца и почек;
- степень — двусторонний отек соска зрительного нерва, отек сетчатки, иногда ее отслойка, фигура «звезды»; состояние угрожающее. Однако в действительности корреляцию тяжести АГ с состоянием глазного дна отмечают не всегда. Согласно рекомендациям Европейского общества по артериальной гипертензии и Европейского общества кардиологов (2003), изменения сетчатки I–II степени при АГ не следует считать обязательным свидетельством поражения органов-мишеней, тогда как ангиоретинопатия III–IV степени всегда является маркером тяжелых осложнений АГ.
Критериями злокачественной гипертензии являются ДАД >120 мм рт. ст. (одно оно может быть первым признаком злокачественной гипертензии), тяжелые изменения на глазном дне, быстрое прогрессирование с органическими изменениями сердца, почек. Дополнительные методы исследования: гематурия, протеинурия, азотемия, анемия. Уровень ренина в сыворотке крови повышен, возможна гипокалиемия в результате вторичного гиперальдостеронизма. При наличии злокачественной АГ необходимо приложить все усилия для исключения курабельных случаев симптоматической гипертензии, обусловленной феохромоцитомой, синдромом Кона, поражением паренхимы или сосудов почек.
Если причины АГ у взрослых (и, соответственно, круг патологии для ДД) относительно хорошо известны (см. ниже), то наиболее вероятные причины повышения АД У детей во многом определяются спектром возрастной патологии. Следует выделять преходящую и постоянную АГ.
Причины преходящей артериальной гипертензии у детей и подростков
Почечные:
- острая почечная недостаточность;
- острый постинфекционный гломерулонефрит;
- нефрит при пурпуре Шенляйна — Геноха;
- гемолитико-уремический синдром;
- острый пиелонефрит;
- травма почки, состояние после оперативного вмешательства на почке или мочевых путях;
- гиперволемия.
Прием лекарственных средств, интоксикация:
- пероральные контрацептивы;
- тестостерон, кортикостероиды;
- амфетамин, эфедрин, кокаин;
- витамин D;
- тяжелые металлы.
Неврологические:
- повышение внутричерепного давления;
- синдром Гийена — Барре;
- энцефалит.
Прочие:
- ожоги;
- гиперкальциемия;
- состояние после операции по поводу коарктации аорты;
- острая интерметтирующая порфирия.
Причины постоянной АГ у детей и подростков
Почечные:
- рефлюкс мочи, обструктивная нефропатия, гидронефроз;
- поликистоз, солитарные кисты почек;
- дисплазия почек;
- хронический гломерулонефрит, в том числе при системных заболеваниях соединительной ткани, васкулитах;
- хроническая почечная недостаточность, гемодиализ, состояние после трансплантации почек.
Сосудистые:
- стеноз устья аорты врожденный или приобретенный (неспецифический аортоартериит — болезнь Такаясу);
- стеноз почечных артерий (одно- или двусторонний) при нейрофиброматозе, артериите;
- состояние после тромбоза почечной вены;
- артериовенозные шунты.
Эндокринные:
- гипертиреоз;
- гиперпаратиреоз;
- болезнь Кушинга;
- адреногенитальный синдром;
- первичный гиперальдостеронизм;
- феохромоцитома;
- сахарный диабет.
Прочие:
- синдром Тернера (часто сочетающийся со стенозом аорты).
Принципы ДД-поиска при АГ см. в табл. 8.5.
Эссенциальную (первичную) артериальную гипертензию диагностируют после исключения вторичной (симптоматической) гипертензии. Эссенциальная АГ маловероятна у пациентов в возрасте младше 16 лет, чаще она развивается в 40–50 лет. Ее этиопатогенез пытались объяснять генетическими факторами, влиянием окружающей среды, особенностями питания, гемодинамическими изменениями (увеличением сердечного объема с повышением периферического сосудистого сопротивления), биохимическими и гормональными нарушениями (резистентность к инсулину, нарушения в системе ренин — ангиотензин — альдостерон и катехоламинов). Действительно, в системе ренин — ангиотензин — альдостерон юкстагломерулярный аппарат помогает регулировать объем циркулирущей крови и АД. Ренин, протеолитический фермент, образующийся в гранулах клеток юкстагломерулярного аппарата, катализирует превращение белка ангиотензиногена в декапептид ангиотензин I, из которого затем под влиянием превращающего фермента образуется октапептид ангиотензин II — мощный гуморальный вазокомпрессорный фактор. Ангиотензин II метаболизируется с образованием гептапептида ангиотензина III, обладающего менее выраженной вазоконстрикторной активностью, однако оказывающего способность стимулировать продукцию альдостерона надпочечниками.
Секреция ренина регулируется четырьмя механизмами. Точечные сосудистые рецепторы отвечают на изменение напряжения стенки приносящей артериолы. Рецепторы в дистальных канальцах определяют скорость поступления и концентрацию ионов натрия. Циркулирующий ангиотензин влияет на секрецию ренина по принципу обратной связи. Симпатическая нервная система регулирует секрецию ренина через β-адренорецепторы.
У пациентов с эссенциальной АГ активность ренина в плазме крови снижена в 25% случаев, повышена — в 15% и не изменена — в 60%. При злокачественной гипертензии активность ренина повышена. Но единого мнения о роли системы ренин — ангиотензин — альдостерон при первичной (идиопатической) гипертензии, за исключением далеко зашедших случаев с высоким АД, нет.
Наряду с путем превращения ангиотензина с участием АПФ существуют также альтернативные пути его метаболизма. Важную роль роль в преобразовании ангиотензина I в ангиотензин II на локальном уровне в различных тканях играют ряд других, отличных от АПФ, ферментов: специфические серологические протеиназы (химазы), катепсины, тонин, пептидилдипептидаза эндотелия клеток и почечная карбоксипептидаза. Наличие альтернативных путей преобразования ангиотензина I в ангиотензин II объясняет случаи недостаточной эффективности ингибиторов АПФ.
Система ренин — ангиотензин — альдостерон, кроме почек, существует во многих других органах. Локальные системы способны продуцировать ангиотензин II независимо от циркуляторной системы ренин — ангиотензин — альдостерон. Система ренин — ангиотензин — альдостерон реализует эффекты как при здоровом сердце, так и при его патологии, регулируя сосудистый тонус, сократимость миокарда, влияет на его массу и гипертрофию.
Активно функционирующая система ренин — ангиотензин — альдостерон выражена в эндотелии, в меньшей степени — в гладких мышечных волокнах сосудистой стенки. Система запускает влияние инсулина и инсулиноподобного фактора роста I, что вызывает рост и гипертрофию сосудистых элементов.
В яичниках эта же система в совокупности с проренином рассматривается как репродуктивный гормон. В яичках она участвует в сперматогенезе и имеет значение для мужской фертильности.
Жировая ткань содержит большое количество ангиотензиногена. Образующийся в жировой ткани ангиотензин II вызывает спазм сосудов и АГ, особенно в случаях избытка жировой ткани.
Система ренин — ангиотензин — альдостерон в фибробластах кожи определяет заживление ран, активируя фактор роста.
В коре надпочечников, особенно в пучковой и гломерулярной зоне, выявлена одна из самых высоких, по сравнению с другими органами, концентрация ангиотензина II. Он участвует в синтезе кортикостероидов и альдостерона. Ренин в надпочечниках синтезируется и действует вне зависимости от его уровня в плазме крови.
Гемато-энцефалический барьер препятствует проникновению компонентов системы ренин — ангиотензин — альдостерон из крови в мозг. Поэтому мозг имеет свою собственную систему. Ангиотензиноген активно синтезируется глиальными клетками. АТ1-рецепторы (вазоконстрикторные) сосредоточены в гипоталамусе, АТ2-рецепторы (вазодилататорные) — в области олив. Большое количество ренина и ангиотензина II содержится в ткани передней доли гипофиза, влияя на гонадотропную регуляцию синтеза эстрогена у женщин и тестостерона у мужчин. Ангиотензин II блокирует высвобождение пролактина.
У пациентов с первичной АГ, в отличие от вторичных форм, повышено внутриклеточное содержание натрия и кальция. Нарушение функционирования катионного насоса может быть результатом высокой резистентности к инсулину. Повышенная концентрация ионов в клетке сопровождается повышением реактивности мышечных волокон в стенках сосудов, увеличением объема плазмы крови и сердечного выброса. В результате этого механизмы саморегуляции приводят к повышению периферического сосудистого сопротивления. Стрессовые реакции, активация симпато-адреналовой системы, повышенный ответ сосудов на вазопрессин также сказываются на уровне АД.
Последние годы ознаменованы поворотом в теоретических взглядах на механизмы возникновения и развития АГ. Ранее АГ объясняли как результат действия вазопрессорных факторов. Но, как оказалось, все не так однозначно. Быстрее и значительней, чем избыток вазоконстрикторов, на АД сказывается дефицит вазодилататоров. Известно, что экстракт из мозгового слоя почки содержит такие вазодилататоры, как брадикинин, нейтральные липиды, простагландин. Отсутствие этих вазодилататоров (при поражении паренхимы почки или при двусторонней нефректомии) ведет к резкому повышению АД. Гипертензия, формирующаяся после нефректомии (ренопривная гипертензия), имеет характер объем- и натрийзависимой.
Роль эндотелия при АГ еще предстоит осмыслить. Клетки эндотелия продуцируют такие вазодилататоры, как оксид азота, простациклин, а также наиболее мощный вазоконстриктор — эндотелии. Дисфункция эндотелия обусловливает дисбаланс этих факторов.
Масла в огонь споров добавляет и тот факт, что вазоконстрикторы и вазодилататоры — это по сути даже не побеги из одного корня, а плоды с одной ветви. Непосредственно из ангиотензина I под действием того же самого АПФ или тканевых пептидаз образуется гептапептид ангиотензин I–VII. Он стимулирует высвобождение аргинин-вазопрессина, вазодилататоров — простагландинов, брадикинина, оксида азота.
Кроме того, действие ангиотензина II зависит от того, с каким из специфических рецепторов он связывается. АТ1-рецепторы обусловливают вазоконстрикцию, пролиферацию клеток и гипертрофию миокарда, антиапоптозный эффект, прооксидантное действие. АТ2-рецепторы — полная противоположность: вазодилатация, торможение пролиферации и роста клеток, стимуляция апоптоза, антиоксидантное действие.
После краткого отступления, посвященного патогенезу, перейдем к собственно клиническим вопросам.
Вторичная, симптоматическая АГ
Почечная гипертензия обусловлена врожденными или приобретенными одно- или двусторонними поражениями паренхимы (ренальная паренхиматозная гипертензия), а также одно- или двусторонним сужением почечной артерии (реноваскулярная гипертензия).
Заболевания паренхимы почек обусловливают около 6–7% всех случаев АГ. Почечную природу гипертензии подтверждает выявление протеинурии, гематурии, пиурии, цилиндрурии, бактерурии, повышенного уровня азотистых веществ в крови. Рентгенографические, радиоизотопные и ультразвуковые методы исследования позволяют выделить две группы паренхиматозных почечных гипертензий: при двустороннем (гломерулонефрит, интерстициальный нефрит, поликистоз) и одностороннем поражении почек.
Двусторонние поражения паренхимы с тенденцией к развитию почечной недостаточности практически всегда протекают с АГ (подробную дифференциальную заболеваний почек см. в соответствующей главе). Причинами гипертензии является повышенная задержка жидкости вследствие усиленной задержки натрия и калия, повышение продукции ренина. Развитие АГ предшествует почечной недостаточности, а в уремической стадии у большинства больных отмечают повышение АД. У пациентов с длительной АГ невозможно определить первичность паренхиматозных изменений в почках, ведь сама АГ вызывает их повреждение (поэтому крайне важно стремиться к нормализации давления, чтобы отсрочить наступление терминальной фазы почечной недостаточности).
Односторонние почечные паренхиматозные заболевания с АГ — это состояния, ведущие к повышению секреции ренина одной почкой. Устранение препятствий на пути оттока мочи или удаление нефункционирующей почки нередко приводит к нормализации АД. К односторонним процессам относятся острый или хронический гидронефроз различного генеза (обструкция мочевыводящих путей камнем, опухолью, тромбом при некрозе верхушки сосочка) или односторонне уменьшенной почке. Последняя может быть как врожденного (тотальная или лобарная гипоплазия почки), так и приобретенного (атрофический хронический интерстициальный нефрит, лучевой нефрит, травматическая атрофия) происхождения. Врожденная гипоплазия почки и интерстициальный нефрит с исходом в нефросклероз — наиболее частые причины АГ при одностороннем поражении паренхимы почки. Рецидивирующая инфекция мочевыводящих путей может свидетельствовать на интерстициальный атрофический нефрит. По данным рентгенологического, эхоГ-исследования и результатам пункционной биопсии возможно распознавание сморщенной и гипоплазированной почки, однако для практической деятельности подобная ДД малозначима. Диагноз «лучевой нефрит» или постравматические изменения устанавливают анамнестически.
У больных с почечной недостаточностью, находящихся на гемодиализе, возможно развитие синдрома «жесткой воды», протекающего с АГ. В основе расстройства лежат острые гиперкальциемия и гипермагниемия, развивающиеся при использовании жесткой воды для приготовления диализных растворов. Синдром стали выявлять чаще после введения методик домашнего диализа, где сложнее проконтролировать состояние дистилляционных аппаратов.
Проявляется во время проведения гемодиализа общей слабостью, оглушенностью, ощущением жара, стеснением в груди, горячей кожей, головной болью, тошнотой, рвотой, онемением рук, артралгией, судорогами в икроножных мышцах, повышением АД на 20–60 мм рт. ст. по сравнению с исходными цифрами. В крови — гиперкальциемия и гипермагниемия.
Тошнота, рвота, повышение АД, головная боль и возможный панкреатит обусловлены гиперкальциемией. Ощущение жара, изредка с понижением АД, объясняется гипермагниемией. Прогноз при данном состоянии благоприятный, поскольку эффекты повышения концентрации кальция и магния в сыворотке крови взаимно нивелируются. При адекватном гемодиализе указанные нарушения быстро устраняются.
Реноваскулярные гипертензии составляют значительную часть вторичных АГ. По разным данным, среди всех форм АГ реноваскулярная гипертензия составляет 2–5%, а у больных, поступающих в терапевтические стационары с симптоматическими почечными гипертензиями, — до 10% случаев и более.
Наиболее частой причиной реноваскулярной АГ является стеноз почечных артерий, который чаще всего обусловлен атеросклерозом (у большинства пациентов) или фибромускулярной дисплазии. Другие причины сужения просвета артерии (стеноз артерии трансплантированной почки, аневризма почечной артерии или аорты, эмболия почечной артерии, васкулит, сдавление почечной артерии опухолью, кистой или при гидронефрозе) выявляют сравнительно редко. Еще реже диагностируют тромбоз почечной артерии, при котором повышение АД — симптом, как правило, по времени достаточно отдаленный от первичных проявлений патологического процесса. Далеко не всегда стеноз почечной артерии приводит к развитию АГ, поскольку определяющим фактором для активации ренин-ангиотензиновой системы является степень стеноза, вызываемые им гемодинамические нарушения и выраженность ишемии почки.
Нельзя забывать и о возможности тромбоза почечной вены. Острый тромбоз вены свойственен детям, его клиническое течение сходно с острым тромбозом почечной артерии. У взрослых этот процесс протекает в основном бессимптомно, его нередко выявляют только на стадии легочной эмболии.
Атеросклероз почечных артерий чаще развивается у мужчин в возрасте старше 50 лет, а фибромускулярная дисплазия — у женщин молодого возраста и ассоцируется с генерализованной дисплазией соединительной ткани.
Кроме возраста пациентов, в пользу реноваскулярной АГ могут также свидетельствовать резистентность к гипотензивной терапии, ухудшение функции почек на фоне применения ингибиторов АПФ, склонность к гипокалиемии и злокачественность течения. Шум, который может выслушиваться над местом стеноза артерии, выявляют также у некоторых пациентов с эссенциальной АГ без сосудистых аномалий. Значительно достовернее результаты эхоГ, позволяющей выявить асимметричные размеры почек (исключить паренхиматозные процессы). Нефросцинтиграфия позволяет определить характер кровоснабжения паренхимы и время поступления изотопа в почки. Гемодинамически значимым является стеноз, при котором просвет артерии уменьшен до 70% и более. С помощью допплер-эхоГ можно измерить скорость кровотока в почечной артерии и определить место стеноза. Методика информативна только при высоком уровне подготовки специалиста; следует учитывать возможность ложноотрицательного результата у пациентов с избыточной массой тела. Чувствительность и специфичность дуплексной допплер-эхоГ при выполнении исследования опытным специалистом достигает 90%. Очень хорошие результаты метода получают при изучении кровотока по артерии трансплантированной почки. Целесообразно применение так называемой высокоэнергетической допплер-эхоГ. Ангиография позволяет детально визуализировать сосудистый рисунок почек. При сопоставлении ее результатов с данными гистологических исследований выяснено, что стеноз атеросклеротического генеза чаше локализуется в устье почечной артерии и в ее первой трети, сочетаясь с атеросклеротическими изменениями аорты и сосудов таза. Фибромускулярная дисплазия может вызывать сужение почечной артерии на всем ее протяжении, однако чаще локализуется в средней и дистальной трети сосуда, в дополнительных ветвях. Рентгеновский снимок сосуда при ангиографии имеет вид «нити жемчужин». Аналогичные изменения выявляют и в других артериях (сонных, внутричерепных, подключичных, селезеночной, чревном стволе и др.).
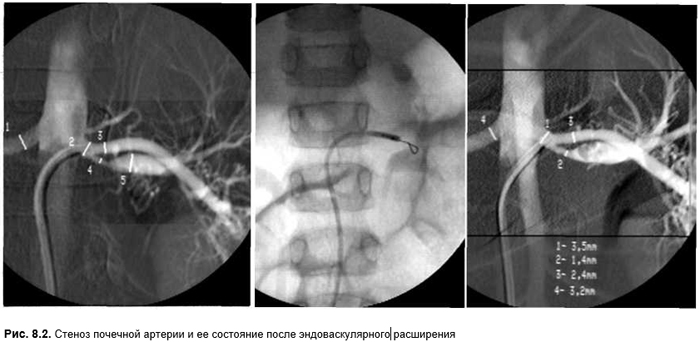
О степени стеноза почечной артерии можно судить также по концентрации ренина в пробах крови, взятых в каждой из двух почечных вен. Если уровень ренина в крови соответствующей вены в 1,5 раза выше чем в системной циркуляции и в 1,3 раза выше чем в крови, взятой из противоположной вены, можно сделать заключение о биохимически активном стенозе и дальнейшем неблагоприятном прогнозе. Но даже в случае отсутствия указанных биохимических изменений, для молодых пациентов предпочтительно оперативное лечение (рис. 8.2).
Эндокринные симптоматические АГ. Гиперальдостеронизм — результат повышенной продукции альдостерона или снижения его метаболической утилизации в печени. ДД гиперальдостеронизма проводят между первичными формами (80% всех случаев) в результате аденомы (синдром Кона), двусторонней гиперплазией (19%) и карциномой надпочечников (1%). В двух последних вариантах активно выделяются и другие гормоны коры надпочечников. При некоторых реноваскулярных и почечно-паренхиматозных АГ после приема гормональных контрацептивов может отмечаться комбинация АГ и вторичного гиперальдостеронизма. В этой ситуации синтез альдостерона стимулируется ангиотензином II и гиперпродукцией АКТГ.
Синдром Кона (первичный гиперальдостеронизм) проявляется гипокалиемической гиперкалийурической (суточная экскреция калия с мочой — более 30 ммоль/сут) доброкачественной АГ с метаболическим ацидозом. В результате усиленной секреции альдостерона повышается реабсорбция натрия, что ведет к задержке воды в организме и к повышению АД. Наряду с гипертензией на первый план выдвигаются мышечные, неврологические и почечные симптомы: мышечная слабость (иногда периодическая) вплоть до невозможности поднять голову или отвести руку от туловища, парестезии, рецидивирующая тетания (даже при нормальных уровнях кальция в сыворотке крови), хроническая водянистая диарея, калиопеническая нефропатия (полиурия, никтурия, полидипсия, гипо- и изостенурия), нормокальциемическая тетания, гипомагниемия, гипокалиемические изменения на ЭКГ. При подтвержденном диагнозе «первичный гиперальдостеронизм» необходимо провести ДД между аденомой коры надпочечника и ее двусторонней гиперплазией, поскольку при последней проводится медикаментозная терапия, а аденома подлежит оперативному удалению. Для ДД этих двух состояний применяют КТ, сцинтиграфию и флебографию. КТ позволяет неинвазивно визуализировать аденомы более 1 см в диаметре. При сцинтиграфии надпочечников с 131I-холестерином выявляют накопление изотопа на стороне аденомы, в то время как с противоположной стороны в результате компенсаторного угнетения синтеза гормонов накопление изотопа меньше, чем в норме. При гиперплазии коры надпочечников распределение изотопа равномерное. По итогам этих двух исследований в большинстве случаев можно с уверенностью установить диагноз и определить тактику ведения пациента. В остальных случаях приходится выполнять флебографию с определением уровня альдостерона в вене с противоположной стороны. Технически процедура возможна при диаметре аденомы более 1 см. Перед введением контрастного средства определяют базальный уровень гормонов надпочечников в нижней полой вене и в венах надпочечников. Из осложнений процедуры известны прорыв контраста в брюшную полость и кровоизлияние в надпочечники.
ДД вторичного гиперальдостеронизма с гипокалиемической гипертензией проводят по принципу последовательного исключения следующих состояний:
- Медикаментозно-индуцированные вторичные АГ с гипокалиемией.
- Реноваскулярная АГ.
- Ренопаренхиматозная АГ.
- Эссенциальная АГ со злокачественным течением.
Среди медикаментозно-индуцированных гипокалиемических гипертензий на первом месте стоят последствия бесконтрольного применения салуретиков. Передозировка этих препаратов обусловливает потерю калия и развитие вторичного гиперальдостеронизма. У 4–5% женщин, пользующихся гормональными контрацептивами, тормозящими овуляцию, развивается вторичный гиперальдостеронизм с АГ, который обычно проходит в течение 6–7 мес после отмены этих препаратов. ДД вторичного гиперальдостеронизма при этих состояниях группы основывается на наличии указаний о предшествующем приеме соответствующих лекарственных препаратов в анамнезе, нормализации уровня калия в сыворотке крови после применения его препаратов и нормализации АД после отмены средств, спровоцировавших гипертензию. Значительно большую сложность представляет ДД первичного гиперальдостеронизма и его вторичных форм, обусловленных реноваскулярной, злокачественной эссенциальной или почечно-паренхиматозной гипертензией. Ясность позволяет внести результаты эхоГ почек и надпочечников, анализы мочи, определение клиренса креатинина. Существенную помощь оказывает определение уровня ренина в плазме крови: при вторичных гипокалиемических гипертензиях ренин стимулирует выработку альдостерона, при первичном гиперальдостеронизме уровень ренина не изменяется.
Гипокалиемические АГ с нормальной или сниженной секрецией альдостерона и ренина являются результатом нарушения синтеза кортизола в коре надпочечников. При этом происходит накопление промежуточных продуктов с минералкортикоидной активностью. Вследствие недостаточного выброса в кровь кортизола повышается уровень адренокортикотропного гормона (АКТГ). Биохимическое разграничение этих состояний в практических целях затруднено, поэтому при ДД учитывают снижение уровня ренина и альдостерона в крови и нормализацию АД после применения дексаметазона, подавляющего синтез АКТГ по принцину обратной связи. Врожденные клинически манифестные дефекты вышеописанной ферментной цепи очень редки, чаще гипокалиемическая АГ с нормальной или сниженной секрецией ренина и альдостерона может развиться при неумеренном употреблении некоторых видов жевательной резинки или лакрицы (солодки). Находящаяся в этих продуктах глицирризиновая кислота блокирует фермент 11β-гидроксистероид-дегидрогеназу, переводящую кортизол в кортизон. В итоге (по-видимому, у генетически предрасположенных лиц) снижаются уровень альдостерона и ренина в плазме крови, развивается псевдогиперальдостеронизм с АГ, гиперкалиурией и гипокалиемией. Установить диагноз позволяет изучение анамнестических данных и определение указанных биохимических показателей.
При синдроме Иценко — Кушинга избыточная продукция кортизола вызывает задержку натрия и воды в организме с гипокалиемическим алкалозом. При опухолях, продуцирующих вещества, близкие по химической структуре к АКТГ, типичные признаки синдрома Иценко — Кушинга могут отсутствовать, а в клинической картине будет доминировать гипокалиемическая АГ. Синдром Иценко — Кушинга как первичное состояние достаточно редок. У женщин возникает в 4 раза чаще, чем у мужчин, преимущественно у пациентов в возрасте 40–60 лет. В 90% случаев сопровождается АГ. Синдром развивается как следствие хронической гиперкортизолемии. Повышается уровень активного не связанного с белком кортизола, дневные колебания его уровня значительно превышают границы нормы, повышается экскреция кортизола почками. На первый план выступают глюкокортикоидные свойства гормона, но при его высокой концентрации начинают проявляться минералкортикоидные и андрогенные свойства. Клинически синдром Иценко — Кушинга характеризуется массивным ожирением преимущественно туловища. Общая масса тела может изменяться незначительно. Лицо круглое, лунообразное, красное, двойной подбородок, затылочный горб, гирсутизм, акне, мраморность кожного рисунка. В подмышечных областях, на животе, ягодицах, бедрах появляются выраженные синюшно-багровые стрии. Кожа атрофичная, сухая, нередки петехии в результате повышенной ломкости сосудов, легко присоединяется инфекция, пиодермия, грибковое поражение ногтей. Полиглобулия. АГ обычно умеренная, в пределах 150/90–180/100 мм рт. ст. У женщин отмечается олиго- и аменоррея, у мужчин — снижение потенции. Отмечается атрофия мышц, поэтому больных беспокоит слабость, а относительно тонкие конечности контрастируют с ожиревшим туловищем. Иногда выявляют латентный инсулинрезистентный сахарный диабет, чаще — снижение толерантности к глюкозе. Типичным для синдрома Иценко — Кушинга является остеопороз, приводящий к компрессионным переломам позвонков, преждевременному закрытию зон роста у детей.
При паранеопластическом синдроме Кушинга не выражены ожирение с нарушенным распределением подкожной жировой клетчатки и стрии. Вследствие общей тяжести состояния и быстротечности основного процесса не успевает сформироваться выраженный остеопороз. Чаще выявляют пигментацию кожи и гипокалиемический алкалоз.
При ятрогенном синдроме Кушинга, развивающемся при применении глюкокортикостероидов, выше вероятность развития катаракты, асептических некрозов костей, практически не выявляемых при первичном синдроме. В противоположность первичному синдрому значительно повышается масса тела.
Гиперкортизолемия развивается в результате повышения функции гипофиза, при эктопической паранеопластической гиперпродукции АКТГ, при АКТГ-независимых опухолях коры надпочечников. Первичный надпочечниковый синдром Кушинга развивается при кортизолсинтезирующих опухолях надпочечников. Обратная связь с гипофизом через гипоталамус сохранена, уровень АКТГ соответственно резко снижен, поэтому другой надпочечник атрофируется. При повышенном синтезе АКТГ в передней доле гипофиза в результате его опухоли или дисфункции гипоталамуса с избыточной продукцией кортикотропин-рилизинг-фактора развивается гиперплазия коры обоих надпочечников. Рилизинг-фактор стимулирует переднюю долю гипофиза и приводит к ее гиперплазии или образованию солитарной или множественной базофильной или хромофобной аденомы. Паранеопластический синдром Кушинга с эктопической продукцией АКТГ или (очень редко) рилизинг-фактора выявляют при раке бронхов или вилочковой железы. Значительно реже АКТГ-подобные полипептиды синтезируются при опухолях яичника, предстательной железы, яичек, щитовидной железы, желудка, поджелудочной железы. Еще реже аналогичный эффект развивается при феохромоцитоме.
Микронодулярная гиперплазия коры надпочечников — редкое семейное заболевание — сопровождается высокой кортизолемией при сниженном уровне АКТГ. В коре надпочечников гистологически выявляют мелкие гормонально активные узелки, окружающая их ткань атрофирована. Причина заболевания заключается в наличии аутоантител, конкурирующих за рецепторы АКТГ и тем самым стимулирующих синтез кортизола.
Макронодулярная гиперплазия коры надпочечников, АКТГ-независимая, развивается при длительном течении нелеченного гипофизарного синдрома Кушинга. При этом некоторые узлы в коре надпочечников теряют обратную связь с гипофизом и начинают секретировать кортизол в собственном ритме. АКТГ может быть как в пределах нормы, так и повышен, проба с применением дексаметазона положительна, то есть сопровождается снижением уровня АКТГ, а секреция кортизола не изменяется.
С признаками синдрома Кушинга протекают фиброзная дисплазия костей (для которой помимо кушингоида характерны также кожные пятна цвета «кофе с молоком», преждевременное половое созревание, акромегалия, гипертиреоз, гиперпаратиреоидизм, кистозные изменения скелета, спонтанные переломы костей, остеосклероз), синдром Нельсона (быстро и агрессивно растущая АКТГ- продуцирующая опухоль гипофиза, развивающаяся у пациентов, подвергнутых двусторонней адреналэктомии по поводу синдрома Кушинга), синдром МакКьюна — Олбрайта, или полиостозная фиброзная дисплазия (характерно наличие следующей триады симптомов: гиперпигментация кожи, фиброзный диссеминированный остит и эндокринопатии с гиперфункцией желез, например преждевременное половое созревание и низкорослость, тиреотоксикоз и кушингоид).
При обследовании больного с синдромом Иценко — Кушинга необходимо провести ДД с алиментарно-конституциональным ожирением, биохимически доказать гиперпродукцию кортизола. При алиментарно-конституциональном ожирении, как и при синдроме Иценко — Кушинга, отмечают избыточное отложение подкожной жировой клетчатки, стрии, гирсутизм, нарушения менструального цикла, гиперлипидемия, АГ, высока вероятность сахарного диабета. Но в отличие от синдрома Иценко — Кушинга, нет остеопороза, ожирение обычно диффузное, нет типичного отложения жировой клетчатки на туловище и затылке, нет характерных изменений кожи с плеторой. Сохранен циркадный ритм выделения кортизола в плазму крови, нет повышенной экскреции кортизола с мочой. Информативной является ДД-проба с дексаметазоном. Препарат в дозе 1 мг применяют перорально в 22 ч, а утром в 8 ч берут венозную кровь для определения содержания кортизола. Уровень кортизола в плазме крови <140 нмоль/л свидетельствует о сохраненных связях гипофиз — надпочечники, что позволяет исключить синдром Иценко — Кушинга и свидетельствует в пользу ожирения. Уровень кортизола выше 140 нмоль/л свидетельствует в пользу синдрома Иценко — Кушинга. Для биохимического подтверждения повышенной продукции кортизола, необходимо определить его уровень в 7; 9; 12; 18 и 23 ч до и после применения 0,5 мг дексаметазона 4 раза в сутки в течение 2 дней. В норме наиболее высокий уровень кортизола определяется утром, затем концентрация начинает снижаться, в полночь его значение в 2 раза ниже утреннего. Если изначально определяется высокий уровень кортизола, нет суточных колебаний ритма его экскреции с мочой, нет снижения секреции гормона (уровень в плазме крови >140 нмоль/л, суточная экскреция 17-гидроксистероидов с мочой превышает 11 мкмоль/сут) после применения дексаметазона, можно говорить о гиперкортицизме. Диагностика синдрома Иценко — Кушинга чаще всего требует проведения всего комплекса клинико-инструментальных и биохимических исследований. В затруднительных случаях приходится осуществлять забор пробы крови из каменистого синуса (sinus petrosus) для определения уровня АКТГ до и после применения рилизинг-фактора; только эта методика позволяет надежно отличить гипофизарную и эктопическую гиперпродукцию АКТГ.
Феохромоцитома — катехоламинпродуцирующая опухоль хромаффинной ткани. В 90% случаев опухоль развивается из мозгового слоя надпочечников, в остальных случаях имеет вненадпочечниковую локализацию — из ганглиев симпатического ствола, в области бифуркации аорты (особенно при семейных случаях), мочевого пузыря (критические подъемы АД во время и после мочеиспускания), гонад, поджелудочной железы, аппендикса). Внебрюшную локализацию отмечают только в 1% всех феохромоцитом. В 8% — феохромоцитомы множественные. Злокачественные формы с инвазивным ростом и метастазами возникают в 5% случаев. Причем даже гистологически бывает очень сложно определить степень злокачественности опухоли. При экстраабдоминальной локализации злокачественные формы выявляют значительно чаще (30%). Может отмечаться в рамках синдромов Гиппеля — Линдау и множественной эндокринной неоплазии (включая синдром Сиппла). При наличии АГ и пигментных пятен на коже необходимо искать феохромоцитому, а при наличии феохромоцитомы — всегда искать пигментые пятна цвета «кофе с молоком», депигментированные участки кожи, нейрофибромы, миомы, гемангиомы, рак щитовидной железы и гиперпаратиреоидизм для исключения генетически детерминированных состояний.
Феохромоцитома — достаточно редкая причина вторичной АГ, тем не менее, диагноз этого состояния очень важен, поскольку гипертонические кризы при феохромоцитоме протекают тяжело и могут закончиться летальным исходом. Часть феохромоцитом злокачественна, поэтому сроки оперативного вмешательства зачастую определяют прогноз в отношении жизни больного. Удаление опухоли приводит к полному излечению АГ. Диагноз этой опухоли может быть толчком к выявлению других генетически детерминированных состояний, позволяет проводить дальнейшее целенаправленное диспансерное наблюдение за прооперированным больным. Клиническая картина феохромоцитомы достаточно пестрая, но сводится к бледности и гипергидрозу кожных покровов, тахикардии, интенсивной головной боли, что объясняется избыточной концентрацией катехоламинов в плазме крови. Если у пациентов с АГ указанных симптомов нет, вероятность феохромоцитомы крайне низкая. Наряду с этим пациентов беспокоят тремор, повышенная возбудимость, уменьшение массы тела, что может служить причиной ошибочного диагноза тиреотоксикоза. Бледность, неврологическая симптоматика и проливной пот напоминают гипогликемические кризы. Интенсивная головная боль, судороги, потеря сознания заставляют думать о мигрени, синдроме Меньера, эпилепсии, гипертензивной энцефалопатии, кровоизлиянии в мозг. Гипертрофия миокарда, выявляемая при эхоГ как результат повышения давления, при поверхностном обследовании пациента может привести к установлению ложного диагноза гипертрофической кардиомиопатии. Многочисленные кардиальные жалобы, нарушения ритма сердца, стенокардия заставляют врача думать о кардиологической патологии.
В зависимости от динамики повышения АД различают несколько вариантов течения феохромоцитомы.
- Феохромоцитома с пароксизмальной гипертензией (около 50%), приступы которой длятся от нескольких минут до часов. Приступ начинается резко, головная боль пульсирующая, невыносимая, тахикардия, аритмия, нарушения зрения, проливной пот, боль в животе, запор. У пациентов пожилого возраста в этот период могут развиться стенокардия или кровоизлияния в мозг. Как результат адреналовых некрозов миокарда возможна острая ЛЖ- недостаточность. Приступы повышения АД могут наслоиться на стабильную гипертензию, но чаще между приступами давление нормализуется, а у некоторых больных в период между кризами отмечают склонность к ортостатическим коллапсам. Приступы повышения АД иногда провоцируются пальпацией живота и спины, массажем, эмоциональной травмой, приемом блокаторов β-адренорецепторов, мочеиспусканием (при расположении опухоли в мочевом пузыре), а у молодых женщин гипертензивные катехоламиновые кризы могут появиться в период беременности и обычно трактуются как эклампсия.
- Феохромоцитома со стабильно повышенным АД (около 50%). ДД с другими формами АГ затруднен, тем не менее и для данной формы характерны катехоламиновые кризы и симптоматика гиперкатехоламинемии (бледность кожных покровов, потливость, гипергликемия, гиперметаболизм).
- Феохромоцитома с преимущественно метаболическим синдромом без АГ (около 5%). Развиваются сахарный диабет, ускоряется обмен веществ. Повышение АД умеренное. Такой тип заболевания отмечается при гиперпродукции преимущественно адреналина, в то время как два первых — при преимущественной гиперпродукции норадреналина.
Диагноз феохромоцитомы основывается на выявлении повышенного уровня катехоламинов в крови, продуктов их обмена и определении выделения катехоламинов с мочой, а также на визуализации опухолевого образования. Биохимически определяют уровень адреналина, норадреналина и ванилилминдальной кислоты. Особенно информативно их определение в период повышения АД. Феохромоцитоме свойственны высокие цифры содержания катехоламинов (>2000 пкг/мл). Перед биохимическим исследованием должен быть исключен прием препаратов, способствующих повышению уровня этих веществ, например резерпина. При эссенциальной АГ возможны пограничные уровни катехоламинов в сыворотке крови (1000–2000 пкг/мл). Для ДД применяют клонидин, блокирующий центральный тонус симпатической системы. Если на этом фоне уровень катехоламинов снижается более чем на 500 пкг/мл, то говорят об отсутствии феохромоцитомы. С ДД-целью показано проведение пробы с тропафеном в период криза. В ответ на введение тропафена, блокирующего симпатические рецепторы, САД и ДАД при феохромоцитоме снижается в среднем соответственно на 65 и 40 мм рт. ст., при АГ другой этиологии — на 50 и 35 мм рт. ст. Если в моче выявляют повышенную концентрацию диоксифенилаланина, допамина и гомованилиновой кислоты, есть основания говорить о злокачественности опухоли.
У нормотензивных пациентов с феохромоцитомой возможно проведение провокационной пробы с глюкагоном. Препарат вводят внутривенно быстро в дозе 0,5–1 мг. При наличии феохромоцитомы в ближайшие 2 мин давление повышается более чем на 35/25 мм рт. ст. Пробу следует выполнять в условиях стационара.
Провокационные пробы с гистамином или тирамином опасны и должны быть строжайшим образом запрещены.
Визуализация опухолевого узла достигается применением эхоГ, КТ, ЯМР-томографии и сцинтиграфии с 131I-мета-йодобензилгуанином. Эти методики достаточно информативны, поэтому аортографию, надпочечниковую артериографию и флебографию в настоящее время применяют редко. При необычной локализации феохромоцитомы в специализированных стационарах приходится проводить зондирование полых вен с посегментарным забором проб крови для определения концентрации катехоламинов.
ДД проводится с другими опухолями симпатической нервной системы, прежде всего с симпатогониомами и симпатобластомами, которые также могут сопровождаться повышением АД. Они возникают преимущественно у детей, характеризуются склонностью к метастазированию, интенсивным выделением диоксифенилаланина, допамина и гомованилиновой кислоты. В редких ситуациях опухоли поджелудочной железы, коры надпочечников способны раздражать хромаффинную ткань и способствовать выбросу катехоламинов. Некоторые нейрогенные АГ обусловлены повышенным выделением норадреналина из нервных окончаний. Умеренная гипкеркатехоламинемия и пароксизмальная АГ может возникать при карциноидном синдроме, острой интермиттирующей порфирии, интоксикации таллием. Высокое АД, сосудистые и кардиальные расстройства требуют проведения ДД с узелковым периартериитом.
Акромегалия, обусловленная избыточной секрецией гипофизарного гормона роста (соматотропного гормона), сопровождается АГ у 30% больных. Последняя определяется, по-видимому, натрий- задерживающим эффектом соматотропного гормона и увеличением объема внеклеточной жидкости.
В 98% случаев гиперсекреция гормона происходит из передней доли гипофиза, где развивается эозинофильная аденома, редко — хромофобная аденома и еще реже — гиперплазия эозинофильных клеток без формирования аденомы. Очень редко выявляют эктопический очаг секреции соматотропного гормона или рилизинг-фактора гормона роста.
Гормон роста стимулирует синтез гепатоцитами соматомедина С, который и ответственней за развитие симптомов акромегалии.
Если избыточная продукция гормона возникает в препубертатный период до закрытия зон роста, то развивается гигантизм, если в детском возрасте, то зоны роста быстро закрываются и формируется акромегалия с низким ростом. Классическая картина акромегалии формируется при появлении аденомы гипофиза у взрослых. Наиболее типичный внешний признак акромегалии — усиленный диспропорциональный рост костей скелета и мягких тканей, носа, увеличение надбровных дуг, подбородка, широкие кисти рук, которым артроз придает еще более неестественный вид. В результате роста гортани появляется низкий грубый голос. Кифосколиоз и сутулость дополняют картину, так что общий вид больного напоминает «дикого человека». Вначале характерны гипергликемия и глюкозурия, затем — гиперлипидемия. На ранних этапах диагноз акромегалии затруднен. Больные отмечают, что прежняя обувь, перчатки стали им тесны. В этих ситуациях полезно попросить пациента принести фотографии 2–3-летней давности. Характерны повышенная потливость и гиперпродукция сальных желез вследствие их гиперфункции. Усиленный рост мягких тканей затрагивает и внутренние органы. Характерны увеличенный в объеме язык, эутиреоидный зоб, расширение границ сердца, гепатоспленомегалия, увеличение объема почек и толстой кишки. Пролиферация соединительной ткани ведет к сдавлению нервов и развитию парестезий. Рост хрящевой ткани сопровождается развитием артрозов и кифоза. Увеличение доли гипофиза приводит к головной боли, диплопии, парезу отводящего нерва, выпадению полей зрения, поэтому в данном случае важно проведение офтальмологического обследования. Повышенное выделение гормона роста обусловливает нарушение утилизации глюкозы и развитие у отдельных больных латентного или клинически проявляющегося сахарного диабета. Изменение сердца в 2 раза по сравнению с общей популяцией повышает риск смерти от кардиальной патологии. Сдавление гипофиза растущей опухолью ведет к нарушению секреции гипофизарного гонадотропина, что сопровождается аменорреей или снижением потенции. В некоторых случаях описано повышение секреции кортикостероидов, так что возможно одновременное развитие акромегалии и синдрома Иценко — Кушинга. В поздних стадиях эозинофильная аденома вытесняет другие участки гипофиза, развивается пангипопитуитаризм, поэтому уже на этапе первоначально выявленной акромегалии следует определять функцию других эндокринных желез.
Диагноз «акромегалия» подтверждают определением уровня в крови соматомедина С до и после применения глюкозы в дозе 100 г, что приводит к супрессии соматотропного гормона. У здоровых людей через 2 ч после в/в капельного вливания глюкозы уровень соматотропного гормона в крови снижается до 93 пкмоль/л и ниже. При акромегалии уровень соматотропного гормона остается выше 140 пкмоль/л. Визуализация аденомы передней доли гипофиза возможна методом ЯМР, менее достоверна КТ. На поздних этапах возможно применение рентгенографии. Если при наличии изменений клинико-биохимических показателей изменений гипофиза выявить не удается, следует думать об эктопической паранеопластической продукции рилизинг-фактора гормона роста, чаще всего выявляемого при карциномах бронхов и поджелудочной железы.
Гипертиреоз и гиперпаратиреоидизм см. в соответствующих разделах.
Эозинофильная аденома гипофиза может быть частью синдрома множественной эндокринной неоплазии I типа (синдром Вермера). Синдром обусловлен изменениями гена, являющегося супрессором опухолей и расположенного на 11-й хромосоме. У 55–65% больных с синдромом множественной эндокринной неоплазии I типа выявляют опухоль гипофиза. Клинические проявления у этих пациентов ничем не отличаются от проявлений у больных со спорадической формой эозинофильной аденомы гипофиза.
Кардиоваскулярные симптоматические артериальные гипертензии
Повышение АД вызывается всеми состояниями, протекающими с увеличением объема сердечного выброса, увеличением объема циркулирующей крови и изменением эластичности сосудов.
Синдром гиперкинетического сердца характеризуется повышением АД (прежде всего его амплитуды) за счет повышения сердечного индекса до 6 л/мин/м2. Возникает в основном у мужчин молодого возраста, протекает с жалобами на боль в сердце, парестезии, одышку, быструю утомляемость, атипичную стенокардию. На ЭКГ как отражение гиперактивности миокарда регистрируются формальные признаки его гипертрофии, рентгенологически — усиленное кровоснабжение легких при неизмененном силуэте сердца, эхоГ — гипертрофия миокарда не выявляется. Состояние пациентов значительно улучшается при применении блокаторов β-адренорецепторов.
Доброкачественная семейная полиглобулия — редкое наследственное заболевание. Передается аутосомно-рецессивно, отмечены аутосомно-доминантные случаи, не исключается Х-сцепленный тип наследования. С детства регистрируют увеличение количества эритроцитов без повышения уровня эритропоэтина. Нет спленомегалии, нет лейкоцитоза и тромбоцитоза. Манифестная клиническая картина формируется только в зрелом возрасте и проявляется АГ, стенокардией, тромбозами, кровотечениями.
Склероз аорты обусловливает потерю ее эластичности и сопровождается повышением САД до 170–190 мм рт. ст. Но ДАД при этом не изменяется, поэтому пульсовое существенно возрастает. При клиническом обследовании выслушивается отчетливый акцент II тона над аортой и шум изгнания на основании сердца. При рентгенологическом исследовании определяется плотная расширенная аорта, иногда визуализируются отложения кальция.
Коарктация аорты в 3–4 раза чаще диагностируется у мужчин и составляет 5–8% всех врожденных пороков сердца. Ее признаками являются головная боль, головокружение, усиленная пульсация в области сердца, одышка напряжения, повышение АД только на руках или только на правой руке. Соответственно этому на лучевой (лучевых) артериях пульс высокий, напряженный, в то время как на бедренных артериях и на тыле стопы едва улавливается. При рентгенологическом исследовании сердце имеет аортальную конфигурацию, в ряде случаев удается увидеть коллатерали (узурация ребер). Но узурация ребер появляется только к 10–12 годам. Пульсация аорты до стеноза усилена, в брюшном отделе — снижена. Грубый систолический шум лучше выслушивается на основании сердца или в межлопаточной области, при открытом артериальном протоке шум систоло-диастолический. Если АД на ногах равно давлению на руках (обычно оно превышает давление на руках на 20 мм рт. ст. и более) или ниже, чем на верхних конечностях, то можно говорить о коарктации аорты. В зависимости от уровня стеноза аорты (до или после отхождения артериального протока) выделяют два типа коарктации:
- Ювенильный тип (предуктальный) характеризуется стенозом аорты до отхождения артериального протока после Truncus brachiocephalicus, проявляется уже в младенчестве или в раннем детском возрасте. Без хирургической коррекции быстро настает летальный исход. Стеноз обычно протяженный, часто сочетается с другими пороками. Артериальный проток лежит дистальнее и нередко остается незаращенным. Возможно формирование право-левого шунта с цианозом нижней половины тела.
- Постдуктальный стеноз (тип, характерный для взрослых) расположен после отхождения артериального протока. Протяженность стеноза обычно невелика. Если артериальный проток открыт, то возникает лево-правый шунт с переполнением сосудов легких. Прогноз любого типа сужения и выраженность престенотической гипертензии определяются степенью уменьшения диаметра аорты и развитием коллатералей. Важную роль в установлении диагноза играет допплерография. Аортография позволяет объективно определить место сужения и его протяженность.
Гипертензия при повышенном ударном и минутном объеме характерна для аортальной недостаточности (повышено только САД, ДАД может вообще не определяться). Быстрый и высокий пульс, диастолический шум на основании сердца, капиллярный пульс, симптом Мюссе, результаты эхоГ позволяют поставить правильный диагноз. В эту же группу симптоматических гипертензий может быть отнесена и АГ при полной атрио-вентрикулярной блокаде. Определяющим для диагноза являются выявление выраженной брадикардии и характерных изменений на ЭКГ. Сердечная недостаточность сопровождается снижением АД.
Нейрогенная АГ возникает при нарушении регуляции центрального или периферического звена. Например, при поражении депрессорного центра в продолговатом мозгу, после ранений мозга с повреждением IX или X пар черепно-мозговых нервов, при энцефалите, менингите, полиомиелите, опухолях мозга, полинейропатиях, отравлениях.
Гипертензия беременных может быть проявлением ранее не диагностированных заболеваний почек, наследственной идиопатической АГ. Каждый случай протеинурии, развившийся до 5 мес беременности, заставляет прежде всего исключать ранее не диагностированное заболевание почек. Такие типы АГ беременных не устраняются после родов, обычно остаются и изменения в анализах мочи. ДД этих АГ беременных с гестозами затруднена. Первичные гестозы (токсикоз беременных, нефропатия беременных, эклампсия) у первородящих развиваются в III триместр и проявляются протеинурией, отеками, АГ. После родов все симптомы исчезают. Развитие судорог свидетельствует о так называемой эклампсии. В период преэклампсии отмечают головную боль, тошноту, рвоту, нарушения зрения. Из осложнений известны отек легких, кровоизлияние в мозг, желтуха, печеночная кома, некроз канальцев и коры почки в итоге почечной гипоксемии с развитием олиго- и анурии. Очень редкой причиной АГ беременных может быть феохромоцитома (см. выше).
«Пищевые» и медикаментозные АГ уже упоминались при обсуждении роли глицирризиновой кислоты (солодка, некоторые виды жевательной резинки). Сюда же следует отнести и гипертензию у лиц, злоупотребляющих кофе, алкоголем (более 50 г/сут в пересчете на чистый этанол), а также возникающую при приеме гормональных контрацептивов. Кроме того, развитие АГ возможно при лечении глюкокортикостероидами.