При выявлении желтухи врач вполне справедливо в первую очередь предполагает патологию печени.
Печень — самый большой и метаболически очень активный орган нашего тела. Она состоит из множества микроскопических функциональных единиц (долек), объединенных центральной веной и портальной триадой. Каждая долька одета соединительной тканью. В центре дольки располагается так называемая центральная вена. От междольковых вен (система v. portae) в дольку проникают внутридольковые капилляры (синусоиды), сливающиеся с капиллярами междольковых артерий и впадающие в центральную вену. Каждая портальная триада — центр, а не периферия микрососудистого объединения, ацинуса. Печеночные же вены оказываются на периферии гексагональной портальной дольки. В зависимости от близости к питающим сосудам ацинус имеет три зоны. Область, ранее рассматривавшаяся как центральная в дольке, оказывается периферической (3-я зона) двух и более ацинусов.
Кровь поступает в печень по воротной системе и печеночной артерии. У взрослого человека в состоянии покоя через печень протекает 1120 мл крови в минуту, что составляет 2/3 от минутного объема крови. Кроме того, в печени находится густая сеть лимфатических сосудов.
Гепатоциты (клетки паренхимы печени) образуют балочки. Эти полигональные клетки, будучи собраны в пласты, распространяются радиально от портальной триады к центральной вене. Именно в гепатоцитах осуществляются основные метаболические процессы в печени. Они ответственны за синтез и выделение желчи, обмен углеводов, синтез липидов и выделение липопротеинов в кровь, образование мочевины, альбумина, факторов свертывания, ферментов, нейтрализацию токсинов, детоксикацию лекарственных препаратов и т. д. Функции гепатоцитов несколько варьируют в зависимости от их расположения в различных частях ацинуса. Глюконеогенез происходит преимущественно в 1-й зоне (рядом с портальной триадой), а гликолиз в 3-й зоне (рядом с центральной веной). Остается только поражаться пространственному распределению функций.
Транспорт желчи начинается по тончайшим канальцам, примыкающим к гепатоцитам. Они сливаются в итоге в межлобулярные протоки, оттуда в печеночный.
В синусоидах расположены четыре вида клеток. Эндотелиальные клетки отличаются от любого другого эндотелия множеством пор (фенестрация), напоминая базальную мембрану. Эндотелиальные клетки способны пропускать макромолекулы, захватывать различные вещества, синтезировать белки, влияющие на внеклеточный матрикс, и участвуют в обмене липопротеинов. Купферовские клетки происходят от клеток-предшественников костного мозга. Исполняя роль тканевых макрофагов, они удаляют токсины и модулируют иммунный ответ. Перисинусоидальные жиронакапливающие клетки Ито депонируют витамин А, синтезируют белки матрикса и могут превращаться в фибробласты. Они, видимо, являются начальным патогенетическим звеном фиброза печени. В небольшом количестве содержатся тканевые лимфоциты, выполняющие функции природных киллеров.
Внеклеточный матрикс состоит из коллагена, эластина, фибронектина, ламинина и других экстрацеллюлярных гликопротеинов. Функции матрикса и его роль в патологии печени изучены недостаточно.
При различных заболеваниях структура печени и соответственно ее функция могут тотально или избирательно изменяться. Алкоголь поражает все структуры печени. Острый вирусный гепатит манифестирует как гепатоцеллюлярный процесс, а первичный билиарный цирроз как нарушение секреции желчи.
Одним из наиболее частых печеночных синдромов, и достаточно ярким, является нарушение пигментного обмена — желтуха.
Термином «желтуха» называют повышение уровня билирубина в сыворотке крови с его отложением в тканях и их желтушным окрашиванием. В норме его концентрация ниже 20 мкмоль/л (1,2мг/дл). Желтушное окрашивание кожи и слизистой оболочки визуально диагностируют при уровне билирубина в крови выше 40 мкмоль/л. Искусственное освещение может маскировать желтуху и при более высоком уровне билирубина. При хорошем общем состоянии пациента следует сразу же исключить «ложную желтуху». Неумеренное употребление моркови, особенно ее сока, тыквы, мандаринов и некоторых других растительных продуктов, богатых ксантинами, применение пикриновой кислоты могут вызвать желтушное окрашивание кожи, прежде всего ладоней. Цвет склер, слизистой оболочки и мочи при этом практически никогда не меняется. При биохимическом исследовании уровень билирубина в пределах нормы.
Ежедневно в организме образуется около 0,3–0,5 ммоль билирубина. 80% его происходит из гемоглобина, освобождающегося при разрушении эритроцитов в ретикулоэндотелиальной системе. 1 г гемоглобина поставляет 60 мкмоль билирубина. Незначительная часть билирубина поступает из других цитохромов, прежде всего из предшественников гемина в костном мозгу. Заболевания с неэффективным гемопоэзом (талассемия, пернициозная анемия) сопровождаются интрамедуллярным образованием значительного количества билирубина и рассматриваются как шунтовые гипербилирубинемии.
При гемолитической желтухе печень не в состоянии связать весь билирубин и часть его остается циркулировать в крови. О неконъюгированной гипербилирубинемии говорят, если свободная фракция билирубина составляет более 15% общего билирубина. Здоровая печень — орган с большими резервными возможностями, поэтому даже при выраженном гемолизе уровень в сыворотке крови (неконъюгированного), не прошедшего через печень и не связанного с глюкуроновой кислотой билирубина редко превышает 70 мкмоль/л. Повышение уровня билирубина >85 мкмоль/л заставляет думать об одновременном поражении паренхимы печени или нарушениях оттока желчи. Неконъюгированной билирубин связан с белком (проба Эрлиха с добавлением спирта), не растворим в воде и поэтому не проникает через почечный фильтр в мочу. Уробилиноген при гемолитической желтухе поступает в мочу и в кал в повышенных количествах.
При паренхиматозной желтухе страдает внутри- печеночный механизм. Хотя способность к глюкуронированию билирубина сохраняется достаточно долго, нарушения внутриклеточной проницаемости обусловливают его появление в крови. В моче выявляют билирубинглюкоронид.
Холестатическая желтуха (вне зависимости от интра- или экстрапеченочного генеза) характеризуется невозможностью поступления сформированного в печени билирубинглюкоронида в кишечник. Повышение давления в желчевыводящей системе приводит к его поступлению в кровь. При полной блокаде желчных путей уробилиноген в моче и в кале не определяется (ахолия).
Выделяют следующие типы желтухи.
- Гемолитическая (см. главу Анемии).
- Паренхиматозная (гепатоцеллюлярная):
А. Негемолитическая преимущественно семейная гипербилирубинемия:
- неконъюгированные гипербилирубинемии: синдромы Криглера — Найяра, Жильберта — Мейленграхта, так называемые шунтовые билирубинемии;
- конъюгированные билирубинемии: синдромы Ротора, Дубина — Джонсона.
B. Инфекционный гепатит:
- острые формы (А-, В-, С- и др.), мононуклеозный, листериозный, лептоспирозный, цитомегаловирусный, герпетический и др.;
- хронические формы (подострый некротизирующий, хронические гепатиты В и С).
C. Токсический гепатит:
- при употреблении наркотических средств;
- алкогольный;
- после отравления бледными поганками, черной бузиной, фосфором, тетрахлоруглеродом, хлороформом и т. п.
D. Медикаментозный гепатит:
- токсический (дозозависимый);
- аллергический (дозонезависимый).
E. Застойная печень:
- болезнь Бада — Киари, правожелудочковая сердечная недостаточность, констриктивный перикардит.
F. Цирроз печени:
- макронодулярный (постнекротический);
- микронодулярный (портальный);
- билиарный.
G. Редкие формы:
- болезни накопления;
- ферментопатии.
- Холестатическая желтуха.
A. Внутрипеченочные формы:
- вирусный, алкогольный гепатит, септический шок;
- медикаментозная (токсическая и аллергическая);
- первичный билиарный цирроз;
- склерозирующий холангит;
- холангиокарцинома;
- семейный рецидивирующий холестаз;
- желтуха беременных.
B. Внепеченочные формы:
- холелитиаз;
- опухоли, в том числе фатерова сосочка и головки поджелудочной железы;
- стриктуры;
- паразитозы;
- панкреатит, псевдокисты поджелудочной железы.
Гемолитическая (надпеченочная, предпеченочная) желтуха возникает при гемолитической анемии, протекающей с гипербилирубинемией. Рассасывание массивных гематом, инфарктов способно вызвать незначительную преходящую гипербилирубинемию. ДД гемолитических желтух с другими видами желтух: наличие признаков гемолиза (снижение уровня гемоглобина и уменьшение продолжительности жизни эритроцитов; ретикулоцитоз; повышение уровня ЛГД из-за ее выхода из эритроцитов), нормальные показатели функции печени. Гемолитическая желтуха обычно выражена умеренно, уровень билирубина не превышает 85 мкмоль/л (в основном неконъюгированная фракция). Отсутствует билирубинурия (исключение — серповидноклеточная анемия), уровень уробилиногена в моче повышен.
Печеночная (паренхиматозная) желтуха имеет сложный патогенез. Изменяется захват билирубина и его глюкуронирование пораженным гепатоцитом, страдает транспорт билирубина по клетке и желчным капиллярам. Особняком стоит семейная гипербилирубинемия с изолированным клеточным нарушением элиминации билирубина. При всех остальных поражениях печени (вирусного, бактериального, токсического генеза) нарушения билирубинового (пигментного обмена) являются только фрагментом общего нарушения функций и структуры печени.
Холестатическая желтуха интра- или экстрапеченочная возникает соответственно при нарушениях экскреции гепатоцитами конъюгированного билирубина или при нарушениях его пассажа по внутри- и/или внепеченочным желчным протокам. Общими признаками холестаза являются кожный зуд, значительное повышение «холестатических» ферментов (щелочная фосфатаза, лейцинаминопептидаза) в сыворотке крови, слабо выраженные признаки цитолиза.
Острый внутрипеченочный холестаз без механической обструкции является результатом повреждения гепатоцитов инфекционными или токсическими агентами. Хронический внутрипеченочный холестаз с механической обструкцией свойствен атрезии внутрипеченочных желчных протоков, склерозирующему холангиту, метастазам опухолей в печень и карциноме внутрипеченочных желчных ходов.
Подпеченочный (внепеченочный) холестаз развивается при нарушениях оттока желчи по внепеченочным желчным протокам (синдром сгущения желчи, холелитиаз, стриктуры, опухоли, аномалии развития желчных протоков, опухоли головки поджелудочной железы, паразитарная инвазия).
При появлении у пациента желтухи важно собрать анамнестические сведения о возможных трансфузиях, инъекциях, контактах с кровью или носителями вирусов, возбудителей гепатитов, приеме алкоголя, наркотиков, лекарственных препаратов. В современных условиях массовой миграции населения представляют интерес сведения о поездках в регионы амебиазной инфекции (абсцессы печени), посещение очагов дифиллоботриоза. Общие симптомы в виде усталости, утомляемости, острого лихорадочного гриппоподобного начала с головной болью, артралгией, диспепсией, непереносимостью табака, алкоголя и жирной пищи до начала желтухи свидетельствуют о поражении печени. Неопределенные общие симптомы, длящиеся месяцами, анорексия и уменьшение массы тела чаще свидетельствуют об опухолевом генезе желтухи. Острая боль типична для холелитиаза, хотя у детей и лиц пожилого возраста возникает значительно реже, чем в зрелом возрасте. Тупая боль, ощущение тяжести в правом подреберье, реже интенсивная боль характерны для гепатитов, застойной печени, эхино- или альвеококкоза, холангита, абсцесса, опухолей. Безболевая желтуха более типична для опухолевой внепеченочной блокады желчеоттока. Лихорадка характерна для инфекционных поражений печени, причем чаще отмечается до развития желтухи. Интермиттирующая лихорадка сопровождает течение холангита и абсцесса печени. Если при заболеваниях печени врач не может объяснить причину лихорадки, необходимо исключить перитонит, флебит печеночных вен или тромбоз воротных сосудов.
Кожные проявления наряду с желтухой, сосудистыми «звездочками», прежде всего характеризующиеся зудом (нередко на коже выявляют расчесы и ссадины, обусловленные им), который при холестазе предшествовать может задолго до появления видимой желтушности. Кожный зуд, однако, не позволяет установить причину холестаза, не помогает дифференцировать внутри- и внепеченочные его формы. Оценка характера кала (ахоличный стул) в сочетании с темной окраской мочи помогают установить диагноз холестатической желтухи. Пальпация печени позволяет определить ее размеры, например увеличение и уплотнение при механической (внепеченочной) желтухе. При паренхиматозной желтухе печень увеличивается незначительно. Иногда при нарушениях оттока желчи из пузыря удается его пропальпировать в виде плотного тугого округлого образования (симптом Курвуазье), что, прежде всего, заставляет думать об опухоли. Гемолитическая и паренхиматозная желтухи сопровождаются спленомегалией, в то время как при механическом холестазе этот признак отсутствует. Асцит при гемолитической желтухе практически не развивается, возможен при острой тяжелой паренхиматозной желтухе и типичен для цирроза печени. Как итог хронического гепатита с исходом в цирроз или при подостром некротизирующем гепатите развиваются венозные коллатерали в виде варикозного расширения вен пищевода и «головы медузы».
Лабораторные исследования — одно из важнейших условий правильной диагностики различных форм желтух. Поскольку печень участвует во многих видах обмена, то нет ни одного универсального теста, требуется комплексное химико-иммунологическое исследование как ее функции, так и состояния клеточных мембран.
На сегодня установлено более 500 метаболических эндокринных функций печени, одна из важнейших — синтез белков, синтез альбуминов. В основном в печени синтезируются и альфа-1-, альфа-2-, бета-глобулины. При патологии в печени синтезируются и гамма-глобулины, хотя основным местом их синтеза является ретикуло-эндотелиальная система.
Альбумины играют ведущую роль в поддержке онкотического давления крови, транспортировке веществ, слаборастворимых в воде. В норме содержание альбуминов в крови составляет 32–55 г/л.
Альфа-1-глобулины — до 90% синтезируются в печени, они богаты липопротеидами. В норме содержание альфа-1-глобулинов в крови составляет 1–4 г/л.
Альфа-2-глобулины. В печени синтезируется до 75% их общего количества. Содержат большое количество глико- и липопротеидов. В норме содержание альфа-2-глобулинов в крови составляет 5–9 г/л, повышаясь при холестазе.
Бета-глобулины — до 50% синтезируются в печени. Обычно эта фракция белка увеличивается при холестазе. В норме содержание бета-глобулинов в крови составляет 6–10 г/л.
Гамма-глобулины в основном представляют собой антитела и синтезируются вне печени. Однако при патологических условиях гамма-глобулины начинаются синтезироваться плазматическими клетками, входящими в воспалительные инфильтраты портальных полей печеночной дольки. В норме содержание гамма-глобулинов составляет 8–17 г/л. Выделяют 5 основных классов иммуноглобулинов (Ig): A, G, D, Е, М. В практике гепатолога широко используется определение IgA, IgG, IgM. IgG — основной иммуноглобулин в сыворотке крови. Концентрация его в сыворотке крови составляет 6— 17 г/л, осуществляет важные защитные функции в отношении патогенных микроорганизмов и токсинов в сосудистом русле и в экстраваскулярных пространствах. IgM содержится в основном в сосудистом русле, играет важную защитную роль на ранних этапах бактериальных инфекций. IgA составляет менее половины иммуноглобулина, содержащегося в организме. Основная его часть в секретах (молоко, секреты кишечного и респираторного трактов, желчь, слюна).
Хронические вирусные заболевания печени сопровождаются преимущественным повышением содержания IgG и IgM, алкогольные — IgA. Для первичного билиарного цирроза особенно характерно повышение уровня IgM. При хронических активных заболеваниях печени отмечают поликлоновую гипериммуноглобулинемию (повышены показатели всех основных классов — A, G, М), что отличает этот тип заболеваний от парапротеинозов, характеризующихся повышением уровня моноклональных иммуноглобулинов. Но в целом иммунологические тесты при заболеваниях печени свидетельствуют только о степени активности процесса, а не о его специфичности. Относительно специфичным является только повышение уровня антимитохондриальных антител при первичном билиарном циррозе печени.
Фибриноген, играющий важную роль в процессах свертывания крови, также синтезируется в печени. В норме содержание фибриногена в крови составляет 5,9–11,7 мкмоль/л. Уровень белка закономерно снижается при тяжелых острых и хронических поражениях печени токсического или вирусного генеза. При заболеваниях печени снижается концентрация протромбина (протромбиновый индекс в норме составляет 90–100%). Для поддержания нормального уровня протромбина необходимо два фактора: достаточное поступление витамина К и интактные гепатоциты. Если нарушается один из двух указанных факторов — уровень протромбина в сыворотке крови снижается. Нарушение всасывания витамина К в кишечнике происходит при обтурационой желтухе. Для ДД причин снижения протромбина в сыворотке крови производят в/м инъекцию водорастворимой формы витамина К (менадион натрий бисульфит). Нормализация уровня протромбина свидетельствует о сохранности функций печени. Если через 12–24 ч после инъекции препарата уровень протромбина в крови не изменяется или изменяется незначительно, то есть основания говорить о поражении паренхимы печени (гепатит или цирроз). При острой дистрофии печени в крови вначале снижается уровень витамин- К-зависимых факторов свертывания: II, VII, IX и X. Снижение уровня фибриногена или V фактора, независимых от витамина К, является прогностически неблагоприятным фактором.
Не менее важную роль играет печень и в углеводном обмене — поддержании стабильного уровня гликемии. В норме содержание глюкозы в сыворотке крови составляет 4,4–6,6 ммоль/л. Тяжелые заболевания печени, в первую очередь гепатоцеллюлярная карцинома, тяжелый острый гепатит, приводят к развитию гипогликемии. Это же состояние развивается и при гликогенозах, при которых в печени накапливается обычный или патологический гликоген. Определение его концентрации и структуры в клетках печени позволяет установить правильный диагноз. Углеводный обмен печени достовернее всего характеризует тест с нагрузкой галактозой с последующим определением ее в крови.
Липидный обмен в печени включает синтез липопротеидов и сложных липидов, в первую очередь холестерина, а также желчных кислот, ряда стероидных гормонов. В печени происходят многочисленные преобразования липидов, она участвует в обмене простых (жиры) и сложных липидов. Важнейший показатель липидного обмена — уровень холестерина и его производных в сыворотке крови. В норме уровень общего холестерина в сыворотке крови составляет 3,07–7,7 ммоль/л. Холестеринсинтезирующая функция печени достаточно устойчива к различным острым повреждениям органа. Исключение составляют острые сосудистые катастрофы («шоковая печень») и острые интоксикации, при которых достаточно часто отмечают гипохолестеринемию. Гипохолестеринемня также возможна при декомпенсированном циррозе печени, высокой активности хронического гепатита.
Концентрация желчных кислот в крови закономерно повышается при холестазе, особенно значительно при длительно существующем холестазе любого происхождения. Наиболее достоверные результаты определения концентрации желчных кислот дает радиоиммунологический метод.
Жирные кислоты в организме содержатся либо в свободном состоянии, либо являются элементами большинства липидов. При повреждении печени они начинают накапливаться в сыворотке крови, оказывая токсическое воздействие на ЦНС. В норме содержание линолевой кислоты составляет 20,39±0,2% всех жирных кислот, а арахидоновой кислоты — 3,22±0,27%. Особенно выраженные нарушения липидного обмена (гиперлипидемию) отмечают при холестазе. В крови повышается концентрация холестерина, желчных кислот, бета-липопротеидов (в норме 3,0–4,5 г/л), триглицеридов (1,02–2,04 ммоль/л) и фосфолипидов (1,5–3,5 г/л). Выраженные нарушения липидного обмена сопровождают алкогольную интоксикацию, алкогольную болезнь печени.
Высокий уровень железа в сыворотке крови типичен для острого гепатита (при исключении гемолиза) как следствие цитолиза. Отличием гемохроматоза, также протекающего с повышением уровня железа (и поражением печени, кстати) является фактически предельное насыщение трасферрина (более 80%) и очень высокие показатели ферритина в сыворотке крови (>1000 мкг/л).
Определение уровня ферментемии имеет важнейшее значение в диагностике заболеваний печени.
АсАТ, АлАТ, альдолазы, сорбитдегидрогеназа и другие находятся в цитоплазме гепатоцитов. Повышение их активности в сыворотке крови свидетельствует об изменении проницаемости клеточной мембраны. Повышение активности глутаматдегидрогеназы и частично АсАТ отражает процесс цитолиза, некроза клеток, хотя их активность повышается также при обтурационной желтухе. При повышенной активности трансаминаз необходимо исключить инфаркт миокарда (уровень ферментов нормализуется через несколько дней), легких, заболевания мышц, гемолитическую и пернициозную анемию, опухоли, тяжелые нарушения обмена веществ при сахарном диабете. При исключении внепеченочных причин гипертрансаминаземии можно с уверенностью говорить о повреждении гепатоцитов. Наиболее высокие уровни АсАТ и АлАТ выявляют при остром гепатите, обострении хронического гепатита, токсическом или медикаментозном гепатите. При остром вирусном гепатите уровень АлАТ обычно выше, чем АсАТ (АсАТ:АлАТ<1). При алкогольной болезни печени, наоборот, уровень АсАТ значительно превышает уровень АлАТ (АсАТ:АлАТ>3). При острой обтурационной желтухе активность обеих трансаминаз повышается, но не более чем в 10 раз по сравнению с нормой. Кроме вне- и внутрипеченочных холестазов, активность трансаминаз повышается при токсических повреждениях печени, инфекционном мононуклеозе, реактивном гепатите, застойной кардиальной печени, циррозе. Поэтому нет смысла при каждом умеренном повышении активности трансаминаз предполагать вирусный гепатит.
Секреторные ферменты образуются в печени и поступают в кровь. К ним относятся факторы свертывания крови и холинэстераза, снижение уровня которых свидетельствует о тяжелых диффузных процессах в паренхиме печени.
Экскреторные энзимы секретируются в гепатоцитах и поступают в желчь: лейцинаминопептидаза и 5-нуклеотидаза. Одновременное повышение уровней обоих ферментов свидетельствует о внутри- или внепеченочной обструкции желчных путей. Очень чувствительна, но не специфична гамма-глутамил-транспептидаза. Ее уровень повышается также на фоне приема алкоголя или лекарственных средств, индуцирующих микросомальные ферменты. Щелочная фосфатаза в сыворотке крови — группа ферментов разнообразного происхождения. Повышается, кроме заболеваний печени, при болезни Педжета, остеомаляции (рахите), гиперпаратиреоидизме, метастазах. Повышение активности фермента обусловлено тем, что щелочная фосфатаза в сыворотке крови в значительной мере состоит из остеогенной фосфатазы, образующейся в остеобластах. Для ДД остеогенного или билиарного происхождения фосфатазы необходимо определить уровни 5-нуклеотидазы и лейцинаминопептидазы. Нормальный уровень билирубина в сыворотке крови на фоне повышения уровня экскреторных ферментов свидетельствует о частичной закупорке желчных путей или об очаговых поражениях печени. Повышение уровня билирубина при значительном одновременном повышении экскреторных ферментов указывает на полную обструкцию внутри- или внепеченочных желчных ходов.
Исследование мочи имеет большое значение в диагностике заболеваний печени. Билирубинурия исключает гемолитическую желтуху. Билирубин в моче присутствует при гепатоцеллюлярных и обструкционных желтухах, синдромах Дубина — Джонсона и Ротора. Отсутствие в моче уробилина при наличии билирубина свидетельствует о полной закупорке желчных путей. Хотя этот же признак выявляют и при паренхиматозной желтухе.
ЭхоГ и КТ позволяют визуализировать многие патологические процессы печени. ЭхоГ является методом выбора при диагностике холелитиаза, холецистита, очаговых поражений печени и поджелудочной железы (опухоли, кисты, ангиомы, крупные узлы регенерации при хроническом гепатите), а также в диагностике начальных проявлений асцита. Допплерография позволяет оценить кровоток в воротной вене, выявить тромбоз печеночной артерии (после трансплантации), или кавернозную трансформацию v. portae. Образования диаметром 1–2 см и более одинаково хорошо выявляют эхоГ и КТ. Небольшие по диаметру абсцессы, узлы выявляют с помощью ЯМР. Однако диагностическую ценность эхоГ и КТ в выявлении диффузных процессов (липодистрофия, начальные этапы цирроза, болезни накопления) признают не все. Хотя динамические наблюдения позволяют с приемлемой степенью надежности выявлять болезни накопления. В этих случаях целесообразнее применить ЯМР, лапароскопию или прицельную биопсию печени. Внепеченочные холестазы, состояние внутрипеченочных желчных ходов наилучшим образом диагностируются с помощью эндоскопической или транскутанной ретроградной холангиопанкреатографии.
Сканирование печени с изотопом технеция (99mТс) основано на быстром захвате изотопа ретикулоэндотелиальными клетками и в норме равномерным распределением в печени. При объемных образованиях >4 см (опухоль, метастазы, абсцесс, киста) определяется «холодный» очаг. Диффузные болезни печени (гепатит, цирроз) характеризуются неравномерным замедленным накоплением изотопа и его усиленным накоплением в селезенке и костном мозгу. При обструкции воротной вены накопление изотопа в паренхиме печени значительно снижено, за исключением хвостатой доли благодаря ее отдельному дренажу в нижнюю полую вену. Но в целом изотопное сканирование печени сейчас значительно уступает возможностям УЗИ диагностики или КТ.
Комплексное использование биохимических проб и методов визуализации позволяет сгруппировать разнообразные проявления поражений печени в четыре основных синдрома:
- синдром цитолиза. Повышение уровней трансаминаз, билирубина в сыворотке крови. Выявляют при остром и хроническом гепатите. Диагноз верифицируется прецизионной биопсией печени;
- мезенхимальный синдром. Повышение уровня гамма- и иммуноглобулинов в крови. Выявляют при хроническом активном гепатите, циррозе печени. Подтверждается лапароскопией и прицельной биопсией;
- синдром холестаза. Повышение активности щелочной фосфатазы, лейцинаминопептидазы, 5-нуклеотидазы, позднее уровней билирубина и холестерина в сыворотке крови. Выявляют при внутри- и внепеченочной обструкции желчных путей. Подтверждается эхоГ, КТ, ЯМР, лапароскопией, ретроградной холангиопанкреатографией;
- синдром паренхиматозной (гепатоцеллюлярной) недостаточности. Снижение уровня альбуминов, протромбина, холинэстеразы, повышение уровня билирубина. Типичен для цирроза печени, острой дистрофии печени. Морфологическое подтверждение затруднено, поскольку из-за высокого риска развития кровотечения биопсия печени не проводится.
Частная ДД желтух
Диагностику гемолитических желтух см. выше.
Идиопатическая негемолитическая гипербилирубинемия объединяет большую группу патологических состояний, развитие которых обусловлено нарушением внутриклеточного транспорта билирубина. При этом отсутствуют признаки гемолиза или заболеваний печени. Большинство из них (важнейшее исключение — синдром Криглера — Найяра) доброкачественны. Их важно учитывать прежде всего для ДД с более тяжелыми заболеваниями. Эти гипербилирубинемии возникают как за счет прямого, так и непрямого билирубина.
Доброкачественные гипербилирубинемии или пигментные гепатозы — группа заболеваний без выраженного изменения структуры и функции печени и без явных признаков гемолиза и холестаза, обусловлены нарушением обмена билирубина, что проявляется стойкой или перемежающейся желтухой.
Сводные ДД признаки доброкачественных гипербилирубинемий представлены в табл. 24.1.
Таблица 24.1
Основные проявления функциональных гибербилирубинемий
| Синдром — признаки | Криглера — Найяра I | Криглера — Найяра II | Жильбера | Мойленграхта | Дубина — Джонса | Ротора | Постгепатическая функциональная желтуха | Физиологическая желтуха новорожденных | Доброкачественный семейный возвратный холестаз | Болезнь Байлера (злокачественный семейный холестаз) | Люси — Дрисколл | |
| Тип наследования | а/р | а/р | а/р | а/р | а/р? | а/р? | ? | ? | а/р | а/р?
а/д? |
а/р?
а/д? |
|
| Возраст манифестации | Неонатальный | Неонатальный | В течение всего детства | Пубертатный | 10–25-е годы жизни | От рождения до пубертатного | До 30-го года жизни | 2–3-й дни жизни | Часто к концу 2-й декады жизни | На 1 -й неделе жизни | Первые дни жизни | |
| Половая принадлежность | Не выражена | Не выражена | Андротропия | Андротропия | Андротропия | Андротропия | Андротропия | Не выражена | Не выражена | Не выражена | Нет достоверных сведений | |
| Основной симптом | Ядерная желтуха | Ядерная желтуха | Субиктеричность | Вялость, диспепсия, пигментация по типу naevi | Диспепсия, иногда колики | Как Дубина — Джонса | Тяжесть в правом подреберье, вегетативная лабильность | Легкая интеричность, снижено потребление воды | Повторные приступы желтухи | Зуд, геморрагии, тромбоцитопения, диарея, стеторея | Ядерная желтуха | |
| Течение желтухи | Тяжелое, прогрессирующее | Средней тяжести, часто прогрессирующее | Постоянное или интермиттирующее | Постоянное или интермиттирующее | Постоянное или интермиттирующее | Постоянное или интермиттирующее | Интермиттирующее, убывающее | Исчезает в течение ближайших 10 дней | Интермиттирующее | Прогрессирующее, интермиттирующее | Тяжелое | |
| Гепатомегалия | +++ | +/- | ++ | ++ | +++ | +/- | +/- или — | +/- или — | +++ | ++++ | +++ | |
| Спленомегалия | Нет | Нет | + или — | — | — или + | — | — | — | — | +++ | + | |
| Биопсия печени | Желчные тромбы, перипортальный цирроз | Желчные тромбы, перипортальный фиброз | Норма | Темно-коричневый мелкозернистый пигмент | Темно-коричневый грубозернистый пигмент в центре долек | Норма | Темно-коричневый мелкозернистый пигмент в центре долек | Норма | Холестаз | Перипортальный фиброз, пролиферация желчных протоков | Нет сведений | |
| Общий билирубин непрямой конъюгированный | 200 мг/л
90 % ? |
200 мг/л
90 % ? |
80 мг/л
70 % 30% |
80 мг/л
70 % 30% |
100 мг/л
50 % 50% |
100 мг/л
50 % 50% |
80 мг/л ?
? |
100 мг/л
90 % |
? | До 300 мг/л
50% 50 % |
До 100 мг/л
90% |
|
| Билирубинурия | Нет | Нет | — | — | — или +/- | — или +/- | — | — | +++ | ++ | — | |
| Уробилиногенурия | Нет | Нет | + | +/++ | + | +/- | — или + | — | +++ | — | — | |
| Проба с бромсульфталеином | Норма | Не изменена | Редко увеличена задержка | В целом не изменена | Усилена задержка | Усилена задержка | Редко — задержка | Транзиторно снижена незначительно | ? | Значительная задержка | ? | |
| Холецистография | Норма | Норма | Норма | Норма | Пероральная нагрузка негативная | Безуспешна | Норма | Норма | Норма | Снижена, возможен холелитаз | ? | |
| Активность глюкоронилтрансферазы | Полностью отсутствует | Уменьшена | Снижена? | Снижена | Норма | Норма | ? | Уменьшена | Норма | ? | Норма, в крови и моче — ингибитор конъюгации билирубина |
Непрямая (неконъюгированная) гипербилирубинемия
Синдром Жильбера (болезнь Мойленграхта. Некоторые авторы рассматривают оба состояния как самостоятельные). Этот вид врожденной негемолитической желтухи передается а/д. Впервые описан в 1901 г. Жильбером. Заболевание обусловлено нарушением захвата билирубина на сосудистом полюсе гепатоцита и нарушением его транспорта к микросомам эндоплазматического ретикулума гепатоцита. Чаще болеют мужчины. Синдром нередко ассоциируется с генерализованной дисплазией соединительной ткани (особенно часто по типу синдромов Марфана или Элерса — Данлоса). Клинические признаки появляются впервые в период полового созревания. Когда болезнь проявляется в более старшем возрасте, ее необходимо дифференцировать с постгепатической гипербилирубинемией. Расспрос больного о наличии желтух у родственников в анамнезе может оказать помощь в установлении диагноза. При обследовании выявляют умеренную желтуху (чаще иктеричность склер на фоне матово-желтушной кожи, особенно лица). Иногда отмечают частичное окрашивание носогубного треугольника, ладоней, подмышечных впадин, стоп). Описывают пылающие и пигментные невусы, пигментацию век, астенический синдром (депрессия, неспособность концентрировать внимание, повышенная утомляемость, слабость, плохой сон и т. д.). У ½ больных скрытый гемолиз (группа риска по холелитиазу). Желтуха усиливается при голодании, инфекции, приеме алкоголя, тяжелой физической и умственной работе. Размеры печени и селезенки остаются, как правило, нормальными. Содержание билирубина в сыворотке крови колеблется от 0,02 до 0,04 г/л. Повышение его уровня происходит за счет непрямой фракции. Билирубинурия отсутствует. Определение уровня печеночных ферментов не имеет решающего диагностического значения. Как и при других видах доброкачественных гипербилирубинемий, печень сохраняет гистологическое строение, близкое к норме. Признаков диспротеиноза, некроза гепатоцитов обычно не выявляют. При проведении ДД синдрома Жильбера имеет значение тест с ограничением энергетической ценности пищи: резкое ограничение энергетической ценности пищи в течение 48 ч вызывает повышение уровня неконъюгированного билирубина. Тест проводится следующим образом. В течение 48 ч больной получает питание энергетической ценностью 400 ккал/сут. В день начала пробы утром натощак и спустя 2 сут определяют уровень билирубина в сыворотке крови. При его повышении на 50–100% проба считается положительной.
ДД синдрома Жильбера в первую очередь проводят со всеми типами неконъюгированной билирубинемии, синдромом Криглера — Найяра II типа, шунтовой билирубинемией (неэффективный гемопоэз с интрамедуллярным образованием значительного количества билирубина или талассемия, пернициозная анемия), гемолитической желтухой и хроническим гепатитом. При гемолитической желтухе клинические признаки появляются в возрасте до 10 лет, а при синдроме Жильбера в юношеском возрасте. Для наследственного микросфероцитоза характерны спленомегалия и умеренная анемия. Степень повышения билирубина при синдроме Жильбера ниже, чем при гемолитической желтухе, при которой отмечают понижение осмотической резистентности и значительное уменьшение продолжительности жизни эритроцитов, изменение их морфологии, ретикулоцитоз, повышениеэкскрецииуробилиновыхтел. Пункционная биопсия печени позволяет отдифференцировать синдром Жильбера от хронического гепатита.
Синдром Криглера — Найяра, или семейная негемолитическая желтуха новорожденных. Впервые описан в 1952 г. Обусловлен нарушением процесса конъюгации билирубина с глюкуроновой кислотой вследствие дефицита глюкоронилтрансферазы. Различают две генетически гетерогенные формы болезни.
При первой форме синдром наследуется а/р. Обусловлен практически полным отсутствием фермента уридин-дифосфат-глюкоронил-трансферазы (УДФГТ). Интенсивная, часто ядерная желтуха обусловлена 20–30-кратным повышением уровня непрямого билирубина в сыворотке крови. Развивается в первые часы и дни жизни ребенка. На первый план выступают симптомы поражения ЦНС: мышечная гипотония, нистагм, опистотонус, атетоз, тонические и клонические судороги, отставание в физическом и умственном развитии. Гематологические показатели остаются в пределах нормы. Билирубинурия отсутствует, количество уробилиновых тел в моче и кале невелико. Неэффективно применение фенобарбитала или глутетимида — индукторов микросомальных ферментов. Больные редко доживают до 1,5 года.
При второй форме синдром наследуется а/д. Присутствует УДФГТ, хотя активность фермента значительно снижена. Интенсивность желтухи менее выражена. Ядерная желтуха не развивается. Эффект фототерапии, индукторов микросомальных ферментов хороший. Уровень непрямой фракции билирубина в сыворотке крови повышается в 5–20 раз. Желчь окрашена, в кале определяется большое количество уробилиногена. Больные доживают до 50 лет и более, но в отдаленный период, особенно при позднем лечении, нередки глухота, хореатетоз, нейромышечные и личностные отклонения, гипоплазия зубов.
ДД синдрома Криглера — Найяра проводят с синдромами Жильбера — Мойленграхта, Дубина — Джонсона, Ротора, Люси — Дрисколла, ядерной желтухой новорожденных любой этиологии, врожденными цирррозом и гепатитом, атрезией желчных ходов или тонкого кишечника.
Физиологическая желтуха новорожденных в отличие от синдрома Криглера — Найяра развивается на 2–3-й день жизни, достигает максимума к 4–6-му дню и самостоятельно устраняется к 10-му дню. Особенно отчетлива у недоношенных или инфицированных младенцев. Обусловлена нефункциональной незрелостью печени, преходящей ферментной недостаточностью с неспособностью захватить и связать весь билирубин, образующийся при физиологическом распаде избытка эритроцитов, свойственного плоду. ДД с желтухой новорожденных, обусловленной гемолизом различного происхождения (изоиммунизация матери вследствие несовместимости крови матери и плода, наследственная микросфероцитарная анемия, недостаточность ферментов эритроцитов), проводят на основании выявления признаков гемолиза (анемия, ретикулоцитоз, уменьшение продолжительности жизни эритроцитов и изменение их формы, несовместимости групп крови).
Первичная семейная гипербилирубинемия
Возникает очень редко, обусловлена интрамедуллярным гемолизом предшественников эритроцитов. Уровень гемоглобина в крови не изменен, ретикулоцитоз умеренный, продолжительность жизни эритроцитов не изменена. Выделение уробилиногена с мочой и стулом повышено.
Синдром Дрисколла — семейная форма преходящей гипербилирубинемии новорожденных за счет стероидных тел в плазме крови матери, блокирующих конъюгацию билирубина. Близкое (но не семейное) состояние известно у некоторых детей при вскармливании грудным молоком, в котором может содержаться неидентифицированный фактор, препятствующий глюкуронированию билирубина.
Прямая (конъюгированная) гипербилирубинемия
Синдром Дубина — Джонсона. Описан в 1954 г. Передается а/p. Проявляется хронической негемолитической желтухой с повышением уровня связанного (конъюгированного, или прямого) билирубина в сыворотке крови. Часто начинается в период полового созревания, но может начаться в любом возрасте. Желтуха носит хронический или интермиттирующий характер, содержание билирубина не превышает 0,06 г/л. Обострение желтухи проявляется болью в правом подреберье, общей слабостью, развивается при наслоении инфекций. В период ремиссии желтуха почти полностью исчезает. Печень умеренно увеличена, плотноватой консистенции. В ½ всех случаев пальпируется селезенка. Активность ферментов сыворотки крови и осадочные функциональные пробы печени остаются в норме. В моче выявляют желчные пигменты. Признаки гемолиза отсутствуют. Бромсульфалеиновая проба изменена. При применении бромсульфалеина его содержание в крови быстро снижается, чтобы затем вновь подняться, и на 90-й и 120-й минуте концентрация превышает таковую на 45-й минуте. То есть происходит нормальный захват красителя с затруднением высвобождения из клеток печени. Достоверно диагноз можно установить при пункционной биопсии, выявляющей отложение в клетках печени крупнозернистого меланиноподобного пигмента темно-коричневого цвета. При лапароскопии печень зеленовато-коричневая, желчный пузырь не изменен.
ДД проводят с хроническим гепатитом и циррозом печени, синдромами Мойленграхта, Ротора, Кароли (кистозное расширение желчных ходов), синдромом (симптомокомплекс) Циве.
Синдром Циве развивается у лиц, злоупотребляющих алкоголем, симптомокомплекс с гемолитической анемией, гиперлипидемией, желтухой.
Вариантом синдрома Дубина — Джонсона (или самостоятельной единицей?) является синдром Бюрка. При нем также выявляют липохромный гепатоз, но БЕЗ желтухи, хотя и со значительной гепатоспленомегалией.
Синдром Ротора — семейная негемолитическая желтуха — описан в 1948 г. Передается а/p. Протекает с преимущественным повышением уровня связанного билирубина в сыворотке крови при нормальной гистологической картине печени. Болезнь протекает как длительная желтуха с умеренным повышением уровня конъюгированного билирубина при нормальных показателях функции печени и хорошим контрастированием желчного пузыря при холецистографии. ДД с синдромом Дубина — Джонсона проводят на основании пункционной биопсии, поскольку при синдроме Ротора никогда не выявляют темного пигмента в клетках печени.
Острая гепатоцеллюлярная желтуха требует проведения ДД с вирусными гепатитами и токсическими и/или медикаментозными поражениями печени. Среди токсических поражений печени первое место занимает алкогольный гепатит, алкогольная жировая дистрофия и цирроз печени.
Частота вирусных гепатитов с каждым годом возрастает в драматической прогрессии. В Европе количество лиц с антителами против вируса гепатита А составляет 10–20%, в Москве не менее 75% всех жителей в возрасте старше 20 лет, в Юго-Восточной Азии еще выше. То есть распространенность гепатита А коррелирует с культурно-гигиеническими характеристиками общества. На сегодня в мире по данным ВОЗ насчитывают более 500 млн носителей вируса гепатита В и более 300 млн — гепатита С. Выделяют 7 типов вирусных гепатитов: А, В, С, D, Е, F, G. Но уже появились сведения о выделении гепатита Т (от греческого «тета»). Алфавит не завершен. Когда не хватит латинского и греческого, добавят китайский.
При этом до 1989 г. лишь гепатиты А и В идентифицировали на основании клинико-лабораторных данных, а остальные объединялись общим понятием «гепатит ни А, ни В». В последние 5–7 лет стало доступным лабораторное выявление маркеров всех видов вирусов, кроме гепатита F. Хронизация процесса происходит в случаях гепатитов В, С и D, имеющих преимущественно парентеральный путь инфицирования. Для гепатитов А и Е хронизация заболевания не характерна, а гепатиты F и G пока недостаточно изучены.
Вирусные гепатиты с фекально-пероральным путем передачи
Острый вирусный гепатит А (HAV-гепатит, инфекционный гепатит, болезнь Боткина). Вызывается РНК-вирусом, который выявляют в стуле за 1–2 нед до манифестации болезни. Основные источники заражения — вода и пища, однако возможен и контактный путь передачи. В эпидемиологически неблагополучных районах основной контингент больных — дети. Клиническая картина гепатита А весьма близка к проявлениям всех видов вирусных гепатитов. Преджелтушную стадию диагностируют редко. Наличие соответствующего эпиданамнеза облегчает задачу. В продромальной стадии отмечают общую слабость, разбитость, анорексию, тошноту, гриппоподобные жалобы, артралгию, уртикарию. Инкубационный период короток и составляет в среднем 21–25 дней. Появление желтухи облегчает диагностику. Нередко увеличиваются размеры печени, чуть позже селезенки. Возможно увеличение ЛУ. Прогностически неблагоприятно сочетание молодого возраста пациента и анатомически небольшой печени.
В крови выявляют лейкопению, плазматические клетки. Уровень билирубина в сыворотке крови обычно не превышает 340 мкмоль/л. Билирубинурия проявляется потемнением мочи, характерен ахоличный кал. При биохимическом исследовании крови определяют повышение уровня трансаминаз. Но если выявляют гаммаглобулинемию, есть основания считать, что врач столкнулся не с острым гепатитом А, а с обострением хронического гепатита другого вида или с ухудшением течения цирроза. Заболевание вирусным гепатитом А протекает обычно благоприятно. Специфическая диагностика вирусного гепатита А основана на выявлении anti-HAV IgM. Антитела к вирусу гепатита А могут сохраняться у переболевшего на протяжении всей жизни. Антитела класса IgM свидетельствуют о свежей инфекции, класса IgG о сравнительно давно перенесенной. На основании лишь эпидемиологических и клинических данных идентификация вирусного гепатита А невозможна. Безжелтушные формы гепатитов протекают так же, как и желтушные, однако отсутствие основного симптома — желтухи — затрудняет диагноз. Он основывается на выявлении повышенной чувствительной печени и данных лабораторных исследований.
Острый вирусный гепатит Е (HEV-гепатит) вызывается РНК-вирусом, передается преимущественно через воду. Инкубационный период болезни составляет в среднем 30–35 сут. Распространен в районах арычного водопользования, в свайных поселениях. Клиническая картина напоминает гепатит А. Летальные исходы отмечают у детей и беременных. Случаи хронизации процесса и развития рака печени не известны. Методом специфической диагностики является выявление в крови anti-HEV и anti-HEV IgM.
Вирусные гепатиты с парентеральным путем заражения
Острый вирусный гепатит В (HBV-гепатит, сывороточный гепатит) вызывается ДНК-вирусом. Заражение происходит парентеральным путем (инъекции, переливание крови, гемодиализ), однако возможен половой путь передачи, а также перинатальный: от матери к новорожденному. В семьях гепатит В передается при пользовании общей посудой (через 5 лет после начала контакта инфицированной обычно бывают все члены семьи). В странах с широким распространением одноразового медицинского инструментария и надежным контролем препаратов крови распространенность гепатита В ниже, чем в экономически неблагополучных регионах. Инкубационный период заболевания длительный, в среднем 60 дней. Клиническое течение гепатита тяжелое, нередко развиваются молниеносные, атипичные и хронические формы, а также вирусоносительство. До ½ всех случаев фульминантного течения гепатита В связано с коинфекцией вируса гепатита D. Методы специфической диагностики — выявление в крови HBsAg и anti-HBcIgM (диагностика возможна при высоких концентрациях anti-HBc). Строение вируса гепатита В сложно. Он состоит из наружной оболочки и ядра, включающего ДНК, ДНК-полимеразу и концевой (коровский) белок. Наружная липопротеиновая оболочка вируса представлена поверхностным антигеном (HBsAg) — первым серологическим маркером гепатита В. В настоящее время термин «австралийский антиген» не применяют. Антитела к HBsAg (anti-HBs) появляются в конце острого периода болезни и сохраняются до 10 лет. Anti-HBs обладают способностью нейтрализовать вирус и рассматриваются как признак иммунитета.
Ядерный (коровский) белок (HBc-Ag) непосредственно в крови инфицированных не определяют, однако anti-HBc появляются первыми среди других антител. Для острого гепатита В характерны высокие титры anti-HBc.
HBe-Ag является растворимым компонентом ядерного белка. Его выявление в сыворотке крови свидетельствует о размножении (репликации) вируса. Как при острых, так и при активно текущих хронических гепатитах, происходит репликация вируса В, что представляет угрозу здоровью носителя или больного, а кровь в этих случаях особенно заразна. Лабораторными показателями репликации служат anti-HBc IgM, HBeAg, ДНК-полимераза и ДНК HBV. Последняя определяется ПЦР и служит самым надежным показателем репликации вируса.
У лиц, перенесших острый вирусный гепатит В, выявляют anti-HBs (указывают на наличие иммунитета) и anti-HBc в небольших титрах.
Острый вирусный гепатит С (HCV-гепатит) ранее классифицировался как гепатит «ни А, ни В», занимая в этой группе гепатитов до 90% всех случаев. В США антитела к вирусу гепатита С выявлены у 1,4% общей популяции и 0,7% доноров. В отдельных популяциях Африки, Ближнего и Среднего Востока распространенность вируса значительно выше: он поражает до 4–6% населения. Гепатит С вызывается РНК-вирусом, идентифицированным в 1989 г. Заражение происходит парентеральным путем (40–50% всех случаев обусловлены введением лекарственных средств или наркотиков; частота сероконверсии или выявления РНК-вируса гепатита С у медицинских работников после укола иглой достигает 10%), половой и перинатальный пути существенного эпидемиологического значения не имеют. В то же время вероятность бытового внутрисемейного инфицирования детей и супруга составляет 4%. В связи со структурной близостью вируса гепатита С к вирусам Flaviviridae (геморрагическая лихорадка денге, желтая лихорадка) обсуждается возможность передачи вируса через укусы членистоногих. Вирус гепатита С часто в процессе размножения образует квазиштаммы, что приводит к его выходу из-под наследственного иммунного контроля. Инкубационный период болезни в среднем составляет 45 дней. Тяжелое течение отмечают сравнительно редко, заболевание протекает малосимптомно, часто незаметно для врачей и самого больного. Гепатит С может сочетаться с некоторыми печеночными и внепеченочными синдромами: поздней кожной порфирией (у около 70% пациентов с порфирией выявляют HCV, но редко у больных с HCV отмечают картину порфирии), очаговым лимфоцитарным сиалоаденитом, изолированными конъюнктивальными язвами Мурена, криоглобулинемией II типа, мембранозно-пролиферативным нефритом. Почему именно возникают иммунные расстройства, неизвестно. Можно дополнить, что до ¼ пациентов с алкогольным поражением печени являются носителями вируса гепатита С.
Хронизация HCV может наступить в 60–80% случаев. Средний период от заражения вирусом до развития клинически значимого хронического гепатита, цирроза и гепатоцеллюлярной карциномы составляет в среднем 18; 21 и 28 лет соответственно. Специфическая диагностика основана на выявлении anti-HCV и HCV-PHK с помощью ПЦР.
Основные сводные данные по характеристикам гепатитов и ДД показатели серологических и геномных проб при гепатитах отражены в табл. 24.2 и 24.3.
Таблица 24.2
Серологические и геномные исследования при вирусных гепатитах
| Интерпретация | Anti-HAV IgG/IgM | HBsAg | Anti-HBc IgG/IgM | НВеАg | Anti-НBe | Anti-HDV IgG/IgM | Anti-HBs | Anti-HCV | HBV—ДНК | HCV-PHK |
| Острый вирусный гепатит А | -/+ | — | -/- | — | — | -/- | — | — | 0 | — |
| Реконвалесцент острого вирусного гепатита А | +/- | — | -/- | — | -/- | — | 0 | |||
| Острый вирусный гепатит В | -/- | + | -/+ | + | — | -/- | — | — | + | — |
| Хронический вирусный гепатит В | -/- | + | +/- | + | -/- | ~~ | — | + | ||
| Коинфекция HBV+HDV | -/- | + | -/+ | + | — | -/+ | — | — | + | — |
| Гепатит D как суперинфекция гепатита В | -/- | + | +/- | +/- | +/- | -/+ | + | |||
| Хронический HBV+HDV | -/- | + | +/- | +/- | +/- | +/- | — | + | — | |
| Острый гепатит А как суперинфекция гепатита В | -/+ | + | +/~ | +/- | +/- | -/- | — | + | ||
| Острый/хронический гепатит С на фоне хронического гепатита В | -/- | + | +/- | +/- | +/- | -/- | — | + | +/- | +/- |
| Реконвалесцент гепатита В | -/- | — | +/- | — | — | -/- | + | — | 0 | — |
| Реконвалесцент гепатита В с острым/хроническим гепатитом С | -/- | — | +/- | — | — | -/- | + | + | 0 | +/- |
| Вакцинированный HBsAg | -/- | — | -/- | — | — | -/- | + | — | 0 | — |
| Ранняя фаза разрешения гепатита В | -/- | +/» | — | -/- | — | ? | ||||
| HBsAg-отрицательный хронический гепатит В | -/- | — | +/- | — | -/- | — | — | ? | ||
| Ложноположительный HbcAb | -/- | — | +/- | — | — | -/- | — | — | ? | — |
| Острый/хронический вирусный гепатит С с anti-HCV | -/- | -/- | -/- | — | + | +/- | ||||
| Острый/хронический вирусный гепатит С без anti-HCV | -/- | — | -/- | — | — | -/- | — | — | 0 | + |
| Острый гепатит А с острым/хроническим гепатитом С | -/+ | -/- | -/- | + | 0 | +/- | ||||
| Ложноположительный HCV | -/- | — | -/- | — | — | -/- | — | + | 0 | |
| Новорожденный от матери с anti-HCV | -/- | — | -/- | — | -/- | + | 0 | — | ||
| Острый гепатит С в стадии ранней реконвалесценции | -/- | -/- | — | -/- | — | + | 0 | |||
| Вирусный гепатит В, вызванный мутантом HBV | -/- | +/- | -/+ | + | -/+ | +/- | + | — |
- +/- может быть как«+», так и«-»; 0 — в этом случае нет необходимости проведения этого исследования.
- Новорожденный от матери с HBV. Показатели зависят от времени инфицирования: внутриутробно — показатели хронического гепатита В, в период прохождения родовых путей — острый гепатит В.
Таблица 24.3
Характеристика форм острого гепатита
| Форма гепатита | Методы специфической диагностики | Путь заражения | Склонность к хронизации процесса |
| A | Anti-HAV IgM, anti-HAV | Фекально-пероральный | Не выявлена |
| В | HBsAg, anti-HBc IgM, HBeAg, HBV-ДНК | Парентеральный, контактный, половой | Выражена |
| С | Anti-HCV, HCV-PHK | Парентеральный, контактный, половой | Чрезвычайно выражена |
| D | Anti-HDV, anti-HDV IgM | Парентеральный | Выражена |
| E | Anti-HEV, anti-HEV IgM | Фекально-пероральный | Не выявлена |
| F | Отсутствуют | Парентеральный | Не уточнена |
| G | HGV-PHK | Парентеральный | Вероятно, имеется |
На сегодня острые вирусные гепатиты А, В, и С занимают основное место в структуре острых вирусных гепатитов. На их долю в России приходится 86–92% всех случаев заболевания. Вирусы гепатитов В и С играют важнейшую роль в развитии хронических заболеваний печени: до 60–70% циррозов и хронических гепатитов, 70–80% первичных раков печени развиваются как отдаленный исход острых гепатитов В и С. Известна высокая частота инфицирования этими вирусами медицинского персонала, а также больных гемодиализных, гематологических, хирургических, стоматологических и инфекционных отделений.
Острый вирусный гепатит D (HDV-гепатит, дельта-гепатит). Вызывается вирусом, близким к вироидам и сателлитным вирусам растений. Открыт в 1977 г. в Италии, распространен в бассейне Средиземного моря. Для размножения вируса гепатита D необходим вирус-помощник, роль которого исполняет HBV, поэтому практически всегда имеет место смешанная инфекция: HBV+HDV. Заражение происходит парентерально, а методом специфической диагностики является выявление anti-HDV и anti-HDV IgM. Присоединение вируса гепатита D вызывает ухудшение течения гепатита В, приводит к фульминантным формам, ускоренному формированию цирроза. Особенно часто вирус гепатита D выявляют у наркоманов, у получающих цитостатики и гемодиализных пациентов.
Острый вирусный гепатит F (HFV-гепатит). В 1992 г. в США было сообщено о наличии нового посттрансфузионного гепатита, обозначенного как гепатит F. На сегодня методов специфической диагностики пока не существует. По своим клинико-эпидемиологическим характеристикам инфекция схожа с острым вирусным гепатитом С.
Острый вирусный гепатит G (HGV-гепатит). Вызывается РНК-вирусом, вероятно, семейства флавовирусов, идентифицированных в США в 1995 г. В структуре острых посттрансфузионных гепатитов «ни А, ни В, ни С» он составляет 7–10%. Часто наличие вируса G сочетается с инфицированностью вирусами В и С. Методом специфической диагностики является выявление HGV-PHK.
Кроме вирусных гепатитов А, В, С, D, Е, F, G, возможны гепатиты, вызванные цитомегаловирусами, вирусом герпеса, Q- и желтой лихорадки, Коксаки, кори, Эпштейна — Барр, лептоспирами, возбудителями болезни кошачьей царапины (Bortanella) и др. (табл. 24.4).
Таблица 24.4
Биологические агенты и вызываемые ими поражения печени
Бактерии
- Туберкулез. Часто субклиническое гранулематозное поражение. Желтуха развивается очень редко. Типично повышение активности щелочной фосфатазы.
- Абсцессы. Занос инфекции гематогенно, per continuitatem, холангит. Обычно грамнегативная и анаэробная флора. Боль, интоксикация. Функции печени умеренно нарушены. ДД с амебиазом.
- Трепонемы. Врожденный гепатит, фиброз. Приобретенный гепатит при вторичном и третичном сифилисе, гуммы.
- Лептоспироз. Желтуха. Почечный синдром.
- Боррелии. Гепатометалия, иногда желтуха.
- Актиномицеты. Гранулематозный гепатит с некрозами.
- Другие. Субклинические гепатиты при системных инфекциях.
Вирусы
- Цитомегаловирус. У новорожденных гепатометалия, желтуха. У взрослых (особенно после гемотрансфузии) напоминает инфекционный мононуклеоз.
- Эпштейна — Барр. Субклиническое поражение у 95% больных инфекционным мононуклеозом. Клинически значимый гепатит у 5%.
- Другие. Вирусы герпеса, Коксаки, ECHO, краснухи и др.
Простейшие
- Амебы. Поражение печени может быть без предшествующей дизентерии. Обычно один большой абсцесс. Лихорадка, интоксикация. Функции печени умеренно нарушены.
- Токсоплазмы. Трансплацентарная инфекция.
- Малярия. Гепатоспленомегалия типична для эндемичных районов, а не спорадических случаев. Желтуха очень умеренная или даже отсутствует, несмотря на выраженный гемолиз.
- Лейшмании (кала-азар). Ретикулоэндотелиальная система инфильтрована паразитами. Гепатоспленомегалия.
Грибы
Гранулематозное поражение при гистоплазмозе (с исходом в кальцинацию), криптококкозе, бластомикозе, кокцидиомикозе и др.
Гельминты
- Токсокароз. Миграция ларв. Гепатоспленометалия, гранулемы, эозинофилия.
- Аскаридоз. Миграция ларв. Гранулемы. Обструкция желчевыводящих путей взрослыми гельминтами.
- Эхинококкоз. Гидатидные кисты, чаще бессимптомные. Функции печени сохранены.
- Шистосомоз. Перипортальные гранулемы. Гепатоспленомегалия, портальная гипертензия.
- Фасциоллез. Острое течение: лихорадка, гепатометалия, эозинофилия. Хроническое течение: холангит, билиарный фиброз печени.
Особые сложности в установлении причин желтухи возникают при гепатите с холестазом компонентом. При этих формах синдром цитолиза отступает на второй план, доминируют симптомы холестаза: зуд, повышение активности щелочной фосфатазы, гистологические признаки застоя желчи. Желтушная фаза заболевания увеличена, что еще более затрудняет ДД с внепеченочными формами холестаза. Уровень гамма-глобулинов нормален или умеренно повышен.
Разнообразны варианты течения острых гепатитов. Подострый некротизирующий гепатит — особая форма течения острого гепатита. Желтуха держится до 4 мес, симптомы холестаза выражены, общее состояние больного тяжелое. Длительное время сохраняется высокая активность трансаминаз в сыворотке крови. Рано возникающие асцит, отеки, энцефалопатия вместе с гипергаммаглобулинемией свидетельствуют о формирующемся циррозе печени. Диагноз устанавливают при лапароскопии и биопсии печени, где выявляют очаговые субмассивные некрозы и крупные узлы регенерации («булыжная печень»). Подострый некротизирующий гепатит отмечают не только при вирусных гепатитах, но и при медикаментозных поражениях печени. У значительного количества пациентов заболевание может закончиться относительно благоприятно: формированием неактивного цирроза печени. Другие пациенты умирают от печеночной комы, или формируется хронический активный гепатит. Данные эхоГ, эндоскопической ретроградной холангиографии, лапароскопии с биопсией печени позволяют исключить заболевания со схожей клинической картиной: вирусный хронический гепатит, выраженный внепеченочный холестаз.
В 2–18% случаев острого вирусного гепатита через 4–6 нед (иногда через 3–6 мес) развивается рецидив (рецидивирующее течение гепатита).
Редко отмечают наиболее злокачественный вариант течения гепатита — фульминантный. Признаками критической динамики являются: резкое ухудшение состояния, лихорадка, нарастание желтухи, прекома, коллапс, стремительное уменьшение размеров печени. Биохимически регистрируют быстрое снижение концентрации факторов свертывания, что свидетельствует о катастрофическом уменьшении объема жизнеспособной паренхимы печени. Предрасполагающие факторы — алкоголизм, терапия новарсенолом, висмутом, препаратами золота. В течение ближайших 7–10 дней наступает летальный исход.
Переход в относительно благоприятный хронический персистирующий гепатит или в прогностически неблагоприятную форму хронического активного гепатита выявляют у 10–15% больных острым гепатитом В и у 30–80% при гепатите С. Хронический гепатит завершается циррозом печени как самостоятельно фатальным, так и приводящим к гепатоцеллюлярной карциноме.
Холестатическая желтуха
ДД паренхиматозной (гепатоцеллюлярной) желтухи и внепеченочной обструкции желчевыводящих путей по результатам изучения анамнеза, клинической картины и лабораторных данных обычно не вызывает трудностей. Сложности возникают при дифференцировании внутрипеченочного и внепеченочного («хирургические желтухи») холестаза. Первым диагностическим методом по скорости и технической простоте получения результатов является эхоГ. Она позволяет выявить причины внепеченочного холестаза, визуализируя опухоль, камень, расширение желчных ходов (симптом «морской звезды»). Но в начальных стадиях, когда расширение желчных ходов еще не сформировалось, диагностическая ценность эхоГ ограничена, так что в целом не превышает 60%. Более достоверной, но травматичной методикой является ретроградная чрескожная или эндоскопическая холангиопанкреатография.
Внутрипеченочный холестаз обусловлен нарушением выведения конъюгированного билирубина. Причина может быть в гепатоците (синдром Дубина — Джонсона), в желчных капиллярах, в желчных ходах, в септальных протоках, то есть в более крупных внутрипеченочных ветвях желчевыводящей системы. Все эти варианты холестаза (за исключением внутриклеточного) характеризуются зудом, повышением уровня прямого билирубина, холестерина, активности щелочной фосфатазы, 5-нуклеотидазы, лейцинаминопептидазы). В отличие от внепеченочного холестаза отсутствует боль в области печени, ее значительное увеличение, расширение желчных ходов, холангит. Внутрипеченочный холестаз на клеточном уровне отмечают при синдромах Ротора, Дубина —-Джонсона, при острой алкогольной дистрофии печени, циррозе, тяжелых общих инфекционных заболеваниях и после операций. Капиллярный и перикапиллярный холестаз развивается при болезни Ходжкина, вследствие приема С-17-алкилированных анаболических гормонов, а также возможен при беременности.
Дуктулярный холестаз свойственен синдрому Алажиля, злокачественному рецидивирующему холестазу, желтухе наркоманов («аллергическая» форма наркотической холестатической желтухи). Дуктулярный, интралобулярный холестаз с вовлечение септальных желчных ходов типичен для синдрома Кароли, атрезии внутрипеченочных желчных ходов и первичного билиарного цирроза. Септальные и большие по диаметру внутрипеченочные желчные ходы поражаются при склерозирующем холангите, холангиокарциноме.
Желтухи беременных принято разделять на две группы. 1-я группа включает желтухи, обусловленные самой беременностью (доброкачественная желтуха беременных — холестатический гепатоз, острая желтая атрофия печени), 2-ю группу составляют заболевания, не связанные с беременностью, а возникающие в ее период или сочетающиеся с ней (острый вирусный гепатит, хронический гепатит и др.).
Острая желтая атрофия печени (синдром Шихена, острый жировой гепатоз беременных, острая жировая дистрофия печени). Этот синдром впервые описан Стандером и Кадденом в 1934 г., а подробная клинико-гистологическая характеристика заболевания дана Шихеном в 1940 г. Он же предложил название «острая желтая атрофия печени». Это очень редкое, но очень опасное осложнение беременности, материнская смертность при котором достигает 60–85%, а перинатальная еще выше.
Заболевание развивается чаще в III триместр беременности при осложнении ее поздним токсикозом. Проявляется тяжелой печеночно-клеточной недостаточностью, геморрагическим синдромом, обусловленным внутрисосудистым свертыванием крови, и поражением почек. В клиническом течении выделяют три стадии. Первая — дожелтушная. Как правило, начинается на 32–34-й неделе беременности. Проявляется тошнотой, кожным зудом, изжогой, слабостью. По мере развития болезни изжога и зуд становятся мучительными и не поддаются лечению. Вторая стадия (спустя 1–2 нед от начала болезни) — желтушная. При появлении выраженной желтухи усиливаются слабость и изжога, к тошноте присоединяется рвота (чаще кровавая) и жжение за грудиной. Появляются признаки печеночной недостаточности. Эти клинические признаки сочетаются с быстрым уменьшением размеров печени. Через 1–2 нед после появления желтухи наступает третья стадия. Характеризуется тяжелой печеночно-почечной недостаточностью, геморрагическим панкреатитом, гастроинтестинальными кровотечениями и заканчивающаяся в большинстве случаев комой и смертью беременной. Печеночная недостаточность, обусловленная острой желтой атрофией печени, в большинстве случаев сочетается с почечной недостаточностью, но не сопровождается энцефалопатией. Это отличает печеночную недостаточность при остром жировом гепатозе беременных (синдром Шихена) от печеночной недостаточности при вирусном гепатите. Беременные остаются в сознании вплоть до терминальной стадии болезни. Клиническая картина в терминальной стадии трудно отличима от коматозных состояний другого генеза.
При лабораторном исследовании крови определяют выраженный лейкоцитоз, резкое (в 10–20 раз) повышение уровня билирубина, активности АлАТ и щелочной фосфатазы, значительное снижение протромбинового индекса, количества тромбоцитов, общего белка и альбуминов крови, некорригируемую гипогликемию, декомпенсированный ацидоз. Клинически провести различия между острой желтой атрофией печени в период беременности, при тяжелых вирусных или лекарственных гепатитах, осложнившимися острой дистрофией печени, очень трудно. Решающее значение в таких случаях принадлежит пункционной биопсии печени. Для острого жирового гепатоза характерно массивное системное ожирение печени без существенных признаков некроза печеночной ткани. Однако коагулопатия затрудняет, а подчас исключает возможность проведения последней. В ряде случаев диагноз «острая желтая атрофия печени» может быть установлен по данным КТ или эхоГ.
Холестатический гепатоз беременных (доброкачественная желтуха беременных, поздний гепатоз беременных с печеночным синдромом, внутрипеченочный холестаз беременных, идиопатическая желтуха беременных) представляет собой экскреторную неполноценность вследствие действия на нормальную печень высокой концентрации женских половых гормонов. Ведущая роль в его развитии принадлежит генетическим дефектам, что подтверждается выявлением такой желтухи в одной семье. Беременность относится к провоцирующим факторам. Нередко такая желтуха развивается у женщин при приеме гормональных контрацептивов. Это осложнение может возникнуть на любом сроке беременности, но чаще развивается в III триместр. Через 1–3 нед после родов желтуха исчезает. Клиническая картина характеризуется умеренно выраженной желтухой с мучительным кожным зудом. Общее состояние, как правило, не нарушается, боли в животе не бывает. В период первой беременности правильный диагноз установить порой трудно, при повторных легче, поскольку заболевание рецидивирует. С каждой последующей беременностью клиническая картина ярче.
ДД проводят с холестазом, обусловленным приемом лекарственных препаратов, острым вирусным гепатитом, первичным билиарным циррозом печени. При холестатическом гепатозе беременных отмечают гипербилирубинемию (повышается в основном прямая фракция до 85,5–102,6 мкмоль/л), повышается активность термолабильной щелочной фосфатазы, гамма-глютамилтрансферазы и 5-нуклеотидазы. Осадочные пробы и протеинограммы не изменяются. В 10–100 раз повышается содержание желчных кислот, преимущественно за счет холевой кислоты, в меньшей мере хенодезоксихолевой. При гистологическом исследовании устанавливают явления очагового холестаза с желчными тромбами в расширенных канальцах без признаков воспаления и некроза. В ряде случаев полезную информацию можно получить при проведении КТ и эхоГ.
Ко 2-й группе заболеваний, приводящих к развитию желтухи у беременных, относят острый и хронический вирусный гепатит, цирроз печени, доброкачественные гипербилирубинемии, болезнь Вильсона — Коновалова, ДД которых описана в соответствующих разделах. Кроме того, у беременных возможна врожденная или приобретенная гемолитическая желтуха, характеризующиеся, независимо от ее причины, анемией, ретикулоцитозом, повышением СОЭ, повышением уровня общего билирубина за счет свободной фракции, ахолурией. Приобретенная гемолитическая желтуха у беременных развивается при пиелонефрите, гинекологическом сепсисе, нефропатии, пузырном заносе, раннем токсикозе, при аутоиммунном процессе и гемотрансфузиях.
ДД желтух беременных представлена в табл. 24.5.
Таблица 24.5
ДД желтух у беременных
| Симптом | Холестатический гепатоз | Острая желтая атрофия печени | Острый вирусный гепатит |
| Анамнез | Желтуха и зуд при предыдущих беременностях, начало болезни во второй половине беременности | Развитие на фоне позднего токсикоза в III триместр беременности | Контакт с больным, оперативное вмешательство, гемотрансфузии |
| Продромальный (преджелтушный) период | Нет | Диспепсия | Диспепсия,астения |
| Интоксикация | Нет | Есть | Есть |
| Лихорадка | Нет | Нет | Нет |
| Пульс | Норма | Тахикардия | Брадикардия |
| Печеночная недостаточность | Нет | Есть | Есть при гепатитах В, Е, D |
| Энцефалопатия | Нет | Есть | Есть при гепатитах В, Е. D |
| Кома | Нет | Есть | Ibidum |
| ДВС-синдром | Нет | Есть | Есть при гепатитах В, Е |
| Гипокоагуляция | Нет | Есть | Есть |
| Геморрагии | Нет | Есть | Есть при гепатитах В, Е |
| Анемия | Нет | Есть | Нет |
| Почечная недостаточность | Нет | Есть | Есть при гепатите Е |
| Кожный зуд | Сильный | Есть | Есть |
| Размер печени | Норма | Уменьшен | Увеличен |
| Боль в правом подреберье | Нет | Нет | Есть |
| Боль в области селезенки | Нет | Нет | Есть |
| Активность АсАТ, АлАТ | Норма | Повышена в 2–3 раза | Резко повышена |
| Тимоловая проба | Норма | Снижена | Увеличена при гепатите А |
| Холестерин | Повышен | Норма | Норма |
| Гипокликемия | Нет | Есть | Нет |
| HbsAg | Нет | Нет | Есть при гепатите В |
Постоперационная желтуха доброкачественная, развивается на 2–3-й день после операции, не сопровождается зудом, лихорадкой, гепатоспленомегалией. Выраженность симптомов зависит от объема операции и выбора наркотических средств. Стул обесцвечен не полностью, билирубинурия умеренная. Активность трансаминаз может оставаться в пределах нормы или незначительно повышаются. Активность щелочной фосфатазы повышается умеренно. Уровень билирубина обычно достигает 80–400 мкмоль/л. Гистологически в биоптатах определяют центролобулярный холестаз. На 10–15-й день наступает самостоятельное излечение. Но в целом генез постоперационной желтухи чрезвычайно разнообразен. Это гемолиз, обширная травма, сепсис, рассасывание гематомы, массивные гемотрансфузии, гипоксемия, недостаточность кровообращения. Тяжелым осложнением является так называемый ишемический гепатит, протекающий с гипоксическим, а не воспалительным поражением печени. Шок и артериальная гипотензия приводят к некрозу 3-й зоны (центролобулярной). Желтуха очень умеренная, а активность трансфераз повышается в десятки и сотни раз. Ишемический гепатит благополучно саморазрешается после общего улучшения статуса пациента.
Истинный послеоперационный гепатит — результат переноса возбудителя с кровью. Он возникает после инкубационного периода, то есть не ранее 2 нед. Это первое ДД-отличие от иных вариантов послеоперационного поражения печени. Например, галотановый гепатит возникает в ближайшие 10 дней после наркоза, сопровождаясь труднообъяснимой лихорадкой (см. Нейролептический синдром).
Наряду с доброкачественной постоперационной холестатической желтухой (см. выше) возможен прогрессирующий холестаз у пациентов, находящихся на полном парентеральном питании. Наряду с холестазом определяют воспалительную реакцию. Патогенез состояния неизвестен. Для развития синдрома обычно требуется не менее 3 нед тотального парентерального питания, но риск холестатически воспалительного поражения печени (в ряде случаев с фиброзом) нарастает параллельно с длительностью тотального парентерального питания и значительно выше у детей.
Желтуха в послеоперационный период может быть вызвана острым панкреатитом или острым некалькулезным холециститом.
Внепеченочный холестаз может развиться при лептоспирозе, сальмонеллезе, колиинфекции мочевыводящих путей, пневмонии. Особенно к этому предрасположены дети. Типично сочетание холестаза с выраженной токсической зернистостью нейтрофильных гранулоцитов.
Лекарственная холестатическая желтуха требует исключения вирусных желтух. Анамнез и социальный статус пациента (желтуха хиппи, названная так по наиболее известной в свое время желтухе в результате заражения гепатитом В при нестерильных инъекциях наркотиков) позволяет провести ДД. Возможны два механизма развития лекарственной желтухи.
- Дозозависимая токсическая форма. Пример — желтуха после применения метилтестостерона, имеющего алкилированный 17-й атом углерода. Холестаз развивается постепенно без воспалительной реакции, без значительного ухудшения общего самочувствия. Активность щелочной фосфатазы повышена, но показатели аминотрансфераз малоизменены. В биоптатах печени центризональный стаз желчи с минимальной портальной реакцией. Отмена препарата приводит к исчезновению синдрома.
Дозозависимая токсическая форма холестаза (стероидный тип холестаза) развивается у 1–2% женщин, принимающих пероральные контрацептивы. Частота этого осложнения очень варьирует по различным странам. Сказывается, видимо, и генетический фактор, и отношение к статистике. Холестаз можно попытаться объяснить влиянием половых гормонов на образование желчи, дисфункцией ресничек, нарушением движения воды в желчных капиллярах. Стероидный тип холестаза тесно связан с холестатическим гепатозом беременных (см. выше). Женщины, перенесшие доброкачественную желтуху беременных, развивают холестаз при приеме гормональных контрацептивов. А у женщин, принимавших пероральные контрацептивы с развитием холестаза, в период беременности разворачивается картина холестатического гепатоза.
- Дозонезависимая «аллергическая» форма развивается чаще. Вызывается большим количеством лекарственных препаратов, самыми вероятными являются тиреостатики, гидантоин, эритромицин, цефалоспорины, аймаллин, фурагиновая группа, толбутамид, препараты золота, хлорпромазин (желтуха более чем у 1% получающих этот препарат), фенотиазин, трициклические антидепрессанты. У большинства (80–90%) предрасположенных лиц желтуха развивается в 1-й месяц терапии. Продромальная стадия напоминает гепатит, но менее интенсивная. Обычно дебютирует с 2–4-дневной гипертермии, после чего на 2–3-й неделе устанавливается субфебрильная температура. Зуд, эозинофилия и биохимические признаки холестаза дополняют критическую картину. Гистологически печень необильно инфильтрирована эозинофильными гранулоцитами и мононуклеарами. Обсуждается непосредственное токсическое влияние на мельчайшие желчные ходы из-за реакции с мембранной АТФазой. Возможен переход в состояние, напоминающее хронический билиарный цирроз.
Хронический гепатит — клинико-морфологический синдром, вызываемый различными причинами и характеризующийся различными степенями некроза гепатоцитов и воспаления. К хроническому гепатиту относят заболевания, при которых клинико-лабораторные и морфологические изменения печени сохраняются в течение 6 мес и более. Хронический гепатит представляет собой спектр заболеваний между острым гепатитом и циррозом. Общепризнана вирусная этиология хронического гепатита. Причины хронизации острого вирусного гепатита выяснены не окончательно. Применимо общее положение о несоответствии резистентности организма и вирулентности и патогенности возбудителя. Гепатоцеллюлярное поражение часто сочетается с гаплотипами HLA В8 и DR3. Имеет значение и аутоиммунный механизм, что подтверждается сочетанием хронического гепатита с аутоиммунным тиреоидитом, нефритом, и гемолитической анемией, выявлением
АНФ, антител к ДНК, к митохондриям, гладкомышечным клеткам, выраженная перипортальная инфильтрация Т-клетками и плазмоцитами, ответ на терапию кортикостероидами и иммуносупрессивными препаратами. Но все это только внешние признаки аутоиммунных расстройств. Еще никто не нашел антител, направленных на антигены гепатоцита. То есть реакция, видимо, достаточно опосредованная. Поражается нечто, что питает и поддерживает гепатоцит, а он уже поражается вторично.
Роль лекарств в развитии хронического гепатита все еще обсуждается. Хотя масса препаратов (в том числе изониазид, нитрофураны, метилдопа и др.) могут вызвать воспалительную клеточную инфильтрацию в печени. Механизм поражения зависит от препарата. Это может быть цитотоксическая реакция, нарушение метаболизма клетки, аутоиммунный эффект.
Хронический гепатит длительное время может оставаться нераспознанным, преобладают общие неспецифические симптомы, депрессивные состояния. У пациентов, получающих иммуносупрессивную и кортикостероидную терапию, могут отсутствовать биохимические проявления, несмотря на репликацию вируса. Зато отмена указанных препаратов ведет к катастрофическому ухудшению течения хронического гепатита вплоть до картины, напоминающей отторжение печени-трансплантата.
В России и сегодня широко используют классификацию хронического гепатита, в основу которой положен морфологический принцип (Гавана, 1968).
- Хронический персистирующий гепатит. Его морфологические критерии — расширение портальных трактов, воспалительная клеточная инфильтрация, локализованная примущественно в портальных трактах, сохранение дольковой структуры, огрубение стромы, отсутствие выраженного фиброза.
- Хронический активный гепатит. Морфологические критерии: некрозы как собственно в дольке, так и в портальных трактах с нарушением целостности пограничной пластинки и развитием фиброзной ткани, а также разной степени выраженности воспалительной клеточной инфильтрации, дольковая дегенерация и фокальный некроз.
- Хронический лобулярный гепатит. Характеризуется мелкими единичными некрозами собственно в дольке и внутридольковой лимфоидно-клеточной инфильтрацией.
На Всемирном конгрессе гастроэнтерологов (Лос-Анджелес, 1994) предложен проект новой классификации хронического гепатита.
- В диагноз «хронический гепатит» — там, где это возможно — необходимо включать этиологический фактор. Таким образом, сохраняются термины «аутоиммунный гепатит» и «хронический вирусный гепатит». В то же время без указания этилогии принимаются такие термины, как «хронический персистирующий гепатит», «хронический активный гепатит», «хронический лобулярный гепатит».
- В группу хронических гепатитов включены также первичный билиарный цирроз, болезнь Вильсона — Коновалова, первичный склерозирующий холангит, альфа-1-антитрипсиновая недостаточность печени, поскольку эти заболевания протекают хронически, а гистологическая картина очень напоминает аутоиммунные и хронические вирусные гепатиты.
- При наличии цирроза печени указывается этиология заболевания, а такие термины, как «портальный», постнекротический», «постгепатитный», «нутритивный», «лаэннековский» цирроз без этиологических характеристик не используют.
Таким образом, в настоящее время предлагается выделять следующие хронические гепатиты:
- хронический гепатит В;
- хронический гепатит С;
- хронический гепатит D;
- хронический вирусный гепатит неизвестного типа;
- аутоиммунный гепатит;
- хронический гепатит, который не классифицирован как вирусный или аутоиммунный;
- хронический лекарственный гепатит;
- первичный билиарный цирроз;
- первичный склерозирующий холангит;
- болезнь Вильсона — Коновалова;
- альфа-1-антитрипсиновая недостаточность печени.
При определении стадии заболевания рекомендовано оценивать наличие или отсутствие портальной гипертензии, гистологически наличие и выраженность фиброза.
Клиническими признаками хронических вирусных гепатитов является недомогание, снижение аппетита, тошнота, желтуха (иногда лишь легкая иктеричность видимой слизистой оболочки), тяжесть в правом подреберье, боль в животе, мышцах и суставах, увеличение печени. Значительно реже отмечают кожный зуд, телеангиоэктазии на коже, увеличение печени и селезенки, похудание, потемнение мочи. Клинические симптомы не всегда могут служить надежными критериями для оценки тяжести хронического гепатита. Подчас они выражены слабо и малоспецифичны, вследствие чего «просматриваются» врачами. Только 25–35% случаев хронического гепатита следуют за манифестным острым. Остальное развивается скрытно и воспринимается de novo, особенно гепатит С. Явные клинические признаки выявляют лишь на далеко зашедшей стадии заболевания и даже при декомпенсации уже сформировавшегося цирроза печени.
Из лабораторных биохимических тестов диагностическую значимость при хроническом гепатите имеет активность АлАТ в сыворотке крови (превышающий норму в 2–3 раза на протяжении 3–4 нед). Исследования АсАТ, ЛДГ имеют меньшую диагностическую значимость. Повышение содержания гамма-глобулина, тимол-вероналовой пробы и снижение сулемовой пробы, снижение уровня протромбина, холинэстеразы, альбумина регистрируют при ухудшении течения заболевания. Основным методом диагностики и ДД хронического гепатита является биопсия печени с последующим гистологическим изучением пунктата, позволяющая уточнить диагноз, определить степень активности иммуновоспалительного процесса, стадию развития заболевания, а часто и эффективность терапии. Чрескожная биопсия печени тонкими аспирационными иглами является относительно безопасным методом исследования и в ряде стран осуществляется амбулаторно. При необходимости биопсию печени производят при лапароскопии. В современных условиях наиболее приемлемым является транссосудистый способ биопсии.
Данные эхоГ печени позволяет определить размеры органа, его структуру и, что особенно важно, выявить начальные признаки портальной гипертензии (расширение портальной и селезеночной вен, появление портокавальных анастомозов, увеличение селезенки, появление асцита).
Основой для этиологической расшифровки заболевания и установления фазы вирусной инфекции является изучение серологических маркеров вирусов гепатитов.
При установлении диагноза «хронический гепатит В» важное значение имеют: 2–3-кратное повышение АлАТ, определяемое неоднократно на протяжении 6 мес, выявление HBsAg в сыворотке крови, отсутствие маркеров вирусов гепатита С и Д, соответствующие клинические проявления.
Предварительный диагноз «хронический гепатит С» основывается на повышении активности АлАТ более чем в 2 раза, выявляемое неоднократно в течении 6 мес, выявлении антител к HCV в сыворотке крови. Репликативная фаза HCV-инфекции подтверждается методом полимеразной цепной реакции. В связи со стертостью клинических проявлений первостепенное значение имеет гистологическое исследование биоптата печени. Сохраняет свое значение и определение таких объективных признаков, как увеличение и уплотнение печени, увеличение селезенки, расширение портальной и селезеночной вен, вен пищевода.
Хронический гепатит D проявляется в виде супер- и коинфекции у больных с HBV-инфекцией. Сочетание HBV и HDV в качестве этиологических факторов нередко отмечают у больных с высокоактивным хроническим гепатитом и быстро прогрессирующим циррозом печени. Наиболее ценным маркером D-инфекции является anti-HDV класса IgM.
Хронический активный гепатит характеризуется чрезвычайно полиморфной клинической картиной. Наряду с усталостью, разбитостью, ощущением тяжести и переполнения в надчревной области, непереносимостью жирной пищи отмечают потливость, склонность к обморокам, депрессивные состояния. Пальпируется увеличенная плотная печень, в большинстве случаев сочетающаяся с увеличенной селезенкой. Желтуха длительное время отсутствует. Определение уровня трансаминаз может иметь решающее значение для диагноза «гепатит» и прогноза его течения, хотя их нормальные показатели не свидетельствуют о его отсутствии. Хронический активный гепатит в противоположность хроническому персистирующему гепатиту течет с гипергаммаглобулинемией. Только после формирования цирроза уровень гамма-глобулинов снижается. У 80% пациентов с хроническим активным гепатитом формируется цирроз печени. Будучи неактивным, цирроз длительное время никак не проявляется, пока не сформируются признаки портальной гипертензии и печеночной недостаточности. После этого внешние проявления болезни принимают галопирующее течение.
Люпоидный гепатит — особо тяжелый вариант течения хронического активного гепатита. Развивается преимущественно у девочек и молодых женщин. Типичны повышения температуры, гипергаммаглобулинемия, артрит, серозит, ложноположительная реакция Вассермана, выявление клеток Харгревса (ЛЕ-клеток), наличие РФ, АНФ, антител к ДНК. Часто развивается симптоматический геморрагический диатез. Ни в коем случае люпоидный гепатит нельзя сводить к варианту СКВ. В действительности речь идет только о тяжелом течении хронического гепатита с аутоиммунными общими неспецифическими реакциями.
Могут возникнуть ДД-сложности в трактовке гипергаммаглобулинемии при хроническом гепатите и плазмоцитомах. Тем более, что у 1/5 всех пациентов с хроническим гепатитом выявляют парапротеинемию.
ДД хронического активного гепатита проводят с подострым некротизирующим гепатитом, первичным билиарным циррозом, циррозом печени, болезнями накопления (особенно болезнь Коновалова — Вильсона и гемохроматоз), хроническим персистирующим гепатитом.
Хронический персистирующий гепатит как исход гепатита В и С может тянуться годами без выраженных клинико-лабораторных проявлений. Субъективных жалоб очень мало. Печень увеличена умеренно, чувствительна при пальпации. Уровень трансаминаз при динамических исследованиях колеблется волнообразно. Гамма-глобулин остается в пределах нормы. Гистологическая картина напоминает таковую при выздоровлении от гепатита. Прогноз хороший.
Гранулематозный гепатит отмечают при милиарном туберкулезе, болезни Бека, бруцеллезе, листериозе, грибковых поражениях, сифилисе, тифе и многих других состояниях. Степень клинико-лабораторных проявлений собственно гепатита варьирует, специфический диагноз основан на результатах лапароскопии и биопсии.
Достаточно много говорят о так называемых реактивных гепатитах. Они представляют собой реакцию печени на системные болезни и, как правило, не требуют отдельного направления влечении пациента.
Токсические поражения печени текут с паренхиматозной и холестатической желтухой. При современным распространении токсикоманий встречаются значительно чаще, чем раньше. Такие экзогенные яды, как аконит и аманит (грибкового и растительного происхождения), тетрахлоруглерод, хлороформ, бензол, фосфор, танин и многие другие вызывают некроз гепатоцитов. Начало чаще острое со рвоты, расстройства стула, коллапса. В течение нескольких дней может развиться печеночная кома. Отравления тетрахлоруглеродом дебютируют с печеночных симптомов и желтухи, но в течение ближайших часов и дней формируется поражение почек, определяющее исход.
При небольших дозах токсинов возможно постепенное начало заболевания, что создает трудности в ДД с вирусными гепатитами.
Лекарственные желтухи с явлениями гепатита могут быть результатом прямого токсического влияния препарата на гепатоцит (цитостатики, тетрациклин, мышьяк, высокие дозы салицилатов и парацетамола) или «аллергического» характера (противосудорожные, особенно производные гидантоина, туберкуло- и цитостатики, метилдопа). В противоположность холестатическим лекарственным желтухам медикаментозные желтухи по типу гепатита («аллергические») наблюдаются достаточно редко (см. синдром холестаза).
Здесь, как нам кажется, можно слегка отвлечься и порассуждать на такую интересную тему, как взаимодействие печени и лекарственных препаратов. (Вообще же обширность и трудная контролируемость ассоциаций, точно так же как желание писать толстые книги обо всем, может быть при двух, вовсе не исключающих друг друга состояниях: гениальности и шизофрении. Надеюсь, что читатели, завершив работу с книгой, благополучно проведут ДД).
Взаимодействие печени и лекарственных препаратов может быть сведено к следующим вариантам:
- метаболизм препаратов в печени, влияние поражений печени на метаболизм препаратов;
- изменения печени под действием препаратов (некоторые положения см. ранее).
Метаболизм лекарственных средств происходит в основном в печени, где они изменяются и/или экскретируются. Вначале препарат подвергается окислению, восстановлению или гидролизу. После этого препарат или его метаболиты конъюгируются с глюкуронидом или сульфатом.
Препараты окисляются в гепатоцитах благодаря системе печеночной монооксигеназы. Это система — комплекс микросомальных ферментов, среди которых основным является гемсодержащий цитохром Р450. Активность системы определяется генетически, но многие препараты способны стимулировать (индукция) или угнетать (ингибировать) энзимную активность. Причем это могут быть и широко распространенные в быту вещества: кофе, никотин, алкоголь, инсектициды и т. д. Поэтому в популяции даже среди здоровых людей метаболизм препарата может варьировать в широких пределах. Эффект ингибиции или индукции абсолютно неспецифичен. Поэтому если какой-то препарат повышает или, наоборот, снижает активность фермента, то соответствующим образом фермент будет действовать и на другой параллельно принимаемый пациентом препарат. Например, если пациент принимает фенобарбитал (применяют для лечения при желтухах новорожденных, входит в состав многих снотворных, противосудорожных, валокордина или корвалола), являющийся сильным индуктором Р450, и одновременно антикоагулянты, то эффект последних будет резко снижен. Аналогичным образом фермент стимулируется и этанолом, поэтому известна толерантность алкоголиков к седативным и наркотическим препаратам. Кетоконазол способен угнетать систему цитохрома, замедляя печеночный метаболизм других препаратов. Печень регулирует и биодоступность препаратов путем их активного клиренса из крови. Это зависит от способности гепатоцита поглощать препарат (индекс экстракции) и объема проходящей через печень крови. Если индекс экстракции очень высокий, то клиренс определяется только объемом крови (лидокаин, пропанолол). Если индекс экстракции низкий, то эффект печеночного кровотока на клиренс незначительный (диазепам, теофиллин). Но для основной массы препаратов клиренс определяется и кровотоком, и индексом экстракции.
Патология печени существенно сказывается на терапевтическом эффекте применяемых препаратов и вероятности побочных эффектов. Это обусловлено нарушением всасывания, связывания с белками, появлением сосудистых шунтов в печени, изменением кровотока, нарушением клиренса, выделением с желчью. Единых прогностических признаков даже по отношению к какому-то одному препарату нет, нет надежной корреляции с показателями функциональных проб печени. Такая неопределенность проблемы объясняется, видимо, не только массой взаимодействующих собственно печеночных факторов, но и изменением органов-мишеней при болезни печени. Например, резко повышенная чувствительность к седативным и наркотическим препаратам вплоть до развития энцефалопатии при циррозе печени объясняется изменением рецепторов к препаратам в ЦНС.
Изменение же собственно печени под действием препаратов тоже очень неоднозначно. Есть непосредственный дозозависимый токсический эффект. Гепатотоксические препараты часто влияют и на другие органы. Гепатотоксический эффект может реализоваться на разных участках ацинуса. Так, фосфорорганические соединения поражают 1-ю (перипортальную) зону, гидрокарбонаты вызывают некроз 3-й (центрилобулярной) зоны и жировую инфильтрацию. Ядовитые грибы вызывают геморрагический некроз, а тетрациклин в высоких дозах (особенно при внутривенном введении и у беременных) мелкоточечную жировую инфильтрацию с картиной гепатита.
Передозировка парацетамола обусловливает блокаду печеночного глютатиона токсическими продуктами его метаболизма, связывание свободных токсических продуктов с макромолекулами гепатоцитов и некрозу 3-й зоны. Алкоголь индуцирует цитохром, разрушающий парацетамол, резко ускоряется образование токсических дериватов, поэтому некроз печени на фоне приема парацетамола у алкоголиков развивается при применении его в гораздо низких дозах.
В ряде случаев поражение печени с желтухой и/или признаками гепатита развивается вне зависимости от дозы препарата и только у предрасположенных к этому лиц. Такое состояние получило название «идиосинкразия». Но этот термин вызывает много вопросов. Доказано, что иногда препараты или их метаболиты изменяют клеточные мембраны путем непосредственного токсического эффекта, а затем уже на измененные белки могут появиться антитела.
Таким образом, вся вышепредставленная градация по холеостатическим желтухам, аллергическому, токсическому гепатиту является условной, построенной по синдромальному, а не патогенетическому принципу.
Цирроз печени различают макронодулярный (постнекротический), микронодулярный (септальный или портальный) и билиарный. Цирроз представляет собой диффузную дезорганизацию архитектоники печени с образованием узлов регенерации, окруженных соединительной тканью. Цирроз может быть врожденным, криптогенным, как исход инфекционных и токсических поражений печени, при белковом и витаминном дефиците, при застойной сердечной недостаточности (цирроз Пика), при гемохроматозе, болезни Вильсона, при нарушениях обмена (гликогенозы, галактоземия). В развитых странах на первое место среди его причин выдвигаются поствирусный и алкогольный цирроз, в Африке вследствие белковой и витаминной недостаточности. То есть цирроз — конечный этап многих вариантов поражений печени. Но, представляя собой конечный этап, он не является застывшим состоянием. Проявления цирроза зависят от основного заболевания, остроты развития, объема поражения. Клиническая картина всех трех морфологических форм в сущности однотипна и сводится к паренхиматозной недостаточности, портальной гипертензии. Печень увеличивается уже на начальной стадии цирроза. Пальпаторно она уплотнена, но даже данные эхоГ и КТ мало проясняют ситуацию. Единственным достоверным методом является биопсия. На 2-й стадии развития цирроза — компенсированный цирроз — появляются такие клинико-лабораторные признаки печеночной недостаточности, как увеличение размеров, плотности и болезненности печени и селезенки, появлении сосудистых «паучков» (до 10 можно трактовать как норму), пальмарной эритемы, выпадения волос, атрофии тестикул, гинекомастии, биохимических изменений. Последние представлены гипергаммаглобулинемией (>35г/л), затем присоединяется и гипоальбуминемия. Активность трансаминаз и щелочной фосфатазы повышена незначительно или вообще не изменена. В 3-й, декомпенсированной стадии, доминируют симптомы портальной гипертензии. Метеоризм достаточно быстро сменяется асцитом. Последний может сформироваться буквально за несколько дней. Коллатерали визуализируются как «голова медузы», варикозное расширение вен пищевода или прямой кишки (геморрой). Печень уменьшается в размерах или из-за асцита вообще не прощупывается, размеры селезенки увеличиваются еще больше. Если не развивается терминальное кровотечение из переполненных коллатеральных вен, возможны анемия, тромбоцитопения, гепатогенный диабет, язвенная болезнь желудка и двенадцатиперстной кишки, билирубиновые камни в желчном пузыре, мальабсорбция вследствие ограничения поступления желчи в кишечник, энцефалопатия, очень редко миелопатия. Причем два последних неврологических осложнения после портокавального шунтирования выявляют даже чаще, чем при хирургически нелеченном циррозе.
Билиарный цирроз может быть первичным и вторичным. Первичный билиарный цирроз — заболевание неясного генеза с отчетливым аутоиммунным механизмом, заключается в хроническом абактериальном (негнойном) воспалении желчных канальцев, междольковых и септальных желчных ходов. Развивается преимущественно у женщин в возрасте 30–70 лет. Первым симптомом является упорный зуд, на годы опережающий все другие признаки. Достаточно быстро присоединяется меланоз открытых участков тела, артралгия и боль в костях, остеопороз, затем стеаторея (холестаз с недостаточностью функции поджелудочной железы), канальцевый ацидоз. Печень значительно увеличена в размерах, плотная (гипертрофический цирроз Гано). Соответственно признакам холестаза значительно повышены билирубин, щелочная фосфатаза, лейцинаминопептидаза и холестерин с формированием ксантом и ксантелазм. На начальных этапах цирроза уровень гамма-глобулинов не повышен, зато повышена концентрация IgM. У 95% пациентов в сыворотке крови выявляют антимитохондриальные антитела. Вначале в биоптатах нет типичных для цирроза печени нодулярных узелков регенерации в дольках печени. Этот гистологический признак формируется позже, что затрудняет раннюю диагностику заболевания.
Первичный билиарный цирроз печени может сочетаться с аутоиммунным тиреоидито.м, РА, склеродермией.
Гемохроматоз («диабет бронзовых людей») должен быть исключен при каждом случае цирроза печени. При гемохроматозе печень страдает из-за перегрузки железом, что является только местным выражением обшей перегрузки железом всего организма. Чаще поражаются лица в возрасте 40–60 лет, мужчины в 6 раз чаше, чем женщины.
Диагностическим признаками гемохроматоза являются:
- коричневая окраска кожи, особенно ладоней, слизистых оболочек;
- сахарный диабет;
- снижение уровня сывороточного трансферрина при резком (70–80%) его насыщении;
- высокий уровень сывороточного ферритина;
- функции печени, особенно в начале, меняются несущественно;
- инфильтративная кардиомиопатия;
- «черная» печень при ЯМР;
- высокий уровень железа в биоптатах печени, слизистой оболочки, костного мозга, в потовых железах.
Болезнь Вильсона — Коновалова обусловлена нарушением обмена меди, начинается в детстве. Признаки поражения печени (желтуха, уменьшение массы тела, асцит) в дебюте конкурируют с неврологической симптоматикой.
Диагноз основывается на таких факторах:
- экстрапирамидная ригидность, тремор, атаксия;
- цирроз печени;
- симптом «полных икр» как результат лимфатических отеков;
- выявление зеленоватого кольца Кайзера — Флейшнера на радужной оболочке глаза;
- снижение уровня церулоплазмина (<200 мг/л) и меди в сыворотке крови;
- увеличение выведения меди с мочой, особенно после назначения D-пеницилламина;
- повышение содержания меди в биоптатах печени.
Дефицит альфа-1-антитрипсина в случаях преимущественно печеночного поражения манифестирует уже в раннем детстве (см. Эмфизема). Печень поражается при наличии аллелей PI*ZZ. Связь поражения печени с аллелями PI*ZZ, ответственными за развитие тяжелой панацинарной эмфиземы у взрослых, неизвестна. Печень поражается только при значительном накоплении альфа-1-антитрипсина в гепатоцитах. При этом ничем не сдерживаемые протеазы (прежде всего эластаза) вызывают гибель клеток.
У детей раннего возраста заболевание начинается с признаков гепатита, холестаза, гепатомегалии. Часть пациентов погибает в первые же месяцы, у остальных развивается цирроз печени.
У новорожденных с выраженным синдромом холестаза поражение гепатоцитов может протекать при минимальной клеточной реакции воспаления, но с преимущественным портальным фиброзом, пролиферацией ходов или дуктулярной гипоплазией. Цирроз формируется достаточно поздно.
Даже если поражение печени при альфа-1-антитрипсиновой недостаточности впервые проявилось только у взрослого человека, то в анамнезе все же выявляют манифестную желтуху новорожденных.
Желтуха при застойной печени обусловлена некрозом гепатоцитов в условиях высокого венозного давления и кислородного голодания. Поэтому активность трансаминаз может быть высокой. Развивается при правожелудочковой недостаточности, при облитерирующем (констриктивном) перикардите, при дилатационных кардиомиопатиях и не всеми признаваемыми как отдельная нозологическая форма хроническими кардитами. Гепатоюгулярный рефлюкс положителен. Печень резко увеличена в размерах, за счет растяжения капсулы спонтанно болезненна, особо чувствительна при пальпации. Селезенка увеличивается незначительно.
Подпеченочная (механическая, хирургическая) желтуха развивается при наличии механического препятствия в желчевыводящих путях. Для механической желтухи типичны болезненность и значительное увеличение печени. Степень увеличения размеров печени в некотором смысле является ДД-признаком, отличающим механическую желтуху от внутрипеченочной, при которой печень увеличивается незначительно. Кроме того, механическая желтуха характеризуется кожным зудом при нормальных размерах селезенки, высоким уровнем билирубина (450–520 мкмоль/л), холестерина, щелочной фосфатазы, лейцинаминопептидазы. Активность трансаминаз умеренно повышена. При тотальном перекрытии желчевыводящих путей стул обесцвечен, уробилиноген и уробилин в моче не определяются. Определяющим для диагноза являются результаты эхоГ, демонстрирующие расширение желчных путей выше их обструкции или результаты ретроградной холангиографии.
Одной из наиболее частых причин обтурационной желтухи является холедохолитиаз. Чаще его отмечают у полных женщин в возрасте старше 40 лет. У детей и лиц пожилого возраста частота развития холелитиаза не зависит от пола, нет и превалирования пикников.
Холелитиаз у тучных и астеничных пациентов отличается по своему генезу. Билирубин удерживается во взвешенном состоянии определенной концентрацией желчных кислот. У тучных людей при нормальном уровне желчных кислот отмечают избыток холестерина, что и способствует его выпадению в осадок. У астеников уровень холестерина нормальный, но пул желчных кислот ограниченный, их концентрация в желчном пузыре поддерживается на нормальном уровне за счет всасывания этих кислот из кишечника и их повторного использования. Ночью или при других условиях ограничения приема пищи нет выделения желчи, нет и всасывания желчных кислот. Нарушается их концентрация и соотношение, это и способствует формированию холелитиаза (рис. 24.1 а, б).
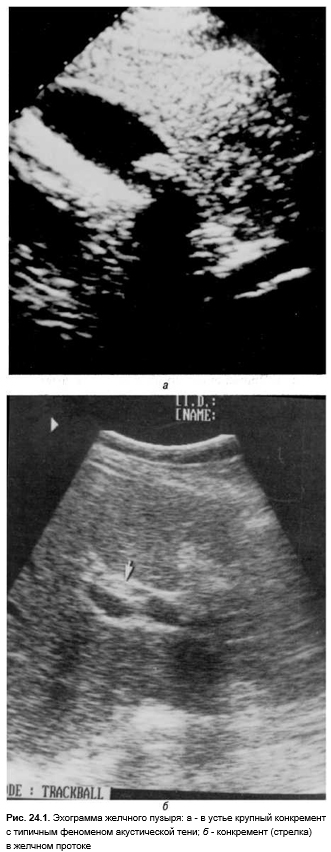
Нередко обсуждаемому виду механической желтухи предшествует желчная колика, хотя следует помнить, что у 20–25% больных вклинивание камня с блокадой оттока желчи не сопровождается болью. Холедохолитиаз достаточно часто сопровождается холециститом, поэтому определяются типичные болевые точки, озноб, высокая лихорадка. Через 12–20 ч после болевого приступа быстро развивается нарастающая желтуха. При механической желтухе, в отличие от опухолевой обструкции, обтурация чаще происходит по вентильному типу, поэтому уровень билирубина не достигает критических цифр, а уробилин в моче отсутствует непостоянно.
В целом уровень билирубинемии не коррелирует со степенью обструкции. Более надежным критерием является активность щелочной фосфатазы (обычно в пределах 2–10 мг/дл). Более высокие показатели типичны для паренхиматозных процессов или опухолевой обструкции.
Нарушения оттока желчи, бактериальное инфицирование желчных ходов приводят к холангиту, характеризующемуся рецидивирующей триадой Шарко: желтуха, потрясающий озноб, боль. Боль иногда отсутствует. В крови признаки холестаза, лейкоцитоз, значительно повышенная СОЭ, повышение активности трансаминаз. Возможно формирование абсцесса печени, сепсиса и вторичного билиарного цирроза. Применения антибиотиков улучшает состояние больного и приводит к ремиссии, но до тех пор пока не устранена основная причина, говорить об излечении невозможно. Холангит наряду с холедохолитиазом может осложнять фасциоллез.
Опухолевая обструкция желчных путей типична для новообразований головки поджелудочной железы, фатерова сосочка, карцином желчных ходов. Поскольку опухоль при этом в большинстве случаев не успевает достичь больших размеров, отсутствуют истощение, повышение СОЭ. Колики нетипичны, боль чаще тупая, отмечают всего у 1/3 пациентов, локализована в эпигастрии. Рак фатерова сосочка на начальных этапах может протекать с волнообразной желтухой, напоминая этим симптомом холелитиаз. При раке головки поджелудочной железы или холедохокарциноме желтуха, появившись, характеризуется только тенденцией к нарастанию. Патогномоничным для низко расположенных обтурирующих карцином является симптом Курвуазье: резко увеличенный, иногда видимый на глаз напряженный желчный пузырь. Холангит развивается редко. Симптом Курвуазье отсутствует при блокаде желчеотгока камнем, так как холедохолитиаз сопровождается холециститом, и воспаленный желчный пузырь с нейтрофильно инфильтрированными ригидными отечными стенками не способен увеличивать свой объем. Обесцвеченный кап и отсутствие желчных пигментов в моче стабильны. Холангит при опухолевой обструкции развивается редко.
Среди других причин, вызывающих подпеченочную желтуху, известны врожденные стенозы холедоха, холедохоцеле, кисты или его приобретенные стриктуры (после холецистэктомии), стеноз фатерова сосочка, отек головки поджелудочной железы при панкреатите или кисты соответствующей локализации, интрадуоденальныс дивертикулы. В качестве казуистической причины механической желтухи любят ссылаться на аскаридоз, хотя очень мало кто из хирургов может вспомнить подобную ситуацию в своей практике.
Объемные процессы печени и желчных ходов могут сопровождаться признаками механической желтухи. Если перекрываются обе ветви желчного протока, то возникает полная обструкция, диагноз которой несложен. Если же объемный процесс менее распространен, то перекрывается или только поддавливается одна долевая ветвь. Возникает частичная обтурационная желтуха. Диагноз ее, безусловно, сложнее. Подпеченочное увеличение ЛУ со сдавлением желчного протока отмечают при лимфоме, лимфосаркоме, лимфогранулематозе, саркоидозе.
Абсцесс печени сопровождается желтухой не только из-за перекрытия желчевыводящих путей, но и в результате токсикоза. Абсцесс чаще всего осложняет течение амебиаза и холангита, может быть гематогенно-артериальным при пневмонии или перифлебитическим при колите, аппендиците, дивертикулите. Первыми признаками обычно бывают боль в правом подреберье, нередко иррадиирующая в правое плечо, потрясающий озноб, лихорадка. Быстрое уменьшение массы тела, интоксикация, общее тяжелое состояние вплоть до потери сознания, болезненная увеличенная печень, высокое стояние и ограничение подвижности правого купола диафрагмы, «септическая» кровь, умеренное повышение уровней трансаминаз и щелочной фосфатазы типичны для абсцесса печени, как впрочем, и для подциафрагмального. Решающее значение имеют методы неинвазивной интраскопии (эхоГ, КТ, ЯМР) и прицельной пункционной биопсии.
Печеночная локализация эхинококковых или альвеококковых кист (по сравнению с вероятностью поражения других органов) является наиболее частой. Это объясняется не столько тем, что печень представляет собой первое «сито» на пути следования паразита, сколько особенностями обмена. Именно в печени интенсивнее всего действует пентозный цикл, из пятичленных сахаров и строится кутикула эхино- или альвеококка. При эхинококкозе печень может увеличиваться в размере. Если гидатидная форма паразита не достигла больших размеров и располагается при этом в глубине паренхимы печени, то она никак не прощупывается. Эозинофилия может отсутствовать. Данные эхоГ и КТ достаточно специфичны (95%) для диагноза. Иммунологические пробы логично завершают обследование.
Доброкачественные врожденные опухоли печени (гемангиома, липома) могут быть признаком нейрокутанных синдромов и диагностируются случайно при УЗИ в поиске причин желтухи (рис. 24.2). Печеночную доброкачественную аденому и локальную нодулярную гиперплазию диагностируют у женщин, длительное время принимавших гормональные контрацептивы. Врожденные кисты могут быть как солидными (рис. 24.3), так и частным проявлениям поликистоза.
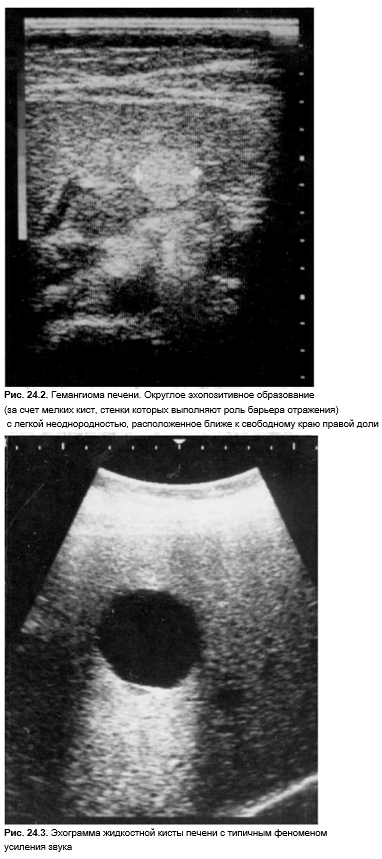
Гепатокарцинома в 80% случаев развивается на фоне цирроза печени. Ее симптомами являются увеличение размеров печени, неопределенного характера боль в правом подреберье, плече и в спине, уменьшение массы тела, небольшой субфебрилитет, гипогликемия, гиперкальциемия, гиперлипидемия, эритроцитоз, портальная гипертензия. Уровни щелочной фосфатазы и альфа-1-фетопротеин повышены. Диагноз подтверждают данные эхоГ, КТ, ЯМР, ангиографии, сцинтиграфии. Гистологическая верификация возможна после прицельной пункционной биопсии. Холангикарцинома клинически не отличается от гепатомы. Если в анамнезе у пациента не было гепатита, если нет цирроза печени, то предположение о злокачественном объемном процессе в желчных ходах кажется предпочтительней гипотезы о гепатоме. Гепатобластома чаще развивается у детей. Она секретирует гонадотропин, поэтому первым проявлением опухоли может быть преждевременное половое созревание.
Чаще чем гепато- или холангиокарциному диагностируют метастазы опухолей. Они вызывают желтуху только при значительных по объему метастатических узлах. Всегда возникает проблема ДД метастаза и первичной опухоли печени. Метастазы в печени типичны для рака молочной железы, желудка, толстой кишки, где и следует искать опухоль при объемном процессе в печени.
К важнейшим общим симптомам и синдромам при гепатопатиях, протекающих с или без желтух, относят печеночную недостаточность, портальную гипертензию, асцит.
Печеночная недостаточность может развиться при любом распространенном паренхиматозном процессе. Эндогенная кома возникает при фульминантном гепатите и прогрессирующем циррозе печени, то есть обусловлена гепатоцеллюлярной недостаточностью. Биохимические пробы резко нарушены. Экзогенная печеночная кома развивается при наличии коллатералей, что обеспечивает транспорт токсинов в обход печени. Основным повреждающим соединением является аммиак, в норме утилизирующийся в печени до мочевины. Разрешающие факторы — белковая перегрузка, диуретики, хирургические вмешательства, медикаменты, конкурирующие с аммиаксодержащими продуктами за гепатоциты. Печеночные пробы при экзогенной коме изменены в меньшей степени, чем при эндогенной. Печеночная недостаточность при циррозах развивается исподволь и может приобретать волнообразное течение. При острых вирусных и токсических гепатитах, острой жировой дистрофии печеночная недостаточность развивается очень быстро. Общими симптомами являются головная боль, ухудшение общего состояния, потеря аппетита, апатия, тремор, foetor hepaticus, гиповолемический шок. Быстро развивается прогрессирующая желтуха, уровень трансаминаз и протромбина резко снижается. Применение менадиона натрия бисульфита не приводит к повышению уровня протромбина. Важнейшим признаком печеночной недостаточности является нарушение сознания, обозначаемое как печеночная кома. Одна из основных причин развития комы — наличие портосистемного или портокавального пути. В кишечнике из белков под действием уре- аз образуются аммиаксодержащие токсины, которые попадают в мозг либо через неполноценную печень, либо минуя ее при наличии портокавальных анастомозов. Развитие комы обусловливают применение лекарственных препаратов, перегрузка кишечника белком (неправильная диета или желудочно-кишечные кровотечения), безбелковая диета, обезвоживание (диуретики, солевые слабительные, потеря асцитической жидкости при пункциях), антибиотики. Печеночная кома клинически характеризуется расстройствами сознания, тремором, изменениями на ЭЭГ. В прекоме развиваются заторможенность мышления и речи, расстройства ориентации, позднее наступают делирий и потеря сознания. Тремор крупноразмашистый. Параллелей между степенью нарушения сознания и выраженностью тремора нет, поэтому рекомендуют регулярно проверять почерк пациента, чтобы рано диагностировать начинающуюся печеночную кому. На ЭКГ отмечают увеличение интервала Р–Q и широкий зубец Т (гепатокардиальный синдром). Уровень билирубина в крови повышается, а трансаминаз падает до субнормальных цифр. Снижаются показатели холестерина и глюкозы крови, протромбина. Значения последнего не реагируют на введение менадиона натрия бисульфита. В моче появляются кристаллы тирозина и лейцина.
Портальную гипертензию диагностируют по наличию коллатералей, спленомегалии и асцита. Степень выраженности и комбинация этих симптомов зависит от уровня блокады кровотока (рис. 24.4). Коллатеральное кровообращение через вены передней брюшной стенки, пищевода, желудка, прямой кишки развивается при всех вариантах портальной гипертензии. Особенно большой объем асцитической жидкости скапливается при циррозе печени и синдроме Бадда — Киари. При тромбозе портальной вены асцит развивается поздно или вообще может отсутствовать. Спленомегалия особенно выражена при идиопатической портальной гипертензии и внепеченочном пресинусоидальном блоке. Но степень увеличения селезенки не применима для целей ДД.
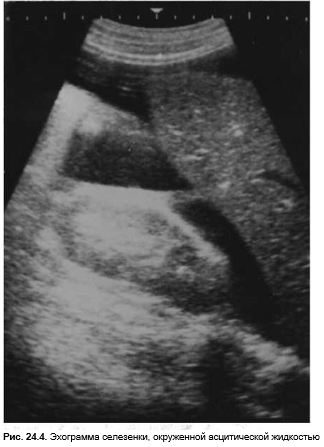
Выделяют подпеченочные, внутрипеченочные и постпеченочные причины портальной гипертензии.
- Подпеченочный (пресинусоидальный) блок возникает чаще при тромбозе воротной вены. Наиболее вероятная причина у детей и людей молодого возраста — пупочный сепсис новорожденных или катетеризация воротной вены при гемолитической болезни новорожденных с целью заменных переливаний крови. Поэтому все манипуляции следует проводить через артерию. Путь восстановления кровотока после тромбоза — это кавернозная перестройка сосуда. Тромбоз воротной вены может быть также при гнойном холангите, панкреатите, у 10% всех больных циррозом печени, при гепатоцеллюлярной карциноме (часто), инвазии сосуда злокачественными опухолями поджелудочной железы, желудка, иногда при эклампсии, после оперативных вмешательств по поводу патологии печени, желчевыводящей системы и поджелудочной железы, спленэктомии, при всех состояниях связанных с замедлением кровотока (констриктивный перикардит, застойная сердечная недостаточность, обструкция печеночных вен) или повышенной вязкостью и свертываемостью крови. Редко отмечают врожденные сужения портальной вены, ее сдавления ЛУ или метастазами опухолей. Выяснение уровня повышения давления разрешает диагностические проблемы.
- Внутрипеченочный пресинусоидальный блок развивается при блокаде в области ворот. Типично повышение внутриселезеночного давления при нормальном внутрипеченочном. Выявляют при врожденном фиброзе печени (составляет до 10% всех портальных гипертензий первых двух десятилетий жизни) и шистосомозе. В отличии от цирроза функции печени не нарушены. Клиника обусловлена спленомегалией и кровотечениями из варикозно расширенных вен пищевода. В случае раннего диагноза портосистемный анастомоз кардинально меняет трагический прогноз на благоприятный. Редко диагностируют первичную идиопатическую портальную гипертензию. Обычно ее выявляют при ангиографии грубых механических препятствий ближе к воротам печени.
- Внутрипеченочный постсинусоидальный блок — это цирроз печени. Повышается как внут- риселезеночное, так и внутрипеченочное давление. Анамнез, нарушение функций печени позволяют установить диагноз.
- Веноокклюзивная болезнь — облитерация мельчайших печеночных венул, но не больших ветвей печеночных вен. Возникает ишемический некроз печени, цирроз. Повреждение венул вызывают алкалоиды из трав Crotalaria и Senecio, диметилнитрозамин, афлатоксин, азатиоприн и противоопухолевые препараты, ионизирующее излучение, реакция трансплантат против хозяина. Венооклюзивная болезнь проявляется асцитом и спленомегалией.
- Пост- или надпеченочный блок — результат затруднения кровотока по венам печени или по воротной вене между печенью и правым предсердием. Развивается при констриктивном перикардите, правожелудочковой недостаточности и при синдроме Бадда — Киари. Синдром Бадда — Киари является результатом блокады hepaticae или нижней полой вены на участке между венами печени и правым предсердием. Обструкцию обусловливают тромбы или соединительно-тканные мембраны, остающиеся на месте тромбов или пролиферативного воспаления. Характеризуется значительным увеличением печени, ее выраженной болезненностью, быстро развивающимся асцитом с высоким содержанием белка в жидкости.
Протекает в двух вариантах:
- Первый, более благоприятный, развивается в течение месяцев и даже лет субклинически. Блок частичный и касается прежде всего нижней полой вены. Развивается при сдавлении опухолью, при тромбозе, при облитерирующем эндофлебите. Последнее состояние может быть спровоцировано и «огуречной травой», выращиваемой на балконах дтя салатов. К тромбозу этой локализации предрасполагает истинная полицитемия, миелопролиферативные заболевания, пероральные контрацептивы, беременность. При быстром увеличении размеров и болезненности печени с асцитом, коллатералями следует подумать о синдроме Бадда — Киари. Трансаминазы повышены за счет гибели гепатоцитов в застойной печени. Гистологически определяют большие поля внутрилобулярных некрозов и признаки венозного застоя. При эхоГ видны расширенные вены печени и увеличенная квадратная доля.
- Второй вариант, катастрофический, с быстрым, в течение нескольких дней фатальным исходом, формируется при тромбозе vv. hepaticae.
Поражение a. hepatica во врачебной практике встречается реже, чем патология венозной системы. Печеночная артерия вариабельна по своему ответвлению, количеству стволов, но клиническое значение этих вариантов не существенно, если не принимать во внимание хирургические и ангиографические проблемы.
Тромбоз a. hepatica обычно вызывается артериитом. До 60% всех случаев узелкового периартериита протекают с тромбозом печеночной артерии или ее ветвей, в 15% приводят к инфаркту печени. Тромбоз может быть вызван также травмой, ангиографией с перфузией противоопухолевых препаратов, трансплантацией печени.
Аневризма печеночной артерии появляется при узелковом периартериите, инфекции, артериосклерозе, травме. Может сдавливать общий желчный проток с развитием механической желтухи. Без лечения аневризма в 75% случаев прорывается в общий желчный проток, брюшную полость (симптом острого живота), полые органы. Диагностируется КТ с усилением, допплерографически и эхоГ, ангиографически.
Жидкость в брюшной полости чаще всего появляется при асците (рис. 24.5) и обсеменение брюшины злокачественными опухолями, но возможна и при других состояниях.
Схематично их можно представить как:
- венозный застой (портальная гипертензия, синдром Бадда — Киари, застойная сердечная недостаточность, констриктивный перикардит). Типично сочетание асцита и периферических отеков;
- гипопротеинемический асцит при нефротических синдромах часто возникает при ДБСТ;
- блокада оттока лимфы (хилезный);
- синдром Мейгса (одновременное наличие асцита и правостороннего плеврального выпота за счет непосредственного поступления асцитической жидкости по прямым лимфогенным путям в плевральную полость);
- гемоперитонеум (травма);
- гнойный, туберкулезный, панкреатогенный, билиарный, карцинозный перитониты.
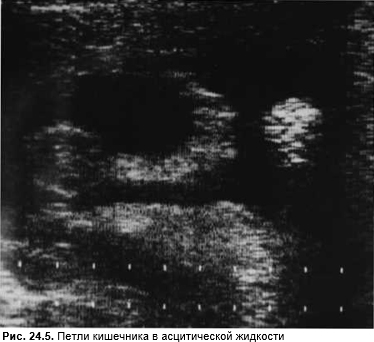
Исследование асцитической жидкости помогает установить правильный диагноз.
Транссудат имеет удельный вес 1005–1015, содержание белка <25 г/л. Возникает при нарушениях венозного оттока: застойная сердечная недостаточность, констриктивный перикардит, портальная гипертензия, цирроз. Цитоз скудный. Обычно абактериальный, его появление не связано с температурной реакцией. Половина всех карциноматозов брюшины протекает с образованием транссудата. При циррозе содержание белка, особенно при повторных пункциях, может достигать 3 г/л и более, увеличивается и удельный вес. Одновременное повышение температуры и появление транссудата подозрительно на наличие туберкулезного перитонита. Этот вариант представляет большие трудности в диагностике. Обычно туберкулезный перитонит развивается постепенно, редко остро. Симптомы раздражения брюшины в отличие от других форм бактериальных перитонитов не выражены. Лейкоцитоз умеренный или даже не отмечаается. СОЭ существенно повышена. При бактериоскопии перитонеальной жидкости возбудителей туберкулеза удается выявить только в 5–6% случаев, методом бактериальных культур не более чем в 45%. Поэтому особое значение придается лапароскопии и биопсии. При продуктивных хронических формах объем асцитической жидкости существенно уменьшается. Организация фибрина ведет к спаечным процессам и непроходимости.
Экссудат чаще имеет воспалительное происхождение, удельный вес >1018, содержание белка достигает 3 г/л и более, цитоз выражен. Может быть серозным, геморрагическим (в половине всех случаев обусловлен карциноматозом, остальные 50% приходится на травмы, тромбоз портальной вены, туберкулез, очень редко панкреатит), фибринозным, хилезным. Экссудат выявляют при коллагенозах, синдроме Бадда — Киари, но наиболее важным ДД-направлением является исключение мезотелиомы у людей, контактировавших с асбестом, или карциноматоза брюшины. Метастатическое обсеменение брюшины диагностируется нелегко. Боль может быть неинтенсивной, в поздних стадиях прощупываются узлы. Лапароскопия и цитологическое исследование решают проблемы.
Хилезный асцит — свидетель затруднения оттока лимфы через грудной проток. Может быть воспалительным (33%), опухолевым (30%), идиопатическим (25%), травматическим, в тропических регионах филяриозным. Псевдохилезный асцит не связан с нарушением лимфооттока по ductus thoracicus, не состоит из лимфы, а напоминает ее своей непрозрачностью и опалесценцией из-за высокого содержания белка. Развивается при опорожняющихся в брюшную полость кистах, например овариальных.
Мукоцеле аппендикса или яичника, прорвавшись в брюшную полость, дает симптомы медленно развивающегося асцита. Опухолевые узлы не прощупываются. При лапароскопии или лапаротомии получают типичную вязкую слизистую массу.
Увеличение живота (псевдоасцит), симулирующее асцит, отмечают при овариальных или ретенционных кистах, целиакии, метеоризме, быстро развивающемся ожирении. В качестве казуистических случаев ложной диагностики указывают на беременность.