Одышка субъективно выражается ощущением нехватки воздуха, невозможности глубокого вдоха, стеснением в груди, необходимостью дополнительных усилий для дыхания. Одышка — это необходимость для больного совершать частые дыхательные движения вне зависимости от его осознанной воли. Патофизиологическая основа одышки — несоответствие между потребностью организма в кислороде и обычными дыхательными движениями. Одышка подразделяется на одышку при тяжелой физической нагрузке (ходьба по лестнице), при минимальной нагрузке (ходьба по горизонтальной поверхности) и одышку в покое. Одышка характеризуется частотой дыхательных движений, одышкой в положении лежа или сидя, периодичностью и глубиной дыхательных движений. Одышка условно подразделяется на:
- кардиальную (недостаточный для эффективного газообмена сердечный выброс);
- легочную:
1) повышенное сопротивление дыханию (БА, трахео- или бронхостеноз, бронхиты, эмфизема);
2) снижение площади газообмена и эластичности легких (пневмосклероз);кардиального генеза
3) увеличение мертвого пространства (эмболия легких);
4) паралич диафрагмы и/или слабость других дыхательных мышц;
5) деформации грудной клетки (кифосколиоз); - экстрапульмональную. Возникает при беременности, ожирении, действии некоторых лекарственных препаратов, эмоциональной лабильности, нарушениях центральной регуляции, анемии, гипоксии, гипоксемии, метаболическом ацидозе, гипертиреозе, лихорадке.
Часто одышка обусловлена одновременным действием нескольких причин. Кардиальные и экстрапульмональные варианты одышки протекают с альвеолярной гипервентиляцией. Легочная одышка может протекать с альвеолярной гипо-, с гипервентиляцией и по смешанному типу.
Семиотика кардиальной одышки
Одышка является ранним признаком сердечной недостаточности, поэтому при возникновении одышки врач всегда думает прежде всего о патологии сердца. Исключают кардиальный генез одышки следующие признаки: отсутствие анамнестических сведений о заболеваниях сердца, нормальные размеры сердца (исключение представляет рестриктивная КМП, гипоплазия ЛЖ, констриктивный перикардит, стеноз левого AV-отверстия), нормальное венозное давление, нормальные показатели ЭКГ и эхоКГ, отрицательные результаты нагрузочных проб, преимущественно левосторонний выпот в плевру (при сердечной недостаточности выпот чаще правосторонний), снижение интенсивности дыхательных шумов.
Важнейшим свидетельством кардиальной одышки является поражение клапанного аппарата, миокарда или перикарда, другие клинико-инструментальные симптомы заболеваний сердца. Одышка при заболеваниях сердца обусловлена отеком стенки бронхиол, паренхимы легких или альвеол либо несоответствием сердечного выброса метаболическим потребностям организма. В последнем случае она может протекать без отека легких. Не каждый случай сердечной недостаточности может сопровождаться одышкой. Например, после приема диуретиков в высоких дозах одышка может отсутствовать, хотя эхоГ достоверно фиксирует снижение сократительной и/или диастолической функции миокарда.
Кардиальная одышка в отличие от легочной протекает без экспираторных затруднений, уменьшается в вертикальном положении больного (ортопноэ) и в покое, усиливается в положении лежа и при нагрузке, газовый состав крови в норме, в то время как при легочной одышке возникает гипоксемия, гиперкапния и респираторный ацидоз. При кардиальной одышке возможно развитие дыхания Чейни — Стокса, которое в этих случаях свидетельствует не о мозговых нарушениях, а о несоответствии напряжения газов в альвеолах и центральной регуляции дыхания в результате замедленного движения крови.
Одышка, важнейший симптом застойной сердечной недостаточности, сочетается с другими признаками этого состояния. Прежде всего — это увеличение размеров сердца. Застойная сердечная недостаточность обусловлена уменьшением выброса и увеличением остаточного объема крови в желудочках, что приводит к их растяжению. В большинстве случаев это ведет к депонированию крови на периферии и признакам застойных легких. Но застой в легких не означает обязательного расширения границ сердца. Так, при стенозе левого AV-отверстия при констриктивном перикардите или рестриктивной кардиомиопатии (КМП) застой крови в легких развивается без увеличения размеров ЛЖ. Остро развившаяся недостаточность митрального или аортального клапанов также может сопровождаться застоем в легких с нормальными или незначительно расширенными границами сердца. Точно так же острые нарушения ритма сердца могут протекать с застоем в легких и неизмененным диаметром ЛЖ. При наличии застоя в легких и нормальных или незначительно увеличенных размерах сердца следует помнить о возможности преимущественно диастолической недостаточности: высокой ригидности миокарда. Она развивается при инфильтративных, рестриктивных и гипертрофических КМП, констриктивном перикардите.
Умеренное увеличение размеров сердца не обязательно свидетельствует о сердечной недостаточности. Большое сердце формируется у спортсменов и рабочих, занятых тяжелым физическим трудом. В этих ситуациях при нагрузочных пробах в отличии от сердечной недостаточности выявляют значительные резервные возможности. Увеличение размеров сердца отмечают и при выпотах в полость перикарда. При этом рентгенологически отмечают снижение пульсации контура сердечной тени, перекрытие нормальных по размерам ворот легких срединной тенью. В отличие от перикардиального выпота при сердечной недостаточности ворота легких расширены и сдвинуты латерально. Но окончательный диагноз возможен только после проведения эхоКГ, позволяющей визуализировать каждую оболочку сердца в отдельности.
Признаком кардиальной патологии является высокий и приподнимающий верхушечный толчок, особенно опущенный в шестое межреберье. Исключением являются случаи смещения сердца при кифосколиозе, воронкообразной или килевидной грудной клетке, высоком стоянии правого купола диафрагмы. Сердечный толчок, визуализируемый в нижней части грудины, в области четвертого и пятого межреберья слева парастернально свидетельствует о расширении ПЖ, но возможен и при тяжелой митральной недостаточности. Этот феномен объясняется подъемом сердца и его смещением вперед за счет увеличенного левого предсердия.
Традиционно большое внимание врачи уделяют оценке пульса. Пульс необходимо оценивать на каротидных артериях, на руках и на ногах симметрично. Оценивают эластичность артерии, частоту пульса и его ритм, наполнение (полный пульс; высокий, слабого наполнения и напряжения; низкий, очень слабый; нитевидный), форму пульса. Последний феномен лучше всего прослеживать на сонных артериях. «Скачущий», высокий пульс типичен для АГ, гиперметаболических состояний, аортальной регургитации, открытого артериального протока. Пульс с двумя пиками и быстрым подъемом отмечают при гипертрофической обструктивной КМП.
Аускультация сердца чрезвычайно важна для установления причин сердечной недостаточности. I тон возникает при захлопывании створок митрального и трехстворчатого клапанов, при натяжении хорд. Мощный миокард ЛЖ быстрее создает давление закрытия левого AV-отверстия, поэтому митральный клапан закрывается чуть раньше трикуспидального. Обычно это несоответствие времени закрытия митрального и трехстворчатого клапанов не улавливается ухом, но у детей, подростков и астеничных юношей возможно небольшое расщепление I тона. Расщепление тонов врач улавливает при аускультации фонендоскопом, если интервал между компонентами составляет не менее 0,02 с. Расщепление лучше выслушивается на выдохе, когда физиологически повышается давление в малом круге и соответственно повышается давление выброса в ПЖ и исчезает на вдохе. Патологическое расщепление I тона отмечают при блокаде правой ножки пучка Гиса с запаздыванием распространения возбуждения по ПЖ, при повышении давления в правом предсердии в случаях стеноза правого AV-отверстия. При аналогичных состояниях (блокада левой ножки пучка Гиса, стеноз левого AV-отверстия) происходит запаздывание митрального компонента I тона и за счет этого возникает его расщепление. В тяжелых случаях возникает громкий («пушечный») I тон или, в особенно неблагоприятных ситуациях, он выслушивается после тона закрытия трехстворчатого клапана. Блокада левой ножки пучка Гиса сопровождается асинхронным сокращением миокарда ЛЖ, медленным повышением давления в ЛЖ, поэтому митральный компонент I тона приглушен. Расщепление I тона может быть обусловлено и дополнительным щелчком изгнания за счет пороков аорты, дилатации и удлинения аорты при АГ, при врожденных пороках или при Л Г. Искусственные клапаны аорты дают в начале изгнания высокочастотный металлический щелчок, вызванный ударом шарика или диска о кольцо. Нередко его выслушивают даже на расстоянии. Биопротезы дают очень тихий или совсем не слышный щелчок.
II тон возникает за счет смыкания полулунных заслонок аортального и пульмонального клапанов. Легочный компонент II тона запаздывает по отношению к аорте. Расщепление отчетливее выслушивается на вдохе и может полностью исчезнуть на выдохе. Парадоксальное расщепление, то есть выслушивание аортального компонента после пульмонального, отмечают при значительном запаздывании закрытия клапана аорты. Подтверждением этого является одновременно записываемая сфигмограмма, где четко регистрируют инцизуру аортального компонента. Запаздывание аортального компонента II тона наблюдается при блокаде левой ножки пучка Гиса и при выраженном стенозе аорты. Запаздывание легочного компонента выявляют при стенозе легочной артерии, дефектах межпредсердной перегородки и блокаде правой ножки пучка Гиса. Стеноз легочной артерии сопровождается приглушением II тона, а дефект межпредсердной перегородки (в отличии от блокады правой ножки) приводит к стабильному расщеплению, не зависящему от вдоха или выдоха.
Дополнительные тоны необходимо дифференцировать от расщепленного II тона.
Тон открытия митрального клапана, высокочастотный и раннедиастолический, появляется через 0,06–0,12 с после захлопывания аортального клапана. Высокочастотный тон открытия митрального клапана типичен для искусственных шариковых или дисковых протезов и свидетельствует об их нормальном функционировании. При имплантированных биопротезах тон открытия митрального клапана очень тихий.
Протодиастолический галоп — физиологический III тон для астеничных юношей, как патологический он рассматривается при объемной перегрузке ЛЖ или ПЖи при перикардиальном фиброзе. III тон называют еще перикардиальным ударом. Он выслушивается в раннюю диастолу, когда резко расширяется неэластичный ЛЖ при его пассивном заполнении. Поэтому протодиастолический галоп отмечают при митральной недостаточности, застойной сердечной недостаточности и констриктивном перикардите. Правожелудочковый III тон наилучшим образом выслушивается в положении пациента лежа на спине в период глубокого вдоха (резкое усиление притока в ПЖ). Левожелудочковый III тон следует выслушивать в положении пациента на левом боку в период глубокого выдоха (наиболее тесное соприкосновение сердца с грудной клеткой).
IV тон, предсердный, как и III, может приводить к формированию ритма пресистолического галопа и является тоном наполнения камер. У здоровых лиц выслушивается крайне редко. Если регистрируется увеличение интервала P–Q, то тихие предсердные тоны определяются достаточно часто. В патологических условиях выслушивается при торможении притока в ЛЖ за счет высокого сопротивления наполнению и сопутствует АГ, стенозу устья аорты, миокардиосклерозу, КМП. IV тон описан и при хронической перегрузке объемом без повышения сопротивления притока крови в желудочки при тяжелой анемии, гипертиреозе, больших периферических артериовенозных фистулах. Если III и IV тон выслушиваются одновременно, то говорят о суммационом галопе, что наблюдается при тахикардии.
Между I и II тонами иногда выслушивается короткий высочастотный дополнительный тон (мезосистолический щелчок). Нередко за ним следует позднесистолический шум. Раньше мезосистолический щелчок трактовался как результат перикардиальных или плевроперикардиальных спаек и воспринимался врачами достаточно спокойно. Но применение эхоКГ, которое вызвало буквально взрыв информации о пролапсе митрального клапана, не оставило сомнений, что описанный звуковой феномен обусловлен именно пролабированием створок. Щелчок возникает при резком натяжении сосочковых мышц, хорд и створок митрального и/или трехстворчатого клапана. Позднесистолический шум — нечто иное, как возникающая за щелчком регургитация. Различают первичный (конституциональный) генетически обусловленный пролапс митрального клапана, протекающий с мукоидной дегенерацией створок и хорд, и вторичный. Первичный пролапс митрального клапана в популяции выявляют с частотой 5%, а по некоторым данным — в 10% случаев. У женщин молодого возраста его регистрируют в 2 раза чаще, чем у мужчин. Это проявление синдромов гипермобильности и долихостеномелии. Обусловлен патологией того же гена на 15-й хромосоме (15qI5–21), который изменяется и при синдроме Марфана. Вторичный пролапс возникает редко при инфаркте верхушки сосочковых мышц, болезни Эбштейна, дефектах межпредсердной перегородки, обструктивной гипертрофической КМП, тяжелой общей дистрофии (например при нервной анорексии). Не исключено, что по мере расшифровки генетических изменений при врожденных пороках сердца, миокардиопатиях и сопутствующих им изменениях соединительной ткани, прежде всего фибриллина, частота вторичного пролапса окажется еще меньшей.
Однако не каждый систолический щелчок связан с пролапсом. Систолический щелчок (клик) может выслушиваться при врожденном стенозе клапана аорты или легочной артерии. Он вызывается резким напряжением миокарда. Щелчок выслушивается тут же за I тоном, в раннюю систолу. Его положение относительно I тона сердца не меняется с изменением гемодинамики. Такой же фиксированный щелчок выслушивается и при тяжелой ЛГ.
Щелчок при миксоматозной дегенерации створки клапана может возникнуть в любой период систолы. При снижении объема наполнения ЛЖ (проба Вальсальвы в положении больного стоя) щелчок сдвигается к I тону. При увеличении объема наполнения (в положении лежа на спине) щелчок выслушивается ближе ко II тону (особенно при пролапсе трехстворчатого клапана).
По трудно объяснимым причинам (вегетативный тонус? условия гемодинамики?) характеристики систолических щелчков весьма варьируют при аускультации одного и того же пациента в разные дни.
Шумы сердца могут быть систолическими, диастолическими и сочетанными. Шумы необходимо оценивать по высоте, громкости, времени возникновения, продолжительности.
Высокочастотные шумы наилучшим образом улавливаются фонендоскопом, а низкочастотные — стетоскопом.
Систолические шумы оцениваются как шумы выброса (эжекции) при истечении турбулентного потока крови через измененные выносные отверстия или регургитационные и шунтовые (сброс крови в камеру с низким давлением). Шум выброса обычно тем громче и длительней, чем выше степень обструкции. Систолические шумы обычно веретеновидные (сгеscendo–diminuendo). Чем выше степень стеноза, тем длительней переход фазы crescendo в фазу diminuendo. Мягкий систолический шум у детей может возникать без каких-либо гемодинамических нарушений и обусловлен возрастной турбулентностью потока.
У многих беременных во втором межреберье слева или справа от грудины выслушивается мягкий систолический шум. Он обусловлен повышением скорости кровотока и увеличением объема циркулирующей крови. Звучность шума резко возрастает при анемии.
Диастолические шумы обусловлены стенозом митрального или трикуспидального клапанов или регургитацией из аорты или легочной артерии. Если шум над митральным или трикуспидальным клапаном возникает при тромбах или опухолях предсердия, то он может меняться в зависимости от положения тела или даже вовсе исчезать как результат изменения позиции внутрисердечного образования.
Патологические изменения ЭКГ отмечают у большинства пациентов с одышкой сердечного генеза как результат длительно существующей перегрузки объемом или давлением или ишемии миокарда. В редких случаях (спустя годы после небольшого инфаркта или при дилатационной кардиомипатии) патологические изменения на ЭКГ, несмотря на наличие симптомов левожелудочковой недостаточности, могут отсутствовать. Кроме этого, депрессия участка ST и уменьшение амплитуды зубца Т могут быть неспецифичны и не свидетельствовать в пользу кардиального генеза одышки. Так, при истинно легочной дыхательной недостаточности при остром приступе БА возможны снижение амплитуды зубца Т и депрессия сегмента ST, сохраняющиеся в течение нескольких часов и даже дней после приступа.
Сердце спортсмена. Типичны синусовая брадикардия покоя, III и IV тоны, систолический шум, изменения на ЭКГ, расширение тени сердца на рентгенограмме. Этот набор признаков — явное свидетельство патологии у обычных людей (так и хочется сказать — здоровых), но у спортсменов — проявление благополучной адаптации к сверхнагрузкам. Поэтому в практике врача возникает проблема ДД патологических и благоприобретенных признаков.
Увеличение общего объема сердца и массы миокарда в целом соответствует увеличению скелетных мышц и особенно заметно при статических нагрузках. Увеличиваются все камеры сердца, но прежде всего за счет миокарда, не за счет внутренних размеров, которые остаются достаточно стабильными. Нарастание сердечного выброса идет по пути увеличения максимального ударного объема. У нетренированных людей прирост величины сердечного выброса отмечается за счет повышения ЧСС, а у выносливых спортсменов — за счет увеличения ударного объема.
У атлетов внутрисердечное давление в покое не изменено. Ударный выброс и потребление тканями кислорода повышено и в покое, и при нагрузке. Увеличение периода диастолического наполнения (брадикардия) также способствует увеличению ударного объема и коронарному кровотоку, который и происходит в основном в диастолу. Повышается уровень гемоглобина и объем циркулирующей крови, что облегчает транспорт кислорода. ЧСС в покое и при субмаксимальных нагрузках снижена. Но как только прекращаются тренировки, размер сердца уменьшается, а ЧСС повышается.
АД У спортсменов обычно мало отличается от АД у нетренированных людей, но каротидный пульс усилен. Верхушечный толчок гипердинамичный. Прослушивается III тон (быстрое наполнение ЛЖ в раннюю диастолу), IV тон выслушивается реже. По левому краю грудины регистрируется систолический шум, происходящий при неламинарном течении большого ударного объема через устья аорты и легочной артерии. Шум лучше выслушивается в положении лежа, уменьшается в положении пациента стоя. Рентгенологически тень сердца округлена, расширена.
На ЭКГ для атлетов типичны синусовая брадикардия, часто с синусовой аритмией или даже миграцией суправентрикулярного водителя ритма. У 32% атлетов регистрируется AV-блокада I степени. Может появиться блокада И степени типа Мобитц I, прежде всего в покое и исчезающий при нагрузке. Возможен эктопический предсердный ритм. Аритмии бессимптомные, уменьшаются или исчезают при нагрузочной тахикардии. Вольтаж комплекса QRS и зубца Т повышен, зубец U высокий. Часты нарушения реполяризации (ST–T), нормализующиеся при тахикардии.
На эхоКГ миокард утолщен, камеры сердца незначительно расширены.
Наличие и выраженность всех вышеуказанных изменений несвязаны напрямую с характером и длительностью нагрузки.
Скоропостижная смерть у молодых здоровых спортсменов значительно чаще, чем в общей популяции. Обусловлена она, видимо, предшествующими изменениями сердца (недиагностированным миокардитом, врожденными аномалиями коронарных артерий, гипертрофической КМП) и возникающей вследствие этого аритмией. Появление последней облегчается брадикардией с длительным рефрактерным периодом, что провоцирует возникновение эктопических желудочковых разрядов.
Следует помнить о фармакологической нагрузке на спортсменов, о которой не любят распространяться.
Общие признаки сердечной недостаточности
Из общих признаков застойной сердечной недостаточности важны анамнестические указания на ИБС, перенесенные ревматические атаки, миокардит, повышенная утомляемость, развитие одышки при нагрузке, ночное ортопноэ, никтурия, нарушения ритма сердца. При клиническом обследовании наряду с расширением границ сердца, перикардиальным или плевральным выпотом, признаками застоя в легких (влажные мелкопузырчатые незвучные хрипы, характерные для левожелудочковой недостаточности) необходимо обратить внимание на наличие возможных признаков правожелудочкой недостаточности: набухшие вены шеи, периферические отеки, «застойные почки» (протеинурия), гепатомегалия. Примечательно, что увеличение размеров печени на 1–2 см даже без ее болезненности и без закругления края, уже указывает на депонирование ею 1–2 л крови.
В целом же симптомами правожелудочковой недостаточности являются ощущение тяжести в правом подреберье и увеличенная чувствительная печень, метеоризм, склонность к диарее, расширенные вены, отеки, асцит, протеинурия.
К признакам левожелудочковой недостаточности относят одышку, ортопноэ, ночные приступы сердечной астмы, застой в легких с крепитирующими хрипами, кровохарканье, сидерофаги («клетки пороков сердца») в мокроте, отек легких, протодиастолический ритм галопа и альтернирующий пульс.
Повышение венозного давления проще всего определить по напряженным яремным венам у пациента в положении лежа, которое не снижается после подъема туловища на 45%. Застойные вены — важнейший ДД признак гемодинамически значимой сердечной недостаточности в противоположность коллапсу, при котором вены выглядят «пустыми». При этом должны быть исключены механические препятствия движению крови по верхней полой вене, что отмечают при лимфомах. Застойные яремные вены возможны при так называемом гепатоюгуллярном рефлюксе — раннем симптоме правожелудочковой недостаточности (см. Правожелудочковая сердечная недостаточность). Отсутствие систолического коллабирования шейных вен и повышение волны V на флебограмме свидетельствует о недостаточности трехстворчатого клапана. При этом на вдохе венозное давление не снижается, а нередко и повышается. Этот признак свойственен не только трикуспидальной недостаточности, но и констриктивному перикардиту (симптом Куссмауля). Нарушения притока крови в ПЖ при его гипертрофии, стенозе трехстворчатого клапана сопровождаются высокой A-волной на флебограмме. Особенно значительные нарушения притока крови в ПЖ возникают при одновременном сокращении предсердия и желудочка. При узловом ритме в каждом сердечном цикле на флебограмме отмечаются гигантские A-волны. При полной AV-блокаде они появляются нерегулярно.
Пульс достаточно надежно отражает наличие сердечной недостаточности. Первоначально появляется тахикардия как отражение повышенной симпатикотонии. Альтернирующий пульс свидетельствует о существенном нарушении функции ЛЖ и наблюдается при декомпенсированной гипертонии, после инфарктов миокарда, стенозе аорты. Альтернирующий пульс, возникающий при аритмии, характеризуется сочетанием слабых и сильных пульсовых толчков при их регулярности. В период измерения АД при максимальном напряжении манжетки вначале прослушиваются тоны Короткова, соответствующие сильным пульсовым толчкам. По мере снижения давления в манжетке и с его снижением до САД слабых сокращений частота тонов Короткова неожиданно повышается вдвое.
Неинвазивная диагностика
Рентгеновские исследования выявляют застойную недостаточность по наличию расширенных и распространенных латерально корней легких, повышению их рентгенконтрастности с утерей обычной внутренней структуры, расширению легочных вен, особенно в верхних полях и по наличию плеврального выпота (чаще правостороннего). При остро возникающей тяжелой сердечной недостаточности застой в легких выглядит как симметричное бабочкообразное затемнение. При тяжелых формах альвеолярного отека легких давление в левом предсердии составляет 26 мм рт. ст. При более легких формах интерстициального отека давление в левом предсердии колеблется от 18 до 25 мм рт. ст. Хотя значительное повышение давления наполнения левого предсердия всегда сопровождается рентгенологическими признаками застоя в легких, сами рентгеновские признаки застоя в легких даже при наличии патологии сердца не всегда формируются при критически повышенном давлении наполнения. Радиологические признаки отека легких без повышения внутрипредсердного давления или при его незначительном повышении описаны у пациентов с инфарктом миокарда.
Данные эхоКГ позволяют оценить характер движения практически всех структур сердца, определить их состояние, охарактеризовать сократимость и эластичность миокарда, при секторальном сканнирова- нии изучить регионарную сократимость, наличие зон акинезии, выявить аневризмы.
Гемодинамические проявления застойной сердечной недостаточности специфичны и проявляются расширением границ сердца (увеличение конечно-диастолического размера камер сердца, повышение конечно-диастолического давления в желудочках), снижением скорости сокращения циркулярных волокон миокарда (снижение скорости систолического повышения давления), снижение силы сокращения (снижение фракции изгнания — отношение УОК к конечно-диастолическому объему, уменьшение УОК).
Клинические аспекты применения различных режимов эхоКГ приведены ниже.
- Клапанные пороки сердца, эндокардиты:
- М-развертка; 2-D. Непосредственная визуализация; определение площади AV-отверстий.
- Допплерография спектральная и цветная. Определение регургитации и гемодинамических градиентов, турбулентности.
- Трансэзофагеальный доступ. Изображение протезов клапанов; определение вегетаций, тромбов в левом предсердии.
- Камеры сердца:
- М-развертка; 2-D. Измерение толщины стенок; размеров камер сердца; массы миокарда; глобальные и региональные показатели функции миокарда.
- Допплерография. Сердечный выброс; внутрисердечное давление; диастолические характеристики.
- Врожденные пороки сердца:
- 2-D. Прижизненная анатомическая картина.
- Допплерография. Гемодинамика и шунты.
- Контрастирование. Выявление право-левых шунтов.
- Патология коронарных сосудов сердца:
- 2-D, М-развертка, стресс-эхоКГ, допплерография. Регионарная сократимость миокарда ЛЖ и ПЖ; диагностика инфаркта миокарда и его осложнений. Выявление аневризм при артериитах.
- КМП:
- М-развертка, 2-D, допплерография. Наличие, тип и выраженность КМП; наличие или отсутствие обструкции при гипертрофической КМП.
- Объемные образования:
- 2-D, М-развертка, трансэзофагеальная эхоКГ. Выявление объемных образований, их локализация (в стенке камеры, в перикарде, экстракардиально, в камере сердца), характер (воспаление, тромб, опухоль).
- Болезни перикарда:
- 2-D, М-развертка, допплерография. Наличие и объем выпота в полость сердечной сорочки; возможности диагностики констриктивного перикардита ограничены.
- Патология аорты:
- 2-D; цветная допплерография; трансэзофагеальный доступ. Обследование восходящей аорты, синуса Вальсальвы.
- Перикардиоцентез:
- 2-D с контрастом. Определение позиции иглы, повышение безопасности.
Эргометрия — важнейшее исследование в ранней оценке функциональной способности органа, поскольку в покое его функция может быть достаточной для компенсации потребностей организма.
Но нет ни одного стандартного монотеста для выявления собственно право- или левожелудочковой недостаточности. Нагрузка на бегущей дорожке, велоэргометрия, пробы с изометрической нагрузкой и другие выявляют не только состояние резервных возможностей миокарда, но и зависят от функции легких, кислород-транспортной функции крови (содержание гемоглобина), уровня тренированности пациента. В случае нормальной функции легких, нормальных показателей гемоглобина при уже установленном заболевании сердца при снижении толерантности к физической нагрузке можно с уверенностью говорить о снижении насосной функции сердца. Но и снижение этой функции может быть обусловлено целым рядом причин: дистрофические или воспалительные изменения миокарда, ИБС и кардиосклероз, нарушения ритма, пороки сердца, нарушения оттока или притока крови в камеры сердца. Если все эти причины отсутствуют, то можно думать о детренированности испытуемого.
Проведение эргометрии с субмаксимальной нагрузкой оптимальней всего с помощью велоэргометра. Проба основывается на достижении ЧСС в 170 уд./мин с удержанием ее стабильной достигнутой нагрузкой в течение 3 мин. Обязательным условием безопасного проведения нагрузочной пробы является удовлетворительное самочувствие пациента и контроль ЭКГ. В возрасте старше 40 лет субмаксимальная частота пульса снижается и рассчитывается по формуле: 210 минус возраст (в годах). Существуют диаграммы по расчету нагрузки по частоте пульса. Нормальные показатели субмаксимальной нагрузки зависят от пола, возраста, площади тела. Для объективизации отдельных конкретных результатов значения, достигнутые испытуемым, вычисляются в процентах от табличных, которые принимаются за 100%. В норме индивидуальные результаты не должны составлять менее 80%. Золотым правилом интерпретации результатов являются следующие положения: 1. Частота пульса 170 уд./мин при высокой нагрузке и увеличенных размерах сердца — тренированное сердце. 2. Частота пульса 170 уд./мин при низкой нагрузке (в Вт) и небольших размерах сердца — свидетельство детренированности. 3. Частота пульса 170 уд./мин при низкой нагрузке и большом сердце — недостаточность миокарда.
Нагрузочные пробы малодостоверны, а то и невозможны на фоне приема препаратов наперстянки, блокады ножек пучка Гиса, у женщин (у здоровых женщин тест с максимальной нагрузкой в 50% случаев по неизвестным причинам ложноположительный), у людей старческого возраста, больных с артритом и ожирением. Поэтому по показаниям проводят перфузию миокарда изотопом таллия 201Т1, в том числе с инъекциями дипирадомола или аденозина. Ложноотрицательный результат может быть обусловлен одновременным приемом теофиллина или кофеинсодержащих препаратов или пищевых продуктов. Их необходимо исключить не менее чем за 1 сут до исследования.
ЯМР или магнитно-резонансная томография (МРТ) даже при одиночном исследовании представляет врачу иногда больше информации, чем целый комплекс других методик. Изображение сердца, коригированное по ЭКГ, позволяет получить более качественную картину, чем КТ или эхоКГ. Возможна очень четкая визуализация миокарда, его подвижности, определение объема камер и наличие опухолей итромбов. Применение парамагнитных контрастных средств служит для оценки перфузии миокарда, причем с большей точностью, чем радионуклидные методики. Магнитно-резонансная ангиография выявляет кровоток в больших коронарных артериях, а магнитно-резонансная спектроскопия позволяет верифицировать очаг инфаркта миокарда.
В специализированных научных учреждениях применяют позитронно-эмиссионную томографию. Методика основана на использовании изотопов, испускающих протоны. Позитроны быстро взаимодействуют с электронами, пара аннигилируется, выбрасывая два гамма-фотона, разлетающихся под углом 180°. В качестве источника позитронов используют изотопы 11С, 15О, 13N. Непревзойденное преимущество методики состоит в ее чувствительности, разрешающей способности и самое главное — в возможности прижизненного непосредственного изучения биохимизма ткани. Но все эти преимущества очень сильно умаляются высокой стоимостью детектора и коротким периодом (<20 мин) полураспада изотопов, что требует размещения исследовательского центра непосредственно рядом с циклотроном.
ДД этиологических факторов сердечной недостаточности
Сердечная недостаточность может быть обусловлена механическими и биохимическими факторами. Механические причины сердечной недостаточности — итог хронической перегрузки камер сердца объемом и/или давлением при наличии пороков сердца, блокады оттока или притока в камеры (опухоли, констриктивный или значительный по объему выпотной перикардит), выпадением значительной массы миокарда из его общего функционирующего объема (инфаркт, кардиосклероз, болезни накопления). Первичные биохимические причины обусловливают сердечную недостаточность при ферментопатиях, болезнях накопления и кардиомипатиях в узком смысле этого слова. Под КМП по рекомендации ВОЗ понимают патологические состояния мышцы сердца, генез которых не известен (см. ниже), что отличает их от поражения миокарда при системных заболеваниях. Данная градация является условной, поскольку механический и биохимический компоненты присутствуют (о чем свидетельствуют вышеперечисленные нозологические формы и синдромы) при каждой форме сердечной недостаточности, взаимообусловливая друг друга. Исходя из частоты этиологических состояний у пациента молодого возраста с сердечной недостаточностью врач может думать прежде всего о биохимических причинах, миокардиопатиях (прежде всего — дилатационной), врожденных пороках сердца, редко — о ревматических. У лиц пожилого возраста наиболее вероятными причинами застойной сердечной недостаточности являются некорригированная АГ, ИБС, клапанные пороки. В некоторых случаях ведущую роль в формировании сердечной недостаточности играет нарушение диастолических свойств миокарда, а не его сократимости. Но чаще всего оба эти компонента выступают сочетанно.
Особенностью сердечной недостаточности у детей является то, что она не право- или левожелудочковая, а всегда глобальная.
Наряду с общими для детей и взрослых причинами развития (объемная перегрузка, кардит, нарушения ритма и др.), существуют возрастные особенности этиологических факторов:
- Для новорожденных типично: состояния после перинатальной асфиксии, гипокальциемия, гипогликемия, гипотиреоз, тяжелая гемолитическая болезнь, сепсис, критический стеноз аорты, гипоплазия ЛЖ, открытый артериальный проток, атрезия легочной артерии, транспозиция магистральных сосудов, аномальный дренаж легочных вен, критические артериовенозные шунты.
- Для детей 1-го года жизни типичны: дефект межжелудочковой перегородки, AV-канал, персистирующий артериальный проток, аномальное отхождение левой коронарной артерии (синдром Бланд — Вайт — Гарланда), стеноз устья аорты, аномальный дренаж легочных вен.
- У детей и подростков: кардит, КМП, хроническая АГ или ЛГ.
Сердечная недостаточность с первично механическими причинами возникновения. Изменения периферического или легочного кровотока как первичная причина перегрузки миокарда.
Основные признаки правожелудочковой (легочное сердце) и левожелудочковой недостаточности приведены в табл. 18.1.
Таблица 18.1
Основные диагностические критерии недостаточности ЛЖ или ПЖ
| Показатель | Левожелудочковая недостаточность | Правожелудочковая недостаточность |
| Ведущие причины | Последствия инфаркта миокарда, пороки сердца, кардиты, АГ, КМП | Синдром первичной или вторичной ЛГ |
| Цианоз | «Цианоз истощения» при декомпенсации | В большинстве случаев выражен |
| Одышка | Ортопноэ | Субъективно — минимальна, не связана с положением тела |
| Аускультация | Ритм галопа над верхушкой сердца, влажные хрипы в базальных отделах легких, при АГ — усиление II тона над аортой | Усилен легочный компонент II тона, расщепление 1 тона на вдохе в тяжелых случаях отсутствует, ритм галопа над грудиной, аускультативная картина, типичная для хронических неспецифических заболеваний легких |
| Тип застоя | Легкие (вторично, при присоединяющейся правожелудочковой недостаточности — ее признаки) | Вены шеи, печень, периферические отеки, почки. При вторичном биохимическом повреждении миокарда ЛЖ — его недостаточность |
| Рентгенологические признаки | Размеры сердца существенно увеличены, аортальной, митральной или миокардиальной конфигурации. Усилен венозный рисунок в верхних полях легких, наличие застойного выпота | Размеры сердца не изменены или увеличен размер ПЖ, расширение ствола легочной артерии. Картина легких определяется основным заболеванием |
| Гематокрит | Практически не изменен | >50% |
| ЭКГ | Чаще левограмма | Чаще правограмма |
| ЭхоКГ | Все варианты поражения левых отделов | Расширение ствола легочной артерии, изменение траектории движения клапана легочной артерии, расширение ПЖ, расширение приводящих вен, повышение показателя соотношения длительности периодов преэжекции и эжекции ПЖ |
| Оксиметрия | Насыщение крови кислородом не нарушено и после вдыхания чистого 02 повышается до максимума | Насыщение крови кислородом снижено и существенно не меняется после его вдыхания |
| Функциональные легочные пробы | Не изменены или изменены несущественно | Резко изменены |
| Сердечный выброс | Снижен | В норме или снижен, очень редко — повышен |
| АД | В норме, часто повышено, может быть снижено | В норме или снижено |
Хроническая перегрузка миокарда при повышении сопротивления в большом круге кровообращения (гипертензивное сердце)
Диагностика гипертензивного сердца обычно не вызывает затруднений. Границы сердца увеличены влево, верхушечный толчок приподнимающий в шестом межреберье, звонкий усиленный II тон над аортой, систолический шум над верхушкой сердца как следствие относительной недостаточности митрального клапана, в тяжелых случаях аускультативно определяется ритм галопа. Но эти же физикальные изменения возможны и при отсутствии АГ. В таких случаях можно думать либо о снижении АД у пациента с АГ в момент обследования, в частности за счет декомпенсации, либо изменение сердца является результатом миокардиосклероза или миокардиопатии. На ЭКГ у пациентов с гипертензивным сердцем регистрируют признак Соколова (SV1 + RV5 или RV6 > 3,5 мВ) особенно в сочетании с депрессией сегмента ST на 0,1 мВ и более и/или дискордантными зубцами Т. Но в целом ряде случаев АГ эти признаки отсутствуют, хотя на эхоКГ выявляют утолщение миокарда задней стенки ЛЖ или межжелудочковой перегородки до 11–12 мм и более. На рентгенограмме выявляют изменения размеров и конфигурации сердечной тени. Следует еще раз отметить, что нормальные размеры сердца и его обычная конфигурация не исключают заболеваний сердца, хотя с очень большой долей вероятности при такой картине можно говорить об отсутствии застойной сердечной недостаточности.
Исключения могут составлять достаточно редкие случаи констриктивного перикардита, концентрического утолщения миокарда в начальных стадиях болезней накопления, хронический кардит с уменьшенной полостью ЛЖ, констриктивная КМП (например при прогрессирующем системном склерозе, эндокардите Лефлера). Оценка размеров сердца в практике проводится по так называемому кардиоторакальному индексу (КТИ): соотношению размера поперечника сердца к поперечнику грудной клетки. В норме он не превышает 50%. КТИ наряду с размерами сердца зависит от конституционального типа пациента (брахи- или долихостеномелия более известные как гиперстения и астения), массы тела пациента, наличия эмфиземы легких, высоты стояния диафрагмы. Впечатление увеличенного сердца возникает при изучении рентгенограмм пациентов с «лежачим сердцем», с «грудью сапожника» и правосторонним сколиозом. Накопление жира в области верхушки сердца может создать у рентгенолога впечатление расширения сердца. Отличием служит меньшая интенсивность тени жировой капсулы по сравнению с тенью сердца. Увеличение тени сердца без признаков сердечной недостаточности выявляют у спортсменов, а также при некоторых врожденных пороках сердца, например при дефектах межпредсердной перегородки с хронической перегрузкой ПЖ. Изменение конфигурации сердца и расширение его тени характерны при застойной сердечной недостаточности, особенно ярко выражены при дилатационной КМП, при хронической ИБС с повторными инфарктами миокарда и кардиосклерозом. Дифференцировать рентгенологически расширение сердца при дилатации или гипертрофии миокарда очень сложно. Рентгенологическое увеличение силуэта сердца происходит не только за счет поражения самого миокарда (его гипертрофия, дилатация полостей), но и за счет аневризмы миокарда, его опухоли, паразитарной кисты или выпота в перикард. Эту задачу ДД достаточно быстро и надежно решает эхоКГ, позволяющая оценить диаметры камер и толщину миокарда практически во всех сегментах. В поздних случаях дилатации сердца его рентгенологический силует «митрализируется». При гипертензивном сердце его силует приобретает вначале «аортальную» конфигурацию, а затем на первый план выступает митральная конфигурация.
Увеличение размеров ЛЖ рентгенологически обычно протекает поэтапно. Первоначально увеличивается только выносящий тракт, что проявляется удлинением дуги ЛЖ вниз и закругленностью верхушки. Позднее увеличивается и путь притока, отмечается расширение сердца влево, закругленность верхнего контура, сердце принимает аортальную конфигурацию («сидящая утка»). Особенно значительно увеличение тени сердца у пациентов с АГ и ожирением, так как перегрузка давлением с концентрической гипертрофией миокарда усугубляется перегрузкой объемом за счет ожирения. Развивается эксцентрическая гипертрофия миокарда и резко возрастает риск формирования застойной сердечной недостаточности. Особенно значительное расширение границ сердца влево отмечают при аортальных пороках, прежде всего — недостаточности аортального клапана или при длительно текущей АГ.
Аневризма стенки сердца, если она достаточно большая по размерам и расположена на передней поверхности сердца, клинически выглядит как усиленная местная пульсация и выпячивание. Но такие случаи крайне редки. В диагностике особое значение имеют дополнительные методы исследования. Аневризма выглядит на рентгенограммах как неправильное выпячивание контура ЛЖ. На ЭКГ регистрируется «застывшая» картина острого инфаркта миокарда. Наиболее достоверный метод диагноза — эхоКГ. Визуализируется выпячивание стенки желудочка, определяется его локализация, распространенность, парадоксальная пульсация, наличие или отсутствие тромбов в аневризматическом выпячивании. Одновременно эхоКГ позволяет четко разграничить выпячивание стенки желудочка (истинная аневризма) от осумкованной перфорации желудочка (ложная аневризма).
Хроническая перегрузка миокарда при повышении давления в малом круге кровообращения (легочное сердце)
Все формы ЛГ (повышение давления в легочной артерии >20 мм рт. ст.) обусловливают перегрузку ПЖ, приводящую первоначально к гипертофии его мышцы, а затем — к декомпенсации. ЛГ возникает в следующих ситуациях:
1. Повышение посткапиллярного давления (систолическая и диастолическая недостаточность ЛЖ, стеноз левого AV-отверстия, миксома левого предсердия, хроническая обструкция вен легкого). При этом типе Л Г сопротивление сосудов легких длительное время остается нормальным.
2. Повышение пропульсивного давления в легких (врожденные пороки сердца со сбросом слева направо). Если шунт открыт на уровне желудочков или аортально-пульмональном уровне, то АД в сосудах легких повышено во всех случаях. Если шунт расположен на уровне предсердий, то давление повышается постепенно. Время стабильного повышения артериального сопротивления в легких вариабельно. Дефекты межжелудочковой перегородки достаточно быстро приводят к повышению сопротивления артериального русла легких, в то время как дефекты межпредсердной перегородки могут до зрелых лет протекать без изменения сопротивления сосудистого русла легких.
3. Повышенное прекапиллярное сопротивление:
А. Хроническая ЛГ сосудистого генеза.
Б. Уменьшение сосудистого русла легких в результате интерстициальных процессов (необструктивная эмфизема легких, рестриктивные заболевания легких, в том числе саркоидоз, «пылевое легкое», постлучевой фиброз).
В. Вазоконстрикция (гипоксия, альвеолярная гиповентиляция при деформациях грудной клетки, обструктивной эмфиземе, хроническом бронхите).
Правожелудочковая недостаточность требует исключения таких причин: декомпенсированная ЛГ (см. вышеперечисленные состояния), декомпенсированный стеноз легочной артерии, инфаркт задней стенки ЛЖ с переходом на ПЖ, тампонада сердца, констриктивный перикардит, карциноидный синдром, рестриктивная К.МП, фиброэластоз эндомиокарда.
Понятие «легочное сердце» (cor pulmonale) объединяет целый ряд острых или хронических состояний, развивающихся в ответ на повышение давления в легочном круге кровообращения. Легочное сердце perse — это расширение ПЖ вторично по отношению к легочным заболеваниям, приводящим к ЛГ, но ни в коем случае не расширение ПЖ при врожденных пороках сердца, приобретенных пороках клапанов, левожелудочковой недостаточности со вторичным расширением правого. Острая перегрузка правых отделов развивается при массивной легочной эмболии или остром тяжелом астматическом приступе, при травмах легкого или оперативном удалении его существенной части. Хроническое легочное сердце развивается при всех причинах, приводящих к ЛГ (см. выше). Наиболее важный механизм развития ЛГ — альвеолярная гипоксия. Она развивается либо при локальной недостаточной вентиляции хорошо перфузируемых альвеол, либо при генерализованном снижении их аэрации. Альвеолярная гипоксия, хроническая или острая, сильный стимулятор спазма легочных сосудов. Хроническая альвеолярная гипоксия, кроме того, запускает процесс гипертрофии мышечных волокон в легочных артериолах. Это еще больше усугубляет вазоконстрикцию. Ее же усиливает и гиперкапнический ацидоз. При хронической гипоксии ЛГ усиливается повышением вязкости крови (вторичная полицитемия и уменьшение минутного объема сердца).
Симптоматика легочного сердца варьирует в зависимости от причин ЛГ:
- Констрикция сосудов легких при альвеолярной гипоксии
- Снижение поступления кислорода при пребывании на большой высоте
- Альвеолярная гиповентиляция. Чаще всего развивается при обструктивной эмфиземе легких. Гиповентиляция — достаточно существенная причина ЛГ при кифосколиозах и торакопластике. Другой причиной является уменьшение сосудистого русла вследствие изменения паренхимы. Эти пациенты страдают хроническим обструктивным бронхитом, у них отмечают цианоз, полиглобулию, гипоксемию, гиперкапнию.
Синдром Пиквика у лиц с выраженным ожирением — нечастая, но наглядная причина альвеолярной гиповентиляции с ЛГ. Альвеолярная гиповентиляция значительно нарастает в положении пациента лежа и снижается в положении стоя. Обычно это пациенты с массой тела в 120 кг и более, с цианозом, полиглобулией, гипоксемией и гиперкапнией. В положении лежа они патологически сонливы, но легко пробуждаются. Уменьшение массы тела приводит к нормализации легочного давления.
Паралич дыхательной мускулатуры при миопатии, миастении, ДМ, болезнях накопления также в результате альвеолярной гипоксии приводит к повышению легочного давления.
- Уменьшение количества функционирующих капилляров легких при поражении его паренхимы
- Уменьшение объема функционирующей паренхимы при необструктивной эмфиземе. У этих пациентов отмечается одышка напряжения, но в противоположность пациентам с обструктивной эмфиземой цианоз не развивается.
Рестриктивные заболевания легких. Эту группу составляют пациенты с пневмокониозом, бериллиозом, саркоидозом, распространенным фиброзным туберкулезом, интерстициальным легочным фиброзом, муковисцидозом, тяжелыми бронхоэктазами, после резекции легкого.
Обструкция сосудов легкого (хроническая ЛГ сосудистого генеза)
Причинами являются:
- рецидивирующие тромбэмболии легочных сосудов;
- эмболии опухолевыми массами;
- множественный тромбоз мелких сосудов легких при криоглобулинемии, серповидно-клеточной анемии;
- врожденные состояния ( периферический стеноз ветвей легочной артерии);
- идиопатическая первичная ЛГ + паразитозы (шистозомиаз, бильгарциоз);
- коллагенозы (особенно склеродермия);
- цирроз печени с портальной гипертензией;
- алиментарная (масло из семян репы);
- медикаментозная.
Наиболее частая причина сосудистой ЛГ — рецидивирующие тромбэмболии, которые в большинстве случаев не диагностируются. На перфузионных пневмосцинтиграммах выявляют легочные поля без включения индикатора. Первичная обструкция сосудов легкого приводит к тяжелейшим формам легочного сердца. В дебюте цианоз не отмечается. На поздних стадиях выражен периферический цианоз. Возможно открытие овального окна, формирование сброса крови справа налево, что обусловливает усиление цианоза. Больные жалуются на ангинозную боль, одышку при нагрузке, а затем и в покое, головокружение, обморочные состояния. При рентгенографии отмечают расширенные легочные артерии, прозрачность легочных полей повышена из-за обеднения кровотока.
Первичная ЛГ — достаточно редкое состояние не установленной причины с гиперплазией интимы, некротизирующим артериитом, облитерацией мелких и средних артерий легких. Летальный исход через 3–6 лет после манифестации. Женщины заболевают в 5 раз чаще мужчин. Средний возраст пациентов — 35 лет. Чем моложе пациент, тем тяжелее протекает болезнь. У многих пациентов за годы до проявления ЛГ отмечают синдром Рейно и артралгию. Некротизируюзий легочной артериит с гиперплазией эндотелия и последующей облитерацией, соответствующей клинической картиной, описан у ряда больных с циррозом печени, а также у нескольких женщин, принимавших с целью похудания угнетающие аппетит таблетки, в настоящее время запрещены в США (дексфенфлюрамин, фентермин).
Для диагноза «первичная Л Г» необходимо исключить все известные причины легочного сердца (см. выше), прежде всего те, которые могут быть смягчены или устранены лечением (например эмболии). Ангиографию легких необходимо проводить в каждом случае наличия несимметричных дефектов перфузии, выявленных при вентиляционном или перфузионном сканировании. Такие очаги гипо- или аперфузии не свойственны первичной ЛГ, но типичны для хронической тромботической окклюзии (исход эмболий). Ангиоскопия легких позволяет выявить даже те хронические тромбы, которые не видны при артериографии.
Вопрос об открытой биопсии легкого до сих пор однозначно не решен.
Клинические признаки легочного сердца
Достаточно часто больные жалуются на одышку, хотя это далеко не всегда ведущий симптом. Одышка, как правило, не носит характера ортопноэ, что отличает ее от левожелудочковой. Из других признаков правожелудочковой недостаточности можно указать на застой в большом круге кровообращения, повышение венозного давления, задержку жидкости в организме. Это проявляется набухшими венами, увеличенной печенью, отеками, асцитом, застойными почками. При гипоксическом легочном сердце отеки возникают без признаков правожелудочковой недостаточности, будучи в этих случаях обусловлены гормонозависимой задержкой солей и жидкости. Ранним клиническим признаком правожелудочковой недостаточности является так называемый гепатоюгулярный рефлюкс. Эта проба заключается в том, что при приподнятом на 45° туловище и спавшихся яремных венах врач поддавливает печень. Функционально неполноценный ПЖ оказывается не в состоянии прокачать кровь, депонированную до того в печени и поступающую в общий кровоток при ее поддавливании. Наступает резкое переполнение яремных вен.
Как отражение гипертрофии ПЖ над областью правых отделов определяется прекардиальная пульсация. Иногда она видна и под мечевидным отростком (эпигастральная пульсация). Для целей ДД следует помнить, что прекардиальная пульсация правых отделов сердца возможна при гипертиреозе и выраженной вегетативной лабильности. Практически всегда определяется тахикардия. При аускультации шумы непостоянны и не характерны. Чаще это систолический веретеновидный шум относительной недостаточности трехстворчатого клапана, усиливающийся на вдохе. Выслушивается акцент II тона над легочной артерией. При выраженной ЛГ инспираторное расщепление II тона может не выслушиваться. Необходимо обратить внимание на убывающий диастолический шум над легочной артерией, указывающий на недостаточность ее клапана. Следует помнить, что выраженный акцент II тона над легочной артерией выслушивается, кроме случаев легочного сердца, и при пороках митрального клапана.
АД при легочном сердце обычно не повышено, даже отмечают склонность к гипотонии. Нередки случаи, когда у взрослых регистрируют САД в <100 мм рт. ст. Нарушения ритма сердца не типичны.
Цианоз, часто с расширением кожных сосудов, — важный, но непостоянный симптом легочного сердца. Цианоз составляют два компонента:
1) гипоксемия в результате дыхательной недостаточности. Кожа при этом серо-пепельного цвета;
2) гипоксемия в результате замедленного кровотока. Именно при этом типе гипоксемии появляется малиновый цианоз. Нередко эти два фактора появления цианоза дополняются третьим: полиглобулией.
При легочном сердце из-за обструктивной эмфиземы с венозным застоем, расширением сосудов мозга, повышением внутричерепного давления и возникающими гипоксемией и респираторным ацидозом нередки неврологические симптомы: двигательное беспокойство, снижение порога судорожной готовности, застойные соски зрительных нервов. Рентгенологически отмечают расширение легочной артерии. Умеренное расширение ПЖ протекает без изменения рентгенологической картины в передне-задней проекции. Значительное расширение ПЖ приводит к приподниманию и закругленности контура ЛЖ, но без его удлинения, что и отличает рентгенологические изменения при гипертрофии ПЖ от рентгенологических признаков при гипертрофии левых камер сердца. Наилучшим образом гипертрофия ПЖ визуализируется на боковых снимках. В этих случаях треугольный промежуток между задним контуром грудины и контуром сердца (ПЖ) значительно сужается.
Расширение легочной артерии отмечают при Л Г как следствие стеноза левого AV-отверстия, при повышении давления в малом круге в результате обструкции легочных сосудов (наиболее часто — при рецидивирующих эмболиях), при лево-правом шунте, ведущим к переполнению малого круга кровообращения (наиболее вероятно при дефектах межпредсердной или межжелудочковой перегородки, при открытом артериальном протоке), при постстенотическом расширении при стенозе легочной артерии, а также при идиопатическом расширении легочной артерии, что выявляют у подростков и астеничных юношей с шумом выброса над легочной артерией. ДД-отличием этого типа расширения легочной артерии от ее постстенотического расширения является свистящий, жужжащий шум при стенозе.
При других заболеваниях, ведущих к формированию легочного сердца, расширение легочной артерии менее выражено и диагностируют реже. При Л Г с застоем в легких при стенозе левого AV-отверстия выявляют такой рентгенологический признак, как линии Керлея. Они представляют собой узкие затемнения над костодиафрагмальным синусом и являются ни чем иным, как расширением и уплотнением лимфатических сосудов. Эти линии появляются при повышении капиллярного давления в легких >20 мм рт. ст. (в норме — 8–10 мм рт. ст.). От линейных ателектазов признак Керлея отличается большей узостью и четкими контурами. Тяжелая ЛГ без повышения давления в левом предсердии рентгенологически протекает с просветвлением периферических полей легких в результате обеднения легочного рисунка.
При ЛГ на ЭКГ не всегда фиксируется правограмма, особенно при эмфиземе легких. При остром легочном сердце в результате инфаркта легкого картина ЭКГ подобна таковой при инфаркте задней стенки ЛЖ.
Объективные признаки повышения давления в малом круге кровообращения можно выявить при эхоКГ. Во время исследования по допплерграмме точно оценивают степень повышения давления в легочной артерии и недостаточность трехстворчатого клапана.
Необходимо указать, что обструктивные заболевания легких ведут не только к формированию легочного сердца, но и к поражению ЛЖ за счет гипоксемии, гиперкапнии, ацидоза и эозинофилии.
Хроническая объемная перегрузка желудочков за счет снижения периферического сопротивления (анемия, артериовенозные фистулы, гипертиреоз, болезнь Педжета).
Известно идиопатическое повышение МОК (гиперкинетический кардиальный синдром, идиопатический гиперкинетический статус), протекающее без соматических заболеваний, приводящих к постоянной тахикардии и повышению МОК. Синдром характеризуется тахикардией, снижением периферического сопротивления, повышением пульсовой амплитуды, снижением резервных возможностей сердца при проведении нагрузочных проб. Причиной этого состояния является высокая эндогенная стимуляция β-адренорецепторов или их повышенная чувствительность. Терапия блокаторами β-адренорецепторов обусловливает нормализцию гемодинамики и повышение толерантности к физической нагрузке.
При гипертиреозе гиперциркуляция также уменьшается после применения блокаторов β-адренорецепторов, но восстановления работоспособности при этом не происходит.
Гипердинамический тип кровобращения с тахикардией, снижением периферического сосудистого сопротивления и повышением МОК отмечают в период беременности. При ранее существовавших заболеваниях сердца в III триместр беременности могут появиться признаки недостаточности кровообращения. Особенно яркая сиптоматика разворачивается у пациенток со стенозом левого AV-отверстия и синдромом Эйзенменгера.
Повышенным МОК характеризуются и люди с симпатикотонией, особенно при эмоциональной или физической нагрузке.
Повышение МОК возможно и в начальных стадиях эссенциальной АГ.
Любая хронически существующая значительная объемная перегрузка желудочков может обусловить развитие сердечной недостаточности. Для ее характеристики употребляют термин «слабость высокого МОК». Патогенетически этот тип сердечной недостаточности объединен снижением периферического сопротивления и причинами сердечной слабости не в сердце, а на периферии в результате наличия шунта при артериовенозных фистулах или циррозе печени, повышенном потреблении кислорода при гипертиреозе, снижением содержания гемоглобина при анемиях. Безусловно, время возникновения сердечной недостаточности при периферически обусловленной перегрузке объемом меняется не в благоприятную сторону при наличии других повреждающих миокард факторов, неизбежно сопутствующих вышеуказанным причинам. Особенно быстро сердечная недостаточность при перегрузке объемом развивается при пороках сердца или инфаркте миокарда в анамнезе. В ДД сердечной недостаточности при перегрузке объемом с другими ее формами важен такой признак, как большая разница САД и ДАД, которая наблюдается только при аортальной недостаточности.
Артериовенозные фистулы могут быть врожденными и приобретенными. Врожденные артериовенозные соустья чаще возникают на нижних конечностях и являются признаками многих наследственных синдромов. В печени и легких артериовенозные шунты выявляют при болезни Рендю — Ослера. Точно также с артериовенозным шунтом протекают гемангиоэндотелиомы печени. Клинически изменения сердца на ранних этапах наблюдения больных с артериовенозными шунтами по нашим данным были неспецифичны. Отмечали трудно классифицируемый систолический шум, тахикардию, увеличение размера печени на 2–3 см. На эхоКГ выявлена гипермоторика миокарда, при сканировании в М-режиме — инцизура на траектории движения межжелудочковой перегородки, что свидетельствовало об избыточной ротации сердца вокруг длинной оси в систолу. УОК повышался по сравнению с нормой на 15–20%. После оперативного лечения улучшение отмечали через 1,5–2 года. При персистировании артериовенозных шунтов гипердинамическая реакция миокарда сменялась гиподинамической.
Приобретенные артериовенозные шунты чаще посттравматические (например после колющего ранения бедра) или ятрогенные. Последнее возможно после сеансов гемодиализа. В этом случае увеличение МОК при этом шунте усугубляется также хронической анемией.
Хроническая анемия приводит к увеличению МОК, если гематокрит снижается до 25% и ниже. Если сердечная недостаточность развивается при гематокрите 20–25%, то ее появление обусловлено не собственно анемией, а провоцирующим влиянием анемии при наличии ранее существовавших миокардиальных повреждений. Критическое повышение МОК начинается с уровня гематокрита 15%. Но при этом имеет значение и гипоксическое повреждение миокарда. При хронических анемиях, протекающих с повышением вязкости крови (болезнь Вальденстрема, миелома), увеличения МОК не наблюдается.
При гипертиреозе МОК увеличивается за счет непосредственного симпатического влияния на миокард, инотропного действия гормонов щитовидной железы, снижения периферического сосудистого сопротивления в результате расширения периферических сосудов при гипертермии и метаболитически обусловленного снижения периферического сопротивления.
Увеличение МОК с сердечной недостаточностью при болезни Педжета происходит редко за счет изменения массы тела при поражении не менее 1/3 скелета и высокой активности процесса. Свидетельством последнего является значительное повышение щелочной фосфатазы. Метастатическая кальцинация митрального кольца с формированием недостаточности митрального клапана усиливает объемную перегрузку ЛЖ.
Объемная перегрузка ЛЖ возникает при болезни бери-бери, циррозе печени, болезни Олбрайта (фиброзной дисплазии костей).
Изменения сердца как первичная причина недостаточности миокарда
Относительная перегрузка мышечных волокон (снижение активной мышечной массы) возникает при миокардиофиброзе, миокардите, травме сердца.
Потеря части мышечных волокон миокарда приводит к перегрузке сохранившихся, завершается их фукциональной несостоятельностью, дистрофией, что обусловливает сердечную недостаточность и ведет к формированию порочного круга.
Острая перегрузка миокарда при быстрой потери функции большой массы миокарда (острый инфаркт миокарда или острый фульминантный миокардит) сопровождается признаками кардиогенного шока. Развивается артериальная гипотония, руки и ноги холодеют, сужается сознание, значительно уменьшается сердечный выброс, развиваются цианоз, застой в легких, снижается диурез. Как правило, возникает тахикардия, а у пациентов с инфарктом в результате рефлекса Бецольда — Яриша — брадикардия.
Эмболия легких приводит к резкой перегрузке правых отделов (легочное сердце), что проявляется тахикардией, одышкой, акцентом II тона над легочной артерией, гипоксемией (рН <70 мм рт. ст.), QIII–SI, типом ЭКГ с инвертированным зубцом Т в правых прекардиальных отведениях.
Острый миокардит диагностируют с большим трудом, хотя это достаточно распространенное состояние. Воспаление может быть паренхиматозным или интерстициальным, от серозного до гнойного. Как правило, миокардит не является самостоятельным заболеванием, а развивается на фоне инфекции или аутоиммунного заболевания. Нередко протекает с поражением других оболочек сердца. Мнение о частоте острого миокардита расходятся, так как критерии диагноза не определены. Если учитывать наличие реполяризационных нарушений у пациентов после перенесенной вирусной инфекции, то заболевание является достаточно распространенным. Частота заболевания будет, несомненно, ниже, если учитывать случаи с кардиомегалией, уменьшением фракции изгнания, выраженной глухостью сердечных тонов, наличием антимиокардиальных антител и повышенной активности креатинфосфокиназы. Выделяют острый ревматический миокардит (частота которого значительно снизилась) и большую группу неоднородных по причинам, течению и прогнозу острых неревматических миокардитов.
Ревматический миокардит проявляется приглушенностью тонов сердца, увеличением интервала Q–T, изменениями сегмента ST, ритмом галопа, разнообразными нарушениями проводимости и возбудимости. Размеры сердца обычно не изменяются. Если отмечается увеличение размеров ЛЖ, то прежде всего следует думать о вальвулите с развитием недостаточности митрального клапана.
Неревматический миокардит сопровождает многие инфекционные, аутоиммунные, обменные (уремия) заболевания. Известны изолированные миокардиты неуточненной этиологии. Фульминантно протекающие бактериальные миокардиты присоединяются к бактериальному эндокардиту, развившемуся у пациентов, получающих иммуносупрессивную или цитостатическую терапию. Чрезвычайно тяжело протекает дифтеритический миокардит, так как в миокарде происходит не только воспалительная клеточная инфильтрация, но изменения проводящей системы и массивный некроз миокардиоцитов под действием дифтеритического токсина. Миокардит развивается на фоне инфекции вирусами Коксаки, ECHO-, аденовирусами, вирусами полиомиелита, кори, краснухи, мононуклеоза, гриппа, эпидемического паротита, а также после скарлатины, пневмонии, лакунарной ангины, сальмонеллеза, болезней Лайма и Чагаса, токсоплазмоза. Общими признаками миокардита (их выраженность варьирует) являются бледность, цианоз, одышка и другие признаки сердечной недостаточности, снижение АД, расширение границ сердца, повышение активности миокардиоспецифических ферментов в крови, AV-блокада III степени, тахикардия, нарушения ритма, регионарная или общая гипокинезия миокарда. Нередко присоединяются признаки перикардита. При остром миокардите влючение изотопа 67G1 в миокард повышено. Около 10–25% всех случаев острого миокардита переходит в хроническую форму, что приводит к развитию дилатационной КМП.
Хронические изменения миокарда с выпадением из функционирующего пула части мышечных волокон отмечают прежде всего при ИБС, атеросклеротических изменениях с миокардиосклерозом. Повторные инфаркты миокарда ведут к появлению достаточно больших полей фиброза в миокарде, стенозирующий коронарокардиосклероз без инфаркта приводит к мелкоочаговому миокардиосклерозу. По мере общего старения населения в мире атеросклеротически обусловленная сердечная недостаточность занимает все большее место в общем спектре этилогических факторов. У многих пациентов с коронарокардиосклерозом отсутствует кардиомегалия. Склероз миокарда обусловливает его высокую ригидность, затруднение притока крови в ЛЖ и повышение давления в левом предсердии. Усиленные сокращения левого предсердия могут проявляться IV тоном. Обычно при коронарокардиосклерозе выслушивается мезо-теле-систолический шум на верхушке, указывающий на недостаточность митрального клапана, обусловленную дисфункцией сосочковых мышц. Шум может выслушиваться только в период ишемического приступа и исчезать после восстановления коронарного кровотока. Для диагноза «миокардиосклероз» большое значение имеет регистрация ЭКГ в покое и при физической нагрузке. В случаях (гипертрофия миокарда ЛЖ, дигитализация, блокада ножек пучка Гиса), когда ЭКГ в период нагрузочных проб оказывается малоинформативной, высокодостоверна сцинтиграфия миокарда с изотопом 201Т1. Снижение регионарной сократимости миокарда хорошо выявляется по данным эхоГ. Коронарокардиография выявляет место и протяженность склеротических изменений сосудов. Подозрение на наличие кардиосклероза подтверждается наличием у пациента таких факторов риска, как гиперлипидемия, АГ, сахарный диабет, алкоголизм, табакокурение). У молодых женщин репродуктивного возраста с инфарктом миокарда следует учитывать возможную роль в развитии тромбоза коронарных артерий пероральных контрацептивов.
Изменения сосудов, ведущие к кардиосклерозу, могут развиться и после тупой травмы грудной клетки (contusio cordis). В редких случаях травма может вызвать разрыв сосудов, чаще — провоцирует клиническую манифестацию уже имевшихся изменений. В интерпретации травмы как причины кардиальных изменений необходимо учитывать фактор времени. Постравматические изменения сердца следуют тут же за травмой. Если изменения возникли спустя 1 сут или даже 1 нед после травмы, то надо искать другие причины. Поэтому непосредственно после травмы необходимо провести ЭКГ с последующим динамическим контролем. Для общей оценки состояния сосудов целесообразен осмотр сосудов глазного дна. В ДД контузии грудной клетки и иных причин кардиальных изменений необходимо исключить травму головного мозга со вторичными кардиальными расстройствами, ранения легких, эмболию жировой тканью при переломах трубчатых костей.
Хронический миокардит (кардит) как причина сердечной недостаточности возникает значительно реже, чем атеросклеротический миокардиосклероз. Если при остром миокардите этиологический фактор устанавливается достаточно часто, то при хроническом миокардите выявление причины заболевания очень затруднено. Нередко фаза воспаления вообще просматривается, и многие случаи хронического кардита диагностируют на стадии, когда они приобретают все черты дилатационной КМП, то есть отсутствие достоверного этилогического фактора и признаков воспаления. Отсюда понятно, почему у 34% больных с дилатационной КМП выявляют энтеровирусную РНК в миокарде. Поэтому диагноз «хронический кардит» основывается на данных эндомиокардиальной прижизненной биопсии или посмертных гистологических исследованиях. При гистологических исследованиях выявляют лимфо- и гранулематозные интерстициальные воспалительные изменения с гигантскими клетками или фиксированные как аутоантитела, так и антитела к возбудителям. В качестве наиболее вероятных этиологических факторов чаще всего называют вирусы Коксаки В, цитомегаловирусы, вирус полиомиелита, риккетсии (Q-лихорадка), боррелии и токсоплазмы. Поражение миокарда возможно при хроническом артрите, болезни Рейтера, анкилозирующем спондилите, системных заболеваниях соединительной ткани с аутоиммунным компонентом (коллагенозах). Так, при СКВ антимиокардиальные антитела нами выявлены у 18–25% больных, их титр коррелировал с активностью процесса, титрами антител к ДНК и антинуклеарным фактором. В Южной Америке хронический миокардит может быть одним из проявлений болезни Чагаса (трипаносомоз). Аутоиммунный механизм ответственен за развитие синдрома Дресслера и постмиокардиотомического синдрома. При этих синдромах на первое место выдвигаются изменения плевры и перикарда. Поражение миокарда обычно минимально. Повышение титра антивирусных антител у этих пациентов может свидетельствовать о том, что иммунный компонент спровоцирован активированием латентной вирусной инфекции.
Хроническая перегрузка давлением и/или объемом при клапанных пороках сердца
Функциональные систолические шумы изгнания на основании сердца прото- и мезосистолические. Здесь же на основании систолический шум при аортоатеросклерозе постоянен, при атеросклеротическом стенозе аортального или (редко) пульмонального клапанов занимает всю систолу, достигая соответственно аортального или пульмонального компонента Итона. При стенозе устья аорты шум позднесистолический, перекрывает аортальный компонент II тона. При дефектах межжелудочковой перегородки систолический шум прослушивается непосредственно за 1 тоном.
Систолический шум на верхушке выявляют достаточно часто. Преимущественно это функциональные шумы, выслушиваемые наиболее часто у худощавых молодых людей, непостоянные по интенсивности, мелодичные, мягкого тембра. Позднесистолический шум, особенно возникающий после систолического щелчка, типичен для пролапса митрального клапана. Систолический шум митральной недостаточности обычно веретенообразный, голосистолический, перекрывает аортальный компонент II тона. При выраженной митральной недостаточности шум убывающий.
Диастолический убывающий шум на основании при недостаточности аортального клапана примыкает ко II тону. При недостаточности клапана легочной артерии с ЛГ (шум Грехема — Стилла при пороках митрального клапана) определяется как диастолическое декресчендо непосредственно после пульмонального компонента II тона. При органической недостаточности клапана легочной артерии без признаков ЛГ максимальная интенсивность диастолического шума, как и его начало, несколько отстает от пульмонального компонента II тона. Вначале этот шум имеет короткий период нарастания по звучности, затем убывает. Его частотные характеристики ниже, чем при шуме Грехема — Стилла, так как регургитация без ЛГ протекает менее интенсивно.
При стенозах митрального или трикуспидального клапанов диастолический шум возникает только после открытия соответствующего AV-клапана.
Систоло-диастолический шум, напоминающий пыхтение маленького паровозика, с точкой наилучшего выслушивания во втором межреберье слева под ключицей типичен для открытого артериального протока.
Нельзя забывать о редких шумах, обусловленных артериовенозными анастомозами, аортопульмональными свищами, а также о венозных шумах («бормотание монахини»). Венозные шумы отличаются от других тем, что они исчезают при натуживании (проба Вальсальвы) и значительно нарастают после декомпрессии.
К одышке кардиального генеза ведут те пороки клапанов сердца, которые сопровождаются застоем в малом круге кровообращения. Диагноз «клапанные пороки сердца» наряду с анамнезом, пальпацией, перкуссией, аускультацией во многом основывается на рентгенографии и особенно эхоГ.
Недостаточность митрального клапана типичной ревматическо-эндокардитической этиологии у людей молодого возраста в настоящее время большая редкость благодаря изменившимся условиям жизни и применению антибиотиков при лечении лихорадочных состояний. Современная активная и широко применяемая антибиотикотерапия значительно сузила «поле деятельности» стрептококков. У людей зрелого возраста митральную недостаточность выявляют чаще. Чистая митральная недостаточность при воспалительных изменениях эндокарда — большая редкость. В той или иной степени она сочетается со стенозом левого AV-отверстия. Истинная недостаточность митрального клапана, особенно у молодых астеничных людей, возможна в результате мукоидной дистрофии эндокарда (см. синдромы Марфана, Элерса — Данлоса, пролапс митрального клапана). Диагноз «митральная недостаточность» — самый частый диагноз из всех клапанных пороков хотя бы потому, что относительная митральная недостаточность следует за дилатацией ЛЖ или атеросклеротическим поражением сосочковых мышц. Поэтому недостаточность митрального клапана выявляют при каждом более или менее выраженном случае АГ, атеросклерозе, аортальной недостаточности, острой дилатации ЛЖ, инфаркте миокарда, хронической эозинофилии, при которой прежде всего поражаются сосочковые мышцы. Всегда, когда врач выслушивает систолический шум на верхушке сердца, у него возникает мысль о недостаточности митрального клапана. Но недостаточность этого клапана имеет типичную звуковую картину. Митральная недостаточность характеризуется аускультативно ослабленным или вообще не выслушиваемым I тоном, шум веретенообразный, голосистолический, высокочастотный, распространяется в левую подмышечную впадину. Аортальный компонент II тона перекрывается систолическим шумом, поэтому выслушивается не отчетливо. В тяжелых случаях выслушивается III тон (протодиастолический галоп). От шума недостаточности митрального клапана необходимо отличать так называемые акцидентальные шумы, то есть шумы изгнания, выслушиваемые на верхушке. Но точка наилучшего выслушивания располагается все-таки на основании сердца, для шума изгнания крови в аорту — во втором межреберье справа парастернально, для легочной артерии — во втором–третьем межреберье слева от грудины. Акцидентальные шумы протомезосистолические, веретеновидные, никогда не приобретают характер жужжания, дрожания, что отличает их от голосистолического шума недостаточности. Единственный голосистолический функциональный шум на верхушке — хордальный писк или хордальное дрожание. Но мелодичность и музыкальность этого шума не позволяют спутать его с любым другим. Шум обусловлен вибрацией аномальной хорды, идущей от межжелудочковой перегородки к боковой стенке ЛЖ или от сосочковой мышцы к межжелудочковой перегородке и оказывающейся в выносном тракте желудочка. Данные эхо КГ позволяют визуализировать дополнительную хорду и разрешить диагностические сомнения, исключив пристеночный тромб или разрыв хорд при инфекционном эндокардите или дисплазии соединительной ткани. Особое значение в диагностике недостаточности митрального клапана имеет допплерография. Методика позволяет оценить наличие, ширину и длину струи регургитации. Регургитация, распространяющаяся в левое предсердие не более чем на 1 см от уровня митрального кольца (¼ предсердия), рассматривается как сброс I степени и трактуется как физиологическая. II степень — сброс на ½ предсердия, III — ¾ предсердия, IV — струя регургитации достигает противоположной от митрального кольца стенки предсердия. Достаточно надежных корреляций I и II степени регургитации с аускультативными данными нет. Минимальную, незначимую гемодинамически недостаточность митрального клапана выявляют приблизительно у 35–40% здоровых лиц.
При недостаточности митрального клапана сравнительно быстро расширяется полость левого предсердия. ЛЖ также всегда расширен, что отличает недостаточность митрального клапана от стеноза левого AV-отверстия. При этом верхушечный толчок смещен не только влево, но и вниз.
Значительные сложности возникают в трактовке систолического щума на верхушке при ревматической атаке. Возникновение ревматического эндокардита сопровождается вначале не устойчивым по тембру и звучности шуму, только значительно позже приобретающему дующий характер и распространяющемуся в подмышечную впадину. Недостаточность митрального клапана при ревматической лихорадке формируется в течение месяцев, а стеноза — нескольких лет, что представляет врачу время для активного вмешательства.
Появление систолического шума с жужжащим оттенком в третьем–четвертом межреберье слева от грудины при инфаркте миокарда заставляет исключать перфорацию межжелудочковой перегородки.
Другие причины неревматической недостаточности митрального клапана сводятся к следующим группам:
- Острая недостаточность митрального клапана при разрыве хордальных нитей. Обычно отмечают при инфекционном эндокардите, но возможна при мукоидной дистрофии на фоне дисплазии соединительной ткани или тупых травм грудной клетки. Основными признаками является резко возникшая левожелудочковая недостаточность в виде значительного застоя в легких, одышки, голосистолического шума убывающего (декресчендо) характера, III и IV тонов сердца. При разрыве хорд передней сосочковой мышцы пан-систолический шум распространяется на спину. При разрыве хорд задней сосочковой мышцы шум иррадиирует во второе межреберье справа от грудины, на сонные артерии, симулирует стеноз аорты. Сохранен синусовый ритм, ЛЖ и левое предсердие в отличие от хронической недостаточности или стеноза не расширены. По данным эхоГ визуализируется разорванная хаотически болтающаяся хорда, пролабирующий митральный клапан.
- Острая недостаточность митрального клапана при инфаркте верхушки сосочковой мышцы. Клиническая картина, дополняемая болью и ЭКГ-симп- томатикой, аналогична вышеописанной.
- Телесистолическая (позднесистолическая) митральная недостаточность чаще всего возникает при пролабировании митрального клапана в результате мукоидной дегенерации створок клапана и хордальных нитей, местной симпатикотонии с нарушением тонуса сосочковых мышц. Створки клапанов и хорды в норме способны выдерживать большую нагрузку (до 10 кг/мм2). Поэтому без патологии соединительной ткани сердца или изменения тонуса сосочковых мышц пролапс просто не может появиться. Тонкими исследованиями доказано, что всегда пролабируют обе створки митрального клапана. Но задняя створка небольшая, перекрывает не более 1/3 площади левого AV-отверстия, глубина ее прогиба в большинстве случаев очень мала. Передняя створка большая, построена из 3 сросшихся лепестков, и глубина провисания оказывается существенной.
Наряду с явными признаками патологии соединительной ткани в генезе пролапса имеют значение и другие факторы. Например, несоответствие размеров сосочковых мышц и хорд, площади створок и AV-отверстия. В то же время отсутствие пролапса у ряда больных с синдромом Марфана объясняют необычно большими размерами передней створки: она оказывается настолько большой, что просто не в состоянии «протиснуться» в левое AV-отверстие.
Как отражение системности процесса, приведшего к пролабированию клапанов сердца, отмечают дефицит карнитина, снижение концентрации Mg в эритроцитах и субнормальное количество лимфоцитов.
- Пролапс митрального клапана выявляют у 1–5% населения. Он крайне редко появляется с рождения, частота его становится значимой в подростковом возрасте, достигая максимума к 20–25 годам. Этиологически пролапс митрального клапана связан с наследственной патологией соединительной ткани. Изменения выявляют в том же гене, что и при синдроме Марфана. Наряду с этим вероятность развития пролапса митрального клапана высока среди лиц с тиреотоксикозом, гинекомастией, мышечной дистрофией Дюшена, миотонической дистрофией, серповидно-клеточной анемией.
В большинстве случаев у пациентов не отмечается какой-либо симптоматики. Там же, где появляется симптоматика, она связана с высоким тонусом симпатической нервной системы и соответствует так называемой нейроциркуляторной дистонии. Больные жалуются на неспецифическую боль в грудной клетке, метеолабильность, цефалгию, слабость, ортостатическую гипотензию, латентную тетанию, одышку. Аускультативно отмечается телесистоли- ческий шум типа крещендо, нередко примыкающий или слегка отстающий от мезосистолического щелчка. Пансистолическое пролабирование створок (рис. 18.1) может сопровождаться голосистолическим веретеновидным шумом. В положение пациента стоя интенсивность шума больше и он начинается раньше, чем в положение пациента лежа. На ЭКГ фиксируют нарушения ритма (у 1/3 пациентов провоцируются психологическими стрессами) и реполяризации. ЭхоГ и ангиографически выявляют провисание одной или обеих створок клапана в полость левого предсердия. Сброс обычно II, редко — III степени. Полости ЛЖ и предсердия, как правило, не расширены. Технические погрешности проведения эхоКГ могут дать неоправданно большие цифры распространенности пролапса митрального клапана, поэтому необходима их клиническая трактовка, точно также как и отрицательных результатов, когда врач, исходя из конституциональных особенностей пациента, а тем более аускультативной картины, ожидает пролабирования створок.
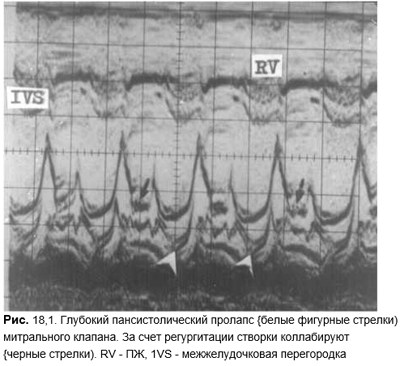
В практических целях пролапс митрального клапана подразделяется на неосложненный (бессимптомный) и осложненный. Неосложненный не сопровождается клинической симптоматикой или инструментальными изменениями, его выявляют случайно при эхоКГ-обследованиях. Продолжительность жизни этих пациентов и вероятность осложний не отличаются от популяционных статистик. В качестве осложненного рассматривается пролапс на фоне манифестных форм дисплазии соединительной ткани, с отчетливым систолическим шумом и среднесистолическим щелчком, с нарушениями ритма сердца (симптомная желудочковая тахикардия у молодых людей обычно связана с сопутствующим биопсийно подтвержденным миокардитом), с синкопальными состояниями, с мукоидной дегенерацией створок, с регургитацией, расширением аорты, с одновременным пролабированием других клапанов сердца, варикозным расширением вен и другими клиникоинструментальными проявлениями. Именно в этой группе высок риск развития инфекционного эндокардита (1:2000 пациентов с выраженной митральной регургитацией). У людей с существенным утолщением створок клапана или хорд высока вероятность разрыва последних или формирования клинически значимой недостаточности клапана. У этих больных в 4,5 раза чаще, чем в популяции, развиваются эмболии в сосуды головного мозга. Риск скоропостижной смерти (< 1% в общей популяции) особенно высок у молодых астеничных женщин с синдромом гипермобильности и семейными случаями скоропостижных смертей, сочетанием щелчка — шума, низкоамплитудным или отрицательным зубцом Т во II, III, aVF и левых прекардиальных отведениях, увеличением интервала Q—T в покое или только при нагрузке, залповыми желудочковыми экстрасистолами. Именно у этих пациентов оказывается максимально высоким уровень катехоламинов в крови.
Пролапс митрального клапана может быть вторичным при поражении миокарда при дерматомиозите, миопатии, миастении, ишемии сосочковых мышц. При вторичном пролапсе вероятность систолического шума и/или мезосистолического щелчка ниже, чем при первичном идиопатическом пролапсе. Это объясняется тем, что щелчок и шум сброса могут быть обусловлены только интенсивно сокращающимся миокардом. Измененный миокард не в состоянии обеспечить мощное сокращение, дающее резкое переразгибание створки клапана или интенсивную струю регургитации.
- Митральная недостаточность при гипертрофической обструктивной кардиомипатии обусловлена необычным направлением тяги передней сосочковой мышцы, которая сдвигает вперед переднюю створку аортального клапана в период систолы. Возможен и пролапс задней створки митрального клапана в предсердие с регургитацией.
- Митральная недостаточность возможна при открытом AV-канале, при корригированной транспозиции аорты.
- Митральная недостаточность при кальцификации митрального кольца особенно часто возникает у женщин с избыточной массой тела в возрасте старше 60–65 лет. Рентгенологически обызвествление обычно выглядит как С-образный кальцинат в основании задней створки. Часто сочетается с кальцификацией аортального клапана и створок аорты. Митральная регургитация обычно выражена умеренно. Очень редкими осложнениями кальцификации митрального кольца являются перианулярные абцессы и эмболии крошками кальция. При отложении кальция на межжелудочковой перегородке появляются нарушения проводимости.
Стеноз левого AV-отверстия, обструкция потока крови из левого предсердия в ЛЖ в результате рубцового спаивания створок митрального клапана, в большинстве случаев являются результатом предшествующего ревматизма. В средних широтах бессимптомный интервал длится 10–20 лет, в жарком климате он сокращается до нескольких лет и стеноз митрального клапана формируется уже у детей.
Стеноз левого AV-отверстия возникает практически только у женщин. В половине всех случаев не удается выявить ранее перенесенный полиартрит. Первые симптомы появляются в возрасте 30–40 лет. У мужчин без ревматического анамнеза стеноз митрального клапана — большая редкость. Такой клинический признак, как малиновый цианоз отмечают нечасто. Поскольку основная гемодинамическая нагрузка падает на сравнительно тонкий миокард левого предсердия, то рано появляется одышка, вначале при нагрузке, иногда на годы опережая симптомы застоя в легких. Больные жалуются на перебои сердца, что является ранним признаком появляющегося мерцания и трепетания предсердий, приступы ночной одышки, иногда — рецидивирующее гемоптоэ. Гемоптиз — результат разрыва мелких сосудов легкого и отека легкого, нередко провоцирующегося увеличением объема крови в период беременности. Эмболии выявляют у 15% больных, прежде всего в сочетании с фибрилляцией предсердия, но могут развиться и при синусовом ритме. При истинном стенозе митрального клапана ЛЖ не увеличен, поэтому верхушечный толчок длительное время не изменен. Только при расширении правых камер сердца верхушечный толчок смешается наружу, но не вниз. Если все-таки выявляют смещение верхушечного толчка и вниз, то следует думать о сочетании митрального стеноза с митральной недостаточностью или пороком аортального клапана. Пальпаторно при стенозе митрального клапана определяется «кошачье мурлыканье»: диастолическое прекардиальное дрожание над верхушкой. В отличие от дрожания, определяемого при стенозах аортального и пульмонального клапанов, при дефектах межжелудочковой перегородки, при недостаточности митрального клапана из-за разрыва хорд, дрожание при стенозе левого AV-отверстия диастолическое, сочетается с пресистолическим акцентом. Четко определяемый прекардиальный толчок слева внизу от грудины свидетельствует о расширении правых отделов сердца. Хорошо пальпируется и выслушивается акцент II тона над легочной артерией.
Аускультативно для стеноза митрального клапана типичен усиленный (хлопающий, «пушечный») I тон. Причина этого — запаздывание I тона в результате повышенного давления в левом предсердии, поэтому митральный компонент совпадает с трикуспидальным и звук усиливается. Кроме того, утолщенные, огрубелые, но еще подвижные створки митрального клапана генерируют более сильный звук при своем захлопывании. Имеет значение и то, что захлопывание створок происходит при более высоком давлении, чем при интактном клапане, хорды и створки испытывают резкое и значительное натяжение, порождающее более сильный звуковой феномен. Однако усиленный I тон выслушивается и при гипертиреозе, экстрасистолиях, анемиях.
I тон запаздывает по отношению к зубцу Q на ЭКГ на 0,08 с и более.
Типичен пресистолический нарастающий по амплитуде шум, возникающий в конце диастолы, быстро нарастающий типа кресчендо, достигающий максимума перед I тоном. Особенно отчетливо выслушивается при синусовом ритме, но хорошо уловим и при мерцании предсердий, особенно при коротких диастолических интервалах, когда существует большой градиент давления между предсердием и желудочком. Пресистолический шум может отсутствовать при минимальном стенозировании митрального клапана. Спровоцировать его появление можно физической нагрузкой и выслушиванием пациента в его положении на левом боку.
При тяжелой недостаточности аортального клапана на верхушке можно прослушать диастолический шум с коротким пресистолическим компонентом (шум Флинта — Августина).
Диастолический шум стеноза митрального клапана необходимо отличать от шума недостаточности клапана легочной артерии (шум Грехема — Стилла). Последний выслушивается как льющийся, никогда не возникает за аортальным компонентом, после аортального компонента выслушивается короткая пауза. Эта пауза позволяет отличить шум относительной недостаточности клапана легочной артерии от шума недостаточности аортального клапана. Недостаточность клапана легочной артерии практически всегда отмечают при застое в малом круге, поэтому выслушивается акцент II тона над легочной артерией и определяется ее расширение.
Тон открытия митрального клапана высокочастотный, возникает через 0,06–0,12 с после II тона и патогномоничен для стеноза левого AV-отверстия. Но при фиброзированных неподвижных створках тон открытия не выслушивается, хотя диастолический шум сохраняется.
Акцент II тона на легочной артерии не является решающим для диагноза, так как свидетельствует только о застое в малом круге. В начальных стадиях стенозирования митрального клапана акцент не выслушивается.
Развивающаяся на поздних этапах недостаточность трехстворчатого клапана определяется по возникновению в динамике систолического шума в четвертом межреберье справа от грудины (первоначально систолический шум выслушивается только на вдохе), по отсутствию систолического коллапса вен и по наличию высокой волны V на флебограмме. Печень при этом увеличивается, а на рентгенограмме определяется раcширение правого предсердия. В целом же рентгенологические находки зависят от степени стенозирования митрального отверстия. Вначале размеры сердца не увеличены, диаметр левого предсердия не меняется или меняется несущественно. Затем размеры левого предсердия значительно увеличиваются, а размеры ЛЖ остаются практически неизменными. Такая картина носит название митральной конфигурации. Митральная конфигурация сердца образуется за счет увеличения левого предсердия, расширения ствола легочной артерии при застое в малом круге с поворотом оси сердца в результате гипертрофии и дилатации правых камер сердца. В поздних случаях на правый контур выходит и правое предсердие.
Наконец, увеличиваются и общие размеры сердца, так как расширяются ПЖ и правое предсердие. Возможна визуализация кальциевых депозитов на фиброзированных створках клапана. Их выявляют в переднезадней проекции слева от позвоночника, а в боковой проекции — между средней и задней третями тени сердца. Хроническая ЛГ приводит к переполнению прежде всего сосудов в верхних полях легких, в нижних — появляются линии Керлея.
На ЭКГ при сохраненном синусовом ритме отмечают типичные широкие, иногда двугорбые, зубцы Р в I, II, V5,6 отведениях. Затем, как правило, присоединяется трепетание предсердий, правый тип ЭКГ и признаки гипертрофии левых отделов. Диагноз «стеноз митрального отверстия» полностью подтверждают данные эхоГ. Отмечается спаянность створок клапана, снижение амплитуды их открытия, уменьшение площади AV-отверстия, снижение скорости диастолического прикрытия, отсутствие предсердной волны на передней створке. Створки выглядят толстыми, грубыми, хорошо визуализируются кальцинаты. Допплерографически определяется градиент давления.
Стеноз левого AV-отверстия может быть обусловлен не постэндокардитическим спаиванием створок митрального клапана, а гемодинамическим блоком за счет высокого конечно-диастолического давления в ЛЖ, например при недостаточности аортального клапана, выразителем чего является шум Флинта.
Очень редко диагностуют врожденный стеноз митрального клапана. Без оперативной коррекции продолжительность жизни детей не превышает 2 лет.
Стенозирование митрального клапана возможно за счет кальцификации створок у людей пожилого возраста, особенно на фоне гипертрофированного миокарда ЛЖ. Но значительно чаще атеросклеротические изменения приводят к недостаточности клапана.
Стеноз левого AV-отверстия может быть механически обусловлен опухолью левого предсердия. В половине всех случаев опухоли сердца — миксомы, из них в 75% случаев они локализуются в левом предсердии. Признаками миксом являются отсутствие ревматического анамнеза, изменчивость шума в зависимости от положения тела больного, синкопальные состояния, эмболии, быстрое прогрессирование сердечной недостаточности с ее рефрактерностью к терапии. Нередко с миксомами сочетаются пери- оральные пятна цвета «кофе с молоком». Возможны семейные случаи миксом. Опухоли сердца могут сопровождаться лейкоцитозом, анемией, гипергаммаглобулинемией, спленомегалией, повышением температуры тела и СОЭ. Решающим исследованием для установления диагноза является эхоГ.
Недостаточность клапанов аорты длительное время протекает скрыто, инкомпетентность миокарда развивается спустя годы или даже десятилетия после формирования порока. Но, раз возникнув, нарушения кровобращения быстро достигают крайних пределов. На первом месте по выраженности симптомов стоит одышка. Из-за низкого кровенаполнения капилляров больные бледны, хотя показатели гемоглобина не изменены. Эта бледность отличает пациентов с недостаточностью аортального клапана от людей с малиновым цианозом при стенозе левого AV-отверстия. Пульс высокий и быстрый (celer et altus). Разница САД и ДАД может достигать 120 мм рт. ст. При поддавливании ногтевой пластинки определяется пульсация капилляров (капиллярный пульс). Такой тип пульса настолько типичен для аортальной недостаточности, что если он не определяется, то либо у пациента практически полностью остро разрушены паруса клапана аорты, либо наряду с недостаточностью клапана имеется и его стенозирование. С другой стороны, высокий и быстрый пульс выявляют при открытом артериальном протоке, при больших артериовенозных фистулах, болезни Педжета, гипертиреозе и других состояниях с высоким МОК, при высокой лихорадке.
Как отражение быстрого и массивного обратного тока крови при недостаточности клапана аорты известны покачивания головы в такт биения сердца и аналогично покачивания ноги, заброшенной на колено. У 5% больных (и только при тяжелой регургитации) отмечается так называемая грудная жаба без признаков поражения коронарных артерий. Развивается она, как правило, по ночам, видимо, из-за усиления регургитации при урежении ритма сердца и облегчении притока крови в горизонтальном положении.
При аортальной недостаточности над крупными артериями выслушивается систоло-диастолический шум, напоминающий шум волчка. При этом диастолический компонент обусловлен ретроградным током крови.
Аускультативно недостаточность клапана аорты проявляется прежде всего льющимся диастолическим шумом, выслушиваемым во второмом межреберье справа от грудины. Чаще точкой наилучшего выслушивания является все-таки точка Боткина — Эрба: слева от грудины в третьемем межреберье. Иногда этот шум прослушивается до верхушки сердца. В начале диастолический шум значительно зависит от положения больного. В положении стоя звучность его значительно выше, чем в положении лежа. Неясный шум при минимальной недостаточности значительно лучше выслушивается при наклоне больного вперед или на выдохе. Диастолический шум над областью проекции клапана аорты и/или в точке Боткина — Эрба достаточно патогномоничен для недостаточности клапана аорты, хотя диастолический шум в этой области может выслушиваться при анемиях. В этих случаях он не аортального, а венозного генеза. В далеко зашедших стадиях порока митрального клапана слева, а иногда и справа от грудины определяется громкий диастолический шум (шум Грехема — Стилла), свидетельствующий не о недостаточности аортального клапана, а о расширении правых отделов сердца с относительной недостаточностью клапана легочной артерии.
При каждом случае недостаточности аортального клапана наряду с диастолическим шумом определяется той или иной степени громкости систолический шум с точкой наилучшего выслушивания практически над проекцией аортального клапана. Но может выслушиваться и в точке Боткина — Эрба, простираясь до верхушки. Основываясь только на наличии систолического шума, ни в коем случае нельзя установить диагноз «стеноз клапана аорты» или «недостаточность митрального клапана». Шум обусловлен не органическими изменениями створок указанных клапанов, а турбулентностью потока большого объема крови. Но если систолический шум сочетается с жужжанием на сонных артериях, то диагноз «сочетанное поражение аортального клапана» более чем вероятен. В пользу этого предположения свидетельствует и отсутствие периферических артериальных тонов при достоверной аортальной недостаточности.
Для диагноза «относительная митральная недостаточность» имеют значение появление дополнительного систолического шума на верхушке сердца, распространяющегося в подмышку, акцент Итона на легочной артерии, митрачизация сердца по данным рентгенографии. При тяжелой недостаточности аортального клапана на верхушке сердца выслушивается диастолический шум наполнения ЛЖ (шум Флинта), отличающийся от истинного органического стеноза митрального отверстия отсутствием тона открытия митрального клапана.
Рентгенологически изменения тени сердца проходят в три этапа. Вначале размеры и конфигурация тени сердца не меняются, хотя возможно удлинение выносного тракта. На этом этапе признаков декомпенсации кровобращения еще нет. Исключение представляют случаи острого разрушения створок при бактериальном эндокардите. Затем сердце приобретает типичную аортальную конфигурацию, расширяется восходящая аорта. Расширение восходящей аорты особенно значительно при комбинированных пороках аортального клапана. Кровообращение и на этом этапе может оставаться компенсированным. На третьем, завершающем, этапе сердце приобретает митральную конфигурацию, отражающую декомпенсацию кровообращения.
По результатам эхо КГ может быть рассчитана площадь недостаточности смыкания створок аортального клапана. В М-режиме четко фиксируется дрожание передней створки митрального клапана, обусловленное струей регургитации (феномен «петушиного гребня») (рис. 18.2), раннесистолическое прикрытие. В тяжелых случаях предсердная волна на траектории движения митрального клапана выше, чем пик открытия в фазу быстрого наполнения, определяется дрожание задней створки и межжелудочковой перегородки. Допплерография, в том числе и цветное картирование, выявляют струю регургитации и ее протяженность. В норме минимальную регургитацию по данным допплерографии, никак не коррелируя с аускультативной картиной, выявляют у 1/3 всех здоровых людей, частота ее повышается с возрастом за счет атеросклеротических изменений и выше средних цифр у людей с дисплазией соединительной ткани.
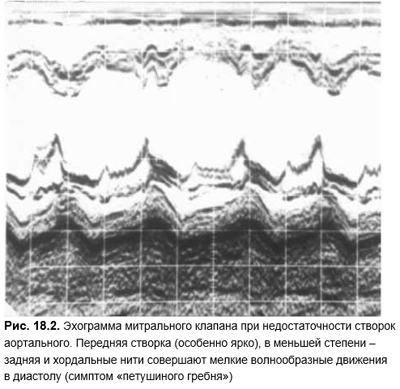
ЭКГ при недостаточности аортального клапана демонстрирует гипертрофию ЛЖ.
Кроме ревматической, недостаточность клапанов аорты может быть последствием инфекционного эндокардита, болезни Рейтера (нередкая причина среди мужчин), сифилиса (в настоящее время этому этиологическому фактору принадлежит далеко не первое место и не из-за редкости инфекции, а из-за широты применения антибиотиков). Аутоиммунного характера поражения аортального клапана по типу тромбэндокардита описаны при СКВ и чаще — при антифосфолипидном синдроме, псориатическом артрите, неспецифическом язвенном колите. Невоспалительного характера недостаточность аортального клапана может быть врожденной при двустворчатом клапане аорты (вероятность данной аномалии — 1:20 000 населения, но клинически значимые случаи выявляют значительно реже), при пролабировании створок у больных с синдромом Марфана, при их миксоматозном разрушении при этом же синдроме, при синдроме Элерса — Данлоса, при атеросклеротических процессах. Вторичного характера недостаточность аортального клапана возможна при расширениях аорты у больных с дисплазиями соединительной ткани, аортитом, в том числе сифилитическим. Указанием на вторичную недостаточность аортального клапана является несоответствие между умеренно расширенным ЛЖ и значительно расширенной аортой. Диастолический шум при вторичной недостаточности аортального клапана более звонкий и музыкальный.
Хроническая недостаточность клапана аорты достаточно легко диагностируется, прогноз при ней определен. Остро возникшая недостаточность менее привычна для врача, видимо, поэтому и диагностируется со значительными колебаниями. Острая недостаточность возникает при инфекционном эндокардите и достаточно редко — при тупых травмах грудной клетки. Указаниями на остро возникшую недостаточность аортального клапана являются тахикардия, короткий диастолический шум и выраженный застой в легких при небольших размерах сердца, отсутствие большой разницы между САД и ДАД. Решающим для экстренного диагноза является эхоГ, позволяющая выявить вегетации (тромбы) на створках, состояние створок, степень регургитации. Если оказывается и преждевременное захлопывание митрального клапана, то необходима срочная операция протезирования аортального клапана, без которой больные могут быстро погибнуть.
Стеноз клапана аорты, по мнению современных исследователей, возникает чаще, чем недостаточность этого клапана, хотя бы только потому, что стеноз в чистом виде — результат атеросклеротического поражения аорты. Стеноз клапана аорты проявляется аускультативно грубым громким систолическим шумом с типичным аортальным пунктом наилучшего выслушивания и завершается очень тихим аортальным компонентом Итона. Этот компонент может вообще отсутствовать, а при тяжелых формах стеноза определяется парадоксальное соотношение легочного и аортального компонентов II тона: запаздывание аортального компонента по отношению к легочному. Шум стеноза аортального клапана распространяется на сонные артерии, особенно отчетливо — на левую.
Стеноз клапана аорты может быть врожденным или приобретенным. Врожденный стеноз клапанов аорты возможен при двустворчатом ее клапане. Двустворчатый клапан аорты чаще ничем не проявляется. Но возможно ограничение движения парусов, либо в результате избыточной нагрузки и натяжения к 5–6-му десятилетию жизни створки склерозируются и затем кальцинируются. Истинно атеросклеротический стеноз клапанов аорты (сенильный стеноз аорты) формируется обычно на 7–8-м десятилетии жизни. У 60% пациентов в возрасте старше 60 лет со значительным стенозом клапана аорты определяется кальцификация митрального кольца. При наличии пролабирования створок, АГ или сахарного диабета кальциноз створок развивается значительно раньше 70 лет и аускультативная картина таких кальцинозов невыразительна. Ранний и выраженный склероз аорты со стенозированием ее клапана может быть проявлением сифилиса.
Известны случаи стеноза клапана аорты, когда над всей областью сердца тоны не выслушиваются, определяется только шум. Но установить диагноз «клапанный стеноз аорты» только на основании шума — неосмотрительно. Для этого диагноза характерно изменение пульса по типу малого и напряженного. Пульсовая кривая на каротидных артериях в фазу повышения пульсового давления имеет типичный зазубренный вид по типу петушиного гребня. Время выброса, легко определяемое по каротидограмме, при стенозе клапана аорты удлиненно и тем значительней, чем выше степень стеноза. Над точкой Боткина — Эрба и над сонными артериями можно определить дрожание, достаточно типичный пальпаторный феномен стеноза. Выраженные формы стеноза с минимальным отверстием между парусами клапана из-за малого объема изгнания и небольшой скорости выброса не сопровождаются дрожанием над сосудами. Точно так же и при функциональных шумах изгнания над аортой дрожания определить не удается, но, в отличие от выраженных форм стеноза, звучность тонов сердца не изменена, а шум не носит грубого характера. Пока паруса аортального клапана сохраняют подвижность, систолический шум часто начинается со щелчка открытия. Типична брадикардия. АД при стенозе обычно снижено. Небольшое повышение АД, прежде всего у людей пожилого возраста, никак не свидетельствует против стеноза аортального клапана. Низкий выброс приводит к легкому возникновению одышки при минимальной нагрузке, к обморокам, к стенокардии. Стенокардия у этих больных, особенно преклонного возраста, может быть результатом атеросклеротического изменения коронарных артерий, но в половине всех случаев сосуды не изменены, а стенокардия возникает из-за крайне низкого субэндокардиального кровотока в толстой мышце ЛЖ. Применение нитратов приводит к обморокам, поскольку периферические сосуды расширяются, АД падает, а стенозированное клапанное кольцо не позволяет ЛЖ выполнить возникшую относительную гиповолемию.
На ЭКГ регистрируют признаки гипертрофии ЛЖ и уменьшение интервала ST. При разнице САД пре- и постстенотического на 60 мм рт. ст. и более степень депрессии сегмента ST прямо пропорциональна степени стеноза.
Стеноз клапана аорты длительное время течет компенсированно, поэтому ЛЖ не увеличен или увеличивается незначительно. Значительное расширение ЛЖ отмечают только при декомпенсации или наличии одновременно и недостаточности клапана. Рентгенологически в боковых проекциях нередко визуализируются кальцинаты на створках аортального клапана, что соответствует средней трети тени сердца. В переднезадней проекции эти же кальцинаты видны значительно реже, поскольку в этом случае они проецируются на тень позвоночника.
На эхоКГ четко регистрируются грубые утолщенные створки с ограниченной сепарацией, постстенотическое расширение аорты, утолщенный миокард ЛЖ, возможно определение площади открытия клапана. Допплерографически можно рассчитать градиент давления. УЗИ-признаки позволяют отличить истинный стеноз клапана (снижение амплитуды открытия, градиент давления) от атеросклеротических изменений (утолщение створок без ограничения подвижности и без градиента давления). Оперативному лечению в обязательном порядке подлежат пациенты, имеющие разницу давления в ЛЖ и в аорте >50 мм рт. ст. или площадь открытия (по эхоКГ) створок <0,8 см2.
Гипертрофическая обструктивная КМП (субаортальный мышечный стеноз) по своим клиническим проявлениям напоминает клапанный стеноз устья аорты и протекает с одышкой (вначале при нагрузке), с головокружениями, синкопальными состояниями. Причиной стеноза является асимметричное утолщение межжелудочковой перегородки близ устья аорты без изменения клапанного аппарата (рис. 18.3). Заболевание в 25% случаев является семейным. По собственным и данным литературы стеноз может сопутствовать генетически обусловленному синдрому лица эльфа (лицо счастливой куклы). Стеноз является динамическим, то есть усиливается в период изгнания и соответственно утолщения и передненаправленного движения межжелудочкой перегородки. Одновременно за счет необычного направления тяги смещенной при гипертрофии сосочковой мышцы и присасывающего действия струи выбрасываемой крови передняя створка митрального клапана движется к межжелудочкой перегородке, сужая выносной тракт еще больше. При этом возникает и вторичная митральная недостаточность. Переднесистолическое движение митрального клапана усиливается при приеме нитроглицерина, ингаляции астмопента или амилнитрита. Каротидный пульс характеризуется быстрым подъемом и наличием 2-й систолической волны или плато. Шум мезо-теле-систолический, точка наилучшего выслушивания — на верхушке (но не над аортой!). Шум значительно усиливается при резком уменьшении притока крови в ЛЖ и соответственно при уменьшении его размеров, что приводит к сближению стенок желудочка и нарастанию степени стеноза. Этот феномен достигается резким вставанием из положения сидя, пробой Вальсальвы или депонированием крови на периферии при приеме вазодилататоров (самый активный и универсальный препарат — нитроглицерин). Наоборот, при повышении периферического сопротивления (положение на корточках с согнутыми в локтях руками и напряженными мышцами) шум уменьшается и может даже полностью исчезнуть, так как повышение периферического сопротивления ведет к затруднению выброса с увеличением полости ЛЖ.
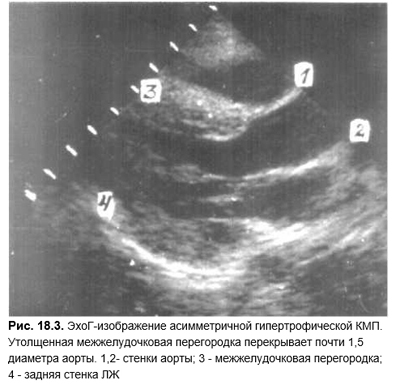
Наряду с вышеописанным мезотелесистолическим шумом на верхушке может выслушиваться высокочастотный раннесистолический шум, распространяющийся в подмышечную область и свидетельствующий о митральной недостаточности. Иногда выслушивается пресистолический галоп.
На ЭКГ выявляют инфарктоподобную картину и блокаду ножек пучка Гиса.
При эхоКГ типично утолщение межжелудочковой перегородки, в 1,5 раза и более превосходящей по толщине заднюю стенку ЛЖ, переднесистолическое движение митрального клапана, среднесистолическое коллабирование (М-образная траектория) аортального клапана. Аналогичная картина движения клапанов может быть выявлена при субаортальном мембранозном стенозе, гипертрофической кардиомипатии с обструкцией и инфильтративной КМП. При катетеризации сердца определяют градиент давления между субаортальной частью выносного тракта и приносящим трактом ЛЖ. Блокаторы β-адренорецепторов приводят к понижению градиента или его полному устранению.
У пациентов пожилого возраста, преимущественно у женщин, гипертрофическая КМП с незначительно утолщенной межжелудочковой перегородкой может сопровождаться систолическим градиентом в выносном тракте ЛЖ за счет значительного смещения вперед обызвествленного митрального клапана. При вентрикулографии внутренняя геометрия ЛЖ у них не изменена, в то время как при гипертрофическом субаортальном стенозе полость ЛЖ приобретает форму банана.
При наличии стеноза в ДД необходимо учитывать и вероятность суправальвулярного стеноза аорты. Систолический шум выброса слышен при этом лучше всего над грудиной или справа сзади над лопаткой, АД на правой руке выше, чем на левой. У людей молодого возраста и у детей следует помнить о субвальвулярном мембранозном стенозе, стенозе устья аорты или о врожденном стенозе ее клапанов.
Недостаточность трехстворчатого клапана, как правило, относительная. Она усиливается на вдохе. При допплерографическом обследовании здоровых лиц гемодинамически несущественный сброс выявляют у 40%. Патологическая регургитация через трехстворчатый клапан характерна при пороках митрального и легочного клапанов, дисфункции сосочковых мышц после инфаркта, как осложнение применения фенфлурамина (см. идиопатическую ЛГ), при миксоматозной дегенерации (параллельно миксоматозной дегенерации митрального клапана). Умеренная и даже тяжелая регургитация через правое AV-отверстие достаточно часто возникает вскоре после удачной митральной вальватомии по поводу митрального стеноза, причем у людей с прежде минимальной или вообще не отмеченной регургитацией. Вероятней всего, резкое увеличение потока через правое AV-отверстие просто демаскирует ранее существовавшие проблемы. Органическую недостаточность отмечают при тромбэндокардитах после постановки катетеров, у наркоманов, а также при болезни Эбштейна, идиопатическом расширении ПЖ, тупой травме грудной клетки, врожденном расщеплении створки. В пользу органической недостаточности трехстворчатого клапана свидетельствует ее персистенция на фоне терапии. О недостаточности трикуспидального клапана необходимо помнить при каждом случае быстрого развития правожелудочковой недостаточности. Клинически отмечается увеличенная пульсирующая печень, выраженный венозный пульс с резкой волной V, значительное увеличение правого предсердия.
Стеноз трехстворчатого клапана практически всегда ревматический и почти всегда сопровождает митральный стеноз. Но появившись, он становится доминирующим. В качестве очень редких причин называют СКВ, миксому правого предсердия, еще реже — врожденное состояние или давление опухоли на правое AV-кольцо. Проявляется диастолическим шумом над точкой выслушивания трехстворчатого клапана справа от грудины внизу. Несмотря на отсутствие цианоза, больных беспокоит одышка, уменьшающаяся в положении стоя. При флебографии вырисовывается высокая волна А, на ЭКГ — гипертрофия правого предсердия, а на рентгенограммах — его увеличение. Катетеризация правых отделов выявляет градиент давления между правыми предсердием и желудочком. Диагностика значительно затрудняется при трепетании правого предсердия, когда выпадают такие признаки стеноза правого AV-отверстия, как повышение волны А на флебограмме и гипертрофия правого предсердия по ЭКГ. ЭхоКГ и допплерография верифицируют клинико-инструментальное заключение.
Недостаточность клапанов легочной артерии развивается при высокой ЛГ или вторично по отношению к стенозу или недостаточности митрального клапана. Диастолический шум регургитации (шум Грехема — Стилла) практически ничем на отличается от его аортального варианта. Громкий шум легочной регургитации еще более усиливается при вдохе. Тихий шум становится еще мягче, несмотря на увеличение кровотока в легочной артерии. Это связано с тем, что мягкий шум наилучшим образом выслушивается во втором межреберье слева от грудины и во время вдоха грудная клетка отводит фонендоскоп в сторону. При пробе Вальсальвы шум регургитации и над легочной артерией, и над аортой стихает (снижение объема кровотока). После прекращения натуживания шум легочной регургитации тут же восстанавливает свою звучность, а шум аортальной регургитации — только после 4–5 сокращений.
Стеноз клапанов легочной артерии — врожденное состояние. В зависимости от степени стеноза может проявиться либо в раннем детстве, либо у взрослых (см. главу Цианоз).
Хроническая объемная перегрузка при брадикардии (полная AV-блокада, синдром слабости синусового узла). Указанные состояния включают целый ряд изменений (синоатриальный блок, выраженная синусовая брадикардия с или без предсердных экстрасистол, синдром тахибрадикардии). Нарушения возбудимости и проводимости — классические примеры недостаточности кровообращения в результате уменьшения МОК из-за редкого сокращения миокарда. Обычно признаки застойной недостаточности миокарда появляются при нагрузке, когда прирост количества сокращений не соответствует кислородному долгу из-за небольшого МОК. При выраженной брадикардии признаки недостаточности кровообращения отмечают и в покое.
Недостаточная подвижность миокарда в результате болезней перикарда обусловливает застойную сердечную слабость при констриктивном перикардите. Характеризуется прежде всего правожелудочковой недостаточностью, выраженным протодиастолическим III тоном, выслушиваемым через 0,08–0,12 с после аортального компонента II тона. Этот перикардиальный щелчок совпадает по времени с тоном открытия митрального клапана, но является низкочастотным и меняется в зависимости от фазы дыхания. На флебограмме регистрируют глубокий крутой коллапс, переходящий в мезотелесистолическое плато, низкий вольтаж на ЭКГ, возможно мерцание правого предсердия, слабые низкоамплитудные волны на рентгенокимограмме. При катетеризации сердца в период сердечного цикла изменения показателей давления в желудочках сердца в диастолу идентичны, во время вдоха САД повышается в ПЖ и снижается в ЛЖ. На выдохе динамика показателей АД носит обратный характер. Противоположные изменения показателей давления при констриктивном перикардите отличают это состояние от рестриктивных нарушений наполнения желудочков, когда изменения САД в ПЖ и ЛЖ содружественны, как и у здоровых. Решающим является рентгенологическая картина обызвествления перикарда, что особенно отчетливо визуализируется в боковой проекции. Констриктивный перикардит с обызвествлениями может быть обусловлен исходами вирусных перикардитов, туберкулеза, облучениями грудной клетки, последствиями оперативных вмешательств. Когда не удается выявить ни одной из указанных причин, говорят об идиопатических формах. На эхоКГ — утолщение и параллельная сепарация (рис. 18.4) листков эпи- и перикарда. Не каждое утолщение листков сердечной сорочки может трактоваться как констриктивный перикардит. Относительно специфическими признаками являются короткое быстрое раннедиастолическое движение задней стенки ЛЖ кзади с постоянным горизонтальным ее положением в другие фазы диастолы. Аналогичные эхоКГ признаки отмечают при рестриктивных и инфильтративных КМП.
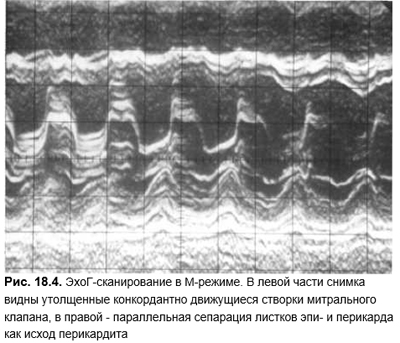
К так называемой недостаточной подвижности миокарда в результате болезней перикарда примыкает понятие о диастолической сердечной недостаточности (синдром ригидного ЛЖ). Обычно это пациенты с АГ, сахарным диабетом, мерцательной аритмией, склеродермией, кардиосклерозом, чаще женщины в преклонном возрасте.
Критериями первичной (изолированной) диастолической недостаточности являются:
- клинические признаки хронической сердечной недостаточности как таковой;
- нормальная или незначительно сниженная сократительная способность миокарда;
- данные о нарушенном расслаблении или заполнении ЛЖ, высокая ригидность миокарда (по эхоКГ-обследованию).
Кардиомиопатии (КМП)
Причина этой группы заболеваний мышцы сердца не известна. Обычно поражаются люди молодого возраста, подростки и дети. Не исключено, что КМП по крайней мере в ряде случаев являются результатом исхода ранее перенесенных хронических кардитов или токсических повреждений миокарда, реакция которого на повреждающие агенты, как известно, определяется генетически. В пользу этого предположения свидетельствует тот факт, что приблизительно в 25% случаев при КМП в миокарде выявляют признаки воспаления. Причем чем моложе пациент, тем выше вероятность выявления воспалительной реакции. У детей в возрасте младше 2 лет признаки миокардита установлены у 45%, у детей старшего возраста — у 15%, у взрослых — в 12%. Следует сразу указать, что ведущим в клинической картине и в прогнозе является сердечная недостаточность: сроки и исход заболевания не определяются наличием или отсутствием клеточной воспалительной реакции в миокарде, присутствием антимиокардиальных антител. Для прогноза более важен показатель фракции изгнания, а не гистологические или электронно-микроскопические изменения в эндомиокардиальных биоптатах. По характеру изменений морфофункциональных показателей миокарда КМП подразделяют на дилатационные, гипертрофические и рестриктивно-облитерирующие. В некоторых случаях обсуждается проблема так называемых латентных КМП, то есть состояний, при которых нет изменений коронарных сосудов, субъективные жалобы минимальны или вообще отсутствуют, могут отмечаться трудно классифицируемые жалобы на боль в грудной клетке, одышку при физической нагрузке, а также связанные с нагрузочными пробами повышение давления в легочной артерии до 30 мм рт. ст. и более, депрессия сегмента ST, повышение уровня лактата в сыворотке крови, патологический тип миокардосцинтиграммы с 201Т1, уменьшение коронарного резерва, изменение показателя эндомиокардиального напряжения (важнейшего критерия поглощения кислорода миокардом) поданным эхоКГ. В эндомиокардиальных биоптатах выявляют неспеци-фические изменения: очажки склероза, гипертрофию и хаотическое расположение мышечных волокон и миофибрилл. Иногда латентная КМП сопутствует генетическим синдромам, в частности синдрому ломкой Х-хромосомы. Если у пациента с латентной КМП нет блокады левой ножки пучка Гиса, то прогноз заболевания относительно благоприятен. Наличие блокады ножки пучка Гиса может указывать на ранние стадии дилатационной КМП.
Дилатационные КМП являются наиболее распространенными. У мужчин выявляют в 3 раза чаше, чем у женщин. В средних широтах из всех установленных причин самыми частыми являются вирусные миокардиты (коксаки 13) и диффузное поражение коронарных артерий, в южных — трипаносомоз (болезнь Чагаса).
К развитию дилатационной КМП предрасположены носители HLA DR4 и DQB1. Важным этиологическим фактором являются аутоиммунные реакции, направленные на миокардиоциты.
Для аутосомно-доминантных форм семейной дилатационной «чистой» КМП описаны шесть генов: Iq32; 9ql3-9q22; 10q21-q23 (сочетание пролапса митрального клапана и дилатационной КМП); 15ql4; lpl-lqJ; Зр25-р22. Еще 2 гена локализованы на Х-хромосоме: Хр21 (быстро прогрессирующая форма у мальчиков-подростков) и Xq28 (КМП с нейтропенией, нарушением митохондрий и 3-метил-глютагон-ацидурией).
Другие генетические формы дилатационной КМП идентифицированы на молекулярном уровне: нарушения карнитин-пальмитол-трансферазы, кар- нитил-ацилкарнитин транслоказы, дефицит длинной цепи 3-гидроксиацил-СоА-дегидрогеназы и очень длинной цепи ацил-СоА-дегидрогеназы. В клинической картине на первое место выдвигается застойная сердечная левожелудочковая недостаточность, кардиомегалия. В тяжелых случаях присоединяется правожелудочковая недостаточность. Изолированное поражение ПЖ — большая редкость. Более чем в половине случаев диагностируют относительную недостаточность митрального клапана, нарушения ритма (чаще галоп при аускультации). На ЭКГ в 35% случаев находят нарушения проводимости по левой ножке пучка Гиса. Решающей для диагноза является эхоКГ, выявляющая резкое расширение ЛЖ без гипертрофии миокарда, но при значительном снижении его сократимости (рис. 18.5). Длительное время показатели эргометрии остаются без изменений, хотя фиксируется отчетливая дилатация желудочка и снижение сократимости миокарда. Приблизительно в 50% случаев пациенты предъявляют жалобы на ангинозные приступы, а на ЭКГ — картина ишемической болезни сердца. Поэтому клинически отличить дилатационную КМП от коронарокардиосклероза практически невозможно. Решающей для ДД является коронарография, позволяющая выявить неизмененные коронарные сосуды при КМП, сочетающиеся с нарушением сократимости и левограммой. Прогноз заболевания неблагоприятный, в течение ближайшего года после появления первых симптомов умирают 10% и в дальнейшем ежегодно — около 12–15% больных. Смерть в половине всех случаев скоропостижная, обусловленная желудочковой аритмией.
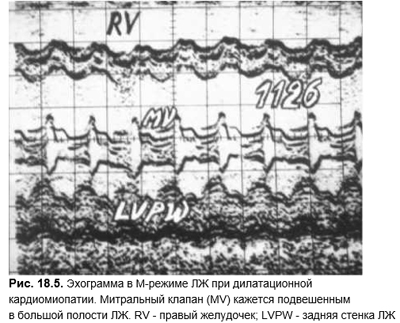
Гипертрофическая КМП протекает нередко с симптомами стеноза устья аорты (см. выше). В ряде случаев патологическая гипертрофия миокарда сочетается с открытым артериальным протоком, множественным лентигенезом, боленью Фридрейха. Не менее чем в 50% случаев гипертрофическая КМП является семейной. Но экспрессивность даже внутри одной семьи очень сильно варьирует. У детей и подростков пенетрантность заболевания неполная, нарастает с возрастом, у взрослых — почти полная. Гипертрофическая КМП, как и другие варианты КМП, будучи морфологически и клинически более или менее определенным состоянием, генетически очень разнородна. Известно несколько генов, кодирующих саркомерные белки, измененные в разных семьях у больных гипертрофической КМП. Это 1q3 (сердечный тропонин Т), 3р (легкая цепь эссенциального миозина), 11р11.2 (миозин-связывающий протеин С), 12q23-24/3 (регуляторная субъединица легкой цепи миозина), 11q11 (тяжелая цепь бетамиозина), 15q2 (альфа-тропомиозин), 19p12.2q13.2 (сердечный тропонин), 7q3 (?). Гипертрофическая КМП может передаваться и через материнские митохондрии. Митохондриальная ДНК матери передается всем ее потомкам (и девочкам, и мальчикам), в то время как митохондриальная ДНК отцов передается очень редко. Примечательно, что если в семье болеет мать, то гипертрофическая КМП чаще передается как а/д состояние.
Если гипертрофическая КМП дебютирует у ребенка в возрасте младше 4 лет, то она, как правило, предстает как один из признаков общего дисморфизма в рамках более широкого синдрома (факоматоз, синдромы Нунен, Видемана — Беквита).
Хотя патогистологическая картина, описанная ниже, достаточно типична для больных гипертрофической КМП, нет единых патогномоничных признаков, отделяющих КМП от других вариантов гипертрофии миокарда.
Гистологически при КМП миокардиоциты очень сильно варьируют по размерам, края клеток недостаточно ровные. Гипертрофированные клетки могут быть расположены под углом друг к другу или даже перпендикулярно, выражен фиброз, изменения мелких интрамуральных артерий. У маленьких девочек с ранним началом болезни выявляют большое количество атипичных митохондрий. Наряду с обсуждаемыми изменениями прогноз и исходы определяют (может быть, даже в большей степени) еще не полностью изученные или даже неулавливаемые трансформации в якобы неизмененных участках: дефекты транспорта кальция, обмена гликогена, изменения сосудов, аритмии и нарушения проводимости (клетки проводящей системы очень немногим отличаются от собственно миокардиоцитов) и т. д.
В подтверждение этой точки зрения можно привести такой факт, что у 60% погибших от гипертрофической КМП изменены 10–15% миокарда (для сравнения: для фатального исхода при инфаркте миокарда или постинфарктном кардиосклерозе требуется поражение не менее 50% миокарда). Риск неожиданной смерти высок у детей и пациентов молодого возраста (из-за желудочковых аритмий), при наличии синкопальных состояний в анамнезе, при семейных вариантах заболевания, при толщине миокарда в 1,8 см и более. Утолщение миокарда в 2 см и более может сопровождаться ишемическим миокардионекрозом с эмболиями по большому кругу кровообращения. Патологическую гипертрофию миокарда чаще всего отмечают по межжелудочковой перегородке и по задней стенке ЛЖ, редко — в области верхушки, еще реже — медиовентрикулярно, по передней стенке ЛЖ, в задней части межжелудочковой перегородки. Выраженность миофиброза нарастает по направлению от перикарда к эндокарду.
При гипертрофической КМП без обструкции (не более 20% всех случаев гипертрофической КМП) внутрижелудочковый градиент давления не возникает ни в покое, ни при физической нагрузке. При необструктивной форме гипертрофической КМП утолщение миокарда особенно отчетливо по межжелудочковой перегородке. У ближайших родственников без какой-либо симптоматики, активно обследованных на эхоГ для поиска семейных вариантов, находят все вышеуказанные варианты локальной гипертрофии. Клиническими признаками гипертрофической необструктивной КМП является ангинозная боль из-за несоответствия массы миокарда и капиллярной сети, гиперплазии и гипертрофии интимы и медии интрамиокардиальных коронарных артерий, ощущение перебоев, головокружение, одышка. Последняя возникает не из-за снижения сократимости (фракция выброса довольно длительное время удерживается на вполне приемлемых цифрах), а из-за высокой ригидности гипертрофированного миокарда с торможением притока крови в ЛЖ (диастолическая недостаточность). Гипертрофия миокарда в средней трети желудочка сопровождается внутриполостным градиентом давления на уровне сосочковых мышц. Дистальная часть ЛЖ истончается и растягивается по типу аневризмы. На ЭКГ выявляют признаки гипертрофии миокарда, высокие зубцы Q и острые отрицательные зубцы Т. Последние особенно типичны для верхушечной гипертрофии миокарда. Решающим для диагноза является эхоКГ, позволяющая выявить степень и локализацию гипертрофии. В динамике, по мере прогрессирующей патологической гипертрофии, необструктивная КМП сменяется обструктивной. Гипертрофическая КМП с признаками обструкции имеет те же проявления, что и субаортальный гипертрофический стеноз. Не всякий случай эхоГ-выявленной обструктивной или необструктивной гипертрофии миокарда может рассматриваться как КМП. Утолщение миокарда, в том числе и асимметричное, может быть у спортсменов, при стенозе устья аорты или ее коарктации, при АГ. Выраженная гипертрофия миокарда вплоть до признаков обструкции выброса может быть следствием хромафинной опухоли, узелкового периартериита с поражением почек, злокачественной АГ. Во всех случаях симптоматической гипертрофии миокарда на ЭКГ отсутствуют отрицательные зубцы Т.
Рестриктивно-облитерирующая КМП — результат утолщения и фиброзирования эндокарда с частичной облитерацией одного или двух желудочков. Рестриктивную КМП некоторые авторы предпочитают подразделять на преимущественно облитеративную с фиброзом эндокарда и субэндокардиального миокарда и рестриктивную (см. далее), вызванную отложением патологических субстанций в миокарде (амилоид, железо). Последнее состояние логичнее назвать инфильтративной КМП. Но патофизиологические, а тем более клинические проявления чрезвычайно близки.
При рестриктивно-облитерирующей КМП процесс захватывает и миокард. Указанная КМП развивается при эндомиокардиальном фиброзе и болезни Лефлера. Эндомиокардиальный фиброз эндемичен для Южной и Западной Африки. Обусловлен, видимо, генетическими особенностями популяции, высокой распространенностью глистных инвазий со свойственной этим состояниям эозинофилией, дефицитом витаминов группы В, животных белков и избытком в рационе арахиса. В Европе заболевание выявляют редко, оно поражает практически только женщин. Клинически проявляется тяжелой сердечной недостаточностью с затруднением притока крови в ригидный ЛЖ. Ангинозная симптоматика и обмороки нечасты. Отмечают набухшие вены шеи. Выслушивается IV тон. Изменения ЭКГ неспецифичны. Иногда снижается вольтаж зубцов, изменяются сегмент ST и зубец Т, может появиться патологический зубец Q без предшествующего инфаркта миокарда. Достаточно часты предсердные и желудочковые аритмии и блокады сердца. Рентгенологически размеры сердца увеличиваются незначительно, в основном за счет левого предсердия и правых камер сердца. Отмечаются признаки относительной недостаточности митрального и трикуспидального клапанов. Данные эхоГ свидетельствуют об утолщении эндокарда и уменьшении полости желудочка, чаще левого. Решающей для установления диагноза является вентрикулография, когда выявляют частичную облитерацию желудочка. Патогномонично наличие остаточных лакун в облитерированной части. Полезной для диагноза является и биопсия эндомиокарда через катетер.
Париетальный эозинофильный фибропластический эндокардит Лефлера клинически протекает с теми же признаками, что и эндомиокардиальный фиброэластоз. Основной диагностический признак — наличие эозинофилии, хотя этот симптом непостоянен. Эозинофильные гранулоциты живут в периферической крови несколько часов, затем поступают в ткани, где переживают до 7 сут. Эозинофильные гранулоциты запускают каскад превращений арахидоновой кислоты с образование тромбоксана А2, который наряду с сосудоповреждающим действием непосредственно активирует ген склероза (см. ранее). При непостоянной и относительно невысокой эозинофилии циркуляция дегранулированных эозинофильных гранулоцитов может свидетельствовать о развитии фибропластического эндокардита.
Осложнением облитерирующей КМП может быть эмболия по большому кругу кровообращения.
Облитерирующие КМП необходимо отличать от констриктивных поражений, комбинированных пороков митрального клапана, карциноидного синдрома, амилоидоза сердца. При рестриктивной КМП скорость притока крови в ПЖ и ЛЖ сердца в раннюю диастолу (фаза быстрого наполнения) в период вдоха и выдоха практически не меняется, в то время как при констриктивном перикардите во время вдоха скорость наполнения ПЖ увеличивается, а ЛЖ уменьшается. Во время выдоха соотношение показателей скорости тока крови через правое и левое AV-отверстия меняется на обратное.
ДД-признаки различных типов КМП суммированы в табл. 18.2.
Таблица 18.2
Особенности различных типов КМП
| Показатель | Тип КМП | ||
| Дилатационная КМП | Гипертрофическая КМП | Рестриктивная КМП | |
| Патофизиология | Преимущественно систолические нарушения. | Преимущественно диастолические нарушения. Возможна обструкция выброса. | Преимущественно диастолические нарушения. |
| Гемодинамика | Диффузно расширен гипокинетический желудочек. Фракция выброса ↓. Конечно-диастолическое давление в норме или ↑. Возможна AV-регургитация. Сердечный выброс ↓. | Фракция выброса ↑. Возможен градиент в выносном тракте ЛЖ. Конечно-диастолическое давление ↑. Возможна митральная регургитация. Сердечный выброс в норме или ↓. | Фракция выброса ↓. Высокое конечно-диастолическое давление. Сердечный выброс в норме или ↓. |
| Клинические проявления | Глобальная сердечная недостаточность. Кардиомегалия. Функциональная AV-регургитация. III и IV тоны. | Стенокардия. Одышка напряжения. Обмороки. Скоропостижная смерть. Шум выброса. Не исключен шум митральной регургитации. IV тон. | Одышка напряжения. Утомляемость. Левожелудочковая → правожелудочковая недостаточность. Функциональная AV-регургитация. |
| ЭКГ | Неспецифические изменения сегмента ST, зубцов Т, Q. | Гипертрофия ЛЖ. Глубокий септальный зубец 0. | Вольтаж ЭКГ ↓. Гипертрофия ЛЖ. |
| Рентгенография | Кардиомегалия. Застой крови в легких. | Кардиомегалии нет. | Расширения сердца нет или умеренное. |
| ЭхоКГ | Левый желудочек расширен, гипокинетичен. Возможны пристеночные тромбы. | Гипертрофия миокарда ± переднесистолическое движение митрального клапана ± среднесистолическое полуприкрытие клапана аорты. | Утолщение миокарда ± облитерация полости. |
| Пятилетняя выживаемость | 30% | 70% | 30% |
Вторичные КМП
Сердце при синдроме Пиквика, ожирение сердца. Едва ли не самый распространенный вариант изменения сердца. При избыточной массе тела жир откладывается не только между листками сердечной сорочки, но и между волокнами миокарда. Жировой дистрофии подвергаются и сами миокардиоциты. Перегрузка сердца жировыми массами приводит к тому, что при каждой систоле миокард вынужден перемещать дополнительную массу. При этом в наименее выгодном положении оказывается ПЖ, чья мышечная масса значительно меньше, чем ЛЖ. Кроме того, возникает несоответствие массы тела и сердечного выброса, который уже не способен в достаточной мере снабжать кислородом ткани. У пациентов с ожирением первые жалобы со стороны сердца появляются по ночам, так как днем часть крови депонируется на периферии, а ночью в горизонтальном положении кровь более равномерно распределяется по телу. Днем типичны обмороки. Присоединяются одышка, тахикардия, ангинозные приступы.
Гипертиреоз приводит к резкой адреналовой гиперстимуляции сердца, усугубляющейся увеличением концентрации адренергических рецепторов миокарда. Одновременно значительно снижается периферическое сопротивление. Обе эти причины приводят к тому, что несмотря на повышение МО, появляются признаки сердечной недостаточности («недостаточность высокого выброса»). Пульсация сердца хорошо видна на глаз. Размеры сердца при гипертиреозе увеличены, выслушивается систолический шум выброса, характерна аритмия, особенно мерцание предсердий (сопровождается повышением риска развития тромбоэмболий), экстрасистолы, застой в большом круге кровобращения. По данным эхоГ толщина миокарда и диаметры камер сердца неизменены или незначительно увеличены. Сократимость миокарда и особенно частота сокращений повышены. Поэтому каждая трудно классифицируемая тахикардия должна служить поводом для исключения тиреотоксикоза. Аускультативно свойственный ранним этапам тиреотоксикоза громкий I тон заставляет исключать малые формы стеноза левого AV-отверстия. Высокий пульс, высокое САД и низкое ДАД требуют исключения недостаточности аортального клапана. На ЭКГ при тиреотоксикозе регистрируют высокие зубцы Т, уменьшение интервала Q–T, признаки повреждения миокарда. Для диагноза «гипертиреозное сердце» и исключения всех вышеперечисленных состояний, взятых по отдельным симптомам, решающим является диагностика собственно гипертиреоза, что не позволяет забывать изотопные методы исследования и определение уровня соответствующих гормонов. Гипертиреозное сердце быстрее и благотворнее реагирует на тиреостатическую терапию, чем на применение сердечных гликозидов.
Гипотиреоз характеризуется брадикардией (хотя иногда регистрируют нормальную ЧСС или даже тахикардию), гипотонией, в 20% случаев выявляют выпот в полость сердечной сорочки. Тоны сердца глухие. На ЭКГ зубцы Т сглажены или даже отрицательные, интервал Q–T увеличен. При биохимических исследованиях типична гиперхолестеринемия, на эхоКГ утолщен миокард, рисунок его нечеткий, по типу отека. Кардиальные изменения получают свою правильную трактовку в сочетании с общими признаками гипотиреоза (зябкость, ломкость и выпадение волос, сухая кожа, снижение умственной и физической активности, анемия, склонность к образованию микседемных отеков). Отеки при застойной сердечной недостаточности могут требовать ДД с микседемными. Но микседемные отеки появляются прежде всего на руках, имеют тестовидную консистенцию, после пальпации не остается вдавления.
Акромегалия часто протекает с увеличением размеров сердца. Приблизительно в 30% случаев развивается манифестная сердечная недостаточность. Поражение сердца обусловлено как избыточной продукцией соматотропного гормона, так и свойственной этим пациентам АГ и коронаросклерозом с рубцовыми изменениями миокарда.
Феохромоцитома вызывает поражение миокарда не только за счет критически высоких цифр АД, но и в результате адреналовых некрозов мышцы сердца и утолщения медии коронарных артерий.
Инфильтративные КМП обусловлены избыточным накоплением в миокарде тех или иных субстанций, что приводит к его утолщению и вытеснению специфической функционирующей ткани. Выявляют при гемохроматозе, гликогеновой болезни, болезни Фабри, саркоидозе, амилоидозе.
Гемохроматоз сопровождается отложением железа в саркоплазме кардиомиоцитов. В начале полость ЛЖ уменьшается, что сближает страдание с рестриктивной КМП. В дальнейшем приблизительно у 1/5 всех пациентовразвивается кардиомегалия с явными симптомами застойной сердечной недостаточности.
Гликогеновая болезнь (гликогеноз) приводит к кардиомегалии с утолщением миокарда в результате массивного отложения гликогена. Особенно типичны эти изменения при гликогенозе II типа (Помпе), но поражение сердца описано и при гликогенозах III и IV типа.
Болезнь Фабри — патологическое отложение гликолипидов во многих внутренних органах — клинически проявляется кардиомегалией и ангиокератомами. Чаще выявляют у людей молодого возраста. Наряду с миокардом поражаются митральный и аортальный клапаны, коронарные сосуды. Картина эхоКГ соответствует необструктивной гипертрофической КМП. Наиболее частой причиной смерти являются инфаркты миокарда.
Саркоидоз наряду с развитием легочного сердца из-за поражения легких в 8% случаев протекает с непосредственным прижизненно диагностируемым поражением сердца. Обычно это недостаточность митрального клапана в результате дисфункции сосочковых мышц и полный AV-блок при поражении межжелудочковой перегородки. При сцинтиграфии выявляют зоны слабого включения изотопа, что отражает наличие рубцовых постинфарктных или специфических саркоидозных изменений как следствие васкулитов и гранулематозной инфильтрации коронарных артерий. Формирование рубцов на месте специфических гранулем Бека после курса преднизолоновой терапии может приводить к аневризме желудочка.
Амилоидоз сердца вначале протекает с утолщением миокарда при незначительно увеличенном внутреннем диаметре ЛЖ. Признаками эхоКГ амилоидоза миокарда являются появление в толще миокарда множества интенсивных сигналов, в динамике сливающихся, и нарушение релаксации миокарда. Отмечено, что к концу фазы быстрого наполнения у здоровых лиц толщина миокарда задней стенки ЛЖ уменьшается на 50–60% максимальной систолической, при РА эта величина составляет 40–50% максимальной систолической, а при амилоидозе — 16–20%. Типичным для диспротеиноза была смена эхоКГ-феномена «выброса хорд» (рис. 18.6) на переднесистолическое движение митрального клапана. Для раннего выявления этого феномена или его лучшей визуализации нами применяемый однократный прием нитроглицерина. В последующем развивается дилатация ЛЖ.
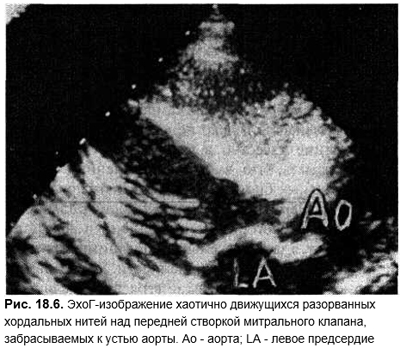
Вторичную рестриктивную КМП отмечают при карциноидном синдроме. Карциноидный синдром, протекающий с поражением сердца, свидетельствует о далеко зашедшем основном заболевании, когда наверняка есть множественные отдаленные метастазы, в том числе в печени. На первый план выступает
правожелудочковая недостаточность. Причинами является утолщение эндокарда и недостаточность трехстворчатого клапана. Иногда изменения эндокарда приводят к стенозу правого AV-отверстия. Митральный клапан и клапан легочной артерии поражаются очень редко. Правые отделы сердца на рентгенограммах расширены умеренно или вообще кажутся неизмененными, поскольку утолщение эндокарда препятствует дилатации сердца. Но давление наполнения ПЖ резко повышено. Вольтаж зубцов на ЭКГ снижен. Возможны эпизоды спазма коронарных артерий со стенокардией Принцметала. Выраженность карциноидного синдрома тесно коррелирует с выделением с мочой производного серотонина — 5-гидроксииндолуксусной кислоты. Некоторые авторы относят ко вторичным рестриктивным КМП и амилоидоз сердца. Поражение сердца при амилоидозе обусловлено не только отложением амилоидных масс в миокарде, но и в стенках сосудов, в проводящей системе. Наличие нефротического синдрома и положительные результаты биопсии слизистой оболочки кишечника верифицируют диагноз. Признаки вторичной рестриктивной КМП описаны при системной склеродермии, амилоидозе, фиброэластозе, болезни Лефлера, Гоше.
КМП свойственны нейро- и миопатиям, отражая гистологическую близость миокарда и поперечнополосатой мускулатуры. Поражение мышцы сердца известно при болезни Фридрейха, миопатии Дюшена (по типу дилатационной КМП), при других вариантах миопатий. Рассматривают в рамках полисистемного митохондриального синдрома (митохондриальная энцефаломиопатия). Связаны с переносом измененной митохондриальной ДНК матери. Общая клиническая картина, выдвигающаяся на первый план неврологическая симптоматика, позволяют правильно интерпретировать кардиальную патологию.
Перипартальная КМП как самостоятельное заболевание признается далеко не всеми. Тем не менее это состояние известно в клинической практике. Следует указать, что в 43% прижизненных эндомиокардиальных биопсий ПЖ выявляют признаки воспаления. Вероятность развития перипартальной КМП выше у многорожавших женщин в возрасте старше 30 лет, а также у женщин с поздними гестозами и при многоплодной беременности. Критериями диагноза являются:
1. Развитие сердечной недостаточности в последний триместр беременности или в ближайшие 6 мес после родов.
2. Отсутствие каких-либо причин, позволяющих объяснить перипартальное возникновение сердечной недостаточности.
3. Отсутствие признаков поражения сердца в последний месяц, предшествовавший беременности.
В клинической картине преобладает кардиомегалия, которая в половине случаев обратима. Прогноз в случаях с обратимой кардиомегалией хороший, последующие беременности протекают без кардиальных осложнений. Если же кардиомегалия сохраняется стабильно, то прогноз плохой, последующие беременности могут способствовать развитию застойной сердечной недостаточности.
Тиаминдефицитная (нутритивная) КМП известна и как «сердце при болезни бери-бери». Наиболее ярким симптомом является резкое расширение всех полостей сердца. Бери-бери, как правило, сопровождается и другими проявлениями: пеллагра, полиневрит. В современных условиях заболевание возникает при поражениях печени, при алкоголизме, одностороннем скудном питании с поступлением менее 1 мг тиамина в сутки. Поражение сердца проявляется на ЭКГ значительным уплощением зубца Т, увеличением интервала Q–T. Фракция выброса снижена. Повышение ригидности миокарда приводит к повышению давления наполнения желудочков. Несмотря на большие внутренние диаметры камер сердца, МОК, в противоположность иным вариантам дилатационной КМП, увеличен. Это несоответствие объясняется расширением периферических сосудов со снижением сопротивления в результате токсического действия пирувата, избыточно образующегося при дефиците витамина В,. Среди лабораторных признаков типичны лактоацидоз, снижение активности транскетолазы в эритроцитах и ее повышение на 25–30% при добавлении in vitro витамина В1. Клинически типичным для бери-бери КМП является быстрый положительный ответ на применение витамина В, со значительным уменьшением размеров полостей сердца. С признаками нутритивных КМП (по типу дилатационной КМП) протекают дефициты селена, карнитина, квашиоркор.
Токсическую КМП чаще всего выявляют при алкоголизме («этаноловое сердце»). В возникновении этаноловой КМП имеет значение плохое питание, гиповитаминоз, дефицит белков. Потребление алкоголя достигает при алкогольной КМП > 100 г/сут. Общим в клинической картине токсических КМП является дилатация сердца, тахикардия, признаки застойной сердечной недостаточности, нарушения ритма, перикардиальный выпот, увеличение интервала Q–T. Типичными для алкогольной КМП являются снижение АД, снижение уровня холестерина, повышение в крови уровня альфа-гидрокси-бутират-дегидрогеназы. После применения витамина В1 (в отличии от бери-бери) нет быстрого положительного ответа. Прогностически течение токсической КМП, по крайней мере на начальных этапах, значительно лучше, чем при истинной дилатационной КМП. После прекращения действия повреждающего фактора на фоне проводимой терапии возможно значительное уменьшение размеров расширенного сердца.
Ятрогенная (медикаментозная) сердечная недостаточность развивается при применении многих препаратов. Инотропно действует большинство антиаритмических лекарственных средств. Блокаторы β-адренорецепторов могут достаточно быстро снизить сократимость миокарда и при ранее существовавшем его повреждении вызвать сердечную недостаточность. Барбитураты, наркотики, галотан, кобальт, ионизирующее излучение оказывают угнетающее действие на миокард. Особенно тяжелые повреждения вызывает адриамицин, применяемый в лечении пациентов с лимфомами и лейкозами. Развивающаяся дистрофия миокарда ведет к резкой кардиомегалии и застойной сердечной недостаточности. Кардиотоксический эффект препарата дозозависим, поэтому не рекомендуется превышать дозу 450 мг/м2. Повреждения миокарда известны и после длительного применения антимигренозных препаратов (фиброз эндокарда ЛЖ, аорты и митрального клапана), фенотиазина, трициклических и квадрициклических антидепрессантов.
Сердечная недостаточность при электролитных нарушениях возникает при гипокалиемии, гипо- и гиперкальциемии. Гипокалиемия развивается при диабетической коме, длительной профузной диареи, гиперальдостеронизме, продолжительном применении салуретиков, семейном пароксизмальном параличе.
Этот тип сердечной недостаточности известен как гиподинамическая недостаточность. Она никогда не является изолированной и самостоятельной, а сопровождает другие заболевания и является результатом обменных или общесоматических заболеваний. На ЭКГ отмечают увеличение интервала Q–T. Механическая систола резко укорочена. АД нормальное или понижено, но симптомы застойной сердечной недостаточности не определяются. В ДД гипокалиемических КМП необходимо исключать интоксикацию (прежде всего снотворными средствами), порфирию, тяжелую печеночную недостаточность, инфекционные заболевания, ревматический миокардит.
При гипокальциемии интервал Q–T увеличен. Клинических признаков сердечной недостаточности не отмечается. Гиперкальциемия проявляется уменьшением интервала Q–Т депрессией сегмента ST, что может напоминать интоксикацию сердечными гликозидами. Одновременно выявляют экстрасистолы и нарушения внутрижелудочковой проводимости. Сократимость миокарда повышена, как и АД.