Боль в области грудной клетки условно можно сгруппировать так:
- Боль кардиоваскулярной этиологии (при патологии венечных артерий, кардиомиопатии, стенозе устья аорты, регургитации, перикардите, расслоении аорты, эмболии или инфаркте легких, легочной гипертензии);
- Легочного генеза (пневмония, плеврит, пневмоторакс);
- Желудочно-кишечного генеза (спазм кардии и привратника, эзофагит, рефлюкс, пептическая язва, панкреатит, холецистит);
- Нейромышечного происхождения и при повреждениях опорно-двигательного аппарата (миозит, хондрит, остит, неврит);
- Прочие (опоясывающий лишай, травмы, опухоли средостения, гипервентиляционный синдром, необъяснимые причины).
Боль в области грудной клетки может быть острой, хронической, рецидивирующей (при ишемической болезни сердца — ИБС), поверхностной (невралгия, миалгия, оссалгия) или глубокой (кардиального генеза, а также боль при эзофагите, опухолях средостения).
При боли в области грудной клетки всегда возникает мысль о болезнях сердца. Именно они являются причиной 70–80% всех случаев боли в груди. У людей молодого возраста, тем более у детей, положение вещей, конечно, иное. Подробный анамнез и клиническое обследование позволяет дифференцировать боль кардиальной этиологии и боль, обусловленную заболеваниями других органов.
Стенокардия — клиническая форма ишемии миокарда в результате поражения венечных артерий (их недостаточности). Коронарная недостаточность может быть острой, латентной (возникающей только при нагрузке) или относительной (1. Несоответствие массы миокарда (при его гипертрофии) и просвета сосудов. 2. Снижение концентрации кислорода в крови при анемии, отравлении угарным газом. 3. Уменьшение кровотока (шок, пороки сердца и т. д.)).
Не каждое поражение коронарных сосудов манифестирует как болевой синдром (стенокардия). Наряду с типичной стенокардией у ряда пациентов отмечают атипичные формы с безболевым тяжелым коронаросклерозом. Безболевые варианты ИБС нередко выявляют у больных сахарным диабетом. У других пациентов ИБС манифестирует остро с развития инфаркта миокарда вплоть до внезапной смерти без предшествующих признаков коронарной недостаточности.
Часто стенокардия воспринимается не как боль, а как ощущение сдавления за грудиной или невозможности дыхания, слабость, зевота, тошнота. Нередко стенокардия протекает с одышкой, что является отражением острого повышения ДАД в ЛЖ. Боль чаще тупая, тянущая, сверлящего характера, локализуется преимущественно загрудинно. Боль иррадиирует в левое плечо, в ульнарную сторону левой руки, реже — в шею, еще реже в правую руку и в верхнюю часть живота. Четко локализуемая острая прокалывающая боль в области верхушки, особенно длительная, связанная с дыханием, свойственна функциональным расстройствам. Длительность стенокардитической боли невелика, чаще менее 5 мин. Типична быстрая положительная реакция на прием нитроглицерина. Хотя боль при диафрагмальной грыже, неинтенсивную желчную колику, спазм желудочно-кишечного тракта также нередко удается купировать нитроглицерином.
Если типичная стенокардическая боль длится более 15 мин, есть основания говорить об ангинозном статусе. Длительная волнообразная по интенсивности боль в грудной клетке чаше носит функциональный или вертеброгенный характер. Хотя волнообразность интенсивности боли свойственна и миокардиту.
Перегрузка сердца вследствие анемии, тахикардии, при гипертиреозе на фоне уже существовавшего коронаросклероза может спровоцировать ангинозный приступ. Часто боль развивается после еды, особенно обильной. Холод, особенно влажный, будучи сильным вазопрессорным фактором, способен вызвать спазм коронарных сосудов, точно так же, как и ходьба против холодного ветра. Реже выявляют тип стенокардии, исчезающий при ходьбе, что подтверждается и данными ЭКГ. Известны приступы стенокардии во сне из-за неспособности сердца перекачивать увеличившийся в результате облегченного венозного возврата объем крови.
Наряду с классическими формами стенокардии существуют смешанные. При этом вероятность приступов стенокардии повышается при психоэмоциональных нагрузках. Эти случаи можно объяснить превалированием влияния блуждающего нерва с уменьшением коронарного кровотока при коронароспазме, однако и коронаросклероз может проявиться при эмоциональном стрессе или на холоде. Вышеуказанные формы характеризуются типичным болевым синдромом и логично завершаются ангинозным статусом или стенокардией типа Принцметала. Последний вариант описывается как атипичный, так как ангинозные приступы развиваются в покое, реже — при нагрузке. На ЭКГ фиксируют типичный подъем сегмента ST, нередко с аритмией. Такие приступы могут не проявляться болью и фиксироваться только при 24-часовом холтеровском мониторировании. В интервалах между спастическими приступами ЭКГ не изменена. «Немая» ишемия миокарда может развиваться без характерных болевых приступов, завершаясь всеми типичными осложнениями коронарокардиосклероза.
Стенокардию по тяжести течения для практических целей некоторые авторы рекомендуют подразделить на 4 формы:
1. Стабильная стенокардия. Приступы развиваются при существенной физической нагрузке, их характер остается постоянным в течение месяцев.
2. Нестабильная стенокардия. Могут отмечаться три варианта: впервые развившаяся стенокардия (<1 мес); изменение характера болевых приступов при уже существовавшей стабильной стенокардии; стенокардия покоя и при незначительных физических нагрузках.
3. Ангинозный статус. Боль длится более 15 мин.
4. Угрожающий инфаркт миокарда. Боль интенсивная, длится дольше обычного приступа, эффект от приема нитроглицерина практически отсутствует. В таких случаях больных необходимо вести как пациентов с инфарктом миокарда.
Стенокардию при заболеваниях венечных сосудов обычно диагностируют уже при тщательном расспросе пациентов. Но в отдельных случаях атипичного течения могут возникнуть диагностические сложности.
Сходная симптоматика возможна при функциональных расстройствах, тяжелом стенозе устья аорты, гипертрофической кардиомиопатии, хроническом легочном сердце, нарушениях ритма и синдроме X.
Ангинозные приступы могут возникнуть в ответ на употребление кокаина.
Хроническое легочное сердце при нагрузке также может проявляться загрудинной болью, часто сочетаясь с одышкой и менее реагируя на покой. Видимо, развивается относительная ишемия правого желудочка (ПЖ), уменьшенный возврат к ЛЖ со снижением коронарного кровотока. Но на первый план выступают легочное сердце с одышкой и цианозом и причины, его вызвавшие.
Экстрасистолы и другие виды аритмий воспринимаются пациентами как неприятные загрудинные ощущения и порой интерпретируются как стенокардия.
Синдром Xпротекает с болью, напоминающей таковую при стенокардии. Проба с нагрузкой по данным ЭКГ свидетельствует об ограничении коронарного резерва. Состояние объясняется изменениями в области артериол, известно как «микроваскулярная стенокардия» и характеризуется хорошим прогнозом.
Стенокардия может протекать с увеличением длительности и интенсивности приступа (angina crescendo) вплоть до инфаркта миокарда. Ангинозные приступы могут урежаться при адекватном лечении, развитии коллатералей, после формирования инфаркта в ишемизированном участке, на фоне снижения физической активности (застойная сердечная недостаточность, перемежающаяся хромота).
Стенокардия может возникать спонтанно в покое (angina decubitus), обычно сопровождаясь тахикардией и повышением АД.
Возможна «тихая стенокардия». При суточном холтеровском мониторировании ЭКГ до 70% всех эпизодов изменений зубца Т и сегмента ST у лиц с поражением коронарных артерий сердца не сопровождаются болью. Эти ЭКГ-признаки очень редки у лиц без патологии коронарных сосудов. Перфузия миокарда с использованием радиоизотопов позволила выявить появление очагов ишемии при интенсивной умственной нагрузке.
Стенокардия у каждого пациента протекает достаточно предсказуемо для него. Известна средняя частота приступов, их длительность и выраженность, появляются «излюбленные» препараты для их купирования. Всякое нарастание симптоматики, появление приступов в покое говорит о так называемой нестабильной стенокардии. Последнее состояние связывают с острым повышением степени окклюзии коронарной артерии в результате повреждения фиброзной ткани над атеромой и адгезии тромбоцитов. У 35–40% пациентов с нестабильной стенокардией при ангиографии выявляют гемодинамически значимый тромб в сосуде, соответствующем ишемизированному очагу в миокарде. У 35% больных с нестабильной стенокардией в ближайшие 3 мес после ее начала развивается инфаркт миокарда.
Клиническое обследование пациентов со стенокардией малопродуктивно. Часто диагностируют сопутствующую АГ и признаки атеросклероза. При подозрении на поражение коронарных артерий сердца необходимо установить наличие факторов риска.
К факторам риска ИБС относят:
- АГ. Но если снижение показателей АД уменьшает риск развития инсульта на 40%, то вероятность возникновения инфаркта миокарда снижается всего на 8%.
- Гиперлипидемии. Наряду с гиперхолестеринемией большое значение имеет гипертриглицеридемия. Прогностически неблагоприятно повышение уровня холестерина липопротеинов низкой плотности и снижение уровня холестерина липопротеинов высокой плотности (антиатерогенная липидная фракция).
- Сахарный диабет, даже если он еще не имеет клинических проявлений. Сердечно-сосудистые заболевания у пациентов с сахарным диабетом развиваются значительно чаще, чем у лиц без него.
- Курение. Фактор, который может быть устранен самим пациентом. Отказ от курения значительно улучшает прогноз при стенокардии и состояние после инфаркта миокарда.
- Ожирение. Особое клинико-прогностическое значение имеет преимущественное ожирение туловища у мужчин (абдоминальный тип). АГ и нарушения жирового обмена развиваются параллельно увеличению массы тела. Ее нормализация может улучшить течение АГ и выраженность гиперлипидемии.
- Острый стресс выступает как разрешающий фактор. При здоровых сосудах острый стресс не приводит к патологическим изменениям в миокарде. Хронический стресс протекает с образованием мелкодисперсных фракций холестерина и других видов атерогенных липидов, что является одним из его основных патогенетических механизмов. К повреждению сосудов приводит и гиперурикемия.
- Поражение венечных артерий сердца считается типичным для людей зрелого и преклонного возраста, однако начинаться оно может уже в раннем детстве и даже пренатально. Известны случаи выявления у плода на последних месяцах до рождения и у новорожденных участков потери эндотелия в коронарных сосудах, отека, фрагментации, разрушения эластической мембраны. Развивается клеточная реакция атипичного воспаления, фиброплазия. В последующем в это место диффундируют макрофаги, пенистые клетки, откладываются липиды, формируется атерома. В клетках, «вмурованных» в атеромы, начинается синтез цитокинов, ведущих к гибели клеток по механизму воспаления либо апоптоза. Первым этапом повреждения считают повышение АД, что отражает выброс катехоламинов у плода внутриматочно или в период родов. Катехоламины высвобождаются при таких стрессах при гипоксии плода и новорожденного, патологической родовой деятельности, маточно-плацентарной недостаточности, врожденных аномалиях развития (особенно коарктация аорты), незрелости плода, недоношенности. Эти причины, а также смена плодного типа кровообращения на взрослый вызывают гемодинамические удары по стенкам коронарных артерий с повреждением эластической мембраны. В области разветвлений коронарных артерий, особенно отхождения от левой коронарной артерии ее передней нисходящей ветви, гемодинамические удары усиливаются турбулентностью. Именно это место является впоследствии излюбленным для локализации атеросклеротических бляшек.
В группе мужчин со стабильной стенокардией, нормальным АД, нормальными характеристиками ЭКГ в покое и без предшествовавшего инфаркта миокарда ежегодная смертность составляет 1,4%, при наличии только АГ вероятность смерти резко возрастает (до 7,5%), при наличии только изменений на ЭКГ — до 8,5%, в случаях сочетания АГ и патологической ЭКГ — 12,5%.
Диагностика поражений венечных артерий осуществляется прежде всего по данным ЭКГ. В начале ИБС ЭКГ в покое в интервалах между приступами стенокардии может оставаться неизмененной или характеризоваться неспецифическими изменениями. При хронических изменениях коронарных артерий отмечают отрицательный, двухфазный зубец Т, депрессию сегмента ST. Более информативна ЭКГ при проведении проб с дозированной физической нагрузкой. Положительным результатом пробы считают появившийся во время нагрузки приступ стенокардии и/или депрессию сегмента ST не менее чем на 0,1 mV (субэндокардиальная гипоксия), или монофазное подъем ST (трансмуральная ишемия). Результаты ЭКГ-проб с нагрузкой малоинформативны при гипертрофии миокарда, блокадах ножек пучка Гиса, гипокалемии, на фоне приема препаратов наперстянки, при анемии и гипервентиляции. Ложноположительный результат отмечают у 20% женщин молодого возраста.
Данные эхоКГ позволяют рассчитать показатель потребления кислорода миокардом по величине эндомиокардиального напряжения, оценить систолические и диастолические характеристики миокарда.
При ангинозном статусе или перенесенном инфаркте возможно выявление очага гипо- или акинезии, аневризмы стенки желудочка. Современные аппараты для эхоКГ позволяют объективно оценить плотность миокарда или провести контрастные исследования.
Сцинтиграфия с 2о1Т1 (таллием) выявляет участки с нормальным и сниженным кровотоком, так как изотоп распределяется в миокарде пропорционально интенсивности перфузии миокарда. При острой ишемии миокарда выявляют дефект накопления, который исчезает в покое. При постинфарктных рубцах дефект накопления остается неизменным.
Радионуклидная вентрикулография позволяет оценить насосную функцию миокарда и выявить ее сегментарные нарушения.
Точное представление о состоянии коронарных артерий дает селективная коронарография. Показаниями для ее проведения являются молодой возраст пациента (<45 лет), атипичная стенокардия, рефрактерная к терапии стенокардия с ограничением качества жизни, нестабильная стенокардия или «прединфарктные состояния», стенокардия или положительный результат нагрузочной пробы после ранее перенесенного инфаркта миокарда, сердечная недостаточность (аневризма стенки желудочка?) после инфаркта. В зависимости от степени тяжести говорят о поражении одного, двух или трех сосудов. При ангиографии можно выявить очаговые или диффузные изменения сосудов. Современная качественная аппаратура позволяет визуализировать сосуды диаметром 1 мм. Обструкция сосуда гемодинамически значима, если она уменьшает его диаметр на 70% и более. До этого значения ишемия не развивается, за исключением случаев спазма или тромбоза. Результаты коронарографии следует трактовать в совокупности с клиническими данными. Высокий риск развития инфаркта миокарда связан с изменениями левой главной коронарной артерии или проксимальной части левой нисходящей. Безусловно, исходы поражения коронарных артерий коррелируют с числом пораженных артерий и степенью стеноза, но прогноз остается хорошим при стабильной стенокардии и сохранной функции ЛЖ, даже если поражены все три сосуда. Снижение сократимости ЛЖ (определяют по фракции выброса) существенно ухудшает прогноз, особенно при одновременном поражении трех сосудов. Пожилой возраст является дополнительным фактором риска.
По результатам клинико-инструментальных исследований принимают решение о проведении чрескожной транслюминальной коронароангиопластики или аортокоронарного шунтирования. Диагностическая аппаратура нового поколения для проведения УЗИ может дать объемное изображение коронарных сосудов или стентов.
Стенокардия при пороках сердца и кардиомиопатиях может развиться при неизмененных коронарных сосудах по типу относительной коронарной недостаточности, то есть при недостаточности перфузии вследствие несоответствия просвета коронарных сосудов и массы миокарда. Коронарный резерв, то есть способность в норме увеличивать коронарный кровоток в 4–5 раз, у этих пациентов значительно снижен. Такая форма стенокардии развивается прежде всего при стенозе устья аорты, аномальном отхождении левой коронарной артерии, гипертрофической и дилатационной кардиомиопатии.
Инфаркт миокарда. В 95% случаев обусловлен острым тромбозом артерии над разрывом атеросклеротической бляшки, предварительно блокировавшей часть просвета сосуда. У 65% больных в ближайшие сутки отмечают спонтанный тромболизис, так что тромботическую окклюзию выявляют приблизительно у 35%. Очень редко причиной инфаркта миокарда является эмболия сосуда. Инфаркт миокарда может возникнуть при спазме сосуда.
Обычно инфаркт миокарда — это поражение мышцы ЛЖ. Правожелудочковый инфаркт возникает при окклюзии правой коронарной или огибающей артерии и характеризуется повышением давления наполнения ПЖ, нередко в сочетании с трикуспидальной регургитацией. Вообще же дисфункцию ПЖ отмечаюту 55% больных с задненижним инфарктом.
Сохранение насосной функции сердца целиком зависит от распространенности инфаркта. Наличие инфаркта или сочетания инфаркта и рубца, захватывающих 50% и более мышцы сердца, ведет к кардиогенному шоку и смерти.
Трансмуральный инфаркт захватывает миокард на всю его толщину от эндокарда до эпикарда и обычно характеризуется деформацией комплекса QRS и изменением зубца Q на ЭКГ.
Субэндокардиальный нетрансмуральный инфаркт сопровождается только изменениями сегмента ST и зубца Т. Субэндокардиальный инфаркт захватывает обычно внутреннюю 1/3 миокарда, где напряжение стенки максимально.
Поскольку клинически отдифференцировать субэндокардиальный и трансмуральный инфаркты практически невозможно, инфаркты лучше классифицировать по данным ЭКГ как инфаркты с или без патологического зубца Q. Инфаркт миокарда диагностируется с учетом клинической картины, данных ЭКГ и энзимного спектра.
Примерно у 60% всех больных за дни или недели до инфаркта миокарда отмечают продромальные признаки: нестабильную стенокардию, утомляемость. Ведущий симптом острого инфаркта миокарда — боль в груди, длящаяся более 15–20 мин. В редких случаях боль может быть менее продолжительной, или вообще отсутствовать («немой» инфаркт), хотя описывают также и боль, длящуюся до 8 ч. Интенсивность боли обычно превышает стенокардитическую, нередко сопровождается страхом смерти. Боль локализуется загрудинно, в левой половине грудной клетки, иногда она опоясывающая, сжимающая. Точная локализация нередко отсутствует. При инфаркте задней стенки ЛЖ боль может быть локализованной в эпигастрии, симулируя перфоративную язву, панкреатит, холелитиаз, заставляя думать об «остром» животе. Иррадиация боли напоминает таковую при стенокардии. Но до 25% инфарктов (прежде всего у лиц пожилого возраста и пациентов с сахарным диабетом), выявленных на ЭКГ, не имеют четкой анамнестической картины, что свидетельствует о частоте «немых» инфарктов.
АД при инфаркте миокарда снижается, возможна картина кардиогенного шока с беспокойством пациента, холодным потом, бледностью. Более чем у ½ больных в ранней стадии инфаркта миокарда выявляют аритмию, преимущественно желудочковую экстрасистолию, брадикардию с атриовентрикулярной блокадой, мерцательную аритмию. При аускультации характерны приглушение тонов, пре- или протодиастолический ритм галопа. При инфаркте задней стенки ЛЖ с дисфункцией сосочковых мышц выслушивается мягкий систолический шум умеренной митральной недостаточности. Как правило, систолический шум негрубый. Если при первом обследовании выслушивается грубый шум, то больше оснований говорить о каких-то предсуществовавших изменениях клапанов. При инфаркте с поражением сосочковых мышц может развиться острая недостаточность митрального клапана. У 1/3 пациентов с инфарктом миокарда через 1–3 дня выслушивается шум трения перикарда. Иногда удается уловить перикардиальный выпот, который лучше всего диагностируют по данным эхоГ. Выявление шума трения перикарда в ближайшие часы после инфаркта миокарда свидетельствует скорее о перикардите, чем об инфаркте. Шум трения перикарда обычно сопровождает инфаркты с патологическим зубцом Q. На 2-е сутки после инфаркта миокарда возможно повышение температуры тела до 39 °C, сохраняющееся до недели. СОЭ повышается в эти же сроки, в то время как лейкоцитоз — в первые же часы. Типичны гипергликемия вплоть до глюкозурии. Персистирование этих биохимических изменений свидетельствует об истинном сахарном диабете.
Решающим для установления диагноза «инфаркт» является ЭКГ-исследование. Хотя неизмененная ЭКГ не исключает инфаркта. Для точной диагностики необходимы исследования в динамике (табл. 16.1).
Таблица 16.1
ЭКГ-стадии течения инфаркта миокарда
| ЭКГ-стадия | ЭКГ-изменения | |
| Острая (свежий инфаркт) | Сверхострая |
|
| I |
|
|
| Переходная |
|
|
| Хроническая (старый инфаркт) | II |
|
|
||
| III |
|
|
Общими признаками являются:
- Подъем сегмента ST выше изолинии в отведениях, соответствующих зоне инфаркта, и зеркальная депрессия этого сегмента в отведениях, соответствующих интактным участкам миокарда. При субэндокардиальном инфаркте отмечают депрессию ST над участком поражения.
- Высокий острый зубец Т (гипоксический). Отмечают очень рано, при госпитализации может отсутствовать.
- Развивается патологический зубец Q, сливающийся с зубцом R над участком инфаркта.
- В подострой стадии зубец Т над участком инфаркта становится отрицательным. Сохраняющийся подъем ST указывает на вероятную аневризму стенки желудочка.
Не всегда удается проследить все стадии инфаркта миокарда, а подострая стадия может затянуться до нескольких недель. По данным ЭКГ сложно говорить о давности инфаркта, хотя при регистрации 12 отведений можно относительно точно локализовать очаг поражения.
Исследование ферментного спектра важно для диагностики и ДД инфаркта миокарда. Повышение активности энзимов, определение которых используют для диагностики ишемии миокарда, отмечают в первые 3–6 ч после инфаркта. Чаще всего определяют КФК общую и ее кардиоспецифический изофермент (МВ-КФК). Специфичность КФК относительна, поскольку внутримышечные инъекции, физические перегрузки, эпилептические приступы, травмы, тяжелые интоксикации также способны вызвать ее повышение. МВ-КФК более кардиоспецифична, но менее чувствительна. Ее определение важно для ДД. Например, при эмболии сосудов легкого повышается уровень КФК, в то время как уровень МВ-КФК остается неизменным. Активность КФК общей и МВ-КФК повышается через 4–6 ч после инфаркта, достигает максимума через 18–24 ч и нормализуется к 2–3-м суткам. Степень повышения уровня КФК коррелирует с размером инфаркта миокарда и может использоваться с прогностической целью. Для диагностики инфаркта применяют определение ЛДГ, ГОТ и ACT. ГОТ реагирует через 4–6 ч после инфаркта, достигает пика через 24–28 ч и нормализуется на 3–5-й день. ЛДГ реагирует медленнее, достигая пика на 2–4-й день. Указанные ферменты недостаточно специфичны. ГОТ повышается при заболеваниях мышц и печени. Активность ЛДГ повышается при многих заболеваниях. Поэтому важно определение ее кардиоспецифической фракции. Определение активности ЛДГ оправдано при инфаркте миокарда, возникшем 2–5 дней назад, когда уровень всех других ферментов уже нормализовался. Для ранней биохимической диагностики инфаркта миокарда целесообразно определять уровень миоглобина в крови, который повышается в первые же часы, хотя следует помнить, что эта проба неспецифична.
ДД проводят с заболеваниями, протекающими с болью в грудной клетке.
Ангинозный статус. Грань между затянувшимся приступом стенокардии и инфарктом миокарда может быть достаточно условной. Решающее значение приобретает сначала ЭКГ, а позднее — биохимические пробы.
С болью в области сердца, напоминающей ангинозную, с нарушениями ритма протекает гастрокардиальный синдром Ремхельда. Характеризуется стенокардитической болью, ощущением сдавления за грудиной, нарушениями ритма сердца (прежде всего — тахикардией, суправентрикулярными и желудочковыми экстрасистолами со снижением АД), болью в эпигастрии, метеоризмом, тошнотой. Причиной синдрома являются аэрофагия, метеоризм с раздуванием области перехода поперечной толстой кишки в нисходящую, большие диафрагмальные грыжи. Патогенез заключается в механическом сдавлении сердца, сердечной сорочки, нижней полой вены, диафрагмальной плевры и, вероятно, в рефлекторной симпатикотонии из-за боли, проецирующейся на органы грудной клетки из брюшной полости. У пациентов со здоровым сердцем указанное расстройство воспринимается как невроз, у пациентов с предшествующей коронарной патологией синдром Ремхельда усиливает ангинозные приступы.
Эмболия сосудов легкого. Эмболии мелких сосудов легкого клинически чаще не диагностируют. Эмболия крупной ветви может симулировать инфаркт миокарда. У 50% ведущим симптомом является боль в грудной клетке, сопровождающаяся страхом смерти. Одновременно развивается выраженная одышка и правожелудочковая недостаточность, набухают вены шеи, появляется акцент II тона над легочной артерией. Тахикардия и тахипноэ затрудняют интерпретацию этих симптомов, решающим для диагноза является ЭКГ с картиной перегрузки правых отделов, снижение рО2 в крови. Сцинтиграфически выявляется участок нарушения кровоснабжения в легких.
Спонтанный пневмоторакс характеризуется болью в грудной клетке, одышкой, приглушенностью дыхательных шумов.
Расслаивающая аневризма аорты протекает с остро возникающей интенсивной болью за грудиной. Поскольку расслаивание чаше протекает хронически, рецидивирующе, то в анамнезе находят указания на несколько эпизодов острой боли, иррадиирующей в основание черепа, спину и ноги. Причинами расслаивающей аневризмы аорты являются аортоартерииты, дисплазии соединительной ткани, атеросклероз, сифилис. Диагноз расслаивающей аневризмы аорты устанавливают на основании данных рентгено-, аорто-, эхоГ или КТ.
При пароксизмальной тахикардии характерны ощущение прекардиального давления, тяжести, коллаптоидного состояния, что иногда напоминает острый инфаркт миокарда.
При неблагоприятном течении инфаркта миокарда с сохраняющейся болью следует исключить повторный инфаркт.
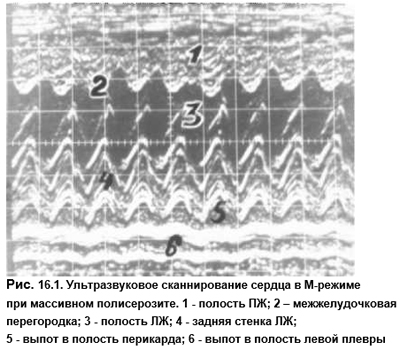
Ухудшение состояния больного может быть обусловлено присоединением синдрома Дресслера, который развивается у 1–3% больных через 2–3 нед после инфаркта. В его основе лежит иммунная реакция на некротизированный участок миокарда с появлением аутоантител. Их выявляют у 85–90% всех больных с инфарктом миокарда (то есть несравненно чаще, чем клинические проявления синдрома. Клинически этот синдром проявляется перикардитом, иногда общим серозитом (рис. 16.1), лихорадкой, ускорением СОЭ, возможна умеренная эозинофилия. Аналогичное состояние известно и кардиохирургам у оперированных больных и обусловлено теми же иммунными реакциями на хирургическую травму миокарда (постмиокардотомический синдром). Прогноз хороший, синдром Дресслера обычно подвергается полному обратному самостоятельному развитию. При яркой выраженности синдрома оправдано назначение короткого курса стероидов в невысоких дозах, обусловливающего стремительное улучшение картины.
Ложная аневризма после разрыва некротизированного участка миокарда — редкое, но крайне тяжелое осложнение. Разрыв аневризмы обычно приводит к скоропостижной смерти из-за тампонады перикарда. Как правило, отмечают на 3–7-й день после инфаркта, проявляется сильной болью, шоковым состоянием. Но в редких случаях благодаря спайкам перикарда объем излившейся крови ограничен, возникает ложная аневризма, хорошо диагностируемая эхоГ и КТ.
Острый перикардит протекает с прекардиальной болью, варьирующими по интенсивности от тупого давления до интенсивных резких. Боль усиливается при кашле, дыхании, в положении лежа. Поэтому больные предпочитают сидеть с легким наклоном вперед. Дыхание частое, неглубокое, так как глубокое дыхание усиливает боль. При аускультации выслушивается шум трения перикарда, характеристика которого при разной степени фибринозных наложений изменяется от нежного шороха до грубого «машинного» звука. Шум трения перикарда усиливается при надавливании фонендоскопом, наклонах туловища, глубоком вдохе. Другим клиническим признаком перикардита является диссоциация границ сердца и звучности тонов сердца в положении стоя и лежа. При перикардите в положении стоя выслушивают приглушенные тоны, лежа — границы сердца расширяются, а тоны становятся более звучными. Феномен объясняется «всплыванием» сердца над жидкостью, скапливающейся по задней стенке ЛЖ и поджимающей сердце к передней грудной клетке. Увеличение объема выпота приводит к стиханию боли вследствие раздвигания воспаленных серозных листков жидкостью. Тоны сердца проводятся далеко влево.
На ЭКГ при перикардите во всех отведениях регистрируют низкий вольтаж (при выраженном выпоте вольтаж колеблется в такт дыханию) и горизонтальная или вогнутая элевация сегмента ST. Этот ЭКГ-признак следует учитывать как отличие от инфарктной ЭКГ-кривой, тем более что при инфаркте миокарда подъем сегмента ST выражен в большей степени, выпуклость направлена вверх, он наблюдается только в отведениях, соответствующих участку инфаркта. Сложности в ДД перикардита могут возникать при синдроме ранней реполяризации, возникающей чаще у пациентов молодого возраста с ваготонией и протекающим с небольшим подъемом сегмента ST. Кроме того, при перикардите нередко отмечают заостренный зубец Р, инвертированный Т.
Острый перикардит практически всегда протекает с выпотом, объем которого определяют основным заболеванием. Признаки тампонады зависят в первую очередь от скорости накопления жидкости в полости сердечной сорочки, и только потом — от ее объема. При медленном заполнении перикардиальной полости объем выпота может достигать 1 л и более и не вызывать тампонады. Клинически тампонада проявляется бледностью, одышкой, резкой глухостью сердечных тонов, расширением границ сердца, набуханием вен шеи, болезненной увеличенной печенью.
Рентгенологически выпот диагностируют, если его объем превышает 250 мл. При таком объеме регистрируют расширение силуэта сердца, сглаженность кардиально-диафрагмального синуса. При больших объемах сердце приобретает вид реторты, треугольника, ворота легких перекрываются расширенной тенью сердца, но поля легких прозрачны. Это является рентгенологическим отличием расширения тени сердца при левожелудочковой недостаточности. Самым надежным методом диагностики перикардиального выпота является эхоГ, позволяющая визуализировать каждую оболочку сердца. Наряду с распространенным выпотным процессом по данным эхоГ можно выявить истинную (целомическую) и ложную (поствоспалительную) кисты перикарда (рис. 16.2) и отдифференцировать их по характеристике стенок и содержимого. Выпот выглядит как свободное пространство между листками эпи- и перикарда. При сопутствующем выпотном плеврите визуализируется и плевральный листок. При большом выпоте появляется парадоксальное движение межжелудочковой перегородки, ложный феномен пролабирования митрального клапана (симптом качающегося сердца). Полуколичественно выпот классифицируется как минимальный (сепарация листков эпи- и перикарда по типу треугольника), умеренный (сепарация листков в систолу и диастолу только по задней стенке ЛЖ) и выраженный (сепарация по передней и задней поверхности сердца). Возможно достаточно точное количественное определение объема. Выпот в перикард часто сопутствует синдрому Дресслера, нефротическому синдрому, уремии, опухолям, туберкулезу, диффузным болезням соединительной ткани (особенно СКВ, системным формам РА), травмам, после операций на сердце (у 5–30%), а также может осложнять терапию прокаинамидом, гидралазином, изониазидом, фенитоином, антикоагулянтами. Определить характер выпота (транссудат, экссудат, гнойный, геморрагический, туберкулезный и т. д.) по данным эхоГ невозможно. Чаще всего в практике врача бывает доброкачественный серозный перикардит, возникающий после вирусных инфекций или сопутствующей пневмонии. Частота других форм перикардита определяется контингентом больных, обследованных в конкретной клинике. Если не удается выяснить причину перикардита, его расценивают как идиопатический. Идиопатические перикардиты в 10–30% случаев рецидивируют в ближайшие месяцы или годы. После рассасывания выпота на какое-то время (определяемое объемом, длительностью воспаления, его видом) сохраняется параллельная сепарация листков эпи- и перикарда. Такую же эхоГ-картину дает накопление жира между листками сердечной сорочки и хронический перикардит. Определить вид выпота, а иногда и его причину, удается после перикардиальной пункции. Геморрагический выпот типичен для передозировки антикоагулянтов, геморрагических диатезов, но прежде всего — для опухолей. В ДД необходимо учитывать разрывы аневризмы синуса Вальсальвы и расслаивающей аневризмы аорты.

Хронический перикардит возникает при туберкулезе, микседеме, ДБСТ, травмах, новообразованиях и уремии. Причем при опухолях, туберкулезе и уремии хронический перикардит обычно безболезненный. Хронический перикардит может быть серозным, хилезным, геморрагическим, гнойным, фибринозным, с очажками кальцинатов. Другой вариант хронического перикардита — преобладание склеротических процессов над экссудативными с облитерацией полости, резким торможением притока крови
в ЛЖ и ПЖ сердца с ее депонированием на периферии. И при остром, и при хроническом перикардите всегда страдают субэпикардиальные слои миокарда. Глубина этого слоя и степень изменения определяются характером и причиной перикардита.
Боль в грудной клетке может возникать и при нарушениях ритма сердца. В таких случаях боль описывается как толчкообразная или как неприятные ощущения. Боль возникает и в покое, нередко исчезает при нагрузке. При подробном сборе анамнеза, как правило, выясняют, что наряду с болью пациенты ощущают перебои, сердцебиение, «замирание» сердца.
Боль в области сердца функционального характера — одно из наиболее частых расстройств, которое необходимо исключать при ДД со стенокардией или с другими органическими состояниями. Очень часто она возникает у женщин молодого возраста, у эмоциональных мужчин, при синдроме гипермобильности, пролапсе митрального клапана. Провоцирующими факторами являются духота, психоэмоциональные перегрузки. Часто развивается не во время физической работы, а после нее. Физическая нагрузка приводит даже к улучшению состояния. Боль может быть тупой, прекардиальной, длиться часами. В других случаях это «простреливающая» боль по типу мимолетного интенсивного укола, четко локализованная, сопровождающаяся затруднением выдоха. ЭКГ и эхоГ — без особенностей. Функциональная боль в сердце рассматривается как проявление общих функциональных расстройств. Нередко она является проявлением синдрома Эффорта (сердце солдата, или сердце новобранца, или синдрома Да Косты). Из дополнительных симптомов отмечают нарушения дыхания (затруднения выдоха с ощущением стеснения за грудиной, комом в горле), гипервентиляционный синдром, головокружение, раздраженный кишечник, парестезию и многие другие.
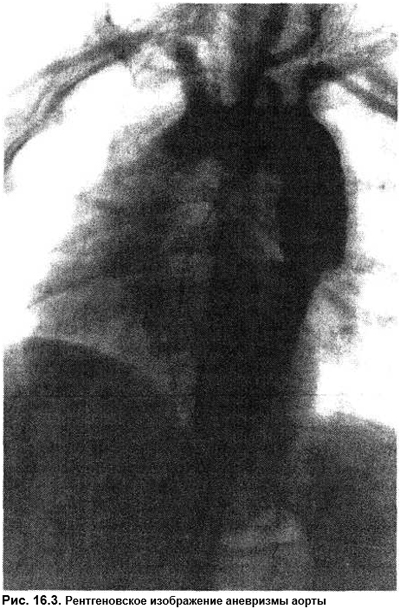
Боль в грудной клетке может возникать и при аневризме аорты (рис. 16.3). Распространенность аневризм аорты можно охарактеризовать классической фразой: бывает чаще, чем диагностируется. По итогам 67 352 вскрытий аневризма аорты выявлена в 516 случаях, причем только в 70 она была диагностирована прижизненно. Длительное время аневризма протекает бессимптомно, боль появляется сравнительно поздно. Пальпаторно выявляют только большие аневризмы брюшной аорты, диаметр которых не менее 5–6 см, протяженность — 3 см. Рентгенологически выявляют прежде всего аневризмы с кальцинированными стенками. При тромбированной аневризме рентгенконтрастное вещество не попадает в аневризматический мешок, и возможны ложноотрицательные результаты. Наилучшие результаты по сочетанию быстроты их получения, неинвазивности, отсутствии лучевой нагрузки и достоверности дает эхоГ. В случаях аневризмы восходящей и брюшной аорты результаты УЗИ полностью совпадают с итогами КТ и ЯМР. Но стоимость последних несравнимо выше. Самая частая причина аневризмы — медианекроз в сочетании с АГ (2/3 всех случаев). Аневризмы аорты появляются при аортоартериите, ДБСТ, болезни Марфана (в том числе и стертые формы), коарктации аорты, открытом артериальном протоке, врожденных деформациях грудной клетки, атеросклерозе (особенно в сочетании с АГ), сифилисе, бактериальном эндокардите. Редко аневризмы формируются после травм. Ятрогенная аневризма может быть следствием травматической катетеризации аорты или сердечно-сосудистых оперативных вмешательств. Расслаивание аневризмы аорты может протекать с интенсивной болью за грудиной, иррадиирующей в ноги, живот, позвоночник, спину, основание черепа. В зависимости от локализации расслаивания это может быть боль за грудиной или в животе. Боль очень упорная, доводящая до шока, практически не устраняется после введения анальгетиков. Нитроглицерин может принести мимолетное облегчение за счет снижения АД и замедления вследствие этого расслаивания анервизмы. Профилактика расширения аневризмы и ее расслаивания в предоперационный период заключается в применении блокаторов β-адренорецепторов.
Аневризма может начинаться чуть выше аортального клапанного кольца (в этом случае у ½ пациентов развивается недостаточность аортальных клапанов) и распространяться на восходящую аорту или даже на ее дугу. При другом варианте аневризма затрагивает только нисходящую аорту. В запущенных формах этого разграничения нет. Расслаивание аневризмы аорты считают острым, если оно длится менее 2 нед, хроническим — 2 нед и более. Острое расслаивание аневризмы ведет к скоропостижной смерти. Хроническое расслаивание сопровождается нарушением кровообращения по ветвям аорты. Сужение устьев сонных артерий приводит к появлению мозговой симптоматики. Сужение плече-головного ствола проявляется отсутствием пульса на лучевой артерии. Расслаивание брюшного отдела аорты может сопровождаться нарушением кровотока по спинномозговым артериям, ишемией спинного мозга, параплегиями и парапарезами, что стимулирует эмболизацию артерий.
Боль в груди при разрыве пищевода. Спонтанный разрыв пищевода (синдром Бурхаве, или «банкетный пищевод») — одна из наиболее серьезных перфораций пищеварительного тракта. Классическая клиническая картина складывается из резкой боли плеврального характера в левой половине грудной клетки, субстернальной боли, форсированной рвоты с небольшой примесью крови. Боль иррадиирует в эпигастральную область и в спину. Тут же возникает дисфагия, одышка. Дыхание быстрое, короткое, поверхностное. Боль в эпигастральной области и напряжение мышц живота могут симулировать прободение пептической язвы желудка или двенадцатиперстной кишки. Но по мере прогрессирования заболевания абдоминальная симптоматика угасает, а торакальная усиливается. Не исключена возможность развития спонтанного пневмоторакса и появления крепитации в супрастернальной области или на шее.
Рентгенологически выявляют левосторонний пневмоторакс и выпот в плевральную полость. Контрастное вещество, принятое внутрь (ни в коем случае не следует назначать сульфат бария; назначают растворимый стерильный контраст), в 70% случаев попадает в левую половину грудной клетки. При подозрении на разрыв пищевода эндоскопия опасна и не рекомендуется.
Быстро присоединяется медиастинит. Показатели смертности резко возрастают, если диагноз установлен спустя 12 ч и более после разрыва.
Боль в грудной клетке при поражении плевры отличается связью с дыханием. Выраженность ее усиливается при вдохе и уменьшается, иногда до почти полного исчезновения, на выдохе. Поэтому пациенты предпочитают дышать часто и поверхностно. Боль иррадиирует на соматом Захарьина — Геда по ходу чувствительной ветви соответствующего нерва. Поэтому при поражении плевры, выстилающей центральные отделы диафрагмы, боль распространяется в плечи, а при поражении периферических отделов диафрагмальной плевры — в живот. При аускультации сухой париетальный плеврит характеризуется типичным шумом трения плевры, усиливающимся при глубоком дыхании. Двусторонний шум трения плевры у людей молодого возраста атлетического телосложения при нетяжелом общем состоянии нередко сопровождает вирусные инфекции, особенно вызванные вирусами Коксаки. Выпот, сопровождающийся лихорадкой, свидетельствует о воспалительных процессах, безлихорадочный выпот типичен для опухолевого экссудата и застойного транссудата. Односторонний застойный плеврит локализован, как правило, справа. Застойный выпот обычно безболевой, но сопровождается выраженной одышкой. Выпот при эмболии легкого проявляется картиной его инфаркта, иногда — кровохарканьем.
Плеврит может развиваться как при пораженных, так и при интактных легких. В последнем случае он только отражает общую сосудистую реакцию экссудатации. В сущности каждый сухой плеврит — это минимальный с преимущественным фибринозным экссудатом выпотной плеврит. Увеличение объема жидкости в плевральной полости приводит к исчезновению шума трения плевры и устранению боли. Дыхательные шумы приглушены прямо пропорционально объему выпота. Сдавление легкого приводит к появлению бронхиального дыхания. Подвижность диафрагмы повышена.
При большом объеме выпота рентгенологически определяют интенсивную гомогенную тень. Она распространяется латерально, заполняет прежде всего синусы. Выпот менее 300 мл в переднезадней проекции диагностируется плохо. Необходимо выполнить снимок в момент глубокого выдоха стоя и в положении лежа на здоровом боку. Междолевые выпоты, осумкованные медиастинальные и диафрагмальные выпоты могут симулировать объемные образования легких. Шварты дают значительно меньшее ослабление дыхательных шумов, снижение движения диафрагмы и не имеют менискообразной тени выпота. Очень информативна эхоГ. Выпот при этом выглядит как эхонегативное образование, контрастирующее с легким и стенкой грудной клетки. Для ДД плеврита большое значение имеет рентгенологическая картина легкого: наличие опухолевых узлов, туберкулеза, застоя, инфаркта, пневмонии.
Геморрагический выпот развивается при опухолях, геморрагическомдиатезе.эмболиилегкого, инфекционных заболеваниях, при сердечной недостаточности и травмах. Пункция плевральной полости и исследование выпота позволяет разграничить транссудат (выпот при изменении онкотического и гидростатического давления) и экссудат (итог нарушения проницаемости клеточных мембран вследствие воспаления). Экссудат в отличие от транссудата богат белком, клетками, характеризуется высоким уровнем ЛДГ, уровень глюкозы в нем ниже, чем в крови. Хотя эти признаки не являются абсолютными, их следует учитывать в общей клинической картине. Так, при лечении пациента с транссудатом мочегонными средствами или при медленной положительной динамике за счет всасывания жидкости уровень белка в оставшемся объеме транссудата повышается. Нет порогового значения лейкоцитов в плевральной жидкости, которое было бы абсолютно специфичным для экссудата. При большом количестве клеток в транссудате (опухоль, травма) характерны высокие значения ЛДГ, свойственные воспалительным процессам.
Иногда требуется проведение повторных пункций с микроскопическим и цитологическим исследованием полученной жидкости, чтобы выяснить истинную причину плеврита, особенно при опухолях и туберкулезе. При подозрении на карциноматоз или туберкулез плевры оправдана ее биопсия, которую безопасно можно провести только при наличии сравнительно большого объема выпота. Но даже при самых кропотливых диагностических поисках около 30% всех выпотных плевритов остаются необъясненными.
Выпотной туберкулезный плеврит развивается обычно через несколько месяцев после инфицирования, хотя отмечают при далеко зашедших легочных формах туберкулеза. Особенно характерен для детей и подростков, но возможен у лиц любого возраста. Может развиваться бессимптомно, но, как правило, повышается температура тела, усиливаются признаки интоксикации. В плевральной жидкости — высокое содержание белка и лимфоцитоз. При бактериоскопии микобактерии туберкулеза выявляют крайне редко, при посевах их выделяют не чаще, чем в 20% случаев. При биопсии плевры в 50% случаев в препарате устанавливают специфические клеточные бугорки или микобактерии.
Выпот при онкологических заболеваниях частый. Особенно он типичен для метастазирующих карцином бронхов и молочной железы. Сложности при диагностике возникают только при неизвестной первичной опухоли. Выпот обычно является экссудатом, богат белком, носит геморрагический характер.
Блокада сосудистого оттока узлами опухолей, особенно при лимфомах, приводит к накоплению транссудата в полости плевры. Выпот при лимфомах развивается в достаточно поздней стадии болезни и сочетается с резким расширением ворот легких. Окончательный диагноз можно установить при цитологическом исследовании и биопсии плевры. Рентгенологические особенности известны при карциноматозном лимфангиите, который выглядит как сетчатое изменение лимфатических сосудов.
Асбестоз вызывает доброкачественный плевральный выпот у 5% лиц, работающих во вредных условиях. Стаж работы обычно составляет 5–30 лет. Но состояние определяется скорее не стажем, а условиями работы. Выпот может быть бессимптомным или протекать с болью, обычно — односторонний, по объему небольшой или умеренный. Представляет собой экссудат, может быть кровянисто окрашен. В 56% случаев сочетается с легочным асбестозом.
Значительные сложности возникают при диагностике мезотелиомы плевры. В анамнезе у этих больных возможны указания на контакт с асбестом. Плеврит характеризуется упорным течением, боль нарастает постепенно, она стабильна, долго локализуется только на пораженной стороне. При рентгенологическом исследовании на париетальной плевре видны округлые, позднее узловатые сливающиеся между собой образования. Цитологическая диагностика затруднена сходством опухолевых клеток и плеврального эпителия.
Саркома плевры редко протекает с выпотом, но сочетается с упорной болью.
С болью в грудной клетке, но менее интенсивной, без четкой локализации, протекают доброкачественные опухоли плевры. Рентгенологически они выглядят как четко ограниченные плотные узловатые затемнения. Это ангиомы, фибромы, липомы, хондромы, невриномы и миксомы. Опухоли данной локализации могут быть частным проявлением общего генетического синдрома, что требует соответствующего поиска.
Выпот в плевральную полость при диффузных болезнях соединительной ткани, при висцеральных формах РА имеет характер экссудата и характеризуется очень низким содержанием глюкозы.
Выпот в плевральную полость при амилоидозе обычно носит характер транссудата, обусловлен общим нефротическим синдромом и изменением стенки сосудов при этом виде парапротеиноза.
Эозинофильный плеврит (количество эозинофильных гранулоцитов >10% общего числа клеток в пункционной жидкости) сопровождает течение опухолей, вирусных и бактериальных инфекций, глистной инвазии.
После пункции плевральной полости и попадания в плевральную полость воздуха в плевральной жидкости увеличиватся количество эозинофильных гранулоцитов, что может ошибочно трактоваться как эозинофильный или опухолевой плевриты.
Плевральный выпот при синдроме желтых ногтей обусловлен затруднением лимфооттока и сочетается с желтыми ногтевыми пластинками и периферическими лимфатическими отеками.
Характеристику плеврального выпота при пневмониях см. в главе Цианоз.
Выпот при инфаркте легкого носит геморрагический характер.
Плевральный выпот при микседеме сочетается с перикардиальным, возникает сравнительно нечасто, богат белком, но беден клетками.
Хилоторакс — это плевральный выпот с содержанием липидов >4 г/л. Возникает при ранениях грудного лимфатического протока или при нарушениях лимфооттока опухолями, при медиастинальном фиброзе, при врожденной дисплазии лимфатических сосудов. В хилезной жидкости высока концентрация нейтральных жиров и жирных кислот. Микроскопически определяют суданофильные капли жира. Уровень триглицеридов составляет 1,24 ммоль/л и выше. В ДД необходимо учитывать так называмый холестериновый плеврит. При нем жидкость кажется золотистой, переливается оттенками радуги за счет отражения света кристаллами холестерина, большое количество которых хорошо выявляется микроскопически. Концентрация холестерина достигает 26ммоль/л, а концентрация нейтральных жиров и жирных кислот низкая. Это состояние не представляет собой синдромальную или нозологическую единицу, а сопровождает хронические воспалительные процессы плевры, особенно инкапсулированный туберкулезный плеврит.
Эмпиема плевры — гнойный плеврит — характеризуется лихорадкой, лейкоцитозом, болью в грудной клетке. В пунктате выявляют большое количество бактерий. Кокковая флора типична для пара- и постпневмонических эмпием плевры, для осложнения бронхоэктазий. Смешанная флора сопровождает опухоли, кисты. «Стерильная» эмпиема, то есть гнойный экссудат без признаков банальной флоры, подозрителен на наличие туберкулезной инфекции.
Плевриты при заболеваниях органов брюшной полости типичны для панкреатитов. В этом случае выпот в плевру локализуется слева и богат амилазой. При синдроме Мейгса выпот сопровождает злокачественные опухоли яичников и сочетается с асцитом. Также с асцитом сочетается и плевральный выпот при циррозе печени. Жидкость в плевральной полости выявляют и при поддиафрагмальных или околопочечных абсцессах.
Ятрогенный выпот в плевральную полость может развиваться при прорыве катетера из подключичной вены и затекании инфузата. При ошибочном введении тонкого зонда для питания, особенно у маленьких детей, он может перфорировать главный бронх и попасть в плевральную полость. Медикаментозно обусловленный выпот в плевру возникает при применении миорелаксанта дантролена (обычно односторонний выпот с примесью крови и эозинофильных гранулоцитов, без легочных инфильтратов). Выпоты при применении агонистов допамина, амиодарона, ИЛ-2 протекают с легочными инфильтратами.
Оценка плеврального синдрома иногда требует проведения инвазивных исследований. К ним относятся торакоцентез, чрезкожная биопсия плевры и торакоскопия.
Торакоцентез — пункция грудной клетки с целью получения жидкости из плеврального пространства. Чаще всего проводят с целью определения этиологии выпота. Терапевтическими целями торакоцен- теза являются удаление критического по объему экссудата (транссудата) для устранения дыхательной недостаточности и введения антибиотиков, склерозирующих или противоопухолевых препаратов. Перед пункцией плевральной полости необходимо убедиться в отсутствии местной инфекции в области предполагаемого выполнения торакоцентеза.
Противопоказаниями к проведению торакоцентеза являются:
- неадекватное поведение пациента;
- некорригированное нарушение свертываемости крови;
- дыхательная недостаточность (за исключением случаев, когда она обусловлена большим выпотом);
- недостаточность кровообращения, выраженные нарушения ритма сердца, нестабильная стенокардия.
Относительные противопоказания:
- искусственная вентиляция легких;
- буллы легкого.
Осложнения процедуры редки и включают: пневмоторакс (попадание воздуха в плевральную полость через иглу или при ранении легкого); кровотечения в плевральную полость или кровоизлияние в ткани грудной клетки (ранение субкостального сосудистого пучка); обморок (в том числе вазовагальный); эмболию воздухом (редко, но с катастрофичными последствиями); внедрение инфекции; ранения селезенки или печени (при низком месте пункции или спленомегалии); отек легкого (удаление более 1 л жидкости из плевральной полости).
Расправление легкого и касание висцеральной плевры о париетальную может сопровождаться умеренной болезненностью. Процедура должна быть прекращена при сильной боли, одышке, брадикардии, выраженной тахикардии, слабости, головокружении и других тревожных признаках, даже если в плевральной полости еще остается жидкость.
Чрезкожная биопсия плевры проводится при неуспехе цитологического исследования. Биопсия значительно более информативна в диагностике ТБ и других гранулематозов. Так, в 80% случаев ТБ диагностируют при 1-й биопсии, в 10% — при двух и более биопсиях, только в 10% — по данным цитологического исследования и посева плевральной жидкости. При опухолях плевры диагноз в 90% случаев устанавливают при сочетании цитологических исследований жидкости и биопсий. Противопоказания и осложнения — те же, что и при торакоцентезе. Но частота развития кровотечений и пневмоторакса значительно выше. Профилактика кровотечений основывается на соблюдении золотого правила: щипцы открывать только горизонтально.
Торакоскопия — эндоскопическое исследование плевры и плеврального пространства. Торакоскопию проводят при невозможности достоверной диагностики причины поражения плевры по данным торакоцентеза и биопсии. В этом случае решающим может оказаться непосредственный осмотр плевры, особенно с прицельной биопсией.
Торакоскопия позволяет установить диагноз у половины больных злокачественным поражением плевры, у которых причина выпота осталась невыясненной после цитологического исследования и биопсии. Противопоказания к торакоскопии не отличаются от таковых при торакоцентезе. Добавляются невозможность проведения наркоза или неспособность перенести коллапс легкого после наложения пневмоторакса. Риск развития осложнений повышается при массивных плевральных спайках.
Пневмоторакс характеризуется болью в грудной клетке, усиливающейся при дыхании, сочетается с дыхательной недостаточностью. Клинический диагноз бывает затруднен, так как дыхательные шумы могут отсутствовать и при выпотном плеврите. Характерен тимпанит, но при тонком слое воздуха в плевральной полости он невыражен.
Рентгенологическая диагностика не вызывает затруднений. Легкое сдвинуто в противоположную сторону, между ним и стенкой грудной клетки определяется полоса просветления. Если увеличивается одышка, появляются цианоз, набухают вены шеи и смещается средостение, то можно говорить о напряженном пневмотораксе, развивающемся при вентильном механизме.
Идиопатический пневмоторакс развивается у лиц молодого возраста долихостеномелического сложения, в 40% случаев рецидивирует.
Симптоматический пневмоторакс развивается при синдромах Марфана, Элерса — Данлоса, эмфиземе легких, бронхиальной астме, бронхэктатической болезни, легочном фиброзе любого генеза, инфаркте легкого, саркоидозе, эмфиземе средостения и перфорации пищевода при дивертикулах и опухолях. Наконец, пневмоторакс возможен как осложнение пункции плевры с ранением легкого.
Межреберная невралгия не является самостоятельным заболеванием. Характеризуется болезненностью по межреберьям, гиперестезией, болезненностью точек выхода межреберных нервов рядом с позвоночником. Лихорадка, повышение СОЭ не типичны для межреберной невралгии и требуют поиска воспалительных состояний. В ДД необходимо учитывать прежде всего опоясывающий лишай, при котором сегментарная болезненность может на дни и даже на неделю опережать типичные высыпания. Борнхольмская болезнь (см. главу Лихорадочные состояния) вначале часто расценивается как межреберная невралгия, а затем при локализации боли в нижних отделах грудной клетки как плеврит.
Боль, исходящая из мышц и костей грудной клетки, диагностируют по локальной болезненности, усиливающейся при надавливании. Боль в мышцах возникает после физических перегрузок, при трихинеллезе и дерматомиозите.
В костях грудной клетки возможны те же процессы, что и в других костях скелета. Это могут быть первичные и метастатические опухоли, эозинофильные гранулемы, туберкулез, остеомиелит.
Боль, исходящую из позвоночника, суставов, пищевода см. в соответствующих разделах.
Боль в области грудной клетки характерна также для болезни Мондора (флебит поверхностных боковых вен грудной клетки), синдрома Титце (болезненное опухание хрящей I; II; редко — III ребра за счет перихондрита, чаще одностороннее, с диффузным утолщением). Нередко сочетается с хроническим легочным процессом, при синдроме «скользящего ребра». Генез этого синдрома неуточнен. При подтягивании реберной дуги пациента слышен щелчок и возникает боль. При той же пробе с противоположной стороны боли не возникает.
Боль при раке молочной железы возникает сравнительно поздно. Определяется узловатое уплотнение.
Чаще беспокоит распирающая боль при мастопатии, усиливающаяся при пальпации. Интенсивность боли усиливается после овуляции. Боль прекращается с началом месячных (см. главу Анамнез).