К настоящему времени позитивное влияние различных гиполипидемических лекарственных средств, таких как ингибиторы ГМГ-КоА-редуктазы (более известных как статины), фибраты, на выживаемость и смертность у пациентов с высоким кардиоваскулярным риском достоверно установлено (Scandinavian Simvastatin Survival Study Group, 1994; Sever P.S. et al., 2003; Sakamoto T. et al., 2006). Эти классы лекарственных средств широко применяют в программах первичной и вторичной профилактики кардиоваскулярных событий (Swedberg K. et al., 2005) не только у пациентов с уже документированной ИБС (Cleland J.G. et al., 2003; Rauchhaus M. et al., 2003). Редукция величины общей смертности и повышение вероятности выживаемости тесно ассоциировались с гиполипидемическим эффектом статинов, фибратов и, вероятно, секвестрантов жирных кислот (Cowburn P.J. et al., 1998; Robinson J.G. et al., 2005). Однако результаты многих исследований свидетельствуют, что эти препараты, вероятно, могут обладать и достаточно выраженной способностью к улучшению клинических исходов, непосредственно не связанной с гиполипидемической активностью (так называемый плейотропный эффект статинов) (Nakagami H et al., 2003). Так, у статинов доказано наличие антивоспалительной, антипролиферативной и антиагрегантной активности, продемонстрирована способность к улучшению пассивно-эластических свойств эндотелия сосудов и снижению тромбофильных свойств крови, повышению тотальной сократительной способности миокарда ЛЖ и регуляции деятельности автономной нервной системы (Jain M.K., Ridker P.M., 2005). Более того, позитивное влияние статинов на выживаемость непосредственно не зависело от уровня липидов плазмы крови (Sever P.S. et al., 2003). Вместе с тем, если достижение целевых уровней плазменной концентрации липидов рассматривается в качестве важнейшей детерминанты, определяющей возможность превенции впервые выявленных случаев ИБС, новых и повторных кардио- и цереброваскулярных событий, то вклад плейотропных эффектов статинов в реализацию улучшения прогноза остается дискутабельным (Kjekshus J. et al., 1997; Aronow W.S., Ahn C., 2002). Так, в метаанализе, проведенном J.G. Robinson и соавторами (2005) и включающем результаты наблюдения за 81 859 пациентами, было установлено, что степень редукции кардиоваскулярных событий, ассоциированных с применением статинов, может быть объяснена преимущественно снижением уровня липидов, в том числе и ХС ЛПНП. Авторы полагают, что нет серьезных указаний на то, что плейотропные эффекты оказывают клинически значимое влияние на выживаемость пациентов с высоким кардиоваскулярным риском. Тем не менее, потенциальные возможности статинов в лечении пациентов с высоким кардиоваскулярным риском, обусловленным различными сердечно-сосудистыми заболеваниями, широко обсуждаются. В то же время предполагается, что и фибраты способны к реализации плейотропного эффекта, аналогичного таковому у статинов (Scirica B.M. et al., 2006; Khush K.K. et al., 2007).
Лечение гиперлипидемии у больных с сердечной недостаточностью
Сердечная недостаточность рассматривается как один из потенциально фатальных и завершающих этапов кардиоваскулярного континуума, сохраняющий свою высокую клиническую и эпидемиологическую значимость для системы здравоохранения. Так, последние десятилетия ознаменовались увеличением продолжительности жизни населения особенно в развитых странах мира, и широким внедрением программ первичной и вторичной профилактики, что привело к повышению выживаемости пациентов с ранее фатальными осложнениями кардиоваскулярных заболеваний. Кроме того, многие факторы риска, такие как артериальная гипертензия, сахарный диабет, ожирение, метаболический синдром, перенесенный инфаркт миокарда, оказывая непосредственное влияние на частоту развития диастолической и систолической дисфункции миокарда в любой возрастной группе больных, способствуют повышению вероятности клинической манифестации сердечной недостаточности (Tsouli S.G. et al., 2008). При этом, у лиц с асимптомной и манифестной сердечной недостаточностью II–III функционального класса (ФК) непосредственной причиной смерти чаще всего являются фатальные нарушения ритма, тогда как у пациентов с тяжелой сердечной недостаточностью — тяжелая дисфункция ЛЖ, острый коронарный синдром и тромбоэмболические осложнения. Приблизительно каждый третий пациент с документированной сердечной недостаточностью независимо от ее тяжести погибает вследствие острого коронарного синдрома. В этой связи редукция величины общей и кардиоваскулярной смерти, повышение вероятности выживания и снижение риска повторных госпитализаций больных с сердечной недостаточностью ишемической этиологии рассматривались в рамках программы вторичной профилактики с включением гиполипидемической терапии в соответствии с действующими клиническими рекомендациям (Grundy S.M. et al., 2004). Статины являются наиболее популярным классом гиполипидемических лекарственных средств, благоприятное влияние которых на выживаемость и смертность у пациентов с высоким кардиоваскулярным риском достоверно установлено (Scandinavian Simvastatin Survival Study Group, 1994; Sever P.S. et al., 2003; Sakamoto T. et al., 2006). Кроме того, статины продемонстрировали способность к редукции частоты фатальных и нефатальных кардиоваскулярных событий в программах первичной и вторичной профилактики (Pedersen T.R. et al., 1998; Heart Protection Study Collaborative Group, 2002).
Прогрессирование сердечной недостаточности тесно ассоциируется с кардиоваскулярным ремоделированием, нейрогуморальной и иммуновоспалительной активацией, нарушением микроциркуляции, формированием периферической миопатии и другими метаболическими нарушениями (Tsouli S.G. et al., 2008). Результаты многих исследований свидетельствуют, что статины, вероятно, могут обладать и достаточно выраженной способностью к улучшению клинических исходов независимо от своего гиполипидемического потенциала (так называемый плейотропный эффект статинов) (Nakagami H. et al., 2003; Liberopoulos E.N. et al., 2005). Результатом плейотропных эффектов веществ этого класса являются улучшение функции эндотелия, стабилизация атеромы, антипролиферативные и антимитогенные влияния, ограничение оксидантного стресса, модуляция эндогенного антитромботического потенциала и антиагрегантной активности (Nakagami H. et al., 2003; Paraskevas K.I. et al., 2007). Более того, позитивный эффект статинов на выживаемость может непосредственно не зависеть от уровня липидов плазмы крови (Sever P.S. et al., 2003; Ridker P.M. et al., 2007). С другой стороны, снижение плазменного уровня липидов, в том числе и общего ХС, рассматривают в качестве весьма чувствительных маркеров неблагоприятного отдаленного прогноза сердечной недостаточности (Horwich T.B. et al., 2002; Rauchhaus M. et al., 2003). Установлено, что в когорте пациентов с документированной манифестной умеренной и тяжелой сердечной недостаточностью повышение выживаемости приблизительно на 25% ассоциируется с повышением плазменного пула общего ХС в среднем на 1 ммоль/л. Причем эта взаимосвязь не зависит от возраста или пола больных, а также от величины фракции выброса (ФВ) ЛЖ, этиологии сердечной недостаточности и функциональной активности пациентов (Rauchhaus M. et al., 2003). В этой связи роль статинов в стратегии лечения дисфункции миокарда выглядит дискутабельно (Aronow W.S., Ahn C., 2002), хотя их способность снижать риск возникновения впервые выявленной сердечной недостаточности ишемической этиологии уже достоверно установлена (Yusuf S. et al., 1992; Kjekshus J. et al., 1997; Krum H., McMurray J.J., 2002).
Влияние статинов на клинические исходы у пациентов с сердечной недостаточностью
Существует достаточно большой объем сведений, касающихся влияния статинов на выживаемость пациентов с асимптомной или манифестной сердечной недостаточностью. S. Yusuf и соавторы (1992) обратили внимание на то, что использование статинов у пациентов с сердечной недостаточностью ишемической этиологии способствует снижению риска смерти и частоты повторных госпитализаций, а также препятствует редукции ФВ ЛЖ. Впервые подобная возможность этого класса веществ была подвергнута изучению в рандомизированном клиническом исследовании Scandinavian Simvastatin Survival Study, хотя этот проект и не был специально спланирован для решения подобной задачи (Kjekshus J. et al., 1997). Оказалось, что среди пациентов, которые не были рандомизированы в группу симвастатина, частота манифестации инфаркта миокарда, явившегося непосредственной причиной возникновения сердечной недостаточности, составила 10,3%, тогда как в группе симвастатина — 8,3% (р<0,015). Кроме того, исследователи выявили достоверное снижение смертности в когорте больных с впервые выявленной сердечной недостаточностью (25,5% в группе симвастатина против 31,9% в группе плацебо).
В последующем W.S. Aronow, C. Ahn (2002), анализируя результаты лечения 1410 больных с инфарктом миокарда и ХС ЛПНП >3,2 ммоль/л (≥125 мг/дл), установили, что применение статинов сопровождается значительно меньшим количеством новых случаев манифестации сердечной недостаточности (31% в группе статинов против 42% в группе плацебо), что позволило им рассматривать использование статинов в качестве негативного предиктора манифестации сердечной недостаточности вообще. Аналогичные результаты были получены и в рандомизированном клиническом исследовании PROVE-IT TIMI 22 (Pravastatin or Atorvastatin Evaluation and Infection Therapy — Thrombolysis in Myocardial Infarction 22) (Scirica B.M. et al., 2006). Оказалось, что аторвастатин в высоких дозах (80 мг/сут) в большей степени снижает риск возникновения сердечной недостаточности у пациентов с острым коронарным синдромом, чем правастатин в высоких дозах (40 мг/сут) (1,6% в группе аторвастатина против 3,1% в группе правастатина; отношение шансов [ОШ]=0,55, 95% ДИ=0,35–0,85; р=0,008).
По данным ретроспективного исследования, проведенного A. Hognestad и соавторами (2004), на основании результатов наблюдения 5477 больных с сердечной недостаточностью, развившейся вследствие инфаркта миокарда, в рандомизированном клиническом исследовании OPTIMAAL (Optimal Therapy in Myocardial Infarction with the Angiotensin II Antagonist Losartan) было установлено, что статины способны потенцировать позитивное влияние блокаторов β-адренорецепторов на выживаемость пациентов с сердечной недостаточностью. Так, величина корригированного ОР общей смерти при применении блокаторов β-адренорецепторов регрессировала на 26,1%, при использовании статинов — на 30,6%, а при комбинированном назначении — на 48,3%. Более того, оказалось, что раннее применение статинов после проведения коронарных интервенционных вмешательств способствует существенному снижению летальности от манифестации сердечной недостаточности (Cleland J.G. et al., 2005; Lipinski M.J. et al., 2006). В исследовании SCD-HeFT, включавшем 2521 пациента с сердечной недостаточностью II–III ФК и ФВ <35%, смертность была достоверно ниже не только у всех больных, получавших статины (ОШ=0,70; 95% ДИ=0,58–0,83), но и в селективно отобранных когортах пациентов: с ишемической кардиопатией (ОШ=0,69; 95% ДИ=0,56–0,86), неишемической кардиопатией (ОШ=0,67; 95% ДИ=0,47–0,96), с имплантируемым дефибриллятором/кардиовертером (ОШ=0,66; 95% ДИ=0,46–0,95) и без такового (ОШ=0,71; 95% ДИ=0,57–0,87), с сердечной недостаточностью II ФК (ОШ=0,62; 95% ДИ=0,48–0,79) и III ФК (ОШ=0,79; 95% ДИ=0,61–1,03) (Dickinson M.G. et al., 2007).
Однако впервые принципиальная возможность повышения выживаемости больных с предсуществующей сердечной недостаточностью, развившейся вследствие инфаркта миокарда, при раннем назначении статинов была продемонстрирована в специально спланированном рандомизированном клиническом исследовании Multicenter Study for Aggressive Lipid-Lowering Strategy by HMG-CoA Reductase Inhibitors in Patients With Acute Myocardial Infarction Investigators (Sakamoto T. et al., 2006). Впоследствии в испытании TNT (Treating to New Targets) в когорте больных с документированной ИБС (n=10 001) на протяжении 4,9 года наблюдения аторвастатин продемонстрировал дозозависимую способность к редукции частоты госпитализаций, ассоциированных с прогрессированием сердечной недостаточности (2,4% в группе высокой дозы [80 мг/сут] против 3,3% в группе низкой дозы [10 мг/сут] аторвастатина; ОШ=0,74; 95% ДИ=0,59–0,94; р=0,0116) (Khush K.K. et al., 2007). Вместе с тем, необходимо отметить, что согласно дизайну исследования TNT пациенты с сердечной недостаточностью III–IV ФК по New York Heart Association (NYHA) и ФВ ЛЖ <30% исключались из числа обследованных. Однако при этом у 7,5% пациентов из группы высокой дозы аторвастатина и у 8,1% больных из группы низкой дозы отмечали анамнестические признаки наличия мягкой и умеренной сердечной недостаточности еще на скрининге. Дополнительный анализ результатов исследования позволил установить, что аторвастатин в высокой дозе был также более эффективен в отношении редукции частоты госпитализаций, ассоциированных с прогрессированием сердечной недостаточности, даже у пациентов с уже существующей сердечной недостаточностью I–II ФК по NYHA (снижение риска составило 41% против 13% в группах больных с и без сердечной недостаточности соответственно) (табл. 13.1). Исследователи пришли к выводу о том, что позитивный эффект аторвастатина скорее всего не связан с общим уменьшением количества ишемических кардиоваскулярных событий, а скорее ассоциируется с редукцией плазменной концентрации ХЛ ЛПНП. Так, в целом каждые 0,6% снижения риска госпитализаций по поводу сердечной недостаточности соответствуют регрессу плазменного пула ХС ЛПНП на 1 мг/дл (на 0,259 ммоль/л) (р=0,007).
Таблица 13.1 Частота госпитализаций, ассоциированных с возникновением или прогрессированием сердечной недостаточности, у пациентов с документированной ИБС в исследовании TNT (Treating to New Targets)
| Показатели | Анамнестические признаки сердечной недостаточности при включении в исследование | ||
| имеются (n=781) | отсутствуют (n=9220) | ||
| Частота госпитализаций, % | Аторвастатин 10 мг | 17,3 | 1,8 |
| Аторвастатин 80 мг | 10,6 | 2,0 | |
| ОШ | 0,59 | 0,87 | |
| 95% ДИ | 0,40–0,88 | 0,64–1,16 | |
| р* | 0,008 | 0,34 | |
*р — критерий достоверности различий между группами.
Тем не менее, авторы испытания полагают, что отсутствие прямой корреляции между этими показателями в группе больных, получавших аторвастатин в высокой дозе (80 мг/сут), свидетельствует о влиянии других качеств препарата. При этом, по данным A.S. Go и соавторов (2006), использование статинов у больных с сердечной недостаточностью (n=24 598) не только позволяет добиться существенного снижения риска госпитализаций по поводу этой патологии (ОР=0,79; 95% ДИ=0,74–0,85), но и приводит к 24% снижению риска наступления летального исхода (ОР=0,76; 95% ДИ=0,72–0,80), что рассматривается как класс-специфический эффект препаратов.
Таким образом, появилась возможность связать влияние статинов в отношении редукции кардиоваскулярных ишемических событий с частотой манифестации сердечной недостаточности или риском ее прогрессирования. Тем не менее, предпринимались попытки оценить перспективы использования терапевтического потенциала статинов в когорте больных с сердечной недостаточностью неишемической этиологии. Так, T.B. Horwich с соавторами (2004) проанализировали результаты лечения 551 больного с тяжелой сердечной недостаточностью (ФВ ЛЖ <40%, в среднем — 25%), среди которых у 55% отмечали дисфункцию ЛЖ неишемического происхождения. Авторы установили, что одногодичная выживаемость, не связанная с ургентной трансплантацией сердца, была достоверно выше в группе пациентов, получавших статины, по сравнению с лицами, не получавшими этот класс лекарственных средств, как в когорте больных с сердечной недостаточностью ишемического (80% против 57%; ОШ=0,35, 95% ДИ=0,19–0,62), так и неишемического происхождения (90% против 71%; ОШ=0,27, 95% ДИ=0,11–0,69). Даже после статистической коррекции в отношении пола, возраста, наличия ИБС, сахарного диабета, плазменного уровня липидов, гемоглобина, креатинина и ФК сердечной недостаточности, использование статинов оставалось независимым предиктором повышения выживаемости пациентов (ОШ=0,41; 95% ДИ=0,18–0,94). Аналогичные результаты были получены и в других рандомизированных клинических исследованиях (Folkeringa R.J. et al., 2006; Go A.S. et al., 2006), в том числе касающихся пациентов пожилого и старческого возраста (Foody J.M. et al., 2006).
Необходимо отметить тот факт, что во многих наблюдениях назначение статинов при выписке из стационара рассматривалось как одна из важнейших составляющих в модуляции не только кардиоваскулярного риска, но и риска общей смерти и прогрессирования сердечной недостаточности (Ray J.G. et al., 2005; Sola S. et al., 2005; Anker S.D. et al., 2006; Foody J.M. et al., 2006; Go A.S. et al., 2006). Вместе с тем, многие из этих испытаний не были специально спланированы для изучения влияния статинов на твердые конечные точки у больных с сердечной недостаточностью, а носили зачастую ретроспективный характер. Так, J.M. Foody и соавторы (2006) фактически использовали национальный реестр о 61 939 пациентах пожилого и старческого возраста, госпитализированных с диагнозом «сердечная недостаточность». В последующий анализ были включены данные о больных с противопоказаниями к назначению статинов (n=54 960) и лицах, получавших лечение лекарственными средствами этого класса, из которых только 16,7% сохранили приверженность к приему статинов после выписки. Используя пропорциональную модель Кокса, авторы пришли к выводу о том, что применение статинов сопровождается существенной редукцией смертности на протяжении первого года и последующих 3 лет лечения (ОШ=0,80; 95% ДИ=0,76–0,84 и ОШ=0,82; 95% ДИ=0,79–0,85 соответственно). Исследователи подчеркивают, что наиболее выраженный позитивный эффект статинов отмечали у больных с сердечной недостаточностью с минимальным уровнем ХС ЛПНП, достигнутым в результате лечебных мероприятий (Foody J.M. et al., 2006). С другой стороны, это противоречие, вероятно, является кажущимся, поскольку на частоту ишемических событий может оказывать влияние не столько этиология сердечной недостаточности, сколько само ее наличие. Так, в рандомизированном клиническом исследовании SOLVD (the Studies Of Left Ventricular Dysfunction) 11,4% пациентов с сердечной недостаточностью неишемической этиологии были госпитализированы с диагнозом инфаркта миокарда или впервые возникшей стенокардии (Hedrich O. et al., 2004). В этой связи возможность редукции частоты случаев кардиоваскулярной смерти, в том числе и ассоциированной с сердечной недостаточностью, при использовании статинов у пациентов с неишемической природой дисфункции ЛЖ выглядит не столь уж неправдоподобной. При этом плейотропные эффекты лекарственных средств этого класса рассматриваются в качестве одних из наиболее реальных кандидатов для объяснения механизмов улучшения клинических исходов у этой категории больных. Так, A.S. Go и соавторы (2006) установили, что использование статинов может быть эффективным как у пациентов с сердечной недостаточностью ишемической этиологии, так и неишемической природы. По данным Heart Protection Study, снижение ХС ЛПНП не только способствует редукции общего количества кардиоваскулярных событий, но и ассоциируется со снижением плазменной концентрации N-терминального фрагмента мозгового натрийуретического пептида (NT-МНУП) — мощного и чувствительного прогностического маркера формирования и прогрессирования сердечной недостаточности и ИБС (Maisel A.S. et al., 2002; Jernberg T. et al., 2004; Emberson J.R. et al., 2007). При этом редукция плазменного пула ХС ЛПНП сопровождалась пропорциональным 14% снижением риска госпитализации и смерти от сердечной недостаточности (95% ДИ=0–25) (Emberson J.R. et al., 2007).
Таким образом, возможность негативного влияния статинов на выживаемость пациентов с сердечной недостаточностью посредством редукции ХС ЛПНП в большинстве рандомизированных клинических исследований не подтверждается, а для оценки клинической значимости плейотропных эффектов этого класса препаратов необходимы специально спланированные испытания.
Липополисахарид-индуцированная эндотоксичность и гиполипидемия при сердечной недостаточности
Гиперлипидемия является документированным фактором риска возникновения любых кардиоваскулярных событий. Однако снижение плазменной концентрации как общего ХС, так и ХС ЛПНП рассматриваются в качестве негативного прогностического фактора у пациентов с сердечной недостаточностью любой этиологии (Horwich T.B. et al., 2002). M. Rauchhaus и соавторы (2000) полагают, что ассоциация между редукцией вероятности выживания больных с сердечной недостаточностью и снижением плазменного уровня липидов может быть объяснена связыванием молекулы липопротеида липополисахаридным (ЛПС) комплексом, абсорбирующимся через стенку кишечника при критическом замедлении кровотока в ней. Гипотеза базируется на представлении о том, что причиной провоспалительной активации, ассоциированной с гиперпродукцией ФНО-α и ряда других провоспалительных цитокинов и приводящей к ухудшению эволюции сердечной недостаточности, является персистенция в плазме крови ЛПС-комплекса стенки грамотрицательных бактерий, составляющих биоценоз кишечника. Предполагается, что вызванная ЛПС-комплексом провоспалительная активация ассоциируется с прогрессирующим ремоделированием сердца и сосудов, формированием метаболической миопатии, снижением функциональной активности пациента, редукцией ФВ ЛЖ, объемного капиллярного кровотока в паренхиматозных органах и кишечнике, а также снижением суточного диуреза. В этой связи снижение плазменного пула общего ХС, отражающего интенсивность провоспалительной активации, может быть рассмотрено как маркер негативной эволюции дисфункции миокарда. Однако эта концепция находит понимание далеко не у всех исследователей. Так, M. Christ и соавторы (2006) обследовали 422 пациента с дилатационной кардиомипатией (ДКМП) и ФВ ЛЖ <32% с клиническими признаками сердечной недостаточности. Авторы пришли к заключению о том, что низкий уровень плазменной концентрации общего ХС не является независимым фактором риска неблагоприятного прогноза, а зависит от тяжести кардиального ремоделирования. С другой стороны, снижение плазменного уровня общего ХС ассоциируется не только с редукцией массы тела, плазменной концентрацией альбумина и формированием кахексии, но и часто сопровождается печеночно-клеточной недостаточностью с элевацией билирубина, трансаминаз и гаммаглутамилтранспептидазы (Batin P. et al., 1995; May H.T. et al., 2006). Причем гиполипидемия связывается именно с прогрессирующим нарушением печеночной функции — известным фактором риска наступления неблагоприятного клинического исхода у пациентов с сердечной недостаточностью (Horwich T.B. et al., 2002).
Таким образом, гиполипидемия может не иметь непосредственной связи с провоспалительной активацией и характеризовать тяжесть печеночной дисфункции при сердечной недостаточности. Так, в ретроспективном испытании H.T. May и соавторам (2006) удалось установить, что в когорте больных с манифестной сердечной недостаточностью увеличение частоты смертельных случаев тесно ассоциировалось с низким и очень высоким уровнем плазменной концентрации общего ХС, а ХС ЛПНП является независимым прогностическим индикатором тяжести заболевания. При этом применение статинов способствовало повышению вероятности выживания, а пациенты с умеренной гиперлипидемией получали наибольшую пользу от их назначения независимо от этиологии сердечной недостаточности. Это утверждение подтвердилось в исследовании S. Sola и соавторов (2006). Авторы рандомизировали 108 пациентов с ФВ ЛЖ <35% и сердечной недостаточностью III ФК по NYHA, развившейся вследствие неишемических причин, на две группы: получающих аторвастатин (20 мг/сут) и плацебо. Интересно, что исходные уровни ХС ЛПНП и ЛПВП плазмы крови были ниже рекомендованных в качестве целевых National Cholesterol Education Program III. Анализ полученных данных показал, что аторвастатин способен существенным образом улучшить геометрические и контрактильные характеристики ЛЖ, а также снизить величину ФК сердечной недостаточности и плазменный пул некоторых маркеров неблагоприятного исхода (табл. 13.2). Это позволило авторам предположить, что позитивное влияние аторвастатина является результатом реализации плейотропных влияний. Напротив, B.E. Вleske и соавторы (2006) не смогли продемонстрировать ассоциацию между гиполипидемическим эффектом аторвастатина в высокой дозе и регрессом биомаркеров сердечной недостаточности у больных с сердечной недостаточностью II ФК и ФВ <40% на протяжении 12 нед наблюдения. По мнению K. Ramasubbu и D.L. Mann (2006) нет оснований полагать, что плейотропные качества статинов могу иметь клиническое значение, поскольку серьезных подтверждений этому мнению не представлено, а большинство эффектов этих препаратов объясняются их гиполипидемическим потенциалом. В этой связи статины должны быть рекомендованы для пациентов с сердечной недостаточностью вследствие ИБС и ассоциированной с гиперлипидемией, как того и требуют клинические рекомендации (Hunt S.A. et al., 2005). С другой стороны, индуцируемое статинами снижение ХС ЛПНП и общего ХС, вероятно, безопасно для всех больных с сердечной недостаточностью вне зависимости от ее этиологии и без кахексии. В целом гиполипидемический эффект статинов не рассматривается как основная причина, приводящая к прогрессированию дисфункции миокарда.
Таблица 13.2 Влияние аторвастатина на структурно-функциональные характеристики ЛЖ, ФК СН, провоспалительную активацию и прооксидантную активность у больных с СН неишемической этиологии
| Показатели | Аторвастатин (n=46) | Плацебо (n=43) | р |
| ИММ ЛЖ, г/м2 | 113 | 118 | 0,1 |
| КДР ЛЖ, мм | 53,4 | 60,3 | 0,01 |
| КСР ЛЖ, мм | 39,1 | 43,1 | 0,01 |
| ФВ, % | 37 | 31 | 0,004 |
| ФК СН | 2,2 | 2,9 | 0,001 |
| СРП, мг/дл | 1,7 | 1,9 | 0,002 |
| ИЛ-6, нг/дл | 13,3 | 17,3 | 0,001 |
| ФНО-R2, нг/дл | 24,3 | 34,5 | 0,001 |
| СДО эритроцитов, µ/г Hb | 649 | 577 | <0,0001 |
ИММ — индекс массы миокарда, КДР — конечно-диастолический размер, КСР — конечно-систолический размер, СН — сердечная недостаточность, СДО — супероксиддисмутаза, ФНО-R2 — рецептор 2-го типа к ФНО.
Статины и дефицит коэнзима Q10
В настоящее время установлено, что дефицит внутриклеточного коэнзима Q10 (убихинона) сопровождается тяжелыми метаболическими нарушениями в различных органах и тканях, в том числе и в кардиомиоцитах (Sander S. et al., 2006). Известно, что при сердечной недостаточности высоких ФК уровень коэнзима Q10 существенно снижается, хотя механизм этого процесса до конца не установлен (Soja A.M., Mortensen S.A., 1997; Weant K.A., Smith K.M., 2005). Известны также случаи формирования кардиомиопатий дилатационного типа при грубых дефектах синтеза убихинона (Rauchova H. et al., 1995). В свою очередь статины, блокируя синтез ХС в печени на уровне мевалоната, одновременно препятствуют продукции Q10, что сопровождается снижением его плазменной концентрации (Folkers K. et al., 1990). Предполагается, что статины могут обладать потенциально негативным влиянием в отношении как минимум кардиомиоцитов, опосредуемым редукцией убихинона (Watts G.F. et al., 1993; Strey C.H. et al., 2005). С другой стороны, о глубине депрессии синтеза этого коэнзима можно судить по степени снижения уровня ХС ЛПНП, поскольку между указанными процессами существует тесная корреляционная взаимосвязь (Bleske B.E. et al., 2001; Berthold H.K. et al., 2006). Сведения о негативных последствиях при применении статинов, реализуемых через индукцию дефицита убихинона, чрезвычайно ограничены. В единственном метаанализе, проведенном S. Sander и соавторами (2006), установлено, что экзогенное введение коэнзима Q10 действительно способствует повышению тотальной контрактильной функции миокарда ЛЖ у пациентов с сердечной недостаточностью. Однако не ясно, реализуется ли клинически значимый дефицит убихинона при применении статинов в рекомендованных дозах. Какие-либо сведения на этот счет отсутствуют.
Механизмы реализации плейотропных эффектов статинов при сердечной недостаточности
Многочисленными исследованиями в когортах больных с сохраненной и нормальной насосной функцией ЛЖ было установлено, что статины способны реализовывать клинически значимый противовоспалительный эффект, который благоприятно сказывается на выживаемости в целом (Chan A.W. et al., 2002; Kinlay S. et al., 2003; Niessner A. et al., 2006). Патогенетический механизм этого явления базируется прежде всего на ингибировании внутриклеточного фактора транскрипции κВ, активатора протеина 1, а также белков Rho и Rac (Jain M.K., Ridker P.M., 2005) с последующим ограничением продукции провоспалительных цитокинов (в том числе СРП, ИЛ-8), а также молекул клеточной адгезии, хемокинов и хемоаттрактантов (Ridker P.M. et al., 2001; Jain M.K., Ridker P.M., 2005). Более того, было установлено, что статины, назначаемые в первые часы после инфаркта миокарда, достоверно снижают плазменный пул лейкоцитов. При этом именно такие пациенты извлекают больше клинической пользы от применения статинов по сравнению с больными, у которых исходный пул лейкоцитов был нормальным и не подвергался модуляции в процессе лечения (Stewart R.A. et al., 2005). Необходимо отметить, что у больных с документированной сердечной недостаточностью повышение уровня лейкоцитов в крови рассматривается как независимый предиктор высокого риска наступления смертельного исхода (Lipinski M.J. et al., 2006).
В многочисленный исследованиях, проведенных ранее, уже была установлена возможность контроля за продукцией провоспалительных цитокинов у больных с сердечной недостаточностью посредством назначения статинов (Mozaffarian D. et al., 2005; Sola S. Go, 2005; Tousoulis D. et al., 2005). Так, S. Sola с соавторами (2005) выявили, что статины способны снижать уровни ИЛ-6, СРП, рецептора 2-го типа к ФНО. Причем аналогичный результат статины демонстрируют у пациентов с сердечной недостаточностью независимо от ее этиологии (Ferns G.A., 2003; Mozaffarian D. et al., 2005; Sola S. et al., 2006).
Повышение выживаемости больных с септическим шоком после назначения статинов рассматривается многими исследователями как одно из наиболее достоверных доказательств наличия клинически значимых плейотропных свойств лекарственных средств этого класса (Hackam D.G. et al., 2006). При этом необходимо отметить, что у большинства пациентов этой категории исходный уровень липидов в крови был субнормальным и это не только не стало ограничением для применения статинов, но и в последующем не рассматривалось как принципиальный фактор ограничения выживаемости (Liappis A.P. et al., 2001). Вместе с тем, существуют и прямо противоположные аргументы. Так, в проспективном популяционном исследовании, включающем 3415 больных с негоспитальной пневмонией, статины не продемонстрировали способности повышать выживаемость, хотя исследователи и выявили снижение плазменного пула провоспалительных цитокинов (Majumdar S.R. et al., 2006). Можно предполагать, что плейотропные эффекты статинов необходимо рассматривать как значительные и существенные только для определенных клинических ситуаций.
Таким образом, обсуждение клинической значимости плейотропных эффектов статинов не сводится к пониманию механизмов реализации этих свойств, даже подтвержденных в эксперименте. По-видимому, в каждом конкретном случае придется приводить реальные клинические доказательства влияния плейотропных качеств статинов на твердые конечные точки.
Влияние статинов на эндотелиальную функцию у больных с сердечной недостаточностью
У больных с сердечной недостаточностью дисфункция эндотелия тесно ассоциирована с нарушением пассивно-эластических качеств сосудистой стенки в зонах микро- и макроциркуляции (Mathier M.A. et al., 1998). При этом напряжение сдвига на эндотелии не способно стимулировать адекватную продукцию оксида азота, результатом чего является формирование недостаточности вазодилатации. С другой стороны, гиперлипидемия, гипергликемия, провоспалительная и нейрогуморальная активация и многие другие факторы способствуют манифестации дисфункции эндотелия, которая, в свою очередь, может приводить к ретенции липопротеидов в сосудистой стенке и усиливать процессы атерогенеза (Ross R., 1993). У больных с сердечной недостаточностью дисфункция эндотелия рассматривается как один из важнейших факторов, приводящих к нарушению объемного кровотока в зонах микроциркуляции, что ассоциируется не только с прогрессированием кардиоваскулярного ремоделирования и снижением эффективного почечного плазмотока, но и с возникновением и прогрессированием миопатии.
Установлено, что статины способны улучшать функцию эндотелия независимо от их гиполипидемического эффекта (John S. et al., 2005). При этом повышение ответа артерий на вазодилатирующие стимулы отмечают уже на 3-й день лечения (John S. et al., 2005). Предполагается, что этот результат может быть объяснен ранней депрессией оксидантного стресса, снижением продукции провоспалительных цитокинов, повышением внутриклеточной активности антиоксидантной системы (Maack C. et al., 2003; Beckman J.A. et al., 2004; Landmesser U. et al., 2005; Tousoulis D. et al., 2005b). В то же время результаты ограниченных по мощности исследований чрезвычайно противоречивы. Так, D. Tousoulis и соавторы (2005a) продемонстрировали существенное повышение ответа плечевой артерии на вазодилатацию после назначения аторвастатина у больных с документированной сердечной недостаточностью. Напротив, B.E. Bleske и соавторы (2006) отметили отсутствие влияния статинов на функцию эндотелия у больных с сердечной недостаточностью, хотя противовоспалительный ответ на лечение авторы зарегистрировали.
Таким образом, реализация позитивного влияния статинов на эндотелиальную функцию пациентов с сердечной недостаточностью требует более четкого документирования в условиях специально спланированных клинических рандомизированных исследований.
Антикоагулянтная активность статинов
Клиническое значение нарушений коагуляционного потенциала при формировании дисфункции эндотелия достоверно установлено (Loscalzo J., 2001). Риск тромбоэмболических осложнений у больных с сердечной недостаточностью составляет 1–3% в год (Hunt S.A. et al., 2005). В то же время использование антикоагулянтов у больных с сердечной недостаточностью и сохраненным синусовым ритмом не ассоциировалось с повышением вероятности выживания и составляет предмет для дискуссии (Cleland J.G. et al., 2004). Существуют сведения о том, что статины способны приводить к снижению тромбогенного потенциала плазмы крови независимо от гиполипидемического эффекта (Casani L. et al., 2005). В эксперименте показано повышение синтеза оксида азота, ассоциированного с депрессией агрегации тромбоцитов, после назначения розувастатина (Schafer A. et al., 2005). Способность статинов стимулировать фибринолиз при сердечной недостаточности была продемонстрирована D. Tousoulis и соавторами (2005c). В целом возможность достижения повышения выживаемости за счет оптимизации коагуляционного потенциала плазмы крови при применении статинов является дискутабельным вопросом.
Влияние статинов на контрактильные качества миокарда у больных с сердечной недостаточностью
Дисфункция ЛЖ является мощным предиктором смертности у пациентов с кардиоваскулярными заболеваниями. Ранее было установлено, что применение статинов сопровождается реверсией гипертрофии ЛЖ и некоторым повышением систолической функции миокарда у больных с артериальной гипертензией и гиперлипидемией (Su S.F. et al., 2000), а также у пациентов, перенесших инфаркт миокарда (Ohara Y. et al., 2005; Sola S. et al., 2006). По данным K. Node и соавторов (2003) уже 14-недельное применение статинов у пациентов с сердечной недостаточностью приводит к достоверному снижению ФК и увеличению ФВ ЛЖ. Предполагается, что в основе благоприятного влияния статинов на функцию миокарда лежит, прежде всего, их способность восстанавливать эффективный коронарный кровоток за счет реверсии эндотелиальной дисфункции, а также антипролиферативный эффект и плейотропный потенциал (Fuller S.J. et al., 1998; Bates K. et al., 2002; Nakagami H. et al., 2003; Tiefenbacher C.P. et al., 2004). Теоретические предположения стали основанием для проведения пилотного 6-месячного рандомизированного плацебо-контролируемого исследования UNIVERSE (The Rosuvastatin Impact on Ventricular Remodelling Lipids and Cytokines), в котором приняли участие 86 больных с сердечной недостаточностью ишемической и неишемической этиологии II–IV ФК (NYHA) и ФВ ЛЖ <40% (Cleland J.G. et al., 2006). Анализ полученных данных стал сюрпризом для исследователей. Оказалось, что в процессе лечения розувастатином не было выявлено каких-либо изменений со стороны пространственной конфигурации полости ЛЖ, его размеров и ФВ.
Статины и активность автономной нервной системы у больных с сердечной недостаточностью
Вариабельность сердечного ритма, во многом характеризующая активность автономной нервной системы, рассматривается как один из мощных предикторов неблагоприятного прогноза (Nolan J. et al., 1998; Lipinski M.J. et al., 2005). В экспериментальной модели сердечной недостаточности статины продемонстрировали способность снижать активность ренин-ангиотензиновой (РАС) и симпатоадреналовой систем и, в том числе, концентрацию ренина и норадреналина в плазме крови, а также приводить к восстановлению барорефлекторной чувствительности (Nickenig G. et al., 1999; Pliquett R.U. et al., 2003). Кроме того, статины оказывают благоприятный эффект в отношении ограничения апоптоза адренергических рецепторов (Ito M. et al., 2004) и экспрессии рецепторов 2-го типа к ангиотензину ІІ (Horiuchi M. et al., 2003; Saijonmaa O. et al., 2004; van der Harst P. et al., 2005). Получены данные о том, что применение статинов у больных с сердечной недостаточностью способствует оптимизации вариабельности сердечного ритма (Hamaad A. et al., 2005; Katircibasi M.T. et al., 2005) и вместе с блокаторами β-адренорецепторов оказывает аддитивное влияние на выживаемость (Krum H. et al., 2006).
Таким образом, несмотря на достаточно большое количество качественных исследований, посвященных терапевтическому потенциалу статинов у больных с сердечной недостаточностью, возникла необходимость в проведении заранее спланированных рандомизированных клинических исследований, способных прояснить ситуацию вокруг гиполипидемических рисков при лечении препаратами этих классов и плейотропных эффектов. В этой связи большие ожидания исследователей были связаны с двумя большими проектами CORONA (Controlled rosuvastatin multinational study in heart failure) и GISSI-CHF (Tavazzi L et al., 2004; Kjekshus J. et al., 2005), в которых предполагается оценить результаты лечения пациентов с сердечной недостаточностью розувастатином в дозе 10 мг/сут. В рандомизированное клиническое исследование CORONA включали пациентов с документированной ИБС и сердечной недостаточностью (n=5016), а в GISSI-CHF — с сердечной недостаточностью неишемического происхождения (n=7000). К сожалению, результаты рандомизированного клинического исследования CORONA, ставшие доступными осенью 2007 г., показали отсутствие достоверного позитивного влияния розувастатина на кардиоваскулярные исходы, оцененные как первичная комбинированная твердая точка (кардиоваскулярная смерть + инсульт + нефатальный инфаркт миокарда) (Hjalmarson Å., 2007; Masoudi F.A., 2007). При этом уровни ХС ЛПНП и СРП снизились весьма значительно (Kjekshus J. et al., 2007). Вместе с тем, розувастатин на протяжении 33 нед лечения привел к выраженному и достоверному снижению частоты госпитализации (табл. 13.3).
Таблица 13.3 Результаты исследования CORONA (Controlled rosuvastatin multinational study in heart failure)
| Показатели | Плацебо (n=2497) | Розувастатин (n=2514) | р |
| Твердые конечные точки | |||
| Первичная твердая конечная точка (кардиоваскулярная смерть + нефатальный инсульт + нефатальный инфаркт миокарда) | 29,3 | 27,5 | 0,12 |
| Нефатальный или фатальный инфаркт миокарда или инсульт | 10,6 | 9,0 | 0,05 |
| Госпитализация | |||
| Все случаи | 4074 | 3694 | 0,007 |
| Кардиоваскулярные причины | 2564 | 2193 | <0,001 |
| Сердечная недостаточность | 1299 | 1109 | 0,01 |
| Нестабильная стенокардия | 90 | 74 | 0,30 |
Таким образом, результаты последних клинических исследований, посвященных перспективам применения статинов у пациентов с сердечной недостаточностью, позволяют как минимум утверждать, что негативные последствия их широкого назначения являются надуманными. Высокая клиническая безопасность была еще раз подтверждена в ходе рандомизированных клинических исследований. Вместе с тем, окончательного ответа на вопрос — насколько высок терапевтический потенциал плейотропных эффектов статинов — пока нет. Вероятно, все еще есть место для широкой дискуссии и продолжения клинических исследований.
Гиполипидемические мероприятия в стратегии первичной и вторичной профилактики мозгового инсульта
К настоящему времени достигнуты значительные успехи в снижении риска возникновения нарушений мозгового кровообращения (НМК). Тем не менее, несмотря на тенденцию к снижению распространенности этой патологии в развитых странах мира, в государствах с развивающейся экономикой отмечают повышение частоты регистрации НМК. Причем около 29% всех мозговых катастроф — повторные (Saver J.L., Goldstein L.B., 2006). В структуре острых НМК уверенно лидирует мозговой ишемический инсульт (88%), а доля геморрагического инсульта за последнее десятилетие сократилась с 20 до 12%, что в некоторой мере объясняется широким внедрением современной стратегии лечения артериальной гипертензии (Mayberg M.R. et al., 1994; Johnston S.C. et al., 2000; Albers G.W. et al., 2002; Adams H.P. et al., 2003; Rashid P. et al., 2003; Saver J.L., Goldstein L.B., 2006). Тем не менее, сохраняющийся высокий уровень смертности и инвалидизации, столь характерный для острых НМК, продолжает рассматриваться экспертами как проявление недостаточно высокой эффективности превенционных и лечебных программ (Albers G.W., et al., 1999; Goldstein L.B. et al., 2001; Sacco R.L. et al., 2006).
Гиперхолестеринемия и гиперлипидемия не являются факторами риска с документированным негативным влиянием в отношении возникновения инсульта (Gorelick P.B., 2002; Amarenco P., Tonkin A.M., 2004). Так, в ряде рандомизированных клинических исследований была установлена позитивная коррелиционная взаимосвязь только между плазменным содержанием общего ХС и риском манифестации впервые выявленного ишемического инсульта, тогда как влияние гиперлипидемии на риск возникновения всех случаев инсульта не было верифицировано. Более того, в результате испытаний, посвященных оценке эффективности статинов, было показано, что последние способны редуцировать риск только нефатального мозгового ишемического инсульта, не влияя на все иные случаи мозговых катастроф (Sandercock P., 2001; Gorelick P.B., 2002). Более того, этот результат был получен в основном в исследованиях по изучению первичной или вторичной профилактики ИБС (Scandinavian Simvastatin Survival Study Group, 1994; Sacks F.M. et al., 1996; Heart Protection Study Collaborative Group, 2002). Оказалось, что у пациентов с ИБС и высоким уровнем риска сердечно-сосудистых заболеваний снижение уровня ХС ЛПНП на 32–35% в результате применения статинов позволяет снизить риск возникновения ишемического инсульта на 19–25% (Primatesta P., Poulter N.R., 2000). Однако данные некоторых эпидемиологических исследований, в частности MRFIT (Multiple Risk Factors Intervention Trial), выявили положительную корреляцию между уровнем общего ХС в плазме крови и риском возникновения геморрагического инсульта. Попытка объяснения этого феномена была сведена к утверждению о том, что очень низкий уровень ХС в плазме крови негативно отражается на структуре и функции клеточных мембран тромбоцитов. Тем не менее, клиническое значение выявленного феномена требовало подтверждения и последующего объяснения. Так, в ходе проведения обширного метаанализа результатов 45 рандомизированных клинических исследований (n=450 тыс.) были детально проанализированы данные о течении 13 тыс. инсультов и не было установлено достоверной прогностической значимости уровня общего ХС в отношении риска острых НМК в целом. В то же время, факт существования возможного высокого риска возникновения геморрагического инсульта в популяции пациентов со сниженным уровнем общего ХС не был подтвержден в ходе специально спланированных рандомизированных клинических исследований. Так, в ходе испытания CCHS (Copenhagen City Heart Study) было установлено, что уровень общего ХС позитивно коррелирует с риском негеморрагического инсульта при значениях первого, превышающих 8 ммоль/л, что делает нецелесообразным агрессивную гиполипидемическую терапию в этой популяции пациентов для превенции цереброваскулярных событий (Cholesterol Treatment Trialists’ Collaborators, 2005). Кроме того, в испытании PROSPER (Pravastatin in elderly individuals at risk of vascular disease) не было выявлено благоприятного влияния правастатина в отношении риска возникновения мозгового ишемического инсульта у больных пожилого возраста с мягкой и умеренной гиперхолестеринемией (общий ХС — 4–9 ммоль/л) (Shepherd J. et al., 2002). С другой стороны, в этом испытании удалось продемонстрировать позитивный эффект препарата на когнитивную функцию пациентов, что сопровождалось выраженным гиполипидемическим эффектом (снижение ХС ЛПНП на 34% от исходного). Аналогичные данные были получены и в других испытаниях (Muldoon M.F., 2001; Rockwood K. et al., 2002).
Тем не менее данные, полученные в ходе многочисленных исследований (LIPID, 4S, CARE, WOSCOPS, HPS, AFCAPS/TexCAPS, ASCOT-LLA), посвященных превенции возникновения кардио- и церебровасулярных событий, позволяли предположить, что статины обладают потенциальными благоприятными нелипидными (плейотропными) эффектами, благодаря которым они могут оказывать супрессирующее влияние на риск возникновения транзиторной ишемической атаки и инсульта (The Multicentre Anti-Atheroma Study (MAAS), 1994; Shepherd J. et al., 1995; Pyorala K. et al., 1997; Downs J.R. et al., 1998; Goldberg R.B. et al., 1998; The Long-Term Intervention with Pravastatin in Ischaemic Disease (LIPID) Study Group, 1998; Heart Protection Study Group, 2002; Sever P.S. et al., 2003). К клинически значимым плейотропным эффектам статинов, вмешивающимся в механизмы реализации острых НМК, относят их противовоспалительные, антиагрегантные, антиоксидантные качества, а также способность к реверсии дисфункции эндотелия и стабилизации атеромы любой локализации (Albert M.A. et al., 2001; Bonetti P.O. et al., 2003; Nissen S.E. et al., 2005; Ridker P.M. et al., 2005). Именно эти соображения и были приняты во внимание при регистрации нового показания к применению симвастатина и правастатина: превенция возникновения ишемического инсульта у пациентов с ИБС (Pandey D.K., Gorelick P.B., 2005). Так, в рандомизированном клиническом исследовании Medical Research Council/British Heart Foundation Heart Protection Study была оценена результативность симвастатина в плане достижения превенции возникновения новых случаев инсульта у пациентов с и без предшествующих цереброваскулярных заболеваний (Collins R. et al., 2004). В этом исследовании приняли участие 20 536 пациентов с ИБС, облитерирующим атеросклерозом артерий нижних конечностей, стенотическими поражениями брахиоцефальных артерий, сахарным диабетом или артериальной гипертензией с наличием других дополнительных факторов кардиоваскулярного риска с исходным уровнем общего ХС >135 мг/дл (3,5 ммоль/л). Все пациенты были рандомизированы в группу симвастатина 40 мг/сут или плацебо. Период наблюдения составил 5 лет. При анализе полученных данных удалось установить существование почти 24% редукции величины относительного риска возникновения первичной конечной точки (все случаи инсульта + коронарной смерти + нефатального инфаркта миокарда + потребность в реваскуляризации) между группами наблюдения. Кроме того, было также отмечено снижение риска возникновения всех инсультов на 27%, ишемического инсульта на 25% (р<0,0001) без достоверного изменения частоты геморрагического инсульта. Вместе с тем, несмотря на то, что в когорте пациентов с ранее перенесенным инсультом применение статинов позволяет добиться достоверного снижения новых кардиоваскулярных событий и реваскуляризационных процедур, статистически значимой редукции частоты развития повторного инсульта достичь не удалось. Фактически, вопрос о том, будут ли эффективны статины у больных без кардиоваскулярных заболеваний в анамнезе, включая ИБС и сахарный диабет, в отношении снижения возникновения новых случаев инсульта оставался открытым. Именно эта гипотеза и была подвергнута изучению в ставшем уже классическим рандомизированном клиническом исследовании SPARCL (Stroke Prevention by Aggressive Reduction in Cholesterol Levels Study) (Amarenco P. et al., 2003). Его особенностью стало включение пациентов с относительно низким уровнем ХС ЛПНП (2,6–4,9 ммоль/л), перенесших инсульт или транзиторную ишемическую атаку, но не имеющих документированных окклюзирующих поражений артерий нижних конечностей или ИБС. Все пациенты были рандомизированы в группу аторвастатина (80 мг/сут) или плацебо. Период наблюдения составил 5 лет. Анализ полученных данных показал, что в группе аторвастатина среднее снижение ХС ЛПНП к концу испытания составило 37%, что сопровождалось снижением относительного риска возникновения первичной твердой конечной точки (общее количество фатальных и нефатальных инсультов) по отношению к группе плацебо на 16%. Вместе с тем, авторы испытания отметили, что частота фатальных инсультов снизилась почти на 43%, тогда как риск возникновения нефатальных инсультов практически не изменился. Кроме того, исследователи отметили существование различий в отношении влияния аторватастина на частоту возникновения различных типов мозгового инсульта. Так, если риск ишемического инсульта достоверно снижался на 22%, то риск геморрагического инсульта статистически значимо возрастал на 66%. Отмеченный феномен был объяснен исследователями как находящийся вне непосредственной связи с оцениваемым способом лечения. По их мнению, частота регистрируемых геморрагических инсультов была столь мала (55 и 33 события в группе аторвастатина и плацебо соответственно), что не позволяла провести корректный анализ. Кроме того, в этом испытании было подтверждено позитивное влияние аторвастатина в отношении редукции риска возникновения кардиоваскулярных событий, включая нефатальный инфаркт миокарда, острый коронарный синдром и потребность в проведении процедур реваскуляризации. Таким образом, достаточно большой объем полученных данных позволил провести изменения в соответствующем разделе клинических рекомендаций, посвященных превенции возникновения инсультов и транзиторной ишемической атаки у пациентов с гиперлипидемией и/или сопутствующими кардиоваскулярными заболеваниями.
В настоящее время в соответствии с действующими рекомендациями у пациентов, имеющих противопоказания к применению статинов или плохую их переносимость, можно использовать производные никотиновой кислоты, фибраты или ингибиторы абсорбции ХС в качестве основных гиполипидемических лекарственных средств, в частности, и с целью снижения риска возникновения инсульта. Так, ниацин (никотиновая кислота) доказал свою способность к редукции общего количества цереброваскулярных событий в рандомизированном клиническом исследовании Coronary Drug Project (Coronary Drug Project Study Group, 1975). Позитивный эффект гемфиброзила в отношении редукции частоты возникновения инсульта в популяции мужчин с документированной ИБС и сниженным уровнем ХС ЛПВП (<40 мг/дл) был продемонстрирован при проведении рандомизированного клинического исследования VA-HIT (Veterans Administration HDL Intervention Trial) (Bloomfield Rubins H. et al., 2001). Вместе с тем, необходимо отметить, что полученные данные в указанных выше исследованиях находились на границе достоверности и должны приниматься во внимание с известной долей осторожности.
Таким образом, к настоящему времени в соответствии с требованиями NCEP III пациенты с инсультом или транзиторной ишемической атакой атеротромботического происхождения с повышенным плазменным содержанием общего ХС/ХС ЛПНП, а также с сопутствующими кардиоваскулярными заболеваниями должны придерживаться общепринятых рекомендаций по модификации образа жизни (класс I, уровень доказательности A). В популяции пациентов с ИБС в анамнезе или асимптомными поражениями органов-мишеней атеросклеротической природы рекомендовано применение статинов в дозах, позволяющих добиться достижения целевого уровня ХС ЛПНП <100 мг/дл, а у больных с множественными дополнительными факторами кардиоваскулярного риска содержание последнего должно быть еще ниже (<70 мг/дл) (класс I, уровень доказательности A). В том случае, когда у больных с инсультом или транзиторной ишемической атакой возможно атеротромботического происхождения не выявлено непосредственных прямых показаний для назначения гиполипидемической терапии (нормальный уровень общего ХС, нет коморбидных кардиоваскулярных заболеваний или не представлено доказательств существования атеросклероза), использование статинов все равно желательно, поскольку последние могут способствовать редукции риска возникновения цереброваскулярных событий (класс IIA, уровень доказательности B). Верификация дислипидемии, ассоциированной с изолированным снижением плазменного содержания ХС ЛПВП <40 мг/дл, в когорте пациентов с инсультом или транзиторной ишемической атакой может стать основанием для назначения ниацина или гемфиброзила (класс IIВ, уровень доказательности B).
Стратегия лечения гипер- и дислипидемии у пациентов с сахарным диабетом 2-го типа и метаболическим синдромом
Сахарный диабет 2-го типа сохраняет свои лидирующие позиции как фактор риска формирования и прогрессирования кардиоваскулярных заболеваний и ХБП. Кроме того, возникновение впервые выявленного сахарного диабета у пациентов с верифицированными сердечно-сосудистыми заболеваниями повышает риск развития неблагоприятных клинических событий в 2–4 раза. В качестве основной причины наступления смертельного исхода в этой когорте пациентов рассматривается атеротромбоз в различных сосудистых бассейнах (Smith S.C. et al., 2006). В свою очередь, гипер- и дислипидемия являются наиболее значительным фактором, обусловливающим возникновение и прогрессирование атеросклероза и его основного осложнения — атеротромбоза. Если в популяции пациентов с сахарным диабетом 1-го типа достижение адекватного контроля над гликемией часто сопровождается существенной и иногда достаточно полной реверсией нарушений липидного обмена, то для больных сахарным диабетом 2-го типа жесткий контроль за гликемией обычно не сопровождается снижением атерогенного потенциала плазмы крови (The Diabetes Control and Complications Trial Research Group, 1993).
В соответствии с действующими клиническими рекомендациями (Expert Panel on Detection, Evaluation, And Treatment of High Blood Cholesterol In Adults, 2001; Fedder D.O. et al., 2002) в лечении гиперлипидемии при сахарном диабете 2-го типа особо важное значение имеет модификация образа жизни. Повышение физической активности (увеличение энергозатрат на 200 ккал/сут) и уменьшение массы тела позволяет добиться редукции уровня ТГ и повышения содержания ЛПВП (табл. 13.4). Пациентам следует рекомендовать придерживаться гиполипидемической диеты, в которой общее содержание жиров не должно превышать 27% энергетической ценности пищи (7% — насыщенные, 10% — мононенасыщенные и 10% — полиненасыщенные жиры), а также ограничение потребления ХС до 200 мг/сут (табл. 13.5).
Важное значение, особенно для уровня ТГ, имеет достижение адекватного контроля за гликемией. Сахароснижающие препараты способны обеспечить умеренное снижение плазменного содержания ТГ, не оказывая существенного влияния в отношении концентрации ХС ЛПВП. Необходимо отметить, что уровень ХС ЛПНП при оптимальном гликемическом контроле также может незначительно снижаться. Однако у многих пациентов достигаемый эффект оказывается недостаточным, что является основанием к назначению гиполипидемических лекарственных средств (Christopher C.P., 2005; Fisman E.Z. et al., 2005; Pedersen T.R. et al., 2005).
Таблица 13.4 Основные направления модификации образа жизни у пациентов с метаболическим синдромом/сахарным диабетом и гиперлипидемией в соответствии с рекомендациями NCEP Adult Treatment Panel III (2002)
| Основные направления модификации образа жизни | Рекомендации |
Нутриенты, повышающие содержание ХС ЛПНП:
|
<7% общей калорийности
<200 мг/сут |
Нутриенты, снижающие содержание ХС ЛПНП:
|
2 г/сут
10–25 г/сут |
| Общая калорийность | Ограничение употребления с пищей высококалорийных продуктов с целью уменьшения массы тела |
| Физическая активность | Достаточное количество физических нагрузок умеренной интенсивности с энергозатратами ≥200 ккал/сут |
Таблица 13.5 Рекомендации по диетическим ограничениям в популяции пациентов с метаболическим синдромом и сахарным диабетом в соответствии с NCEP Adult Treatment Panel III (2002)
| Компоненты пищевого рациона | Рекомендации |
| Полиненасыщенные жиры | Ограничение до 10% общей калорийности |
| Мононенасыщенные жиры | Ограничение до 20% общей калорийности |
| Общее потребление жиров | Ограничение до 25–30% общей калорийности |
| Углеводы | Ограничение до 50–60% общей калорийности |
| Растительные волокна | 20–30 г/сут |
| Белок | Около 15% общей калорийности |
В соответствии с требованиями Американской диабетической ассоциации (American Diabetes Association, ADA), оптимальный уровень ХС ЛПНП у взрослых пациентов с сахарным диабетом 2-го типа и сопутствующими кардиоваскулярными заболеваниями должен быть <2,6 ммоль/л (100 мг/дл), а при отсутствии последних — <3,4 ммоль/л (Pitt B., 2005; Tenenbaum A., Fisman E.Z., 2004). Оптимальным уровнем ХС ЛПВП является 1,15 ммоль/л (45 мг/дл) и более, а ТГ — <2,3 ммоль/л (200 мг/дл). Кроме достижения целевого уровня ХС ЛПНП терапия должна быть направлена на адекватную коррекцию атерогенной гипердислипидемии (см. табл. 13.5). В соответствии с NCEP Adult Treatment Panel III (АТР ІІІ) в качестве вторичной конечной точки у пациентов с гипертриглицеридемией рекомендовано содержание ХС не-ЛПНП (NCEP, 2002). Последний показатель является расчетным и верифицируется по следующей формуле:
целевой уровень ХС не-ЛПНП = целевой уровень ХС ЛПНП + 30 мг/дл.
Начало фармакологической гиполипидемической терапии у таких пациентов должно рассматриваться индивидуально с учетом не только характера и тяжести нарушений липидного обмена, но и сопутствующих факторов кардиоваскулярного риска (табл. 13.6). В когорте пациентов с документированным сахарным диабетом 2-го типа/метаболическим синдромом предпочтительнее использовать все возможности для первичной профилактики возникновения атеросклероза и кардиоваскулярных заболеваний. Фармакологическая гиполипидемическая терапия должна быть начата после верифицкации недостаточной эффективности модификации образа жизни, включающей приверженность к диете, в течение первых 3 мес. Тем не менее, у пациентов с уже документированными кардиоваскулярными заболеваниями или очень высоким уровнем ХС ЛПНП (>5,15 ммоль/л) назначение соответствующих гиполипидемических препаратов следует проводить немедленно после верификации диагноза.
Таблица 13.6 Рекомендации по фармакологическому лечению гиперлипидемии в популяции пациентов с метаболическим синдромом/сахарным диабетом в соответствии с NCEP Adult Treatment Panel III (2002)
| № | Основные направления лечения гиперлипидемии |
| 1 | Верификация величины суммарного (тотального) кардиоваскулярного риска |
| 2 | Достижение целевого уровня ХС ЛПНП |
| 3 | Коррекция атерогенной гипердислипидемии |
| 4 | Достижение целевого уровня ХС не-ЛПНП |
| 5 | Повышение уровня ХС ЛПВП |
В соответствии с рекомендациями NCEP АТР III (2002) и ADA (2008) пациентам с сахарным диабетом 2-го типа гиполипидемические средства назначают при инициальном плазменном уровне ХС ЛПНП >2,6 ммоль/л после диетической терапии и улучшения контроля за гликемией (табл. 13.7). Больным без кардиоваскулярных заболеваний в анамнезе гиполипидемические лекарственные средства показаны при повышении ХС ЛПНП >3,35 ммоль/л. Для всех случаев первичной конечной точкой лечения является достижение и поддерживание целевого уровня ХС ЛПНП <2,6 ммоль/л. Поскольку для пациентов с сахарным диабетом гипертриглицеридемия также является независимым фактором риска возникновения кардиоваскулярных заболеваний, то решение вопроса о начале гиполипидемической терапии при изолированном повышении уровня ТГ основывается прежде всего на идентификации дополнительных факторов риска, в том числе наличии документированных кардиоваскулярных заболеваний. Так, у пациентов с сахарным диабетом 2-го типа без кардиоваскулярных заболеваний и факторов риска гиполипидемическая лекарственная терапия показана при уровне ТГ >4,5 ммоль/л до достижения целевого уровня <2,3 ммоль/л. В когорте больных с сопутствующими кардиоваскулярными заболеваниями или облитерирующим атеросклерозом артерий нижних конечностей назначение гиполипидемических лекарственных средств рекомендовано уже при повышении плазменной концентрации ТГ >1,7 ммоль/л. Во всех остальных случаях подобное назначение необходимо сделать у пациентов с сахарным диабетом 2-го типа с плазменным содержанием ТГ >2,3 ммоль/л. Соответственно, у всех больных этих категорий должны быть использованы гиполипидемическая диета, режим расширенных физических нагрузок, меры по уменьшению избыточной массы тела, ограничение употребления алкоголя и отказ от курения.
Таблица 13.7 Целевые уровни ХС ЛПНП у пациентов с метаболическим синдромом/сахарным диабетом 2-го типа в соответствии с NCEP Adult Treatment Panel III (2002)
| Характеристики | Значение | |
| Категории риска | Очень высокий | |
| ИБС | Документирована | |
| Факторы риска, эквивалентные ИБС | Присутствуют | |
| Факторы риска ИБС | Факторы риска возникновения метаболического синдрома, особенно ТГ ≥200 мг/дл, ХС не-ЛПВП ≥130 мг/дл, ХС ЛПВП <40 мг/дл | |
| Величина 10-летнего риска | Не определена | |
| Рекомендации в соответствии с NCEP Adult Treatment Panel III | ||
| Пороговый уровень ХС ЛПНП | Для инициальной МОЖ | ≥100 мг/дл |
| Для инициального фармакологического лечения | ≥100 мг/дл | |
| <100 мг/дл | ||
| Целевые уровни ХС ЛПНП | <100 мг/дл | |
| <70 мг/дл | ||
МОЖ — модификация образа жизни.
В табл. 13.8 приведены рекомендации по гиполипидемической терапии у пациентов с метаболическими факторами риска в соответствии с требованиями American Heart Association and National Heart, Lung, and Blood Institute Scientific Statement.
Таблица 13.8 Рекомендации по гиполипидемической терапии у пациентов с метаболическими факторами риска в соответствии с требованиями American Heart Association and National Heart, Lung, and Blood Institute Scientific Statement (Grundy S.M. et al., 2005)
| Метаболические факторы риска | Цели терапии | Целевые уровни | Рекомендации |
| Атерогенная дислипидемия | Первичная цель: снижение уровня ХС ЛПНП | Для пациентов с очень высоким кардиоваскулярным риском <2,6 ммоль/л (100 мг/дл), оптимально <70 мг/дл | МОЖ + гиполипидемические лекарственные средства для достижения рекомендованного целевого уровня ХС ЛПНП
Если ХС ЛПНП >100 мг/дл, инициально рекомендуется прием гиполипидемических лекарственных средств При невозможности достичь целевого уровня ХС ЛПНП <100 мг/дл при использовании монотерапии, рекомендовано применение комбинации гиполипидемических препаратов Если исходный уровень ХС ЛПНП <100 мг/дл, гиполипидемическая терапия рекомендована только для пациентов с документированными кардиоваскулярными заболеваниями |
| Для пациентов с высоким кардиоваскулярным риском <3,4 ммоль/л (130 мг/дл), оптимально <100 мг/дл (2,6 ммоль/л) | МОЖ + гиполипидемические препараты для достижения рекомендованного целевого уровня ХС ЛПНП, если после применения только МОЖ плазменное содержание ХС ЛПНП остается >3,4 ммоль/л (130 мг/дл)
Если исходный уровень ХС ЛПНП составляет 100–129 мг/дл, а оцененная величина кардиоваскулярного риска превышает ожидаемый уровень, то гиполипидемическая лекарственная терапия может быть рекомендована инициально |
||
| Для пациентов с умеренным кардиоваскулярным риском <3,4 ммоль/л (130 мг/дл) | МОЖ + гиполипидемические препараты для достижения рекомендованного целевого уровня ХС ЛПНП, если после применения только МОЖ плазменное содержание ХС ЛПНП остается >4,1 ммоль/л (160 мг/дл) | ||
| Для пациентов с низким кардиоваскулярным риском <4,9 ммоль/л (160 мг/дл) | МОЖ + гиполипидемические препараты для достижения рекомендованного целевого уровня ХС ЛПНП, если после применения только МОЖ плазменное содержание ХС ЛПНП остается >190 мг/дл
Для пациентов с инициальным уровнем ХС ЛПНП 160–189 мг/дл рекомендована гиполипидемическая лекарственная терапия |
||
| Атерогенная дислипидемия | Вторичная цель: снижение ХС не-ЛПВП | Для пациентов с очень высоким и высоким кардиоваскулярным риском <3,4 ммоль/л (130 мг/дл), оптимально <100 мг/дл | Интенсивная фармакологическая гиполипидемическая терапия
Добавить фибрат (предпочтительнее фенофибрат) или производное никотиновой кислоты, если уровень ХС не-ЛПВП не достигает целевых значений Если концентрация ТГ >500 мг/дл, рекомендовано инициальное лечение фибратами или производными никотиновой кислоты как препаратами первой линии |
| Для пациентов с умеренным кардиоваскулярным риском <160 мг/дл (оптимально <30 мг/дл) | |||
| Для пациентов с низким кардиоваскулярным риском <190 мг/дл | |||
| Третичная цель: повышение уровня ХС ЛПВП | Для всех категорий пациентов | МОЖ, включающая повышение физической активности и уменьшение массы тела | |
| Возможно дополнительное применение фибратов или производных никотиновой кислоты как дополнительных компонентов гиполипидемической терапии | |||
| Лечение артериальной гипертензии | Снижение АД <140/90 мм рт. ст., в диабетической популяции пациентов <130/80 мм рт. ст. | Для всех категорий пациентов | Если исходная величина АД ≥120/80 мм рт. ст., рекомендуется МОЖ
Если исходная величина АД ≥140/90 мм рт. ст. (в диабетической популяции пациентов ≥130/80 мм рт. ст.), рекомендуются антигипертензивные лекарственные средства для достижения и поддерживания целевого уровня АД |
| Гипергликемия натощак | Снижение уровня гликемии натощак | Для пациентов с повышением уровня глюкозы натощак, таковой должен составлять <100 мг/дл (5,6 ммоль/) | МОЖ, включающая повышение физической активности и уменьшение массы тела |
| Для пациентов с документированным сахарным диабетом 2-го типа: НbA1 <7% | МОЖ, включающая повышение физической активности и уменьшение массы тела
Фармакотерапия для достижения НbA1 <7% |
||
| Тромбофилия | Снижение риска возникновения тромбозов | Для пациентов с высоким и очень высоким риском | Низкие дозы ацетилсалициловой кислоты или ее комбинация с клопидогрелом при наличии верифицированного нестабильного кардиоваскулярного заболевания и отсутствия традиционных противопоказаний |
| Для пациентов с умеренным риском | Низкие дозы ацетилсалициловой кислоты в целях первичной превенции и при отсутствии традиционных противопоказаний к применению | ||
| Провоспалительная активация | Уменьшение выраженности провоспалительной активации, том числе содержания СРП | Для всех пациентов | Нет специальной стратегии лечения, основанной на принципах доказательной медицины
Обсуждается возможность использования статинов |
МОЖ — модификация образа жизни; АД — артериальное давление. Очень высокий риск — наличие кардиоваскулярных заболеваний или 10-летний риск возникновения ИБС превышает 20%; высокий риск — 10-летний риск возникновения ИБС 10–20%; умеренный риск — 2 фактора кардиоваскулярного риска и 10-летний риск возникновения кардиоваскулярных событий <10%; низкий риск — нет или 1 фактор кардиоваскулярного риска и 10-летний риск возникновения кардиоваскулярных событий <10%.
Статины (ингибиторы ГМГ-КоА-редуктазы)
К настоящему времени клиническая эффективность статинов у пациентов с сахарным диабетом 2-го типа/метаболическим синдромом в отношении предотвращения возникновения кардиоваскулярных событий и ограничения прогрессирования атеросклероза достоверно установлена (Cannon C.P. et al., 2004; de Lemos J.A. et al., 2004; Christopher C.P., 2005; LaRosa J.C. et al., 2005; Pedersen T.R. et al., 2005). Более того, способность этого класса веществ в когорте пациентов с сахарным диабетом 2-го типа улучшать клинические исходы существенно выше, чем в недиабетической популяции (Fisman E.Z. et al., 2005; Pitt B., 2005).
Тем не менее, несмотря на широкое применение статинов частота возникновения кардиоваскулярных событий в этой популяции пациентов остается высокой (табл. 13.9). Обсуждается вопрос о том, может ли специфический характер гиперлипидемии при сахарном диабете 2-го типа/метаболическом синдроме оказывать непосредственное влияние на формирование не всегда адекватного ответа на лечение, даже при условии достижения целового уровня ХС ЛПНП (Tenenbaum A., Fisman E.Z., 2004).
Таблица 13.9 Эффективность использования статинов у пациентов с сахарным диабетом
| РКИ | Частота кардиоваскулярных событий | Cнижение относительного риска, % | Снижение абсолютного риска, % | ЧБНЛ | |
| Контроль | Интервенция | ||||
| Программы первичной профилактики | |||||
| AFCAPS/TexCAPS | 6/71 | 4/84 | 44 | 4 | 27 |
| ALLHAT-LLT | – | – | 11 | – | – |
| HHS | 8/76 | 2/59 | 68 | 7 | 14 |
| HPS | 367/1976 | 276/2006 | 26 | 5 | 21 |
| PROSPER | 28/205 | 32/191 | 23 | 3 | 32 |
| ASCOT-LLA | 46/1274 | 38/1258 | 16 | 1 | 170 |
| Программы вторичной профилактики | |||||
| 4S | 44/97 | 24/105 | 50 | 23 | 4 |
| CARE | 112/304 | 81/282 | 22 | 8 | 12 |
| HPS | 381/1009 | 325/972 | 11 | 4 | 23 |
| LIPID | 88/386 | 76/396 | 16 | 4 | 28 |
| LIPS | 31/82 | 26/120 | 57 | 16 | 6 |
| Post-CABG | 14/53 | 26/120 | 57 | 12 | 8 |
| PROSPER | 31/115 | 38/112 | 26 | 7 | 14 |
РКИ — рандомизированные клинические исследования; ЧБНЛ — число больных, которых необходимо лечить для предотвращения одного события.
Предполагают, что типичная для пациентов с сахарным диабетом 2-го типа так называемая смешанная гиперлипидемия, известная как lipid quartet (гипертриглицеридемия + снижение уровня ХС ЛПВП + мелкие плотные частицы ЛПНП + аккумуляция обогащенных ХС ремнантов апо-В липопротеинов), отличающаяся особенно высокой атерогенностью, сохраняет свою способность к модуляции кардиоваскулярного риска, поскольку улучшение липидного профиля плазмы крови в основном касается только его количественного состава. В этой связи большой интерес представляло проведение прямого сопоставления гиполипидемической активности различных статинов и вероятности достижения целевого уровня ХС ЛПНП уже после первых недель терапии при использовании рекомендованных доз в рутинной клинической практике. Так, результаты прямого сопоставления гиполипидемической эффективности различных статинов (розувастатин, аторвастатин, симвастатин, правастатин) в условиях 8-недельного рандомизированного клинического исследования MERCURY (The Measuring Effective Reductions in Cholesterol Using Rosuvastatin Therapy) у 3140 пациентов с гиперлипидемией, среди которых 43% пациентов удовлетворяли критериям метаболического синдрома в соответствии с требованиями NCEP ATP III, показали, что частота достижения целевого уровня ХС ЛПНП у больных с метаболическим синдромом и без такового при использовании одного лекарственного средства существенно не отличаются (Stender S. et al., 2005). Таким образом, авторы исследования пришли к выводу о том, что гиполипидемическая эффективность статинов не зависит от наличия метаболического синдрома. С другой стороны, вероятность достижения целевого уровня ХС ЛПНП у различных представителей класса статинов может различаться. Так, в ряде рандомизированных клинических исследований, таких как ACCESS, CURVES и TARGET TANGIBLE, было продемонстрировано преимущество гиполипидемического потенциала аторвастатина перед правастатином, симвастатином, флувастатином (Jones P. et al., 1998; Marz W. et al., 1999; Andrews T.C. et al., 2001). В то же время, все эти исследования не были специально спланированы как посвященные оценке эффективности терапии статинов в популяции больных сахарным диабетом или метаболическим синдромом. В этой связи формально чрезвычайно трудно экстраполировать полученные в них данные именно на эту популяцию пациентов.
С целью проведения прямого сопоставления гиполипидемического потенциала статинов в когорте больных с метаболическими факторами риска были спланированы и проведены ряд рандомизированных клинических исследований. Так, в испытании ANDROMEDA розувастатин (10 мг/сут) превосходил аторвастатин (10 мг/сут) по способности снижать содержание ХС ЛПНП (–51,3% против –39,0% соответственно) у пациентов с сахарным диабетом 2-го типа. При этом в когортах больных, получавших розувастатин и аторвастатин, целевой уровень ХС ЛПНП, рекомендованный European Atherosclerosis Society (<2,5 ммоль/л), был достигнут в 94 и 79% случаев соответственно (Betteridge J.D., Gibson M., 2004). Аналогичные результаты были продемонстрированы в ходе испытания CORALL, котором розувастатин в суточной дозе 10 мг/сут доказал свое преимущество перед аторвастатином в суточной дозе 20 мг (Franken A.A.M. et al., 2004).
Одним из первых специально спланированных рандомизированных клинических исследований, посвященных изучению клинической результативности статинов в когорте больных с метаболическим синдромом, был COMETS (The COmparative Study with Rosuvastatin in Subjects with METabolic Syndrome) (Stalenhoef A.F. et al., 2005). В этом рандомизированном клиническом исследовании приняли участие 397 взрослых больных, рандомизированных в группы розувастатина (10 мг/сут), аторвастатина (10 мг/сут) или плацебо. Продолжительность периода наблюдения составила 12 нед. В качестве первичной конечной точки использовалась величина редукции плазменной концентрации ХС ЛПНП от исходного уровня (в %). Анализ полученных результатов показал, что розувастатин превосходит аторвастатин по способности редуцировать ХС ЛПНП (–42,7% против –36,6%, р<0,001) и повышать ХС ЛПВП (9,3% против 4,8, р<0,05). Количество пациентов, у которых удалось достичь рекомендованного уровня ХС ЛПНП в соответствии с требованиями NCEP ATP III, в группах розувастатина и аторвастатина составило 91 и 79% соответственно (р<0,001). В целом, исследователи пришли к выводу о том, что инициальный выбор статина с наиболее выраженным гиполипидемическим потенциалом может иметь решающее значение для повышения вероятности достижения целевого уровня ХС ЛПНП и повышения комплаентности пациента.
В то же время атерогенная гиперлипидемия при сахарном диабете или метаболическом синдроме часто ассоциируется с выраженной гипертриглицеридемией. Теоретически статины уступают фибратам в отношении редукции плазменной концентрации ТГ. Гипотеза о том, что статины способны эффективно контролировать атерогенную гиперлипидемию у пациентов с метаболическим синдромом, даже ассоциированную с высокой гипертриглицеридемией, была подвергнута изучению в ходе проведения рандомизированного клинического исследования STELLAR (Statin Therapies for Elevated Lipid Levels compared Across doses to Rosuvastatin). При сопоставлении влияния розувастатина в ранжированных дозах (10 мг, 20 мг, 40 мг) в отношении содержания ТГ, ХС ЛПВП и ХС ЛПНП оказалось, что препарат проявляет дозозависимый гиполипидемический потенциал. Так, уровень ТГ снизился на 22,3–33,8%, содержание ХС ЛПВП возросло на 7,6–10,4%, а пул ХС ЛПНП редуцировал на 43,9–55,3% (Deedwania P.C. et al., 2005). Таким образом, при мягкой и умеренной гипертриглицеридемии гиполипидемическая активность статинов может быть вполне достаточной для достижения целевого уровня ТГ.
Таким образом, в рандомизированных клинических исследованиях по первичной и вторичной профилактике кардиоваскулярных событий терапевтический и гиполипидемический потенциал статинов как в диабетической, так и в недиабетической популяции был достаточно четко установлен. Тем не менее, вопрос о том, должны ли все пациенты с сахарным диабетом 2-го типа или метаболическим синдромом получать статины с целью редукции величины кардиоваскулярного риска, несмотря на наличие гиперлипидемии, остается дискутабельным. Многие эксперты склоняются к мнению о том, что большое количество коморбидных состояний в этой популяции больных оказывает серьезное влияние на клинические исходы, а широкое применение статинов создает определенные социально-экономические сложности. В этой связи действующие клинические соглашения сохраняют возможность применения статинов только у пациентов с сопутствующей гипер- или дислипидемией. С другой стороны, целевой уровень ХС ЛПНП, рекомендованный NCEP ATP III, для больных сахарным диабетом 2-го типа с кардиоваскулярными заболеваниями достаточно низок (<1,8 ммоль/л; 70 мг/дл). Причем большинство пациентов даже молодого возраста (<40 лет) не имеют такового ни на этапе первичного обращения за медицинской помощью, ни в процессе лечения. В этой связи решение вопроса о назначении статина независимо от исходного уровня ХС ЛПНП может зависеть от субъективного мнения врача.
Роль фибратов в лечении гиперлипидемии у пациентов с сахарным диабетом 2-го типа/метаболическим синдромом
Опыт применения фибратов в клинической практике насчитывает более 4 десятилетий. Представители лекарственных средств этого класса отличаются уникальной способностью к выраженному снижению содержания преимущественно ТГ в плазме крови, а также редукции ХС ЛПНП и повышению ХС ЛПВП (Tenenbaum A., Fisman E.Z., 2004). Фибраты, являясь агонистами PPAR-α рецепторов, оказывают благоприятное влияние в отношении обмена глюкозы, а также могут создавать условия для снижения риска возникновения серьезных кардиоваскулярных событий, в том числе инфаркта миокарда, у больных с метаболическим синдромом и сахарным диабетом (Fruchart J.C., 2001; Sacks F.M., 2002; Verges B., 2004). Несмотря на то что объем доказательств в отношении позитивного влияния фибратов на твердые клинические конечные точки существенно меньше по сравнению со статинами, тем не менее, первые продемонстрировали свою способность к редукции риска манифестации любых, в том числе и нефатальных, кардиоваскулярных событий (Frick M.H. et al., 1987; Ericsson C.G. et al., 1997; Elkeles R.S. et al., 1998; Rubins H.B. et al., 1999; The Bezafibrate Infarction Prevention (BIP) study, 2000; Meade T. et al., 2002; Tenenbaum A. et al., 2005b). Необходимо отметить, что благоприятное влияние в отношении возникновения сердечно-сосудистых заболеваний при использовании фибратов, в основном гемфиброзила и безафибрата, было преимущественно документировано в популяции пациентов с более чем тремя компонентами метаболического синдрома (Frick M.H. et al., 1987; Rubins H.B. et al., 1999; Tenenbaum A. et al., 2005c). Кроме того, до сих пор прямых сопоставлений терапевтической результативности фибратов и статинов с учетом твердых клинических конечных точек так и не было проведено. Тем не менее, теоретически принято считать, что фибраты оказывают не только благоприятное, но и более селективное воздействие на инсулинорезистентость, уровень глюкозы натощак, содержание ТГ и ХС ЛПВП, что может быть особенно важным именно для больных с абдоминальным ожирением, сахарным диабетом 2-го типа и метаболическим синдромом в плане превенции последующих кардио- и цереброваскулярных событий.
Гемфиброзил
Впервые способность представителя класса фибратов гемфиброзила к достоверной супрессии риска возникновения больших (внезапная сердечная смерть + нефатальный инфаркт миокарда) кардиоваскулярных событий была установлена в ходе проведения специально спланированного рандомизированного клинического исследования HHS (Helsinki Heart Study), посвященного первичной превенции сердечно-сосудистых заболеваний в финской популяции больных с гиперлипидемией (Frick M.H. et al., 1987). Период наблюдения пациентов составил 18 лет. Анализ полученных данных показал, что в группе гемфиброзила смертность от ИБС была на 23% ниже, чем в группе плацебо. Причем у тех пациентов, которые на момент включения в исследование имели наиболее высокие уровень ТГ и индекс массы тела, гемфиброзил продемонстрировал еще более впечатляющие результаты, снизив риск возниковения смерти от ИБС на 71%, а общую смертность — на 33% (Tenkanen L. et al., 2006).
В последующем в программе вторичной профилактики VA-HIT (Veterans Affairs High-density lipoprotein cholesterol Intervention Trial), в состав популяции которой вошли 30% больных сахарным диабетом, гемфиброзил способствовал достоверной редукции больших кардиоваскулярных событий на 22% (Rubins H.B. et al., 1999). Кроме того, в популяции больных с метаболическим синдромом между степенью снижения риска возникновения сердечно-сосудистых заболеваний при применении гемфиброзила и количеством компонентов последнего была установлена прямая корреляционная взаимосвязь (Manninen V. et al., 1992; Rubins H.B. et al., 2002).
Таким образом, клиническая эффективность гемфиброзила была доказана в программах как первичной, так и вторичной профилактики кардиоваскулярных событий в популяции пациентов с умеренной и тяжелой гиперлипидемией, метаболическим синдромом, абдоминальным ожирением и сахарным диабетом 2-го типа.
Клиническая результативность фенофибрата в свете результатов рандомизированного клинического исследования FIELD (Fenofibrate Intervention and Event Lowering in Diabetes)
В рандомизированном клиническом исследовании FIELD (Fenofibrate Intervention and Event Lowering in Diabetes) подвергалась тестированию гипотеза о существовании позитивного влияния фенофибрата на клинические кардиоваскулярные исходы у пациентов с сахарным диабетом 2-го типа (Keech A. et al., 2005). В этом исследовании приняли участие 9795 больных в возрасте 50–75 лет с сахарным диабетом 2-го типа, ранее не получавших терапию статинами. В качестве первичных конечных точек предполагалось учитывать все коронарные события (кардиоваскулярную смерть + нефатальный инфаркт миокарда). Вторичными конечными точками были кардиоваскулярная смерть, инфаркт миокарда, инсульт, потребность в проведении коронарной или каротидной реваскуляризации. Все пациенты были рандомизированы в группы фенофибрата или плацебо. Период наблюдения больных составил 5 лет. Анализ полученных данных показал, что использование фенофибрата способствует недостоверной 11% редукции частоты выявляемости первичной конечной точки (5,2 и 5,9% в группе фенофибрата или плацебо соответственно; р=0,16). В то же время в группе активного лечения отмечено статистически значимое уменьшение общего количества вторичных кардиоваскулярных конечных точек на 11% (р=0,035), нефатального инфаркта миокарда на 24% (р=0,01), коронарной реваскуляризации на 21% (р=0,003), потребности в проведении любой реваскуляризации на 20% (р=0,001). В когорте пациентов без предшествующих сердечно-сосудистых заболеваний (78% популяции больных, включенных в исследование) фенофибрат способствовал снижению частоты выявляемости первичной конечной точки на 25% (р=0,014), а также общего количества кардиоваскулярных событий и процедур на 19% (р=0,004). Кроме того, фенофибрат продемонстрировал способность к предотвращению возникновения микрососудистых осложнений, таких как ретинопатия (5,2% против 3,6% в группе плацебо и фенофибрата соответственно, снижение ОР=30%; р=0,0003) и альбуминурия (2,5% абсолютной редукции между группами и 1,2% снижения величины ОР (р=0,002)).
Необходимо отметить, что в соответствии с дизайном исследования исследователи сохраняли возможность применения статинов дополнительно к фенофибрату или плацебо. Так, частота использования других гиполипидемических лекарственных средств (преимущественно статинов) составляла 17 и 8% в группах плацебо и фенофибрата соответственно (р<0,0001). Кроме того, в последней группе больных чаще (по сравнению с плацебо) применялись такие лекарственные средства, как иАПФ (р=0,003), блокаторы β-адренорецепторов (р=0,01), диуретики (р=0,006), а также процедуры коронарной реваскуляризации (р=0,003), которые могли оказать самостоятельное влияние на отдаленный прогноз. Кроме того, повышение уровня ХС ЛПВП у пациентов, включенных в исследование FIELD, к концу периода наблюдения было меньше ожидаемого (5% по сравнению с заявленными 18%, как это было в исследовании BIP — Bezafibrate Infarction Prevention). Все это стало основанием для широкой дискуссии по поводу необходимости использования фенофибрата в популяции пациентов с сахарным диабетом/метаболическим синдромом и кардиоваскулярными заболеваниями в анамнезе. В целом, большинство исследователей придерживалось мнения о необходимости ограничения использования этого представителя класса фибратов с целью превенции кардиоваскулярных клинических исходов в популяции больных с метаболическими факторами риска.
Результаты клинического применения безафибрата у пациентов с метаболическим синдромом
В отличие от других представителей фибратов, безафибрат обладал уникальными фармакологическими качествами, связанными с возможностью активации сразу трех субтипов PPAR-рецепторов (PPAR-α, -γ и -δ) в сопоставимых дозах (Willson T.M. et al., 2000; Berger J., Moller D.E., 2002; Tenenbaum A. et al., 2005a). В ранних исследованиях безафибрат продемонстрировал возможность снижения интенсивности прогрессирования коронарного атеросклероза, что ассоциировалось со статистически значимой редукцией частоты выявляемости коронарных событий (Ericsson C.G. et al., 1997; Elkeles R.S. et al., 1998). В последующем аналогичный эффект был доказан и для популяции пациентов с документированным облитерирующим атеросклерозом артерий нижних конечностей (Meade T. et al., 2002). Однако в последнем испытании безафибрат способствовал лишь появлению тенденции к уменьшению общего количества коронарных событий при достоверной редукции частоты выявляемости нефатальных кардиоваскулярных событий и случаев внезапной сердечной смерти. Причем эти результаты были установлены преимущественно в когорте лиц с исходным уровнем ТГ >200 мг/дл (The Bezafibrate Infarction Prevention (BIP) study, 2000).
В целом, основываясь на результатах рандомизированного клинического исследования BIP (табл. 13.10), многие исследователи предполагали, что безафибрат мог бы быть особенно эффективным в плане превенции наступления кардиовасулярных клинических исходов в популяции пациентов с метаболическими факторами риска, например у больных с метаболическим синдромом или сахарным диабетом 2-го типа (Tenenbaum A. et al., 2004b; 2005; 2006). Действительно, в последующем оказалось, что препарат в этой когорте больных способствует регрессу общего количества случаев фатального и нефатального инфаркта миокарда (ОР=0,71; 95% ДИ=0,54–0,95 и ОР=0,67; 95% ДИ=0,49–0,91 соответственно), а также тенденции к снижению риска кардиоваскулярной смерти (ОР=0,74, 95% ДИ=0,54–1,03). Причем последний результат удалось продемонстрировать только у пациентов с менее чем 3 критериями метаболического синдрома. Если у пациентов отмечали 4 и более критерия этого заболевания, то показатель редукции величины кардиоваскулярной смерти становился еще более значимым (ОР=0,44, 95% ДИ=0,25–0,80) (Tenenbaum A. et al., 2006). При этом препарат снижал вероятность возникновения впервые выявленного сахарного диабета 2-го типа (Tenenbaum A. et al., 2004a; 2005). Таким образом, полученные результаты позволили рассматривать безафибрат как эффективное средство превенции кардиоваскулярных исходов у пациентов с метаболическим синдромом и сахарным диабетом 2-го типа даже вне непосредственной связи с его гиполипидемическим потенциалом (Bloomfield H.E., 2006).
Таблица 13.10 Результаты исследования BIP (Bezafibrate Infarction Prevention)
| Клинические исходы | % пациентов | ОР | р* | |
| Безафибрат ретард 400 мг/сут | плацебо | |||
| Нефатальный инфаркт миокарда | 9,5 | 13,8 | 0,67 | 0,009 |
| Фатальный инфаркт миокарда | 1,9 | 1,5 | 1,26 | 0,60 |
| Все случаи инфаркта миокарда | 11,1 | 15,2 | 0,71 | 0,02 |
| Внезапная смерть | 3,4 | 3,6 | 0,95 | 0,80 |
| Первичная твердая конечная точка | 14,1 | 18,4 | 0,75 | 0,03 |
*р — критерий достоверности различий между группами безафибрата и плацебо.
Предполагают, что способность безафибрата к стимуляции процессов утилизации глюкозы тканями, преимущественно скелетными мышцами, и снижение продукции СЖК за счет агонистического эффекта в отношении трех субтипов PPAR-рецепторов (Groop L.C., 1999; Fruchart J.C. et al., 2001; Lakka H.M. et al., 2002; Tenenbaum A. et al., 2003) является основой для реализации его органопротекторного эффекта, включая реверсию дисфункции эндотелия и инсулинорезистентности. Многие исследователи полагают, что контролирующее влияние безафибрата в отношении адипогенеза может иметь преимущество перед его гиполипидемическим эффектом в плане повышения инсулинорезистентности и редукции макро- и микрососудистых осложнений, включая инфаркт миокарда и ретинопатии соответственно. Кроме того, безафибрат способен приводить к повышению экспрессии генов, вовлекаемых в механизмы оксидации СЖК, синтеза апо-А-I- и апо-А-II-липопротеинов, а также к снижению экспрессии генов, кодирующих продукцию апо-С-III-липопротеина, ряда провоспалительных цитокинов и ингибиторов фибринолиза. Это сопровождается не только повышением синтеза ЛПВП при минимизации включения ТГ в состав липопротеидов, но и улучшением реологических свойств крови, снижением ее тромбофилического потенциала, а также супрессией провоспалительной активации (Jones I.R. et al., 1990; Rovellini A. et al., 1992; Taniguchi A. et al., 2001; Jonkers I.J. et al., 2002). Кроме того, необходимо отметить, что между благоприятным влиянием безфибрата на уровень ХС ЛПВП и выраженностью редукции риска возникновения ИБС не установлено прямой взаимосвязи, что позволяет говорить о существовании плейотропных эффектов фибратов, аналогичных таковым у статинов (Despres J.P. et al., 2004). Таким образом, возможно, что и нелипидные эффекты фибратов могут иметь клиническое значение и должны быть приняты во внимание при проведении программ первичной и вторичной превенции кардиоваскулярных событий (Bloomfield H.E., 2006).
Производные никотиновой кислоты
Никотиновая кислота (ниацин) способна оказывать благоприятное влияние в отношении фракций липопротеинов и практически всех классов липопротеидов, способствуя повышению содержания ЛПВП и редукции ЛП (a) преимущественно посредством снижения интенсивности катаболизма апо-A-I-липопротеина (Jin F.Y. et al., 1997). Доказана способность ниацина к стимуляции процессов ретенции ХС из макрофагов, компартментализированных в сосудистой стенке. Кроме того, препарат способен ингибировать печеночную диацилглицерин-ацилтрансферазу-2 (ДАГАТ-2), которая является ключевым ферментом синтеза ТГ, инкорпорирующихся в состав ЛПОНП (Ganji S.H. et al., 2004). Установлено, что никотиновая кислота обладает способностью ингибировать липолиз в адипоцитах посредством снижения активности гормончувствительной триглицеридлипазы (Tunaru S. et al., 2003). В результате суммации вышеуказанных эффектов никотиновая кислота проявляет способность к выраженной редукции плазменной концентрации ЛПНП, ТГ и повышению ЛПВП.
Клиническая результативность никотиновой кислоты в отношении предотвращения возникновения кардиоваскулярных событий была впервые установлена в ходе проведения рандомизированного клинического исследования CDP (Coronary Drug Project), в котором принял участие 8341 мужчина, перенесший инфаркт миокарда (The Coronary Drug Project Research Group, 1973). В результате 6-летнего наблюдения этой популяции пациентов удалось продемонстрировать возможность достоверного снижения частоты возникновения кардиоваскулярных событий при применении никотиновой кислоты (Canner P.L. et al., 2006). Вместе с тем, у большинства пациентов (85%) отмечали покраснение кожи, кожную сыпь, а также кожный зуд как результат лекарственной терапии, что существенно снижало комплаентность больных назначенной терапии (Birjmohun R.S. et al., 2005). Как результат, в этом испытании 75% больных по этой причине отказались от дальнейшего участия в исследовании (Choi B.G. et al., 2006). В последующем использование формы медленного высвобождения — ниацина — приводило к заметному сокращению частоты негативных побочных эффектов, хотя их общее количество продолжало оставаться высоким (26%) (Birjmohun R.S. et al., 2005). С другой стороны, новая форма выпуска обладала большей гепатотоксичностью по сравнению с традиционной никотиновой кислотой. Попытки снизить частоту отказа от лечения никотиновой кислотой привели к созданию форм с контролируемым высвобождением, отличающихся не только более высокой переносимостью, но и более низкой гепатотоксичностью (McCormack P.L., Keating G.M., 2005). Несмотря на все эти усилия, переносимость новых форм никотиновой кислоты оставляет желать лучшего. Кроме того, исследователи установили, что к числу неблагоприятных побочных эффектов этого лекарственного средства можно отнести ухудшение гликемического контроля (Garg A., Grundy S.M., 1990) и снижение чувствительности тканей к инсулину (Kelly J.J. et al., 2000; Poynten A.M. et al., 2003), что ограничивает использование препарата в популяции пациентов с сахарным диабетом 2-го типа и метаболическим синдромом (Vega G.L. et al., 2005).
Секвестранты желчных кислот
В настоящее время среди различных секвестрантов желчных кислот в рутинной клинической практике наиболее широко применяют колестирамин, колесевелам и колестипол. Эти лекарственные средства имеют принципиально сходный механизм действия, затрагивающий связывание желчных кислот в просвете тонкой кишки, что ограничивает их реабсорбцию и препятствует ресинтезу ХС гепатоцитами. Установлено, что снижение реабсорбции желчных кислот на 40% приводит к снижению плазменного содержания ХС ЛПНП на 15–26% и повышению синтеза ХС ЛПВП преимущественно за счет апо-А-I-липопротеина (Shepherd J. et al., 1979). Наиболее значительным рандомизированным клиническим исследованием, посвященным оценке клинической эффективности секвестрантов желчных кислот, используемых в монотерапии при гиперхолестеринемии, стало Lipid Research Clinics Coronary Primary Prevention Trial (LRC-CPPT). В этом исследовании приняли участие 3806 мужчин с гиперхолестеринемией без документированной ИБС. Все пациенты были рандомизированы в группы колестирамина или плацебо. Анализ полученных данных показал 19% редукцию частоты возникновения новых случаев ИБС в группе активного лечения (Lipid Research Clinics Program, 1984). Вместе с тем, необходимо принимать во внимание, что секвестранты желчных кислот не имеют системной биодоступности и могут негативно влиять на абсорбцию некоторых лекарственных средств, витаминов и жиров (Insull W., 2006). Эти особенности могут оказывать серьезное влияние на переносимость терапии. Еще одним лимитирующим фактором терапии секвестрантами желчных кислот считают их незначительную способность к повышению уровня ЛПВП, что существенным образом снижает их гиполипидемический потенциал у пациентов с высоким уровнем ТГ в плазме крови. С другой стороны, секвестранты желчных кислот могут быть особенно полезны в тех клинических ситуациях, когда использование статинов или фибратов ограничено или невозможно (тяжелые заболевания печени или почек, низкая переносимость). В соответствии с действующими клиническими рекомендациями секвестранты желчных кислот могут быть рассмотрены как дополнительный компонент комплексной терапии пациентов с сахарным диабетом 2-го типа или метаболическим синдромом при формировании резистентной к лечению гиперлипидемии. Предполагают, что значительная часть таких больных имеют семейные формы гиперхолистеринемии.
Эзетимиб
Эзетимиб является относительно новым лекарственным средством, блокирующим абсорбцию ХС на уровне транслокации последнего в цитоплазму энтероцитов тощего кишечника (Toth P.P., Davidson M.H., 2005a). Подобно секвестрантам желчных кислот, эзетимиб препятствует связыванию ХС с молекулой ABC-протеина, являющейся своеобразным трансмембранным переносчиком последнего. Протеин-переносчик ABC локализован в энтероцитах тощей кишки и ответственен за эксфузию ХС и растительных стероидов, ассоциированных с желчными кислотами билиарного происхождения, в цитоплазму энтероцитов (Sudhop T. et al., 2002). В экспериментальных исследованиях было показано, что эзетимиб подобно другим гиполипидемическим лекарственным средствам способствует ограничению прогрессирования атеросклероза преимущественно за счет супрессии плазменного содержания ХС ЛПНП и, возможно, плейотропных эффектов (Davis H.R. Jr. et al., 2001). Одновременное применение эзетимиба и статина отличается аддитивным характером взаимодействия при реализации гиполипидемического потенциала. В то же время, потенцирование благоприятного влияния статинов при добавлении эзетимиба в отношении твердых клинических конечных точек еще не установлено. В целом, эзетимиб имеет благоприятный терапевтический профиль, а также отличается хорошей переносимостью и приемлемым уровнем безопасности даже при сочетанном применении с другими гиполипидемическими лекарственными средствами. Доказательная база для эзетимиба у пациентов с гиперлипидемией и метаболическими факторами кардиоваскулярного риска чрезвычайно ограничена. Тем не менее, добавление препарата к статинам позволяет добиться достижения целевого уровня ХС ЛПНП без использования высоких доз последних, переносимость которых не всегда оптимальна. Это позволяет повысить приверженность пациентов к лечению и, вероятно, повысить результативность последнего.
Ингибиторы СЕТР
В настоящее время существует большой интерес к лекарственным средствам, обеспечивающим селективное повышение содержания ХС ЛПВП посредством ингибирования СЕТР. Уже закончены первые этапы клинических исследований, посвященные первым представителям нового класса гиполипидемических лекарственных средств: JTT-705 и торцетрапибу (CP-529,414), а также проанализирован их терапевтический потенциал при монотерапии и в сочетании со статинами (Kuivenhoven J.A. et al., 2005; van der Steeg W.A. et al., 2005; Schaefer E.J., Asztalos B.F., 2006). Вместе с тем, их влияние на реверсию атеросклеротических поражений артерий еще до конца не установлено. Полагают, что существует потенциальная возможность того, что изолированное ингибирование СЕТР может не оказывать супрессирующего влияния в отношении атеросклероза (Hirano K. et al., 2000; Klerkx A.H. et al., 2006), даже несмотря на увеличение содержания ЛПВП (Shah P.K., Kaul S., Nilsson J. et al., 2001a; b). Тем не менее, результаты, полученные в экспериментальных исследованиях, выглядят вполне обнадеживающими. В клинических условиях торцетрапиб способствовал повышению плазменного содержания ХС ЛПВП на 46–106% исходного уровня без существенного изменения концентрации других липопротеидов (Brousseau M.E. et al., 2004). При изучении молекулы JTT-705 оказалось, что уровень ХС ЛПВП повышается в среднем на 34%, а ЛПНП — снижается на 7% от исходного (de Grooth G.J. et al., 2002). В целом, терапевтический потенциал нового класса гиполипидемических лекарственных средств выглядел оптимистично. Вместе с тем, четкие клинические рекомендации, касающиеся его применения у пациентов с дислипидемией и метаболическим синдромом или сахарным диабетом 2-го типа, дать не представляется возможным ввиду недостаточности доказательной базы (Bays H. et al., 2005; Burnett J.R., 2005). Вместе с тем, в 2006 г. после завершения рандомизированного клинического исследования ILLUMINATE (Lipid Level Management to Understand Its Impact in Atherosclerotic Events) были получены данные о том, что торцетрапиб способен повышать риск возникновения впервые выявленной артериальной гипертензии, а в комбинации с аторвастатином — способствовать повышению риска фатальных кардиоваскулярных событий и общей смертности (McKenney J.M. et al., 2006). В последующем в рандомизированном клиническом исследовании ILLUSTRATE (The Investigation of Lipid Level Management Using Coronary Ultrasound to Assess Reduction of Atherosclerosis by CETP Inhibition and HDL Elevation) была подтверждена способность торцетрапиба повышать уровень системного артериального давления (Tall A.R. et al., 2007; Nicholls S.J. et al., 2008). Вместе с тем, в ходе этого испытания было установлено, что комбинация торцетрапиба с аторвастатином превосходила монотерапию аторвастатином по способности редуцировать плазменную концентрацию ЛПНП и повышать уровень ЛПВП (Funder J.W., 2010; Natarajan P. et al., 2010; Spratt K.A., 2010). В то же время добавление торцетрапиба к аторвастатину, несмотря на выявленный синергичный гиполипидемический эффект, не привело к реверсии объема атером (Tobis J.M., Perlowski A., 2009). Полученные в ходе этих испытаний данные вызвали широкую дискуссию вокруг перспективности использования плазменного уровня ЛПВП и объема атеромы как суррогатных маркеров клинической эффективности гиполипидемической терапии (Lange R.A., Lindsey M.L., 2008; Briel M. et al., 2009; Mackness B., Mackness M., 2009).
В этой связи компания-производитель торцетрапиба («Pfizer», США) самостоятельно инициировала прекращение клинических испытаний препарата (Trial Drug Lifts «Good» Cholesterol Levels, 2005; Pfizer news release, 2006; Cavigiolio G. et al., 2010). Таким образом, торцетрапид в настоящее время не рассматривается как перспективный гиполипидемический препарат, а клинические исследования, посвященные изучению его эффективности и безопасности, заморожены (Chapman M.J. et al., 2010).
Комбинированное применение различных гиполипидемических лекарственных средств
Поскольку достижение целевого уровня ХС ЛПНП является основой для проведения эффективной превенции кардиоваскулярных событий не только у пациентов с метаболическими факторами риска, комбинирование различных гиполипидемических лекарственных средств является залогом проведения успешной стратегии лечения гиперлипидемии. Несмотря на то что статины рассматриваются как препараты выбора для лечения атерогенной гиперлипидемии в этой популяции пациентов, фибраты, ниацин или секвестранты желчных кислот могут быть использованы в качестве монотерапии при невозможности применения первых. Кроме того, комбинирование этих лекарственных средств вполне возможно при условии, что ожидаемая польза превышает риск, а уровень безопасности приемлемый (Jokubaitis L.A., 1996; Beggs P.W. et al., 1999; Gavish D. et al., 2000; Kyrklund C. et al., 2001; Shek A., Ferrill M.J., 2001; Farnier M., 2003; Farnier M. et al., 2003). Прежде всего, это касается комбинации статинов и фибратов, для которых доказано повышение риска возникновения рабдомиолиза и миопатий (Robins S.J., 2003; Fazio S., Linton M.F., 2004; UK HDL-C Consensus Group, 2004; Tenenbaum A. et al., 2004c; Robins S.J., Bloomfield H.E., 2006).
Селективные блокаторы CB1-эндогенных канабиоидных рецепторов
К настоящему времени получены доказательства того, что ожирение может оказывать самостоятельное влияние на клинические исходы у пациентов с сахарным диабетом 2-го типа и метаболическим синдромом. Установлено, что CB1-рецепторы эндогенной канабиоидной системы играют центральную роль в регуляции обмена веществ, пищевого поведения и адипогенеза. В двух крупных исследованиях RIO – North America (n=3040) и RIO – Europe (n=1507) продолжительностю 1 и 2 года соответственно, посвященных клиническому применению представителя нового класса лекарственных средств — антагониста CB1-рецепторов эндогенной канабиоидной системы римонабанта в ранжированных дозах 5 мг/сут и 20 мг/сут, удалось продемонстрировать позитивное влияние последнего в отношении уменьшения массы тела и улучшения липидного профиля плазмы крови (табл. 13.11) (Pi-Sunyer X., 2004; van Gaal L., 2005).
Таблица 13.11 Результаты рандомизированного клинического исследования
| Параметры | RIO – North America (1 год) | RIO – Europe (2 года) | ||
| Плацебо | Римонабант (20 мг/сут) | Плацебо | Римонабант (20 мг/сут) | |
| Масса тела, кг | –2,8 | –8,7* | –2,5 | –7,2 |
| Окружность талии, см | –3,9 | –8,2* | –3,4 | –7,5 |
| ХС ЛПВП, мг/дл | 7,2 | 16,1* | – | – |
| Изменение ХС ЛПВП, % | – | – | 16,8 | 28,2* |
| ТГ, мг/дл | 4,1 | –11,5* | – | – |
| Изменение ТГ, % | – | – | 6,3 | –8,8* |
| Изменение количества пациентов с метаболическим синдромом, % | –2,5 | –13,7 | –20 | –50 |
*Достоверность различий между группами римонабанта и плацебо.
В рамках проведения рандомизированного клинического исследования RIO (Rimonabant in Obesity) LIPIDS было проведено сопоставление клинической эффективности двух доз римонабанта по сравнению с плацебо в когорте 1036 больных с ожирением и документированной гиперлипидемией. Среди пациентов, включенных в исследование RIO (Rimonabant in Obesity) LIPIDS, у 42,2% отмечали метаболический синдром, верифицированный в соответствии с критериями NCEP ATP III. Пациентам рекомендовалось снижение общей суточной калорийности на 600 ккал без использования специфической диеты. Все больные были рандомизированы в группы римонабанта 5 мг/сут или 20 мг/сут или плацебо. Продолжительность наблюдения составила 1 год. К концу периода наблюдения уменьшение массы тела в группе активного лечения превысило ≥5% у 90% пациентов и ≥10% у 44% больных соответственно. Кроме того, исследователи обратили внимание на существенное улучшение липидного профиля плазмы крови, а также выраженное уменьшение объема талии, особенно в группе больных, получавших римонабант в высокой дозе (Despres J.P., 2004).
К 52-й неделе наблюдения у больных всех групп было зарегистрировано повышение содержания ХС ЛПВП. Вместе с тем, именно в группе лиц, в лечении которых использовали римонабант в дозе 20 мг/сут, этот прирост был наиболее значительным и составил 23% исходного уровня. Кроме того, в этой когорте больных препарат оказывал статистически значимое влияние в отношении снижения плазменного содержания ТГ (15%) и СРП (27%), что ассоциировалось с повышением уровня апо-А-липопротеина. Как и в исследовании RIO – North America и RIO – Europe, в этом испытании было документировано уменьшение количества критериев метаболического синдрома у каждого второго пациента, получавшего римонабант в дозе 20 мг/сут, на 19,6% (р<0,001). Таким образом, результаты рандомизированного клинического исследования RIO-LIPIDS впервые позволили уточнить роль эндогенной канабиоидной системы как потенциальной мишени для фармакологического вмешательства с целью реверсии выраженности метаболических факторов риска. В то же время, роль римонабанта в модуляции кардиоваскулярных клинических исходов в этой категории больных еще придется установить.
Метформин
Улучшение липидного профиля плазмы крови у пациентов с сахарным диабетом 1-го типа при достижении адекватного контроля за гликемией было доказано достаточно давно. Вместе с тем, для больных с метаболическим синдромом и сахарным диабетом 2-го типа аналогичный эффект доказан не был. Тем не менее, при проведении рандомизированного клинического исследования Diabetes Prevention Program Randomized Trial, в котором приняли участие пациенты с повышением содержания глюкозы натощак (53% всех пациентов имели верифицированный метаболический синдром), оказалось, что метформин (1700 мг/сут) по сравнению с модификацией образа жизни способен оказывать благоприятное влияние не только на массу тела, уровень глюкозы натощак, но и на липидный профиль плазмы крови (табл. 13.12) (Orchard T., et al., 2005). Исследователи пришли к заключению о том, что использование метформина в этой популяции пациентов может оказывать нормализующее влияние на липидный обмен, однако переоценивать интенсивность этого эффекта не следует.
Таблица 13.12 Эффективность метформина по сравнению с модификацией образа жизни у пациентов с метаболическим синдромом. Результаты исследования Diabetes Prevention Program Randomized Trial (2005)
| Компоненты метаболического синдрома | Кумулятивная частота событий (%) в течение 3 лет наблюдения | |||||
| Пациенты без метаболического синдрома | Пациенты с метаболическим синдромом | |||||
| Плацебо | Метформин | МОЖ | Плацебо | Метформин | МОЖ | |
| Окружность талии, превышающая пороговый уровень | 33 | 15* | 8** | 93 | 89* | 81** |
| Снижение ХС ЛПВП | 70 | 67 | 68 | 87 | 79* | 78 |
| Повышение уровня ТГ | 27 | 30 | 18** | 73 | 72 | 60** |
| Повышение уровня глюкозы натощак | 40 | 29* | 28** | 74 | 60* | 55** |
| Артериальная гипертензия | 41 | 44 | 35** | 81 | 80 | 68** |
МОЖ — модификация образа жизни; *достоверность различий между группами метформина и плацебо; **достоверность различий между группами МОЖ и метформина.
Кроме того, существуют стратегические подходы, направленные на редукцию массы тела и/или уменьшение объема жировой ткани у пациентов с метаболическим синдромом и абдоминальным ожирением путем модификации образа жизни и фармакологической интервенции, целью которых является снижение кардиоваскулярного риска (табл. 13.13) (Davidson M. et al., 2008; Nissen S.E. et al., 2008; Psaty B.M., Lumley T., 2008; van der Steeg W.A. et al., 2008).
Таблица 13.13 Основные подходы, направленные на редукцию массы тела и/или уменьшение объема жировой ткани у пациентов с метаболическим синдромом и абдоминальным ожирением
| Интервенция | Результат вмешательства | ||||||||
| Метаболизм липидов | Глюкоза крови | ФНО-α крови | Активность компонентов РАС в циркулирующей крови | Уровень половых гормонов в крови | |||||
| Объем жировой ткани | Концентрация СЖК в плазме крови | Лептин крови | Адипонектин крови | ||||||
| Андрогены | Эстрогены | ||||||||
| Гиполипидемическая и гипокалорийная диета | ↓ | ↓ | ↓ | ↑ | ↓ | ↓ | ↓ | ↓ | ↓/– |
| Расширение физической активности | ↓ | ↓ | ↓ | ↑ | ↓ | ↓ | ↓ | ↓ | ↓/– |
| PPRA-γ агонисты (пиоглитазон, розиглитазон) | ↓/– | ↓ | ↓/– | ↑ | ↓ | ↓ | – | ↑ | ↓/– |
| Орлистат | ↓ | ↓ | ↓ | ↑ | ↓ | ↓ | ? | ↓ | ? |
| Сибутрамин | ↓ | ↓ | ↓ | ↑/– | ↓ | ? | ? | ? | ? |
| Антагонисты канабиоидных рецепторов | ↓ | ↓ | ↓ | ↑ | ↓ | ↓ | ? | ? | ? |
Таким образом, статины и безафибрат являются предпочтительными лекарственными средствами, оказывающими благоприятное влияние в отношении липидного профиля плазмы крови, что ассоциируется с достоверным улучшением клинических исходов в популяции пациентов с метаболическими факторами риска (Verges B., 2005). В качестве второго компонента гиполипидемической терапии можно рассмотреть ниацин, секвестранты желчных кислот (Canner P.L. et al., 1986) или эзетимиб (Toth P.P., Davidson M.H., 2005b). Торцетрапиб, продемонстрировавший в ряде рандомизированных клинических исследований способность повышать риск возникновения кардиоваскулярных событий, не рассматривается в настоящее время как перспективное гиполипидемическое лекарственное средство. Комбинирование гиполипидемических препаратов различных групп является рекомендованным при условии мониторирования уровня безопасности и не оптимальном уровне ХС ЛПНП/ЛПВП/ТГ, несмотря на монотерапию статинами. Кроме того, расширение физической активности, гипокалорийная и гиполипидемическая диета в сочетании с рядом лекарственных средств, способствующих редукции массы тела (орлистат, сибутрамин, антагонисты каннабиоидных рецепторов), способствует дополнительному улучшению клинических исходов, в том числе за счет уменьшения выраженности провоспалительной и нейрогуморальной активации.
Использование гиполипидемических лекарственных средств у пациентов с фибрилляцией предсердий
Целесообразность применения гиполипидемической стратегии с целью предотвращения новых случаев возникновения фибрилляции предсердий доказана в основном для статинов. Предполагается, что их антиаритмический эффект может быть ассоциирован с противовоспалительным, антиоксидантным потенциалом, способностью к стабилизации ионных каналов кардиомиоцитов, улучшением функции эндотелия артерий и эндокарда. В наиболее крупном и специально спланированном рандомизированном клиническом исследовании, посвященном этому вопросу, ARMYDA-3 (Atorvastatin for Reduction of MYocardial Dysrhythmia After cardiac surgery) было выявлено, что аторвастатин в дозе 40 мг/сут обладает способностью к снижению частоты манифестации не только новых случаев фибрилляции предсердий, но и редуцирует потребность в ургентной госпитализации, обусловленной этой причиной. Причем благоприятный клинический эффект препарата сопровождался прогрессивным снижением плазменной концентрации СРП (р=0,01). В последующем в крупномасштабном 8-летнем ретроспективном наблюдении оказалось, что превентивное применение статинов перед выполнением хирургической реваскуляризации существенным образом улучшает клинические исходы, в том числе ассоциированные с редукцией частоты возникновения фибрилляции предсердий.
Таким образом, накопленные сведения позволяют предположить, что статины обладают некоторым антиаритмическим потенциалом, клиническое значение которого еще предстоит уточнить. Во всяком случае, рутинное использование этого класса веществ позволяет надеяться, что реализация их дополнительных качеств может повысить результативность гиполипидемической терапии.
Возможности гиполипидемической терапии в отношении редукции риска возникновения тромбоэмболии легочной артерии
К настоящему времени в ряде рандомизированных клинических исследований установлено, что у пациентов, получающих длительное лечение статинами, выявлена тенденция к редукции частоты возникновения венозных тромбозов. Интересно, что подобный результат документирован только для статинов и не может быть распространен на других представителей класса гиполипидемических лекарственных средств (Grady D. et al., 2000).
Впервые редукция риска тромбоэмблических осложнений при применении статинов была установлена в ходе проведения крупного рандомизированного клинического исследования Heart and Estrogen/Progestin Replacement Study (HERS), в котором принимали участие женщины с документированной ИБС, получавшие лечение эстрогеном или плацебо (Grady D. et al., 2000). Анализ полученных данных показал, что на частоту тромбоэмболических осложнений в венозном бассейне оказывало непосредственное влияние использование эстрогена. При этом в когорте лиц, в лечении которых дополнительно применялись статины, вероятность возникновения указанного осложнения снижалась почти на 50% по сравнению с теми пациентами, у которых не применяли лекарственных средств этого класса. При проведении ретроспективного когортного исследования с включением пациентов в возрасте старше 65 лет, получавших лечение гормонами щитовидной железы (n=77 993), J.G. Ray с соавторами (2001) показали, что дополнительное назначение статинов способно существенным образом снизить риск возникновения тромбозов глубоких вен нижних конечностей (ОР=0,78; 95% ДИ=0,69–0,87; по сравнению с группой лиц, в лечении которых не использовались статины). В последующем H.T. Sorenson и соавторы (2009) сопоставили результаты применения статинов у 5824 пациентов с контрольной группой, насчитывающей 58 240 больных. ОР манифестации тромбоза глубоких вен нижних конечностей в группе лиц, получавших статины, составил 0,74 (95% ДИ=0,63–0,85).
Таким образом, ретроспективные наблюдения наглядно свидетельствовали о существовании благоприятного влияния статинов на частоту глубоких венозных тромбозов нижних конечностей. Первое специально спланированное рандомизированное клиническое исследование, посвященное изучению этого вопроса, JUPITER (Justification for the Use of Statins in Primary Prevention: an Intervention Trial Evaluating Rosuvastatin), было проведено R.J. Glynn и соавторами (2009). В этом испытании приняли участие 17 802 пациента обоего пола с плазменным содержанием ХС ЛОПНП <130 мг/дл и CРП >2,0 мг/л. Все пациенты были рандомизированы в группы розувастатина (20 мг/сут) или плацебо. Через 1,9 года наблюдения частота тромбоза глубоких вен нижних конечностей составила 0,18 и 0,32 случаев в год в группах розувастатина и плацебо соответственно (ОР=0,57; 95% ДИ=0,37–0,86; р<0,007). По мнению исследователей, полученные данные свидетельствуют о наличии у статинов антитромботического потенциала (Kearney D., Fitzgerald D., 1999). В то же время, результаты рандомизированного клинического исследования JUPITER трудно экстраполировать на популяцию пациентов с высоким риском возникновения тромбоэмболических осложнений, особенно в отношении лиц, подвергаемых ортопедическим вмешательствам. Поэтому клиническое значение выявленного антитромботического потенциала статинов необходимо подтвердить не в когорте больных с уровнем риска, соответствующим таковому в общей популяции, а в селективных популяциях больных. В этой связи большой интерес представляет наблюдение D. Khemasuwan и соавторов (2010), которые использовали статины в лечении 740 пациентов с солидными новообразованиями различной локализации. В течение 2-месячного периода лечения новые случаи тромбоза глубоких вен были зарегистрированы у 21% пациентов, не получавших статины, и у 8% больных, получавших лечение этими лекарственными средствами (ОР=0,33; 95% ДИ=0,19–0,57). Авторы полагают, что полученные ими данные позволяют расширить показания к применению статинов, поскольку последние лишены неблагоприятных побочных эффектов антикоагулянтов и не требуют проведения сложных и дорогостоящих методов контроля за безопасностью. Вместе с тем, клиническое значение полученных данных необходимо подтвердить в более крупном специально спланированном исследовании.
Клиническое значение и стратегия лечения гиперлипидемий у пациентов с ХБП
Формирование ХБП обычно ассоциируется с высоким риском возникновения различных кардиоваскулярных событий и часто сопровождается развитием гипер- и дислипидемии (Kasiske B.L., 1998; Culleton B.F. et al., 1999). Необходимо отметить, что в этой популяции пациентов абсолютная величина кардиоваскулярного риска обычно варьирует в достаточно широких пределах и зависит не только от возраста и пола больных, этиологической принадлежности ХБП, СКФ, анемии, тромбофилических изменений системы крови, но и от тяжести нарушений липидного обмена. Кроме того, у пациентов с различными кардиоваскулярными заболеваниями формирование ХБП негативно отражается на вероятности выживания, а основными причинами неблагоприятных клинических исходов являются фатальные и нефатальные сердечно-сосудистые события (Shulman N.B. et al., 1989; Weiner D.E. et al., 2004). Так, даже незначительная редукция СКФ сопровождается существенным повышением риска кардиоваскулярной смертности (Mann J.F. et al., 2001; Sarnak M.J. et al., 2003), а в когорте больных, подвергаемых гемодиализу или другой процедуре заместительной терапии, абсолютная величина кардиоваскулярного риска превосходит популяционный уровень в 10–20 раз (Foley R.N. et al., 1998). В этой связи, все пациенты с гиперлипидемией и документированным снижением СКФ или установленной ХБП должны рассматриваться как лица с очень высоким кардиоваскулярным риском (Kasiske B.L., 1998). В предыдущих исследованиях было показано, что распространенность гипер- и дислипидемии у пациентов с ХБП существенно выше, чем в общей популяции (Kasiske B.L., 1998). При этом тяжесть нарушений липидного обмена устойчиво коррелирует с выраженностью протеинурии и редукции СКФ. Вместе с тем, следует отметить, что эти взаимоотношения не являются, безусловно, облигатными. Так, гипер- и дислипидемия часто рассматриваются как один из компонентов нефротического синдрома. Хотя не все пациенты с документированным нефротическим синдромом имеют сниженную СКФ. Тем не менее, в когорте лиц с нефротическим синдромом выраженность нарушений липидного обмена гораздо выше, чем у пациентов без этой патологии (Kasiske B.L., 1998).
Установлено, что нефротический синдром характеризуется прогрессивным повышением плазменного содержания ХС и ХС ЛПНП, ТГ, а также редукцией ХС ЛПВП (Expert Panel on Detection, Evaluation, And Treatment of High Blood Cholesterol In Adults, 2001). Интересно, что концентрация ТГ у пациентов этой категории может быть достаточно вариабельной (Appel G.B. et al., 1985). У пациентов без нефротического синдрома и со сниженной СКФ выраженность протеинурии тесно коррелирует с гиперлипидемией и протеинурией (Keane W.F., Eknoyan G., 1999). Кроме того, получены данные о том, что между содержанием ХС ЛПВП и протеинурией имеется обратная линейная взаимосвязь (Bianchi S. et al., 1999). Фактически, многие эксперты убеждены в том, что именно вторичная гипер- и дислипидемия у пациентов с ХБП является наиболее мощным фактором, обусловливающим возникновение и прогрессирование кардиоваскулярных заболеваний в этой популяции (Ordonez J.D. et al., 1993). Интересно, что характер нарушения липидного обмена у больных с ХБП и сахарным диабетом очень близок, хотя и отличается превалированием плазменного содержания ТГ (Attman P.O. et al., 1992; Joven J. et al., 1993). Однако величина кардиоваскулярного риска может существенно различаться (Attman P.O. et al., 1992).
Характеристика различных нарушений липидного обмена у пациентов с ХБП в зависимости от наличия нефротического синдрома представлена в табл. 13.14. Анализируя представленные данные, P.O. Attman и соавторы (1992) пришли к заключению о том, что частота возникновения гипер- и дислипидемии в когорте лиц с ХБП без нефротического синдрома несколько ниже ожидаемой по сравнению с общей популяцией. Вместе с тем, общая тенденция выглядит вполне предсказуемо: выраженность гиперлипидемии, независимо от ее формы, тесно ассоциируется с тяжестью нефропатии.
Таблица 13.14 Частота верификации различных нарушений липидного обмена в популяциях пациентов с ХБП (Attman P.O. et al., 1992)
| Характеристика популяции | Общий ХС | ХС ЛПНП | ХС ЛПВП | ТГ |
| >240 мг/дл | >130 мг/дл | <35 мг/дл | >200 мг/дл | |
| 6,21 ммоль/л | 3,36 ммоль/л | 0,91 ммоль/л | 2,26 ммоль/л | |
| Общая популяция, % | 20 | 40 | 15 | 15 |
| Пациенты с ХБП и нефротическим синдромом, % | 90 | 85 | 50 | 60 |
| Пациенты с ХБП без нефротического синдрома, % | 30 | 10 | 35 | 40 |
Гиперлипидемия как фактор прогрессирования ХБП
К настоящему времени гиперлипидемия рассматривается как независимый фактор формирования и прогрессирования нефропатии (Moorhead J.F. et al., 1982). В ряде рандомизированных клинических исследований и метаанализов показано, что гиполипидемические мероприятия способствуют предотвращению дальнейшего снижения СКФ и нарастания протеинурии у пациентов с ХБП независимо от ее этиологии (Fried L.F. et al., 2001; Lee T.M. et al., 2003). Так, по данным T.M. Lee и соавторов (2002), S. Bianchi и соавторов (2003), статины приводят к реверсии выраженности протеинурии и повышению СКФ. При этом благоприятный эффект статинов в отношении предотвращения редукции последней наиболее выражен у лиц с высокой протеинурией или нефротическим синдромом (Tonelli M. et al., 2003). Многие эксперты полагают, что нефропротекторный эффект антигипертензивной терапии, даже в случае использования рекомендованных доз иАПФ, АРА, а также достижение целевого уровня гликозилированного гемоглобина у больных с диабетической нефропатией не являются залогом успешных превентивных мер в отношении снижения интенсивности прогрессирования ХБП (Lewis E.J. et al., 1993; The Diabetes Control and Complications Trial Research Group, 1993; Klahr S. et al., 1994; Brenner B.M. et al., 2001; Nakao N. et al., 2003). В этой связи дополнительное проведение гиполипидемических мероприятий, направленное не только на редукцию плазменной концентрации проатерогенных липопротеидов, выраженности протеинурии и сохранения СКФ, но и на снижение кардиоваскулярного риска, вероятно, обусловленное возможными плейотропными эффектами статинов, может иметь серьезное клиническое значение (Bianchi S. et al., 2003; Tonelli M. et al., 2003). Необходимо отметить, что плейотропные эффекты статинов могут быть реализованы у пациентов с нормальным или даже сниженным уровнем ХС ЛПНП (Ridker P.M. et al., 1998; Heart Protection Study Collaborative Group, 2002; Blanco-Colio L.M. et al., 2003; Collins R. et al., 2003). Широко обсуждается вопрос о клиническом значении таких свойств статинов, как антипролиферативная, противовоспалительная и тромболитическая активность (Oda H., Keane W.F., 1999; McFarlane S.I. et al., 2002). Вместе с тем, терапевтический потенциал плейотропных эффектов статинов, особенно его возможная связь с повышением вероятности выживания пациентов с ХБП, пока не нашла однозначного подтверждения в широкомасштабных специально спланированных рандомизированных клинических исследованиях (Scandinavian Simvastatin Survival Study Group, 1994; The Long-Term Intervention with Pravastatin in Ischaemic Disease (LIPID) Study Group, 1998). Во всяком случае, статины сохраняют свои лидирующие позиции как наиболее перспективный класс гиполипидемических лекарственных средств в когорте пациентов с ХБП (Tonelli M. et al., 2004).
Современные принципы лечения гиперлипидемии у пациентов с ХБП
Согласно действующему клиническому соглашению K/DOQI (Kidney Disease Outcomes Quality Initiative) для всех пациентов с ХБП рекомендуется идентификация вида и тяжести нарушений липидного обмена, включающая изменение плазменного уровня общего ХС, ХС ЛПНП, ХС ЛПВП, ТГ (Kidney Disease Outcomes Quality Initiative (K/DOQI) Group, 2003). В соответствии с рекомендациями NCEP ATP III выявление повышенного уровня общего ХС требует проведения дополнительных измерений содержания ХС ЛПНП, ХС ЛПВП, ТГ для идентификации вида гиперлипидемии до применения гиполипидемических мероприятий (Fedder D.O. et al., 2002). Кроме того, ATP III допускает возможность применения гиполипидемических лекарственных средств у пациентов с ХБП при нормальном или даже сниженном уровне ХС ЛПНП при условии ассоциации заболевания с сахарным диабетом или метаболическим синдромом (Fedder D.O. et al., 2002). Причем при мониторировании ответа на лечение необходимо использовать не ХС ЛПНП, а комбинацию показателей, включающую содержание ТГ, ХС ЛПНП и не-ЛПНП.
Рекомендации K/DOQI, направленные на достижение адекватного контроля над гиперлипидемией, представлены на рис. 13.1. Фактически, существенных отличий между стратегией лечения вторичных гиперлипидемий у пациентов с ХБП и без таковой нет (Expert Panel on Detection, Evaluation, And Treatment of High Blood Cholesterol In Adults, 2001). Тем не менее, в когорте больных с ХБП и нефротическим синдромом первичной целью терапии, позволяющей не только предотвратить дальнейшее прогрессирование заболевания, но снизить вероятность возникновения кардиоваскулярных событий, является достижение адекватного контроля за нефротическим синдромом, а если это не представляется возможным — редукция степени протеинурии (Appel G.B. et al., 1985). При этом во всех случаях пациенты должны придерживаться гиполипидемической диеты, эффективность которой доказана даже у больных с неконтролируемым нефротическим синдромом. В то же время, диетические ограничения не способны оказывать существенного влияния на клинические исходы, что требует использования гиполипидемических лекарственных средств, а иногда и их комбинации. Среди первых статины рассматриваются как препараты первой линии (first-line drugs) (Kasiske B.L., 1998).
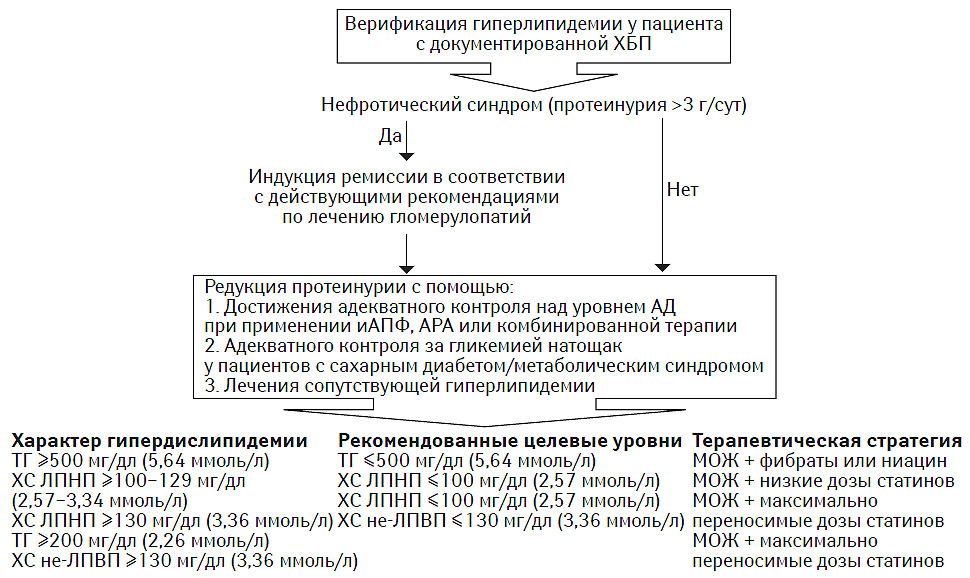
Рис. 13.1. Алгоритм принятия решения при выборе стратегии лечения гиперлипидемии у пациентов с ХБП в соответствии с рекомендациями K/DOQI (2003)
МОЖ — модификация образа жизни, АД — артериальное давление. Модификация образа жизни для взрослых больных с ХБП включает в себя диетические ограничения, расширение физической активности, снижение употребления алкоголя и отказ от курения.
Необходимо отметить, что современная стратегия лечения пациентов с диабетической нефропатией, осложненной нефротическим синдромом, близка к таковой, применяемой у больных с недиабетической нефропатией. В когорте пациентов с сахарным диабетом и протеинурией/нефротическим синдромом иногда возникает необходимость в применении фибратов в высоких дозах в качестве монотерапии или комбинации со статинами. Это обусловлено наличием тяжелой гипертриглицеридемии. Тем не менее, клинический опыт применения этих лекарственных средств у пациентов с редуцированной СКФ свидетельствует о существовании потенциальной опасности подобной комбинации, что связано не только с риском манифестации рабдомиолиза, но и с высокой вероятностью нарушения почечной функции. Полагают, что мероприятия, направленные на достижение адекватного контроля над гликемией у пациентов с диабетической нефропатией, могут оказывать благоприятное влияние на выраженность сопутствующей гипер- и дислипидемии и редукцию кардиоваскулярного риска (Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel II), 1994; Expert Panel on Detection, Evaluation, And Treatment of High Blood Cholesterol In Adults, 2001).
У пациентов с уровнем ТГ натощак >500 мг/дл (≥5,65 ммоль/л) первичной целью терапии является предотвращение возникновения острого панкреатита — потенциально фатального осложнения в этой когорте лиц. Это достигается посредством использования модификации образа жизни, фибратов и ниацина при редукции ТГ натощак менее указанного выше уровня.
Для пациентов с плазменным содержанием ХС ЛПНП в пределах 100–129 мг/дл (2,57–3,34 ммоль/л) основной целью терапии является редукция этого показателя <100 мг/дл (2,57 ммоль/л), при этом в качестве препарата первой линии должны быть рассмотрены низкие дозы стантинов, назначаемые на фоне общепринятых мероприятий по модификации образа жизни. Аналогичный подход должен быть использован и для больных с ХБП с плазменным содержанием ХС ЛПНП ≥130 мг/дл (3,36 ммоль/л). Достижение целевого уровня ХС ЛПНП <100 мг/дл (2,57 ммоль/л) часто требует назначения статинов в максимально рекомендованных дозах.
При повышении концентрации ТГ ≥200 мг/дл (2,26 ммоль/л) в сочетании с уровнем не-ЛПНП >130 мг/дл (3,36 ммоль/л) основной целью терапии является снижение последней <130 мг/дл. В качестве инициальных гиполипидемических мероприятий следует рассмотреть модификацию образа жизни и применение статинов в низких дозах.
В заключение необходимо отметить, что в отличие от рекомендаций K/DOQI (2003) стратегия гиполипидемической терапии в соответствии с требованиями NCEP ATP III исходит из допущения о том, что для наиболее оптимального улучшения клинических исходов требуется достижение как можно более низких значений ХС ЛПНП. Эти представления нашли свое отражение в модификации целевого уровня ХС ЛПНП для пациентов с высоким кардиоваскулярным риском. Если предпоследняя редакция документа фокусировала усилия на необходимости достижения плазменного содержания ХС ЛПНП <100 мг/дл (2,57 ммоль/л), то недавние обновления консенсуального соглашения содержат более жесткие критерии успешности лечения: ХС ЛПНП должен быть <70 мг/дл (1,81 ммоль/л) (Grundy S.M. et al., 2004). Таким образом, можно сделать вывод, что гиполипидемическая стратегия у пациентов с ХБП должна быть максимально агрессивной и настойчивой. Вместе с тем, вокруг подобного подхода продолжаются дискуссии относительно его экономической целесообразности и безопасности, что, вероятно, требует продолжения исследований в этом направлении.
Гиполипидемические мероприятия в когорте пациентов с метаболическим синдромом, ассоциированным со злокачественными новообразованиями
Метаболический синдром рассматривается как один из наиболее значимых факторов кардиоваскулярного риска (Expert Panel on Detection, Evaluation, And Treatment of High Blood Cholesterol In Adults, 2001; Park Y.W. et al., 2003), а также риска возникновения новообразований различных локализаций (Pothiwala P. et al., 2009). Кроме того, полученные к настоящему времени данные свидетельствуют о том, что радикальное лечение ряда опухолей, в том числе и рака молочной железы, предстательной железы, часто сопровождается возникновением метаболических нарушений, в ряде случаев классифицируемых как метаболический синдром (Keating N.L. et al., 2008). Таким образом, последний представляется в качестве своеобразного модулятора, опосредующего вклад опухолевидных образований и ятрогенных вмешательств в глобальный кардиоваскулярный риск (Grundy S.M. et al., 2005; Boppidi H., Daram S.R., 2008; Solymoss B.C. et al., 2009). Необходимо отметить, что в этом контексте многие эксперты отмечают тенденцию к спекуляциям вокруг длительного применения половых гормонов как основных индукторов возникновения инсулинорезистентности, ожирения, гиперлипидемии, повышения уровня глюкозы натощак и иногда артериальной гипертензии (Castaneda E. et al., 1971; Wortsman J., Soler N.G., 1982; Ahmed M.H. et al., 2005; Cupisti S. et al., 2008). Так, возникновение андроидного ожирения и метаболического синдрома часто связывается с широким применением антиэстрогенов (тамоксифен, ингибиторы ароматазы) при лечении рака молочной железы у женщин и антиандрогенов (аналоги лютеинизирующего рилизинг-фактора) при терапии рака предстательной железы (Chlebowski R.T. et al., 2002; Denham J.W. et al., 2005; D’Amico A.V. et al., 2007). Установлено, что тамоксифен способен оказывать непосредственное негативное влияние в отношении адипогенеза (Nguyen M.C. et al., 2001; Michelsen T.M. et al., 2009), потенцируя возникновение стеатоза печени, гиперлипидемии и ожирения (Bruno S. et al., 2005).
Вместе с тем, не исключается также роль гендерных особенностей, возраста пациентов, характера новообразования, а также наследственных причин возникновения гиперлипидемии (Dunaif A., Thomas A., 2001; Dunaif A., 2006; Regitz-Zagrosek V. et al., 2006). Так, манифестация метаболического синдрома у мужчин часто ассоциируется с дефицитом тестостерона (Lunenfeld B., 2007; Stanworth R.D., Jones T.H., 2009), в том числе индуцированным орфоэктомией (D’Amico A.V. et al., 2007a; b; Dorum A. et al., 2008). Более того, между выраженностью дефицита тестостерона и риском возникновения сахарного диабета 2-го типа установлена прямая взаимосвязь (Traish A.M. et al., 2009). Тем не менее, гормон-модифицирующая терапия ряда новообразований продолжает рассматриваться в качестве основной причины формирования метаболического синдрома в этой популяции пациентов (Cuzick J. et al., 2007; Galvao D.A. et al., 2008).
В соответствии с современными представлениями, вероятность 5-летнего выживания пациентов с документированными опухолями, такими как рак предстательной железы или рак молочной железы у женщин, даже в том случае, когда последние чувствительны к гормон-модифицирующей терапии, значительно ниже, чем у пациентов с метаболическим синдромом (Braga-Basaria M. et al., 2006). В этой связи достижение устойчивой ремиссии является первичной целью терапии. Вместе с тем, учитывая ятрогенный характер формирующегося метаболического синдрома и его негативное влияние в отношении клинических кардиоваскулярных исходов, терапия последнего должна осуществляться в соответствии с общепринятыми рекомендациями, включая модификацию образа жизни, отказ от курения и употребления алкоголя, использование метформина для лечения сахарного диабета 2-го типа, гиполипидемических лекарственных средств в зависимости от характера выявленных нарушений липидного обмена (Chlebowski R.T. et al., 2002; Goodwin P.J., 2008; Hede K., 2008; Ligibel J.A. et al., 2008; Mathur R. et al., 2008; Cohen P., 2009; Martin C.K. et al., 2009).
Стратегия лечения гипер- и дислипидемии у пациентов с ВИЧ-1, получающих АРВТ
У пациентов, инфицированных ВИЧ-1 и получающих АРВТ, достаточно часто (в 70–80% случаев) регистрируются различные формы нарушений липидного обмена, особенно гипертриглицеридемия и гиперхолестеринемия. Причем повышение плазменной концентрации ТГ и общего ХС тесно ассоциируется с манифестацией липодистрофического синдрома, хотя выявленная зависимость и не является абсолютно линейной. Развивающаяся при проведении АРВТ гиперлипидемия является мульфакторным патологическим состоянием, этиопатогенез которого не в полной мере установлен. Существуют предположения, что использование в клинической практике именно определенных АРВП, таких как невирапин, эфавиренз, абакавир, или комбинаций на их основе, оказывает наибольшее влияние в отношении риска возникновения потенциально атерогенной гиперлипидемии у ВИЧ-инфицированных пациентов (Staszewski S. et al., 1999).
Немедикаментозное лечение
В соответствии с действующими клиническими рекомендациями перед началом проведения медикаментозного лечения необходимо идентифицировать не только вторичные (дисфункция щитовидной железы, ХБП, ятрогенные формы и т.п.), но и возможные первичные причины возникновения гиперлипидемии, такие как семейная гиперхолестеринемия, смешанная гиперлипидемия (Dube M.P. et al., 2000). Кроме того, следует проводить традиционные мероприятия, направленные на коррекцию модифицируемых факторов риска, включая отказ от курения и употребления алкоголя, расширение физической активности, адекватное лечение артериальной гипертензии и сахарного диабета. Для женской популяции особенно актуальным является ограничение применения или отказ от использования пероральных контрацептивов как в фертильном возрасте, так и в период менопаузы, даже несмотря на возможные благоприятные изменения липидного профиля вследствие терапии эстрогенами, так как подобный подход может ассоциироваться с повышением риска тромбозов и возникновения опухолей молочной железы. У женщин в перименопаузальный период после экстирпации матки возможность эстрогензаместительной терапии более четко определена соответствующими клиническими соглашениями. Во всех случаях необходимо принимать во внимание риск и ожидаемую пользу от обсуждаемого подхода.
В любой ситуации у ВИЧ-инфицированных пациентов применение комбинаций АРВП (ингибитор обратной транскриптазы + ингибитор внутриклеточных протеаз или два различных ингибитора обратной транскриптазы) ассоциируется с высоким риском возникновения липодистрофии и гиперлипидемии (Montaner J.S. et al., 1998; Moyle G.J., 1999; Murphy R.L. et al., 1999). Однако большинство исследований, в которых были продемонстрированы негативные метаболические эффекты АРВТ, не являлись специально спланированными рандомизированными клиническими исследованиями (Martinez E. et al., 1999; Barreiro P. et al., 2000; Bonnet E. et al., 2000; Opravil M. et al., 2000; Viciana P. et al., 2000; Ruiz L. et al., 2001). В последующем оказалось, что использование только ингибиторов внутриклеточных протеаз вместо ингибиторов обратной транскриптазы существенно снижает вероятность манифестации нарушений липидного обмена, включая изолированную гипертриглицеридемию, что подтверждает в значительной мере ятрогенный характер описываемых изменений (Harris M. et al., 1999; Rozembaum W. et al., 1999; Clumeck N. et al., 2001; Walli R.K. et al., 2001; Estrada V. et al., 2002; Negredo E. et al., 2002). С другой стороны, многие исследователи полагают, что замена относительно старых АРВП или их комбинаций (ритонавир, ритонавир + саквинавир, ритонавир + индинавир) на новые (нелфинавир) способствует уменьшению выраженности уже существующей липодистрофии, но не гарантирует возникновения впервые выявленных форм нарушений липидного обмена в когорте больных, получающих в качестве препаратов выбора новые ингибиторы внутриклеточных протеаз (Duncombe C., 2000; Tebas P. et al., 2000; Domingo P. et al., 2001; Wensing A.M. et al., 2001). Таким образом, модификация образа жизни, лечение коморбидных состояний и соответствующие изменения в режимах АРВТ не обеспечивают в полной мере редукцию риска возникновения гиперлипидемии и липодистрофии у ВИЧ-инфицированных пациентов (Moyle G.J. et al., 2001).
Медикаментозная гиполипидемическая терапия
Фармакологическая гиполипидемическая терапия является рекомендованной стратегией лечения гиперлипидемии, индуцированной применением АРВП в случае недостаточной эффективности диеты, модификации образа жизни и лечения корморбидных состояний (Dube M.P. et al., 2000). Вместе с тем, выбор инициального гиполипидемического препарата может представлять определенные трудности, связанные с потенциальным взаимодействием АРВП и статинов, которые чаще всего рассматриваются как наиболее предпочтительные лекарственные средства при лечении гиперхолестеринемии (Knopp R.H., 1999; Fichtenbaum C.J., Gerber J.G., 2002; Williams D., Feely J., 2002). Так, установлено, что при одновременном применении комбинации ритонавир + саквинавир с симвастатином и ловастатином системная биодоступность последних повышается на 30–59% и 30–47% соответственно вследствие конкурентного антагонизма за сайты связывания на системе цитохрома CYP 3A4 (Williams D., Feely J., 2002). Аналогичным эффектом обладает и аторвастатин (Transon C. et al., 1996; Kantola T. et al., 1998; Palacios R. et al., 2002). Потенциально это может повысить риск возникновения миопатий и рабдомиолиза. С другой стороны, флувастатин, который метаболизируется с участием иных ферментных систем (CYP 2C9), или правастатин, который вообще не подвергается CYP-деградации, имеют более низкий риск возникновения потенциально неблагоприятного взаимодействия с АРВП (Dresser G.K. et al., 2000; Penzak S.R. et al., 2000; Williams D., Feely J., 2002).
Вместе с тем, к настоящему времени доказано их позитивное влияние в отношении редукции риска возникновения кардиоваскулярных событий, в том числе и фатальных, в популяции ВИЧ-инфицированных лиц с сопутствующей гиперлипидемией (Gould A.L. et al., 1998). Таким образом, для пациентов, получающих АРВП, наиболее предпочтительными гиполипидемическими лекарственными средствами группы статинов являются правастатин и флувастатин по 10 мг/сут и 20 мг/сут соответственно (Baldini F. et al., 2000). В то же время использование симвастатина, ловастатина и аторвастатина у ВИЧ-инфицированных пациентов, получающих АРВП, должно быть ограничено.
Фибраты могут иметь больший терапевтический потенциал у пациентов с изолированной гипертриглицеридемией или смешанной гиперлипидемией, особенно учитывая тот факт, что они используют отличную от CYP 3A4 систему деградации, преимущественно ассоциированную с цитохромами CYP 4A, что не приводит к клинически значимому взаимодействию с АРВП (Mastroianni C.M. et al., 1990; Bloomfield Rubins H. et al., 1999; Thomas J.C. et al., 2000; Calza L. et al., 2002). Вместе с тем, комбинированное использование фибратов и статинов у ВИЧ-инфицированных пациентов не рекомендуется из-за опасности потенцирования рисков возникновения миопатии и рабдомиолиза (Dube M.P. et al., 2000). Доказательства благоприятного влияния фибратов в отношении гиперлипидемии у ВИЧ-инфицированных больных представлены для гемфиброзила (1200 мг/сут), безафибрата (400 мг/сут) и фенофибрата (200 мг/сут) (Calza L. et al., 2002). Ниацин, секвестранты желчных кислот и производные ω-3 ненасыщенных жирных кислот не рекомендованы в качестве препаратов первой или второй линий в лечении гиперлипидемии у этой популяции больных (Garg A., Grundy S.M., 1990; Dube M.P. et al., 2000). Целевые уровня общего ХС, ХС ЛПНП, ХС ЛПВП и ТГ определены действующим соглашением National Cholesterol Education Program.
Современные подходы к лечению посттрансплантационной гиперлипидемии
В соответствии с действующими клиническими рекомендациями риск возникновения кардиоваскулярных событий у реципиента донорских органов обусловлен в основном атерогенной гипер- и дислипидемией, артериальной гипертензией и посттрансплантационным сахарным диабетом. Достижение адекватного контроля хотя бы за одним из указанных факторов риска способствует почти 50% редукции риска нейро- и кардиоваскулярной смертности. В то же время необходимо принять во внимание тот факт, что гиперлипидемия, верифицирующаяся у каждого второго реципиента, должна рассматриваться как один из важнейших факторов риска хронической реакции отторжения трансплантата. Причем пациенты, перенесшие ортотопическую трансплантацию сердца, в большей мере подвержены негативному влиянию гиперлипидемии, чем, например, реципиенты донорской печени.
Если NCEP Adult Treatment Panel II (1994) и Panel III (2003) рекомендовали проводить измерение общего ХС и ХС ЛПВП у взрослых пациентов каждые 5 лет, а при верификации дополнительных факторов кардиоваскулярного риска ежегодно, то у реципиентов донорских органов мониторинг липидного профиля плазмы крови необходимо проводить каждые 6 мес после трансплантации (Pedersen T.R., 1995). Причем гиполипидемическая терапия должна быть начата даже в том случае, когда у реципиента выявлено только снижение уровня ХС ЛПВП при нормальных концентрациях общего ХС или ХС ЛПНП. Для более точной оценки величины кардиоваскулярного риска предложены специальные шкалы, позволяющие идентифицировать вероятного кандидата для проведения гиполипидемических мероприятий среди реципиентов (Haq I.U. et al., 1995). В качестве основных стратегий, направленных на повышение вероятности выживания реципиента за счет редукции частоты кардио- и цереброваскулярных событий, применяют диетические ограничения, гиполипидемическую терапию, модификацию образа жизни (отказ от курения и употребления алкоголя), коррекцию факторов риска (уменьшение массы тела, лечение артериальной гипертензии и посттрансплантационного сахарного диабета), а также применение ω-3 ненасыщенных жирных кислот, хотя эфективность последних окончательно не доказана (Nelson J. et al., 1988; Sacks F.M.et al., 1996).
Гиполипидемическая диета
К настоящему времени установлено, что добавление в пищу растительных жиров, замещение ω-6 ненасыщенных жирных кислот ω-3-производными в экспериментальных условиях повышало выживаемость трансплантата (Billiar T.R. et al., 1988; Perez R.V. et al., 1988). Предполагают, что ω-3 ненасыщенные жирные кислоты способны оказывать умеренное иммуномодулирующее действие преимущественно за счет ингибирования синтеза ИЛ-1, ФНО-α, снижения экспрессии антигенов главного комплекса гистосовместимости HLA-DR (Schreiner G.F. et al., 1988; Endres S. et al., 1989), а также препятствовать возникновению атеросклероза в артериях графта (Otto D.A. et al., 1990), способствовать улучшению регионарной гемодинамики в трансплантате, снижая риск возникновения реакций отторжения (Jevnikar A.M. et al., 1988; Kelley V.E. et al., 1989; Sweny P. et al., 1989; Urakaze M. et al., 1989; Homan van der Heide J.J. et al., 1990; Goren A. et al., 1991; Berthoux F.C. et al., 1992; Homan van der Heide J.J. et al., 1992; Homan van der Heide J.J. et al., 1993; Badalamenti S. et al., 1995). Тем не менее, специально спланированных рандомизированных клинических исследований, посвященных этому вопросу, пока не проведено. Существуют данные экспериментальных и клинических исследований, свидетельствующие о позитивном в отношении липидного профиля плазмы крови влиянии специальной диеты, в состав которой были включены соевые протеины. Так, в метаанализе 38 рандомизированных клинических исследований, проведенном J.W. Anderson и соавторами (1995), удалось показать, что обогащенная соевым протеином пища способствует снижению концентрации общего ХС. Вместе с тем редукция ХС ЛПНП оказалась статистически не значимой (Chait A. et al., 1993; Krauss R.M. et al., 1995).
Гиполипидемические лекарственные средства
Выбор инициального гиполипидемического лекарственного средства у реципиентов донорских органов далеко не всегда однозначен. Так, колестирамин представляется оптимальным препаратом для эффективного лечения гиперхолестеринемии у пациентов после трансплантации печени. Однако этот препарат вступает в конкурентные взаимоотношения с циклоспорином на этапе абсорбции. Причем результат подобной интерференции точно неизвестен и требует проведения мониторирования плазменной концентрации циклоспорина в крови. С другой стороны, практически все секвестранты желчных кислот способны приводить к обстипации, что сопровождается повышением ретенции натрия и увеличением плазменного пула ТГ. Ниацин особенно эффективен при смешанных формах гиперлипидемии, но обладает клинически значимой гепатотоксичностью, а также способен индуцировать гиперурикемию и нарушение толерантности к глюкозе. Дериваты фиброевой кислоты, особенно гемфиброзил, способствуют эффективному снижению отношения общий ХС/ХС ЛПВП, что имеет большое значение для пациентов, перенесших трансплантацию почек. Однако последнее обстоятельство лимитирует их применение после трансплантации печени (Kirk J.K., Dupuis R.E., 1995). Таким образом, именно статины, обладающие наиболее оптимальным отношением эффективность/безопасность, стали рассматриваться в качестве кандидатов для проведения гиполипидемической терапии практически во всех когортах реципиентов донорских органов.
Так, было установлено, что у пациентов, перенесших трансплантацию почки и получающих преднизолон в комбинации с азатиоприном, ловастатин способствует существенному снижению концентрации общего ХС и ХС ЛПНП, не оказывая статистически значимого влияния на уровень ХС ЛПВП (Kasiske B.L. et al., 1990). Исследователи отметили хорошую переносимость препарата в дозе 20 мг/сут, отсутствие признаков поражения печени и трансплантата. С другой стороны, существуют сведения, касающиеся возможности повышения риска развития рабдомиолиза у пациентов с ортотопической трансплантацией сердца, получавших комбинацию циклоспорина и ловастатина (Norman D.J. et al., 1988). Хорошую переносимость и высокую гиполипидемическую эффективность правастатина в когорте больных с трансплантированной донорской почкой отметили N. Yoshimura и соавторы (1992). По данным J.A. Kobashigawa и соавторов (1995), у реципиентов донорского сердца, получавших циклоспорин, преднизолон и азатиоприн, отмечали хорошую переносимость правастатина в ранжированных дозах 20–40 мг/сут. Исследователи отметили благоприятное влияние правастатина в отношении риска возникновения реакции отторжения трансплантата. Некоторые эксперты связывают подобный эффект статинов с их способностью угнетать клеточно-зависимую цитотоксичность и функцию NK-клеток (Cutts J.L., Bankhurst A.D., 1990). Флувастатин также продемонстрировал хороший гиполипидемический потенциал в когорте реципиентов донорской почки, способствуя редукции плазменного содержания общего ХС на 13%, ХС ЛПНП на 22%, апo-B-липопротеина на 13% исходного уровня, не оказывая влияния на концентрацию в плазме крови циклоспорина, креатинфосфокиназы, трансаминаз, билирубина и креатинина (Li P.K.T. et al., 1995). При проведении метаанализа 154 рандомизированных клинических исследований (n=3065), посвященных эффективности применения различных гиполипидемических лекарственных средств у реципиентов донорских органов, в том числе и почек, Z.A. Massy и соавторам (1995) удалось показать, что статины в низких дозах отличаются вполне приемлемым уровнем эффективности и безопасности. Вместе с тем, в популяции реципиентов донорской почки с высоким уровнем ТГ и низкой концентрацией ХС ЛПВП в плазме крови достаточно эффективными могут быть и фибраты.
Поскольку терапевтический потенциал четырех статинов (ловастатин, правастатин, симвастатин и флувастатин) у пациентов, перенесших трансплантацию органов, был установлен, определенный интерес представляло проведение прямого сопоставления их эффективности и, особенно, безопасности. Результаты исследования I. Hsu и соавторов (1995) показали, что гиполипидемический потенциал 10 мг симвастатина соответствует 20 мг ловастатина, 20 мг правастатина и 15 мг флувастатина. При формировании посттрансплантационной гиперлипидемии, индуцированной циклоспорином, ловастатин и симвастатин демонстрируют более высокий уровень эффективности, но в то же время правастатин отличается большей безопасностью, особенно в связи с критически низким риском развития миопатии. В этой связи именно он может быть рассмотрен как препарат первой линии при лечении больных этой группы. Комбинированная терапия, включающая статин и гемфиброзил, может быть рекомендована пациентам, не достигшим рекомендованного уровня ХС ЛПНП, а также инициально при тяжелой или смешанной гиперлипидемии. При этом необходимо помнить о возможности повышения риска рабдомиолиза. В то же время, клинически значимые побочные эффекты при применении этой комбинации редки.
Такой агрессивный подход к лечению посттрансплантационной гиперлипидемии во многом объясняется ее исключительной атерогенностью. Предполагается, что у реципиентов донорских органов редукция риска возникновения ИБС при снижении содержания ХС ЛПНП на 1 ммоль/л может быть даже выше, чем в общей популяции (Lipid Research Clinics Program, 1984). С другой стороны, адекватный контроль за гиперлипидемией может способствовать снижению риска реакции отторжения трансплантата и, возможно, снижению доз глюкокортикостероидов, роль которых в индукции посттрансплантационной гиперлипидемии и сахарного диабета общеизвестна (Hricik D.E. et al., 1992; Hariharan S. et al., 1993; Ingulli E. et al., 1993). В то же время попытки снижения суточной дозы преднизолона или других иммуносупрессантов часто оказываются безуспешными, поскольку негативно отражаются на риске реакции отторжения трансплантата (Hricik D.E., Schulak J.A., 1993; Hricik D.E., 1994). В этих ситуациях статины позволяют не только снизить кардиоваскулярный риск, ассоциированный с редукцией плазменного содержания атерогенных фракций липопротеидов, но и в некоторой мере стабилизировать ситуацию с иммунологическим конфликтом (Reisman L. et al., 1990; Pirsch J.D. et al., 1991; Miller L.W., 1992; Hricik D.E. et al., 1993; Padbury R.T. et al., 1993; Ratcliffe P.J. et al., 1993; McDiarmid S.V. et al., 1995). Многие исследователи предпочитают в этих ситуация рекомендовать альтернативную схему приема глюкокортикостероидов или иных иммуносупрессоров, таких как микофеноловая кислота, такролимус, на фоне ежедневного применения комбинированной гиполипидемической терапии (Curtis J.J. et al., 1982; Cattran D.C. et al., 1979).
Гиперлипидемия у пациентов, перенесших трансплантацию почки и поджелудочной железы
В настоящее время трансплантация почки и поджелудочной железы рассматривается как наиболее оптимальная процедура для пациентов с терминальной почечной дисфункцией, развившейся вследствие сахарного диабета 1-го типа. Многочисленные экспериментальные и клинические исследования продемонстрировали благоприятное влияние указанного вида трансплантации в отношении липидного профиля плазмы крови в этой когорте больных (Pyke D., 1991; Hughes T.A. et al., 1995). Ожидается, что решение некоторых технических аспектов позволит расширить показания к проведению этой процедуры (Jindal R.M., 1994), тем более что одной из основных причин наступления летального исхода после успешной трансплантации являются инфаркт миокарда и внезапная сердечная смерть (Canner P.L. et al., 1986; Amsterdam E.A. et al., 1994; Superko H.R., Krauss R.M., 1994; Deedwania P.C. et al., 1997). К настоящему времени получены ограниченные сведения, касающиеся благоприятного влияния некоторых статинов (ловастатин, правастатин) на выживаемость в этой когорте больных (Otto D.A. et al., 1990).
Таким образом, необходимо отметить, что характер и тяжесть посттрансплантационной гиперлипидемии может отличаться у реципиентов, перенесших различные виды трансплантационных процедур. В частности, это может объясняться особенностями проводимой в каждом конкретном случае иммуносупрессивной терапии (Amsterdam E.A. et al., 1994; McManus B.M. et al., 1994; Imagawa D.K., et al., 1996). В целом гиполипидемическая терапия, независимо от тяжести посттрансплантационной гиперлипидемии, может способствовать улучшению клинических исходов, в том числе связанных со снижением риска возникновения реакции отторжения трансплантата. Вместе с тем, вопрос о том, насколько агрессивным должен быть подход к снижению уровня ХС ЛПНП, окончательно не решен (Jacobs D. et al., 1992; Boushey C.J. et al., 1995) и в настоящее время чаще всего зависит от субъективного мнения врача (Heitmann B.L. et al., 1995).
Литература
- Adams H.P. Jr., Adams R.J., Brott T. et al.; Stroke Council of the American Stroke Association. (2003) Guidelines for the early management of patients with ischemic stroke: a scientific statement from the Stroke Council of the American Stroke Association. Stroke, 34: 1056–1083.
- Ahmed M.H., Saad R.A., Osman M.M. (2005) Ezetimibe: effective and safe treatment for dyslipidaemia associated with nonalcoholic fatty liver disease. Response to: Toth P.P., Davidson M.H. Simvastatin and ezetimibe: combination therapy for the management of dyslipidaemia. Expert Opin. Pharmacother, 6: 131–139.
- Albers G.W., Caplan L.R., Easton J.D. et al.; TIA Working Group. (2002) Transient ischemic attack: proposal for a new definition. N. Engl. J. Med., 347: 1713–1716.
- Albers G.W., Hart R.G., Lutsep H.L. et al. (1999) Supplement to the guidelines for the management of transient ischemic attacks: a statement from the Ad Hoc Committee on Guidelines for the Management of Transient Ischemic Attacks, Stroke Council, American Heart Association. Stroke, 30: 2502–2511.
- Albert M.A., Danielson E., Rifai N. et al. (2001) Effect of statin therapy on C-reactive protein levels: the pravastatin inflammation/ CRP evaluation (PRINCE): a randomized trial and cohort study. JAMA, 286: 64–70.
- Amarenco P., Bogousslavsky J., Callahan A.S. et al.; SPARCL Investigators (2003) Design and baseline characteristics of the Stroke Prevention by Aggressive Reduction in Cholesterol Levels (SPARCL) study. Cerebrovasc Dis., 16: 389–395.
- Amarenco P., Tonkin A.M. (2004) Statins for stroke prevention: disappointment and hope. Circulation, 109 (suppl. 1): III-44–III-49.
- Amsterdam E.A., Hyson D., Kappagoda C.T. et al. (1994) Nonpharmacological therapy for coronary artery atherosclerosis: results of primary and secondary prevention trials. Am. Heart J., 128: 1344–1352.
- Anderson J.W., Johnstone B.M., Cook-Newell M.E. (1995) Meta-analysis of the effects of soya protein intake on serum lipids. N. Engl. J. Med., 333: 276–282.
- Andrews T.C., Ballantyne C.M., Hsia J.A. et al. (2001) Achieving and maintaining National Cholesterol Education Program low-density lipoprotein cholesterol goals with five statins. Am. J. Med., 111: 185–91.
- Anker S.D. et al. (2006) Statin use and survival in patients with chronic heart failure—results from two observational studies with 5,200 patients. Int. J. Cardiol., 112: 234–242.
- Appel G.B., Blum C.B., Chien S. et al. (1985) The hyperlipidemia of the nephrotic syndrome. Relation to plasma albumin concentration, oncotic pressure, and viscosity. N. Engl. J. Med., 312: 1544–8.
- Aronow W.S., Ahn C. (2002) Frequency of congestive heart failure in older persons with prior myocardial infarction and serum low-density lipoprotein cholesterol > or =125 mg/dL treated with statins versus no lipid-lowering drug. Am. J. Cardiol., 90: 147–149.
- Attman P.O., Nyberg G., William-Olsson T. et al. (1992) Dyslipoproteinemia in diabetic renal failure. Kidney Int., 42: 1381–1389.
- Badalamenti S., Salerno F., Lorenzano E. et al. (1995) Renal effects of dietary supplementation with fish oil in cyclosporine-treated liver transplant recipients. Hepatology, 22: 1695–701.
- Baldini F., Di Giambenedetto S., Cingolani A. et al. (2000) Efficacy and tolerability of pravastatin for the treatment of HIV-1 protease inhibitor-associated hyperlipidaemia: a pilot study. AIDS, 14: 1660–1662.
- Barreiro P., Soriano V., Blanco F. et al. (2000) Risks and benefits of replacing protease inhibitors with nevirapine in patients with long-term successful triple combinations. In: Seventh Conference on Retroviruses and Opportunistic Infections, San Francisco, CA, January 30–February 2, 2000 [Abstract 537].
- Bates K., Ruggeroli C.E., Goldman S. et al. (2002) Simvastatin restores endothelial NO-mediated vasorelaxation in large arteries after myocardial infarction. Am. J. Physiol. Heart Circ. Physiol., 283: H768–H775.
- Batin P., Wickens M., McEntegart D. et al. (1995) The importance of abnormalities of liver function tests in predicting mortality in chronic heart failure. Eur. Heart J., 16: 1613–1618.
- Bays H., McKenney J., Davidson M. (2005) Torcetrapib/atorvastatin combination therapy. Expert Rev. Cardiovasc. Ther., 3: 789–820.
- Beckman J.A., Liao J.K., Hurley S. et al. (2004) Atorvastatin restores endothelial function in normocholesterolemic smokers independent of changes in low-density lipoprotein. Circ. Res., 95: 217–223.
- Beggs P.W., Clark D.W., Williams S.M. et al. (1999) A comparison of the use, effectiveness and safety of bezafibrate, gemfibrozil and simvastatin in normal clinical practice using the New Zealand Intensive Medicines Monitoring Programme (IMMP). Br. J. Clin. Pharmacol., 47: 99–104.
- Berger J., Moller D.E. (2002) The mechanisms of action of PPARs. Annu. Rev. Med., 53: 409–435.
- Berthold H.K., Naini A., Di Mauro S. et al. (2006) Effect of ezetimibe and/or simvastatin on coenzyme Q10 levels in plasma: a randomised trial. Drug Saf, 29: 703–712.
- Berthoux F.C., Guerin C., Burgard G. et al. (1992) One-year randomized controlled trial with omega-3 fatty acid-fish oil in clinical renal transplantation. Transplant. Proc., 24: 2578–2582.
- Betteridge J.D., Gibson M.; ANDROMEDA study investigators (2004) Effect of rosuvastatin and atorvastatin on LDL-C and CRP levels in patients with type 2 diabetes: results of the ANDROMEDA study. 74th European Atherosclerosis Society Congress 2004. Atherosclerosis, Suppl. 5: 107–108, abstract M.464.
- Bianchi S., Bigazzi R., Caiazza A. et al. (2003) A controlled, prospective study of the effects of atorvastatin on proteinuria and progression of kidney disease. Am. J. Kidney Dis., 41: 565–570.
- Bianchi S., Bigazzi R., Campese V.M. (1999) Microalbuminuria in essential hypertension: significance, pathophysiology, and therapeutic implications. Am. J. Kidney Dis., 34: 973–995.
- Billiar T.R., Bankey P.E., Svingen B.A. et al. (1988) Fatty acid intake and Kupfer cell function: fish oil alters eicosanoid and monokine production to endotoxin stimulation. Surgery, 104: 343–349.
- Birjmohun R.S., Hutten B.A., Kastelein J.J. et al. (2005) Efficacy and safety of high-density lipoprotein cholesterol-increasing compounds: a meta-analysis of randomized controlled trials. J. Am. Coll. Cardiol., 45: 185–197.
- Blanco-Colio L.M., Tunon J., Martin-Ventura J.L. et al. (2003) Antiinflammatory and immunomodulatory effects of statins. Kidney Int., 63: 12–23.
- Bleske B.E., Nicklas J.M., Bard R.L. et al. (2006) Neutral effect on markers of heart failure, inflammation, endothelial activation and function, and vagal tone after high-dose HMG-CoA reductase inhibition in non-diabetic patients with non-ischemic cardiomyopathy and average low-density lipoprotein level. J. Am. Coll. Cardiol., 47: 338–341.
- Bleske B.E., Willis R.A., Anthony M. et al. (2001) The effect of pravastatin and atorvastatin on coenzyme Q10. Am. Heart. J., 142: E2.
- Bloomfield H.E. (2006) The role of fibrates in a statin world. Arch. Intern. Med., 166: 715–716.
- Bloomfield Rubins H., Davenport J., Babikian V. et al.; VA-HIT Study Group. (2001) Reduction in stroke with gemfibrozil in men with coronary heart disease and low HDL cholesterol: the Veterans Affairs HDL Intervention Trial (VA-HIT). Circulation, 103: 2828–2833.
- Bloomfield Rubins H., Robins S.J., Collins D. et al. (1999) Gemfibrozil for the secondary prevention of coronary heart disease in men with low levels of high-density lipoprotein cholesterol. N. Engl. J. Med., 341: 410–418.
- Bonetti P.O., Lerman L.O., Napoli C. et al. (2003) Statin effects beyond lipid lowering — are they clinically relevant? Eur. Heart J., 24: 225–248.
- Bonnet E., Lepec R., Bluteau M. et al. (2000) Evolution of lipodystrophy syndrome and lipidic profile in HIV patients after switching from protease inhibitors to efavirenz. In: Seventh Conference on Retroviruses and Opportunistic Infections, San Francisco, California, January 30–February 4, 2000 [Abstract 49].
- Boppidi H., Daram S.R. (2008) Nonalcoholic fatty liver disease: hepatic manifestation of obesity and the metabolic syndrome. Postgrad. Med., 120: E01–07.
- Boushey C.J., Beresford S.A., Omenn G.S. et al. (1995) A quantitative assessment of plasma as a risk factor for vascular disease: probable benefits of increasing folic acid intakes. JAMA, 274: 1049–1057.
- Braga-Basaria M., Dobs A.S., Muller D.C. et al. (2006) Metabolic syndrome in men with prostate cancer undergoing long-term androgen-deprivation therapy. J. Clin. Oncol., 24: 3979–3983.
- Brenner B.M., Cooper M.E., de Zeeuw D. et al. (2001) Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy. N. Engl. J. Med., 345: 861–869.
- Briel M., Ferreira-Gonzalez I., You J.J. et al. (2009) Association between change in high density lipoprotein cholesterol and cardiovascular disease morbidity and mortality: systematic review and meta-regression analysis. BMJ, 338: b92–b92.
- Brousseau M.E., Schaefer E.J., Wolfe M.L. et al. (2004) Effects of an inhibitor of cholesteryl ester transfer protein on HDL cholesterol. N. Engl. J. Med., 350: 1505–1515.
- Bruno S., Maisonneuve P., Castellana P. et al. (2005) Incidence and risk factors for non-alcoholic steatohepatitis: prospective study of 5408 women enrolled in Italian tamoxifen chemoprevention trial. BMJ, 330: 932.
- Burnett J.R. (2005) Torcetrapib + atorvastatin (Pfizer). Curr Opin Investig Drugs, 6: 944–950.
- Calza L., Manfredi R., Chiodo F. (2002) Use of fibrates in the management of hyperlipidemia in HIV-infected patients receiving HAART. Infection, 30: 26–31.
- Canner P.L., Berge K.G., Wenger N.K. et al. (1986) Fifteen year mortality in Coronary Drug Project patients: long-term benefit with niacin. J. Am. Coll. Cardiol., 8: 1245–1255.
- Canner P.L., Furberg C.D., McGovern M.E. (2006) Benefits of niacin in patients with versus without the metabolic syndrome and healed myocardial infarction (from the Coronary Drug Project). Am. J. Cardiol., 97: 477–479.
- Cannon C.P., Braunwald E., McCabe C.H. et al. (2004) Pravastatin or atorvastatin evaluation and infection therapy-thrombolysis in myocardial infarction 22 investigators. Intensive versus moderate lipid lowering with statins after acute coronary syndromes. N. Engl. J. Med., 350: 1495–504.
- Casani L. et al. (2005) Pravastatin reduces thrombogenicity by mechanisms beyond plasma cholesterol lowering. Thromb Haemost, 94: 1035–1041.
- Castaneda E., Perez A.E., Guillen M.A. et al. (1971) Metabolic studies in a patient with testicular feminization syndrome. Am. J. Obstet. Gynecol., 110: 1002–1007.
- Cattran D.C., Steiner G., Wilson D.R. et al. (1979) Hyperlipidemia after renal transplantation: natural history and pathophysiology. Ann. Intern. Med., 91: 554–559.
- Cavigiolio G., Geier E. G., Shao B. et al. (2010) Exchange of apolipoprotein A-I between lipid-associated and lipid-free states. A potential target for oxidative generation of dysfunctional high density lipoproteins. J. Biol. Chem., 285: 18847–18857.
- Chait A., Brunzell J.D., Denke M.A. et al. (1993) Rationale of the diet-heart statement of the American Heart Association. Report of the Nutrition Committee. Circulation, 88(6): 3008–3029.
- Chan A.W., Bhatt D.L., Chew D.P. et al. (2002) Early and sustained survival benefit associated with statin therapy at the time of percutaneous coronary intervention. Circulation, 105: 691–696.
- Chapman M.J., Le Goff W., Guerin M. et al. (2010) Cholesteryl ester transfer protein: at the heart of the action of lipid-modulating therapy with statins, fibrates, niacin, and cholesteryl ester transfer protein inhibitors. Eur. Heart J., 31: 149–164.
- Chlebowski R.T., Aiello E., McTiernan A. (2002) Weight loss in breast cancer patient management. J. Clin. Oncol., 20: 1128–1143.
- Choi B.G., Vilahur G., Yadegar D. et al. (2006) The role of high-density lipoprotein cholesterol in the prevention and possible treatment of cardiovascular diseases. Curr. Mol. Med., 6: 571–587.
- Cholesterol Treatment Trialists’ Collaborators (2005) Efficacy and safety of cholesterol-lowering treatment: prospective meta-analysis of data from 90056 participants in 14 randomised trials of statins. Lancet, 366: 1267–1278.
- Christ M., Klima T., Grimm W. et al. (2006) Prognostic significance of serum cholesterol levels in patients with idiopathic dilated cardiomyopathy. Eur. Heart J., 27: 691–699.
- Christopher C.P. (2005) The IDEAL cholesterol: lower is better. JAMA, 294: 2492–2494.
- Cleland J.G., Daubert J.C., Erdmann E. et al. (2005) The effect of cardiac resynchronization on morbidity and mortality in heart failure. N. Engl. J. Med., 352: 1539–1549.
- Cleland J.G., Findlay I., Jafri S. et al. (2004) The Warfarin/Aspirin Study in Heart failure (WASH): a randomized trial comparing antithrombotic strategies for patients with heart failure. Am. Heart J., 148: 157–164.
- Cleland J.G., Swedberg K., Follath F. et al. (2003) The EuroHeart Failure survey programme-a survey on the quality of care among patients with heart failure in Europe. Part 1: patient characteristics and diagnosis. Eur. Heart J., 24: 442–463.
- Cleland J.G., Coletta A.P., Nikitin N.P. et al. (2006) Clinical trials update from the American College of Cardiology: Darbepoetin alfa, ASTEROID, UNIVERSE, paediatric carvedilol, UNLOAD and ICELAND. Eur. J. Heart Fail., 8: 326–329.
- Coronary Drug Project Study Group (1975) Clofibrate and niacin in coronary heart disease. JAMA, 231: 360–381.
- Clumeck N., Goebel F., Rozenbaum W. et al. (2001) Simplification with abacavir-based triple nucleoside therapy versus continued protease inhibitor-based highly active antiretroviral therapy in HIV-1-infected patients with undetectable plasma HIV-1 RNA. AIDS, 15: 1517–1526.
- Cohen P. (2009) Metformin for the prevention of androgen deprivation induced metabolic syndrome, obesity and type 2 diabetes. Med. Hypotheses, 72: 227–228.
- Collins R., Armitage J., Parish S. et al. (2003) MRC/BHF Heart Protection Study of cholesterol-lowering with simvastatin in 5963 people with diabetes: a randomised placebo-controlled trial. Lancet, 361: 2005–2016.
- Collins R., Armitage J., Parish S. et al.; Heart Protection Study Collaborative Group (2004) Effects of cholesterol-lowering with simvastatin on stroke and other major vascular events in 20536 people with cerebrovascular disease or other high-risk conditions. Lancet, 363: 757–767.
- Cowburn P.J., Cleland J.G., Coats A.J. et al. (1998) Risk stratification in chronic heart failure. Eur. J. Heart, 19: 696–710.
- Culleton B.F., Larson M.G., Wilson P.W. et al. (1999) Cardiovascular disease and mortality in a community-based cohort with mild renal insufficiency. Kidney Int., 56: 2214–2219.
- Cupisti S., Kajaia N., Dittrich R. et al. (2008) Body mass index and ovarian function are associated with endocrine and metabolic abnormalities in women with hyperandrogenic syndrome. Eur. J. Endocrinol., 158: 711–719.
- Curtis J.J., Galla J.H., Woodford S.H. et al. (1982) Effect of alternate-day prednisone on plasma lipids in renal transplant recipients. Kidney Int., 22: 42–47.
- Cutts J.L., Bankhurst A.D. (1990) Reversal of lovastatinmediated inhibition of natural killer cell cytotoxicity by interleukin 2. J. Cell. Physiol., 145: 244–52.
- Cuzick J., Ambroisine L., Davidson N. et al. (2007a) Use of luteinising-hormone-releasing hormone agonists as adjuvant treatment in premenopausal patients with hormone-receptor-positive breast cancer: a meta-analysis of individual patient data from randomised adjuvant trials. Lancet, 369: 1711–1723.
- D’Amico A.V., Denham J.W., Bolla M. et al. (2007b) Short- vs long-term androgen suppression plus external beam radiation therapy and survival in men of advanced age with node-negative high-risk adenocarcinoma of the prostate. Cancer, 109: 2004–2010.
- D’Amico A.V., Renshaw A.A., Loffredo B. et al. (2007) Duration of testosterone suppression and the risk of death from prostate cancer in men treated using radiation and 6 months of hormone therapy. Cancer, 110: 1723–1728.
- Davidson M., Meyer P.M., Haffner S. et al. (2008) Increased high-density lipoprotein cholesterol predicts the pioglitazone-mediated reduction of carotid intima-media thickness progression in patients with type 2 diabetes mellitus. Circulation, 117: 2123–2130.
- Davis H.R. Jr., Compton D.S., Hoos L. et al. (2001) Ezetimibe, a potent cholesterol absorption inhibitor, inhibits the development of atherosclerosis in ApoE knockout mice. Arterioscler. Thromb. Vasc. Biol., 21: 2032–2038.
- de Grooth G.J., Kuivenhoven J.A., Stalenhoef A.F. et al. (2002) Efficacy and safety of a novel cholesteryl ester transfer protein inhibitor, JTT-705, in humans: a randomized phase II dose-response study. Circulation, 105: 2159–2165.
- de Lemos J.A., Blazing M.A., Wiviott S.D. et al. (2004) A to Z Investigators: Early intensive vs a delayed conservative simvastatin strategy in patients with acute coronary syndromes: phase Z of the A to Z trial. JAMA, 292: 1307–1316.
- Deedwania P.C., Amsterdam E.A., Vagelos R.H.; California Cardiology Working Group on Post-MI Management (1997) Evidence-based, cost-effective risk stratification and management after myocardial infarction. California Cardiology Working Group on Post-MI Management. Arch. Intern. Med., 157: 273–280.
- Deedwania P.C., Hunninghake D.B., Bays H.E. et al.; STELLAR Study Group (2005) Effects of rosuvastatin, atorvastatin, simvastatin, and pravastatin on atherogenic dyslipidemia in patients with characteristics of the metabolic syndrome. Am. J. Cardiol., 95: 360–366.
- Denham J.W., Steigler A., Lamb D.S. et al. (2005) Short-term androgen deprivation and radiotherapy for locally advanced prostate cancer: results from the Trans-Tasman Radiation Oncology Group 96.01 randomised controlled trial. Lancet Oncol., 6: 841–850.
- Despres J.P., Lemieux I., Robins S.J. (2004) Role of fibric acid derivatives in the management of risk factors for coronary heart disease. Drugs, 64: 2177–2198.
- Despres J.P. (2004) Rimonabant in obesity. Presented at the American College of Cardiology Scientific Session 2004. March 9, New Orleans, La. Late Breaking Clinical Trials II.
- Dickinson M.G., Ip J.H., Olshansky B. et al. (2007) Statin use was associated with reduced mortality in both ischemic and nonischemic cardiomyopathy and in patients with implantable defibrillators. Am. Heart J., 153: 573–578.
- Domingo P., Matias-Guiu X., Pujol R.M. et al. (2001) Switching to nevirapine decreases insulin levels but does not improve subcutaneous adipocyte apoptosis in patients with highly active antiretroviral therapy-associated lipodystrophy. J. Infect. Dis., 184: 1197–1201.
- Dorum A., Tonstad S., Liavaag A.H. et al. (2008) Bilateral oophorectomy before 50 years of age is significantly associated with the metabolic syndrome and Framingham risk score: a controlled, population-based study (HUNT-2). Gynecol. Oncol., 109: 377–383.
- Downs J.R., Clearfield M., Weis S. et al. (1998) Primary prevention of acute coronary events with lovastatin in men and women with average cholesterol levels: results of AFCAPS/TexCAPS. Air Force/Texas Coronary Atherosclerosis Prevention Study. JAMA, 279: 1615–1622.
- Dresser G.K., Spence J.D., Bailey D.G. (2000) Pharmacokinetic-pharmacodynamic consequences and clinic relevance of cytochrome P450 3A4 inhibition. Clin. Pharmacokinet., 38: 41–57.
- Dube M.P., Sprecher D., Henry W.K. et al. (2000) Preliminary guidelines for the evaluation and management of dyslipidemia in adults infected with human immunodeficiency virus and receiving antiretroviral therapy: recommendations of the Adult AIDS Clinical Trial Group Cardiovascular Disease Focus Group. Clin. Infect. Dis., 31: 1216–1224.
- Dunaif A. (2006) Insulin resistance in women with polycystic ovary syndrome. Fertil Steril., 86(Suppl. 1): S13–14.
- Dunaif A., Thomas A. (2001) Current concepts in the polycystic ovary syndrome. Annu. Rev. Med., 52: 401–419.
- Duncombe C. (2000) Reversal of hyperlipidemia and lipodystrophy in patients switching therapy to nelfinavir. J. Acquir Immune Defic. Syndr., 24: 78–79.
- Elkeles R.S., Diamond J.R., Poulter C. et al. (1998) Cardiovascular outcomes in type 2 diabetes. A double-blind placebo-controlled study of bezafibrate: the St. Mary’s, Ealing, Northwick Park Diabetes Cardiovascular Disease Prevention (SENDCAP) Study. Diabetes Care, 21: 641–648.
- Emberson J.R., Ng L.L., Armitage J. et al.; Heart Protection Study Collaborative Group (2007) N-terminal Pro-B-type natriuretic peptide, vascular disease risk, and cholesterol reduction among 20,536 patients in the MRC/BHF heart protection study. J. Am. Coll. Cardiol., 49: 311–319.
- Endres S., Ghorbani R., Kelley V.E. et al. (1989) The effect of dietary supplementation with n-3 polyunsaturated fatty acids on the synthesis of interleukin-I and tumor necrosis factor by mononuclear cells. N. Engl. J. Med., 320: 265–271.
- Ericsson C.G., Nilsson J., Grip L. et al. (1997) Effect of bezafibrate treatment over five years on coronary plaques causing 20% to 50% diameter narrowing (The Bezafibrate Coronary Atherosclerosis Intervention Trial (BECAIT)). Am. J. Cardiol., 8: 1125–1129.
- Estrada V., De Villar N.G., Larrad M.T. et al. (2002) Long-term metabolic consequences of switching from protease inhibitors to efavirenz in therapy for human immunodeficiency virus-infected patients with lipoatrophy. Clin. Infect. Dis., 35: 69–76.
- Expert Panel on Detection, Evaluation, And Treatment of High Blood Cholesterol In Adults (2001) Executive Summary of The Third Report of The National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, And Treatment of High Blood Cholesterol In Adults (Adult Treatment Panel III). JAMA, 285: 2486–2497.
- Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel II) (1994) National Cholesterol Education Program. Second Report of the Expert Panel on Detection, Evaluation, and Treatment of High Blood Chloesterol in Adults (Adult Treatment Panel II). Circulation, 89: 1333–445.
- Farnier M. (2003) Combination therapy with an HMG-CoA reductase inhibitor and a fibric acid derivative: a critical review of potential benefits and drawbacks. Am. J. Cardiovasc. Drugs., 3: 169–178.
- Farnier M., Salko T., Isaacsohn J.L. et al. (2003) Effects of baseline level of triglycerides on changes in lipid levels from combined fluvastatin + fibrate (bezafibrate, fenofibrate, or gemfibrozil). Am. J. Cardiol., 92: 794–797.
- Fazio S., Linton M.F. (2004) The role of fibrates in managing hyperlipidemia: mechanisms of action and clinical efficacy. Curr. Atheroscler. Rep., 6: 148–157.
- Fedder D.O., Koro C.E., L’Italien G.J. (2002) New National Cholesterol Education Program III guidelines for primary prevention lipid-lowering drug therapy: projected impact on the size, sex, and age distribution of the treatment eligible population. Circulation., 105: 152–156.
- Ferns G.A. (2003) Differential effects of statins on serum CRP levels: implications of recent clinical trials. Atherosclerosis, 169: 349–351.
- Fichtenbaum C.J., Gerber J.G. (2002) Interactions between antiretroviral drugs and drugs used for the therapy of the metabolic complications encountered during HIV infection. Clin. Pharmacokinet., 41: 1195–1211.
- Fisman E.Z., Adler Y., Tenenbaum A. (2005) Statins research unfinished saga: desirability versus feasibility. Cardiovasc. Diabetol., 4: 8.
- Foley R.N., Parfrey P.S., Sarnak M.J. (1998) Epidemiology of cardiovascular disease in chronic renal disease. J. Am. Soc. Nephrol., 9(12 Suppl.): S16–S23.
- Folkeringa R.J., van Kraaij D.J., Tieleman R.G. et al. (2006) Statins associated with reduced mortality in patients admitted for congestive heart failure. J. Card. Fail., 12: 134–138.
- Folkers K., Langsjoen P., Willis R. et al. (1990) Lovastatin decreases coenzyme Q levels in humans. Proc. Natl. Acad. Sci. USA, 87: 8931–8934.
- Foody J.M., Shah R., Galusha D. et al. (2006) Statins and mortality among elderly patients hospitalized with heart failure. Circulation, 113: 1086–1092.
- Franken A.A.M., Wolffenbuttel B.H.R., Vincent H.H. (2004) On behalf of the Dutch CORALL study group. Cholesterol-lowering effects of rosuvastatin compared with atorvastatin in patients with type 2 diabetes. 74th European Atherosclerosis Society Congress 2004. Atherosclerosis, (Suppl. 5): 118, abstract M.513.
- Frick M.H., Elo O., Haapa K. et al. (1987) Helsinki Heart Study: primary-prevention trial with gemfibrozil in middle-aged men with dyslipidemia. Safety of treatment, changes in risk factors, and incidence of coronary heart disease. N. Engl. J. Med., 317: 1237–1245.
- Fried L.F., Orchard T.J., Kasiske B.L. (2001) Effect of lipid reduction on the progression of renal disease: a meta-analysis. Kidney Int., 59: 260–269.
- Fruchart J.C. (2001) Peroxisome proliferator-activated receptor-alpha activation and high-density lipoprotein metabolism. Am. J. Cardiol., 88(12A): 24N–29N.
- Fruchart J.C., Staels B., Duriez P. (2001) The role of fibric acids in atherosclerosis. Curr. Atheroscler. Rep., 3: 83–92.
- Fuller S.J., Gillespie-Brown J., Sugden P.H. (1998) Oncogenic src, raf, and ras stimulate a hypertrophic pattern of gene expression and increase cell size in neonatal rat ventricular myocytes. J. Biol. Chem., 273: 18146–18152.
- Funder J.W. (2010) Aldosterone, sodium, and hypertension: lessons from torcetrapib? Hypertension, 55: 221–223.
- Galvao D.A., Newton R.U., Taaffe D.R. et al. (2008) Can exercise ameliorate the increased risk of cardiovascular disease and diabetes associated with ADT? Nat. Clin. Pract. Urol., 5: 306–307.
- Ganji S.H., Tavintharan S., Zhu D. et al. (2004) Niacin noncompetitively inhibits DGAT2 but not DGAT1 activity in HepG2 cells. J. Lipid. Res., 45: 1835–1845.
- Garg A., Grundy S.M. (1990) Nicotinic acid as therapy for dyslipidemia in non-insulin-dependent diabetes mellitus. JAMA, 264: 723–726.
- Gavish D., Leibovitz E., Shapira I. et al. (2000) Bezafibrate and simvastatin combination therapy for diabetic dyslipidaemia: efficacy and safety. J. Intern. Med., 247: 563–569.
- Glynn R.J., Danielson E., Fonseca F.A.H. et al. (2009) A randomized trial of rosuvastatin in the prevention of venous thromboembolism. N. Engl. J. Med., 360: 1851–1861.
- Go A.S., Lee W.Y., Yang J. et al. (2006) Statin therapy and risks for death and hospitalization in chronic heart failure. JAMA, 296: 2105–2111.
- Goldberg R.B., Mellies M.J., Sacks F.M. et al. (1998) Cardiovascular events and their reduction with pravastatin in diabetic and glucose-intolerant myocardial infarction survivors with average cholesterol levels: subgroup analyses in the Cholesterol and Recurrent Events (CARE) trial: The Care Investigators. Circulation, 98: 2513–2519.
- Goldstein L.B., Adams R., Becker K. et al. (2001) Primary prevention of ischemic stroke: a statement for healthcare professionals from the Stroke Council of the American Heart Association. Circulation, 103: 163–182.
- Goodwin P.J. (2008) Insulin in the adjuvant breast cancer setting: a novel therapeutic target for lifestyle and pharmacologic interventions? J. Clin. Oncol., 26: 833–834.
- Gorelick P.B. (2002) Stroke prevention therapy beyond antithrombotics: unifying mechanisms in ischemic stroke pathogenesis and implications for therapy: an invited review. Stroke, 33: 862–875.
- Goren A., Stankiewicz H., Goldstein R. et al. (1991) Fish oil treatment of hyperlipidemia in children and adolescents receiving renal replacement therapy. Pediatrics, 88: 265–268.
- Gould A.L., Rossouw J.E., Santanello N.C. et al. (1998) Cholesterol reduction yields clinical benefits: impact of statin trials. Circulation, 97: 946–952.
- Grady D., Wenger N.K., Herrington D. et al. (2000) Postmenopausal hormone therapy increases risk for venous thromboembolic disease. Ann. Intern. Med., 132: 689–696.
- Groop L.C. (1999) Insulin resistance: the fundamental trigger of type 2 diabetes. Diabetes Obes. Metab., (Suppl. 1): S1–S7.
- Grundy S.M., Cleeman J.I., Daniels S.R. et al. (2005) Diagnosis and management of the metabolic syndrome: an American Heart Association/National Heart, Lung, and Blood Institute Scientific Statement. Circulation, 112: 2735–2752.
- Grundy S.M., Cleeman J.I., Merz C.N. et al.; National Heart, Lung and Blood Institute; American College of Cardiology Foundation; American Heart Association (2004) Implications of recent clinical trials for the National Cholesterol Education Program Adult Treatment Panel III guidelines. Circulation, 110: 227–39.
- Hackam D.G., Mamdani M., Li P. et al. (2006) Statins and sepsis in patients with cardiovascular disease: a population-based cohort analysis. Lancet, 367: 413–418.
- Hamaad A., Sosin M., Lip G.Y. et al. (2005) Short-term adjuvant atorvastatin improves frequency domain indices of heart rate variability in stable systolic heart failure. Cardiovasc. Drugs. Ther., 19: 183–187.
- Haq I.U., Jackson P.R., Yeo W.W. et al. (1995) Sheffield risk and treatment table for cholesterol lowering for primary prevention of coronary disease. Lancet, 346: 1467–1471.
- Hariharan S., Schroeder T.J., Weiskittel P. et al. (1993) Prednisone withdrawal in HLA identical and haplotypematched liver-related donor and cadaver renal transplant recipients. Kidney Int., 44(Suppl.): S730–735.
- Harris M., Larsen G., Bell M. et al. (1999) Replacing a protease inhibitor with efavirenz form management of protease inhibitor toxicity. In: First International Workshop on Adverse Drug Reactions and Lipodystrophy in HIV, San Diego, CA, USA, 26–28 June 1999.
- Heart Protection Study Collaborative Group (2002) MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20,536 high-risk individuals: a randomised placebo-controlled trial. Lancet, 360: 7–22.
- Hede K. (2008) Doctors seek to prevent breast cancer recurrence by lowering insulin levels. J. Natl. Cancer. Inst., 100: 530–532.
- Hedrich O., Jacob M., Hauptman P.J. (2004) Progression of coronary artery disease in non-ischemic dilated cardiomyopathy. Coron Artery Dis., 15: 291–297.
- Heitmann B.L., Lissner L., Sorensen T.I.A. et al. (1995) Dietary fat intake and weight gain in women genetically predisposed for obesity. Am. J. Clin. Nutr., 61: 1213–1217.
- Hirano K., Yamashita S., Matsuzawa Y. (2000) Pros and cons of inhibiting cholesteryl ester transfer protein. Curr. Opin. Lipidol., 11: 589–596.
- Hjalmarson Å. (2007) Controlled Rosuvastatin Multinational Trial in Heart Failure (CORONA)—Results of an outcomes trial in patients with ischemic heart disease and heart failure. American Heart Association 2007 Scientific Sessions; November 5, Orlando, FL. Late-breaking clinical trials 2.
- Hognestad A., Dickstein K., Myhre E. et al.; OPTIMAAL Investigators (2004) Effect of combined statin and beta-blocker treatment on one-year morbidity and mortality after acute myocardial infarction associated with heart failure. Am. J. Cardiol., 93: 603–606.
- Homan van der Heide J.J., Bilo H.J., Donker A.J. et al. (1992) The effects of dietary supplementation with fish oil on renal function and the course of early postoperative rejection episodes in cyclosporine-treated renal transplant recipients. Transplantation, 54: 257–263.
- Homan van der Heide J.J., Bilo H.J.G., Donker J.M. et al. (1993) Effect of dietary fish oil on renal function and rejection in cyclosporine-treated recipients of renal transplants. N. Engl. J. Med., 329: 769–773.
- Homan van der Heide J.J., Bilo H.J.G., Tegzess A.M. et al. (1990) The effects of dietary supplementation with fish oil on renal function in cyclosporine-treated renal transplant recipients. Transplantation, 49: 523–527.
- Horiuchi M., Cui T.X., Li Z. et al. (2003) Fluvastatin enhances the inhibitory effects of a selective angiotensin II type 1 receptor blocker, valsartan, on vascular neointimal formation. Circulation, 107: 106–112.
- Horwich T.B., Hamilton M.A., Maclellan W.R. et al. (2002) Low serum total cholesterol is associated with marked increase in mortality in advanced heart failure. J. Card. Fail., 8: 216–224.
- Horwich T.B., MacLellan W.R., Fonarow G.C. (2004) Statin therapy is associated with improved survival in ischemic and non-ischemic heart failure. J. Am. Coll. Cardiol., 43: 642–648
- Hricik D.E. (1994) Posttransplant hyperlipidemia: the treatment dilemma. Am. J. Kidney Dis., 23: 766–771.
- Hricik D.E., Bartucci M.R., Mayes J.T. et al. (1992) The effects of steroid withdrawal on lipoprotein profiles of cyclosporine in cyclosporine-treated kidney-pancreas transplant recipients. Transplantation, 54: 878–81.
- Hricik D.E., O’Toole M.A., Schulak J.A. et al. (1993) Steroid-free immunosuppression in cyclosporine-treated renal transplant recipients: a meta-analysis. J. Am. Soc. Nephrol., 4: 1300–1305.
- Hricik D.E., Schulak J.A. (1993) Metabolic effects of steroid withdrawal in adult renal transplant recipients. Kidney Int., 44(Suppl.): S726–729.
- Hsu I., Spinler A., Johnson N.E. (1995) Comparative evaluation of the safety and efficacy of HMGCoA reductase inhibitor monotherapy in the treatment of primary hypercholesterolemia. Ann. Pharmacother., 29: 743–759.
- Hughes T.A., Gaber A.O., Amiri H.S. et al. (1995) Kidney-pancreas transplantation: the effect of portal versus systemic venous drainage of the pancreas on the lipoprotein composition. Transplantation, 60: 1406–1412.
- Hunt S.A., Abraham W.T., Chin M.H. et al. (2005) ACC/AHA 2005 Guideline Update for the Diagnosis and Management of Chronic Heart Failure in the Adult: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Update the 2001 Guidelines for the Evaluation and Management of Heart Failure): developed in collaboration with the American College of Chest Physicians and the International Society for Heart and Lung Transplantation: endorsed by the Heart Rhythm Society. Circulation, 112: e154–235.
- Imagawa D.K., Dawson S., Holt C.D. et al. (1996) Hyperlipidemia after liver transplantation. Transplantation, 62: 934–942.
- Ingulli E., Tejani A., Markell M. (1993) The beneficial effects of steroid withdrawal on blood pressure and lipid profile in children posttransplantation in the cyclosporine era. Transplantation, 55: 1029–1033.
- Insull W. Jr. (2006) Clinical utility of bile acid sequestrants in the treatment of dyslipidemia: a scientific review. South Med. J., 99: 257–273.
- Ito M., Adachi T., Pimentel D.R. et al. (2004) Statins inhibit beta-adrenergic receptor-stimulated apoptosis in adult rat ventricular myocytes via a Rac1-dependent mechanism. Circulation, 110: 412–418.
- Jacobs D., Blackburn H., Higgins M. et al. (1992) Report of the conference on low blood cholesterol: mortality associations. Circulation, 86: 1046.
- Jain M.K., Ridker P.M. (2005) Anti-inflammatory effects of statins: clinical evidence and basic mechanisms. Nat. Rev. Drug. Discov., 4: 977–987.
- Jernberg T., James S., Lindahl B. et al. (2004) Natriuretic peptides in unstable coronary artery disease. Eur. Heart J., 25: 1486–1493.
- Jevnikar A.M., Petric R., Holub B.J. et al. (1988) Effect of cyclosporine on plasma lipids and modification with dietary fish oil. Transplantation, 46: 722–725.
- Jin F.Y., Kamanna V.S., Kashyap M.L. (1997) Niacin decreases removal of high-density lipoprotein apolipoprotein A-I but not cholesterol ester by Hep G2 cells. Implication for reverse cholesterol transport. Arterioscler. Thromb. Vasc. Biol., 17: 2020–2028.
- Jindal R.M. (1994) Pancreatic islet transplantation for diabetes. Postgrad. Med. J., 70: 665–666.
- John S., Schneider M.P., Delles C. et al. (2005) Lipid-independent effects of statins on endothelial function and bioavailability of nitric oxide in hypercholesterolemic patients. Am. Heart. J., 149: 473.
- Johnston S.C., Gress D.R., Browner W.S. et al. (2000) Short-term prognosis after emergency department diagnosis of TIA. JAMA, 284: 2901–2906.
- Jokubaitis L.A. (1996) Fluvastatin in combination with other lipid-lowering agents. Br. J. Clin. Pract., (Suppl. 77A): 28–32.
- Jones I.R., Swai A., Taylor R. et al. (1990) Lowering of plasma glucose concentrations with bezafibrate in patients with moderately controlled NIDDM. Diabetes Care, 13: 855–863.
- Jones P., Kafonek S., Laurora I. et al. (1998) Comparative dose efficacy study of atorvastatin versus simvastatin, pravastatin, lovastatin, and fluvastatin in patients with hypercholesterolemia (the CURVES study). Am. J. Cardiol., 81: 582–7.
- Jonkers I.J., Mohrschladt M.F., Westendorp R.G. et al. (2002) Severe hypertriglyceridemia with insulin resistance is associated with systemic inflammation: reversal with bezafibrate therapy in a randomized controlled trial. Am. J. Med., 112: 275–280.
- Joven J., Villabona C., Vilella E. (1993) Pattern of hyperlipoproteinemia in human nephrotic syndrome: influence of renal failure and diabetes mellitus. Nephron., 64: 565–569.
- Kidney Disease Outcomes Quality Initiative (K/DOQI) Group (2003) K/DOQI clinical practice guidelines for management of dyslipidemias in patients with kidney disease. Am. J. Kidney Dis., 41(4 Suppl. 3): I–IV, S1–S91.
- Kantola T., Kivisto K., Neuvonen P.J. (1998) Effects of itraconazole on the pharmacokinetics of atorvastatin. Clin. Pharmacol. Ther., 64: 58–65.
- Kasiske B.L. (1998) Hyperlipidemia in patients with chronic renal disease. Am. J. Kidney Dis., 32: S142–S156.
- Kasiske B.L., Tortorice K.L., Heim-Duthoy K.Ib. et al. (1990) Pravastatin treatment of hypercholesterolemia in renal transplant recipients. Transplantation, 49: 95–100.
- Katircibasi M.T., Canatar T., Kocum H.T. et al. (2005) Decreased heart rate recovery in patients with heart failure: effect of fluvastatin therapy. Int. Heart. J., 46: 845–854.
- Keane W.F., Eknoyan G. (1999) Proteinuria, albuminuria, risk, assessment, detection, elimination (PARADE): a position paper of the National Kidney Foundation. Am. J. Kidney Dis., 33: 1004–1010.
- Kearney D., Fitzgerald D. (1999) The anti-thrombotic effects of statins. J. Am. Coll. Cardiol., 33: 1305–1307.
- Keating N.L., O’Malley A.J., Smith M.R. (2006) Diabetes and cardiovascular disease during androgen deprivation therapy for prostate cancer. J. Clin. Oncol., 24: 4448–4456.
- Keech A., Simes R.J., Barter P. et al. (2005) FIELD study investigators. Effects of long-term fenofibrate therapy on cardiovascular events in 9795 people with type 2 diabetes mellitus (the FIELD study): randomised controlled trial. Lancet, 366: 1849–1861.
- Kelley V.E., Kirkman R.L., Bastos M. et al. (1989) Enhancement of immunosuppression by substitution of fish oil as a vehicle for cyclosporine. Transplantation, 48: 98–102.
- Kelly J.J., Lawson J.A., Campbell L.V. et al. (2000) Effects of nicotinic acid on insulin sensitivity and blood pressure in healthy subjects. J. Hum. Hypertens., 14: 567–572.
- Khemasuwan D., DiVietro M.L., Tangdhanakanond K. et al. (2010) Statins decrease the occurrence of venous thromboembolism in patients with cancer. Am. J. Med., 123: 60–65.
- Khush K.K., Waters D.D., Bittner V. et al. (2007) Effect of high-dose atorvastatin on hospitalizations for heart failure: subgroup analysis of the Treating to New Targets (TNT) Study. Circulation, 115: 576–583.
- Kinlay S., Schwartz G.G., Olsson A.G. et al.; Myocardial Ischemia Reduction with Aggressive Cholesterol Lowering Study Investigators (2003) High-dose atorvastatin enhances the decline in inflammatory markers in patients with acute coronary syndromes in the MIRACL study. Circulation, 108: 1560–1566.
- Kirk J.K., Dupuis R.E. (1995) Approaches to the treatment of hyperlipidemia in the solid organ transplant recipient. Ann. Pharmacother., 29: 879–91.
- Kjekshus J., Dunselman P., Blideskog M. et al.; CORONA Study Group (2005) A statin in the treatment of heart failure? Controlled rosuvastatin multinational study in heart failure (CORONA): study design and baseline characteristics. Eur. J. Heart. Fail., 7: 1059–1069.
- Kjekshus J., Pedersen T.R., Olsson A.G. et al. (1997) The effects of simvastatin on the incidence of heart failure in patients with coronary heart disease. J. Card. Fail., 3: 249–254.
- Kjekshus J., Apetrei E., Barrios V. et al.; CORONA Group (2007) Rosuvastatin in older patients with systolic heart failure. N. Engl. J. Med., 357: 2248–2261.
- Kjekshus J., Pedersen T.R., Olsson A.G. et al. (1997) The effects of simvastatin on the incidence of chronic heart failure in patients with coronary heart disease. J. Card. Fail., 249–254.
- Klahr S., Levey A.S., Beck G.J. et al. (1994) The effects of dietary protein restriction and blood-pressure control on the progression of chronic renal disease. Modification of Diet in Renal Disease Study Group. N. Engl. J. Med., 330: 877–884.
- Klerkx A.H., El Harchaoui K., van der Steeg W.A. et al. (2006) Cholesteryl ester transfer protein (CETP) inhibition beyond raising high-density lipoprotein cholesterol levels: pathways by which modulation of CETP activity may alter atherogenesis. Arterioscler. Thromb. Vasc. Biol., 26: 706–715.
- Knopp R.H. (1999) Drug treatment of lipid disorders. N. Engl. J. Med., 341: 498–511.
- Kobashigawa J.A., Katznelson S., Laks H. et al. (1995) Effect of pravastatin on outcomes after cardiac transplantation. N. Engl. J. Med., 333: 621–627.
- Krauss R.M., Chait A., Stone N.J. (2006) Soya protein and serum lipids. N. Engl. J. Med., 1995; 333: 1715–1716.
- Krum H., Bailey M., Meyer W. et al. (2007) Impact of statin therapy on clinical outcomes in chronic heart failure patients according to beta-blocker use: results of CIBIS II. Cardiology, 108: 28–34.
- Krum H., McMurray J.J. (2002) Statins and chronic heart failure: do we need a large-scale outcome trial? J. Am. Coll. Cardiol., 1567–1573.
- Kuivenhoven J.A., de Grooth G.J., Kawamura H. et al. (2005) Effectiveness of inhibition of cholesteryl ester transfer protein by JTT-705 in combination with pravastatin in type II dyslipidemia. Am. J. Cardiol., 95: 1085–1088.
- Kyrklund C., Backman J.T., Kivisto K.T. et al. (2001) Plasma concentrations of active lovastatin acid are markedly increased by gemfibrozil but not by bezafibrate. Clin. Pharmacol. Ther., 69: 340–345.
- Lakka H.M., Laaksonen D.E., Lakka T.A. et al. (2002) The metabolic syndrome and total and cardiovascular disease mortality in middle-aged men. JAMA, 288: 2709–2716.
- Landmesser U., Bahlmann F., Mueller M. et al. (2005) Simvastatin versus ezetimibe: pleiotropic and lipid-lowering effects on endothelial function in humans. Circulation, 111: 2356–2363.
- Lange R.A., Lindsey M.L. (2008) HDL-cholesterol levels and cardiovascular risk: acCETPing the context. Eur. Heart J., 29: 2708–2709.
- LaRosa J.C., Grundy S.M., Waters D.D. et al.; Treating to New Targets (TNT) Investigators (2005) Intensive lipid lowering with atorvastatin in patients with stable coronary disease. N. Engl. J. Med., 352: 1425–1435.
- Lee T.M., Su S.F., Tsai C.H. (2002) Effect of pravastatin on proteinuria in patients with well-controlled hypertension. Hypertension, 40: 67–73.
- Lewis E.J., Hunsicker L.G., Bain R.P. et al.; The Collaborative Study Group (1993) The effect of angiotensin-converting-enzyme inhibition on diabetic nephropathy. N. Engl. J. Med., 329: 1456–1462.
- Li P.K., Mak T.W., Chan T.H. et al. (1995) Effect of fluvastatin on lipoprotein profiles in treating renal transplant recipients with dyslipoproteinemia. Transplantation, 60: 652–656.
- Liappis A.P., Kan V.L., Rochester C.G. et al. (2001) The effect of statins on mortality in patients with bacteremia. Clin. Infect. Dis., 33: 1352–1357.
- Liberopoulos E.N., Daskalopoulou S.S., Mikhailidis D.P. et al. (2005) A review of the lipid-related effects of fluvastatin. Curr. Med. Res. Opin., 21: 231–244.
- Ligibel J.A., Campbell N., Partridge A. et al. (2008) Impact of a mixed strength and endurance exercise intervention on insulin levels in breast cancer survivors. J. Clin. Oncol., 26: 907–912.
- Lipid Research Clinics Program (1984) The Lipid Research Clinics Coronary Primary Prevention Trial results. JAMA, 251: 351–374.
- Lipinski M.J., Vetrovec G.W., Gorelik D. et al. (2005) The importance of heart rate recovery in patients with heart failure or left ventricular systolic dysfunction. J. Cardiac. Fail., 11: 624–630.
- Lipinski M.J., Martin R.E., Cowley M.J. et al. (2006) Effect of statins and white blood cell count on mortality in patients with ischemic left ventricular dysfunction undergoing percutaneous coronary intervention. Clin. Cardiol., 29: 36–41.
- Loscalzo J. (2001) Nitric oxide insufficiency, platelet activation, and arterial thrombosis. Circ. Res., 88: 756–762.
- Lunenfeld B. (2007) Testosterone deficiency and the metabolic syndrome. Aging Male, 10: 53–56.
- Maack C., Kartes T., Kilter H. et al. (2003) Oxygen free radical release in human failing myocardium is associated with increased activity of rac1-GTPase and represents a target for statin treatment. Circulation, 108: 1567–1574.
- Mackness B., Mackness M. (2009) High-density lipoprotein: why all the fuss? Ann. Clin. Biochem., 46: 5–7.
- Maisel A.S., Krishnaswamy P., Nowak R.M. et al.; Breathing Not Properly Multinational Study Investigators (2002) Rapid measurement of B-type natriuretic peptide in the emergency diagnosis of heart failure. N. Engl. J. Med., 347: 161–167.
- Majumdar S.R., McAlister F.A., Eurich D.T. et al. (2006) Statins and outcomes in patients admitted to hospital with community acquired pneumonia: population based prospective cohort study. BMJ, 333: 999.
- Mann J.F., Gerstein H.C., Pogue J. et al. (2001) Renal insufficiency as a predictor of cardiovascular outcomes and the impact of ramipril: the HOPE randomized trial. Ann. Intern. Med., 134: 629–636.
- Manninen V., Tenkanen L., Koskinen P. et al. (1992) Joint effects of serum triglyceride and LDL cholesterol and HDL cholesterol concentrations on coronary heart disease risk in the Helsinki Heart Study. Implications for treatment. Circulation, 85: 37–45.
- Martin C.K., Church T.S., Thompson A.M. et al. (2009) Exercise dose and quality of life: a randomized controlled trial. Arch Intern Med., 169: 269–278.
- Martinez E., Conget I., Lozano L. et al. (1999) Reversion of metabolic abnormalities after switching from HIV-1 protease inhibitors to nevirapine. AIDS, 13: 805–810.
- Marz W., Wollschlager H., Klein G. et al. (1999) Safety of lowdensity lipoprotein cholestrol reduction with atorvastatin versus simvastatin in a coronary heart disease population (the TARGET TANGIBLE trial). Am. J. Cardiol., 84: 7–13.
- Masoudi F.A. (2007) Statins for ischemic systolic heart failure. N. Engl. J. Med., 357:2301–2304.
- Massy Z.A., Ma J.Z., Louis T.A. et al. (1995) Lipid-lowering therapy in patients with renal disease. Kidney Int., 48: 188–198.
- Mastroianni C.M., d’Ettorre G., Forcina G. et al. (1990) Rhabdomyolisis after cerivastatin/gemfibrozil therapy in an HIV-infected patient with protease inhibitor-related hyperlipidaemia. AIDS, 15: 820–821.
- Mathier M.A., Rose G.A., Fifer M.A. et al. (1998) Coronary endothelial dysfunction in patients with acute-onset idiopathic dilated cardiomyopathy. J. Am. Coll. Cardiol., 32: 216–224.
- Mathur R., Alexander C.J., Yano J. et al. (2008) Use of metformin in polycystic ovary syndrome. Am. J. Obstet. Gynecol., 199: 596–609.
- May H.T., Muhlestein J.B., Carlquist J.F. et al. (2006) Relation of serum total cholesterol, C-reactive protein levels, and statin therapy to survival in heart failure. Am. J. Cardiol., 98: 653–658.
- Mayberg M.R., Batjer H.H., Dacey R. et al. (1994) Guidelines for the management of aneurysmal subarachnoid hemorrhage: a statement for healthcare professionals from a special writing group of the Stroke Council, American Heart Association. Stroke, 25: 2315–2328.
- McCormack P.L., Keating G.M. (2005) Prolonged-release nicotinic acid: a review of its use in the treatment of dyslipidaemia. Drugs, 65: 2719–2740.
- McDiarmid S.V., Farmer D.A., Goldstein L.I. et al. (1995) A randomized prospective trial of steroid withdrawal after liver transplantation. Transplantation, 60: 1443–1450.
- McFarlane S.I., Muniyappa R., Francisco R. et al. (2002) Clinical review 145: Pleiotropic effects of statins: lipid reduction and beyond. J. Clin. Endocrinol. Metab., 87: 1451–1458.
- McKenney J.M., Davidson M.H., Shear C.L. et al. (2006) Efficacy and safety of torcetrapib, a novel cholesteryl ester transfer protein inhibitor, in individuals with below-average high-density lipoprotein cholesterol levels on a background of atorvastatin. J. Am. Coll. Cardiol., 48: 1782–1790.
- McManus B.M., Malcom G., Kendall T.J. et al. (1994) Lipid overload and proteoglycan expression in chronic rejection of human transplanted heart. Clin. Transplant., 8: 336–340.
- Meade T., Zuhrie R., Cook C. et al. (2002) Bezafibrate in men with lower extremity arterial disease: randomised controlled trial. BMJ, 325: 1139.
- Michelsen T.M., Pripp A.H., Tonstad S. et al. (2009) Metabolic syndrome after risk-reducing salpingo-oophorectomy in women at high risk for hereditary breast ovarian cancer: a controlled observational study. Eur. J. Cancer., 45: 82–89.
- Miller L.W. (1992) Steroid withdrawal in heart transplantation. J. Heart Lung. Transplant., 11: 401.
- Montaner J.S., Reiss P., Cooper D. et al. (1998) A randomized, doubleblind trial comparing combinations of nevirapine, didanosine and zidovudine for HIV-infected patients: the INCAS trial. J. Am. Med. Assoc., 279: 930–937.
- Moorhead J.F., Chan M.K., El-Nahas M. et al. (1982) Lipid nephrotoxicity in chronic progressive glomerular and tubulo-interstitial disease. Lancet, 2: 1309–1311.
- Moyle G.J. (1999) Efavirenz: shifting the HAART paradigm in adult HIV-1 infection. Exp. Opin. Invest. Drugs, 8: 473–486.
- Moyle G.J., Lloyd M., Reynolds B. et al. (2001) Dietary advice with or without pravastatin for the management of hypercholesterolaemia associated with protease inhibitor therapy. AIDS, 15: 1503–1508.
- Mozaffarian D., Minami E., Letterer R.A. et al. (2005) The effects of atorvastatin (10 mg) on systemic inflammation in heart failure. Am. J. Cardiol., 96: 1699–1704.
- Muldoon M.F. (2001) Report on statins and dementia disputed. Arch. Neurol., 58: 1166–1167.
- Murphy R.L., Katlama C., Johnson V. et al. (1999) The ATLANTIC study/a randomized open-label trial comparing two protease inhibitors-sparing antiretroviral strategies versus a standard PIcontaining regimen: 48-week data. In: 39th Interscience Conference on Antiretroviral Agents and Chemotherapy, San Francisco, California. September 26–29, 1999.
- Nakagami H., Jensen K.S., Liao J.K. (2003) A novel pleiotropic effect of statins: prevention of cardiac hypertrophy by cholesterol-independent mechanisms. Ann. Med., 35: 398–403.
- Nakao N., Yoshimura A., Morita H. et al. (2003) Combination treatment of angiotensin-II receptor blocker and angiotensin converting-enzyme inhibitor in non-diabetic renal disease (COOPERATE):a randomised controlled trial. Lancet, 361: 117–124.
- Natarajan P., Ray K.K., Cannon C.P. (2010) High-density lipoprotein and coronary heart disease: current and future therapies. J. Am. Coll. Cardiol., 55: 1283–1299.
- National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) (2002) Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) final report. Circulation, 106: 3143–3421.
- National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel II) (1993) Summary of the second report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel II). JAMA, 269: 3015–23.
- Negredo E., Cruz L., Paredes R. et al. (2002) Virological, immunological, and clinical impact of switching from protease inhibitors to nevirapine or to efavirenz in patients with human immunodeficiency virus infection and long-lasting viral suppression. Clin. Infect. Dis., 34: 504–510.
- Nelson J., Beauregard H., Gelinas M. et al. (1988) Rapid improvement of hyperlipidemia in kidney transplant patients with a multifactorial hypolipidemic diet. Transplant. Proc., 20: 1264–1270.
- Nguyen M.C., Stewart R.B., Banerji M.A. et al. (2001) Relationships between tamoxifen use, liver fat and body fat distribution in women with breast cancer. Int. J. Obes. Relat. Metab. Disord., 25: 296–298.
- Nicholls S.J., Tuzcu E.M., Brennan D.M. et al. (2008) Cholesteryl ester transfer protein inhibition, high-density lipoprotein raising, and progression of coronary atherosclerosis: insights from ILLUSTRATE (Investigation of Lipid Level Management Using Coronary Ultrasound to Assess Reduction of Atherosclerosis by CETP Inhibition and HDL Elevation). Circulation, 118: 2506–2514.
- Nickenig G., Bäumer A.T., Temur Y. et al. (1999) Statin-sensitive dysregulated AT1 receptor function and density in hypercholesterolic men. Circulation, 100(21): 2131–2134.
- Niessner A., Steiner S., Speidl W.S. et al. (2006) Simvastatin suppresses endotoxin-induced upregulation of toll-like receptors 4 and 2 in vivo. Atherosclerosis, 189: 408–413.
- Nissen S.E., Nicholls S.J., Wolski K. et al. (2008) Comparison of Pioglitazone vs Glimepiride on Progression of Coronary Atherosclerosis in Patients With Type 2 Diabetes: The PERISCOPE Randomized Controlled Trial. JAMA, 299: 1561–1573.
- Nissen S.E., Nicholls S.J., Wolski K. et al.; PERISCOPE Investigators, STRADIVARIUS Investigators (2008) Effect of rimonabant on progression of atherosclerosis in patients with abdominal obesity and coronary artery disease. The STRADIVARIUS randomized controlled trial. JAMA, 299: 1547–1560.
- Nissen S.E., Tuzcu E.M., Schoenhagen P. et al. (2005) Statin therapy, LDL cholesterol, C-reactive protein, and coronary artery disease. N. Engl. J. Med., 352: 29–38.
- Node K., Fujita M., Kitakaze M. et al. (2003) Short-term statin therapy improves cardiac function and symptoms in patients with idiopathic dilated cardiomyopathy. Circulation, 108: 839–843.
- Nolan J., Batin P.D., Andrews R. et al. (1998) Prospective study of heart rate variability and mortality in chronic heart failure: results of the United Kingdom heart failure evaluation and assessment of risk trial (UK-heart). Circulation, 98: 1510–1516.
- Norman D.J., Ilingworth D.R., Munson J. et al. (1988) Myolysis and acute renal failure in a heart-transplant recipient receiving lovastatin. N. Engl. J. Med., 318: 46–47.
- Oda H., Keane W.F. (1999) Recent advances in statins and the kidney. Kidney Int. (Suppl.) 71: S2–S5.
- Ohara Y., Hiasa Y., Hosokawa S. et al. (2005) Impact of hydroxymethylglutaryl coenzyme A reductase inhibition on left ventricular remodeling in patients with acute anterior myocardial infarction after primary coronary angioplasty. Int. Heart. J., 46: 987–995.
- Opravil M., Hirschel B., Lazzarin A. et al. (2002) A randomized trial of simplified maintenance therapy with abacavir, lamivudine, and zidovudine in human immunodeficiency virus infection. J. Infect. Dis., 185: 1251–1260.
- Orchard T., Temprosa M., Goldberg R. et al.; Diabetes Prevention Research Group (2005) The effect of metformin and intensive lifestyle intervention on the metabolic syndrome: the Diabetes Prevention Program Randomized Trial. Ann. Intern. Med., 142: 611–619.
- Ordonez J.D., Hiatt R.A., Killebrew E.J. et al. (1993) The increased risk of coronary heart disease associated with nephrotic syndrome. Kidney Int., 44: 638–642.
- Otto D.A., Kahn D.R., Hamm M.W. et al. (1990) Improved survival of heterotopic cardiac allografts in rats with dietary n-3 polyunsaturated fatty acids. Transplantation, 50: 193–198.
- Padbury R.T., Gunson B.K., Dousset B. et al. (1993) Steroid withdrawal from long-term immunosuppression in liver allograft recipients. Transplantation, 55: 789–794.
- Palacios R., Santos J., Gonzalez M. et al. (2002) Efficacy and safety of atorvastatin in the treatment of hypercholesterolaemia associated with antiretroviral therapy. J Acquir. Immune. Defic. Syndr., 30: 536–537.
- Pandey D.K., Gorelick P.B. (2005) Expanding indications for statins in cerebral ischemia: a quanitative study. Arch. Neurol., 62: 67–72.
- Paraskevas K.I., Tzovaras A.A., Briana D.D. et al. (2007) Emerging indications for statins: a pluripotent family of agents with several potential applications. Curr. Pharm. Des., 13: 3622–3636.
- Park Y.W., Zhu S., Palaniappan L. et al. (2003) The metabolic syndrome: prevalence and associated risk factor findings in the US population from the Third National Health and Nutrition Examination Survey, 1988–1994. Arch. Intern. Med., 163: 427–436.
- Pedersen T.R. (1995) Lowering cholesterol with drugs and diet. N. Engl. J. Med., 333: 1350–1351.
- Pedersen T.R., Faergeman O., Kastelein J.J. et al. (2005) Incremental Decrease in End Points Through Aggressive Lipid Lowering (IDEAL) Study Group. High-dose atorvastatin vs usual-dose simvastatin for secondary prevention after myocardial infarction: the IDEAL study: a randomized controlled trial. JAMA, 294: 2437–2445.
- Pedersen T.R., Olsson A.G., Faergeman O. et al. (1998) Lipoprotein changes and reduction in the incidence of major coronary heart disease events in the Scandinavian Simvastatin Survival Study (4S). Circulation, 97: 1453–1460.
- Penzak S.R., Chuck S.K., Stajich G.V. (2000) Safety and efficacy of HMGCoA reductase inhibitors for treatment of hyperlipidemia in patients with HIV infection. Pharmacotherapy, 20: 1066–1071.
- Perez R.V., Munda R., Alexander J.W. (1988) Dietary immunoregulation of transfusion-induced immunosuppression. Transplantation, 445: 614–617.
- Pfizer news release (2006) In interests of patient safety, Pfizer stops all torcetrapib clinical trials; company has notified FDA and is in the process of notifying all clinical investigators and other regulatory authorities, December 2.
- Pirsch J.D., Armburst M.J., Knechtle S.J. et al. (1991) Effect of steroid withdrawal on hypertension and cholesterol levels in living related recipients. Transplant. Proc., 23: 1363–1364.
- Pi-Sunyer X. (2004) RIO–North America: 1-year results. Presented at the American Heart Association Scientific Sessions 2004; November 8, New Orleans, La.
- Pitt B. (2005) Low-density lipoprotein cholesterol in patients with stable coronary heart disease — is it time to shift our goals? N. Engl. J. Med., 352: 1483–1484.
- Pliquett R.U., Cornish K.G., Peuler J.D. et al. (2003) Simvastatin normalizes autonomic neural control in experimental heart failure. Circulation, 107: 2493–2498.
- Pliquett R.U., Cornish K.G., Zucker I.H. (2003) Statin therapy restores sympathovagal balance in experimental heart failure. J. Appl. Physiol., 95: 700–704.
- Pothiwala P., Jain S.K., Yaturu S. (2009) Metabolic syndrome and cancer. Metab. Syndr. Relat. Disord., 7: 279–288.
- Poynten A.M., Gan S.K., Kriketos A.D. et al. (2003) Nicotinic acid-induced insulin resistance is related to increased circulating fatty acids and fat oxidation but not muscle lipid content. Metabolism, 52: 699–704.
- Primatesta P., Poulter N.R. (2000) Lipid concentrations and the use of lipid lowering drugs: evidence from a national cross sectional survey. BMJ, 321: 1322–1325.
- Psaty B. M., Lumley T. (2008) Surrogate end points and FDA approval: a tale of 2 lipid-altering drugs. JAMA, 299: 1474–1476.
- Pyke D. (1991) Pancreas transplantation. Diabet. Metab. Rev., 7: 3–14.
- Pyorala K., Pedersen T.R., Kjekshus J. et al. (1997) Cholesterol lowering with simvastatin improves prognosis of diabetic patients with coronary heart disease: a subgroup analysis of the Scandinavian Simvastatin Survival Study (4S). Diabetes Care, 20: 614–620.
- Ramasubbu K., Mann D.L. (2006) The emerging role of statins in the treatment of heart failure. J. Am. Coll. Cardiol., 47: 342–344.
- Rashid P., Leonardi-Bee J., Bath P. (2003) Blood pressure reduction and secondary prevention of stroke and other vascular events: a systematic review. Stroke, 34: 2741–2748.
- Ratcliffe P.J., Firth J.D., Higgins R.M. et al. (1993) Randomized controlled trial of complete steroid withdrawal in renal transplant patients receiving triple immunosuppression. Transplant. Proc., 25: 590.
- Rauchhaus M., Coats A.J., Anker S.D. (2000) The endotoxin-lipoprotein hypothesis. Lancet, 356: 930–933.
- Rauchhaus M., Clark A.L., Doehner W. et al. (2003) The relationship between cholesterol and survival in patients with chronic heart failure. J. Am. Coll. Cardiol., 1933–1940.
- Rauchová H., Drahota Z., Lenaz G. (1995) Function of coenzyme Q in the cell: some biochemical and physiological properties. Physiol. Res., 44: 209–216.
- Ray J.G., Gong Y., Sykora K. et al. (2005) Statin use and survival outcomes in elderly patients with heart failure. Arch. Intern. Med., 165: 62–67.
- Ray J.G., Mamdani M., Tsuyuki R.T. et al. (2001) Use of statins and the subsequent development of deep vein thrombosis. Arch. Intern. Med., 161: 1405–1410.
- Regitz-Zagrosek V., Lehmkuhl E., Weickert M.O. (2006) Gender differences in the metabolic syndrome and their role for cardiovascular disease. Clin. Res. Cardiol., 95: 136–147.
- Reisman L., Lieberman K.V., Burrows L. et al. (1990) Follow-up of cyclosporine-treated pediatric renal allograft recipients after cessation of prednisone. Transplantation, 49: 76–80.
- Ridker P.M., Fonseca F.A., Genest J. et al. (2007) Baseline characteristics of participants in the JUPITER trial, a randomized placebo-controlled primary prevention trial of statin therapy among individuals with low low-density lipoprotein cholesterol and elevated high-sensitivity C-reactive protein. Am. J. Cardiol., 100: 1659–1664.
- Ridker P.M., Rifai N., Clearfield C. et al.; Air Force/Texas Coronary Atherosclerosis Prevention Study Investigators (2001) Measurement of C-reactive protein for the targeting of statin therapy in the primary prevention of acute coronary events. N. Engl. J. Med., 344: 1959–1965.
- Ridker P.M., Cannon C.P., Morrow D. et al. (2005) C-reactive protein levels and outcomes after statin therapy. N. Engl. J. Med., 352: 20–28.
- Ridker P.M., Rifai N., Pfeffer M.A. et al. (1998) Inflammation, pravastatin, and the risk of coronary events after myocardial infarction in patients with average cholesterol levels. Cholesterol and Recurrent Events (CARE) Investigators. Circulation, 98: 839–844.
- Robins S.J. (2003) Cardiovascular disease with diabetes or the metabolic syndrome: should statins or fibrates be first line lipid therapy? Curr. Opin. Lipidol., 14: 575–583.
- Robins S.J., Bloomfield H.E. (2006) Fibric acid derivatives in cardiovascular disease prevention: results from the large clinical trials. Curr. Opin. Lipidol., 17: 431–439.
- Robinson J.G., Smith B., Maheshwari N. et al. (2005) Pleiotropic effects of statins: benefit beyond cholesterol reduction? A meta-regression analysis. J. Am. Coll. Cardiol., 46: 1855–1862.
- Rockwood K., Kirkland S., Hogan D.B. et al. (2002) Use of lipid-lowering agents, indication bias, and the risk of dementia in community-dwelling elderly people. Arch. Neurol., 59: 223–227.
- Ross R. (1993) The pathogenesis of atherosclerosis: a perspective for the 1990s. Nature, 362: 801–809.
- Rovellini A., Sommariva D., Branchi A. et al. (1992) Effects of slow release bezafibrate on the lipid pattern and on blood glucose of type 2 diabetic patients with hyperlipidaemia. Pharmacol. Res., 25: 237–245.
- Rozembaum W., Adda N., Nguyen T. et al. (1999) Prospective follow-up of a protease inhibitor substitution for efavirenz in patients with HIV-related lipodystrophy syndrome. In: First International Workshop on Adverse Drug Reactions and Lipodystrophy in HIV, San Diego, CA, USA, 26–28 June 1999.
- Rubins H.B., Robins S.J., Collins D. et al. (1999) Gemfibrozil for the secondary prevention of coronary heart disease in men with low levels of high-density lipoprotein cholesterol. Veterans Affairs High-Density Lipoprotein Cholesterol Intervention Trial Study Group. N. Engl. J. Med., 341: 410–418.
- Rubins H.B., Robins S.J., Collins D. et al. (2002) Diabetes, plasma insulin, and cardiovascular disease: subgroup analysis from the Department of Veterans Affairs high-density lipoprotein intervention trial (VA-HIT). Arch. Intern. Med., 162: 2597–2604.
- Ruiz L., Negredo E., Domingo P. et al. (2001) Antiretroviral treatment simplification with nevirapine in PI-experienced patients with HIV-associated lipodystrophy: one-year prospective follow-up of a multicentre, randomised, controlled study. J. Acquir. Immune. Defic. Syndr., 27: 229–236.
- Sacco R.L., Adams R., Albers G. et al. (2006) Guidelines for prevention of stroke in patients with ischemic stroke or transient ischemic attack. A statement for healthcare professionals from the American Heart Association/American Stroke Association Council on Stroke: co-Sponsored by the Council on Cardiovascular Radiology and Intervention: the American Academy of Neurology affirms the value of this guideline. Stroke, 37: 577–617.
- Sacks F.M.; Expert Group on HDL Cholesterol (2002) The role of high-density lipoprotein [HDL] cholesterol in the prevention and treatment of coronary heart disease: Expert Group recommendations. Am. J. Cardiol., 90: 139–143.
- Sacks F.M., Pfeffer M.A., Moyle L.A. et al. (1996) The effect of pravastatin on coronary events after myocardial infarction in patients with average cholesterol levels. N. Engl. J. Med., 335: 1001–1009.
- Saijonmaa O., Nyman T., Stewen P. et al. (2004) Atorvastatin completely inhibits VEGF-induced ACE upregulation in human endothelial cells. Am. J. Physiol. Heart. Circ. Physiol., 286: H2096–H2102.
- Sakamoto T., Kojima S., Ogawa H. et al.; Multicenter Study for Aggressive Lipid-Lowering Strategy by HMG-CoA Reductase Inhibitors in Patients With Acute Myocardial Infarction Investigators (2006) Effects of early statin treatment on symptomatic heart failure and ischemic events after acute myocardial infarction in Japanese. Am. J. Cardiol., 97: 1165–1171.
- Sander S., Coleman C.I., Patel A.A. et al. (2006) The impact of coenzyme Q10 on systolic function in patients with chronic heart failure. J. Card. Fail., 12: 464–472.
- Sandercock P. (2001) Statins for stroke prevention? Lancet, 357: 1548–1549.
- Sarnak M.J., Levey A.S., Schoolwerth A.C. et al. (2003) Kidney disease as a risk factor for development of cardiovascular disease: a statement from the American Heart Association Councils on Kidney in Cardiovascular Disease, High Blood Pressure Research, Clinical Cardiology, and Epidemiology and Prevention. Circulation, 108: 2154–2169.
- Saver J.L., Goldstein L.B. (2006) The new standing guideline committee policy of the American Stroke Association Stroke Council. Stroke, 37(3): 753–753.
- Scandinavian Simvastatin Survival Study Group (1994) Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S). Lancet, 344: 1383–1389.
- Schaefer E.J., Asztalos B.F. (2006) Cholesteryl ester transfer protein inhibition, high-density lipoprotein metabolism and heart disease risk reduction. Curr. Opin. Lipidol., 17: 394–398.
- Schäfer A., Fraccarollo D., Eigenthaler M. et al. (2005) Rosuvastatin reduces platelet activation in heart failure: role of NO bioavailability. Arterioscler. Thromb. Vasc. Biol., 25: 1071–1077.
- Schreiner G.F., Flye W., Brunt E. et al. (1988) Essential fatty acid depletion of renal allografts and prevention of rejection. Science, 240: 1032–1033.
- Scirica B.M., Morrow D.A., Cannon C.P.; PROVE IT-TIMI 22 Investigators (2006) Intensive statin therapy and the risk of hospitalization for heart failure after an acute coronary syndrome in the PROVE IT-TIMI 22 study. J. Am. Coll. Cardiol., 47(11): 2326–2331.
- Sever P.S., Dahlof B., Poulter N.R. et al. (2003) Prevention of coronary and stroke events with atorvastatin in hypertensive patients who have average or lower-thanaverage cholesterol concentrations, in the Anglo-Scandinavian Cardiac Outcomes Trial — Lipid Lowering Arm (ASCOT-LLA): a multicentre randomised controlled trial. Lancet, 361: 1149–1158.
- Shah P.K., Kaul S., Nilsson J. et al. (2001а) Exploiting the vascular protective effects of high-density lipoprotein and its apolipoproteins: an idea whose time for testing is coming, part I. Circulation, 104: 2376–2383.
- Shah P.K., Kaul S., Nilsson J. et al. (2001b) Exploiting the vascular protective effects of high-density lipoprotein and its apolipoproteins: an idea whose time for testing is coming, part II. Circulation, 104: 2498–2502.
- Shek A., Ferrill M.J. (2001) Statin-fibrate combination therapy. Ann. Pharmacother., 35: 908–917.
- Shepherd J., Blauw G.J., Murphy M.B. et al. (2002) Pravastatin in elderly individuals at risk of vascular disease (PROSPER): a randomised controlled trial. Lancet, 360: 1623–1630.
- Shepherd J., Cobbe S.M., Ford I. et al. (1995) Prevention of coronary heart disease with pravastatin in men with hypercholesterolemia. West of Scotland Coronary Prevention Study Group. N. Engl. J. Med., 333: 1301–1307.
- Shepherd J., Packard C.J., Morgan H.G. et al. (1979) The effects of cholestyramine on high density lipoprotein metabolism. Atherosclerosis, 33: 433–444.
- Shulman N.B., Ford C.E., Hall W.D. et al.; The Hypertension Detection and Follow-up Program Cooperative Group (1989) Prognostic value of serum creatinine and effect of treatment of hypertension on renal function. Results from the hypertension detection and follow-up program. Hypertension, 13(Suppl.): I80–I93.
- Smith S.C. Jr., Allen J., Blair S.N. et al.; AHA/ACC; National Heart, Lung and Blood Institute (2006) AHA/ACC guidelines for secondary prevention for patients with coronary and other atherosclerotic vascular disease: 2006 update: endorsed by the National Heart, Lung, and Blood Institute. Circulation, 113: 2363–2372.
- Soja A.M., Mortensen S.A. (1997) Treatment of congestive heart failure with coenzyme Q10 illuminated by meta-analyses of clinical trials. Mol. Aspects. Med., 18(Suppl.): S159–S168.
- Sola S., Mir M.Q., Lerakis S. et al. (2006) Atorvastatin improves left ventricular systolic function and serum markers of inflammation in nonischemic heart. J. Am. Coll. Cardiol., 47: 332–337.
- Sola S., Mir M. Q., Lerakis S., et al. (2005) Statin therapy is associated with improved cardiovascular outcomes and levels of inflammatory markers in patients with heart failure. J. Card. Fail., 11: 607–612.
- Solymoss B.C., Bourassa M.G., Marcil M. et al. (2009) Long-term rates of cardiovascular events in patients with the metabolic syndrome according to severity of coronary-angiographic alterations. Coron. Artery Dis., 20: 1–8.
- Sorenson H.T., Horvath-Puho E., Sogaard K.K. et al. (2009) Arterial cardiovascular events, statins, low-dose aspirin and subsequent risk of venous thromboembolism: a population-based case-control study. J. Thromb. Haemost., 7: 521–528.
- Spratt K.A. (2010) Targeting low-density lipoprotein cholesterol in cardiovascular health. J. Am. Osteopath. Assoc., 110: Sii–SS1.
- Stalenhoef A.F., Ballantyne C.M., Sarti C. et al. (2005) A COmparative study with rosuvastatin in subjects with METabolic Syndrome: results of the COMETS study. Eur. Heart J., 26: 2664–2672.
- Stanworth R.D., Jones T.H. (2009) Testosterone in obesity, metabolic syndrome and type 2 diabetes. Front Horm Res., 37: 74–90.
- Staszewski S., Morales-Ramirez J., Tashima K.T. et al.; Study 006 Team (1999) Efavirenz plus zidovudine and lamivudine, efavirenz plus indinavir and indinavir plus zidovudine and lamivudine in the treatment of HIV-infection in adults. N. Engl. J. Med., 341: 1865–1873.
- Stender S., Schuster J., Barter P. et al.; On behalf of the MERCURY Study Group (2005) Comparison of rosuvastatin with atorvastatin, simvastatin and pravastatin in achieving cholesterol goals and improving plasma lipids in hypercholesterolaemic patients with or without the metabolic syndrome in the MERCURY I trial. Diabetes Obes. Metab., 7: 430–438.
- Stewart R.A., White H.D., Kirby A.C. et al.; Long-Term Intervention With Pravastatin in Ischemic Disease (LIPID) Study Investigators (2005) White blood cell count predicts reduction in coronary heart disease mortality with pravastatin. Circulation, 111: 1756–1762.
- Strey C.H., Young J.M., Molyneux S.L. et al. (2005) Endothelium-ameliorating effects of statin therapy and coenzyme Q10 reductions in chronic heart failure. Atherosclerosis, 179: 201–206.
- Su S.F., Hsiao C.L., Chu C.W. et al. (2000) Effects of pravastatin on left ventricular mass in patients with hyperlipidemia and essential hypertension. Am. J. Cardiol., 86: 514–518.
- Sudhop T., Lutjohann D., Kodal A. et al. (2002) Inhibition of intestinal cholesterol absorption by ezetimibe in humans. Circulation, 106: 1943–1948.
- Superko H.R., Krauss R.M. (1994) Coronary artery disease regression: convincing evidence for the benefit of aggressive lipoprotein management. Circulation, 90: 1056–1069.
- Swedberg K., Cleland J., Dargie H. et al. (2005) Guidelines for the diagnosis and treatment of chronic heart failure: executive summary (update 2005): the Task Force for the Diagnosis and Treatment of Chronic Heart Failure of the European Society of Cardiology. Eur. Heart J., 26: 1115–1140.
- Sweny P., Wheeler D.C., Lui S.F. et al. (1989) Dietary fish oil supplements preserve renal function in renal transplant recipients with chronic vascular rejection. Nephrol. Dial. Transplant., 4: 1070–5.
- Tall A.R., Yvan-Charvet L., Wang N. (2007) The failure of torcetrapib: was it the molecule or the mechanism? Arterioscler. Thromb. Vasc. Biol., 27: 257–260.
- Taniguchi A., Fukushima M., Sakai M. et al. (2001) Effects of bezafibrate on insulin sensitivity and insulin secretion in non-obese Japanese type 2 diabetic patients. Metabolism, 50: 477–480.
- Tavazzi L., Tognoni G., Franzosi M.G. et al. (2004) Rationale and design of the GISSI heart failure trial: a large trial to assess the effects of n-3 polyunsaturated fatty acids and rosuvastatin in symptomatic congestive heart failure. Eur. J. Heart Fail., 6: 635–641.
- Tebas P., Yarasheski K., Powderly W.G. et al. (2000) A prospective open-label pilot trial of a maintenance nevirapine-containing regimen in patients with undetectable viral loads on protease inhibitors regimens for at least 6 months. In: Seventh Conference on Retroviruses and Opportunistic Infections, San Francisco, CA, January 30–February 2, 2000 [Abstract 45].
- Tenenbaum A., Fisman E.Z. (2004) Which is the best lipid-modifying strategy in metabolic syndrome and diabetes: fibrates, statins or both? Cardiovasc. Diabetol., 3: 10.
- Tenenbaum A., Fisman E.Z., Boyko V. et al. (2006) Attenuation of progression of insulin resistance in patients with coronary artery disease by bezafibrate. Arch. Intern. Med., 166: 737–741.
- Tenenbaum A., Fisman E.Z., Motro M. (2003) Metabolic syndrome and type 2 diabetes mellitus: focus on peroxisome proliferator activated receptors (PPAR). Cardiovasc. Diabetol., 2: 4.
- Tenenbaum A., Fisman E.Z., Motro M. (2004) Bezafibrate and simvastatin: different beneficial effects for different therapeutic aims. J. Clin. Endocrinol. Metab., 89: 1978.
- Tenenbaum A., Motro M., Fisman E.Z. (2005) Dual and pan-peroxisome proliferator-activated receptors (PPAR) co-agonism: the bezafibrate lessons. Cardiovasc. Diabetol., 4: 14.
- Tenenbaum A., Motro M., Fisman E.Z. et al. (2004) Peroxisome proliferator-activated receptors ligand bezafibrate for prevention of type 2 diabetes mellitus in patients with coronary artery disease. Circulation, 109: 2197–2202.
- Tenenbaum A., Motro M., Fisman E.Z. et al. (2005) Bezafibrate for the secondary prevention of myocardial infarction in patients with metabolic syndrome. Arch. Intern. Med., 165: 1154–1160.
- Tenenbaum A., Motro M., Fisman E.Z. et al. (2005) Effect of bezafibrate on incidence of type 2 diabetes mellitus in obese patients. Eur. Heart J., 26: 2032–2038.
- Tenenbaum A., Motro M., Schwammenthal E. et al. (2004) Macrovascular complications of metabolic syndrome: an early intervention is imperative. Int. J. Cardiol., 97: 167–172.
- Tenkanen L., Manttari M., Kovanen P. et al. (2006) Gemfibrozil in the treatment of dyslipidemia: an 18-year mortality follow-up of the Helsinki Heart Study. Arch. Intern. Med., 166: 743–748.
- The Bezafibrate Infarction Prevention (BIP) study (2000) Secondary prevention by raising HDL cholesterol and reducing triglycerides in patients with coronary artery disease. The Bezafibrate Infarction Prevention (BIP) study. Circulation, 102: 21–27.
- The Coronary Drug Project Research Group (1973) The Coronary Drug Project: design, methods, and baseline results. Circulation, 47: 1–50.
- The Diabetes Control and Complications Trial Research Group (1993) The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N. Engl. J. Med., 329: 977–986.
- The Long-Term Intervention with Pravastatin in Ischaemic Disease (LIPID) Study Group (1998) Prevention of cardiovascular events and death with pravastatin in patients with coronary heart disease and a broad range of initial cholesterol levels. N. Engl. J. Med., 339: 1349–1357.
- The Multicentre Anti-Atheroma Study (MAAS) (1994) Effect of simvastatin on coronary atheroma. The Multicentre Anti-Atheroma Study (MAAS). Lancet, 344: 633–638.
- Thomas J.C., Lopes-Virella M.F., Del Bene V.E. et al. (2000) Use of fenofibrate in the management of protease inhibitor-associated lipid abnormalities. Pharmacotherapy, 20: 727–734.
- Tiefenbacher C.P., Friedrich S., Bleeke T. et al. (2004) ACE inhibitors and statins acutely improve endothelial dysfunction of human coronary arterioles. Am. J. Physiol. Heart Circ. Physiol., 286: H1425–H1432.
- Tobis J.M., Perlowski A. (2009) Atheroma volume by intravascular ultrasound as a surrogate for clinical end points. J. Am. Coll. Cardiol., 53: 1116–1118.
- Tonelli M., Isles C., Curhan G.C. et al. (2004) Effect of pravastatin on cardiovascular events in people with chronic kidney disease. Circulation, 110: 1557–1563.
- Tonelli M., Moye L., Sacks F.M. et al.; Cholesterol and Recurrent Events Trial Investigators (2003) Effect of pravastatin on loss of renal function in people with moderate chronic renal insufficiency and cardiovascular disease. J. Am. Soc. Nephrol., 14: 1605–1613.
- Toth P.P., Davidson M.H. (2005a) Cholesterol absorption blockade with ezetimibe. Curr. Drug Targets Cardiovasc. Haematol. Disord., 5: 455–462.
- Toth P.P., Davidson M.H. (2005b) Simvastatin plus ezetimibe: combination therapy for the management of dyslipidaemia. Expert Opin. Pharmacother., 6: 131–139.
- Tousoulis D., Antoniades C., Bosinakou E. et al. (2005a) Effects of atorvastatin on reactive hyperemia and inflammatory process in patients with congestive heart failure. Atherosclerosis, 178: 359–363.
- Tousoulis D., Antoniades C., Vassiliadou C. et al. (2005b) Effects of combined administration of low dose atorvastatin and vitamin E on inflammatory markers and endothelial function in patients with heart failure. Eur. J. Heart Fail., 7: 1126–1132.
- Tousoulis D., Antoniades C., Bosinakou E. et al. (2005c) Effects of atorvastatin on reactive hyperaemia and the thrombosis-fibrinolysis system in patients with heart failure. Heart, 91: 27–31.
- Traish A.M., Saad F., Feeley R.J. et al. (2009) The dark side of testosterone deficiency: III. Cardiovascular disease. J. Androl., 30: 477–494.
- Transon C., Leemann T., Dayer P. (1996) In vitro comparative inhibition profiles of major human drug metabolising cytochrome P450 isoenzyme (CYP 2C9, CYP 2D6 and CYP 3A4) by HMGCoA reductase inhibitors. Eur. J. Clin. Pharmacol., 50: 209–215.
- Trial Drug Lifts «Good» Cholesterol Levels, Study to test whether it prevents cardiovascular disease (2005) Health Day April 7.
- Tsouli S.G., Liberopoulos E.N., Goudevenos J.A. et al. (2008) Should a statin be prescribed to every patient with heart failure? Heart Fail. Rev., 13: 211–225.
- Tunaru S., Kero J., Schaub A. et al. (2003) PUMA-G and HM74 are receptors for nicotinic acid and mediate its anti-lipolytic effect. Nat. Med., 9: 352–355.
- UK HDL-C Consensus Group (2004) Role of fibrates in reducing coronary risk: a UK Consensus. Curr. Med. Res. Opin., 20: 241–247.
- Urakaze M., Hamazaki T., Kashiwabara H. et al. (1989) Favorable effects of fish oil concentrate on risk factors for thrombosis in renal allografts recipients. Nephron., 53: 102–109.
- van der Harst P., Wagenaar L.J., Buikema H. et al. (2005) Effect of intensive versus moderate lipid lowering on endothelial function and vascular responsiveness to angiotensin II in stable coronary artery disease. Am. J. Cardiol., 96: 1361–1364.
- Van der Steeg W.A., El-Harchaoui K., Kuivenhoven J.A. et al. (2005) Increasing high-density lipoprotein cholesterol through cholesteryl Ester transfer protein inhibition: a next step in the fight against cardiovascular disease? Curr. Drug Targets Cardiovasc. Haematol. Disord., 5: 481–488.
- van der Steeg W.A., Holme I., Boekholdt S.M. et al. (2008) High-density lipoprotein cholesterol, high-density lipoprotein particle size, and apolipoprotein A-I: significance for cardiovascular risk: the IDEAL and EPIC-Norfolk studies. J. Am. Coll. Cardiol., 51: 634–642.
- Van Gaal L. (2005) RIO–Europe: 2-year results. Presented at the ACC Scientific Sessions 2005; March 8, Orlando, Fla.
- Vega G.L., Cater N.B., Meguro S. et al. (2005) Influence of extended-release nicotinic acid on nonesterified fatty acid flux in the metabolic syndrome with atherogenic dyslipidemia. Am. J. Cardiol., 95: 1309–1313.
- Verges B. (2004) Clinical interest of PPARs ligands. Diabetes Metab, 30: 7–12.
- Verges B. (2005) Role for fibrate therapy in diabetes: evidence before FIELD. Curr. Opin. Lipidol., 16: 648–651.
- Viciana P., Alarcon A., Martin D. et al. (2000) Partial improvement of lipodystrophy after switching from HIV-1 protease inhibitors to efavirenz. In: Seventh Conference on Retroviruses and Opportunistic Infections, San Francisco, CA, January 30–February 2, 2000 [Abstract 48].
- Walli R.K., Michl G.M., Bogner J.R. et al. (2001) Improvement of HAART-associated insulin resistance and dyslipidemia after replacement of protease inhibitor with abacavir. Eur. J. Med. Res., 6: 413–421.
- Watts G.F., Castelluccio C., Rice-Evans C. et al. (1993) Plasma coenzyme Q (ubiquinone) concentrations in patients treated with simvastatin. J. Clin. Pathol., 46: 1055–1057.
- Weant K.A., Smith K.M. (2005) The role of coenzyme Q10 in heart failure. Ann. Pharmacother., 39: 1522–1526.
- Weiner D.E., Tighiouart H., Stark P.C. et al. (2004) Kidney disease as a risk factor for recurrent cardiovascular disease and mortality. Am. J. Kidney Dis., 44: 198–206.
- Wensing A.M., Reedijk M., Boucher C.A.B. et al. (2001) Replacing ritonavir by nelfinavir or nelfinavir/saquinavir as a part of highly active antiretroviral therapy leads to an improvement of triglyceride levels. AIDS, 15: 2191–2193.
- Williams D., Feely J. (2002) Pharmacokinetic-pharmacodynamic drug interactions with HMG-CoA reductase inhibitors. Clin. Pharmacokinet., 41: 343–370.
- Willson T.M., Brown P.J., Sternbach D.D. et al. (2000) The PPARs: from orphan receptors to drug discovery. J. Med. Chem., 43: 527–550.
- Wortsman J., Soler N.G. (1982) Abnormalities of fuel metabolism in the polycystic ovary syndrome. Obstet. Gynecol., 60: 342–345.
- Yoshimura N., Oka T., Okamoto M. et al. (1992) The effects of pravastatin on hyperlipidemia in renal transplant recipients. Transplantation, 53: 94–99.
- Yusuf S., Pepine C.J., Garces C. et al. (1992) Effect of enalapril on myocardial infarction and unstable angina in patients with low ejection fractions. Lancet, 1173-1178.