В настоящее время формальная оценка риска возникновения кардиоваскулярного события (фатального или нефатального) рассматривается как объективизация причин для изменения интенсивности вмешательства у пациентов с артериальной гипертензией (Anderson K.M. et al., 1991; Campbell N.R.C. et al., 2006). Большинство экспертов полагают, что наличие прямой взаимосвязи между величиной артериального давления и риском развития мозгового инсульта, а также наличием артериальной гипертензии, гиперлипидемии, сахарного диабета и ХБП, с одной стороны, и величиной кардиоваскулярного риска — с другой, являются достаточным основанием для предпочтения оценки глобального риска, а не риска возникновения кардиоваскулярных событий (Hoes A.W. et al., 1995). Тем не менее, многие национальные и, в том числе, Европейские рекомендации, посвященные превенции кардиоваскулярных событий, исходят из необходимости расчета 10-летнего риска возникновения ИБС как одной из ведущей причин инвалидизации и смертности (Wood D. et al., 1998a; b; Wallis E.J. et al., 2000; 2001). Подобный подход является фактически прагматическим со всех точек зрения, поскольку допускает тот факт, что риск возникновения ИБС с высокой степенью достоверности прогнозирует манифестацию любого кардиоваскулярного события в отношении ¾, то есть 30% риск возникновения ИБС соответствует 40% кардиоваскулярному риску (Wallis E.J. et al., 2000). Типичным примером подобного отношения к вопросу являются рекомендации Британского общества по изучению артериальной гипертензии, в которых уже более 7 лет используется формализованный подход как к оценке риска, так и к выбору стратегии лечения на основе аппроксимационной компьютерной программы Joint British Societies’ Cardiac Risk Assessor (British Cardiac Society, British Hyperlipidaemia Association, British Hypertension Society, endorsed by the British Diabetic Association, 1998). Последняя предоставляет врачу информацию в виде математической величины 10-летнего риска (Wood D. et al., 1998a; b). Таким образом, интенсивность мероприятий, направленных на модуляцию суммарного риска, основывается на расчете риска возникновения ИБС. С другой стороны, Европейская система расчета риска SCORE призвана использовать расчет суммарного кардиоваскулярного риска для принятия решения об интенсивности профилактического и лечебного вмешательства (Wood D. et al., 1998a; b). Настоящая глава посвящена анализу различных методов расчета риска и естественных ограничений, возникающих при попытках их клинического применения.
Подходы к расчету и оценке кардиоваскулярного риска
Методы, используемые для расчета и оценки кардиоваскулярного риска, существенным образом разнятся (Chobanian A.V. et al., 2003; European Society of Hypertension — European Society of Cardiology, 2003; Whitworth J.A., 2003). В рекомендациях Европейского общества по изучению гипертензии (European Society of Hypertension — European Society of Cardiology, 2003) и Всемирной организации здравоохранения (Whitworth J.A., 2003) тотальный кардиоваскулярный риск рассматривается как результат влияния дополнительных факторов риска, поражения органов-мишеней и наличия ассоциированных клинических состояний. Такой подход основан, прежде всего, на результатах Framingham Heart Study. В целом, любой пациент с артериальной гипертензией может быть стратифицирован в одну из групп низкого (<10%), среднего (15–20%), высокого (20–30%) и очень высокого риска (>30%) возникновения кардиоваскулярного заболевания на протяжении 10-летнего периода в зависимости от величины артериального давления и/или наличия дополнительных факторов риска. При этом наличие клинически значимых дополнительных факторов риска, поражений органов-мишеней и ассоциированных клинических состояний (таких как сахарный диабет) может явиться достаточным основанием для стратификации пациента в группу высокого или очень высокого риска даже при величине офисного артериального давления <140/90 мм рт. ст. (Vasan R.S. et al., 2001).
Многочисленными исследованиями показано, что пациенты с артериальной гипертензией при наличии большого числа дополнительных факторов риска демонстрируют более тяжелый прогноз, чем больные без таковых. Так, в условиях 14-летнего наблюдения установлено, что один дополнительный фактор риска у пациентов в возрасте старше 55 лет приводит к повышению частоты наступления смертельного исхода в 3 раза, а ≥2 факторов риска — в 4,5 раза. Для больных молодого возраста (<55 лет) с артериальной гипертензией эти взаимоотношения еще более драматические. Один фактор риска способствует повышению вероятности смертельного исхода в 5 раз, а три дополнительных фактора риска — в 15 раз. По данным исследования MRFIT (Multiple Risk Factor Intervention Trial) абсолютный риск смерти с поправкой на возраст, половую принадлежность, количество выкуренных сигарет, уровня общего ХС плазмы крови и величины артериального давления в >3 раза выше у пациентов с наличием сахарного диабета, чем без него.
Поражения органов-мишеней и кардиоваскулярный риск
В соответствии с рекомендациями Европейского общества кардиологов (ESC-ESH) среди поражений органов-мишеней наибольшее клинические значение имеют гипертрофия ЛЖ, утолщение интима-медиального сегмента общей сонной артерии, ХБП, микроальбуминурия (табл. 11.1).
Таблица 11.1 Факторы, формирующие высокий кардиоваскулярный риск, согласно требованиям Европейского общества по изучению гипертензии (European Society of Hypertension — European Society of Cardiology, 2003)
| Факторы риска | Органы-мишени | Сахарный диабет | Ассоциированные клинические состояния |
| Артериальная гипертензия | Гипертрофия ЛЖ | Уровень глюкозы натощак 7,0 ммоль/л | Цереброваскулярные заболевания |
| Мужчины в возрасте >55 лет | ЭКГ-признаки гипертрофии ЛЖ (критерии Соколова — Лайона) или Корнуэльский эхоКГ-индекс) и/или документированное подтверждение наличия атеромы/утолщения интима-медиального сегмента общей сонной артерии >0,9 мм | Постпрандиальный уровень глюкозы >11,0 ммоль/л | Мозговой ишемический инсульт |
| Женщины в возрасте >65 лет | Концентрация креатинина в плазме крови у мужчин 115–133 мкмоль/л и у женщин — 107–124 мкмоль/л |
Мозговой геморрагический инсульт | |
| Курение | Микроальбуминурия (30–3000 мг/сут) или отношение альбумин/креатинин >22 мг/г (>2,5 мг/ммоль) у мужчин и >31 мг/г (>3,5 мг/ммоль) — у женщин | Транзиторная ишемическая атака | |
| Дислипидемия: общий ХС >6,5 ммоль/л или ХС ЛПНП >4,0 ммоль/л или ХС ЛПВП <1,0 ммоль/л у мужчин и <1,2 ммоль/л — у женщин | Инфаркт миокарда | ||
| Наследственно отягощенный семейный анамнез (у мужчин в возрасте <55 лет и у женщин <65 лет) | Стенокардия | ||
| Абдоминальное ожирение (окружность талии >102 см у мужчин и >88 см — у женщин) | Коронарная реваскуляризация | ||
| СРП >1 мг/л | Сердечная недостаточность | ||
| ХБП | |||
| Диабетическая нефропатия | |||
| Протеинурия | |||
| Окклюзирующие заболевания периферических артерий | |||
| Ретинопатия |
Таблица модифицирована из работы G. Mansia (2006).
Гипертрофия ЛЖ
Впервые прямая взаимосвязь между гипертрофией ЛЖ и снижением вероятности выживания в когорте пациентов, не страдающих артериальной гипертензией, была документирована в Framingham Heart Study (Kannel W.B. et al., 1970). В настоящее время гипертрофия ЛЖ рассматривается как независимый фактор риска общей, кардиоваскулярной и внезапной смерти, любых цереброваскулярных событий, а также возникновения сердечной недостаточности. По данным P. Verdecchia и соавторов (2001) среди 2363 ранее нелеченных пациентов с артериальной гипертензией (средний возраст — 51±12 лет, 47% — женщины) количество цереброваскулярных событий было достоверно (р<0,01) выше в когорте пациентов с наличием ЭКГ-критериев гипертрофии ЛЖ (относительный риск (ОР) составил 1,79; 95% доверительный интервал (ДИ)=1,17–2,76). В то же время сохраняется дискуссия о том, какая именно гипертрофия ЛЖ обладает наибольшим негативным влиянием на величину кардиоваскулярного риска (Jennings G., Wong J., 1997). Во всяком случае, установлено, что концентрическая гипертрофия ЛЖ в меньшей мере влияет на отдаленный прогноз, чем иррегулярная форма (Vakili B.A. et al., 2001; Palmieri V. et al., 2006).
Существуют попытки повысить прогнозирующую ценность гипертрофии ЛЖ путем введения дополнительного параметра, например диаметра левого предсердия, митральной регургитации и т.п. (Gerdts E. et al., 2007). Однако данные регрессионного анализа Кокса свидетельствуют о наличии тесной ассоциации между гипертрофией ЛЖ и вышеуказанными параметрами в отношении величины кардиоваскулярного риска (Koren M.J. et al., 1991; Verdecchia P. et al., 1998). При этом дополнительные факторы не имеют самостоятельного влияния на прогноз и не являются независимыми (Mancia G. et al., 2006). В тоже время плазменный пул ХС ЛПНП, НОМА-индекс и уровень ночного систолического артериального давления являются независимыми предикторами формирования гипертрофии ЛЖ при эссенциальной артериальной гипертензии (Anan F. et al., 2007).
Предполагается, что взаимосвязь между видом гипертрофии ЛЖ и вероятностью выживания не является абсолютной и тесно зависит от характера кардиоваскулярного заболевания (Lee K.W., Lip G.Y., 2003). Так, систолическая дисфункция ЛЖ оказывается более весомым фактором риска у больных с манифестной сердечной недостаточностью, чем гипертрофия ЛЖ, независимо от ее величины и вида. Напротив, для больных с артериальной гипертензией, сахарным диабетом и метаболическим синдромом/абдоминальным ожирением показано различное по интенсивности влияние гипертрофии ЛЖ на прогноз (Ganau A. et al., 1992; Devereux R.B. et al., 2002). Кроме того, манифестация сахарного диабета и абдоминальное ожирение тесно ассоциированы с гипертрофией ЛЖ как в мужской, так и в женской популяции (Lee M. et al., 1997). Причем в мужской популяции преобладает дилатация полости ЛЖ с иррегулярной формой гипертрофии ЛЖ, а в женской — концентрическая гипертрофия ЛЖ (Palmieri V. et al., 2001). Установлено, что эти формы гипертрофии ЛЖ существенным образом отличаются между собой как морфологически, так и интенсивностью сопутствующей им иммуно-воспалительной и нейрогуморальной активации (Opie L.H. et al., 2006), что оказывает неоднозначное влияние на вероятность выживания пациентов в мужской и женской популяции (Duncan B.B. et al., 2003; Schillaci G. et al., 2006).
Таким образом, геометрические и морфологические различия гипертрофии ЛЖ в популяции больных с сахарным диабетом и абдоминальным ожирением могут оказывать различное по интенсивности влияние на отдаленный прогноз (Lips D.J. et al., 2003). По крайней мере, к настоящему времени уже четко установлена взаимосвязь между многими факторами кардиоваскулярного риска (такими как гиперинсулинемия, дислипидемия, оксидантный стресс) и массой миокарда ЛЖ (Vasan R.S. et al., 2003). В этой связи можно предположить, что гипертрофия ЛЖ оказывает негативное влияние на отдаленный прогноз в зависимости от ее этиологического варианта (Frey N., Olson E.N., 2003), что, собственно, и подтвердили клинические и популяционные исследования (Palmieri V. et al., 2006; Mancia G. et al., 2007).
Утолщение интима-медиального сегмента общей сонной артерии и уменьшение величины ее внутреннего диаметра
Многочисленными исследованиями установлено, что утолщение интима-медиального сегмента общей сонной артерии является независимым фактором риска развития инфаркта миокарда и мозгового инсульта. Кроме того, процессы ремоделирования артерий, ассоциированные с уменьшением их внутреннего диаметра, повышением «жесткости» и возникновением дисфункции эндотелия также могут рассматриваться как факторы риска манифестации церебро- и кардиоваскулярных событий (Gokce N. et al., 2003; Rizzoni D. et al., 2003; Sutton-Tyrrell K. et al., 2005; Schmieder R.E., 2006; van Popele N.M. et al., 2006). При этом «жесткость» артериальной стенки и дисфункция эндотелия как предикторы высокого кардиоваскулярного риска сохраняют свое значение как в молодой (Raitakari O.T. et al., 2003; Juonala M. et al., 2004), так и в старшей возрастной популяции (Mattace-Raso F.U. et al., 2006; Laurent, Boutouyrie, 2007). Кроме того, важными маркерами атеросклеротического поражения сосудов, ассоциированными с повышением вероятности выживания в связи с манифестацией кардиоваскулярных событий, являются провоспалительная активация и оксидантный стресс (Willerson J.T., Ridtker P.M., 2004). В настоящее время СРП рассматривается как достаточно валидный показатель величины популяционного кардиоваскулярного риска (Ridker P.M. et al., 2002), который уже представляется исследователям в качестве факториальной составляющей глобального риска, а не маркером провоспалительной активации (Blake G.J. et al., 2003). Уже существуют прогностические модели, позволяющие на основе результатов пропорциональной системы Кокса использовать различные биомаркеры, характеризующие интенсивность воспалительных процессов, в качестве предикторов неблагоприятного исхода у пациентов высокого риска (Yarnell J.W. et al., 2004). Однако генетическая детерминированность плазменного пула СРП, даже в условиях антигенной экспансии, является причиной сформировавшейся среди исследователей дискуссии, касающейся возможности использования параметра, обладающего индивидуальной вариабельностью, для оценки индивидуального риска (Blake G.J. et al., 2003). Подобные ограничения справедливы практически для всех биологических маркеров (Pearson T.A., 2002; Morange P.E. et al., 2004). Действительно, насколько валидной может являться оценка показателя риска, если существуют достаточно веские сомнения в правомочности экстраполяции результатов популяционных исследований на конкретного пациента? Таким образом, хотя многие биологические маркеры и рассматриваются в качестве перспективных моделей для оценки индивидуального риска, применение их ограничено именно за счет высокой индивидуальной вариабельности, влияющей на степень методологической ошибки смещения (methodological bias) (Pearson T.A., 2002; Seda O. et al., 2005).
ХБП
Согласно данным Фремингемского исследования ХБП рассматривается как мощный предиктор кардиоваскулярной заболеваемости и смертности (Weiner D.E. et al., 2007). Так, в когорте больных с II–V стадией ХБП вероятность манифестации серьезных кардиоваскулярных событий в 10–30 раз выше, чем в любой другой популяции пациентов (Sarnak M.J. et al., 2003). При этом между величиной скорости клубочковой фильтрации (СКФ) и кардиоваскулярной смертностью имеется тесная прямая корреляционная взаимосвязь (Go A.S. et al., 2004). Особенно актуальной является оценка глобального риска у пациентов с ранними стадиями ХБП. В этой связи стратификация больных осуществляется, в частности, исходя из предварительно рассчитанной СКФ. К настоящему времени существуют несколько рекомендованных способов расчета этого показателя (Levey A.S. et al., 1999; Rule A.D. et al., 2004). Хотя оба способа анализа СКФ основаны на результатах многочисленных исследований, реально они предлагаются для пациентов со значимым снижением СКФ, тогда как их точность существенно ограничена в когорте лиц с нормальной или умеренно сниженной почечной функцией (Lin J. et al., 2003). Таким образом, при использовании точки разделения СКФ <60 мл/мин•1,73 м2 ряд пациентов не будут отнесены в группу высокого риска именно из-за недостатков самой методики стратификации (Levey A.S. et al., 2007). С другой стороны, использование анализа расчетной СКФ в когорте больных с кардиоваскулярными заболеваниями, особенно с сердечной недостаточностью, не является достаточно обоснованным (Levey A.S. et al., 2000), хотя прогнозирующая ценность снижения СКФ <60 мл/мин•1,73 м2 для риска наступления смертельного исхода оставалась высокой. В этой связи большинство исследователей склонны считать оценку СКФ в качестве вполне приемлемой методики стратификации в группу высокого риска (Kidney Disease Outcomes Quality Initiative [K/DOQI], 2004).
Альбуминурия
Альбуминурия (экскреция альбумина >30 мг/сут) и отношение альбумин/креатинин >22 мг/г (2,5 мг/моль) у мужчин и >31 мг/г (3,5 мг\ммоль) — у женщин тесно ассоциированы с повышением кардиоваскулярного риска (Go A.S. et al., 2004) и часто являются отражением сопутствующей дисфункции эндотелия, которая также рассматривается как достаточно мощный фактор риска неблагоприятного прогноза (Deckert T. et al., 1989; Clausen P. et al., 2001). Тем не менее, экскреция альбумина в количестве <300 мг/сут требует дополнительной верификации других причин ее возникновения (от инфекции мочевыводящих путей до сердечной недостаточности) и к оценке риска на ее основе необходимо подходить достаточно осторожно (American Diabetes Association, 2005). Кроме того, на чувствительность этого теста может оказать непосредственное влияние предшествующий прием иАПФ и антагонистов рецепторов ангиотензина (АРА) ІІ.
Таким образом, только неоднократное подтверждение диагностически значимого уровня экскреции альбумина с мочой при исключении вторичных причин ее возникновения дает основания для использовании этого параметра в качестве маркера высокого кардиоваскулярного риска, хотя этот тест в настоящее время рекомендован как стандартная процедура в реальной клинической практике (Levey A.S. et al., 2003).
Гиперлипидемия
Взаимосвязь между содержанием общего ХС в плазме крови и риском возникновения кардиоваскулярных событий является хорошо установленным фактом. Тем не менее, указанная взаимосвязь не является абсолютно линейной (рис. 11.1). Вместе с тем, риск коронарной катастрофы повышается линейно (зона умеренного риска), если уровень общего ХС в плазме крови находится в пределах 5,2–6,2 ммоль/л. При повышении уровня общего ХС >6,2 ммоль/л риск возникновения впервые выявленной ИБС повышается экспоненциально (зона высокого риска) (Conroy R. et al., 2003). Аналогичная зависимость прослеживается при повышении содеражания ХС ЛПНП в плазме крови >4,0 ммоль/л или снижении ХС ЛПВП <1,0 ммоль/л у мужчин и <1,2 ммоль/л — у женщин.
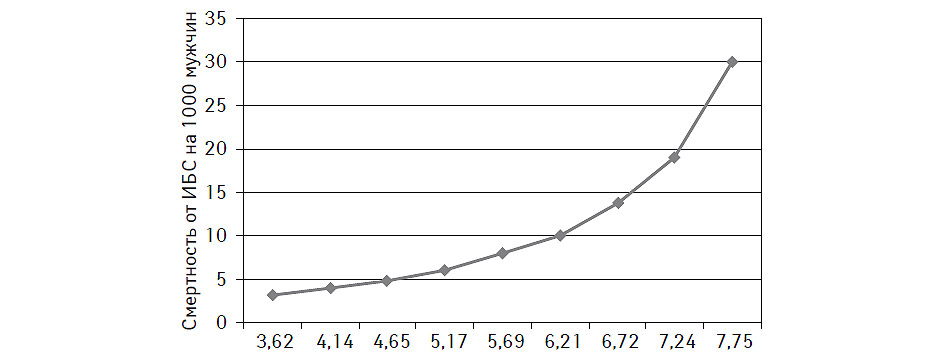
Рис. 11.1. Взаимосвязь между уровнем общего ХС и летальностью мужчин от ИБС. Содержание общего ХС (ммоль/л) в плазме крови
Современная концепция тотального кардиоваскулярного риска
На протяжении многих лет концепция профилактики кардиоваскулярных заболеваний основывается на контроле за различными факторами риска, такими как артериальная гипертензия, дислипидемия, сахарный диабет, ожирение и курение (Campbell N.R.C. et al., 2006). Вместе с тем каждый из этих факторов чаще всего рассматривается изолированно как объект вмешательства, а сведения об их интегральном влиянии на прогноз кардиоваскулярных заболеваний основаны либо на ретроспективных, либо на популяционных исследованиях. Тем не менее, такой подход игнорирует существующее убеждение в том, что кардиоваскулярные заболевания являются мультифакторными по определению, и что сложные взаимоотношения между различными факторами риска, которые включаются в понятие суммарного или тотального сердечно-сосудистого риска, часто игнорируются.
Попытки изменить ситуацию предпринимались неоднократно. Начиная с 90-х годов ХХ в. в клиническом руководстве Joint Task Force of European Societies (1994) впервые было предложено использовать расчет суммарного кардиоваскулярного риска для принятия решения об интенсивности профилактического и лечебного вмешательства (Pyorala K. et al., 1994), что должно было индивидуализировать стратегию вмешательства. Важно, что этот подход создавался как способ идентификации асимптомных пациентов высокого риска возникновения ИБС в общей популяции. В следующих редакциях этого документа последовательно отстаивалась позиция, согласно которой любое профилактическое или лечебное вмешательство должно быть соотнесено с соответствующей величиной суммарного кардиоваскулярного риска (Wood D. et al., 1998a; b; European guidelines on CVD prevention ESC, 2003). Кроме того, в третьей редакции консенсуальных рекомендаций Европейского общества кардиологов (Third Joint Task Force of European Cardiology Societies, 2003), посвященных этой проблеме, большее место занимали не только способы профилактики ИБС вообще, а стратегические подходы к предотвращению манифестации клинических признаков атеросклероза любой локализации, включая мозговой инсульт, заболевания периферических артерий и атеротромбоз. В настоящее время рекомендации по расчету суммарного кардиоваскулярного риска интегрированы и инкорпорированы во многие документы Европейского общества кардиологов: Expert Panel on Detection, Evaluation and Treatment of High Blood Cholesterol in Adults, 2001; European Society of Hypertension — European Society of Cardiology, 2003; Joint British Societies’ guidelines on prevention of cardiovascular disease in clinical practice, 2005.
Таким образом, модель расчета суммарного кардиоваскулярного риска явилась неотъемлемой частью стратегии, направленной на предотвращение возникновения первичных случаев кардиоваскулярных заболеваний, то есть программ первичной профилактики. Вместе с тем, совершено понятно, что многие пациенты с уже установленной ИБС, а также лица с сахарным диабетом, изолированной систолической артериальной гипертензией и/или гипердислипидемией могут нуждаться в несколько отличных от вышеописанных тактических подходах. Учитывая множественность направлений для реализации риска у пациентов таких категорий, стратегия выбора вмешательства не должна основываться на простом делении по дихотомическому принципу: вмешиваться или не вмешиваться. Очевидно, что врачу необходимо принимать обоснованное клиническое решение о модификации образа жизни, изменении профессиональной деятельности либо применении медикаментозной терапии, часто изменяя лишь интенсивность вмешательства, а не его содержание. Поэтому практикующий специалист в полном праве рассчитывать на мониторирование ответа в отношении любого вмешательства, основанного на глобальной оценке риска. В клиническом смысле это означает: нет ответа на вмешательство — неправильно рассчитан риск — неадекватно выбрана интенсивность лечения. В этом смысле показательна диаграмма риска SCORE, согласно которой пациентом высокого риска можно считать любое лицо с 5% шансом погибнуть от ИБС в течение ближайших 10 лет (Conroy R. et al., 2003). И хотя система градуирует риск от 1% величины, она дает несколько схематическое впечатление о том, что риск <5% модифицировать не нужно, тогда как вся интенсивность современных научных возможностей должна быть направлена именно на «высокорискового» больного. Если придерживаться точки зрения, что перспектив решения вопроса вообще нет, поскольку отказ от модификации риска у «низкорисковых» пациентов неизбежно приводит к пополнению рядов «высокорисковых» больных, создается впечатление, что адекватный контроль за риском — это неэффективный титанический труд, пожирающий ресурсы системы здравоохранения.
По мнению G. De Backer (2006) все это косвенно указывает на то, что оценки, положенные в основу расчета высокого кардиоваскулярного риска, произвольны и основаны не на прочной научной основе, а на сугубо практических соображениях, таких как структура системы здравоохранения в странах Евросоюза, планы и возможности систем обязательного медицинского страхования здоровья, некоторые экономические детерминанты. Выбор точки разделения на уровне 5% риска первоначально был сделан преимущественно для того, чтобы соотнести принципиальную способность системы здравоохранения и запланированные объемы медицинского страхования у пациентов с высоким кардиоваскулярным риском. Это, в свою очередь, привело к упрощенному делению всей популяции без клинических признаков ИБС на две группы: «высокорисковую» (в верхнем сегменте шкалы риска) и «низкорисковую» (все другие шкалы). В действительности же, ситуация совершенно другая, что недавно убедительно подтверждено результатами Framingham Heart Study. Оказалось, что отсутствие документированных факторов риска у пациентов в возрасте ≤50 лет непосредственно не ассоциируется с ожидаемым низким кардиоваскулярным риском и повышением выживания (Lloyd-Jones D.M. et аl., 2006). Тем не менее, как только хотя бы один фактор риска начинает присутствовать в популяции, кардиоваскулярный риск возрастает в значительной степени как у мужчин, так и у женщин. В целом, пропорция пациентов с оптимальным профилем кардиоваскулярного риска (<1% за 10 лет) является очень лимитированной даже в популяции лиц без клинических проявлений кардиоваскулярных заболеваний. Рядом популяционных исследований установлено, что среди >20 тыс. мужчин и >5 тыс. женщин в возрасте 35–59 лет (De Bacquer D. et al., 2005) только 2,2% мужчин и 6,9% женщин имеют уровень артериального давления <130/80 мм рт. ст., концентрацию ХС в плазме крови <5,0 ммоль/л, индекс массы тела по Кетле <25 кг/м2, а также никогда не курили и не курят. Таким образом, реальный кардиоваскулярный риск практически здоровой популяции далек от оптимального.
С другой стороны, кроме традиционного подхода к оценке кардиоваскулярного риска, существуют не менее аргументированные методы дополнительного анализа величины риска. Последние основаны на предположении о том, что большинство шкал оценки риска не позволяют его индивидуализировать. Так, в настоящее время предложены маркеры, прогностический потенциал которых заметно превышает таковой в традиционно используемых моделях. Обсуждается возможность внедрения в клиническую практику рутинной оценки следующих факторов высокого кардиоваскулярного риска: содержание в плазме крови мелких плотных частиц ЛПНП, оценка «угрожаемости» атеромы по системе Coronary Calcium Score (EBCT) и характера ремоделирования коронарных артерий при проведении их компьютерной томографии, уровень гомоцистеина и подклассов ЛПВП в крови, содержание апо-А- и апо-В-липопротеинов с расчетом их соотношения, измерение толщины интима-медиального сегмента внутренней сонной артерии, а также уровня ЛП (a) и липопротеинассоциированной фосфолипазы A2 (Lp-PLA2 PLAC). Вместе с тем, стоимость внедрения таких прогностических моделей достаточно высока, что является основным препятствием для использованиях их в рутинной клинической практике.
Можно согласиться с мнением о том, что реальную профилактику кардиоваскулярных заболеваний необходимо начинать за несколько десятилетий до зрелого возраста, поскольку наличие даже единственного фактора риска в молодом возрасте тесно ассоциируется с существенным снижением вероятности выживания. Кроме того, хорошо известно, что модификация образа жизни и факторов риска также эффективна и в более старом сегменте населения. Таким образом, здравый смысл и субъективное мнение врача могут быть рассмотрены как достаточное основание для внедрения программ интенсивной профилактики кардиоваскулярных заболеваний в любой когорте населения. Принципы доказательной медицины (evidence based medicine) никогда не были самоцелью и не должны существовать вопреки очевидной логике, тем более, что полиморбидность зачастую рассматривается как естественное ограничение для получения клинических доказательств. Однако именно преодоление полиморбидности и является наиболее важным залогом успешности выполнения программ по модификации факторов риска.
Таким образом, произвольное манипулирование «точками разделения» (cut off point) в шкалах риска приводит к излишней акцентуации на определенных стратегиях профилактики и, наоборот, к недостаточно активному внедрению эффективных мер профилактики в ряде когорт населения. Это противоречит самой идее о том, что любое вмешательство должно быть основано на детальной оценке и расчете суммарного риска и сводит понимание проблемы к серьезному упрощению. Вполне логично выглядит утверждение о том, что контроль за высоким риском в популяции не означает проведение вмешательств только «высокорисковому» пациенту. Стратегия профилактики возникновения кардиоваскулярных заболеваний может быть эффективной только тогда, когда она прилагается на когорты лиц с различным суммарным риском.
Литература
- American Diabetes Association (2005) Standards of medical care in diabetes. Diabetes Care, 28: S4–S36.
- Anan F., Yonemochi H., Masaki T. et al. (2007) High-Density Lipoprotein Cholesterol and Insulin Resistance Are Independent and Additive Markers of Left Ventricular Hypertrophy in Essential Hypertension. Hypertens. Res., 30: 125–131.
- Anderson K.M., Odel P.M., Wilson P.W. et al. (1991) Cardiovascular disease risk profiles. Am. Heart J., 121: 293–298.
- Blake G.J., Rifai N., Buring J.E. et al. (2003) Blood pressure, C-reactive protein, and risk of future cardiovascular events. Circulation, 108: 2993–2999.
- British Cardiac Society, British Hyperlipidaemia Association, British Hypertension Society, endorsed by the British Diabetic Association (1998) Joint British recommendations on prevention of coronary heart disease in clinical practice. Heart, 80(Suppl. 2): S1–29.
- Campbell N.R.C., Khan N.A., Grover S.A. (2006) Barriers and remaining questions on assessment of absolute cardiovascular risk as a starting point for interventions to reduce cardiovascular risk. J. Hypertens., 24: 1683–1685.
- Chobanian A.V., Bakris G.L., Black H.R. et al. (2003) The seventh report of the joint national committee on prevention, detection, evaluation, and treatment of high blood pressure: the JNC 7 report. JAMA, 289: 2560–2572.
- Clausen P., Jensen J.S., Jensen G. et al. (2001) Elevated urinary albumin excretion is associated with impaired arterial dilatory capacity in clinically healthy subjects. Circulation, 103: 1869–1874.
- Conroy R., Pyorala K., Fitzgerald A. et al. (2003) Prediction of 10-year risk of fatal cardiovascular disease in Europe: the SCORE project. Eur. Heart J., 24: 987–1003.
- De Backer G.J. (2006) A total cardiovascular risk estimate should not be used dichotomously. Hypertens., 24: 1697–1698.
- De Bacquer D., Pelfrene E., Clays E. et al. (2005) Perceived job stress and incidence of coronary events: 3-year follow-up of the Belgian Job Stress Project cohort. Am. J. Epidemiol., 161: 434–441.
- Deckert T., Feldt-Rasmussen B., Borch-Johnsen K. et al. (1989) Albuminuria reflects widespread vascular damage: the Steno hypothesis. Diabetologia, 32: 219–226.
- Devereux R.B., De Simone G., Palmieri V. et al. (2002) Relation of insulin to left ventricular geometry and function in African American and white hypertensive adults: the HyperGEN study. Am. J. Hypertens., 15: 1029–1035.
- Duncan B.B., Schmidt M.I., Pankow J.S. et al. (2003) Low-grade systemic inflammation and the development of type 2 diabetes: the atherosclerosis risk in communities study. Diabetes, 52: 1799–1805.
- European guidelines on CVD prevention ESC Committee for Practice Guidelines to improve the quality of clinical practice and patient care in Europe (2003) Third Joint European Societies’ Task Force on Cardiovascular Disease Prevention in Clinical Practice. Eur. J. Cardiovasc. Prev. Rehabil., 10(Suppl. 1): S1–S78.
- European Society of Hypertension — European Society of Cardiology Guidelines Committee (2003) 2003 European Society of Hypertension-European Society of Cardiology Guidelines for the management of arterial hypertension. J. Hypertens., 21: 1011–1053.
- Expert Panel on Detection, Evaluation and Treatment of High Blood Cholesterol in Adults (2001) Executive summary of the Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation and Treatment of High Blood Cholesterol in Adults (Adult Treatment panel III). JAMA, 285: 2486–2497.
- Frey N., Olson E.N. (1992) Cardiac hypertrophy: the good, the bad, and the ugly. Annu. Rev. Physiol., 65: 45–79.
- Ganau A., Devereux R.B., Roman M.J. et al. (1992) Patterns of left ventricular hypertrophy and geometric remodeling in essential hypertension. J. Am. Coll. Cardiol., 19: 1550–1558.
- Gerdts E., Wachtell K., Omvik P. et al. (2007) Left atrial size and risk of major cardiovascular events during antihypertensive treatment. Hypertension, 49: 311–318.
- Go A.S., Chertow G.M., Fan D. et al. (2004) Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization. N. Engl. J. Med., 351: 1296–1305.
- Gokce N., Keaney J.F. Jr., Hunter L.M. et al. (2003) Predictive value of noninvasively determined endothelial dysfunction for long-term cardiovascular events in patients with peripheral vascular disease. J. Am. Coll. Cardiol., 41: 1769–1775.
- Hoes A.W., Grobbee D.E., Lubson J. (1995) Does drug treatment improve survival? Reconciling the trials in mild to moderate hypertension. J. Hypertens., 13: 805–811.
- Jennings G., Wong J. (1997) Reversibility of left ventricular hypertrophy and malfunction by antihypertensive treatment. In: Hansson L., Birkenhager W. (Eds.). Handbook of hypertension assessment of hypertensive organ damage. Elsevier Science BV, Amsterdam, p. 184–223.
- Joint British Societies’ guidelines on prevention of cardiovascular disease in clinical practice (2005) Heart, 91(Suppl. 5): V1–V52.
- Juonala M., Viikari J.S.A., Laitinen T. et al. (2004) Interrelations between brachial endothelial function and carotid intima-media thickness in young adults. The Cardiovascular Risk in Young Finns Study. Circulation., 110: 2918–2923.
- Kannel W.B., Gordon T., Castelli W.P. et al. (1970) Electrocardiographic left ventricular hypertrophy and risk of coronary heart disease. The Framingham study. Ann. Intern. Med., 72: 813–822.
- Kidney Disease Outcomes Quality Initiative (K/DOQI) (2004) K/DOQI clinical practice guidelines on hypertension and antihypertensive agents in chronic kidney disease. Am. J. Kidney Dis., 43(Suppl. 1): S1–S290.
- Koren M.J., Devereux R.B., Casale P.N. et al. (1991) Relation of left ventricular mass and geometry to morbidity and mortality in uncomplicated essential hypertension. Ann. Intern. Med., 114: 345–352.
- Laurent, Boutouyrie (2007) Recent advances in arterial stiffness and wave reflection in human hypertension. Hypertension, 49: 1202–1206.
- Lee K.W., Lip G.Y. (2003) Insulin resistance and vascular remodelling, in relation to left ventricular mass, geometry and function: an answer to LIFE? J. Hum. Hypertens., 17: 299–304.
- Lee M., Gardin J.M., Lynch J.C. et al. (1997) Diabetes mellitus and echocardiographic left ventricular function in free-living elderly men and women: The Cardiovascular Health Study. Am. Heart. J., 133: 36–43.
- Levey A.S., Andreoli S.P., DuBose T. et al. (2007) Chronic Kidney Disease: Common, Harmful, and Treatable-World Kidney Day 2007. Clin. J. Am. Soc. Nephrol., 2: 401–405.
- Levey A.S., Bosch J.P., Lewis J.B. et al. (1999) A more accurate method to estimate glomerular filtration rate from serum creatinine: a new prediction equation. Modification of Diet in Renal Disease Study Group. Ann. Intern. Med., 130: 461–470.
- Levey A.S., Coresh J., Balk E. et al.; National Kidney Foundation (1991) National Kidney Foundation practice guidelines for chronic kidney disease: evaluation, classification, and stratification. Ann. Intern. Med., 139: 137–147.
- Levey A.S., Greene T., Kusek J.W. et al.; MDRD Study Group (2000) A simplified equation to predict glomerular filtration rate from serum creatinine. J. Am. Soc. Nephrol., 11: 155A.
- Lin J., Knight E.L., Hogan M.L. et al. (2003) A comparison of prediction equations for estimating glomerular filtration rate in adults without kidney disease [published correction in J. Am. Soc. Nephrol., 2005, 16: 2814]. J. Am. Soc. Nephrol., 14: 2573–2580.
- Lips D.J., deWindt L.J., van Kraaij D.J. et al. (2003) Molecular determinants of myocardial hypertrophy and failure: alternative pathways for beneficial and maladaptive hypertrophy. Eur. Heart J., 24: 883–896.
- Lloyd-Jones D.M., Leip E.P., Larson M.G. et al. (2006) Prediction of lifetime risk for cardiovascular disease by risk factor burden at 50 years of age. Circulation, 113: 791–798.
- Mancia G., Bombelli M., Corrao G. et al. (2007) Metabolic syndrome in the Pressioni Arteriose Monitorate E Loro Associazioni (PAMELA) Study: daily life blood pressure, cardiac damage, and prognosis. Hypertension, 49: 40–47.
- Mancia G., Scopelliti F., Grassi G. (2006) Hypertension and the Heart. Seminars in Cardiothoracic and Vascular Anesthesia, 10: 198–202.
- Mancia G. (2006) Total cardiovascular risk: a new treatment concept. J. Hypertens., 24(Suppl. 2) S17–S24.
- Mattace-Raso F.U., van der Cammen T.J., Hofman A. et al. (2006) Arterial stiffness and risk of coronary heart disease and stroke: the Rotterdam Study. Circulation, 113: 657–663.
- Morange P.E., Simon C., Alessi M.C. et al. (2004) Endothelial cell markers and the risk of coronary heart disease: the Prospective Epidemiological Study of Myocardial Infarction (PRIME) study. Circulation, 109: 1343–1348.
- Opie L.H., Commerford P.J., Gersh B.J. et al. (2006) Controversies in ventricular remodelling. Lancet, 367: 356–367.
- Palmieri V., Bella J.N., Arnett D.K. et al. (2001) Effect of type 2 diabetes mellitus on left ventricular geometry and systolic function in hypertensive subjects: Hypertension Genetic Epidemiology Network (HyperGEN) study. Circulation, 103: 102–107.
- Palmieri V., Okin P., Bella J.N. et al. (2006) Electrocardiographic strain pattern and left ventricular diastolic function in hypertensive patients with left ventricular hypertrophy: the LIFE study. J. Hypertens., 24: 2079–2084.
- Pearson T.A. (2002) New tools for coronary risk assessment: what are their advantages and limitations? Circulation, 105: 886–892.
- Pyorala K., De Backer G., Graham I. et al. (1994) Prevention of coronary heart disease in clinical practice: recommendations of the Task Force of the European Society of Cardiology, European Atherosclerosis Society and European Society of Hypertension. Atherosclerosis, 110: 121–161.
- Raitakari O.T., Juonala M., Kahonen M. et al. (2003) Cardiovascular risk factors in childhood and carotid artery intima-media thickness in adulthood: the Cardiovascular Risk in Young Finns Study. JAMA, 290: 2277–2283.
- Ridker P.M., Rifai N., Rose L. et al. (2002) Comparison of C-reactive protein and low-density lipoprotein cholesterol levels in the prediction of first cardiovascular events. N. Engl. J. Med., 347: 1557–1565.
- Rizzoni D., Porteri E., Boari G.E.M. (2003) Prognostic significance of small-artery structure in hypertension. Circulation, 108: 2230–2236.
- Rule A.D., Larson T.S., Bergstralh E.J. et al. (2004) Using serum creatinine to estimate glomerular filtration rate: accuracy in good health and in chronic kidney disease. Ann. Intern. Med., 141: 929–937.
- Sarnak M.J., Levey A.S., Schoolwerth A.C. et al., American Heart Association Councils on Kidney in Cardiovascular Disease, High Blood Pressure Research, Clinical Cardiology, and Epidemiology and Prevention (2003) Kidney disease as a risk factor for development of cardiovascular disease: a statement from the American Heart Association Councils on Kidney in Cardiovascular Disease, High Blood Pressure Research, Clinical Cardiology, and Epidemiology and Prevention. Circulation, 108: 2154–2169.
- Schillaci G., Pirro M., Pucci G. et al. (2006) Different impact of the metabolic syndrome on left ventricular structure and function in hypertensive men and women. Hypertension, 47: 881–886.
- Schmieder R.E. (2006) Endothelial dysfunction: how can one intervene at the beginning of the cardiovascular continuum? J. Hypertens., 24(Suppl. 2): S31–S35.
- Seda O., Tremblay J., Sedova L. et al. (2005) Integrating genomics and transcriptomics with geo-ethnicity and the environment for the resolution of complex cardiovascular diseases. Curr. Opin. Mol. Ther., 7: 583–587.
- Sutton-Tyrrell K., Najjar S.S., Boudreau R.M. et al.; The Health ABC Study (2005) Elevated aortic pulse wave velocity, a marker of arterial stiffness, predicts cardiovascular events in well-functioning older adults. Circulation, 111: 3384–3390.
- Vakili B.A., Okin P.M., Devereux R.B. (2001) Prognostic implications of left ventricular hypertrophy. Am. Heart J., 141: 334–341.
- Van Popele N.M., Mattace-Raso F., Rozemarjin V. et al. (2006) Aortic stiffness is associated with atherosclerosis of the coronary arteries in older adults. The Rotterdam study. J. Hypertens., 24: 2371–2376.
- Vasan R.S., Larson M.G., Leip E.P. et al. (2001) Impact of high-normal blood pressure on the risk of cardiovascular disease. N. Engl. J. Med., 345: 1291–1297.
- Vasan R.S., Sullivan L.M., Roubenoff R. et al. (2003) Inflammatory markers and risk of heart failure in elderly subjects without prior myocardial infarction: the Framingham Heart Study. Circulation, 107: 1486–1491.
- Verdecchia P., Schillaci G., Borgioni C. et al. (1998) Prognostic significance of serial changes in left ventricular mass in essential hypertension. Circulation, 97: 48–54.
- Verdecchia P., Porcellati C., Reboldi G. et al. (2001) Left ventricular hypertrophy as an independent predictor of acute cerebrovascular events in essential hypertension. Circulation, 104: 2039–2044.
- Wallis E.J., Ramsay L.E., Haq I.U. et al. (2000) Coronary and cardiovascular risk estimation for primary prevention: validation of a new Sheffield table in the 1995 Scottish health survey population. BMJ, 320: 671–676.
- Wallis E.J., Ramsay L.E., Haq I.U. et al. (2001) Is coronary risk an accurate surrogate for cardiovascular risk for treatment decisions in mild hypertension? A population validation. J. Hypertens., 19: 691–696.
- Weiner D.E., Tighiouart H., Griffith J.L. (2007) Kidney disease, framingham risk scores, and cardiac and mortality outcomes, Am. J. Med., 6: e1–e8.
- Whitworth J.A.; World Health Organization, International Society of Hypertension Writing Group (2003) 2003 World Health Organization (WHO) / International Society of Hypertension (ISH) statement on management of hypertension. J. Hypertens., 21: 1983–1992.
- Willerson J.T., Ridtker P.M. (2004) Inflammation as a cardiovacular risk factor. Circulation, 109(Suppl. II): II-2–II-10.
- Wood D., De Backer G., Faergeman O. et al. (1998a) Prevention of coronary heart disease in clinical practice. Recommendations of the Second Joint Task Force of European and other Societies on coronary prevention. Eur. Heart J., 19: 1434–1503.
- Wood D., Durrington P., Poulter N. et al.; British Cardiac Society, British Hyperlipidaemia Association, British Hypertension Society and endorsed by the British Diabetic Association (1998b) Joint British recommendations on prevention of coronary heart disease in clinical practice. Heart, 80(Suppl. 2): S1–29.
- Yarnell J.W., Patterson C.C., Sweetnam P.M. et al. (2004) Haemostatic/inflammatory markers predict 10-year risk of IHD at least as well as lipids: The Caerphilly collaborative studies. Eur. Heart J., 25: 1049–1056.