ОБЩИЕ ПОЛОЖЕНИЯ
Значение острого коронарного синдрома, к которому относят как ИМ, так и нестабильную стенокардию, в формировании структуры заболеваемости и смертности от ИБС неоднократно демонстрировалось авторитетными клиническими исследованиями. Так, согласно европейскому регистру Euro Heart Survey on Acute Coronary Syndromes I (ACS-I, Европейского кардиологического исследования острого коронарного синдрома), который охватывал 25 стран Европы, в 2000–2001 гг. смертность и развитие нефатального ИМ за 6 мес после развития острого коронарного синдрома составляли 10,2% (рис. 2.1).
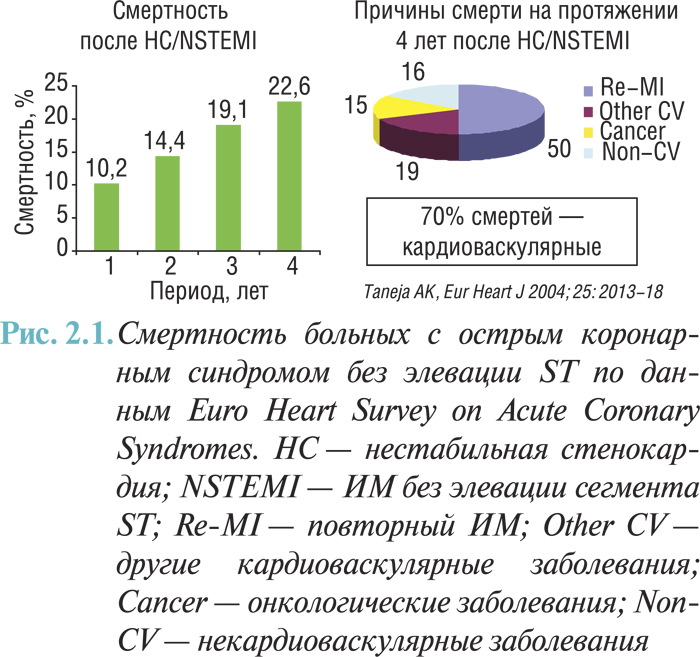
ACS-I включал 10 484 пациента, выписанных с диагнозом «острый коронарный синдром». Euro Heart Survey on Acute Coronary Syndromes II (ACS-II) включал 6385 пациентов (2004 г.) из 190 клиник 32 стран. Распределение по типам острого коронарного синдрома было сравнимо в обоих исследованиях — 42 и 47% составили больные с ИМ, остальные — выписаны с диагнозом «острый коронарный синдром без элевации ST» (NSTE-ACS). Средний возраст пациентов составлял 65 лет, % из них мужчины. 30-дневная смертность при остром коронарном синдроме без элевации ST практически не отличалась в двух исследованиях и составляла 3,5 и 3,4%, при ИМ снизилась с 8,4 до 6,4%.
Авторы отметили увеличение количества инвазивных процедур при остром коронарном синдроме без элевации ST. Увеличилось количество пациентов, которым проводили коронароангиографию, с 52 до 63%, повысилась также частота проведения перкутанного коронарного вмешательства — с 25 до 37%, включая стентирование — 18% в ACS-I и 34% — в ACS-II. Частота назначения оптимальной медикаментозной терапии (блокаторы β-адренорецепторов, антиагреганты, ингибиторы АПФ, статины) также повысилась с 2001 по 2004 г. Особенно значительно увеличилась доля статинов — с 53% в ACS-I до 80% в ACS-II и клопидогрела — с 29 до 61%.
Регистр GRACE (Global Registry of Acute Coronary Events), который охватывает 30 стран мира, дает приблизительно такие же цифры. Интересно, что оба регистра фиксируют преимущественно больных с острым коронарным синдромом без элевации сегмента ST (в GRACE — это 63%). Канадский регистр острого коронарного синдрома зарегистрировал высочайшую смертность на протяжении года именно среди пациентов с не-2-инфарктом — почти 10%.
Регистр острого коронарного синдрома — CRUSADE (Coronary Revascularization UltraSound Angioplasty DEvice trial) в США демонстрирует в значительной мере аналогичные цифры. Ангиография проводится в 62% случаев, перкутанное коронарное вмешательство — в 37%, АКШ — в 12%. Назначение медикаментозной терапии при выписке из клиники также аналогично — ацетилсалициловая кислота в 90% случаев, блокаторы β-адренорецепторов — 83%, ингибиторы АПФ — 61%, статины — 79%, клопидогрел — 56%. Средняя 7-дневная смертность составляет 4,7%.
КЛАССИФИКАЦИЯ
Согласно приказу № 436 Министерства здравоохранения Украины от 03.07.2006 г. в утвержденных протоколах предоставления медпомощи по специальности «Кардиология» в части «Предоставление медпомощи больным с острым коронарным синдромом без элевации ST (ИМ без зубца Q и нестабильная стенокардия)» эти патологические состояния относятся к рубрике I20–I22 по МКБ-10.
ПРИЗНАКИ И КРИТЕРИИ ДИАГНОСТИКИ ЗАБОЛЕВАНИЯ
Острый коронарный синдром — группа симптомов и признаков, позволяющих заподозрить острый ИМ или нестабильную стенокардию.
Термин «острый коронарный синдром» используется при первом контакте с больными как предварительный диагноз. Включает острый коронарный синдром со стойкой элевацией сегмента ST на ЭКГ и без таковой. Первый в большинстве случаев предшествует острому ИМ с зубцом Q на ЭКГ, второй — острому ИМ без зубца Q и нестабильной стенокардии (заключительные клинические диагнозы).
Острый ИМ — это некроз любой массы миокарда вследствие острой продолжительной ишемии. Нестабильная стенокардия — острая ишемия миокарда, тяжесть и продолжительность которой недостаточна для развития некроза миокарда. Острый ИМ без подъема ST без Q отличается от нестабильной стенокардии повышением уровня биохимических маркеров некроза миокарда в крови, которые при нестабильной стенокардии отсутствуют.
Практически можно выделить две категории пациентов с острым коронарным синдромом (определение Европейского общества кардиологов):
- Пациенты с возможным острым коронарным синдромом с продолжительным дискомфортом в грудной клетке и персистирующей элевацией сегмента ST (или возникшей блокадой левой ножки пучка Гиса). Сохранение элевации сегмента ST обычно свидетельствует об острой тотальной коронарной окклюзии. Цель терапии состоит в быстрой, полной и стойкой реканализации путем применения фибринолитиков (если они не противопоказаны) или выполнение первичной ангиопластики (если это технически возможно).
- Пациенты с болью в грудной клетке и изменениями на ЭКГ, которые могут свидетельствовать об ИБС. При этом нет персистирующей элевации сегмента ST, но есть стойкая или краткосрочная депрессия сегмента ST или инверсия зубца Т, уплощение зубца Т, псевдонормализация зубцов Т или неспецифические изменения ЭКГ; при поступлении больного может сохраняться нормальная картина ЭКГ. В эту категорию можно включить также пациентов с характерными для ишемии изменениями ЭКГ, но без симптомов («немая ишемия»).
Сейчас очевидно, что острые коронарные синдромы, а именно нестабильная стенокардия и ИМ, имеют общий анатомический субстрат. Паталогоанатомические, ангиоскопические и биологические наблюдения доказали, что нестабильная стенокардия и ИМ характеризуются разными клиническими проявлениями, но имеют одинаковый патофизиологический механизм, а именно разрыв атеросклеротической бляшки или ее эрозию, с различной степенью наложения тромба или дистальной эмболизацией. Разработаны клинические критерии, позволяющие клиницисту принимать своевременные решения и избирать лучшую тактику лечения, опираясь на стратификацию риска и патогенетический подход к вмешательству.
Стратегия ведения пациентов с острыми коронарными синдромами заключается в коррекции ишемии и симптомов, динамическом наблюдении путем серийной регистрации ЭКГ, повторных измерениях маркеров некроза миокарда (тропонина и МВ-фракции КФК) и начала соответствующей терапии после подтверждения диагноза.
Эти рекомендации касаются лишь ведения пациентов с подозрением на острый коронарный синдром без стойкой элевации сегмента ST.
Следует указать на несколько ограничений. Эти рекомендации максимально соответствуют рекомендациям Европейского общества кардиологов 2007 г. (Guidelines for the diagnosis and treatment of non-ST-segment elevation acute coronary syndromes. The Task Force for the Diagnosis and Treatment of Non-ST-Segment Elevation Acute Coronary Syndromes of the European Society of Cardiology. European Heart Journal (2007) 28, 1598–1660). Они базируются на доказательствах, полученных во многих клинических исследованиях. Необходимо помнить, что эти исследования выполняли на отобранных популяциях с определенными клиническими характеристиками, которые не всегда отображают реальную клиническую практику врача. Следует признать также быстрый прогресс в изучении острых коронарных синдромов; эти рекомендации отображают накопленные на это время знания. Следует также заметить, что рекомендации отображают наиболее современные технологии лечения острого коронарного синдрома, включая инвазивные вмешательства, возможность выполнения которых есть далеко не во всех клиниках Украины, но врачи должны знать современный алгоритм лечения острого коронарного синдрома и стараться выполнять его.
ПАТОФИЗИОЛОГИЯ
Исследования, выполненные на протяжении последних десятилетий, позволили понять и в значительной мере раскрыть сложные механизмы возникновения острого коронарного синдрома. В общем, острые коронарные синдромы обусловлены острым или подострым первичным снижением снабжения миокарда кислородом, которое провоцируется разрывом атеросклеротической бляшки, ассоциированным с воспалением, тромбозом, вазоконстрикцией и микроэмболизацией (рис. 2.2).
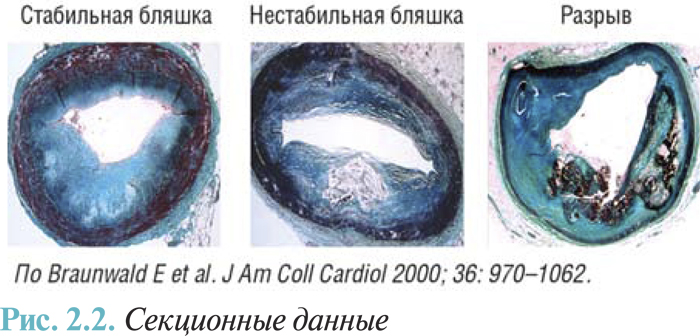
Разрыв бляшки и эрозия
Доказано, что атеросклероз — это не постепенный, линейный процесс, а скорее заболевание с фазами стабильности и нестабильности, внезапное и непредусмотренное изменение симптомов, очевидно, связанных с разрывом бляшки. Бляшки, склонные к разрыву, имеют большое липидное ядро, низкую плотность гладкомышечных клеток, высокую плотность макрофагов, тонкую фиброзную покрышку из дезорганизованного коллагена, а также высокую концентрацию тканевого фактора. Липидное ядро формирует клеточную массу внутри коллагенового матрикса бляшки. После гибели тучных клеток липидное ядро может создаваться путем активного растворения коллагена металлопротеиназами, а не только путем пассивного накопления. Липидное ядро бляшек, предрасположенных к разрыву, характеризуется высоким содержанием эфиров ХС со значительной долей полиненасыщенных жирных кислот. На граничных участках разорванных бляшек доля полиненасыщенных жирных кислот меньше по сравнению с их центром. Относительная пропорция различных жирных кислот может влиять на локальное формирование тромбоцитарных сгустков и тромба.
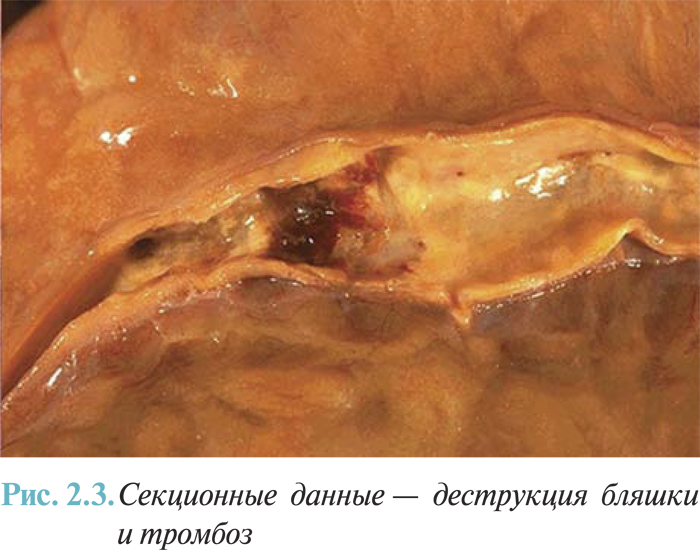
Активный разрыв, вероятно, связан с секрецией протеолитических энзимов макрофагами, которые могут ослабить фиброзную покрышку. Пассивный разрыв бляшки связан с физическими силами, которые действуют в наиболее слабом участке фиброзной покрышки в месте соединения бляшки и близлежащей «нормальной» стенки. Уязвимость бляшки может зависеть от кругового напряжения стенки, размещения, размера и состава липидного ядра, а также влияния потока крови на поверхность стенки бляшки. Кроме разрыва бляшки как один из базисных механизмов патогенеза острого коронарного синдрома описывали эрозию бляшки, которую выявляют чаще у женщин, пациентов с сахарным диабетом и АГ. Есть определенные доказательства того, что эрозия более распространена на фоне стеноза высокой степени, а также при локализации стеноза в правой коронарной артерии. При острой коронарной смерти ее распространенность оценивают в 40%, при остром ИМ — в 25%. Для разрыва бляшки эти показатели составляют соответственно 37% у женщин и 18% у мужчин. Когда возникает эрозия, тромб прилипает к поверхности бляшки, а когда бляшка разрывается, тромб вовлекает более глубокие пласты бляшки, вплоть до липидного ядра; когда последняя ситуация не корригируется соответствующими структурными изменениями, она может способствовать росту и быстрому прогрессированию атеросклеротической бляшки (рис. 2.3).
Воспаление
Клиническое течение ИБС часто характеризуется непрогнозируемостью, более чем в 60% случаев острый коронарный синдром развивается на фоне гемодинамически незначимого стеноза, не превышающего 50% и не вызывающего ишемических явлений. По данным метаанализа 4 крупных исследований, только в 14% случаев острый ИМ возникал на фоне стеноза выраженностью более 70%, а ангиографически установлено менее интенсивное поражение коронарных артерий у лиц с предшествовавшими острым коронарным синдромом или ИМ, чем у пациентов со стабильной стенокардией.
Данные клинических наблюдений свидетельствуют о том, что причиной развития острого коронарного синдрома является не выраженность стеноза, а нестабильность атеросклеротической бляшки, поэтому реваскуляризационные вмешательства уменьшают тяжесть симптомов стенокардии, повышают качество жизни больных с ИБС, но мало отражаются на риске развития ИМ. С другой стороны, липидокорригирующая терапия, практически не влияя на тяжесть стеноза, оказывает выраженное предупреждающее действие в отношении конечных точек.
В последние годы накапливается все больше фактов, свидетельствующих о ведущей роли воспаления не только в инициации и прогрессировании атеросклероза, но и развитии его острых клинических проявлений, поскольку нестабильность бляшки определяется прежде всего текущим в ней воспалительным процессом. Во многих случаях развитие острого коронарного синдрома провоцируется инфицированием, ведь известно, что частота развития ИМ и кардиальная смертность значительно возрастают во время и после бактериальных инфекций и эпидемий гриппа.
Большинство исследователей разделяет точку зрения, что активация системного воспаления у больных с острым коронарным синдромом является первичной и лежит в основе его развития, а не отражает реакцию на повреждение миокарда, хотя сам по себе некроз миокарда — мощный провоспалительный стимул. Повышенное содержание в крови маркеров воспаления является особенно значимым прогностическим признаком коронарных событий у лиц со стабильным или бессимптомным течением ИБС. Это убедительно свидетельствует в пользу того, что воспаление, лежащее в основе дестабилизации ИБС, имеет самостоятельный характер и в значительной мере независимо как от выраженности стенозирующего поражения коронарных сосудов, так и некроза миокарда.
Предпосылкой для развития нестабильности бляшки является и накопление в ней внеклеточных липидов, определяемое интенсивным апоптозом пенистых клеток макрофагальной природы. В бляшке возникает «зона смерти», где цитотоксические соединения типа оксистеролов, входящие в состав модифицированных липопротеинов, захваченных макрофагами, вызывают их дисфункцию и апоптоз.
Гепатоциты секретируют СРБ через 6 ч после специфической стимуляции. Поэтому наличие высокого уровня СРБ в период до 6 ч после появления симптоматики острого коронарного синдрома не может быть связано с некрозом миокарда и отражает уровень локального воспаления в бляшке до ее разрушения. Это подтверждалось и отсутствием у исследованных больных повышенного уровня в плазме крови МВ-фракции КФК или тропонина Т. Проведение секционного исследования погибших от ИМ показало, что уровень СРБ коррелировал с количеством склонных к разрушению тонкостенных бляшек. Эти данные свидетельствуют о том, что повышенный уровень СРБ в первые 6 ч развития острого коронарного синдрома отражает воспалительную активность в разрушенной бляшке.
В то же время высокий уровень белков острой фазы у пациентов с нестабильной стенокардией не коррелирует изолированно ни с выраженностью атеросклеротического поражения сосудов, ни с выраженностью некроза миокарда. Более четкая зависимость отмечена между активностью системного воспаления и характером динамики процесса после острого коронарного синдрома, выраженность острой фазы прямо коррелировала как с коротко-, так и с долговременным прогнозом. У 45% пациентов с нестабильной стенокардией, у которых уровень СРБ остается повышенным на протяжении 3 мес, риск повторных дестабилизаций на протяжении 1 года был более высоким.
Одной из непосредственных причин дестабилизации атеросклеротической бляшки может являться действие окисленных ЛПНП на лектиноподобные рецепторы LOX-1, экспрессируемые гладкомышечными клетками, с развитием их апоптоза. Этот эффект наиболее характерен для краев бляшки, наиболее склонных к разрушению; он полностью воспроизводится в условиях культуры, где окисленные ЛПНП в концентрации >60 мкг/мл вызывали гибель гладкомышечных клеток посредством апоптоза.
Таким образом, анализ данных литературы позволяет сделать заключение, что причиной разрушения бляшки с развитием острого коронарного синдрома является активация текущего в ней локального воспалительного процесса, что приводит к деструкции фиброзной капсулы в сочетании с возрастанием активности клеточных и плазменных факторов свертывающей системы и угнетением фибринолитической системы. Активность локального воспаления в сосудистой стенке может возрастать спонтанно или потенцироваться внешними факторами — системным воспалительным процессом с инфекционным, иммунным или аутоиммунным компонентами, гемодинамическими влияниями, прежде всего повышением АД, оксидантным стрессом. Действие каждого из потенцирующих факторов будет отражаться наличием в крови соответствующих маркеров — белков острой фазы, гидроперекисями липидов, сероположительностью к определенным возбудителям, антителами к модифицированным липопротеинам, HSP (белкам теплового шока). Именно поэтому наличие выраженного системного воспалительного процесса, высокий уровень СРБ в плазме крови существенно повышают риск разрушения атеросклеротической бляшки и развития острых коронарных явлений, но не являются обязательными для них. Острый коронарный синдром может развиваться и без выраженного повышения содержания в крови маркеров воспаления, так как уровень продукции воспалительных медиаторов непосредственно в бляшке не всегда достаточен для того, чтобы существенно отразиться на их содержании в системной циркуляции. Это объясняет, почему примерно в 50% случаев острый ИМ может развиваться на фоне нормального содержания в крови СРБ и других маркеров системного воспалительного процесса.
В эпидемиологических исследованиях даже умеренное повышение содержания в плазме крови СРБ у здоровых лиц сочетается с повышенным риском развития атеросклероза и ИБС. Показано, что у мужчин в верхнем квинтиле содержания СРБ (>2,1 мг/л) риск развития ИМ повышен в 3 раза, мозгового инсульта — в 2 раза по сравнению с лицами в нижнем квинтиле (0,55 мг/л). В проспективном исследовании 144 пациентов, у которых развилось симптоматическое поражение периферических артерий, уровень СРБ оказался на 35% выше (1,34 в сравнении с 0,99 мг/л соответственно), чем у 144 испытуемых, не имевших сосудистых поражений на протяжении 60 мес наблюдения. При этом риск развития поражения возрастал прогрессивно в каждом последующем квартиле концентрации СРБ.
Независимое прогностическое значение уровня СРБ в определении риска коронарных событий как у пациентов с ИБС, так и у здоровых лиц показано в результатах ряда многоцентровых исследований. У испытуемых с содержанием СРБ в верхнем квартиле риск развития ИМ был выше в 2,9 раза, эта зависимость сохранялась на протяжении 6 лет наблюдения. Среди 936 здоровых испытуемых риск развития основных кардиальных явлений на протяжении 8 лет наблюдения в верхнем квинтиле распределения концентрации СРБ был в 3 раза выше, чем у лиц в нижнем квинтиле.
Помимо этого, уровень СРБ является достоверным показателем исхода дестабилизации клинического течения ИБС — летальный исход был отмечен соответственно в 2,2; 3,6 и 7,5% случаев в каждом последующем тертиле распределения его концентрации в плазме крови у больных с острым коронарным синдромом. В другом исследовании на протяжении 8 лет наблюдения у лиц в верхнем квартиле содержания СРБ риск развития ИМ был в 2,9, а инсульта — в 1,9 раза выше, чем в нижней.
Результаты ряда крупных многоцентровых исследований подтвердили, что повышенный уровень СРБ в крови сочетается с неблагоприятным кратко- и долгосрочным прогнозом ИБС, повышенным риском развития коронарных событий. Установлено, что концентрация СРБ в крови у здоровых лиц и у больных с ИБС коррелирует с риском развития острого коронарного синдрома, инсульта или внезапной смерти и является их достоверным прогностическим признаком. В проспективном исследовании установлено, что содержание СРБ в плазме крови у пациентов с ИБС, у которых развился острый ИМ, было повышено в 4 раза по сравнению с нормой и в 2 раза — по сравнению с содержанием у лиц с неосложненным течением ИБС. У больных с нестабильной стенокардией уровень СРБ >3 мг/л сочетался с более чем двукратным повышением риска развития ИМ, эта зависимость усиливалась при повышении его уровня >10 мг/л. Повышенный уровень СРБ является достоверным предиктором повышенного риска развития ИМ, инсульта и необходимости коронарной реваскуляризации даже у лиц с содержанием ХС ЛПНП <130 мг/дл.
Уровень СРБ в крови у пациентов с нестабильной стенокардией не менее информативен в прогнозировании риска развития кардиальной смерти, чем уровень маркеров некроза миокарда. Показано, что среди пациентов с уровнем тропонина Т <0,06 мкг/л летальный исход на протяжении 37 мес наблюдения возникал в 1,2% случаев, до 0,6 мкг/л — в 8,7% случаев и с уровнем, превышающим 0,6 мкг/л, — в 15,4%. Среди пациентов с уровнем СРБ <2 мг/л смертность составила 5,7%, до 10 мг/л — 7,8%, >10 мг/л — 16,5%. Среди пациентов с содержанием фибриногена в крови <3,4 г/л кардиальная смерть отмечена в 5,4% случаев, с уровнем <3,9 г/л — в 12%, >4,0 г/л — в 12,9%. Между содержанием в крови СРБ и фибриногена, с одной стороны, и тропонина Т — с другой, не отмечено достоверной зависимости, что свидетельствует о том, что системное воспаление в большей степени является причиной развития острого ИМ, чем его следствием.
Установлено также наличие корреляции между риском развития тяжелых клинических исходов после проведения коронарной ангиопластики и исходным уровнем СРБ: к 30-му дню — в нижнем квартиле его содержания частота развития осложнений составила 3,9%, в верхнем — 14,2%. В то же время сама ангиопластика и имплантация стента также приводят к развитию воспаления и значительному возрастанию содержания в крови СРБ через 48–72 ч после вмешательства.
Трансформация стабильной стенокардии в нестабильную обычно сочетается с повышением уровня СРБ, сывороточного амилоида А (SAA) и интерлейкина-6 в плазме крови, что свидетельствует об активации локального и развитии системного воспалительного процесса.
У больных, перенесших нестабильную стенокардию, повышенный уровень СРБ (>3 мг/л) является предвестником повторной дестабилизации.
В то же время несмотря на отмечаемое у большинства пациентов с острым коронарным синдромом повышение содержания в крови маркеров воспаления и высокую значимость уровня СРБ как предиктора кардиальных событий у здоровых лиц, лиц группы высокого риска и пациентов со стабильной стенокардией, вопрос о том, в какой степени воспаление является причиной дестабилизации процесса, а в какой оно возникает как следствие повреждения миокарда, остается спорным. Некроз миокарда может являться мощным стимулом для продукции СРБ, и потому его уровень в крови рассматривается не только как предвестник, но и маркер повреждения сердца. Показано, что концентрация СРБ возрастает через 4–6 ч после развития ИМ и, удваиваясь каждые 6 ч, повышается через 24–96 ч в >100 раз.
В ряде исследований установлена корреляция между уровнем СРБ в крови, высвобождением КФК, размером зоны некроза, риском развития недостаточности ЛЖ и разрывов его стенки. На протяжении 1 года после перенесенного ИМ концентрация СРБ >20 мг/л являлась показателем высокого риска развития аневризмы желудочка, СН и кардиальной смерти.
Однако в других работах установлено, что уровень СРБ достоверно повышен у больных с острым ИМ преимущественно в тех случаях, где его развитию предшествовал достаточно длительный период нестабильной стенокардии, тогда как острое развитие ИМ может не сопровождаться повышением содержания в крови СРБ. Высокий уровень СРБ при остром коронарном синдроме отмечен и у пациентов без биохимических признаков некроза миокарда (тропонин-отрицательных) и поэтому может быть отражением активации хронического воспалительного состояния, характерного для атеросклероза и предрасполагающего к разрушению бляшки. У лиц с острым коронарным синдромом, но без признаков повреждения миокарда и повышения уровня тропонина I содержание СРБ <5 мг/л не сопровождалось повторным развитием кардиальных событий, >5 мг/л — в 11% случаев. Кроме того, у здоровых испытуемых прием ацетилсалициловой кислоты и статинов предотвращал развитие кардиальных событий только при высоких показателях СРБ. Помимо этого, выживаемость лиц с острым коронарным синдромом максимальна при нормальном уровне СРБ и тропонина и минимальна при возрастании уровня обоих, а повышенное значение каждого из показателей — тропонина, СРБ и интерлейкина-6 является достоверным предвестником тяжелого исхода. Наибольший риск развития повторных коронарных событий на протяжении 6 мес у лиц с острым коронарным синдромом отмечен при одновременном повышении уровня СРБ и тропонина I, тогда как при отсутствии этих изменений повторные кардиальные события не наблюдались. Эти данные также свидетельствуют о самостоятельном прогностическом значении уровня СРБ в крови, не зависящем от наличия некроза миокарда.
Прогностическая значимость уровня СРБ в плазме крови у лиц с ИБС определяется наличием прямой его зависимости от состояния бляшки. Так, при постмортальном исследовании 302 случаев внезапной смерти среднее значение СРБ составляло 3,2 мг/л при остром разрыве бляшки, 2,9 мг/л — при ее эрозии, 2,5 мг/л — при стабильной бляшке и 1,4 мкг/мл — в контроле, состояние бляшки коррелировало с уровнем СРБ независимо от возраста, пола, курения и ИМТ. Интенсивность окрашивания макрофагов атеросклеротических поражений по СРБ была достоверно более высокой в случаях повышенного его содержания в плазме крови, что означает наличие у лиц с ИБС прямой связи содержания СРБ в плазме крови и атеросклеротической бляшке. Существование этой связи патогенетически обусловлено тем, что СРБ может синтезироваться не только в печени, но и непосредственно в макрофагах в зоне воспаления. Показано, что в бляшках СРБ локализуется в пенистых клетках или связан внеклеточно с белками комплемента.
Приведенные данные означают, что СРБ прямо участвует в развитии воспалительного компонента атеросклероза, ИБС и ее острых форм и может являться как показателем активности процесса, так и одной из мишеней при проведении ангиопротекторных вмешательств.
Приведенные данные свидетельствуют о том, что воспаление играет определяющую роль не только в возникновении, но также в прогрессировании и разрушении атеросклеротической бляшки, а высокий уровень СРБ и ряда других маркеров активности воспаления прямо коррелирует с риском развития тяжелых коронарных событий.
Тромбоз
Тромбоз индуцируется в месте разрыва или эрозии бляшки. Может привести к быстрым изменениям выраженности стеноза, субтотальной или тотальной окклюзии сосуда. Наполненное липидами ядро, которое приоткрывается после разрыва бляшки, является высокотромбогенным и характеризуется более высокой концентрацией тканевого фактора, чем другие компоненты бляшки. Более того, существует сильная связь между активностью тканевого фактора и присутствием макрофагов. Системная прокоагулянтная активность моноцитов драматически возрастает при нестабильной стенокардии. Могут также вовлекаться другие факторы, которые способствуют системной гиперкоагуляции; в образовании тромба принимают участие также гиперхолестеринемия, фибриноген, нарушение фибринолиза и инфекция. Тромб, который появляется при остром коронарном синдроме, преимущественно богат тромбоцитами. Преходящие эпизоды окклюзии или субтотальной окклюзии сосудов и ассоциированные с этим преходящие симптомы и изменения ЭКГ можно объяснить спонтанным тромболизисом.
Однако нарушение целостности атеросклеротической бляшки не является единственной детерминантой развития острого коронарного синдрома. По результатам аутопсий бессимптомное разрушение бляшек в коронарных артериях отмечается примерно у 9% здоровых лиц, у 22% пациентов с сахарным диабетом и АГ. В то же время у лиц, погибших от кардиальных причин, менее 50% всех разрушившихся бляшек (в среднем более 2 в каждом случае) приводят к развитию внутрисосудистого тромбоза, достаточного для воспроизведения критического ограничения кровотока.
Вопрос о том, как окклюзирующий тромбоз коронарной артерии с последующим развитием ИМ может возникать на фоне умеренного стенозирования и уменьшения сосудистого просвета только на 50–60%, длительное время оставался неясным. Известно, что для развития стабильного тромба в месте повреждения сосудистой стенки необходимо уменьшение просвета не менее чем на 90–95%, поскольку в противном случае пристеночный тромб смывается потоком крови в связи с высокой скоростью движения в коронарных артериях и большим градиентом давления, возникающим в месте окклюзии. Это кажущееся противоречие получило четкое разъяснение в исследовании, основанном на сопоставлении коронароангиограмм, полученных у 20 больных в пределах 1 нед до развития ИМ, с теми, регистрация которых предшествовала ИМ на 3–6 мес. Результаты этого анализа свидетельствовали о том, что разрушение бляшки и возникновение окклюзирующего тромба с развитием ИМ разделены значительным промежутком времени. В сроки, предшествовавшие ИМ за несколько недель или месяцев, стеноз был слабо выражен (в среднем 30%), очень редко имел эксцентрический характер и неровности. За 3 дня до развития ИМ на фоне клинических признаков нестабильной стенокардии пораженный коронарный сегмент характеризовался значительным стенозом (в среднем 71%), эксцентрически расположенным поражением и множественными неровностями — индикаторами разрушения бляшки.
На основании этих данных авторы пришли к заключению, что разрушение бляшки сочетается с геморрагией в нее и развитием интрамурального тромба, в результате чего резко возрастает выраженность стеноза, возникают условия для образования окклюзирующего внутрисосудистого тромба, прекращения кровотока и развития ИМ. Поэтому кровотечение в разрушенную бляшку, развитие интрамурального тромба и резкое возрастание степени стеноза являются компонентами острого коронарного синдрома, обусловливающими развитие окклюзирующего тромба и острого ИМ у лиц, у которых за несколько дней до обострения стеноз мог даже не достигать гемодинамически значимого уровня.
Внутрисосудистое тромбообразование даже в условиях выраженных нарушений целостности сосудистой стенки является патологическим процессом и может возникать только при повышенной активности свертывающей системы крови. Поэтому нарушение гемостатической функции является одной из важнейших составляющих патогенеза острого коронарного синдрома и особенно его трансформации в ИМ. Многократно показано, что липиды и липопротеины оказывают модулирующее влияние на экспрессию и функцию тромботических, фибринолитических, реологических факторов и на гемостаз в целом.
Особенно это характерно для липопротеинов, богатых ТГ (ХМ и их ремнантов, ЛПОНП), которые повышают активность фактора VII (проконвертина), ингибитора активации плазминогена 1 типа (PAI-1), вязкость крови и плазмы крови. Они также активируют тромбоциты, стимулируют экспрессию транскрипционных факторов клетками эндотелия, тогда как ЛПВП ингибируют агрегацию тромбоцитов и эритроцитов, уменьшают вязкость крови, подавляют активность транскрипционных факторов и ингибитора активации плазминогена 1 типа. Поэтому характер реакции свертывающей системы и риск развития окклюзирующего тромба после разрушения или эрозии бляшки в значительной мере определяются уровнем и спектром липопротеинов крови.
Гипертриглицеридемия и алиментарная гиперлипидемия сопровождаются повышением активности фактора VII в результате того, что свободные жирные кислоты, образующиеся при гидролизе ТГ до ЛПОНП, частично остаются ассоциированными с их поверхностью, обусловливая появление на ней отрицательного заряда и активацию внешнего пути свертывания крови. Эти эффекты особенно выражены у лиц с нарушениями липидного обмена, характерными для сахарного диабета, и неоднократно установлено, что уровень ТГ, глюкозы и инсулина в крови прямо коррелирует с активностью ингибитора активации плазминогена 1-го типа и обратно — с активностью тканевого активатора плазминогена (t-PA). Помимо этого, повышение содержания ХМ, ЛПОНП и ЛПНП в крови сопровождается возрастанием ее вязкости, она существенно повышена у больных с фенотипом IV (семейная гипертриглицеридемия) и IIb (семейная гиперхолестеринемия). Сочетание этих изменений обусловливает значительное возрастание тромбогенной активности у лиц с повышенным содержанием в крови ремнант липопротеинов, богатых ТГ.
Тромб, формируемый в месте разрыва бляшки, может делиться на небольшие фрагменты, которые мигрируют вместе с течением крови, вызывая окклюзию артериол и капилляров. Эти тромбоцитарные эмболы способны служить причиной небольших участков некроза (минимальное повреждение миокарда, малые инфаркты) при отсутствии окклюзии эпикардиальной коронарной артерии.
Вазоконстрикция
Богатый на тромбоциты тромб может выделять вазоконстрикторные субстанции, такие как серотонин и тромбоксан А2. Это предопределяет вазоконстрикцию в месте разрыва бляшки или в микроциркуляторном русле. Описанный эффект является доминирующим фактором вариантной стенокардии Принцметала, что характеризуется преходящим, внезапным сужением сегмента коронарной артерии, которому не предшествует повышение потребности миокарда в кислороде. Эти эпизоды острой трансмуральной ишемии провоцируются локализованным коронарным вазоспазмом, который ведет к сильному сужению или окклюзии одной или больше больших эпикардиальных коронарных сосудов.
Миокард
Паталогоанатомические исследования у пациентов с острым коронарным синдромом без персистирующей элевации сегмента ST позволили выявить широкий спектр патологических изменений в миокарде, которые связаны с пораженным сосудом. При нестабильной стенокардии миокард может оставаться неизмененным или с различной степенью выраженности некроза. У некоторых пациентов выявляют участки некроза клеток в миокарде, появление которых объясняли повторными эпизодами эмболизации.
Сердечный тропонин Т или тропонин I являются наиболее чувствительными и специфическими маркерами миокардиального некроза, которые стали методами выбора в обследовании пациентов с подозрением на острый коронарный синдром. Ограниченные участки некроза часто не удается выявить рутинными измерениями КФК или МВ-фракции КФК. Содержание этих ферментов может оставаться в пределах нормы или несколько выше верхней границы нормы. Повышенные уровни сердечного тропонина при отсутствии изменений МВ-фракции КФК обозначают как «минимальное повреждение миокарда». Эта концепция имеет большое практическое значение относительно неблагоприятного исхода и выбора режима терапии.
ДИАГНОЗ
Жалобы
Клиническая картина острого коронарного синдрома включает широкое многообразие симптомов. Классические черты типичной ишемической сердечной боли хорошо известны. Обычно различают несколько вариантов клинического течения: продолжительный (>20 мин) — ангинозная боль в покое, возникновение впервые в жизни тяжелой стенокардии (III ФК по классификации Канадского общества по сердечно-сосудистым заболеваниям) или недавняя дестабилизация предварительно стабильной стенокардии с достижением по крайней мере III ФК (прогрессирующая стенокардия). Продолжительную боль отмечают у 80% пациентов, тогда как впервые возникшую тяжелую стенокардию или прогрессирующую стенокардию — лишь у 20%.
Впрочем, довольно распространенными являются атипические варианты течения острого коронарного синдрома. Они чаще наблюдаются у пациентов молодого (25–40 лет) и пожилого (>75 лет) возраста, пациентов с сахарным диабетом и женщин. К атипичным проявлениям нестабильной стенокардии относят боль, преимущественно в покое, боль в эпигастральном участке, нарушение со стороны ЖКТ, пульсирующая боль в грудной клетке, боль с некоторыми признаками плеврита, нарастание одышки. В одном из многоцентровых исследований острую ишемию миокарда диагностировали у 22% пациентов, которые поступали в отделение неотложной помощи с резкой или пульсирующей болью в грудной клетке, у 13% пациентов с болью типа плеврита и лишь у 7% пациентов, у которых боль в грудной клетке воспроизводилась путем пальпации. Кроме того, вариантную стенокардию, которая составляет часть спектра нестабильной стенокардии, нередко не удается диагностировать при поступлении больных.
Физикальное обследование
При физикальном обследовании, включающем, в частности, осмотр грудной клетки, аускультацию, измерение ЧСС и АД, нередко не выявляют патологических изменений. Цель обследования — исключить наличие некардиальных причин боли в грудной клетке, возможность неишемических сердечных расстройств (перикардит, заболевания клапанов сердца), потенциальных способствующих экстракардиальных факторов, пневмоторакса, признаков гемодинамической нестабильности и дисфункции ЛЖ.
ЭКГ
Регистрация ЭКГ в покое — ключевой элемент обследования пациентов с подозрением на острый коронарный синдром. Это полезное средство скрининга пациентов с атипическими жалобами, позволяющее выявить признаки других заболеваний, таких как перикардит, легочная эмболия или кардиомиопатия. Желательно осуществить запись ЭКГ в момент возникновения симптомов и сравнить ее графику с моментом, когда симптомы исчезнут. Очень ценную информацию дает сравнение с предыдущими ЭКГ, особенно у пациентов с сопутствующей сердечной патологией, такой как ГЛЖ или перенесенный ранее ИМ. Выраженные зубцы Q, которые могут свидетельствовать о предыдущем ИМ, позволяют заподозрить выраженный атеросклероз коронарных артерий, но не обязательно свидетельствуют о нестабильности состояния на момент обследования.
Сдвиги сегмента ST и изменения зубца Т — наиболее надежные ЭКГ-индикаторы нестабильной фазы течения ИБС. Депрессия сегмента ST более чем на 1 мм в двух или более отведениях ЭКГ, которая возникает на фоне соответствующего клинического состояния, с высокой вероятностью свидетельствует об остром коронарном синдроме, равно как инверсия зубцов Т (более чем на 1 мм) в отведениях с доминирующим зубцом R, хотя последнее изменение менее специфично.
Глубокая симметричная инверсия зубцов Т в передних грудных отведениях часто связана с тяжелым стенозом проксимального отдела левой передней нисходящей коронарной артерии. Неспецифические сдвиги сегмента ST и изменения зубца Т (менее чем на 1 мм) менее специфичны. Их нередко выявляют у пациентов, у которых другими методами удалось исключить нестабильную стенокардию. Иногда во время ишемических приступов возникают эпизоды блокады ножки пучка Гиса. Следует признать, что полностью нормальная картина ЭКГ у пациентов с типичными ангинозными симптомами не исключает возможности острого коронарного синдрома. Приблизительно у 5% больных с нормальной картиной ЭКГ, которых выписывали из отделений неотложной помощи, в конечном счете диагностировали острый ИМ или нестабильную стенокардию. Кроме того, регистрация нормальной ЭКГ у пациента с выраженной болью в грудной клетке свидетельствует о необходимости рассмотрения других возможных причин болевого синдрома.
Элевация сегмента ST свидетельствует о наличии трансмуральной ишемии, вызванной коронарной окклюзией. Персистирующая элевация сегмента ST характерна для формирования ИМ. Преходящую элевацию сегмента ST отмечают при остром коронарном синдроме и особенно при стенокардии Принцметала.
Для выявления или исключения наличия изменений сегмента ST во время обратимых эпизодов боли в грудной клетке или при немой ишемии миокарда полезно осуществлять мониторирование сегмента ST во множественных отведениях.
Биохимические маркеры повреждения миокарда
Среди маркеров некроза миокарда сейчас преимущество отдают сердечному тропонину Т или тропонину I, которые являются более специфичными и надежными в этих условиях, чем традиционные сердечные энзимы, такие как КФК или ее изоэнзим — МВ-фракция КФК. Установлено, что любое повышение содержания тропонина Т или I отображает некроз клеток миокарда. При наличии признаков ишемии миокарда (боль в груди, изменения сегмента ST) эти изменения расценивают как ИМ.
Комплекс тропонина формируется тремя отличительными структурными протеинами (тропонины I, С и T). Размещается в тонких волокнах сократительного аппарата ткани скелетных и сердечных мышц, которая регулирует кальций-зависимое взаимодействие миозина и актина. Сердечные изоформы всех трех тропонинов кодируются различными генами, их можно отличить моноклональными антителами, которые распознают определенную последовательность аминокислот. Сердечные изоформы тропонина T и I имеются исключительно в кардиомиоцитах. Поэтому выявление сердечного тропонина T или тропонина I специфично для повреждения миокарда, что позволяет говорить об этих маркерах как о новом золотом стандарте диагностики. При условиях «ложноположительного» повышения содержания МВ-фракции КФК, например при травме скелетных мышц, исследование тропонинов позволяет выявить наличие любого повреждения сердца. У пациентов с ИМ начальный рост концентрации тропонинов в периферической крови наблюдается через 3–4 ч, что обусловлено их высвобождением из депо, а при персистирующей элевации удерживается на протяжении до 2 нед, что связано с протеолизом контрактильного аппарата. Значительное пропорциональное повышение тропонинов и низкие концентрации тропонина в плазме крови у здоровых лиц позволяют выявлять повреждение миокарда приблизительно у И пациентов, которые поступают с нестабильной стенокардией, даже без изменения активности МВ-фракции КФК. Важно подчеркнуть, что повышение тропонина возможно при других опасных для жизни состояниях, которые проявляются болью в грудной клетке, таких как расслаивающая аневризма аорты или эмболия легких. Это необходимо учитывать при проведении дифференциальной диагностики.
Следует признать, что однократного определения содержания тропонина при поступлении пациента в госпиталь недостаточно, поскольку у 10–15% пациентов изменения содержания тропонина выявляют в более поздние часы. Для того чтобы установить или исключить наличие повреждения миокарда, на протяжении первых 6–12 ч после поступления или после любых последующих эпизодов сильной боли в грудной клетке необходимо повторять анализы крови. Если последний эпизод боли в грудной клетке был более чем за 12 ч до первого определения тропонина, второе определение можно пропустить при отсутствии других оснований подозревать ИМ.
Повышение содержания сердечных тропонинов также наблюдается в условиях неишемического повреждения миокарда. Это не следует рассматривать как ложноположительный результат тестов, а скорее как отображение чувствительности маркера. Истинные ложноположительные результаты документированы для тропонина T при скелетных миопатиях или ХПН, а для тропонина I — в связи со взаимодействием иммунных реактивов с цепями фибрина или гетерофильными антителами. Современные реактивы позволяют преодолеть эти ограничения, хотя иногда могут наблюдаться ложноположительные результаты.
Следует помнить, что ряд патологических состояний также может вызывать повышение уровня тропонина:
- Контузия сердца или другие травматические повреждения, включая операции шунтирования, абляции, установка искусственного водителя ритма и другие.
- Застойная СН — острая и хроническая.
- Расслоение аорты, заболевание аортальных клапанов.
- ГКМП.
- Тахи- или брадиаритмия, блокада.
- Апикальный «баллонный» синдром.
- Рабдомиолиз с повреждением миокарда.
- Эмболия ЛА, легочная гипертензия.
- Почечная недостаточность.
- Острые неврологические заболевания, включая инсульт или субарахноидальное кровотечение.
- Инфильтративные заболевания, такие как амилоидоз, саркоидоз, склеродермия.
- Воспалительные заболевания, такие как миокардит, перикардит, эндокардит.
- Отравление токсинами или лекарственным средством.
- У пациентов в критическом состоянии, особенно с дыхательной недостаточностью или сепсисом.
- Ожоги, особенно при >30% повреждении площади тела.
- Экстремальные перегрузки.
Не существует фундаментальных отличий между оценкой тропонина Т и тропонина I. Отличия результатов исследований преимущественно объясняются разными критериями включения пациентов, отличиями способа получения образцов крови для анализа, использованием реактивов с разными диагностическими границами.
Изменения во времени различных маркеров некроза миокарда приведены на рис. 2.4.
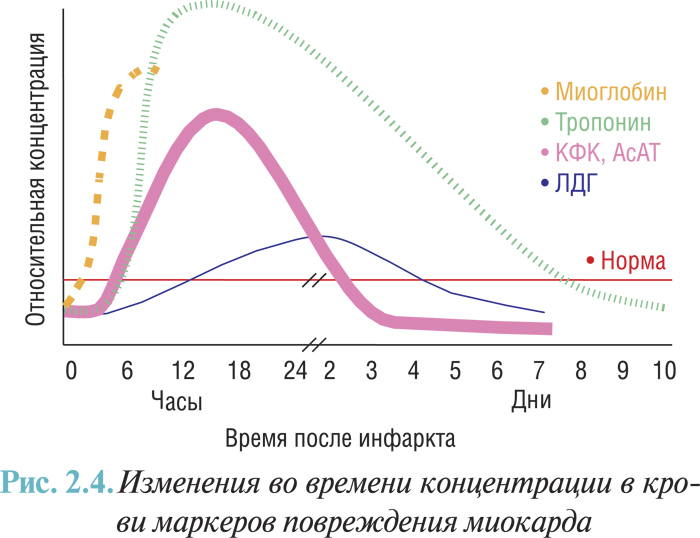
Миоглобин — относительно ранний маркер, тогда как изменение уровня МВ-фракции КФК или тропонина появляются позднее. У пациентов с обширным ИМ концентрация тропонина остается повышенной на протяжении 1–2 нед. Это может усложнять диагностику повторного некроза (реинфаркта) у пациентов с недавно перенесенным ИМ. В этом случае преимущество для выявления реинфаркта имеет повторное измерение МВ-фракции КФК или миоглобина.
Рекомендации по диагностике:
- У пациентов с подозрением на острые формы ИБС диагноз должен базироваться на комплексном анализе клинической картины, ЭКГ, уровня биомаркеров.
- Регистрацию 12 отведений ЭКГ в покое необходимо провести в пределах 10 мин от момента первого контакта больного с врачом и повторять при возобновлении симптомов, через 6 и 24 ч и при выписке из госпиталя.
- Измерение уровня тропонина Т или I необходимо осуществлять при поступлении больного на протяжении 60 мин и повторить через 6–12 ч при первичном отрицательном результате.
- У пациентов без возобновления ангинозной боли при нормальной ЭКГ и тропониновом тесте показано перед выпиской проведение неинвазивных стресс-тестов.
ОЦЕНКА РИСКА
Выбор тактики ведения пациентов с установленным диагнозом «острый коронарный синдром» определяется риском прогрессирования в острый ИМ и риском смерти.
Острые коронарные синдромы диагностируют в гетерогенной группе пациентов с разнообразными клиническими проявлениями, отличиями степени и выраженности коронарного атеросклероза и различным риском формирования тромбоза (а именно с быстрым прогрессированием в ИМ). Для индивидуализированного выбора адекватного лечения необходимо повторно оценивать риск возникновения тяжелых последствий острого коронарного синдрома. Такую оценку следует проводить от момента установления диагноза или поступления больного в госпиталь, базируясь на доступной клинической информации и данных лабораторных исследований. Первичная оценка позже дополняется информацией о динамике симптомов, ЭКГ-признаках ишемии, результатами лабораторных тестов и функционального состояния ЛЖ. Кроме возраста и предыдущего анамнеза ИБС, ключевыми элементами оценки риска являются клиническое обследование, оценка ЭКГ и биохимических параметров.
Факторы риска
Пожилой возраст и мужской пол ассоциируются с более тяжелым течением ИБС и повышенным риском неблагоприятного исхода. Возникновение в прошлом таких проявлений ИБС, как тяжелая или продолжительная стенокардия или предыдущий ИМ, также ассоциируется с более частыми последующими событиями. Другие факторы риска — наличие в анамнезе дисфункции ЛЖ или застойной СН, а также сахарный диабет и АГ. Большинство хорошо известных факторов риска являются также индикаторами более плохого прогноза у пациентов с нестабильным течением ИБС.
Клиническая картина
Важную информацию для оценки прогноза обеспечивают оценка клинической картины, продолжительность периода после последнего эпизода ишемии, наличие стенокардии в покое и ответ на медикаментозное лечение. Классификация, предложенная Ю. Браунвальдом, базируется на клинических особенностях и позволяет оценить клинические исходы. Именно этой классификацией преимущественно пользуются в научных исследованиях. Но для выбора оптимальной тактики лечения следует также принимать во внимание другие индикаторы риска.
ЭКГ
ЭКГ — важнейший метод не только для установления диагноза, но и для прогностической оценки. У пациентов с депрессией сегмента ST риск развития последующих сердечных событий выше, чем у таковых с изолированной инверсией зубца Т, у которых в свою очередь риск выше, чем в случае нормальной картины ЭКГ при поступлении.
Результаты некоторых исследований порождают сомнения относительно прогностического значения изолированной инверсии зубца Т. Стандартная ЭКГ в покое не отображает адекватно динамику развития коронарного тромбоза и ишемии миокарда. Почти % эпизодов ишемии при дестабилизации ИБС немые и потому с малой вероятностью могут быть выявлены при обычной регистрации ЭКГ. Полезную информацию может дать холтеровское мониторирование ЭКГ, но его результаты получают лишь через несколько часов или дней после записи. Перспективной методикой является компьютеризированное мониторирование ЭКГ в 12 отведениях в режиме реального времени (on-line). У 15–30% пациентов с дестабилизацией ИБС выявляют преходящие эпизоды колебаний сегмента ST, преимущественно депрессии. У этих пациентов риск развития последующих кардиальных событий возрастает. Кроме регистрации ЭКГ в покое и других распространенных клинических параметров, независимую прогностическую информацию обеспечивает мониторирование ЭКГ. У пациентов с количеством ишемических эпизодов >0–2 в сутки частота смерти или развития ИМ через 30 дней составляла 9,5%, у пациентов с количеством ишемических эпизодов >2–5 и >5 — 12,7 и 19,7% соответственно.
Маркеры повреждения миокарда
У пациентов с нестабильным течением ИБС с повышенными уровнями тропонина ранние и отдаленные клинические исходы неблагоприятны по сравнению с таковыми у пациентов без изменений уровня тропонина. Появление в крови маркеров некроза миокарда, в частности сердечных тропонинов на фоне сердечного события, ассоциируется с риском развития реинфаркта и сердечной смерти. Риск возникновения новых событий коррелирует со степенью повышения уровня тропонина. По данным B. Lindahl, выраженное повышение уровня тропонина ассоциируется с высокой смертностью при продолжительном наблюдении, сниженной функцией ЛЖ, но умеренным риском реинфаркта. Повышение риска, связанное с изменением уровней тропонина, не зависит от других факторов риска, в частности изменений ЭКГ в покое или при продолжительном мониторировании ЭКГ, а также маркеров воспалительной активности. Немедленная оценка уровня тропонина полезна для определения раннего риска у пациентов с острым коронарным синдромом. Выявление пациентов с повышенными уровнями тропонина также полезно для выбора тактики лечения у лиц с нестабильным течением ИБС. В недавно законченных исследованиях показано, что особую пользу при повышении уровня тропонина дают низкомолекулярные гепарины и ингибиторы гликопротеиновых рецепторов IIb/IIIa в отличие от случаев, когда уровень тропонина не повышается.
Маркеры воспалительной активности
Сообщали о том, что факторами риска у пациентов с острым коронарным синдромом является повышение уровней фибриногена и СРБ, но эти данные подтверждаются не во всех исследованиях. Например, в исследовании FRISC (FRagmin during InStability in Coronary artery disease) повышение уровня фибриногена ассоциировалось с повышенным риском смерти при коротком и длительном наблюдении и/или повышенным риском дальнейшего развития ИМ. Прогностическое значение уровня фибриногена не зависело от данных ЭКГ и уровней тропонина. Впрочем, в исследовании TIMI III (Thrombolysis In Myocardial Infarction) гиперфибриногенемия ассоциировалась с большим количеством ишемических эпизодов во время пребывания пациентов в госпитале; вместе с тем не отмечали связи со случаями смерти или ИМ во время 42-дневного наблюдения. Прогностическое значение повышения уровня СРБ отмечается наиболее высоким у пациентов с признаками повреждения миокарда. В некоторых исследованиях повышение концентрации СРБ преимущественно связано с риском смерти при продолжительном наблюдении в отличие от уровня фибриногена, который связан с риском дальнейшего возникновения ИМ и смертностью (рис. 2.5).
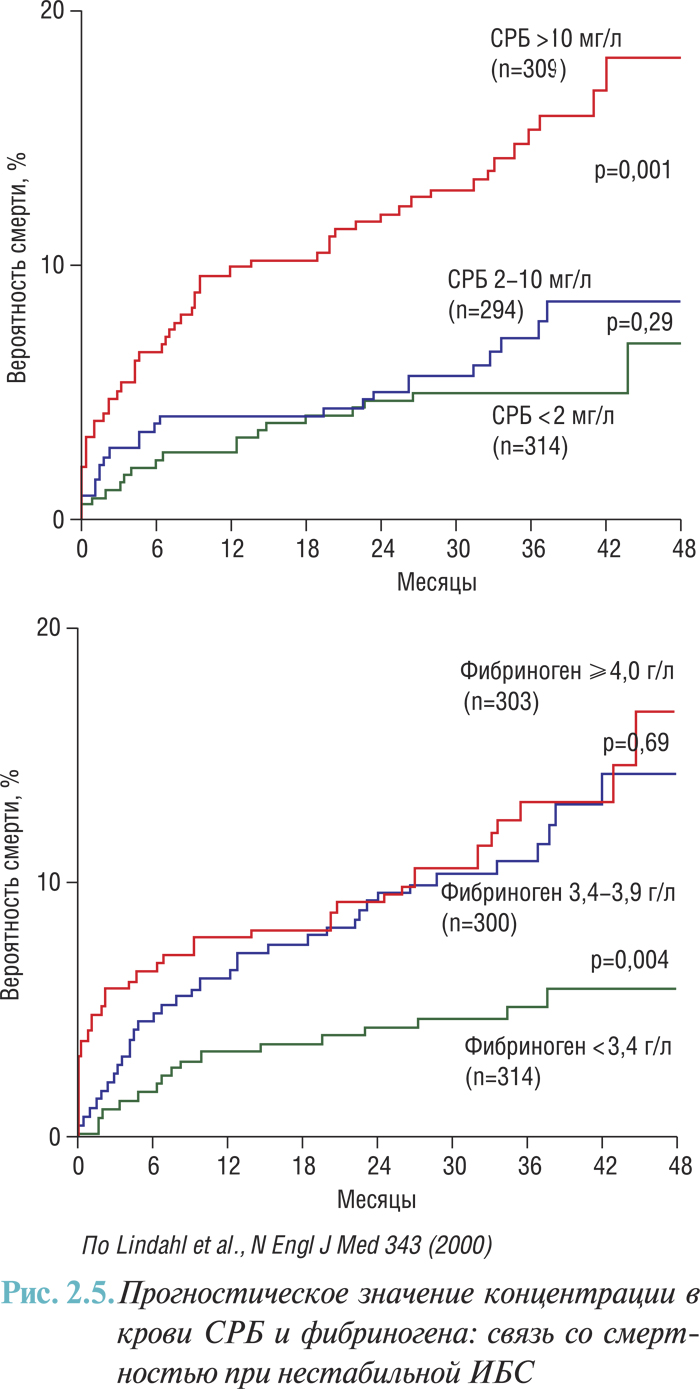
Тропонин Т и СРБ сильно коррелируют с риском сердечной смерти при продолжительном их выявлении и являются независимыми факторами риска, но их эффекты аддитивны один к другому и к другим клиническим маркерам.
Сильными предикторами смертности при непродолжительном и длительном наблюдении являются повышенные уровни МНУП и интерлейкина-6.
У пациентов с острыми коронарными синдромами выявили раннее повышение содержания растворимых внутриклеточных молекул адгезии и интерлейкина-6. Повышенные уровни интерлейкина-6 позволяют также идентифицировать пациентов с максимальной ожидаемой пользой от ранней инвазивной стратегии и длительного антитромботического лечения. Более детальное изучение этих маркеров может обеспечить дополнительную информацию о патогенезе острых коронарных синдромов.
Маркеры тромбоза
Связь между повышенным образованием тромбина и неблагоприятным исходом у пациентов с нестабильной стенокардией выявляли в некоторых, но не во всех исследованиях.
С формированием венозного тромбоза ассоциированы такие изменения антикоагулянтной системы, как дефицит протеина С (активируемого фактора коагуляции XIV), протеина S (кофактора протеина С), антитромбина. Но риск острого коронарного синдрома не связан ни с одним из этих факторов. В популяции и у пациентов с нестабильной стенокардией риск будущих коронарных событий был выше у пациентов со сниженной фибринолитической активностью крови. До настоящего времени проведено лишь несколько больших исследований фибринолитической активности и ее связи с острофазовыми протеинами у пациентов с дестабилизацией ИБС. Сейчас исследование маркеров гемостаза не рекомендуют для стратификации риска или выбора индивидуализированного лечения при дестабилизации ИБС.
Эхокардиография
Систолическая функция ЛЖ — важный параметр для оценки прогноза, который можно легко и точно оценить методом эхоКГ. Во время ишемии выявляют участки преходящей гипокинезии или акинезии сегментов стенки ЛЖ, функция которых восстанавливается после нормализации кровотока. Фоновая дисфункция ЛЖ, а также другие состояния, такие как аортальный стеноз или ГКМП, имеют важное значение в прогностической оценке и ведении таких больных.
Нагрузочный тест перед выпиской
После стабилизации состояния и перед выпиской больного полезным средством верификации диагноза ИБС, оценки раннего и отдаленного риска развития коронарных событий является стресс-тест.
Проба с физической нагрузкой имеет высокую негативную прогностическую ценность. Параметры, отображающие функцию сердца, дают по крайней мере такую же ценную прогностическую информацию, как индексы ишемии миокарда, а объединение этих параметров обеспечивает дополнительную информацию для оценки прогноза. Немало пациентов не могут выполнить пробу с физической нагрузкой, и это само по себе свидетельствует о плохом прогнозе. Для повышения чувствительности и специфичности оценки прогноза в этих случаях, особенно у женщин, используют такие методы визуализации сердца, как перфузионная сцинтиграфия миокарда и стресс-эхоКГ. Но длительных исследований прогностического значения стресс-эхоКГ у пациентов, которые перенесли эпизод дестабилизации ИБС, до этого времени недостаточно.
Коронарная ангиография
Это исследование дает уникальную информацию о наличии и тяжести ИБС. У пациентов со множественным поражением сосудов, а также со стенозом ствола левой коронарной артерии риск развития тяжелых сердечных событий выше. Ангиографическая оценка характеристик и локализации повреждения сосудов осуществляется в тех случаях, когда рассматривается необходимость реваскуляризации. Индикаторами риска являются сложные, продольные и сильно кальцифицированные повреждения, ангуляции сосудов. Но наиболее высоким является риск при наличии дефектов наполнения, которые указывают на внутрикоронарный тромбоз.
Рекомендации по стратификации риска
Оценка риска должна быть точной, надежной и желательно несложной и доступной, связанной с наименьшими затратами. Рекомендуется использовать метод оценки риска с помощью программы GRACE (Global Registry of Acute Coronary Events), которая загружается с сайта: www.outcomes.org/grace. После ответа на вопросы программы полученные итоговые цифры размещают в табл. 2.1, что поможет определить кратко- и долгосрочный риск течения ИБС у пациентов, перенесших острый коронарный синдром.
Таблица 2.1
Прогнозирование у больных, перенесших острый коронарный синдром
|
Категории риска, рассчитанные по прогнозированию госпитальной смертности и смертности через 6 мес (GRACE risk score) |
||
| Категория риска | Баллы риска по шкале GRACE | Госпитальная летальность, % |
| Низкий | <108 | <1 |
| Промежуточный | 109–140 | 1–3 |
| Высокий | >140 | >3 |
| Категория риска | Баллы риска по шкале GRACE | Смертность за 6 мес, % |
| Низкий | <88 | <3 |
| Промежуточный | 89–118 | 3–8 |
| Высокий | >118 | >8 |
ЛЕЧЕНИЕ
Противоишемические средства
Эти препараты уменьшают потребление миокардом кислорода через снижение ЧСС, АД или ослабление сократительности ЛЖ или вызывают вазодилатацию.
Блокаторы β-адренорецепторов
Доказательства благоприятных эффектов блокаторов β-адренорецепторов при нестабильной стенокардии базируются на результатах небольших по объему рандомизированных исследований, патофизиологических соображениях и экстраполяции опыта лечения стабильной стенокардии и острого ИМ. Блокаторы β-адренорецепторов — конкурентные ингибиторы эффектов циркулирующих катехоламинов. При нестабильной стенокардии первичные эффекты блокаторов β-адренорецепторов обусловлены их влиянием на β1-адренорецепторы и уменьшением потребления миокардом кислорода.
По данным метаанализа, лечение блокаторами β-адренорецепторов ассоциируется со снижением на 13% риска прогрессирования в острый ИМ. Кроме того, в рандомизированных исследованиях доказан достоверный эффект блокаторов β-адренорецепторов на смертность при остром ИМ. Блокаторы β-адренорецепторов рекомендуют при остром коронарном синдроме при отсутствии противопоказаний; у пациентов групп высокого риска предпочтение отдают внутривенному введению этих препаратов (уровень доказательности В). Убедительных данных о том, что определенный препарат группы блокаторов β-адренорецепторов более эффективен при нестабильной стенокардии, нет. Если вероятность возникновения побочных эффектов высокая, в частности при фоновом легочном заболевании или дисфункции ЛЖ, в начале лечения предпочтение чаще отдают препарату короткого действия. Начало парентеральной терапии блокаторами β-адренорецепторов требует тщательного контроля функции жизненно важных органов и желательно продолжительного мониторирования ЭКГ. Затем переходят на пероральное применение блокаторов β-адренорецепторов для достижения целевой ЧСС 50–60 уд./мин. Противопоказаниями к назначению блокаторов β-адренорецепторов являются тяжелые нарушения AV-проводимости, анамнестические указания о БА или острой дисфункции ЛЖ.
Нитраты
Применение нитратов при нестабильной стенокардии преимущественно базируется на патофизиологических соображениях и клиническом опыте. Благоприятный эффект нитратов и других классов препаратов, таких как сиднонимины, связан с их влиянием на периферическое и коронарное кровообращение. Прежде всего терапевтическое действие нитратов определяется эффектом венодилатации, уменьшением преднагрузки и КДО ЛЖ, который ведет к уменьшению потребления миокардом кислорода. Кроме того, нитраты расширяют нормальные и атеросклеротично измененные коронарные артерии, увеличивают коронарный коллатеральный кровоток и угнетают агрегацию тромбоцитов.
Исследования эффективности нитратов при нестабильной стенокардии были небольшими по объему и носили характер наблюдений.
До сих пор не проводили рандомизированных плацебо-контролируемых исследований, в которых был бы доказан благоприятный эффект этого класса препаратов в уменьшении выраженности симптомов и количества неблагоприятных сердечных событий, а также представлены отличия различных способов введения нитратов (внутривенного, перорального, буккального) относительно уменьшения выраженности клинических симптомов.
У пациентов с острыми коронарными синдромами, нуждающимися в госпитальном лечении, при отсутствии противопоказаний следует рассмотреть необходимость внутривенного введения нитратов (уровень доказательности С). Дозу нужно титровать до исчезновения симптомов или до появления побочных эффектов (особенно головной боли или артериальной гипотензии). Ограничением для продолжительной терапии нитратами является феномен толерантности, который зависит от назначенной дозы и продолжительности лечения.
После достижения клинического эффекта внутривенное введение нитратов можно заменить альтернативными методами непарентерального введения с достаточными интервалами между приемами препарата. Другой возможный путь связан с применением нитратоподобных средств, таких как сиднонимины и активаторы калиевых каналов.
Блокаторы кальциевых каналов
Блокаторы кальциевых каналов — вазодилатирующие препараты. Кроме того, они оказывают непосредственное влияние на AV-проведение импульсов и ЧСС. По химической структуре и фармакологическим эффектам различают три подкласса блокаторов кальциевых каналов: дигидропиридиновые производные (нифедипин), производные бензотиазепина (дилтиазем) и производные фенилалкиламина (верапамил). Препараты каждого подкласса отличаются по своему вазодилатирующему действию, способности угнетать сократительную функцию миокарда и замедлять AV-проведение импульсов. AV-блокаду могут вызывать фенилалкиламины. Нифедипин и амлодипин обусловливают наиболее выраженную дилатацию периферических артерий, тогда как дилтиазем характеризуется наиболее слабым вазодилатирующим эффектом. Все подклассы обеспечивают подобную коронарную вазодилатацию.
В нескольких рандомизированных клинических исследованиях установлено, что блокаторы кальциевых каналов эффективны относительно уменьшения выраженности симптомов у пациентов с нестабильной стенокардией, причем их эффект подобен тому, что вызывают блокаторы β-адренорецепторов. При сравнении нифедипина и метопролола выявлено, что при лечении нифедипином отмечена тенденция к повышению риска развития ИМ или возвратной стенокардии по сравнению с плацебо, тогда как при применении метопролола или комбинации двух препаратов частота этих событий снизилась. В одном исследовании пациентам с нестабильной стенокардией на протяжении 51 нед после выписки назначали блокаторы β-адренорецепторов или дилтиазем. На фоне дилтиазема отмечали недостоверное повышение риска смерти (33% против 20%) и повторной госпитализации (уровень риска 1,4). Впрочем, в двух других исследованиях дилтиазем оказывал незначительный благоприятный эффект.
Результаты метаанализа эффектов блокаторов кальциевых каналов у пациентов с нестабильной стенокардией позволили предположить, что эти препараты не предотвращают развития острого ИМ и не снижают смертность. В частности, лечение короткодействующим нифедипином может ассоциироваться с дозозависимым отрицательным эффектом относительно смертности у пациентов с ИБС. С другой стороны, существуют доказательства защитного влияния дилтиазема и верапамила при ИМ без элевации сегмента ST (уровень доказательности С).
Блокаторы кальциевых каналов обеспечивают уменьшение выраженности симптомов у пациентов, которые уже получают нитраты и блокаторы β-адренорецепторов; их назначение целесообразно у некоторых пациентов с противопоказаниями к блокаторам β-адренорецепторов, а также в подгруппе пациентов с вариантной стенокардией. Нифедипин и другие производные дигидропиридина не следует применять без сопутствующей терапии блокаторами β-адренорецепторов. Применение препаратов группы блокаторов кальциевых каналов необходимо избегать при выраженной дисфункции ЛЖ или нарушениях AV-проведения импульсов.
Таким образом, антиишемическая терапия сводится к следующему:
- Блокаторы β-адренорецепторов рекомендованы при отсутствии противопоказаний, особенно при наличии АГ или тахикардии (IB).
- Внутривенное или пероральное введение нитратов используется для купирования ангинозных атак (IC).
- Блокаторы кальциевых каналов назначают как симтоматическую терапию дополнительно к нитратам и блокаторам β-адренорецепторов или у пациентов с противопоказаниями к блокаторам β-адренорецепторов или в подгруппах с вазоспастической стенокардией (IB).
- Нифедипин или другие дигидропиридиновые препараты не применяют (IIIB), особенно в комбинации с блокаторами β-адренорецепторов.
Антитромбиновые препараты
Внутрикоронарный тромбоз имеет существенное значение в патогенезе острых коронарных синдромов. Исходя из того, что тромб состоит из фибрина и тромбоцитов, предотвратить его формирование и способствовать его растворению могут такие группы препаратов:
- ингибиторы тромбина: прямые (гирудин) и косвенные (нефракционированный гепарин, низкомолекулярный гепарин);
- антитромбоцитарные средства (ацетилсалициловая кислота, тиклопидин, блокаторы гликопротеиновых рецепторов IIb/IIIa);
- фибринолитические средства.
Гепарин и низкомолекулярный гепарин
В предыдущих рекомендациях по лечению пациентов с нестабильной стенокардией и ИМ без элевации сегмента ST нефракционированный гепарин был признан средством выбора при проведении антитромбиновой терапии. Впрочем, доказательства эффективности нефракционированного гепарина менее убедительны, чем других стратегий лечения. В клинической практике поддержание терапевтического протромбинового контроля затруднено в связи с непрогнозируемым связыванием гепарина с протеинами плазмы крови. Кроме того, гепарин характеризуется ограниченной эффективностью в случаях, когда тромбин связан со сгустками, богатыми тромбоцитами.
Недостатки нефракционированного гепарина:
- гепарин связывается с белками плазмы крови, адсорбируется на поверхности эндотелиальных клеток, фагоцитируется макрофагами — утрата биологической активности вводимого гепарина и плохая предсказуемость антикоагулянтного эффекта у конкретного больного;
- при назначении гепарина с лечебной целью необходим тщательный индивидуальный лабораторный контроль. В одном из крупных исследований TIMI 9B установлено, что во время внутривенного введения гепарина АЧТВ находилось в пределах терапевтических значений только около 30% всего времени в течение суток;
- практически сложно обеспечить как минимум 48 (лучше 72)-часовую непрерывную внутривенную инфузию препарата;
- тромбоцитарный фактор IV способен инактивировать гепарин, помимо этого тромбоциты способны связывать фактор Xa и таким образом защищать его от действия гепарина;
- гепарин ввиду больших размеров своей молекулы не способен инактивировать тромбин, связанный с фибрином и субэндотелиальными структурами, таким образом гепарин не может активно противодействовать фибринообразованию в месте разрыва бляшки;
- гепарин способен усиливать агрегацию тромбоцитов под влиянием различных индукторов, кроме тромбина;
- показано, что при нестабильной стенокардии применение гепарина с поддержанием АЧТВ в 2 раза выше контроля сопровождается быстрым снижением уровня фибринопептида А, однако снижения уровня фрагмента протромбина 1+2 (F1+2) не происходит. Таким образом, снижая активность тромбина, гепарин не влияет на его образование и риск развития тромбоза во время терапии гепарином сохраняется;
- действие гепарина продолжается только в течение его непрерывной внутривенной инфузии, более того, после прекращения гепаринотерапии отмечают реактивацию тромботического процесса с возможным развитием ИМ;
- частота иммунной тромбоцитопении на фоне введения гепарина составляет 1–3%, ее возникновение связано с появлением антител к гепарину и компонентам мембраны тромбоцитов, которые активируют тромбоциты и вызывают распространенный тромбоз микрососудов, сама тромбоцитопения носит вторичный характер и образуется в результате потребления тромбоцитов в образующихся тромбах.
При отсутствии ацетилсалициловой кислоты лечение гепарином ассоциируется с более низкой частотой возникновения рефрактерной стенокардии, ИМ и смерти по сравнению с плацебо (снижение риска на 29%), тогда как ацетилсалициловая кислота снижает риск по сравнению с плацебо на 56%. Комбинация ацетилсалициловой кислоты и гепарина не имела достоверно большего защитного эффекта, чем ацетилсалициловая кислота в качестве монотерапии. Начальный защитный эффект гепарина терялся после прекращения терапии (феномен рикошета). Соответственно не было доказательств стойкого защитного эффекта гепарина.
По данным метаанализа эффектов гепарина в дополнение к терапии ацетилсалициловой кислотой у пациентов с нестабильной стенокардией (6 рандомизированных исследований) частота смерти или ИМ в группе ацетилсалициловая кислота + гепарин составляла 7,9%, в группе монотерапии ацетилсалициловой кислотой — 10,3% (абсолютное снижение риска на 2,4%; соотношение риска 0,74 (95% доверительные интервалы (ДИ) 0,5–1,09); p=0,10 (уровень доказательности В).
Эти результаты не позволяют уверенно говорить о целесообразности назначения гепарина в дополнение к ацетилсалициловой кислоте. Впрочем, большие по объему исследования до настоящего времени не проводились. Несмотря на это, в клинических руководствах рекомендуют применять стратегию одновременного применения нефракционированного гепарина и ацетилсалициловой кислоты, что можно расценивать как прагматическую экстраполяцию существующих доказательств.
По сравнению с нефракционированным гепарином низкомолекулярные гепарины характеризуются усиленной активностью против фактора Ха, сравнительно с активностью против фактора анти-IIа (антитромбиновая активность). Кроме того, низкомолекулярные гепарины менее чувствительны к тромбоцитарному фактору 4 и имеют более прогнозированный антикоагулянтный эффект с меньшей вероятностью возникновения тромбоцитопении.
Преимуществами низкомолекулярного гепарина также являются:
- значительно лучшая по сравнению с обычным гепарином прогнозируемость антитромботического эффекта ввиду отсутствия связывания с белками плазмы крови и мембранами эндотелиоцитов, соответственно терапия низкомолекулярными гепаринами не требует столь тщательного индивидуального лабораторного контроля;
- более высокая биодоступность (до 90% после глубокой подкожной инъекции) низкомолекулярных гепаринов, что позволяет назначать их подкожно не только с профилактической, но и лечебной целью;
- более продолжительная антитромботическая активность (период полувыведения >4,5 ч после внутривенного введения против 50–60 мин у обычного гепарина) с возможностью назначения 1–2 раза в сутки.
Эти препараты можно назначать подкожно, исходя из дозы, которая зависит от массы тела пациента; при этом не требуется лабораторный контроль. Различные низкомолекулярные гепарины характеризуются сходной активностью в предотвращении и лечении венозного тромбоза, несмотря на некоторые отличия в фармакологии и периоде полувыведения. В нескольких клинических исследованиях, проведенных в последнее время, сравнивали эффективность низкомолекулярных гепаринов с плацебо или с нефракционированным гепарином.
В исследовании FRISC доказали пользу применения дальтепарина по сравнению с плацебо у пациентов с нестабильной стенокардией или ИМ без элевации сегмента ST, которые получали фоновую терапию ацетилсалициловой кислотой, а также целесообразность назначения такого лечения на протяжении длительного периода. В 4 рандомизированных исследованиях сравнивали эффективность различных низкомолекулярных гепаринов и нефракционированного гепарина.
Результаты метаанализа 4 исследований не позволили получить убедительные доказательства отличия безопасности и эффективности между низкомолекулярными гепаринами и нефракционированным гепарином. Метаанализ свидетельствовал о том, что продолжительное применение низкомолекулярных гепаринов ассоциировалось с повышением риска больших кровотечений (соотношение риска 2,26; 95% ДИ 1,63–3,41; p<0,0001).
Тем не менее, результаты дальнейших исследований изменили точку зрения на эффективность низкомолекулярных гепаринов. Существуют убедительные доказательства того, что у пациентов, которые получают ацетилсалициловую кислоту, низкомолекулярные гепарины более эффективны по сравнению с плацебо (уровень доказательности А). В 2 исследованиях получены данные в пользу низкомолекулярного гепарина (эноксапарина) сравнительно с нефракционированным гепарином при применении в начале лечения.
Поскольку у больных, которым вводят низкомолекулярные гепарины, трудно определить уровень активности антикоагулянта (например определить АЧТВ), то кардиологи отделений интенсивной терапии выражают опасения по поводу замены нефракционированного гепарина низкомолекулярным для больных, которым планируется проведение катетеризации с возможным перкутанным коронарным вмешательством.
В исследовании NICE-1 внутривенное введение эноксапарина (1,0 мг/кг массы тела) осуществляли у 828 больных с последующим наблюдением после элективной ангиопластики без внутривенного введения ингибитора гликопротеиновых рецепторов IIb/IIIа. Частота кровотечений (1,1% для больших кровотечений и 6,2% — для малых через 30 дней) была сопоставима с частотой, выявленной в предыдущих исследованиях, в которых пациентам вводили нефракционированный гепарин.
Как уже указывалось, сравнение низкомолекулярных гепаринов с нефракционированным гепарином проводили в 4 крупных рандомизированных исследованиях (рис. 2.6).
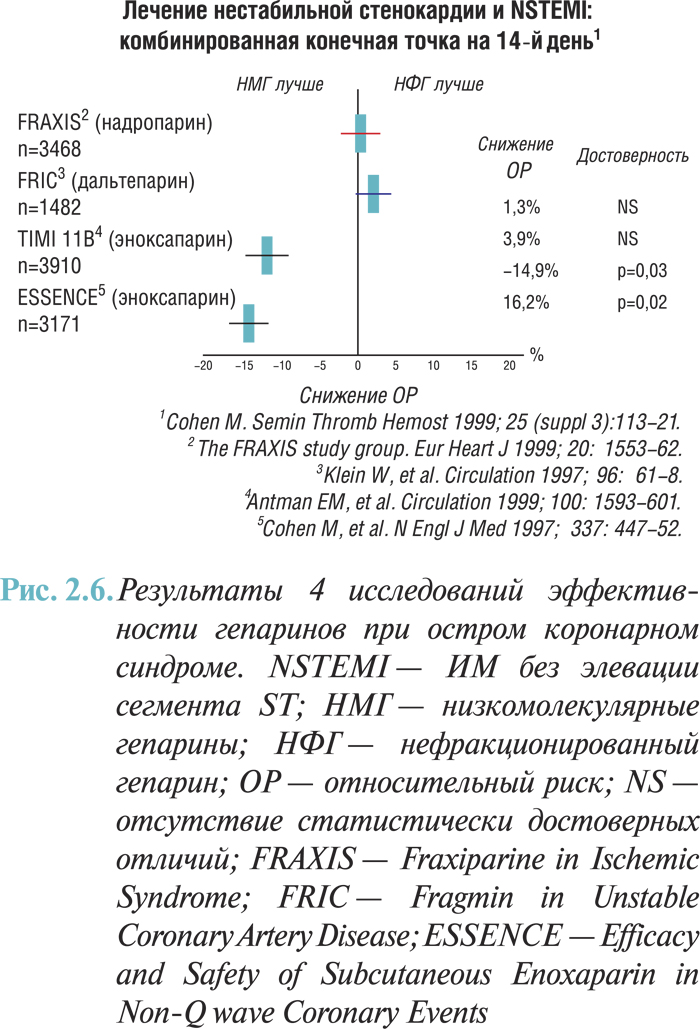
В исследовании FRIC (фрагмин при нестабильной ИБС) 1482 больным с нестабильной стенокардией или ИМ без подъема сегмента SТ вводили дальтепарин (120 МЕ/кг подкожно 2 раза в сутки) или нефракционированный гепарин в течение 6 дней. С 6-го по 45-й день больные были опять рандомизированы по группам для введения дальтепарина (двойная слепая фаза) (120 МЕ/КГ 1 раз в сутки) или плацебо. В течение первого этапа исследования риск смерти, развития ИМ или возвратной стенокардии был недостоверно выше при применении дальтепарина (9,3% по сравнению с 7,65%; р=0,33), а риск смерти или развития ИМ не изменялся (3,9% по сравнению с 3,6%; р=0,8). Частота летального исхода при применении дальтепарина также была несколько выше (1,5% по сравнению с 0,4% при введении нефракционированного гепарина; р=0,057). В период с 6-го по 45-й день частота летального исхода, развития ИМ или возвратной стенокардии была сопоставимой в группах применения препарата и плацебо.
В исследовании ESSENCE эноксапарин (1 мг/кг 2 раза в сутки подкожно) сравнивали со стандартным нефракционированным гепарином (5000 ЕД болюсно) с последующей инфузией при коррекции дозы по величине АЧТВ в пределах от 55 до 86 с и введением в течение от 48 ч до 8 дней (средняя продолжительность в обеих группах — 2,6 дня). При применении нефракционированного гепарина необходимая величина АЧТВ достигалась в период от 12 до 24 ч только у 46% больных. Комплексный показатель, включающий смертность, развитие ИМ или возвратной стенокардии, снижался при применении эноксапарина на 16,2% через 14 дней (19,8% для нефракционированного гепарина по сравнению с 16,6% для эноксапарина; р=0,019) и на 19% через 30 дней (23,3% против 19,8%; р=0,017). Смертность не изменялась, а для частоты летального исхода и развития ИМ отмечали тенденцию к снижению на 29% (р=0,06) через 14 дней и на 26% (р=0,08) через 30 дней.
В исследовании TIMI IIВ 3910 больных с UA/NSTEMI (Unstable Angina/Non-ST-Elevation Myocardial Infarction) рандомизированы по группам введения эноксапарина (30 мг внутривенные болюсные инъекции, затем по 1 мг/кг подкожно через каждые 12 ч) или нефракционированного гепарина (болюсная инъекция 70 ЕД/кг, затем инфузия — 15 ЕД/кг/ч с коррекцией дозы по величине АЧТВ до достижения величины АЧТВ, превышающей в 1,5–2,5 раза контрольную). После терапии больных переводили на амбулаторное лечение, во время которого тем, кому ранее вводили нефракционированный гепарин, 2 раза в сутки назначали эноксапарин или плацебо. Эта стадия исследования была рандомизированной двойной слепой. Эноксапарин вводили в среднем 4,6 дня, а нефракционированный гепарин — 3 дня. Комплексный показатель, включавший смертность, частоту развития ИМ и потребность в ургентной реваскуляризации (количество приступов возвратной стенокардии, требующее немедленного проведения коронарной реваскуляризации в период госпитализации или после выписки, что приводило к повторной госпитализации и проведению коронарной реваскуляризации), снижался на 8-е сутки с 14,5 до 12,4%; р=0,048; через 43 дня — с 19,6 до 17,3%; р=0,048. Смертность или частота развития ИМ через 14 дней снижалась с 6,9 до 5,7%; р=0,114; через 43 дня — с 8,9 до 7,9%; р=0,276. Амбулаторное лечение не имело существенных преимуществ, более того, при амбулаторном лечении риск возникновения сильного кровотечения достоверно повышался. Применение эноксапарина как при стационарном, так и при амбулаторном лечении сопровождалось также повышением риска развития малых кровотечений.
Исследование FRAXIS включало три параллельные группы и было посвящено сравнению низкомолекулярного гепарина надропарина, вводимого в течение 6 или 14 дней, с нефракционированным гепарином, который применяли в качестве контроля. В исследование были включены 3468 больных с UA/NSTEMI. Комплексный показатель, включавший смертность, частоту развития ИМ или рефрактерной стенокардии, составлял через 14 дней 18,1% в группе нефракционированного гепарина, 17,8% — в группе больных, которым вводили надропарин в течение 6 дней, и 20,0% — в группе лиц, леченных надропарином в течение 14 дней. Через 3 мес этот показатель соответственно составлял 22,2; 22,3 и 26,2%; р<0,03 при сравнении данных в группе 14-дневного применения надропарина и в группе введения нефракционированного гепарина. У больных, леченных надропарином, во все периоды исследования отмечали тенденцию к повышению смертности и комплексного показателя, характеризующего смертность и частоту развития ИМ.
Таким образом, в 2 исследованиях с эноксапарином продемонстрировано преимущество этого препарата по сравнению с нефракционированным гепарином, а в 2 исследованиях (одно с дальтепарином, второе — с надропарином) продемонстрировано нейтральное действие или выявлены неблагоприятные тенденции. Такие разнородные результаты можно объяснить целым рядом причин — различиями в группах больных, типе исследования, дозировках гепарина, свойствах различных низкомолекулярных гепаринов (разную молекулярную массу и соотношение антифактора Ха и антифактора 11а), а также другими неидентифицированными влияниями. При метаанализе результатов 2 исследований с эноксапарином с участием 7081 больного выявлено статистически достоверное снижение (приблизительно на 20%) смертности, частоты развития ИМ или потребности в срочной реваскуляризации на 2; 8; 14 и 43-й день и смертности или частоты развития ИМ на 8; 14 и 43-й день. На 8; 14 и 43-й день отмечали также тенденцию к снижению смертности.
Несмотря на привлекательность сравнения относительных эффектов лечения с помощью различных низкомолекулярных гепаринов (см. рис. 2.6), следует признать ограниченность такого косвенного сравнения. Единственно надежным является непосредственное сравнение в ходе проведения хорошо спланированного клинического исследования или нескольких исследований. Сравнение различных терапевтических средств (например различные препараты низкомолекулярных гепаринов) со стандартным препаратом (например нефракционированным гепарином) в различных исследованиях не позволяет сделать вывод об относительной эффективности различных низкомолекулярных гепаринов, что обусловлено вариабельностью оцениваемых параметров как в контрольной, так и экспериментальной группе вследствие различий в протоколах исследования, в сопутствующем лечении и т.д. Подобные соображения применимы и к сравнению действия ингибиторов тромбоцитарных гликопротеиновых рецепторов IIb/IIIа.
В исследованиях FRISC, FRIC, TIMI IIВ, а также в FRISC II оценивали возможные преимущества продолжительного введения низкомолекулярных гепаринов после выписки из больницы. В первых 3 исследованиях не удалось продемонстрировать преимущества такого лечения после острой фазы заболевания. В исследовании FRISC с 6-го по 35-й или 45-й день вводили дальтепарин в более низких дозах; в исследовании FRIC больных после первоначального 6-дневного лечения повторно рандомизировали по группам для дополнительного введения дальтепарина в течение 40 дней. В исследовании TIMI IIВ период амбулаторного лечения составлял от 5 до 6 нед, а в исследовании FRAXIS — 1 нед. Исследование FRISC II отличалось по своему типу: дальтепарин вводили всем больным минимум 5 дней. Затем больные были рандомизированы по группам для введения плацебо или дальтепарина 2 раза в сутки в течение 90 дней. При анализе результатов исследований выявлено значительное снижение в группе дальтепарина комплексного показателя, включавшего смертность и частоту развития ИМ, через 30 дней (3,1% по сравнению с 5,9%; р=0,002), но не через 3 мес (6,7% по сравнению с 8,0%; р=0,17). Показатель, характеризующий смертность, частоту развития ИМ или частоту реваскуляризации в течение всего периода лечения, снизился через 3 мес (29,1% по сравнению с 33,4%; р=0,031). Преимущества продолжительного применения дальтепарина проявлялись лишь у тех больных, которые отвечали на лечение и у которых в начале исследования был повышен уровень тропонина Т. Эти результаты могут быть одним из показаний для длительного применения низкомолекулярных гепаринов у некоторых больных, которые поддаются лечению или у которых отложено проведение ангиографии.
Итак, вообще можно сделать вывод о том, что «острое» применение низкомолекулярных гепаринов по крайней мере не менее эффективно, чем нефракционированного гепарина (уровень доказательности А). Впрочем, эноксапарин имел преимущества сравнительно с нефракционированным гепарином в 2 исследованиях по прямым сравнениям препаратов (по комбинированной конечной точке — сумме случаев смерти, ИМ и возвратной стенокардии).
Низкомолекулярные гепарины имеют важные практические преимущества, которые состоят в простоте применения, более стойком антитромбиновом эффекте, отсутствии потребности в мониторировании, а также в профиле безопасности применения, подобном нефракционированному гепарину. Результаты наблюдений позволяют предположить сходство профиля безопасности низкомолекулярных гепаринов и нефракционированного гепарина при применении вместе с ингибиторами гликопротеина IIb/IIIa (исследование NICE, 2000). Умеренное по объему исследование с участием 750 пациентов свидетельствует о лучшей эффективности и безопасности эноксапарина по сравнению с нефракционированным гепарином у пациентов, которые также получали эптифибатид. Впрочем, доказательства в пользу продолжительного амбулаторного применения низкомолекулярных гепаринов менее убедительны.
Ингибиторы фактора Ха
В последние несколько лет проводили исследование селективного блокатора фактора Ха, синтетического пентасахарида фондапаринукса. В исследовании OASIS-5 (Organization to Assess Strategies for Ischaemic Syndromes) сравнивали эффективность применения 2,5 мг фондапаринукса подкожно 1 раз в сутки с эноксапарином — 1 мг/кг 2 раза в сутки на протяжении 8 дней (в среднем — 5,2 дня). Первичные конечные точки — смерть, ИМ или стойкая ишемия на 9-й день зафиксированы одинаково часто — в 5,7% в группе эноксапарина и 5,8% — фондапаринукса, но частота «больших» кровотечений в группе фондапаринукса была почти вдвое меньше — 2,2% против 4,1% в группе эноксапарина; р<0,001. Таким образом, комбинированная конечная точка наблюдалась достоверно чаще в группе эноксапарина — 9,0% против 7,3%; р<0,001. На 30-й день отмечали более 608 низкую смертность в группе фондапаринукса — 2,9% против 3,5%; р<0,02; такая же тенденция наблюдалась через 6 мес после острого коронарного синдрома — смертность в группе фондапаринукса составляла 5,8% против 6,5% в группе эноксапарина; р<0,05. Комбинированная конечная точка, которая включала смерть, ИМ или инсульт через 6 мес, также была меньше при применении фондапаринукса — 11,3% против 12,5%; р<0,007.
Прямые ингибиторы тромбина
В исследовании GUSTO IIb (Global Utilization of Streptokinase and Tissue Plasminogen Activator for Occluded Coronary Arteries) оценивали эффективность прямого ингибитора тромбина гирудина и гепарина у пациентов с острым коронарным синдромом, которые не получали тромболитических средств. Благоприятные последствия терапии гирудином наблюдали в ранние сроки (через 24 ч и 7 дней), но на 30-й день отличие между клиническими группами не было статистически достоверным.
В исследовании OASIS-2 оценивали эффективность применения гирудина в более высокой дозе на протяжении 72 ч по сравнению с нефракционированным гепарином. Первичной конечной точкой была смерть от сердечно-сосудистых причин или ИМ через 7 дней, которая произошла у 4,2% пациентов в группе нефракционированного гепарина и у 3,6% в группе гирудина; р=0,077. Эффект лечения достигался на протяжении первых 72 ч (относительный риск 0,76; ДИ 0,59–0,99). Количество кровотечений, которые требовали трансфузии жидкости, увеличилось (1,2% против 0,7%), но количество опасных для жизни кровотечений или инсультов не увеличилось.
Данные комбинированного анализа результатов исследований OASIS-1, OASIS-2 и GUSTO IIb указывают на то, что риск сердечно-сосудистой смерти или ИМ снизился на 22% через 72 ч, на 17% — через 7 дней и на 10% — через 35 дней после начала лечения (уровень доказательности В). Результаты статистически достоверны через 72 ч и 7 дней и характеризуются пограничной достоверностью через 35 дней; р=0,057. Гирудин признали как средство для лечения пациентов с гепарин-индуцированной тромбоцитопенией, но ни один из гирудинов до этого времени не получил официального разрешения для лечения при острых коронарных синдромах.
Эффективность еще одного прямого ингибитора тромбина — бивалирудина в сравнении с нефракционированным гепарином изучали у больных, которым проводили перкутанное коронарное вмешательство. Исследователи выявили достоверно меньшую частоту значительных кардиальных осложнений (смерть, ИМ, повторные реваскуляризации) в группе бивалирудина (6,2% против 7,9%; р<0,039) и частоту кровотечений (3,5 и 9,3% соответственно; р<0,001) на 7-й день исследования. Таким образом, бивалирудин рассматривается как альтернативная ургентная антикоагулянтная терапия при проведении перкутанного коронарного вмешательства.
В исследовании ACUITY (Acute Catheterization and Urgent Intervention Triage Strategy) сравнивали эффективность 3 медикаментозных стратегий у больных с острым коронарным синдромом среднего и высокого риска, у большинства из которых проведено перкутанное коронарное вмешательство (56,3%) и шунтирование (11,1%). На 30-й день сравнивали частоту значительных коронарных событий (смерти от любой причины, ИМ или внеплановой реваскуляризации вследствие повторной ишемии) и частоту кровотечений на фоне применения нефракционированного гепарина или низкомолекулярных гепаринов в сочетании с ингибиторами гликопротеиновых рецепторов IIb/IIIa (1-я группа — 4603 больных); бивалирудин в сочетании с ингибиторами гликопротеиновых рецепторов IIb/IIIa (2-я группа — 4604 больных); только бивалирудин (4612 больных). Не выявлено разницы в частоте кардиальных осложнений во всех трех группах, но частота кровотечений была меньше у больных, получавших бивалирудин, в сравнении с 1-й группой (3,0% против 5,7%; р<0,001).
Антагонисты витамина К
Несмотря на то что в небольших исследованиях сочетание антагонистов витамина К с ацетилсалициловой кислотой давало выигрыш в частоте кардиальных конечных точек, повышенная частота кровотечений перекрывала этот положительный эффект, а учитывая довольно удачную комбинацию (ацетилсалициловая кислота + клопидогрел), антагонисты витамина К в стандартных ситуациях не используются и могут рассматриваться в качестве терапии при фибрилляции предсердий.
Коррекция осложнений антитромбиновой терапии, связанных с кровотечениями
При незначительных кровотечениях обычно достаточно прекратить введение антитромбиновых средств. При выраженных кровотечениях, в частности рвоте кровью, мелене или внутричерепных геморрагиях, необходимым может оказаться введение антагонистов гепарина, что обусловливает повышение риска рикошетного тромботического феномена. Антикоагулянтные и геморрагические эффекты нефракционированного гепарина корригируются протамина сульфатом в эквимолярной концентрации. Протамин нейтрализует активность антифактора IIа, но лишь частично нейтрализует антифактор Ха низкомолекулярного гепарина.
Таким образом, рекомендации по применению антикоагулянтов следующие:
- Антикоагулянты рекомендуются всем пациентам с острым коронарным синдромом в дополнение к антитромбоцитарной терапии (IA).
- Антикоагулянты выбирают в соответствии с определенным риском развития кровотечения и ишемических событий (IB). Показаны такие антикоагулянты, как нефракционированный гепарин, низкомолекулярные гепарины, фондапаринукс, бивалирудин. Выбор зависит от выбранной стратегии — ургентной инвазивной, ранней инвазивной или консервативной (IB).
- В случае ургентной инвазивной стратегии нефракционированный гепарин (IC) или эноксапарин (IIaB), или бивалирудин (IB) следует назначить немедленно.
- При отсутствии ургентной ситуации и наличии времени для выбора стратегии лечения рекомендуется назначение фондапаринукса как имеющего лучший профиль эффективность/безопасность (IA). Эноксапарин демонстрирует менее предпочтительное соотношение безопасность/эффективность (IIaB).
- При инвазивных вмешательствах введение нефракционированного гепарина (IC), эноксапарина (IIaB) или бивалирудина (IB) необходимо продолжать во время проведения процедуры.
- Введение антикоагулянтов должно быть остановлено в течение 24 ч после инвазивной процедуры (IIaC). При консервативной стратегии введение фондапарина, эноксапарина или другого низкомолекулярного гепарина может продолжаться до выписки из госпиталя (IB).
Антитромбоцитарные средства
В понимании стратегии антитромбоцитарной терапии важно знать, что в сутки вырабатывается приблизительно 1011 тромбоцитов в физиологических условиях, при необходимости интенсивность выработки может увеличиться в 10 раз.
Продолжительность жизни тромбоцитов составляет приблизительно 10 дней. Таким образом, тромбоциты — безъядерные клетки крови, которые обеспечивают оборотный источник хемокинов, цитокинов и факторов роста, которые брикетируются и упакованы в гранулах. Кроме того, активированные тромбоциты могут синтезировать простаноиды (прежде всего тромбоксан A2) из арахидоновой кислоты фосфолипидов с помощью быстро скоординированной активации фосфолипазы, ЦОГ-1 и тромбоксансинтетазы-3. Недавно сформированные тромбоциты также стимулируют образование изоформ ЦОГ (ЦОГ-2) и простагландин E-синтазы, это явление заметно ассоциировано с ускоренной регенерацией тромбоцитов, и хотя активированные тромбоциты не могут синтезировать белки de novo, они могут транслировать конститутивную мРНК (матричную РНК) в белки. Таким образом, тромбоциты могут участвовать в воспалении и сосудистом повреждении, антитромбоцитарные эффекты могут влиять на белки (производные тромбоцитов), сигнальные для инициации воспалительного и/ или пролиферативного ответа.
Образование тромба в результате разрыва атеросклеротической бляшки
В процессе разрыва атеросклеротической бляшки происходит обнажение прокоагулянтных субстанций субэндотелиального пространства сосуда, а также липидного ядра бляшки, в норме изолированных от протекающей крови клетками эндотелия.
Такими субстанциями являются компоненты соединительнотканного матрикса сосуда — главным образом коллаген, а также фибронектин, ламинин, витронектин и др. Высокая тромбогенность липидного ядра бляшки объясняется накоплением в ней в больших количествах тканевого фактора (тканевого тромбопластина), освобождающегося при разрушении пенистых клеток и макрофагов, также тканевой фактор содержится и в эндотелиальных клетках, но в норме им более присущи антитромботические функции.
Эндотелий, помимо барьерной функции, активно препятствует адгезии и агрегации тромбоцитов за счет синтеза простациклина (простагландина I2), эндотелиального релаксирующего фактора, а также активаторов плазминогена тканевого и урокиназного типов, кроме того, на поверхности эндотелиальных клеток выявлен гликопротеид тромбомодулин, обладающий способностью к связыванию и инактивации тромбина.
На начальном этапе коагуляционного каскада происходит адгезия (прилипание) тромбоцитов к месту повреждения эндотелия. Процесс адгезии осуществляется благодаря наличию специфических гликопротеидных комплексов (рецепторов) в мембране тромбоцита, моментально связывающихся со своими лигандами в экстрацеллюлярном матриксе. При этом для процесса взаимодействия между лигандом и рецептором мембраны тромбоцита необходимо присутствие фактора Виллебранда, который также синтезируется клетками эндотелия сосудов.
Таким образом, в результате адгезии на поверхности разрыва эндотелия формируется монослой тромбоцитов. Связывание рецепторов мембраны тромбоцита со своими лигандами в субэндотелии является пусковым фактором для следующей стадии тромбообразования — стадии агрегации тромбоцитов. При этом тромбоциты изменяют свою форму, становясь из дискоидных сферическими, на поверхности их мембраны появляются псевдоподии. Одновременно происходит высвобождение содержимого плотных гранул тромбоцитов, секретируются индукторы агрегации тромбоцитов — АДФ и серотонин, фактор 4 тромбоцитов, тромбоцитарный фактор роста и др. Также происходит повышение активности фосфолипаз А2 и С, которые, расщепляя мембранные фосфолипиды, приводят к высвобождению арахидоновой кислоты. Далее арахидоновая кислота под влиянием ЦОГ и тромбоксансинтетазы превращается через промежуточную стадию эндопероксидов в тромбоксан А2. Тромбоксан А2, являясь мощным индуктором агрегации тромбоцитов, также вызывает выраженную вазо- и бронхоконстрикцию.
В результате высвобождения в кровоток многочисленных проагрегантов (АДФ, серотонин, тромбоксан А2, адреналин, тромбин и др.) происходит осуществление механизма положительной обратной связи, проявляющейся в усилении первоначальной агрегации тромбоцитов с одновременным вовлечением в процесс агрегации соседних неактивированных клеток.
Одновременное действие нескольких индукторов агрегации (в противном случае в кровеносном русле постоянно образовывались бы тромбоцитарные тромбы) является стимулом к началу общего финального этапа агрегационного процесса: на мембранах псевдоподий происходят информационные изменения IIb/IIIа рецепторов, сопровождающиеся многократным увеличением их аффинности к своим лигандам, прежде всего к фибриногену и фактору Виллебранда. Молекулы фибриногена и фактора Виллебранда, являясь мультивалентными, способны взаимодействовать одновременно с большим количеством тромбоцитов, что приводит к образованию многочисленных межклеточных «мостиков».
Таким образом, заключительной стадией процесса активации тромбоцитов является построение тромбоцитарного агрегата, представляющего собой множество активированных тромбоцитов, соединенных между собой с помощью молекул фибриногена и фиксированных к месту повреждения эндотелия посредством фактора Виллебранда.
Однако активации тромбоцитов и формирования тромбоцитарного тромба недостаточно для развития симптомокомплекса острой коронарной недостаточности (острого коронарного синдрома), более того, большинство разрывов бляшек протекает бессимптомно и выявляется на аутопсийном материале у погибших от некардиальных причин больных. Помимо непосредственного разрыва бляшки для развития того или иного варианта острого коронарного синдрома необходимо одновременное стечение многих предрасполагающих факторов: замедление тока крови по сосуду, соотношение между активностью систем свертывания крови и фибринолиза, состояния тромбоцитов. Большое значение в развитии тромбоза имеет освобождение в момент разрыва бляшки тканевого фактора, сосредоточенного главным образом в липидном ядре и эндотелиоцитах покрышки бляшки и являющегося в комплексе с активной формой фактора VII активатором внешнего пути коагуляции. Концентрация фактора VII во время разрыва бляшки оказывает во многом определяющее влияние на дальнейшее развитие коронарного тромбоза и формирование симптомокомплекса острого коронарного синдрома.
Таким образом, помимо активации тромбоцитарного звена гемостаза, для возникновения клинических проявлений острого коронарного синдрома необходимо исходное состояние гиперкоагуляции к моменту разрыва бляшки. В этом отношении особенно показательны данные исследований концентрации в сыворотке крови фибринопептида A и фрагмента протромбина 1+2 (F1+2) — маркеров превращения фибриногена в фибрин под действием тромбина и протромбина в тромбин соответственно. У больных с различными клиническими проявлениями острого коронарного синдрома содержание в крови фибринопептида A и фрагмента протромбина 1+2 значительно повышено, более того, на сегодня продемонстрировано значение показателей фибринопептида A и фрагмента протромбина 1+2 в плане оценки отдаленного прогноза больных после перенесенного эпизода острой коронарной недостаточности. В ходе исследований, наряду с повышением концентрации фибринопептида A и фрагмента протромбина 1+2 в острый период, выявлено сохранение высоких значений фрагмента протромбина 1+2 через 6 мес после перенесенного эпизода нестабильной стенокардии или нетрансмурального ИМ, что указывает на персистирующую тромбинемию даже у категории относительно «стабилизированных» больных. Учитывая, что тромбин на сегодня является самым сильным из известных индукторов агрегации тромбоцитов, можно предположить, что именно сохраняющаяся (предшествующая) тромбинемия создает благоприятную почву для развития коронарного тромбоза при возникновении разрыва атеросклеротической бляшки. Эта гипотеза проверена в ходе многоцентрового клинического исследования GUSTO IIb с использованием прямого ингибитора тромбина — рекомбинантного гирудина. Однако после подведения итогов лечения более 8 тыс. больных с нестабильной стенокардией и ИМ без зубца Q не получено статистических различий в конечных точках (смерть, ИМ с зубцом Q, проведение коронарной ангиопластики) между исследуемой и контрольной (ацетилсалициловая кислота + нефракционированный гепарин) группами больных. Возможно, объяснением этому является низкая доза применяемого гирудина (в исследовании GUSTO IIa продемонстрирован реальный геморрагический эффект полной дозы гирудина) и соответствующее незначительное его влияние на характеристики образования тромбина.
По крайней мере 4 различных белка тромбоцитов среди известных представляют возможную цепь обратимой ингибиции с переменными эффектами антитромбоцитарных агентов, то есть ЦОГ-1, гликопротеиновые рецепторы IIb/IIIa, простагландин Н2/тромбоксан A2-рецепторы и AДФ-рецепторы P2Y12. Неполное, обратимое ингибирование тромбоцитарной ЦОГ-1 традиционными НПВП (NSAIDs) демонстрирует клинический эффект, неподтвержденный в рандомизированных клинических исследованиях.
Различные неселективные НПВП могут замедлять тромбоксан A2-зависимую функцию тромбоцита путем конкурентного, обратимого ингибирования ЦОГ-1. При применении в обычной противовоспалительной дозе эти лекарственные средства замедляют активность тромбоцитарной ЦОГ-1 от 70 до 90%. Такое ингибирование может быть недостаточным, чтобы блокировать скопление тромбоцитов in vivo. Некоторые ингибиторы ЦОГ-1, которые были исследованы на антитромботическую эффективность в относительно небольших рандомизированных клинических исследованиях, — сульфинпиразон, флурбипрофен, индобуфен и трифлусал — не одобрены как антитромбоцитарные средства в США, хотя доступны в нескольких европейских странах.
Тромбоксан А2/простагландин Н2-рецепторы сцеплены с рецепторами G-протеина, которые в результате стимуляции приводят к активации фосфолипазы С и повышению внутриклеточной концентрации ионов Ca2+.
Были синтезированы мощные (Kd (константа диссоциации лиганд-рецепторного комплекса) по меньшей мере наномолярный диапазон) и с длительным действием (период полураспада >20 ч) антагонисты рецепторов тромбоксана А2/простагландина H2, включая GR 32191 (вапипрост), BMS-180291 (ифетробан), и BM 13.177 (сулотробан). Несмотря на антитромботические эффекты, демонстрируемые на животных, и интересные кардиопротекторные влияния, демонстрируемые на собаках и хорьках, эти препараты дали неутешительные результаты в фазе II/III клинических испытаний.
Антагонист рецепторов тромбоксана А2/простагландина H2 С-18886 недавно завершил вторую фазу клинических испытаний с обнадеживающим результатом.
Новый класс прямых P2Y12-антагонистов (например AR-C69931MX (кангрелор)) в настоящее время изучается, предварительные результаты говорят о более эффективной блокаде этих рецепторов, чем клопидогрелом.
Классификация антитромбоцитарных препаратов
- Ингибиторы адгезии: антитела к гликопротеину Ib, антитела к фактору Виллебранда
- Ингибиторы агрегации:
- Ингибиторы гликопротеиновых рецепторов IIb/IIIa.
- Ингибиторы АДФ-рецепторов.
- Ингибиторы тромбина (гирудин).
- Ингибиторы ЦОГ (ацетилсалициловая кислота).
- Ингибиторы тромбоксансинтетазы (пирмагрел).
- Ингибиторы тромбоксансинтетазы и рецепторов к тромбоксану (ридогрел).
- Активаторы аденилатциклазы (простациклин, алпростадил).
- Ингибиторы ФДЭ (пентоксифиллин).
Ацетилсалициловая кислота
Ацетилсалициловая кислота угнетает ЦОГ-1 и блокирует формирование тромбоксана А2. Таким образом блокируется агрегация тромбоцитов, индуцированная через этот путь. В 3 рандомизированных исследованиях ацетилсалициловая кислота снижала риск смерти или ИМ у пациентов с нестабильной стенокардией. Данные метаанализа свидетельствовали о том, что ацетилсалициловая кислота в дозе 75–150 мг не менее эффективна, чем в более высоких дозах.
При остром ИМ антитромбоцитарная терапия (почти исключительно ацетилсалициловой кислотой) способна уменьшать количество сосудистых событий (рис. 2.7). Кроме кратковременного эффекта, ацетилсалициловая кислота обеспечивает также улучшение прогноза при продолжении лечения. Побочные эффекты со стороны ЖКТ при применении ацетилсалициловой кислоты в таких низких дозах отмечают относительно нечасто, а с появлением кишечно-растворимых форм ацетилсалициловой кислоты эти осложнения почти исчезли. Существуют некоторые противопоказания, к которым относят активную пептическую язву, локальное кровотечение или геморрагический диатез. Проявления аллергии наблюдаются редко. Учитывая это, ацетилсалициловую кислоту рекомендуют назначать всем пациентам с подозрением на острый коронарный синдром при отсутствии противопоказаний (уровень доказательности А) и в дальнейшем для длительного лечения (уровень доказательности А).
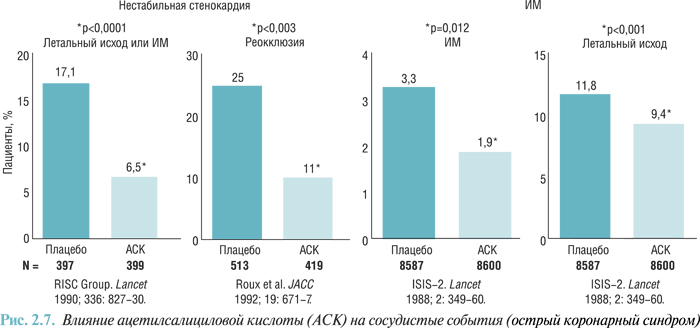
Антагонисты рецепторов АДФ: тиенопиридины
Тиклопидин и его дериват клопидогрел — ингибиторы АДФ, обеспечивающие агрегацию тромбоцитов. Эффективность тиклопидина изучали лишь в 1 исследовании. Относительно часто на фоне применения этого препарата наблюдают желудочно-кишечные расстройства и аллергические реакции. Кроме того, могут возникать нейтропения или тромбоцитопения. Препаратом, который заменил тиклопидин, стал клопидогрел.
Эффективность клопидогрела исследовали на фоне приема ацетилсалициловой кислоты в дозе 75–325 мг у пациентов с острым коронарным синдромом в большом клиническом исследовании CURE (Clopidogrel in Unstable angina to prevent Recurrent ischaemic Events) с участием 12 562 пациентов. Включали больных, госпитализированных на протяжении 24 ч после возникновения симптомов с изменениями ЭКГ или повышением уровня миокардиальных ферментов. Рандомизированно назначали нагрузочную дозу 300 мг клопидогрела и дальнейшую дозу препарата 75 мг 1 раз в сутки и сравнивали с пациентами, принимавшими плацебо, на протяжении 9 мес. Количество первичных исходов (смерть от сердечно-сосудистых причин, нефатальный ИМ или инсульт) достоверно уменьшилась с 11,4 до 9,3% (снижение абсолютного риска на 2,1%; относительный риск 0,80; 95% ДИ 0,72–0,90; p<0,001). Частота случаев рефрактерной ишемии во время первой госпитализации существенным образом (p=0,007) снизилась с 2,0 до 1,4% (снижение абсолютного риска на 0,6%, относительный риск 0,68; 95% ДИ 0,52–0,90), но существенным образом не отличалась после выписки (7,6% в обеих группах). Массивные кровотечения достоверно чаще отмечали в группе клопидогрела — 3,7% против 2,7% (повышение абсолютного риска на 1%, относительный риск 1,38; 95% ДИ 1,13–1,67; p=0,001). Количество пациентов, которым было необходимо переливание двух или больше единиц, было больше в группе клопидогрела сравнительно с плацебо (2,8% против 2,2%; p=0,02). Массивные кровотечения выявляли приблизительно так же часто во время раннего лечения (<30 дней), как и позднего (>30 дней после рандомизации) (2,0 и 1,7% соответственно). Малые кровотечения развивались достоверно чаще в группе клопидогрела, чем плацебо (5,1% против 2,4%; p<0,001). Несколько меньшее количество пациентов в группе клопидогрела нуждалось в коронарной реваскуляризации (36% против 36,9%). Несмотря на это, важно обратить внимание на 1822 пациента в группе клопидогрела, у которых осуществили хирургическое шунтирование коронарных артерий. После проведенного вмешательства не отмечали достоверного увеличения количества эпизодов массивных кровотечений (1,3% против 1,1%). Но среди 912 пациентов, которые не прекратили применение исследуемого препарата за 5 дней перед вмешательством, частота массивных кровотечений была выше в группе клопидогрела (9,6% против 6,3%; p=0,06).
Четкое повышение риска развития кровотечения отмечали при повышении дозы ацетилсалициловой кислоты (со 100 до 100–300 и >300 мг у пациентов групп плацебо (соответственно 2,0; 2,2 и 4,0% массивных кровотечений) и клопидогрела (2,5; 3,5 и 4,9%). В исследованиях CURE и APT (Anti Platelet Trialist’s Collaboration) не наблюдали четких признаков улучшения исхода при повышении дозы ацетилсалициловой кислоты. Рекомендуют применять клопидогрел в сочетании с поддерживающими дозами ацетилсалициловой кислоты (100 мг).
В субанализе PCI-CURE (Percutaneous Coronary Intervention-Clopidogrel in Unstable Angina to Prevent Recurrent Events) выявлено, что у пациентов, которым выполняли ангиопластику, применение клопидогрела более чем за 6 ч до вмешательства сопровождалось снижением риска к 28-му дню на 38%. При этом общая частота развития кровотечений была такой же, а желудочно-кишечных кровотечений — ниже (на 9,3%), чем после применения ацетилсалициловой кислоты.
В исследовании CAPRIE (Clopidogrel versus Aspirin in Patients at Risk of Ischemic Events) сравнивали эффективность клопидогрела и ацетилсалициловой кислоты в отношении предупреждения ишемического инсульта, ИМ или «сосудистой» смерти у 19 185 больных с признаками атеросклеротического заболевания сосудов (перенесшие ишемический инсульт, ИМ или с заболеванием периферических артерий). Средняя длительность наблюдения — 1,91 года. Это исследование также показало преимущество клопидогрела перед ацетилсалициловой кислотой. Еще одно исследование — CREDO (Clopidogrel for the Reduction of Events During Observation), в котором уже целенаправленно изучали эффективность указанных препаратов после проведения внутрисосудистых вмешательств, продемонстрировало снижение риска развития комбинированной конечной точки на 27% по сравнению с ацетилсалициловой кислотой. В исследовании CLASSICS (CLopidogrel ASpirin Stent International Cooperative Study) изучали сравнительную безопасность и эффективность комбинаций: ацетилсалициловая кислота + клопидогрел и ацетилсалициловая кислота + тиклопидин. Первая комбинация оказалась практически вдвое безопаснее в плане частоты развития кровотечений.
И последнее по времени крупное исследование — CHARISMA (Clopidogrel for High Atherothrombotic Risk and Ischemic Stabilization, Management and Avoidance), результаты которого опубликованы в 2006 г. В течение минимум 1 года наблюдали 15 603 пациентов, и вновь было подтверждено преимущество клопидогрела перед ацетилсалициловой кислотой у больных с документированными проявлениями ИБС, но не у пациентов, у которых отмечали только факторы риска развития ИБС.
В последние годы ведутся поиски новых антиагрегантов, имеющих тот же механизм блокады АДФ-рецепторов тромбоцитов. Так, в исследовании (JUMBO)-TIMI 26 (The Joint Utilization of Medications to Block Platelets Optimally) изучали эффекты прасугрела — как частоту кровотечений, так и кардиальных событий у больных, подвергшихся ургентному перкутанному коронарному вмешательству, по сравнению с клопидогрелом. В этом ограниченном исследовании (904 пациента) не отмечено достоверных отличий ни в частоте кровотечений (1,7 и 1,2% соответственно), ни во влиянии на конечные точки. В недавно законченном исследовании этого препарата у 13 608 больных с острым коронарным синдромом TRITON-TIMI-38 (Trial to Assess Improvement in Therapeutic Outcomes by Optimizing Platelet Inhibition with Prasugrel — Thrombolysis in Myocardial Infarction) прасугрел продемонстрировал лучший, чем у клопидогрела, эффект относительно кардиальных событий, но он сопровождался достоверно большей частотой кровотечений, в том числе фатальных.
Эффективность еще одного антиагреганта — AZD6140 сравнивали с эффектами клопидогрела в исследовании DISPERSE 2 (Dose confIrmation Study assessing anti-Platelet Effects of AZD6140 vs. clopidogRel in non-ST-segment Elevation myocardial infarction), результаты которого обнародованы на сессии АСС в 2006 г. Отмечены хорошая переносимость и дозозависимый эффект препарата по отношению к интенсивности агрегации тромбоцитов, превышавший таковой у клопидогрела. В настоящее время проводится большое исследование AZD6140, PLATO (A Study of Platelet Inhibition and Patient Outcomes), в которое включено 16 000 больных в 1000 клиниках 40 стран.
Таким образом, рекомендации по применению пероральных антиагрегантов следующие:
- Ацетилсалициловая кислота рекомендуется всем пациентам с острым коронарным синдромом без элевации ST, без противопоказаний, в нагрузочной дозе 160–325 мг (IA) с последующим применением 75 или 100 мг длительное время (IA).
- Всем пациентам назначают клопидогрел в нагрузочной дозе 300 мг, в дальнейшем 75 мг/сут (IA). Клопидогрел принимают 12 мес при отсутствии угрозы кровотечения (IA).
- Клопидогрел также назначают всем пациентам с противопоказаниями к ацетилсалициловой кислоте (IB).
- Пациентам перед инвазивной процедурой клопидогрел назначают в дозе 600 мг (нагрузочная) (IIaB).
- У пациентов, принимающих клопидогрел, при возможном хирургическом вмешательстве (АКШ) операцию следует отложить на 5 сут с отменой препарата (IIaC).
- НПВП (селективные ингибиторы ЦОГ-2) не рекомендуется назначать в комбинации с ацетилсалициловой кислотой или клопидогрелом (IIIC).
- Клопидогрел можно применять в комбинации со всеми статинами (IB).
- Временное или полное прекращение применения ацетилсалициловой кислоты, клопидогрела или обоих препаратов необходимо тщательно оценивать с учетом высокого риска повторения коронарных событий, особенно после установки определенного типа стентов.
Блокаторы гликопротеиновых рецепторов IIB/IIIA
Активированные гликопротеиновые рецепторы IIb/IIIa связываются с фибриногеном, что ведет к формированию мостиков между активированными тромбоцитами и образованию тромбоцитарных тромбов. Разработаны прямые ингибиторы гликопротеиновых рецепторов IIb/IIIa. Их эффективность оценивали в клинических ситуациях, при которых важное значение отводили активации тромбоцитов, в частности во время перкутанных коронарных вмешательств, при остром коронарном синдроме, а также недавно у пациентов, получающих тромболитическую терапию по поводу острого ИМ.
Проведено чрезвычайно большое количество исследований с применением препаратов этой группы, что обусловлено надеждой, которую возлагали на них кардиологи и которая пока оправдалась лишь частично.
При острых коронарных синдромах изучали четыре препарата группы блокаторов рецепторов гликопротеина IIb/IIIa для внутривенного введения.
Абциксимаб — моноклональное антитело. Неспецифический блокатор, который тесно связывается с рецептором и характеризуется медленным исчезновением эффекта угнетения тромбоцитов после прекращения лечения.
Эптифибатид — циклический пептид, селективно угнетающий рецепторы гликопротеина IIb/IIIa. Характеризуется коротким периодом полужизни, угнетение тромбоцитов исчезает через 2–4 ч после прекращения терапии.
Тирофибан — маленький непептидный антагонист, напоминающий трипептидную последовательность фибриногена. Блокада рецепторов быстрая (5 мин), селективная и быстро обратимая (от 4 до 6 ч).
Ламифибан — синтетический, непептидный селективный блокатор рецепторов с периодом полувыведения около 4 ч.
Оценивают также эффективность блокаторов рецепторов гликопротеина IIb/IIIa для перорального применения, в частности ортофибана, сибрафибана, ледрафибана и других препаратов.
Учитывая результаты ряда рандомизированных исследований, лечение препаратами группы блокаторов рецепторов гликопротеина IIb/IIIa рекомендуют всем пациентам с острым коронарным синдромом, у которых выполняют перкутанное коронарное вмешательство (уровень доказательности А). Инфузия должна длиться на протяжении 12 ч (абциксимаб) или 24 ч (эптифибатид, тирофибан) после процедуры.
Осуществлены 7 рандомизированных исследований, в которых блокаторы рецепторов гликопротеина IIb/IIIa систематически применяли в дополнение к ацетилсалициловой кислоте и «стандартному» нефракционированному гепарину у пациентов с острым коронарным синдромом (EPIC (Evaluation of 7E3 for the Prevention of Ischemic Complications), CAPTURE (Chimeric C7E3 Fab Antiplatelet Therapy in Unstable Refractory angina), EPILOG (Evaluation of PTCA to Improve Long-term Outcome by c7E3 GP IIb/IIIa Receptor Blockade), EPISTENT (Evaluation of Platelet IIb/IIIa Inhibitor for Stenting), RESTORE (Randomized Efficacy Study of Tirofiban for Outcomes and REstenosis), IMPACT II (IMProving Asthma Control Trial), ESPRIT (European/Australasian Stroke Prevention in Reversible Ischaemia Trial)). В общем, их результаты свидетельствуют об умеренном, но достоверном снижении риска смерти или ИМ через 30 дней у пациентов с острым коронарным синдромом без стойкой элевации сегмента ST. Медикаментозная терапия блокаторами рецепторов гликопротеина IIb/IIIa в первые дни после поступления больного, после чего осуществляется перкутанное коронарное вмешательство или шунтирование коронарных артерий, достоверно снижает риск смерти или ИМ с 4,3 до 2,9%.
Учитывая результаты 3 рандомизированных исследований, возможность назначения блокаторов гликопротеиновых рецепторов IIb/IIIa в дополнение к ацетилсалициловой кислоте и гепарина в низкой дозе, которую корригировали в зависимости от массы тела, необходимо рассматривать у всех пациентов с острым коронарным синдромом и повышенным уровнем тропонина Т или тропонина I, которым планируют раннюю реваскуляризацию (уровень доказательности А).
Вместе с тем продолжительное пероральное применение этих препаратов у больных с острым коронарным синдромом или после коронарных вмешательств не сопровождалось улучшением прогноза. Метаанализ выявил даже умеренное, но достоверное повышение смертности.
Таким образом, рекомендации относительно применения блокаторов гликопротеиновых рецепторов IIb/IIIa сводятся к следующему:
- У пациентов с умеренным или высоким риском, особенно с повышенным уровнем тропонина, депрессией сегмента ST или сахарным диабетом эптифибатид или тирофибан можно рассматривать как вспомогательную антиагрегантную пер оральную терапию (IIaA).
- Обязательно оценить риск развития кровотечения при одновременном назначении антиагрегантов и антикоагулянтов.
- Пациенты, которые получали терапию эптифибатидом или тирофибаном, перед проведением ангиографии должны продолжать это лечение в течение и после процедуры перкутанного коронарного вмешательства.
- Пациентам группы высокого риска, которым не были назначены ингибиторы гликопротеиновых рецепторов IIb/IIIa перед процедурой перкутанного коронарного вмешательства, рекомендуется назначение абциксимаба немедленно после процедуры. Польза от применения эптифибатида или тирофибана в данном случае не доказана.
- Ингибиторы гликопротеиновых рецепторов IIb/IIIa необходимо комбинировать с антикоагулянтами (IA).
- Бивалирудин может быть использован как альтерантива комбинации: ингибиторы гликопротеиновых рецепторов IIb/IIIa + гепарин (IIаВ).
- Если поражение коронарной артерии установлено и перкутанное коронарное вмешательство планируется в течение 24 ч с использованием ингибиторов гликопротеиновых рецепторов IIb/IIIa, наиболее безопасно и эффективно применение абциксимаба (IIаВ).
Дозы и режимы применения препаратов
Пероральная антиагрегантная терапия:
- Ацетилсалициловую кислоту назначают в начальной дозе 160–325 мг некишечно-расворимой формы, в дальнейшем — 75–100 мг/сут.
- Клопидогрел 75 мг/сут после нагрузочной дозы 300 мг (600 мг — если этого требует острота ситуации).
Антикоагулянты:
- Фондапаринукс 2,5 мг подкожно 1 раз в сутки.
- Эноксапарин 1 мг/кг массы тела подкожно каждые 12 ч.
- Дальтепарин 120 МЕ/кг каждые 12 ч.
- Надропарин 86 МЕ/кг каждые 12 ч.
- Нефракционированный гепарин внутривенно болюсно 60–70 МЕ/кг (максимум — 5000 МЕ) с последующей инфузией 12–15 МЕ/кг/ч (максимум — 1000 МЕ/ч), поддерживая АЧТВ в 1,5–2,5 раза выше контрольного значения.
- Бивалирудин внутривенно болюсно 0,1 мг/кг с последующей инфузией 0,25 мг/кг/ч. Дополнительное внутривенное введение болюсно 0,5 мг/кг и инфузией в повышенной дозе 1,75 мг/кг/ч перед проведением перкутанного коронарного вмешательства.
Ингибиторы гликопротеиновых рецепторов IIb/IIIa:
- Абциксимаб 0,25 мг/кг внутривенно болюсно с последующей инфузией 0,125 мг/кг/мин (максимум — 10 мг/мин) на протяжении 12–24 ч.
- Эптифибатид 180 мг/кг внутривенно болюсно (второй болюс через 10 мин после перкутанного коронарного вмешательства), в дальнейшем — инфузия 2,0 мг/кг/мин на протяжении 72–96 ч.
- Тирофибан 0,4 мг/кг/мин внутривенно на протяжении 30 мин с последующей инфузией 0,10 мг/кг/мин на протяжении 48–96 ч. Режим с более высокой дозой (болюс 25 мг/кг + инфузия 0,15 мг/кг/мин на протяжении 18 ч) сейчас проходит тестирование в клинических исследованиях.
Коррекция осложнений терапии блокаторами рецепторов гликопротеина IIB/IIIA, связанных с кровотечениями
Риск развития кровотечений, связанных с применением антитромбоцитарных средств и, в частности, блокаторов рецепторов гликопротеина IIb/IIIa, непосредственно зависит от дозы одновременно применяемого гепарина, потому при использовании этих препаратов рекомендуют особый режим дозирования гепарина. При условии перкутанного коронарного вмешательства нецелесообразно повышать дозу гепарина >70 МЕ/кг массы тела, а целевое активированное время свертывания составляет 200 с. При возникновении локальных осложнений, таких как выраженная гематома или продолжительное кровотечение в месте пункции, может появиться потребность в хирургическом вмешательстве.
У незначительной части пациентов при парентеральном применении блокаторов гликопротеиновых рецепторов IIb/IIIa может возникнуть тромбоцитопения. После прекращения введения препарата уровень тромбоцитов обычно нормализуется. Для абциксимаба может быть актуальной проблема повторного назначения, поскольку этому препарату присуща иммуногенность. Впрочем, по данным реестров безопасность и эффективность абциксимаба оказались не хуже, чем при первом применении препарата.
В недавних рекомендациях «The Task Force on the Use of Antiplatelet Agents in Patients with Atherosclerotic Cardiovascular Disease of the European Society of Cardiology» итоговая таблица применения антиагрегантов выглядит следующим образом (табл. 2.2).
Таблица 2.2
Рекомендации по применению антиагрегантов согласно «The Task Force on the Use of Antiplatelet Agents in Patients with Atherosclerotic Cardiovascular Disease of the European Society of Cardiology»
| Заболевание | Рекомендация | Примечание | Уровень доказательности |
| ИБС | |||
| Стабильная стенокардия | Ацетилсалициловая кислота | 1A | |
| Клопидогрел | Как альтернатива ацетилсалициловой кислоте | 1C+ | |
| Острый коронарный синдром с перкутанным коронарным вмешательством | Ацетилсалициловая кислота | 1A | |
| Без стойкой элевации сегмента ST | Клопидогрел + ацетилсалициловая кислота | Более эффективен, чем монотерапия ацетилсалициловой кислотой | 1A |
| Внутривенно ингибиторы гликопротеиновых рецепторов IIb/IIIa | При внутрисосудистых вмешательствах | 1A | |
| Без перкутанного коронарного вмешательства | Ацетилсалициловая кислота | 1A | |
| Клопидогрел + ацетилсалициловая кислота | Более эффективен, чем монотерапия ацетилсалициловой кислотой | 1A | |
| Внутривенно ингибиторы гликопротеиновых рецепторов IIb/IIIa | Тирофибан или эптифибатид | 2A | |
| Острый ИМ | Ацетилсалициловая кислота | 1A | |
| С первичным перкутанным коронарным вмешательством | Внутривенно ингибиторы гликопротеиновых рецепторов IIb/IIIa | Абциксимаб | 1A |
| Предшествующий ИМ | Ацетилсалициловая кислота | 1A | |
| Клопидогрел | Как альтернатива ацетилсалициловой кислоте | 1A | |
| После коронарного шунтирования | Ацетилсалициловая кислота | 1A | |
| Перкутанное коронарное вмешательство | Ацетилсалициловая кислота | 1A | |
| Клопидогрел | При стентировании | 1A | |
| Тиклопидин | При стентировании | 1A | |
| Внутривенно ингибиторы гликопротеиновых рецепторов IIb/IIIa | Возможно при стабильной стенокардии | 2A | |
| Ишемический инсульт | Ацетилсалициловая кислота | 1A | |
| Предшествующий инсульт | Ацетилсалициловая кислота | 1A | |
| Клопидогрел | Как альтернатива ацетилсалициловой кислоте | 1A | |
| Заболевания периферических сосудов | Ацетилсалициловая кислота | 1C+ | |
| Клопидогрел | Как альтернатива ацетилсалициловой кислоте | 1A | |
| Первичная профилактика в группах высокого риска | |||
| Сахарный диабет | Ацетилсалициловая кислота | 2B | |
| АГ | Ацетилсалициловая кислота | 2A | |
| Фибрилляция предсердий | Ацетилсалициловая кислота | При средней и высокой степени риска одновременно с варфарином | 1A |
| Заболевания клапанов сердца | Ацетилсалициловая кислота | Ревматические пороки клапанов сердца без применения варфарина | 1B |
| Оперированные клапаны сердца | Ацетилсалициловая кислота | В комбинации с варфарином у пациентов с искусственными клапанами | 2B |
Фибринолитическая терапия
Фибринолитическая терапия уменьшает размер внутрикоронарного тромба и достоверно улучшает выживаемость у пациентов с острыми коронарными синдромами, которые сопровождаются элевацией сегмента ST. Вместе с тем при нестабильной стенокардии стрептокиназа, анистреплаза, тенектеплаза и урокиназа в нескольких исследованиях неизменно ухудшали выживаемость.
Риск смерти и ИМ в общем анализе данных нескольких исследований, в которые включили 2859 пациентов, составлял 9,8% при терапии фибринолитиками и 6,9% — в контрольной группе. Подобные результаты получены также в метаанализе результатов лечения 3563 пациентов. Итак, тромболитическую терапию не рекомендуют пациентам с острым коронарным синдромом без стойкой элевации сегмента ST.
Коронарная реваскуляризация
Цель выполнения реваскуляризации (путем перкутанного коронарного вмешательства или шунтирования коронарных артерий) — лечение при возвратной или продолжающейся ишемии миокарда, предотвращение развития ИМ или смерти. Показание для реваскуляризации и выбор стратегии лечения определяются распространенностью и ангиографическими характеристиками поражения коронарных артерий.
Коронарная ангиография
Коронарная ангиография — единственный метод исследования, позволяющий оценить наличие и степень выраженности поражения коронарных артерий. Решение о выполнении хирургического вмешательства базируется на данных коронарной ангиографии. Частота осуществления коронарной ангиографии отличается в разных странах. Согласно данным EuroHeart Survey среди 5367 пациентов с острым коронарным синдромом без элевации сегмента ST коронарная ангиография была выполнена в 52%.
Показания и сроки выполнения коронарной ангиографии обсуждаются дальше в разделе, посвященном стратегиям ведения больных с острыми коронарными синдромами. Выполнение коронарной ангиографии не имеет особых предостережений. Лишь в случаях гемодинамической нестабильности (отек легких, артериальная гипотензия, тяжелая жизненно опасная аритмия) иногда желательно осуществить вмешательство с применением внутриаортальной баллонной помпы, ограничить количество коронарных инъекций и не выполнять вентрикулографию, которая может обусловить дестабилизацию неустойчивого состояния гемодинамики. В этих случаях функцию ЛЖ можно оценить эхоКГ-методом.
Результаты исследований TIMI IIIB и FRISC 2 свидетельствуют о том, что у 30–38% пациентов с нестабильными коронарными синдромами диагностируют поражение одной, а у 44–59% — нескольких коронарных артерий. Частота незначительного поражения коронарных артерий составляет от 14 до 19%. Стеноз ствола левой коронарной артерии диагностируют в 4–8% случаев. Оценка изменений ЭКГ при поступлении помогает установить поражение, которое, вероятно, приводит к острому коронарному синдрому.
Важным маркером риска является присутствие тромба в месте повреждения сосуда. Маркерами высокого риска являются эксцентричность, нечеткие границы, изъязвленность, нерезкость изображения и дефекты наполнения. Сравнительно с ангиоскопией коронарная ангиография характеризуется высокой специфичностью и низкой чувствительностью к выявлению тромбов.
Описание «причинного» повреждения является чрезвычайно существенным фактором выбора соответствующих вмешательств. Важные данные, которые исключают возможность коронарного вмешательства с имплантацией стента, — чрезмерная извитость сосуда, кальцификация и стеноз в месте сгиба. Эти изменения часто выявляют у пациентов пожилого возраста.
Перкутанное коронарное вмешательство
Безопасность и эффективность перкутанного коронарного вмешательства при острых коронарных синдромах существенным образом улучшились благодаря применению стентов и блокаторов гликопротеиновых рецепторов IIb/IIIa. В EuroHeart Survey у 25% общей популяции выполняли перкутанное коронарное вмешательство, у 74% — имплантацию стента, у 27% — назначали блокаторы гликопротеиновых рецепторов IIb/IIIa.
Имплантация стента при нестабильных формах ИБС — относительно безопасная процедура, позволяющая механически стабилизировать разорванную бляшку в месте повреждения. Такое преимущество стентирования особенно весомо при повреждениях с высоким риском, но при надлежащем медикаментозном сопровождении.
По данным исследования BENESTENT II (BElgium, NEtherlands STENT II trial, 1998) имплантация стента — безопасная процедура и ассоциируется с меньшим риском рестеноза на протяжении 6 мес, чем баллонная дилатация.
Фрагмент исследования EPISTENT показал, что сочетание имплантации стента и введения абциксимаба ассоциировалось с достоверно меньшей частотой значительных осложнений, чем при стентировании на фоне введения плацебо. Эффективность комбинации стентирования и введения абциксимаба была выше, чем баллонной ангиопластики и абциксимаба. Эти данные отмечали также в подгруппе пациентов с нестабильными формами ИБС.
Необходимо помнить, что исход коронарной реваскуляризации в значительной мере определяет активность системного воспаления. Установлено, что воспаление и рекрутирование нейтрофильных гранулоцитов в поврежденную сосудистую стенку после имплантации стента являются важнейшими факторами развития рестеноза, частота которого в настоящее время достигает 25–30%. Основной причиной усиленного образования неоинтимы в этих условиях является возрастание экспрессии адгезивных молекул (CD11b/CD18) лейкоцитами, ответственными за их прочную адгезию к тромбоцитам и фибриногена на стенке поврежденного сосуда.
Поверхностное повреждение сосудистой стенки сочетается с ранней и транзиторной инфильтрацией нейтрофильных гранулоцитов, тогда как вызванное стентированием глубокое повреждение приводит к рекрутированию моноцитов/макрофагов длительностью от дней до недель. На материалах аутопсий показано, что через 1 мес после имплантации стента в коронарные артерии источником 30% неоинтимальных клеток являются гладкомышечные клетки, 70% — моноциты. В исследовании, проведенном с участием 62 пациентов с имплантацией стента, установлена экспрессия CD11b на поверхности нейтрофильных гранулоцитов уже через 24 ч после вмешательства, прогрессирующая до 48 ч. Эти изменения были достоверно более выражены у пациентов с последующим развитием рестеноза. Применение статинов на протяжении 1 года после реваскуляризации позволяет снизить содержание СРБ в плазме крови, уменьшить на 40% частоту развития рестенозов и ИМ, на 50% — частоту смерти. Таким образом, следует всегда помнить, что устанавливая стент, мы вмешиваемся в чрезвычайно тонкие механизмы функционирования сосудистой стенки, что может спровоцировать самостоятельные интенсивные повреждения с запуском каскада воспаления — образование/обострение воспаления атеросклеротической бляшки — тромбоза. Именно это и было доказано в последних клинических исследованиях эффективности разных типов стентов как при хронической ИБС, так и при острых ее формах.
В 2005 г. приняты рекомендации Европейского общества кардиологов по инвазивным вмешательствам — Guidelines for Percutaneous Coronary Interventions. The Task Force for Percutaneous Coronary Interventions the European Society of Cardiology.
Показания для срочной (в течение 48 ч) ангиографии следующие:
- Повторяющаяся боль в покое.
- Динамика сегмента ST — депрессия >0,1 мВ или транзиторная (<30 мин) элевация ST >0,1 мВ.
- Повышение уровня тропонина I, тропонина Т или МВ-фракции КФК.
- Гемодинамическая нестабильность.
- Угрожающие аритмии (желудочковая тахикардия, фибрилляция желудочков).
- Ранняя постинфарктная стенокардия.
- Сахарный диабет.
- В остальных случаях проводят оптимальную медикаментозную терапию с отсроченной ангиографией после стабилизации состояния.
Эти же рекомендации звучали на 13-й конференции American Academy of Emergency Medicine (AAEM) в марте 2007 г., где также подчеркивалось, что перкутанное коронарное вмешательство имеет преимущество перед оптимальной медикаментозной терапией лишь у больных с повышенным риском.
Таким образом, рекомендации Европейского общества кардиологов 2007 г. относительно инвазивной тактики у больных с острым коронарным синдромом без элевации ST выглядят так:
- Ургентная коронаровентрикулография рекомендуется пациентам с рефрактерной или возвратной стенокардией в сочетании с динамическими изменениями ST, с СН, угрожающими нарушениями ритма или гемодинамической нестабильностью (IC).
- Ранняя (<72 ч) коронаровентрикулография с последующей реваскуляризацией (перкутанное коронарное вмешательство или АКШ) рекомендуется больным со средним и высоким риском (IA).
- Рутинная инвазивная тактика у пациентов без среднего или высокого риска не рекомендуется (IIIC).
- Перкутанное коронарное вмешательство без установленного повреждения сосудов (по данным ангиографии) не рекомендуется (IIIC).
- При выборе типа стента (BMS или DES) необходимо учитывать возможные некардиальные хирургические вмешательства, требующие отмены антиагрегантов (IC).
Хирургическое шунтирование коронарных артерий
Данные EuroHeart Survey свидетельствуют, что частота выполнения АКШ составляет 5,4% с существенными отличиями в разных странах. Применение современных хирургических методов ассоциируется с низкой операционной смертностью. В исследовании FRISC II смертность составляла 2% через 1 мес, в исследовании TACTICS (Treat Angina with Aggrastat and Determine Cost of Therapy with an Invasive or Conservative Strategy) — 1,7%. Хирургическое лечение постинфарктной (<30 дней) нестабильной стенокардии ассоциируется с более высокой (6,8%) операционной смертностью (от 0 до 16%) и частотой развития периоперационного ИМ (5,9%, диапазон от 0 до 15%). У пациентов с нестабильными формами ИБС, которым выполняют АКШ, профили риска разные. Периоперационная смертность и заболеваемость выше у пациентов с тяжелой нестабильной стенокардией, а также с нестабильной стенокардией после недавнего (<7 дней) ИМ. Впрочем, следует вспомнить, что в последних исследованиях по инвазивным вмешательствам АКШ ассоциировалось с низкой (2,1%) смертностью, несмотря на то что большинство вмешательств выполняли у пациентов с заболеванием ствола или нескольких коронарных артерий и в ранние сроки после ИМ (<7 дней).
С учетом результатов ряда исследований предыдущая агрессивная антитромбоцитарная терапия должна рассматриваться как относительное противопоказание к раннему АКШ, но может требовать специфических хирургических мер по уменьшению кровотечения, в некоторых случаях — переливания тромбоцитов. Впрочем, если нет показаний для неотложного хирургического вмешательства, лучше прекратить применение препарата и выполнить вмешательство через 5 дней.
Противовоспалительное лечение
Учитывая то что патофизиология воспаления изложена выше, а некоторые методы влияния на процессы воспаления (в частности статины) приведены в соответствующем разделе, назовем лишь ряд исследований, в которых авторы пытались воздействовать на клиническое течение острого коронарного синдрома с помощью антибиотиков. Проведено довольно много исследований, в которых отмечали действие антибиотиков и противовирусных препаратов на некоторые показатели воспаления, но до сих пор существенные клинические эффекты не получены.
Заслуживает внимания несколько недавних наблюдений, в которых отмечены положительные изменения в клиническом течении ИБС в том случае, когда в острый период больным были выполнены прививки против гриппа.
На Европейском конгрессе кардиологов в 2002 г. были доложены результаты исследования, проведенного в Аргентине (E. Gurfinkel, E. Beck, J. Bono, J. Sintopinto, G. Bozovich, B. Miutner, Buenos Aires, Argentini). 100 пациентов в первые 72 ч после развития ИМ были привиты вакцинами A/Moscow/10/99-like virus, A/New Ciledonii/20/99 (H1N1)-like virus и AB/Sichuin/379/99-like virus. Через 6 мес оказалось, что по комбинированной конечной точке (смерть, нефатальный ИМ и возвратная ишемия) группа лечения продемонстрировала лучшее клиническое течение ИБС (10%) против контрольной группы (24%; р=0,008). Эти данные позволяют предположить полезность антигриппозных прививок у пациентов с высокой степенью риска, особенно в наших широтах с частыми эпидемиями гриппа.
Выбор тактики ведения больных: перкутанное коронарное вмешательство или АКШ
В случаях однососудистого поражения с показаниями для реваскуляризации обычно выполняют перкутанное коронарное вмешательство с имплантацией стента и сопутствующим назначением блокаторов гликопротеиновых рецепторов IIb/IIIi. Хирургическую реваскуляризацию выполняют лишь, если анатомия коронарного русла не способствует безопасному выполнению перкутанного вмешательства (например при чрезмерных поворотах сосуда или выраженной ангуляции).
В случаях поражения ствола или трех сосудов, особенно при наличии дисфункции ЛЖ, обычно выполняют операцию АКШ, которая улучшает прогноз выживаемости больных, качество жизни и снижает уровень госпитализации. Более того, АКШ характеризуется лучшим, по сравнению с перкутанным вмешательством, соотношением стоимости и эффективности, поскольку эффективнее обеспечивает уменьшение выраженности симптомов и снижает потребность в повторном вмешательстве.
В случаях двухсосудистого заболевания (или трехсосудистого поражения, при возможности стентирования) выбор тактики ведения пациентов осуществляется индивидуально. Анализ подгруппы пациентов с нестабильными формами ИБС в исследованиях CABRI (Coroniry Angioplisty versus Bypiss Revisculirizition Investigition, 1996) и BARI (Bypiss Angioplisty Revisculirizition Investigition, 1997) не выявил достоверных отличий внутригоспитальной смертности и количества случаев ИМ в группах ангиопластики и АКШ. Тем не менее, количество повторных процедур реваскуляризации было больше при выполнении перкутанных вмешательств (40–60%), чем АКШ (5–10%). Наблюдение в исследовании BARI длилось 7 лет; за этот период не выявлено отличия в уровне смертности. Лишь в подгруппе пациентов с сахарным диабетом исход был лучшим при выполнении АКШ, чем ангиопластики.
В рандомизированном исследовании ARTS (Arterial Revascularization Therapies Study) сравнивали результаты и соотношение затрат и эффективности выполнения стентирования сравнительно с АКШ у 1200 пациентов со множественными поражениями сосудов сердца, среди которых было 36% пациентов с нестабильными формами ИБС. Лечение было успешным у 97% пациентов в группе стентирования и у 96% — хирургического вмешательства. Суммарное количество неблагоприятных событий (смерть, ИМ, инсульт, потребность в реваскуляризации) через 30 дней составляло 8,7% в группе стентирования и 6,8% — в группе АКШ (отличия недостоверные). При 2-летнем наблюдении заметили разницу между группами (20,5% против 15,2%) вследствие потребности в дальнейшем выполнении реваскуляризации в группе стентирования. Другие исследования дали противоречивые результаты.
В общем, нет четких доказательств преимуществ одной стратегии лечения сравнительно с другой. Впрочем, у многих пациентов со множественным поражением сосудов сердца некоторые повреждения сосудов не могут быть устранены путем ангиопластики и стентирования, потому хирургическое вмешательство должно быть методом первого выбора.
У некоторых пациентов со множественным поражением сосудов, которые нуждаются в тотальной реваскуляризации (что невозможно достичь при перкутанном вмешательстве), но у которых ранняя операция ассоциируется с очень высоким риском, можно отдать преимущество стратегии первоначального перкутанного вмешательства, направленного лишь на причинное повреждение. Поэтапное перкутанное лечение можно выполнять также у лиц с тяжелыми сопутствующими заболеваниями. У пациентов с сужением ствола левой коронарной артерии и тяжелыми сопутствующими заболеваниями в определенных случаях избирают ангиопластику с имплантацией стента.
Инвазивная или консервативная стратегия лечения
В 2 рандомизированных исследованиях сравнивали результаты современных хирургических вмешательств и медикаментозной терапии. В исследование FRISC-II (1999) включили 2457 пациентов с нестабильными формами ИБС групп высокого риска. У всех пациентов на протяжении последних 48 ч возникла боль в грудной клетке, которая сопровождалась депрессией сегмента ST, инверсией зубца Т или биохимическими маркерами повреждения миокарда. В группе ранней инвазивной стратегии выполняли перкутанное вмешательство в среднем через 4 дня или АКШ — через 8 дней. В другой группе вмешательства выполняли лишь в случае тяжелой стенокардии. Процедуры реваскуляризации осуществили на протяжении первых 10 дней у 71% пациентов в первой (инвазивной) и у 9% во второй (консервативной) группе, а на протяжении первых 12 мес — соответственно у 78 и 43% пациентов. В частности, через 1 год перкутанное коронарное вмешательство осуществили у 44 и 21% пациентов; АКШ — у 38 и 23%. Через 1 год наблюдения проследили вероятную разницу общей смертности: 2,2% против 3,9% (относительный риск 0,57; 95% ДИ 0,36–0,90), а также ИМ: 8,6% против 11,6% (относительный риск 0,74; 95% ДИ 0,59–0,94) в пользу инвазивной стратегии. Количество пациентов с симптомами стенокардии, которые требовали новых госпитализаций, в группе инвазивной стратегии было вдвое меньше.
В исследование TACTICS включили 2220 пациентов с острым коронарным синдромом без персистирующей элевации сегмента ST, которых рандомизировали в группы ранней (2–48 ч) инвазивной стратегии, включая рутинную коронарную ангиографию с дальнейшей реваскуляризацией (если она была необходимой) и более консервативной стратегии, когда катетеризацию выполняли лишь в случае объективных признаков возвратной ишемии или патологических результатов стресс-теста. В этом исследовании у 60% пациентов группы инвазивной терапии осуществили процедуру в госпитале, тогда как у 36% пациентов группы медикаментозной терапии осуществили процедуру реваскуляризации. Несмотря на это, частота первичной конечной точки (общее количество случаев смерти, нефатального ИМ и регоспитализации вследствие острого коронарного синдрома) достоверно снизилась при 6-месячном наблюдении в группе инвазивной стратегии (19,4 и 15,4%, абсолютное снижение риска — 4%, относительный риск 0,78; p=0,025).
Несколько метаанализов, проведенных S.R. Mehta и соавторами (7 исследований), показали преимущество рутинной (то есть для всех больных с нестабильной стенокардией) перед селективной (по показаниям) процедуры перкутанного коронарного вмешательства, но авторы отмечают сложность этого анализа в связи с переходом больных из одной группы в другую уже после рандомизации. В более поздних исследованиях установлено, что при продолжительном наблюдении инвазивная тактика имеет преимущество перед консервативной только у больных с повышенным уровнем тропонина (то есть высокого риска).
Что касается эффективности стентирования в зависимости от типов стентов (металлических стентов — BMS), покрытых лекарством (элютинг-стентов — DES), в последние 2 года появились исследования и анализы национальных регистров острого коронарного синдрома, в которых подвергались сомнению преимущества DES-стентов. Так, анализ шведского регистра Swedish Coronary Angiography and Angioplasty Registry (SCAAR) включал всех пациентов, которым в 2003 и 2004 г. имплантированы DES (6033 больных) и металлические стенты (13 738 пациентов). Оказалось, что через 3 года не было различий в частоте кардиальной смерти и ИМ в двух группах. Через 6 мес в группе DES чаще отмечали жесткие конечные точки с достоверной разницей. Авторы считают, что снижение частоты смерти/ИМ в течение первых 6 мес на 13,7% компенсируется их повышением на 12,7% на протяжении следующего года при DES-стентировании. Между 6 мес и 3 годами только риск смерти был на 30% выше у пациентов DES-группы.
На конгрессе в Барселоне Robbert de Winter представил окончательные результаты исследования ICTUS (Invasive Versus Conservative Treatment in Unstable Coronary Syndromes ). В течение 3 лет наблюдали 1200 пациентов, перенесших острый коронарный синдром без подъема сегмента ST. Больных распределили на две группы — группу с ранней (в течение 48 ч после появления симптомов и повышения уровня тропонина) инвазивной стратегией и группу селективной стратегии, в которой проводили оптимальное медикаментозное лечение, а перкутанное коронарное вмешательство проводили только в случае рефрактерной ишемии или наличия ишемии при нагрузочном тестировании перед выпиской. Исследование показало отсутствие преимущества ранней инвазивной стратегии у этих больных по сравнению с оптимальной медикаментозной терапией. Частота первичных точек — смертность, ИМ или повторная госпитализация по поводу острого коронарного синдрома не отличались в обеих группах при наблюдении в течение 3 лет. Эти результаты отличаются от опубликованных ранее — FRISC II и RITA-3 (Randomized Intervention Trial of Unstable Angina).
Итак, современная инвазивная стратегия после предшествующего применения современных противоишемических и противотромботических лекарственных средств у пациентов с нестабильной стенокардией только с высокой степенью риска снижает вероятность смерти, ИМ, количество симптомов и повторных госпитализаций по сравнению с консервативной стратегией (уровень доказательности А).
Тактика ведения больных с острым коронарным синдромом в отдельных популяционных группах
Пациенты преклонного возраста
Ввиду того, что количество больных с острым коронарным синдромом в мире увеличивается почти пропорционально удлинению жизни (в Европе количество больных с острым коронарным синдромом в возрасте >75 лет составляет 27–34%), а частота смерти у них в 2 раза превышает таковую у пациентов в возрасте <75 лет, особенности лечения этой категории больных привлекают все большее внимание исследователей.
Прежде всего у пациентов преклонного возраста затруднена диагностика коронарного события в связи с полиморфизмом жалоб (вследствие значительного количества сопутствующих заболеваний), значительными исходными изменениями ЭКГ, большим количеством случаев ХСН.
Лечение пациентов с острым коронарным синдромом усложняется повышенным риском кровотечений вследствие применения антикоагулянтов, особенно в сочетании с антиагрегантами. Поэтому у больных преклонного возраста необходима тщательная оценка возможной эффективности и риска развития кровотечения при применении этих препаратов.
Рекомендации:
- У пациентов преклонного возраста (>75 лет) часто отмечают атипические коронарные симптомы. Активное выявление острого коронарного синдрома у этих больных должно базироваться на более тщательном анализе, чем у пациентов более молодого возраста.
- Планирование рутинной ранней инвазивной стратегии должно исходить из возможности повышенного риска осложнений процедуры, особенно в случае АКШ.
Зависимость от пола
Известно, что у женщин первые симптомы ИБС возникают в среднем на 10 лет позже, чем у мужчин. Европейские регистры острого коронарного синдрома отмечают преобладающее количество случаев у женщин в возрасте 65 лет против 71 года у мужчин, при этом у 45% женщин с острым коронарным синдромом возраст >75 лет. Немного чаще у женщин регистрируют сахарный диабет — 26% против 22%. Учитывая эти факторы риска, смертность среди женщин с острым коронарным синдромом без элевации сегмента ST по данным GUSTO 2B выше (в 30-дневной срок), чем среди мужчин. В то же время европейские регистры зарегистрировали более редкое применение современных лечебных стратегий у женщин (клопидогрел, перкутанное коронарное вмешательство). Таким образом, рекомендуется одинаковое лечение при остром коронарном синдроме, включая перкутанное коронарное вмешательство, независимо от пола (учитывая гендерные сопутствующие заболевания).
Сопутствующий сахарный диабет
Наличие сахарного диабета у больных с острым коронарным синдромом является независимым фактором риска смерти, которая в 2 раза выше, чем смертность при остром коронарном синдроме без сопутствующего сахарного диабета. У пациентов с сахарным диабетом отмечают также большее количество сопутствующих заболеваний — нарушение функции почек, СН, перенесенный инсульт и общее поражение сосудистой системы. В общем, приблизительно у 20–30% больных с острым коронарным синдромом без элевации сегмента ST — сахарный диабет преимущественно II типа с инсулинорезистентностью, выявляют его чаще у женщин — 41,6% против 30,7% у мужчин. Кроме того, у пациентов с сахарным диабетом частота АГ (81% против 66% у больных без сахарного диабета) и ожирения (28,5% против 18,6%) значительно выше. Если учитывать не только клинический диагноз «сахарный диабет», а и нарушение толерантности к глюкозе или повышенный уровень глюкозы натощак, у 2/3 пациентов с хронической или острой формой ИБС отмечают проблемы с регуляцией метаболизма глюкозы. Поэтому пациенты с сахарным диабетом нуждаются в более интенсивном наблюдении, прежде всего контроле уровня глюкозы (есть данные, что повышение на 3 ммоль/л глюкозы у больных с ИМ повышает смертность на 20% при длительном наблюдении).
Следует помнить, что у пациентов с острым коронарным синдромом без элевации сегмента ST в сочетании с сахарным диабетом процедуры ангиографии и/или ангиопластики могут вызвать контраст-индуцированную нефропатию.
Учитывая это, метформин следует отменять за 24 ч до проведения процедуры или на 1 сут после ее проведения. Риск кетоацидоза в этом случае незначительный, но упреждается повышенный риск нефропатии. Применение метформина можно восстановить через 48 ч после проведения процедуры, если нет симптомов прогрессирования почечной недостаточности.
В целом, проведение инвазивных процедур в сочетании с антитромботической терапией рекомендуется. В 2 исследованиях — FRISC-2 и TACTICS-TIMI-18 (Treat angina with Aggrastat and determine Cost of Therapy with an Invasive or Conservative Strategy — Thrombolysis in Myocardial Infarction 18), зарегистрировано 22–27% снижение частоты смерти и нефатального ИМ у больных сахарным диабетом после ранней инвазивной стратегии в сравнении с консервативной.
Учитывая высокую частоту множественного повреждения сосудов венечного русла у больных сахарным диабетом, чаще используют с хорошими результатами АКШ, базируясь на исследовании BARI (Bypass Angioplasty Revascularization Investigation). В ряде исследований при сравнении эффективности перкутанного коронарного вмешательства и GABG (Coronary Artery Bypass Graft) у больных сахарным диабетом и острым коронарным синдромом без элевации ST после неэффективной консервативной терапии не получены преимущества — 3-летняя выживаемость в группе перкутанного коронарного вмешательства составляла 81%, GABG — 72% (статистически недостверно). Применение более современных методик стентирования и медикаментозного сопровождения не изменило картину, хотя у этих пациентов раннее стентирование имеет преимущество перед консервативной терапией. Сопутствующее применение блокаторов гликопротеиновых рецепторов IIb/IIIa при стентировании повышает выживаемость по данным метаанализа 6 больших рандомизированных исследований. У 6458 больных сахарным диабетом и острым коронарным синдромом без элевации ST применение блокаторов гликопротеиновых рецепторов IIb/IIIa приводило к снижению 30-дневной смертности на 26% (6,2% против 4,6%; р<0,007). Тем не менее, даже Европейские регистры острого коронарного синдрома дают меньший процент применения этой группы препаратов у больных сахарным диабетом, чем у недиабетиков, что требует коррекции.
Таким образом, рекомендации относительно лечения при остром коронарном синдроме без элевации ST с сопутствующим сахарным диабетом сводятся к следующему:
- Жесткий контроль уровня глюкозы и достижение нормогликемии, насколько это возможно, у всех пациентов с сахарным диабетом и острым коронарным синдромом без элевации ST.
- Инфузия инсулина возможна для достижения нормогликемии у части больных острым коронарным синдромом без элевации ST с высоким уровнем глюкозы.
- Больным с сопутствующим сахарным диабетом рекомендуется раннее инвазивное вмешательство.
- Больным с сахарным диабетом внутривенное введение блокаторов гликопротеиновых рецепторов IIb/IIIa должно предшествовать и сопровождать процедуру перкутанного коронарного вмешательства.
Лечение пациентов с хроническими заболеваниями почек
Как известно, существует пять степеней почечной недостаточности, определяемых по уровню гломерулярной фильтрации — от >90 мл/мин/1,73 м2 (I стадия) до <15 мл/мин/1,73 м2 (V стадия). Однако в клинической практике чаще используют показатель клиренса креатинина. Данные национальных регистров Европы и США демонстрируют повышенную почти в 2 раза частоту кардиальной смертности и смертности от других причин у больных с хроническими заболеваниями почек, даже включая I степень недостаточности. Таким образом, хронические заболевания почек являются новым нетрадиционным фактором риска, таким как показатели воспаления, гипергомоцистемия и протромботические состояния. Следует помнить, что причиной почечной недостаточности приблизительно в 50% случаев является сахарный диабет. Больные с острым коронарным синдромом без элевации сегмента ST демонстрируют такую же частоту почечной недостаточности, как и другие больные с острыми и хроническими формами ИБС. В Европейских рекомендациях приведена таблица применения ряда кардиологических препаратов при ренальной дисфункции, но в комментариях к ней есть указание, что таблица не является окончательной, поскольку существуют значительные отличия в рекомендациях разных стран и в инструкциях к применению препаратов.
Рекомендации для пациентов с острым коронарным синдромом без элевации ST и сопутствующими хроническими заболеваниями почек:
- Клиренс креатинина и/или гломерулярной фильтрации необходимо рассчитывать для каждого пациента, госпитализированного по поводу острого коронарного синдрома без элевации ST (IB). У мужчин и женщин преклонного возраста, а также у больных с недостаточной массой тела нормальный уровень креатинина в плазме крови может не соответствовать имеющимся у них сниженным уровням клиренса креатинина и гломерулярной фильтрации (IB).
- Пациенты с хроническими заболеваниями почек должны получать такую же терапию первой линии, как и другие больные.
- У пациентов с клиренсом креатинина <30 л/мин или гломерулярной фильтрации <30 мл/мин/1,73 м2 требуются осторожность при назначении антикоагулянтов и коррекции дозы, следует также учитывать противопоказания (IC).
- Рекомендуется регулировать введение нефракционированного гепарина соответственно показателям АЧТВ при клиренсе креатинина <30 мл/мин или гломерулярной фильтрации <30 мл/мин/1,73 м2.
- Блокаторы гликопротеиновых рецепторов IIb/IIIa можно применять у этих больных, но следует корригировать дозу эптифибатида и тирофибана. Необходима осторожность с учетом высокого риска развития кровотечений при использовании абциксимаба (IB).
- У пациентов с хроническими заболеваниями почек и клиренсом креатинина <60 мл/мин отмечают повышенный риск развития кардиальных осложнений, поэтому они нуждаются в проведении реваскуляризации при первой возможности (IIаВ).
- Следует учитывать возможность развития контраст-индуцированной нефропатии (IB).
Лечение больных с острым коронарным синдромом без элевации сегмента ST с сопутствующей анемией
Частота случаев анемии у больных с острым коронарным синдромом может составлять 5–10% (диагноз анемии устанавливают согласно рекомендациям ВОЗ — гематокрит <39% для мужчин и <36% для женщин и уровень гемоглобина <13 г/дл для мужчин и <12 г/дл для женщин). Метаанализ исследований, в которые включили около 40 000 больных с острым коронарным синдромом (включая ИМ), установил у них достоверное влияние анемии на 30-дневные конечные точки. Повышение частоты смерти, ИМ и повторных ишемических атак зарегистрированы при уровне гемоглобина <11 г/дл — 1,45% на каждый 1 г/дл по сравнению с больными с уровнем гемоглобина 15–16 г/дл. Но частота кардиоваскулярных осложнений также повышалась при уровне гемоглобина >16 г/дл. Наличие анемии чаще выявляют как сопутствующее заболевание у пациентов преклонного возраста, с сахарным диабетом и почечной недостаточностью. Анемия ухудшает прогноз при проведении перкутанного коронарного вмешательства или GABG.
Рекомендации для пациентов с острым коронарным синдромом без элевации сегмента ST с сопутствующей анемией:
- Низкий исходный уровень гемоглобина является независимым маркером риска развития ишемических событий и кровотечений в течение 30 сут заболевания. Это следует учитывать при определении степени риска (IB).
- Все необходимые анализы должны быть выполнены перед определением тактики лечения.
- Незначительная анемия у больных с острым коронарным синдромом без элевации ST не требует гемотрансфузии, за исключением случаев анемии вследствие применения соответствующих препаратов.
ПРОДОЛЖИТЕЛЬНОЕ ВЕДЕНИЕ БОЛЬНЫХ
Большинство сердечных событий регистрируют на протяжении нескольких месяцев после первых клинических проявлений острого коронарного синдрома. Начальная стабилизация состояния пациента не означает стабилизации базисного патологического процесса. Данных относительно продолжительности процесса заживления разорванной бляшки немного. Некоторые исследования свидетельствуют о возможности быстрого прогрессирования «причинных» поражений при остром коронарном синдроме, несмотря на начальную клиническую стабилизацию на фоне медикаментозной терапии. Повышенное образование тромбина отмечали на протяжении 6 мес после эпизода нестабильной стенокардии или ИМ.
Кроме того, исследования, в которых оценивали эффективность гепарина в дополнение к ацетилсалициловой кислоте, свидетельствовали о повышении вероятности клинических событий после прекращения введения гепарина. Несмотря на это, в исследовании FRISC II продолжение терапии низкомолекулярным гепарином было полезным лишь у пациентов, ожидающих инвазивных вмешательств.
Агрессивная модификация факторов риска показана всем пациентам, которым диагностирован острый коронарный синдром.
Пациентам следует прекратить курить. Их нужно проинформировать о вредности курения как важного фактора риска. Врачу необходимо подчеркивать необходимость физической активности и диеты согласно критериям лечения и профилактики хронических форм ИБС.
Необходимо корригировать массу тела, чему способствует физическая активность. Уменьшение массы тела в свою очередь нормализует липидный профиль и обмен глюкозы. Теоретически целью являются снижение ИМТ <25 кг/м2 или объема талии меньше 102 см у мужчин и 88 см у женщин. На практике хорошим результатом является уменьшение массы тела на 10% исходного уровня как первый шаг.
Необходимо оптимизировать контроль уровня АД. Он не должен превышать 140/90 мм рт. ст. у пациентов без сахарного диабета и 130/80 мм рт. ст. — при сахарном диабете или хронической ренальной дисфункции. Этому частично также помогает уменьшение массы тела и физическая активность.
В особом внимании нуждаются больные сахарным диабетом (следует проводить все вышеуказанные мероприятия). У пациентов с установленным диагнозом следует поддерживать уровень HbA1c <6,5%.
Изменение липидного профиля
Липидоснижающую терапию следует начать немедленно. Активное воздействие на ЛПНП и ЛПОНП, ТГ и ЛПВП следует проводить, начиная с первых часов обострения ИБС, и продолжать длительное время в соответствии с рекомендациями по лечению хронической ИБС.
Статины
Ингибиторы ГМГ-КоА-редуктазы существенным образом снижают смертность и вероятность коронарных событий у пациентов с высоким, средним или даже низким (<3,0 ммоль/л) уровнем ХС ЛПНП. Данные, полученные в небольших подгруппах пациентов в 4 исследованиях (PURSUIT (Platelet Glycoprotein IIb–IIIa in Unstable Angina: Receptor Suppression Using Integrilin Therapy), PRISM (Platelet Receptor Inhibition in Ischemic Syndrome Management), PRISM-PLUS (Platelet Receptor Inhibition in Ischemic Syndrome Management in Patients Limited by Unstable Signs and Symptoms) и TACTICS), позволяют предположить, что статины способны обеспечить быстрый результат у пациентов с острым коронарным синдромом, но эти данные получены без рандомизации (рис. 2.8).
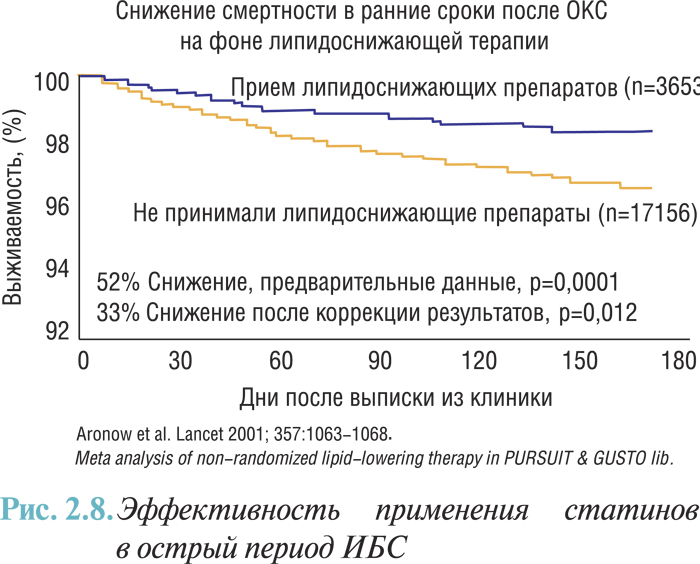
В шведском реестре RIKS-HIA (Register of Information and Knowledge about Swedish Heart Intensive Care Admission) смертность на протяжении 1 года была ниже у пациентов с ИМ без элевации сегмента ST, выписанных на фоне терапии статинами, чем без этих препаратов. В других исследованиях оценивали наличие немедленного эффекта статинов при остром коронарном синдроме (исследование A to Z) и эффективность применения препаратов в высоких дозах сравнительно со средними (TNT (Treating to New Targets), SEARCH (Study of the Effectiveness of Additional Reductions in Cholesterol and Homocysteine), IDEAL (Incremental Decrease in Clinical Endpoints Through Aggressive Lipid Lowering). Несколько ангиографических исследований эффектов липидоснижающей терапии позволяют предположить, что улучшение клинического исхода не обязательно сопровождается регрессией атеросклероза, а может быть связано с деактивацией воспаленной бляшки, обратным развитием эндотелиальной дисфункции, снижением активности протромботических факторов.
Согласно данным регистра GRACE исходы острого коронарного синдрома у больных, принимавших предварительно статины и не принимавших их, выглядят следующим образом (табл. 2.3).
Таблица 2.3
Влияние предварительного применения статинов на исходы острого коронарного синдрома
| Госпитальное событие, % | Предварительно принимали статины (n=4056) | Не принимали статины (n=15 481) | p |
| Окончательный диагноз: ИМ с элевацией сегмента ST | 18,4 | 37,6 | >0,001 |
| Уровень КФК в 2 раза превышает норму | 24,7 | 45,0 | >0,001 |
| ИМ через 24 ч или рецидивирующий ИМ | 6,9 | 10,1 | >0,001 |
| Застойная СН | 12,4 | 15,6 | >0,001 |
| Кардиогенный шок | 2,3 | 5,0 | >0,001 |
| Отек легких | 5,2 | 6,8 | >0,001 |
| Остановка сердца | 2,6 | 5,9 | >0,001 |
| Сердечный приступ | 0,8 | 1,1 | 0,078 |
| Смерть | 3,1 | 6,9 | >0,001 |
Так, предварительный прием статинов в 2 раза снижал частоту различных осложнений острого периода ИМ, включая смерть.
В 2006 г. закончено крупное иследование PROVE-IT (TIMI 22) (Pravastatin or Atorvastatin Evaluation and Infection Therapy) — двойное слепое рандомизированное исследование с участием 4160 пациентов с острым коронарным синдромом длительностью <10 дней и общим ХС <240 мг/дл. На фоне приема ацетилсалициловой кислоты + стандартной терапии больные в двух основных группах принимали 40 мг правастатина или 80 мг аторвастатина (агрессивная терапия) на протяжении 2 лет. Каждая группа делилась еще на 2 группы, пациенты одной из которых принимали антибиотик гатифлоксацин 400 мг 10 дней в месяц.
Первичные конечные точки: смерть, ИМ, инсульт, нестабильная стенокардия, требующая госпитализации или реваскуляризации (>30 дней после рандомизации). Агрессивная терапия аторвастатином оказалась на 16% (р<0,005) эффективнее, чем правастатином. В то же время применение антибиотика практически ничего не добавило к положительным эффектам лечения.
Метаанализ 8 крупных рандомизированных исследований, посвященных применению статинов в острый период ИБС, показал достоверное снижение смертности, реинфарктов и реваскуляризации. Анализ включал 15 995 пациентов с острым коронарным синдромом, рандомизированных по признаку назначения агрессивной терапии статинами (n=8037) по сравнению с обычной консервативной терапией стандартными дозами статинов или плацебо (n=7958). Статины назначали между 6 ч и 10 сут после госпитализации; средняя продолжительность терапии составляла 15 мес. Общая смертность снизилась на 25% больше в группе агрессивной терапии, кардиоваскулярная смертность снизилась больше на 22%. Не выявлено достоверной разницы в снижении частоты повторных ИМ, отмечена тенденция к снижению частоты развития инсультов в группе агрессивной терапии. По мнению авторов, снижение ХС при остром коронарном синдроме должно достигать 50–70 мг/дл.
В 2004 г. на сессии АНА Фади А. Сааб из Кардиоваскулярного центра университета Мичигана доложил о результатах наблюдения 2523 больных с острым коронарным синдромом (ИМ и нестабильная стенокардия) в 1999–2002 гг. в университетской клинике. 884 пациента были исключены из группы, поскольку им не назначали статины или они принимали статины перед заболеванием. Оставшиеся пациенты были рандомизированы на 2 группы — 1-я (1284) — получавшие статины начиная с первых 24 ч от начала развития острого коронарного синдрома, и 2-я (355) — пациенты, которым статины назначили позднее. Конечными точками были смерть, ИМ, инсульт, реинфаркт, СН и комбинированная точка — смерть, инсульт, реинфаркт.
Частота развития комбинированной конечной точки в госпитальный период оказалась существенно ниже в группе больных, принимавших статины начиная с первых 24 ч — 10,4% против 15,7% (р<0,03), у них также достоверно реже развивались признаки СН.
При анализе NRMI 4 (National Registry of Myocardial Infarction 4) авторы установили, что статины были назначены 39 096 из 174 635 (22,4%) пациентов в первые 24 ч госпитализации. Это дало снижение риска госпитальной смертности по сравнению с группой пациентов, не принимавших статины (4,0% против 15,4%; относительный риск 0,23; 95% ДИ 0,22–0,25). У пациентов группы высокого риска, которым отменили статины, был такой же высокий риск смертности — 16,5% против 15,4%.
T. Lenderink и соавторы изучили 7-дневную смертность 10 484 больных с острым коронарным синдромом, 1426 из которых статины назначали в первые 24 ч заболевания, остальным — по истечению этого срока. Смертность в группе раннего применения статинов оказалась достоверно ниже — 0,4% по сравнению с «поздней» группой — 2,6%.
В регистре ACSIS (Acute Coronary Syndrome Israeli Survey, Регистр острых коронарных синдромов Израиля) оценивали влияние предшествующей острым коронарным синдромам терапии статинами на исходы заболевания. В анализ вошли больные, госпитализированные в марте — апреле 2006 г. Из них принимали статины перед поступлением (Stat+) 938 пациентов и не принимали (Stat-) 1108. Первичная конечная точка была комбинированной — смерть, СН или возвратная ишемия между выпиской из госпиталя и 30-м днем заболевания. Мультивариантный анализ показал различие при выписке в 2 группах в пользу Stat+ — 35% (относительный риск 0,65; p=0,01). На 30-й день различие практически не изменилось — относительный риск 0,69.
Появились данные о влиянии терапии стати-нами на динамику насосной функции у больных с острым коронарным синдромом. В проспективном регистре острого коронарного синдрома (STEMI (ST-Elevation Myocardial Infarction), NSTEMI, UA) German MITRA PLUS (Maximal Individual Therapy of Acute Myocardial Infarction PLUS registry) подверглись анализу 18 936 пациентов, выписанных после перенесенного острого коронарного синдрома. Конечные точки, включая динамику ФВ, учитывали спустя 14 мес (в среднем 399 дней). Сравнивали влияние терапии статинами на смертность больных с различной исходной насосной функцией миокарда (ФВ <40% и >40%) в клинике. 14-месячная смертность на фоне терапии статинами в обеих группах была практически в 2 раза ниже, чем у больных, не принимавших статины, как при ФВ >40% (3,8% против 7,4%; относительный риск 0,74), так и при ФВ <40% (12,8 против 22,3%; относительный риск 0,67).
Кроме того, установлено, что предварительный прием аторвастатина улучшает течение острого коронарного синдрома у больных, подвергшихся раннему перкутанному коронарному вмешательству (результаты ARMYDA-ACS (Atorvastatin for Reduction of Myocardial Damage During Angioplasty-Acute Coronary Syndromes)).
171 пациент с острым коронарным синдромом без элевации сегмента ST был рандомизирован по признаку применения аторвастатина (80 мг за 12 ч до проведения перкутанного коронарного вмешательства с последующим приемом 40 мг, n=86) или плацебо (n=85). Через 30 дней регистрировали стандартные жесткие конечные точки MACE (Major Adverse Cardiac Event) (смерть, ИМ, ургентная реваскуляризация). Первичные конечные точки зарегистрированы у 5% пациентов, принимавших аторвастатин, и у 17% — плацебо (p=0,01). Это различие обеспечивалось преимущественно за счет частоты развития ИМ (5% против 15%; p=0,04). При мультивариантном анализе предварительное применение аторвастатина обусловило снижение риска MACE в течение 30 дней на 88% (OR= 0,12; 95% ДИ; p=0,004).
Наши исследования влияния симвастатина и аторвастатина также позволяют рекомендовать эти препараты уже с первых часов заболевания острым коронарным синдромом, выявлены многогранные эффекты этой группы препаратов — снижение уровня СРБ на 40% уже через 2 мес, закономерное снижение уровня ЛПНП и ТГ, интенсивности перекисного окисления ЛПНП, уменьшение выраженности синдрома инсулинорезистентности у больных с острым коронарным синдромом.
Рекомендации по применению статинов у больных с острым коронарным синдромом:
- Гиполипидемическую терапию статинами необходимо назначать всем пациентам (при отсутствии противопоказаний) независимо от уровня ХС как можно раньше (в течение 1–4 дней после поступления) для снижения уровня ХС ЛПНП <100 мг/дл (<2,6 ммоль/л) (IB).
- Интенсивная липидоснижающая терапия с целью снижения уровня ХС ЛПНП <70 мг/дл (<1,81 ммоль/л) может продолжаться 10 дней после поступления (IIaB).
На основании многочисленных исследований доказана необходимость применения ацетилсалициловой кислоты в дозе 75–150 мг. Согласно данным метаанализа назначение ацетилсалициловой кислоты в более высоких дозах не имеет преимуществ. У пациентов, ранее перенесших ИМ, применение ацетилсалициловой кислоты на протяжении в среднем 27 мес позволяет уменьшить количество сосудистых событий — 36 на 1000 пациентов, при этом случаев нефатального ИМ на 18 меньше, случаев смерти — на 14.
Учитывая результаты исследования CURE, клопидогрел в дозе 75 мг следует назначать на протяжении по крайней мере 9 мес, возможно 12 мес. В этом случае дозу ацетилсалициловой кислоты нужно снизить до 75–100 мг.
Блокаторы β-адренорецепторов улучшают прогноз у пациентов, перенесших ИМ, и после перенесенного острого коронарного синдрома лечение этими препаратами необходимо продолжать.
Самостоятельное значение во вторичной профилактике коронарных синдромов могут иметь ингибиторы АПФ. В рандомизированных исследованиях SOLVD (Studies of Left Ventricular Dysfunction) и SAVE (Survival and Ventricular Enlargement, 1992) у пациентов с ИБС и поражением ЛЖ частота сердечных событий на фоне применения ингибиторов АПФ снизилась. Эффект предотвращения ИМ становился очевидным через 6 мес активного лечения. Эти данные являются сильным аргументом в пользу того, что эффекты ингибиторов АПФ не ограничиваются контролем уровня АД. Преимущества ингибиторов АПФ могут быть связаны со стабилизацией атеросклеротической бляшки. В исследовании НОРЕ (Heart Outcomes Prevention Evaluation, 2000) у пациентов с атеросклеротическими поражениями сосудов без СН или дисфункции ЛЖ на фоне лечения рамиприлом на протяжении 4–6 лет смертность от сердечно-сосудистых причин снизилась на 25% сравнительно с плацебо (p=0,0002), частота случаев ИМ — на 20% (p=0,005). Впрочем, в исследовании HOPE не получен эффект в подкатегории пациентов с нестабильной стенокардией, которую определяли по изменениям сегмента ST и зубца Т, но это могло быть обусловлено случайными факторами.
Таким образом, кроме вышеуказанных методов лечения, больным после перенесенного острого коронарного синдрома рекомендуется назначать:
- Блокаторы β-адренорецепторов — всем больным с редуцированной ФВ (IA).
- Ингибиторы АПФ — всем пациентам с ФВ ЛЖ <40% и пациентам с сахарным диабетом, АГ или хроническим заболеванием почек (IA).
- Ингибиторы АПФ — и другим пациентам с острым коронарным синдромом для предупреждения повторных ишемических событий (IIaB).
- Блокаторы ангиотензиновых рецепторов — пациентам, устойчивым к ингибиторам АПФ и/или с СН на фоне ИМ с ФВ ЛЖ <40% (IB).
- Блокаторы альдостероновых рецепторов — пациентам после ИМ, которые уже принимают ингибиторы АПФ и блокаторы β-адренорецепторов и у которых сохраняется ФВ ЛЖ <40% и имеется сахарный диабет или СН (при отсутствии почечной дисфункции или гиперкалиемии (IB).
Осложнения, связанные с лечением
Кровотечения
Кровотечение является наиболее частым некардиальным осложнением у пациентов с острым коронарным синдромом без элевации ST. Вообще используют общие дефиниции кровотечений TIMI или GUSTO, в которых приведена локализация и необходимость гемотрансфузии. Больше всего должны привлекать внимание массивные кровотечения — интракраниальные геморрагии или клинически явные (в том числе и видимые) с потерей >5 г/дл гемоглобина.
В целом, выявляют от 2 до 8% кровотечений у больных с острым коронарным синдромом без элевации сегмента ST, чаще всего связанных с применением антитромботических препаратов или приемом их в высоких дозах, а также инвазивных процедур. Регистр GRACE при анализе 24 045 пациентов зарегистрировал 3,9% массивных кровотечений у больных с ИМ, 4,7% — при остром коронарном синдроме без элевации сегмента ST и 2,3% — при нестабильной стенокардии. Независимыми предикторами риска развития кровотечений, согласно этому регистру, являются возраст (повышение частоты на 1,22% каждые 10 лет), женский пол, предыдущие кровотечения, применение перкутанного коронарного вмешательства, почечная недостаточность, применение блокаторов гликопротеиновых рецепторов IIb/IIIa, гепарина, тромболитиков, диуретиков, внутривенное введение инотропных агентов.
Конечно, кровотечение значительно ухудшает прогноз для больных. Результаты метаанализов, регистров и исследований свидетельствуют, что массивные кровотечения в 4 раза повышают риск смерти, в 5 раз — риск развития повторного ИМ и в 3 раза — риск инсульта в первые 30 сут. По данным уже упоминавшегося OASIS-5, риск развития ишемических осложнений коррелировал с частотой кровотечений. Так, частота смерти составляла 12,9% против 2,8%, риск развития ИМ — 13,9% против 3,6%, риск инсульта — 3,6% против 0,8% у больных с кровотечениями по сравнению с неосложненным течением острого коронарного синдрома на протяжении 30 сут.
С учетом вышеизложенного при угрозе кровотечения рекомендуется:
- определение риска возможного возникновения кровотечения как важного и необходимого компонента лечения. Риск повышается при применении антитромботических препаратов в высоких или чрезмерных дозах, при длительном их использовании, комбинации нескольких антитромботических агентов, в преклонном возрасте, при наличии ренальной дисфункции, при недостаточной массе тела, у больных женского пола и при проведении перкутанного коронарного вмешательства (IB).
- принимать во внимание определенный риск развития кровотечения при планировании лечебной стратегии.
- учитывать, что небольшие кровотечения могут устраняться без прекращения основного лечения.
- учитывать, что гемотрансфузия может приводить к отрицательным последствиям, ее назначение следует определять индивидуально, не рекомендуется ее применение у гемодинамически стабильных пациентов с гематокритом >25% или уровнем гемоглобина >8 г/л (IG).
Реабилитация
Кроме модификации факторов риска и медикаментозной терапии, больные, перенесшие острый коронарный синдром без элевации сегмента ST, нуждаются в реабилитационных мероприятиях. Каждому больному следует проводить повторный тест с физической нагрузкой через 4–7 нед после выписки. С учетом результатов всех проведенных исследований пациента следует проинформировать о допустимых физических нагрузках, возможной интенсивности и виде работ, сексуальной активности.
В Украине действует система поэтапной реабилитации больных, перенесших острый коронарный синдром, включая острый коронарный синдром без элевации сегмента ST. Согласно этой системе работающие пациенты, независимо от возраста, после выписки из реабилитационного или кардиологического отделения должны быть направлены в реабилитационное отделение санатория соответствующей области. Основной критерий направления в санаторий — стабилизация состояния и возможность физической нагрузки, адекватной ходьбе на 1000 м без ангинозной боли и изменений на ЭКГ (подробно методики реабилитации на стационарном и санаторном этапах изложены в соответствующих рекомендациях).
СТРАТЕГИЯ ВЕДЕНИЯ ПАЦИЕНТА С ОСТРЫМ КОРОНАРНЫМ СИНДРОМОМ
В этом разделе обсуждается стратегия, приемлемая для большинства пациентов с подозрением на острый коронарный синдром. Следует признать, что специфические данные у отдельных пациентов могут обусловить необходимость отклонения от предложенной стратегии. В каждом случае врач должен принимать решение, учитывая особенности анамнеза, клинические проявления, данные, полученные во время наблюдения и обследования в клинике, доступное лечение. Эти рекомендации следует рассматривать как такие, которые подходят для большинства случаев, хотя у определенных пациентов и при особых условиях возможен выбор других путей.
Тактика ведения больных с острым коронарным синдромом без элевации ST представлена на схеме 2.1.
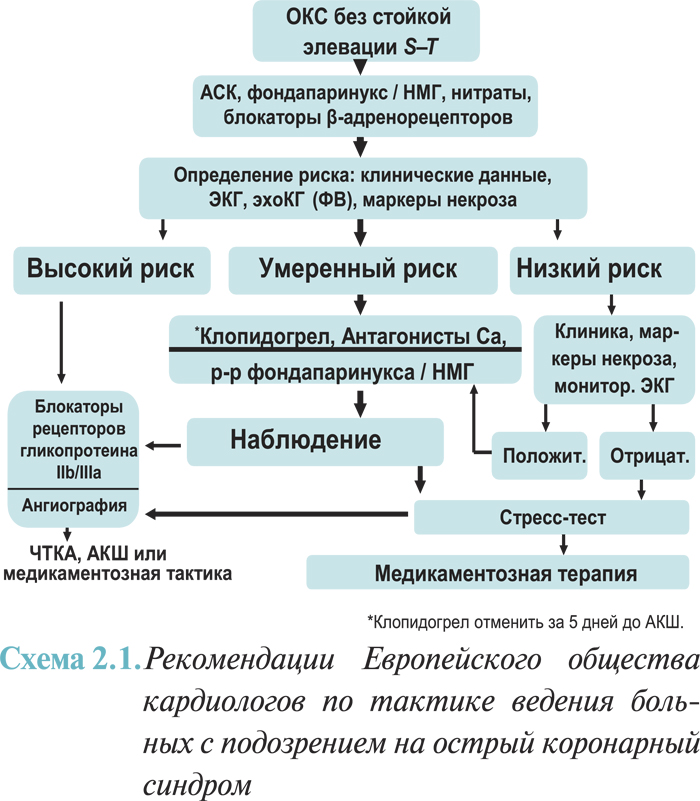
Необходимо отметить, что почти идентичный алгоритм лечения больных с острым коронарным синдромом без элевации сегмента ST принят в 2007 г. АНА (схема 2.2).

Первый шаг: оценка при поступлении
У большинства пациентов можно выявить лишь дискомфорт (боль) в грудной клетке, подозрение на острый коронарный синдром является предварительным диагнозом.
Начальное обследование включает:
- Детальный опрос и точное описание симптомов. Необходимо физикальное обследование с учетом возможного наличия заболевания клапанов сердца (аортальный стеноз), ГКМП, СН и заболевания легких.
- Определение вероятности ИБС (включая комплексный анализ возраста, факторов риска, предыдущих ИМ, АКШ, перкутанного коронарного вмешательства.
- Необходимо зарегистрировать ЭКГ. Сравнение с предыдущей ЭКГ, если такая имеется, очень полезно, в частности у пациентов с фоновой сердечной патологией, такой как ГЛЖ или ранее диагностированная ИБС.
- На основе этих данных, которые необходимо получить за 10 мин после первого общения с пациентом, больных подразделяют на три большие группы:
- ИМ, который нуждается в немедленной реперфузии;
- острый коронарный синдром без элевации сегмента ST;
- сомнительный острый коронарный синдром.
Лечение пациентов с ИМ описано в соответствующих рекомендациях. Сомнительный острый коронарный синдром следует устанавливать с осторожностью и после исключения всех возможных подобных состояний, включая травмы. Рекомендуется также регистрация правых грудных отведений ЭКГ.
Проведение в дополнение к вышесказанному анализов крови, которые должны быть получены в течение 60 мин (тропонин Т или I, МВ-фракция КФК, креатинин, гемоглобин и количество лейкоцитов), позволяет перейти ко второму шагу определения стратегии лечения больных, отнесенных в группу острого коронарного синдрома без элевации сегмента ST.
Второй шаг: уточнение диагноза и определение риска
В случаях острого коронарного синдрома без стойкой элевации сегмента ST (депрессия сегмента ST, отрицательные зубцы Т, псевдонормализация Т или нормальная картина ЭКГ) следует проводить начальное лечение согласно приведенному перечню (табл. 2.4).
Таблица 2.4
Начальное лечение при остром коронарном синдроме без стойкой элевации сегмента ST
| Кислород | Ингаляция (4–8 л/мин), если сатурация <90% |
| Нитраты | Сублингвальное или внутривенное применение (при САД не ниже 90 мм рт. ст.) |
| Ацетилсалициловая кислота | Стартовая доза 160–325 мг некишечно-растворимой формы с дальнейшим переходом на 75–150 мг/сут. Внутривенное введение может рассматриваться |
| Клопидогрел | Нагрузочная доза 300 мг (или 600 мг при быстром планировании инвазивного вмешательства) с последующим переходом на 75 мг/сут |
| Антикоагулянты | Выбор зависит от стратегии лечения: |
| Нефракционированный гепарин внутривенно болюсно 60–70 МЕ/кг массы тела (максимум — 5000 МЕ) с дальнейшей инфузией 12–15 МЕ/кг/ч (максимум — 1000 МЕ/ч) до повышения АЧТВ в 1,5–2,5 раза | |
| Фондапаринукс 2,5 мг/сут подкожно | |
| Эноксапарин 1 мг/кг 2 раза в сутки подкожно | |
| Дальтепарин 120 МЕ/кг 2 раза в сутки подкожно | |
| Надропарин 86 МЕ/кг 2 раза в сутки подкожно | |
| Бивалирудин 0,1 мг/кг болюсно с последующим введением 0,25 мг/кг/ч | |
| Морфин | 3–5 мг внутривенно или подкожно, в зависимости от интенсивности боли |
| Пероральные блокаторы β-адренорецепторов | Преимущественно при тахикардии или АГ при отсутствии признаков СН |
| Атропин | 0,5–1,0 мг внутривенно при брадикардии |
В течение этого шага другие диагнозы должны быть подтверждены или исключены, особенно острая анемия, эмболия ЛА, аортальная диссекция.
Определение риска
Определение риска развития коронарных событий в раннем и отсроченном (<6 мес) прогнозе рассматривалось в соответствующем разделе. Следует указать, что выбор стратегии лечения больных с острым коронарным синдромом без элевации сегмента ST должен базироваться на объединении оценки рисков как коронарных событий, так и возможных кровотечений, в том числе при проведении ангиографии (из места пункции артерии) и применении антитромботических мероприятий. Необходимо учитывать инструкции к соответствующим препаратам.
Третий шаг: инвазивная стратегия
Сердечная катетеризация рекомендуется как средство предотвращения осложнений заболевания и оценки отсроченного прогноза. Необходимость и срочность инвазивной стратегии устанавливают после определения риска и отнесения больных к одной из 3 групп: консервативной, ранней инвазивной или ургентной инвазивной.
Консервативная стратегия
Пациенты, которые целиком соответствуют нижеследующим критериям, относятся к группе низкого риска без необходимости применения ранней инвазивной стратегии:
- без повторной ангинозной боли;
- без симптомов СН;
- без патологических изменений на ЭКГ при поступлении или при повторной ее регистрации через 6–12 ч;
- без повышения уровня тропонина (исходного и через 6–12 ч).
Такие пациенты в дальнейшем могут проходить лечение как лица с хронической ИБС, перед выпиской проводят стресс-тест. Пациентов, не соответствующих всем приведенным критериям, следует направлять на катетеризацию.
Ургентная инвазивная стратегия
Эту стратегию необходимо применять у больных, которые находятся на ранней стадии миокардиального повреждение по данным ЭКГ или относятся к группе высокого риска кардиальных осложнений. Это пациенты:
- с рефрактерной ангинозной болью;
- повторяющейся болью с депрессией сегмента ST, несмотря на интенсивную антиангинальную терапию;
- с клиническими симптомами СН или гемодинамической нестабильности (в том числе шок);
- с угрожающей жизни аритмией (фибрилляция желудочков или желудочковая тахикардия).
Ранняя инвазивная стратегия
Значительная часть пациентов положительно отвечают на оптимальную медикаментозную терапию, но все же имеют повышенный риск и нуждаются в проведении ангиографии. Время ее проведения устанавливают с учетом имеющихся возможностей, но не позднее 72 ч от начала заболевания. Следующие критерии требуют проведения ранней ангиографии:
- повышенный уровень тропонина;
- динамика сегмента ST или зубца Т на ЭКГ (болевая или немая) >0,5 мм;
- наличие сахарного диабета;
- сниженная функция почек (гломерулярная фильтрация <60 мл/мин/1,73 м);
- снижение ФВ ЛЖ <40%;
- ранняя постинфарктная стенокардия;
- проведенное в течение предыдущих 6 мес перкутанное коронарное вмешательство;
- предыдущее АКШ;
- умеренный риск в соответствии с таблицей определения риска.
Блокаторы гликопротеиновых рецепторов IIb/IIIa (тирофибан, эптифибатид) необходимо добавлять к стандартной терапии перед проведением катетеризации в случаях повышенного уровня тропонина, динамики ST/T, сахарного диабета.
Четвертый шаг: определение методики реваскуляризации
Если на ангиограмах не выявлено критического повреждения коронарных сосудов, больному назначают медикаментозную терапию, одновременно уточняют диагноз «острый коронарный синдром». Конечно, отсутствие ангиографических признаков повреждения коронарных сосудов не может служить поводом для снятия диагноза «острый коронарный синдром» при наличии симптомов ишемии, подтвержденных биомаркерами. В этих случаях больные продолжают принимать лечение, определенное для острого коронарного синдрома без элевации сегмента ST. У пациентов с поражением одного сосуда показано перкутанное коронарное вмешательство со стентированием этой артерии. У пациентов со множественным поражением сосудов тактику реваскуляризации (перкутанного коронарного вмешательства или АКШ) следует определять индивидуально. Преимущественно проводят последовательное использование перкутанного коронарного вмешательства пораженной артерии, ответственной за острую ишемию, с последующим шунтированием.
Не рекомендуется менять антикоагулянты при проведении перкутанного коронарного вмешательства. Пациентам, принимавшим фондапаринукс, перед проведением перкутанного коронарного вмешательства может быть добавлен нефракционированный гепарин. Пациенты, получавшие тирофибан или эптифибатид, должны получать инфузии этих препаратов во время перкутанного коронарного вмешательства. Пациентам, не получавшим терапию блокаторами гликопротеиновых рецепторов IIb/IIIa, следует преимущественно назначать абциксимаб перед перкутанным коронарным вмешательством.
При планировании АКШ необходимо отменить клопидогрел и отложить операцию на 5 сут, если клиническая ситуация позволяет.
Пятый шаг: выписка и ведение больных после выписки
Хотя большинство кардиальных событий у больных с острым коронарным синдромом без элевации сегмента ST приходится на острый период, риск ИМ и смерти может возрастать в течение следующих месяцев, поэтому пациенты нуждаются в усиленном наблюдении. Конечно, проведение ранней реваскуляризации снижает риск аритмической смерти до 2,5% по сравнению с почти 80% в первые 12 ч, но прогрессирование атеросклеротического поражения при ненадлежащем медикаментозном лечении и наблюдении может приводить к повторным эпизодам острого коронарного синдрома. Необходима также интенсивная модификация факторов риска у всех пациентов.
В заключение еще раз подчеркиваем, что острый коронарный синдром без элевации сегмента ST часто дает худший прогноз, чем острый ИМ, и учитывая это требует такого же интенсивного лечения в острый период и наблюдения после выписки. Следует помнить, что подтвержденный острый коронарный синдром является наиболее надежной верификацией ИБС, что требует дальнейшего лечения согласно рекомендациям по лечению хронической ИБС как пациентов с наиболее высоким риском осложнений.
ЛИТЕРАТУРА
- Насонов Е.Л. (1999) Маркеры воспаления и атеросклероз: значение С-реактивного белка. Кардиология, 39: 81–85.
- ACSIS (2007) Eur. Heart J., 28 (Abstr. Suppl.): 835.
- Akkerhuis K.M., Klootwij k P.A., Lindeboom W. et al. (2001) Recurrent ischaemia during continuous multilead ST-segment monitoring identifies patients with acute coronary syndromes at high risk of adverse cardiac events; meta-analysis of three studies involving 995 patients. Eur. Heart J., 22: 1997–2006.
- American College of Cardiology 55th Annual Scientific Session, Presented by Anthony A., Bavry M.D., MPH, fellow in the Department of Medicine at the Cleveland Clinic Foundation in Ohio.
- Antithrombotic, Trialist, Collaboration (2002) Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ, 324: 71–86.
- Antman E.M., Cohen M., Radley D. et al. (1999) Assessment of the treatment effect of enoxaparin for unstable Angina/Non-Q-wave myocardial infarction: TIMI IIB-ESSENCE meta-analysis. Circulation, 100: 1602–1608.
- Antman E.M., McCabe C.H., Gurfinkel E.P. et al. (1999) Enoxaparin prevents death and cardiac ischemic events in unstable angina/non-Q-wave myocardial infarction. Results of the thrombolysis in myocardial infarction (TIMI) IIB trial. Circulation, 100: 1593-1601.
- Anzai T., Yoshikawa T., Shiraki H. et al. (1997) C-reactive protein as a predictor of infarct expansion and cardiac rapture after a first Q-wave acute myocardial infarction. Circulation, 96: 778-784.
- Ardissino D., Merlini P.A., Gamba G. et al. (1996) Thrombin activity and early outcome in unstable angina pectoris. Circulation, 93: 1634-1639.
- ARMYDA-ACS randomized trial (2007) Eur. Heart J., 28 (Abstr. Suppl.): 731.
- BARI investigators (1997) Five-year clinical and functional outcome comparing bypass surgery and angioplasty in patients with multivessel coronary disease. A multicenter randomized trial. Writing Group for the Bypass Angioplasty Revascularization Investigation (BARI) Investigators. JAMA, 277: 715-721.
- Bartnik M. (2004) The prevalence of abnormal glucose regulation in patients with coronary artery disease across Europe.The Euro Heart Survey on diabetes and the heart. Eur. Heart J., 25: 1880-1890.
- Becker R.C.C., Bovill E. et al. (1996) Prognostic value of plasma fibrinogen concentration in patients with unstable angina and non-Q-wave myocardial infarction (TIMI IIIB trial). Am. J. Cardiol., 78: 142-147.
- Bitti J.A. et al. (2001) Bivalirudin versus heparin during coronary angioplasty for unstable or postinfarction angina: final report reanalysis of the Bivalirudin Angioplasty Study. Am. Heart J., 142: 952-959.
- Braunwald E. (1989) Unstable angina. A classification. Circulation, 80: 410-414.
- Burke A.P., Tracy R.P., Kolodgie F. et al. (2002) Elevated C-reactive protein values and atherosclerosis in sudden coronary death. Association with different pathologies. Circulation, 105: 2019-2023.
- CABRI Investigators (1996) First-year results of CABRI (Coronary Angioplasty versus Bypass Revascularization Investigation. Circulation, 93: 847.
- Cairns J.A., Singer J., Gent M. et al. (1989) One year mortality outcomes of all coronary and intensive care unit patients with acute myocardial infarction, unstable angina or other chest pain in Hamilton, Ontario, a city of 375,000 people. Can. J. Cardiol., 5: 239-256.
- Campbell R.W.F., Turpie A.G.G., Maseri A. et al. (1998) Management strategies for a better outcome in unstable coronary artery disease. Clin. Cardiol., 21: 314-322.
- Cannon C.P., Weintraub W.S., Demopoulos LA. et al. (2001) Comparison of early invasive and conservative strategies in patients with unstable coronary syndromes treated with the glycoprotein Ilb/IIIa inhibitor tirofiban. N. Engl. J. Med., 344: 1879-1887.
- Davies E., Gawad Y., Takahashi M. et al. (1997) Analytical performance and clinical utility of a sensitive immunoassay for determination of human cardiac troponin I. Clin. Biochem., 30: 479-490.
- DePace N., Herling I.M., Kotler M.N. et al. (1982) Intravenous nitroglycerin for rest angina. Potential pathophysiologic mechanisms of action. Arch. Intern. Med., 142: 1806-1809.
- Eikelboom J.W., Anand S.S., Malmberg K. et al. (2000) Unfractionated heparin and low-molecular-weight heparin in acute coronary syndrome without ST elevation: a meta-analysis. Lancet; 355: 1936-1952.
- EPISTENT Investigators (1998) Randomised placebo-controlled and balloon-angioplasty-controlled trial to assess safety of coronary stenting with use of platelet glycoprotein Ilb/IIIa blockade. The EPISTENT Investigators. Evaluation of Platelet Ilb/IIIa Inhibitor for Stenting. Lancet, 352: 87-92.
- Ernofsson M., Strekerud F., Toss H. et al. (1998) Low-molecular weight heparin reduces the generation and activity of thrombin in unstable coronary artery disease. Thromb Haemost, 79: 491-501.
- Falk E., Shah P., Fuster V. (1995) Coronary plaque disruption. Circulation, 92: 657-671.
- Ferguson J.J. (2000) Combining low-molecular-weight heparin and glycoprotein Ilb/IIIa antagonists for the treatment of acute coronary syndromes: the NICE 3 story. National Investigators Collaborating on Enoxaparin. J. Invas. Cardiol., 12 (Suppl. E): E10-3; discussion E25-8.
- Fisch C. (1997) The clinical ECG; sensitivity and specificity. Elsevier.
- Fonarow G.C., Wright R.S., Spencer F.A. (2005) National Registry of Myocardial Infarction 4 Investigators. Effect of statin use within the first 24 hours of admission for acute myocardial infarction on early morbidity and mortality. Am. J. Cardiol., 96: 611-616.
- Fox K.A. (1999) Implications of the Organization to Assess Strategies for Ischemic Syndromes-2 (OASIS-2) study and the results in the context of other trials. Am. J. Cardiol., 84: 26M-31M.
- FRISC study group (1996) Low-molecular-weight heparin during instability in coronary artery disease, Fragmin during Instability in Coronary Artery Disease (FRISC) study group. Lancet, 347: 561-568.
- FRISCII investigators (1999) Invasive compared with non-invasive treatment in unstable coronary artery disease: FRISC II prospective randomised multicentre study. FRagmin and Fast Revascularisation during Instability in Coronary artery disease Investigators. Lancet, 354: 708-715.
- FTT Trialists (1994) Indications for fibrinolytic therapy in suspected acute myocardial infarction: collaborative overview of early mortality and major morbidity results from all randomised trials of more than 1000 patients. Fibrinolytic Therapy Trialists’ (FTT) Collaborative Group. Lancet, 343: 311-322.
- German MITRA PLUS (2007) Eur. Heart J., 28 (Abstr. Suppl.): 520.
- Gottsauner-Wolf M., Zasmeta G., Hornykewycz S. et al. (2000) Plasma levels of C-reacive protein after coronary stent implantation. Eur. Heart. J., 102: 2165-2168.
- Gusto IIB investigators (1996) A comparison of recombinant hirudin with heparin for the treatment of acute coronary syndromes. The Global Use of Strategies to Open Occluded Coronary Arteries (GUSTO) lib investigators. N. Engl. J. Med., 335: 775-782.
- Hamm C.W., Heeschen C., Goldmann B. et al. (1999) Benefit of abciximab in patients with refractory unstable angina in relation to serum troponin T levels. c7E3 Fab Antiplatelet Therapy in Unstable Refractory Angina (CAPTURE) Study Investigators. N. Engl. J. Med., 340: 1623-1629.
- Haverkate F., Thompson S.G., Pyke S.D.M. (1997) Production of C-reactive protein and risk of coronary events in stable and unstable angina. Lancet, 349: 462-466.
- Held P.Y.S., Furberg C.D. (1989) Calcium channel blockers in acute myocardial infarction and unstable angina: an overview. Br. Med. J., 299: 1187-1192.
- Kaplan K.D.R., Parker M., Przybylek J. et al. (1983) Intravenous nitroglycerin for the treatment of angina at rest unresponsive to standard nitrate therapy. Am. J. Cardiol., 51: 694-698.
- Karlsson J.E., Berglund U., Bjorkholm A. et al. (1992) Thrombolysis with recombinant human tissue-type plasminogen activator during instability in coronary artery disease: effect on myocardial ischemia and need for coronary revascularization. TRIG Study Group. Am. Heart J., 124: 1419-1426.
- Kataoka H., Kume N., Miyamoto S.et al. (2001) Oxidized LDL modilates Bax/ Bcl-2 through the lectinlike ox-LDL receptor-1 in vascular smooth muscle cells. Arterioscl. Thromb. Vasc. Biol., 21: 955-960.
- Katus H.A., Looser S., Hallermayer K. et al. (1992) Development and in vitro characterization of a new immunoassay of cardiac troponin T. Clin. Chem., 38: 386-393.
- Lagerqvist B. et al. (2006) 5-year outcomes in tye FRISC — II randomised trial of an invasive versus a nonivasive strategy in non-ST-elevation acute coronary syndrome: a follow-ap study. Lancet, 368: 998-1004.
- Leebeek F.W.G., Boersma E., Cannon C.P. et al. (2002) Oral glycoprotein Ilb/ IIIa receptor inhibitors in patients with cardiovascular disease: why were the results so unfavourable. Eur. Heart J., 23: 444-457.
- Lenderink T. et al. (2006) Eur. Heart J., 27(15): 1799-1804.
- Lindahl B. (1996) Biochemical markers of myocardial damage for early diagnosis and prognosis in patients with acute coronary syndromes. Minireview based on a doctorial thesis. Ups. J. Med. Sci, 101: 193-232.
- Lindemann S., Tolley N.D., Dixon D.A. et al. (2001) Activated platelets mediate inflammatory signaling by regulated interleukin 1 p synthesis. J. Cell. Biol., 154: 485-490.
- Lindmark E., Diderholm E., Wallentin L. et al. (2001) Relationship between interleukin 6 and mortality in patients with unstable coronary artery disease: effects of an early invasive or noninvasive strategy. JAMA, 286: 2107-2113.
- McGuire et al. (2000) Influence of diabetes mellitus on clinical outcomes across the spectrum of acute coronary syndromes. Findings from the GUSTO-IIb study. GUSTO-IIb investigators. Eur. Heart J., 21: 1750-1758.
- Mehta S. R. et al. (2005) Randomized, blinded trial comparing fondaparinucs with unfractionated heparin in patients undergoing contemporary percutaneous coronar intervention: Arixtra Study in Percutaneous Coronary intervention (ASPIRE) Pilot Trial. Csrculation, 111: 1390-1397.
- Mehta S.R et al. (2005) Routine vs selective invasive strategies in patients with acute coronary syndromes: a collaborative meta-analysis of randomised trials. JAMA, 293: 2908-2917.
- Miami Trial research group (1985) Metoprolol in myocardial infarction. Eur. Heart J., 6: 199-226.
- Morrow D.A., Rifai N., Antman E.M. et al. (2000) Serum amyloid A predicts early mortality in acute coronary syndromes: a substudy. JACC, 35: 358-362.
- Nyman I., Areskog M., Areskog N.H. et al. (1993) Very early risk stratification by electrocardiogram at rest in men with suspected unstable coronary heart disease. The RISC Study Group. J. Intern. Med., 234: 293-301.
- Nyman I., Wallentin L., Areskog M. et al. (1993) Risk stratification by early exercise testing after an episode of unstable coronary artery disease. The RISC Study Group. Int. J. Cardiol., 39: 131-142.
- Ojio S., Takatsu H., Tanaka T. et al. (2000) Considerable time from the onset of plaque rupture and/or thrombi until the onset of acute myocardial infarction in humans. Coronary angiographic findings within 1week before the onset of infarction. Circulation, 102: 2063-2069.
- Oler A., Whooley M.A., Oler J. et al. (1996) Adding heparin to aspirin reduces the incidence of myocardial infarction and death in patients with unstable angina. A meta-analysis. JAMA, 276: 811-815.
- Parodi O., Simonetti I., Michelassi C. (1986) Comparison of verapamil and propanolol therapy for angina pectoris at rest. A randomized, multiple crossover, controlled trial in the coronary care unit. Am. J. Cardiol., 57: 899-906.
- Patrono C. (1998) Pharmacology of antiplatelet agents. In: Loscalzo J, Schafer Al, editors. Thrombosis and Hemorrhage. Williama Wilkins, Baltimore, 1181-1192.
- Patrono C., Coller B., Dalen J.E. et al. (2001) Platelet-Active Drugs: The relationships among dose, effectiveness, and side effects. Chest., 119: 395-635.
- Patrono C., Patrignani P., Garcia Rodriguez L.A. (2001) Cyclooxygenase-selective inhibition of prostanoid formation: transducing biochemical selectivity into clinical read-outs. J. Clin. Invest., 108: 7-13.
- Ridker P.M., Rifai N., Clearfield M., et al. (2001) Measurement of C-reactive protein for the targeting of statin therapy in the primary prevention of acute coronary events. N. Engl. J. Med., 344: 1959-1965.
- Roffi M. et al. (2002) Early and sustained dual oral antiplatelet therapy following percutaneous coronary intervention: a randomized controlled trial. JAMA, 288: 2411-2420.
- Rosenson R.S., Lowe G.D.O. (1998) Effects of lipids and lipoproteins on thrombosis and rheology. Atherosclerosis, 140: 271-280.
- Roubin G.S.H.P., Eckhardt I. et al.(1982) Intravenous nitroglycerine in refractory unstable angina pectoris. Aust. N. Z. J. Med., 12: 598-602.
- Sabatine M.S. et al. (2005) Association of gemoglobin levels with clinical outcomes in acute coronary syndromes. Circulation, 111: 2042-2049.
- Sano T., Tanaka A., Namba N. et al. (2003) C-Reactive protein and lesion morphology in patients with acute myocardial infarction. Circulation.,108: 282-285.
- Savonitto S., Ardissino D., Granger C.B. et al. (1999) Prognostic value of the admission electrocardiogram in acute coronary syndromes. JAMA, 281: 707-713.
- Schreiber T.L., Macina G., Bunnell P. et al. (1990) Unstable angina or non-Q wave infarction despite long-term aspirin: response to thrombolytic therapy with implications on mechanisms. Am. Heart J., 120: 248-255.
- Schreiber T.L., Macina G., McNulty A. et al. (1989) Urokinase plus heparin versus aspirin in unstable angina and non-Q-wave myocardial infarction. Am. J. Cardiol., 64: 840.
- Schreiber T.L., Rizik D., White C. et al. (1992) Randomized trial of thrombolysis versus heparin in unstable angina. Circulation., 86: 1407-1414.
- Serruys P.W., Unger F., Sousa J.E. et al. (2001) Comparison of coronary-artery bypass surgery and stenting for the treatment of multivessel disease. N. Engl. J. Med., 344: 1117-1124.
- Serruys P.W., van Hout B., Bonnier H. et al. (1998) Randomised comparison of implantation of heparin-coated stents with balloon angioplasty in selected patients with coronary artery disease (Benestent II). Lancet, 352: 673-681.
- Stenestrand U., Wallentin L. (2002) Early revascularization and 1-year survival in 14-days survivors of acute myocardial infarction: a prospective cohort study. Lancet, 359: 1805-1811.
- Stone G.W. et al. (2006) Bivalirudin for patients with acute coronary syndromes. N. Engl. J. Med., 355: 2203-2216.
- The GUSTO Investogators (1993) An international randomized trial comparing four thrombolytic strategies for acute myocardial infarction. N. Engl. J. Med., 329: 673-628.
- The Task Force on the Use of Antiplatelet Agents in Patients with Atherosclerotic Cardiovascular Disease of the European Society of Cardiology (2004) Eur. Heart J., 25: 166-181.
- Theroux P., Ouimet H., McCans J. et al. (1988) Aspirin, heparin, or both to treat acute unstable angina. N. Engl. J. Med., 319: 1105-1111 .
- Theroux P., Taeymans Y., Morissette D. et al. (1985) A randomized study comparing propranolol and diltiazem in the treatment of unstable angina. J. Am. Coll. Cardiol., 5: 717-722.
- Theroux P., Waters D., Qiu S. et al. (1993) Aspirin versus heparin to prevent myocardial infarction during the acute phase of unstable angina. Circulation, 88: 2045-2048.
- TIMI IIIB investigators (1994) Effects of tissue plasminogen activator and a comparison of early invasive and conservative strategies in unstable angina and non-Q-wave myocardial infarction. Results of the TIMI IIIB Trial. Thrombolysis in Myocardial Ischemia. Circulation, 89: 1545-1556.
- Toschi V.G.R., Lettino M., Fallen J.T. (1997) Tissue factor predicts the thrombogenicity of human atherosclerotic components. Circulation, 95: 594-599.
- Toss H., Lindahl B., Siegbahn A. et al. (1997) Prognostic influence of increased fibrinogen and C-reactive protein levels in unstable coronary artery disease. FRISC Study Group. Fragmin during Instability in Coronary Artery Disease. Circulation, 96: 4204-4210.
- van Domburg R.T., van Miltenburg-van Zij l A.J., Veerhoek R.J. et al. (1998) Unstable angina: good long-term outcome after a complicated early course. J. Am. Coll Cardiol., 31: 1534-1539.
- van Miltenburg-van Zj l A.J., Simoons M.L., Veerhoek R.J. et al. (1995) Incidence and follow-up of Braunwald subgroups in unstable angina pectoris. J. Am. Coll. Cardiol., 25: 1286-1292.
- Virmani R., Kolodgie F.D., Burke A.P. et al. (2000) Lessons from sudden coronary death: a comprehensive morphological classification scheme for atherosclerotic lesions. Arterioscler. Thromb. Vase Biol., 20: 1262-1275.
- Wilcox I., Freedman S.B., Allman K.C. et al. (1991) Prognostic significance of a predischarge exercise test in risk stratification after unstable angina pectoris. J. Am. Coll. Cardiol., 18: 677-683.
- Wiviott S.D., Braunwald E., McCabe C.H. et al. (2007) Prasugrel vs clopigogrel in patients with acute coronary syndromes. N. Eng. J. Med., 357: 2001-2015.
- Yusuf S. et al. (2006) Efficacy and safety of fondaparinucs compared to enoxaparin in 20,078 patients with acute coronary syndromes without ST segment elevation. The OASIS (Organization to Acute ischemic Syndromes)-5 investigators. N. Engl. J. Med., 354: 1464-1476.
- Yusuf S., Wittes J., Friedman L. (1988) Overview of results of randomized clinical trials in heart disease. II. Unstable angina, heart failure, primary prevention with aspirin, and risk factor modification. JAMA, 260: 2259-2263.
- Yusuf S., Zhao F., Mehta S.R. et al. (2001) Effects of clopidogrel in addition to aspirin in patients with acute coronary syndromes without ST-segment elevation. N. Engl. J. Med., 345: 494-502.
- Yusuf S., Zucker D., Chalmers T.C. (1994) Ten-year results of the randomized control trials of coronary artery bypass graft surgery: tabular data compiled by the collaborative effort of the original trial investigators. Part 1 of 2. Online. J. Curr. Clin. Trials., Doc. No. 145.