ВВЕДЕНИЕ
Современный арсенал лекарственных средств для лечения пациентов с сердечно-сосудистыми заболеваниями чрезвычайно обширен, он включает около 20 основных фармакологических групп, насчитывающих сотни препаратов с различными механизмами действия.
Классификация сердечно-сосудистых лекарственных средств (Чазов Е.И., Беленков Ю.Н., 2004):
- Блокаторы β-адренорецепторов
- Антагонисты кальция (блокаторы кальциевых каналов)
- Ингибиторы АПФ
- Блокаторы рецепторов ангиотензина II
- Антигипертензивные средства центрального действия
- агонисты центральных α2-рецепторов
- агонисты имидазолиновых I1-рецепторов
- Вазодилататоры прямого действия (миотропные)
- Блокаторы α-адренорецепторов
- Ганглиоблокаторы
- Диуретики
- петлевые (мощные) диуретики
- тиазидные и тиазидоподобные диуретики
- ингибиторы карбоангидразы
- калийсберегающие диуретики
- антагонисты альдостероновых рецепторов
- Нитраты
- Сердечные гликозиды
- Адреномиметики
- Антиаритмические лекарственные средства
Средства, влияющие на свертывание крови и функцию тромбоцитов:
- Антикоагулянты прямого действия
- нефракционированный (стандартный) гепарин
- низкомолекулярный (фракционированный) гепарин
- фондапаринукс натрия
- ингибиторы тромбина прямого действия
- Антикоагулянты непрямого действия
- Антиагреганты
- кислота ацетилсалициловая
- производные тиенопиридина
- блокаторы гликопротеиновых IIв/IIIа рецепторов тромбоцитов
- Фибринолитики
- Гиполипидемические лекарственные средства
- ингибиторы ГМГ-КоА-редуктазы (статины)
- производные фиброевой кислоты (фибраты)
- никотиновая кислота и ее производные
- НПВП
- Наркотические анальгетики
- Флеботонизирующие лекарственные средства
В связи с тем, что в Украине с 2000 г. в соответствии с международными требованиями принята классификация лекарственных средств, рекомендованная ВОЗ (1999), — анатомо-терапевтическая классификация — Anatomical Therapeutic Chemical (АТС) classification system, — то в современной практике используются номенклатура и терминология, принятые АТС. В связи с этим мы приводим классификацию кардиоваскулярных лекарственных средств, соответствующую требованиям ВОЗ (табл. 1.1).
Таблица 1.1. Классификация лекарственных средств, влияющих на сердечно-сосудистую систему (АТС, WHO, 2007)
| С01 | Кардиологические препараты |
| С01А | Сердечные гликозиды |
| С01АА | Гликозиды наперстянки |
| С01АВ | Гликозиды морского лука (Scilla maritima) |
| С01АС | Гликозиды строфанта |
| С01АХ | Прочие сердечные гликозиды |
| С01В | Антиаритмические средства I и III класса |
| С01ВА | Антиаритмические препараты Iа класса |
| С01ВВ | Антиаритмические препараты Ib класса |
| С01ВС | Антиаритмические препараты Iс класса |
| С01ВD | Антиаритмические препараты III класса |
| C01BG | Прочие антиаритмические препараты I класса |
| C01C | Негликозидные кардиотонические средства |
| С01СА | Адренергические и допаминергические препараты |
| C01CE | Ингибиторы ФДЭ |
| С01СХ | Прочие кардиотонические средства |
| С01D | Вазодилататоры, применяемые в кардиологии |
| С01DA | Органические нитраты |
| C01DB | Вазодилататоры хинолоновой структуры |
| C01DX | Прочие вазодилататоры, применяемые в кардиологии |
| C01E | Прочие кардиологические препараты |
| С01EA | Простагландины |
| C01EB | Прочие кардиологические препараты |
| C01EX | Различные комбинированные кардиологические препараты |
| С02 | Гипотензивные лекарственные средства |
| С02А | Антиадренергические средства с центральным механизмом действия |
| С02АА | Алкалоиды раувольфии |
| С02АВ | Метилдопа |
| С02АС | Агонисты имидазолиновых рецепторов |
| С02В | Антиадренергические средства, ганглиоблокаторы |
| С02ВА | Производные сульфония |
| С02ВВ | Вторичные и третичные амины |
| С02ВС | Соединения бис-четвертичного аммония |
| С02С | Антиадренергические средства с периферическим механизмом действия |
| С02СА | Блокаторы α-адренорецепторов |
| С02СС | Производные гуанидина |
| C02D | Средства, влияющие на тонус гладких мышц артериол |
| C02DA | Тиазидные производные |
| C02DB | Производные гидразинофталазина |
| C02DС | Производные пиримидина |
| C02DD | Производные нитроферрицианида |
| C02DG | Производные гуанидина |
| С02К | Прочие гипотензивные средства |
| С02КА | Алкалоиды, за исключением алкалоидов раувольфии |
| С02КВ | Ингибиторы тирозингидроксилазы |
| С02КC | Ингибиторы МАО |
| С02КD | Антагонисты серотонина |
| С02КX | Прочие гипотензивные средства |
| С02L | Комбинации гипотензивных и диуретических средств |
| С02LA | Комбинированные препараты, содержащие алкалоиды раувольфии и диуретики |
| С02LB | Комбинированные препараты, содержащие метилдопу и диуретики |
| С02LC | Комбинированные препараты, содержащие агонисты имидазолиновых рецепторов и диуретики |
| С02LE | Комбинированные препараты, содержащие блокаторы α-адренорецепторов и диуретики |
| С02LF | Комбинированные препараты, содержащие производные гуанетидина и диуретики |
| С02LG | Производные гидразинофталазина в комбинации с диуретиками |
| С02LK | Алкалоиды (за исключением алкалоидов раувольфии) в комбинации с диуретиками |
| С02LL | Ингибиторы МАО в комбинации с диуретиками |
| С02LN | Антагонисты серотонина в комбинации с диуретиками |
| С02LX | Прочие гипотензивные препараты в комбинации с диуретиками |
| C02N | Комбинации гипотензивных препаратов в АТС-ГР. С02 |
| C03 | Мочегонные препараты |
| С03А | Мочегонные препараты с умеренно выраженной активностью, группа тиазидов |
| С03АА | Простые тиазидные диуретики |
| С03АВ | Комбинации тиазидных диуретиков и препаратов калия |
| С03АН | Комбинации тиазидных диуретиков с психолептиками и/или анальгетиками |
| С03АХ | Тиазидные диуретики в комбинации с прочими лекарственными средствами |
| С03В | Нетиазидные диуретики с умеренно выраженной активностью |
| С03ВА | Cульфамиды, простые препараты |
| С03ВВ | Сульфамиды в комбинации с препаратами калия |
| С03ВC | Ртутные диуретики |
| С03ВD | Производные ксантина |
| С03ВK | Сульфамиды в комбинации с прочими препаратами |
| С03ВX | Прочие нетиазидные диуретики с умеренно выраженной активностью |
| С03С | Высокоактивные диуретики |
| С03СA | Простые препараты сульфамидов |
| С03СB | Сульфамиды в комбинации с препаратами калия |
| С03СC | Производные арилоксиуксусной кислоты |
| С03СD | Производные пиразолона |
| С03СX | Прочие высокоактивные диуретики |
| С03D | Калийсберегающие диуретики |
| С03DА | Антагонисты альдостерона |
| С03DВ | Прочие калийсберегающие диуретики |
| С03Е | Комбинации диуретиков, включающие калийсберегающие препараты |
| С03ЕA | Диуретики с умеренно выраженной активностью в комбинации с калийсберегающими средствами |
| С03ЕB | Высокоактивные диуретики в комбинации с калийсберегающими средствами |
| С04 | Периферические вазодилататоры |
| С04А | Периферические вазодилататоры |
| С04АA | Производные 2-амино-1-фенилэтанола |
| С04АB | Производные имидазолина |
| С04АC | Никотиновая кислота и ее производные |
| С04АD | Производные пурина |
| С04АE | Алкалоиды спорыньи |
| С04АF | Ферменты |
| С04АX | Прочие периферические вазодилататоры |
| С05 | Ангиопротекторы |
| С05А | Средства для лечения геморроя и анальных трещин для местного применения |
| С05АА | Кортикостероиды |
| С05АВ | Антибиотики |
| С05АD | Местноанестезирующие средства |
| С05АE | Миорелаксанты |
| С05АX | Прочие средства для лечения геморроя и анальных трещин для местного применения |
| С05В | Средства, применяемые при варикозном расширении вен |
| С05ВА | Гепарин или гепариноиды для местного применения |
| С05ВВ | Склерозирующие препараты для локального введения |
| С05ВХ | Прочие склерозирующие препараты |
| С05С | Капилляростабилизирующие средства |
| С05СА | Биофлавоноиды |
| С05СХ | Прочие капилляростабилизирующие средства |
| С07 | Блокаторы β-адренорецепторов |
| С07А | Блокаторы β-адренорецепторов |
| С07АА | Неселективные блокаторы β-адренорецепторов |
| С07АВ | Селективные блокаторы β-адренорецепторов |
| С07АG | Сочетанные блокаторы α- и β-адренорецепторов |
| С07В | Блокаторы β-адренорецепторов в комбинации с тиазидными диуретиками |
| С07ВA | Неселективные блокаторы β-адренорецепторов с тиазидными диуретиками |
| С07ВB | Селективные блокаторы β-адренорецепторов с тиазидными диуретиками |
| С07ВG | Сочетанные блокаторы α- и β-адренорецепторов с тиазидными диуретиками |
| С07С | Блокаторы β-адренорецепторов в комбинации с прочими диуретиками |
| С07СA | Неселективные блокаторы β-адренорецепторов с прочими диуретиками |
| С07СB | Селективные блокаторы β-адренорецепторов в комбинации с прочими диуретиками |
| С07СG | Сочетанные блокаторы α- и β-адренорецепторов в комбинации с прочими диуретиками |
| С07D | Блокаторы β-адренорецепторов в комбинации с тиазидными и прочими диуретиками |
| С07DА | Неселективные блокаторы β-адренорецепторов, тиазидные и прочие диуретики |
| С07DВ | Селективные блокаторы β-адренорецепторов, тиазидные и прочие диуретики |
| С07Е | Блокаторы β-адренорецепторов в комбинации с вазодилататорами |
| С07ЕА | Неселективные блокаторы β-адренорецепторов и вазодилататоры |
| С07ЕВ | Селективные блокаторы β-адренорецепторов и вазодилататоры |
| С07F | Блокаторы β-адренорецепторов в комбинации с прочими гипотензивными препаратами |
| С07FА | Неселективные блокаторы β-адренорецепторов с прочими гипотензивными препаратами |
| С07FВ | Cелективные блокаторы β-адренорецепторов с прочими гипотензивными препаратами |
| С08 | Антагонисты кальция |
| С08С | Селективные антагонисты кальция с преимущественным действием на сосуды |
| С08СА | Производные дигидропиридина |
| C08CX | Прочие селективные антагонисты кальция с преимущественным действием на сосуды |
| С08D | Селективные антагонисты кальция с преимущественным действием на сердце |
| C08DА | Производные фенилалкиламина |
| C08DB | Производные бензотиазепина |
| С08Е | Неселективные антагонисты кальция |
| С08ЕА | Производные фенилалкиламина |
| С08ЕХ | Прочие неселективные блокаторы кальциевых каналов |
| C08G | Антагонисты кальция в комбинации с диуретиками |
| C08GA | Антагонисты кальция и диуретики |
| С09 | Средства, действующие на РАС |
| С09А | Ингибиторы АПФ |
| С09АА | Ингибиторы АПФ монокомпонентные |
| С09В | Комбинированные препараты ингибиторов АПФ |
| С09ВА | Ингибиторы АПФ и диуретики |
| С09ВВ | Ингибиторы АПФ и антагонисты кальция |
| С09С | Монопрепараты антагонистов ангиотензина II |
| C09CA | Простые препараты антагонистов ангиотензина II |
| С09D | Комбинированные препараты ингибиторов ангиотензина II |
| С09DA | Антагонисты ангиотензина II и диуретики |
| С09DB | Антагонисты ангиотензина II и блокаторы кальциевых каналов |
| C09Х | Прочие средства, действующие на РААС |
| С09ХА | Ингибиторы ренина |
| С10 | Гиполипидемические лекарственные средства |
| С10А | Гиполипидемические препараты, монокомпонентные |
| С10АA | Ингибиторы ГМГ-КоА-редуктазы |
| С10АB | Фибраты |
| С10АC | Секвестранты желчных кислот |
| С10АD | Никотиновая кислота и ее производные |
| С10АX | Прочие гиполипидемические препараты |
| C10B | Гиполипидемические средства, комбинации |
| C10BA | Ингибиторы ГМГ-КоА-редуктазы в комбинации с прочими гиполипидемическими |
| C10BX | Ингибиторы ГМГ-КоА-редуктазы, прочие комбинации |
| В01 | Антитромботические средства |
| В01А | Антитромботические средства |
| В01АА | Антагонисты витамина К |
| В01АB | Группа гепарина |
| В01АC | Антиагреганты |
| В01АD | Ферменты |
| В01АE | Прямые ингибиторы тромбина |
| В01АX | Прочие антитромботические средства |
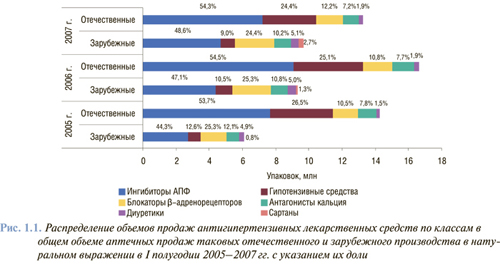
В Украине в настоящее время разрешено для медицинского применения свыше 700 наименований из вышеуказанных лекарственных средств, их потребление и арсенал постоянно расширяются. Только для лечения АГ, согласно информации «Фармстандарт» компании «Морион», а также исследований «PromotestSM» компании «Medical Data Management Ukraine» и проекта «PrIndex» компании «КОМКОН-Фарма Украина», в I полугодии 2007 г. в Украине продано через аптечную сеть антигипертензивных препаратов на сумму более 0,25 млрд грн., то есть выше на 14,9% по сравнению с аналогичным периодом 2006 г. В структуре потребления наиболее объемным кластером являются ингибиторы АПФ (50,9% объема продаж) (рис. 1.1).
Все это требует от врача-кардиолога глубоких и разносторонних знаний в области клинической фармакологии* как фундаментальной основы, в соответствии с позициями доказательной медицины, рациональной фармакотерапии.
В настоящее время в клинической фармакологии появились подходы, которые помогают улучшить качество жизни больных с различными, в том числе и тяжелыми, кардиоваскулярными заболеваниями.
Фармацевтам вместе с производителями лекарственных средств удалось достичь высокой степени безопасности новых препаратов при длительном применении относительно риска развития онкологических заболеваний, сахарного диабета, сосудистых поражений головного мозга и др. Геномные технологии создают перспективу создания новых поколений лекарственных средств, призванных решать проблему неизлечимых на сегодня заболеваний, например кардиомиопатии.
Подобные успехи клинической фармакологии обусловлены развитием фармакоэпидемиологии, доказательной медицины, фармакогенетики.
За последнее десятилетие разработаны технологии для решения современных проблем медицины. Так, оценку эффективности лечения стали проверять по так называемым конечным твердым точкам (для сердечно-сосудистых заболеваний это ИМ, ишемический инсульт, смертность в результате сердечно-сосудистых заболеваний и т.д.). Подобный подход позволяет решать фундаментальные проблемы заболеваемости и снижения смертности, особенно относительно лекарственных средств, исследуемых во многолетних исследованиях по оценке эффективности и безопасности, на выходе которых можно будет получить инструменты для достижения целевых уровней АД, ХС, функции внешнего дыхания и т.д.
Применение точных биохимических лабораторных маркеров безопасности лекарственных средств повысили достоверность доклинических и клинических исследований. Сейчас появился целый ряд новых разработок, позволяющих решить вопрос безопасности применения лекарственных средств у пациентов с сердечно-сосудистыми заболеваниями. Кроме того, в настоящее время составной частью рандомизированных клинических исследований является фармакоэкономическая приемлемость новых препаратов и технологий.
В последние годы для лечения целого ряда кардиоваскулярных заболеваний (хроническая СН, АГ, острый ИМ, стенокардия, нарушение ритма сердца) применяют целый ряд лекарственных средств, эффективных с позиций доказательной медицины (ингибиторы АПФ, блокаторы β-адренорецепторов, антагонисты кальция (особенно длительно действующие), гиполипидемические препараты — статины, антиагрегантные препараты). Для многих групп указанных лекарственных средств подтвержден высокий уровень доказательности, то есть высокий уровень достоверности данных, полученных в ходе крупных рандомизированных клинических исследований. В связи с этим, ряду основных клинико-фармакологических особенностей кардиоваскулярных лекарственных средств посвящен данный раздел настоящего руководства.
Лекарственное вещество
Лекарственное вещество является действующим началом лекарственного средства.
Лекарственные вещества получают химическим синтезом из лекарственного сырья путем его специальной обработки, а также биотехнологическими методами, включая генную и клеточную инженерию.
Лекарственное средство
В соответствии с законом Украины «О лекарственных средствах» (1996) под лекарственными средствами подразумевают «вещества или их смеси естественного, синтетического или биотехнологического происхождения, применяемые для предотвращения беременности, профилактики, диагностики и лечения пациентов или изменения состояния и функции организма».
Лекарственным средством в фармакологии называют лекарственное вещество в определенной лекарственной форме.
Наряду с лекарственными веществами, в состав лекарств входят вспомогательные вещества, необходимые для приготовления лекарственных средств в готовой лекарственной форме.
Словосочетание «лекарственное средство» имеет ряд равноценных синонимов: лекарство, лекарственный препарат, лечебное средство, медицинский препарат, однако термин «лекарственный препарат» чаще используют для обозначения лекарственного средства, когда это касается индивидуального химического вещества или его лекарственной формы.
Если лекарственное средство состоит из одного лекарственного вещества, эти понятия совпадают.
Для того чтобы лекарственное вещество начало оказывать действие на организм, необходимо его поступление (всасывание), которое определяется лекарственной формой (схема 1.1) и путем введения (схема 1.2).
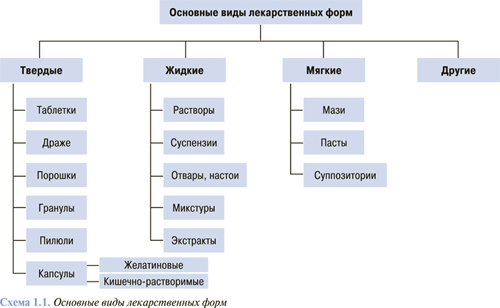

Основные виды лекарственных форм
Все лекарственные средства производятся и выпускаются на фармацевтический рынок в определенной лекарственной форме — то есть форме, придаваемой лекарственному веществу (-ам) в удобном для практического применения состоянии, при котором достигается необходимый лечебный или профилактический эффект.
Лекарственная форма — способ выпуска лекарственного средства. В лекарственные средства входят дополнительные вещества (целлюлоза, крахмал, тальк, сахар, мука и др.), которые изменяют вкус, цвет или количество препарата. Суточная дозировка лекарственного вещества обычно измеряется в миллиграммах — такое количество лекарственного вещества представляет собой лишь несколько мелких крупинок, едва видимых глазом. Чтобы облегчить прием заданного количества лекарственного вещества, в него добавляют балластные вещества, увеличивающие объем лекарственной формы до размеров, хорошо видимых невооруженным глазом. Кроме того, они могут влиять на сохранность лекарственного вещества, на скорость его высвобождения из лекарственной формы, что в большинстве случаев позволяет пациенту самостоятельно принимать лекарственные препараты (схема 1.3).

Лекарственные формы в зависимости от консистенции делятся на жидкие (растворы, настои, отвары, настойки, экстракты, слизи, микстуры, линименты), мягкие (мази, пасты, пластыри) и твердые (таблетки, драже, порошки). Одно и то же лекарственное средство может быть назначено в различных лекарственных формах (в растворе, мази, таблетках и др.).
Все пути введения лекарственных средств имеют свои преимущества и недостатки (табл. 1.2–1.5, см. схема 1.2).
Таблица 1.2. Преимущества и недостатки перорального применения лекарственных препаратов
| Преимущества | Недостатки |
| Удобство применения | Медленное развитие терапевтического эффекта |
| Возможность самостоятельного применения препаратов пациентами | Индивидуальная вариабельность терапевтических эффектов |
| Возможность раздражения слизистой оболочки ЖКТ |
Таблица 1.3. Преимущества и недостатки энтерального пути введения лекарственных средств
| Преимущества | Недостатки |
| Комфортность для больного | Вариабельность терапевтических эффектов |
| Не требуется участия медицинского персонала | Невозможность введения лекарственных веществ, разрушающихся в ЖКТ или обладающих сильным раздражающим действием |
| Возможность длительной терапии | Ограниченная возможность применения препаратов при рвоте, поносе, бессознательном состоянии пациента |
Таблица 1.4. Преимущества и недостатки внутримышечного введения лекарственных препаратов
| Преимущества | Недостатки |
| Быстрое достижение максимальной концентрации в плазме крови и быстрое развитие терапевтического эффекта | Болезненность |
| Возможность применения препаратов, разрушающихся при других путях введения | Возможность повреждения сосудов или нервов |
| Зависимость скорости всасывания от капиллярного кровотока | |
| Необходимость участия медицинского персонала |
Таблица 1.5. Преимущества и недостатки подкожного пути введения лекарственных препаратов
| Преимущества | Недостатки |
| Медленное всасывание | Болезненность |
| Достижение концентрации препарата в плазме крови, близкой к стандартной, что обеспечивает стабильный терапевтический эффект | Зависимость скорости всасывания от местного кровотока |
| Возможность применения препаратов, разрушающихся при других путях введения | Неэффективность при серьезных нарушениях местного кровообращения, например при шоке |
| Возможность развития воспаления, гематомы в месте введения | |
| Необходимость участия медицинского персонала |
Сублингвальное (под язык) и суббукальное (защечное) введение лекарственных веществ основано на том, что слизистая оболочка ротовой полости имеет обильное кровоснабжение, особенно области языка и его корня. Такое введение лекарственных средств обычно обеспечивает их быстрое поступление в системный кровоток, минуя печень, с высокой степенью биодоступности и соответственно быстрое развитие терапевтических эффектов. Например, при сублингвальном введении нитратов их максимальная концентрация в крови достигает в течение 1–2 мин. При сублингвальном применении пропранолола его биодоступность в 3 раза выше, чем при пероральном. Сублингвально вводят нифедипин, клонидин для купирования гипертонического криза, глицин — для нормализации мозгового кровотока. Большинство гомеопатических средств применяют сублингвально или суббукально.
Основные препараты для сублингвального и суббукального применения указаны в табл. 1.6. Как следует из табл. 1.7, эти препараты относятся к разным фармакологическим группам и имеют различные спектры терапевтического действия.
Таблица 1.6. Основные препараты системного действия для сублингвального и суббукального применения
| Препарат | Основные показания к применению |
| Сублингвальные препараты | |
| Биклотимол | Инфекционно-воспалительное заболевание слизистой оболочки рта |
| Глицин | Нарушение кровообращения головного мозга, стресс |
| Клонидин | Гипертонический криз |
| Молсидомин | Приступ стенокардии |
| Нитроглицерин | Приступ стенокардии |
| Нифедипин | Гипертонический криз |
| Суббукальные препараты | |
| Нитроглицерин | Приступ стенокардии |
Таблица 1.7. Примеры некоторых лекарственных препаратов с широким и узким терапевтическим диапазоном
| Широкий терапевтический диапазон | Узкий терапевтический диапазон |
| Антациды | Антиаритмические средства (в том числе хинидин, прокаинамид, дигоксин) |
| Большинство антибиотиков | Антикоагулянты и другие препараты, влияющие на свертываемость крови (в том числе ацетилсалициловая кислота) |
| Гепатопротекторы | Аминогликозидные антибиотики |
| Гидрофильные сердечные гликозиды | Гормоны и их синтетические аналоги |
| Дерматологические средства | Иммуномодуляторы, иммуносупрессанты |
| Диуретики | Противосудорожные препараты (фенитоин) |
| Местные анестетики | Регуляторы аппетита |
| Большинство | Средства для наркоза |
| НПВП | Сердечные гликозиды |
| Обволакивающие препараты | Нейролептические препараты |
| Регуляторы моторики кишечника | Стимуляторы дыхания |
| Слабительные, препараты для лечения диареи | Сурфактанты |
| Цитостатические препараты |
При сублингвальном или суббукальном введении лекарственных средств важно равномерно и полностью рассасывать соответствующую лекарственную форму, иначе уменьшается поступление лекарственного вещества в кровь и снижается эффективность терапии.
Недостатки сублингвального и суббукального путей введения лекарственного вещества
К сожалению, не все препараты для энтерального введения всасываются в ротовой полости. Обычно при сублингвальном введении в системный кровоток поступают неорганические соли, моносахара, аминокислоты и другие низкомолекулярные органические соединения.
Сублингвальный и суббукальный пути введения имеют ограничения при наличии любых воспалительных заболеваний полости рта. Кроме того, при длительном применении некоторые препараты могут сами индуцировать раздражение слизистой оболочки ротовой полости.
ДОЗИРОВАНИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ. ФАРМАКОКИНЕТИКА И ФАРМАКОДИНАМИКА ЛЕКАРСТВЕННЫХ СРЕДСТВ
Форма выпуска лекарственного вещества во многом определяет его путь введения в организм. После поступления лекарственного вещества в организм одновременно начинаются два процесса:
- Изменение концентрации лекарственного вещества во времени. Эти процессы количественно описывает фармакокинетика.
- Взаимодействие лекарственного вещества с молекулярными мишенями действия в органах и тканях организма, определяющие терапевтический эффект и побочные реакции лекарственного средства. Эти вопросы изучает фармакодинамика.
Соотношение между фармакокинетикой и фармакодинамикой схематично представлено на cхеме 1.4. Оба эти процесса играют важную роль в механизмах действия лекарственных веществ, без них развитие терапевтического эффекта невозможно. В реальных условиях четкой грани между фармакокинетическими и фармакодинамическими процессами нет. Нарушение любой составляющей приводит к изменению концентрации лекарственного вещества в месте действия и соответственно — к снижению эффективности терапии или повышению вероятности развития побочных реакций.
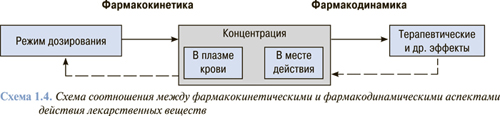
Концентрация лекарственного вещества в плазме крови и месте действия, а также развитие терапевтических эффектов и побочных реакций определяется режимом дозирования лекарственного вещества.
Доза — количество лекарственного вещества на прием. Выделяют разовую, суточную и курсовые дозы. В разовых дозах обычно назначают препараты для экстренного вмешательства в жизнедеятельность организма. Действие этих лекарственных средств обычно проявляется достаточно быстро. В суточных дозах обычно назначают препараты, обладающие кумулятивным (накопительным) эффектом. При этом суточная доза может быть разделена на несколько приемов. В курсовых дозах обычно назначают препараты с отсроченным терапевтическим эффектом. Для некоторых препаратов такого типа эмпирически подобраны схемы введения, определяющие то количество лекарственного вещества, которое необходимо ввести в тот или иной день проводимой терапии.
Для определения доз лекарственных средств и оценки их безопасности обычно используют экспериментальный метод. С его помощью на подопытных животных в экспериментальной практике определяют эффективную, токсическую и летальную дозы.
Под эффективной понимают дозу, вызывающую определенный фармакологический эффект, например гипотензивный, противовоспалительный. Токсическая — это доза, приводящая к развитию токсических осложнений. Летальная — доза, приводящая к гибели подопытных животных. Эти дозы принято обозначать как ED (effective dose), TD (toxic dose) и LD (lethal dose).
Чаще всего определяют ED1, ED50, ED99, TD1, TD50, TD99, LD1, LD50, и LD99, то есть дозы, обусловившие эффект (например гибель) у 1; 50 и 99% исследуемых животных. Так, ED1 характеризует минимальную дозу, способную оказать фармакологический эффект, ED50 — дозу, вызывающую эффект у половины исследованных животных, ED99 — дозу, вызывающую эффект практически у всех животных.
Следует отметить, что для одного и того же лекарственного вещества эффективная доза может отличаться в зависимости от того, какой эффект является желательным. Так, для взрослого человека эффективная доза ацетилсалициловой кислоты в качестве антитромботического средства составляет 0,075–0,5 г/сут, в качестве противоревматичекого средства — 3 г/сут.
Отметим, что LD определяется только на животных. Для человека определены значения ED и для ряда лекарственных веществ — значения TD. Чем больше интервал между ED50 и TD50, тем более безопасным является его применение:
- Если ED99<TD1, то в терапевтических дозах препарат токсических эффектов не вызывает;
- Если ED1≤TD1, то даже в минимальной дозе применение препарата сопряжено с развитием токсических осложнений;
- Если ED1>ТD1, то препарат токсичен.
Так, относительно безопасным считается применение НПВП, диуретиков, сердечных гликозидов и др. Применение противоопухолевых препаратов, нейролептиков и других практически всегда сопряжено с риском развития токсических осложнений (см. табл. 1.7).
Эксперименты на животных не позволяют выявить все возможные терапевтические и побочные реакции. Особенно это касается кумулятивных эффектов и эффектов пролонгированного применения препаратов. В этих условиях также трудно определить реальное тератогенное и мутагенное действие. Поэтому после испытания новых лекарственных веществ на животных их исследуют на людях — и лишь затем разрешают для применения.
При изучении действия лекарственных препаратов на здоровых добровольцах определяют минимальную терапевтическую и минимальную токсическую дозы. Минимальная терапевтическая доза (аналог ED1) определяется минимальным количеством лекарственного вещества, которое необходимо ввести для получения терапевтического эффекта. Минимальная токсическая доза (аналог ТD1) определяется минимальным количеством лекарственного вещества, при котором начинается развитие нежелательных, побочных или токсических явлений. Диапазон между минимальной токсической и терапевтической дозой называется терапевтическим диапазоном. Чем шире терапевтический диапазон, тем меньше вероятности возникновения осложнений при применении данного лекарственного вещества. Минимальная терапевтическая и минимальная токсическая доза лекарственного вещества во многом определяется путем введения лекарственного вещества в организм. Поэтому оптимизация фармакологической терапии может быть сведена к поддержанию концентрации лекарственного вещества в заданной ткани в пределах терапевтического диапазона. Это позволит достигнуть лечебного эффекта без развития побочного действия. Поскольку в большинстве случаев выявить концентрацию лекарственного вещества в месте его действия (в точке приложения) не представляется возможным, чаще всего на практике определяют концентрацию в плазме крови, поскольку именно концентрация лекарственного вещества в плазме крови определяет его системное действие: поступление в органы мишени и развитие побочных реакций. Поэтому оптимизация лечения с целью повышения эффективности терапии и снижения риска развития побочных реакций может быть сведена к определению концентрации лекарственного вещества в плазме крови либо в других биологических средах организма человека.
Следовательно, режим дозирования лекарственного вещества должен быть подобран так, чтобы концентрация лекарственного вещества в плазме крови была в пределах терапевтического диапазона. Закономерности изменения концентрации лекарственных веществ в организме изучает фармакокинетика. Теоретическая часть этой науки основана на математических методах анализа процессов изменения концентрации лекарственных веществ в организме. Клиническая фармакокинетика базируется на терапевтическом лекарственном мониторинге (therapeutic drug monitoring, TЛМ) — определении концентрации лекарственных веществ в биологических тканях и жидкостях, что позволяет рационально подбирать индивидуальный режим применения лекарственного средства у больного для достижения максимального терапевтического эффекта и безопасности.
Клиническая фармакокинетика основана на существовании взаимосвязи между доступной определению концентрацией лекарственного средства (например в плазме крови или цельной крови) и его эффектами (терапевтическими или побочными). Для многих лекарств это действительно справедливо, но в некоторых случаях выявить такую взаимосвязь не удается. Как правило, концентрация лекарственного средства в крови связана с его концентрацией в ткани-мишени. Клиническая фармакокинетика позволяет количественно оценить зависимость эффекта от дозы и интерпретировать данные о динамике концентрации лекарственного средства в биологических жидкостях. Выбор и коррекция схемы лечения с учетом фармакокинетических закономерностей позволяет повысить эффективность и безопасность медикаментозного лечения.
Необходимость изменить дозу при тех или иных физиологических и патологических состояниях зачастую обусловлена изменением фармакокинетики препарата. К наиболее важным фармакокинетическим параметрам относятся клиренс, характеризующий элиминацию препарата, объем распределения — кажущийся объем, в котором содержится лекарственное вещество, период полувыведения (Т½) — параметр, характеризующий скорость выведения препарата из организма, и биодоступность — доля введенного препарата, поступившая в системный кровоток. Менее значимые параметры — скорость всасывания и скорость распределения.
Клиренс
Клиренс лекарственного вещества — это важнейший фармакокинетический параметр, позволяющий подобрать дозовый режим при длительном лечении. Чтобы обеспечить необходимый терапевтический эффект и свести к минимуму риск побочного действия, средняя концентрация препарата в сыворотке крови в стационарном состоянии должна находиться в пределах терапевтического диапазона. Если биодоступность составляет 100%, в стационарном состоянии скорость элиминации препарата равна скорости его поступления.
Скорость поступления = Сl × Ссредн, (1.1)
где скорость поступления — количество введенного препарата в единицу времени, Сl — суммарный клиренс, а Ссредн — средняя концентрация препарата в сыворотке крови в стационарном состоянии. Если известна требуемая средняя концентрация препарата в сыворотке крови, скорость поступления можно рассчитать по клиренсу.
Важнейшая с клинической точки зрения особенность клиренса — он, как правило, не зависит от концентрации препарата. Дело в том, что системы, отвечающие за элиминацию большинства лекарственных средств (ферментные, транспортные), обычно не насыщаются, и абсолютная скорость элиминации линейно зависит от концентрации препарата в сыворотке крови. Иными словами, элиминация подчиняется кинетике первого порядка — доля препарата, удаляемая за единицу времени, постоянна. Если же системы элиминации насыщаются, постоянна не доля, а количество препарата, удаляемого за единицу времени.
При этом элиминация подчиняется кинетике нулевого порядка, а клиренс зависит от концентрации препарата в сыворотке крови:
Сl = Vm / (Кm + С), (1.2)
где Km — концентрация препарата, при которой скорость элиминации составляет половину от максимальной, а Vm — максимальная скорость элиминации, С — концентрация препарата в сыворотке крови.
Понятие клиренса лекарственного средства аналогично понятию клиренса в физиологии почек. Так, клиренс креатинина равен отношению скорости экскреции креатинина с мочой к концентрации креатинина в плазме крови. В общем случае клиренс лекарственного средства равен отношению скорости элиминации вещества всеми органами к концентрации препарата в биологической жидкости.
Сl = скорость элиминации / С. (1.3)
Если клиренс постоянный, скорость элиминации прямо пропорциональна концентрации лекарственного средства. Клиренс отражает не количество элиминировавшегося препарата, а объем биологической жидкости (плазма крови или цельная кровь), полностью очищающийся от данного вещества за единицу времени. Этот показатель можно рассчитать для плазмы крови или цельной крови, а также определить клиренс свободного препарата.
Элиминация лекарственных средств осуществляется почками, печенью и другими органами. Рассчитав клиренс для каждого органа как отношение скорости элиминации данным органом к концентрации препарата (например в плазме крови) и просуммировав клиренсы для всех органов, получим суммарный клиренс.
Сlпоч + Сlпеч + Сlпр = Сl, (1.4)
где Сlпоч — почечный клиренс, Сlпеч — печеночный клиренс, Сlпр — клиренс для прочих органов (лекарственные средства могут метаболизироваться в других органах, выводятся с калом, потом, слюной).
В стационарном состоянии суммарный клиренс можно определить с помощью уравнения 1.1. При однократном введении препарата, биодоступность которого равна 100%, а элиминация подчиняется кинетике первого порядка, суммарный клиренс можно рассчитать на основании закона сохранения массы и интегрирования уравнения 1.3 по времени.
Сl = Доза / AUC. (1.5)
Например. Клиренс пропранолола (для цельной крови) составляет 16 мл/мин/кг (1120 мл/мин при массе тела 70 кг). Препарат элиминируется преимущественно печенью, то есть за 1 мин печень очищает от пропранолола 1120 мл крови. Клиренс не всегда соответствует плазмотоку (или кровотоку) через орган, отвечающий за элиминацию. Если препарат связывается с эритроцитами, скорость его доставки в этот орган существенно выше, чем можно предположить исходя из концентрации препарата в плазме крови. В стационарном состоянии клиренс для плазмы крови и цельной крови выглядит следующим образом:
Сlп / Сlк = Ск / Сп = 1 + Ht × [Сэ / Сп – 1], (1.6)
где Сlп — клиренс для плазмы крови, Сlк — клиренс для цельной крови, Сп — концентрация препарата в плазме крови, Ск — концентрация препарата в цельной крови, Сэ — концентрация препарата в эритроцитах, Ht — гематокрит.
Таким образом, клиренс для цельной крови равен частному от деления клиренса для плазмы крови на отношение концентраций препарата в цельной крови и плазме крови.
Распределение
Объем распределения. Этот второй важнейший фармакокинетический параметр характеризует распределение препарата в организме. Объем распределения (Vр) равен отношению общего содержания вещества в организме (ОСО) к его концентрации (С) в плазме крови или цельной крови. Объем распределения часто не соответствует никакому реальному объему. Этот объем, необходимый для равномерного распределения вещества в концентрации, равной концентрации этого вещества в плазме крови или цельной крови.
Vр = ОСО / С. (1.7)
Объем распределения отражает долю вещества, содержащегося во внесосудистом пространстве. У человека массой тела 70 кг объем плазмы крови составляет 3 л, ОЦК — около 5,5 л, межклеточной жидкости — 12 л, общее содержание воды в организме — примерно 42 л. Однако объем распределения многих лекарственных веществ гораздо больше этих величин. Например, если у человека массой тела 70 кг в организме содержится 500 мкг дигоксина, его концентрация в плазме крови составляет 0,75 нг/мл. Разделив общее содержание дигоксина в организме на его концентрацию в плазме крови, получим, что объем распределения дигоксина равен 650 л. Это более чем в 10 раз превышает общее содержание воды в организме. Дело в том, что дигоксин распределяется преимущественно в миокарде, скелетных мышцах и жировой ткани, так что его содержание в плазме крови невелико. Объем распределения лекарственных средств, активно связывающихся с белками плазмы крови (но не с компонентами тканей), примерно соответствуют объему плазмы крови. Вместе с тем некоторые лекарственные средства содержатся в плазме крови преимущественно в связанной с альбумином форме, но имеют большой объем распределения за счет депонирования в других тканях.
Период полувыведения
Период полувыведения (Т½) — это время, за которое концентрация вещества в сыворотке крови (или его общее содержание в организме) снижается вдвое. В рамках однокамерной модели определить Т½ очень просто. Полученное значение используют затем для расчета дозы. Однако для многих лекарственных средств приходится использовать многокамерную модель, поскольку динамика их концентрации в сыворотке крови описывается несколькими экспоненциальными функциями. В таких случаях рассчитывают несколько значений Т½.
В настоящее время общепризнано, что Т½ зависит от клиренса и объема распределения вещества. В стационарном состоянии зависимость между Т½, клиренсом и объемом распределения вещества приблизительно описывается следующим уравнением:
Т½ ≈ 0,693 х Vp / Cl. (1.8)
Клиренс характеризует способность организма элиминировать вещество, поэтому при снижении этого показателя вследствие какого-либо заболевания Т½ увеличивается. Но это справедливо лишь в том случае, если не меняется объем распределения вещества. Например, с возрастом Т½ диазепама увеличивается, но не за счет снижения клиренса, а вследствие увеличения объема распределения (Klotzet et al., 1975). На клиренс и объем распределения влияет степень связывания вещества с белками плазмы крови и тканей, так что прогнозировать изменение Т½ при том или ином патологическом состоянии не всегда возможно.
По Т½ не всегда можно судить об изменении элиминации препарата, зато этот показатель позволяет рассчитать время достижения стационарного состояния (в начале лечения, а также при изменении дозы или частоты введения). Концентрация лекарственного вещества в сыворотке крови, составляющая примерно 94% средней стационарной, достигается за время, равное 4 х Т½. Кроме того, с помощью Т½ можно оценить время, необходимое для полной элиминации вещества из организма, и рассчитать интервал между введениями.
Биодоступность и скорость всасывания
Биодоступность. Как выше отмечено, в системный кровоток поступает не весь всосавшийся препарат. Количество лекарственного средства, поступившее в системный кровоток, зависит не только от дозы, но и от биодоступности. Последняя определяется степенью всасывания, а также степенью элиминации, которой лекарственное средство подвергается до поступления в системный кровоток. Помимо неполного всасывания (см. выше), низкая биодоступность может быть обусловлена интенсивным метаболизмом в кишечнике или печени либо экскрецией с желчью.
Скорость всасывания, как правило, не влияет на среднюю концентрацию препарата в сыворотке крови в стационарном состоянии, но может существенно сказываться на фармакологических эффектах. Если препарат поступает в системный кровоток быстро (например при внутривенном струйном введении) и первоначально распределяется в небольшом объеме, концентрация его в сыворотке крови может быть достаточно высокой. По мере распределения препарата в менее интенсивно кровоснабжаемые органы и ткани она снижается. Если препарат поступает в системный кровоток медленнее (например при внутривенной инфузии), его распределение начинается еще до того, как будет введена вся доза. Поэтому максимальная концентрация в сыворотке крови ниже и достигается позднее. Препараты длительного действия обеспечивают медленное, равномерное всасывания лекарственных средств, снижая колебания концентрации препарата в сыворотке крови в период между введениями. Скорость распределения лекарственного вещества в разные ткани-мишени может быть разной, поэтому при изменении скорости введения выраженность терапевтических эффектов и побочных реакций может временно меняться.
Подбор и коррекция дозы
Терапевтический эффект при однократном введении препарата появляется спустя некоторое время после введения, постепенно достигается максимума, затем ослабевает и исчезает.
Его динамика соответствует концентрации препарата в сыворотке крови, что определяется его фармакологическими особенностями (всасывание, распределение, элиминация). Терапевтический эффект появляется по достижении терапевтической концентрации и возрастает по мере ее повышения. Длительность эффекта зависит от времени, в течение которого концентрация препарата в сыворотке крови превышает терапевтическую. Аналогичным образом побочные реакции зависят от токсической концентрации препарата. В диапазоне между этими концентрациями (терапевтический диапазон) лекарственное средство эффективно, но не оказывает побочных реакций. При многократном введении препарата дозу и интервал между введениями подбирают таким образом, чтобы достичь максимального терапевтического эффекта при минимальном побочном действии. Нижней границей терапевтического диапазона, как правило, считают концентрацию препарата в сыворотке крови, при которой терапевтический эффект составляет примерно половину максимального. Верхняя же граница соответствует концентрации, в которой побочные реакции возникают не более чем у 5–10% больных. Токсическая концентрация некоторых лекарственных средств превышает терапевтическую менее чем в 2 раза. Следует помнить и об индивидуальных особенностях пациентов: одни хорошо переносят концентрацию препарата в сыворотке крови, превышающую токсическую, а у других возникают выраженные побочные реакции, когда концентрация в сыворотке крови остается в пределах терапевтического диапазона.
Если фармакологические эффекты лекарственных средств оценивать легко (например по изменению АД или уровню глюкозы плазмы крови), то дозу можно подбирать методом проб и ошибок. Чтобы определить, в каких пределах и насколько часто можно менять дозу, применяют эмпирические правила, учитывающие вышеприведенные фармакологические закономерности (например, дозу меняют не более чем на 50% и не чаще чем через 3–4 Т½). Если дозозависимой токсичности нет, для обеспечения максимальной эффективности и увеличения времени действия препарата можно применять его в дозе значительно выше средней терапевтической. Так, например, поступают с большинством блокаторов β-адренорецепторов.
Если фармакологические эффекты оценить тяжело, лекарственное средство обладает узким терапевтическим диапазоном, высокий риск побочных реакций при неэффективности лечения или препарат применяют с профилактической целью, дозу меняют незначительно, тщательно наблюдая больных для выявления побочных реакций. Так или иначе средняя концентрация лекарственного средства в стационарном состоянии должна находиться в пределах терапевтического диапазона. В большинстве случаев определять фактическую концентрацию препарата в сыворотке крови нет необходимости: достаточно лишь знать, как она зависит от дозы и частоты введения. Однако для небольшого количества препаратов терапевтическая концентрация отличается от токсической всего в 2–3 раза (дигоксин, теофиллин, лидокаин, аминогликозиды, циклоспорины, противосудорожные средства) в стационарном состоянии, в которой он эффективен, но обусловливает минимум побочных реакций. Затем измеряют фактическую концентрацию препарата и при необходимости корригируют дозу так, чтобы фактическая концентрация была максимально приближена к требуемой.
Поддерживающая доза
В большинстве случаев лекарственные средства вводят дробно или в виде инфузии так, чтобы стационарная концентрация находилась в пределах терапевтического диапазона. В стационарном состоянии скорость поступления препарата равна скорости его элиминации. Подставив в уравнение требуемую концентрацию препарата в сыворотке крови, получим:
Скорость поступления = Ссредн x Cl / F, (1.9)
где F — биодоступность.
Зная требуемую сывороточную концентрацию препарата, его клиренс и биодоступность, можно рассчитать дозу и частоту введения.
Дозу и частоту приема (то есть скорость поступления препарата) можно рассчитать на основании уравнения 1.9. Биодоступность дигоксина равна 0,7.
Скорость поступления = Ссредн x Cl / F = 1,5 нг/мл х 1,6 / 0,7 мл/мин/кг = 3,43 нг/кг/мин = 236 нг/мин = 236 х 60 х 24 / 1000 мкг/сут = 340 мкг/сут = 0,34 мг/сут.
На практике дозу округляют до ближайшей стандартной, например до 375 мкг/сут или до 0,25 мг/сут. В первом случае средняя концентрация в плазме крови в стационарном состоянии составит 1,5 х 375 / 340 = 1,65 нг/мл, во втором — 1,5 х 250 / 340 = 1,1 нг/мл.
Интервал между введениями
Желательно, чтобы в промежутке между введениями не было резких колебаний концентрации препарата в сыворотке крови. Если бы всасывание и распределение препарата происходили мгновенно, размах этих колебаний зависел бы только от Т½. Когда интервал между введениями равен Т½, минимальная и максимальная концентрация различаются в 2 раза, что вполне допустимо.
Если терапевтический диапазон лекарственного средства достаточно широк, то есть в концентрациях, значительно превышающих терапевтическую, оно переносится хорошо, можно назначать максимальные дозы. В данном случае интервал между введениями может быть намного больше Т½, что очень удобно для больного.
Для лекарственного средства с узким терапевтическим диапазоном нередко приходится измерять максимальную и минимальную концентрации препарата в сыворотке крови. Минимальную концентрацию в стационарном состоянии (Смин) дигоксина рассчитывают по следующему уравнению:
Смин = F x Доза / Vp) / 1-е-кТ x е-кТ, (1.10)
где к = 0,693 / Т½, а Т — интервал между введениями. Величина е-кТ представляет собою долю предыдущей дозы, оставшуюся в организме к моменту введения следующей дозы (с учетом биодоступности).
Насыщающую дозу можно принимать внутрь или вводить внутривенно. Чтобы снизить риск побочных реакций, ее дробят. Вначале вводят 0,5 мг, через 6–8 ч — еще 0,25 мг, тщательно наблюдая больного. Последние 0,25 мг при необходимости тоже можно разделить на 2 дозы по 0,125 мг и вводить с интервалом 6–8 ч, особенно если на прием дигоксина в поддерживающий дозе планируется перейти в течение 24 ч с момента начала лечения.
Индивидуальный подбор дозы
Схему лечения определяют на основании закономерностей всасывания, распределение и элиминации препарата и фармакокинетических параметров (F, Cl, Vp, и T½. Рекомендуемые схемы обычно рассчитаны на «среднего» больного. Для многих лекарственных средств стандартное отклонение таких параметров, как F, Cl, и Vp, составляет соответственно 20; 50 и 30%. Иными словами, в 95% случаев концентрация препарата в сыворотке крови в стационарном состоянии находится в пределах от 35 до 270% требуемой, что неприемлемо для препаратов с узким терапевтическим диапазоном. Поэтому индивидуальный подбор дозы и частоты введения — важнейшее условие эффективности лечения. Основываясь на вышеописанных фармакологических закономерностях, схему лечения подбирают таким образом, чтобы обеспечить необходимый терапевтический эффект и свести к минимуму риск побочных реакций. По возможности измеряют концентрацию лекарственных средств в сыворотке крови. На основании полученных данных по специальным методикам корригируют дозу препаратов с узким терапевтическим диапазоном (например сердечных гликозидов, антиаритмических средств, дифенина, теофиллина).
Количественные и качественные методы фармакокинетики сложны и дорогостоящи для обычного применения, которое к тому же во многих случаях не оправдано, так как существуют отработанные схемы дозирования лекарственных средств и их коррекции с учетом индивидуальных особенностей пациентов. Однако в ряде случаев для этого необходим терапевтический лекарственный мониторинг, который обязателен в следующих ситуациях, к которым в первую очередь относятся (Белоусов Ю.Б., Гуревич К.Г., 2005):
- Значительная индивидуальная вариация фармакокинетических параметров препаратов. Например, известны случаи, когда лечебный эффект препарата в плазме крови достигался при минимальной терапевтической концентрации. Так, острые гепатотоксические эффекты в результате применения парацетамола были отмечены в плазме крови в соответствии с терапевтическим коридором, а другие факторы, которые могли бы привести к подобному осложнению (например алкоголизм), были исключены.
- Особенности фармакокинетики у детей и лиц пожилого возраста. У первых отмечают существенные вариации в развитии систем метаболизма и экскреции лекарственного вещества. Практически у всех лиц пожилого возраста выявляют заболевания, изменяющие фармакокинетические параметры известных лекарственных препаратов или требующие комплексной терапии, при которой могут возникнуть непредсказуемые лекарственные взаимодействия. Кроме того, с возрастом даже у лиц без заболевания почек отмечается снижение почечного клиренса креатинина, что характеризует снижение эффективности системы элиминации лекарственных средств.
- Узкий терапевтический диапазон лекарственного препарата, высокая вероятность развития побочных реакций даже при использовании минимальных терапевтических концентраций лекарственного вещества.
- Период беременности, кормления грудью и прочие состояния, при которых необходимо полностью исключить риск развития побочных реакций лекарственной терапии, или ситуации, при которых существенно изменяются фармакокинетические параметры препаратов.
- Нелинейная фармакокинетика препаратов, когда нет четкой связи между концентрацией лекарственного вещества в крови и терапевтическим эффектом. При этом обычно постулируется, что развитие побочных реакций связано с изменением концентрации лекарственного вещества в плазме крови или эффекторной ткани.
- Заболевания, изменяющие фармакокинетические параметры лекарственных препаратов: СН, печеночная и почечная недостаточность, заболевание ЖКТ.
- Необходимость проведения комплексного лечения, непредсказуемость эффектов сочетанной фармакотерапии. При этом следует учитывать прием пациентом безрецептурных препаратов, растительных компонентов, а также характер питания. Обычно терапевтический лекарственный мониторинг необходим при одновременном применении >5 лекарственных средств, включая лекарственные формы для местного применения, витаминные средства, гормональные контрацептивы, средства народной медицины, гомеопатические субстанции и т.д. Однако при назначении сильнодействующих или имеющих одинаковые системы метаболизма препаратов либо во всех указанных в п. 1–6 случаях терапевтический лекарственный мониторинг может потребоваться уже при применении >2 лекарственных средств.
МЕХАНИЗМЫ ДЕЙСТВИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Фармакодинамика
Изучает механизм действия лекарственных средств, а также их биохимические и физиологические эффекты. В ее задачи входит описание химических и физических взаимодействий между препаратом и клеткой-мишенью, а также полного спектра и выраженности его фармакологических эффектов. Знание фармакодинамических закономерностей позволяет правильно подобрать медикаментозное лечение. Фармакодинамические исследования обеспечивают более глубокое понимание регуляции биохимических и физиологических процессов в организме (Катцунг Б.Г., 1998; Лоуренс Д.Р. и соавт., 2002).
Действие большинства лекарственных средств опосредовано их связыванием с макромолекулами организма. Изменение функционального состояния этих макромолекул, в свою очередь, запускает цепь биохимических и физиологических реакций, которые преобразуются в фармакологический эффект. Макромолекулы, с которыми взаимодействуют химические вещества, называются рецепторами. Таким образом, любые функционально активные макромолекулы могут служить рецепторами для лекарственных средств. Из этого утверждения вытекает несколько важных следствий. Во-первых, с помощью лекарственных средств можно изменять скорость любого физиологического процесса в организме. Во-вторых, лекарственные средства лишь изменяют естественные физиологические функции клетки, не придавая ей новых свойств.
Рецепторы
Большинство рецепторов представляют собой белки. Это рецепторы гормонов, факторов роста, медиаторов, белки, участвующие в важнейших метаболических и регуляторных реакциях (дигидрофолатредуктаза, ацетилхолинэстераза), транспортные белки (Na+, К+-АТФаза), структурные белки (тубулин). В роли рецепторов могут выступать и клеточные компоненты иной химической природы, например нуклеиновые кислоты, с которыми взаимодействуют противоопухолевые средства.
Фармакологическое значение имеют рецепторы эндогенных регуляторных факторов — гормонов, медиаторов и т.д. Эти рецепторы служат мишенями для многих лекарственных средств, обычно действующих избирательно благодаря высокой специфичности рецепторов по отношению к эндогенным лигандам. Лекарственные средства, которые при связывании с рецептором воспроизводят физиологический эффект эндогенного лиганда, называются аганистами, или стимуляторами. Препараты, которые не вызывают такого эффекта, но препятствуют связыванию эндогенных лигандов, называют антагонистами, или блокаторами. Вещества, эффект которых менее выражен, чем эффект агонистов, называют частичными агонистами. Препараты, стабилизирующие рецептор в неактивированой конформации, относят к обратным агонистам.
Структурно-функциональная зависимость
Химическая структура препарата достаточно жестко определяет его сродство к рецепторам и внутреннюю активность. Незначительное изменение химического строения может существенно отразится на фармакологических свойствах.
На этом в значительной мере основан синтез новых лекарственных средств. Поскольку химическая модификация не обязательно отражается на всех фармакологических свойствах в равной степени, можно улучшить эффективность и безопасность препарата, повысить его избирательность, усовершенствовать фармакокинетические характеристики. Например, многие применяемые в клинике антагонисты гормонов и медиаторов синтезированы путем химической модификации эндогенных веществ.
Точки приложения лекарственных средств
Поскольку действие лекарственных средств опосредовано рецепторами, точка приложения препарата определяется не только особенностями его распределения, но и локализацией рецепторов, а фармакологические эффекты зависят от функциональной значимости этих рецепторов. Фармакологические эффекты лекарственных средств, чьи рецепторы распространены во многих органах и тканях, разнообразны. Если эти рецепторы выполняют жизненно важную для клеток функцию, применять препарат в терапевтических целях не только трудно, но и небезопасно. Тем не менее подобные препараты могут иметь большое клиническое значение. Так, сердечные гликозиды, широко применяемые при СН, изменяют транспорт ионов через клеточную мембрану, от которого зависит жизнедеятельность клетки. Они обладают узким терапевтическим диапазоном и очень токсичны. Другим примером могут служить противоопухолевые средства. Если же рецепторы, с которыми взаимодействует препарат, имеются лишь на нескольких типах дифференцированных клеток, его действие более избирательно. У этих лекарственных средств побочных реакций может быть меньше, но все же эти средства могут оказаться токсичными, если их рецепторы выполняют жизненно важную функцию. Подобным образом действуют некоторые биологические яды (ботулотоксин и др.). Кроме того, даже если прямой фармакологический эффект избирателен, то его последствия могут оказаться более многообразными.
Рецепторы эндогенных регуляторных факторов
Термином рецептор обозначают любой макромолекулярный компонент клетки, с которым связывается лекарственное средство. Один из наиболее важных рецепторов лекарственных средств — клеточные белки, которые служат рецепторами для эндогенных регуляторных факторов — гормонов, факторов роста, медиаторов. Связываясь с эндогенным лигандом, рецепторы передают поступающий от него сигнал внутрь клетки-мишени.
От рецептора сигнал поступает к клеточным мишеням (эффекторным белкам) непосредственно или через промежуточные сигнальные молекулы — белки-преобразователи. Рецептор, белки-преобразователи и эффекторные белки образуют рецепторно-эффекторную систему. Ближайший в цепи передачи сигнала эффекторный белок часто представляет собой не конечный эффектор (непосредственно влияющий на клеточные функции), а фермент или транспортный белок, участвующий в образовании, транспорте либо инактивации второго посредника — иона или небольшой молекулы. Второй посредник, в свою очередь, переносит информацию к разнообразным внутриклеточным мишеням, обеспечивая их одновременную реакцию на сигнал от одного рецептора.
Рецепторы, белки-преобразователи и эффекторные белки не только передают информацию. Они также координируют сигналы, поступающие от разных лигандов, с одной стороны, и все эти сигналы с метаболическими процессами в клетке — с другой.
Действуя как катализаторы, рецепторы усиливают биологический сигнал. Благодаря этому важному свойству они служат прекрасными мишенями для лекарственных средств. Впрочем, усилителями сигнала служат не только рецепторы с ферментативной активностью, а все известные рецепторы. Действительно, при связывании одной молекулы лиганда с рецептором, сопряженным с ионным каналом, через последний проходит множество ионов. То же самое справедливо и в отношении рецепторов стероидных гормонов: одна молекула гормона запускает транскрипцию многих копий мРНК, на основе которых синтезируются многочисленные молекулы белка.
В зависимости от структуры и механизма действия рецепторы биологически активных веществ делят на несколько классов. Количество этих классов небольшое.
Рецепторы с ферментативной активностью
Самая большая группа рецепторов, обладающих ферментативной активностью, — это мембранные рецепторы с собственной протеинкиназной активностью. Они фосфорилируют разнообразные эффекторные белки, расположенные с внутренней стороны клеточной мембраны. В результате изменяется функция этих белков или их взаимодействие с другими белками.
Существует еще один класс рецепторов с протеинкиназной активностью — это рецепторы, сопряженные с протеинкиназами. Они лишены внутриклеточного каталитического домена, но при взаимодействии с агонистом связывают или активируют на внутренней поверхности мембраны внутриклеточные протеинкиназы. Таковы рецепторы нейротрофических факторов и состоящие из нескольких субъединиц антигенраспознающие рецепторы Т- и В-лимфоцитов. Последние взаимодействуют также с фосфотирозинфосфатами. Функция других рецепторов, не имеющих внутриклеточного эффекторного домена, возможно, опосредована какими-то другими эффекторными белками.
Сходную структуру имеют и другие рецепторы с собственной ферментативной активностью. К ним относятся, например, рецепторы с собственной фосфотирозинфосфатазной активностью: их внеклеточный домен похож по аминокислотной последовательности на молекулы адгезии. Для многих рецепторов с собственной фосфотирозинфосфатазной активностью эндогенные лиганды не известны. Тем не менее, по данным генетических и биохимических исследований, проведенных на разных типах клеток, ферментативная активность этих рецепторов играет важную роль. Внутриклеточный домен рецепторов предсердного натрийуретического гормона, других НУП, а также рецепторов гуанилина обладает собственной гуанилатциклазной активностью и синтезирует цГМФ, выступающий в роли второго посредника. Возможно, существуют и другие рецепторы с собственной ферментативной активностью.
Рецепторы, сопряженные с ионными каналами
Рецепторы некоторых медиаторов непосредственно связаны с ионными каналами, при взаимодействии с лигандом избирательно пропускающими через клеточную мембрану те или иные ионы (хемочувствительные каналы, ионотропные рецепторы-каналы, ионотропные рецепторы).
Рецепторы, сопряженные с G-белками
Это довольно большой класс рецепторов, которые взаимодействуют с эффекторами через G-белки (белки, использующие замену гуанин дифосфата (ГДФ) на гуанин трифосфат (ГТФ). К нему относятся рецепторы многих биогенных аминов, липидных сигнальных молекул (в частности эйкозаноидов), разнообразных пептидных и белковых лигандов. В качестве эффекторов выступают ферменты (аденилатциклаза, фосфолипаза С) и калиевые и кальциевые мембранные каналы. Большое количество и важная физиологическая роль рецепторов, сопряженных с G-белками, делает их прекрасными мишенями для лекарственных средств: на эти рецепторы действует примерно половина всех назначаемых врачами препаратов (исключая антибиотики).
Клетка может нести на своей поверхности до 20 рецепторов, каждый из которых избирательно взаимодействует с одним или несколькими типами G-белков (у разных типов α-субъединицы различаются). α-Субъединица способна взаимодействовать с одним или несколькими эффекторными белками, что позволяет согласовывать сигналы от рецепторов разных лигандов с помощью одного G-белка. С другой стороны, один рецептор может запускать несколько механизмов внутриклеточной передачи сигнала, активируя несколько типов G-белков, и воздействовать на разные эффекторные белки через одну и ту же α-субъединицу. Столь сложная система дивергенции и конвергенции сигналов обеспечивает гибкую регуляцию клеточных функций (Ross, 1992).
Внутриклеточные рецепторы
Рецепторы стероидных и тиреоидных гормонов, кальцитриола и ретиноидов представляют собой растворимые внутриклеточные ДНК-связывающие белки, регулирующие транскрипцию определенных генов (Mangelsdorf et al., 1994). Эти рецепторы принадлежат к суперсемейству лиганд-чувствительных регуляторов транскрипции. Функция факторов транскрипции регулируется посредством фосфорилирования, взаимодействия с клеточными белками, метаболитами и другими регуляторными компонентами клетки.
Системы вторых посредников цАМФ
В интеграции внешних сигналов участвуют также системы вторых посредников. Хотя рецепторов и белковых сигнальных молекул известно гораздо больше, чем вторых посредников, последние задействованы во множестве путей внутриклеточной передачи сигнала. К наиболее изученным вторым посредникам относятся цАМФ, цГМФ, Са2+, ИФ3 (инозитол трифосфат), ДАГ (диацилглицерол), N0. Эта группа разнородных соединений постоянно пополняется. Вторые посредники взаимодействуют напрямую (изменяя метаболизм друг друга) или косвенно (воздействуя на одни и те же внутриклеточные мишени). Функцию вторых посредников, а также регуляцию их образования (или высвобождения), расщепления и выведения из клетки удобно рассматривать на примере цАМФ. Этот второй посредник синтезируется под действием аденилатциктазы при активации многих рецепторов, сопряженных с G-белками. (Gs-белок активирует аденилатциклазу, (Gi-белок — ингибирует.
Существует не менее 10 тканеспецифичных изоформ аденилатциктазы, различающихся по механизмам регуляции активности.
Как правило, цАМФ активирует протеинкиназы А (цАМФ-зависимые протеинкиназы) — небольшую группу родственных белков. Эти протеинкиназы в свою очередь фосфорилируют не только конечные внутриклеточные мишени (ферменты, транспортные белки), но и другие протеинкиназы и прочие регуляторные белки. К последним относятся, например, факторы транскрипции. Они отвечают за опосредованную цАМФ регуляцию транскрипции генов, обеспечивая отсроченную клеточную реакцию на сигнал. Помимо активации протеинкиназ цАМФ воздействует непосредственно на мембранные катионные каналы, играющие важную роль, в частности, в функционировании нейронов. Таким образом, сигнал от цАМФ вызывает цепь биохимических изменений в клетке-мишени.
Кальций. Еще один хорошо изученный второй посредник — внутриклеточный Са2+. Ионы Са2+ поступают в цитоплазму различными путями: по мембранным каналам (зависимый от (G-белков, потенциалзависимый, регулируемый К+ либо самим Са2+), а также по каналам, расположенным в особых участках эндоплазматического ретикулума и открывающимся под действием ИФ3, а в скелетных мышцах — в результате деполяризации мембраны. Удаление кальция из цитоплазмы происходит двумя путями: он поглощается эндоплазматическим ретикулумом или выводится из клетки. Са2+ передает сигналы гораздо большему количеству белков, чем цАМФ, — ферментам, участвующим в клеточном метаболизме, протеинкиназам, кальцийсвязывающим белкам. Последние взаимодействуют с другими конечными и промежуточными эффекторами.
Регуляция рецепторов
Рецепторы не только управляют физиологическими и биохимическими функциями, но и сами служат объектами регуляции. Эта регуляция осуществляется на уровне синтеза и распада их макромолекул, посредством образования ковалентной связи с другими молекулами, взаимодействия с регуляторными белками, перемещения рецептора. Регуляции подвержены также белки-преобразователи и эффекторные белки. Регулирующие сигналы могут поступать от путей внутриклеточной передачи, активируемых при стимуляции самого рецептора (по механизму обратной связи), а также от других рецепторов (напрямую или опосредованно).
Длительная стимуляция рецепторов лекарственных средств обычно приводит к снижению реакции на него — в той же концентрации препарат вызывает менее выраженный эффект. Это явление, называемое десенситизацией, рефрактерностью, привыканием, играет важную роль в клинической практике: например, при длительном применении β-адреномиметиков для лечения пациентов с БА выраженность реакции на эти препараты уменьшается.
Гомологическая десенситизация касается только стимулированных рецепторов и специфична по отношению к лиганду. При гетерологичной десенситизации уменьшается выраженность реакции на другие лиганды, рецепторы которых действуют через тот же путь внутриклеточной передачи сигнала. В первом случае отрицательная обратная связь обеспечивается воздействием на сам рецептор (фосфорилирование, протеолиз, снижение синтеза), во втором случае помимо рецептора она может затрагивать и другие белки, участвующие во внутриклеточной передаче сигнала.
Напротив, если в течение продолжительного времени рецепторы не стимулируются, их чувствительность к агонистам возрастает (например, при продолжительном лечении β-адреноблокатором пропронололом повышается чувствительность β-адренорецепторов к β-адреностимуляторам).
Заболевания, обусловленные нарушениями функции рецепторов
Помимо индивидуальных различий в чувствительности к лекарственным средствам существуют заболевания, обусловленные нарушением функции тех или иных компонентов механизма внутриклеточной передачи сигнала от рецептора к эффектору. При выпадении функции высокоспециализированых рецепторов фенотипические проявления заболевания могут быть ограниченными (например, при тестикулярной феминизации, связанной с генетическим обусловленным отсутствием или структурными дефектами андрогенных рецепторов). Если нарушен более универсальный механизм внутриклеточной передачи сигнала, симптомы болезни разнообразнее, как, например, при миастении и некоторых формах инсулинорезистентного сахарного диабета, вызванных соответственно аутоимунными нарушениями функции N-холинорецепторов и рецепторов инсулина. Дефекты какого-либо компонента, участвующего в передаче сигнала от многих рецепторов, приводят ко множественным эндокринным нарушениям. Примером может служить гетерозиготная форма дефицита белка Gs, активирующего аденилатциктазу во всех клетках (Spiegel and Weinstein, 1995). Гомозиготная форма дефицита этого белка, вероятно, приводит к смерти.
Нарушения в структуре или локализации рецепторов могут проявиться ослабленной или усиленной реакцией на лекарственное средство, а также другими нежелательными эффектами.
Мутации, кодирующие рецепторы генов, способны изменять как реакцию на однократное применение препарата, так и эффективность длительного лечения. Например, дефект β-адренорецепторов, отвечающих за расслабление гладких мышц бронхов и регулирующих сопротивление дыхательных путей, усугубляет снижение чувствительности этих рецепторов к β-адреностимуляторам при длительном лечении пациентов с БА. По мере выявления мутаций, ответственных за нарушение функции рецепторов, и клонирования соответствующих генов появится возможность разработать методы лечения таких заболеваний.
Классификация рецепторов
Традиционно рецепторы лекарственных средств выявляли и классифицировали на основании эффектов и относительной активности действующих на эти рецепторы избирательных агонистов (стимуляторов) и антагонистов (блокаторов). Например, эффекты ацетилхолина, которые воспроизводятся при взаимодействии с холинорецепторами алкалоида мускарина и блокируются атропином, называют мускариновыми эффектами, а эффекты, которые воспроизводятся при взаимодействии с холинорецепторами никотина, — никотиновыми эффектами. Рецепторы, которые опосредуют действие мускарина и никотина, получили название соответственно М- и N-холинорецепторов. Хотя подобная классификация обычно не отражает механизм действия лекарственных средств, она удобна для систематизации их эффектов. Действительно, утверждение, что лекарственное средство стимулирует рецепторы определенного типа, одновременно определяет спектр эффектов данного препарата и вещества, усиливающие или ослабляющие эти эффекты. Однако правомочность таких утверждений может меняться с выявлением новых типов и подтипов рецепторов, открытием дополнительных механизмов действия лекарственных средств или ранее неизвестных побочных эффектов.
Подтипы рецепторов
С появлением все более разнообразных высокоизбирательных лекарственных средств стало ясно, что ранее известные типы рецепторов делятся на множество подтипов. Существенным подспорьем в изучении новых подтипов рецепторов стали методы молекулярного клонирования, а получение рекомбинантных рецепторов облегчило создание избирательно действующих на эти рецепторы лекарственных средств. Различные, но родственные подтипы рецепторов часто (хотя и не всегда) взаимодействуют с разными агонистами и антагонистами. Рецепторы, для которых избирательные агонисты и антагонисты не выявлены, обычно относятся не к отдельному подтипу, а к изоформам одного и того же рецептора. Отдельные подтипы могут различаться и по механизмам внутриклеточной передачи сигнала. М1— и М3-холинорецепторы, например, действуют через белок Gq, который активирует фосфолипазу С опосредовано вызывает выброс Са2+ из внутриклеточных депо, а М2— и М4-холинорецепторы — через белок Gi, который ингибирует аденилатциклазу. Вместе с тем деление рецепторов на типы и подтипы зачастую определяется не механизмом действия, а случайным выбором или базируется на устоявшихся представлениях. Так, α1-, α2-и β-адренорецепторы различаются по реакции на лекарственные средства и по механизму передачи сигнала (активируют соответственно белки Gi, Gq и Gs), хотя α- и β-адренорецепторы относятся к разным типам, а α1— и α2-адренорецепторы — к разным подтипам внутри одного типа. Изоформы α1-адренорецепторов — α1А, α1В и α1D мало отличаются по своим биохимическим свойствам; то же самое характерно и для изоформ разных подтипов β-адренорецепторов (β1, β2 и β3).
Различия между подтипами рецепторов используют для создания высокоизбирательных лекарственных средств, например препаратов, оказывающих разное действие на одну и ту же ткань благодаря связыванию с подтипами рецепторов, различающихся механизмами внутриклеточной передачи сигнала. Кроме того, лекарственные средства могут избирательно воздействовать на определенные клетки или ткани, экспрессирующие рецепторы того или иного подтипа. Чем больше избирательность лекарственных средств (по отношению к определенной ткани или по отношению к определенному эффекту), тем более благоприятно соотношение его пользы и нежелательных эффектов.
С помощью молекулярно-генетических методов открыты не только разные изоформы рецепторов, но и гены, кодирующие новые, ранее не известные рецепторы. Многие из этих рецепторов уже отнесены к тому или иному известному классу, а их функция изучена с помощью соответствующих лигандов. Однако для некоторых рецепторов лиганды до сих пор не найдены.
Открытие множества изоформ одного и того же рецептора, кодируемых разными генами (особенно если изоформы не различаются по механизмам внутриклеточной передачи сигнала и взаимодействуют с одними и теми же эндогенными лигандами) позволяет независимо регулировать экспрессию рецепторов в разных клетках в соответствии с потребностями организма в разные возрастные периоды.
Действие лекарственных средств, не опосредованное рецепторами
Не все лекарственные средства действуют через макромолекулярные структуры — рецепторы. Некоторые препараты взаимодействуют с небольшими молекулами или ионами, присутствующими в организме в норме либо при том или ином патологическом состоянии. Так, антациды нейтрализуют соляную кислоту в желудке. Месна (лекарственное средство, которое быстро выделяется почками и нейтрализует свободные радикалы) связывается с активными метаболитами некоторых противоопухолевых средств, уменьшая выраженность побочных реакций со стороны мочевых путей. Ряд биологически малоактивных веществ (например маннитол) можно вводить в количествах, достаточных для повышения осмолярности биологических жидкостей, и таким образом менять распределение внеклеточной и внутриклеточной жидкости. С помощью этих веществ можно усилить диурез, увеличить ОЦК, устранить отек головного мозга. Кроме того, их применяют в качестве слабительных.
Некоторые лекарственные средства могут встраиваться в компоненты клетки и изменять их функции благодаря структурному сходству с входящими в состав этих компонентов веществ. Например, аналоги пуринов и пиримидинов встраиваются в нуклеиновые кислоты и используются в качестве противовирусных и противоопухолевых средств.
Количественные аспекты взаимодействия лекарственных средств с рецепторами
Основы фармакологии рецепторов
Фармакология рецепторов изучает количественную сторону действия лекарственных средств на биологические системы. Разные биологические системы реагируют на один и тот же препарат по-разному; это касается и организма человека, с одной стороны, и экспериментальных фармакологических моделей — с другой. В результате могут возникнуть ошибки. Чтобы прогнозировать действие лекарственных средств в любых условиях, необходимо разработать стандартную шкалу оценки фармакологической активности, применимую для любой биологической системы. В этом и состоит основная задача фармакологии рецепторов.
Ведущим понятием в фармакологии рецепторов служит кривая доза — эффект, описывающая зависимость эффекта лекарственных средств от его концентрации в области рецепторов. Взаимодействие лекарственных средств с рецептором включает два компонента: 1) связывание, 2) активацию. Способность препарата связываться с рецептором, то есть вступать с ним в химическое взаимодействие, называется сродством. Способность лекарственных средств после образования комплекса с рецептором вызывать его активацию называется внутренней активностью. Внутренняя активность зависит от химической структуры препарата.
Оккупационная теория
Согласно этой классической теории взаимодействия веществ с рецепторами, фармакологический эффект возникает при связывании рецептора с лекарственным средством, а образование комплекса препарат — рецептор подчиняется закону действующих масс. С некоторыми изменениями эта теория была использована для создания модели, описывающей действие агонистов (Ariёns, 1954; Stephenson, 1956; Furchgott, 1966) и антагонистов (Gaddum, 1937; 1957; Schild, 1957). Стефенсоном было введено также важное понятие стимуляции, отражающее степень активации рецепторов под действием того или иного агониста.
Критерием сродства лекарственного средства к рецептору служит Kd (константа диссоциации) комплекса препарат — рецептор; доля занятых рецепторов зависит от концентрации лекарственного средства и Kd. Константа пропорциональности ε — это внутренняя активность препарата, то есть его способность вызывать фармакологический эффект. Произведение доли занятых рецепторов, внутренней активности препарата и общего числа рецепторов представляют собой величину стимуляции, то есть сигнала, который получает биологическая система. Этот сигнал запускает цепь биохимических изменений, в ходе которых он передается конечным эффекторным белкам, генерирующим ответную реакцию. Эффект лекарственных средств зависит от доли занятых рецепторов и механизмов внутриклеточной передачи сигнала.
Количественная оценка взаимодействия рецепторов с агонистами
Взаимодействие лекарственных средств с биологическими системами можно охарактеризовать двумя показателями — активностью и эффективностью. Об эффективности судят по величине максимального фармакологического эффекта. Активность препарата зависит от четырех параметров: два из них характеризуют биологическую систему (плотность рецепторов и эффективность механизма усиления сигнала), два других — взаимодействие вещества с рецептором (сродство препарата к рецепторам и его внутреннюю активность).
Количественная оценка взаимодействия рецепторов с антагонистами
Как правило, антагонисты так или иначе блокируют рецепторы. Конкурентный антагонист не обладает внутренней активностью, но имеет сродство к рецептору и конкурирует с агонистом за участки связывания. Для конкурентных антагонистов характерен параллельный сдвиг вправо кривой доза — эффект для агониста; максимальный эффект агониста не изменяется. Величина этого сдвига зависит от концентрации антагониста и его сродства с рецепторами и, следовательно, может служить показателем сродства антагониста к рецепторам. Следует помнить, что частичные агонисты тоже могут конкурировать с полными агонистами за участки связывания с рецептором. Но, в отличие от антагонистов, которые в достаточной концентрации могут полностью заблокировать действие полных агонистов, частичные агонисты с ростом концентрации подавляют эффект полных агонистов только до определенного уровня — своего максимального эффекта. Таким образом, частичные агонисты можно применять в тех случаях, когда необходимо ослабить стимуляцию рецепторов, полностью не блокируя их.
Иногда диссоциация комплекса антагонист — рецептор происходит столь медленно, что связь между ними можно считать необратимой. При определенных концентрациях антагониста максимальный эффект агониста уменьшается. Такие препараты относятся к неконкурентным антагонистам. В основе неконкурентного антагонизма могут лежать и иные молекулярные механизмы. Аналогичная картина наблюдается в том случае, когда за участки связывания с рецептором конкурируют истинно необратимые антагонисты.
Если участки связывания агониста и антагониста с рецептором разные, последний тоже относят к неконкурентным антагонистам. Такой антагонизм обусловлен аллостерическим взаимодействием. Аллостерические антагонисты снижают сродство рецептора к агонистам. В некоторых случаях аллостерическое взаимодействие приводит к усилению действия агонистов, то есть препараты действуют как синергисты. Синергисты можно использовать для усиления сигнала от рецепторов и, что особенно важно, для восстановления опосредованых ими физиологических эффектов в тех случаях, когда уменьшено количество рецепторов (миастения, болезнь Альцгеймера).
Благодаря молекулярно-генетическим методам, позволившим усилить экспрессию рецепторов, выявить и синтезировать дефектные рецепторы, постоянно активированные вследствие мутаций, был открыт новый тип антагонистов — обратные агонисты. Как уже упоминалось выше, рецепторы могут спонтанно (в отсутствие лиганда) принимать активированную конформацию и вызывать клеточную реакцию. Наблюдать клеточную реакцию в отсутствие агониста обычно не удается, потому что доля активированых рецепторов, конститутивная (не обусловленная связыванием с агонистом) активация рецепторов вызовет заметную клеточную реакцию, которая не подавляется при добавлении конкурентного антагониста. Поскольку обратные агонисты избирательно связываются с неактивированными рецепторами, сдвигая равновесие в сторону последних, они подавляют конститутивный сигнал от рецепторов. В отсутствие конститутивной активации рецепторов обратные агонисты ведут себя как конкурентные антагонисты. Этим отчасти можно объяснить, почему обратный агонизм был открыт недавно, а некоторые препараты, которые теперь относят к обратным агонистам, прежде считались конкурентными антагонистами.
Расшифровка генома человека дала новый толчок открытию ранее неизвестных рецепторов и новых их классов. Вместе с колоссальными возможностями, открывшимися благодаря новым методам разработки лекарственных средств (комбинаторная химия, технологии рекомбинантных ДНК), это позволяет надеяться на появление огромного разнообразия высокоизбирательных лекарственных средств.
*По определению ВОЗ клиническая фармакология — это наука, изучающая действие лекарственных средств на организм здорового и больного человека, особенности эффективности и безопасности лекарственных средств при физиологических и патологических состояниях у пациентов с различными заболеваниями и позволяющая оптимизировать фармакотерапию, исходя из принципа польза/риск (WHO, 1999).
ЛИТЕРАТУРА
- Белоусов Ю.Б., Гуревич К.Г. (2005) Клиническая фармакокинетика. Практика дозирования лекарств. Спецвыпуск серии «Рациональная фармакотерапия». Литтерра, Москва, 268 с.
- Катцунг Б.Г. (1998) Базисная клиническая фармакология. В 2 т. Пер. с англ. Бином-Невский Диалект, Санкт-Петербург, 608 с.
- Коваленко В.Н., Викторов А.П. (ред.) (2007) Компендиум 2007 — лекарственные препараты. МОРИОН, Киев, 2270 с.
- Лоуренс Д.Р., Беннет П.Н., Браун М. Дж. (2002) Клиническая фармакология. Пер. с англ. Медицина, Москва, 680 с.
- Чазов Е.И., Беленков Ю.Н. (2004) Рациональная фармакотерапия сердечно-сосудистых заболеваний: Руковод. для практикующих врачей. Литтерра, Москва, 972 с.