ФИЗИЧЕСКИЕ ОСНОВЫ эхоКГ
Ультразвук представляет собой распространение продольно-волновых колебаний в упругой среде с частотой >20 000 колебаний в секунду. УЗ-волна — это сочетание последовательных сжатий и разрежений, а полный цикл волны представляет собой компрессию и одно разрежение. Частота УЗ-волны — число полных циклов за определенный промежуток времени. Единицей частоты УЗ-колебаний принят герц (Гц), составляющий одно колебание в секунду. В медицинской практике применяют УЗ-колебания с частотой от 2 до 30 МГц, а соответственно в эхоКГ — от 2 до 7,5 МГц.
Скорость распространения ультразвука в средах с различной плотностью разная; в мягких тканях человека достигает 1540 м/с. В клинических исследованиях ультразвук используют в форме луча, который распространяется в среде различной акустической плотности и при прохождении через гомогенную среду, то есть среду, имеющую одинаковую плотность, структуру и температуру, распространяется прямолинейно.
Пространственная разрешающая способность УЗ-диагностического метода определяется минимальным расстоянием между двумя точечными объектами, на котором их еще можно различить на изображении как отдельные точки. УЗ-луч отражается от объектов, величина которых не менее 1/4 длины УЗ-волны. Известно, что чем выше частота УЗ-колебаний, тем обычно уже ширина луча и меньше его проникающая способность. Легкие являются значительным препятствием на пути распространения ультразвука, поскольку имеют наименьшую из всех тканей глубину половинного затухания. Поэтому трансторакальное эхоКГ (ТТ-эхоКГ)-исследование ограничено областью, где сердце прилежит к передней грудной стенке и не прикрыто легкими.
Для получения УЗ-колебаний используют датчик со специальными пьезоэлектрическими кристаллами, преобразующими электрические импульсы в УЗ-импульсы и наоборот. При подаче электрического импульса пьезокристалл изменяет свою форму и расправляясь генерирует УЗ-волну, а отраженные УЗ-колебания, воспринимаемые кристаллом, изменяют его форму и вызывают появление на нем электрического потенциала. Данные процессы позволяют одновременно использовать УЗ-пьезокристаллический датчик как в качестве генератора, так и приемника УЗ-волн. Электрические сигналы, сгенерированные пьезокристаллом датчика под воздействием отраженных УЗ-волн, затем преобразуются и визуализируются на экране прибора в виде эхограмм. Как известно, параллельные волны отражаются лучше и именно поэтому на изображении более четко видны объекты, находящиеся в ближней зоне, где выше интенсивность излучения и вероятность распространения параллельных лучей перпендикулярно к границам раздела сред.
Регулировать протяженность ближней и дальней зоны можно, изменяя частоту излучения и радиус УЗ-датчика. На сегодня с помощью конвергирующих и рассеивающих электронных линз искусственно удлиняют ближнюю зону и уменьшают расхождение УЗ-лучей в дальней зоне, что позволяет значительно повысить качество получаемых УЗ-изображений.
В клинике для эхоКГ-исследования используют как механические, так и электронные датчики. Датчики с электронно-фазовой решеткой, имеющие от 32 до 128 и более пьезоэлектрических элементов, встроенных в виде решетки, называют электронными. При эхоКГ-исследовании датчик работает в так называемом импульсном режиме, при котором суммарная длительность излучения УЗ-сигнала составляет <1% общего времени работы датчика. Большее время датчик воспринимает отраженные УЗ-сигналы и преобразует их в электрические импульсы, на основе которых затем строится диагностическое изображение. Зная скорость прохождения ультразвука в тканях (1540 м/с), а также время движения ультразвука до объекта и обратно к датчику (2•t), рассчитывают расстояние от датчика до объекта.
Соотношение между расстоянием до объекта исследования, скоростью распространения ультразвука в тканях и временем лежит в основе построения УЗ-изображения. Отраженные от мелкого объекта импульсы регистрируются в виде точки, его положение относительно датчика во времени отображается линией развертки на экране прибора. Неподвижные объекты будут представлены прямой линией, а изменение глубины положения вызовет появление волнистой линии на экране. Данный способ регистрации эхосигналов называется одномерной эхоКГ. При этом по вертикальной оси на экране эхокардиографа отображается расстояние от структур сердца до датчика, а по горизонтальной — шкала времени. Датчик при одномерной эхоКГ может посылать импульсы с частотой 1000 сигналов в секунду, что обеспечивает высокую временную разрешающую способность М-режима исследования.
Последующим этапом развития метода эхоКГ явилось создание приборов для двухмерного изображения сердца. При этом сканирование структур производится в двух направлениях — как по глубине, так и по горизонтали в режиме реального времени. При проведении двухмерной эхоКГ сечение исследуемых структур отображается в пределах сектора 60–90° и построено множеством точек, изменяющих положение на экране в зависимости от изменения глубины расположения исследуемых структур во времени относительно УЗ-датчика. Известно, что частота кадров при двухмерной эхоКГ-изображения на экране эхоКГ-прибора, как правило, от 25 до 60 в секунду, что зависит от глубины сканирования.
Одномерная эхоКГ
Одномерная эхоКГ — самый первый в историческом плане метод УЗИ сердца. Главным отличительным признаком сканирования в М-режиме является высокое временное разрешение и возможность визуализации мельчайших особенностей структур сердца в движении. В настоящее время исследование в М-режиме осталось весомым дополнением к основной двухмерной эхоКГ.
Суть метода заключается в том, что сканирующий луч, ориентированный на сердце, отражаясь от его структур, принимается датчиком и после соответствующей обработки и анализа весь блок полученных данных воспроизводится на экране прибора в виде УЗ-изображения. Таким образом, на эхограмме в М-режиме вертикальная ось на экране эхокардиографа отображает расстояние от структур сердца до датчика, а по горизонтальной оси отображается время.
Для получения основных эхоКГ-сечений при одномерной эхоКГ УЗИ проводят в парастернальной позиции датчика с получением изображения вдоль длинной оси ЛЖ. Датчик располагают в третьем или четвертом межреберье на 1–3 см слева от парастернальной линии (рис. 7.1).
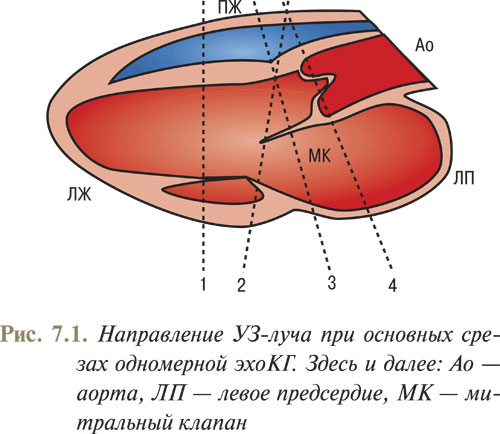
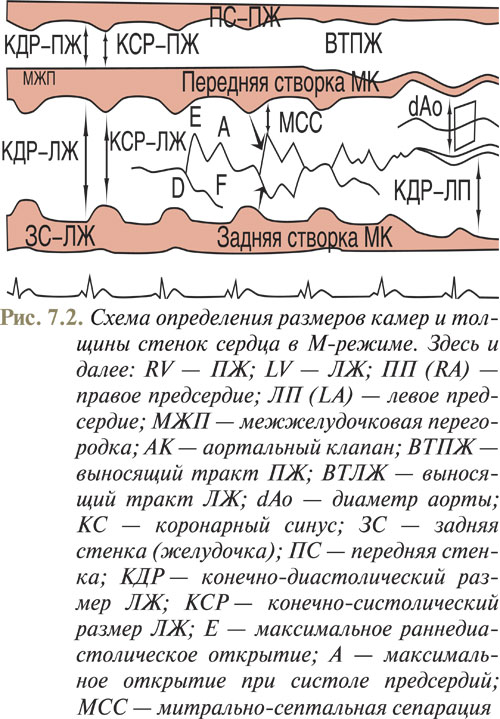
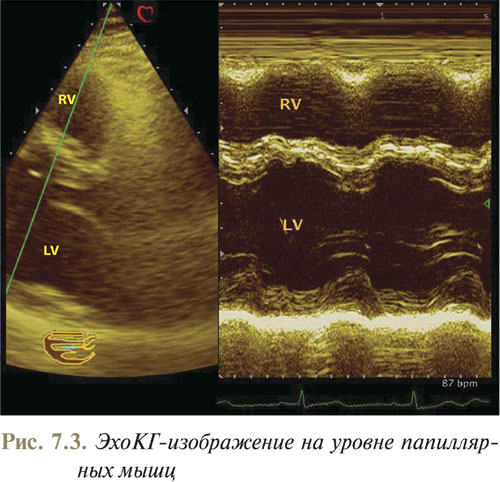
При направлении УЗ-луча вдоль линии 1 (см. рис. 7.1) получают возможность оценить размеры камер, толщину стенок желудочков, а также рассчитать показатели, характеризующие сократительную способность сердца (рис. 7.2) по визуализированной на экране эхоКГ (рис. 7.3). Сканирующий луч должен перпендикулярно пересекать межжелудочковую перегородку и далее проходить ниже краев митральных створок на уровне папиллярных мышц.
Ориентируясь на полученное изображение по КДР и КСР ЛЖ, рассчитывают его КДО и КСО, используя формулу Teicholtz:
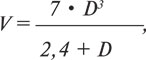
где V — объем ЛЖ, D — переднезадний размер ЛЖ.
Современные эхокардиографы имеют возможность автоматического расчета показателей сократительной способности миокарда ЛЖ, среди которых следует выделить ФВ, фракционное укорочение (ФУ), скорость циркулярного укорочения волокон миокарда (Vcf). Расчет вышеуказанных показателей производят по формулам:

где dt — время сокращения задней стенки ЛЖ от начала систолического подъема до вершины.
Использование М-режима как метода определения размеров полостей и толщины стенок сердца ограничено из-за затруднения перпендикулярного сканирования относительно стенок сердца.
Для определения размеров сердца наиболее точным методом является секторальное сканирование (рис. 7.4), методика которого описана далее.
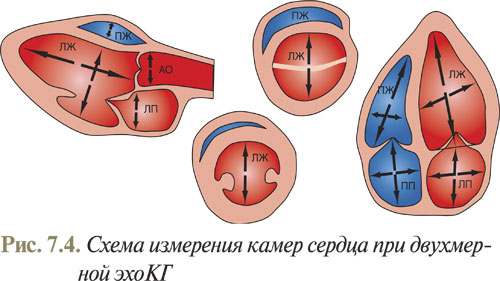
Нормальные значения измерений в М-режиме у взрослых приведены в приложении 7.2.
Следует учитывать и искажение некоторых показателей производимых измерений при сканировании в М-режиме у больных с нарушением сегментарной сократимости миокарда ЛЖ.
У этой категории пациентов при расчете ФВ будет учитываться преимущественно сократительная способность задней стенки ЛЖ и базальных сегментов межжелудочковой перегородки, в связи с чем расчет глобальной сократительной функции у этих больных производится иными методами.
С аналогичной ситуацией исследователи сталкиваются и при расчете ФУ и Vcf . Исходя из этого, показатели ФВ, ФУ и Vcf у больных с сегментарными нарушениями при проведении одномерной эхоКГ не используются.
В то же время при проведении одномерной эхоКГ можно выделить признаки, по которым судят о снижении сократительной способности миокарда ЛЖ. К таким признакам относят преждевременное открытие аортального клапана, когда последний открывается до регистрации комплекса QRS на ЭКГ, увеличение более чем на 20 мм расстояния от точки Е (см. рис. 7.2) до межжелудочковой перегородки, а также преждевременное закрытие митрального клапана.
Используя результаты измерений в данной позиции сканирующего луча при одномерной эхоКГ, применяя формулу Penn Convention, можно расчитать массу миокарда ЛЖ:
Масса миокарда ЛЖ (г) = 1,04 • [(КДР + МЖП + ТЗС)3 — КДР3] — 13,6,
где КДР — конечно-диастолический размер ЛЖ, МЖП — толщина межжелудочковой перегородки, ТЗС — толщина задней стенки ЛЖ.
При изменении угла наклона датчика и сканировании сердца вдоль линии 2 (см. рис. 7.1) на экране четко визуализируются стенки ПЖ, МЖП, передняя и задняя створки митрального клапана, а также задняя стенка ЛЖ (рис. 7.5).
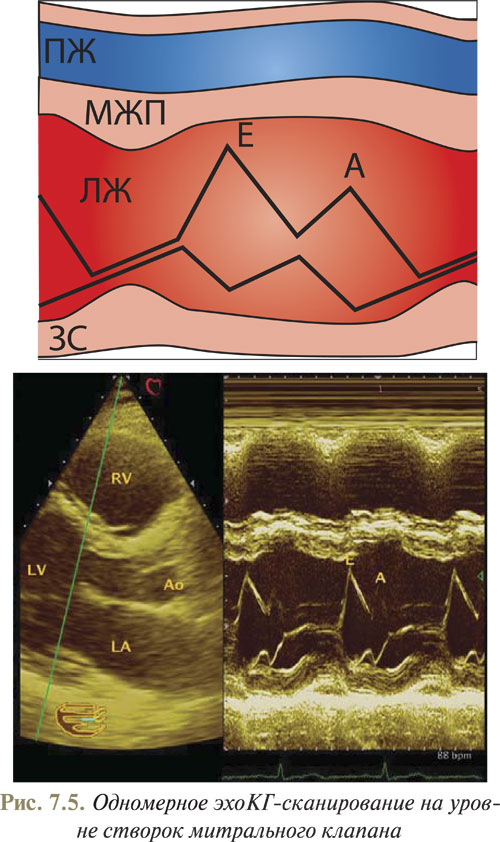
Створки митрального клапана в диастолу совершают характерные движения: передняя — М-образное, а задняя — W-образное. В систолу обе створки митрального клапана дают графику косовосходящей линии. Следует отметить, что в норме амплитуда движения задней створки митрального клапана всегда меньше, чем передней его створки.
Продолжая изменять угол наклона и направив датчик вдоль линии 3 (см. рис. 7.1), получаем изображение стенки ПЖ, межжелудочковой перегородки и, в отличие от предыдущей позиции, только переднюю створку митрального клапана, совершающую М-образное движение, а также стенку левого предсердия.
Новое изменение угла наклона датчика вдоль линии 4 (см. рис. 7.1) приводит к визуализации выносящего тракта ПЖ, корня аорты и левого предсердия (рис. 7.6).
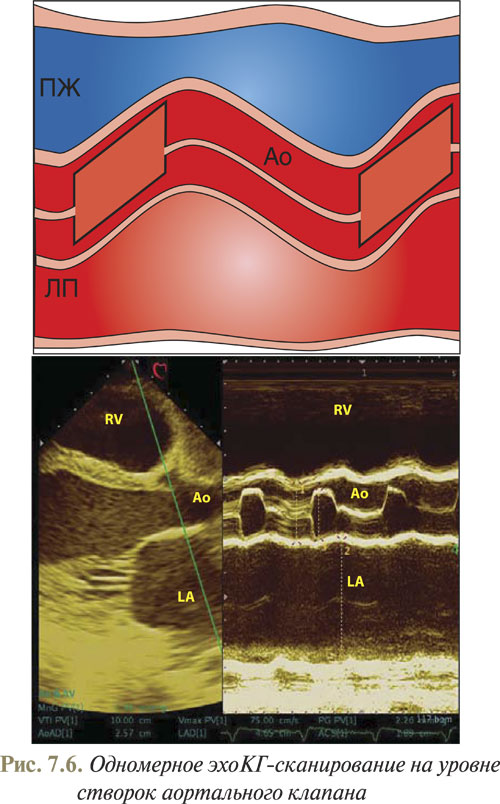
На полученном изображении передняя и задняя стенки аорты представляют собой параллельные волнистые линии. В просвете аорты находятся створки аортального клапана. В норме створки аортального клапана в систолу ЛЖ расходятся, а в диастолу смыкаются, образуя в движении замкнутую кривую в виде коробочки. Используя данное одномерное изображение, определяют диаметр левого предсердия, размер задней стенки левого предсердия, а также диаметр восходящего отдела аорты.
Двухмерная эхоКГ
Двухмерная эхоКГ является основным методом УЗ-диагностики в кардиологии. Датчик размещают на передней грудной стенке в межреберных промежутках около левого края грудины либо под реберной дугой или в яремной ямке, а также в зоне верхушечного толчка.
ОСНОВНЫЕ эхоКГ-ДОСТУПЫ
Определены четыре основные УЗ-доступы для визуализации сердца:
1) парастернальный (окологрудинный);
2) апикальный (верхушечный);
3) субкостальный (подреберный);
4) супрастернальный (надгрудинный).
Парастернальный доступ по длинной оси
УЗ-срез из парастернального доступа по длинной оси ЛЖ является основным, с него начинают эхоКГ-исследование, по нему ориентируют ось одномерного сканирования.
Парастернальный доступ по длинной оси ЛЖ позволяет выявить патологию корня аорты и аортального клапана, подклапанную обструкцию выхода из ЛЖ, оценить функцию ЛЖ, отметить движение, амплитуду движения и толщину межжелудочковой перегородки и задней стенки, определить структурные изменения или нарушение функции митрального клапана, или его поддерживающих структур, выявить расширение коронарного синуса, оценить левое предсердие и выявить объемное образование в нем, а также провести количественную допплеровскую оценку митральной или аортальной недостаточности и определить мышечные дефекты межжелудочковой перегородки цветовым (или пульсовым) допплеровским методом, а также измерить величину систолического градиента давления между камерами сердца.
Для корректной визуализации датчик размещают перпендикулярно к передней грудной стенке в третьем или четвертом межреберье около левого края грудины. Сканирующий луч направляют по гипотетической линии, соединяющей левую подвздошную область и середину правой ключицы. Структуры сердца, находящиеся ближе к датчику, всегда будут визуализированы в верхней части экрана. Таким образом, сверху на эхоКГ находятся передняя стенка ПЖ, далее — межжелудочковая перегородка, полость ЛЖ с папиллярными мышцами, сухожильными хордами и створками митрального клапана, а задняя стенка ЛЖ визуализируется в нижней части эхоКГ. При этом межжелудочковая перегородка переходит в переднюю стенку аорты, а передняя митральная створка — в заднюю стенку аорты. У корня аорты видно движение двух створок аортального клапана. Правая коронарная створка аортального клапана всегда является верхней, а нижняя створка может быть как левой коронарной, так и некоронарной, что зависит от плоскости сканирования (рис. 7. 7).
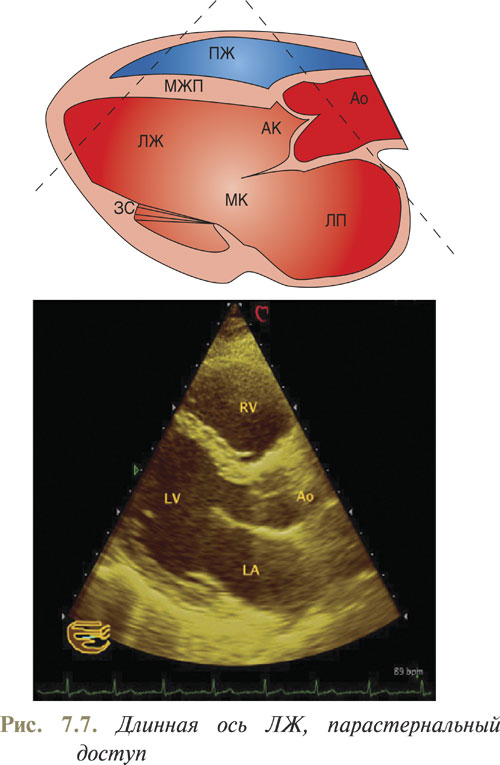
В норме движение створок аортального клапана видно нечетко, поскольку они довольно тонкие. В систолу створки аортального клапана видны как две параллельные прилегающие к стенкам аорты полоски, которые в диастолу удается увидеть только по центру корня аорты в месте смыкания. Нормальная визуализация створок аортального клапана бывает при их утолщении или у лиц с хорошим эхоокном.
Створки митрального клапана обычно хорошо визуализируются и в диастолу совершают характерные движения, а митральный клапан открывается дважды. При активном поступлении крови из предсердия ЛЖ в диастолу митральные створки расходятся и свисают в полость ЛЖ. Затем митральные створки, приближаясь к предсердию, частично закрываются после окончания раннедиастолического наполнения желудочка кровью, что и называют раннедиастолическим прикрытием митрального клапана.
В систолу левого предсердия поток крови во второй раз производит диастолическое открытие митрального клапана, амплитуда которого меньше раннедиастолического. В систолу желудочков створки митрального клапана закрываются, и после фазы изометрического сокращения открывается аортальный клапан.
В норме при визуализации ЛЖ по короткой оси его стенки образуют мышечное кольцо, все сегменты которого равномерно утолщаются и приближаются к центру кольца в систолу желудочка.
При парастернальном доступе по длинной оси ЛЖ выглядит как равносторонний треугольник, в котором вершина — верхушка сердца, а основание — условная линия, соединяющая базальные части противоположных стенок. Сокращаясь, стенки равномерно утолщаются и равномерно приближаются к центру.
Таким образом, парастернальное изображение ЛЖ по его длинной оси дает возможность исследователю оценить равномерность сокращения его стенок, межжелудочковой перегородки и задней стенки. В то же время при данном УЗ-срезе у большинства пациентов не удается визуализировать верхушку ЛЖ и оценить ее сокращение.
При этом УЗ-срезе в предсердно-желудочковой борозде визуализируется коронарный синус — образование меньшего, чем нисходящая аорта, диаметра. Коронарный синус собирает венозную кровь от миокарда и несет ее в правое предсердие, а у некоторых пациентов коронарный синус бывает значительно шире, чем в норме, и его можно спутать с нисходящей аортой. Расширение коронарного синуса в большинстве случаев происходит из-за того, что в него впадает добавочная левая верхняя полая вена, что является аномалией развития венозной системы.
Далее, при повороте плоскости сканирования по часовой стрелке и ориентировании ее параллельно к левому краю грудины нисходящую аорту можно вывести позади структур сердца по длинной оси.
Чтобы оценить выносящий тракт ПЖ и определить движение и состояние створок клапана ЛА, а также увидеть проксимальный отдел ЛА и провести измерения допплеровских показателей потока крови через клапан ЛА, необходимо вывести клапан ЛА вместе с выносящим трактом ПЖ и стволом ЛА. С этой целью из парастернального доступа, получив изображение ЛЖ по длинной оси, датчик необходимо незначительно повернуть по часовой стрелке и наклонить под острым углом к грудной клетке, направив линию сканирования под левый плечевой сустав (рис. 7.8). Для лучшей визуализации часто помогает положение пациента на левом боку с задержкой дыхания на выдохе.
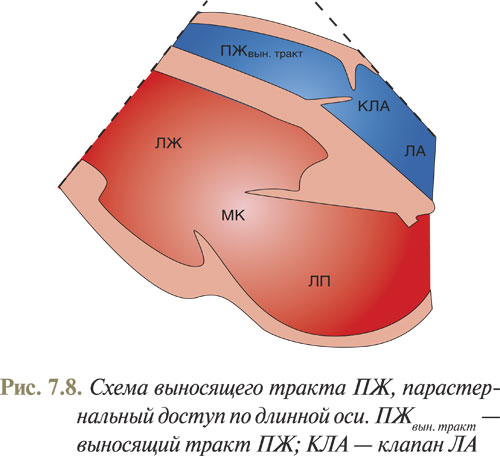
Данное изображение дает возможность оценить движение створок клапана ЛА, которые двигаются так же, как створки аортального клапана, а в систолу полностью прилегают к стенкам артерии и перестают визуализироваться. В диастолу они смыкаются, препятствуя обратному току крови в ПЖ. При допплеровском исследовании в норме часто выявляют слабый обратный ток через клапан ЛА, что не характерно для нормального аортального клапана.
Для визуализации приносящего тракта ПЖ необходимо из точки визуализации ЛЖ по длинной оси направить УЗ-луч в загрудинную область и несколько повернуть датчик по часовой стрелке (рис. 7.9).
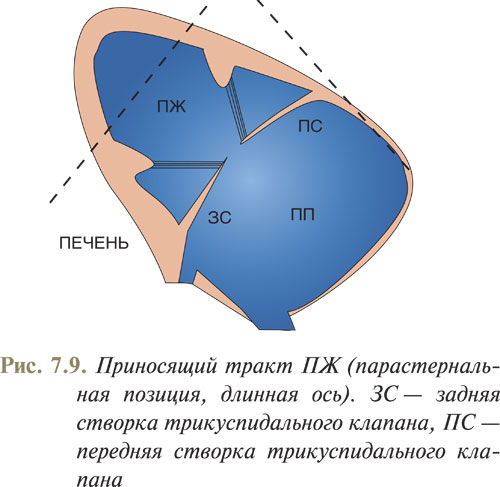
При данной плоскости сканирования достаточно хорошо определяется положение и движение створок трикуспидального клапана, где передняя створка относительно больше и длиннее, чем задняя или септальная. В норме трикуспидальный клапан практически повторяет движения митрального клапана в диастолу.
Не меняя ориентации датчика, часто удается вывести и место впадения коронарного синуса в правое предсердие.
Парастернальный доступ по короткой оси
В режиме реального времени это изображение дает возможность оценить движение створок митрального и трикуспидального клапанов. В норме в диастолу они расходятся в противоположные стороны, а в систолу двигаются в направлении друг к другу. При этом следует обратить внимание на равномерность циркулярной сократимости ЛЖ (все его стенки должны сокращаться, приближаясь к центру на одинаковое расстояние, одновременно утолщаясь), движение межжелудочковой перегородки; ПЖ, который на этом срезе имеет серповидную или приближенную к треугольной форму, а его стенка сокращается в том же направлении, что и межжелудочковая перегородка.
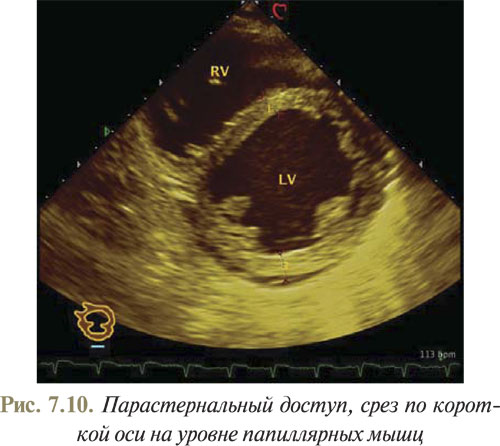
Для получения изображения сердца из парастернального доступа по короткой оси необходимо расположить датчик в третьем-четвертом межреберье слева от края грудины под прямым углом к передней грудной стенке, затем поворачиваем датчик по часовой стрелке до тех пор, пока плоскость сканирования не разместится перпендикулярно к длинной оси сердца. Далее, наклоняя датчик к верхушке сердца, получаем разные срезы по короткой оси. На первом срезе получаем парастернальное изображение ЛЖ по короткой оси на уровне папиллярных мышц, которые выглядят, как два круглых эхогенных образования, расположенные ближе к стенке ЛЖ (рис. 7.10).
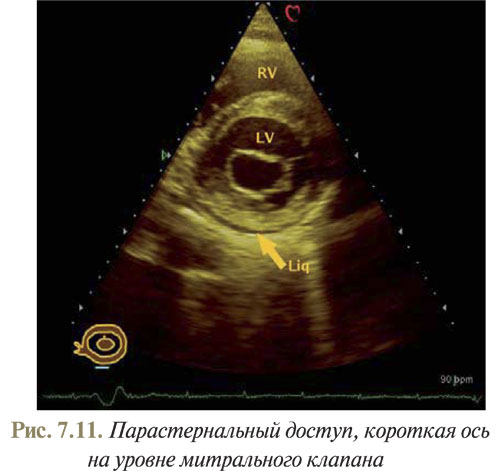
Из полученного изображения поперечного среза сердца на уровне папиллярных мышц плоскость сканирования следует наклонить к основанию сердца, чтобы получить срез ЛЖ по короткой оси на уровне митрального клапана (рис. 7.11). Затем, наклоняя плоскость сканирования к основанию сердца, визуализируем УЗ-плоскость на уровне аортального клапана (рис. 7.12а).
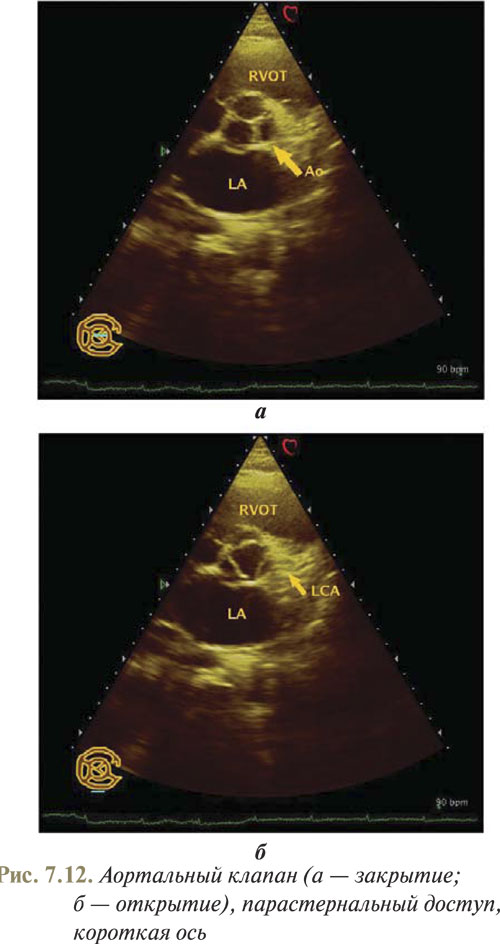
В данной плоскости сканирования корень аорты и створки аортального клапана находятся в центре изображения и в норме при закрытом положении створки образуют характерную фигуру, напоминающую букву Y. Правая коронарная створка расположена сверху. Некоронарная створка прилегает к правому предсердию, а левая коронарная створка — к левому предсердию. В систолу створки аортального клапана открываются, образуя фигуру в виде треугольника (рис. 7.12б). На этом срезе можно оценить движение створок клапана ЛА и их состояние. При этом выносящий тракт ПЖ расположен спереди от кольца аорты, а начальный отдел ствола ЛА виден на коротком протяжении.
Для выявления врожденных аномалий аортального клапана, например бикуспидального аортального клапана, который является наиболее частым врожденным пороком сердца, это сечение является оптимальным.
Нередко при этой же позиции датчика удается определить устье и основной ствол левой коронарной артерии, которые видны на ограниченном протяжении сканирования.
При большем наклоне плоскости сканирования к основанию сердца получаем срез на уровне бифуркации ЛА, что дает возможность оценить анатомические особенности сосуда, диаметр ее ветвей, а также применяется для допплеровского измерения скорости потока крови и определения его характера. Используя цветовую допплерографию при данной позиции сканирующего луча, можно выявить в месте бифуркации ЛА турбулентный ток крови из нисходящей аорты в ЛА, что является одним из диагностических критериев открытого артериального протока.
Если максимально наклонить датчик к верхушке сердца, можно получить его срез по короткой оси, что дает возможность оценить синхронность сокращения всех сегментов ЛЖ, полость которого на данном срезе в норме имеет округлую форму.
Верхушечный доступ
Верхушечный доступ используется прежде всего для определения равномерности сокращения всех стенок сердца, а также движения митрального и трикуспидального клапанов.
Кроме структурной оценки клапанов и изучения сегментарной сократимости миокарда, при верхушечных изображениях создаются более благоприятные условия для допплеровской оценки кровотока. Именно при таком положении датчика потоки крови идут параллельно или почти параллельно направлению хода УЗ-лучей, что обеспечивает высокую точность измерений. Поэтому с использованием верхушечного доступа проводятся такие допплеровские измерения, как определение скоростей кровотока и градиентов давления на клапанах.
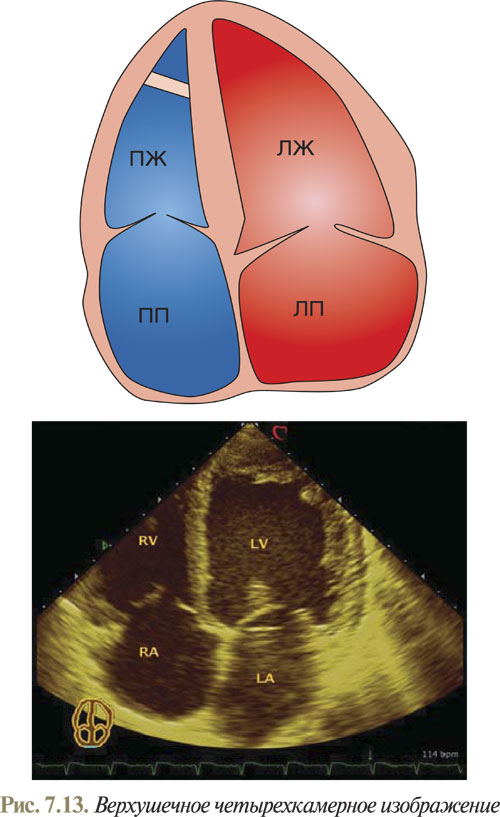
При апикальном доступе визуализация всех четырех камер сердца достигается размещением датчика на верхушке сердца и наклоном линии сканирования до получения искомого изображения на экране (рис. 7.13).
Для достижения наилучшей визуализации следует уложить пациента на левый бок, а датчик установить в область верхушечного толчка параллельно ребрам и направить его на правую лопатку.
В настоящее время наиболее часто используется ориентация эхоКГ-изображения таким образом, чтобы верхушка сердца находилась в верхней части экрана.
Для лучшей ориентации в визуализированной эхоКГ необходимо учитывать, что перегородочная створка трикуспидального клапана прикрепляется к стенке сердца немного ближе к верхушке, чем передняя створка митрального клапана. В полости ПЖ при корректной визуализации определяется модераторный тяж. В отличие от ЛЖ, в ПЖ более выражена трабекулярная структура. Продолжая исследование, опытный оператор без затруднения может вывести изображение нисходящего отдела аорты по короткой оси ниже левого предсердия.
Необходимо помнить, что оптимальная визуализация любой структуры при УЗИ достигается только в том случае, если эта структура размещена перпендикулярно ходу УЗ-луча, если же структура расположена параллельно, то изображение будет менее четким, а при незначительной толщине даже отсутствовать. Именно поэтому довольно часто из верхушечного доступа при четырехкамерном изображении центральная часть межпредсердной перегородки часто кажется отсутствующей. Таким образом для выявления дефекта межпредсердной перегородки необходимо использовать и другие доступы, и учитывать, что при верхушечном четырехкамерном изображении наиболее четко визуализируется межжелудочковая перегородка в ее нижней части. Изменение функционального состояния сегмента межжелудочковой перегородки зависит от состояния кровоснабжающей коронарной артерии. Так, ухудшение функции базальных сегментов межжелудочковой перегородки зависит от состояния правой или огибающей ветви левой коронарной артерии, а верхушечный и средний сегменты перегородки — от передней нисходящей ветви левой коронарной артерии. Соответственно функциональное состояние боковой стенки ЛЖ зависит от сужения или окклюзии огибающей ветви.
Для того чтобы получить верхушечное пятикамерное изображение, необходимо после получения апикального четырехкамерного изображения, наклонив датчик к передней брюшной стенке, сориентировать плоскость эхоКГ-среза под правую ключицу (рис. 7.14).
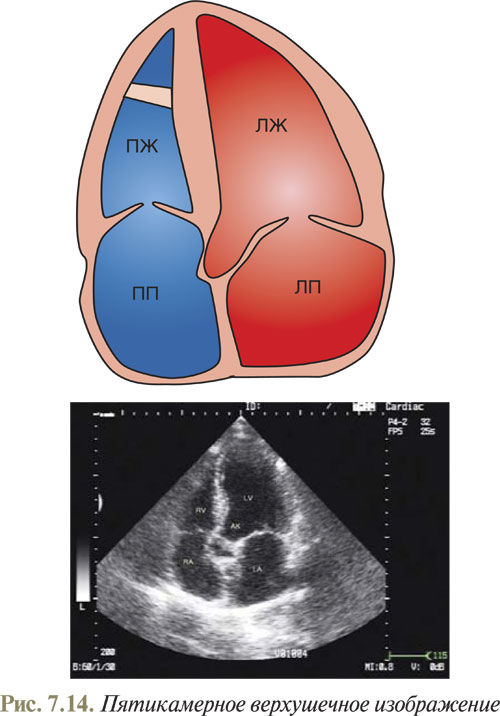
При допплер-эхоКГ верхушечное пятикамерное изображение используется для расчета основных показателей кровотока в выносящем тракте ЛЖ.
Определив в качестве исходной позиции датчика четырехкамерное апикальное изображение, легко визуализировать верхушечное двухкамерное изображение. С этой целью производят ротацию датчика против часовой стрелки на 90° и наклоняют латерально (рис. 7.15).
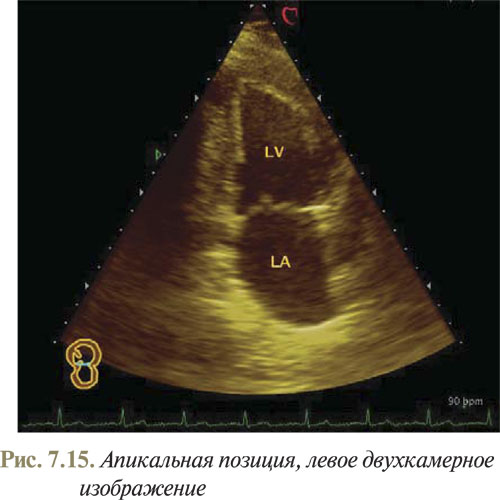
ЛЖ, который находится вверху, отделяют от предсердия обе митральные створки. Стенка желудочка, находящаяся на экране справа, является передней, а слева — заднедиафрагмальной.
Поскольку в данной позиции довольно четко визуализируются стенки ЛЖ, левое двухкамерное изображение из апикального доступа используется для оценки равномерности сокращения стенок ЛЖ.
Далее, при повороте датчика против часовой стрелки на 30°, выводим верхушечное изображение ЛЖ по длинной оси.
При таком изображении в динамике можно корректно оценить работу митрального и аортального клапанов.
Используя «кинопетлю» в данной эхоКГ-позиции, также можно определить сегментарную сократимость межжелудочковой перегородки и заднебоковой стенки ЛЖ и исходя из этого косвенно оценить кровоток в огибающей ветви левой коронарной артерии, а также частично и в правой коронарной артерии, которые участвуют в кровоснабжении заднебоковой стенки ЛЖ.
Субкостальный доступ
Наиболее частой причиной шунтирующих потоков и их акустических эквивалентов являются дефекты межпредсердной перегородки. По разным статистическим данным, эти пороки составляют 3–21% случаев всех врожденных пороков сердца. Известно, что это наиболее часто развивающийся порок во взрослой популяции.
При субкостальном четырехкамерном изображении (рис. 7.16) положение межпредсердной перегородки по отношению к ходу лучей становится приближенным к перпендикулярному. Поэтому именно из этого доступа достигается лучшая визуализация межпредсердной перегородки и проводится диагностика ее дефектов.
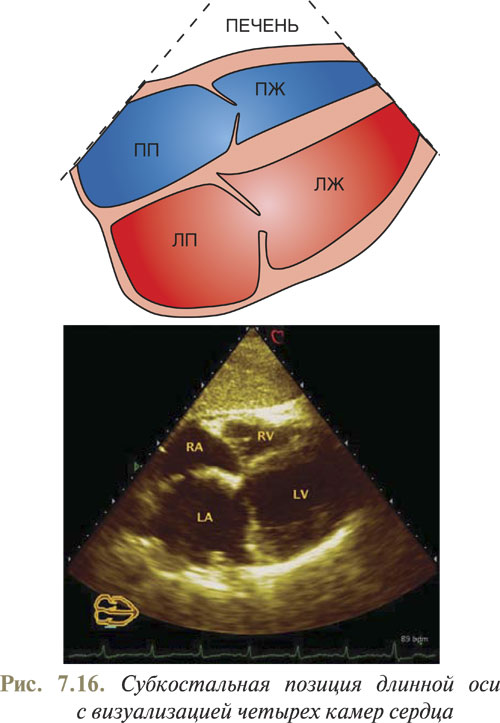
Для визуализации всех четырех камер сердца из субкостального доступа датчик размещают у мечевидного отростка, а плоскость сканирования ориентируют вертикально и наклоняют вверх, чтобы угол между датчиком и брюшной стенкой составлял 30–40° (см. рис 7.16). При этом срезе над сердцем определяется и паренхима печени. Особенностью данного УЗ-изображения является то, что увидеть верхушку сердца не представляется возможным.
Прямым эхоКГ-признаком дефекта является выпадение участка перегородки, который на изображении в формате серой шкалы представляется черным относительно белого.
В практике эхоКГ-исследования наибольшие трудности возникают при диагностике дефекта венозного синуса (sinus venosus), особенно высоких дефектов, локализующихся у верхней полой вены.
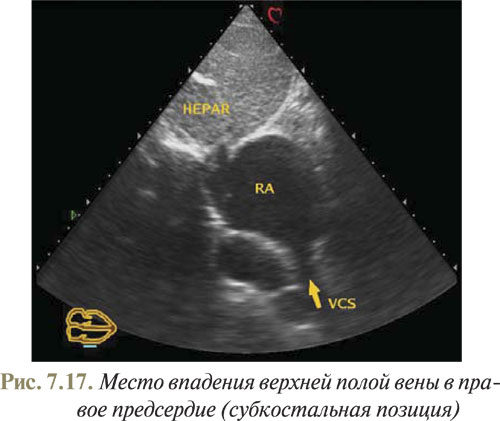
Как известно, существуют особенности УЗ-диагностики дефекта венозного синуса, связанные с визуализацией межпредсердной перегородки. Для того чтобы увидеть данный сектор межпредсердной перегородки из исходного положения датчика (при котором была получена субкостальная визуализация четырех камер сердца), необходимо повернуть его по часовой стрелке с ориентацией плоскости сканирующего луча под правое грудинно-ключичное соединение. На полученной эхоКГ хорошо виден переход межпредсердной перегородки в стенку верхней полой вены (рис. 7.17).
Следующим этапом обследования пациента является получение изображения как четырех камер сердца, так и восходящей аорты при субкостальном доступе (рис. 7.18). Для этого линию сканирования датчика из исходной точки наклоняют еще выше.

Следует отметить, что данный эхоКГ-срез является наиболее корректным и часто используемым при обследовании больных с эмфиземой легких, а также у пациентов с ожирением и узкими межреберными промежутками для исследования аортального клапана.
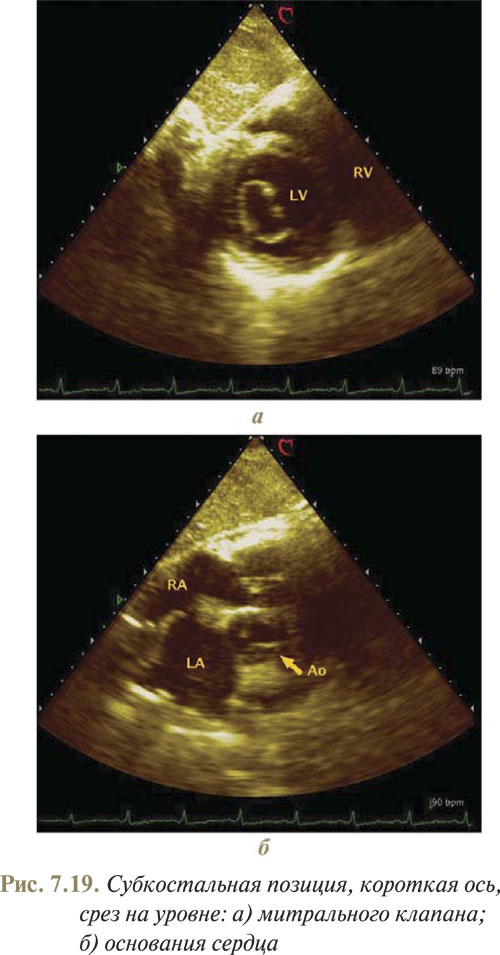
Для получения изображения по короткой оси из субкостального доступа датчик следует повернуть по часовой стрелке на 90°, исходя из позиции визуализации субкостального четырехкамерного изображения. В результате выполненных манипуляций можно получить ряд графических срезов на разных уровнях сердца по короткой оси, наиболее информативными из которых являются срезы на уровне папиллярных мышц, митрального клапана (рис. 7.19а) и на уровне основания сердца (рис. 7.19б).
Далее для визуализация изображения нижней полой вены по ее длинной оси из субкостального доступа датчик ставят в эпигастральную ямку, а плоскость сканирования ориентируют сагиттально по срединной линии, несколько наклонив вправо. При этом нижняя полая вена визуализируется сзади от печени. На вдохе нижняя полая вена частично спадается, а на выдохе, когда возрастает внутригрудное давление, становится шире.
Определение изображения брюшного отдела аорты по ее длинной оси требует ориентации плоскости сканирования сагиттально, при этом датчик располагают в эпигастральной ямке и слегка наклоняют влево. В данной позиции видно характерную пульсацию аорты, а спереди от нее хорошо визуализируется верхняя брыжеечная артерия, которая, отделившись от аорты, сразу поворачивает вниз и идет параллельно к ней.
Если повернуть плоскость сканирования на 90°, то можно увидеть сечение обоих сосудов по короткой оси. На эхоКГ нижняя полая вена находится справа от позвоночника и имеет форму, приближенную к треугольнику, при этом аорта располагается слева от позвоночника.
Супрастернальный доступ
Супрастернальный доступ используют в основном для обследования восходящего отдела грудной аорты и начальной части ее нисходящего отдела.
Размещая датчик в яремной ямке, плоскость сканирования направляют вниз и ориентируют по ходу дуги аорты (рис. 7.20).
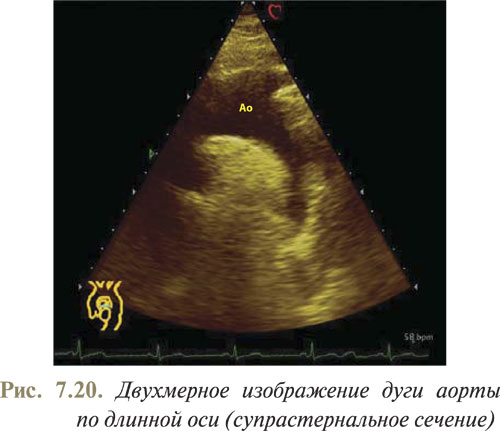
Под горизонтальной частью грудной аорты визуализируется сечение правой ветви ЛА по короткой оси. При этом можно хорошо вывести отхождение артериальных ветвей от дуги аорты: плечеголовного ствола, левых сонной и подключичной артерий.
В данной позиции наиболее корректно визуализируется весь восходящий отдел грудной аорты, с аортальным клапаном включительно и частично ЛЖ, при наклоне плоскости сканирования немного вперед и направо. Из этой исходной точки плоскость сканирования поворачивают по часовой стрелке, что дает возможность получить изображение поперечного (по короткой оси) сечения дуги аорты.
На данной эхоКГ горизонтальный отдел дуги аорты имеет вид кольца, а справа от него находится верхняя полая вена. Далее под аортой видна правая ветвь ЛА по длинной оси и еще глубже — левое предсердие. В некоторых случаях удается увидеть место впадения всех четырех легочных вен в левое предсердие. Установив датчик в правую надключичную ямку и направив сканирующую плоскость вниз, можно визуализировать верхнюю полую вену на всем ее протяжении.
Рекомендации по проведению эхоКГ у пациентов с сердечной патологией в соответствии с руководством по клиническому применению эхоКГ ACC, AHA и Американского эхокардиологического общества (ASE) (Cheitlin M.D., 2003) представлены в табл. 7.1, 7.3–7.20.
Таблица 7.1
Рекомендации по проведению эхоКГ при подозрении на заболевание грудного отдела аорты
| Класс I |
|
| Класс IIa |
| Мониторинг пациентов с хирургически устраненным расслоением аорты* |
*ТТ-эхоКГ должна быть методом первичного выбора в этих ситуациях, а чреспищеводную эхоКГ следует использовать только, если исследование неполное или необходима дополнительная информация. Чреспищеводная эхоКГ — методика, показанная при исследовании аорты, особенно в неотложных ситуациях.
Таким образом, используя разные доступы к сердцу, можно получить многочисленные срезы, которые дают возможность оценить анатомическое строение сердца, размеры его камер и стенок, взаимное расположение сосудов.
Классификация эффективности и целесообразности применения определенной процедуры:
- Класс I — наличие консенсуса экспертов и/или доказательства эффективности, целесообразности применения и благоприятного действия процедуры.
- Класс II — спорные доказательства и отсутствие консенсуса экспертов относительно эффективности и целесообразности процедуры:
-
- 11а — «чаша весов» доказательств/консенсуса экспертов перевешивает в сторону эффективности и целесообразности процедуры;
- IIb — «чаша весов» доказательств/консенсуса экспертов перевешивает в сторону неэффективности и нецелесообразности применения процедуры.
- Класс III — наличие консенсуса экспертов и/или доказательств относительно неэффективности и нецелесообразности применения процедуры, а в отдельных случаях даже ее вред.
К сожалению, не всегда удается получить качественное изображение из разных доступов, описанных в этом разделе, особенно если сердце прикрыто легкими, межреберные промежутки узкие, живот с толстым слоем подкожной жировой клетчатки, а шея короткая и толстая, то эхоКГ-исследование становится затруднительным.
ДОППЛЕР-эхоКГ
Суть метода основана на эффекте Допплера и применительно к эхоКГ заключается в том, что отраженный от движущего объекта УЗ-луч меняет свою частоту в зависимости от скорости движения объекта. Особенность сдвига частоты УЗ-сигнала зависит от направления движения объекта: если объект движется от датчика, то частота отраженного от объекта ультразвука будет ниже, чем частота ультразвука, который был послан датчиком. И соответственно если объект движется в направлении к датчику, то частота УЗ-сигнала в отраженном луче будет выше, чем исходная.
При этом, анализируя изменения частоты ультразвука, отраженного от движущегося объекта, определяют:
- скорость объекта, которая тем больше, чем значительнее частотный сдвиг посланного и отраженного УЗ-сигнала;
- направление движения объекта.
Изменение частоты отраженного ультразвука зависит и от угла между направлением движения объекта и направлением сканирующего УЗ-луча. В то же время частотный сдвиг будет наибольшим, когда оба направления совпадают. Если посланный УЗ-луч ориентирован перпендикулярно к направлению движения объекта, изменения частоты отраженного ультразвука не произойдет. Таким образом, для большей точности выполняемых измерений необходимо стремиться направлять УЗ-луч параллельно линии движения объекта. Естественно, что выполнить это условие бывает сложно, а иногда просто невозможно. По этой причине современные эхокардиографы оснащены программой угловой коррекции, которая автоматически учитывает поправку на угол при расчете градиента давления, а также скорости кровотока.
Для этой цели и используется уравнение Допплера, которое позволяет корректно определять скорость потока крови с учетом поправки на угол между направлением кровотока и линией излучаемого ультразвука:
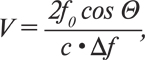
где V — скорость кровотока, с — скорость распространения ультразвука в среде (постоянная величина, равная 1560 м/с), Δf — сдвиг частоты УЗ-сигнала, f0 — исходная частота излученного ультразвука, Θ — угол между направлением кровотока и направлением излученного ультразвука.
При определении скорости кровотока в сердце и в сосудах в роли движущего объекта выступают эритроциты, которые движутся как относительно УЗ-луча датчика, так и относительно отраженного сигнала. Именно поэтому, как видно из уравнения, коэффициент в числителе равен 2, поскольку сдвиг частоты УЗ-сигнала происходит дважды.
Таким образом, частотный сдвиг зависит и от частоты посылаемого сигнала: чем она ниже, тем большие скорости могут быть измерены, что зависит от датчика, частоту которого необходимо выбирать наименьшую.
В настоящее время существует несколько видов допплеровского исследования, а именно: импульсно-волновая допплер-эхоКГ (Pulsed wave Doppler), постоянно-волновая допплер-эхоКГ (Continuous wave Doppler), тканевое допплеровское исследование (Doppler Tissue Imaging), энергетическое допплеровское исследование (Colour Doppler Energy), цветовая допплер-эхоКГ (Colour Doppler).
Импульсно-волновая допплер-эхоКГ
Суть метода импульсно-волновой допплер-эхоКГ заключается в том, что в датчике используется только один пьезокристалл, который служит одновременно и для генерации УЗ-волны, и для приема отраженных сигналов. При этом излучение идет в виде серии импульсов, очередной излучается после регистрации отраженных предыдущих УЗ-колебаний. Посланные УЗ-импульсы, частично отражаясь от объекта, скорость движения которого измеряется, меняют частоту колебаний и регистрируются датчиком. С учетом известной скорости распространения звуковой волны в среде (1540 м/с) аппарат обладает программной возможностью избирательного анализа только волн, отраженных от объектов, находящихся на определенном расстоянии от датчика в так называемом контрольном или пробном объеме. Применяя импульсно-волновую допплер-эхоКГ на большой глубине, корректно можно определить только кровоток, скорость которого не превышает 2 м/с. В то же время на меньших глубинах удается проводить достаточно точные измерения более скоростных потоков крови.
Таким образом, преимущество метода импульсно-волновой допплер-эхоКГ заключается в том, что он предоставляет возможность определять скорость, направление и характер потока крови в конкретной зоне установленного объема.
Существует прямая зависимость между частотой повторения УЗ-сигналов и максимальной скоростью потока крови. Максимальная скорость кровотока, измеряемая данным методом, ограничена пределом Найквиста. Это связано с возникновением искажения допплеровского спектра при вычислении скорости, превосходящей предел Найквиста. В данном случае визуализируется только часть кривой допплеровского спектра с обратной стороны от линии нулевой скорости, а другая часть спектра нивелируется на уровне скорости, соответствующей пределу Найквиста.
В связи с этим для корректности проводимых измерений снижают частоту повторения излучаемых импульсов при исследовании потоков крови в опрашиваемой зоне, находящейся далеко от датчика. Для исключения искажения измерений на спектральной допплеровской кривой при выполнении допплеровского исследования импульсной волной снижается значение максимальной скорости кровотока, которую можно определить. На экране эхоКГ-график допплеровского спектра представлен как развертка скорости во времени. При этом на графике выше изолинии отображен кровоток, направленный к датчику, а ниже изолинии — от датчика. Таким образом, сам график состоит из совокупности точек, яркость которых прямо пропорциональна количеству движущихся с определенной скоростью эритроцитов в данный момент времени. Изображение графика допплеровского спектра скоростей при ламинарном кровотоке характеризуется малой шириной, обусловленной небольшим разбросом скоростей, и представляет собой относительно узкую линию, состоящую из точек с примерно одинаковой яркостью.
В отличие от ламинарного типа кровотока, для турбулентного характерен больший разброс скоростей и увеличение ширины видимого спектра, поскольку возникает в местах ускорения потока крови при сужении просвета сосудов. При этом график допплеровского спектра состоит из множества точек разной яркости, находящихся на различном расстоянии от базовой линии скорости, и визуализируется на экране в виде широкой линии с размытыми контурами.
Необходимо отметить, что для корректной ориентации УЗ-луча при выполнении допплеровского исследования в эхоКГ-аппаратах предусмотрен звуковой режим, обеспеченный методом трансформации допплеровских частот в обычные звуковые сигналы. Для оценки скорости и характера кровотока через митральный и трикуспидальный клапаны методом импульсно-волновой допплер-эхоКГ датчик ориентируют так, чтобы получить верхушечное изображение с размещением контрольного объема на уровне створок клапанов с небольшим смещением к верхушке от фиброзного кольца (рис. 7.21).
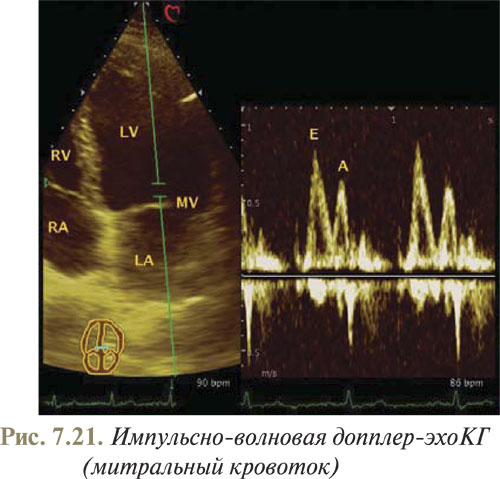
Исследование кровотока через митральный клапан при импульсно-волновой допплер-эхоКГ проводят, используя не только четырех-, но и двухкамерные апикальные изображения. Разместив контрольный объем на уровне створок митрального клапана, определяют максимальную скорость трансмитрального кровотока. В норме диастолический митральный кровоток является ламинарным, а спектр кривой митрального кровотока расположен выше базовой линии и имеет две скоростные вершины. Первый пик в норме выше и соответствует фазе быстрого наполнения ЛЖ, а второй пик скорости меньше первого и является отображением кровотока при сокращении левого предсердия. Максимальная скорость трансмитрального кровотока в норме находится в пределах 0,91,0 м/с. При исследовании кровотока в аорте при верхушечной позиции датчика, на нормальном графике скорости потока крови спектр кривой аортального кровотока находится ниже изолинии, поскольку кровоток направлен от датчика. Максимальная скорость отмечается на уровне аортального клапана, ибо это самое узкое место.
Если во время допплеровского исследования пульсовой волной выявлен высокоскоростной кровоток при митральной регургитации, то корректное определение скорости кровотока становится невозможным из-за предела Найквиста. В этих случаях для точного определения потоков с высокой скоростью используют постоянно-волновую допплер-эхоКГ.
Постоянно-волновая допплер-эхоКГ
При допплеровском исследовании постоянной волной один или несколько пьезоэлектрических элементов непрерывно излучают УЗ-волны, а другие пьезоэлементы непрерывно принимают отраженные УЗ-сигналы. Основное преимущество метода состоит в возможности исследования высокоскоростного кровотока по всей глубине исследования на пути сканирующего луча без искажения допплеровского спектра. Однако недостатком данного допплеровского исследования является невозможность пространственной локализации по глубине места кровотока.
При постоянно-волновой допплер-эхоКГ используют два типа датчиков. Применение одного из них дает возможность одновременно визуализировать двухмерное изображение в режиме реального времени и исследовать кровоток, направив УЗ-луч в место диагностического интереса. К сожалению, эти датчики из-за довольно больших размеров неудобно использовать у пациентов с узкими межреберными промежутками и затруднительно ориентировать УЗ-луч максимально параллельно кровотоку. При использовании датчика с маленькой поверхностью появляется возможность достичь хорошего качества допплеровского исследования постоянной волной, но без получения двухмерного изображения, что может создать сложности для исследователя при ориентации сканирующего луча.
Для обеспечения точной направленности УЗ-луча необходимо запомнить местоположение двухмерного датчика перед переключением на датчик пальчикового типа. Также важно знать отличительные черты графики потока при различной патологии. В частности, поток трикуспидальной регургитации, в отличие от митральной, ускоряется при вдохе и имеет более длительное время полуснижения давления. При этом следует не забывать использовать различные доступы. Исследование кровотока при аортальном стенозе производят как при апикальном, так и при супрастернальном доступе.
Полученная информация предоставляется в акустическом и графическом виде, при котором отображается развертка скорости потока во времени.
На рис. 7.22 отображено апикальное изображение ЛЖ по длинной оси, где направленность УЗ-волны в просвет аортального клапана отображена в виде сплошной линии. График скоростей кровотока представляет собой кривую с полностью заполненным просветом под рамкой и отображает все скорости, определяемые по ходу УЗ-луча. Максимальная скорость регистрируется по четкому краю параболы и отображает скорость кровотока в отверстии аортального клапана. При нормальном кровотоке спектр кривой находится под базовой линией, поскольку поток крови через аортальный клапан направлен от датчика.
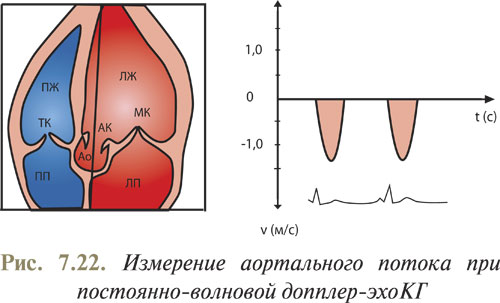
Известно, что чем больше разница давления выше и ниже места сужения, тем больше скорость в области стеноза, и наоборот; исходя из этого, можно определить градиент давления. Эта закономерность используется для расчета градиента давления по скорости кровотока в месте стенозирования. Данные расчеты производят по формуле Бернулли:
ΔР = 4 • V2,
где ΔР — градиент давления (м/с), V — максимальная скорость потока (м/с).
Таким образом, определив максимальную скорость и рассчитав максимальный систолический градиент давления между желудочком и соответствующим сосудом, можно оценить тяжесть аортального стеноза и стеноза клапана ЛА.
В случае определения тяжести митрального стеноза пользуются средним диастолическим градиентом давления на митральном клапане.
Данный градиент рассчитывают по средней скорости диастолического кровотока через митральное отверстие. Современные эхокардиографы оснащены программами автоматического расчета средней скорости диастолического кровотока и градиента давления. Для этого просто необходимо обвести спектр кривой трансмитрального кровотока.
Для больных с дефектом межжелудочковой перегородки величина градиента систолического давления между ЛЖ и ПЖ имеет большое прогностическое значение. При расчете данного градиента систолического давления определяют скорость кровотока через дефект из одной камеры сердца в другую. С этой целью допплеровское исследование постоянной волной проводят при ориентации датчика таким образом, чтобы УЗ-луч проходил через дефект по возможности максимально параллельно кровотоку.
Таким образом, постоянно-волновую допплер-эхоКГ эффективно применяют для определения высоких мгновенных скоростей кровотока. Кроме того, метод широко используется для определения значений интеграла скорость/время, а также максимальной скорости кровотока, вычисления градиента давления и времени снижения градиента давления вдвое. При помощи допплеровского исследования постоянной волной проводят измерения градиента давления в ЛА, вычисление параметра dp/dt обоих желудочков сердца и измерение динамического градиента давления при обструкции выносящего тракта ЛЖ.
Цветовая допплер-эхоКГ
Метод цветовой допплер-эхоКГ дает возможность автоматически определять характер и скорость кровотока одновременно в большом количестве точек в пределах заданного сектора, а информация подается в виде цвета, который накладывается на основное двухмерное изображение. Каждая точка кодируется определенным цветом в зависимости от того, в каком направлении и с какой скоростью в ней происходит движение эритроцитов. При размещении точек достаточно плотно и оценке в режиме реального времени можно получить изображение, воспринимаемое как движение цветных потоков через сердце и сосуды.
Принцип цветового допплеровского картирования по сути не отличается от импульсно-волновой допплер-эхоКГ. Отличие заключается лишь в режиме представления полученной информации. При допплеровском исследовании импульсной волной проводится перемещение контрольного объема по двухмерному изображению в участках, представляющих интерес для определения кровотока, а полученная информация отображается в виде графика скоростей кровотока. Разными оттенками красного и синего цветов обычно отображают направленность кровотока, а также среднюю скорость и наличие искажения допплеровского спектра.
Направление потока в одном направлении может подаваться в красно-желтом, а в другом — сине-голубом цветовом спектре. Учитываются только два основных направления: к датчику и от датчика. Обычно потоки крови, направленные к датчику, на эхоКГ представляются красным цветом, а направленные от датчика — синим (рис. 7.23).
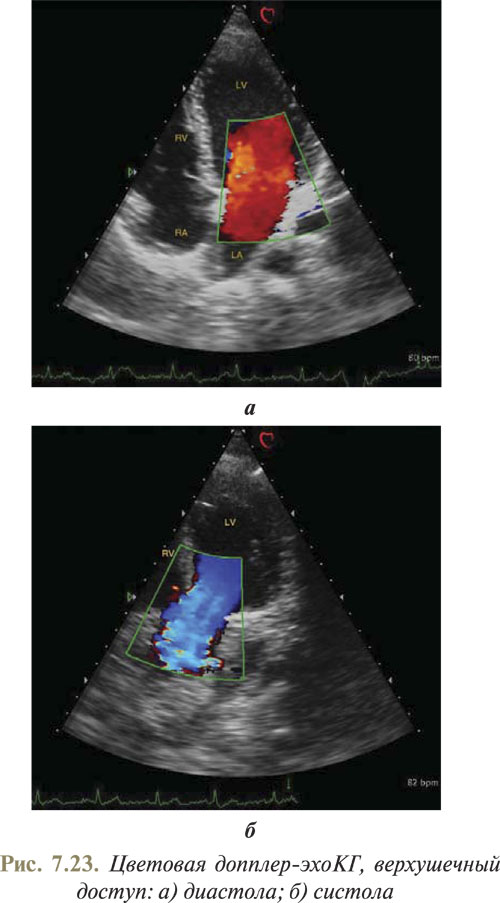
Скорость кровотока дифференцируется по яркости цветовой гаммы на полученном изображении. Чем ярче цвет, тем выше скорость потока. Если скорость равна нулю и кровоток отсутствует, на экране визуализируется черный цвет.
Во всех современных эхокардиографах на экране приводится цветовая шкала, отображающая соответствие направления и скорости кровотока тому или иному цветовому спектру.
При турбулентных потоках к основным цветам — красному и синему — обычно добавляются оттенки зеленого, что при цветовом картировании проявляется мозаичностью окраски. Такие оттенки появляются при регистрации регургитации или потоков стенозированных просветов. Как и любой метод, цветовая допплер-эхоКГ имеет свои недостатки, основными из которых являются относительно низкая временная разрешающая способность, а также невозможность отображения высокоскоростных потоков крови без искажений. Последний недостаток связан с явлением переброса, которое проявляется в том случае, если определяемая скорость кровотока превышает ограничение Найквиста и визуализируется на экране через белый цвет. Необходимо отметить, что при использовании режима цветового картирования качество двухмерного изображения нередко ухудшается.
При исследовании разных отделов аорты можно визуализировать смену направления потоков по отношению к сканирующему лучу датчика. По отношению к УЗ-лучу в восходящем отделе аорты поток крови идет во встречном направлении и отображается оттенками красного цвета. В нисходящем отделе аорты отмечается противоположная направленность кровотока (от сканирующего луча), что соответственно визуализируется оттенками синего цвета. Если кровоток будет иметь направление, перпендикулярное УЗ-лучу, то вектор скорости при проецировании на направление сканирования дает нулевое значение. Этот участок отображается в виде полоски черного цвета, разделяющей красный и синий цвет, что указывает на скорость, равную нулю. Таким образом, для корректного восприятия отображаемой цветовой гаммы необходимо четко представлять направленность потоков относительно сканирующего УЗ-луча.
Тканевой допплер
Суть метода заключается в исследовании движения миокарда с помощью модифицированной обработки допплеровского сигнала. Объектом исследования являются движущиеся стенки миокарда, дающие кодированное цветом изображение в зависимости от направленности их движения аналогично допплеровскому исследованию потоков. Движение исследуемых структур сердца от датчика отображается оттенками голубого цвета, а к датчику — оттенками красного. Изображение миокарда методом допплер-эхоКГ в клинической практике можно использовать для оценки функции миокарда, анализа нарушения регионарной сократимости миокарда (благодаря возможности одновременной регистрации средней скорости движения всех стенок ЛЖ), количественной оценки систолического и диастолического движения миокарда, визуализации других движущихся тканевых структур сердца.
Энергетическое допплеровское исследование
Используя оригинальную методику при энергетическом допплеровском исследовании, удается оценить интенсивность потока благодаря анализу отраженного УЗ-сигнала от движущихся эритроцитов. Информация отображается в цвете, как бы накладываясь на черно-белое двухмерное изображение обследуемого органа, определяя сосудистое русло. Этот способ допплеровского исследования активно вошел в клиническую медицину и довольно широко применяется в оценке кровенаполнения органов и степени их перфузии. Диагностические возможности данного метода проявились в исследовании сосудистого русла при тромбозе глубоких вен голени и нижней полой вены, дифференциации окклюзии внутренней сонной артерии от стеноза со слабым кровотоком, выявлении хода позвоночных артерий, изображении сосудов с выраженной извилистостью, контурировании бляшек, сужающих просвет сосудов, а также транскраниальном изображении сосудов головного мозга.
Цветовой М-режим
При методике цветового М-режима на экране эхокардиографа визуализируется изображение, соответствующее стандартному М-режиму с отображением скорости и направления кровотока, как при цветовой допплер-эхоКГ. Цветовое представление потоков крови нашло свое применение при оценке диастолического расслабления миокарда, а также для определения локализации и продолжительности турбулентных потоков.
ЧРЕСПИЩЕВОДНАЯ эхоКГ
Чреспищеводная эхоКГ — эхоКГ- и допплер-эхоКГ-исследование сердца с помощью эндоскопического зонда со встроенным УЗ-датчиком.
Пищевод непосредственно прилежит к левому предсердию, которое размещено кпереди от него, а нисходящая аорта — кзади. В результате расстояние от апертуры чреспищеводного датчика до структур сердца составляет несколько сантиметров и менее, в то время как у ТТ-датчика может достигать многих сантиметров. Это один из определяющих факторов получения высококачественного изображения. По данным специальной группы ACC/AHA, более чем в половине случаев чреспищеводная эхоКГ дает новую или дополнительную информацию о структуре и функции сердца, уточняет прогноз и тактику лечения. Представляет также немедленные результаты в масштабе реального времени об эффективности реконструктивных операций, протезировании клапанов сразу после прекращения искусственного кровообращения. Изображение, полученное через пищевод, позволяет преодолеть ограничения, типичные для стандартной ТТ-эхоКГ, связанные с экстракардиальными факторами: 1) респираторные артефакты — ХОБЛ (в том числе эмфизема), гипервентиляция; 2) ожирение, наличие выраженного слоя подкожно-жировой клетчатки; 3) выраженный реберный каркас грудной клетки; 4) развитые молочные железы; а также с кардиальными факторами: 1) акустическая тень протеза сердечного клапана; 2) кальциноз клапана; 3) малые размеры объемных образований. Метод обеспечивает практически абсолютное, равномерное акустическое окно хорошего качества. Использование высокочастотных датчиков (5–7 МГц) позволяет на порядок улучшить пространственную разрешающую способность в аксиальном и латеральном направлениях. Это еще один определяющий фактор получения высококачественного изображения, недоступного при проведении стандартной эхоКГ. С помощью данного метода можно исследовать структуры, недоступные при стандартной эхоКГ: верхняя полая вена, ушки предсердий, легочные вены, проксимальные части венечных артерий, синусы Вальсальвы, грудная аорта. Открыты новые возможности в исследовании правого сердца. Выявлены уникальные возможности чреспищеводной эхоКГ у пациентов в критическом состоянии, при внутриоперационном мониторинге функции желудочка, когда требуется диагностика гиповолемии, систолической дисфункции желудочка, транзиторной ишемии, ИМ. Метод высокоэффективен для дифференциальной диагностики объемных и условно принимаемых за объемные образований сердца: опухолей, тромбов; предвестников системной тромбоэмболии: спонтанного эхоКГ-контрастирования полости, нитей фибина; вегетаций малых размеров, нитей шва протеза клапана, ложных хорд желудочка, миксоматозной дегенерации митрального клапана. Метод чреспищеводной эхоКГ сравнивали с другими методами, в том числе рассматриваемыми в качестве стандартных, включая стандартную двухмерную эхоКГ (Коваленко В.Н. и соавт., 2003).
Протокол исследования определяется конкретной клинической ситуацией, чреспищеводной эхоКГ всегда предшествует чрезгрудное эхоКГ-исследование.
Показания к проведению чреспищеводной эхоКГ
1. Субоптимальная стандартная ТТ-эхоКГ.
2. Выявление инфарктобусловившей венечной артерии.
3. Оценка эффективности реконструктивных операций, протезирования клапанов, трансплантированного сердца, состоятельность аортокоронарных маммарно-коронарных шунтов сразу после выхода из искусственного кровообращения. Оценка стентирования венечной артерии.
4. Внутриоперационный мониторинг общей и локальной функции желудочка; диагностика ишемии, ИМ; дифференциация состояния гиповолемия/систолическая дисфункция желудочка.
5. Точная диагностика значимости стенотических и регургитирующих потоков при пороках сердца.
6. Патологические состояния аорты, включая расслаивающую аневризму, коарктацию.
7. Необходимость проведения дифференциального диагноза объемных и условно принимаемых за объемные образований сердца:
7.1. Опухоль.
7.2. Тромб.
7.3. Вегетация (инфекционный эндокардит).
7.4. Абсцесс кольца клапана.
7.5. Аневризматическое расширение венечной артерии.
7.6. Аневризма перегородки предсердий, ее липоматоз.
7.7. Миксоматозная дегенерация парусов митрального клапана.
7.8. Ложная хорда желудочка.
7.9. Сеть Хиари.
7.10. Нити шва протеза клапана.
7.11. Спонтанное эхоКГ-контрастирование полости предсердия (предвестник тромбоэмболии).
7.12. Нити фибрина (предвестник тромбоэмболии).
7.13. Микропузырьки.
8. Оценка инфекционных осложнений, связанных с установленными катетерами и электродами, включая электрод пейсмекера.
9. Диагностика септальных дефектов, включая малые коммуникации.
10. Наличие рецидивирующих ПЖ-ритмов (подозрение на аритмогенную дисплазию ПЖ сердца).
11. Предполагаемый источник системной тромбоэмболии в предсердиях или ушке предсердия, нижней полой вене.
12. Выявление парадоксальной воздушной эмболии у пациентов при нейрохирургических процедурах, лапараскопии, цервикальной ламинэктомии.
13. ТЭЛА.
14. Контроль эффективности перикардиоцентеза, эндомиокардиальной биопсии.
15. Отбор доноров для трансплантации сердца.
Осложнения процедуры чреспищеводной эхоКГ
Тяжелые:
- Перфорация пищевода.
- Преходящий паралич голосовых связок.
- Травма ротовой полости.
- Кровотечение из варикозно расширенных вен пищевода или вследствие фрагментации внутрипищеводно расположенной опухоли.
- Фибрилляция желудочков, другие желудочковые ритмы.
- Ларингоспазм.
- Бронхоспазм.
- Тонические, клонические судороги.
- Ишемия миокарда.
Легкие:
- Транзиторная гипо- и гипертензия.
- Рвота.
- Суправентрикулярные нарушения ритма.
- Стенокардия.
- Гипоксемия.
Основные плоскости сканирования
Методика чреспищеводной эхоКГ предполагает план исследования, который разделен на три этапа. Базальное, четырехкамерное и трансгастральное сканирование возможно на различных пунктах локализации конца эндоскопа относительно расстояния от передних зубов пациента (рис. 7.24).
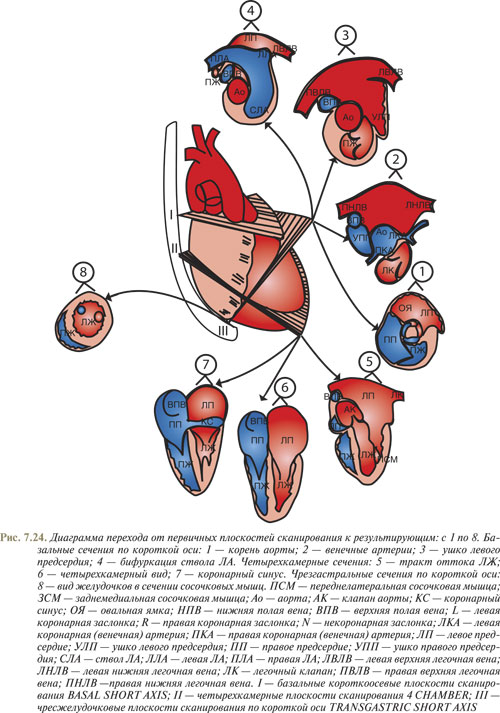
Затем переходят от общего плана исследования к частному, с получением стандартных результирующих плоскостей сканирования. Сканированием по базальной короткой оси получают по крайней мере четыре стандартных вида: с 1 по 4 (см. рис. 7.24). В четырехкамерном сечении — три вида: с 5 по 7, что примерно соответствует стандартным ТТ-двухмерным эхоКГ-видам по длинной оси. При помещении конца эндоскопа в фундальную часть желудка (трансгастральное сканирование по короткой оси) получают сечение желудочков на уровне средних отделов сосочковых мышц ЛЖ (см. рис. 7.24, вид 8), где проводится анализ локальной функции сегментов стенок желудочка, мониторинг его общей функции.
Уровень усиления сигнала начально устанавливают до получения артефактов — то есть высоко с целью определения истинных контуров эндокарда.
Наклоняя конец эндоскопа кверху или же слегка извлекая, получают последовательное сканирование структур по базальной короткой оси (см. рис. 7.24, вид 1).
В результате конец эндоскопа помещается сразу сзади левого предсердия.
ВОЗМОЖНОСТИ РАЗЛИЧНЫХ МЕТОДИК эхоКГ
Сравнительные возможности различный методик эхоКГ представлены в табл. 7.2
Таблица 7.2
Сравнительные возможности различный методик эхоКГ#
| Показатель | ТТ-эхоКГ | Спектральный допплер | Цветовая допплер-эхоКГ | Чреспищеводная эхоКГ | |
| М-режим | 2D-режим | ||||
| Анатомия — патология | |||||
| Размер полостей | ++++ | ++++ | — | — | ++ |
| Толщина стенок | ++++ | +++ | — | — | +++ |
| Соотношение полостей | + | ++++ | — | — | +++ |
| Раннее закрытие митрального клапана | ++++ | + | — | — | + |
| Масса ЛЖ | ++++ | ++++ | — | — | — |
| Систолическое движение митрального клапана вперед | ++++ | +++ | — | — | +++ |
| Образования ЛЖ (опухоли, тромбы, вегетации) | + | +++ | — | — | ++++ |
| Образования в предсердиях и ПЖ | + | ++ | — | — | ++++ |
| Анатомическая клапанная патология | ++ | ++++ | — | — | ++++ |
| Дефекты перегородок | + | ++++* | ++ | ++++ | ++++ |
| Выпот в перикарде | ++ | ++++ | — | — | ++ |
| Функция | |||||
| Общая систолическая функция ЛЖ (ФВ) | ++ | ++++ | ++ | — | +++ |
| Региональные движения стенок | + | +++ | — | — | ++++ |
| Тяжесть стеноза клапанов | + | ++ | ++++ | +++ | ++ |
| Тяжесть клапанной регургитации | + | + | +++ | +++ | +++ |
| Место шунтов слева-направо и справа-налево | — | +++* (суммарно) |
+++ | +++ (суммарно) |
+++ |
| Систолическое давление в ЛЖ и ЛА | — | — | ++++ | — | — |
| Давление наполнения ЛЖ | — | — | ++ | — | — |
| УОК и сердечный выброс | + | ++ (сумарно) |
+++ | — | — |
| Диастолическая функция ЛЖ | + | + | +++ | — | — |
| Выявление ишемии и жизнеспособного миокарда при помощи физической нагрузки или фармакологических проб | +++ | ||||
| Заболевания аорты | — | ++ | — | ++ | ++++ |
| Оценка протезированных клапанов | + | ++ | ++++ | +++ | ++++ |
+ Наименьшая ценность (применимость); ++++ наибольшая ценность; — не применимо; #если сигнал допплеровского тока крови субоптимальный, введение эхоконтрастного агента может улучшить качество сигнала; *с контрастом (внутривенное введение солевой смеси); 2D — двухмерный режим.
ОЦЕНКА ФУНКЦИИ ЖЕЛУДОЧКОВ СЕРДЦА
Систолическая функция
Основным и наиболее часто используемым показателем суммарной сократимости ЛЖ является ФВ. Наиболее широкое распространение получил метод определения ФВ по одномерной эхоКГ, который состоит в измерении КДР и КСР с последующим вычислением объемов ЛЖ:
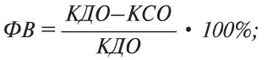
Однако этот метод имеет серьезные недостатки из-за того, что, во-первых, у очень многих больных не удается достичь прохождения линии сканирования строго перпендикулярно к межжелудочковой перегородке, что необходимо для точности расчетов, во-вторых, формула Тейхольца для расчета объема ЛЖ верна только тогда, когда его геометрия правильная.
У пациентов с ИБС и при некоторых других заболеваниях преимущественно в систолу геометрия ЛЖ нарушается. Также нельзя забывать и о том, что при этом методе учитывается сократимость только базальных отделов ЛЖ. Из-за этих же причин фракция укорочения и скорость циркулярного укорочения не могут использоваться как показатели систолической функции ЛЖ (они также определяются по базальным сегментам ЛЖ).
Поэтому были предложены другие, планиметрические методы определения объемов ЛЖ в систолу и диастолу с последующим расчетом ФВ. При этих методах используется верхушечный доступ или комбинация верхушечного доступа с парастернальным доступом по короткой оси (методы Bullet, Simpson и др.). Проведение исследования этими методами требует очень много времени при их довольно низкой точности. Из-за этого они не нашли широкого применения при рутинном обследовании больных.
Часто опытные врачи оценивают ФВ визуально. Результаты исследований свидетельствуют, что при определенной квалификации визуальная оценка ФВ является очень точной.
В настоящее время одной из самых точных и в то же время простых методик определения ФВ является вычисление соотношения ударного объема ЛЖ, полученного при импульсной допплерографии в выносящем тракте ЛЖ на уровне аортальных створок, к КДО, рассчитанному по формуле Тейхольца. Данный метод позволяет оценивать систолическую функцию ЛЖ у больных с сегментарными нарушениями сократимости, а также при выраженной митральной недостаточности, когда значительная часть крови в систолу выбрасывается не в аорту, а возвращается в левое предсердие. Этот метод точно регистрирует минимальные изменения ФВ в динамике, что особенно ценно при оценке течения заболевания и эффективности лечения пациентов с систолической дисфункцией ЛЖ. В норме суммарная сократимость ЛЖ должна составлять >55%. Удобно делить нарушения суммарной сократимости ЛЖ на следующие степени: умеренное снижение (ФВ ЛЖ — 40–55%), снижение средней тяжести (ФВ ЛЖ — 30–40%), выраженное снижение (ФВ ЛЖ <30%).
Данная классификация является довольно удобной и позволяет следить за течением болезни и эффективностью терапии, а также точно оценивать прогноз пациентов.
У больных с СН большое прогностическое значение имеют размер полости ЛЖ в базальном отделе и ФУ. Если базальные отделы ЛЖ сокращаются удовлетворительно, то функционирует «левожелудочковая манжетка», обеспечивающая достаточный выброс крови в аорту. У больных с удовлетворительной сократимостью базальных отделов отмечают значительно лучший прогноз, чем у тех, у которых один или несколько базальных сегментов сокращаются патологически. Информативность исследования повышается, если наряду с величиной ФВ одновременно оценивать индекс сократимости ЛЖ, который характеризует выраженность сегментарных нарушений.
Для характеристики суммарной сократимости ЛЖ имеет значение и оценка движения митральных створок. При значительно сниженной суммарной сократимости ЛЖ в раннюю диастолу происходит патологическое прикрытие митральных створок вследствие высокого конечно-диастолического давления в ЛЖ.
Для определения систолической функции ЛЖ можно использовать допплер-эхоКГ. Для этого рекомендуется определять время ускорения потока и временной интеграл скорости потока в выносящем тракте ЛЖ. Если сократимость ЛЖ снижена, то уменьшается площадь временного интеграла скорости и время ускорения, которое определяется от начала ускорения потока до достижения максимальной скорости.
Диастолическая функция
В клинической практике довольно часто отмечают случаи, когда у больных развивается ХСН, а желудочки при этом не увеличены и ФВ нормальная, поскольку продуктивность работы сердца зависит не только от его способности выбрасывать кровь в аорту в систолу, но и от его возможности заполниться кровью в диастолу. У этих больных наблюдается характерная рентгенологическая картина: застой в малом круге кровообращения при отсутствии кардиомегалии. В этой ситуации причиной застойной СН может быть нарушение диастолического расслабления миокарда и/или его повышенная жесткость. Процесс расслабления после сокращения не является пассивным, 15% всех энергетических затрат миокарда идут на покрытие нужд диастолы. Нарушение процесса диастолического расслабления и снижение податливости миокарда ЛЖ возникают при таких заболеваниях, как ИБС, АГ, аортальный стеноз, ГКМП. Кроме того, миокард становится жестким и неподатливым при развитии фиброза.
Катетеризация сердца и определение первой производной давления по времени (dP/dT) являются эталонным методом исследования диастолической функции сердца. Однако импульсная допплер-эхоКГ является довольно простым, неинвазивным и достаточно надежным методом оценки диастолической функции миокарда. Для оценки диастолической функции ЛЖ при проведении эхоКГ получают верхушечное четырехкамерное изображение и размещают пробный объем во входном тракте ЛЖ. Следует получить график потока через митральное отверстие с наибольшей скоростью. Обычно это удается на уровне краев митральных створок в диастолу, то есть немного дальше от фиброзного кольца клапана в направлении к верхушке желудочка. При хорошем качестве записи четко видны момент начала и момент прекращения потока через митральный клапан, а также максимальная скорость раннего диастолического наполнения (точка Е) и максимальная скорость в предсердную систолу (точка А).
Если воспользоваться постоянно-волновым допплеровским методом и направить сканирующий луч так, чтобы он на пути к митральному отверстию пересек выносящий отдел ЛЖ, то можно зарегистрировать, кроме диастолического митрального потока, еще и систолический поток крови, выбрасываемой в аорту. Такая запись дает возможность измерить длительность периода изоволюмической релаксации (IVRT): от момента прекращения выброса крови в аорту до начала митрального потока (рис. 7.25).
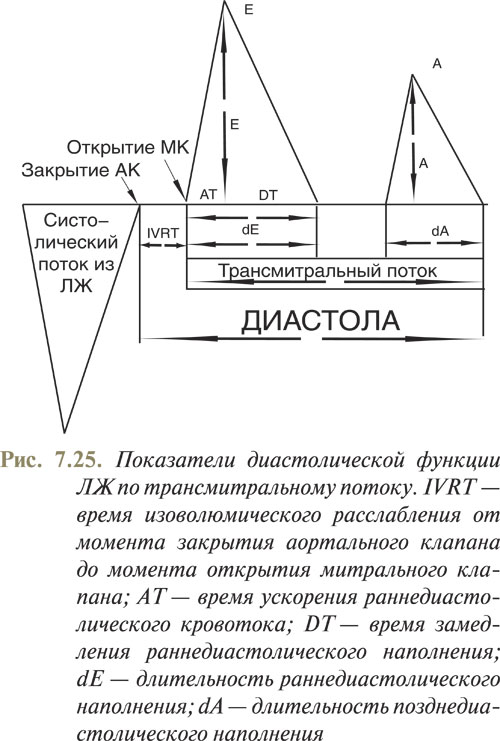
Нормальная длительность периода изоволюмической релаксации (isovolumic relaxation time, IVRT) составляет 70-90 мс, при ухудшении расслабления ЛЖ эта величина возрастает. С целью оценки диастолической функции миокарда нашли широкое применение диастолические временные интервалы. Среди них и время ускорения раннедиастолического потока (acceleration time — AT), которое определяют от начала трансмитрального потока до достижения максимальной скорости (Е) и которое в норме составляет 100±10 мс. Показатель длительности раннедиастолического наполнения — dE, нормальное значение которой 214±26 мс и которая значительно увеличивается при обструкции выносящего тракта ЛЖ. Также для характеристики диастолической функции миокарда используется время замедления (deceleration time — DT) — от точки, когда достигнута максимальная скорость раннедиастолического наполнения, до момента его прекращения; нормальная величина — 190±20 мс.
Отношение максимальной скорости раннедиастолического потока (Е) к потоку, обусловленному систолой предсердий (А), — важный показатель диастолической функции (Е/А). В норме колеблется от 1,07 до 2,35.
При нарушении диастолической функции ЛЖ выделяют различные типы графиков потока. Первый из них связан с нарушением релаксации ЛЖ и характеризуется такими изменениями: увеличивается период изоволюмической релаксации; снижается скорость раннедиастолического наполнения, а скорость потока вследствие систолы предсердий не меняется или возрастает; соответственно уменьшается отношение Е/А; увеличивается время замедления раннедиастолического потока.Такой характер потока чаще отмечают у лиц с ГЛЖ и/или ИБС при нормальном или умеренно повышенном давлении в левом предсердии, когда систолическая функция ЛЖ не нарушена, а выявляется только нарушение диастолического расслабления. Как следствие, уменьшается раннедиастолическое наполнение желудочка кровью, а на долю предсердия приходится соответственно большая работа, которая вызывает его дилатацию. Аналогичная графика потока выявляется у больных с остро возникшим повышением постнагрузки.
У некоторых пациентов с выраженной ГЛЖ и небольшой полостью ЛЖ наблюдается поток в выносящем тракте в позднюю диастолу и период изоволюмического сокращения. Скорость этого потока прямо пропорциональна скорости пика А трансмитрального потока и обратно пропорциональна объему ЛЖ в диастолу. Этот феномен, вероятно, связан с плохой податливостью ЛЖ и неспособностью его быстро увеличиться в размере, при этом кровь в систолу предсердий быстро устремляется в выносящий тракт.
Другой тип графики потока, рестриктивный, бывает у больных, у которых намного более выражены симптомы застойной СН или снижена податливость ЛЖ. Для него характерны такие показатели: короткий период IVRT; нормальная или повышенная скорость раннедиастолического наполнения — высокая волна Е; сниженная или нормальная скорость наполнения вследствие систолы предсердия — снижена волна А; укороченное DT раннедиастолического потока. Такая графика трансмитрального потока объясняется тем, что в этих случаях давление в левом предсердии значительно повышено, а его сократительная способность существенно ослаблена. В раннюю диастолу создается высокое давление наполнения ЛЖ, которое способствует быстрому поступлению крови из предсердия, а в систолу предсердий остается относительно небольшой объем крови для проталкивания в неподатливый желудочек. Подобную картину выявляют также у больных с повышенной преднагрузкой, рестриктивной кардиомиопатией, перикардиальной констрикцией.
Кроме указанных показателей, диастолическую функцию можно характеризовать с помощью временных интегралов скорости раннедиастолического и предсердного наполнения (Е’ и А’ ), а также их доли в общем диастолическом наполнении (Е’/Т’ и А’/Т’). Временной интеграл скорости определяется как площадь под кривой скорости потока, поэтому Е’ — площадь под той частью кривой, которая отражает изменение скорости в фазу раннедиастолического наполнения, А’— наполнение вследствие предсердной систолы. Т’ — площадь под всей кривой изменения скорости диастолического потока. Нормальные значения этих показателей:
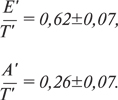
У пациентов с ИБС и сохраненной ФВ ЛЖ снижается первый из этих двух показателей и повышается второй по сравнению со здоровыми лицами тех же возрастных групп.
Выявлено, что после успешной чрескожной баллонной коронарной ангиопластики наступает быстрая нормализация этих показателей. Также отмечено, что лечение пациентов с АГ сопровождается улучшением диастолической функции ЛЖ, что подтверждается нормализацией значений индексов Е’/Т’ и А’/Т’.
Таким образом, можно выявить три типа трансмитрального потока при заполнении ЛЖ. Нормальный тип характеризуется тем, что волна Е несколько выше волны А. При нарушении релаксации ЛЖ волна Е является низкой, а волна А становится высокой. При рестриктивном характере диастолического заполнения ЛЖ волна Е становится высокой, а волна А — более низкой. При ИБС или АГ нарушение диастолической функции сначала проявляется в том, что волна Е становится низкой, а волна А — высокой. Если же развивается СН или возникает митральная недостаточность — состояния, при которых повышается давление в левом предсердии (давление наполнения ЛЖ), то происходят противоположные изменения: волна Е становится высокой, а волна А — более низкой. В процессе трансформации одного патологического типа трансмитрального потока в другой может наблюдаться «псевдонормализация» графики трансмитрального потока. Необходимо помнить, что на графику трансмитрального потока влияют и другие факторы. С возрастом первая волна (Е) снижается, а вторая (А) — повышается, также повышается волна А при тахикардии.
В настоящее время апробированы подходы определения состояния диастолической функции ЛЖ посредством оценки трансмитрального потока с использованием цветового М-режима с определением угла распространения раннедиастолического потока в ЛЖ, который зависит от способности ЛЖ к активной релаксации.
РЕКОМЕНДАЦИИ ПО ПРОВЕДЕНИЮ эхоКГ ПРИ ОТДЕЛЬНЫХ ЗАБОЛЕВАНИЯХ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ
ЭхоКГ в оценке патологии клапанов сердца
ЭхоКГ особенно показана при оценке сердечных шумов, стенозов и регургитаций всех четырех клапанов сердца, оценки функционирования протезированных клапанов и у больных с инфекционным эндокардитом (Erbel R. и соавт., 2001; Клив Розендорф, 2007) (см. табл. 7.3–7.20).
Таблица 7.3
Рекомендации по проведению эхоКГ у пациентов с сердечными шумами (согласно АСС/AHA/ASE, 2003)
| Класс I |
|
| Класс IIa |
| Пациент без клинической симптоматики, с низкой вероятностью сердечного заболевания, но у которого диагноз заболевания сердца не может быть обоснованно исключен с помощью стандартного клинического обследования сердечно-сосудистой системы |
| Класс III |
| Взрослый пациент без клинической симптоматики, сердечный шум которого расценен опытным специалистом как функциональный или незначимый |
Таблица 7.4
Рекомендации по применению эхоКГ при стенозе клапанов
| Класс I |
|
| Класс IIa |
|
| Класс IIb |
|
| Класс III |
|
Таблица 7.5
Рекомендации по проведению эхоКГ при нативной клапанной регургитации
| Класс I |
|
| Класс IIb |
|
| Класс III |
|
Таблица 7.6
Рекомендации по эхоКГ при пролапсе митрального клапана
| Класс I |
| Диагноз; оценка гемодинамической тяжести, морфологии створок, и/или компенсации функции желудочков у больных с клиническими признаками пролапса митрального клапана |
| Класс IIa |
|
| Класс III |
|
Таблица 7.7
Рекомендации по проведению эхоКГ при инфекционном эндокардите: протезированные клапаны
| Класс I |
|
| Класс IIa |
| Оценка персистирующей лихорадки без данных о бактериемии или новом шуме* |
| Класс IIb |
| Рутинное повторное исследование при неосложненном эндокардите под влиянием антибиотикотерапии* |
| Класс III |
| Оценка транзиторной лихорадки при отсутствии данных о бактериемии или новый шум |
*Чреспищеводная эхоКГ может обеспечить врача новой информацией в дополнение к полученной при проведении ТТ-эхоКГ.
Таблица 7.8
Рекомендации по эхоКГ при инфекционном эндокардите: нативные клапаны
| Класс I |
|
| Класс IIa |
|
| Класс IIb |
| Рутинное повторное исследование при неосложненном эндокардите под влиянием антибиотикотерапии |
| Класс ІІІ |
| Выявление причины транзиторной лихорадки при отсутствии данных о бактериемии или новый шум |
*Чреспищеводная эхоКГ часто может предоставить врачу дополнительную информацию в дополнение к полученной при ТТ-эхоКГ. Роль чреспищеводной эхоКГ в качестве исследования «первого ряда» нуждается в дальнейшем обосновании.
Таблица 7.9
Рекомендации по эхоКГ при интервенционных вмешательствах при клапанных заболеваниях сердца и протезировании клапанов
| Класс I |
|
| Класс IIa |
| Рутинная повторная эхоКГ-оценка после базисных исследований пациентов с замещениями клапанов, легкой и средней степенью дисфункции желудочков, без изменения клинической симптоматики |
| Класс IIb |
| Рутинная повторная оценка во время повышения степени недостаточности биопротеза без клинических данных о дисфункции протеза |
| Класс III |
|
*Чреспищеводная эхоКГ может обеспечить врача новой информацией в дополнение к полученной при проведении ТТ-эхоКГ.
Таблица 7.10
Рекомендации по использованию эхоКГ в диагностике острых ишемических синдромов миокарда
| Класс I |
|
| Класс IIa |
| Идентификация локализации/тяжести заболевания у пациентов с развивающейся ишемией (в ходу) |
| Класс III |
| Подтверждение диагноза «острый ИМ», уже установленного стандартными методами |
*Проведение чреспищеводной эхоКГ показано, когда ТТ-эхоКГ диагностически неинформативна.
Таблица 7.11
Рекомендации по использованию эхоКГ в диагностике и прогнозировании хронической ИБС
| Класс I |
|
| Класс IIa |
|
| Класс IIb |
|
| Класс III |
|
В табл. 7.11 и 7.13: *физическая нагрузка или фармакологическая стресс-эхоКГ; **стресс-эхоКГ с добутамином.
Таблица 7.12
Рекомендации по эхоКГ при оценке интервенционных вмешательств при хронической ИБС
| Класс I |
|
| Класс II |
|
| Класс III |
| Рутинная оценка у пациентов без клинической симптоматики после реваскуляризации |
*Физическая нагрузка или фармакологическая стресс-эхоКГ.
Таблица 7.13
Рекомендации по применению эхоКГ в оценке риска, прогнозирования и эффективности лечения при острых ишемических миокардиальных синдромах
| Класс I |
|
| Класс IIa |
|
| Класс IIb |
| Оценка позднего прогноза (≥2 года после перенесенного ИМ) |
| Класс III |
| Рутинные повторные оценки при отсутствии любых изменений клинического статуса |
Оценка сегментарной сократимости ЛЖ
ЭхоКГ и ее чреспищеводный вариант открывают для клиники ценную возможность диагностики инфарктобусловившей венечной артерии по вторичным (механическим) признакам нарушения коронарной перфузии — локальной дисфункции сегмента стенки желудочка.
Согласно представлениям о так называемом ишемическом каскаде, механические аномалии (локальная дисфункция сегмента стенки желудочка) наступают уже на этапе неоднородности кровотока, а депрессия сегмента ST на ЭКГ регистрирует один из конечных этапов ишемии. Уменьшение венечного кровотока на >50% в бассейне инфарктобусловившей артерии сопровождается появлением механических аномалий движения стенки желудочка, которые можно регистрировать при эхоКГ-исследовании. Это обстоятельство позволяет регистрировать ишемию на ранних этапах ишемического каскада, задолго до появления смещений сегмента ST на ЭКГ, ангинозной боли. Хотя эхоКГ в состоянии покоя не относится к методам диагностики ИБС, тем не менее посегментный анализ движения стенок камер сердца эффективен и информативен в ряде клинических ситуаций. Анализ предоставляет объективные данные для оценки эффективности лечения острых форм ИБС за счет возможности отслеживания локальной функции стенок желудочка в динамике. Метод позволяет оценивать эффективность хирургической реваскуляризации, коронарной ангиопластики. Успешно конкурирует с ангиографией в оценке прогноза осложнений, летального исхода острого ИМ. Метод позволяет оценить объем некротизированного и жизнеспособного миокарда, особенно эффективно при использовании стресс-эхоКГ. Сегментный анализ позволяет проводить дифференциальную диагностику при боли в грудной клетке: отсутствие механических аномальных движений стенки желудочка практически исключает ишемию миокарда и/или ИМ в качестве причины болевого синдрома. Сегментный анализ особенно информативен в том случае, когда трактовка и интерпретация стандартной ЭКГ затруднена относительно топики поражения при блокадах, гипертрофии, повторных ИМ, на фоне применения лекарственных средств. Не вызывает сомнения обоснованность проведения сегментного анализа при ИМ ПЖ или при его вовлечении при ИМ нижнедиафрагмальной стенки ЛЖ.
Для сегментного анализа в чреспищеводной эхоКГ используют стандартизованные подходы, детально разработанные для стандартной двухмерной эхоКГ, стрессовой эхоКГ. Подходы основаны на том, что эхоКГ-сегменты стенки желудочка, предсердия васкуляризируются соответствующей ветвью венечной эпикардиальной сети сердца. Благодаря анатомическим данным, прямым сопоставлениям результатов коронароангиографии, аутопсии и стандартной эхоКГ установлены регионы миокарда, васкуляризация которых осуществляется эпикардиальными венечными артериями сердца. Эти данные подтверждены и документированы при проведении эхоКГ-исследования на экспериментальной модели с применением специальной мелкодисперсной среды при ее селективном введении в главные венечные стволы. Для анализа локальной функции сегмента стенки желудочка применяются стандартные двухмерные эхоКГ-виды: короткоосевые парастернальные с плоскостью сканирования на трех уровнях — митральный клапан, средние отделы сосочковых мышц ЛЖ, верхушка сердца; парастернальный длинноосевой вид с оптимальным изображением митрального клапана; апикальные четырех- и двухкамерные изображения по длинной оси. Стандартизованным и унифицированным считается подход, предполагающий деление стенок ЛЖ на 16 сегментов (Segar D.S. et al., 1992), предложенный Американским обществом эхокардиографии (рис. 7.26).
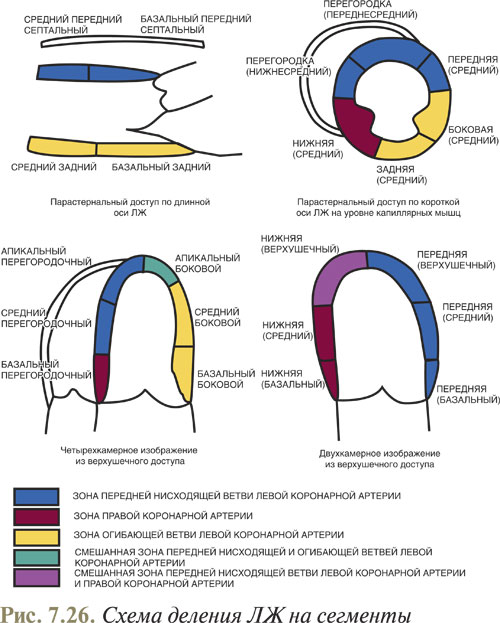
Каждый сегмент соответствует 6,25% поверхности желудочка, а верхушка — 25%. В практике исследований применяют номенклатуру и томографический анализ, где используется и 14-сегментная модель ЛЖ: по 6 сегментах на верхней и средней трети, 2 — на верхушке. Анализ предполагает дополнительно длинноосевые проекции, поскольку короткоосевые в ряде случаев имеют низкую воспроизводимость, а механические аномалии движения стенки желудочка должны быть подтверждены несколькими ортогональными позициями.
Установлено, что передние и переднеперегородочные сегменты верхней и средней трети ЛЖ, а также верхушечный сегмент васкуляризируются левой передней нисходящей артерией. Перегородочные нижние и задние на базальном и среднем уровне — правой венечной артерией. Боковые, базальный и средний, — левой огибающей артерией. Во взрослой популяции в 85% наблюдений или в 90% случаев сегменты задней стенки ЛЖ васкуляризируются задней нисходящей артерией, отходящей от правой венечной артерии — правовенечная форма кровоснабжения. В остальном числе наблюдений задняя нисходящая артерия отходит от левой огибающей артерии. Тем не менее с клинической точки зрения сеть ствола левой венечной артерии всегда более значима, поскольку васкуляризирует большинство сегментов стенок ЛЖ. Вместе с тем имеются данные, указывающие, что лево- и правовенечные формы отмечают лишь в 10 и 5% наблюдений соответственно, а более часто выявляемой оказывается равномерная, при которой оба крупных венечных ствола имеют примерно равные регионы кровоснабжения. Считается, что короткоосевой вид в плоскости сканирования сосочковых мышц — это обычно вид выбора для диагностики механических аномальных движений стенки желудочка, а также для мониторирования функции желудочка с высокой вероятностью внутриоперационной ишемии.
Дисфункция переднеперегородочного сегмента на среднем уровне и отсутствие изменений этого сегмента на базальном указывают на высокую вероятность окклюзии левой передней нисходящей артерии ниже отхождения передней септальной ветви. Апикальные сегменты нижней трети ЛЖ снабжаются левой передней нисходящей артерией. Задние апикальные сегменты нижней трети всегда питаются задней нисходящей артерией, которая может отходить как от левой огибающей артерии, так и от правой венечной артерии. Если инфарктобусловившей окажется левая передняя нисходящая артерия, механическая сегментная дисфункция может выявляться во всех апикальных сегментах, тогда как в случае тромбоза в системе правой венечной артерии — задней нисходящей артерии — только в задних сегментах.
Особое внимание рекомендуется уделять сегментам базального уровня — заднебазальному, базальному боковому, базальному нижнеперегородочному. Механическую дисфункцию заднебазального сегмента задней стенки ЛЖ может имитировать систолическое латеральное движение эпи- и эндокардиальных контуров без утолщения с небольшим истончением в фазе изоволюмического сокращения. Феномен латерального движения не следует расценивать как артефакт или локальную дисфункцию вследствие ИМ. Аналогичным подходом следует руководствоваться относительно базального бокового и базального перегородочного сегментов, систолическое движение которых в норме в условиях покоя ограничено. Стрессовая эхоКГ может выявить изолированную гипокинезию указанных сегментов, что следует расценивать как ложноположительный результат. Изолированная, наблюдающаяся только в указанных базальных сегментах, гипокинезия является вариантом нормальной реакции как у интактных лиц, так и в популяции с поражением коронарных артерий (Varga A. еt al., 1992). Низкая чувствительность в выявлении локальной дисфункции стенок ЛЖ установлена для нижних сегментов в состоянии покоя при компьютерном анализе.
Оценивая локализацию и протяжение механических сегментных аномалий одновременно проводят их количественный анализ, который указывает на степень выраженности дисфункции. Существуют два способа анализа: визуальный и компьютерный (цифровой). Компьютерный анализ удобен в случаях, когда требуется количественная оценка дисфункции сегментов в процессе лечения. Однако визуальный анализ признан более точным, особенно при гипокинезии. Он используется в качестве контрольной процедуры при анализе локальной функции сегмента стенки желудочка. Наличие подобного визуального контрольного теста, который применяется в большинстве медицинских центров, приобретает особое значение: сегменты миокарда, сохранившие способность к систолическому утолщению в покое и пребывающие в состоянии гипокинезии (в сопоставлении с акинетичными), чаще оказываются жизнеспособными.
Разработаны многочисленные протоколы исследования. Часто используется протокол, уже ставший классическим и включающий следующие характеристики:
- нормокинезия (систолическая экскурсия эндокарда) >5 мм;
- гипокинезия 2–5 мм;
- акинезия <2 мм;
- дискинезия.
В клинической практике пользуется популярностью стандартная номенклатура анализа аномальных движений сегмента стенки, где маркером дискинезии считается отсутствие систолического утолщения и/или наличие систолического истончения сегмента стенки. Эта модель представляется удобной в практическом аспекте, поскольку имеется возможность анализировать тот или иной регион миокарда с различных проекций. Это приобретает особое значение при исследовании взрослой популяции, когда для конкретной эхоКГ-проекции имеются ограничения. К достоинствам модели следует отнести стандартную номенклатуру, что обеспечивает унификацию процедуры и тщательный анализ двухмерной томограммы.
Некоторые протоколы предполагают учет ряда рубрик дополнительно: компенсаторная гиперкинезия, дискинезия + аневризма, дискинезия + рубец. Тем не менее в клинической практике уместно применять протоколы, которые хорошо описывают прогноз и осложнения острого ИМ.
Американским обществом эхокардиографии предложена 16-сегментная модель ЛЖ, однако короткоосевые томограммы часто опасифицированы и/или плохо воспроизводимы. Поэтому возрастает роль апикальных изображений.
Индекс асинергии (отношение суммы значений экскурсий сегментов с дисфункцией к количеству исследованных сегментов) сегментного анализа используется как прогностический показатель выживаемости на кратко-долгосрочный период, распределяет пациентов с острым ИМ на подгруппы высокого и низкого риска. Установлено, что индекс асинергии обладает значимо большей прогностической чувствительностью, нежели общая ФВ камеры желудочка. Его значение >1,9 расценивается как прогностически неблагоприятное.
При значении >2,0 частота осложнений острого периода ИМ достигала 89% против 16% — при значении <2,0. Поэтому индекс асинергии удобно использовать как маркер прогноза осложнений и летального исхода острого периода ИМ.
Известно, что чреспищеводная эхоКГ в варианте добутаминового теста с целью выявления жизнеспособного миокарда повышала чувствительность и специфичность диагностики стандартной эхоКГ с 84 и 81% до 91 и 100% соответственно. Проводя чреспищеводную эхоКГ-внутриоперационную диагностику механических сегментных аномалий, всегда необходимо учитывать давление наполнения желудочка, его податливость, другие параметры кровоснабжения, которые являются величинами переменными, их значения могут широко варьировать, оказывая влияние на систолическую экскурсию сегмента стенки желудочка.
С целью получения более объективной картины механических сегментных аномалий в 1989 г. разработана концепция использования импульсного допплеровского метода. Метод допплеровского изображения ткани (DTI) позволяет получать цифровой анализ пиковых скоростей расслабления/сокращения сегментов стенок, пиковый миокардиальный градиент скорости, который предполагает соотнесение указанных параметров к систолическому утолщению стенки. Метод практически не зависит от ручной планиметрии и субъективного фактора, хорошо воспроизводим. Результаты исследования удобно архивируются с возможностью повторного анализа и сопоставлений в процессе лечения.
Новые возможности сегментного анализа открывает цифровая вычитательная эхоКГ с высокой скоростью кадров.
Артериальная гипертензия
ЭхоКГ — неинвазивная диагностическая процедура выбора в оценке влияния системной АГ на сердце как наиболее частой причины развития ГЛЖ и застойной СН у взрослых. Пациентам с пограничной АГ без признаков ГЛЖ на ЭКГ эхоКГ может быть показана непосредственно для оценки ГЛЖ. Значение повторных исследований у пациентов с АГ без клинической симптоматики и нормальной функцией ЛЖ не установлено.
Таблица 7.14
Рекомендации по эхоКГ при АГ
| Класс I |
|
| Класс IIa |
|
| Класс IIb |
| Стратификация риска для прогнозирования производительности работы ЛЖ |
| Класс III |
|
Кардиоэмболические заболевания и сосудистые окклюзивные события
Двухмерная эхоКГ является единственной методикой, легко осуществляемой и широко применяемой для выявления потенциального источника эмболии.
Исследования могут проводиться с использованием ТТ- или чреспищеводного доступа. В табл. 7.15 сопоставлены данные по чреспищеводной и ТТ-эхоКГ в плане выявления потенциальных источников эмболии.
Таблица 7.15
ТТ-эхоКГ по сравнению с чреспищеводной эхоКГ для выявления потенциальных источников кардиоэмболии
| Диагностика с помощью ТТ-эхоКГ* | Диагностика с помощью чреспищеводной эхоКГ |
|
|
*Достаточно проведения ТТ-эхоКГ; чреспищеводную эхоКГ можно проводить дополнительно, однако это исследование не обязательно.
Информативная ТТ-эхоКГ позволяет с уверенностью диагностировать заболевание, а чреспищеводная эхоКГ в данном случае не обеспечивает получения дополнительной информации. При выявлении заболевания методом ТТ-эхоКГ проведение чреспищеводной эхоКГ у всех пациентов не обязательно. Диагностическая ценность уставленного диагноза возрастает при проведении чреспищеводной эхоКГ после отрицательных результатов ТТ-эхоКГ или же в том случае, если выявленные признаки являются уникальными и могут быть определены только на чреспищеводной эхоКГ, даже в случае результативной ТТ-эхоКГ.
Эти категории предполагают, что высококачественная ТТ-эхоКГ является диагностическим методом оценки потенциальных кардиальных источников эмболии. В случае сомнительных результатов ТТ-эхоКГ необходимо дополнительно проводить чреспищеводную эхоКГ.
Таблица 7.16
Рекомендации по выполнению эхоКГ у пациентов с цереброваскулярными или другими сосудистыми окклюзивными событиями
| Класс I |
|
| Класс IIa |
| Пациенты с подозрением на эмболию или цереброваскулярное заболевание невыясненной этиологии и клинической значимости |
| Класс IIb |
| Пациенты с неврологическим событием и выраженным цереброваскулярным заболеванием, достаточным для того, чтобы развилось клиническое событие |
| Класс III |
| Пациенты, у которых результаты эхоКГ не повлияют на решение о применении антикоагулянтной терапии или других подходов к диагностике или лечению |
Аритмии
При наличии аритмии роль эхоКГ состоит в первую очередь в выявлении сопутствующей сердечной патологии, знание о которой повлияет на лечение аритмии или обеспечит прогностическую информацию. В этом плане эхоКГ-исследование часто проводят у больных с фибрилляцией или трепетанием предсердий, предсердными тахикардиями, желудочковой тахикардией или фибрилляцией желудочков. Хотя эхоКГ обеспечивает полноценную информацию о влиянии аритмии на сердечную функцию, не существует рекомендаций относительно повторных клинических исследований, за исключением случаев произошедших изменений клинического статуса или если результат эхоКГ может повлиять на принятие решения о лечебной тактике.
Таблица 7.17
Рекомендации по эхоКГ у пациентов с нарушениями ритма сердца и сердцебиением
| Класс I |
|
| Класс IIa |
|
| Класс IIb |
|
| Класс III |
|
Таблица 7.18
Рекомендации по эхоКГ перед кардиоверсией
| Класс I | |
| I |
|
| Класс IIa | |
| IIa | Пациенты с фибрилляцией предсердий длительностью <48 ч и другими заболеваниями сердца* |
| Класс IIb | |
| IIb |
|
| Класс III | |
| III |
|
*Только чреспищеводная эхоКГ.
Обмороки
Таблица 7.19
Рекомендации по эхоКГ у пациентов с обмороками
| Класс I |
|
| Класс IIa |
| Обмороки у пациентов профессий высокого риска (например летчики) |
| Класс IIb |
| Обмороки неясной этиологии без выявленных сердечных заболеваний по данным анамнеза или физикального обследования |
| Класс III |
|
ЭхоКГ как метод скрининга
Многогранность метода эхоКГ делает возможным его применение в качестве метода скрининга. Однако среди многих состояний, которые могут быть выявлены с помощью эхоКГ, только незначительная часть соответствует критериям для скрининга лиц без клинической симптоматики. К соответствующим этим критериям заболеваниям относятся наследственные болезни сердца и крупных сосудов, когда в качестве исследуемой группы для скрининга выступают члены семьи пациента с наличием патологии. Одни из наиболее распространенных заболеваний, попадающие в эту категорию, — кардиомиопатия и синдром Марфана.
Последние достижения в области молекулярной генетики выявили семейную основу многих форм кардиомиопатий (Charron P. et al., 1997). Хотя в будущем в качестве метода скрининга все шире будет использоваться генетическое тестирование, в настоящее время одним из основных методов скрининга продолжает оставаться эхоКГ. Генетическое тестирование, дополненное эхоКГ, обеспечивает документирование генетического субстрата заболевания с последующим определением его проявлений и прогрессирования. Однозначно определена роль эхоКГ как метода скрининга для трех форм миопатии ГКМП и ДКМП, а также аритмогенная дисплазия ПЖ.
Таблица 7.20
Рекомендации по проведению эхоКГ для скрининга наличия сердечно-сосудистого заболевания
| Класс I |
|
| Класс IIb |
| Пациенты с системными заболеваниями, которые могут поражать сердце |
| Класс III |
|
НОРМАЛЬНЫЕ ЗНАЧЕНИЯ РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ В М- И В-РЕЖИМАХ У ВЗРОСЛЫХ ЛИЦ
Приложение 7.1
Нормальные значения измерений в В-режиме у взрослых лиц: апикальная четырехкамерная позиция (с учетом площади поверхности тела)
| ЛЖ (КД) длинная ось, см/м2 | 4,1–4,9 |
| ЛЖ (КС) длинная ось, см/м2 | 2,7–3,5 |
| ЛЖ (КД) короткая ось, см/м2 | 2,3–2,9 |
| ЛЖ (КС) короткая ось, см/м2 | 1,4–2,0 |
| ПЖ (КД) длинная ось, см/м2 | 3,6–4,6 |
| ПЖ (КС) длинная ось, см/м2 | 2,5–3,5 |
| ПЖ (КД) короткая ось, см/м2 | 1,3–2,1 |
| ПЖ (КС) короткая ось, см/м2 | 0,9–1,7 |
| ЛП (КД) длинная ось, см/м2 | 1,1–1,9 |
| ЛП (КС) длинная ось, см/м2 | 1,7–2,5 |
| ЛП (КД) короткая ось, см/м2 | 0,9–1,5 |
| ЛП (КС) короткая ось, см/м2 | 1,5–2,1 |
| ПП (КД) длинная ось, см/м2 | 1,1–1,7 |
| ПП (КС) длинная ось, см/м2 | 1,9–2,7 |
| ПП (КД) короткая ось, см/м2 | 1,1–1,9 |
| ПП (КС) короткая ось, см/м2 | 1,4–2,2 |
| Корень Ао, см | 1,8–3,0 |
| Восходящая Ао, см | 1,7–4,1 |
| ЛА на уровне створок, см | 1,5–2,5 |
| НПВ, см | 1,5–2,0 |
Параметры приведены по Вилкенсхоф У., Крук И. (2007) Справочник по эхокардиографии. Медицинская литература, Москва.
Здесь и далее в приложениях: КС — конец систолы, КД — конец диастолы, ЛП — левое предсердие, ПП — правое предсердие, НПВ — нижняя полая вена.
Приложение 7.2
Нормальные значения измерений в М-режиме у взрослых лиц
| Ао (КД), мм | 27 | 21–44 |
| ЛП (КС), мм | 29 | 18–39 |
| ПЖ (КД), мм | 19 | 9–26 |
| ПЖ (КС), мм | 18 | 15–22 |
| МЖП (КД), мм | 9 | 6–12 |
| ЗСЛЖ (КД), мм | 9 | 6–12 |
| МЖП/ЗСЛЖ | <1,3:1 | |
| ЛЖ (КД), мм | 47 | 37–56 |
| ЛЖ (КС), мм | 35 | 27–37 |
| ФУ, % | 25–45 | |
| LVET, мс | 280 | 230–334 |
| MCC-расстояние, мм | >6 | 5–10 |
| АоК-раскрытие створок, мм | >16 | 15–22 |
| ФВ, % | 62 | 45–90 |
Параметры приведены по Вилкенсхоф У., Крук И. (2007) Справочник по эхокардиографии. Медицинская литература, Москва.
МЖП — межжелудочковая перегородка, ЗСЛЖ — задняя стенка ЛЖ, LVET — время выброса ЛЖ, МСС — митрально-септальная сепарация.
Приложение 7.3
Нормальные значения измерений в В-режиме у взрослых лиц
| Позиция исследования | Норма (средние значения ±2 ст), см | Средние значения, см | Индекс, см/м2 |
| Апикальная четырехкамерная | |||
| ЛЖ (КД) длина | 6,9–10,3 | 8,6 | 4,1–5,7 |
| ЛЖ (КД) поперечник | 3,3–6,4 | 4,7 | 2,2–3,1 |
| ЛЖ (КС) поперечник | 1,9–3,7 | 2,8 | 1,3–2,0 |
| ПЖ длина | 6,5–9,5 | 8,0 | 3,8–5,3 |
| ПЖ поперечник | 2,2–4,4 | 3,3 | 1,0–2,8 |
| Парастернальная длинная ось | |||
| ЛЖ (КД) | 3,5–6,0 | 4,8 | 2,3–3,1 |
| ЛЖ (КС) | 2,1–4,0 | 3,4 | 1,4–2,1 |
| ПЖ | 1,9–3,8 | 2,8 | 1,2–2,0 |
| Парастернальная короткая ось на уровне створок МК | |||
| ЛЖ (КД) | 3,5–6,2 | 4,8 | 2,3–3,2 |
| ЛЖ (КС) | 2,3–4,0 | 3,2 | 1,5–2,2 |
| На уровне папиллярных мышц | |||
| ЛЖ (КД) | 3,5–5,8 | 4,7 | 2,2–3,1 |
| ЛЖ (КС) | 2,2–4,0 | 3,1 | 1,4–2,2 |
Параметры приводятся по Вилкенсхоф У., Крук И. (2007) Справочник по эхокардиографии. Медицинская литература, Москва.
Приложение 7.4
Нормальные показатели максимальных скоростей потоков у взрослых лиц
| Показатель | Hatle, м/с | Kisslo, м/с | Labovitz, м/с |
| MК | 0,9 (0,6–1,3) | 0,9 (0,6–1,4) | 0,4–1,3 |
| ТК | 0,5 (0,3–1,3) | 0,6 (0,4–0,8) | 0,3–1,0 |
| ЛК | 0,7 (0,6–1,3) | 0,7 (0,5–0,9) | 0,5–1,5 |
| АоК | 1,3 (1,0–1,7) | 1,4 (0,9–1,8) | 0,5–1,8 |
| ВосхАо | 0,5–1,5 | ||
| НисхАо | 0,5–1,5 |
МК — митральный клапан, ТК — трикуспидальный клапан, АоК — аортальный клапан, ЛК — клапан ЛА, ВосхАо/НисхАо — восходящая/нисходящая часть аорты.
Параметры приведены по следующим источникам:
Hatle L. (1985) Doppler Ultrasound in Cardiology. Lea&Febiger. Philadelphia.
Kisslo J. et al. (1986) Basic Doppler Echocardiography. Churchill Livingstone, New York, Edinburgh, London, Melbourne.
Labovitz A. (1988) Doppler Echocardiography. Lea&Febiger, Philadelphia.
Приложение 7.5
Нормальные значения показателей потоков в аорте и ЛА у взрослых лиц
| Показатель | Аорта | ЛА |
| Vмакс, м/с | 0,92 (0,72–1,20) | 0,63 (0,44–0,78) |
| ET, мс | 294 (265–325) | 331 (280–380) |
| AT, мс | 98 (83–118) | 159 (160–185) |
| Среднее ускорение, м/с2 | 9,40 (7,35–13,18) | 3,96 (2,70–5,15) |
| Среднее замедление, м/с2 | 4,73 (3,90–6,30) | 3,56 (2,57–4,60) |
АТ — время ускорения потока, ЕТ — время выброса, Vмакс — максимальная скорость.
Параметры приведены по Gardin J. et al. (1984) Evaluation of blood flow velocity in the ascending aorta and main pulmonary artery of normal subjects by Doppler echocardiography. Am. Heart J., 107: 310.
Приложение 7.6
Показатели динамики наполнения ЛЖ у взрослых лиц
| Возраст, лет | <50 | >50 |
| Митральный клапан | ||
| пик Е, м/с | 0,72±0,14 | 0,62±0,14 |
| пик A, м/с | 0,40±0,10 | 0,59±0,14 |
| Е/А-соотношение | 1,9±0,6 | 1,1±0,3 |
| DT, мс | 179±20 | 210±36 |
| IVRT, мс | 76±11 | 90±17 |
| Легочные вены | ||
| пик S, м/с | 0,48±0,09 | 0,71±0,09 |
| пик D, м/с | 0,5±0,1 | 0,38±0,09 |
| пик A, м/с | 0,19±0,04 | 0,23±0,14 |
DT — время замедления потока, IVRT — время изоволюмического расслабления.
Параметры приведены по Klein A., Cohen G. (1992) Doppler echocardiographic assessment of constrictive pericarditis, cardiac amyloidosis, and cardiac tamponade. Cleve Clin. J. Med., 59: 281.
Приложение 7.7
Показатели динамики наполнения ПЖ у взрослых лиц
| Возраст, лет | <50 | >50 |
| Трехстворчатый клапан | ||
| Е, м/с | 0,51±0,07 | 0,41±0,08 |
| A, м/с | 0,27±0,08 | 0,33±0,08 |
| Е/А-соотношение | 2,0±0,5 | 1,34+0,40 |
| DT, мс | 188±22 | 198±23 |
| IVRT, мс | 76±11 | 90±17 |
| Верхняя полая вена | ||
| пик S, м/с | 0,41±0,09 | 0,42±0,12 |
| пик D, м/с | 0,22±0,05 | 0,22±0,05 |
| пик А, м/с | 0,13±0,03 | 0,16±0,03 |
Параметры приведены по Klein A., Cohen G. (1992) Doppler echocardiographic assessment of constrictive pericarditis, cardiac amyloidosis, and cardiac tamponade. Cleve Clin. J. Med., 59: 281.
ЛИТЕРАТУРА
- Абдулаев Р.Я., Соболь Ю.С., Шиллер Н.Б. и др. (1998) Современная эхокардиография. Фортуна-Пресс, Харьков, 248 с.
- Бобров В.А., Чубучный В.Н., Иванив Ю.А., Павлюк В.И. (1998) Трансторакальная эхокардиография: методика исследования и клиническая интерпретация. Дельфин, Киев, 84 с.
- Вилкенсхоф У., Крук И. (2007) Справочник по эхокардиографии. Медицинская литература, Москва, 223 с.
- Клінічна допплєрівська ультрасонографія (2001) За ред. Пола Л. Аллана, Пола А. Доббіса, Мирона А. Посняка та ін. Пер. з англ. Медицина світу, Львів. 293 с.
- Коваленко В.Н., Деяк С.И. (ред.) (2004) Клиническое применение эхокардиографии: Практ. пособие для врача. Киев, 32 с.
- Коваленко В.Н., Коношевич С.Н. (2003) Клиническая чреспищеводная эхокардиография. Мотор Сич, Запорожье, 178 с.
- Митьков В.В. (рук.) (1996) Клиническое руководство по ультразвуковой диагностике. 2-е изд. Т. 1. Видар, Москва, 336 с.
- Основы кардиологии: принципы и практика (2007) Под ред. Клива Розендорфа. 2-е изд. Медицина світу, Львов. 1064 с.
- Стаднюк Л.А., Лапшин О.В., Динник О.Б., Долженко М.М. и др. (2004) Стрес-ехокардіографія: Навч. посіб., Київ, 164 с.
- Фейгенбаум Х. (1999) Эхокардиография. Пер. с англ. под ред. В.В. Митькова. Видар, Москва, 512 с.
- Шиллер Н., Осипов М.А. (2005) Клиническая эхокардиография. Москва, 347 с.
- Attenhofer J.C.G., Tutina J., Mayer K. et al. (2000) Echocardiography in the evaluation of systolic murmurs of unknown cause. Am. J. Med., 108: 614-620.
- Aurigemma G.P., Gaash W.H., Villegas B. et al. (1995) Noninvasive assessment of left ventricular mass, chamber volume, and contractile function. Curr. Probl. Cardiol., 20: 361-440;
- Charron P., Dubourg O., Desnos M. et al. (1997) Diagnostic value of electrocardiography and echocardiography for familial hypertrophyc cardiomyopathy in a genotyped adult population. Circulation, 96: 214-229.
- Cheitlin M.D., Armstrong W.F., Aurigemma G.P. et al. (2003) ACC/AHA/ASE 2003 guideline update for the clinical application of echocardiography: summary article — a report of the American college of cardiology. American heart association task force on practice guidelines (ACC/AHA/ASE committee to update the 1997 guidelines for the clinical application of echocardiography). J. Am. Coll. Cardiol., 42(5): 954-970.
- Erbel R., Alfonso F., Boileau C. et al. (2001) Diagnosis and management of aortic dissection. Europ. Heart. J., 22: 1642-1681.
- Gibler W.B., Runyon J.P., Levy R.C. et al. (1995) A rapid diagnostic and treatment center for patients with chest pain in the emergency department. Ann. Emerg. Med., 25: 1-8.
- Mulvagh S.L., De Maria A.N., Feintein S.B. et al. (2000) Contrast echocardiography: Current and future applications. American Society of echocardiography task force on standards and guidelines for the use of ultrasonic contrast in echocardiography. J. Am. Soc. Echocardiogr., 13(4): 331-342.
- Segar D.S., Brown S.C., Sawada S.C. et al. (1992) Dobutamine stress echocardiography: corellation with coconary lesion severity as determined by quantitative angiography. J. Am. Coll. Cardiol. 19: 1197-1202.
- Varga A., Picano E., Dodi C. et al. (1992) Madness and method in stress echo reading. Eur. Heart. J. 20(17): 1271-1275.